ISOLASI, IDENTIFIKASI KOMPONEN KIMIA DAN UJI BIOASSAY DENGAN METODE BHRINE SHRIMP LETHALITY TEST (BSLT) PADA
LARVA UDANG (Artemia salina Leach) EKSTRAK N-HEKSAN DAUN GANJENG (Piper betle L) ASAL HUTAN LINDUNG DUSUN ARAKEKE,
DESA MAMAMPANG, KECAMATAN EREMERASA, KABUPATEN BANTAENG, SULAWESI SELATAN
OLEH :
NUR AMIRAH RESKI 701001131082 KELOMPOK V
FARMASI A
LABORATORIUM FITOKIMIA PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI ALAUDDIN MAKASSAR
DAFTAR ISI
HALAMAN JUDUL...ii
LEMBAR PENGESAHAN...iii
KATA PENGANTAR...iv
DAFTAR ISI...v
BAB I PENDAHULUAN...1
A. Latar Belakang...1
B. Maksud dan Tujuan Percobaan...3
C. Prinsip Percobaan...4
BAB II TINJAUAN PUSTAKA...7
A. Uraian Tumbuhan Daun Ganjeng...7
B. Metode Ekstraksi………..9
C. Partisi...13
D. Kromatografi Lapis Tipis...13
E. Kromatografi Lapis Tipis Preparatif………..17
F. KLT Multi Eluen dan Dua Dimensi...18
G. Bioassay...20
1. Brine Shrimp Lethaly Test (BSLT)...20
H. Uraian Bahan...20
I. Uraian Larva………...24
BAB III METODE KERJA……….27
A. Alat dan Bahan...27
BAB IV HASIL DAN PEMBAHASAN………38
A. Tabel Pengamatan………...38
B. Pembahasan………41
BAB V PENUTUP……….54
A. Kesimpulan………...54
B. Saran……….54
KEPUSTAKAAN……….55
LAMPIRAN I. Skema Kerja………57
II. Perhitungan……….66
III. Gambar Kurva Baku………...76
IV. Gambar Pengamatan………..78
KATA PENGANTAR
“Syukur Alhamdulillah” ungkapan yang patut dipanjatkan kehadirat Allah swt. atas berkat rahmat, dan hidayah-Nya lah sehinggah pembuataan jurnal yang berjudul “LAPORAN LENGKAP PRAKTIKUM FITOKIMIA” ini dapat berjalan dan terselesaikan sesuai yang diharapkan.
Dan tak lupa pula kami hanturkan rasa terima kasih yang tak terhingga kepad asisten yang telah memberikan arahan dan bimbingan kepada kami serta rekan-rekan mahasiswa yang telah memberikan dukungannya dalam pembuatan laporan lengkap ini.
Kami menyadari bahwa laporan yang kami buat masih jauh dari kesempurnaan. Olehnya itu kami mengharapkan saran, kritik, serta masukan demi kebaikan pembuatan laporan di lain waktu. Walaupun laporan yang kami sajikan ini masih jauh dari kesemprnaan tetapi kami berharap semoga apa yang kami tuangkan dalm laporan ini mampu memberikan pemahaman, ide-ide baru dan pengetahuan kepada pembaca serta memberikan manfaat bagi khalayak banyak, karena pada dasarnya kesempurnaan hanya milik Allh swt. semata.
Samata-Gowa, april 2016
ISOLASI, IDENTIFIKASI KOMPONEN KIMIA DAN UJI BIOASSAY DENGAN METODE BHRINE SHRIMP LETHALITY TEST (BSLT) PADA
LARVA UDANG (Artemia salina Leach) EKSTRAK N-HEKSAN DAUN GANJENG (Piper betle L) ASAL HUTAN LINDUNG DUSUN ARAKEKE,
DESA MAMAMPANG, KECAMATAN EREMERASA, KABUPATEN BANTAENG, SULAWESI SELATAN
Disetujui Oleh:
Asisten Pembimbing
Sitti Nur Hajiah Kasim
Mengetahui:
Koordinator Asisten Laboran
Muhammad Rusdi. S.,Si.,M.Si.,Apt Sukri, S.Farm BAB I
A. Latar Belakang
Negara Indonesia memiliki potensi yang sangat besar dalam membudidayakan obat-obatan yang berasal dari alam, dapat dilihat dari kekayaan alamnya yang melimpah baik di darat maupun di laut. Di Indonesia saat ini baru 450 jenis tumbuhan obat yang telah diteliti khasiatnya. 200 jenis di antaranya dapat dikonsumsi sebagai jamu (Endarwati, 2005).
Obat tradisional yang digunakan saat ini merupakan warisan turun temurun dari nenek moyang kita dari generasi yang satu ke generasi berikutnya, sehingga keberadaannya terkait dengan budaya bangsa Indonesia. Dalam perkembangannya, penggunaan tumbuhan obat dan obat tradisional sebagai salah satu upaya kesehatan mengalami perkembangan dari masa ke masa dan merupakan catatan sejarah kehidupan kita (Katno & Pramono. 2002).
Fitokimia adalah ilmu yang mempelajari kandungan kimia dari bahan alam yang mempunyai khasiat obat. Bahan alam meliputi tumbuhan, hewan, mineral, serta biota laut. Bahan alam tersebut mengandung beberapa komponen kimia yang dapat digunakan sebagai obat. Obat yang berasal dari bahan alam dikenal luas sebagai obat tradisional (Gunawan, 2004).
Sebagaimana firman Allah S.w.t (Q.S Al-An’am/6: 99)
dan delima yang serupa dan yang tidak serupa. Perhatikanlah buahnya di waktu pohonnya berbuah dan (perhatikan pulalah) kematangannya. Sesungguhnya pada yang demikian itu ada tanda-tanda (kekuasaan Allah) bagi orang-orang yang beriman (Q.S Al – An’am 6 : 99)
Pesatnya perkembangan penelitian dalam bidang obat, telah menyediakan berbagai jenis pilihan obat sehingga diperlukan pertimbangan yang cermat dalam memilih obat untuk suatu penyakit. Walaupun temuan dan terobosan substansial di bidang obat telah memberikan konstribusi yang besar dalam meningkatan pelayanan kesehatan, namun perlu disadari bahwa obat dapat menimbulkan efek yang tidak diinginkan apabila penggunaannya tidak tepat (Endarwati, 2005).
Dilakukan isolasi dan identifikasi komponen kimia daun Ganjeng karena daun Ganjeng ini memiliki beberapa khasiat yaitu untuk pemakaian dalam, berguna untuk mengobati batuk, bronkhitis, gangguan lambung (gastritis), rheumatik, bengkak-bengkak, menghilangkan bau badan, dan keputihan (leucorrhoe). Sedangkan untuk pemakaian luar daun sirih berguna untuk mengobati ekzema, luka bakar, koreng (Pyodermi), kurap kaki, bisul, mimisan, perdarahan gusi, mengurangi produksi ASI (Air Susu Ibu), dan menghilangkan gatal (Wijayakusuma,1992).
Dengan tujuan untuk mendapatkan bahan obat tradisional, perlu diambil sampel dari daerah setempat untuk diteliti melalui pemeriksaan organoleptik, anatomi dan morfologi serta kandungan kimianya. Sehingga dapat diketahui secara pasti dan dapat dipublikasikan kepada masyarakat sekitar tentang khasiat sampel tersebut dan ciri-ciri sampel tersebut agar mudah dikenali. Dengan begitu kesadaran masyarakat akan bahan obat tradisional di sekitar lingkungannya akan meningkat dan tidak menutup kemungkinan mereka akan lebih merawat lingkungan sekitarnya (Endarwati, 2005).
Mengetahui dan memahami cara penyiapan sampel, ekstraksi, partisi, kromatografi lapis tipis (KLT), uji Bhrine Shrimp Lethalithy Test (BSLT), fraksinasi, kromatografi lapis tipis preparatif (KLTP), multi eluen dan dua dimensi serta identifikasi senyawa tumbuhan Ganjeng (Piper betle L.)
2. Tujuan Percobaan
a. Mengetahui cara ekstraksi komponen kimia dalam sampel daun Ganjeng (Piper betle L.) dengan metode refluks dan maserasi
b. Mengetahui cara pemisahan senyawa berdasarkan kepolaran dengan metode partisi cair-padat dan partisi cair-cair
c. Mengetahui cara penentuan eluen yang sesuai dengan metode KLT (Kromatografi Lapis Tipis)
d. Mengetahui cara pengujian toksisitas sampel daun Ganjeng (Piper betle L.) dengan menggunakan larva udang (Arthemia salina)
e. Mengetahui cara isolasi sampel daun Ganjeng (Piper betle L.) dengan menggunakan metode KLT Preparatif dan Kromatografi Cair Vakum (KCV) f. Mengetahui uji kemurnian senyawa dengan menggunakan metode KLT
multieluen dan dua dimensi
g. Mengetahui cara identifikasi komponen kimia dengan menggunakan pereaksi tertentu.
a. Maserasi
Penyarian zat aktif yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari yang sesuai selama 1 x 24 jam kemudian disaring dan diambil filtratnya kemudian dipekatkan.
b. Perkolasi
Penyarian zat aktif atau zat berkhasiat dari serbuk simplisia yang dilakukan dengan cara serbuk simplisia di tempatkan dalam suatu bejana silinder, yang bagian bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai mencapai keadaan jenuh.
c. Refluks
Penyarian zat aktif pada simplisia melalui proses penyarian yang berkesinambungan di mana simplisia dan cairan penyari dipanaskan bersama-sama. Pada temperatur tertentu, cairan penyari akan mendidih sambil mengekstraksi zat aktif yang ada dalam sel. Karena panas, uap akan naik ke kondensor dan mengalami kondensasi lalu turun menyari simplisia. Demikian seterusnya hingga zat aktif tersari sempurna dan diulang 3 kali sampai 4 jam hingga proses ekstraksi sempurna.
d. Sokhletasi
Prinsip penggunaan metode ini adalah dengan cara memanaskan pelarut hingga membentuk uap dan membasahi sampel. Pelarut yang sudah membasahi sampel kemudian akan turun menuju labu pemanasan dan kembali menjadi uap untuk membasahi sampel, sehingga penggunaan pelarut dapat dihemat karena terjadi sirkulasi pelarut yang selalu membasahi sampel. Proses ini sangat baik untuk senyawa yang tidak terpengaruh oleh panas.
Penentuan ketoksikan ekstrak dengan metode BSLT (Brine Lethality Test) menggunakan larva udang (Artemia salina) dengan memasukkan 10 ekor larva Artemia salina secara acak ke dalam vial yang telah berisi sampel dan control
negative dan setelah 24 jam dihitung jumlah larva yang mati dengan menggunakan parameter Lethal Concentration 50 (LC50) .
2. Isolasi
a. Kromatografi Lapis Tipis
Pemisahan senyawa dengan metode KLT Preparatif yang terjadi berdasarkan perbedaan daya serap dan daya partisi serta kelarutan dari komponen-komponen kimia yang akan bergerak mengikuti kepolaran eluen, oleh karena daya serap adsorben terhadap komponen kimia tidak sama, maka komponen bergerak dengan kecepatan yang berbeda sehingga hal inilah yang menyebabkan pemisahan.
b. Kromatografi cair Vakum
Proses isolasi dengan menggunakan Kromatografi Cair Vakum (KCV) untuk memisahkan golongan senyawa menggunakan silika gel sebagai absorben dan berbagai perbandingan pelarut n-heksan, etil asetat, methanol dan menggunakan pompa vakum untuk memudahkan penarikan eluen.
3. Identifikasi komponen kimia a. UV 254 nm
b. Pada UV 366 nm
Pada UV 366 nm, noda akan berflouresensi dan lempeng akan tampak berwarna gelap. Penampakan noda pada lampu UV 366 nm adalah karena adanya interaksi antara sinar UV dengan gugus kromofor yang terikat oleh ausokrom yang ada pada noda tersebut. Flouresensi cahaya yang tampak merupakan emisi cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang tereksitasi dari tingkat energi dasar ke tingkat energi yang lebih tinggi kemudian kembali ke keadaan semula sambil melepaskan energi. Sehingga noda yang tampak pada lampu UV 366 nm terlihat terang karena silika gel yang digunakan tidak berflouresensi pada sinar UV 366 nm.
c. Pereaksi H2SO4 10%
Prinsip penampakan noda pada pereaksi H2SO4 10 % adalah berdasarkan
kemampuan asam sulfat yang bersifat reduktor dalam merusak gugus kromofor dari zat aktif simplisia sehingga panjang gelombangnya akan bergeser ke arah yang lebih panjang (UV menjadi VIS) sehingga noda menjadi tampak oleh mata.
d. Perekasi Dragendorrf
Pada pengujian senyawa golongan alkaloid, plat silika gel hasil uji KLT disemprot dengan pereaksi Dragendorff, uji positif apabila menghasilkan noda berwarna coklat atau jingga.
e. Pereaksi AlCl3
Pada pengujian senyawa flavonoid, plat silika gel hasil uji KLT disemprot dengan AlCl3. Timbul noda berwarna kuning yang menandakan ekstrak mengandung
flavonoid bebas. Flavonoid bebas jenis flavonol akan memberikan warna kuning cerah untuk menunjukkan hasil positif flavonoid.
Indikasi positif steroid ditandai dengan adanya perubahan warna menjadi biru kehijauan. Pada terpenoid, indikasi positif ditandai dengan perubahan warna menjadi merah, ungu atau kecoklatan.
TINJAUAN PUSTAKA A. Uraian Tanaman
1. Klasifikasi Tumbuhan (Tjitrosoepomo, 2005) Kingdom : Plantae
Subkingdom : Tracheobionta Super Divisi : Spermatophyta Division : Magnoliophyta Class : Magnoliopsida Sub Class : Magnoliidae
Ordo : Piperales
Family : Piperaceae
Genus : Piper
Species : Piper betle L. 2. Nama Daerah
namuera (Saberi), etouwon (Armahi), nai wadok (Sarmi), mera (Sewan), mirtan (Berik), afo (Sentani), wangi (Sawa), freedor (Awija), dedami (Marind) (Wijayakusuma,1992)
3. Morfologi Tumbuhan
Banyak ditanam di halaman, batang berwarna hijau kecokelatan, permukaan kulit kasar dan berkerut-kerut, mempunyai nodule/ruas yang besar tempat keluarnya akar. Tumbuh memanjat dan bersandar pada batang pohon lain. Tinggi dapat mencapai 5 m-15 m. Daun tebal, tumbuh berseling, bertangkai, daun berbentuk jantung dengan ujung daun meruncing, tepi rata. Lebar 2,5 10 cm, panjang 5 cm-18 cm, mengeluarkan bau aromatik bila diremas. Bunga tersusun dalam bentuk bulir, merunduk, panjang 5 cm-15 cm, sendiri-sendiri di ujung cabang dan ketiak daun. Buahnya buah buni, bulat, berdaging, berwarna kuning hijau, menyambung menjadi bulat panjang. Biji berbentuk bulat (Wijayakusuma,1992).
4. Kandungan Kimia
Daun Ganjeng mempunyai kandungan kimia minyak atsiri 1%-4,2%, hidroksikavicol, kavicol 7,2%-16,7%, kavibetol 2,7%-6,2%, allypyrokatekol 0%-9,6%, karvakrol 2,2%-5,6%, eugenol 26,6%-42,5%, eugenol methyil eter 4,2%-15,8%, p-cymene 1,2%-2,5%, cineole 2,4%-4,8%, caryophyllene 3,0%-9,8%, cadinene 2,4%-15,8%, estragol, terpenena, seskuiterpena, fenil propane, tannin, diastase 0,8%-1,8%, gula, pati (Wijayakusuma,1992).
5. Khasiat Tumbuhan
kurap kaki, bisul, mimisan, perdarahan gusi, mengurangi produksi ASI (Air Susu Ibu), dan menghilangkan gatal (Wijayakusuma,1992).
B. Metode Ekstraksi 1. Maserasi
Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang diluar sel, maka larutan yang terpekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan diluar sel dengan larutan di dalam sel.
Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat yang mudah mengembang dalam cairan penyari, tidak mengandung benzoin dan lain-lain. Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol, atau pelarut lain. Bila cairan penyari digunakan air maka untuk mencegah timbulnya kapang, dapat ditambahkan bahan pengawet, yang diberikan pada awal penyarian.
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan peralatan sederhana dan mudah diusahakan. Kerugian cara maserasi adalah pengerjaanya lama dan penyariannya kurang sempurna.
2. Perkolasi
a. Aliran cairan penyari menyebabkan adanya pergantian larutan yang terjadi dengan larutan yang konsentrasinya lebih rendah, sehingga meningkatkan derajat perbedaan konsentrasi.
b. Ruangan diantara serbuk-serbuk simplisia membentuk saluran tempat mengalir cairan penyari. Karena kecilnya saluran kapiler tersebut, maka kecepatan pelarut cukup untuk mengurangi lapisan batas, sehingga dapat meningkatkan perbedaan konsentrasi.
3. Sokhletasi
Pada metode sokhletasi ini bahan yang akan diekstraksi berada pada sebuah kantung ekstraksi (kertas, karton, dan sebagainya). Di dalam sebuah alat ekstraksi dari gelas yang bekerja kontinyu (perkolator). Wadah gelas yang mengandung kantung diletakkan di antara labu suling dan suatu aliran balik dan dihubungkan dengan melalui pipa pipet. Labu tersebut berisi pelarut, yang menguap dan mencapai ke dalam pendingin aliran balik melalui pipa pipet, dan berkondensasi didalamnya, menetes ke atas bahan yang diekstraksi dan membawa keluar bahan yang diekstraksi. Larutan berkumpul di dalam wadah gelas dan setelah mencapai tinggi maksimal secara otomatis ditarik ke dalam labu, dengan demikian zat yang terekstraksi tetimbun melalui penguapan kontinyu dari bahan pelarut murni.
ekstraksi, terutama dari titik didih bahan yang digunakan, dapat bekerja negatif terhadap bahan tumbuhan yang peka terhadap suhu (glikosida, alkaloida).
Adapun cara kerja sokhletasi yaitu pertama-tama yang harus dilakukan adalah serbuk sampel dibungkus dengan kertas saring atau tempat tertentu. Kemudian dimasukkan ke dalam alat sokhlet. Pelarut etanol ditambahkan dari bagian atas sampai tumpah ke dalam labu. Ditambahkan pelarut lagi kira-kira sampai setengahnya. Labu yang sudah berisi pelarut tersebut dipanaskan pada suhu tertentu sampai mendidih. Pada proses ini uap pelarut akan naik dan bersentuhan dengan kondensor. Dimana uap akan terkondensasi dan menetes di atas sampel dan selanjutnya merendam sampel tersebut. Selama proses ini serbuk sampel akan terekstraksi. Apabila ekstrak sudah sampai pada batas “pipa sifon” maka ekstrak akan turun ke labu dan akan mendidih kembali. Proses ini akan berjalan kontinyu sampai semua ekstrak terekstraksi (Depkes RI, 1986: 28).
4. Refluks
Cara ini termasuk cara ekstraksi berkesinambungan. Bahan yang akan diekstraksi direndam dalam cairan penyari dalam labu alas bulat yang dilengakapi dengan pendingin tegak, kemudian dipanaskan sampai mendidih lalu cairan penyari akan menguap, dan uap tersebut akan diembunkan oleh pendingin tegak dan turun kembali menyari zat aktif dalam simplisia demikian seterusnya. Ekstraksi secara refluks biasanya dilakukan selama 3-4 jam.
kemudian labu alas bulat dipasang kuat pada statif dan ditempatkan diatas water bath atau heating mantel lalu dipasang kondensor pada labu alas bulat yang
dikuatkan dengan klem dan statif. Aliran air dan pemanas dijalankan sesuai dengan suhu pelarut yang digunakan. Setelah 4 jam dilakukan penyaringan, filtrat ditampung di dalam wadah penampung dan ampasnya ditambah lagi dengan pelarut dan dikerjakan seperti semula. Ekstraksi dilakukan 3-4 jam. Filtrat yang diperoleh dikumpulkan dan dipekatkan dengan rotavapor.
Keuntungan dari metode ini adalah digunakan untuk mengekstraksi sampel-sampel yang mempunyai tekstur kasar dan tahan pemanasan langsung. Kerugiannya adalah membutuhkan volume total pelarut yanf besar dan sejumlah manipulasi dari operator (Sastromihardjojo, Hardjono, 2009: 65-67).
5. Destilasi Uap Air
Destilasi uap dapat dipertimbangkan untuk menyari serbuk simplisia yang mengandung komponen yang mempunyai titik didih tinggi pada tekanan udara normal. Pada pemanasan biasa kemungkinan akan terjadi kerusakan zat aktifnya. Untuk mencegah hal tersebut maka penyarian dilakukan dengan destilasi uap.
6. Partisi Cair-Cair dan Cair-Padat
Ekstraksi cair-cair adalah proses pemisahan zat terlarut didalam 2 macam zat pelarut yang tidak saling bercampur atau dengan kata lain perbandingan konsentrasi zat terlarut dalam pelarut organik, dan pelarut air. Hal tersebut memungkinkan karena adanya sifat senyawa yang dapat terlarut dalam air dan adapula senyawa yang dapat larut dalam pelarut organik. Ekstraksi bahan alam dilakukan dengan cara : ekstrak metanol terlebih dahulu dipekatkan kemudian ditimbang dan ditimbahkan sedikit air hingga diperoleh suspensi yang homogen. Kemudian dipindahkan ke dalam corong pisah dan ditambahkan dietil eter (pelarut organik), setelah itu corong pisah ditutup, dibalik dan kran corong dibuka lalu dikocok satu arah beberapa kali hingga didapatkan massa yang terdistribusi. Setelah itu kran corong ditutup lalu corong dibalik dan dibiarkan hingga terjadi pemisahan. Lapisan air dikeluarkan dan lapisan eter ditampung. Lapisan air dikocok lagi dengan dieti eter kembali biasanya dilakukan 3 kali ekstraksi.
Ekstraksi cair-cair (liquid extraction, solvent extraction): solute dipisahkan dari cairan pembawa (diluen) menggunakan solven cair. Campuran diluen dan solven ini adalah heterogen ( immiscible, tidak saling campur), jika dipisahkan terdapat 2 fase, yaitu fase diluen (rafinat) dan fase solven (ekstrak). Fase rafinat sama dengan fase residu, berisi diluen dan sisa solut. Fase ekstrak sama dengan fase yang berisi solut dan solven (Fitokimia UMI, 2011).
7. Identifikasi dengan Kromatografi Lapis Tipis (KLT)
fisikokimia. Lapisan yang memisahkan, yang terdiri atas bahan berbutir-butir (fase diam), ditempatkan pada penyangga berupa pelat gelas, logam, atau lapisan yang cocok. Campuran yang akan dipisah, berupa larutan, ditotolkan berupa bercak atau pita (awal). Setelah pelat atau lapisan diletakkan dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler (pengembangan). Selanjutnya, senyawa yang tidak berwarna harus ditampakkan (dideteksi).
KLT dapat dipakai dengan dua tujuan. Pertama, dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau preparatif. Kedua, dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi. Dengan memakai KLT, pemisahan senyawa yang amat berbeda seperti senyawa organik alam dan senyawa organik sintetik, kompleks anorganik-organik, dan bahkan ion anorganik, dapat dilakukan dalam beberapa menit dengan alat yang harganya tidak terlalu mahal. Jumlah cuplikan serendah beberapa mikrogram atau setinggi 5 gram dapat ditangani, bergantung pada alat yang ada dan gejala kromatografi yang terlibat. Kelebihan KLT yang lain ialah pemakaian pelarut dan cuplikan yang jumlahnya sedikit, kemungkinan penotolan cuplikan berganda (saling membandingkan langsung cuplikan praktis), dan tersedianya berbagai metode (seperti KCP, KCC, dan kromatografi eksklusi).
aluminium. Lempeng yang lazim berukuran 20cm x 5cm. Untuk memperoleh hasil yang dapat dibandingkan pada KLT, beberapa kondisi harus diperhatikan (Stahl, 1985: 1).
a. Fase diam (lapisan penjerap)
Lapisan dibuat dari salah satu penjerap yang khusus digunakan untuk KLT yang dihasilkan oleh berbagai perusahaan. Panjang lapisan tersebut 200 mm dengan lebar 200 atau 100 mm. Untuk analisis, tebalnya 0,1-0,3 mm, biasanya 0,2 mm. Sebelum digunakan lapisan disimpan dalam lingkungan yang tidak lembab dan bebas dari uap laboratorium.
Adsorben yang paling banyak digunakan dalam KLT adalah silika gel dan aluminium oksida. Silika gel umumnya mengandung zat tambahan kalsium sulfat untuk mempertinggi daya lekatnya. Zat ini digunakan sebagai adsorben universal untuk kromatografi senyawa netral, asam dan basa. Aluminium oksida mempunyai kemampuan koordinasi dan oleh karena itu sesuai untuk pemisahan senyawa yang mengandung gugus fungsi berbeda. Aluminium oksida mengandung ion alkali dan dengan demikian bereaksi basa dalam suspensi air. Disamping kedua adsorben yang sangat aktif ini dalam hal tertentu dapat digunakan kieselgur yang kurang aktif sebagai lapis sorpsi. Untuk pemisahan tertentu selanjutnya juga digunakan poliamida, selulosa, kalsium dan magnesium selikat serta adsorben yang diimpregasi (Stahl, 1985:5).
b. Fase gerak (pelarut pengembang)
Dalam kromatografi jerapan (atau KLT) aktivitas zat penjerap tergantung pada eluen yang paling berpengaruh terhadap hasil kromatografi. Bila keaktivan zat penjerap meningkat karena uadara agak lembab, penahana (retensi) bahan atau senyawa yang dipisahkan menurun sehingga ada kemungkinan harga Rf dari senyawa yang dipisahkan itu bertukar. Karena itulah bila dipakai pelarut bebas air, ruang kromatografi harus mempunyai kelembaban nisbi 50% yang dapat diperoleh dengan menempatkan asam sulfat 44% (d=1,340). Selanjutnya semua lempeng yang akan dipakai diaktifkan atau dinonaktifkan di atas asam sulfat pekat tersebut selama 30 menit dalam ruang CAMAG-Vario-KS (Stahl, 1985: 6).
Perbandingan kecepatan ini disingkat dengan Rf (Rate of Flow). Rf=Jarak yang ditempuh senyawa terlarut
Jarak yang ditempuholeh pelarut
Faktor yang mempengaruhi harga Rf adalah : a. Ukuran partikel pada adsorben
b. Derajat keaktifan dari lapisan penjerap c. Ketetapan perbandingan dari eluen d. Konsentrasi zat yang dipanaskan e. Kejenuhan chamber
f. Diameter penotol g. Tehnik percobaan
h. Suhu
i. Keseimbangan
j. Jumlah cuplikan yang digunakan
k. Tebal dan kerataan dari lapisan penjerap l. Pelarut
Jenis-jenis adsorben antara lain sebagai berikut : a. Magnesium oksida
b. Magnesium karbonat
c. Silika gel
d. Aluminium oksida e. Potassium karbonat
f. Calsium oksida
g. Magnesium silikat
Manfaat penggunaan KLT antara lain :
a. Pemeriksaan kualitatif dan kemurnian senyawa obat. b. Pemeriksaan simplisia hewani dan tanaman.
c. Pemeriksaan komposisi dan komponen aktif sediaan obat.
d. Penentuan kualitatif masing-masing senyawa aktif campuran senyawa obat (Sastroamidjojo, 1985: 34-36 dan Gritter, 1991: 112-115.)
8. Identifikasi senyawa dengan Kromatografi Lapis Tipis Preparatif
Cara pembuatan lempeng kaca. Kerja ini kemudian agak diringankan dengan adanya penyaput otomatis. Meskipun begitu, dengan menggunakan alat itu pun diperlukan tindakan pencegahan tertentu. Pelat kaca harus dibersihkan hati-hati dengan aseton untuk menghilangkan lemak. Kemudian bubur silica gel (atau penjerap lain) dalam air harus dikocok kua-kuat selama jangka waktu tertentu (misalnya 90 detik) sebelum penyaputan. Tergantung pada ukuran partikel-partikel penjerap, mungkin harus ditambahkan kalsium sulfat hemihidrat (15%) untuk membantu melekatkan penjerap pada plat kaca. Akhirnya, setelah penyaputan, pelat harus dikeringkan pada suhu kamar dan kemudian diaktifkan dengan pemanasan dalam tanur pada suhu 100oC–110oC selama 30 menit. Pada beberapa pemisahan
garam anorganik (misalnya perak nitrat untuk KLT pemerakan), dan hal ini penting baik dikerjakan pelat yang disaput sendiri di laboratorium ialah karena kadar air silika gel dapat dikendalikan. Hal ini merupakan faktor yang kritis untuk beberapa pemisahan (Harborne, 1987: 13).
KLT preparatif dilakukan dengan menggunakan lapisan tebal (sampai 1 mm) sebagai pengganti lapisan penjerap yang ipis (0.10 mm-0,2 mm), pelat preparatif yang dibua oleh pabrik dapat dibeli. Kandungan yang sudah dipisah dapat diperoleh kembali dengan cara mengerok penjerap di tempat yang sesuai pada pelat yang telah dikembangkan, lalu serbuk dielusi dengan pelarut seperti eter, dan akhirnya dipusingkan untuk menghilangkan penjerap (Harborne, 1987: 14).
Demikian kuatnya lapisan penjerap melekat pada kaca sehingga memungkinkan pengembangan plat berulang-ulang dengan pengembang yang sama atau beberapa pengembang yang berbeda, dengan mengeringkan pelat sebelum pengembangan berikutnya. Pilihan lain ialah sistem KLT multieliminasi yang dirancang oleh Van Sumere (1969). Pada cara ini, untuk pemisahan yang rumit, pelat kaca segiempat yang sudah disaput dengan penjerap dipotong pada tahap yang tepat dengan pemotong kaca. Penjerap-baru disemprotkan merata pada pelat, dilakukan di antara dua pengembangan (Harborne, 1987: 14-15).
9. KLT Multi Eluen dan Dua Dimensi
Multi eluen adalah penggunaan eluen atau fase gerak yang berbeda yang memungkinkan pemisahan analit dengan berdasarkan tingkat polaritas yang berbeda (Wall, 2005: 112).
meningkatkan resolusi komponen dengan nilai RF bawah 0,5. Beberapa pengembang dilakukan dengan pelarut yang berbeda dalam arah yang sama, masing-masing yang menjalankan jarak yang sama atau berbeda, disebut elusi bertahap. "Sebuah fase kurang polar dapat digunakan pertama, diikuti oleh fase yang lebih polar, atau sebaliknya. Pemindahan material nonpolar kebagian atas lapisan, meninggalkan zat terlarut polar terganggu dari mana dia berasal. Setelah kering, zat terlarut polar dipisahkan oleh pengembang dengan eluen (Fried, 1999:112).
Keuntungannya adalah kadang-kadang pelat KLT tampaknya tidak cukup lama untuk memberikan pemisahan yang diperlukan pada komponen sampel (Wall, 2005: 113).
KLT dua arah atau dua dimensi ini bertujuan untuk meningkatkan resolusi sampel ketika komponen-komponen solute mempunyai karakteristik kimia yang hampir sama, karenanya nilai Rf juga hampir sama sebagaimana dalam asam-asam amino. Selain itu, dua sistem fase gerak yang sangat berbeda dapat digunakan secara berurutan sehingga memungkinkan untuk melakukan pemisahan analit yang mempunyai tingkat polaritas yang berbeda (Gandjar, 2009: 364).
Bagaimanapun juga, suatu metode telah dikembangkan. Dulunya asam amino telah dipisahkan dengan cara ini selama berabad-abad (Wall, 2005: 115).
10. Bioassay
a. Brine Shrimp Lethality Test (BST)
Brine Shrimp Lethality Test (BST) adalah suatu metode pengujian dengan menggunakan hewan uji yaitu larve udang (Artemia salina Leach), yang dapat digunakan sebagai bioassay yang sederhana untuk meneliti toksisitas akut suatu senyawa, dengan cara menentukan nilai LC 50 yang dinyatakan dari komponen aktif suatu simplisia maupun bentuk sediaan ekstrak dari suatu tanaman. Apabila suatu ekstrak tanaman bersifat toksik menurut harga LC 50 dengan metode BST, maka tanaman tersebut dapat dikembangkan sebagai obat anti kanker. Namun, bila tidak bersifat toksik maka tanaman tersebut dapat diteliti kembali untuk mengetahui khasiat lainnya dengan menggunakan hewan coba lain yang lebih besar dari larva udang (Artemia salina Leach) seperti mencit dan tikus secara in vivo. Suatu senyawa dinyatakan mempunyai potensi toksisitas akut jika mempunyai harga LC 50 kurang dari 1000 μg/ml. LC 50 (Lethal Concentration 50) merupakan konsentrasi zat yang menyebabkan terjadinya kematian pada 50 % hewan percobaan yaitu larva udang (Artemia salina Leach) (Pisutthanan et al, 2004. 13-18).
C. Uraian Bahan
1. Aquadest (Dirjen POM, 1979: 96)
Nama resmi : AQUA DESTILLATA Nama lain : Aquades, air suling. Rumus molekul : H2O
Rumus struktur :
Pemerian : Cairan jernih, tidak berwarna, tidak berbau, tidak mempunyai rasa
Penyimpanan : Dalam wadah tertutup baik. Kegunaan : Sebagai pelarut.
2. Etil asetat (Rowe, 2009: 253)
Nama resmi : ETHYL ACETATE
Nama lain : Acetic acid ethyl ester, acetic ester, acetic ether, acetoxyethane, etil etanoat, etil asetat.
Rumus molekul : C4H8O2 Rumus struktur :
Berat molekul : 88,1
Pemerian : Cairan jernih, tidak berwarna, mudah menguap dengan aroma seperti buah, harum, mudah terbakar. Kelarutan : Larut dalam 10 bagian air pada suhu 25°C, etil asetat
lebih larut dalam air pada suhu yang lebih rendah dari pada suhu yang lebih tinggi. Larut dalam aseton, kloroform, diklorometana, etanol (95%), dan eter, dan beberapa pelarut organik.
Kegunaan : Sebagai eluen. 3. Metanol (Sweetman, 2009: 2024)
Nama resmi : METHYL ALCOHOL
Rumus struktur :
Berat molekul : 32,04
Pemerian : Cairan tidak berwarna, jernih, mudah menguap, cairan higroskopis, mudah bergerak, bau khas, rasa panas, mudah terbakar.
Kelarutan : Bercampur dengan air, membentuk cairan jernih tidak berwarna, larut dengan diklorometana, dengan alkohol, dengan eter, dengan benzena, dan dengan sebagian besar pelarut organik lainnya.
Penyimpanan : Dalam wadah tertutup rapat, jauh dari panas, percikan dan nyala api terbuka.
Kegunaan : Sebagai pelarut. 4. Kloroform (Dirjen POM, 1995: 206)
Nama resmi : CHLOROFORMUM
Nama lain : Kloroform, Triklorometana [67-66-3] Rumus molekul : CHCl3
Rumus struktur :
Berat molekul : 119,38
Kelarutan : Sukar larut dalam air, dapat bercampur dengan etanol, dengan eter, dengan benzena, dengan heksana, dan dengan lemah dan minyak menguap.
Kegunaan : Sebagai pelarut.
Penyimpanan : Dalam wadah tertutup rapat, terlindung dari cahaya, pada suhu tidak lebih dari 30°.
5. NaCl (Dirjen POM, 1995: 584)
Nama resmi : NATRII CHLORIDUM Nama lain : Natrium klorida
Rumus molekul : NaCl Rumus struktur : Na – Cl Berat molekul : 458,44
Pemerian : Hablur bentuk kubus, tidak berwarna atau serbuk hablur putih, rasa asin.
Kelarutan : Mudah larut dalam air, sedikit lebih mudah larut dalam air mendidih, larut dalam gliserin, sukar larut dalam etanol.
Kegunaan : Sebagai medium perkembang biakan larva udang. Penyimpanan : Dalam wadah tertutup baik.
6. N-Heksan (Sweetman, 2009: 2024)
Nama resmi : n –HEXANE
Nama lain : n-Heksane Rumus molekul : C6H14
Berat molekul : 86,18
Pemerian : Cairan jernih, tidak berwarna, mudah terbakar, mudah menguap dengan bau samar.
Penyimpanan : Dalam wadah kedap udara. Kegunaan : Sebagai pelarut dan eluen. 7. Ragi (Dirjen POM, 1995: 1153)
Nama resmi : Ekstrak ragi
Sinonim : Sari ragi
Pemerian : Kuning kemerahan sampai coklat, bau khas tidak busuk.
Kelarutan : Larut dalam air, membentuk larutan kuning sampai coklat, bereaksi asam lemah.
Penympanan : Dalam wadah tertutup baik.
Kegunaan : Sebagai pakan larva Arthemia salina L. D. Uraian Larva
1. Klasifikasi (Mudjiman, 1998)
Filum : Arthopoda
Divisio : Crustaceae
Subdivisio : Branchiopoda
Ordo : Anostraca
Famili : Artemiidae
Genus : Artemia
Species : Artemia salina L. 2. Morfologi (Mudjiman, 1998)
(nauplii) dan artemia dewasa. Telur yang baru dipanen dari alam berbentuk bulat dengan ukuran 0,2-0,3 mm. Telur yang menetas akan berubah menjadi larva. Telur yang baru menetas ini berukuran kurang lebih 300 µ. Dalam pertumbuhannya larva mengalami 15 kali perubahan bentuk yang merupakan satu tingkatan hidup, setelah itu berubah menjadi artemia dewasa.
Waktu yang diperlukan sampai menjadi artemia dewasa umumnya sekitar 2 minggu. Berbentuk silinder dengan panjang 12-15 mm. Tubuh terbagi atasl bagian kepala, dada dan perut. Pada bagian kepala terdapat 2 tangkai mata, 2 antena dan dua antenula. Dada terbagi atas 12 segmen yang masing-masing mempunyai sepasang kaki renang. Perut ternagi atas 8 segmen. Dapat hidup dalam air dengan suhu 25o
-30oC dan pH sekitar 8-9.
3. Uraian Tentang Larva (Mudjiman, 1998)
Telur-telur yang kering direndam dalam air laut yang bersuhu 25oC akan
menetas dalam waktu 24-36 jam. Dari dalam cangkangnya keluarlah burayak (larva) yang juga dikenal dengan istilah nauplius. Dalam perkembangan selanjutnya, burayak akan mengalami 15 kali perubahan bentuk (metamorfosis). Burayak tingkat I dinamakan instar, tingkat II instar II, tingkat III Instar III, demikian seterusnya sampai Instar XV. Setelah itu berubahlah mereka menjadi artemia dewasa.
(rahang) dan rudimenter kecil. Sedangkan dibagian perur (ventral) sebelah depan terdapatlah labrum.
Pada pangkal sungut besar (antena II) terdapat bangunan seperti duri yang menghadap ke belakang (gnotobasen seta) bangunan ini merupakan cirri khusus untuk membedakan burayak instar I, instar II dan instar III. Pada burayak instar I (baru menetas) gnotobasen setanya masih belum berbulu dan juga belum bercabang.
Sekitar 24 jam setelah menetas, burayak akan berubah menjadi instar II. Lebih lama lagi akan berubah menjadi instar III. Pada tingkatan II, gnotobasen setanya sudah berbulu tapi masih belum bercabang. Sedangkan pada instar III, selain berbulu gnotobasen seta tersebut sudah bercabang II.
Pada tingkatan instar II, burayak mulai mempunyai mulut, saluran pencernaan dan dubur. Oleh karena itu, mereka mulai mencari makan, bersamaan dengan itu, cadangan makanannya juga sudah mulai habis. Pengumpulan makanannya dengan cara menggerak-gerakkan antena II-nya. Selain itu untuk mengumpulkan makanan antena II juga berfungsi untuk bergerak. Tubuh instar II dan instar III sudah lebih panjang dari instar I.
BAB III
METODE PRAKTIKUM A. Alat dan Bahan
1. Alat yang digunakan
Adapun alat yang digunakan pada percobaan ini yaitu alat refluks, cawan porselin, chamber, corong, corong pisah, gelas ukur, gelas kimia, gegep, kain putih, labu alas bulat, lampu UV 366 dan 254 nm, lampu belajar, lempeng kaca, mangkok kaca, magnetik stirrer, pipet tetes, pipa kapiler, pensil, penggaris, pipet volume, pinset, pompa vakum, oven, rotary evaporator, senter glass, sendok besi, statif dan klem, tabung sentrifuge, timbangan, timbangan analitik, timbangan ohaus, vial.
2. Bahan yang digunakan
Adapun bahan yang digunakan pada percobaan ini yaitu aquadest, aluminium foil, butanol, etil asetat, garam tidak beryodium, H2SO4, kertas saring, karet gelang,
kapas, kloroform, lakban, lempeng silika gel, metanol, n-butanol, n-hexan, daun Ganjeng (Piper betle L), permipan, plastik bening, serbuk silika gel.
B. Cara Pengerjaan Sampel 1. Penyiapan Sampel
Diucapkan basmalah. Diambil sampel berupa daun Ganjeng. Di cuci bersih daun Ganjeng, kemudian dipotong-potong kecil. Di keringkan dengan cara diangin-anginkan pada tempat yang tidak terkena sinar matahari langsung, kemudian disortasi kering.
2. Pembuatan Herbarium
sampel tidak ditumbuhi mikroba. Ditempelkan herba pada sasak dengan menggunakan selotip bebas asam dan ditutup sasak.
3. Ekstraksi a. Maserasi
Diucapkan basmalah. Disiapkan alat dan bahan yang akan digunakan. Dipotong kecil-kecil sampel daun Ganjeng. Ditimbang sampel sebanyank 150 gram. Kemudian dimasukkan 150 gram sampel ke dalam toples. Dibasahi sampel menggunakan larutan metanol. Ditambahkan pelarut metanol ke dalam toples hingga melewati sampel (sampel terendam). Ditutup toples menggunakan aluminium foil kemudian ditutup rapat dengan penutup toples. Dibiarkan sampel terendam selama ± 24 jam. Dilakukan proses penyarian setelah ± 24 jam menggunakan kain putih dan corong yang telah disumbat kapas. Dilakukan proses remaserasi sampel yang telah disaring tadi. Ditampung hasil maserasi.
4. Sokletasi
Diucapkan basmalah. Disiapkan alat dan bahan yang akan digunakan. Ditimbang sampel daun Ganjeng sebanyak 50 gram. Dimasukkan sampel ke dalam labu alas bulat. Ditambahkan 500 ml metanol ke dalam labu alas bulat. Dirangkai alat sokletasi. Dimulai penyarian 20-24 siklus. Ditampung hasil ekstrak daun Ganjeng
5. Refluks
6. Partisi a. Partisi Cair-Cair
Diucapkan basmalah. Disiapkan alat dan bahan. Ditimbang ekstrak metanol daun Ganjeng sebanyak 2 gram. Dilarutkan ekstrak dengan 30 ml hexan dan dimasukkan ke dalam corong pisah. Disuspensikan ekstrak yang tidak larut dengan 10 ml air dan dimasukkan ke dalam corong pisah. Digojog corong pisah hingga homogen dan didiamkan beberapa saat hingga terbentuk dua lapisan pelarut. Dipipet lapisan n-hexan kemudian ditampung dalam wadah yang disaring terlebih dahulu menggunakan corong dan kertas saring. Ditambahkan kembali 30 ml n-hexan ke dalam corong pisah lalu digojog hingga terbentuk lagi dua lapisan pelarut. Dilakukan penggantian pelarut n-hexan sebanyak 5 kali. Diuapkan lapisan n-hexan yang diperoleh. Ditambahkan pelarut n-butanol jenuh air pada lapisan air dalam corong pisah sebanyak 10 ml kemudian digojok. Didiamkan corong pisah hingga terbentuk dua lapisan. Ditampung lapisan n-butanol jenuh air lalu disaring. Ditambahkan kembali pelarut n-butanol jenuh air dan penggantian pelarut n-butanol dilakukan pula sebanyak 5 kali. Diuapkan lapisan n-butanol jenuh air hingga kental. Ditimbang masing-masing ekstrak n-hexan dan n-butanol jenuh air. Dilakukan identifikasi senyawa dengan menggunakan teknik KLT (Kromatografi Lapis Tipis)
b. Partisi Cair-Padat
larutan n-hexan dalam tabung jernih. Digunakan larutan n-hexan sebanyak 1000 ml atau 1 liter dengan 10 siklus. Dihitung rendamen yang didapatkan.
7. Kromatografi Lapis Tipis a. Pengaktifan Lempeng silika
Disiapkan lempeng. Diukur batas bawah 1 cm dan batas atas 0,5 cm. Dimasukkan dalam oven hingga melengkung.
b. Penjenuhan chamber
Dimasukkan pelarut metanol dan etil 2:1 dan sebagainya. Digoyang-goyangkan chamber. Dimasukkan potongan kertas saring hingga mencapai tutup chamber. Ditandai chamber jenuh yang terelusi dengan pelarut pada kertas saring. c. Penyiapan sampel
Disiapkan alat dan bahan. Disiapkan sampel yang akan ditotol ke dalam 3 buah vial, vial pertama (ekstrak larut hexan), vial ke 2 (ekstrak tidak larut n-hexan), dan vial 3 (ekstrak larut metanol). Dilarutkan ekstrak n-hexan pada vial dengan n-hexan secukupnya hingga tidak terlalu pekat, kemudian ditutup dengan aluminium foil. Dilarutkan ekstrak tidak larut hexan dengan kloroform secukupnya hingga tidak terlihat pekat kemudian ditutup dengan aluminium foil. Dilarutkan ekstrak metanol pada vial 3 dengan metanol secukupnya hingga tidak terlihat pekat kemudian ditutup dengan aluminium foil. Divorteks ketiga vial hingga homogen. d. Pengujian Kromatografi Lapis Tipis
lempeng. Diamati dilampu UV 366 nm dan lampu UV 254 nm. Apabila tidak terdapat noda yang diinginkan maka lempeng disemprot dengan H2SO4 10% dan
dipanaskan hingga noda menjadi bercak kehitaman. Dilakukan pengujian berulang dengan perbandingan pelarut berbeda sampai profil KLT ditemukan.
8. BSLT (Brine Shirmp Lethality Test) a. Pembuatan air bebas protozoa
Diucapkan basmalah. Disiapkan alat dan bahan. Ditimbang garam tidak beriodium kira-kira 37 gram. Diukur aquadest 1000 ml (1 liter). Dilarutkan 38 gram NaCl (garam) tidak beriodium dalam 1 liter air. Diaduk kemudian disaring. Dimasukkan ke dalam toples kemudian ditutup.
b. Penyiapan larutan stok
Disiapkan alat dan bahan. Ditimbang ekstrak metanol, ekstrak larut n-hexan, dan ekstrak tidak larut n-hexan masing-masing sebanyak 30 mg. Ditambahkan 3 ml pelarut metanol ke dalam ekstrak metanol, 3 ml pelarut n-hexan ke dalam ekstrak larut n-hexan dan 3 ml pelarut n-butanol untuk ekstrak yang tidak larut n-hexan. Ditutup setiap ekstrak yang telah ditambahkan pelarut.
c. Penyiapan sampel ekstrak
d. Uji BSLT
Dimasukkan 10 ekor larva udang (Artemia salina L.) ke dalam vial dan dicukupkan dengan air laut sampai 5 ml. Ditambahkan 1 tetes suspensi ragi (9 mg/5 ml) ke dalam vial. Dihitung jumlah larva yang mati setelah 1x24 jam.
e. Penyiapan larutan uji
Ditetaskan larva udang dalam wadah penetas berbentuk kerucut berisi air laut yang dilengkapi dengan lampu sebagai sumber cahaya dan aerator sebagai sumber O2. Dibiarkan selama 1x24 jam. Dipindahkan ke dalam wadah gelap yang disisinya
merupakan wadah terang. Ditandai larva uji yang baik dengan larva yang berada pada wadah yang terang.
9. Kromatografi Kolom (KK) dan Kromatografi Cair Vakum (KCV) a. Kromatografi Kolom
Diucapkan basmalah. Disiapkan alat dan bahan yang akan digunakan. Dibebas lemakkan dengan dibilas menggunakan metanol. Dimasukkan kapas pada bagian bawah dari kolom. Dimasukkan silika gel sampai mengisi ¾ dari kolom lalu ketuk-ketuk hingga tidak terbentuk gelembung gas. Dikeluarkan silika dan ditimbang. Ditimbang sampel dengan perbandingan 1:100 sampel dan silika . Disuspensikan silika gel dan ekstrak dengan eluen pertama. Dimasukkan ke kolom lalu mampatkan. Dimasukkan selapis kertas saring di bagian atas. Ditampung isolat dalam vial dengan kecepatan alir 20 tetes per menit. Ditotolkan pada lempeng. Dilihat penampakan noda pada lampu UV 254 nm dan 366 nm. Digabung sampel dengan profil KLT yang sama lalu hitung nilai Rf nya.
b. Kromatografi Cair Vakum
ke dalam senter glass lalu dimampatkan. Diletakkan kertas sering diatasnya. Difraksinasi sampel dengan kromotografi cair vakum menggunakan eluen n-hexan, etil, dan metanol dengan berbagai perbandingan yang telah diketahui. Dimasukkan eluen n-hexan 60 ml, hexan:etil, dan etil:metanol masing-masing perbandingan ke dalam senter gelas lalu hasil fraksinasinya ditampung dalam wadah yang telah disiapkan. Diuapkan hasil fraksi hingga diperoleh ekstrak kental. Difraksinasi masing-masing ekstrak yang diperoleh dari berbagai perbandingan eluen saat dimasukkan ke dalam vial lalu diencerkan dengan pelarut kloroform:metanol. Ditotol ekstrak yang telah larut pada lempeng kemudian dielusi dengan eluen hexan:etil dengan perbandinga 3:1. Dilihat penampakan noda pada lempeng di bawah UV 254 nm dan 366 nm. Digabungkan sampel yang mempunyai profil KLT yang sama hingga diperoleh 2 fraksi (fraksi A dan fraksi B). Diuapkan pelarut fraksi yang diperoleh kemudian ditimbang. Dimasukkan masing-masing fraksi ke dalam vial secukupnya lalu dilarutkan dengan kloroform:metanol. Ditotol masing-masing fraksi pada lempeng kemudian dielusi. Fraksi A dielusi dengan hexan:etil (3:1) dan fraksi B dielusi dengan eluen etil:metanol (7:1). Dilihat penampakan noda fraksi A dan fraksi B di bawah lampu UV 254 nm dan 366 nm.
10. Kromatografi Lapis Tipis Preparatif a. Pembuatan lempeng
Dibaca basmalah. Disiapkan alat dan bahan yang akan digunakan. Ditimbang serbuk silika sebanyak 20 gram. Diukur 50 ml aquadest. Dihomogenkan serbuk silika dan aquadest ke dalam erlenmeyer hingga terbentuk bubur silika. Dituang bubur silika di atas lempeng kaca berukuran 20cm x 20cm dan diratakan. Didiamkan lempeng 1x24 jam. Diaktifkan lempeng dalam oven dengan suhu 1100 C selama 1-2
b. Penotolan sampel
Disiapkan alat dan bahan yang akan digunakan. Dilarutkan ekstrak fraksi A dalam vial dengan pelarut kloroform:metanol (1:1). Ditotolkan ekstrak yang larut pada lempeng preparatif yang telah diaktifkan menggunakan pipa kapiler. Diukur eluen hexan:etil (3:1) masing-masing 45 ml dan 15 ml lalu dimasukkan ke dalam chamber lalu dijenuhkan. Setelah chamber jenuh, lempeng preparatif yang telah ditotol dimasukkan ke dalam chamber kemudian chamber ditutup dan ditunggu hingga proses elusi selesai. Setelah proses elusi selesai, lempeng dikeluarkan dari chamber lalu diangin-anginkan hingga eluennya menguap. Dilihat penampakan noda yang berbentuk pita pada UV 366 nm dan 254 nm. Diberi tanda noda yang berbentuk pita lalu dikeruk. Diperoleh 2 noda kemudian masing-masing noda di masukkan ke dalam 2 mangkok berbeda yang telah ditimbang dan diberi tanda noda 1 dan noda 2. Ditambahkan masing-masing noda dengan kloroform:metanol (1:1) sebanyak 10 ml, lalu dihomogenkan kemudian dipipet ke dalam tabung sentrifuge. Disentrifuge sampel dengan kecepatan 2500 rpm dalam waktu 5 menit. Setelah disentrifuge diperoleh dua lapisan yaitu cairan yang bening dan endapan. Dipipet cairan yang bening dari masing-masing noda ke dalam 2 vial yang berbeda yang telah ditimbang.
11. Multieluen dan dua dimensi a. Multieluen
1) Pengaktifan lempeng
Dibaca basmalah. Diambil lempeng yang akan digunakan yaitu lempeng silika gel F 254 yang berukuran 20cm x 20cm, dipotong dengan ukuran 7cm x 2cm. diaktifkan dalam oven pada suhu 1100C selama 30-60 detik. Setelah diaktifkan
2) Penotolan sampel
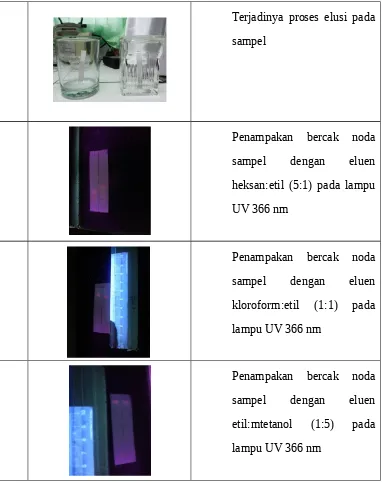
Dibaca basmalah. Disiapkan alat dan bahan. Disiapkan 2 noda hasil kromatografi lapis tipis preparatif yang akan ditotol pada lempeng silika gel yaitu noda 1 dan noda 2. Ditotol masing-masing noda pada lempeng silika gel yang telah diaktifkan. Disiapkan eluen yaitu hexan:etil (5:1), kloroform:etil (1:1), dan etil:methanol (1:5). Dielusi masing-masing noda dengan eluen yang telah disiapkan. Kemudian diamati penampakan noda masing-masing di bawah lampu UV 366 nm. b. Dua dimensi
1) Pengaktifan lempeng
Dibaca basmalah. Diambil lempeng yang akan digunakan yaitu lempeng silika gel F 254 yang berukuran 20cm x 20cm, dipotong dengan ukuran 7cm x 2cm. diaktifkan dalam oven pada suhu 1100C selama 30-60 detik. Setelah diaktifkan
lempeng diukur batas atas dan batas bawahnya. 2) Penotolan sampel
12. Identifikasi Golongan Senyawa a. Pengaktifan Lempeng
Dibaca basmalah. Diambil lempeng yang akan digunakan yaitu lempeng silika gel F 254 yang berukuran 20cm x 20cm, dipotong dengan ukuran 7cm x 2cm. diaktifkan dalam oven pada suhu 1100C selama 30-60 detik. Setelah diaktifkan
lempeng diukur batas atas dan batas bawahnya. b. Uji Identifikasi Golongan Senyawa
Dibaca basmalah. Disiapkan alat dan bahan yang akan digunakan. Ditotol noda 1 dan 2 pada lempeng silika gel sebanyak 12 totolan. Noda 1, 6 totolan dan noda kedua juga 6 totolan. Di masukkan eluen hexan : etil ke dalam chamber secara bersamaan, kemudian chamber dijenuhkan. Setelah jenuh, dimasukkan lempeng yang telah ditotol ke dalam chamber. Ditunggu hingga proses elusi selesai. Setelah proses elusi selesai, diamati lempeng di bawah lampu UV 366 nm. Setelah tampak noda yang diinginkan, lempeng kemudian dipotong-potong hingga menjadi 12 bagian yang terdiri atas 6 bagian noda pertama dan 6 bagian noda kedua. Setelah dipotong-potong, setiap lempeng disemprot atau ditetesi sejumlah pereaksi. Perekasi yang digunakan disini yaitu pereaksi Dragondorff untuk mengidentifikasi senyawa golongan alkaloid, perekasi Lieberman-Burchard untuk mengidentifikasi senyawa golongan steroid, pereaksi AlCl3 untuk mengidentifikasi senyawa golongan
flavonoid, pereaksi FeCl3 untuk mengidentifikasi senyawa golongan fenol dan
BAB IV
No Ekstrak Profil KLT Nilai Rf
b. Nilai Probit
No Fraksi ke Nilai Rf
0,58 cm
1 9,95 gram 9,7 gram 0,21 gram
2 10,42 gram 9,8 gram 0,62 gram
Pereaksi an
Daun Ganjeng (Piper betle L.) adalah salah satu tumbuhan yang sampai saat ini banyak dikenal sebagai tanaman obat. Daunnya sering digunakan sebagai obat yang dipercaya memiliki khasiat mencegah penyakit infeksi saluran kemih, pembersih gigi, obat sakit perut, dan obat luka oleh masyarakat Makassar, Sulawesi Selatan. Daun Ganjeng (Piper betle L.) diketahui mengandung Minyak atsiri. Mengingat manfaat dari Daun Ganjeng (Piper betle L.) yang banyak bermanfaat bagi tubuh.
Fitokimia adalah ilmu yang mempelajari kandungan kimia dari bahan alam yang mempunyai khasiat obat. Bahan alam meliputi tumbuhan, hewan, mineral, serta biota laut. Bahan alam tersebut mengandung beberapa komponen kimia yang dapat digunakan sebagai obat. Obat yang berasal dari bahan alam dikenal luas sebagai obat tradisional (Gunawan, 2004).
Adapun alat-alat yang digunakan pada praktikum kali ini yaitu: batang pengaduk, beker gelas, chamber, cawan porselin, corong, corong pisah, eksikator, gelas ukur, gelas arloji, kain putih, kipas angin, klem, lampu belajar, lap halus, lap kasar, lempeng kaca, lumpang, mikro pipet, mikroskop, magnetik stirer, neraca analitik, oven, pengayak, pipa kapiler, pipet tetes, rota vaporator, saringan vakum, sentrifuge, sendok tanduk, sendok besi, senter glass, spatel, spoit, statif, toples, tabung reaksi, tabung sentrifuge, timbangan kasar, vial.
L.), etanol, etilasetat, n-hexan, kloroform, KOH etanolik, kertas saring, larva udang (Artemia salina L), lempeng silika gel GF 254, metanol, n-hexan, n-butanol, permipan, plastik bening, serbuk silika gel GF 254, sel telur larva udang (Artemia salina L).
Dalam praktikum ini akan dilakukan percobaan untuk ekstraksi senyawa aktif tumbuhan tertentu yang berkhasiat obat. Percobaan dilakukan mulai dari pengambilan sampel, kemudian ekstraksi dan identifikasi senyawa kimia yang terdapat pada ekstrak tersebut dengan metode Kromatografi Lapis Tipis dan dengan menggunakan pereaksi kimia. Sampel tumbuhan yang digunakan dalam percobaan ini adalah daun Ganjeng atau disebut daun Sirih (Piper betle L.).
Daun Ganjeng diambil dengan cara dipetik langsung. Kemudian sampel dicuci hingga bersih dengan air mengalir dan kemudian dikeringkan dengan cara diangin-anginkan (tidak di bawah matahari langsung) agar komponen aktifnya tidak mudah terurai. Cara pengeringan dengan diangin-anginkan dan tidak di bawah matahari langsung terutama digunakan untuk mengeringkan bagian tanaman yang lunak seperti bunga dan daun. Setelah kering sampel dipotong kecil-kecil dengan tujuan untuk memudahkan molekul-molekul air yang terdapat dalam dalam sel tumbuhan dapat menguap dengan mudah.
Penghilangan molekul-molekul air ini dilakukan karena air merupakan medium yang mudah ditumbuhi mikroba atau jamur. Keberadaan mikroba atau jamur ini nantinya dapat mengganggu hasil ekstraksi senyawa aktif dari sampel. Selain itu tujuan dari pengeringan ini dilakukan juga dimaksudkan untuk mencegah terjadi reaksi enzimatis di dalam sel, di mana reaksi enzimatis ini dapat berlangsung bila simplisia mengandung air dengan jumlah lebih dari 10 %.
diambil dari habitatnya ditujukan untuk memisahkan simplisia yang utuh dan layak untuk diekstraksi dengan bagian tanaman lain yang tidak dibutuhkan serta kotoran dan benda asing seperti tanah, pasir serta kerikil. Sortasi yang kedua, yaitu sortasi kering yang dilakukan pada saat sampel telah dikeringkan untuk selanjutnya dapat diekstraksi dengan metode yang sesuai.
Setelah itu sampel dirajang hingga sesuai dengan ukuran yang diinginkan. Adapun tujuan dari proses ekstraksi ini adalah untuk menarik komponen kimia yang terdapat dalam simplisia. Ekstraksi yang dilakukan disesuaikan dengan sifat kimia fisika dari sampel dan juga tergantung dari zat yang dikandungnya.
Pada percobaan ini dilakukan ekstraksi dengan cara maserasi. Maserasi adalah penyarian zat aktif yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari yang sesuai pada temperatur kamar terlindung dari cahaya. Proses ekstraksi yang terjadi yaitu cairan penyari akan masuk ke dalam sel melewati dinding sel dan masuk ke dalam rongga yang mengandung zat aktif, kemudian zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka larutan yang konsentrasinya tinggi akan terdesak keluar dan diganti oleh cairan penyari dengan konsentrasi rendah (proses difusi). Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara di luar sel dan di dalam sel. Setelah proses maserasi selesai, kemudian di saring dengan kain putih. Digunakan kain putih agar ekstrak tidak terkontaminasi pewarna dari kain. Digunakan pula larutan penyari metanol, karena metanol bersifat semipolar sehingga dapat menarik komponen kimia yang bersifat polar maupun non polar pada daun sirih. Kemudian ekstrak metanol tersebut dikeringkan hingga larutan penyari menguap. Dari hasil percobaan ini diperoleh hasil ekstrak 2,067 gram.
cair-cair adalah ekstraksi cair-cair (corong pisah) merupakan pemisahan komponen kimia di antara 2 fase pelarut yang tidak saling bercampur di mana sebagian komponen larut pada fase pertama dan sebagian larut pada fase kedua, lalu kedua fase yang mengandung zat terdispersi dikocok, lalu didiamkan sampai terjadi pemisahan sempurna dan terbentuk dua lapisan fase cair, dan komponen kimia akan terpisah ke dalam kedua fase tersebut sesuai dengan tingkat kepolarannya dengan perbandingan konsentrasi yang tetap.
Sampel daun Ganjeng, dipartisi cair-padat. Prinsip dari ekstraksi cair-padat yaitu penarikan komponen kimia pada suatu sampel dengan menggunakan satu pelarut yang pelarutannya dilakukan secara terpisah di mana komponen kimia akan terlarut dalam pelarut dengan cepat dengan bantuan sentrifuge berdasarkan gaya sentrifugasi. Cara kerjanya yaitu pertama-tama disiapkan alat dan bahan yang akan digunakan untuk partisi cair-padat. Kemudian ditimbang ekstrak metanol sebanyak 5 gram. Lalu ekstrak metanol yang telah ditimbang, dilarutkan dengan 1000 ml n-heksan sedikit demi sedikit dalam lumpang dan digerus. Kemudian hasil gerusan disentrifuge dengan kecepatan 2500 rpm selama 5 menit. Dipisahkan antara ekstrak larut dan tidak larut n-heksan dan untuk yang larut n-heksan disaring menggunakan kertas saring dan ditampung pada mangkok. Dilakukan terus menerus dengan perlakuan yang sama hingga ekstrak yang ada pada lumpang menjadi bening. Dan semua hasil tampungan larut n-heksan diuapkan dan yang tidak larut n-heksan disimpan pada cawan porselin sebagai sampel ekstrak yang tidak larut n-heksan. Kemudian masing-masing ditimbang bobot ekstrak. Dari sini diperoleh larut heksan 4,06 gram dan tidak larut heksan 1,75 gram.
Penggunaan kromatografi sangat membantu dalam pendeteksian senyawa metabolit sekunder dan dapat dijadikan sebagai patokan untuk proses pengerjaan berikutnya dalam menentukan struktur senyawa. Prinsipnya atas dasar perbedaan adsorpsi atau partisi oleh fase diam di bawah gerakan pelarut pengembang. Bahan adsorben sebagai fase diam dapat digunakan silika gel, alumina dan serbuk selulosa. Partikel silika gel mengandung gugus hidroksil pada permukaannya yang akan membentuk ikatan hidrogen dengan molekul polar air. Fase diam untuk kromatografi lapis tipis seringkali juga mengandung substansi yang mana dapat berflouresensi dalam sinar ultra violet. Fase gerak merupakan pelarut atau campuran pelarut yang sesuai.
Sebelum menotolkan sampel ke lempeng KLT, terlebih dahulu dibuat batas atas dan batas bawah dengan menggunakan pensil. Hal ini bertujuan untuk mengetahui dimana penotolan sampel itu, dalam penandaan tidak digunakan tinta karena pewarna dari tinta akan bergerak selayaknya kromatogram dibentuk. Hal ini dapat mempengaruhi proses pengelusian senyawa sampel.
Di dalam chamber diisi dengan eluen, dimana untuk setiap sampel memiliki eluen dengan campuran yang sama yaitu n-heksan:etil asetat (3:1) untuk sampel daun Ganjeng. Chamber tersebut terlebih dahulu dijenuhkan. Dalam hal ini chamber ditutup rapat dengan tujuan agar meyakinkan bahwa atmosfer dalam chamber terjenuhkan dengan uap pelarut. Penjenuhan udara dalam chamber dengan uap menghentikan penguapan pelarut sama halnya dengan pergerakan pelarut dalam KLT. Untuk mendapatkan kondisi ini, dalam chamber biasanya ditempatkan beberapa kertas saring yang terbasahi oleh pelarut.
pergerakan pelarut. Di sini akan kita lihat mulai akan ada noda terpisah-pisah, ini dikarenakan setelah sampel dilarutkan dengan eluen, maka sampel akan ikut berinteraksi juga dengan silika yang ada di lempeng. Senyawa yang terperangkap di bagian paling bawah menunjukan bahwa senyawa tersebut paling tinggi kepolarannya karena lempeng ini bersifat polar sehingga senyawa yang paling tinggi kepolarannya akan tinggal dibagian bawah lempeng, ini terjadi karena sifatnya itu like dissolve like yang di mana jika kepolarannya sama akan suka sama suka. Senyawa ini dapat membentuk ikatan hidrogen yang akan melekat pada silika lebih kuat dibanding senyawa lainnya. Kita dapat mengatakan bahwa senyawa ini terjerap lebih kuat dari senyawa yang lainnya. Penjerapan merupakan pembentukan suatu ikatan dari satu substansi pada permukaan.
Eluen yang digunakan merupakan kombinasi dari dua atau tiga macam pelarut, hal ini dimaksudkan untuk mencapai semua tingkat kepolaran sehingga diharapkan eluen ini dapat mengangkat noda dengan tingkat kepolaran yang berbeda-beda pula. Dengan perbandingan jumlah pelarut yang digunakan adalah perbandingan yang didasarkan pada pengalaman bahwa eluen tersebut dapat menarik komponen kimia yang maksimal. Namun jika pada penampakan noda belum didapat jumlah noda yang maksimal atau posisi noda yang terlalu ke atas atau ke bawah maka perbandingan eluen yang digunakan dapat dimodifikasikan kembali.
itu diamati penampakan noda yang terbentuk pada UV 254 dan UV 366, difoto hasil noda yang tampak pada UV 254 dan 366 nm.
Mekanisme penampakan noda pada UV yaitu suatu metode yang mengabsorbsi cahaya ultraviolet akan mencapai suatu keadaan tereksitasi dan kemudian memancarkan cahaya ultraviolet atau cahaya tampak pada waktu kembali ke tingkat dasar (emisi), emisi inilah yang digambarkan sebagai fluoresensi. Pada UV 254 nm, lempeng F254 yang mengalami flouresensi, dimana lempeng F254
mengabsorbsi cahaya ultraviolet mencapai suatu keadaan tereksitasi dan kemudian memancarkan cahaya ultraviolet atau cahaya tampak sebagai fluoresensi, sedangkan noda akan terlihat gelap, tidak dapat tampak bila mengandung gugus kromofor.
Penampakan noda pada lampu UV 366 nm adalah karena adanya daya interaksi antara sinar UV dengan gugus kromofor yang terikat oleh auksokrom yang ada pada noda tersebut. Fluoresensi cahaya yang tampak merupakan emisi cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang tereksitasi dari tingkat energi dasar ke tingkat energi yang lebih tinggi kemudian kembali ke keadaan semula sambil melepaskan energi. Energi inilah yang menyebabkan perbedaan fluoresensi warna yang dihasilkan oleh tiap noda.
Brine Shrimp Lethality Test (BST) adalah suatu metode pengujian dengan menggunakan hewan uji yaitu Artemia salina L., yang dapat digunakan sebagai bioassay yang sederhana untuk meneliti toksisitas akut suatu senyawa, dengan cara menentukan nilai LC50 yang dinyatakan dari komponen aktif suatu simplisia maupun
bentuk sediaan ekstrak dari suatu tanaman. Apabila suatu ekstrak tanaman bersifat toksik menurut harga LC50 dengan metode BST, maka tanaman tersebut dapat
mencit dan tikus secara in vivo. Suatu senyawa dinyatakan mempunyai potensi toksisitas akut jika mempunyai harga LC50 kurang dari 1000 μg/ml. LC50 (Lethal
Concentration 50) merupakan konsentrasi zat yang menyebabkan terjadinya
kematian pada 50 % hewan percobaan yaitu larva Artemia salina L.
Brine Shrimp Lethality Test (BST) adalah suatu metode uji hayati yang tepat dan murah untuk skrining dalam menentukan toksisitas suatu ekstrak tanaman aktif dengan menggunakan hewan uji Artemia Salina L. Artemia Salina L sebelumnnya telah digunakan dalam bermacam-macam uji hayati seperti uji pestisida, polutan, mikotoksin, anastetik, komponen seperti morfin, kekarsinogenikan, dan toksikan dalam air laut. Uji dengan organisme ini sesuai untuk aktifitas farmakologi dalam ekstrak tanaman yang bersifat toksik. Penelitian menggunakan Artemia salina L ternyata juga mempunyai aktivitas sitotoksik.
Pada hari kedua yaitu pemindahan larva, di mana larva yang bagus atau masih hidup pada toples yang berada dalam plastik kerucut dipindahkan ke dalam wadah plastik yang telah dibagi dua. Larva dari toples diletakkan pada wadah plastik yang tertutup sedangkan wadah yang bagian dua diberi cahaya lampu dan aerator, didiamkan lagi selama 1x24 jam. Aerator ini digunakan untuk membantu proses penetasan udang.
Pada hari ketiga, diambil masing-masing vial sampel konsentrasi [1000], [100], [10], kontrol pelarut sebanyak 15 buah yang telah diuapkan dan juga diambil vial kontrol air laut sebanyak 5 buah. Kemudian diambil larva udang dari wadah plastik dan ditampung sebagian pada beker gelas. Setelah itu diambil 10 ekor larva udang pada beker gelas lalu dimasukkan ke dalam tiap vial. Kemudian ditambahkan 1-2 tetes permipan sebagai sumber makanan untuk larva pada masing-masing vial yang telah berisi 10 ekor larva udang. Didiamkan selama 1 x 24 jam.
Pada hari keempat yaitu pengamatan, di mana dilihat larva udang yang mati pada tiap-tiap vial. Setelah itu dihitung larva yang mati.
Dari hasil percobaan diperoleh hasil dimana untuk ekstrak n-heksan diperoleh persen kematian larva pada konsentrasi 1000 ppm 78%, konsentrasi 100 ppm 62% dan pada konsentrasi 50 ppm 8%. Untuk ekstrak larut n-heksan diperoleh persen kematian larva pada konsentrasi 1000 ppm 86%, konsentrasi 100 ppm 60% dan konsentrasi 10 ppm 48%. Sedangkan pada ekstrak tidak larut n-heksan diperoleh persen kematian larva pada konsentrasi 1000 ppm 64%, konsentrasi 100 ppm 46%, dan pada konsentrasi 10 ppm sebanyak 30%. Dan pada vial yang berisi pelarut dan kontrol air laut tidak ditemukan adanya larva udang yang mati. Dari hasil perhitungan kematian larva diperoleh kembali hasil untuk nilai LC50 pada ekstrak
tidak larut n-heksan diperoleh nilai LC50 sebesar 20,52. Jadi yang esktrak yang baik
untuk uji BSLT ini adalah ekstrak larut n-hexan dengan hasil LC50 sebesar 17,37.
Setelah dilakukan uji BSLT selanjutnya dilakukan uji fraksinasi dimana cara kerjanya yaitu Pertama-tama disiapkan alat dan bahan yang akan digunakan. Setelah itu ditimbang 1,5 gram ekstrak n-heksan serta timbang pula silika gel G.60 sebanyak 7 gram. Dimasukkan ekstrak larut n-heksan ke dalam silika gel G.60 dan digerus hingga homogen. Timbang lagi silika gel G.60 sebanyak 13 gram dan dimasukkan ke dalam center glass lalu dimampatkan. Setelah mampat tambahkan hasil gerusan bubur silika dengan ekstrak larut n-heksan ke dalam center glass dan dimampatkan kembali. Selanjutnya diletakkan kertas saring yang telah disesuaikan ukurannya dengan center glass dibatas bubur silika yang telah dimampatkan lalu dimasukkan perbandingan eluen yang telah dibuat satu per satu. Ditampung pada mangkok yang berbeda setiap hasil fraksinya dengan perbandingan eluen yang berbeda, yaitu eluen Pertama n-hexan, kedua n-hexan:etil, ketiga etil, kemudian etil:metanol dan yang terakhir metanol. Setelah itu diuapkan semua hasil fraksi yang diperoleh. Setelah itu larutkan dengan kloroform dan metanol (1:1) pada hasil fraksi tadi. Selanjutnya ditotolkan pada lempeng yang telah diaktifkan semua hasil fraksi yang telah dilarutkan kemudian dielusi. Setelah itu amati hasil noda yang nampak. Selanjutnya amati kromatogram yang sama pada lempeng dan yang sama disatukan dalam satu wadah kemudian diuapkan kembali.
UV 254 nm dan 366 nm. Dari noda yang ditemukan nanti selanjutnya digunakan untuk identifikasi.
Didapatkan hasil untuk bobot fraksinya diperoleh 2 gabungan fraksi dengan bobot yang berbeda untuk fraksi pertama diperoleh bobot sebesar 0,25 gram dan fraksi kedua diperoleh bobot sebesar 0,11 gram.
Setelah dilakukan fraksinasi, selanjutnya dilakukan identifikasi noda dengan metode KLTP (Kromatografi Lapis Tipis Preparatif). Di mana cara kerjanya yaitu pertama-tama dibuat lempeng preparatif dengan cara, ditimbang serbuk silika gel 20 gram untuk 3 lempeng preparatif berukuran 20cm x 20cm. Dibuat suspensi silika dengan menambahkan 50 ml aquadest. Diatur lempeng kaca sejajar, dituang silika gel di atas lempeng kaca dan diratakan. Didiamkan selama 1x24 jam. Setelah itu diaktifkan di dalam oven dengan suhu 1100C selama 1-2 jam. Setelah lempeng
preparatif aktif, ditotolkan ekstrak pada lempeng dengan ukuran yang lebih besar biasanya 20cm x 20cm. Setelah ditotolkan, sampel kemudian dielusi dengan eluen n-hexan:etil dengan menggunakan chamber besar dan eluen sebanyak 60 ml dengan perbandingan eluen yang digunakan 3:1. Setelah proses elusi selesai, akan tampak noda yang berbentuk pita, kemudian noda tersebut diberi tanda dan dikeruk. Noda yang didapatkan terdiri atas 2 noda. Setelah ke dua noda tersebut dikeruk, masing-masing noda ditambahkan pelarut kloroform:metanol sebanyak 10 ml, lalu dihomogenkan, kemudian dipipet ke dalam tabung sentrifuge. Sampel disentrifuge dengan kecepatan 2500 rpm dalam waktu 5 menit. Setelah disentrifuge diperoleh 2 lapisan yaitu cairan bening dan endapan. Dipipet cairan bening dari masing-masing noda ke dalam 2 vial yang berbeda.
digunakan. Ditotol noda hasil kromatografi lapis tipis preparatif pada lempeng silika gel yang telah diaktifkan. Diukur eluen yang akan digunakan yaitu n-hexan:etil dengan perbandingan 5:1 sebanyak n-hexan 5ml dan etil 1 ml, kloroform:etil dengan perbandingan 1:1 sebanyak kloroform 2 ml dan etil 2 ml, serta etil:metanol dengan perbandingan 1:5 sebanyak etil 1 ml dan metanol 5 ml. Kemudian, dielusi masing-masing noda dengan eluen yang telah disiapkan. Setelah proses elusi selesai, diamati penampakan noda pada lampu UV.
Setelah didapatkan noda pada metode multieluen, selanjutnya dilakukan identifikasi golongan senyawa, cara kerjanya yaitu dibaca basmalah. Disiapkan alat dan bahan yang akan digunakan. Diaktifkan lempeng silika gel. Ditotol noda 1 dan 2 pada lempeng silika gel sebanyak 12 totolan. Masing-masing noda terdiri atas 6 totolan. Setelah itu, dimasukkan eluen n-hexan:etil ke dalam chamber secara bersamaan, kemudian chamber dijenuhkan. Setelah jenuh, dimasukkan lempeng yang telah ditotol ke dalam chamber. Ditunggu hingga proses elusi selesai. Setelah proses elusi selesai, diamati lempeng di bawah lampu UV 366 nm. Setelah tampak noda yang diinginkan, lempeng kemudian dipotong-potong hingga menjadi 12 bagian yang terdiri atas 6 bagian noda pertama dan 6 bagian noda kedua. Setelah dipotong-potong, setiap lempeng disemprot atau ditetesi sejumlah pereaksi. Perekasi yang digunakan disini yaitu pereaksi Dragondorff untuk mengidentifikasi senyawa golongan alkaloid, perekasi Lieberman-Burchard untuk mengidentifikasi senyawa golongan steroid, pereaksi AlCl3 untuk mengidentifikasi senyawa golongan
flavonoid, pereaksi FeCl3 untuk mengidentifikasi senyawa golongan fenol dan