EFEK KONSUMSI MINUMAN BUBUK KAKAO LINDAK
BEBAS LEMAK TERHADAP AKTIVITAS ANTIOKSIDAN
DAN KETERSEDIAAN HAYATI FLAVONOID PADA
PLASMA MANUSIA
WELLI YULIATMOKO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI PENELITIAN
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa penelitian Efek Konsumsi Minuman Bubuk Kakao Lindak Bebas Lemak terhadap Aktivitas Antioksidan dan Ketersediaan Hayati Flavonoid pada Plasma Manusia adalah karya sendiri dibawah bimbingan Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc dan Dr. Ir. Feri Kusnandar, M.Sc dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka pada bagian akhir usulan penelitian ini.
Bogor, Agustus 2007
RINGKASAN
WELLI YULIATMOKO. Efek Konsumsi Minuman Bubuk Kakao Lindak Bebas Lemak terhadap Aktivitas Antioksidan dan Ketersediaan Hayati Flavonoid pada Plasma Manusia. Dibimbing oleh FRANSISKA R. ZAKARIA dan FERI KUSNANDAR
Bubuk kakao lindak bebas lemak hasil samping produksi lemak kakao mengandung senyawa flavonoid yang berfungsi sebagai antioksidan tubuh sehingga bermanfaat bagi kesehatan. Peneltian ini bertujuan menguji efek konsumsi minuman bubuk kakao lindak bebas lemak terhadap aktivitas antioksidan plasma dan ketersediaan hayati flavonoid pada plasma manusia. Responden wanita yang sehat dibagi dalam dua kelompok, yaitu kelompok kakao (n = 9) mengkonsumsi minuman bubuk kakao lindak yang diberi susu skim dan gula dan kelompok kontrol (n = 9) mengkonsumsi minuman yang sama tanpa penambahan bubuk kakao lindak bebas lemak. Semua responden yang terlibat memenuhi persyaratan, sehat menurut hasil pemeriksaan dokter, dan bersedia menandatangani informed consent. Pengambilan darah dilakukan sebelum dan sesudah intervensi untuk analisis vitamin C, analisis aktivitas antiradikal bebas dengan metode 2,2-diphenyl-1-pycrilhydrazyl (DPPH), analisis kadar malonaldehid (MDA) plasma, analisis pembentukan diena terkonjugasi, analisis kadar protein plasma, dan analisis kuantitatif kadar flavonoid dalam plasma.
Hasil penelitian memperlihatkan adanya peningkatan secara nyata (p< 0,05) kadar vitamin C dari 4,97 mg/l menjadi 5,11 mg/l, peningkatan antiradikal bebas dari 26,43% menjadi 42,28%, dan penurunan secara nyata (p< 0,05) kadar MDA plasma dari 0,93 µmol menjadi 0,59 µmol kelompok kakao sesudah intervensi selama 25 hari. Seperti halnya dengan analisis diena terkonjugasi, konsumsi bubuk kakao lindak bebas lemak juga cenderung memperpanjang fase lag oksidasi diena terkonjugasi dari 46,67 menit menjadi 50,56 menit. Analisis kadar flavonoid juga memperlihatkan adanya peningkatan senyawa flavonoid (katekin) plasma dari 2,34 µg/ml menjadi 5,14 µg/ml.
Dari penelitian ini dapat disimpulkan bahwa bubuk kakao lindak bebas lemak hasil samping produksi lemak kakao dapat meningkatkan sistem antioksidan plasma sehingga bermanfaat bagi kesehatan.
ABSTRACT
WELLI YULIATMOKO. The Effect of Fat Free Lindak Cocoa Powder Drink Consumption on Antioxidant Activity and Flavonoid Bioavailability of Human Plasma. Under the direction of FRANSISKA R. ZAKARIA and FERI KUSNANDAR
Fat free cocoa powder is a rich source of flavonoid antioxidants including epicatechin, catechin, and procyanidins, which have attracted interest regarding cardiovascular health. The aim of this research was to evaluate the effect of Indonesian fat free cocoa powder drink consumption on antioxidant activity and flavonoid bioavailability of human plasma. Healthy woman subjects were divided into cocoa group (n=9) and control group (n=9). Cocoa powder drink containing skim milk and sugar was given to the cocoa group. The control group received only water containing skim milk and sugar. The criteria of the respondents were appropriate health according to medical diagnosis and informed consent signature. Their peripheral blood was withdrawn for the analysis of antioxidant capacity and flavonoid bioavailability. Antioxidants capacity consisted of antiradical by DPPH method, malonaldehyde (MDA) content, vitamin C, and diene conjugation. Flavonoid bioavailability was analyzed using catechin as a standard analysis in human plasma by HPLC method.
The data of cocoa group showed that there were significantly increased in antiradical activity from 26.43% to 42.28%, vitamin C from 4.97 mg/l to 5.11 mg/l and decreased in MDA content from 0.93 µmol to 0.59 µmol (p<0.05). Cocoa consumption increased lag phase oxidation of diene conjugation from 46.67 minute to 50.56 minute. Flavonoid quantity analysis showed that there was increased plasma catechin from 2.34 µg/ml to 5.14 µg/ml.
In conclusion, The Indonesian fat free lindak cocoa powder has increased plasma antioxidant system, which manifests good health function.
© Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi
EFEK KONSUMSI MINUMAN BUBUK KAKAO LINDAK
BEBAS LEMAK TERHADAP AKTIVITAS ANTIOKSIDAN
DAN KETERSEDIAAN HAYATI FLAVONOID PADA
PLASMA MANUSIA
WELLI YULIATMOKO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Efek Konsumsi Minuman Bubuk Kakao Lindak Bebas Lemak terhadap Aktivitas Antioksidan dan Ketersediaan Hayati Flavonoid
pada Plasma Manusia Nama : Welli Yuliatmoko NIM : F251050021
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Fransiska R.Zakaria, M.Sc Dr. Ir. Feri Kusnandar, M.Sc. Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof.Dr.Ir.Betty Sri Laksmi Jenie, MS Prof.Dr.Ir. Khairil Anwar Notodiputro, MS
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini dapat diselesaikan dengan baik. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2006 ini dengan judul Efek Konsumsi Minuman Bubuk Kakao Lindak Bebas Lemak Terhadap Aktivitas Antioksidan dan Ketersediaan Hayati Flavonoid pada Plasma Manusia.
Terima kasih penulis ucapkan kepada Tim Riset Unggulan Terpadu XII (RUT) tahap II tahun 2006 yaitu Bapak Dr.Ir. Misnawi (Pusat Penelitian Kopi dan Kakao Indonesia di Jember) dan Ibu Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc. (Dosen Pascasarjana Ilmu Pangan IPB) atas bantuan dana penelitian. Selanjutnya penulis mengucapkan terima kasih kepada pengelola beasiswa BPPS atas bantuan beasiswa dan pimpinan Universitas Terbuka atas kesempatan melanjutkan studi. Terima kasih juga penulis haturkan kepada Ibu Prof. Dr. Ir. Fransiska R. Zakaria, M.Sc.dan Bapak Dr. Ir. Feri Kusnandar, M.Sc selaku pembimbing, serta Dr. Ir. Endang Prangdimurti, M.Si selaku penguji yang telah banyak memberi saran. Terima kasih yang dalam penulis sampaikan pada semua responden atas keiklasan dalam mentaati intervensi selama penelitian berlangsung. Penulis juga mengucapkan terima kasih kepada tim kakao, yaitu Erni, Fitri, Eris, dan Retno, dan teman-teman mahasiswa pascasarjana program studi ilmu pangan khususnya angkatan 2005, dan semua pihak yang telah memberikan bantuan selama penelitian berlangsung. Terimakasih juga diucapkan kepada teman-teman di asrama Buchori atas pengertiannya. Akhinya ungkapan terima kasih yang dalam disampaikan kepada Ayah Alimin (almarhum), Ibu Enden, istri tercinta Choirun Nisa, Putri tersayang Fitri dan Ami, serta seluruh keluarga atas segala kasih sayangnya.
Semoga karya ilmiah ini bermanfaat
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 29 Juli 1973 sebagai anak ke lima dari tiga belas
saudara pasangan Ayahanda Alimin (Almarhum) dan Ibu Enden.
Pendidikan dasar sampai menengah atas diselesaikan di Kabupaten
Lampung Tengah, Lampung. Pendidikan tingkat sarjana penulis raih pada tahun
1998 dari Jurusan Teknologi Hasil Pertanian Universitas Lampung, Lampung.
Penulis menjadi staf pengajar pada Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Terbuka sejak tahun 2001 sampai sekarang. Pada
tahun 2005, penulis melanjutkan pendidikan di Sekolah Pascasarjana Institut
DAFTAR ISI
Halaman
DAFTAR TABEL... vi
DAFTAR GAMBAR... vii
DAFTAR LAMPIRAN... viii
PENDAHULUAN... 1 Ketersediaan Hayati (Bioavailabilitas) Flavonoid... Kromatografi Cair Kinerja Tinggi (HPLC)... 4 Kadar Malondialdehida (MDA) Plasma... Aktifitas Antiradikal Bebas Plasma... Analisis Diena Terkonjugasi... Analisis Flavonoid dalam Plasma... 32 SIMPULAN DAN SARAN... 50
DAFTAR PUSTAKA... 51
DAFTAR TABEL
Halaman
1 Tabel 1 Komposisi kimia bubuk kakao lindak bebas lemak per 100
gram... 5
2 Komposisi kimia bubuk kakao per 100 gram... 5
3 Kandungan polifenol produk kakao... 7
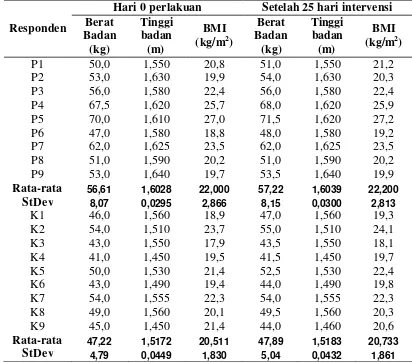
4 Data antropometri responden sebelum dan sesudah intervensi
(Kusumantias, 2007)... 33
5 Komponen standar katekin yang dideteksi dengan HPLC... 47
6 Komponen plasma yang diduga komponen flavonoid (katekin) dari kelompok kakao dan kelompok kontrol sebelum (0 hr) dan sesudah
DAFTAR GAMBAR
Halaman
1 Struktur kimia senyawa flavonoid yang umum terdapat pada kakao
dan produk olahan kakao... 6
2 Mekanisme reaksi gugus fenol dari senyawa fenolik dengan senyawa radikal (Ranney 1979)... 15
3 Pembagian kelas flavonoid ( CIC 2001)... 16
4 Struktur kimia flavonoid... 16
5 Scavenging radikal bebas oleh flavonoid... 17
6 Struktur kimia tiga bentuk asam askorbat... 18
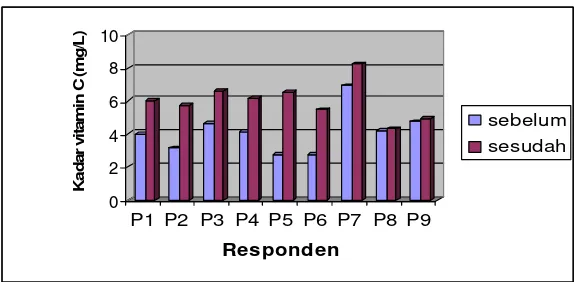
7 Kadar vitamin C plasma kelompok kakao sebelum dan sesudah intervensi... 37
8 Kadar vitamin C plasma kelompok kontrol sebelum dan sesudah intervensi... 37
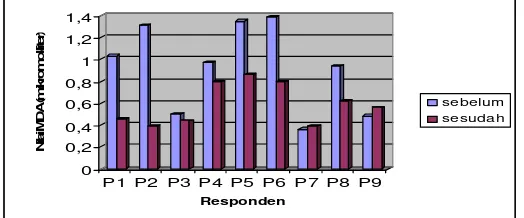
9 Kadar MDA plasma kelompok kakao sebelum dan sesudah intervensi... 39
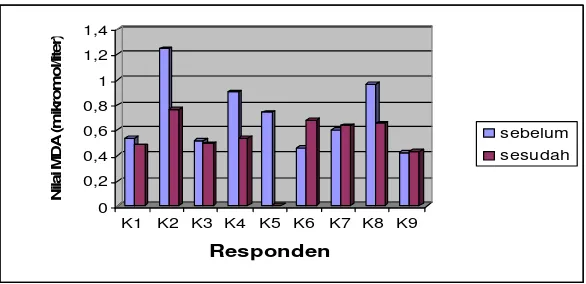
10Kadar MDA plasma kelompok kontrol sebelum dan sesudah intervensi . ... 40 11Aktivitas antiradikal bebas plasma kelompok kakao sebelum dan sesudah intervensi... 42
12Aktivitas antiradikal bebas plasma kelompok kontrol sebelum dan sesudah intervensi... 42
13Kurva oksidasi diena terkonjugasi plasma kelompok kakao (P2) dan kelomok kontrol (K1) sebelum dan sesudah intervensi... 44
14Kurva oksidasi diena terkonjugasi plasma kelompok kakao (P3) dan kelomok kontrol (K9) sebelum dan sesudah intervensi... 44
15Rata-rata nilai fase lag oksidasi diena terkonjugasi plasma kelompok kakao sebelum dan sesudah intervensi... 45
DAFTAR LAMPIRAN
Halaman
1 Informed consent (pernyataan kesediaan) menjadi responden
penelitian... 59
2 Menu makan pagi dan makan malam responden yang disiapkan oleh peneliti selama intervensi berlangsung... 60
3 Kuesioner kesehatan fisik, pola makan, dan kebiasaan komsumsi makanan jajanan... 61
4 Hasil analisis data dengan uji (t-test)... 71
5 Rekapitulasi nilai rata-rata hasil penelitian... 75
6 Kurva standar penentuan konsentrasi vitamin C... 76
7 Kurva standar penentuan konsentrasi MDA plasma... 77
8 Kromatogram HPLC fraksi standar (katekin)... 78
9 Kromatogram HPLC fraksi plasma kelompok kakao 0 hari... 79
10Kromatogram HPLC fraksi plasma kelompok kakao 25 hari... 80
11Kromatogram HPLC fraksi plasma kelompok kontrol 0hari... 81
PENDAHULUAN
Latar Belakang
Berbagai masalah komplek yang dihadapi oleh masyarakat saat ini seperti
pencemaran, radiasi dan kontaminasi pada makanan, dan diet tinggi asam lemak
tidak jenuh (ALTJ) dapat menyebabkan terbentuknya radikal bebas yang berlebih
dalam tubuh manusia. Radikal bebas merupakan molekul yang mempunyai
elektron yang tidak berpasangan dalam orbit terluarnya sehingga kondisinya tidak
stabil. Dengan sifat ini, radikal bebas dapat menyebabkan berbagai penyakit.
Radikal bebas juga dapat menyebabkan berbagai kerusakan sel seperti kerusakan
membran, protein, DNA, sehingga menyebabkan berbagai jenis penyakit seperti
autoimun, penuan dini, dan arterosklerosis, yang selanjutnya dapat menyebabkan
timbulnya berbagai penyakit kronis.
Sistem pertahanan tubuh terhadap senyawa kimia berbahaya seperti radikal
bebas terjadi melalui sistem antioksidan (Zakaria et al 1996). Antioksidan dapat mencegah kerusakan akibat radikal bebas karena mampu memperlambat atau
mencegah proses oksidasi. Antioksidan dapat ditemukan dalam tubuh diantaranya
glutation, ubiquinol, dan asam urat yang diproduksi pada metabolisme normal.
Antioksidan juga dapat ditemukan pada makanan seperti vitamin E, C, dan
karotenoid. Perlindungan antioksidan terhadap plasma darah merupakan
gambaran dari perlindungan total terhadap tubuh, karena di samping bagian dari
darah yang penting dalam sistem pencernaan, plasma juga merupakan tempat
bermuaranya berbagai metabolit sel tubuh. Sehingga kondisi antioksidan di
plasma penting untuk diketahui. Beberapa produk metabolit hasil oksidasi
senyawa radikal seperti malonaldialdehid (MDA) dan diena terkonjugasi
dijadikan model oleh para peneliti untuk menggambarkan sistem pertahanan
antioksidan tubuh terhadap senyawa radikal bebas (Zakaria et al 1996; Septiana 2000; Prangdimurti 2007).
Biji kakao merupakan salah satu bahan yang kaya akan senyawa flavonoid
diantaranya adalah senyawa flavanol yang berfungsi sebagai antioksidan.
Flavonoid dalam kakao umumnya ditemukan dalam bentuk katekin, efikatekin,
antioksidannya lebih tinggi dibandingkan dengan anggur, teh hijau, dan teh hitam
(Lee et al 2003). Beberapa peneliti melaporkan manfaat senyawa flavanol di bidang kesehatan, seperti memacu peredaran darah dengan baik, agen
perlindungan terhadap kardiovaskular, berpengaruh pada fungsi platelet, mengatur
tekanan darah, produksi nitrit oksida, dan dapat menurunkan oksidasi low density lipoprotein (LDL) pada manusia sehingga dapat mencegah timbulnya penyakit aterosklerosis (Fisher et al 2003; Heiss et al 2003; Yan Zhu et al 2005).
Sampai saat ini kualitas kakao asal Indonesia masih memprihatikan. Hal ini
bisa dilihat dari rendahnya harga kakao Indonesia di pasaran dunia. Kakao asal
Indonesia masih ditawar murah, bahkan nilainya terpaut US$ 90 sampai US$ 120
per ton dari harga kakao di pasar komoditi London, yang saat ini sudah mencapai
US$ 1.725. Bahkan belakangan ini kakao Indonesia malah tidak bisa lagi masuk
ke sejumlah pabrik di Singapura dan Malaysia. Beberapa hal yang diduga
sebagai penyebabnya adalah ekspor kakao asal Indonesia didominasi oleh biji-biji
kakao lindak tanpa fermentasi. Biji-biji kakao yang difermentasi lebih disukai
karena dapat meningkatkan cita rasa produk kakao. Kakao lindak umumnya
hanya digunakan sebagai bahan pelengkap dalam mengolah kakao mulia. Di
samping itu, biji-biji tersebut pada proses pengolahan hanya dijadikan sebagai
sumber lemak
Bubuk kakao lindak bebas lemak merupakan hasil samping produksi lemak
kakao masih mengandung senyawa polifenol yang cukup tinggi. Menurut
Misnawi et al 2002a bubuk kakao tanpa fermentasi mengandung polifenol 120-180 g/kg; 37% diantaranya dalam bentuk monomer flavan-3-ol, 58% dalam
bentuk oligomer dan 5% sisanya berupa antosianin dan polifenol lainnya. Bentuk
monomer lebih mudah diserap dalam sistem pencernaan tubuh. Hasil penelitian
secara in vitro terhadap bubuk kakao bebas lemak tersebut menunjukkan bahw a bubuk kakao mempunyai kapasitas antioksidan, melindungi sel limfosit dari
berbagai oksidator, dan tidak bersifat toksik terhadap sel limfosit (Zairisman
2006; Olivia 2006). Kekuatan antioksidan polifenol kakao didukung oleh
kelarutannya yang tinggi dalam sistem yang heterogen, bahkan dalam sistem
emulsi lemak sekalipun (Ziegleder & Sandmeier 1983). Hasil penelitian Jinap &
kakao masih tetap tinggi bahkan lebih baik dari a-tokoferol walaupun telah
dipanaskan sampai 140oC selama 45 menit. Dengan demikian peluang untuk
memanfaatkan bubuk kakao lindak bebas lemak menjadi sumber antioksidan
masih sangat besar. Oleh karena itu, perlu dilakukan penelitian lebih lanjut secara
in vivo dengan menggunakan manusia sebagai respondennya. Sehingga dapat diketahui keamanan minuman bubuk kakao lindak bebas lemak dalam
meningkatkan kesehatan manusia.
Tujuan
Tujuan umum dari penelitian ini adalah menguji efek konsumsi minuman
bubuk kakao bebas lemak terhadap kadar antioksidan plasma darah manusia.
Adapun tujuan khusus dari penelitian ini adalah
1. menguji efek minuman bubuk kakao lindak bebas lemak dalam meningkatkan
aktivitas antioksidan dan melindungi plasma dari kerusakan oksidatif dengan
cara mengukur kadar vitamin C plasma, mengukur kapasitas antioksidan
menggunakan radikal bebas stabil DPPH, mengukur kadar malondialdehid
(MDA) dan mengukur kadar diena terkonjugasi.
2. mengukur efek minuman bubuk kakao bebas lemak terhadap bioavailabilitas
flavonoid dalam plasma manusia.
Hipotesis
Hipotesis penelitian ini adalah mengkonsumsi minuman bubuk kakao
lindak bebas lemak dapat meningkatkan aktivitas antioksidan, menurunkan kadar
MDA, dan dapat meningkatkan flavonoid dalam plasma manusia
Manfaat Penelitian
1. Memberikan informasi tentang khasiat minuman bubuk kakao bebas lemak
sebagai antioksidan alami
2. Memberikan informasi ilmiah tentang khasiat bubuk kakao bebas lemak
varietas lokal terhadap kesehatan
3. Meningkatkan citra positif kakao varietas lokal Indonesia
Kakao
Tanaman kakao (Theobroma cacao L) tumbuh baik di daerah hutan tropis seperti halnya wilayah Indonesia. Bahkan kakao merupakan salah satu komoditi
andalan perkebunan Indonesia dimana luas arealnya mencapai 770 ribu he ktar
dengan produksi tahunan mencapai 435 ribu ton. Produksi yang cukup besar ini
menempatkan Indonesia sebagai produsen kakao terbesar ketiga setelah Ivory
Coast dan Ghana (DJBPP 2004).
Dua jenis kakao yang dominan ditanam di Indonesia, yaitu kakao mulia
atau kakao edel (fine/ flavour cocoa) yang berasal dari varietas criollo dengan buah berwarna merah dan kakao lindak (bulk cocoa) berasal dari varietas forestero dan trinitro dengan warna buah hijau. Kakao lindak merupakan kakao kualitas
kedua dan digunakan sebagai bahan pelengkap dalam mengolah kakao mulia.
Jenis kakao lindak inilah yang dominan di perkebunan Indonesia (DJBPP 2004).
Komoditi kakao Indonesia tahun 2006 di pasar dunia masih
memprihatinkan. Kakao dari Indonesia masih ditawar murah, bahkan nilainya
terpaut US$ 90 sampai US$ 120 per ton dari harga kakao di pasar komoditi
London, yang saat ini sudah mencapai US$ 1.725 (938 poundsterling) per ton.
Bahkan belakangan ini kakao produk Indonesia malah tidak bisa lagi masuk ke
sejumlah pabrik di Singapura dan Malaysia. Rendahnya nilai komoditi ini, tidak
terlepas dari rendahnya kualitas kakao Indonesia. Salah satu penyebabnya kakao
asal Indonesia didominasi oleh jenis kakao lindak yang tidak difermentasi. Kakao
lindak tergolong dalam kakao kualitas ke dua yang digunakan sebagai bahan
pelengkap dalam mengolah kakao mulia.
Komposisi kimia biji kakao atau bubuk kakao berbeda-beda. Tabel 1
menggambarkan hasil analisis proksimat terhadap bahan baku yang digunakan
yaitu bubuk kakao lindak bebas lemak dari Pusat Penelitian Kopi dan Kakao
Indonesia di Jember. Komposisi kimia bubuk kakao ini sedikit berbeda dengan
hasil analisis yang dilakukan oleh Cheney (1999) terhadap varietas yang berbeda
(Tabel 2). Variasi ini bisa disebabkan karena berbagai faktor seperti bentuk
Misnawi dan Selamat (2003) kandungan dan komposisi polifenol dalam biji kakao
dipengaruhi oleh proses fermentasi.
Tabel 1 Komposisi kimia bubuk kakao lindak bebas lemak per 100 gram
Nutrisi Komposisi (g/100 g)
Karbohidrat 51,42
Protein 28,075
Lemak 2,585
Air 10,415
Abu 7,505
Sumber: Yuliatmoko (2007); Hasanah (2007); Amri (2007); Kusumantias (2007)
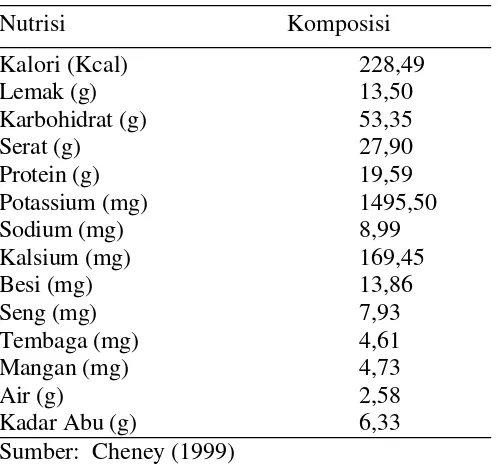
Tabel 2 Komposisi kimia bubuk kakao per 100 gram
Nutrisi Komposisi
Kalori (Kcal) 228,49
Lemak (g) 13,50
Karbohidrat (g) 53,35
Serat (g) 27,90
Protein (g) 19,59
Potassium (mg) 1495,50
Sodium (mg) 8,99
Kalsium (mg) 169,45
Besi (mg) 13,86
Seng (mg) 7,93
Tembaga (mg) 4,61
Mangan (mg) 4,73
Air (g) 2,58
Kadar Abu (g) 6,33
Sumber: Cheney (1999)
Kakao merupakan salah satu jenis pangan yang mengandung senyawa
polifenol, yang dapat bertindak sebagai antioksidan yang bermanfaat bagi
kesehatan manusia (Sanbongi et al 1998). Kandungan total polipenol pada kakao lebih tinggi dibandingkan dengan anggur, teh hitam, dan teh hijau (Lee et al
2003). Kelompok senyawa polifenol yang banyak terdapat pada kakao adalah
tunggal seperti katekin dan epikatekin dan juga berbentuk senyawa oligomer
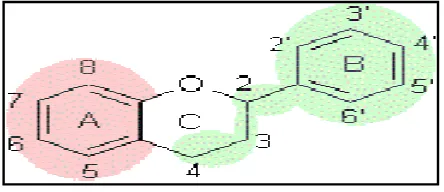
seperti prosianidin (Gambar 1)(CIC 2001).
Gambar 1 Struktur kimia senyawa flavonoid yang umum terdapat dalam
kakao dan produk olahan kakao
Antioksidan polifenol kakao memiliki kelarutan yang tinggi dalam sistem
yang heterogen, bahkan dalam sistem emulsi lemak sekalipun. Menurut Misnawi
(2003) aktifitas antioksidan polifenol biji kakao masih tetap tinggi walaupun telah
dipanaskan sampai 140oC selama 45 menit. Sementara itu, polifenol dengan
konsentrasi tinggi dalam kakao memberi pengaruh negatif terhadap citarasa
berupa rasa sepat dan pahit yang berlebihan serta menghambat pembentukan
komponen-komponen aroma selama penyanggraian (Misnawi et al 2004b).
Beberapa manfaat flavanol di bidang kesehatan telah berhasil diteliti.
Penelitian secara in vitro dan in vivo menyimpulkan bahwa flavanol pada biji kakao memiliki kapasitas antioksidan yang mampu menekan hidrogen peroksida
dan anion superoksida, melindungi lemak dari kerusakan oksidasi, bertindak
sebagai anti mikroba, menghambat pertumbuhan tumor dan kanker, dan
melindungi penyakit-penyakit karena oksidasi low density lipoprotein (Wan et al
2001; Kattenberg 2000; Sanbongi et al 1998).
Mathur et al (2002) menyatakan bahwa flavanol dalam produk kakao memiliki kapasitas antioksidan dan aktivitas anti-inflamantori yang mempunyai
kemampuan untuk mencegah penyakit kardiovaskular akibat stress oksidatif. Dalam penelitian yang lain disebutkan bahwa mengkonsumsi kakao yang kaya
akan flavanol berpengaruh positif pada aliran darah perifer (Fisher et al 2003). Prosianidin
Disamping itu, konsumsi cairan ekstrak kakao yang kaya akan antioksidan dapat
menurunkan aktivitas enzim petanda tumor pada hati tikus percobaan (Amin et al
2004). Zhu et al (2005) melaporkan bahwa kecenderungan eritrosit sel darah manusia untuk hemolisis akibat radikal bebas dapat dikurangi secara signifikan
setelah mengkonsumsi minuman yang mengandung flavanol kakao. Penelitian
yang lain secara in vitro menyebutkan bahwa ekstrak bubuk kakao bebas lemak dari biji kakao non fermentasi dalam pelarut air mampu memberikan efek
perlindungan terhadap sel limfosit manusia (Olivia 2006). Selain itu, flavanol
pada biji kakao juga bisa mengurangi resiko mortalitas dan morbiditas
kardiovaskuler, kanker dan osteoporosis dan bisa mencegah penyakit
neurodegeneratif serta diabetes militus (Grassi et al 2006).
Biji kakao biasanya diolah menjadi berbagai macam produk olahan seperti
pasta kakao (chocolat liquor), bubuk kakao (cocao powder), mentega kakao (cocoa butter) dan coklat gelap (dark chocolate). Coklat gelapmengandung 15% pasta kakao, dan 60% mentega kakao, gula, dan aditif. Sedangkan bubuk kakao
dibuat dengan menghilangkan mentega kakao dari pasta kakao (Vinson et al
1999). Kandungan polifenol produk kakao tersebut berbeda-beda antara satu
dengan yang lainnya (Tabel 3).
Tabel 3 Kandungan polifenol produk kakao
Produk kakao Jumlah polifenol total (mg / g)
Bubuk kakao 20
Coklat gelap 8.4
Coklat susu 5
Sumber : Wollgast & Anklam (2000)
Bubuk kakao lindak bebas lemak dari biji kakao non fermentasi pada
mengandung 120-180 g/kg polifenol (Misnawi et al 2002a). Bubuk kakao lindak bebas lemak dari jenis bulk masak yang digunakan dalam penelitian ini mengandung total fenol sebesar 35,5 ppm tiap 0,8 mg/ml ekstrak kakao dalam
pelarut air (Zairisman 2006).
Bubuk kakao lindak bebas bebas lemak dari biji kakao non fermentasi
Penelitian Kopi dan Kakao Indonesia Jember. Bubuk kakao lindak bebas lemak
ini merupakan hasil samping produksi lemak kakao. Bubuk kakao lindak bebas
lemak merupakan produk kakao yang berbentuk bubuk yang diperoleh dari pasta
kakao setelah dihilangkan lemaknya. Ditemukannya kandungan polifenol yang
tinggi dalam bubuk kakao lindak bebas lemak ini mumungkinkan diproduksinya
bubuk kakao ini secara komersial.
Proses pembuatan bubuk kakao bebas lemak sebagai berikut: biji kakao
basah dicuci bersih dan di oven pada suhu 50°C sampai kadar air 7,5%.
Selanjutnya kulit ari dipisahkan, keping biji yang diperoleh dihaluskan dengan
blender (penghancur biji). Pasta kakao yang diperoleh kemudian dipisahkan lemaknya (defatting) dalam soxhlet apparatus menggunakan pelarut petroleum benzen (titik didih 40-60°C). Bubuk kakao yang diperoleh kemudian dihaluskan
sampai kehalusan < 40 mesh kemudian disimpan dalam kemasan kedap udara
(Misnawi 2005).
Radikal bebas
Radikal bebas merupakan suatu molekul atau senyawa yang sangat reaktif
karena memiliki satu elektron atau lebih yang tidak berpasangan pada orbital
luarnya. Radikal bebas dapat bereaksi dengan molekul sel dengan cara mengikat
elektron molekul tersebut sehingga menimbulkan reaksi berantai yang dapat
menghasilkan radikal bebas baru. Radikal bebas dapat bereaksi dengan
komponen penyusun membran, enzim, dan DNA (Wijaya 1996).
Radikal bebas dapat menyebabkan stress oksidatif, yaitu keadaan ketidakseimbangan antara reactive oxcygen species (ROS) / reactive nitrogen species (RNS) dan antioksidan (Halliwell & Guitteridge 1999). Jika radikal bebas berada dalam jumlah berlebihan dan jumlah antioksidan seluler tetap atau lebih
sedikit maka kelebihannya tidak bisa dinetralkan dan berakibat pada kerusakan sel
(Langseth 1995). Kerusakan sel merupakan gangguan atau perubahan yang dapat
mengurangi viabilitas dan fungsi essensial sel (Kehrer 1993). Stress oksidatif
dapat menyebabkan kematian sel secara apoptosis dan nekrosis. Menurut Zitouni
terjadinya kerusakan membran (sebagai contohnya akan meningkatkan sekresi
albumin urin dan memacu diabetes).
Senyawa-senyawa yang menjadi target ROS atau radikal bebas adalah
molekul-molekul seluler dan ektraseluler seperti protein, asam lemak tidak jenuh
ganda, glikoprotein, lipoprotein, dan bahan-bahan penyusun DNA seperti
karbohidrat dan basa purin.
Pembentukan Radikal Bebas
Terbentuknya radikal bebas dalam tubuh dapat terjadi melalui dua cara,
yaitu endogen dan eksogen. Secara endogen, radikal bebas diproduksi secara
kontinyu pada tubuh manusia sebagai konsekuensi dari metabolisme normal
melalui sistem transport elektron, dan aktivitas oksidasi seperti siklooksigenase.
Radikal bebas diproduksi di dalam sel oleh mitokondria, membran plasma,
lisosom, peroksisom, retikulum endoplasmik, dan inti sel. Secara eksogen,
radikal bebas didapat dari polusi luar melalui jalan pernafasan, makanan, dan
penyerapan kulit (Supari, 1996). Bahan pangan tercemar yang dikonsumsi dan
masuk ke dalam tubuh juga mengakibatkan terbentuknya radikal bebas dalam
tubuh. Senyawa logam seperti Pb akan mengkatalisis terbentuknya hidroksil
radikal jika bertemu dengan peroksida. Senyawa pemutih bahan pangan seperti
benzoil peroksida dalam tubuh dapat dirubah menjadi senyawa radikal yang telah
diteliti berperan dalam kerusakan DNA sehingga dapat menyebabkan
terbentuknya tumor atau kanker. Hidrokarbon aromatik yang mengkontaminasi
bahan pangan dari asap rokok, tanah, polusi udara, dan air, bahan tambahan
pangan, melalui reaksi oksidasi, reduksi, dan hidroksilasi akan diubah menjadi
senyawa epoksi yang bersifat elektrofil dan dapat menyerang DNA. Senyawa
amin heterosiklik yang terbentuk selama proses pemanggangan, bila masuk
kedalam tubuh akan berubah menjadi senyawa radikal yang dapat beraksi dengan
rantai DNA. Senyawa pestisida seperti karbon tetraklorida, paraquat, dan diquat
yang sering terdapat dalam produk sayur dan buah, dapat juga menjadi radikal
yang reaktif yang dapat menyebapkan peroksidasi lemak (Zakaria 1996).
Hidroperoksil Radikal (HO2*). Hidroperoksil radikal mempunyai potensi untuk menyebabkan sitotoksik dalam sistem biologis. Faktor yang
menyebabkannya adalah karena mampu melewati membran biologis, dan sifatnya
yang reaktif sehingga dapat menginisiasi terjadinya peroksidasi lipid, terutama
pada lipoprotein densitas rendah (LDL). Hidroperoksil radikal lebih reaktif
dibandingkan dengan anion superoksida radikal (Halliwell & Guitteridge 1990).
Anion Superoksida Radikal (O2*). Radikal bebas ini merupakan hasil reduksi satu elektron oksigen dan dapat terjadi pada hampir semua sel aerobik
yang menjalankan reaksi transper elektron (Zakaria 1996). Pada organisme
aerobik, 95% oksigen dalam sel direduksi menjadi air oleh rantai pernafasan pada
mitokondria, proses reduksi ini melibatkan 4 elektron dan 2 proton. Kebocoran
electron diperkirakan mencapai 1 sampai 5%, electron yang bocor ini bereaksi
dengan oksigen membentuk radikal superoksida, hydrogen peroksida (H2O2), dan
radikal hidroksil (OH*) (Lehninger 1993).
Proses fagositosis akan menghasilkan sejumlah besar superoksida sebagai
bagian dari mekanisme yang bertujuan untuk membunuh mikroorganisme asing.
Pada inflamasi kronis, mekanisme perlindungan normal ini bersifat merusak.
Dalam larutan encer, radikal ini merupakan pereduksi yang lemah untuk
mengoksidasi molekul seperti asam askorbat dan thiol. Tetapi merupakan
senyawa pereduksi yang kuat untuk beberapa kompleks besi seperti sitokrom c
dan ferri-EDTA. Dalam larutan encer radikal ini akan segera mengalami reaksi
dismutase dengan katalisator superoksida dismutase (SOD) membentuk hidrogen peroksida dan oksigen (Guitteridge 1995).
Hidrogen Peroksida (H2O2). Hidrogen peroksida merupakan oksidan lemah yang relatif stabil, tetapi dengan adanya ion logam transisi, maka senyawa
ini akan membentuk radikal yang reaktif. Senyawa ini akan segera bercampur
dengan air, dan diperlakukan seperti molekul air oleh tubuh, yang dapat berdifusi
melewati membran sel. Hidrogen peroksida yang tidak dikehendaki dihilangkan
dari sel dengan bantuan enzim katalase, glutation peroksidase (GSH) dan
peroksidase lainnya (Guitteridge 1995)
Peristiwa iskemi yaitu deplesi ATP akibat kekurangan oksigen dimana
diubah oleh xantin oksidase, menjadi asam urat dan radikal bebas seperti: superoksida, hidroksil, dan hidrogen peroksida (Haliwell & Guitteridge 1999).
Hidroksil Radikal (OH*). Hidroksil radikal merupakan senyawa oksidan yang sangat berbahaya, karena sifatnya yang sangat reaktif dibandingkan dengan
senyawa radikal lainnya sehingga dapat merusak sejumlah besar molekul biologis.
Senyawa ini dapat terbentuk dari H2O2 dengan katalis ion Fe2+, reaksi ini dikenal
dengan nama reaksi Fenton (Guitteridge 1985). Reaksi Fenton dapat terbentuk
melalui reaksi oksidasi-reduksi yang dikatalis oleh Fe+2 dan Fe+3 yang berasal
dari hemoglobin dan mioglobin (Zakaria 1996; Haliwell & Guitteridge 1999).
Radikal ini dapat terbentuk sebagai respon terhadap radiasi, sinar
ultraviolet, polusi lingkungan, asap rokok, hiperoksida, dan olah raga yang
berlebihan. Radiasi elektromagnetik dengan panjang gelombang rendah
(misalnya sinar gamma) dapat memecah air dalam tubuh menghasilkan radikal
hidroksil. Radikal ini akan menyerang semua molekul yang berdekatan
dengannya dan menimbulkan reaksi berantai.
Nitrit Oksida (NO*). Radikal bebas fisiologis yang lain adalah nitrit oksida, yang dibuat oleh sel-sel endotel dari dinding pembuluh darah sebagai
faktor relaksasi. Nitrit oksida ini mempunyai fungsi fisiologis untuk relaksasi
vaskuler dan dapat menekan oksidasi lipoprotein yang amat penting untuk
pencegahan aterosklerosis. Namun pada kondisi tertentu nitrit oksida dapat
bereaksi dengan radikal superoksida membentuk peroksinitrit yang merupakan
oksidan kuat yang akan bereaksi dengan protein dan lipid (Wijaya 1996).
Dampak Negatif Radikal Bebas
Berbagai kerusakan yang ditimbulkan oleh serangan radikal bebas terhadap
sel-sel tubuh antara lain:
Kerusakan Membran Sel. Komponen terpenting membran sel adalah fosfolipid, glikolipid, dan kolesterol. Fosfolipid dan glikolipid mengandung asam
lemak tak jenuh ganda yang sangat rentan terhadap serangan radikal bebas,
terutama radikal hidroksil. Radikal hidroksil dapat menimbulkan reaksi berantai
yang dikenal dengan nama peroksidasi lipid. Akibat akhir dari reaksi berantai ini
toksik terhadap sel, antara lain aldehida seperti malondialdehida (MDA),
9-hidroksinonenal, serta berbagai hidrokarbon seperti etana (C2H6) dan pentana
(C5H12). Semuanya ini mengakibatkan kerusakan membran sel dan
membahayakan sel (Wijaya 1996)
Kerusakan Protein. Menurut Wijaya (1996) radikal bebas dapat merusak protein karena dapat mengadakan reaksi dengan asam-asam amino penyusun
protein. Di antara asam amino penyusun protein yang paling rawan adalah sistein
karena gugus sulfidril (SH) yang dikandungnya rentan terhadap serangan radikal
bebas. Pembentukan ikatan disulfida menimbulkan ikatan intra dan antar molekul
protein sehingga molekul protein tersebut kehilangan fungsi fisiologisnya.
Kerusakan DNA. Radikal bebas merupakan salah satu penyebab kerusakan DNA. Kerusakan ini dapat mengakibatkan terjadinya mutasi sel dan
menimbulkan penyakit kanker (Halliwell & Guitteridge 1985)
Autoimun. Autoimun adalah terbentuknya antibodi terhadap sel tubuh biasa. Adanya antibodi terhadap sel tubuh dapat mengakibatkan kerusakan
jaringan tubuh (Halliwell & Guitteridge 1985).
Penuaan Dini. Kerusakan jaringan oleh radikal bebas terjadi secara terus menerus, perlahan, dan pasti. Hal ini disebabkan efisiensi proses pemusnahan
radikal bebas dalam tubuh tidak terjadi secara sempurna. Jaringan yang rusak ini
mengakibatkan terjadinya proses penuaan dini (Halliwell & Guitteridge 1985).
Aterosklerosis. Oksidasi LDL merupakan tahap awal terjadinya arterosklerosis. Serangan radikal hidroksil pada PUFA pada permukaan LDL
mengawali terjadinya reaksi peroksidasi lipid yang menyebabkan modifikasi
oksidatif dari PUFA dan degradasi apolipoprotein B (Wijaya 1996).
Indikator pengukuran radikal bebas
Malonaldehid (MDA). MDA adalah senyawa dialdehid yang mengandung 3 atom karbon dengan gugus karbonil yang berada pada posisi C1 dan C3. MDA
mempunyai rumus kimia C3H4O2 dengan berat molekul 72. Malonaldehid
merupakan salah satu hasil oksidasi lipid pada tahap propagasi dari dekomposisi
Konsentrasi MDA dalam material biologi telah digunakan secara luas
sebagai indikator keberadaan radikal bebas. MDA dapat mengadakan cross link
dengan residu lisin yang bebas pada apo-B dari LDL. MDA dijumpai juga
sebagai produk samping biosintesis prostaglandin (Zakaria 1996; Jialal & Devaraj
1997).
Analis MDA merupakan analisis radikal bebas secara tidak langsung dan
cukup mudah untuk menentukan jumlah radikal bebas yang terbentuk. Analisis
radikal bebas secara langsung sangat sulit dilakukan, karena radikal ini merupakan
senyawa yang tidak stabil dan cenderung untuk merebut elektron senyawa lain
agar menjadi lebih stabil. Reaksi ini berlangsung cepat sehingga pengukurannya
sangat sulit bila dalam bentuk senyawa radikal bebas (Guitteridge 1995).
Menurut Conti et al (1991), MDA dapat melakukan reaksi penambahan nukleofilik (nukleophilic addition reaction) dengan asam tiobarbiturat (TBA) membentuk senyawa MDA-TBA. Senyawa ini berwarna merah jambu yang dapat
diukur intensitas warnanya dengan menggunakan spektrofotometer. Inilah yang
merupakan dasar analisis dengan metode TBA. 1,1,3,3-tetraetoksipropan
merupakan prekusor MDA sehingga sebagai larutan standar dapat digunakan
larutan tetraektoksipropan. Peningkatan kadar MDA dapat ditekan dengan
pemberian antioksidan seperti vitamin C, A, dan E dan beberapa komponen
bioaktif yang secara keseluruhan dapat menekan proses peroksidasi lipid.
Diena Terkonjugasi. Reaksi tidak terkendali radikal bebas terhadap komponen sel seperti asam lemak tidak jenuh ganda (PUFA), heksosa, pentosa,
asam amino, dan komponen DNA menghasilkan beberapa produk seperti : MDA,
diena terkonjugasi, dikarbonil, dan asam 15-hidroperoksi-5,8,4,13
eikosatetraenoik (15-HPETE). Proses pembentukan diena terkonjugasi, pada
tahap awal terjadi laju oksidasi yang tergantung antioksidan endogen. Fase ini
merupakan fase lag dari oksidasi. Fase lag kemudian diikuti dengan fase
propagasi yang terjadi setelah penurunan jumlah antioksidan endogen. Pada fase
propagasi terjadi peningkatan abstraksi H dari ALTJ, sehingga terjadi peningkatan
diena terkonjugasi. Fase propagasi kemudian diikuti dengan fase dekomposisi.
Pada fase terakhir ini terbentuk aldehid seperti MDA, 4 hidrosinonenal (HNE),
Antioksidan
Antioksidan adalah zat yang mampu memperlambat atau mencegah proses
oksidasi (Schuler 1990). Antioksidan bereaksi dengan oksidan sehingga
mengurangi kapasitas oksidan untuk menimbulkan kerusakan. Sementara itu,
menurut Cillard et al (1980) dan Schluler (1990) antioksidan adalah zat dengan kadar lebih rendah dari zat yang mudah teroksidasi, secara nyata mampu
memperlambat oksidasi zat tersebut. Sebaliknya pada kadar tinggi zat antioksidan
bersifat peroksidan. Antioksidan biologis adalah zat yang mampu melindungi
sistem biologis dari kerusakan akibat kelebihan oksidasi (Krinsky 1992).
Antioksidan primer adalah suatu molekul yang dapat memberikan atom
hidrogen secara cepat kepada radikal lipid sehingga radikal yang terbentuk lebih
stabil dari daripada radikal lipidnya atau diubah menjadi produk lain yang lebih
stabil. Zat-zat yang termasuk dalam golongan ini dapat berasal dari alam seperti
tokoferol, polifenol, lesitin, fosfatida, dan asam askorbat serta antioksidan buatan
seperti butylated hydroxyanisole (BHA) dan butylated hydroxytoluene (BHT). Sedangkan antioksidan sekunder adalah suatu zat yang dapat mencegah kerja
prooksidan sehingga dapat digolongkan sebagai sinergi. Beberapa asam organik
tertentu dapat mengikat logam-logam, misalnya satu molekul asam sitrat akan
mengikat prooksidan Fe seperti pada minyak kedelai (Winarno 1997).
Antioksidan fenolik seperti vitamin C, flavonoid, turunan asam sinamat,
coumarin dan komponen fenolik pada umumnya merupakan antioksidan primer.
Senyawa fenol dapat berfungsi sebagai antioksidan primer karena mampu
menghentikan reaksi radikal bebas pada oksidasi lipida (Kochhar & Rossell,
1990).
Antioksidan dapat ditemukan dalam tubuh seperti glutation, ubiquinol dan
asam urat yang diproduksi pada metabolisme normal. Antioksidan juga dapat
ditemukan pada makanan seperti vitamin E, C, dan karotenoid (Langseth 1995).
Mekanisme kerja antioksidan dapat melalui beberapa cara, seperti:
menghambat terbentuknya radikal bebas, menjadi perantara dalam netralisasi
P-450 (Charpentier & Cateora 1996). Menurut Shahidi (1997), antioksidan
diketahui bekerja pada berbagai tahapan oksidasi molekul lemak, yaitu dengan
cara menurunkan kadar oksigen, menangkap singlet oksigen, mencegah tahap
inisiasi reaksi rantai melalui penangkapan radikal hidroksil, mengikat ion logam
katalisator, dekomposisi produk utama menjadi senyawa non radikal dan memutus
reaksi rantai untuk mencegah kelanjutan penarikan elektron dari substrat.
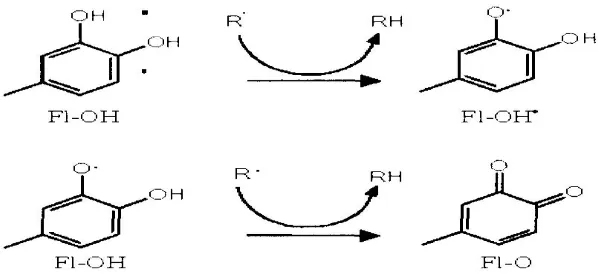
Mekanisme reaksi antioksidan senyawa fenolik terjadi melalui pemberian
atom hidrogen dari gugus hidroksil dengan cepat kepada senyawa radikal
(Gambar 2). Radikal antioksidan yang terbentuk dari mekanisme tersebut cukup
stabil sehingga tidak akan bekerja sebagai inisiator bagi reaksi rantai berikutnya
(Ranney, 1979). Kestabilan dari radikal antioksidan tersebut juga terjadi melalui
delokalisasi elektron tidak berpasangan pada cincin aromatiknya berdasarkan
reaksi isomerasi (Gorton, 1994)
Gambar 2 Mekanisme reaksi gugus fenol dari senyawa fenolik dengan
senyawa radikal (Ranney 1979)
Flavonoid merupakan salah satu kelas dari polifenol yang terdiri dari
beberapa sub kelas seperti flavone, flavonol, flavanone, flavanol, dan anthocyanin
Flavonoid merupakan komponen yang memiliki berat molekul rendah, dan
pada dasarnya adalah phenylbenzopyrones dengan berbagai variasi pada struktur dasarnya, yaitu tiga cincin utama yang saling melekat (Gambar 4). Struktur dasar
ini terdiri dari dua cincin benzena (A dan B) yang dihubungkan melalui cincin
heterosiklik piran atau piron (dengan ikatan ganda) yang disebut cincin ”C”
(Middleton et al 2000). Hal ini dipertegas lagi oleh Miean dan Mohamed (2001) bahwa struktur flavonoid adalah rangkaian cincin karbon C6C3C6.
Gambar 4 Struktur kimia flavonoid.
Mekanisme reaksi antioksidan senyawa flavonoid terjadi melalui proses
scavenging radikal bebas (Gambar 5). Potensial reduksi senyawa flavonoid yang
rendah (0,23 E <0,75) dapat mereduksi secara termodinamik radikal bebas dengan
FLAVONOID
Monomer flavonol,
(tomat, bawang) Monomers-katekins dan efikatekins (teh, kakao,apel )
Flavanols
Oligomers-proanthosianidin
Prodelphinidins. Contoh teh Pigmen merah lainnya
Prosianidin, contoh: kakao, apel, kacang
Gambar 3 Pembagian kelas flavonoid ( CIC 2001).
PHENOLIC ACID LAIN-LAIN
potensial oksidasi antara 2,13 – 1,0 V. Radikal flavonoid (F1-O*) dapat bereaksi
kembali dengan senyawa radikal bebas kedua, membentuk struktur kuinon yang
stabil. Radikal-flavonoid (F1-O*) yang reaktif akan mengalami reaksi terminasi
dengan radikal bebas (R*) membentuk senyawa flavonoid-radikal (F1-OR) yang
stabil dan tidak reakti ( Pietta 2000).
Gambar 5 Scavenging radikal bebas oleh flavonoid
Keterangan:
R* = senyawa radikal bebas F1-OH = senyawa golongan flavonoid F1-O* = radikal-flavonoid
Untuk mengukur aktivitas suatu antioksidan dapat dilakukan dengan
beberapa cara. Prinsip pengukuran ini adalah dengan cara mengadu atau
mereaksikan senyawa antioksidan dengan senyawa radikal. Salah satu tes yang
sudah dikembangkan adalah tes antioksidan dengan menggunakan senyawa
DPPH. Tes dengan metode ini merupakan uji secara kolorimetri berdasarkan
warna. Warna yang terbentuk berasal dari hasil reaksi antara radikal bebas DPPH
dengan antioksidan. Reaksi yang terjadi adalah DPPH* + AH à DPPH-H + A*.
DPPH* dalam bentuk radikal memberikan absorpsi yang maksimum pada panjang
gelombang 517 nm. Setelah direduksi oleh antioksidan, maka terbentuk
Vitamin C
Vitamin C atau asam askorbat merupakan kristal putih yang mudah larut
dalam air. Vitamin C cukup stabil dalam keadaan kering, tetapi mudah rusak
dalam keadaan larut, terutama bila bersentuhan dengan udara (oksidasi) bila
terkena panas. Oksidasi dipercepat dengan kehadiran besi dan tembaga. Vitamin
C tidak stabil dalam larutan alkali, tetapi cukup stabil dalam larutan asam.
Vitamin C adalah vitamin yang paling labil (Almatsier 2002).
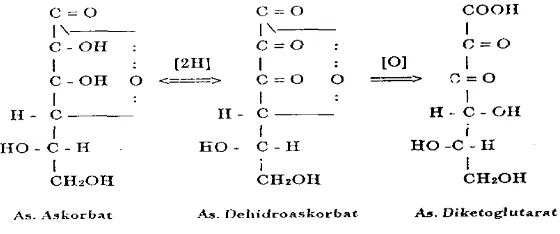
Asam askorbat terdapat dalam 2 bentuk (Gambar 5) , yaitu tereduksi (asam
askorbat), pada subyek normal 80% vitamin C yang bersirkulasi terdapat dalam
bentuk ini, sedangkan bentuk teroksidasi (asam dehidroaskorbat) dapat meningkat
pada kasus patologik, misalnya arthritis rhematoid. Bila asam dehidroaskorbat
teroksidasi lebih lanjut akan berubah menjadi asam diketoglutarat yang tidak aktif
secara biologis (Muctadi 2000)(Gambar 6).
Sumber : Muchtadi 2000
Gambar 6 Struktur kimia tiga bentuk asam askorbat.
Vitamin C mudah rusak selama pemrosesan dan penyimpanan. Laju
kerusakan meningkat karena adanya kerja logam dan kerja enzim. Enzim yang
mengandung tembaga atau besi dalam gugus prostetiknya merupakan katalis yang
efisien untuk penguraian asam askorbat. Enzim paling penting untuk golongan ini
adalah askorbat oksidase, fenolase, sitokrom oksidase, dan peroksidase. Asam
askorbat dioksidasi dengan adanya udara pada kondisi netral dan basa. Pada pH
asam vitamin C lebih stabil(Almatsier 2002).
Vitamin C mudah diserap secara aktif dan mungkin pula secara difusi pada
bagian atas usus halus lalu masuk ke peredaran darah melalui vena porta.
Konsumsi tinggi sampai 12 gram (sebagai pil) hanya diserap sebanyak 16%.
Vitamin C kemudian dibawa ke semua jaringan. Konsentrasi tertinggi adalah di
dalam jaringan adrenal, pituitari, dan retina. Penyerapan asam askorbat pada
hewan-hewan yang bergantung pada vitamin C, nampaknya membutuhkan suatu
sistem transpor aktif. Asam askorbat siap diserap jika jumlah yang masuk kecil.
Jika jumlah yang masuk berlebihan, penyerapan melalui usus menjadi terbatas.
Sekitar 80 sampai 90% vitamin C dari makanan dapat diserap. Menu yang kaya
dengan pektin dapat menurunkan ekskresi asam askorbat melalui urin pada
manusia. Asam askorbat yang terserap secara tepat mencapai keseimbangan
dengan cadangan vitamin tersebut dalam tubuh. Orang dewasa yang sehat
menerima masukan vitamin C yang cukup mempunyai cadangan dalam tubuh
mendekati 1,5 gram asam askorbat. Sekitar 3 sampai 4% asam askorbat yang ada
dalam cadangan tubuh dipakai setiap hari. Masukan 60 mg asam askorbat per
hari akan mempertahankan cadangan tubuh kira-kira 1,5 gram. Cadangan tubuh
vitamin C yang lebih besar dapat tercapai dengan masukan vitamin C yang lebih
banyak. Jika cadangan tubuh ”jenuh”, kelebihan vitamin C ya ng diserap akan
dimetabolisasi atau diekskresikan melalui urin. Dalam keadaan ini tingkat
konsentrasi asam askorbat plasma ”tinggal” sekitar 1,5 mg/L (Sauberlich 1987).
Pada level molekular, askorbat dan dehidro askorbat mempunyai sifat
pereduksi seperti halnya vitamin E. Dalam keadaan demikian vitamin tersebut
mempunyai sifat sebagai antioksidan yang mempengaruhi redoks-potensial tubuh
(Linder 1985). Aktivitas asam askorbat sebagai antioksidan berdasarkan
kemampuannya bereaksi dengan radikal bebas. Asam askorbat diubah menjadi
askorbil radikal yang dengan cepat mengalami disproposionasi menjadi askorbat
dan dehidroaskorbat yang dapat bereaksi dengan oksigen toksik, seperti anion
superoksida dan hidroksil radikal (Deshpande et al 1996).
Vitamin C melindungi bagian sel dan jaringan yang larut air dan
mengurangi kembalinya senyawa radikal tokoferol ke bentuk aktif pada membran
seluler (Kaur & Kapoor 2001). Asam askorbat sebagai antioksidan dapat
menangkap singlet oksigen dan radikal peroksida, sehingga dapat melindungi
membran sel. Asam askorbat juga dapat membantu mereduksi radikal a-tokoferil
mencegah oksidasi asam lemak. Vitamin C juga mempunyai pengaruh protektif
terhadap perkembangan, baik fase awal maupun fase akhir kanker perut.
Pemberian vitamin A (30.000 IU/hari), vitamin C (1000mg/hari), dan vitamin E
(70mg/hari) dapat mencegah proliferasi sel, sehingga dapat disimpulkan bahwa
vitamin antioksidan tersebut dapat mencegah ti mbulnya kanker (Muchtadi 2000).
Status vitamin C tubuh ditetapkan melalui tanda-tanda klinik seperti
pendarahan gusi dan kapiler di bawah kulit dan pengukuran kadar vitamin C
dalam darah. Tanda dini kekurangan vitamin C dapat diketahui bila kadar vitami n
C dalam darah di bawah 0.2 mg/dl (Almatsier 2002).
Plasma Darah
Plasma adalah suatu larutan encer yang terdiri atas 90 persen air dan 10
persen komponen terlarut. Lebih dari 70 persen padatan-padatan terlarut plasma
merupakan protein-protein plasma. Protein-protein utama plasma antara lain:
serum albumin, lipoprotein densitas sangat rendah (VLDL), lipoprotein densitas
rendah (LDL), immunoglobulin lipoprotein densitas tinggi, fibrinogen, dan
prothrombin. Selain protein tersebut, plasma juga mengandung sejumlah
protein-protein pengangkut khusus seperti transferrin yang mengangkut besi. Di samping
protein-protein, plasma juga mengandung komponen organik, metabolit organik,
dan hasil-hasil buangan. Komponen anorganik yang ada dalam plasma adalah
NaCL, buffer bikarbonat, buffer fosfat, CaCI2, MgCI2, KCI, dan Na2SO4.
Sedangkan metabolit organik dan hasil-hasil buangan yang dikandung plasma
adalah glukosa, asam amino, laktat, piruvat, badan keton, sitrat, urea, dan asam
urat (Lehninger 1994).
Plasma darah juga mengandung hampir 700 mg lipida per 100 ml, yang
terikat pada a dan ß-globulin. Komponen lipida yang dimaksud adalah total
lipida, triasil gliserol, kolesterol dan esternya, dan fosfolipid.
Pengukuran konsentrasi komponen-komponen plasma penting dalam
diagnosis dan pengobatan penyakit. Volume plasma normal adalah sekitar 5 %
berat badan atau secara kasar 3500 ml (berat badan 70 kg).
merupakan tahap awal dari lesi aterosklerosis dalam arteri intima. Mekanisme
pembentukan dan penguraian hidroperoksida lipid di dalam plasma darah penting
diketahui dalam upaya pencegahan aterosklerosis (Frei et al 1988).
Plasma manusia dilengkapi dengan mekanisme pertahanan antioksidan.
Antioksidan plasma yang penting adalah asam askorbat, asam urat, a-tokoferol,
albumin berikatan dengan bilirubin, group sulfihidril protein. Disamping itu,
enzim superoksidase dismutase ektraseluler dan selenium tergantung glutation
peroksedase di laporkan dapat meningkatkan pertahanan antioksidan plasma (Frei
et al 1988).
Beberapa hasil penelitian menunjukkan bahwa senyawa bioaktif seperti
polifenol dapat melindungi plasma dari oksidasi oleh radikal bebas. Menurut
Zakaria et al 2001 senyawa yang dikandung oleh ekstrak jahe dapat meningkatkan resistensi LDL plasma terhadap oksidasi dan melindungi akumulasi kolesterol
dalam makropag. Dalam penelitian lain dikatakan bahwa senyawa polifenol pada
produk kakao dapat menurunkan oksidasi LDL pada plasma (Mathur et al 2002). Disamping itu, senyawa polipenol pada kakao juga telah dilaporkan dapat
meningkatkan antioksidan gizi yaitu vitamin E plasma dan menurunkan kadar
MDA plasma (Fraga et al 2005).
Penelitian secara in vivo yang menggunakan plasma sebagai model menyebutkan senyawa epikatekin telah ditemukan dalam plasma setelah 2 jam
dari mengkonsumsi produk coklat dan kakao (Baba et al 2000). Dalam penelitian yang lain disebutkan bahwa suplemetasi asam askorbat dapat mencegah
terbentuknya peroksidasi lipid dalam plasma (Frei et al 1988).
Ketersediaan Hayati (Bioavailabilitas) Flavonoid
Biovailabilitas adalah sejumlah komponen dari bahan pangan yang dapat
diukur setelah penyerapan di dalam suatu jaringan. Pengukuran bioavailabilitas
dari suatu bahan pangan berguna untuk mengetahui nilai biologi dan evaluasi nilai
gizinya serta untuk menunjukkan daya cernanya sehingga dapat dimanfaatkan
oleh organisme yang mengkonsumsinya (Langseth 2000).
Nilai bioavailabilitas setiap komponen bahan pangan selalu berbeda-beda
pula dari matrixnya. Faktor penyerapan serta bioavailabilitas yang berbeda-beda
dari senyawa antioksidan sangat mempengaruhi ketersediaan senyawa antioksidan
di dalam sel. Bioavailabilitas senyawa antioksidan dalam bahan pangan
dipengaruhi oleh proses pengolahan, pengaruh matrix bahan pangan, serat
makanan, kandungan lemak, faktor-faktor fisiologis (Boileou et al 1997), kiralitas dan bentuk kimia senyawa antioksidan tersebut (Papas 1999). Dalam penelitian
yang lain disebutkan beberapa faktor yang mempengaruhi bioavailabilitas
flavonoid adalah: (1) struktur penyusun senyawa flavonoid (matrik dari senyawa
flavonoid), (2) keberadaan gula dalam tubuh, (3) keberadaan serat dalam tubuh,
dan (4) status gizi (Hollman et al 1997).
Untuk dapat digunakan pada studi terhadap manusia, kandungan flavonoid
pada makanan harus dihubungkan dengan bioavailabilitasnya, termasuk absorbsi,
metabolisme, dan eksresi dari metabolitnya. Data mengenai penyerapan flavonoid
setelah dikomsumsi belum banyak dan jenis komponen flavonoidnya juga masih
terbatas (Peterson & Dwyer 2000).
Katekin anggota dari kelas flavanol yang telah dipelajari lebih ekstensif,
telah diserap dan muncul di plasma antara 1 sampai 2 jam setelah komsumsi,
flavon, dan flavonol muncul dalam plasma pada 1 sampai 3 jam setelah konsumsi.
(Peterson & Dwyer 2000)
Menurut Walle et al (2000), model penyerapan flavonoid mengasumsikan bahwa flavonoid glukosida terlalu polar untuk diserap oleh usus halus dan
penyerapan tergantung pada pemutusan ikatan ß-glukosida oleh mikroflora usus.
Laporan lain mengenai metabolisme flavonoid menyatakan bakteri intestina
mempunyai aktivitas glikosidase yang mampu melepaskan gugus gula dari
flavonoid dalam bentuk glikosida (Middlenton et al 2000). Flavonoid dapat mengalami proses oksidasi maupun reduksi seperti metilasi, glukoronidasi
maupun sulfatasi pada hewan. Middleton et al (2000) melaporkan mengenai metabolisme kuarketin dan katekin dalam hati menggunakan hati tikus yang telah
di isolasi (isolated perfused red liver). Flavonoid dikonversi menjadi metabolit yang tersulfatasi dan/atau terglukoronidasi, yang kemudian di ekskresi melalui
yang mempunyai kemampuan mereduksi tinggi diserap terutama dalam bentuk
terglukoronidasi, yaitu 96.5% ± 4.6 dari jumlah yang diserap.
Sejumlah laporan memperkirakan bahwa flavonoid dapat masuk ke dalam
sirkulasi darah dalam bentuk yang telah terglukoronidasi kemudian tersufatasi
dalam hati serta termetilasi dalam hati dan ginjal (Azuma et al 2002).
Pada manusia, bioavailabilitas flavonoid berkisar antara 1 sampai 26%.
Pada tubuh kita flavonoid akan bersikulasi dalam plasma, terdapat sebagai
glukoronida, metil dan sulfat konjugat atau kombinasi dari ketiganya yang
merupakan hasil reaksi enzim fase I dan fase II (Grassi et al 2006).
Kromatografi Cair Kinerja Tinggi(HPLC)
Analisis kimia menggunakan metode kramatografi didasarkan pada
pemisahan komponen yang terpartisi di antara dua fase dalam suatu
kesetimbangan dinamis dan mengalir. Proses ini dilakukan dengan menggerakkan
fase mekanis (fase gerak), relatif terhadap fase lainnya (fase diam).
Pemisahan kromatografi yang paling baik akan diperoleh jika fase diam
mempunyai luas permukaan sebesar-besarnya, sehingga memastikan
kesetimbangan yang baik antara fase. Persyaratan kedua agar pemisahan baik
adalah fase gerak harus bergerak dengan cepat sehingga difusi sekecil-kecilnya.
Untuk memperoleh permukaan fase diam yang luas, pada sebagian besar sistem
kromatografi digunakan penjerap atau penyanggah berupa serbuk halus. Untuk
memaksa fase gerak bergerak lebih cepat melalui fase diam yang terbagi pada
serbuk halus, harus digunakan tekanan tinggi. Dengan dipenuhinya persyaratan
tersebut, diperoleh tehnik kromatografi cair yang paling kuat yakni HPLC. Jadi
pada HPLC fase gerak dialirkan dengan cepat dan hasilnya di deteksi dengan
instrumen (Gritter et al 1991).
Keuntungan utama dari HPLC adalah mampu menangkap komponen yang
memiliki stabilitas panas terbatas ataupun yang bersifat volatil. HPLC merupakan
metode yang sangat sensitif, tepat, selektif, dan memiliki tingkat otomatis yang
tinggi, sehingga lebih sederhana dalam pengoperasiannya (Macrae 1988).
Disamping itu, HPLC banyak digunakan untuk analisis karena kemudahan injeksi,
seperti sampel cairan, padatan yang dilarutkan, maupun sampel yang labil
terhadap pemanasan. Modern HPLC telah banyak diaplikasikan seperti
pemisahan, identifikasi, pemurnian, dan penghitungan komponen yang bervariasi.
Menurut Adamson et al (1999) HPLC merupakan metode yang efektif untuk mendeteksi dan menghitung komponen fenol dan metode ini telah
digunakan secara luas. HPLC telah digunakan dalam menghitung prosianidin
dalam kakao dan coklat.
Dalam penelitian lain Mark et al 2005 mengungkapkan bahwa HPLC merupakan metode yang telah banyak digunakan untuk analisis kuantitatif
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Biokimia dan Laboratorium
Kimia Departemen Ilmu dan Teknologi Pangan, Laboratorium Kimia PAU
Pangan dan Gizi IPB, Laboratorium Kultur Jaringan Bagian Patologi dan
Laboratorium Terpadu Fakultas Kedokteran Hewan IPB Bogor, serta Klinik
Farfa Darmaga. Penelitian dilaksanakan pada bulan Juni 2006 sampai Maret
2007.
Bahan dan Alat
Bahan
Bahan baku yang digunakan pada penelitian ini adalah bubuk kakao lindak
bebas lemak non fermentasi. Bubuk kakao ini diperoleh dari Pusat Penelitian
Kopi dan Kakao Indonesia di Jember. Bahan lain yang digunakan adalah gula
pasir, air panas, dan susu bubuk skim.
Bahan kimia: Asam askorbat, 2,4-dinitrofenilhidrazin (DNPH), H2SO4
65%, metanol pro-analisis, 2,2-diphenyl-1-pycrilhydrazyl (DPPH), aquabides, NaCl 0,9%-NaHCO3, CuSO4, pereaksi polin, albumin serum sapi,
1,1,3,3-tetraetoksipropana (Sigma), asam tiobarbiturat (TBA), buffer fosfat pH3, dan
1-butanol. Standar flavonoid katekin (Sigma), alkohol 90%, etanol 95%, metanol,
HPLC, air bebas ion, dan enzim ß-glukoronidase/sulfatase from Helix Pomatia
type HP-1 (G 7017, Sigma)
Alat
Alat–alat: tabung vacutainer steril, mikropipet, penangas air, lemari es,
gelas piala, vortek, sentrifuse (JOUAN, tipe CR 412), laminar air flow (Holten
Laminar air tipe HV 2472), spektrophotometer (Shimadzu), lema ri pendingin,
mikroplate reader (BIO-RAD, Benchmark), kuvet, alat pengukur pH, HPLC
(Shimadzu CLASS-VP V6.12SP2) dengan kolom C18 (3,9 x 150 mm, 4 µm)
dengan detektor UV pada panjang gelombang 280 nm, inkubator, gelas ukur, dan
Peralatan sekali pakai yang digunakan adalah syringe 50 ml (terumo),
syringe 3 ml, tabung sentrifuse steril 15 dan 50 ml sekali pakai (corning), lempeng
mikro 96 sumur (corning), repeater (eppendorf), dispenser tip (marsh), dan tabung
vacutainer ukuran 9 ml.
Metode Penelitian
Pembuatan Minuman Bubuk Kakao Lindak Bebas Lemak
Minuman bubuk kakao dibuat dari 4 gram bubuk kakao bebas lemak
ditambahkan 2 gram gula dan 2 gram susu bubuk skim kemudian dilarutkan
dalam 100 ml air panas. Minuman ini selanjutnya diberi nama mi numan bubuk
kakao lindak bebas lemak. Sedangkan minuman untuk kelompok kontrol dibuat
dari 2 gram susu bubuk skim ditambah 2 gram gula kemudian dilarutkan dalam
100 ml air panas tanpa penambahan bubuk kakao lindak bebas lemak. Minuman
ini selanjutnya diberi nama minuman kontrol. Minuman bubuk kakao lindak
bebas lemak maupun minuman kontrol diminum oleh responden dalam keadaan
hangat. Penyiapan minuman bubuk kakao bebas lemak dilakukan bersama
dengan tim (Erniati 2007; Kusumantias 2007; Amri 2007; Hasanah 2007).
Persiapan Responden
Kriteria seleksi responden yang terlibat dalam penelitian ini antara lain:
berjenis kelamin perempuan atau mahasiswi Institut Pertanian Bogor, umur 22-27
tahun, sehat atau tidak menderita penyakit yang serius berdasarkan tes dokter
yang ditunjuk, bertempat tinggal di lokasi yang sama, dan bersedia
menandatangani informed konsent. Pemeriksaan kesehatan terhadap responden dilakukan oleh seorang dokter di Klinik Farfa Darmaga Bogor. Pemeriksaan
kesehatan dilakukan sebelum dan sesudah intervensi.
Jumlah responden yang terlibat dalam penelitian ini adalah 18 orang yang
dibagi dalam dua kelompok masing-masing beranggotakan 9 orang. Kelompok
pertama atau kelompok kakao adalah kelompok yang diintervensi untuk
meminum minuman bubuk kakao lindak bebas lemak. Kelompok kedua atau
yang terbuat dari 2 gram gula ditambah susu yang dilarutkan dalam 100 ml air.
panas. Penyiapan responden dilakukan bersama-sama dengan tim (Erniati 2007;
Kusumantias 2007; Amri 2007; Hasanah 2007).
Pelaksanaan Intervensi (Nurrahman et al 1999)
Intervensi dilaksanakan selama 25 hari di rumah indekos mahasiswi di
kompleks perumahan IPB II Sindang Barang. Pelaksanaan intervensi dilakukan
setiap hari pada jam 07.00 - 08.00 WIB. Setiap responden pada kelompok kakao
diintervensi untuk meminum minuman bubuk kakao yang telah disediakan. Sama
halnya dengan kelompok kontrol diintervensi untuk minum minuman yang
diperuntukkan untuk kelompok kontrol. Minuman bubuk kakao disiapkan setiap
hari oleh peneliti yang sekaligus mengawasi responden meminum minuman
bubuk kakao dan susu. Semua responden mendapat sarapan pagi sebelum
mengkonsumsi minuman bubuk kakao dan makan malam dengan menu yang
seragam. Seminggu sekali selama pelaksanaan intervensi dilakukan diskusi yang
melibatkan seluruh responden mengenai penelitian dan kesehatan umum.
Sebelum pelaksanaan intervensi juga dilakukan penandatanganan surat
perjanjian (Informed consent) (Lampiran 1) dan wawancara terhadap responden dengan format kuisioner standar (Lampiran 2). Kuisioner tersebut berisi
pertanyaan-pertanyaan mengenai status sosial ekonomi, pengetahuan tentang
pangan, pola konsumsi, dan kebiasaan membeli makanan jajanan.
Pengukuran Status Gizi (Nurrahman et al 1999)
Pengukuran status gizi responden dilakukan secara antropometri yang
meliputi tinggi badan (TB) dan berat badan (BB). Penggolongan status gizi
menurut “body mass index” (BMI) dengan satuan Kg/m2, yaitu:
BMI = BB/TB2
Dimana: BMI < 17,0, kekurangan berat badan tingkat berat BMI 17,0 – 18,4, kekurangan berat badan tingkat ringan
BMI 18,5 – 25,0, normal
BMI 25,1 – 27,0, kelebihan berat badan tingkat ringan
Pengambilan Darah
Pengambilan darah dilakukan sebelum dan sesudah responden mengalami
intervensi dengan meminum minuman bubuk kakao. Pengambilan darah
dilakukan di Klinik Farfa Dramaga pada jam 07.00-08.00 pagi oleh seorang
asisten transfusi darah. Darah diambil sebanyak 35 ml dengan menggunakan
jarum precisionglide TM steril sekali pakai, kemudian di masukkan ke dalam
tabung vacutainer steril yang mengandung antikoagulan. Darah yang diambil
dibawa ke Laboratorium Kultur Jaringan Bagian Patologi FKH IPB untuk
pemisahan plasmanya.
Plasma Darah
Darah yang telah dimasukkan dalam tabung vacutainer steril yang
mengandung antikoagulan dilakukan pemisahan komponen seluler dengan
sentrifugasi sampel darah pada 514 g selama 5 menit dengan menggunakan
sentrifus dengan rotor swing. Bagian darah yang lebih berat (sel darah merah)
berada di bagian bawah, sedangkan plasma darah terpisah ke bagian atas. Plasma
darah diambil atau dipisahkan dengan mikropipet kemudian dimasukkan ke dalam
tabung sentrifus yang telah disiapkan.
Analisis Vitamin C (Zakaria et al 1996)
Asam askorbat sebanyak 1 gram dilarutkan dalam 1 liter TCA 5% larutan
stok. Selanjutnya membuat larutan standar dengan cara mengambil 2 ml larutan
stok untuk diencerkan sampai 100 ml dengan TCA 5%. Dari larutan sta ndar
dibuat kurva standar dari konsentrasi 1 mg/l sampai 12 mg/l.
Sebanyak 500 µl plasma, blanko dan standar dicampur dengan 100 µl
larutan DNPH dengan cara divortek, selanjutnya diinkubasi suhu 37°C selama 4 jam. Kemudian ditambah 750 µl H2SO4 65% dan didiamkan selama satu jam di
dalam ruang gelap. Selanjutnya disentrifus dengan kecepatan 704 g selama 10
menit, absorbansinya dibaca dengan spektrophotometer pada panjang gelombang
Analisis Aktivitas Antiradikal Bebas Plasma dengan Metode DPPH (Modifikasi Turkmen et al 2005)
Sampel plasma diambil sebanyak 1 ml menggunakan mikropipet 1 ml
kemudian dimasukkan ke dalam tabung sentrifus dan ditambah kan metanol pro-analisis 1 ml serta DPPH 0.2 mM sebanyak 1 ml dan dikocok. Tabung kemudian disimpan dalam ruang gelap (tanpa cahaya) selama 60 menit. Sampel di sentrifus
pada 704 g selama 10 menit. Sampel kemudian diukur menggunakan
spektrofotometer pada panjang gelombang 517 nm. Sebagai kontrol digunakan
campuran larutan DPPH dan metanol. Absorbansi dari tiap sampel didapat dan
aktivitas antioksidannya dihitung dengan menggunakan rumus :
%
Analisis Kadar Malondialdehida (MDA) Plasma (Modifikasi Metode Winarsi 2002; Hong et al 2000)
Mula-mula dibuat berbagai larutan standar MDA dari
1,1,3,3-tetraetoksipropana dengan pelarut air bebas ion dengan konsentrasi 1,25, 1,5,
1,75, 2,25 pmol/µl. Pereaksi dibuat dengan melarutkan 1,728 gram TBA (asam
tiobarbiturat) dalam 100 ml buffer fosfat pH 3.
Sebanyak 75 µl sampel plasma atau standar dimasukkan kedalam tabung
sentrifus, kemudian ditambahkan 75 µl TCA 20% (dalam 0,6 mol/L HCl).
Setelah itu didinginkan dalam lemari pendingin selama 20 menit, campuran
tersebut disentrifus pada 704g selama 20 menit. Sebanyak 100 µl supernatan
yang diperoleh ditambahkan 20 µl pereaksi TBA dan selanjutnya campuran
tersebut dididihkan selama 30 menit. Setelah didinginkan dengan air kran
campuran tersebut dimasukkan ke dalam sumur-sumur mikroplat 96 sumur dan
absorbansinya diukur dengan menggunakan mikroplate reader pada panjang gelombang 540 nm. Kurva standar dibuat dengan memplot nilai absorbansi
dengan konsentrasi standar. Konsentrasi MDA plasma dapat dihitung
Analisis Diena Terkonjugasi Plasma (Zakaria et al 2001)
Sampel plasma diencerkan dengan NaCL 0,9 %-NaHCO3 1 mM sampai
konsentrasi protein 10 µg/ml, kemudian dioksidasi dengan penambahan 5 µM
CuSO4 (konsentrasi akhir) pada 37°C. Pembacaan absorbansi pada 234 nm
dilakukan setiap 5 menit selama 2 jam. Kadar diena terkonjugasi dihitung dari
pengukuran absorbansi (A) pada slope tangen kurva selama fase propagasi dengan koefisien molar ekstingsi (ω ) 234 untuk diena terkonjugasi adalah 29.500
(mol/l)-1 cm-1. Fase lag yang merupakan fase sebelum atau mulai terjadinya
oksidasi diukur dari mulai penambahan CuSO4 dengan titik perpotongan tange n
fase propagasi yang diekstrapolasikan ke waktu (absis). Fase lag dinyatakan
dengan menit.
Analisis Kadar Protein Plasma (Metode Lowry 1951)
Kurva standar dibuat dengan seri pengenceran albumin serum sapi (ASS)
1000 µg/ ml. yaitu 800, 600, 400, 200, 100 µg/ ml. Sebanyak 1,2 ml larutan ASS
dari masing-masing pengenceran ditambahkan 6 ml CuSO4alkalis (dengan
komposisi 1ml CuSO4.5H2O, 1 ml Na-tartarat 2 %, 98 ml Na2CO3 2 % dalam
0,1 N NaOH). Untuk larutan sampel sebanyak 1.2 ml larutan sample ditambah Cu
alkali.
Setelah dibiarkan selama 10 menit pada suhu ruang, ke dalam setiap tabung
ditambahkan 0,3 ml pereaksi folin, diaduk dan dibiarkan selama 30 menit.
Pengukuran absorbansi dilakukan pada panjang gelombang 650 nm. Kadar