ISOLASI SENYAWA FLAVONOIDA DARI KULIT BATANG
TUMBUHAN MANGGA
(Mangifera indica L)SKRIPSI
EKA MAULINA PASARIBU
080822024
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI KULIT BATANG TUMBUHAN MANGGA(Mangifera indica L)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana Sains
EKA MAULINA PASARIBU 080822024
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA
DARI KULIT BATANG MANGGA
(Mangifera indica L)
Kategori : SKRIPSI
Nama : EKA MAULINA PASARIBU
Nomor Induk Mahasiswa : 080822024
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU
PENGETAHUAN ALAM (FMIPA)
UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, Juni 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
(Drs. Philipus. H. Siregar) (Sovia Lenny, Ssi, Msi )
NIP 195805041986011002 NIP 19751018200032001
Diketahui/Disetujui Oleh:
Departemen Kimia FMIPA USU
(DR.Rumondang Bulan, MS)
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI KULIT BATANG TUMBUHAN MANGGA (Mangifera indica L)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2011
PENGHARGAAN
Segala puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Kuasa, karena atas kasih dan rahmatNYA penulis dapat menyelesaikan skripsi ini dengan baik.
Ucapan terima kasih yag sebesar-besarnya penulis sampaikan kepada kedua orangtua, Ayahanda P.Pasaribu, SH dan Ibunda M.br Sinaga atas segala doa, motivasi dan nasehat yang tiada henti sehingga skripsi ini dapat terselesaikan dengan baik, dan kepada adik-adik penulis Cyputra Marcus, Nancy Yohana, Evan Nathanael dan Vina Anasthasia Pasaribu.
Dengan segala kerendahan hati penulis juga ingin menyampaikan terimakasih yang begitu besar kepada:
1. Ibu Sovia Lenny, S.Si, M.si, selaku dosen pembimbing 1 dan dosen akademis yang telah banyak memberikan pengarahan dan bimbingan kepada penulis dalam penyelesaian penelitian dan penyempurnaan skripsi.
2. Bapak Drs. Philippus Siregar, M.si selaku pembimbing 2 yang telah memberikan masukan dalam penyelesaian skripsi.
3. Ketua dan Sekretaris Departemen Kimia Ibu Dr. Rumondang Bulan Nst, M.S dan Bapak Drs. Albert Pasaribu, Msc serta semua dosen di Departemen Kimia FMIPA USU Khususnya Dosen Kimia Bahan Alam.
4. Analis Laboratorium LIPI Serpong-Tangerang, pegawai di FMIPA USU.
5. Abang yang kukasihi Jolly Marpaung, Amd yang memberikan banyak dukungan dan motivasi dalam penyelesaian skripsi ini. .
6. Teman-teman Kimia Ekstensi stambuk 2008 dan rekan-rekan asisten Kimia Bahan Alam yang selaku membantu penulis dalam melakukan penelitian. 7. Mariska Hutajulu selaku rekan satu penelitian penulis di laboratorium Kimia
Bahan Alam.
8. Kak Mia, Fransiska, Tini, Nova dan Neeta selaku sahabat-sahabat yang memberikan banyak dukungan dan motivasi dalam penyelesaian skripsi ini.
Semoga Tuhan memberkati kita semua.
Medan, Juni 2011
Penulis
ABSTRAK
THE ISOLATION FLAVONOID COMPOUND FROM FRUITS OF MANGGO (Mangifera indica L)
ABSTRACT
DAFTAR ISI
3.3. Prosedur Penelitian 33
3.3.1. Penyedian Sampel 33
3.3.2.1. Uji Busa 33 3.3.2.2. Skrining Fitokimia 34
3.3.3. Prosedur Untuk Memperoleh Senyawa Kimia dari Ekstrak Kulit
Batang Tumbuhan Mangga 34
3.3.4. Analisis Kromatografi Lapis Tipis 35 3.3.5. Isolasi Senyawa Flavonoida Dengan Kromatografi Kolom 35
3.3.6. Pemurnian 36
3.3.7. Uji Kemurnian Hasil Isolasi Dengan Kromatografi Lapis Tipis 36
3.3.8. Penentuan Titik Lebur 37
3.3.9. Analisis Spektroskopi Senyawa Hasil Isolasi 37
3.4. Bagan Penelitian 38
BAB 4 HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 39
4.2. Pembahasan 40
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 42
5.2. Saran 42
DAFTAR PUSTAKA 43
DAFTAR GAMBAR
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Tumbuhan Mangga 45
Lampiran 2. Determinasi Tumbuhan Mangga 46
Lampiran 3. Hasil Kromatografi Lapis Tipis Senyawa Hasil Isolasi Melalui
Penampakan Noda dengan Pereaksi 47 Lampiran 4. Spektrofotometri UV-Visible Senyawa Hasil Isolasi 48 Lampiran 5.Spektrum Infra Merah Senyawa Hasil Isolasi 49 Lampiran 6. Spektrum Senyawa Pembanding Inframerah 50 Lampiran 7. Spektrofotometri Resonansi Magnetik Proton Senyawa Hasil Isolasi 51
ABSTRAK
THE ISOLATION FLAVONOID COMPOUND FROM FRUITS OF MANGGO (Mangifera indica L)
ABSTRACT
BAB 1 PENDAHULUAN
1.1.Latar Belakang
Berbagai jenis tumbuhan mengandung senyawa metabolit sekunder, seperti alkaloid,
flavonoid, steroid, terpenoid, saponin dan lain-lain. Senyawa metabolit sekunder yang
terdapat dalam tumbuhan merupakan zat bioaktif yang berkaitan dengan kandungan
kimia dalam tumbuhan, sehingga sebagian tumbuhan dapat digunakan sebagai bahan
obat. Tanpa adanya suatu senyawa bioaktif dalam tumbuhan secara umum tumbuhan
tersebut tidak dapat digunakan sebagai obat.
Menurut penelitian masa kini, obat-obat tradisional memang bermanfaat bagi
kesehatan dan kini digencarkan penggunaannya karena lebih mudah dijangkau
masyarakat baik harga maupun ketersediaannya. Obat tradisional pada saat ini banyak
digunakan karena menurut beberapa penelitian tidak terlalu menyebabkan efek
samping karena masih bisa dicerna oleh tubuh. Bagian dari obat tradisional yang bisa
dimanfaatkan adalah akar, rimpang, kulit batang, buah, daun dan bunga (Ulya,2007).
Salah satu dari tumbuhan yang biasa digunakan sebagai tumbuhan obat adalah
tumbuhan Mangga (Mangifera indica L) famili Anarcardiaceae. Tumbuhan Mangga
(Mangifera indica) tergolong kelompok buah berdaging dengan bentuk, ukuran,
warna, citarasa yang beranekaragam. Bagian tumbuhan Mangga yang paling penting
dan berguna dalam kehidupan manusia sehari-hari, terutama bagi kesehatan adalah
getah, kulit batang, buah muda, dan buah masak. Getah Mangga dari bagian batang
atau ranting dapat dimanfaatkan sebagai obat tradisional untuk penyakit luar, seperti
eksim, kudis, dan gatal-gatal. Penyakit rematik atau persendian nyeri dapat diobati
digunakan sebagai manisan, juga berkhasiat sebagai obat beberapa jenis penyakit.
Di India Mangga yang masih hijau digunakan sebagai obat gangguan darah, empedu,
dan pencernaan, membantu pembentukan sel-sel baru, mencegah pendarahan, dan
menyembuhkan sariawan. Selain itu buah Mangga muda dapat berkhasiat untuk
mengatasi diare, disentri, wasir dan sembelit (Rukmana, 1997).
Buah Mangga memiliki kemampuan antioksidatif yang dihasilkan oleh berbagai
senyawa yang terdapat di dalamnya, yaitu betakaroten senyawa yang dapat
memberikan perlindungan terhadap kanker karena dapat menetralkan radikal bebas.
Vitamin E, vitamin C untuk meningkatkan daya tahan tubuh serta memperkecil
kemungkinan terjangkitnya berbagai bakteri dan kuman. Buah Mangga juga
mengandung senyawa flavonoid. Kandungan flavonoid dalam buah Mangga yang
mempunyai gugus hidroksi bebas dapat menghambat aktivitas sitokrom (Aminary,
2009).
Tumbuhan Mangga ini sudah pernah diteliti sebelumnya yang mengandung
senyawa kimia yaitu antosianin. Kandungan Antosianin ini dapat ditemukan pada
batang, kulit buah dan daun mangga. Antosianin pada kulit buah Mangga dijumpai
sebagai paenoidin 3-galactoside (Sukartini, 2008).
O- Flavonol dan C- glikosida xanton juga merupakan hasil ekstraksi dari kulit
buah tumbuhan Mangga (Mangifera indica L) dan dikarakterisasi menggunakan alat
HPLC. Diantara komponen yang telah dianalisa, tujuh senyawa merupakan turunan quercetin O-glikosida, dan empat turunan xanton C-glikosida juga telah ditemukan
pada tumbuhan tersebut (Andreas, 2003)
Dari hasil skrinning fitokimia diketahui bahwa di dalam kulit batang Mangga
terdapat senyawa flavonoida. Dari uraian diatas dan berdasarkan literatur, maka
penulis tertarik untuk mengisolasi senyawa kimia bahan alam hayati dari golongan
1.2.Permasalahan
Bagaimana cara mengisolasi senyawa flavonoida yang terdapat di dalam kulit batang
tumbuhan Mangga (Mangifera indica L)
1.3.Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi senyawa flavonoida dari kulit batang
tumbuhan Mangga (Mangifera indica L)
1.4.Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan sumber informasi ilmiah pada
bidang kimia bahan alam hayati dalam pengembangan ilmu kimia senyawa flavonoida
khususnya pada kulit batang tumbuhan Mangga (Mangifera indica L)
1.5.Lokasi Penelitian
Sampel yang digunakan merupakan kulit batang tumbuhan Mangga Udang dengan
umur sekitar ± 2 tahun diperoleh dari daerah Padangbulan Pasar II, Medan, Provinsi
Sumatera Utara. Penelitian dilakukan di laboratorium kimia Bahan Alam FMIPA
USU. Identifikasi struktur dengan spektrokopi UV-Visible, spektroskopi FT-IR, dan
spektroskopi H-NMR dilakukan di LIPI serpong-Tangerang.
1.6.Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap kulit batang
uji skrining fitokimia untuk senyawa flavonoida, yaitu dengan menggunakan pereaksi
FeCl3 5%, NaOH 10%, Mg-HCl dan H2SO4(p).
Tahap isolasi yang dilakukan :
1.Ekstraksi Maserasi
2.Ekstraksi Partisi
3.Analisis Kromatografi Lapis Tipis
4.Analisis Kromatografi Kolom
5.Rekristalisasi
Tahapan analisis hasil isolasi yang dilakukan adalah:
1. Analisis Kromatografi Lapis Tipis
2. Pengukuran titik lebur
3. Identifikasi dengan menggunakan Spektrometri UV-Visible,
Spektrofotometri Infra Merah (FT-IR) dan Spektrofotometri Resonansi
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Mangga
2.1.1. Morfologi Tumbuhan Mangga
Mangga adalah tanaman buah asli dari India. Kini, tanaman ini tersebar di berbagai
penjuru dunia termasuk Indonesia. Tanaman Mangga dapat tumbuh dengan baik di
dataran rendah dan berhawa panas. Akan tetapi, ada juga yang dapat tumbuh di daerah
yang memiliki ketinggian hingga 600 meter di atas permukaan laut. Batang pohon
Mangga tegak, bercabang agak kuat. Kulit tebal dan kasar dengan banyak celah-celah
kecil dan sisik-sisik bekas tangkai daun. Warna kulit batang yang sudah tua biasanya
coklat keabuan sampai hitam. Pohon Mangga yang berasal dari biji pada umumnya
tegak, kuat dan tinggi sedangkan yang berasal dari sambungan atau tempel lebih
pendek dan cabang membentang. Daun yang masih muda biasanya berwarna
kemerahan, keunguan, atau kekuningan yang kemudian hari akan berubah pada bagian
permukaan sebelah atas menjadi hijau mengkilat, sedangkan bagian permukaan bawah
berwara hijau muda. Bunga Mangga biasanya bertangkai pendek, jarang sekali yang
bertangkai panjang, dan berbau harum seperti bunga lili. Kelopak bunga biasanya
bertaju 5. Buah Mangga termasuk buah batu yang berdaging, dengan ukuran dan
bentuk yang sangat berubah-ubah bergantung pada macamnya, mulai dari bulat, bulat
telur, hingga lonjong memanjang. Panjang buah kira-kira 2.5 -3.0 cm. Kulit buah agak
tebal berbintik-bintik kelenjar, hijau kekuningan atau kemerahan bila masak. Daging
buah jika masak berwarna merah jingga, kuning, berserabut atau tidak, manis sampai
masam dengan banyak air dan berbau kuat sampai lemah. Biji berwarna putih, gepeng
memanjang tertutup endokrap yang tebal, mengayu dan berserat. Biji ini terdiri dari,
2.1.2. Sistematika Tumbuhan Mangga
Sistematika Tumbuhan Mangga adalah sebagai berikut :
Kingdom : Plantae
2.1.3. Manfaat Tumbuhan Mangga
Bagian tumbuhan Mangga yang paling penting dan berguna dalam kehidupan manusia
sehari-hari, terutama bagi kesehatan adalah getah, kulit batang, buah muda, dan buah
masak. Getah Mangga dari bagian batang atau ranting dapat dimanfaatkan sebagai
obat tradisional untuk penyakit luar, seperti eksim, kudis, dan gatal-gatal. Penyakit
rematik atau persendian nyeri dapat diobati dengan menggunakan kulit batang pohon
Mangga. Buah Mangga muda selain dapat digunakan sebagai manisan, juga berkhasiat
sebagai obat beberapa jenis penyakit. Di India Mangga yang masih hijau digunakan
sebagai obat gangguan darah, empedu, dan saluran pencernaan. Memakan buah
Mangga muda secara teratur mempunyai daya penyembuh gangguan darah, karena
menambah kelenturan pembuluh darah, membantu pembentukan sel-sel baru,
mencegah pendarahan, dan menyembuhkan sariawan. Selain itu buah Mangga muda
dapat berkhasiat untuk mengatasi diare, disentri, wasir dan sembelit (Rukmana, 1997).
2.1.4. Khasiat Tumbuhan Mangga
Para ahli meyakini mangga adalah sumber karotenoid yang disebut beta crytoxanthin,
yaitu bahan penumpas kanker yang baik. Mangga juga kaya vitamin, antioksidan
seperti vitamin C dan E. Satu buah mangga mengandung tujuh gram serat yang dapat
kolesterol agar tetap normal. Mangga memiliki sifat kimia dan efek farmakologis
tertentu, yaitu bersifat pengelat (astringent), peluruh urine, penyegar, penambah nafsu
makan dan antioksidan. Kandungan asam galat pada Mangga sangat baik untuk
saluran pencernaan. Sedangkan kandungan riboflavinnya sangat baik untuk kesehatan
mata, mulut, dan tenggorokan. Buah Mangga juga mengandung senyawa flavonoida.
Kandungan flavonoida dalam buah Mangga yang mempunyai gugus hidroksi bebas
dapat menghambat aktivitas sitokrom.
2.2. Senyawa Flavonoida
Flavonoida adalah suatu kelompok senyawa fenol terbesar yang ditemukan di alam
dan yang memiliki potensial sebagai antioksidan serta bioaktifitas sebagai obat.
Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk
daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini
berada di dalam tumbuh-tumbuhan, kecuali alga. Namun ada juga flavonoida yang
terdapat pada hewan, misalnya dalam kelenjar bau berang-berang dan sekresi lebah.
Dalam sayap kupu - kupu dengan anggapan bahwa flavonoida berasal dari
tumbuh-tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di
dalam tubuh mereka. Penyebaran jenis flavonoida pada golongan tumbuhan yang
tersebar yaitu angiospermae, klorofita, fungi, briofita (Markham, 1988).
Sekitar 2% dari seluruh karbon yang difotosintesis oleh tumbuhan (atau
kira-kira 1 x 109 ton/tahun) diubah menjadi flavonoida atau senyawa yang berkaitan
dengannya. Sebahagian besar tanin pun berasal dari flavonoida. Jadi flavonoida
merupakan salah satu golongan fenol alam yang terbesar.
Flavonoida merupakan senyawa 15 karbon yang umumnya tersebar di seluruh
dunia tumbuhan. Lebih dari 2000 flavonoida yang berasal dari tumbuhan telah
diidentifikasi. Kerangka dasar flavonoida biasanya diubah sedemikian rupa sehingga
terdapat lebih banyak ikatan rangkap, menyebabkan senyawa itu dapat menyerap
Sebagian besar flavonoida yang terdapat pada tumbuhan terikat pada molekul
gula sebagai glikosida dan dalam bentuk campuran, jarang sekali dijumpai berupa
senyawa tunggal. Disamping itu sering ditemukan campuran yang terdiri dari
flavonoida yang berbeda klas. Misalnya antosianin dalam mahkota bunga yang
berwarna merah, ungu dan biru. Piigmen ini juga terdapat di berbagai bagian
tumbuhan lain, misalnya buah tertentu batang, daun, dan bahkan akar. Sering
flavonoida terikat di sel epidermis. Flavonoida dalam tumbuhan mempunyai fungsi
sebagai pigmen warna, fungsi fisiologis dan patologi, aktivitas farmakologi dan
flavonoida dalam makanan.
Senyawa flavonoida dalam tubuh manusia berfungsi sebagai antioksidan
sehingga baik untuk pencegahan kanker. Manfat lain dari flavonoida ini adalah untuk
melindungi sel, meningkatkan efektivitas vitamin C, anti inflamasi, anti fertilasi,
antidiabetes, diuretik dan sebagai antibiotik (Ulya,2007).
2.2.1. Struktur dasar senyawa flavonoida
Senyawa flavonoida mempunyai kerangka dasar karbon yang terdiri dari 15 atom
karbon, dua cincin benzen (C6) terikat pada suatu rantai propana (C3) sehingga bentuk
susunan C6 –C3 – C6.
Struktur dasar flavonoida dapat digambarkan sebagai berikut:
C C C
A B
Gambar 1. Kerangka dasar senyawa flavonoida
Cincin A adalah karakteristik phloroglusinol atau bentuk resorsinol tersubstitusi.
Namun sering terhidroksilasi lebih lanjut :
Cincin B adalah karakteristik 4-, 3,4-, 3,4,5- terhidroksilasi
C3
Pola biosintesa flavonoida pertama kali disarankan oleh Birch. Menurut Birch, pada
tahap-tahap pertama dari biosintesa flavonoida suatu unit C6-C3 berkombinasi dengan
tiga unit C2 menghasilkan unit C6-C3-(C2 + C2 + C2).Kerangka C15 yang dihasilkan
dari kombinasi ini telah mengandung gugus-gugus fungsi oksigen pada posisi-posisi
yang diperlukan.
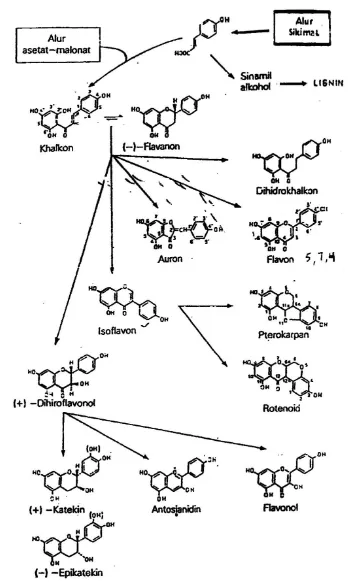
Adapun cincin A dari struktur flavonoida berasal dari jalur poliketida, yakni
kondensasi dari tiga unit asetat atau malonat, sedangkan cincin B dan tiga atom
karbon dari rantai propan berasal dari jalur fenilpropanoid (jalur shkimat). Dengan
demikian, kerangka dasar karbon dari flavonoida dihasilkan dari kombinasi antara dua
jalur biosintesa yang utama untuk cincin aromatik, yakni jalur shkimat dan jalur asetat
Senyawa-senyawa flavonoida yang terdapat dalam semua bagian tumbuhan
tinggi, seperti bunga, daun, ranting, buah, kayu, kulit kayu, dan akar. Akan tetapi,
senyawa flavonoida tertentu seringkali terkonsentrasi dalam suatu jaringan tertentu,
misalnya antosianidin adalah zat warna dari bunga, buah dan daun.
Sebagian besar dari flavonoida alam ditemukan dalam bentuk glikosida,
dimana unit flavonoida terikat pada suatu gula. Oleh karena itu, ada baiknya bila pada
kesempatan ini diingatkan kembali bahwa secara umum, suatu glikosida adalah
kombinasi antara suatu gula dan suatu alkohol yang saling berikatan melalui ikatan
glikosida. Pada prinsipnya ikatan glikosida terbentuk apabila gugus hidroksil dari
alkohol beradisi kepada gugus karbonil dari gula.
Pada hidrolisa oleh asam, suatu glikosida terurai kembali atas
komponen-komponennya menghasilkan gula dan alkohol yang sebanding, dan alkohol yang
dihasilkan ini disebut agliko. Lazimnya, residu gula dari glikosida flavonoida alam
ialah glukosa, ramnosa, galaktosa, dan gentibiosa sehingga glikosida tersebut
masing-masing disebut glukosida, ramnosida, galaktosida dan gentiobiosida.
Flavonoida dapat ditemukan sebagai mono, di atau triglikosida, dimana satu,
dua atau tiga gugus hidroksil dalam molekul flavonoida terikat oleh gula.
Poliglikosida larut dalam air dan hanya sedikit larut dalam pelarut-pelarut organik
seperti eter, benzen, klorofom, dan aseton.
Dari segi struktur, senyawa-senyawa flavonoida turunan flavon dapat dianggap
sebagai 2-arilkromon. Oleh sebab itu, sebagaimana kromon dan kumarin, flavonoid
dapat dideteksi berdasarkan warnanya dibawah sinar tampak atau sinar ultraviolet.oleh
karena itu, karakterisasi flavonoida akhir-akhir ini lazimnya dilakukan dengan
2.2.3. Klasifikasi Senyawa Flavonoida
Flavonoida merupakan senyawa metabolit sekunder yang terdapat pada tanaman hijau
kecuali alga. Flavonoida yang lazim ditemukan pada tumbuhan tingkat tinggi
(angiospermae) adalah flavon dan flavonol dengan C- dan O- glikosida, isoflavon C-
dan O-glikosida dan dihidrokhalkon, proantosinidin dan antosianin. Golongan flavon,
flavonol, khalkon, flavanon, dan isoflavon juga sering ditemukan dalam bentuk
aglikonnya.
Istilah flavonoida diberikan untuk senyawa-senyawa fenol yang berasal dari
kata flavon, yaitu nama dari salah satu flavonoid yang terbesar jumlahnya dalam
tumbuhan. Senyawa-senyawa flavon ini mempunyai kerangka 2-fenilkroman, dimana
posisi orto dari cincin A dan atom karbon yang terikat pada cincin B dari
1.3-diarilpropana dihubungkan oleh jembatan oksigen sehingga membentuk cincin
heterosiklik yang baru (cincin C).
Senyawa-senyawa flavonoida terdiri dari beberapa jenis, tergantung pada
tingkat oksidasi dari rantai propan dari sistem 1,3 diaril propan. Dalam hal ini, flavan
mempunyai tingkat oksidasi yang terendah sehingga senyawa ini dianggap sebagai
senyawa induk dalam tatanama senyawa-senyawa turunan flavon.
Dari berbagai jenis flavonoid tersebut, flavon, flavonol, dan antosianin adalah
jenis yang banyak ditemukan di alam, sehingga seringkali dinyatakan sebagai
flavonoida utama. Sedangkan jenis-jenis flavonoida yang tersebar di alam dalam
jumlah yang terbatas ialah khalkon, flavanon dan leukoantosianidin.
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga
menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum
sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan
Flavonoida O-Glikosida
Flavonoida biasanya terdapat sebagai flavonoida O-glikosida, pada senyawa tersebut
satu gugus hidroksil flavonoida (atau lebih) terikat pada satu gula engan ikatan
hemiasetal yang tidak tahan asam. Pengaruh glikosilasi menyebabkan flavonoida
menjadi kurang reaktif dan lebih mudah larut dalam air (cairan). Sifat terakhir ini
memungkinkan penyimpanan flavonoida di dalam vakuol sel. Walaupun gugus
hidroksil pada setiap posisi dalam inti flavonoida dapat diglikosilasi.
Glukosa merupakan gula yang sangat penting umum terlibat, walaupun
galaktosa, ramnosa, xilosa dan arabinosa sering juga terdapat. Gula lain yang
kadang-kadang ditemukan ialah alosa, manosa, fruktosa, apiosa dan asam glukuronat
serta galakturonat.
Flavonoida C-glikosida
Gula juga terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat
langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tidak tahan asam.
Glikosida yang demikian disebut C-glikosida. Sekarang gula yang terikat pada atom C
hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoida. Jenis gula yang
terlibat ternyata jauh lebih sedikit daripada jenis gula pada O-glikosida, biasanya dari
jenis glukosa yang paling umum (misalnya viteksin, orientin), dan juga galaktosa
(misalnya apigenin 8-C galaktosida), ramnosa (misalnya violantin), xilosa (misalnya
visenin -1) dan arabinosa. Jenis aglikon flavonoida yang terlibat juga sangat terbatas.
Walaupun isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk
C-glikosida, sebegitu jauh hanya flavon C- glikosida yang paling lazim ditemukan.
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan
keragaman pada rantai C3 yaitu :
1. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon
antioksidan dan antiimflamasi. Flavonol lain yang terdapat di alam bebas kebanyakan
merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana
basa dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada
pengerjaannya masih dapat dilakukan.
O
3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi
warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis
glikosida pada flavonol. Flavon stabil terhadap asam kuat dan eternya yang mudah
didealkilasi dengan penambahan HI atau HBr, atau dengan aluminium klorida dalam
pelarut inert. Flavon yang paling umum dijumpai adalah apigenin dan luteolin.
Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling
umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui
ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida.
Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa
3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai
fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai
pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya
tidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein)
memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi
kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia
berubah menjadi coklat.
O
O
Struktur Isoflavon
4. Flavanon
Flavanon (biasanya sebagai glikosida) terdistribusi luas di alam. Flavanon terdapat di
dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari
tanaman genus prenus dan buah jeruk ; dua glikosida yang paling lazim adalah
neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O
O
Struktur Flavanon
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika
dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena
konsentrasinya rendah dan tidak berwarna.
O
O
OH
Struktur Flavanonol
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu.
Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir
dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat
sebagai antioksidan.
O HO
OH OH
OH OH
Struktur Katekin
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tan warna, terutama terdapat pada tumbuhan
berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin,
O
OH
HO
OH
Struktur Leukoantosianidin
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam
tumbuhan. Pigmen yng berwarna kuat dan larut dalam air ini adalah penyebab hampir
semua warna merah jambu, merah marak , ungu, dan biru dalam daun, bunga, dan
buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu
struktur aromatik tunggal yaitu sianidin, dan semuanya terbentuk dari pigmen sianidin
ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau
glikosilasi. Antosianin ini umumnya tidak terdapat di lumut hati, ganggang, dan
tumbuhan tingkat rendah lainnya, walaupun beberapa antosianin dan flavonoida ada di
lumut tertentu. Antosianin jarang ditemui di gimnospermae, walaupun gimnospermae
mengandung jenis lain dari flavonoida.
O
OH
Struktur Antosianin9. Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila
dikromatografi kertas. Aglikon flavon dapat dibedakan dari glikosidanya, karena
hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas
O
Struktur Khalkon
10.Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita.
Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi
kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah
menjadi merah jingga bila diberi uap amonia. (Robinson, 1995)
HC
O
O
Struktur Auron
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana
semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan
semuanya mempunyai sejumlah sifat yang sama yakni:
Golongan flavonoida Penyebaran Ciri khas
Antosianin
bergerak dengan BAA pada kertas. Menghasilkan antosianidin (warna dapat diekstraksi dengan amil alkohol) bila jaringan dipanaskan dalam HCl 2M selama setengah jam.
Flavon
setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal; maksimal spektrum pada 330-350 nm. Mengandung gula yang terikat melalui ikatan C-C; bergerak dengan pengembang air, tidak seperti flavon biasa.
Pada kromatogram BAA beupa bercak redup dengan RF tinggi .
Dengan amonia berwarna merah maksimal spektrum 370-410 nm. Berwarna merah kuat dengan Mg / HCl; kadang – kadang sangat pahit .
Bergerak pada kertas dengan pengembang air; tak ada uji warna yang khas.
2.2.4. Metoda isolasi senyawa flavonoida
a. Metoda Isolasi Senyawa Flavonoida oleh Chowdhurry
Pada metoda ini, daun tumbuhan dikeringkan terlebih dahulu sebanyak 100 gram.
Lalu diekstraksi dengan Petroleum Eter (60-80 oC) dalam alat soklet selama 10 jam.
Selanjutnya diekstraksi dengan Benzena selama 10 jam. Ekstrak Benzena diuapkan
pelarutnya, menghasilkan semipadat berwarna coklat. Lalu dilarutkan dalam Eter dan
dipisahkan dalam suasana asam, basa dan netral. Fraksi pertama (ada empat macam)
masing-masing 50 ml dielusi dengan Benzena memberikan residu padat dengan titik
Kristalisasi dengan Metanol menghasilkan senyawa flavonoida (I), kristal
tidak berwarna dengan titik lebur 156 oC. Penelitian ini juga dilakukan oleh Dreyer,
L., D.,dengan melakukan pengukuran titik lebur, kromatografi lapis tipis dengan
Spektrum Infra Merah. Dari fraksi lima sampai delapan masing-masing dilarutkan
dengan Benzena lalu menghasilkan zat padat berwarna kuning terang dengan titik
lebur 191-193 oC. Kristalisasi dilakukan dengan Metanol menghasilkan Hibiscetin
Hepta Metil Eter, titik lebur 196-197 oC, kristal berwarna kuning sebanyak 50 gram
(Chowdhurry, 1971).
b. Metoda Isolasi Senyawa Flavonoida oleh Joshi
Daun tumbuhan yang telah dikeringkan diekstraksi dengan heksana, lalu ekstrak
n-heksana dikromatografi kolom dengan fasa diam alumina, menghasilkan kristal
dengan titik lebur 125-126 oC sebanyak 0,1%. Diidentifikasi, ekotin C23H26O10.
(Joshi, 1969).
c. Metoda Isolasi Senyawa Flavonoida oleh Dreyer, L.D
Dalam metoda ini, daun diekstraksi dengan Aseton, kemudian pelarut dievaporasi dan
diperoleh ekstrak pekat. Ektrak pekat yang diperoleh dikromatografi kolom dengan
menggunakan alumina sebagai fasa diam dan Benzena sebagai fasa gerak hingga
dihasilkan residu. Lalu direkristalisasi dengan campuran etil asetat : n-heksana dan
dilanjutkan dengan Metanol. Diperoleh kristal kuning terang, diidentifikasi sebagai
3,3`,4`,5,5`,6,7-hepta metoksi flavon dengan titik lebur 156-157oC (Dreyer, 1968).
d. Metoda Isolasi Senyawa Flavonoida oleh Harborne
Dalam metoda ini, daun yang segar dimaserasi dengan MeOH, lalu disaring. Ekstrak
MeOH dipekatkan dengan rotari evaporator. Lalu ekstrak pekat yang dihasilkan,
diasamkan dengan H2SO4 2M, didiamkan, lalu diesktraksi dengan Kloroform. Lapisan
Kloroform diambil, lalu diuapkan, sehingga dihasilkan ekstrak polar pertengahan
2.2.5. Sifat kelarutan flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia senyawa
fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat,
bila dibiarkan dalam larutan basa, dan disamping itu terdapat oksigen, banyak yang
akan terurai. Karena mempunyai sejumlah gugus hidroksil, atau suatu gula,flavonoida
merupakan senyawa polar, maka umumnya flavonoida cukup larut dalam pelarut polar
seperti Etanol (EtOH), Metanol (MeOH), Butanol (BuOH), Aseton, Dimetilsulfoksida
(DMSO), Dimetilformamida (DMF), Air dan lain-lain. Adanya gula yang terikat pada
flavonoida (bentuk yang umum ditemukan) cenderung menyebabkan flavonoida lebih
mudah larut dalam air dan dengan demikian campuran pelarut yang disebut diatas
dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon
yang kurang polar seperti isoflavon, flavanon dan flavon serta flavonol yang
termetoksilasi cenderung lebih mudah larut dalam pelarut seperti Eter dan Kloroform
(Markham, 1988).
2.3. Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang akan
ditentukan berada dalam keadaan murni, tidak tercampur dengan
komponen-komponen lainnya.
Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya
perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang
akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang
2.3.1. Kromatografi
Kromatografi melibatkan pemisahan terhadap campuran berdasarkan perbedaan
tertentu yang dimiliki oleh senyawanya. Perbedaan yang dapat dimanfaatkan meliputi
kelarutan dalam berbagai pelarut serta sifat polar. Kromatografi biasanya terdiri dari
fasa diam (fasa stationer) dan fasa gerak (fasa mobil).
Fasa stasioner mungkin suatu zat padat atau suatu cairan dan fasa yang
bergerak mungkin suatu cairan atau suatu gas (Underwood, 1981).
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat – sifat dari fasa diam,
yang dapat berupa zat padat atau zat cair. Jika fasa diam berupa zat padat disebut
kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Karena fasa
gerak dapat berupa zat cair atau gas maka ada empat macam sistem kromatografi
yaitu:
1. Fasa gerak cair–fasa diam padat (kromatografi serapan):
a.kromatografi lapis tipis
b.kromatografi penukar ion
2. Fasa gerak gas–fasa diam padat, yakni kromatografi gas padat
3. Fasa gerak cair–fasa diam cair (kromatografi partisi), yakni kromatografi
kertas.
4. Fasa gerak gas–fasa diam zat cair, yakni :
a. kromatografi gas–cair
b. kromatografi kolom kapiler
2.3.1.1. Kromatografi lapis tipis
Kromatografi Lapis Tipis digunakan untuk memantau kemajuan reaksi dan untuk
mengenali komponen tertentu.
Kromatografi Lapis Tipis pada plat berlapis yang berukuran lebih besar,
biasanya 5x20 cm, 10x20 cm, atau 20x20 cm. Biasanya memerlukan waktu
yaitu fase diam atau sifat lapisan, dan fase gerak atau campuran pelarut pengembang.
Fase diam dapat berupa serbuk halus yang berfungsi sebagai permukaan penyerap
atau penyangga untuk lapisan zat cair. Fase gerak dapat berupa hampir segala macam
pelarut atau campuran pelarut. Umumnya, fase diam bersifat polar, dan senyawa polar
akan melekat lebih kuat pada lempeng daripada senyawa tak polar akibat interaksi
tarik-menarik dipol. Senyawa polar cenderung berdekatan dengan tempat semula
dibandingkan senyawa tak polar. Senyawa tak polar kurang melekat erat pada fase
diam polar sehingga bergerak maju lebih jauh ke atas lempeng. Jadi, jarak tempuh ke
atas lempengan merupakan cerminan polaritas senyawa. Peningkatan polaritas pelarut
akan menurunkan interaksi senyawa dengan fase diam sehingga memungkinkan
senyawa dalam fase gerak bergerak lebih jauh pada lempeng.
Pemisahan senyawa dengan Kromatografi Lapis Tipis seperti senyawa organik
alam dan senyawa organik sintetik dapat dilakukan dalam beberapa menit dengan alat
yang harganya tidak terlalu mahal. Jumlah cuplikan beberapa mikrogram atau
sebanyak 5 g dapat ditangani. Kelebihan KLT yang lain ialah pemakaian jumlah
pelarut dan jumlah cuplikan yang sedikit. Kromatografi Lapis Tipis (KLT) merupakan
salah satu metode pemisahan yang cukup sederhana yaitu dengan menggunakan plat
kaca yang dilapisi silika gel dengan menggunakan pelarut tertentu (Gritter,1991).
Nilai utama Kromatografi Lapis Tipis pada penelitian senyawa flavonoida
ialah sebagai cara analisis cepat yang memerlukan bahan sangat sedikit. Menurut
Markham, Kromatografi Lapis Tipis terutama berguna untuk tujuan berikut:
1. Mencari pelarut untuk kromatografi kolom
2. Analisis fraksi yang diperoleh dari kromatografi kolom
3. Identifikasi flavonoida secara ko-kromatografi.
4. Isolasi flavonoida murni skala kecil
5. Penyerap dan pengembang yang digunakan umumnya sama dengan penyerap
dan pengembang pada kromatografi kolom dan kromatografi kertas
2.3.1.2. Kromatografi kolom
Kromatografi cair yang dilakukan dalam kolom besar merupakan metode
kromatografi terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 g). Pada
kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada
bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam, dan
tabung plastik. Pelarut atau fasa gerak dibiarkan mengalir melalui kolom karena
aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa
linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan
berupa fraksi ketika keluar dari atas kolom (Gritter, 1991).
Dengan menggunakan cara ini, skala isolasi flavonoida dapat ditingkatkan
hampir ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran
flavonoida (berupa larutan) diatas kolom yang berisi serbuk penyerap (seperti
selulose, silika atau poliamida), dilanjutkan dengan elusi beruntun setiap komponen
memakai pelarut yang cocok. Kolom hanya berupa tabung kaca yang dilengkapi
dengan keran pada salah satu ujung (Markham, 1988).
2.3.1.3. Harga Rf (Reterdation Factor)
Mengidentifikasi noda-noda dalam lapisan tipis lazim menggunakan harga Rf yang
diidentifikasikan sebagai perbandingan antara jarak perambatan suatu zat dengan
jarak perambatan pelarut yang dihitung dari titik penotolan pelarut zat. Jarak yang
ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Untuk
mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan
dengan harga Rf senyawa pembanding.
Jarak perambatan bercak dari titik penotolan
Rf =
Jarak perambatan pelarut dari titik penotolan
2.3.2. Kristalisasi
Pengkristalan kembali (rekristalisasi) melibatkan pemurnian suatu zat padat dengan
jalan melarutkan zat padat tersebut, mengurangi volume larutannya dengan
pemanasan, dan kemudian mendinginkan larutan. Dengan memanaskan larutan,
pelarut akan menguap hingga larutan mencapai titik lewat jenuh. Saat larutan
mendingin, kelarutan akan berkurang secara cepat dan senyawa mulai mengendap.
Agar rekristalisasi berjalan dengan baik, kotoran setidak-tidaknya harus dapat
larut dalam pelarut untuk rekristalisasi atau mempunyai kelarutan lebih besar daripada
senyawa yang diinginkan. Jika hal ini tidak dipenuhi, kotoran akan ikut mengkristal
bersama senyawa yang diinginkan (Stephen,2003).
2.3.3. Ekstraksi
Ekstraksi adalah suatu proses pemisahan dari bahan padat maupun cair dengan
bantuan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi yang
diinginkan tanpa melarutkan material lainnya. Ekstraksi merupakan proses pemisahan
suatu bahan dari campurannya, ekstraksi dapat dilakukan dengan berbagai cara.
Ekstraksi menggunakan pelarut didasarkan pada kelarutan komponen terhadap
komponen lain dalam campuran.
Faktor-faktor yang mempengaruhi laju ekstraksi adalah:
1. Tipe persiapan sampel
2. Waktu Ekstraksi
3. Kuantitas pelarut
4. uhu pelarut
5. Tipe pelarut
Ekstraksi dapat dilakukan dengan metoda maserasi, sokletasi, dan perkolasi.
Maserasi merupakan cara penyaringan sederhana yang dilakukan dengan cara
merendam serbuk dalam pelarut selama beberapa hari dengan temperatur kamar yang
terlindungi dari cahaya. Metode maserasi digunakan untuk menyaring serbuk halus
Keuntungan dari metode ini adalah peralatannya yang sederhana. Sedangkan
kerugiannya antara lain waktu yang diperlukan untuk mengekstraksi sampel cukup
lama, pelarut yang digunakan lebih banyak.
Ekstraksi dengan metoda sokletasi dapat dilakukan secara bertingkat dengan
berbagai pelarut berdasarkan kepolarannya, misalnya n-heksana, Eter, Benzena,
Kloroform, Etil asetat, Etanol, Metanol, dan Air.
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif
terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak yang pekat
biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotarievaporator
(Harborne, 1996).
2.4. Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia–fisika yang mengamati
tentang interaksi atom atau molekul dengan radiasi elektromagnetik.
Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan
spektrofotometer dan data yang keluar dari instrumen ini disebut spektrum atau
spektra. Spektra dapat diartikan berupa rentangan (range) panjang gelombang atau
frekuensi. Instrumen yang memakai monokromator celah tetap pada bidang fokus
disebut sebagai spektrometer. Apabila spektrometer tersebut dilengkapi dengan
detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja, 1955).
Informasi Spektroskopi Inframerah menunjukkan tipe – tipe dari adanya gugus
fungsi dalam satu molekul dan Resonansi Magnetik Inti yang memberikan informasi
tentang bilangan dari setiap tipe dari atom hidrogen dan juga memberikan informasi
Walaupun spektrum Inframerah merupakan kekhasan sebuah molekul secara
menyeluruh gugus atom tertentu memberikan penambahan pita-pita pada kerapatan
tertentu, ataupun bangun molekul selebihnya. Keberlakuan seperti itulah yang
memungkinkan kimiawan memperoleh informasi tentang struktur yang berguna serta
mendapatkan acuan bagi peta umum frekuensi gugus khas (Silverstein,1986).
2.4.1. Spektrometri ultra violet
Serapan molekul di dalam derah ultra violet dan terlihat dari spektrum bergantung
pada struktur ultra elektronik dari molekul. Spektra ultraviolet dan terlihat dari
senyawa-senyawa organik yang berkaitan erat dengan transisi-transisi diantara
tingkatan-tingkatan tenaga elektronok. Disebabkan karena hal ini, maka serapan
radiasi ultraviolet/terlihat sering dikenal sebagai spektroskopi elektronik.
Transisi-transisi tersebut biasanya antara orbital ikatan dan orbital ikatan atau orbital pasangan
bebas dengan orbital non ikatan tak jenuh atau orbital anti ikatan. Panjang gelombang
serapan adalah merupakan ukuran dari pemisahan tingkatan-tingkatan tenaga dari
orbital-orbital yang bersangkutan (Sastrohamidjojo,1991)
Spektrum Flavonoida biasanya ditentukan dalam larutan dengan pelarut
Metanol (MeOH) atau Etanol (EtOH). Spektrum khas terdiri atas dua maksima pada
rentang 240-285 nm (pita II) dan 300-550 nm (pita I). Kedudukan yang tepat dan
kekuatan nisbi maksima tersebut memberikan informasi yang berharga mengenai sifat
flavonoida dan pola oksigenasinya. Ciri khas spektrum tersebut ialah kekuatan nisbi
yang rendah pada pita I dalam dihidroflavon, dihidroflavonol, dan isoflavon serta
kedudukan pita I pada spektrum khalkon, auron dan antosianin yang terdapat pada
panjang gelombang yang tinggi.
Ciri spektrum golongan flavonoida utama dapat ditunjukkan sebagai berikut:
2.4.2. Spektrofotometri infra merah (FT-IR)
Spektrofotometri inframerah sangat penting dalam kimia modren, terutama dalam
daerah organik. Spektrofotometri jenis ini biasanya digunakan untuk menetapkan
gugus fungsional yang terdapat pada sampel. Namun demikian, spektroskopi
inframerah ini tidak dapat memberikan informasi mengenai struktur sebanyak yang
diberikan spektroskopi resonansi magnetik inti proton (1H-NMR).
Spektroskopi inframerah merupakan salah satu alat yang banyak dipakai untuk
mengidentifikasi senyawa, baik alami maupun buatan. Dalam bidang fisika bahan,
seperti bahan –bahan polimer, inframerah juga dipakai untuk mengkarakterisasi
sampel. Suatu kendala yang menyulitkan dalam mengidentifikasi senyawa dengan
inframerah adalah tidak adanya aturan yang baku untuk melakukan interpretasi
spektrum. Karena kompleksnya interaksi dalam vibrasi molekul dalam suatu senyawa
dan efek-efek eksternal yang sulit dikontrol seringkali diprediksi teoretik tidak lagi
sesuai. Pengetahuan dalam hal ini sebahagian besar diperoleh secara empiris dan
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi
getaran yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm -1
(panjang gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan
diubah menjadi putaran energi molekul.
Penyerapan energi elektromagnetik dari berbagai panjang gelombang
menghasilkan berbagai eksitasi dalam molekul. Radiasi Inframerah misalnya
bersesuaian dengan energi yang berkaitan dengan getaran molekul. Sebuah cuplikan
yang ditempatkan di dalam spektrofotometer Inframerah dan dikenal radiasi IR yang
berubah panjang gelombang secara berkesinambungan menyerap cahaya jika radiasi
yang masuk bersesuaian dengan energi getaran molekul tertentu. Spektrofotometer
Inframerah memayar daerah rentangan dan lenturan daerah molekul. Penyerapan
radiasi dicatat dan menghasilkan sebuah spektrum Inframerah. Satuan yang ada
kaitannya dengan frekuensi dikenal dengan bilangan gelombang yang dinyatakan
(cm-1) (Stanley, 1988).
Dalam molekul sederhana beratom dua atau beratom tiga tidak sukar untuk
menentukan jumlah dan jenis vibrasinya dan menghubungkan vibrasi-vibrasi tersebut
dengan energi serapan. Tetapi untuk molekul-molekul beratom banyak, analisis
jumlah dan jenis vibrasi itu menjadi sukar sekali atau tidak mungkin sama sekali,
karena bukan saja disebabkan besarnya jumlah pusat – pusat vibrasi, melainkan
karena juga harus diperhitungkan terjadinya saling mempengaruhi (interaksi) beberapa
pusat vibrasi.
Vibrasi molekul dapat dibagi dalam dua golongan , yaitu vibrasi regang dan vibrasi
lentur.
Vibrasi regang
Di sini terjadi terus menerus perubahan jarak antara dua atom di didalam suatu
molekul. Vibrasi regang ini ada dua macam yaitu vibrasi regang simetris dan tak
simetri.
2.Vibrasi lentur
Di sini terjadi perubahan sudut antara dua ikatan kimia. Ada empat macam vibrasi
vibrasi rocking dan vibrasi keluar bidang yang dapat berupa waging atau berupa
twisting (Noerdin, 1985)
2.4.3. Spektrofotometri resonansi magnetik inti proton (1H-NMR)
Spektrofotometri Resonansi Magnetik Inti Proton merupakan alat yang berguna pada
penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai
berbagai jenis atom hidrogen dalam molekul. Struktur NMR memberikan informasi
mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap
lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen
(Cresswell, 1982).
Spektroskopi resonansi magnetik nuklir yang paling umum dikenal sebagai
spektroskopi 1H-NMR, adalah nama yang diberikan kepada teknik yang
mengeksploitasi sifat magnetik inti tertentu. Frekuensi resonansi, penyerapan energi
dan intensitas sinyal sebanding dengan kekuatan medan magnet.
Spektrometri Resonansi Magnetik Inti pada umumnya digunakan untuk :
1. Menentukan jumlah proton yang dimiliki lingkungan kimia yang sama
pada suatu senyawa organik.
2. Mengetahui informasi mengenai struktur suatu senyawa organik.
Pergeseran kimia adalah pengukuran medan dalam keadaan bebas. Semua
proton-proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa
kadang-kadang menunjukkan pergeseran kimia yang sama. Setiap senyawa
memberikan penaikan menjadi puncak absorbsi tungal dalam spektrum NMR. Di
dalam medan magnet, perputaran elektron-elektron valensi dari proton menghasilkan
medan magnet yang melawan medan magnet yang digunakan. Hingga setiap proton
dalam molekul dilindungi dari medan magnet yang digunakan dan bahwa besarnya
perlindungan ini tergantung pada kerapatan elektron yang mengelilinginya. Makin
besar kerapatan elektron yang mengelilingi inti, maka makin besar pula medan yang
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah
tetrametilsilan (TMS). Senyawa ini mempunyai beberapa kelebihan; lamban seacara
kimia, isotop magnet, serta larut dalam kebanyakan pelarut organik; TMS
memberikan puncak serapan tajam tunggal serta menyerap pada medan lebih tinggi
BAB 3
9. Neraca Analitis Mettler PM 480
10. Alat pengering Memmers
11. Rotari evaporator Buchi B-480
12. Labu alas 500 ml Pyrex
13. Alat pengukur titik lebur
14. Statif dan klem
20. Bejana Kromatografi Lapis Tipis
21. Spektrofotometer FT-IR
22. Spektrofotometer UV-Visible
23. Spektrofotometer 1H-NMR
24. Kertas Saring
3.2. Bahan-Bahan
1. Kulit batang tumbuhan Mangga (Mangifra indica L)
2. Metanol
3. n-heksana
4. Klorofom p.a E.Merck
5. Aquades
6. Silika gel 60 Gtype G E.Merck Art. 554
7. Pereaksi Feri Klorida 5%
8. Pereaksi Natrium Hidroksida 10%
9. Pereaksi H2SO4(p)
10. Pereaksi Mg-HCl
11. Etil Asetat
3.3. Prosedur Penelitian
3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah kulit batang tumbuhan Mangga yang diperoleh dari daerah
Padangbulan, Pasar II, Sumatera Utara. Kulit batang tumbuhan Mangga dikeringkan,
lalu dihaluskan sampai diperoleh serbuk kulit batang Mangga sebanyak 640 g.
3.3.2 Uji Pendahuluan Terhadap Ekstrak Tumbuhan Mangga
Serbuk kulit batang tumbuhan Mangga diidentifikasi dengan menggunakan cara:
1.Uji busa
2.Skrining fitokimia
3.3.2.1. Uji Busa
Ekstrak metanol kulit batang tumbuhan Mangga sebanyak 10ml dimasukkan ke dalam
Lalu dikocok–kocok dengan kuat hingga terbentuk busa dan didiamkan selama 10
menit. Ternyata busa hilang yang membuktikan bahwa di dalam kulit batang
tumbuhan Mangga tidak terdapat senyawa glikosida .
3.3.2.2. Skrining Fitokimia
Untuk mengetahui adanya senyawa flavonoida pada kulit batang Mangga, maka
dilakukan uji pendahuluan secara kualitatif sebagai berikut :
Prosedur :
Dimasukkan ± 10 gram serbuk halus kulit batang tumbuhan Mangga (Mangifera
indica L) yang telah dikeringkan ke dalam erlenmeyer. Ditambahkan metanol ± 10 ml. Didiamkan. Disaring. Dibagi ekstrak metanol ke dalam 4 tabung reaksi.
Ditambahkan masing-masing pereaksi
a. Tabung I : dengan Fecl3 5% menghasilkan larutan berwarna hitam
b. Tabung II : dengan H2SO4(p) menghasilkan larutan orange kekuningan
c. Tabung III : dengan Mg-HCl menghasilkan larutan berwarna merah muda
d. Tabung IV : dengan NaOH10% menghasilkan larutan berwarna biru violet
3.3.3. Prosedur Untuk Memperoleh Senyawa Flavonoida dari Ekstrak Pekat Kulit Batang Mangga
Serbuk kulit batang Mangga ditimbang sebanyak 640g, dimasukkan ke dalam bejana
dan ditambahkan dengan pelarut metanol sampai semua sampel terendam oleh pelarut
dan dibiarkan selama 48 jam dan sesekali diaduk. Maserat disaring dan diperoleh
ekstrak berwarna hijau. Maserasi dilakukan berulang kali dengan menggunakan
pelarut metanol sampai ekstrak metanol yang diperoleh memberikan hasil uji yang
diperoleh dikumpulkan dan dipekatkan dengan menggunakan alat rotarievaporator
sehingga diperoleh ekstrak pekat metanol, kemudian diekstraksi partisi dengan
menggunakan pelarut n-heksana, sehingga terbentuk lapisan n-heksana dan lapisan
metanol. Kemudian ditambahkan pelarut etil asetat, dan disaring. Selanjutnya fraksi
etil asetat dipekatkan dengan alat rotarievaporator sehingga diperoleh ekstrak pekat
etil asetat sebanyak 6,50 gram.
3.3.4. Analisis Kromatografi Lapis Tipis (KLT)
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak etil asetat dengan
menggunakan fasa diam silika gel 60F254. Fasa gerak yang digunakan adalah
campuran kloroform : metanol dengan perbandingan (90 : 10)v/v ; (80 : 20)v/v;
(70:30)v/v; (60:40)v/v;(50:50)v/v.
Prosedur:
Dimasukkan 10 ml larutan fase gerak kloroform : metanol (90:10)v/v ke dalam bejana
kromatografi kemudian dijenuhkan .Ditotolkan ekstrak pekat etil asetat pada plat
KLT. Dimasukkan plat ke dalam bejana yang telah berisi pelarut yang telah
dijenuhkan, lalu ditutup dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana,
lalu dikeringkan. Diamati warna bercak yang timbul dan dihitung harga Rf yang
diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut etil asetat :
metanol (90:10)v/v ; (80:20)v/v ;(70 :30)v/v ;(60:40)v/v ;(50:50)v/v. Hasil pemisahan
yang baik diberikan pada fase gerak kloroform : metanol (90:10)v/v.
3.3.5. Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kromatografi kolom dilakukan terhadap ekstrak
pekat etil asetat kulit batang mangga yang telah diperoleh. Fasa diam yang digunakan
adalah silika gel 60 G dan fasa gerak adalah campuran pelarut Kloroform : Metanol
Prosedur:
Dirangkai seperangkat alat kolom kromatografi. Terlebih dahulu dibuburkan silika gel
60 G dengan menggunakan n-heksan, diaduk-aduk hingga homogen lalu dimasukkan
ke dalam kolom kromatografi. Kemudian dielusi dengan menggunakan n-heksan
100% hingga silika gel padat dan homogen. Dimasukkan 6.50 g ekstrak etil asetat
kulit batang mangga ke dalam kolom kromatografi yang telah berisi bubur silika gel di
puncak kolom, lalu ditambahkan fasa gerak kloroform : metanol (90 : 10) ; (80 : 20) ;
(70 : 30) ; (60 : 40)v/v secara perlahan – lahan, dan diatur sehingga aliran fasa yang
keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas . Hasil
yang diperoleh ditampung dalam botol vial setiap 10 ml , lalu di KLT dan digabung
fraksi dengan harga Rf yang sama. Setelah itu diuji flavonoida dan diuapkan sampai
pelarutnya habis sehingga terbentuk kristal.
3.3.6. Pemurnian
Kristal yang diperoleh dari fraksi yang terbanyak yaitu pada fraksi 29-33 dilakukan
pemurnian kristal untuk memastikan kemurniannya.
Prosedur:
Senyawa pada fraksi 29-33 dilarutkan dengan etil asetat, kristal hasil isolasi larut
sedangkan pengotor tidak larut, kemudian filtrat dipisahkan dan diuapkan kembali.
3.3.7. Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian kristal dilakukan dengan kromatografi lapis tipis dengan menggunakan
fasa diam silika gel 60 F254 dengan fasa gerak kloroform : metanol (90:10) v/v.
Prosedur:
Ditotolkan kristal yang sebelumnya dilarutkan pada plat KLT .Dimasukkan plat KLT
tersebut ke dalam bejana kromatografi yang telah jenuh . Setelah pelarut fasa gerak
merembes sampai batas tanda plat KLT dikeluarkan dari bejana, dikeringkan dan noda
yang terlihat di bawah lampu UV berwarna kuning kemudian difiksasi dengan
menggunakan pereaksi FeCl3 5% menghasilkan noda berwarna hitam yang
menunjukkan bahwa senyawa tersebut positif flavonoida.
3.3.8. Penentuan Titik Lebur
Senyawa hasil isolasi yang telah murni, dimasukkan ke dalam alat pengukur titik
lebur, diamati perubahan temperatur sampai diperoleh kristal melebur.
3.3.9. Analisis Spektroskopi Kristal Hasil Isolasi
Analisis Spektrofotometer UV-Visible, Spektrofotometer Inframerah,
Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) dilakukan di LIPI
3.4. Bagan Penelitian
Diskrining fitokimia
Dimaserasi dengan methanol selama ±48 jam Disaring
Ditampung setiap fraksi sebanyak 10 ml dalam botol vial
Di KLT tiap fraksi dengan menggunakan eluen klorofom : metanol (90 :10)v/v
Ekstrak etil asetat Ekstrak metanol ( tak diteliti lebih lanjut ) Lapisan metanol Lapisan n-heksana
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Dari hasil skrining pendahuluan terhadap ekstrak metanol dari kulit batang Mangga
dengan adanya penambahan pereaksi-pereaksi warna untuk menentukan golongan
senyawa kimia yang dikandung dengan menggunakan pereaksi flavonoid yakni;
H2SO4(p), NaOH 10 % , FeCl3 5 % dan Mg – HCl menunjukkan bahwa di dalam kulit
batang Mangga mengandung adanya senyawa flavonoida.
Dari hasil kromatografi lapis tipis dengan menggunakan adsorben silika gel
60F254, dapat diketahui bahwa pelarut yang baik untuk mengisolasi senyawa
flavonoida dari kulit batang tumbuhan Mangga adalah kloroform : metanol pada
perbandingan (90:10)v/v.
Dari hasil isolasi kulit batang Mangga diperoleh senyawa berwarna kuning
berbentuk kristal sebanyak 41 mg dengan titik lebur 150-152oC.
Dari hasil analisis Spektrofotometer ultra violet –visible ( UV – Visible )
dengan pelarut metanol memberikan panjang gelombang maksimum ( λ maks ) 280,4
nm dan 212 nm(Lampiran D).
.
Hasil analisis Spektrofotometer FT-IR dari senyawa hasil isolasi menunjukkan
pita serapan sebagai berikut :
1. Pada bilangan gelombang 3493,09 cm-1, menunjukkan adanya vibrasi dari
2. Pada bilangan gelombang 1639,49 cm-1, menunjukkan adanya vibrasi C = O
3. Pada bilangan gelombang 1512,19 cm-1-1608,63 cm -1 menunjukkan adanya
vibrasi C=C
4. Pada bilangan gelombang 1460,11 cm-1, menunjukkan vibrasi CH2
5. Pada bilangan gelombang 1371,39 cm-1 menunjukkan vibrasi CH3
6. Pada bilangan gelombang 1031,92 cm-1 - 1263,37 cm-1 menunjukkan C-O
dari gugus eter.
7. Pada bilangan gelombang 817,72 cm-1 menunjukkan vibrasi C-H dari senyawa
aromatik.
Hasil analisis Spektrofotometer Resonansi Magnetik Proton (1HNMR) memberikan
pergeseran kimia pada daerah sebagai berikut :
1. Pergeseran kimia pada daerah δ = 0,9377 ppm merupakan puncak singlet
menunjukkan pergeseran kimia proton dari CH3-C-
2. Pergeseran kimia pada daerah δ = 3,3025 ppm merupakan puncak singlet,
3,7777 ppm merupakan puncak singlet menunjukkan pergeseran kimia proton
dari CH3- O –
3. Pergeseran kimia pada daerah δ = 6,8652, merupakan puncak doublet, 7,0988
ppm merupakan puncak singlet menunjukkan pergeseran kimia proton gugus
aromatis.
4. Pergeseran kimia pada daerah δ = 8,1340 ppm merupakan puncak singlet
menunjukkan pergeseran kimia proton gugus OH yang terikat pada cincin
aromatis.
4.2 Pembahasan
Kulit batang tumbuhan Mangga dinyatakan mengandung senyawa flavonoida
berdasarkan hasil skrinning fitokimia yang dilakukan dengan pereaksi FeCl3 5%,
NaOH 10%, H2SO4(p), Mg-HCl.
Dari data spektrum UV-Vis dengan menggunakan pelarut metanol menghasilkan
panjang gelombang pendek sekitar 283 nm yang menunjukkan bahwa adanya gugus
hidroksil (OH) dari struktur flavon pada posisi C-6 (Albach,2003).
Spektrum UV kristal senyawa yang diperoleh juga bersesuaian dengan spektrum UV
pembanding (Lampiran F) dari senyawa Quarcetin anhydrate
(3,3’,4’,5,7)-pentahydroxyflavone (Charles,1977). Dan hal ini dapat disesuaikan dengan spektrum
1
H-NMR senyawa flavonoida (Lampiran H.1. ).
Dari hasil interpretasi spektrum Resonansi Magnetik Inti Proton (1HNMR),
senyawa hasil isolasi dengan menggunakan pelarut Aseton diperoleh :
1. Pergeseran kimia pada daerah δ = 0,9377 ppm merupakan puncak singlet
menunjukkan pergeseran kimia proton dari CH3 - C.
2. Pergeseran kimia pada daerah δ = 3,32025 ppm merupakan puncak singlet dan
pada daerah δ = 3,7777 ppm merupakan puncak singlet, menunjukkan proton- proton dari CH3-O– yang diduga merupakan substituen berada pada C-3 dan
H-4’ cincin C senyawa flavonoida (Lampiran H.2.) (Mabry,1970)
3. Pergeseran kimia pada daerah δ = 7,0988 ppm merupakan puncak singlet
menunjukkan proton H-8 pada cincin A flavonoida (Lampiran H.2.)
(Mabry,1970)
4. Pergeseran kimia pada daerah δ = 8,1340 ppm merupakan puncak singlet
menunjukkan adanya proton OH yang terikat pada cincin aromatis pada C-6
pada cincin A senyawa flavonoida (Lampiran H.1.) (Mabry,1970).
Berdasarkan analisis data dan interpretasi yang dilakukan pada spektrum UV,
spektrum Infra Merah (FT-IR) dan spektrum Resonansi Magnetik Inti Proton
(1H-NMR) dapat diduga bahwa kristal bewarna kuning yang telah diisolasi dari kulit
batang tumbuhan Mangga (Mangifera indica L) adalah senyawa flavonoida jenis
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Hasil isolasi yang diperoleh dari 640 g kulit batang Mangga merupakan
senyawa berwarna kuning berbentuk kristal sebanyak 41mg.
2. Berdasarkan hasil uji skrining fitokimia dan analisis Kromatografi Lapis Tipis
dengan penampakan noda menggunakan pereaksi Feri Klorida yang
menghasilkan larutan hitam, Natrium Hidroksida yang menghasilkan larutan
biru violet, pereaksi H2SO4(p) yang menghasilkan larutan orange kekuningan
dan pereaksi Mg-HCl yang menghasilkan larutan merah muda dapat
disimpulkan kristal kuning hasil isolasi merupakan senyawa flavonoida.
3. Dari hasil interpretasi spektrum Inframerah (FT-IR), spektrofotometer
UV-Visible dan juga berdasarkan literatur bahwa kristal hasil isolasi
merupakan senyawa flavonoida jenis flavon.
5.2. Saran
1. Perlu dilakukan analisis Spektroskopi Massa dan 13C-NMR, agar diperoleh
data-data yang lebih mendukung untuk menentukan struktur senyawa
DAFTAR PUSTAKA
Albach, Dirk. C.2003.’ Acylated Flavone glycosides from Veronica’Phytochemistry 64,1295-1301.
Andreas, 2003.’Identification of Flavonol and Xanthone Glycosides from Mango (Mangifera indica L) Peels by High-Performance Liquid Chromatography Electrospray Ionization Mass Spectrometry’. Institute of Food Technology, Section Plant Foodstuff Technology, Hohenheim University.Germany.
Aminary, 2009, ‘Pengaruh Perasan Buah Mangga Terhadap Farmakokinetika Parasetamol yang diberikan Bersama secara oral pada Kelinci Jantan’, Skripsi Sarjana. Universitas Muhammadyah Surakarta: Surakarta.
Biemann,K.1983. Tables of Spectral Data for Structure Determination of Organic Compounds ,2nd edition .Spinger –Verlag Berlin Heidelberg. Germany.
Charles,J.P. 1977. The Aldrich Library of Infrared Spectra. Edirtion III. New York.
Creswell, C. J. 1982. Analisa Spektrum Senyawa Organik. Edisi ke-2. Terjemahan Kosasih Padmawinata dan Iwang Soediro. Bandung: ITB.
Chowdurry, B.K.1971. Hibiscetin Heptamethyl Ether,a Natural Flavone. Journal Indian Chem .48(1) : halaman.80-82
Dreyer,L.D.1986. Chemataxonomy of The Rutaceae ,Constituent of Murrayapaniculata(Linn.)Jack.The Journal of Organic Chemistry .33(3658): halaman. 3575
Gritter, R. J. 1991. Pengantar kromatografi. Terbitan ke-2. Terjemahan Kosasih Padmawinata. ITB: Bandung.
Harborne, J. B. 1996. Metoda Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terbitan ke-2. Terjemahan Kosasih Padmawinata dan Iwang Soediro. ITB. Bandung
Joshi,B.S.1969 .Structure of Exoticin ,a Flavone from the Leaves of Murraya exotica (Linn.). Journal Indian Chem .7, halaman. 636
Mabry, T. J. Dkk. 1970. The Systematic Identification of Flavonoids. New York: Springer Verlag.
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasih Padmawinata. ITB. Bandung
Muldja, M.H.1995 .Analisis Instrumental.Cetakan ke-1. Airlangga Universitas Press. Surabaya
Nakanishi,K.1974. Natural Products Chemistry.2. Kodansha Ltd. New York
Rukmana, H. 1997. Budidaya Mangga. Kanisius. Yogyakarta.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-4. Terjemahan Kosasih Padmawinata. ITB Press. Bandung
Stanley, H. 1988. Kimia Organik 1. ITB Press. Bandung.
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Gadjah Mada University Press. Yogyakarta
Silverstein, R. M. 1986. Penyidikan Spektrometrik Senyawa Organik. Edisi ke-4. Terjemahan A. J. Hartomo dan Anny Victor Purba. Erlangga. Jakarta
Simanjuntak.2007. Ringkasan Kuliah Kimia Organik Bahan Alam. UNIMED:MEDAN.
Stephen, M.D. 2003.Intisari Kimia Organik. Penerbit Hipokrates. Jakarta.
Sudjadi.1986. Metode Pemisahan, Kanisius. Yogyakarta.
Sukartini. 2008. ‘Potensi Kandungan Antosianin Pada Daun Muda Tanaman Mangga sebagai Kriteria Seleksi Dini Zuriat Mangg’. Balai Penelitian Tanaman Buah Tropika:Solok.
Torsell,K.B.G.1983.Natural product Chemistry ,A Mechanistic aand Biosynthetic Approach to Secondary Metabolism. John Wiley And Sons. New York Limited.halaman 138.
Lampiran 3. Hasil Kromatografi Lapis Tipis Senyawa Hasil Isolasi
No. Penampakan Bercak Pereaksi Warna Noda Rf
1. I FeCl3 Hitam 0,73