EKSTRAKSI KAROTENOID DARI KEPALA UDANG
SECARA ENZIMATIS DAN KARAKTERISASI
PROFIL KAROTENOID SEBAGAI ANTIOKSIDAN
DIAH LESTARI AYUDIARTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Ekstraksi Karotenoid dari Kepala Udang secara Enzimatis dan Karakterisasi Profil Karotenoid sebagai Antioksidan adalah karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
Diah Lestari Ayudiarti
ABSTRACT
DIAH LESTARI AYUDIARTI. Extraction of Carotenoid through Enzymatic from Shrimp Head and Characterization of Carotenoid Profile as Antioxidant. Supervised by JOKO SANTOSO, SRI PURWANINGSIH and ROSMAWATY PERANGINANGIN.
Shrimp head is fisheries waste that contains minerals, chitin and pigments. These waste can be extracted as an antioxidant source since it’s contains carotenoids such as astaxanthin and beta carotene. The purpose of this research was to determine the optimum concentration of HCl on demineralizing shrimp head and to determine the optimum concentration of enzymes (pepsin or papain) on carotenoid pigments extracting and to characterize it’s antioxidant properties. The research consisted of two steps, i.e. preliminary and main research. The preliminary research was carried out to find out the optimum HCl concentration on demineralizing of shrimp head; whereas the main research was conducted to determine the optimum concentration of pepsin and papain enzymes on extracting of carotenoid pigments. Demineralization of shrimp head was initiated by cooking for 10 minutes (70-80 oC), continued by soaking in HCl in concentration of 0; 0.75; 1.00 and 1.25M for 30 minutes. The optimum condition to demineralize of shrimp head waste was using HCl 1,25M for 30 minutes, whereas the optimum activities of pepsin and papaine enzymes were pH 4 at 45 oC and pH 6.2 at 55 oC respectively. The concentration optimum of pepsin enzyme on carotenoid pigments extracting was 3%, which obtained phenolic compound of 83.76 mg GAE/l, inhibited oxidation of 32.87% (equal to 285.79 mgAAE/100 g), had IC50 2.05 μg/ml and contained 15.58% of beta carotene and 13.65% of astaxanthin; whereas the optimum concentration of papain enzyme was 8%, produced phenolic compound of 49.35 mgGAE/L, inhibited oxidation 17.27% (equal to 150.00 mgAAE/100 g), had IC50 3.85 μg/ml, contained 15,58% of beta caroten and 11,62% of astaxanthin.
RINGKASAN
DIAH LESTARI AYUDIARTI. Ekstraksi Karotenoid dari Kepala Udang secara Enzimatis dan Karakterisasi Profil Karotenoid sebagai Antioksidan. Dibimbing oleh JOKO SANTOSO, SRI PURWANINGSIH dan ROSMAWATY PERANGINANGIN.
Udang di Indonesia sampai sekarang masih merupakan komoditas perikanan yang memiliki nilai ekonomis tinggi. Volume ekspor udang Indonesia tahun 2010 mencapai 140.940 ton yang memiliki nilai sebesar US$ 989.708.000. Potensi ekspor udang beku di Indonesia tiap tahun semakin meningkat. Ekspor udang beku tanpa kulit dan kepala sebesar 60% dari total ekspor. Limbah padat hasil produksi olahan udang vanname sebesar 36-47% dari total ekspor. Penanganan limbah harus ditangani secara tepat agar tidak menimbulkan dampak negatif bagi lingkungan. Kepala dan kulit udang banyak mengandung protein, senyawa kitin dan pigmen karotenoid. Pigmen karotenoid terdiri dari beberapa jenis seperti likopen, karoten, xantophil, zeaxanthin dan astaxanthin. Penelitian ini bertujuan untuk mengekstrak karotenoid dari limbah kepala udang secara enzimatis untuk dikarakterisasi sebagai antioksidan.
Bahan baku yang digunakan pada penelitian ini adalah limbah kepala udang yang diperoleh dari limbah hasil pengolahan perusahaan di daerah Muara Baru. Hasil karakteristik bahan baku kepala udang vanname adalah kadar air 75,13%, kadar abu 7,05%, kadar lemak 1,98%, dan kadar protein 15,31%.
Pada penelitian pendahuluan dilakukan proses demineralisasi menggunakan HCl yang berfungsi untuk mengurangi jumlah mineral seperti kalsium. Proses demineralisasi dilakukan dengan cara merendam kepala udang dalam HCl 0; 0,75; 1,00 dan 1,25 M selama 30 menit, sehingga jumlah mineral (kalsium) dalam kepala udang dapat berkurang. Hasil demineralisasi kepala udang terbaik adalah menggunakan asam klorida sebesar 1,25 M karena dapat mendemineralisasi kadar abu yang terdapat dalam kepala udang sebesar 4,09%.
Ekstraksi karotenoid dari kepala udang dilakukan dengan menggunakan enzim pepsin dan enzim papain yang merupakan modifikasi dari metode Babu et al. (2008). Kepala udang diagitasi dalam larutan enzim pepsin menggunakan pelarut buffer fosfat-sitrat dengan konsentrasi 2, 3 dan 4% (b/b) selama 2 jam (pH 4 dan suhu 45 °C) atau enzim papain menggunakan buffer fosfat-sitrat dengan konsentrasi 4, 6 dan 8% (b/b) (pH 6,2 dan suhu 55 °C) selama 2 jam. Ekstraksi menggunakan enzim pepsin 3% dapat menghasilkan senyawa fenolat sebesar 83,76 mgGAE/L, memiliki kandungan beta karoten sekitar 15,58 ppm dan astaxanthin sebesar 13,65 ppm yang dapat menghambat terjadinya oksidasi sebesar 32,87% yang setara dengan 285,79 mgAAE/100g dan memiliki IC50 sebesar 2,05μg/mL. Hasil ekstraksi menggunakan enzim papain 8% dapat
© Hak Cipta milik IPB, Tahun 2011
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
Kegiatan penelitian dalam rangka penulisan Tesis ini dibiayai oleh :
Balai Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan
EKSTRAKSI KAROTENOID DARI KEPALA UDANG
SECARA ENZIMATIS DAN KARAKTERISASI
PROFIL KAROTENOID SEBAGAI ANTIOKSIDAN
DIAH LESTARI AYUDIARTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Departemen Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ekstraksi Karotenoid dari Kepala Udang secara Enzimatis dan Karakterisasi Profil Karotenoid sebagai Antioksidan Nama Mahasiswa : Diah Lestari Ayudiarti
NRP : C351070091
Mayor : Teknologi Hasil Perairan
Disetujui
Komisi Pembimbing
Dr. Ir. Joko Santoso, M.Si Ketua
Dr. Ir. Sri Purwaningsih, M.Si Prof(R). Dr. Rosmawaty P., MS Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Teknologi Hasil Perairan
Dr. Tati Nurhayati, S.Pi, M.Si Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya
sehingga penulis dapat menyelesaikan karya ilmiah ini. Tema yang dipilih dalam
penelitian ini adalah Ekstraksi Karotenoid dari Kepala Udang secara Enzimatis
dan Karakterisasi Profil karotenoid sebagai Antioksidan.
Penulis mengucapkan terima kasih kepada:
1. Dr. Ir. Joko Santoso, M.Si, Dr. Ir. Sri Purwaningsih, M.Si, dan
Prof. Dr. Rosmawaty Peranginangin, MS selaku Pembimbing, yang telah
membimbing, memberikan arahan dan masukan kepada penulis dalam
menyelesaikan tesis ini;
2. Dra. Ella Salamah, M.Si selaku Penguji, yang telah memberikan arahan dan
masukan kepada penulis dalam menyelesaikan tesis ini;
3. Dr. Tati Nurhayatai, S.Pi, M.Si selaku Ketua Program Studi Pasca Sarjana
yang telah memberikan masukan kepada penulis;
4. Bapak Wayan Lendra dan Ibu Mariyam yang telah memberikan dukungan
dan motivasi;
5. Kepala Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan
Perikanan, Prof. Dr. Hari Eko Irianto;
6. Prof. Dr. Sumpeno Putro (alm) yang telah membantu dalam memilih Program
Studi di IPB serta memotivasi dalam kelancaran studi, dan beasiswa;
7. Badan Riset Kelautan dan Perikanan (BRKP) sebagai sponsor beasiswa;
8. Ibu Dwi Suryaningrum, dan Ibu Murniyati sebagai Koordinator kegiatan di
Pengolahan Produk;
9. Teman dekat dan sahabat, Ekin, yang selalu ada disetiap saat, serta kakakku
Meivi Janti;
10.Teman-teman atau sahabat-sahabatku di BBRP2B seperti Mba Ema, Mba Ida,
Devi, Mba Yeni, dan Mba Yanti yang selalu mendukung, dan membagi
informasi selama proses penelitian ini;
11.Teman-teman THP angkatan 2007, Mba Elin, Mba Tati, Krisan, Ulin, Sevri,
seperti Mba Uci yang teman berjuang di garis finish serta Lilis, Vivin, dan
Indah (THP S1);
12.Teman-teman kos Lia, Mba Mila, dan Dian yang selalu mendoakan
kelulusanku;
13.Teman-teman di BBRP2B lainnya yang selalu membantu dan memotivasi
selama proses penelitian ini seperti Pak Tazwir, Pak Nurul, Mba Dewi Zilda,
Gintung, dan lainnya yang tidak dapat disebutkan satu per satu;
14.Mba Ema dan Mas Ismail staff administrasi THP yang selalu membantu
Saya.
Penulis menyadari bahwa karya ilmiah ini masih ada kekurangan, oleh
karena itu saran dan kritik yang bersifat membangun sangat diharapkan agar dapat
memberikan informasi dalam pengembangan karya tulis ini lebih lanjut. Semoga
karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Surabaya pada tanggal 15 Maret 1981 sebagai anak
kedua dari dua bersaudara, pasangan Wayan Lendra dan Mariyam. Penulis
memasuki jenjang Sekolah Dasar tahun 1987 dan lulus tahun 1993 di
SDN Dr. Soetomo VII, Surabaya; melanjutkan ke jenjang SMP tahun 1993
sampai 1996 di SMPN 10 Surabaya; jenjang SMU di tahun 1996 sampai 1999 di
SMUN 21 Surabaya. Penulis melanjutkan kuliah Strata 1 tahun 1999 di Program
Studi Kimia (FMIPA) Universitas Airlangga sampai tahun 2003.
Penulis bekerja sebagai Pelaksana Peneliti di Kelompok Pengolahan Produk
di Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan
sejak tahun 2003. Pada tahun2007 penulis memperoleh kesempatan menjadi karya
siswa BRKP untuk melanjutkan jenjang pendidikan ke Strata 2 di Sekolah
DAFTAR ISI
3.3.1 Penelitian pendahuluan ... 22
3.4.7 Analisis total fenol dengan metode folin-ciocalteu
(Orak 2006) ... 27 3.4.8 Penentuan komposisi beta karoten (Zhao et al. 2004) ... 28 3.4.9 Penentuan komposisi astaxanthin (Lee et al. 2004) ... 28 3.4.10 Uji aktivitas antioksidan metode
2,2-difenil-1-pikrilhidrazil (DPPH) (Okawa 2001)... 28
3.5 Rancangan Percobaan dan Analisis Data ... 29
4. HASIL PEMBAHASAN ... 31
4.1 Penelitian Pendahuluan ... 31 4.1.1 Karakterisasi bahan baku kepala udang vanname ... 31 4.1.2 Pengaruh demineralisasi terhadap kadar air kulit kepala
udang vanname (Litopenaeus vannamei) ... 32 4.1.3 Pengaruh demineralisasi terhadap kadar abu kulit kepala
udang vanname (Litopenaeus vannamei) ... 33 4.1.4 Pengaruh demineralisasi terhadap kadar lemak kulit kepala
udang vanname (Litopenaeus vannamei) ... 35 4.1.5 Pengaruh demineralisasi terhadap kadar protein kulit kepala
udang vanname (Litopenaeus vannamei) ... 36 4.1.6 Uji aktivitas enzim pepsin dan papain ... 38
4.2 Penelitian Utama ... 40 4.2.1 Karakteristik total fenol hasil ekstraksi dari kepala udang
vanname (Litopeneaus vannamei) ... 40 4.2.2 Profil beta karoten hasil ekstraksi dari kepala udang
vanname (Litopenaus vannamei) ... 42 4.2.3 Profil astaxanthin hasil ekstraksi dari kepala udang
vanname (Litopenaus vannamei) ... 44 4.2.4 Karakteristik aktivitas antioksidan hasil ekstraksi dari
DAFTAR TABEL
Halaman
1 Komposisi kimia udang vanname ... 9 2 Pengelompokan enzim protease ... 14
3 Komposisi asam amino penyusun papain ... 16
4 Uji aktivitas enzim ... 26
DAFTAR GAMBAR
10 Nilai rata-rata kadar lemak kepala udang hasil demineralisasi ... 36
11 Nilai rata-rata kadar protein kepala udang hasil demineralisasi ... 37
12a Uji aktivitas enzim pepsin pada suhu optimum ... 38
12b Uji aktivitas enzim papain pada suhu optimum ... 38
13a Uji aktivitas enzim pepsin pada pH optimum ... 39
13b Uji aktivitas enzim papain pada pH optimum... 39
14a Kandungan total fenol hasil ekstraksi kepala udang menggunakan enzim pepsin ... 41
14b Kandungan total fenol hasil ekstraksi kepala udang menggunakan enzim papain ... 41
15 Profil standar beta karoten ... 42
16a Profil beta karoten untuk hasil ekstraksi menggunakan
enzim pepsin 2% ... 43
16b Profil beta karoten untuk hasil ekstraksi menggunakan
enzim pepsin 3% ... 43
16c Profil beta karoten untuk hasil ekstraksi menggunakan
enzim pepsin 4% ... 43
16d Profil beta karoten untuk hasil ekstraksi menggunakan
enzim papain 4% ... 43
16e Profil beta karoten untuk hasil ekstraksi menggunakan
16f Profil beta karoten untuk hasil ekstraksi menggunakan
enzim papain 8% ... 43
17 Profil standar astaxanthin ... 44
18a Profil astaxanthin untuk hasil ekstraksi menggunakan
enzim pepsin 2% ... 45
18b Profil astaxanthin untuk hasil ekstraksi menggunakan
enzim pepsin 3% ... 45
18c Profil astaxanthin untuk hasil ekstraksi menggunakan
enzim pepsin 4% ... 45
18d Profil astaxanthin untuk hasil ekstraksi menggunakan
enzim papain 4% ... 45
18e Profil astaxanthin untuk hasil ekstraksi menggunakan
enzim papain 6% ... 45
18f Profil astaxanthin untuk hasil ekstraksi menggunakan
enzim papain 8% ... 45 19a Persen inhibisi hasil ekstraksi menggunakan enzim pepsin ... 47
19b Persen inhibisi hasil ekstraksi menggunakan enzim papain ... 47
20a Aktivitas antioksidan (AEAC) hasil ekstraksi menggunakan
enzim pepsin ... 48
20b Aktivitas antioksidan (AEAC) hasil ekstraksi menggunakan
enzim papain ... 48
21a Aktivitas antioksidan (IC50) hasil ekstraksi menggunakan
enzim pepsin ... 49
21b Aktivitas antioksidan (IC50) hasil ekstraksi menggunakan
DAFTAR LAMPIRAN
Halaman
1 Tabel analisis ragam dan hasil uji lanjut Tukey pada proses demineralisasi terhadap kadar air kepala udang vanname (Litopenaeus vannamei) ... 63 2 Tabel analisis ragam dan hasil uji lanjut Tukey pada proses demineralisasi
terhadap kadar abu kepala udang vanname (Litopenaeus vannamei) ... 64 3 Tabel analisis ragam dan hasil uji lanjut Tukey pada proses demineralisasi
terhadap kadar lemak kepala udang vanname (Litopenaeus vannamei) ... 65 4 Tabel analisis ragam dan hasil uji lanjut Tukey pada proses demineralisasi
terhadap kadar protein kepala udang vanname (Litopenaeus vannamei) ... 66 5 Kurva kalibrasi asam galat dan kadar total fenol hasil ekstraksi ... 67
6 Tabel analisis ragam dan hasil uji lanjut Tukey terhadap kadar total fenol hasil ekstraksi dari kepala udang vanname (Litopenaeus vannamei)
menggunakan enzim pepsin. ... 68
7 Tabel analisis ragam dan hasil uji lanjut Tukey terhadap kadar total fenol hasil ekstraksi dari kepala udang vanname (Litopenaeus vannamei)
menggunakan enzim papain ... 69
8 Analisis kemampuan inhibisi asam askorbat dan aktivitas antioksidan
sampel hasil ekstraksi dari kepala udang ... 70
9 Tabel analisis kemampuan inhibisi dan hasil analisis uji lanjut Tukey terhadap hasil ekstraksi dari kepala udang vanname
(Litopenaeus vannamei) menggunakan enzim pepsin ... 71 10 Tabel analisis kemampuan inhibisi dan hasil analisis uji lanjut Tukey
terhadap hasil ekstraksi dari kepala udang vanname
(Litopenaeus vannamei) menggunakan enzim papain ... 72 11 Tabel analisis aktivitas antioksidan AEAC dan hasil analisis
uji lanjut Tukey terhadap hasil ekstraksi dari kepala udang vanname
(Litopenaeus vannamei) menggunakan enzim pepsin ... 73 12 Tabel analisis aktivitas antioksidan AEAC dan hasil analisis
uji lanjut Tukey terhadap hasil ekstraksi dari kepala udang vanname
(Litopenaeus vannamei) menggunakan enzim papain ... 74 13 Tabel analisis aktivitas antioksidan IC50 dan hasil analisis
uji lanjut Tukey terhadap hasil ekstraksi dari kepala udang vanname
14 Tabel analisis aktivitas antioksidan IC50 dan hasil analisis
uji lanjut Tukey terhadap hasil ekstraksi dari kepala udang vanname
(Litopenaeus vannamei) menggunakan enzim papain ... 76
1.
PENDAHULUAN
1.1 Latar Belakang
Udang di Indonesia sampai sekarang masih merupakan komoditas perikanan
yang memiliki nilai ekonomis tinggi. Pemerintah melalui Departemen Perdagangan
telah menetapkan udang sebagai komoditas ekspor pada urutan keenam (Departemen
Kelautan dan Perikanan 2008). Komoditas udang saat ini diperoleh dari penangkapan
di alam maupun dari hasil budidaya tambak. Data menunjukkan lahan tambak udang
vanname sebesar 1,2 juta hektar dengan kapasitas produksi tahun 2007 mencapai 352.220 ton, 75% lahan ditangani oleh petambak tradisional dan sisanya oleh
petambak semi-intensif dan petambak intensif oleh perusahaan (Trobos 2009).
Volume ekspor udang Indonesia tahun 2010 mencapai 140.940 ton yang
memiliki nilai sebesar US$ 989.708.000. Potensi ekspor udang beku di Indonesia
tiap tahun semakin meningkat. Ekspor udang beku tanpa kulit dan kepala sebesar
60% (KKP 2011). Hafiz (2009) menyatakan ukuran rata-rata berat per ekor udang
vanname (Litopenaeus vannamei) siap konsumsi adalah 15 g dengan komposisi daging 8,67 g, bobot kepala sebesar 4,33 g, dan bobot kulit sebesar 2 g. Komposisi
rendemen rata-rata per ekor udang vannamei adalah daging sebesar 58%, kepala sebesar 29% dan kulit sebesar 13%. Limbah padat hasil produksi olahan udang
vanname sebesar 36-47%.
Holanda dan Netto (2006) menyatakan pemanfaatan limbah cangkang udang
selama ini hanya terbatas untuk campuran pakan ternak dan pembuatan kitosan.
Kepala dan kulit udang ini banyak mengandung protein, senyawa kitin dan pigmen
karotenoid. Rodriguez-Amaya (2006) menunjukkan bahwa pigmen karotenoid terdiri
dari beberapa jenis, seperti likopen, karoten, xantophil, zeaxanthin, dan astaxanthin.
Astaxanthin merupakan pigmen dominan dalam kulit udang yang akan mengalami
perubahan warna dari biru-hijau-coklat menjadi merah keoranyean bila terkena panas.
Astaxanthin adalah pigmen golongan karotenoid yang termasuk karoten
2
menyatakan karotenoid bermanfaat bagi kesehatan manusia, sebab karotenoid dapat
mencegah aktivitas kanker paru-paru, kanker prostat, penyakit jantung, katarak,
infeksi Human Immune Virus.
Ciapara et al. (2006) menunjukkan bahwa karotenoid juga dapat mencegah infeksi bakteri, meningkatkan sistem kekebalan tubuh, mencegah peradangan dan
sebagai pelindung kerusakan Deoxyribonucleic Acid akibat sinar ultra violet. Furr dan Clark (1997) menyatakan karotenoid berfungsi sebagai antikolesterol karena
dapat membentuk emulsi dengan lemak membentuk kilomikron dan mudah
terabsorpsi pada lapisan pencernaan. Penelitian Kurashige et al. (1990) dan Shimidzu et al. (1996) menunjukkan karotenoid mempunyai aktivitas sebagai antioksidan 100 kali lebih kuat dibandingkan vitamin E. Berdasarkan hasil penelitian
Chew et al. (1999) karotenoid dapat mengurangi pertumbuhan tumor payudara sebesar 50% melalui uji in vivo.
Metode ekstraksi karotenoid pada udang telah dilakukan baik dengan pelarut
bahan kimia, super kritikal karbondioksida, dan enzim. Ekstraksi menggunakan
pelarut bahan kimia memerlukan jumlah bahan kimia yang banyak sehingga akan
menghasilkan banyak limbah cair pada akhir proses dan dimungkinkan pada hasil
ekstraksi masih terdapat residu bahan kimia yang berbahaya bagi kesehatan.
Ekstraksi karotenoid menggunakan metode super kritikal karbondioksida
menghasilkan rendemen yang kecil. Babu et al. (2008) menyatakan ekstraksi karotenoid secara enzimatis menghasilkan rendemen yang tinggi dan ramah
lingkungan. Shacindra et al. (2005) telah melakukan ekstraksi karotenoid menggunakan pelarut aseton pada berbagai bagian tubuh udang dan menghasilkan
rendemen sebesar 10,4-17,4 g/g pada daging udang, 35,8-153,1 µg/g pada kepala,
59,8-104,7 g/g pada kulit udang. Lopez et al. (2004) membandingkan bahwa ekstraksi karotenoid menggunakan superkritikal karbondioksida menghasilkan
rendemen 71% lebih kecil dibandingkan dengan cara manual. Hasil penelitian Babu
(2008) menunjukkan ekstraksi karotenoid menggunakan enzim juga telah
diaplikasikan pada kepala udang, hasil rendemen yang diperoleh sebesar 75,7–96,8
3
Chakrabarti (2002) telah melakukan penelitian ekstraksi karotenoid
menggunakan enzim protease dan rendemen yang dihasilkan sebesar 30-40 ppm.
Enzim protease berfungsi untuk memutus ikatan peptida sehingga pigmen yang
terdapat dalam kulit dan kepala udang dapat diekstrak dan diperoleh pigmen
karotenoid bebas. Mineral dalam kulit udang seperti kalsium, karbonat, dan fosfor
akan menghambat proses ekstraksi. Mineral dapat berasosiasi dengan protein dan
menguatkan ikatan peptida. Proses pemanasan tidak dapat menghilangkan mineral
tetapi penambahan asam atau basa dapat memutuskan ikatan mineral (demineralisasi)
dan meningkatkan daya tolak menolak elektrostatik sehingga melonggarkan jaringan
protein. Penelitian untuk melihat pengaruh proses demineralisasi terhadap ekstraksi
karotenoid dari kepala udang menggunakan enzim papain dan pepsin komersial perlu
dilakukan serta menguji karakteristik hasil ekstraksi sebagai antioksidan.
1.2 Perumusan Masalah
Pada umumnya udang diekspor dalam bentuk segar dan beku. Ekspor beku
dapat menggunakan atau tanpa menggunakan kepala dan kulit. Kepala dan kulit
udang sisa pengolahan pembekuan digolongkan sebagai limbah padat. Selama ini
limbah padat tersebut hanya dimanfaatkan sebagai pakan dan sebagai sumber kitin
serta kitosan. Padahal limbah kepala dan kulit udang mengandung pigmen
karotenoid yang mempunyai banyak manfaat antara lain sebagai antioksidan.
Ekstraksi karotenoid telah banyak dilakukan dengan berbagai metode baik
dengan pelarut bahan kimia, super kritikal karbondioksida ataupun enzim. Proses
ekstraksi menggunakan pelarut bahan kimia menghasilkan banyak limbah cair pada
akhir proses dan dimungkinkan pada hasil ekstraksi masih terdapat residu bahan
kimia yang berbahaya bagi kesehatan. Ekstraksi karotenoid menggunakan metode
super kritikal karbondioksida menghasilkan rendemen yang kecil. Alternatif proses
ekstraksi karotenoid yang lebih murah, menghasilkan rendemen yang tinggi, dan
4
Penelitian untuk melihat pengaruh proses demineralisasi terhadap ekstraksi
karotenoid dari kepala udang menggunakan enzim pepsin dan papain perlu dilakukan
serta menguji karakteristik hasil ekstraksi sebagai antioksidan.
1.3 Tujuan dan Manfaat Penelitian
Penelitian diharapkan dapat menemukan metode ekstraksi secara enzimatis
untuk mendapatkan karotenoid terbaik serta dapat menjadi salah satu alternatif dalam
pemenuhan kebutuhan antioksidan yang berasal dari limbah kepala udang. Tujuan
umum penelitian ini adalah mengekstrak karotenoid dari limbah kepala udang secara
enzimatis untuk dikarakterisasi sebagai antioksidan. Tujuan khusus penelitian ini
adalah:
1) Menentukan konsentrasi HCl optimum dalam proses demineralisasi.
2) Menentukan konsentrasi enzim pepsin terbaik untuk mengekstraksi karotenoid
sebagai antioksidan.
3) Menentukan konsentrasi enzim papain terbaik untuk mengekstraksi karotenoid
sebagai antioksidan.
1.4 Hipotesis
Adapun hipotesis penelitian ini adalah:
(1) Penggunaan HCl akan berpengaruh terhadap proses demineralisasi.
(2) Penggunaan konsentrasi enzim pepsin akan berpengaruh terhadap ekstrak
karotenoid sebagai antioksidan.
(3) Penggunaan konsentrasi enzim papain akan berpengaruh terhadap ekstrak
karotenoid sebagai antioksidan.
1.5 Kerangka Pemikiran
Saat ini udang beku diekspor tanpa menggunakan kepala dan kulit sehingga
menghasilkan banyak limbah padat. Kepala dan kulit udang mengandung pigmen
5
diantaranya sebagai antioksidan. Proses ekstraksi karotenoid dapat dilakukan dengan
pelarut bahan kimia, super kritikal karbondioksida dan secara enzimatis. Proses
ekstraksi menggunakan pelarut bahan kimia menghasilkan banyak limbah cair dan
berbahaya bagi kesehatan. Ekstraksi karotenoid menggunakan metode super kritikal
karbondioksida menghasilkan rendemen yang kecil. Ekstraksi karotenoid secara
enzimatis lebih ramah lingkungan dan menghasilkan rendemen yang tinggi.
Ekstraksi karotenoid dari limbah kepala udang dengan enzim dapat lebih ekonomis
bila menggunakan enzim komersial yang berharga rendah, misalnya enzim papain
dibandingkan menggunakan enzim murni, seperti enzim pepsin. Enzim papain dan
pepsin merupakan enzim protease yang memiliki spesifitas tinggi, hanya
mengkatalisis substrat tertentu, tidak membentuk produk samping yang tidak
diinginkan, mempunyai produktivitas yang tinggi sehingga dapat mengurangi biaya.
Produk akhir pada umumnya tidak terkontaminasi sehingga mengurangi biaya
purifikasi dan mengurangi efek kerusakan terhadap lingkungan. Kerangka pemikiran
6
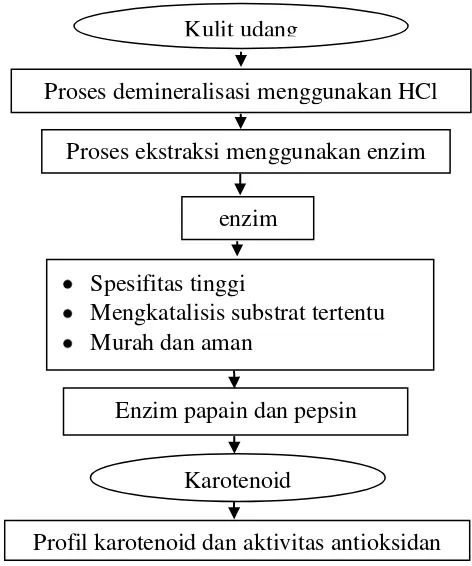
Gambar 1 Kerangka pemikiran penelitian. Kulit udang
Proses demineralisasi menggunakan HCl
Proses ekstraksi menggunakan enzim
enzim
Enzim papain dan pepsin
Karotenoid
Profil karotenoid dan aktivitas antioksidan Spesifitas tinggi
7
2. TINJAUAN PUSTAKA
2.1 Udang Vanname (Litopenaeus vannamei)
Udang vanname (Litopnaeus vannamei) merupakan organisme akuatik asli pantai Pasifik Meksiko, Amerika Tengah, dan Amerika Selatan. Udang vanname
memiliki nama umum Pacific white shrimp, camaron blanco, dan longostino. Udang vaname dapat tumbuh sampai 230 mm, menyukai dasar yang berpasir dengan 5 pasang kaki renang (pleopod) serta sepasang uropod (mirip ekor) yang membentuk kipas bersama-sama telson. Sifat udang vaname aktif pada kondisi gelap dan dapat hidup pada kisaran salinitas lebar dan suka memangsa sesama jenis (kanibal), tipe
pemakan lambat tapi terus menerus (continous feeder) serta mencari makan lewat organ sensor. Spesies ini memiliki 6 stadia naupli, 3 stadia protozoa, 3 stadia mysis,
8
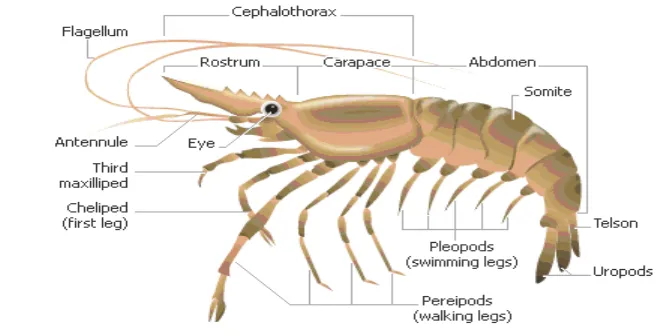
menjadi juvenil dan akhirnya menjadi dewasa. Anatomi tubuh udang dapat dilihat pada Gambar 2.
Gambar 2 Anatomi udang (Pustekom 2005).
Pada udang betina, gonad pada awal perkembangannya berwarna
keputih-putihan yang kemudian berubah menjadi coklat keemasan atau hijau kecoklatan pada
saat pemijahan. Pada masa pemijahan, telur akan dibuahi oleh sperma. Telur-telur
yang telah dibuahi akan terdapat pada bagian dasar atau melayang-layang di air.
Telur jenis udang ini tergantung dari ukuran individu, udang dengan berat 30g sampai
45 g menghasilkan telur sebanyak 100.000 sampai 250.000 butir. Telur yang
memiliki diameter 0,22 mm, proses claeveage pada tingkat nauplius terjadi kira-kira 14 jam setelah proses bertelur (Dinas Kelautan dan Perikanan Daerah 2009).
Hafiz (2009) menyatakan udang vanname memiliki berat kepala sebesar 29%, daging sebesar 58%, dan pada kulit sebesar 13%. Ukuran rata-rata tiap bagian-bagian
udang didapatkan berat total rata-rata sebesar 15 g, tanpa kepala sebesar 10,67 g,
tanpa kepala dan kulit sebesar 8,67 g, bobot kepala sebesar 4,33 g, dan bobot rata-rata
9
Tabel 1 Komposisi kimia udang vanname
Parameter Jumlah (%)
Karotenoid adalah pigmen alami yang disintesis oleh tanaman, alga, jamur,
kapang dan bakteri. Karotenoid juga ditemukan dalam ikan (salmon, trout, sea beam, kakap merah, dan tuna), kulit, cangkang atau kerangka luar hewan air, seperti
moluska (clam, oyster, scallop) dan crustacea (lobster, kepiting, udang). Gimeno et al. (2007) menyatakan pigmen ini tidak dapat disintesis sendiri oleh hewan-hewan tersebut tetapi diperoleh dari makanan, yaitu alga.
Jenis pigmen karotenoid terdiri dari beberapa jenis, seperti likopen, karoten,
xantophil, zeaxanthin, dan astaxanthin. Hal ini disebabkan karotenoid dapat
mengalami reaksi kimia yang menghasilkan turunannya dengan sifat kimia yang
masih sama (Rodriguez-Amaya et al. 2006). Struktur karotenoid merupakan turunan dari likopen yang masing-masing terdiri dari 40 atom C dengan dua cincin pada
bagian ujungnya. Cincin yang terdapat pada karotenoid dihubungkan oleh atom C
yang terkonjugasi atau sistem polien. Dua pigmen karotenoid, yaitu α dan β-karoten
hanya disusun oleh atom C dan H yang pada bagian ujungnya mengalami siklisasi.
Xanthophil merupakan turunan karotenoid yang mengalami substitusi oksigen,
zaexanthin merupakan turunan karotenoid yang mengalami hidrogenasi dan
mengandung gugus hidroksi. Gugus oksi terdapat dalam canthaxanthin, sedangkan
kombinasi gugus hidroksi dan oksi terdapat dalam astaxanthin. Ikatan ganda
terkonjugasi pada karotenoid merupakan gugus kromofor yang memberikan warna.
Setiap ikatan rangkap pada rantai alifatisnya akan memberikan dua bentuk
konfigurasi geometri, yaitu isomer cis dan trans. Isomer cis lebih stabil dibandingkan
10
pigmen yang memberikan warna kuning, oranye atau merah pada ikan dan udang
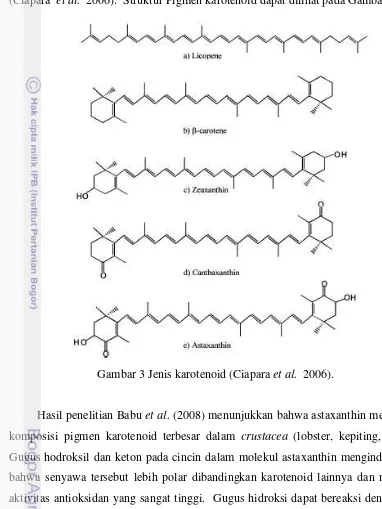
(Ciapara et al. 2006). Struktur Pigmen karotenoid dapat dilihat pada Gambar 3.
Gambar 3 Jenis karotenoid(Ciapara et al. 2006).
Hasil penelitian Babu et al. (2008) menunjukkan bahwa astaxanthin merupakan komposisi pigmen karotenoid terbesar dalam crustacea (lobster, kepiting, udang). Gugus hodroksil dan keton pada cincin dalam molekul astaxanthin mengindikasikan
bahwa senyawa tersebut lebih polar dibandingkan karotenoid lainnya dan memiliki
aktivitas antioksidan yang sangat tinggi. Gugus hidroksi dapat bereaksi dengan satu
atau dua asam lemak membentuk monoester dan diester. Bentuk teresterifikasi ini
mengakibatkan astaxanthin bersifat hidrofobik (tidak larut dalam air), diester bersifat
lebih hidrofobik dibandingkan dengan bentuk monoester. Astaxanthin dalam
11
bentuk terkonjugasi dengan protein atau membentuk ester dengan asam lemak seperti
palmitat, oleat atau linoleat (Hussein et al. 2006).
Karotenoid memiliki sifat tidak larut dalam air, sedikit larut dalam minyak,
larut dalam hidrokarbon alifatik dan aromatik serta larut dalam hidrokarbon
terklorinasi, seperti kloroform dan metilen klorida (Simpson 1982). Karotenoid
sangat bermanfaat bagi kesehatan karena dapat mencegah oksidasi asam lemak tak
jenuh (Khanafari 2007).
Karotenoid bermanfaat bagi kesehatan manusia, sebab karotenoid dapat
mencegah aktivitas kanker paru-paru, kanker prostat, penyakit jantung dan katarak
(Olson 1999). Ciapara et al. (2006) menyatakan bahwa karotenoid juga dapat mencegah infeksi bakteri, meningkatkan sistem kekebalan tubuh, mencegah
peradangan dan sebagai pelindung kerusakan DNA akibat sinar UV. Olson (1999)
menyatakan beta karoten dapat mencegah beberapa aktivitas kanker, seperti kanker
tenggorokan dengan konsumsi sebesar 15 mg selama 6 tahun, kanker usus dengan
dosis sebesar 25 mg selama 5 tahun, kanker kulit dengan dosis 50 mg selama 5 tahun,
dan kanker prostat dengan dosis 20 mg selama 5-8 tahun. Astaxanthin dapat
mencegah aktivitas kanker karena dapat menekan pertumbuhan kanker dan
meningkatkan daya tahan tubuh untuk melawan antigen. Chew et al. (1999) menyatakan bahwa 0,1 dan 0,4% astaxanthin dapat mencegah kanker payudara pada
tikus. Astaxanthin juga dapat mencegah penyakit jantung, sebab astaxanthin dapat
mencegah oksidasi Low Density Lipoprotein (LDL) yang merupakan kolesterol jahat penyebab arteriosclerosis.
Astaxanthin dapat berfungsi sebagai antibakteri dari Helicobacter pylori
penyebab kanker usus. Koloni H. pylori di lapisan mukosa usus dihambat karena adanya astaxanthin pada lapisan mukosa usus (Wadstron & Alejung 2001).
Astaxanthin memiliki efek antiinflamasi dengan menghambat sitokin dan chemokin.
Astaxanthin bisa mencegah kelelahan mata, katarak diabetik, mempertajam
penglihatan. meningkatkan daya tahan otot, dan mencegah kerut (Hussein et al.
12
2.3Ekstraksi Karotenoid
Ekstraksi karotenoid merupakan suatu proses untuk memperoleh karotenoid
dari bahan yang diduga mengandung karotenoid, seperti kulit udang. Karotenoid
dalam kulit udang merupakan senyawa kompleks yang berikatan secara nonkovalen
dengan protein (Gimeno et al. 2007).
Babu et al. (2008) menyatakan ekstraksi karotenoid telah banyak dilakukan dengan berbagai metode, yaitu menggunakan pelarut kimia, minyak, superkritikal
karbondioksida, bakteri, dan enzim. Ekstraksi karotenoid meggunakan pelarut kimia
telah banyak dilakukan diantaranya menggunakan heksana, aseton, metanol, dan
etanol. Ekstraksi karotenoid menggunakan pelarut kimia memang efektif akan tetapi
memiliki beberapa kekurangan, yaitu proses pemisahan pelarut kimia dengan
karotenoid sangat sulit sehingga dapat mendegradasi karotenoid dan hasil
ekstraksinya tidak aman bagi kesehatan. Maoka dan Akimoto (2008) telah
mengekstraksi karotenoid dari kulit udang menggunakan aseton menghasilkan
rendemen sebesar 0,1 mg/g. Gimeno et al. (2007) menyatakan bahwa ekstraksi karotenoid menggunakan aseton lebih efektif dibandingkan dengan etanol.
Ekstraksi menggunakan pelarut minyak tidak dapat dijadikan sebagai suplemen
kesehatan karena kandungan asam lemak tak jenuhnya sangat tinggi sehingga tidak
baik untuk kesehatan (Lee et al. 1999). Shacindra et al. (2005) telah melakukan ekstraksi karotenoid menggunakan pelarut aseton pada berbagai bagian tubuh udang
dan menghasilkan rendemen sebesar 10,4-17,4 ppm pada daging udang, 35,8-153,1
ppm pada kepala, dan 59,8-104,7 ppm pada kulit udang.
Ekstraksi karotenoid menggunakan superkritikal karbondioksida juga telah
banyak dilakukan. Hasil ekstraksi menggunakan metode ini sangat kecil dan merusak
struktur dari astaxanthin. Lopez et al. (2004) membandingkan bahwa ekstraksi karotenoid menggunakan superkritikal karbondioksida menghasilkan rendemen 71%
lebih kecil dibandingkan dengan cara manual. Chakrabarti (2002) telah melakukan
penelitian ekstraksi karotenoid menggunakan enzim protease dan rendemen yang
dihasilkan sebesar 30 – 40 ppm. Penggunaan enzim protease berguna untuk memutus
13
enzim dalam ekstraksi karotenoid tidak menghasilkan residu yang berbahaya bagi
tubuh dan lingkungan.
2.4 Enzim Protease
Enzim merupakan suatu kelompok protein yang berperan sangat penting
dalam proses aktivitas biologis. Enzim terdapat pada hewan, tumbuhan, maupun
mikroba. Enzim berperan sebagai katalisator pada sel dan sifatnya sangat khas
karena enzim hanya bekerja pada substrat tertentu dan dengan jenis reaksi tertentu
(Lehninger 1995). Enzim memiliki efisiensi katalitik yang tinggi dimana sebuah
molekul enzim dapat mengurai 10 ribu sampai 1 juta substrat per menit (Richardson
1976).
Kelebihan enzim sebagai katalisator dibandingkan dengan bahan-bahan kimia
lainnya adalah memiliki sifat spesifitas yang tinggi, hanya mengkatalisis substrat
tertentu, tidak terbentuk produk samping yang tidak diinginkan, mempunyai
produktivitas yang tinggi sehingga dapat mengurangi biaya, produk akhir pada
umumnya tidak terkontaminasi sehingga mengurangi biaya purifikasi dan
mengurangi efek kerusakan terhadap lingkungan (Chaplin dan Burke 1990).
Protease adalah enzim yang mengkatalisasi pemecahan ikatan peptide dalam
peptide, polipeptida, dan protein dengan menggunakan reaksi hidrolisis menjadi
molekul-molekul yang lebih sederhana seperti peptide rantai pendek dan asam amino
(Naiola & Widyastusti 2002). Aktivitas enzim ini membutuhkan air sehingga
dikelompokkan dalam kelas hidrolase. Hidrolisis ikatan peptide adalah reaksi
penambahan-penghilangan, dimana protease bertindak sebagai nukleofili membentuk
intermediet tetrahedral dengan atom karbon karbonil pada ikatan peptide (Bauer et al.
1996). Protease berperan dalam sejumlah reaksi biokimia seluler yang diperlukan
untuk degradasi protein nutrien, mekanisme patogenisitas, proses koagulasi darah,
proses sporulasi, diferensiasi, sejumlah proses pasca translasi protein, dan mekanisme
14
Tabel 2 Pengelompokan enzim protease
Pengelompokan Jenis Enzim Keterangan Contoh
Golongan pertama Enzim
Golongan keempat Protease asam Pada sisi aktifnya terdapat dua gugus
mempercepat reaksi yang dikatalisis enzim, tetapi kenaikan suhu dapat
mempengaruhi struktur enzim sehingga terjadi inaktivasi (Reed 1975). Semua enzim
adalah protein, dan aktivitasnya tergantung kepada integritas strukturnya sebagai
protein. Penataan tertentu pada rantai samping asam amino suatu enzim di sisi
aktifnya menentukan tipe molekul yang dapat terikat dan bereaksi di situ. Ada sekitar
lima rantai samping dalam enzim. Banyak molekul-molekul nonprotein kecil yang
terhubung pada sisi aktif enzim, molekul-molekul ini disebut kofaktor atau koenzim
(Ngili 2009). Sumber enzim adalah organisme hidup seperti hewan, tanaman, dan
mikroba. Enzim protease dibagi menjadi dua golongan yaitu golongan eksopeptidase
dan golongan endopeptidase.
2.4.1 Papain
Papain merupakan salah satu enzim proteolitik yang paling banyak digunakan
dalam industri. Aplikasinya cukup luas, mulai dari bahan pelunak daging hingga
15
industri biologi lainnya (Winarno 1986). Papain stabil terhadap suhu tinggi pada pH
mendekati netral. Pada pH asam (kurang dari 4) papain akan cepat menjadi inaktif
pada suhu tinggi. Pada pH yang sangat asam (kurang dari 2) inaktivasi sangat cepat
terjadi walaupun pada suhu 25OC. Papain mempunyai pH optimum 7,2 pada substrat
Benzoil Arginil Etil Ester (BAEE), pH 6,5 pada substrat kasein, pH 7,0 pada albumin,
dan pH 5,0 pada gelatin (Muchtadi et al. 1992).
Berat molekul papain adalah 20.500 kDa, di bawah mikroskop bentuk kristal
papain dari getah kering buah papaya berupa jarum tetapi setelah disimpan beberapa
bulan pada suhu rendah akan berubah hexagonal pipih memanjang. Perubahan
bentuk kristal ini tidak merubah aktivitasnya (Arief 1975). Enzim ini tergolong
protease sulfhidril. Papain mempunyai keaktifan sintetik. Disamping keaktifan
untuk memecah protein, papain mempunyai kemampuan membentuk protein baru
atau senyawa yang menyerupai protein yang disebut plastein dari hasil hidrolisis
protein (Winarno 1986). Kemurnian aktivitas enzim papain ditandai dengan daya
aktivitas proteolitik yang tinggi dan kelarutan dalam air yang tinggi juga. Daya
proteolitik enzim papain sangat aktif pada suasana reduktif sehingga dengan
penambahan bahan-bahan pereduksi akan menambah aktivitas yang besar terhadap
sisi aktif sehingga enzim menjadi inaktif. Penambahan garam NaCl dan KCl
konsentrasi rendah akan menambah aktivitas enzim, tetapi konsentrasi lebih dari 2%
akan merusak enzim papain (Arief 1975).
Kemampuan papain dalam menghidrolisis sebagian besar substrat protein lebih
ekstensif dibandingkan dengan protease lainnya, seperti tripsin dan pepsin (Leung
1996). Aktivitas katalisis papain dilakukan melalui hidrolisis yang berlangsung pada
sisi aktif papain. Mekanisme pengikatan enzim terhadap substrat tersusun atas dua
tahap yaitu, tahap pertama reaksi asilasi dengan bentuk intermediet acyl-enzim dan
tahap kedua merupakan deasilasi yang menghidrolisis hasil intermediet (Wong 1989).
16
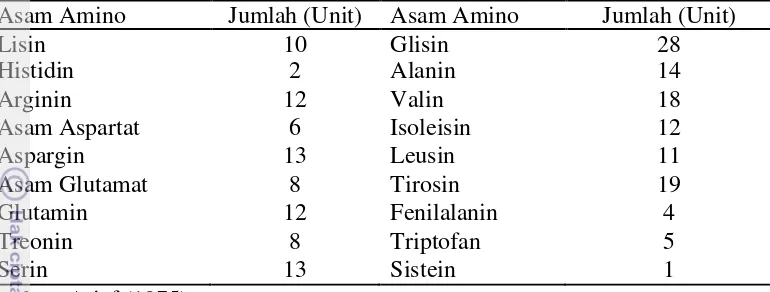
Tabel 3 Komposisi asam amino penyusun papain
Asam Amino Jumlah (Unit) Asam Amino Jumlah (Unit)
Lisin 10 Glisin 28
Semua jenis asam amino ikut menyusun struktur papain kecuali metionin.
Aktivitas papain ditentukan oleh 2 gugus sulfhidril bebas dari 6 gugus sulfhidril yang
dimiliki. Protease sulfhidril ini mengandung unsur sulfur sekitar 1,2% (Glazer dan
Smith 1971).
Logam berat seperti Cd2+, Zn2+, Fe2+, Cu2+, Hg2+, dan Pb2+ bersifat menghambat
papain. Papain dapat diaktifkan kembali dengan penambahan sistein serta Etilen Diamin Tetra Asetat (EDTA) dengan cara mengikat logam yang telah terikat pada sisi aktif logam. Aktivitas papain dipengaruhi oleh gugus aktif –SH bebas, maka pelarut
tiol juga bertindak sebagai penghambat papain. Iodoasetat atau iodoasetamida
bereaksi dengan gugus sulfhidril bebas dari papain menyebabkan inaktivasi
irreversibel begitu juga dengan pereaksi aldehida (Liener 1974).
2.4.2 Pepsin
Pepsin adalah kelompok enzim protease asam. Enzim pepsin memiliki
penamaan EC 3.4.4.1 dan mempunyai gugus aktif karbonil. Pepsin merupakan
enzim hidrolase yang mengkatalisis reaksi hidrolisis suatu substrat dengan
pertolongan molekul air (Winarno 1986). Pepsin dapat memecah protein menjadi
fragmen yang lebih kecil. Pepsin adalah enzim pencernaan yang dibentuk di dalam
mukosa lapis lambung berbentuk pepsinogen. Keasaman isi lambung yang tinggi
akan membantu perubahan pepsinogen menjadi pepsin secara autokatalitik
17
dalam enzim ini suka memecah ikatan peptida yang terdapat diantara gugus aromatik
dari asam amino. Enzim ini akan menghirolisis ikatan peptida antara asam amino
seperti –Leu-Val-, -Glu-Ala-, -Ala-Leu- (Bergmeyer 1983).
Pepsin sangat aktif pada pH rendah (pH1,0). Pada pH di bawah 5, pepsinogen
terpecah dan terbentuklah pepsin yang aktif. Berat molekul pepsin adalah 33.000
kDa mempunyai 321 residu asam amino, sangat stabil pada pH 5-5,3, dan aktif pada
pH 1-4 dengan keaktifan optimum pada pH 1,8 (Winarno 1986).
Enzim pepsin mempunyai daya katalitik yang lebih tinggi pada keasaman yang
tinggi sehingga menguntungkan karena dapat mencegah kontaminasi bakteri dan
pembusukan. Indonesia mempunyai potensi yang besar sebagai penghasil enzim
pepsin, karena enzim pepsin dapat diperoleh dari lambung hewan ruminansia, seperti
sapi, kambing, dan domba dimana populasi hewan ternak tersebut sangat tinggi
(Mahdi dan Aulannia`am 2001)
2.5 Antioksidan
Antioksidan merupakan senyawa yang dapat mencegah terjadinya oksidasi.
Antioksidan dikelompokkan berdasarkan mekanisme kerjanya menjadi antioksidan
primer dan antioksidan sekunder. Antioksidan primer merupakan antioksidan yang
dapat bereaksi dengan radikal lemak dan mengubahnya menjadi produk yang lebih
stabil seperti tokoferol, lesitin, dan asam askorbat. Antioksidan sekunder merupakan
antioksidan yang dapat mereduksi kecepatan rantai inisiasi seperti asam sitrat dan
EDTA (Gordon 1990).
Ranney (1979) mengklasifikasikan antioksidan berdasarkan prinsip kerjanya
dalam mencegah terjadinya proses oksidasi menjadi 3 golongan. Pertama adalah
antioksidan yang memiliki gugus fenol dan amina aromatik seperti Butil Hidroksi
Anisole (BHA) dan Butil Hidroksi Toluen (BHT). Antioksidan bekerja dengan cara
menangkap radikal bebas dan membentuk produk substrat nonradikal dan suatu
radikal antioksidan. Radikal antioksidan ini cukup stabil sehingga dapat mencegah
reaksi berikutnya, sehingga radikal tersebut tidak akan berperan sebagai inisiator dari
18
seperti dilauril tiodipropionat (DLTP). Antioksidan ini bekerja dengan cara
menangkap molekul-molekul hidroperoksida dalam sistem. Ketiga adalah
antioksidan yang dapat menginaktivasi logam yang bisa mempercepat terjadinya
oksidasi.
Radikal bebas merupakan sekelompok zat kimia yang sangat reaktif karena
memiliki satu atau lebih elektron yang tidak berpasangan. Radikal bebas adalah
oksidan, tetapi tidak semua oksidan merupakan radikal bebas. Oksidan merupakan
senyawa yang dapat menerima elektron dan radikal bebas merupakan atom atau
gugus yang orbital luarnya memiliki elektron yang tidak berpasangan (Fessenden dan
Fessenden1994).
Tubuh mencerna makanan untuk menghasilkan energi, pada proses ini sejumlah
radikal bebas juga terbentuk. Radikal bebas berfungsi untuk memberikan
perlindungan tubuh terhadap serangan bakteri dan parasit. Radikal bebas tidak
menyerang sasaran spesifik, sehingga akan menyerang asam lemak tidak jenuh ganda
dari membran sel, struktur sel, dan DNA. Tahapan oksidasi lemak dapat dilihat pada
Gambar 4.
Gambar 4 Mekanisasi oksidasi asam lemak (Bragadóttir 2001).
Mekanisme terjadinya oksidasi lemak diawali dengan terjadinya donor
hidrogen dari lemak (LH) ke radikal bebas(X•) yang terjadi pada tahap inisiasi.
Proses penyerangan radikat bebas akan membentuk radikal peroksidasi lipid (LOO•)
19
sangat berpotensi memiliki efek menghancurkan. Peroksidasi lipid dapat dikurangi
atau dikontrol dengan menambahkan antioksidan (AH) yang akan menghentikan
proses oksidasi. Deshpande et al. (1996) menyatakan senyawa karotenoid dapat menangkap radikal bebas dan menonaktifkannya. Struktur molekul karotenoid
memiliki rantai karbon terkonjugasi yang sangat reaktif karena terdapat banyak
elektron yang mampu bereaksi dengan radikal peroksil dan senyawa elektrofilik
lainnya. Senyawa karotenoid bereaksi dengan radikal peroksil membentuk radikal
resonansi yang terstabilkan (Burton dan Ingold 1984) atau terjadi transfer elektron
sehingga terbentuk anion peroksida alkil dan kation astaxanthin radikal (Britton
1995). Terao (1989) menyatakan bahwa astaxanthin dan canthaxanthin lebih reaktif
terhadap hidroperoksida dibandingkan β-karoten dan zeaxanthin. Miki (1991)
menyatakan bahwa astaxanthin dapat menangkap reactive oxygen species (ROS) 10 kali lebih kuat dibandingkan zeaxanthin, lutein, tunaxanthin, canthaxanthin, dan β
-karoten serta 100 kali lebih kuat dibandingkan dengan α-tocopherol. Jørgensen dan
Skibsted (1993) menyatakan tingkat keefektifan senyawa karotenoid sebagai
antioksidan adalah astaxanthin > canthaxanthin > β-carotene. Andersen et al. (1990) menyatakan astaxanthin memiliki dua gugus hidroksil pada atom C 3 dan 3´, yang
membuatnya bersifat lebih hidrofobik dibandingkan senyawa karotenoid lainnya
sehingga semakin hidrofobik senyawa antioksidan itu semakin mudah bereaksi
dengan hidrogenperoksida dalam lemak.
2.6 Uji Aktivitas Antioksidan Metode 2,2-difenil-1-pikrilhidrazil (DPPH)
Pengujian aktivitas antioksidan dapat menggunakan metode DPPH
(2,2-difenil-1-pikrilhidrazil) yang merupakan metode serapan radikal. Metode ini sangat efektif
karena metodenya sederhana, mudah, dan menggunakan sampel dalam jumlah yang
sedikit dengan waktu yang singkat (Hanani 2005). Pengukuran aktivitas antioksidan
sampel dilakukan pada panjang gelombang 517 nm yang merupakan panjang
gelombang maksimum DPPH. Adanya aktivitas antioksidan dari sampel
mengakibatkan perubahan warna pada larutan DPPH dalam metanol yang semula
20
dari ekstrak dinyatakan dalam persentase inhibisinya terhadap radikal DPPH.
Persentase inhibisi ini didapatkan dari perbedaan serapan antara absorban DPPH
dengan absorban sampel yang diukur dengan spektrofotometer UV-Vis. Besarnya
aktivitas antioksidan ditandai dengan nilai IC50, yaitu konsentrasi larutan sampel yang
dibutuhkan untuk menghambat 50% radikal bebas DPPH.
Mekanisme penangkapan radikal DPPH oleh antioksidan cukup sederhana,
yaitu berupa donasi proton kepada radikal. Senyawa-senyawa yang memungkinkan
mendonasikan protonnya memiliki aktivitas penangkapan radikal cukup kuat.
Senyawa tersebut adalah golongan fenol, flavonoid, tanin, senyawa yang memiliki
banyak gugus sulfida, dan alkaloid. Donasi proton menyebabkan radikal DPPH
(berwarna ungu) menjadi senyawa non-radikal. Senyawa non-radikal DPPH tersebut
tidak berwarna. Aktivitas penangkapan radikal dapat dihitung dari peluruhan radikal
DPPH. Kadar radikal DPPH tersisa diukur secara spektrofotometri pada panjang
gelombang 517 nm (Blois. 1958; Munim et al. 2008). Mekanisme Donor proton pada uji DPPH dapat dilihat pada Gambar 5.
21
3. METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Waktu penelitian ini dilakukan pada bulan Juni 2009-November 2010.
Penelitian ini dilakukan di Balai Besar Riset Pengolahan Produk dan Bioteknologi
Kelautan dan Perikanan (BRP2BKP) Slipi, Jakarta. Proses penelitian ini dilakukan di
laboratorium pengolahan hasil perikanan untuk preparasi kepala udang dan ekstraksi
karotenoid, laboratorium kimia untuk uji proksimat kepala udang, laboratorium
bioteknologi untuk uji aktivitas enzim protease, dan laboratorium instrumen untuk
karakterisasi hasil ekstraksi seperti uji aktivitas antioksidan dan komposisi karotenoid
di Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan.
3.2 Bahan dan Alat
Penelitian ini menggunakan bahan yang terdiri dari bahan untuk proses
ekstraksi dan bahan analisis.
3.2.1 Bahan
Bahan yang digunakan dalam penelitian ini adalah limbah kepala udang, yang
diperoleh dari PT. Wirontono Baru, Jakarta. Limbah kepala udang diperoleh dalam
keadaan mentah kemudian dicuci dan disimpan dalam cold storage. Bahan lain yang
digunakan dalam proses ekstraksi adalah enzim papain, enzim pepsin, buffer sitrat
fosfat, Na2SO4,CHCl3, dan metanol. Bahan yang digunakan untuk analisis adalah
H2SO4, batu didih, folin ciocalteu, NaOH, H3BO3, HCl, larutan dietil eter, buffer
asam, dan basa serta akuades.
3.2.2 Alat
Alat-alat yang digunakan untuk penelitian ekstraksi karotenoprotein terdiri dari
beaker glass, magnetik stirrer, hot plate, mortar, dan corong pisah. Alat-alat yang digunakan untuk analisis adalah spektrofotometer UV (Shimadzhu), tabung Kjeldahl,
destruktor, labu takar, buret, cawan porselen, oven, desikator, labu lemak, alat
22
3.3 Tahapan Penelitian
Penelitian dilakukan dalam 2 bagian, yaitu penelitian pendahuluan dan
penelitian utama. Penelitian pendahuluan yaitu melakukan proses demineralisasi
menggunakan HCl dan penelitian utama adalah mengekstraksi karotenoid
menggunakan enzim papain dan enzim pepsin kemudian mengkarakterisasi hasil
ekstraksi sebagai antioksidan.
3.3.1 Penelitian pendahuluan
Penelitian pendahuluan ini dilakukan proses demineralisasi menggunakan HCl
yang berfungsi untuk mengurangi jumlah mineral, seperti kalsium. Kepala udang
yang mentah dibersihkan dan dicuci menggunakan air sampai bersih dan dikukus
sampai berubah warna kemerahan selama 10 menit. Proses demineralisasi dilakukan
dengan cara merendam kepala udang dengan menggunakan HCl pada konsentrasi 0;
0,75; 1,00, dan 1,25 M selama 30 menit dengan perbandingan 1:4 (b/v) (limbah
kepala udang : larutan HCl). Kepala udang yang telah direndam dalam HCl
kemudian dicuci menggunakan air bersih sampai pH netral kemudian dianalisis kadar
air, abu, protein, dan lemak. Proses demineralisasi kepala udang dapat dilihat pada
Gambar 6.
Gambar 6 Proses demineralisasi kepala udang (Turana 1997). Kepala udang
(Demineralisasi*)
Penambahan HCl (0; 0,75; 1,00 dan 1,25 M) (kulit udang : HCl (1:4), selama 30 menit
Pembersihan dan Pencucian
Pengukusan
23
3.3.2 Penelitian utama
Ekstraksi karotenoid dari kepala udang dilakukan menggunakan enzim papain
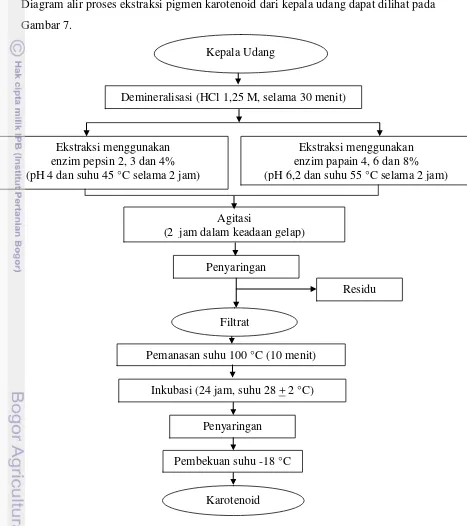
dan enzim pepsin yang merupakan modifikasi dari metode Babu et al. (2008). Diagram alir proses ekstraksi pigmen karotenoid dari kepala udang dapat dilihat pada
Gambar 7.
Gambar 7 Proses ekstraksi karotenoid dari kepala udang (Babu et al. 2008) Keterangan: = proses yang dilakukan, = bahan.
Kepala Udang
Pemanasan suhu 100 °C (10 menit)
Karotenoid Pembekuan suhu -18 °C Ekstraksi menggunakan
enzim pepsin 2, 3 dan 4% (pH 4 dan suhu 45 °C selama 2 jam)
Agitasi
(2 jam dalam keadaan gelap)
Demineralisasi (HCl 1,25 M, selama 30 menit)
Ekstraksi menggunakan enzim papain 4, 6 dan 8% (pH 6,2 dan suhu 55 °C selama 2 jam)
Penyaringan
Filtrat
Residu
Inkubasi (24 jam, suhu 28 + 2 °C)
24
Kepala udang diagitasi dalam larutan enzim papain menggunakan pelarut buffer
fosfat-sitrat dengan konsentrasi 4, 6, dan 8% (b/b) selama 2 jam (pH 6.2 dan suhu 55
°C) atau pepsin (pH 4 dan suhu 45 °C) menggunakan pelarut bufer fosfat-sitrat
dengan konsentrasi 2, 3, dan 4% (b/b) selama 2 jam. Larutan disaring menggunakan
penyaring yang berukuran pori 5-10 µm dan filtratnya dipanaskan selama 10 menit
pada suhu 100 °C dan didiamkan selama 24 jam pada suhu 28 + 2 °C, kemudian
filtrat disaring menggunakan kertas whatman 41 dan dibekukan pada suhu -18 °C.
Filtrat yang sudah beku kemudian freeze drying kering.
3.4 Prosedur Analisis
3.4.1 Analisis kadar air (AOAC 2000)
Sampel yang sudah homogen ditimbang 2 g dan diletakkan di dalam cawan kosong
yang sudah ditimbang beratnya, cawan dan tutupnya sudah dikeringkan di dalam oven
serta didinginkan di dalam desikator. Cawan yang berisi sampel kemudian ditutup dan
dimasukkan ke dalam oven dengan suhu 100 °C selama 5 jam atau sampai beratnya
konstan. Cawan lalu didinginkan di dalam desikator dan setelah dingin cawan
ditimbang. Kadar air dapat dihitung dengan rumus:
Kadar air (wet basis) (%) = 100%
W2 = berat sampel setelah dikeringkan (g)
3.4.2 Analisis kadar abu (AOAC 2000)
Sampel sebanyak 2 g dimasukkan ke dalam cawan pengabuan yang telah ditimbang
dan dibakar di dalam tanur serta didinginkan dalam desikator. Cawan yang berisi sampel
dimasukkan ke dalam tanur pengabuan dan dibakar sampai diperoleh abu berwarna
keabu-abuan. Suhu pemanasan dinaikkan secara bertahap sampai suhu mencapai 650 °C
dan dibiarkan selama 1 jam. Setelah suhu tungku pengabuan turun sekitar 200 °C, cawan
25
ditimbang beratnya. Perlakuan ini diulang sampai mencapai berat yang konstan. Kadar
abu dapat dihitung dengan rumus:
3.4.3 Analisis kadar lemak (AOAC 2000)
Labu lemak dikeringkan dalam oven, didinginkan dalam desikator kemudian
ditimbang. Sebanyak 5 g sampel dibungkus kertas saring, kemudian dimasukkan ke
dalam alat ekstruksi soxhlet. Pelarut lemak dituangkan secukupnya ke dalam labu lemak.
Refluks dilakukan selama minimum 5 jam sampai pelarut yang turun kembali ke dalam
labu lemak berwarna jernih. Pelarut yang ada di labu lemak tersebut didestilasi, labu yang
berisi hasil ekstraksi dipanaskan dalam oven pada suhu 100 ºC selama 60 menit atau
sampai beratnya tetap. Labu lemak yang telah didinginkan dalam desikator, lalu ditimbang
sampai memperoleh berat yang konstan. Berat lemak dapat dihitung dengan rumus:
%
3.4.4 Analisis kadar protein (AOAC 2000)
Penentuan kadar protein dilakukan dengan metode mikrokjeldahl. Sampel
ditimbang sebanyak 0,5 g, kemudian dimasukkan ke dalam labu destruksi,
ditambahkan kjeltab dan 10 mL H2SO4 pekat. Sampel didestruksi sampai terbentuk
larutan hijau bening. Larutan dibiarkan sampai dingin lalu dipindahkan ke dalam alat
destilasi. Labu kjeldahl dicuci menggunakan akuades kemudian larutan tersebut
dimasukkan ke dalam alat destilasi dan ditambahkan 20 mL NaOH pekat sampai
berwarna coklat kehitaman, kemudian didestilasi. Destilat ditampung ke dalam
erlenmeyer 125 mL yang berisi 10 mL H3BO3 4% dan 2 tetes indikator campuran
metilen merah dan metilen biru sampai berwarna hijau kebiruan, destilasi dihentikan
dan destilat dititrasi dengan HCl 0,02 N sampai berwarna merah muda. Larutan
26
3.4.5 Uji aktivitas enzim (Bergmeyer 1983)
Aktivitas enzim papain dan pepsin diuji berdasarkan jumlah tirosin yang
dibebaskan oleh substrat. Substrat kasein dan standar yang digunakan adalah tirosin.
Perlakuan penentuan suhu optimum papain maka larutan diinkubasi pada suhu 45, 50,
55, 60, dan 65 oC dengan pH buffer 6, sedangkan perlakuan penentuan suhu optimum
pepsin larutan diinkubasi pada suhu 35, 40, 45, 50, dan 55 °C dengan pH buffer 4,5.
Perlakuan penentuan pH optimum papain maka larutan diinkubasi dilakukan dengan
menggunakan pH buffer 5,8; 6,0; 6,2; 6,4; dan 6,6 dengan suhu optimum yang telah
diketahui sedangkan perlakuan penentuan pH optimum pepsin larutan diinkubasi
dengan menggunakan pH buffer 4,1; 4,3; 4,5; 4,7; dan 4,9 dengan suhu optimum
yang telah diketahui. Untuk setiap sampel yang dianalisis, harus disertai dengan
blanko dan standar, dengan perincian seperti pada Tabel 4.
Tabel 4 Uji aktivitas enzim
Pereaksi Sampel (ml) Blanko (ml) Standar (ml)
Buffer fosfat citrate (0,01 M) 1.0 1.0 1.0
Didiamkan pada suhu sesuai perlakuan selama 10 menit lalu disaring dengan kertas saring
Filtrat 1.50 1.50 1.50
Na2CO3 (0,4 M) 5.00 5.00 5.00
Pereaksi Folin 1.00 1.00 1.00
Didiamkan selama 20 menit pada suhu sesuai perlakuan
Diukur dengan spektrofotometer pada = 578 nm(enzim pepsin) dan = 650 nm (enzim papain).
27
Aktivitas total enzim dihitung berdasarkan jumlah tirosin yang dihasilkan per
mL enzim per menit dengan rumus sebagai berikut :
UA = (Asp-Abl) X P X 1/T
(Ast-Abl)
Keterangan :
UA = jumlah tirosin yang dihasilkan per mL enzim per menit Asp = nilai absorbansi sampel
Abl = nilai absorbansi blanko Ast = nilai absorbansi standar P = faktor pengenceran
T = waktu inkubasi (10 menit)
3.4.6 Analisis kadar protein enzim (Lowry et al. 1951)
Pembuatan kurva standar dilakukan dengan memasukkan larutan BSA kedalam
tabung reaksi dengan volume masing-masing 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9
dan 1,0 mL. Blanko dipersiapkan dengan membuat larutan tanpa protein standar.
Pada setiap tabung reaksi ditambahkan air hingga volume total 4 mL dan
5,5 mL pereaksi C, dicampur secara merata dan dibiarkan selama 10-15 menit pada
suhu kamar. Pada masing-masing tabung reaksi ditambahkan 0,5 pereaksi folin
ciocalteu, larutan dikocok merata dengan cepat sesudah penambahan. Larutan
dibiarkan selama lebih kurang 30 menit sampai warna biru terbentuk dan diukur
absorbansinya pada 750 nm, kemudian dibuat kurva standar.
3.4.7 Analisis total fenol dengan metoda folin-ciocalteu (Orak 2006)
Sampel sebanyak 0,3 g dilarutkan sampai 10 mL dengan metanol:air (1:1)
Larutan sampel dipipet 0,2 mL, ditambahkan 15,8 mL akuabidest, dan 1 mL reagen
Folin–Ciocalteu kemudian dikocok. Larutan didiamkan selama 8 menit dan
ditambahkan 3 mL Na2CO3 20% kemudian didiamkan selama 2 jam pada suhu
kamar. Sampel dianalisis menggunakan spektrofotometer UV-Vis pada panjang
gelombang serapan maksimum 765 nm yang akan memberikan komplek biru.
Larutan induk asam galat dibuat dengan menimbang 0,25 g asam galat, ditambahkan
5 mL etanol 96 %, dan ditambahkan akuabidest sampai 50 mL, sehingga diperoleh
28
konsentrasi 50, 100, 150, 200, 250, dan 300 mg/L asam galat. Larutan asam galat
ditambahkan 1 mL reagen Folin Ciocalteu lalu dikocok. Larutan didiamkan selama 8
menit tambah 3 mL larutan Na2CO3 dikocok sampai homogen kemudian didiamkan
selama 2 jam pada suhu kamar. Larutan diukur absorbansinya pada panjang
gelombang serapan maksimum 765 nm, lalu dibuat kurva kalibrasinya hubungan
antara konsentrasi asam galat (mg/L) dengan absorban.
3.4.8 Penentuan komposisi beta karoten (Zhao et al. 2004)
Kadar beta karoten ditentukan dengan metode HPLC. Sampel dielusi dengan
HPLC Shimadzu Liquid Chromatograph, kolom C18 15 cm x 4 mm, detector
UV-VIS Photodiode Array, dengan fasa gerak metanol : asetonitril : tetrahidrofuran (75:20:5) pada kecepatan alir 1,2 mL/menit. Eluen dimonitor menggunakan
spektrofotometer pada panjang gelombang 400 nm.
3.4.9 Penentuan komposisi astaxanthin (Lee et al. 1999)
Kadar astaxanthin ditentukan dengan menggunakan metode HPLC. Sampel
sebanyak 0,3 mL direaksikan dalam 5 mL aseton kemudian diinjeksikan dalam
HPLC melalui kolom ODS (25 cm X 4,6 mm dengan ukuran partikel 5µm).
Sampel dielusi menggunakan campuran metanol : diklorometan : asetonitril : air
(67,5:22,5:9,5:0,5) dengan daya alir 1 mL/mnt. Eluen dimonitor menggunakan
spektrofotometer pada panjang gelombang 450 nm.
3.4.10 Uji aktivitas antioksidan metode 2,2-difenil-1-pikrilhidrazil (DPPH) (Okawa 2001)
Ekstrak ditimbang sebanyak 10 mg, kemudian dilarutkan dengan 10 mL
metanol dalam labu ukur 10 mL, maka didapatkan konsentrasi 1 mg/mL.
Pengenceran dilakukan dengan menambahkan metanol sehingga diperoleh sampel
dengan konsentrasi (10, 30, 50, 70, 90 g/mL). Penentuan aktivitas antioksidan
masing-masing konsentrasi dipipet sebanyak 0,2 mL larutan sampel dengan pipet
29
50 M. Campuran dihomogenkan dan dibiarkan selama 30 menit ditempat gelap,
serapan diukur dengan spektrofotometer UV - Vis pada panjang gelombang 515 nm,
sebagai pembanding digunakan asam askorbat (konsentrasi 2,3,4,5,6 g/mL) dengan
perlakuan yang sama dengan sampel uji. Aktivitas antioksidan sampel ditentukan
oleh besarnya hambatan serapan radikal DPPH melalui perhitungan persentase
inhibisi serapan DPPH dengan menggunakan rumus :
Inhibisi (%) = 100%
A kontrol = Serapan radikal DPPH 50 M pada panjang gelombang 515 nm.
A Sampel = Serapan sampel radikal DPPH 50 M pada panjang gelombang 515 nm.
Aktivitas antioksidan juga dapat diekspresikan dalam ascorbic acid equivalent antioxidant capacity (AEAC) (Leong dan Shui 2002) menggunakan persamaan sebagai berikut :
Perhitungan IC50 atau inhibiton concentration berdasarkan pada persamaan berikut :
IC50 = IC50 askorbat / AEAC (mgAA /100 g)
100.000
3.5 Rancangan Percobaan dan Analisis Data
Pada penelitian ini variabel proses yang diduga berpengaruh terhadap kualitas
astaxanthin yang dihasilkan adalah konsentrasi HCl dan konsentrasi enzim. Pada
proses demineralisasi dicobakan HCl pada empat konsentrasi yaitu 0; 0,75; 1,00; dan
1,25 dengan tiga kali ulangan. Pada proses ekstraksi astaxanthin dicobakan dua jenis
enzim yaitu pepsin dengan tiga taraf konsentrasi yaitu 2, 3, dan 4% dan papain
dengan tiga taraf konsentrasi yaitu 4, 6, dan 8%. Ulangan dilakukan sebanyak tiga
30
pengaruh konsentrasi enzim adalah rancangan acak lengkap faktor tunggal dengan
model linier (Torrie & Steel 1995). Persamaan yang digunakan adalah:
Yij = µ + Ai + εij
Keterangan:
Yij = Respon percobaan karena pengaruh faktor A taraf ke-i, ulangan ke-j
= Nilai tengah umum atau rataan
Ai = Pengaruh taraf ke-i (i = 0; 0,75; 1,00; dan 1,25 M) atau (i = , 2, 3, dan 4%)
atau (i = 4, 6, dan 8%) dimana faktor A (A = Konsentrasi HCl atau enzim pepsin atau papain)
εij = Kesalahan percobaan karena pengaruh faktor ke-A taraf ke-i pada ulangan
ke-j (j= 1, 2, 3)
Jika hasil analisis berbeda nyata, dilanjutkan uji lanjut Tukey (w). Rumus yang
digunakan:
w = qα (p,fe)SY
Keterangan:
qα = (Ymaks– Ymin) / SY ;
fe = derajat bebas galat