PENILAIAN MPV DAN
AGGREGASI TROMBOSIT
PADA PENDERITA DIABETES MELLITUS TIPE 2
TESIS
MALAYANA RAHMITA NASUTION 08711013/PK
PROGRAM MAGISTER KLINIK-SPESIALIS ILMU PATOLOGI KLINIK
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
PENILAIAN MPV DAN AGREGASI TROMBOSIT PADA
PENDERITA DIABETES MELLITUS TIPE 2
T E S I S
Untuk memperoleh gelar Magister Kedokteran Klinik di Bidang
Ilmu Patologi Klinik / M. Ked (Clin.Path) pada Fakultas Kedokteran
Universitas Sumatera Utara
MALAYANA RAHMITA NASUTION
08711013/PK
PROGRAM MAGISTER KLINIK-SPESIALIS ILMU PATOLOGI KLINIK
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
Judul Tesis : Penilaian MPV dan Agregasi Trombosit pada Penderita Diabetes Mellitus Tipe 2
Nama Mahasiswa : Malayana Rahmita Nasution Nomor Induk Mahasiswa : 087111013
Program Magister : Magister Kedokteran Klinik Konsentrasi : Patologi Klinik
Menyetujui Komisi Pembimbing
Pembimbing I
Prof. dr. Adi Koesoema Aman, Sp.PK-KH
Pembimbing II
DR. Dr. Dharma Lindarto, Sp. PD-KEMD
Disahkan oleh :
Ketua Departemen Patologi Klinik Ketua Program Studi Departemen FK-USU/RSUP H. Adam Malik Patologi Klinik FK-USU/
Medan RSUP H. Adam Malik Medan
Prof. dr. Adi Koesoema Aman, Sp.PK-KH
NIP. 19491011 1979 01 1 001 NIP. 1948711 1979 03 2 001
Prof.DR.dr.Ratna Akbari Gani, Sp.PK-KH
Telah diuji pada
Tanggal : 17 Oktober 2013
PANITIA PENGUJI TESIS
Ketua : Prof. dr. Adi Koesoema Aman, Sp. PK-KH ...
Anggota : 1. Prof. DR. dr. Ratna Akbari Ganie, Sp.PK-KH ...
2. DR. dr. Dharma Lindarto, Sp. PD-KEMD ...
3. Prof. Herman Hariman, Ph.D, Sp. PK-KH ...
4. dr. Ricke Loesnihari, MKed (ClinPath), Sp.PK-K ...
UCAPAN TERIMA KASIH
Assalamualaikum Wr. Wb.
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya serta atas ridha-Nya sehingga penulis dapat menyelesaikan penulisan tesis ini. Tesis ini disusun untuk memenuhi persyaratan dan merupakan tugas akhir pendidikan Magister Kedokteran Klinik di bidang Ilmu Patologi Klinik pada Fakultas Kedokteran Universitas Sumatera Utara.
Selama penulis mengikuti pendidikan dan proses penyelesaian penelitian untuk karya tulis ini, penulis telah banyak mendapat bimbingan, petunjuk, bantuan dan pengarahan serta dorongan baik moril dan materil dari berbagai pihak sehingga penulis dapat menyelesaikan pendidikan dan karya tulis ini.
Penulis menyadari penelitian dan penulisan tesis ini masih jauh dari kesempurnaan sebagaimana yang diharapkan. Oleh sebab itu dengan segala kerendahan hati, penulis mengharapkan masukan yang berharga dari semua pihak untuk perbaikan di masa yang akan datang.
Pada kesempatan ini, perkenankanlah penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar – besarnya kepada :
1. Prof. dr. Adi Koesoema Aman, Sp. PK – KH selaku pembimbing dan Ketua Departemen Patologi Klinik FK USU yang telah memberikan bimbingan, bantuan serta saran – saran yang sangat berharga dalam pelaksanaan penelitian dan penyelesaian tesis ini.
2. Prof. DR. dr. Ratna Akbari Ganie, Sp.PK – KH sebagai Ketua Program Studi di Departemen Patologi Klinik FK USU yang telah memberikan bantuan dan masukan dalam pelaksanaan penelitian dan penyelesaian tesis ini.
4. Prof. dr. Herman Hariman, PhD, Sp.PK – KH selaku Sekretaris Departemen Patologi Klinik FK USU yang telah memberikan bimbingan, pengarahan, dan saran – saran selama saya mulai pendidikan sampai dengan selesainya penulis tesis ini.
5. dr. Ricke Loesnihari, M.Ked (Clin Path), Sp.PK(K) selaku Sekretaris Program Studi di Departemen Patologi Klinik FK USU yang telah memberikan bimbingan dan sumbangan pemikiran sehingga saya dapat menyelesaikan penelitian dan penulisan tesis ini.
6. Prof. dr. Burhanuddin Nasution, Sp.PK-KN, KGEH yang telah banyak memberikan bimbingan dan pengarahan selama pendidikan dan menyelesaikan penulisan tesis ini.
7. Rektor Universitas Sumatera Utara, Prof. DR. Dr. Syahril Pasaribu, DTM&H, MSc(CTM), Sp.A(K) yang telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan Magister Kedokteran Klinik di bidang Patologi Klinik dan Program Pendidikan Dokter Spesialis (PPDS) Patologi Klinik di FK USU.
8. Dekan FK USU, Prof. dr. Gontar A. Siregar, Sp.PD-KGEH, yang telah memberikan kesempatan kepada penulis untuk mengikuti pendidikan Magister Kedokteran Klinik di bidang Patologi Klinik dan PPDS Patologi Klinik di FK USU.
9. Direktur RSUP H. Adam Malik Medan yang telah memberikan kesempatan pada penulis untuk mengikuti pendidikan selama di rumah sakit.
10. Kepada para dosen saya dr. Muzahar, DMM, Sp.PK-K, (Alm) dr. Ardjuna, Sp.PK-K, dr. Zulfikar Lubis, Sp.PK-K, dr. Ozar Sahnuddin, Sp.PK-K, dr. Nelly E. Samosir, Sp.PK, dan dr. Ida Adhayanti, Sp.PK yang telah mengajarkan dan memberikan pengarahan selama saya mengikuti pendidikan dan penyelesaian tesis ini.
12. Seluruh teman sejawat PPDS Patologi Klinik FK USU beserta para analis di RSUP H. Adam Malik Medan yang telah banyak membantu dan mengajarkan saya, serta semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu dalam terlaksananya penelitian serta penulisan tesis ini.
13. Teristimewa kepada orang tua saya, Ibunda dan Ayahanda H. Siti Asmawati Lubis dan Prof. dr. Burhanuddin Nst, SpPK-KN, bapak dan ibu mertua saya drg. Eddy Anwar Ketaren, SpBM dan drg. Dewi Anggraini yang telah memberikan kasih sayang, motivasi, dukungan dan semangat kepada saya untuk terus belajar.
14. Kepada suami saya tercinta dr. Aga Shahri Putera Ketaren, SpOT yang telah mendampingi saya dengan penuh pengertian, perhatian dan kasih sayang, memberikan motivasi dan pengorbanan selama saya mengikuti pendidikan hingga saya menyelesaikan pendidikan ini. Juga untuk anak-anakku terkasih Ayla Afifah Hadya Ketaren dan Affan Ahmad Haadi Ketaren yang selalu menjadi penyejuk hati dalam suka dan duka.
15. Kepada abang saya dr. Syafrizal Amin Nst, dr. Andre Pasha Ketaren, SpJP, dan Iman Mahlil Lubis, ST, kakak saya dr. Iridha Wahyumi dan dr. Devira Zahara, SpTHT-KL dan adik-adik saya dr. Arfian Amin Nst, dr. Alia Namira Ketaren, dan Fahri Amin Nst yang senantiasa memberikan dukungan kepada saya. Kepada para keponakan saya, Aisyah, Sissy dan Khansa serta seluruh keluarga yang selalu mendoakan, memberikan dorongan, motivasi cinta dan kasih sayang, bantuan moril dan materil selama penulis mengikuti pendidikan ini.
Semoga Allah SWT senantiasa melimpahkan kasih sayang dan karunia-Nya kepada kita semua dan segala budi baik yang telah diberikan mendapatkan balasan yang setimpal dari Allah yang Maha Kuasa.
Akhirnya penulis mengharapkan semoga penelitian dan tulisan ini bermanfaat bagi kita semua. Amin, Wassalamualaikum Wr. Wb.
DAFTAR ISI
Lembar Pengesahan Tesis ... i
Lembar Penetapan Panitia Penguji ... ii
Ucapan Terima Kasih ... iii
Daftar Isi ... Daftar Singkatan ... vi
Daftar Gambar ... vii
Daftar Tabel ... viii
Daftar Lampiran ... ix
Abstrak ... x
BAB 1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Hipotesis Penelitian ... 3
1.4. Tujuan Penelitian 1.4.1. Tujuan Umum ... 3
1.4.2. Tujuan Khusus ... 3
1.5. Manfaat Penelitian 1.5.1. Bidang Penelitian ... 4
1.5.2. Bidang Akademik ... 4
1.5.3. Untuk Peneliti ... 4
BAB 2. TINJAUAN PUSTAKA
2.1. Diabetes Mellitus
2.1.1. Defenisi ... 5
2.1.5.3. Peningkatan produksi glukosa hepatik dan lipid ... 11
2.1.6. Komplikasi ... 12
2.2. Trombosit 2.2.1. Produksi Trombosit ... 14
2.2.2. Morfologi ... 14
2.2.3. Fungsi Trombosit ... 15
2.2.4. Pembentukan Sumbat Trombosit ... 16
2.2.4.1. Adhesi Trombosit ... 16
2.2.4.2. Aggregasi Trombosit ... 17
2.2.4.3. Reaksi Pembebasan ... 18
2.2.4.4. Aktifitas Prokoagulan Trombosit ... 19
2.2.4.5. Aggregasi Trombosit Ireversibel ... 20
2.2.5. Trombosit pada Diabetes Mellitus ... 20
2.3. Tes Fungsi Trombosit ... 23
2.3.1. Light Transmission Aggregometer (LTA) ... 23
2.3.1.1. Prinsip Pemeriksaan ... 23
2.3.1.2. Variabel Pemeriksaan Aggregasi Trombosit ... 26
2.3.1.2.1. Venapuncture ... 26
2.3.1.2.3. Tabung Kaca vs Tabung Plastik ... 27
2.3.1.2.4. Koreksi Jumlah Trombosit ... 27
2.3.1.2.5. Kontaminasi Sel Darah Merah, Hemolisis dan Lipemia ... 28
2.3.1.2.6. Fibrinogen ... 28
2.3.1.2.7. pH ... 28
2.3.1.2.8. Suhu ... 28
2.3.1.2.9. Kecepatan Putaran Aggregasi ... 29
2.3.1.2.10. Batasan Waktu pada Aggregasi Trombosit ... 29
2.3.1.3. Agonis ... 30
2.3.1.4. Obat-obatan yang Mempengaruhi Aggregasi Trombosit ... 32
2.3.2. Mean Platelet Volume (MPV) ... 35
2.3.3. Kerangka Teori ... 36
BAB 3. METODOLOGI PENELITIAN 3.1. Desain Penelitian ... 37
3.2. Tempat dan Waktu Penelitian ... 32
3.3. Populasi dan Sampel Penelitian ... 32
3.4. Sampel Penelitian 3.4.1. Cara Pengambilan Sampel Penelitian ... 37
3.4.2. Besar Sampel ... 37
3.5. Kriteria Penelitian 3.5.1. Kriteria Inklusi ... 38
3.6. Identifikasi Variabel
3.6.1. Variabel Bebas ... 39
3.6.2. Variabel Terikat ... 39
3.7. Kerangka Konsep ... 39
3.8. Definisi Operasional ... 39
3.9. Cara Kerja 3.9.1. Pengambilan Sampel ... 41
3.9.2. Pengolahan dan Pemeriksaan Sampel ... 41
3.9.3. Pemantapan Kualitas ... 43
3.10. Masalah Etika (Ethical Clearance) dan Persetujuan Setelah Penjelasan (Informed Consent) ... 45
3.11. Rencana Pengolahan dan Analisis Data ... 45
3.12. Kerangka Kerja ... 46
BAB 4. HASIL PENELITIAN ... 47
BAB 5. PEMBAHASAN 5.1 Karakteristik Subjek Penelitian ... 51
5.2 Korelasi MPV dengan Aggregasi Trombosit pada Kelompok Diabetes Mellitus Tipe 2 Terkontrol ... 52
BAB 6. KESIMPULAN DAN SARAN
6.1 Kesimpulan ... 54 6.2 Saran ... 54
DAFTAR SINGKATAN
DM : Diabetes Mellitus
HSP : Hexosamine Synthesis Pathway
ADP : Adenosine Diphosphate
LTA : Light Transmission Aggregometer
MPV : Mean Platelet Volume
OGTT : Oral Glucose Tolerance Test ADA : American Diabetes Association
IGT : Impaired Glucose Tolerance
AGE : Advanced Glycation End Product VLDL : Very Low Density Lipoprotein
GP : Glikoprotein
PRP : Platelet-rich Plasma
PPP : Platelet-poor Plasma
DAFTAR GAMBAR
Gambar 2.1. Skema Sederhana Jalur Sintesis Hexosamine ... 9
Gambar 2.2. Patofisiologi Diabetes Mellitus Tipe 2 ... 11
Gambar 2.3. Komplikasi Diabetes Mellitus Tipe 2 ... 13
Gambar 2.4. Gambaran Skematik Morfologi Trombosit ... 15
Gambar 2.5. Fungsi Normal Trombosit ... 16
Gambar 2.6. Mekanisme Terjadinya Disfungsi Endotel pada Diabetes Mellitus ... 22
Gambar 2.7. Respon Trombosit yang Diukur dalam Cuvette Aggregometer ... 24
Gambar 2.8. Perhitungan Persentasi Aggregasi Trombosit ... 25
Gambar 2.9. Tahapan Aggregasi Trombosit ... 25
DAFTAR TABEL
Tabel 2.1. Kriteria Diagnosa untuk Diabetes ... 8
Tabel 3.1 Scale Set Aggregasi Trombosit ... 44
Tabel 4.1 Data Demografi Berdasarkan Jenis Kelamin ... 47
Tabel 4.2 Karakteristik Subjek Penelitian ... 48
Tabel 4.3 Korelasi MPV dengan Aggregasi Trombosit pada Kelompok DM Tipe 2 Terkontrol ... 49
DAFTAR LAMPIRAN
Lampiran 1 Lembar Penjelasan Kepada Calon Subjek Penelitian Lampiran 2 Formulir Data Pasien
Lampiran 3 Lembar Persetujuan Setelah Penjelasan Lampiran 4 Ethical Clearence
PENILAIAN MPV DAN AGGREGASI TROMBOSIT PADA PENDERITA
DIABETES MELLITUS TIPE 2
Malayana R. Nst,(1)
1
Departemen Patologi Klinik, Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik Medan
Adi Koesoema Aman,(1) Dharma Lindarto,(2)
2
Departemen Ilmu Penyakit Dalam Divisi Endokrinologi, Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik Medan
ABSTRAK
Objektif: Mengetahui perbedaan nilai MPV dan aggregasi trombosit pada penderita DM tipe 2 terkontrol dan tidak terkontrol.
Metode: Penelitian dilakukan secara potong lintang pada 22 orang penderita DM tipe 2 terkontrol dan 28 orang penderita DM tipe 2 tidak terkontrol periode Juni hingga Agustus 2013. Sampel darah puasa diperiksa darah lengkap, HbA1c, TG, dan aggregasi trombosit.
Hasil: Nilai MPV pada kelompok DM tipe 2 terkontrol dan tidak terkontrol tidak berbeda bermakna (p=0,598), begitu juga nilai aggregasi trombosit dengan konsentrasi ADP 1µM, 2µM, 5µM, dan 10µM, dengan nilai p secara berurutan p=0,464, p=0,868, p=0,984 dan p=0,401. MPV berkorelasi bermakna dengan aggregasi trombosit di konsentrasi ADP 1µM dan 5µM pada kelompok DM tipe 2 terkontrol (r=0,591; p=0,004 untuk ADP 1µM dan r=0,521; p=0,013 untuk ADP 5µM). MPV berkorelasi bermakna dengan aggregasi trombosit di konsentrasi ADP 2µM pada kelompok DM tipe 2 tidak terkontrol (r=0,405; p=0,033).
Kesimpulan: Tidak dijumpai perbedaan bermakna antara nilai MPV dan aggregasi trombosit pada kelompok DM tipe 2 terkontrol dibanding tidak terkontrol. Terdapat hubungan bermakna antara MPV dengan aggregasi trombosit pada kelompok DM tipe 2 terkontrol.
MPV AND PLATELET AGGREGATION IN DIABETES MELLITUS TYPE 2
Malayana Rahmita Nasution,(1)(1) Department of Clinical Pathology, School of Medicine, University of Sumatera Utara/ H.Adam Malik Medan Hospital
Adi Koesoema Aman,(1) Dharma Lindarto,(2)
(2) Department of Internal Medicine, School of Medicine, University of Sumatera Utara/ H.Adam Malik Medan Hospital
ABSTRACT
Background: Diabetes mellitus patients often have hypercoagilable blood, as evidenced by the increased coagulation, impaired fibrinolysis, endothelial dysfunction and platelet hyperactivity. Hyperactive platelet is a major determinant of prothrombotic state in DM. By assessing MPV and platelet aggregation, which is a marker of platelet activity, in patients with type 2 DM, is expected to help predict acute events.
Objective : This research aims to know the differences of MPV and aggregation platelet between poor glycemic control and good glycemic control group in type 2 DM patients.
Methods: This cross sectional study was conducted in 22 people with good glycemic control and 28 people with poor glycemic control from June to August 2013. Fasting blood samples were analyzed for CBC, HbA1c, TG and platelet aggregation. MPV and platelet aggregation value were compared between groups using independent t-test.
Results: there is no significant difference in MPV and platelet aggregation between groups (p=0,598, p=0,464 (1µM), p=0,868 (2µM), p=0,984 (5µM), p=0,401 (10µM)). MPV correlate significantly with platelet aggregation at 1µM and 5µM ADP concentration in good glycemic control group (r=0,591; p=0,004 at 1µM ADP dan r=0,521; p=0,013 at 5µM ADP). MPV correlate significantly with platelet aggregation at 2µM ADP concentration in poor glycemic control group (r=0,405; p=0,033).
Conclusion: There was significant differences in MPV and platelet aggregation between groups, but there is a significant correlation between MPV and platelet aggregation in good glycemic control type 2 DM group.
PENILAIAN MPV DAN AGGREGASI TROMBOSIT PADA PENDERITA
DIABETES MELLITUS TIPE 2
Malayana R. Nst,(1)
1
Departemen Patologi Klinik, Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik Medan
Adi Koesoema Aman,(1) Dharma Lindarto,(2)
2
Departemen Ilmu Penyakit Dalam Divisi Endokrinologi, Fakultas Kedokteran Universitas Sumatera Utara/RSUP H. Adam Malik Medan
ABSTRAK
Objektif: Mengetahui perbedaan nilai MPV dan aggregasi trombosit pada penderita DM tipe 2 terkontrol dan tidak terkontrol.
Metode: Penelitian dilakukan secara potong lintang pada 22 orang penderita DM tipe 2 terkontrol dan 28 orang penderita DM tipe 2 tidak terkontrol periode Juni hingga Agustus 2013. Sampel darah puasa diperiksa darah lengkap, HbA1c, TG, dan aggregasi trombosit.
Hasil: Nilai MPV pada kelompok DM tipe 2 terkontrol dan tidak terkontrol tidak berbeda bermakna (p=0,598), begitu juga nilai aggregasi trombosit dengan konsentrasi ADP 1µM, 2µM, 5µM, dan 10µM, dengan nilai p secara berurutan p=0,464, p=0,868, p=0,984 dan p=0,401. MPV berkorelasi bermakna dengan aggregasi trombosit di konsentrasi ADP 1µM dan 5µM pada kelompok DM tipe 2 terkontrol (r=0,591; p=0,004 untuk ADP 1µM dan r=0,521; p=0,013 untuk ADP 5µM). MPV berkorelasi bermakna dengan aggregasi trombosit di konsentrasi ADP 2µM pada kelompok DM tipe 2 tidak terkontrol (r=0,405; p=0,033).
Kesimpulan: Tidak dijumpai perbedaan bermakna antara nilai MPV dan aggregasi trombosit pada kelompok DM tipe 2 terkontrol dibanding tidak terkontrol. Terdapat hubungan bermakna antara MPV dengan aggregasi trombosit pada kelompok DM tipe 2 terkontrol.
MPV AND PLATELET AGGREGATION IN DIABETES MELLITUS TYPE 2
Malayana Rahmita Nasution,(1)(1) Department of Clinical Pathology, School of Medicine, University of Sumatera Utara/ H.Adam Malik Medan Hospital
Adi Koesoema Aman,(1) Dharma Lindarto,(2)
(2) Department of Internal Medicine, School of Medicine, University of Sumatera Utara/ H.Adam Malik Medan Hospital
ABSTRACT
Background: Diabetes mellitus patients often have hypercoagilable blood, as evidenced by the increased coagulation, impaired fibrinolysis, endothelial dysfunction and platelet hyperactivity. Hyperactive platelet is a major determinant of prothrombotic state in DM. By assessing MPV and platelet aggregation, which is a marker of platelet activity, in patients with type 2 DM, is expected to help predict acute events.
Objective : This research aims to know the differences of MPV and aggregation platelet between poor glycemic control and good glycemic control group in type 2 DM patients.
Methods: This cross sectional study was conducted in 22 people with good glycemic control and 28 people with poor glycemic control from June to August 2013. Fasting blood samples were analyzed for CBC, HbA1c, TG and platelet aggregation. MPV and platelet aggregation value were compared between groups using independent t-test.
Results: there is no significant difference in MPV and platelet aggregation between groups (p=0,598, p=0,464 (1µM), p=0,868 (2µM), p=0,984 (5µM), p=0,401 (10µM)). MPV correlate significantly with platelet aggregation at 1µM and 5µM ADP concentration in good glycemic control group (r=0,591; p=0,004 at 1µM ADP dan r=0,521; p=0,013 at 5µM ADP). MPV correlate significantly with platelet aggregation at 2µM ADP concentration in poor glycemic control group (r=0,405; p=0,033).
Conclusion: There was significant differences in MPV and platelet aggregation between groups, but there is a significant correlation between MPV and platelet aggregation in good glycemic control type 2 DM group.
BAB 1
PENDAHULUAN
1.1.
LATAR BELAKANG
Diabetes merupakan kelainan metabolisme dari karbohidrat, protein
dan lemak yang dihasilkan dari kurangnya ketersediaan insulin atau
penurunan efek biologis dari insulin.1 Diabetes mellitus (DM) tipe 2 menggambarkan kondisi hiperglikemia yang menyertai defisiensi insulin
relatif daripada mutlak.2,3
Dengan bertambah majunya suatu negara, terjadi perubahan pada
lingkungan yang meningkatkan prevalensi obesitas dan menurunkan tingkat
aktivitas masyarakat, menyebabkan meningkatnya prevalensi DM tipe 2.4,5 Di dunia prevalensi DM meningkat secara dramatis, diperkirakan > 360 juta
orang akan menderita diabetes pada tahun 2030.5 Indonesia diperkirakan menjadi peringkat keenam pada tahun 2030 dengan jumlah penderita
diabetes dewasa sebanyak 12 juta orang, dengan penderita terbanyak berada
pada rentang usia 40-60 tahun.7 Menurut Riskesda 2007 DM menempati urutan ketiga dari penyebab kematian di Indonesia.8
Kematian pada pasien DM terutama disebabkan oleh komplikasi
aterotrombotik yang mempengaruhi percabangan arteri koroner, serebral
dan perifer.9 Pasien-pasien diabetes sering memiliki darah yang
hypercoagulable, terbukti dengan meningkatnya koagulasi, gangguan fibrinolisis, disfungsi endotel dan hiperaktifitas trombosit.10-12 Penyimpangan ini menurunkan ambang koagulasi dalam sirkulasi arteri
dimana trombus-trombus penghambat menyebabkan kerusakan organ
hipoksik. Maka, terlihat jelas bahwa trombosit yang hiperaktif merupakan
salah satu penentu utama dari keadaan pretrombotik pada diabetes
Aktifitas trombosit dapat dinilai dengan menggunakan tes fungsi
trombosit. Salah satu tes fungsi trombosit yang sudah banyak digunakan
adalah light transmission aggregometry (LTA) yang mengukur aggregasi trombosit pada, dan juga merupakan gold standard dari tes fungsi trombosit.14,15
Aggregasi trombosit terhadap ADP meningkat pada penderita
diabetes. Persentase aggregasi trombosit pada penderita DM dengan
komplikasi klinis lebih tinggi daripada pasien tanpa komplikasi.16 Gϋven dkk mengatakan bahwa aggregasi trombosit yang diinduksi oleh ADP lebih
tinggi pada penderita DM tipe 2 daripada individu sehat (P < 0.05).17
Namun, pemeriksaan aggregasi trombosit menggunakan LTA hanya
bisa dilakukan di laboratorium tertentu dan pengerjaannya membutuhkan
waktu dan kerja intensif, darah segar dan kemampuan untuk
menginterpretasikan.18,19 Karena itu, dibutuhkan pemeriksaan yang lebih sederhana, mudah dan murah yang dapat menggambarkan fungsi trombosit.
Pada tahun 1996, Bath dkk mengatakan bahwa volume trombosit
merupakan penanda dari aktifasi dan fungsi trombosit.20 Demikian juga dengan penelitian selanjutnya oleh Bancroft dkk pada tahun 2000,
mengatakan bahwa volume trombosit merupakan penanda dan mungkin
penentu dari fungsi trombosit karena trombosit besar lebih aktif daripada
trombosit berukuran normal.21 Dikatakan juga bahwa volume trombosit yang diukur dengan mean platelet volume (MPV) meningkat pada keadaan tertentu dengan faktor resiko pembuluh darah, seperti hiperkolesterolemia
dan diabetes mellitus.20
Volume trombosit yang dinilai melalui pemeriksaan mean platelet volume (MPV) merupakan pemeriksaan sederhana, mudah dan murah yang dapat digunakan untuk memprediksi kejadian akut.22
Beberapa penelitian terdahulu melaporkan nilai MPV lebih tinggi
pada pasien diabetes daripada pasien non-diabetes, dan diantara pasien
diabetes nilai MPV lebih tinggi pada pasien dengan komplikasi
kontrol kadar gula darah yang buruk berhubungan dengan meningkatnya
komplikasi mikro- dan makrovaskular dari diabetes.25 Di tahun 2009, Demirtunc dkk melaporkan terdapat hubungan antara kontrol kadar gula
darah yang buruk dengan meningkatnya aktifitas trombosit pada pasien DM
tipe 2.26
Di Indonesia terutama di Medan, belum ada penelitian yang
memeriksa nilai MPV sebagai penanda aktifitas trombosit pada
pasien-pasien DM tipe 2. Untuk itu peneliti membandingkan nilai MPV dengan
aggregasi trombosit pada penderita DM tipe 2 terkontrol dan tidak
terkontrol.
1.2.
RUMUSAN MASALAH
Dengan memperhatikan latar belakang di atas, dapat dirumuskan
masalah penelitian sebagai berikut: “Apakah ada perbedaan nilai MPV
dengan aggregasi trombosit pada penderita DM tipe 2 terkontrol dan tidak
terkontrol?”
1.3.
HIPOTESIS PENELITIAN
Ada perbedaan nilai MPV pada penderita DM tipe 2 dengan kadar
gula darah terkontrol dan tidak terkontrol.
1.4.
TUJUAN PENELITIAN
1.4.1. Tujuan UmumMengetahui perbedaan nilai MPV dengan aggregasi trombosit
pada penderita DM tipe 2 terkontrol dan tidak terkontrol.
1.4.2. Tujuan Khusus
1.4.2.1. Mengetahui perbedaan nilai MPV pada penderita DM tipe 2
1.4.2.2. Mengetahui perbedaan persentasi aggregasi trombosit pada
penderita DM tipe 2 terkontrol dan tidak terkontrol.
1.4.2.3. Melihat korelasi antara nilai MPV dengan persentasi
aggregasi trombosit pada penderita DM tipe 2 terkontrol.
1.4.2.4. Melihat korelasi antara nilai MPV dengan persentasi
aggregasi trombosit pada penderita DM tipe 2 tidak
terkontrol.
1.5.
MANFAAT PENELITIAN
1.5.1. Bidang PenelitianHasil penelitian diharapkan dapat menjadi data dasar tentang
pemeriksaan aggregasi trombosit pada penderita DM tipe 2 di kota
Medan, sehingga dapat dipakai pada penelitan selanjutnya.
1.5.2. Bidang Akademik
Dengan adanya penelitian ini diharapkan dapat memberikan
wawasan dan sumbangan kemajuan ilmu pengetahuan khususnya
tentang pemahaman pemeriksaan aggregasi trombosit pada penderita
DM tipe 2.
1.5.3. Untuk Peneliti
Penelitian ini diharapkan dapat dipakai sebagai sarana untuk
melatih cara berpikir dan membuat suatu penelitian berdasarkan
metodologi yang baik dan benar dalam proses pendidikan.
1.5.4. Untuk Masyarakat
Diharapkan dengan mengetahui nilai MPV pada penderita DM
tipe 2 terkontrol dan tidak terkontrol maka, pemeriksaan ini mungkin
dapat dipakai sebagai penanda aktifitas trombosit mungkin dapat
BAB 2
TINJAUAN PUSTAKA
2.1.
DIABETES MELLITUS
2.1.1. DefenisiDiabetes mellitus merupakan kelainan metabolisme dari
karbohidrat, protein dan lemak yang dihasilkan dari kurangnya
ketersediaan insulin atau penurunan efek biologis dari insulin, yang
ditandai dengan hiperglikemia.1,2,5
Diabetes mellitus tipe 2, yang merupakan 90-95% dari
populasi diabetes, meliputi individual yang mengalami resistensi
insulin disertai defisiensi insulin relatif.2
2.1.2. Klasifikasi
Klasifikasi dari diabetes meliputi empat golongan klinis:3,5 1. Diabetes tipe 1
Destruksi sel-β, umumnya menjurus ke defisiensi insulin
absolute.
A. Immune-mediated
B. Idiopathic
2. Diabetes tipe 2
Bervariasi mulai dari resisten insulin dominan disertai
defisiensi insulin relative hingga kurangnya sekresi insulin
disertai dengan resistensi insulin.
3. Diabetes tipe lain
A. Defek genetik sel-β pancreas
C. Penyakit-penyakit dari eksokrin pancreas (seperti cystic
fibrosis)
D. Endokrinopati (akromegali, Cushing’s syndrome,
glucagonoma, pheochromocytoma, hyperthyroidism,
somatostatinoma, aldosteronoma)
E. Akibat obat-obatan atau zat kimia (seperti pada
pengobatan AIDS atau setelah transplantasi organ)
F. Infeksi (rubella kongenital, cytomegalovirus, coxsackie)
G. Diabetes imunologis yang jarang (“stiff-person” syndrome, anti-insulin reseptor antibodi)
H. Sindroma lainnya yang terkadang berkaitan dengan
diabetes (Down’s syndrome, Klinefelter’s syndrome,
Turner’s syndrome, Wolfram’s syndrome, Huntington’s
chorea, Laurence-Moon-Biedl syndrome, myotonic
dystrophy, porphyria, Prader-Willi syndrome)
4. Diabetes mellitus gestational (GDM)
2.1.3. Epidemiologi
Prevalensi DM di dunia telah meningkat drastis selama dua
dekade terakhir, dari perkiraan 30 juta kasus pada tahun 1985
menjadi 177 juta kasus di tahun 2000. Berdasarkan kecenderungan
ini, > 360 juta orang diperkirakan akan menderita diabetes pada
tahun 20305,7. Indonesia merupakan negara kedelapan dengan
jumlah penderita diabetes dewasa terbanyak di dunia pada tahun
2010, dan diperkirakan menjadi peringkat keenam pada tahun 2030
dengan jumlah penderita diabetes dewasa sebanyak 12 juta orang,
dengan penderita terbanyak berada pada rentang usia 40-60 tahun.7 Menurut Riskesda 2007 prevalensi DM di Indonesia adalah 5,7%,
dengan jumlah kasus sebanyak 84.473 kasus, dan angka kematian
akibat penyakit tidak menular meningkat menjadi 60%, dimana DM
2.1.4. Diagnosis
Selama beberapa dekade, diabetes didiagnosis berdasarkan
kriteria glukosa plasma, baik glukosa plasma puasa atau nilai 2-h 75-g oral 75-glucose tolerance test (OGTT). Pada tahun 1997, kriteria diagnostik direvisi oleh Expert Committee on the Diagnosis and
Classification of Diabetes Mellitus dengan mengobservasi hubungan
antara kadar glukosa dan munculnya retinophaty. Analisis itu menghasilkan nilai diagnostik yang baru yaitu ≥126 mg/dl (7.0
mmol/l) untuk glukosa plasma puasa dan ditegaskan dengan nilai
glukosa plasma 2 jam setelah puasa ≥200 mg/dl (11.1 mmol/l).
Dengan semakin terstandarisasinya pemeriksaan HbA1C dan
hasilnya yang dapat diterapkan pada seluruh populasi, maka ADA
menyetujui untuk menggunakan HbA1C sebagai tes untuk
mendiagnosa DM dengan nilai ≥6.5% (tabel 1).3
Tabel 2.1. Kriteria Diagnosa untuk Diabetes3
1. A1C ≥6.5%. Pemeriksaan harus dilakukan di laboratorium mengunakan metode yang disertifikasi oleh NGSP dan sesuai standar
pemeriksaan DCCT.*
2. Glukosa Plasma Puasa ≥126 mg/dl (7.0 mmol/l). Puasa didefinisikan dengan tidak ada intake kalori selama minimal 8 jam.*
3. Glukosa Plasma Dua-jam ≥200 mg/dl (11.1 mmol/l) dengan OGTT. Pemeriksaan harus dilakukan sesuai ketetapan WHO, menggunakan glukosa yang setara dengan 75 g glukosa anhydrous yang dilarutkan
dalam air.
4. Pasien dengan gejala klasik dari hiperglikemia atau krisis hiperglikemik, glukosa plasma random ≥200 mg/dl (11.1 mmol/l).
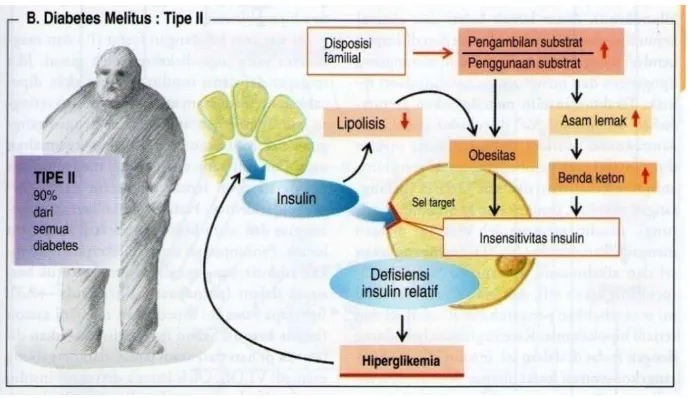
2.1.5. Patofisiologi
DM tipe 2 dikarakteristikkan dengan sekresi insulin yang
terganggu, resistensi insulin, produksi glukosa hepatik yang
berlebihan, dan metabolisme lemak abnormal.1,5 Sebagian besar pasien diabetes mellitus tipe 2 memiliki berat badan berlebih.5,27 Obesitas terjadi karena disposisi genetik, asupan makanan yang
terlalu banyak, dan aktifitas fisik yang terlalu sedikit.4,5,27 Ketidakseimbangan antara suplai dan pengeluaran energi
meningkatkan konsentrasi asam lemak di dalam darah, akan
menurunkan penggunaan glukosa di otot dan jaringan lemak.27 Pada tahap awal, toleransi glukosa akan tetap mendekati-normal,
meskipun resistensi insulin, karena sel beta pancreas
mengimbanginya dengan meningkatkan produksi insulin. Seiring
dengan berkembangnya resistensi insulin dan kompensasi
hiperinsulinemia, sel-sel beta pancreas pada individu tertentu tidak
dapat mempertahankan kondisi hiperinsulinemia. Impaired Glucose Tolerance (IGT), ditandai dengan meningkatnya glukosa
postprandial, akan berkembang. Penurunan sekresi insulin dan peningkatan produksi glukosa hepatik memicu timbulnya diabetes
dengan hiperglikemia puasa. Akhirnya, kegagalan sel beta dapat
terjadi.5
2.1.5.1. Metabolisme Abnormal
Resistensi insulin, menurunnya kemampuan insulin
untuk bekerja pada jaringan target (terutama otot, hati dan
lemak), merupakan ciri yang menonjol dari DM tipe 2 dan
dihasilkan dari kombinasi disposisi genetic dan obesitas.
Resistensi insulin mengurangi penggunaan glukosa oleh
glukosa hepatic; efek keduanya menimbulkan
hiperglikemia.1,5
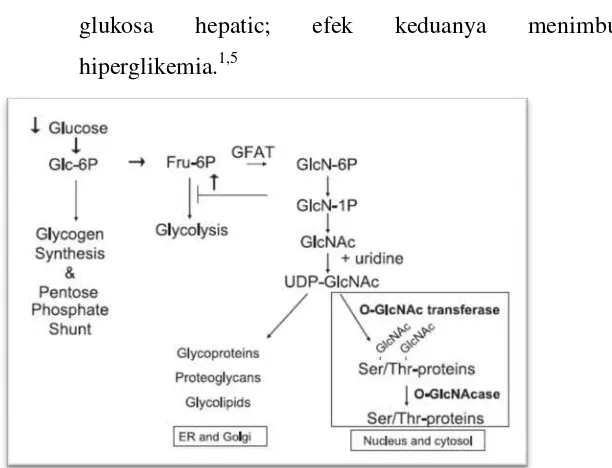
Gambar 2.1. Skema sederhana jalur sintesis hexosamine. Panah hitam menunjukkan bahwa
aliran kedalam jalur sintesis dapat ditingkatkan dengan meningkatkan glukosa yang masuk
atau menghambar glikolisis.6
Mekanisme tepat bagaimana timbulnya resistensi
insulin pada DM tipe 2 belum dapat dijelaskan. Beberapa
laboratorium mengusulkan bahwa jalur sintesis hexosamine
(HSP) berperan dalam perkembangan resistensi insulin dan
komplikasi vaskular pada diabetes. Pada sistem ini terjadi
modifikasi protein posttranslational, dimana
N-acetylgalactosamine (GlcNAc) diubah menjadi O-linkage
(O-GlcNAc), yang bagian modifikasinya (O
-GlcNAcylation) berdekatan dengan bagian posporilasi,
menunjukkan adanya fungsi regulasi. Fungsi signifikan dari
O-GlcNAcylation telah dilaporkan pada beberapa protein, termasuk pada insulin receptor substrates (IRS)-1 dan 2
juga mungkin pada GLUT4. Modifikasi reversibel inilah
yang diusulkan oleh banyak peneliti sebagai mekanisme
yang menyebabkan peningkatan aktifitas HSP dapat
Obesitas pada DM tipe 2 juga merupakan bagian dari
proses patogenik. Meningkatnya massa adipocyte
menyebabkan meningkatnya jumlah asam lemak bebas dan
produk sel lemak lainnya yang bersirkulasi. Selain
mengatur berat badan, selera makan, dan pengeluaran
energy, adipokines (sitokin jaringan lemak) juga mengatur sensitivitas insulin. Peningkatan produksi asam lemak bebas
dan beberapa adipokines dapat menyebabkan resistensi insulin pada otot rangka dan hati. Dengan kata lain, asam
lemak bebas mengurangi penggunaan glukosa di otot
rangka, memicu produksi glukosa oleh hati, dan merusak
fungsi sel beta. Sebaliknya, produksi adiponectin (peptide
peka-insulin) oleh adipocyte menurun pada obesitas dan
berkontribusi pada terjadinya resistensi insulin hepatik.
Produk-produk adipocyte dan adipokines juga menciptakan keadaan inflamasi dan dapat menjelaskan kenapa penanda
inflamasi seperti IL-6 dan C-reaktive protein sering meningkat pada DM tipe 2.1,5
2.1.5.2. Sekresi Insulin Berkurang
Sekresi dan sensitifitas insulin saling berhubungan.
Pada DM tipe 2, sekresi insulin awalnya meningkat sebagai
respon terhadap resistensi insulin untuk mempertahankan
toleransi glukosa yang normal. Awalnya, defek sekresi
insulin ringan dan hanya melibatkan sekresi insulin yang
distimulasi glukosa. Akhirnya, defek sekresi insulin
berlanjut ke tahap dimana sekresi insulin sangat tidak
adekuat.1,5
Alasan menurunnya kapasitas sekresi insulin pada DM
tipe 2 masih belum jelas. Asumsinya adalah terdapat defek
insulin—menuju pada kegagalan sel beta. Lingkungan
metabolik diabetes juga memiliki pengaruh negatif terhadap
fungsi islet. Contohnya, hiperglikemia kronis akan
melemahkan fungsi islet (“glucose toxicity”) dan
memperburuk hiperglikemia. Perbaikan kontrol glikemik
berhubungan dengan perbaikan fungsi islet. Dan juga, peningkatan jumlah asam lemak bebas (“lipotoxicity”) dan lemak makanan dapat juga memperburuk fungsi islet. Massa sel beta menurun pada individu dengan DM tipe 2
yang telah berlangsung lama.1,5
2.1.5.3. Peningkatan Produksi Glukosa Hepatik dan Lipid
Pada DM tipe 2, resistensi insulin di hati
menggambarkan kegagalan hiperinsulinemia untuk
menekan glukoneogenesis. Akibat resistensi insulin di
jaringan lemak dan obesitas, aliran asam lemak bebas dari
adipocyte meningkat, menyebabkan meningkatnya sintesa
lemak [very low density lipoprotein (VLDL) dan
trigliserida] di hati.5,27
2.1.6. Komplikasi
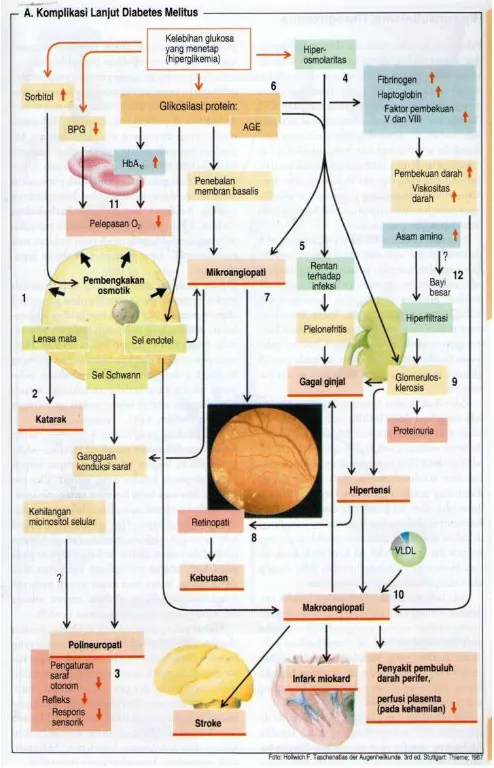
Kelainan metabolik pada defisiensi insulin yang tidak diterapi
secara adekuat akan menyebabkan perubahan yang luas dan
ireversibel di dalam tubuh.27
Di dalam sel glukosa direduksi menjadi sorbitol dan tidak
dapat melalui membrane sel. Penumpukan sorbitol di dalam sel
menyebabkan pembengkakan sel (A1), di lensa mata hal ini akan
menimbulkan katarak (A2), pada sel Schwann dan neuron akan
mengurangi konduksi saraf (polineuropati), terutama system saraf
otonom, reflex dan fungsi sensorik (A3).27
Sel yang tidak dapat mengambil cukup glukosa akan menyusut
akibat hiperosmolaritas ekstrasel (A4), fungsi sel limposit yang
menyusut akan terganggu dan tubuh rentan terhadap infeksi (A5).27 Hiperglikemi meningkatkan pembentukan protein plasma yang
mengandung gula, seperti fibrinogen, haptoglobin, macroglobulin-α2
serta factor pembekuan V-VIII (A6), yang meningkatkan viskositas
darah sehingga meningkatkan resiko trombosis.27
Glycoprotein, atau dikenal juga sebagai glikosilasi lanjut
produk akhir (AGE) merupakan komponen normal yang ada di
membrane basalis pembuluh darah kecil dan kapiler. Peningkat
konsentrasi glukosa intraseluler yang dihubungkan dengan kadar
gula darah yang tidak terkontrol pada diabetes mendukung
pembentukan AGEs.1 Penumpukan AGEs ini menyebabkan
gangguan struktur membrane basalis dengan penurunan
permeabilitas dan penyempitan lumen (A7).1,27 Pada retina
menyebabkan timbulnya retinopati (A8), di ginjal akan terjadi
glomerulosklerosis yang menyebabkan proteinuria, penurunan laju
filtrasi glomerulus akibat kehilangan glomerulus, hipertensi dan
Bersama dengan peningkatan VLDL, peningkatan viskositas
darah, dan hipertensi mendorong terjadinya makroangiopati
(A10).5,27
Akhirnya, glukosa dapat bereaksi dengan hemoglobin (HbA)
untuk membentuk HbA1C, yang peningkatan konsentrasinya di
dalam darah menunjukkan keadaan hiperglikemia yang telah
berlangsung lama. HbA1C memiliki afinitas yang tinggi terhadap
oksigen, sehingga sukar melepas oksigen di perifer (A11). Defisiensi
insulin yang menetap selanjutnya menyebabkan penurunan
konsentasi 2,3-bifosfogliserat (BPG), sehingga memperkuat afinitas
2.2. TROMBOSIT
2.2.1. Produksi Trombosit
Trombosit, dihasilkan dari megakariosit sumsum tulang,
sebuah sel raksasa yang memiliki 8-32 inti hasil dari pembelahan inti
tanpa disertai pembelahan sel,2 yang memiliki ukuran 1-2µm.10
Prekursor megakariosit, megakarioblast, muncul melalui
proses diferensiasi dari sel induk hemopoetik. Megakariosit
mengalami pematangan dengan replikasi inti endomitotik yang
sinkron, memperbesar volume sitoplasma sejalan dengan
penambahan lobus inti menjadi kelipatan duanya. Pada berbagai
stadium dalam perkembangannya (paling banyak pada stadium inti
delapan), sitoplasma menjadi granular dan trombosit dilepaskan.
Produksi trombosit mengikuti pembentukan mikrovesikel dalam
sitoplasma sel yang menyatu membentuk membrane pembatas
trombosit. tiap sel megakariosit menghasilkan 1000-1500 trombosit.
Sehingga diperkirakan akan dihasilkan 35.000/ul trombosit per hari.
Interval waktu semenjak diferensiasi sel induk sampai produksi
trombosit berkisar sekitar 10 hari.2,28,29
Trombopetin adalah pengatur utama produksi trombosit,
dihasilkan oleh hati dan ginjal. Trombopetin meningkatkan jumlah
dan kecepatan maturasi megakariosit.2,30,31
Jumlah trombosit normal adalah sekitar 250 x 109/l (rentang 150-400 x 109/l) dan lama hidup trombosit yang normal adalah 7-10 hari. Hingga sepertiga dari trombosit produksi sumsum tulang dapat
terperangkap dalam limpa yang normal, tetapi jumlah ini meningkat
menjadi 90% pada kasus splenomegali berat.2,30,32
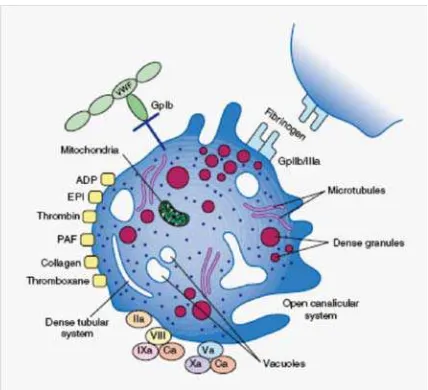
2.2.2. Morfologi
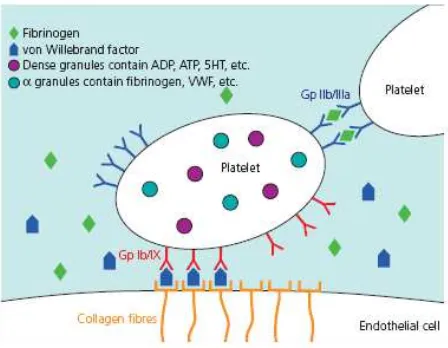
Glikoprotein permukaan sangat penting dalam reaksi adhesi
dan agregasi trombosit. Adhesi pada kolagen difasilitasi oleh
perlekatan trombosit pada von Willebrand factor (VWF) dan
subendotel vascular. Reseptor IIb/IIIa juga merupakan reseptor
untuk fibrinogen yang penting dalam agregasi trombosit.30,31,32
Membran plasma berinvaginasi ke bagian dalam trombosit
untuk membentuk suatu sistem membrane (kanalikular) terbuka yang
menyediakan permukaan reaktif yang luas tempat protein koagulasi
plasma diabsorbsi secara selektif. Fosfolipid membran (faktor
trombosit 3) sangat penting dalam konversi faktor X menjadi Xa dan
protrombin (faktor II) menjadi thrombin (faktor IIa).30,31,32
Di bagian dalam trombosit terdapat kalsium, nukleotida
(terutama ADP, ATP dan serotonin) yang terkandung dalam granula
padat. Granula alfa mengandung antagonis heparin, faktor
pertumbuhan (PDGF), β-tromboglobulin, fibrinogen, vWF. Organel spesifik lain meliputi lisosom yang mengandung enzim hifrolitik,
dan peroksisom yang mengandung katalase. Selama reaksi
pelepasan, isi granula dikeluarkan ke dalam sistem kanalikular.30,31,32
2.2.3. Fungsi Trombosit
Fungsi utama trombosit adalah pembentukan sumbat mekanik
selama respon hemostasis normal terhadap cedera vascular. Tanpa
trombosit, dapat terjadi kebocoran darah spontan melalui pembuluh
darah kecil. Reaksi trombosit berupa adhesi, sekresi, agregasi dan
fusi serta aktivitas prokagulannya sangat penting untuk
fungsinya.32,33,34
2.2.4. Pembentukan Sumbat Trombosit
Agar dapat terjadi hemostasis primer yang normal, dan agar
trombosit memenuhi tugasnya membentuk sumbat trombosit inisial,
maka harus terdapat trombosit dalam jumlah memadai di dalam
sirkulasi, dan trombosit tesebut harus berfungsi normal. Fungsi
hemostasis normal memerlukan peran serta trombosit yang
berlangsung secara teratur, yang penting dalam pembentukan sumbat
hemostatik primer. Hal ini melibatkan, pada awalnya, adhesi
trombosit, agregasi trombosit dan akhirnya reaksi pembebasan
trombosit disertai rekrutmen trombosit lain.32,34-38
Gambar 2.5. Fungsi normal trombosit.39
2.2.4.1. Adhesi Trombosit
Setelah cedera pembuluh darah, trombosit melekat pada
jaringan ikat subendotel yang terbuka. Trombosit menjadi
aktif apabila terpajan ke kolagen subendotel dan bagian
jaringan yang cedera. Adhesi trombosit melibatkan suatu
jaringan yang terpajan atau cedera. Adhesi trombosit
bergantung pada faktor protein plasma yang disebut faktor
von Willebrand, yang memiliki hubungan yang integral dan
kompleks dengan faktor koagulasi antihemofilia VIII
plasma dan reseptor trombosit yang disebut glikoprotein Ib
membrane trombosit. Adhesi trombosit berhubungan
dengan peningkatan daya lekat trombosit sehingga
trombosit berlekatan satu sama lain serta dengan endotel
atau jaringan yang cedera. Dengan demikian, terbentuk
sumbat hemostatik primer atau inisial. Pengaktifan
permukaan trombosit dan rekrutmen trombosit lain
menghasilkan suatu massa trombosit lengket dan
dipermudah oleh proses agregasi trombosit.33,34,40,41
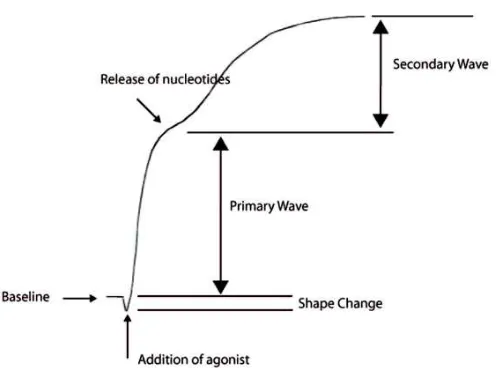
2.2.4.2. Aggregasi Trombosit
Agregasi adalah kemampuan trombosit melekat satu
sama lain untuk membentuk suatu sumbat. Agregasi awal
terjadi akibat kontak permukaan dan pembebasan ADP dari
trombosit lain yang melekat ke permukaan endotel. Hal ini
disebut gelombang agregasi primer. Kemudian, seiring
dengan makin banyaknya trombosit yang terlibat, maka
lebih banyak ADP yang dibebaskan sehingga terjadi
gelombang agregasi sekunder disertai rekrutmen lebih
banyak trombosit. Agregasi berkaitan dengan perubahan
bentuk trombosit dari discoid menjadi bulat. Gelombang
agregasi sekunder merupakan suatu fenomena ireversibel,
sedangkan perubahan bentuk awal dan agregasi primer
masih reversible.33,34,40,41
In vitro, agregasi dapat dipicu dengan reagen ADP,
thrombin, epinefrin, serotonin, kolagen atau antibiotik
Agregasi in vitro juga terjadi dalam dua fase; aggregasi
primer atau reversible dan agregasi sekunder atau
ireversibel.
Pengikatan ADP yang dibebaskan dari trombosit aktif
ke membrane trombosit akan mengaktifkan enzim
fosfolipase, yang menghidrolisis fosfolipid di membrane
trombosit untuk menghasilkan asam arakidonat. Asam
arakidonat adalah precursor mediator kimiawi yang sangat
kuat baik pada agregasi maupun inhibisi agregasi yang
terlibat dalam jalur prostaglandin. Melalui proses ini, asam
arakidonat diubah di sitoplasma trombosit oleh enzim
siklooksigenase menjadi endoperoksida siklik, PGG2 dan
PGH2. Stimulator kuat untuk agregasi trombosit, senyawa
tromboksan A2, dihasilkan oleh kerja enzim tromboksan
sintetase pada berbagai endoperoksidase siklik ini.
Tromboksan A2 adalah senyawa yang sangat aktif, tetapi
tidak stabil yang mengalami penguraian menjadi
tromboksan B2 yang stabil dan inaktif. Tromboksan A2
juga merupakan vasokonstriktor kuat yang akan mencegah
pengeluaran darah lebih lanjut dari pembuluh yang
rusak.33,34,40,41
2.2.4.3. Reaksi Pembebasan
Pemajanan kolagen atau kerja thrombin menyebabkan
sekresi isi granul trombosit yang meliputi ADP, serotonin,
fibrinogen, enzim lisosom, β-tromboglobulin dan factor trombosit 4. Kolagen dan thrombin mengaktifkan sintesis
prostaglandin trombosit. Terjadi pelepasan diasilgliserol
(yang mengaktifkan fosforilasi protein melalui protein
kalsium intrasel) menyebabkan terbentuknya tromboksan
A2.33,34,41
Agregasi primer melibatkan perubahan bentuk
trombosit dan disebabkan oleh kontraksi mikrotubulus.
Gelombang agregasi trombosit sekunder melibatkan
terutama pelepasan mediator-mediator kimiawi yang
terdapat di dalam granula padat. Pelepasan ini melengkapi
fungsi utama ketiga trombosit, yaitu reaksi pembebasan.
Reaksi pembebasan diperkuat oleh peningkatan kalsium
intrasel, yang semakin mengaktifkan dan meningkatkan
pembebasan tromboksan A2. Tromboksan A2 memperkuat
agregasi trombosit serta mempunyai aktivitas vasokonstriksi
yang kuat. Reaksi pelepasan dihambat oleh zat-zat yang
meningkatkan kadar cAMP trombosit, salah satunya adalah
prostasiklin (PGI2) yang disintesis oleh sel endotel
vascular. Prostasiklin merupakan inhibitor agregasi
trombosit yang kuat dan mencegah deposisi trombosit pada
endotel vascular normal.33,34,41
2.2.4.4. Aktifitas Prokoagulan Trombosit
Setelah agregasi trombosit dan reaksi pelepasan,
fosfolipid membrane yang terpajan (factor trombosit 3)
tersedia untuk 2 jenis reaksi dalam kaskade koagulasi.
Kedua reaksi yang diperantarai fosfolipid ini bergantung
pada ion kalsium. Reaksi pertama (tenase) melibatkan
faktor IXa, VIIIa dan X dalam pembentukan faktor Xa.
Reaksi kedua (protrombinase) menghasilkan pembentukan
thrombin dari interaksi factor Xa, Va dan protrombin.
Permukaan fosfolipid membentuk cetakan yang ideal untuk
konsentrasi dan orientasi protein-protein tersebut yang
2.2.4.5. Aggregasi Trombosit Ireversibel
Konsentrasi ADP yang tinggi, enzim yang dilepaskan
selama reaksi pelepasan dan protein kontraktil trombosit
menyebabkan fusi yang irreversible pada trombosit yang
beragregasi [ada lokasi cedera vascular. Trombin juga
mendorong terjadinya fusi trombosit, dan pembentukan
fibrin memperkuat stabilitas sumbat trombosit yang
terbentuk.34,36,41
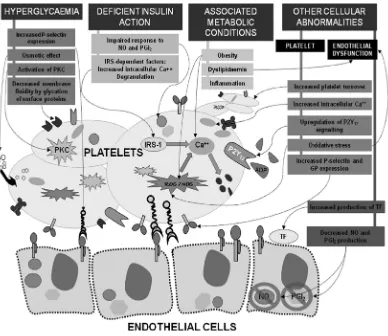
2.2.5. Trombosit pada Diabetes Mellitus
Gangguan fungsi trombosit pada pasien dengan DM dapat
disebabkan oleh beberapa mekanisme, seperti hiperglikemia,
defisiensi insulin, kondisi metabolik yang menyertai, dan
abnormalitas seluler lainnya. Hiperglikemia dapat meningkatkan
reaktifitas trombosit melalui glikasi protein permukaan trombosit
(mengganggu aliran membrane dan oleh karena itu meningkatkan
adhesi trombosit), mengaktifkan protein kinase C (mediator aktifasi
trombosit), merangsang ekspresi P-selectin (protein adhesi
permukaan) dan efek osmotiknya. Defisiensi insulin juga memegang
peranan penting dalam gangguan fungsi trombosit melalui
mekanisme berbeda, yaitu yang tergantung sindroma resistensi
insulin (IRS-dependent), seperti meningkatnya konsentrasi kalsium
intraseluler yang mempercepat degranulasi trombosit dan aggregasi
trombosit, dan faktor lain yang tidak tergantung IRS, seperti
terganggunya respon terhadap NO dan PGI2, yang meningkatkan
reaftifitas trombosit. Kondisi metabolic yang sering menyertai DM
juga berperan pada hiperreaktifitas trombosit, termasuk obesitas,
dislipidemia, dan meningkatnya inflamasi sistemik. Obesitas, juga
berperan dalam disfungsi trombosit, terutama dalam adhesi dan
sitosolik. Abnormalitas profil lemak, khususnya trigliserida, juga
mempengaruhi reaktifitas trombosit melalui mekanisme yang
berbeda, termasuk merangsang terjadinya disfungsi endotel.
Disfungsi endotel merupakan karakteristik DM, yang meningkatkan
reaktifitas trombosit dengan menurunkan produksi NO dan PGI2 dan
memicu timbulnya keadaan prothrombotic melalui peningkatan produksi tissue factor (TF). Pasien dengan DM menunjukkan abnormalitas trombosit lainnya yang dapat meningkatkan adhesi dan
aktifasi trombosit, seperti: meningkatnya ekspresi protein permukaan
(P-selectin dan GP IIb/IIIa), bertambahnya konsentrasi kalsium
sitosolik, meningkatnya signalling P2Y12, meningkatnya turnover
trombosit, dan oxidative stress, yang memicu produksi berlebihan oksigen dan nitrogen reaktif.10 Aktifasi dari jalur nuclear transcription factor- κB (NF-κB) juga menyebabkan perubahan
fungsi endotel kearah prothrombotic, yang bersama dengan
gangguan metabolisme trombosit dan perubahan jalur sinyal
intratrombosit, menyebabkan terjadinya komplikasi aterothrombotic
pada DM.42
Telah diterima secara umum bahwa pada diabetes distribusi
volume trombosit perifer melebar dan bergeser kea rah trombosit
yang lebih besar.43 Trombosit yang lebih besar dan lebih muda dianggap lebih reaktif. Distribusi volume trombosit (biasa diukur
sebagai mean platelet volume) berkorelasi positif dengan jumlah reseptor glikoprotein trombosit (GPIb dan GPIIb/IIIa) pada
membrane trombosit, kapasitas sintesa tromboxan dan kandungan
granul trombosit dari berbagai protein spesifik trombosit.44 Hal ini dianggap mencerminkan sistem megakariosit-trombosit yang aktif
dan meningkatnya turnover. Megakariosit bereaksi terhadap perubahan lingkungan seperti dyslipoproteinemia. Karenanya,
ketidakseimbangan endokrin pada DM sepertinya berperan penting.
kultur, yang mengindikasikan kemungkinan pengaruh insulin pada
siklus endomitotik megakariosit.43
Gambar 2.6. Mekanisme Terjadinya Disfungsi Trombosit Pada Diabetes
Mellitus.9
Penelitian sistem megakariosit-trombosit pada saat diabetes timbul
dan pada kondisi penggunaan insulin jangka panjang pada tikus
dewasa, menunjukkan peningkatan rekrutmen sel-sel progenitor
bersama dengan konsumsi megakariosit matang dengan ploid yang
lebih tinggi merupakan penjelasan terjadinya peningkatan ukuran
dan jumlah, juga ekspresi GPIIb/IIIa, pada onset diabetes dan setelah
terapi insulin. Percepatan maturasi megakariosit, bersama dengan
dilepasnya sejumlah besar trombosit besar, mencerminkan efek
2.3. TES FUNGSI TROMBOSIT
Tes fungsi trombosit dimulai dengan dilakukannya bleeding time in
vivo oleh Duke pada tahun 1910,45 dan masih dianggap sebagai tes penyaring fungsi trombosit yang paling bermanfaat hingga awal tahun
1990-an.46-48 Selama 10-15 tahun terakhir ini, penggunaan bleeding time sudah semakin menurun karena telah diketahui keterbatasannya dan
berkembangnya tes penyaring lain yang tidak terlalu invasive.49-50
Pada tahun 1960-an ditemukan alat pengukur aggregasi trombosit
(light transmission aggregometry [LTA]) yang kemudian merubah cara
identifikasi dan diagnosis dari kelainan hemostasis primer.51,53 LTA masih dianggap sebagai gold standard untuk pemeriksaan fungsi trombosit dan, dengan menambahkan agonis dalam beberapa konsentrasi berbeda pada
trombosit yang diaduk (stirred), memungkinkan untuk mendapatkan banyak
informasi dari berbagai aspek yang berbeda pada fungsi dan biokimia
trombosit.15
Walaupun LTA telah menjadi gold standard yang tidak tergantikan untuk mendiagnosis kelainan-kelainan yang berkaitan dengan trombosit,
juga diketahui dengan baik bahwa LTA tidak menggambarkan fungsi
trombosit seperti pada kondisi invivo dengan akurat, dan penggunaannya
masih terbatas pada laboratorium-laboratorium umum. Meskipun banyak
peneliti yang telah menggunakan flow chambers dan mikroskop untuk
mempelajari perilaku trombosit pada keadaan yang menyerupai kondisi in
vivo, tes ini masih terbatas pada laboratorium khusus tertentu saja dan tidak
ideal untuk digunakan sebagai tes rutin. Hal ini, ditambah dengan
kekurangan LTA dan bleeding time, membuka jalan untuk berkembangnya
model alat pengukur aggregasi trombosit yang mudah digunakan.15
2.3.1. Light Transmission Aggregometer (LTA) 2.3.1.1. Prinsip Pemeriksaan
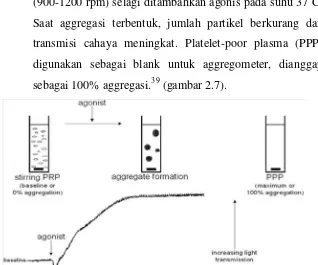
Tahun 1962 O`Brien dan Born menemukan instrument
turbidimetri45, dan memanfaatkan prinsip bahwa absorben dari suatu suspensi tergantung pada jumlah partikel bukan
ukuran. Darah sodium sitrat diputar menggunakan
centrifuge berkecepatan rendah (850g selama 3 menit atau
100g selama 10 menit) untuk mendapatkan platelet-rich plasma (PRP) yang dianggap sebagai 0% aggregasi. PRP kemudian dipindahkan ke cuvet dengan stirrer dan diaduk
(900-1200 rpm) selagi ditambahkan agonis pada suhu 370C. Saat aggregasi terbentuk, jumlah partikel berkurang dan
transmisi cahaya meningkat. Platelet-poor plasma (PPP)
digunakan sebagai blank untuk aggregometer, dianggap
sebagai 100% aggregasi.39 (gambar 2.7).
Gambar 2.7. Respon trombosit yang diukur dalam cuvette aggregometer53
Untuk mengukur persentasi aggregasi yang terjadi,
jarak antara baseline dan 100% aggregasi (B) diukur dan
dibandingkan dengan jarak antara baseline dengan
amplitudo maksimum yang terbentuk (A). Pembagian nilai
A dengan B merupakan persentasi maksimal aggregasi
Gambar 2.8. Perhitungan persentasi aggregasi trombosit.54
Agonis yang berbeda akan menghasilkan pola agregasi
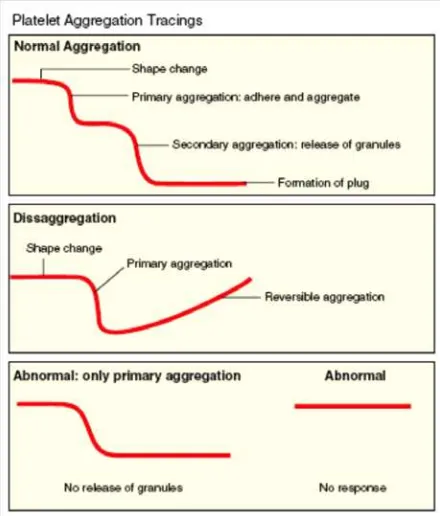
yang berbeda. Pola agregasi yang tercatat merupakan kurva
waktu vs optical density (OD), yang dapat memperlihatkan lag phase, shape phase, dan gelombang pertama dan kedua
dari proses aggregasi (gambar 2.9).55
Pola aggregasi trombosit dikenal dengan istilah respon
primer trombosit yang timbul akibat penambahan agonis
eksogen seperti ADP, diikuti oleh respon sekunder yang
timbul dari pelepasan adenine nukleotida yang terdapat
dalam dense granul trombosit. Respon tersebut dikenal
sebagai gelombang pertama dan kedua (gambar 2.10).54 Respon bifasik ini dapat tidak terlihat pada
penambahan agonis konsentrasi tinggi.53
Gambar 2.10. Pola biphasic pada aggregasi trombosit.54
2.3.1.2. Variabel Pemeriksaan Aggregasi Trombosit 2.3.1.2.1. Venapuncture
Pengambilan sampel darah pada orang dewasa
dianjurkan untuk menggunakan jarum dengan
ukuran 18-20G, sedang pada anak-anak
menggunakan jarum berukuran 23-25G.
Pengambilan sampel menggunakan syringe
lebih dianjurkan dari vacutainer.54 Peningkatan respon terhadap ADP dosis rendah dijumpai
2.3.1.2.2. Antikoagulan
Antikoagulan yang sesuai untuk pemeriksaan
aggregasi trombosit adalah sodium sitrat (0,102
M, 0,129 M sitrat buffered atau non buffered) dengan rasio perbandingan 9 bagian darah
dengan 1 bagian antikoagulan.53,54 Sodium sitrat 0,1 M buffered lebih dianjurka untuk digunakan
karena dapat membantu mempertahankan pH,
terutama jika sampel harus menunggu 1-2 jam
sebelum dikerjakan.54
2.3.1.2.3. Tabung Kaca vs Tabung Plastik
Pemeriksaan aggregasi trombosit harus
menggunakan tabung plastik atau tabung kaca
yang dilapisi silikon. Tabung kaca yang tidak
dilapisi akan menyebabkan aktivasi platelet, dan
akhirnya mempengaruhi hasil.54
2.3.1.2.4. Koreksi Jumlah Trombosit
Ada beberapa pendapat yang berbeda mengenai
perlu atau tidaknya menstandarisasi jumlah
trombosit pada PRP yang digunakan untuk
pemeriksaan aggregasi trombosit.53,54,56 Karena telah dilaporkan bahwa variasi respon aggregasi
berhubungan dengan jumlah trombosit,
perbandingan respon aggregasi pada pasien
yang berbeda atau pada penelitian multicenter
mengharuskan adanya standarisasi jumlah
trombosit.56 Biasanya pemeriksaan aggregasi trombosit dilakukan pada jumlah trombosit
2.3.1.2.5. Kontaminasi Sel Darah Merah, Hemolisis dan Lipemia
Pemeriksaan aggregasi trombosit dilakukan
berdasarkan transmisi optikal, adanya partikel
kontaminan, seperti sel darah merah, atau lemak
dapat mempengaruhi kemampuan aggregometer
untuk mengukur aggregasi trombosit dan dapat
menyebabkan menurunnya persentasi aggregasi.
Sel darah merah yang lisis akan melepaskan
ADP, yang dapat menyebabkan trombosit
refrakter pada penambahan ADP eksogem53,54
2.3.1.2.6. Fibrinogen
Aggregasi trombosit membutuhkan fibrinogen
untuk dapat terjadi. Kadar fibrinogen yang
terlalu rendah atau fibrinogen dengan struktur
yang abnormal dapat menghambat aggregasi
trombosit.54
2.3.1.2.7. pH
Pemeriksaan aggregasi trombosit sebaiknya
dilakukan pada pH 7,2-7,4. Bila pH plasma
turun hingga 6,4 maka tidak akan terjadi
aggregasi, demikian juga bila ph meningkat
hingga diatas 8,0 maka akan terjadi aggregasi
spontan. Disarankan untuk menyimpan plasma
trombosit pada tabung yang bertutup.53,54
2.3.1.2.8. Suhu
Pemeriksaan aggregasi trombosit dilakukan
vivo, sedangakan untuk penyimpanannya
sebelum dilakukan pemeriksaan dianjurkan
pada suhu ruangan.53,54
2.3.1.2.9. Kecepatan Putaran Aggregasi
Agar aggregasi terjadi, trombosit harus kontak
satu sama lain. Jika agonis ditambahkan pada
trombosit yang tidak diputar, maka trombosit
hanya akan teraktifasi namun tidak
beraggregasi. Kecepatan putaran yang optimal
pada setiap alat diperhitungkan berdasarkan
tinggi kolom PRP, diameter kuvet, dan ukuran
batangan pemutar yang digunakan.53,54
2.3.1.2.10. Batasan Waktu Pada Aggregasi Trombosit
Trombosit membutuhkan waktu satu jam
”istirahat” setelah persiapan PRP untuk
mendapatkan respon stabil pada ketiga
konsentrasi (2, 5, 10 µM) dari agonis ADP yang
digunakan pada pemeriksaan aggregasi.
Kestabilan respon trombosit ini akan bertahan
selama 3 jam, kemudian akan mulai menghilang
dimulai dari konsentrasi ADP yang paling
rendah. Karena itu direkomendasikan untuk
menyelesaikan pemeriksaan aggregasi dalam
waktu kurang dari 3 jam setelah persiapan PRP
dilakukan.53
2.3.1.3. Agonis
Penambahan agonis trombosit pada PRP menyebabkan
ke spiny sphere yang berkaitan dengan peningkatan sementara dari optical density. Pengecualian terjadi pada
epinephrine dimana tidak dijumpai adanya perubahan
bentuk dan ristocetin yang menyebabkan agglutinasi
trombosit bukannya aggregasi.56
Terdapat dua tipe agonis: agonis kuat (kolagen,
trombin, TxA2) yang langsung menyebabkan terjadi-nya
aggregasi, sintesa TxA2 dan sekresi granul trom-bosit, dan
agonis lemah (ADP & epinephrine) yang menyebabkan
terjadinya aggregasi tanpa sekresi. 56
Agonis yang sering digunakan antara lain:
1. ADP
Konsentrasi ADP 1-10 µM sering digunakan pada
pemeriksaan aggregasi trombosit. Konsentrasi rendah
ADP dapat menghasilkan kurva tunggal (monophasic)
ataupun biphasic. Pada konsentrasi rendah ikatan
fibrinogen bersifat reversibel dan trombosit akan
disaggregasi. Konsentrasi ADP yang lebih tinggi
(10-20 µM) dapat menutupi respon biphasic yang
ditimbulkan oleh pelepasan ADP endogen. Aspirin
akan menghambat respon aggregasi ADP yang terlihat
pada konsentrasi rendah, akibat dihambatnya jalur
siklooksigenase dan pelepasan isi granul.53,54,56
2. Epinephrine
Pada pemeriksaan aggregasi trombosit konsen-trasi
epinephrine yang paling sering dipakai adalah 5-10
µM. Biasanya, respon pertama yang muncul berupa
gelombang kecil, terkadang diikuti oleh gelombang
oleh aspirin, NSAIDs, antihistamin, dan beberapa
antibiotik.53,54,56 Epinephrin merupakan agonis yang paling tidak konsisten dari keseluruhan agonis yang
sering digunakan.53,54 Apabila abnor-malitas hanya terlihat pada agonis epinephrine, maka akan meragukan
untuk menegakkan diagnosis kelainan berdasarkan
hasil tersebut.54
3. Kolagen
Kolagen merupakan agonis yang paling kuat,
konsentrasi yang biasa dipakai adalah 1-5 µg/mL.
Aggregasi yang diinduksi kolagen menunjukkan lag phase selama 1 menit, ketika trombosit melekat pada fibril kolagen dan mengalami perubahan bentuk dan
kemudian pelepasan. Respon aggregasi yang diukur
adalah gelombang kedua yang merupakan lanjutan dari
peristiwa aktifasi dan pelepasan trombosit. Pada
kolagen konsentrasi rendah, respon aggregasi dihambat
oleh aspirin dan anti trombosit lainnya.53,54,56
4. Ristocetin
Pada keadaan trombosit normal dan jumlah antigen von
Willebrand faktor cukup, antibiotik ristocetin dengan
konsentrasi 1,5 mg/mL, menyebabkan agglutinasi
trombosit GPIb/VWF-dependent. Bila dijumpai respon abnormal maka kemungkinan penyakit von Willebrand
atau sindrom Bernard-Soulier (kekurangan kompleks
5. α-thrombin
Merupakan agonis yang sangat kuat, namun pada
sediaan PRP, α-trombin akan memotong fibrinogen dan menuntun terjadinya pembentukan bekuan. Konsentrasi
α-trombin 0,1-0,5 U/mL dapat digunakan untuk
mengaktifasi platelet yang dipersiapkan melalui proses
pencucian dan gel-filtered.53,54
6. Asam Arakidonat
Asam arakidonat direaksikan dengan siklooksigenase,
akan dikonversikan menjadi thromboxane A2, agonis
trombosit yang kuat. Aspirin menghambat
siklooksigense dan akan menghambat aggregasi
trombosit yang diinduksi oleh asam arakidonat. Pasien
yang mengkon-sumsi aspirin atau memiliki gangguan
pelepasan intrinsik atau Glanzmann thrombasthenia
akan memiliki pola aggregasi abnormal.53,54
7. Adrenalin
Adrenaline berikatan dengan reseptor α2-adrenergic
yang ada di permukaan trombosit menyebabkan
terhambatnya adenyl cyclase dan pelepasan ion
kalsium. Konsentrasi yang biasa digunakan adalah
5-10µM. Gelombang aggregasi yang terjadi mirip dengan
aggregasi yang diinduksi oleh ADP.57
2.3.1.4. Obat-obatan yang Mempengaruhi Aggregasi Trombosit
Banyak obat-obatan yang dapat mempengaruhi fungsi
trombosit. Jika hasil pemeriksaan aggregasi trombosit yang
didapatkan tidak menggambarkan suatu kelainan dengan
obat-obatan dalam seminggu atau 10 hari sebelum
pemeriksaan.
1. Antibiotik
Antibiotik yang memiliki struktur cincin β-lactam, seperti penicillin dan cephalosporins, dapat
menyebabkan terjadi perubahan membran yang
menghambat interaksi antara reseptor dan agonis atau
mempengaruhi influx kalsium ion.53
2. Dypiridamole
Dipyridamole adalah pyrimidopyrimidine yang
menghambat uptake adenosine dalam trombosit, sel
endotel dan eritrosit, menyebabkan peningkatan lokal
kadar adenosine yang menstimulasi adenilat siklase
trombosit dan meningkatkan kadar cyclic 3’,
5’-adenosine monophosphate (cAMP). Peningkatan ini
mengurangi kemampuan beraggregasi.53
3. Fibrinolytik
Fibrinolisis dan pembentukan fibrin degradation products
(FDPs) berhubungan dengan menurunnya aggregasi
trombosit. FDPs bersaing dengan fibrinogen untuk
berikatan pada membran trombosit dan mengganggu
aggregasi trombosit.53
4. Dextran
Pemberian dextran intravena dapat menyebabkan
menurunnya fungsi trombosit. Pada pasien dengan
penyakit arteri perifer, Dextran 40 mengurangi terjadinya
ekspresi marker aktifasi seperti P-selectin pada
permukaan eritrosit.53
5. Anastesi
Obat-obatan anastesi telah menunjukkan efeknya
terhadap respon aggregasi trombosit dan melibat-kan
peningkatan resiko terjadinya komplikasi per-darahan.
Obat-obatan anastesi seperti lidokain, dibukain, kokain,
dll. memiliki efek langsung terha-dap membran
trombosit. Penambahan kokain pada trombosit in vitro
menyebabkan berkurangnya ikatan fibrinogen dengan
reseptor GpIIb-IIIa.53
6. Inhibitor Trombin
Trombin memegang peranan regulasi dalam patofisiologi
dari sindroma koroner akut. Trombin memperantarai
perubahan fibrinogen menjadi fibrin, mengaktifkan
faktor XIII yang menstabilisasi bekuan, dan merupakan
agonis trombosit yang kuat. Generasi terbaru dari
inhibitor trombin direk yang bekerja secara bebas dari
antithrombin III dapat menghambat ikatan bekuan dan
trombin juga aktifasi trombosit yang diinduksi oleh
trombin.53
7. Thienopyridines
ADP merupakan agonis trombosit yang berfungsi dengan
berikatan pada reseptor yang bergandengan dengan
protein G, P2Y1 dan P2Y12. Reseptor P2Y12 merupakan
reseptor utama pada ADP yang memperantarai ikatan
8. Antagonis GpIIb-IIIa
Antagonis IIIa berikatan dengan reseptor
GPIIb-IIIa (integrin αIIbβ3) dan mencegah terjadinya ikatan
antara fibrinogen atau VWF pada trombosit yang
teraktifasi. Antagonis GPIIb-IIIa, eptifibatide,
abciximab, dan tirofiban merupakan yang paling kuat
dari seluruh antiplatelet karena ketika berikatan dengan
GPIIb-IIIa, aggregasi trombosit terhadap semua agonis
(ADP, kolagen) akan dihambat secara signifikan.53
2.3.2. Mean Platelet Volume(MPV)
MPV dan trombosit dihitung menggunakan automated blood
cells counter yang menggunakan teknologi aperture-impedance
untuk mengukur trombosit. Di samping itu, sel-sel difokuskan
melewati celah kecil secara hidrodinamik, dan gelombang listrik
yang sesuai dengan ukuran dan volume sel dihasilkan. Pemisah
“autodiscriminators” yang bergerak memisahkan antara machine noise pada bagian bawah dan sel darah merah pada bagian atas dari setiap distribusi volume trombosit. MPV dihitung dengan
menggunakan rumus: MPV (fL)=Pct (%)x1000÷Plt (x103/µL),
dimana Plt adalah jumlah trombosit dan jumlah partikel diantara
pemisah atas dan bawah, Pct merupakan platelet crit dan dihitung
2.3.3. Kerangka Teori
Genetic Predispotition
Deranged Insulin Release
Insulin Resistance
Obesity
Decrease Glucose Uptake
Increased Hepatic Glucose Output
Hiperglikemia
Hiperaktifitas Trombosit
DM Tipe 2 Terkontrol
Tidak terkontrol
Aktifasi Trombosit
Vascular Complications
Microcirculatory Disturbance Aterogenesis Trombogenesis Environmental