SIMULASI DAN VISUALISASI DINAMIKA MOLEKUL
DENGAN MODEL POTENSIAL LENNARD JONES
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
LILI ANGGRAINI HARAHAP
040801016
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SIMULASI DAN VISUALISASI DINAMIKA MOLEKUL DENGAN MODEL POTENSIAL LENNARD JONES
Kategori : SKRIPSI
Nama : LILI ANGGRAINI HARAHAP NIM : 040801016
Program Study : SARJANA (S1) FISIKA Departemen : FISIKA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, 21 Oktober 2008
Diketahui/disetujui oleh
Departemen Fisika FMIPA USU
Ketua, Pembimbing
PERNYATAAN
SIMULASI DAN VISUALISASI DINAMIKA MOLEKUL DENGAN MODEL POTENSIAL LENNARD JONES
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya
Medan, 21 Oktober 2008
PENGHARGAAN
Puji dan Syukur penulis persembahkan kepada Allah SWT yang telah melimpahkan kasih sayang serta karunia-Nya kepada penulis hingga skripsi ini berhasil diselesaikan dengan baik dan tepat pada waktu yang telah ditetapkan. Shalawat dan salam kepada Nabi Muhammad SAW sebagai suri tauladan terbaik di muka bumi.
SIMULASI DAN VISUALISASI DINAMIKA MOLEKUL DENGAN MODEL
POTENSIAL LENNARD JONES
ABSTRAK
Simulasi dinamika molekul merupakan suatu pemodelan interaksi partikel dengan
penghitungan gerak partikel secara periodik dan pengintegrasian/penjumlahan
keseluruhan dari persamaan gerak. Hal ini dilakukan dengan mengkombinasikan
mekanika statistik dan teori kinetik, sehingga unsur-unsur mikroskopik molekul dapat
dikalkulasikan. Terdapat tiga tujuan utama dilakukan Simulasi ini. Pertama, parameter
yang ingin disimulasi dibandingkan dengan hasil secara eksperimen, jika terdapat
kesamaan maka hasil eksperimen dapat dijelaskan berdasarkan model simulasi.
Kedua, MDS dapat digunakan untuk menginterpretasi hasil eksperimen. Ketiga
bertujuan untuk memberikan pemahaman mendasar dari gerak dan interaksi molekul
dan juga memberikan arahan dalam melakukan pengujian, baik itu secara teoritik
maupun secara eksperimen. Simulasi ini menggunakan software teknik komputasi
matlab versi 6.1.
Dengan memvisualisasikan bentuk histogram dan grafik dari interaksi
antarmolekul menunjukkan bahwa simulasi ini memenuhi spesifikasi ketelitian yang
MOLECULAR DYNAMICS SIMULATION AND VISUALIZATION BY USING
LENNARD JONES MODEL
ABSTRACT
Molecular Dynamics Simulation (MDS) models properties of a system of interacting
particles by repeteadly calculating the interactions between the particles and
integrating their equations of motion. Combining statistical mechanics and kinetic
theory, microscopic properties of the system can be calculated. There are three main
scenarios for the use of MDS. The first scenario, the simulated properties are
compared with experimental result, and when the two agree, it is reasonable to claim
that the experimental result can be explained by the simulation model. The second,
MDS are used to interprate experimental result. The third giving exploratory tool to
gain an initial understanding of a molecular motion and interaction problem, also give
guidance among possible lines of investigation, be it theoretical or experimental. This
simulations using the language of technical computing Matlab version 6.1
With visualizing the histogram and graph form the interaction of molecular
dynamics shows that this simulation gain the specification of error needed.
DAFTAR ISI
1.4 Metodologi Penelitian 2 1.5 Sistematika Penulisan 3 Bab 2 Tinjauan Pustaka 5 2.1 Sistem dan Lingkungan 5
2.2 Dinamika Molekul 7 2.3 Mekanika Klasik 10
2.4 Mekanika Statistik 12 2.4.1 Energi Kinetik 12
2.4.2 Energi Potensial 13 2.4.3 Temperatur 13 2.4.4 Tekanan 14 2.4.5 Distribusi Kecepatan 15 2.4.6 Jalan bebas rata-rata 16 2.4.7 Gerak Brown 17 2.5 Model Interaksi antarmolekul 18 2.5.1 Potensial Lennard Jones 18 2.5.2 Gaya Antarmolekul 20 Bab 3 Analisis dan Perancangan Simulasi Dinamika Molekul 22 3.1 Analisis Masalah 22
3.1.1 Syarat Batas Periodik dan Kotak Simulasi 22 3.1.2 Jarak terdekat antarmolekul 23 3.1.3 Kecepatan rata-rata interaksi partikel 23
3.1.4 Posisi dan kecepatan setelah interaksi 27 3.2 Perancangan diagram alir 28
4.1 Distribusi Kecepatan Partikel 34
4.2 Jalan Bebas rata-rata 40
4.3 Potensial Lennard Jones 43
4.4 Gaya antarmolekul 45
Bab V Kesimpulan dan Saran 47
5.1 Kesimpulan 47
5.2 Saran 47
DAFTAR GAMBAR
Halaman
SIMULASI DAN VISUALISASI DINAMIKA MOLEKUL DENGAN MODEL
POTENSIAL LENNARD JONES
ABSTRAK
Simulasi dinamika molekul merupakan suatu pemodelan interaksi partikel dengan
penghitungan gerak partikel secara periodik dan pengintegrasian/penjumlahan
keseluruhan dari persamaan gerak. Hal ini dilakukan dengan mengkombinasikan
mekanika statistik dan teori kinetik, sehingga unsur-unsur mikroskopik molekul dapat
dikalkulasikan. Terdapat tiga tujuan utama dilakukan Simulasi ini. Pertama, parameter
yang ingin disimulasi dibandingkan dengan hasil secara eksperimen, jika terdapat
kesamaan maka hasil eksperimen dapat dijelaskan berdasarkan model simulasi.
Kedua, MDS dapat digunakan untuk menginterpretasi hasil eksperimen. Ketiga
bertujuan untuk memberikan pemahaman mendasar dari gerak dan interaksi molekul
dan juga memberikan arahan dalam melakukan pengujian, baik itu secara teoritik
maupun secara eksperimen. Simulasi ini menggunakan software teknik komputasi
matlab versi 6.1.
Dengan memvisualisasikan bentuk histogram dan grafik dari interaksi
antarmolekul menunjukkan bahwa simulasi ini memenuhi spesifikasi ketelitian yang
MOLECULAR DYNAMICS SIMULATION AND VISUALIZATION BY USING
LENNARD JONES MODEL
ABSTRACT
Molecular Dynamics Simulation (MDS) models properties of a system of interacting
particles by repeteadly calculating the interactions between the particles and
integrating their equations of motion. Combining statistical mechanics and kinetic
theory, microscopic properties of the system can be calculated. There are three main
scenarios for the use of MDS. The first scenario, the simulated properties are
compared with experimental result, and when the two agree, it is reasonable to claim
that the experimental result can be explained by the simulation model. The second,
MDS are used to interprate experimental result. The third giving exploratory tool to
gain an initial understanding of a molecular motion and interaction problem, also give
guidance among possible lines of investigation, be it theoretical or experimental. This
simulations using the language of technical computing Matlab version 6.1
With visualizing the histogram and graph form the interaction of molecular
dynamics shows that this simulation gain the specification of error needed.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Teori-teori mengenai material pada dasarnya dapat memberikan informasi yang cukup
untuk memprediksi sifat material pada skala makroskopik maupun mikroskopik.
Namun analisa dan perancangan material secara eksperimen biasanya harus dilakukan
berulang-ulang dan memakan waktu yang cukup lama serta memerlukan biaya yang
cukup mahal, selain itu ada berbagai kondisi yang sulit untuk diimplementasikan,
misalnya eksperimen pada suhu maupun tekanan yang tinggi. Karena ukuran atom
yang sangat kecil (jari-jari atom orde 10-10) maka sangat tidak memungkinkan bagi
kita untuk mengamati perilaku atom secara langsung. Tetapi dengan berkembangnya
kemajuan komputer dan kemampuan komputasi yang jauh lebih baik dari pada
dahulu, maka perilaku interaksi gerak atom seperti tarik menarik, tolak menolak,
tumbukan, gerak acak, dan sebagainya dapat kita amati dan analisis secara langsung
melalui simulasi, dan pergerakannya dapat diamati melalui visualisasi dengan
menggunakan komputer sebagai alat bantu.
Dinamika Molekul merupakan suatu teknik yang digunakan untuk mengamati
pergerakan molekul yang saling berinteraksi. Pergerakan molekul ini dipengaruhi oleh
suatu potensial yang dibentuk oleh medan gaya dari partikel-partikel lain disekitarnya.
Hanya saja karena jumlah partikel yang berperan dalam membentuk potensial itu
sangatlah banyak jumlahnya (Bilangan Avogadro berorde 1023) , maka akan sangat
sulit untuk mengkalkulasikannya. Untuk itu, telah dikembangkan beberapa jenis
penyederhanaan kalkulasi untuk menyelesaikan permasalah dinamika molekuler ini,
yang tentunya masing-masing metode pasti memiliki keterbatasan misalnya ketelitian
masing-masing metode. Salah satu model potensial yang sering digunakan dalam
simulasi dinamika molekul adalah metode Potensial Lennard Jones. Salah satu
keuntungan dari teknik simulasi ini adalah sifatnya yang deterministik yaitu jika suatu
waktu yang lainnya akan dapat ditentukan. Ciri khas dari potensial ini adalah adanya
fungsi batas (cut off function) yang membatasi jumlah atom yang terlibat selama
perhitungan potensial yang bekerja pada suatu atom, sehingga dengan fungsi batas ini,
atom-atom yang jauh terpisah dari atom dari suatu jarak tertentu yang lebih jauh dapat
diabaikan sehingga mengurangi jumlah perhitungan. Walaupun hal ini mengurangi
ketelitian, tetapi pada kenyataannya kontribusi atom pada suatu potensial berbanding
terbalik secara eksponensial dengan jaraknya sehingga metode ini dapat diterima.
1.2Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Memahami prinsip dinamika molekul melalui simulasi
2. Melakukan uji coba simulasi dinamika molekul dengan berbagai parameter
yang berbeda
3. Menggunakan program bantu untuk mensimulasi dan memvisualisasikan
gerakan molekul
1.3Batasan Masalah
Penelitian dengan simulasi dinamika molekul pada penelitian ini dibatasi pada:
1. Simulasi dilakukan hanya pada ensemble mikrokanonikal yaitu sistem dengan
energi dan temperatur konstan.
2. Simulasi dibatasi pada distribusi molekul dan gerak molekul dengan
menggunakan mekanika klasik.
3. Simulasi untuk potensial dan gaya antarmolekul digunakan model
potensial lennard jones.
4. Simulasi dan visualisasi gerak molekul dengan menggunakan program
matlab 6,1
1.4Metodologi Penelitian
Penelitian dilakukan dengan langkah-langkah sebagai berikut:
1. Studi literature
Merupakan tahap pengumpulan literature mengenai termodinamika
statistik, dinamika molekul, potensial lennard jones, dan teknik
2. Perancangan model
Merupakan tahap menentukan persamaan-persamaan matematis dengan
variable-varibel yang telah ditentukan.
3. Pembuatan algoritma
Merupakan metode terstruktur yang berisi tahapan-tahapan penyelesaian
masalah dinamika molekul.
4. Pembuatan program komputer
Tahap ini merupakan implementasi dari model dan algoritma yang telah
dibuat ke dalam program computer dengan menggunakan bahasa
pemrograman matlab 6,1
5. Analisa hasil simulasi
Memberikan analisa hasil uji coba simulasi dan visualisasi dinamika
molekul yang telah diperoleh.
6. Penulisan Laporan.
1.5 Sistematika Pembahasan
Laporan tugas akhir ini disusun dalam lima bab yaitu sebagai berikut:
Bab I Pendahuluan
Bab ini menjelaskan latar belakang penelitian, tujuan penelitian, batasan
masalah, dan sistematika pembahasan.
Bab II Tinjauan Pustaka
Bab ini menjelaskan landasan teori yang digunakan dalam penelitian, yaitu
dasar persamaan gerak, mekanika statistik, dasar-dasar dinamika molekul,
model interaksi system dengan lingkungan, model interaksi antarmolekul yang
digunakan untuk mengolah informasi yang akan diimplementasikan dalam
simulasi.
Bab III Perancangan Simulasi Dinamika Molekul
Bab ini membahas tentang implementasi fisis yang telah diperoleh ke dalam
perangkat lunak. Perancangan perangkat lunak ini menggunakan bahasa
pemrograman matlab versi 6,1.
Bab ini memberikan hasil uji coba simulasi dinamika molekul yang telah
dilakukan pada bab III untuk melihat kesesuaian spesifikasi metode yang
digunakan sehingga dapat dianalisa hasil yang telah diperoleh.
Bab V Kesimpulan dan saran
Bab ini memberikan kesimpulan dari hasil perancangan program yang telah
BAB II
TINJAUAN PUSTAKA
2.1 Atom dan Molekul
Definisi molekul yang sederhana yaitu bagian yang terkecil dari suatu zat yang masih
mempunyai sifat yang sama dengan zat tersebut. Sebagai contoh, suatu molekul gula
adalah bagian yang terkecil dari zat gula, yang masih mempunyai sifat gula meskipun
secara fisik tidak tampak seperti butiran gula. Contoh lain adalah molekul air. Seperti
zat lain, air tersusun atas molekul-molekul. Di dalam molekul, kita masih dapat
menemukan bagian terkecil lagi yang tidak tampak dengan mata. Ada sekitar 100 jenis
bagian yang lebih kecil dari molekul yang disebut atom.
Gambar 2.1 Struktur atom dan molekul
Di alam semesta terdapat sekitar 105 jenis atom. Semua zat dan molekul terdiri
dari satu atau lebih atom, karena atom-atom adalah bahan dasar dari suatu molekul
yang nantinya akan membentuk senyawa atau zat. Atom ini juga biasa disebut elemen
atau unsur. Contoh bebrapa unsur, antara lain : Hidrogen (H), Argon (Ar), Nitrogen
(N), Oksigen (O), Besi (Fe), dan sebagainya. Dua atom atau lebih atom yang sama
molekul dibedakan atas molekul unsur dan molekul senyawa. Molekul unsur adalah
molekul yang terbentuk dari gabungan dua atom atau lebih atom –atom yang sejenis.
Molekul senyawa adalah molekul yang terbentuk dari atom –atom yang tidak sejenis.
Misalnya H2O (molekul air), CO2 (molekul karbon dioksida), molekul (NH3
Sebelum membahas lebih jauh tentang dinamika molekul, terlebih dahulu
perlu didefenisikan pengertian dari sistem dan lingkungan karena dinamika molekul
pada dasarnya adalah mengamati perilaku molekul-molekul yang saling berinteraksi
satu sama lain dan juga interaksi dalam suatu sistem terhadap lingkungannya. Sistem
adalah suatu keadaan yang menjadi pusat perhatian atau apa yang diamati, sedangkan
Lingkungan adalah segala sesuatu yang berada di luar sistem yang dapat
mempengaruhi keadaan sistem secara langsung. Pemisah antara sistem dan
lingkungan disebut batas yang secara teoritis tidak memiliki massa maupun volume
yang signifikan. Apabila antara sistem dan lingkungan memungkinkan terjadinya
pertukaran materi dan energi, maka sistem tersebut merupakan sistem terbuka. Jika
hanya terbatas pada pertukaran energi sedangkan materi tidak dapat menembus batas
maka sistem tersebut merupakan sistem tertutup. Sedangkan jika pertukaran materi
maupun energi tidak mungkin terjadi, maka sistem tersebut merupakan sistem
terisolasi
), dan
sebagainya.
Gambar 2.1 Sistem dan lingkungan molekul Batas
Lingkungan
Dalam sistem terdapat ensemble yang merupakan kumpulan dari keadaan
sistem yang memiliki keadaan makroskopis sama tetapi memiliki keadaan
mikroskopis berbeda. Beberapa contoh ensemble yang sering digunakan dalam
dinamika molekul adalah ensemble mikroknonikal, ensemble kanonikal, ensemble
isobarik-isotermal. Namun pada simulasi dinamika molekul ini hanya dibatasi pada
ensemble mikrokanonikal yaitu ensemble yang memiliki karakteristik jumlah
molekul N dan volume V yang tidak berubah serta energi total yang tetap pula.
Ensemble ini merupakan sistem terisolasi sehingga tidak ada interaksi antara sistem
dan lingkungan, dengan demikian energi tidak dapat keluar dan memasuki sistem dan
energi totalnya akan tetap konstan.
Dari segi mikroskopik, didefenisikan bahwa suatu gas hanya dapat didekati
dengan memakaikan hukum-hukum mekanika klasik secara statistik. Yang
merupakan deenisi mikroskopik tersebut adalah:
1. Suatu gas terdiri partikel-pertikel, yang dinamakan molekul-molekul.
Bergantung pada gas tersebut, maka setiap molekul terdiri dari sebuah
atom atau sekelompok atom. Jika gas tersebut merupakan sebuah elemen
atau suatu persenyawaan dan berada dalam suatu keadaan stabil, maka kita
dapat meninjau semua molekulnya sebagai molekul-molekul yang identik.
2. Molekul-molekul bergerak secara serampangan dan menuruti
hukum-hukum gerak Newton. Molekul-molekul bergerak di dalam semua arah dan
dengan berbagai laju. Di dalam menghitung sifat-sifat geraka, maka kita
menganggapbahwa mekanika Newton dapat dipakai pada tingkat
mikroskopik.
3. Jumlah seluruh molekul adalah besar. Arah dan laju gerakan dari setiap
molekul dapat berubah secara tiba-tiba karena tumbukan dengan dinding
atau dengan molekul lain. Setiap molekul khas akan mengikuti sebuah
jalan yang berliku-liku karena tumbukan-tumbukan ini. akan tetapi karena
banyaknya jumlah molekul yang terlibat maka kita menganggap bahwa
jumlah besar tumbukan yang dihasilkan akan mempertahankan distribusi
kecepatan molecular secara keseluruhan dan keserampangan/ keacakan
gerakan.
4. Volume molekul-molekul merupakan jumlah pecahan kecil yang dapat
5. Tidak ada gaya-gaya yang cukup besar (appreciable forces) yang beraksi
pada molekul-molekul kecuali selama tumbukan
6. Tumbukan-tumbukan adalah elastic dan tumbukan-tumbukan terjadi dalam
waktu yang sangat singkat. Tumbukan antarmolekul dengan dinding
wadah akan mempertahankan kekekalan energy kinetik.
2.2 Dinamika Molekul
Dinamika molekul merupakan suatu pembahasan mengenai pergerakan
molekul-molekul yang saling berinteraksi. Sedangkan Simulasi Dinamika Molekul
(Molecular Dynamics Simulation) merupakan suatu teknik simulasi yang
memungkinkan kita untuk melihat pergerakan molekul dalam suatu material dengan
cara menghitung gerakan tiap atom satu persatu. Materi pada skala makroskopis
terdiri dari molekul-molekul yang jumlahnya sangat banyak. Namun dikarenakan
adanya keterbatasan komputasi, maka simulasi dinamika molekul ini hanya dapat
melakukan perhitungan untuk jumlah ratusan ataupun ribuan molekul saja walaupun
pada dasarnya jika dilibatkan molekul dengan jumlah lebih banyak maka akan
semakin realistik hasil yang diperoleh. Hal ini dapat dilakukan dengan menggunakan
fungsi batas dari gaya potensial masing-masing molekul yang terlibat sehingga hanya
dengan menggunakan sampel ratusan molekul saja kita sudah dapat melihat
bagaimana dunia atomic berinteraksi.
Keunggulan lain dari simulasi dinamika molekul ini adalah sifatnya yang
deterministik, artinya jika keadaan suatu materi pada waktu tertentu telah diketahui
maka keadaan materi tersebut pada waktu berbeda dapat ditentukan dengan tepat. Hal
yang paling penting dalam melakukan simulasi dinamika molekul ini adalah
melakukan pemodelan sistem, yang terdiri dari model interaksi antar molekul dan
model interaksi antar molekul dengan lingkungannya. Pemodelan sistem ini akan
menentukan kebenaran simulasi dari segi fisis.
Adapun langkah-langkah yang harus dilakukan dalam melakukan simulasi
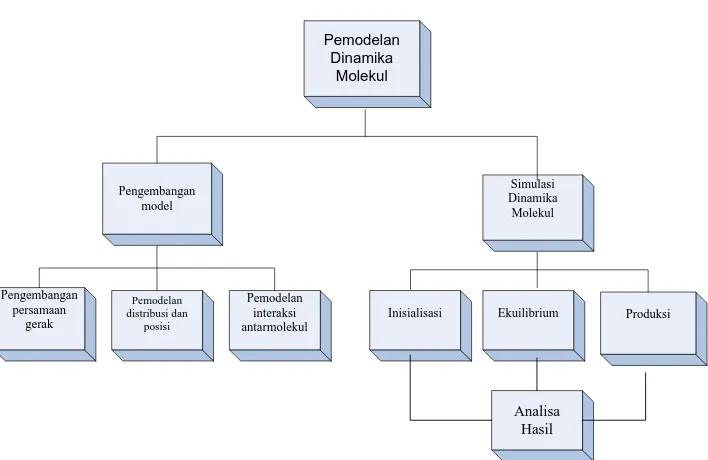
Gambar 2.2 Bagan simulasi dinamika molekul
Dinamika molekul dilakukan dengan langkah-langkah berikut:
1. Pengembangan model
Pengembangan model dilakukan sebagai persiapan awal simulasi. Model ini
dapat diperoleh berdasarkan teori. Model interaksi antarmolekul dilakukan
apabila terjadi interaksi antar molekul satu dengan lainnya sehingga
dibutuhkan pengembangan persamaan gerak. Interaksi antar sistem dan
lingkungan dibutuhkan untuk pengendalian tekanan dan juga temperatur
sistem
2. Simulasi dinamika molekul
Metode molecular dynamics (dinamika molekul) mengkomputasi phase spase
trajectory dari suatu koleksi molekul yang secara individu mengikuti hukum
klasik dari motion. Simulasi awal dilakukan sistem dengan energi yang konstan,
point awal adalah Hamiltonian yang mendskripsikan interaksi anata N partikel.
Secara analisis, solusi sistem dari persamaan differensial order kedua didapat
dengan melakukan integrasi dua kali dari waktu 0 ke waktu t untuk
Simulasi komputer dari sistem molecular dapat dibagi menjadi 3 tahapan yaitu:
1. Tahap Inisialisasi (Initialitation)
Pada tahap ini kondisi awal ditetapkan Tahap inisialisasi terdiri dari
penentuan sistem unit, dan parameter simulasi. Inisialisasi melibatkan
penentuan posisi awal dan kecepatan awal molekul-molekul. Pada
algoritma ini anggap posisi adalah dan velocity diambil dari distribusi
Boltzman
2. Tahap Ekuilibrium (Equilibration)
Equilibrium dapat dibangun jika sistem sudah ditetapkan untuk energi
kinetik dan potensial tertentu.
3. Tahap Produksi (Production)
Tahap produksi adalah tahap utama dalam simulasi dinamika molekul
yaitu ketika hasil simulasi telah diperoleh. Program diawali dengan
pendeklarasian variabel dan parameter yang digunakan dalam program.
Lalu dilanjutkan dengan menyiapkan inisial konfigurasi agar diperoleh
hasil.
Molekul-molekul yang berada dekat batas sistem atau permukaan memiliki molekul
tetangga yang lebih sedikit dari pada yang berada di tengah sistem sehingga
mengakibatkan efek permukaan yang sangat kecil sedangkan simulasi dinamika
molekul ini juga sangat dipengaruhi oleh efek permukaan. Hal ini menyebabkan
informasi yang akan diperoleh dominan merupakan sifat materi yang berada dekat
permukaan, padahal yang paling penting untuk diamati adalah sifat materi itu sendiri.
Untuk menghindari hal ini, maka interaksi molekul dengan batas dihilangkan dengan
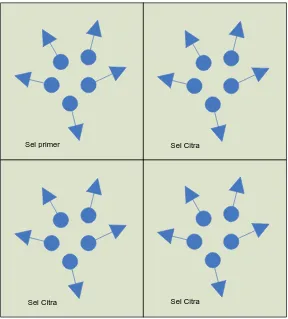
Gambar 2.3 Sel Primer dan sel citra
Objek yang diamati dibagi menjadi sel-sel yang identik satu sama lain. Sel yang
diamati disebut dengan sel primer sedangkan sel lain yang tidak diamati disebut
dengan sel citra yang juga memiliki semua informasi (misalnya posisi dan kecepatan
molekul) yang sama dengan sel primer. Pembuatan syarat batas periodik ini
memberikan implikasi yaitu apabila sebuah molekul meninggalkan sel primer,
molekul tersebut akan digantikan dengan sel citranya yang masuk ke dalam sel primer
secara bersamaan. Posisi molekul yang keluar dari sel primer tersebut diganti dengan
posisi baru yaitu posisi citranya yang masuk ke dalam sel primer. Kondisi ini
menyebabkan jumlah atom yang berada dalam sel akan konstan.
2.3Mekanika Klasik
Mekanika Klasik adalah bagian dari ilmu fisika mengenai gaya yang bekerja pada
benda. Sering dinamakan "Mekanika Newton" dari Newton dan Hukum Gerak Newton. Mekanika klasik dibagi menjadi sub bagian lagi, yaitu statika (mempelajari
benda diam), kinematika (mempelajari benda bergerak), dan dinamika(mempelajari
Sel primer Sel Citra
benda yang terpengaruh gaya). Penyebab gerak suatu benda atau partikel disebut
sebagai dinamika gerak. Dalam pembahasan mengenai dinamika molekul ini, akan
dibahas mengenai konsep-konsep yang menghubungkan kondisi gerak benda dengan
keadaan-keadaan luar yang menyebabkan perubahan gerak benda. Dalam dinamika
molekul ini, digunakan ketiga hukum Newton:
1. Hukum Inersia atau kelembaman, menyatakan bahwa suatu partikel akan
cenderung untuk mempertahankan geraknya. Suatu partikel apabila diam,
maka akan tetap diam dan apabila bergerak maka akan tetap bergerak dengan
kecepatan konstan selama tidak ada pengaruh luar yang mengubah kondisi
geraknya.
2. Hukum Newton kedua menyatakan bahwa percepatan sebanding dengan
resultan gaya yang dialami oleh benda tersebut dan bernading terbalik dengan
massanya, dan arah percpatan sejajar dengan arah gayanya. Jika partikel
dengan massa m menerima gaya , maka partikel tersebut akan mengalami
percepatan sebesar
(2.1)
3. Hukum Newton ketiga ini disebut dengan hukum aksi-reaksi. Jika partikel i
memberikan gaya pada partikel j sebesar , maka partikel j akan memberikan
gaya pada partikel i sebesar
(2.2)
Dari pembahasan di atas dapat disimpulkan bahwa kuantitas gerak suatu benda
tergantung pada massa inersia dan juga kecepatan benda. Untuk itu didefenisikan
suatu besaran vector yang disebut sebagai momentum yang merupakan kuantitas
gerak suatu benda. Ketiga hukum Newton ini memberikan konsekwensi hukum
kekekalan momentum. Dalam suatu sistem terisolasi (ensemble mikrokanonikal),
momentum dari masing-masing partikel dapat berubah-ubah akibat interaksi satu
sama lain, namun momentum totalnya tidak berubah. Momentum total sistem diamati
(2.3)
Dimana m adalah massa molekul dan p adalah momentum molekul.
2.4Mekanika Statistik
Mekanika statistika adalah aplikasi dari teori probabilitas yang mengkombinasikan
matematika ke bidang mekanika yang menangani gerak partikel atau objek yang
dikenai suatu gaya. Mekanika statistik ini dibutuhkan untuk mengkonversi
informasi pada skala atomic menjadi informasi pada skala makroskopik.
Kemampuan untuk membuat prediksi makroskopik berdasarkan informasi dari
sifat mikroskopik. Konsep partikel bebas diperkenalkan ketika suatu partikel bebas
dari adanya pengaruh gaya atau interasi dari luar sistem fisis yang ditinjau.
Dikatakan, dalam kerangka acuan inersia, ruang bersifat homogeny dan isotropic.
Jika partikel bebas bergerak dengan kecepatan konstan dalam suatu sistem
koordinat selama interval waktu tertentu tidak mengalami perubahan kecepatan,
sehingga konsekwensinya adalah waktu bersifat homogen.
Menurut mekanika statistic, kuantitas fisis diperoleh sebagai rata-rata
konfigurasi tersebut terhadap waktu. Konfigurasi posisi dan momentum
molekul-molekul menentukan sifat-sifat yang dimiliki oleh materi tersebut sifat-sifat
tersebut antara lain adalah energi, temperature, tekanan, dan entalpi dan
sebagainya.
2.4.1 Energi Kinetik
Energy kinetic sistem adalah jumlah dari energy kinetic setiap molekul.
(2.4)
Dengan
Sedangkan energy total suatu sistem tersusun dari energy potensial dan juga
(2..5)
Untuk sistem terisolasi dimana tidak ada energy yang menembus batas, sistem bersifat
konservatif atau energi sistem konstan. Konservasi energi ini adalah salah satu cara
untuk memeriksa kebenaran simulasi ensemble mikrokanonikal.
2.4.2 Energi Potensial
Persamaan berdasarkan fisika Kuantum menyatakan gerak tiap partikel di alam
semesta ditentukan oleh potensial yang dibentuk oleh medan gaya dari
partikel-partikel lain di sekitarnya. Energy potensial adalah jumlah dari semua energy
potensial molekul-molekul dalam sistem.
(2.6)
Dengan adalah set posisi titik pusat massa atom atau molekul,
, sedangkan energy total suatu sistem tersusun dari
energy potensial dan juga energi kinetik sistem.
(2.7)
Untuk sistem terisolasi dimana tidak ada energy yang menembus batas, sistem bersifat
konservatif atau energi sistem konstan. Konservasi energi ini adalah salah satu cara
untuk memeriksa kebenaran simulasi ensemble mikrokanonikal.
2.4.3 Temperatur
Ditinjau menurut termodinamika statistik, temperature merupakan suatu skala dari
energy kinetic molekul-molekul penyusunnya. Untuk tiga dimensi, hubungan antara
energy kinetik terhadap temperatur dinyatakan oleh:
(2.8)
(2. 9)
Dimana K adalah energy kinetic total sistem, N adalah jumlah molekul sistem,
adalah konstanta Boltzman dan T adalah temperature.
2.4.4 Tekanan
Tekanan didefenisikan sebagai gaya yang bekerja tegak lurus pada suatu satua luas,
yang secara matematis dinyatakan dengan:
(2.10)
Dengan menggunakan Hukum Newton kedua:
(2.11)
Maka tekanan dapat dinyatakan sebagai suatu fluks momentum atau momentum
yang menembus suatu satuan luas dalam suatu satuan waktu. Sedangkan menurut
termodinamika statistik, tekanan seperti ini terdiri dari dua bagian yaitu:
1. Fluks momentum akibat molekul yang menembus suatu permukaan luas
selama dt, dinotasikan dengan
(2.12)
2. Fluks momentum akibat gaya yang bekerja antara dua molekul yang berada
pada sisi yang berbeda dari permukaan luas, dinotasikan dengan (
(2.13)
Maka tekanan total menurut termodinamika statistik adalah:
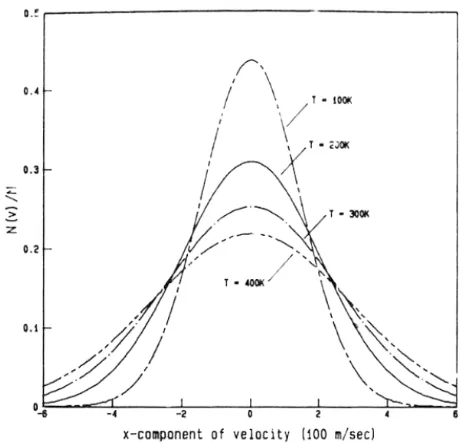
2.4.5 Distribusi kecepatan
Untuk memahami bagaimana distribusi kecepatan dalam suatu wadah pengamatan
kotak kubus, dapat diandaikan saja apabila kotak pengamatannya diam, distribusi
kecepatan itu akan simetris di sekitar kecepatan nol(jumlah molekul yang bergerak ke
kanan akan sama banyaknya dengan jumlah molekul yang bergerak ke kiri), dan kita
juga memperkirakan bahwa distribusinya akan sedemikian rupa sehingga peluang
untuk menemukan sebuah molekul dengan kecepatan besar adalah sangat kecil sekali.
Hal ini disebabkan molekul-molekul dalam materi dapat memiliki kecepatan yang
berbeda-beda sehingga terbentuk suatu distribusi kecepatan. Secara statistik dapat
diperoleh bahwa molekul-molekul akan paling banyak berada paa suatu kecepatan
tertentu, dan akan semakin berkurang jumlah molekulnya dengan semakin jauh
kecepatan ny dari suatu kecepatan tersebut. Salah satu penyebabnya adalah karena
molekul-molekul dalam materi akan saling bertabrakan dan berinteraksi. Interaksi ini
menyebabkan adanya pemerataan energy kinetic, karena molekul yang bergerak lebih
cepat memberikan tambahan momentum pada molekul yang bergerak lebih lambat
dan sebaliknya. Distribusi kecepatan yang terjadi berbentuk distribusi normal, dan
dinamakan disribusi Maxwell-Boltzman. Distribusi Maxwell-Boltzman bergantung
waktu suhu ini dirumuskan dengan:
(2.15)
2.4.6 Jalan bebas rata-rata
Diantara tumbukan-tumbukan yang berturutan, sebuah molekul dalam suatu gas akan
bergerak dengan laju yang konstan sepanjang sebuah garis lurus. Jarak rata-rata
diantara tumbukan-tumbukan yang berturutan seperti itu dinamakan dengan jalan
bebas rata-rata (mean-free-path).
Gambar 2.5 Jalan bebas rata-rata molekul
Sebuah molekul yang berjalan melalui suatu gas, bertumbukan dengan
molekul-molekul lain sepanjang jalan yang dilaluinya. Sudah tentu bahwa semua
molekul lainnya bergerak dengan cara yang sama. Seandainya molekul-molekul
adalah titik-titik, maka molekul tidak akan bertumbukan sama sekali dan jalan bebas
rata-rata sama dengan tak berhingga. Akan tetapi, molekul-molekul bukanlah
merupakan titik-titik dan karena itu terjadilah tumbukan-tumbukan. Jika
molekul-molekul tersebut sangat banyak jumlahnya sehingga menempati seluruh ruangan yang
tersedia bagi molekul-molekul tersebut, dan tidak ada lagi ruangan untuk gerakan
translasi, maka jalan bebas rata-rata akan sama dengan nol. Jadi jalan bebas rata-rata
dihubungkan kepada ukuran molekul dan banyaknya molekul persatuan volume. Jalan
bebas rata-rata l adalah jarak rata-rata di antara tumbukan-tumbukan yang berturutan.
Maka l merupakan jarak total vt yang ditempuh di dalam waktu t dibagi dengan
banyaknya tumbukan yang terjadi di dalam waktu ini. secara matematis ditulis
(2.16)
2.4.7 Gerak Brown
Gerak Brown dinamai menurut ahli Botani Inggris Robert Brown yang pada tahun
1827 menemukan bahwa tepung sari yang tergantung di dalam air memperlihatkan
gerak sebarang yang kontinu jika dilihat di bawah mikroskop. Mula-mula gerak ini
dianggap sebagai suatu bentuk kehidupan, tetapi segera ditemukan bahwa
partikel-partikel yang tidak bersifat organik sekalipun memiliki perilaku yang serupa. Tidak
ada keterangan kuantitatif mengenai fenomena ini hingga dikembangkannya teori
kinetik. Kemudian pada tahun 1905, Albert Einstein menegmbangkan teori Gerak
Brown Einstein menyebutkan bahwa harus ada pergerakan suatu gerak
partikel-partikel mikroskopik yang terbuka kepada pengamatan tanpa mengetahui bahwa
pengamatan-pengamatan yang menyangkut gerak Brown ternyata telah lama dikenal.
Gambar 2.6 Sketsa Gerak Brown
Gambar di atas merupakan sketsa gambar yang ditemukan oleh V. Henry pada
tahun 1908 dari pengamatan sinematografinya mengenai gerakan Brown. Henry
menggunakan sebuah mikroskop dengan kamera gambar dengan kecepatan 20
berliku-liku memperlihatkan keadaan dari lima partikel. Skala pada alas dibagi-bagi atas
micrometer(micron = nilai 10-6
Awalnya partikel-partikel yang diamati adalah sangat besar dibandingkan
dengan molekul-molekul fluida dan ditembaki secara terus-menerus pada semua sisi
oleh molekul-molekul tersebut. Jika partikel cukup besar dan jumlahnya juga besar,
maka banyaknya molekul yang sama akan menumbuk partikel-partikel pada semua
sisi pada setiap saat.untuk partikel yang lebih kecil dengan jumlah lebih kecil maka
banyaknya molekul yang menumbuk berbagai sisi partikel pada setiap saat,
semata-mata hanyalah merupakan kemungkinan, mungkin tidak sama, yakni akan terjadi
fluktuasi.maka partikel pada setiap saat mengalami gaya yang tak seimbang yang
menyebabkan partikel tersebut bergerak dengan berbagai cara dengan sangat tidak
teratur.
)
2.5 Model Interaksi Antarmolekul 2.5.1 Potensial Lennard Jones
Energi intermolekuler yang juga disebut dengan energi potensial didefenisikan sebagai
perbedaan antara energi molekul dan juga penjumlahan energi kompleks molekul
yang terpisah. Pada pemisahan tak terhingga, energy intermolekul adalah nol, dan
ketika kedua molekul saling mendekati satu sama lain, energi intermolekul mulai
menjadi negative dan mulai mencapai keadaan keseimbangan jika mempunyai energy
intermolekul terendah. Jika dua molekul ini saling mendekat maka energi
intermolekulnya tidak lagi menjadi negative tetapi menjadi positif kembali
(tolak-menolak). Untuk satu pasangan molekul, potensial intermolekul adalah suatu fungsi
orientasi relative terhadap jarak antara kedua pusat massa molekul.
Model interaksi antarmolekul yang diperlukan adalah hukum gaya
antarmolekul, yang ekivalen dengan fungsi energy potensial antarmolekul. Pemilihan
energi fungsi energi potensial harus dilakukan sebelum melakukan simulasi.
Pemilihan model interaksi antarmolekul sangant menentukan kebenaran simulasi dari
sudut pandang fisika. Karena berada dalam skala atomik, interaksi secara prinsip harus
diturunkan secara kuantum, dimana perilaku prinsip ketidakpastian Heisenberg. Namun kita dapat melakukan pendekatan mekanika klasik dimana atom dan molekul
dianggap sebagai suatu titik pusat massa. Model interaksi itu harus memenuhi dua
yang saling berinteraksi. Ini berarti ada gaya tolak-menolak antarmolekul. Kedua,
molekul-molekul tersebut harus saling mengikat, atau adanya gaya tarik-menarik.
Pada suatu jarak tertentu, kedua
gaya tersebut saling meniadakan sehingga gaya resultannya sama dengan nol.
Untuk N jumlah atom dalam suatu simulasi maka fungsi energy potensial
adalah dimana adalah set posisi titik pusat massa atom atau molekul,
dimana . Salah satu model energy potensial antara dua
molekul yang dikembangkan adalah Potensial Lennard Jones. Model ini dianggap
paling sederhana, namun memiliki ketelitian yang baik untuk simulasi. Model
potensial ini dirumuskan dengan:
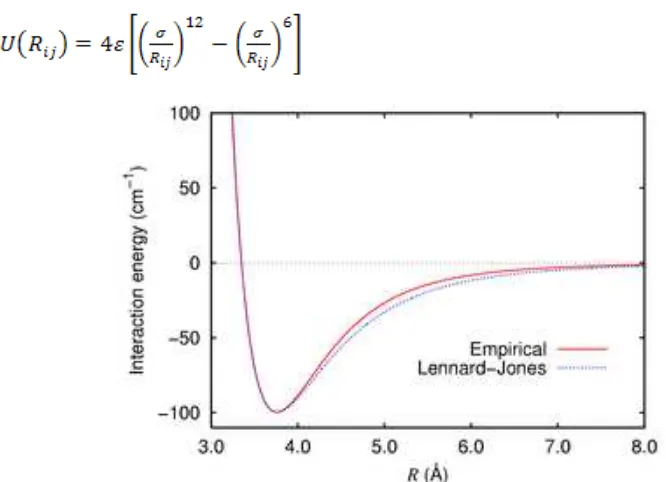
(2.17)
Dengan n dan m merupakan bilangan bulat positif yang dipilih,dimana n > m, i dan j
adalah indeks dari molekul, atau jarak antara molekul i dan j,
sedangkan adalah parameter jarak, dan adalah parameter yang menyatakan
kekuatan interaksi. Pilihan yang umum untuk m dan n adalah m=6 dan n=12.
Sehingga persamaan (2.17) menjadi
(2.18)
2.5.2 Gaya Antarmolekul
Gaya-gaya di antara molekul-molekul adalah berasal dari gaya elektromagnet.
Molekul-molekuli ini netral secara listrik dengan pengertian bahwa muatan negatif
dari elektron-elektron adalah sama besarnya dan berlawanan tandanya dengan muatan
inti-inti. Bila dua molekul saling mendekati, maka muatan pada masing-masing
molekul akan terganggu dan berpindah sedikit dari kedudukan yang biasa sedemikian
rupa sehingga jarak rata-rata diantara muatan yang berlawanan di dalam kedua-dua
molekul tersebut adalah sedikit lebih kecil daripada jarak rata-rata diantara muatan
yang sejenis. Maka, sebuah gaya tarik-menarik antarmolekul akan dihasilkan. Ini
hanya terjadi bila molekul-molekul sangat dekat terhadap satu sama lain, sehingga
gaya-gaya ini hanya beraksi pada jarak-jarak pendek (short range forces). Jika
molekul-molekul tersebut sangat dekat terhadap satu sama lain sehingga
muatan-muatannya yang sebelah luar mulai tumpang tindih (overlap), maka gaya antarmolekul
tersebut menjadi gaya tolak menolak.
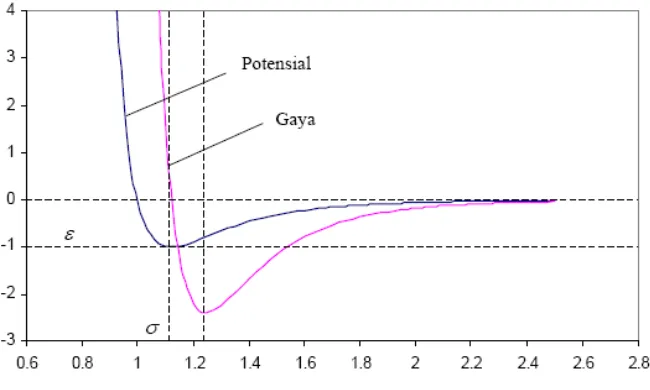
Gaya merupakan negatif dari gradien potensial. Jika dianggap molekul
kira-kira berbentuk simetri bola, maka kita dapat menjelaskan gaya-gaya antarmolekul
secara grafik dengan menggambarkan tenaga potensial bersama dari dua molekul,U,
sebagai fungsi dari jarak r di antara titik pusat molekul-molekul tersebut. Gaya F
yang beraksi pada setiap molekul dihubungkan dengan tenaga potensial U oleh:
(2.19)
Untuk potensial Lennard Jones, besar gaya adalah:
(2.20)
Gaya positif adalah gaya tolak menolak dan gaya negatif adalah gaya tarik-menarik.
Model Lennard jones ini menggambarkan adanya gaya tolak-menolak dengan suku
yang mndominasi pada jarak dekat dan gaya tarik menarik dengan suku
Gambar 2.8 Grafik Gradient Potensial Lennard Jones
Dari persamaan (2.29), maka dapat diturunkan untuk masing-masing sumbu:
Maka diperoleh:
BAB III
ANALISIS DAN PERANCANGAN SIMULASI DINAMIKA MOLEKUL
3.1 Analisis Masalah
Dalam suatu material zat padat terdiri dari susunan atom-atom. Susunan ini terdiri
atas dua susunan yaitu amorf dan Kristal. Pada amorf akan ditemukan susunan atom
yang tidak teratur dan jangkauan yang pendek, sedangkan pada struktur Kristal
susunan atomnya teratur dalam suatu jangkaun tertentu.Untuk lebih memudahkan
pengertian, maka dapat dikatakan bahwa atom-atom dalam kristal suatu zat padat
tersusun secara teratur dan susunan atom-atom tersebut menentukan struktur kristal
dari logam. Susunan dari atom-atom tersebut disebut cell unit.Dalam hal ini, cell unit
adalah sebuah kubus dengan atom-atom menempati kedelapan dari sudut kubus dan
atom lainnya berada pada pusat masing-masing dari keenam bidang kubus.
3.1.1. Syarat Batas Periodik dan Kotak Simulasi
Simulasi dinamika molekul dilakukan dalam kubus dengan dimensi LxLxL dngan
struktur Fcc (Face Centered Cubic) karena bentuk ini paling memudahkan syarat bats
periodic. Pada mulanya molekul diamati pada setiap sudut kubus sehingga
mengakibatkan jumlah molekul yang terlibat akan berjumlah 2n yaitu 28= 256
sedangkan apabila melibatkan satu atom lagi dari bagian permukaan kubus maka
jumlah molekul akan menjadi 29 = 512
3.1.2. Posisi awal
3.1.3. Pemotongan potensial
Penghitungan interaksi antarmolekul memakan waktu paling lama dalam simulasi
dinamika molekul ini. Agar waktu komputasi yang dilakukan tidak memakan waktu
lama, maka interaksi molekul hanya dihitung dengan tetangga terdekat saja. Teknik
seperti ini banyak dilakukan dalam dinamika molekulmateri dalam fase
padat.pemotongan potensial dilakukan dengan menggunakan jarak cut offdi antara
tetangga pertama dan tetangga kedua molekul dalam kotak simulasi. Jarak cut off
dipasang di antara tetangga pertama yang berjarak L dan tetangga kedua berjarak
.
Jarak terdekat antarmolekul
Molekul-molekul yang bergerak secara acak menyebabkan ketidakmerataan
penempatan molekul. Hal ini menyebabkan adanya molekul-molekul yang saling
menumpuk atau berjarak terlalu dekat sehingga terjadi gaya tolak-menolak maupun
tarik-menarik yang terlalu besar. Untuk mencegah hal ini, maka molekul-molekul ini
disusun dalam bentuk kubus sebagai posisi awalnya yang merupakan stuktur yang
sesuai untuk fase padat. Panjang rusuk kubus adalah jarak dimana molekul-molekul
berada pada potensial terendah. Untuk model Potensial Lennard Jones, maka jarak
tersebut jika hanya memperhitungkan tetangga terdekatnya saja adalah dengan
menggunakan persamaan 2.31:
3.1.2 Kecepatan rata-rata interaksi partikel
Seandainya sejenis gas berada dalam suatu ruangan. Maka dapat dipastikan jumlah
molekulnya sangatlah banyak sehingga tidak mungkin bagi kita untuk menentukan
keadaan molekul-molekul tersebut satu persatu. Molekul-molekul tersebut sangat aktif
bergerak bebas dalam ruang tersebut sehingga sangat tidak mungkin bagi kita untuk
dengan kecepatan tertentu. Kita hanya mampu meramalkan keadaan berdasarkan
kebolehjadiannya (probabilitas). Adapun kebolehjadian (probabilitas) ini,ada
kaitannya dengan statistic, hanya saja tidak diperlakukan seperti statistic
demografi(kependudukan) dimana kita perlu menggunakan sampel untuk meramalkan
populasi itu.
Prinsip yang biasa diterapkan adalah prinsip keacakan/random dimana semua
molekul mempunya kebolehjadian yang sama untuk berada di titik manapun di dalam
ruang dan bisa bergerak ke arah manapun dengan momentum manapun sesuai dengan
batasa-batasan yang berlaku. Dengan demikian dari segi kecepatan bergerak dapat
dikatakan bahwa rata-rata kecepatan semua molekul pada arah sumbu koordinat
adalan nol, tetapi rata kuadratnya tidak sama dengan nol.
(3.3)
(3.4)
Untuk menghitung tekanan gas yang ditimbulkan oleh molekul-molekul tersebut,
maka dapat dianggap dinding tempat molekul bergerak adalah sebuah dinding dengan
luas dA yang akan ditumbukoleh molekul-molekul yang kelajuannya v di depan dA
dan arahnya membentuk sudut dengan normal pada elemen bidang tersebut.jika per
cacah molekul terdapat n(v) buah molekul yang menumbuk dinding dA selama dt,
maka volumenya adalah: . Dengan demikian cacah yang menumbuk
dinding dA adalah:
(3.5)
Apabila tumbukan yang mengenai dinding adalah lenting sempurna, maka momentum
yang diperoleh dA dalam waktu dt adalah:
(3.6)
Atau perubahan momentumnya setiap detik yang diterima oleh dA akibat
(3.7)
Dengan demikian,gaya yang bekerja (gaya=perubahan momentum) pada dinding dA
adalah:
(3.8)
Gaya yang ditimbulkan oleh semua molekul adalah:
(3.9)
Jadi, tekanan gas pada dinding adalah;
(3.10)
Atau energy kinetik gas:
(3.11)
Persamaan-persamaan di atas dapat didekati dengan melalui probabilitas. Andaikan
terjadi keseimbangan suhu T dalam sistem, maka kebolehjadian bahwa sebuah partikel
berada pada posisi antara r dan r+dr dengan kelajuan antara v dan v+dv adalah:
(3.12)
Dimana P(r,v) disebut probability density dari partikel, dan Ek(r,v)adalah energy
kinetiknya. A adalah tetapan yang bisa diperoleh melalui integrasi pada batas-batas
Integral dari persamaan (2.13) di atas dapat dilakukan dengan separasi variabel,
dengan asumsi bahwa energy kinetiknya independen terhadap r , dengan demikian,
persamaan menjadi:
(3.13)
Dimana P(v) adalah probabilitas bahwa partikel memiliki kelajuan antara v dan v+dv.
Dalam koordinat silinder, kebolehadian ini adalah:
(3.14)
Karena distribusi kecepatanadalah sama di segala arah, maka komponen sudut
(angular)dapat diintegrasi dengan batas-batasnya dan memberikan:
(3.15)
Pada persamaan ini, konstanta telah ditetapkan melalui kondisi .
Bentuk distribusi kecepatan ini disebut distribusi Maxwell-Boltzman.
Beberapa kuantitas yang yang berkaitan dengan energu kinetic gas, dapat
dikalkulasikan sebagai berikut:
(3.16)
Persamaan (2.17) di atas adalah persamaan kcepatan raa-rata partikel. Sedangkan
kecepatan r.m.s partikel adalah:
Kemudian dari persamaan (2.18) ini dapat dijabarkan energy kinetic rata-rata partikel
yaitu:
(3.18)
3.1.4 Posisi dan Kecepatan Setelah Interaksi
Molekul dapat dianggap sebagai partikel yang bergerak bebas sedemikian rupa
sehingga sangatlah sulit untuk diketahui besaran fisisnya satu per satu.para fisikawan
hanya dapat meramalkan keadaan rata-ratanya. Partikel-partikel tersebut saling
bertabrakan dengan pergerakannya sehingga didefenisikanlah sebuah jalan bebas
rata-rata(mean free path) sebagai jarak tempuh rata-rata partikel sebelum bertabrakan.
Nilai rata-rata dari jumlah tabrakan yang rata-rata dialami oleh sebuah partikel
persatuan waktu biasa disebut sebagai frekwensi tabrakan, f.
Suatu simulasi dinamika molekul lainnya untuk melakukan simulasi terhadap
partikel gas dapat dilakukan dengan menggunakan persamaan Boltzman. Algoritma
ini sebagiamana halnya untuk dinamika molekuler lainnya, menyatakan keadaan
sistem partikel dalam posisi dan kecepatan {r,v}. Evolusi dari sistem dilakukan
dengan integrasi melalui beda waktu(time step) yang biasanya dalam orde rata-rata
waktu tabrakan antarpartikel. Pada setiap langkah integrasi partikel pada awalnya
dianggap bergerak tanpa tabrakan sehingga setiap partikel mempunyai posisi:
(3.19)
Setelah itu partikel akan bertabrakan dengan partikel lainnya sehingga kecepatannya
akan dikembalikan ke kecepatan semula. Semua pasangan partikel (i,j) dalam sebuah
sel memiliki kemungkinan untuk bertabrakan. Kebolehjadian ini berbanding langsung
dengan kelajuan relatifnya.
Apabila pasangan yang brtabrakan telah dipilih, maka kecepatan mereka perlu
dievaluasi. Kekekalan momentum memberikan petunjuk bahwa kecepatan pusat
massa tidak berubah karena tabrakan, sehingga:
Hukum kekekalan energy juga memberikan petunjuk bahwa kecepatan relative tidak
berubah karena tabrakan, sehingga:
(3.21)
Kecepatan setelah tabrakan dihitung sebagai berikut:
(3.22)
Jumlah tabrakan yang terjadi dalam satu sel selama selang waktu adalah:
(3.23)
Dimana adalah volume sel. Tetapi, dengan menerapkan acceptance-rejection,
maka:
(3.24)
Sehingga jumlah partikel yang akan bertabrakan adalah:
(3.25)
3.2 Perancangan Diagram alir (flowchart)
Proses perancangan program bantu dalam laporan tugas akhir ini dirancang melalui
tahapan-tahapan sebagai berikut:
1. Perancangan diagram alir dan algoritma penentuan persamaan distribusi awal dan
akhir kecepatan partikel, kecepatan relatif interaksi partikel, potensial lennard
2. Pembuatan program lengkap berdasarkan rancangan diagram alir dan algoritma
dengan menggunakan program matlab 6.1
Dalam merancang suatu program yang terstruktur dan terkendali dengan baik,
terlebih dahulu perlu dilakukan perancangan diagram alir (flowchart) serta algoritma
program sehingga dapat memperjelas langkah-langkah dalam membuat program
start
Input nilai:
Jumlah partikel, Konstanta Boltzman, massa atom, diameter atom, suhu, densitas, panjang kotak simulasi
Hitung laju partikel
Hasil
Laju partikel dan Jumlah partikel (histogram)
Input Jumlah selang waktu
Pause (1)
Hitung distribusi akhir Laju partikel
Hasil
End
N
Y
start
Input nilai:
Jumlah partikel, Konstanta Boltzman, massa atom, diameter atom, suhu, densitas, panjang kotak simulasi
Hitung laju awal partikel dan kecepatan dinding
Memberi nilai pada posisi R1, R2= bilangan random
Hasil
Hitung kecepatan gerak molekul random
end
start
Input nilai: Kerapatan, Tetapan lennard jones
Hasil Gunakan rumus Potensial lennard
jones
End K=0
3
>
k
Inc(k)
N
Y
start
Input nilai: Kerapatan, Tetapan lennard jones
Hasil Gunakan rumus
Gaya interaksi antarmolekul
End K=0
3
>
k
Inc(k)
N
Y
BAB IV
HASIL DAN PEMBAHASAN
4.1 Distribusi Kecepatan Partikel
Terjadinya distribusi kecepatan disebabkan molekul-molekul dalam materi memiliki
kecepatan yang berbeda-beda. Gambar di bawah ini memperlihatkan keadaan molekul
pada keadaan awal dan pada keadaan setelah beberapa time step yang berbeda.
Simulasi dilakukan untuk jumlah partikel 256 dan 512. Setiap satu molekul dirancang
agar molekul memiliki effnumber , artinya satu molekul mewakili ribuan atom dengan
tujuan untuk mempermudah penghitungan selama kalkulasi. Effnumber diperoleh dari
persamaan:
masukkan jumlah molekul:256
setiap molekul mewakili 104874 atom >>
masukkan jumlah molekul:256
setiap molekul mewakili 104874 atom jumlah selang waktu:10
>>
Gambar 4.2 Distribusi akhir kecepatan molekul pada time step 10
masukkan jumlah molekul: 256
setiap molekul mewakili 104874 atom jumlah selang waktu:50
>>
masukkan jumlah molekul:256
setiap molekul mewakili 104874 atom jumlah selang waktu:100
>>
Gambar 4.4 Distribusi akhir kecepatan molekul pada time step 100
masukkan jumlah molekul:256
setiap molekul mewakili 104874 atom jumlah selang waktu:500
>>
masukkan jumlah molekul:512
setiap partikel mewakili 52437 atom
Gambar 4.6 distribusi awal kecepatan partikel
masukkan jumlah molekul:512
setiap molekul mewakili 52437 atom jumlah selang waktu:10
>>
masukkan jumlah molekul:512
setiap molekul mewakili 52437 atom jumlah selang waktu:100
>>
Gambar 4.8 Distribusi akhir kecepatan molekul pada time step 100
masukkan jumlah molekul:512
setiap molekul mewakili 52437 atom jumlah selang waktu:100
>>
masukkan jumlah molekul:512
setiap molekul mewakili 52437 atom jumlah selang waktu:1000
>>
Gambar 4.10 Distribusi akhir molekul ada timestep 1000
Berdasarkan gambar-gambar di atas dapat dilihat bagaimana partikel-partikel
terdistribusi dalam berbagai selang waktu. Laju akar rata-rata kuadrat (root-mean
square speed) merupakan laju molekul efektif yang stabil. Pada gambar terdapat
kondisi awal dimana seua molekul yang terlibat memiliki distribusi laju Vx yang
sama. Tetapi kondisi ini tidak akan bertahan terus untuk waktu yang lama karena laju
partikel akan berubah dengan adanya tumbukan-tumbukan.
Banyaknya molekul yang mempunyai laju (misal v1 dan v2) menyamai luas di
bawah kurva garis v1 dan v2. Jumlah molekul dalam sebuah interval ∆V yang
diberikan akan semakin besar jika laju bertambah besar sampai ke suatu titik
maksimum dan kemudian secara asymptotic menuju nol, sedangkan jangkauan
kelajuannya menjadi lebih besar sehingga distribusi tersebut akan semakin melebar
seperti yang tampak pada gambar. Hal ini dapat terjadi jika V≤Vrms. Simulasi
dilakukan untuk jumlah partikel 256 dimana setiap partikel memiliki 104874 atom
pada time step yang berbeda. Penjelasan yang sama juga diperoleh untuk jumlah
4.2 Jalan bebas rata-rata molekul
Tumbukan-tumbukan berurutan yang dialami oleh molekul-molekul akan bergerak
dengan laju konstan sepanjang garis lurus. Simulasi dilakukan dengan kotak simulasi
dimana memiliki volume sebesar 1 kubik-mikron. Dengan volume yang sangat kecil
ini, maka sudah dapat dipastikan bahwa julah atom sangat banyak sekali (dapat
mencapai orde 106 bahkan lebih) sehingga proses komputasi satu per satu partikel
akan memakan waktu yang sangat lama. Oleh karena itu, pada program dirancang
agar partikel memiliki effnumber , artinya satu partikel mewakili ribuan atom, juga
merupakan kumpulan molekul sehingga posisinya akan merupakan posisi rata-rata.
Demikian pula kecepatannya, yaitu kecepatan rata-rata kumpulan molekul tersebut.
Kecepatan awal partikel menurut sumbu y dan sumbu z ditetapkan nol dan kecepatan
menurut sumbu x adalah ± vinit. Lebar sel Lc dalam orde jalan bebas rata-rata,
sehingga sel dapat dianggap homogen. Selang waktu τ = a.Lc/<v>, dimana nilai a dipilih < 1 ( misalnya a=0.2). dengan demikian setiap partikel rata-rata menghabiskan
beberapa selang waktu dalam kotak simulasi.
masukkan jumlah molekul yang akan disimulasi: 2 satu molekul simulasi=1.34238e+007 atom
lebar sistem adalah 15.9784 dari jalan bebas rata2/n masukkan kecepatan dinding sebagai bil.mach: 0.4
kecepatan dinding -3.89352 dan 3.89352 m/det >>
masukkan jumlah molekul yang akan disimulasi: 4 satu molekul simulasi=6.71192e+006 atom
lebar sistem adalah 15.9784 dari jalan bebas rata2/n masukkan kecepatan dinding sebagai bil.mach: 0.4 kecepatan dinding -3.89352 dan 3.89352 m/det
>>
Gambar 4.12 Jalan bebas rata-rata untuk 4 molekul
masukkan jumlah molekul yang akan disimulasi: 6 satu molekul simulasi=4.47461e+006 atom
lebar sistem adalah 15.9784 dari jalan bebas rata2/n masukkan kecepatan dinding sebagai bil.mach: 0.4
kecepatan dinding -3.89352 dan 3.89352 m/det >>
masukkan jumlah molekul yang akan disimulasi: 8 satu molekul simulasi=3.35596e+006 atom
lebar sistem adalah 15.9784 dari jalan bebas rata2/n masukkan kecepatan dinding sebagai bil.mach: 0.4 kecepatan dinding -3.89352 dan 3.89352 m/det
>>
Gambar 4.14 Jalan bebas rata-rata untuk 8 molekul
Gambar di atas mendemonstrasikan gerakan kontinu dari molekul-molekul yang
bergerak ke segala arah dengan berbagai laju. Jika molekul-molekul adalah sangat
banyak sehingga menempati seluruh ruangan yang tersedia bagi molekul-molekul
tersebut, dan tidak ada lagi ruangan untuk gerakan translasi, maka jalan bebas rata-rata
akan sama dengan nol. Karena partikel-partikel yang terlibat sangat banyak
jumlahnya, maka banyaknya molekul yang sama akan menumbuk partikel-partikel
pada semua sisi pada setiap saat. Untuk partikel-partikel yang lebih kecil dan jumlah
molekulnya lebih kecil maka banyaknya molekul yang menumbuk hanyalah
merupakan kemungkinan, mungkin tidak sama sehingga akan terjadi fluktuasi.
Garis-garis yang berliku-liku memperlihatkan kedudukan dari masing-masing partikel yang
4.3 Potensial Lennard Jones
Untuk mendapatkan grafik potensial dari persamaan potensial Lennard Jones
(persamaan 2-18), diinput nilai-nilai sebagai berikut:
, ,
Dimana adalah jarak antara molekul i dan j , adalah= parameter jarak, dan
adalah parameter yang menyatakan kekuatan interaksi
Gambar 4.15 Grafik pemotongan potensial dan Gaya --- Potensial Lennard Jones
Gambar 4.16 Grafik Potensial Lennard jones
Grafik di atas menggambarkan tenaga potensial U dan gaya F sebagai fungsi dari
jarak di antara titik-titik pusat molekul. Gaya F yang bekerja pada setiap molekul
dihubungkan dengan tenaga potensial oleh
Bila dua molekul saling mendekati, maka muatan masing-masing molekul akan
terganggu dan berpindah sedikit demi sedikit dari kedudukannya sehingga jarak
rata-rata antara muatan yang berlawanan adalah sedikit lebih kecil dari jarak rata-rata-rata-rata
antara muatan sejenis sehingga akan dihasilkan gaya tarik menarik.Jika
molekul-molekul tersebut sangat dekat terhadap satu sama lain hingga muatan-muatannya
saling tumpang tindih (overlap), maka akan terjadi gaya tolak menolak.
Ciri khas dari potensial lennard jones ini adalah adanya fungsi batas (cut off function)
pada molekul. Dengan adanya fungsi batas ini, atom-atom yang jauh dari atom
molekul tersebut, lebih jauh dari suatu jarak tertentu, dapat diabaikan sehingga
mengurangi jumlah perhitungan. Walaupun hal ini mengurangi ketelitian, tetapi pada
kenyataannya kontribusi atom pada suatu potensial berbanding terbalik secara
eksponensial dengan jaraknya sehingga metode ini dapat diterima.
4.4 Gaya Antarmolekul
Gaya merupakan negatif dari gradient potensial. Untuk mendapatkan persamaan
potensial dapat diperoleh dari
Sama seperti pada potensial Lennard Jones, diinput nilai-nilai sebagai berikut:
, ,
Dimana adalah jarak antara molekul i dan j , adalah= parameter jarak, dan
adalah parameter yang menyatakan kekuatan interaksi
Grafik di atas menggambarkan suatu nilai gaya F yang khas. Di sini kita dapat
membayangkan sebuah molekul yang dibuat tetap di O. Maka molekul yang lainnya
akan ditolak dari O bila lereng (slope) dari F adalah negative dan akan ditarik ke O
bila lereng tersebut adalah positif . Pada ro tidak ada gaya yang beraksi pada
molekul-molekul tersebut sehingga besarnya tenaga potensial pada keadaan ini adalah nol.
Terdapat suatu “titik balik”(turning point) dari gerakan tersebut dimana terjadi
pemisahan titik pusat dari dua buah molekul pada titik balik tersebut yang merupakan
jarak pendekatan yang paling pendek ketika terjadi tumbukan. Akibat adanya
perbedaan ukuran muatan dan juga penyusun muatan dalam dapat mengakibatkan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Pada distribusi laju partikel (hasil sub-bab 4.1), apabila interval laju ∆ V
pada suatu titik mencapai maksimum, maka kecepatannya kemudian akan
berkurang secara asympotik menuju nol.
2. Jalan bebas rata-rata dihubungkan kepada ukuran molekul dan banyaknya
molekul persatuan volume yang bertabrakan satu dengan lainnya sehingga
membentuk lintasan acak/random (hasil sub-bab 4.2)
3. Jarak pisah antar atom dalam molekul Rij memiliki nilai tertentu yaitu
, nilai yang lebih jauh dari nilai tersebut dapat diabaikan
sehingga mengurangi jumlah perhitungan dan ketelitian, namun grafik
menunjukkan bahwa kontribusi atom pada potensial berbanding terbalik
secara eksponensial terhadap jarak sehingga metode ini dapat diterima.
4. Dengan menggunakan persamaan potensial lennard jones (hasil sub-bab
4.3), tidak perlu mengkalkulasi gerakan seluruh atom (ribuan atau jutaan
atom), karena hanya dengan melibatkan ratusan atom saja kita sudah
dapat mengamati bagaimana dunia atomik berinteraksi.
5.2 Saran
1. Dilakukan modifikasi simulasi agar dapat melihat pengaruh parameter
lainnya seperti suhu dan tekanan.
2. Penyempurnaan pada program pendukung untuk menampilkan hasil yang
lebih sempurna
DAFTAR PUSTAKA
Haile, J.M.1992. Molecular Dynamics Simulation: Elementary Methods, John Wiley& Sons, Inc.
Huang, Kerson.1987. Statistical Mechanics. John Wiley & Sons, Inc.
Witoelar, Aree. 2002. Perancangan dan Analisa Simulasi Dinamika Molekul
Ensemble Mikrokanonikal dan Kanonikal dengan Potensial Lennard Jones,
Tugas Akhir. Institut Teknologi Bandung
S, Budi Sutedjo. 2004. Algoritma dan Teknik Pemrograman. Edisi ketiga.Yogyakarta: Penerbit Andi.
Etter, M Delores.2003. Pengantar matlab 6. PT INDEKS Kelompok. Jakarta: GRAMEDIA.
Reif, F.1965. Fundamentals of Statistical and Thermal Physics, McGraw-Hill Publishing Company
Suarga. 2007. Fisika Komputasi, Solusi Problematika Fisika denganMatlab, edisi pertama. Yogyakarta: Penerbit Andi.
Hedman, Fredrik. 2006. Algorithms for Molecular Dynamics Simulations, advancing
the Computational Horizon. Stocholm University.
Perangin-angin, Kasiman. 2006. Pengenalan Matlab. Yogyakarta: Penerbit Andi.
Fahmi, Mahuddin. 1999. Perancangan Perangkat Lunak Simulasi Dinamika Molekul
dengan model Potensial Lennard Jones. Tugas Akhir.
Halliday, David. 1998. Fisika. Jilid 1. Edisi ketiga. Jakarta: Penerbit Erlangga
LAMPIRAN
List program 1 histogram distribusi kecepatan awal partikel
%list program gerak molekul-distribusi kecepatan %inisialisasi variabel
rand('seed',1);
npart=input('masukkan jumlah partikel:'); boltz=1.3806e-23; %tetapan boltzman mass=6.63e-26; %massa atom argon
fprintf('setiap partikel mewakili %g atom\n',ceil(eff_num));
List program 2 histogram distribusi kecepatan partikel pada berbagai time step
%dsmc01-algoritma DSMC untuk simulasi kecepatan partikel %inisialisasi variabel
rand('seed',1);
npart=input('masukkan jumlah partikel:'); boltz=1.3806e-23; %tetapan boltzman mass=6.63e-26; %massa atom argon diam=3.66e-10; %diameter atom argon
T=273; %suhu kelvin
density=1.78; %rapat massa atom argon
L=1e-6; %panjang kotak 1 mikron
eff_num=density/mass*L^3/npart;
fprintf('setiap partikel mewakili %g atom\n',ceil(eff_num));
vbin=50:100:1050; %histogram distribusi kecepatan awal hist(vmag,vbin);title('distribusi awal kecepatan');
string=sprintf('distribusi akhir,waktu=%g det',nstep*tau);
%distribusi akhir dari kecepatan partikel hist(vmag,vbin);title(string);
xlabel('laju partikel');ylabel('jumlah partikel') grid on
return end
List Program Jalan Bebas rata-rata (gerak random)
%Gerak random
%inisialisasi variabel rand('seed',1);
npart=input('masukkan jumlah partikel yang akan disimulasi: ');
fprintf('satu partikel simulasi=%g atom\n',eff_num); mfp=1/(sqrt(2)*pi*diam^2*density/mass);
fprintf('lebar sistem adalah %g dari jalan bebas rata2/n ',L/mfp);
mpv=sqrt(2*boltz*T/mass); %kecepatan awal
vwall_m=input('masukkan kecepatan dinding sebagai bil.mach: ');
vwall=vwall_m*sqrt(5/3*boltz*T/mass)*[-1 1]; fprintf('kecepatan dinding %g dan %g
m/det\n',vwall(1),vwall(2));
x=L*rand(npart,1); %memberi nilai pada posisi
v=mpv*sqrt(-log(ones(npart,3)-rand(npart,3))).*sin(2*pi*rand(npart,3));
%v adalah kecepatan thermal dengan bilangan acak Gaussian v(:,2)=v(:,2)+vwall(1)+vwall(2)-vwall(1)*(x(:)/L);
plot(v,x);xlabel('posisi');
ylabel('jalan bebas rata-rata'); end
List Program Potensial Lennard Jones
%grafik fungsi y=4*lennard*den/den*2^1/6 lennard=0.625;
den=1,78;
x=den/den*2^1/6; k=0;
for n=1:2:7 n10=10*n;
x=linspace(-2,2,n10); y=4*lennard*(x.^12-x.^6); k=k+1;
subplot(2,2,k) plot(x,y,'r')
title(['plot fungsi dengan banyak data n= ',num2str(n10)])
axis([-2,2,-.8,.8]); xlabel('R(A)');
ylabel('interaksi potensial LJ'); grid