UJI SEROLOGI Tomato chlorosis virus (ToCV) PADA
TANAMAN TOMAT (Lycopersicon esculentum Mill.)
RIZA DESTARI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Uji Serologi Tomato chlorosis virus (ToCV) pada Tanaman Tomat (Lycopersicon esculentum Mill.)”
adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Riza Destari
NIM A34090031
ABSTRAK
RIZA DESTARI. Uji Serologi Tomato chlorosis virus (ToCV) pada Tanaman Tomat (Lycopersicon esculentum Mill.). Dibimbing oleh GEDE SUASTIKA.
Tomato chlorosis virus (ToCV) merupakan salah satu anggota genus Crinivirus yang ditularkan melalui kutukebul dan terbatas hanya pada jaringan floem tanaman inangnya. Virus ini dilaporkan telah menginfeksi tanaman tomat di dunia dan pertama kali dilaporkan di Indonesia pada tahun 2006. Pada tanaman tomat, ToCV menimbulkan gejala berupa menguningnya bagian di antara tulang daun (interveinal yellowing) yang berawal dari daun bagian bawah dan berkembang ke bagian atas tanaman. Virus ini juga dapat mengakibatkan turunnya kebugaran tanaman dan menurunkan hasil produksi karena dapat menunda proses pematangan dan buah yang dihasilkan berukuran lebih kecil. Antiserum poliklonal telah berhasil dibuat dengan menggunakan coat protein
(CP) ToCV yang diekpresikan pada Escherichia coli. Penelitian ini bertujuan untuk menganalisis reaksi dan titer antiserum dengan menggunakan uji serologi melalui metode agarose gel precipitation test (AGPT) dan dot immunobinding assay (DIBA). Titer antiserum diukur dengan menggunakan sap tanaman yang tidak diencerkan yang berasal dari tanaman tomat terinfeksi ToCV. Berdasarkan hasil penelitian ini, antiserum ToCV bereaksi secara spesifik dengan antigen ToCV. Sinyal positif pada metode AGPT dan DIBA tampak jika antiserum bereaksi dengan sap tanaman tomat sumber ToCV, akan tetapi sinyal positif tidak tampak jika antigen berasal dari sap tanaman tomat sehat. Titer antiserum yang didapatkan dengan metode AGPT adalah 1/2, sedangkan dengan menggunakan DIBA titer antiserum mencapai 1/10000. Oleh karena itu, DIBA merupakan metode serologi yang dapat dipertimbangkan dalam deteksi ToCV dengan menggunakan antiserum ini.
Kata kunci: agarose gel precipitation test, titer antiserum, dot immunobinding assay.
ABSTRACT
RIZA DESTARI. Serological Test of Tomato chlorosis virus (ToCV) in Tomato Plants (Lycopersicon esculentum Mill.). Supervised by GEDE SUASTIKA.
Tomato chlorosis virus (ToCV), a whitefly-transmitted and phloem-limited Crinivirus infecting tomatoes worldwide, is reported for the first time occur in Indonesia in 2006. In tomato, ToCV cause interveinal yellowing that developed initially on lower leaves and then progressed to the upper part of the plant. Affected plants were less vigorous and yielded less due to reduced fruit growth and delayed ripening. Polyclonal antiserum has been already produced using capsid proteins of ToCV expressed in Escherichia coli. Reaction and titer of the antiserum were analyzed in this research. Serological reactions were analyzed using agarose gel precipitation test (AGPT) and dot immunobinding assay (DIBA). The titer of the antiserum was measured using undiluted sap prepared from ToCV-infected tomato leaf tissues. Based on the research result, the ToCV antiserum was specifically reacted with ToCV antigen. AGPT and DIBA gave a strong positive signal if the antiserum was reacted with ToCV-containing sap, but there no any positive signal if the antigen extracted from healthy tomato plant. Using AGPT method, the titer of the antiserum was only 1/2, but using DIBA the titer was reach up to 1/10000. The DIBA, therefore, considered as a reliable serological method for the ToCV using this antiserum.
UJI SEROLOGI Tomato chlorosis virus (ToCV) PADA
TANAMAN TOMAT (Lycopersicon esculentum Mill.)
RIZA DESTARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Uji Serologi Tomato chlorosis virus (ToCV) pada Tanaman Tomat (Lycopersicon esculentum Mill.)
Nama Mahasiswa : Riza Destari
NIM : A34090031
Disetujui oleh
Dr. Ir. Gede Suastika, M.Sc Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, M.Si Ketua Departemen
PRAKATA
Puji syukur kehadirat Allah SWT karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi dengan segala kemampuan dan keterbatasan yang dimiliki penulis. Skripsi yang berjudul “Uji Serologi Tomato chlorosis virus
(ToCV) pada Tanaman Tomat (Lycopersicon esculentum Mill.)” disusun sebagai salah satu syarat dalam memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr. Ir. Gede Suastika, M. Sc selaku dosen pembimbing akademik dan sekaligus dosen pembimbing skripsi atas bimbingannya selama penelitian. Dr. Ir Sri Hendrastuti Hidayat, M. Sc, dan Dr. Ir. Tri Asmira Damayanti, M. Agr yang telah memberikan saran, nasihat, serta pengarahan selama di laboratorium. Staf pengajar di Departemen Proteksi Tanaman yang telah memberikan pengajaran mata kuliah selama di Departemen Proteksi Tanaman. Kepada Fitrianingrum Kurniawati, M. Si dan Sari Nurulita, SP yang telah berkenan menjadi tutor selama penelitian. Teman-teman Laboratorium Virologi yang senantiasa membantu selama penelitian dan teman-teman HPT 46 yang selalu ada dalam suka dan duka. Kepada orang tua tercinta bapak Samsul Rizal, ibu Yulizar, adik Ari Saputra, dan adik Ferri Yusra yang selalu memberikan semangat, motivasi, doa, dan kasih sayang yang tulus.
Semoga skripsi ini bermanfaat
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
BAHAN DAN METODE 3
Tempat dan Waktu Penelitian 3
Metode Penelitian 3
Tanaman Tomat Sumber ToCV 3
Ekstraksi RNA Total 3
Sintesis complementary cDNA 4
Amplifikasi DNA 4
Elektroforesis 5
Agarose Gel Precipitation Test (AGPT) 6
Dot Immunobinding Assay (DIBA) 6
HASIL DAN PEMBAHASAN 8
Tanaman Tomat Sumber ToCV 8
Reaksi Antiserum terhadap ToCV 9
Agarose Gel precipitation Test (AGPT) 9
Dot Immunobinding Assay (DIBA) 10
Titer Antiserum ToCV 11
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Komposisi reaktan reverse transcription untuk sintesis cDNA genom ToCV
2 Gejala penyakit klorosis pada tanaman tomat, dicirikan dengan (a) menguningnya bagian di antara tulang daun (interveinal yellowing); (b) nekrotik pada beberapa bagian daun; dan (c) terjadinya perubahan warna menjadi keunguan (bronzing)
8
3 Hasil amplifikasi DNA terhadap gen coat protein ToCV menggunakan reverse transcription-polymerase chain reaction. Marker 1 kb DNA ladder (Thermo Scientific, USA) [Lajur M]; kontrol negatif (tanaman sehat) [Lajur K(-)]; tanaman bergejala [Lajur 1, 2, dan 3]
9
4 Reaksi antigen (sap tanaman terinfeksi ToCV [AgTo] atau sap tanaman tomat sehat [AgKo] dengan antibodi (antiserum ToCV [AsTo])) pada metode agarose gel precipitation test
10
5 Reaksi antigen (sap tanaman tomat sehat [Lajur H] dan tomat terinfeksi ToCV [Lajur T]) dengan antibodi (antiserum ToCV) pada metode dot immunobinding assay
10
6 Reaksi antiserum ToCV [As] terhadap antigen (partikel virus dalam sap tanaman tomat [Ag]) melalui agarose gel pricipitation test pada pengenceran 1/1 [Lajur a]; 1/2 [Lajur b]; dan (c) 1/4 [Lajur c]
12
7 Reaksi antiserum ToCV terhadap antigen (partikel virus dalam sap tanaman tomat) melalui dot immunobinding assay pada pengenceran 1/1000 [Membran a]; 1/10000 [Membran b]; dan 1/100000 [Membran c]
PENDAHULUAN
Latar Belakang
Tomato chlorosis virus (ToCV) merupakan salah satu anggota genus Crinivirus yang termasuk ke dalam famili Closteroviridae yang ditularkan oleh kutukebul dan terbatas hanya pada jaringan floem. Virus ini pertama kali ditemukan tahun 1996 di pertanaman tomat (Lycopersicon esculentum Mill.) rumah kaca di daerah Florida bagian utara. Gejala yang ditimbulkan berupa menguningnya bagian di antara tulang daun (interveinal yellowing) yang berawal dari daun-daun di bagian bawah dan berkembang ke bagian atas tanaman. Gejala demikian dapat menghambat proses fotosintesis tanaman (Wintermantel dan Wisler 2006). Selain itu virus ini juga dapat menurunkan kebugaran tanaman dan menyebabkan kehilangan hasil (Wisler et al. 1998a) karena menunda proses pematangan buah, serta buah yang dihasilkan ukurannya menjadi jauh lebih kecil (Navas-Castillo et al. 2000). Keberadaan ToCV telah dilaporkan dibeberapa negara di dunia seperti Amerika Serikat (Wisler et al. 1998b) khususnya Florida (Wintermantel dan Wisler 2006), Cyprus (Papayiannis et al. 2006), Meksiko (Alvarez-Ruiz et al. 2007), Turki (Cevik 2008), Pulau Mayotte (Masse et al.
2008) dan termasuk Indonesia (Hartono dan Wijanarko 2007; Suastika et al.
2010) karena telah menjadi kendala penting bagi pertanaman tomat.
Adanya serangan ToCV tentu sangat mengkhawatirkan mengingat produksi tomat Indonesia yang cukup tinggi. Berdasarkan data Badan Pusat Statistik (BPS) produksi tomat di Indonesia pada tahun 2010, 2011, dan 2012 secara berturut-turut adalah 891 616 ton, 954 046 ton, dan 887 556 ton (BPS 2012). Perlu adanya cara tepat untuk mengetahui adanya infeksi virus ini sedini mungkin di lapangan. Beberapa ahli telah mengembangkan berbagai macam cara untuk mendeteksi keberadaan virus yang menginfeksi tanaman salah satunya melalui deteksi molekuler seperti reverse transcription-polymerase chain reaction (RT-PCR) (Agrios 2005). Deteksi melalui RT-PCR lebih banyak dilakukan karena dapat memberikan hasil yang cepat serta akurat. Akan tetapi, deteksi melalui RT-PCR sangat sulit dilakukan karena kendala biaya alat dan bahan yang cukup mahal. Oleh karena itu cara lain yang mulai dikembangkan salah satunya adalah deteksi melalui uji serologi.
Uji serologi merupakan suatu metode yang digunakan untuk deteksi virus pada tanaman yang dapat memberikan hasil lebih sensitif, spesifik, dan tidak memerlukan waktu yang cukup lama serta dengan biaya yang terjangkau. Metode uji serologi untuk deteksi virus tanaman terdiri dari agarose gel precipitation test
2
Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis reaksi antiserum ToCV dan mengukur titer antiserum ToCV melalui AGPT dan DIBA.
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi mengenai cara deteksi ToCV pada tanaman tomat dengan menggunakan uji serologi dengan titer antiserum yang berbeda.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, pada bulan Maret sampai September 2013.
Bahan dan Alat
Bahan yang digunakan terdiri dari daun tanaman tomat yang positif terinfeksi Tomato chlorosis virus (ToCV), antiserum ToCV yang telah tersedia di Laboratorium Virologi Tumbuhan IPB yang merupakan hasil imunisasi kelinci dengan protein produk ekspresi gen CP ToCV pada Escherichia coli (Kurniawati 2012).
Metode Penelitian
Tanaman Tomat Sumber ToCV
Sampel tanaman tomat diperoleh dari daerah Pacet dan Pasir Sarongge Kabupaten Cianjur, Jawa Barat berdasarkan gejala yang dimiliki seperti menguningnya bagian di antara tulang daun (interveinal yellowing), nekrotik, serta perubahan warna daun menjadi merah keunguan (bronzing). Verifikasi keberadaan ToCV pada sampel tanaman tersebut dilakukan melalui RT-PCR yang terdiri dari proses ekstraksi RNA total, sintesis complementary cDNA, amplifikasi DNA, dan elektroforesis dengan menggunakan Bench-Top Protocols for Xprep Plant RNA Mini Kit (PKT Korea).
Ekstraksi RNA Total. Ekstraksi dilakukan untuk mendapatkan RNA total dengan menggunakan Bench-Top Protocols for Xprep Plant RNA Mini Kit (PKT Korea). Sebanyak 0.1 g sampel daun tanaman yang bergejala digerus dalam nitrogen cair dan ditambahkan 500 µl bufer XPRB yang mengandung 1%
mercaptoethanol. Hasil gerusan selanjutnya dipipet ke dalam filter column
berwarna putih dan disentrifugasi selama 2 menit dengan kecepatan 13000 rpm. Supernatan yang ada dipipet tanpa menyentuh pelet dan dipindahkan ke tabung koleksi baru sambil dihitung volumenya. Selanjutnya supernatan ditambahkan dengan ethanol 96% sebanyak 1/2 volume supernatan yang ada (±100 µl). Suspensi tersebut dicampur dengan cara membolak-balikkan tabung koleksi sebanyak 10 kali.
Setelah tercampur, suspensi tersebut dipipet ke dalam XPPLR mini column
4
dipindahkan ke tabung koleksi yang baru dan disentrifugasi selama 3 menit dengan kecepatan 13000 rpm. Sebanyak 20 µl RNAse free water (air bebas nuklease) ditambahkan ke dalam XPPLR mini column dan didiamkan selama 1 menit. Kemudian, disentrifugasi kembali selama 2 menit dengan kecepatan 13000 rpm untuk mendapatkan RNA total. RNA total ini yang selanjutnya digunakan sebagai templat dalam reaksi RT.
Sintesis complementary cDNA. Proses RT-PCR dilakukan menggunakan kit komersial Access RT-PCR System (Promega, USA). Hasil ekstraksi RNA berupa RNA total selanjutnya dilakukan sintesis DNA melalui proses Reverse Transcription (RT) atau transkipsi balik yang digunakan untuk merubah RNA menjadi DNA. Adapun komposisi bahan yang digunakan dalam proses RT-PCR terdapat pada Tabel 1.
Tabel 1 Komposisi reaktan reverse transcription untuk sintesis cDNA genom ToCV
Reaksi RT dilakukan dengan menggunakan Automated Thermal cycler
(Gene Amp PCR System 9700; PE Applied Biosystem, USA) dalam volume total 10 µl. RT diprogram satu siklus pada suhu 25 ºC selama 5 menit, 42 ºC selama 60 menit, dan 70 ºC selama 15 menit. Hasil RT berupa cDNA selanjutnya digunakan dalam proses PCR.
Amplifikasi DNA. Reaksi PCR dilakukan dengan menggunakan Go Taq Green Master Mix 2x (Promega, Madison, USA) dalam volume total 25 µl. Adapun komposisi bahan yang digunakan dalam proses PCR terdapat pada Tabel 2.
5
Primer yang digunakan dalam proses PCR merupakan primer yang spesifik untuk mendeteksi ToCV, yaitu ToCV CP-R (5’-AATTAAAAGCTTTTAGCAA CCAGTTATCGATGCAAG-3’) dan ToCV CP-F (5’-AATTAAGGATCCGAG AACAGTGCYGTTGC-3’) yang digunakan untuk mengamplifikasi genom virus pada bagian coat protein (CP) sebesar 700 bp.
Program amplifikasi terdiri dari denaturasi awal pada suhu 94 ºC selama 4 menit; dilanjutkan 30 siklus untuk denaturation (fase pemisahan utas DNA) pada suhu 94 ºC selama 1 menit, annealing (penempelan primer) pada suhu 45 ºC selama 1 menit, elongation (sintesis untaian DNA baru) pada suhu 72 ºC selama 2 menit; ditambah pasca extention pada suhu 72 ºC selama 10 menit, dan disimpan pada 4 ºC. Proses PCR dilakukan dengan menggunakan mesin PCR Automated Thermal Cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA).
6
Agarose Gel Precipitation Test (AGPT)
Reaksi antigen-antibodi pada metode AGPT dilakukan pada media 1% gel agarose (Sigma, USA). Agar dibuat dengan melarutkan 0.1 g agarose dan 0.01 g Natrium azida dalam 5 ml aquabidest dan 5 ml buferPBS [NaCl 8 g, Na2HPO4
1.15 g, KH2PO4 0.2 g, KCl 0.2 g, aquades 1000 ml] pH 7.4 yang kemudian
dipanaskan dalam microwave selama 1 menit. Agar yang sudah cair tersebut dituangkan di atas kaca preparat dengan ketebalan sekitar 2 mm dan dibiarkan pada suhu ruang hingga terbentuk gel. Gel agar kemudian dilubangi dengan cork borer berdiameter 4 mm dan jarak 4 mm antar lubang. Lubang diisi dengan reaktan berbeda yang terdiri dari antigen dan antibodi sebanyak 20 µl. Antigen yang dimasukkan berupa sap tanaman tomat yang positif terserang ToCV dan tanaman sehat sebagai kontrol negatif. Sap disiapkan dengan menggerus daun tomat dalam bufer PBS dengan perbandingan 1/10 (b/v). Antibodi yang dimasukkan berupa antiserum ToCV yang telah tersedia di Laboratorium Virologi Tumbuhan IPB yang merupakan hasil imunisasi kelinci dengan protein produk ekspresi gen CP ToCV pada E. coli (Kurniawati 2012). Antiserum diencerkan mulai dari 1/1 (tanpa pengenceran), 1/2, 1/4, 1/8, 1/16, 1/32, sampai 1/64 dalam
aquabidest. Terbentuknya garis presipitasi sebagai hasil dari reaksi antigen-antibodi pada gel agarose diamati setelah inkubasi semalam pada suhu ruangan.
Gambar 1 Ilustrasi pengujian AGPT. antigen; antibodi.
Dot Immunobinding Assay (DIBA)
DIBA dilakukan berdasarkan metode Mahmood et al. (1997). Membran nitroselulosa direndam terlebih dahulu dalam bufer TBS [Tris HCl 0.02 M, NaCl 0.15 M, dalam 100 ml aquades steril] selama 1 menit dan dikeringanginkan sebelum digunakan. Antigen berupa sap disiapkan dengan menggerus daun tomat sumber virus dan yang sehat dalam bufer TBS dengan perbandingan 1/10 (b/v). Setelah dijernihkan dengan sentrifugasi 5000 rpm selama 2 menit, sebanyak 4 µl sap diteteskan pada membran nitroselulosa dan dibiarkan hingga kering. Selanjutnya membran direndam dalam larutan blocking (non fat milk 2% dalam TBS yang mengandung Triton X-100 dengan konsentrasi akhir 2%) selama 2 jam sambil digoyang dengan kecepatan 50 rpm. Membran dicuci sebanyak 5 kali dengan menggunakan dH2O selama 5 menit untuk setiap pencucian sambil
7
direndam dalam antiserum ToCV yang diencerkan 1/1000, 1/10000, dan 1/100000 dalam TBSM (TBS yang mengandung non fat milk 2%) selama 24 jam pada suhu 4 ºC. Setelah dicuci sebanyak 5 kali dengan bufer TBST(TBS, 0.05% Tween-20), membran direndam dalam konjugat Goat anti rabbit-IgG (Sigma, USA) yang dilarutkan dengan seri pengenceran yang sama dalam TBSM, selama 60 menit dalam suhu 4 ºC. Membran dicuci kembali dengan TBST sebanyak 5 kali. Setelah pencucian, membran siap untuk diwarnai di dalam larutan nitro blue tetrazolium
(NBT)/ bromo chloro indolil phosphate (BCIP) sebanyak 100 µl untuk setiap 5 ml bufer AP [Tris HCl 0.1 M, NaCl 0.1 M, MgCl2 5 mM, pH 9.5 dalam 200 ml
HASIL DAN PEMBAHASAN
Tanaman Tomat Sumber ToCV
Tanaman tomat yang digunakan sebagai sumber ToCV merupakan tanaman yang menunjukkan gejala penyakit klorosis yang dikoleksi dari daerah Pacet dan Pasir Sarongge Kabupaten Cianjur, Jawa Barat. Penyakit klorosis pada tanaman tomat sampel dicirikan dengan gejala menguning pada bagian di antara tulang daun (interveinal yellowing), beberapa bagian daun mengalami nekrotik, atau perubahan warna menjadi merah keunguan (bronzing) (Gambar 2). Gejala seperti ini bersesuaian dengan yang dideskripsikan oleh Wintermantel dan Wisler (2006).
Gambar 2 Gejala penyakit klorosis pada tanaman tomat, dicirikan dengan (a) menguningnya bagian di antara tulang daun (interveinal yellowing); (b) nekrotik pada beberapa bagian daun; dan (c) terjadinya perubahan warna menjadi keunguan (bronzing).
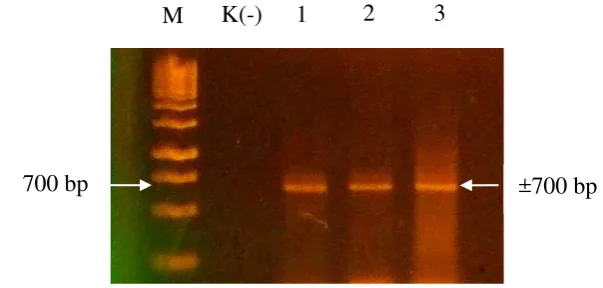
Deteksi keberadaan ToCV pada tanaman tomat sampel berhasil dilakukan melalui RT-PCR (Gambar 1). Dari beberapa tanaman tomat yang dikoleksi, tiga diantaranya memberikan sinyal positif pada RT-PCR yang menggunakan primer spesifik untuk ToCV yaitu CP-R (5’AATTAAAAGCTTTTAGCAACCAGT TATCGATGCAAG-3’) dan ToCV CP-F (5’-AATTAAGGATCCGAGAACAG TGCYGTTGC-3’).
9
Gambar 3 Hasil amplifikasi DNA terhadap gen coat protein ToCV menggunakan
reverse transcription-polymerase chain reaction. Marker 1 kb DNA
ladder (Thermo Scientific, USA) [Lajur M]; kontrol negatif (tanaman sehat) [Lajur K(-)]; tanaman bergejala [Lajur 1, 2, dan 3].
Hal ini ditunjukkan dengan ditemukannya pita DNA hasil amplifikasi dengan PCR berukuran ±700 bp (Fitriasari 2010) yang merupakan DNA ToCV yang sesuai dengan target basa primer CP-F dan CP-R yang digunakan (Gambar 3). Tanaman yang positif terinfeksi ToCV digunakan sebagai sumber virus pada uji serologi selanjutnya.
Reaksi Antiserum terhadap ToCV
Agarose Gel Precipitation Test (AGPT)
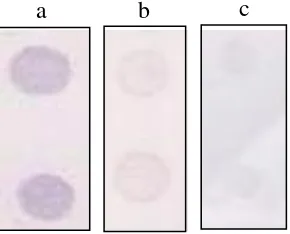
AGPT dilakukan untuk melihat reaksi pengendapan antigen oleh antibodi spesifik. Pengendapan antigen oleh antibodi ini diperlihatkan oleh adanya garis presipitasi di media gel agarose (Natih et al. 2010). Hasil pengujian dengan metode AGPT menunjukkan bahwa antiserum dapat bereaksi dengan jelas terhadap antigen ToCV. Hal ini ditandai dengan terbentuknya garis presipitasi berwarna putih yang tampak di antara lubang gel agarose yang diisi dengan antigen (sap tanaman bergejala) dan antibodi (antiserum) setelah 2-3 hari pengamatan (Gambar 4). Reaksi yang tampak pada pada kontrol negatif menunjukkan antiserum tidak bereaksi terhadap antigen tanaman, sehingga tidak terbentuk garis presipitasi.
700 bp ±700 bp
10
Gambar 4 Reaksi antigen (sap tanaman terinfeksi ToCV [AgTo]) atau sap tanaman tomat sehat [AgKo] dengan antibodi (antiserum ToCV [AsTo]) pada metode agarose gel precipitation test.
Garis presipitasi yang tidak terbentuk pada kontrol negatif menandakan bahwa antibodi yang terkandung di dalam antiserum tersebut hanya mengenali protein CP ToCV (dalam bentuk partikel virus) dan tidak mengenali protein lain seperti protein tanaman tomat (Adnyani 2012). Reaksi positif yang terdapat pada (Gambar 4) menunjukkan bahwa antiserum hasil imunisasi kelinci dengan protein produk ekspresi gen CP ToCV pada E. coli (Kurniawati 2012) dengan spesifik dapat bereaksi terhadap antigen ToCV.
Dot Immunobinding Assay (DIBA)
Hasil pengujian dengan metode DIBA yang menunjukkan reaksi antara antibodi (antiserum ToCV) dengan antigen (sap tanaman tomat sakit dan sehat) tampak pada Gambar 5. Hasil pengujian menunjukkan tidak terjadi reaksi antara antiserum ToCV dengan komponen tanaman tomat. Hal ini ditunjukkan dengan tidak terjadinya perubahan warna ungu pada membran yang telah ditetesi sap tanaman tomat sehat (Gambar 5). Berbeda dengan bagian membran yang ditetesi sap tanaman tomat yang positif terserang ToCV, terjadi reaksi antara antiserum ToCV dengan antigen ToCV (partikel virus) yang ditunjukkan dengan adanya perubahan warna ungu pada membran yang ditetesi sap tanaman sumber ToCV (Gambar 5).
Gambar 5 Reaksi antigen (sap tanaman tomat sehat [Lajur H] dan tomat terinfeksi ToCV [Lajur T]) dengan antibodi (antiserum ToCV) pada metode dot immunobinding assay.
10
AgKo AgTo
AsTo AsTo
11
Perubahan warna ungu disebabkan karena antiserum ToCV yang merupakan hasil imunisasi kelinci dengan protein produk ekspresi gen CP ToCV pada E. coli
(Kurniawati 2012) yang digunakan sebagai antibodi primer berikatan dengan pita CP ToCV sebagai antigennya. Anti Rabbit IgG AP-Conjugated (konjugat Goat
anti rabbit-IgG) yang digunakan sebagai antibodi sekunder akan mengikat antibodi primer tersebut, sehingga pada saat dilakukan pewarnaan dengan menggunakan substrat NBT/ BCIP yang akan berikatan dengan enzim AP (alkalin phosphatase) pada antibodi sekunder sehingga menghasilkan dot berwarna ungu pada membran nitroselulosa (Widodo dan Aulanni’am 2005). Sama halnya seperti hasil yang didapatkan dari metode AGPT, bahwa antibodi yang terkandung di dalam antiserum tersebut hanya mengenali protein CP ToCV (dalam bentuk partikel virus) dan tidak mengenali protein lain seperti protein tanaman tomat (Adnyani 2012), sehingga hasil yang ditunjukkan pada kontrol negatif (tanaman sehat) tidak menunjukkan adanya perubahan warna ungu. Selain itu, antiserum yang digunakan (diuji) bereaksi spesifik hanya dengan partikel ToCV.
Titer Antiserum ToCV
Titer antiserum adalah tingkat pengenceran tertinggi dari suatu antiserum yang masih memberikan sinyal positif terhadap adanya kompleks antigen-antibodi pada uji serologi tertentu (Noordam 1973). Antigen yang digunakan dalam penelitian ini merupakan partikel ToCV yang terdapat dalam sap tanaman tomat yang positif terinfeksi ToCV dan tidak dilakukan pengenceran. Sedangkan antiserum yang digunakan merupakan hasil imunisasi kelinci dengan protein produk ekspresi gen CP ToCV pada E. coli (Kurniawati 2012) yang dilakukan seri pengenceran pada tingkat tertentu yang berbeda untuk setiap uji serologi. Hasil titer antiserum ToCV yang digunakan disajikan pada Tabel 3.
Tabel 3 Titer antiserum poliklonal ToCV pada metode agarose gel precipitation test (AGPT) dan dot immunobinding assay (DIBA) pada seri
*Pengujian sejenis telah dilakukan sebanyak 5-7 kali dan memberikan hasil yang konsisten
12
berbeda. Pada metode AGPT, sinyal positif merupakan akumulasi presipitasi kompleks Ag-Ab yang dilihat secara langsung. Oleh karena itu, reaksi antigen dan antibodi pada AGPT memberikan sinyal positif pada tingkat pengenceran antiserum yang sangat rendah yaitu 1/2, sedangkan pada tingkat pengenceran yang lebih tinggi sudah tidak terlihat lagi garis presipitasi (Gambar 5, Tabel 3). Hal ini terjadi karena pada tingkat pengenceran yang lebih tinggi, kompleks Ag-Ab yang terakumulasi tidak mencukupi untuk dilihat secara langsung dengan kasat mata. Berdasarkan hasil penelitian ini dapat dinyatakan bahwa titer antiserum ToCV ini mencapai 1/2 dengan AGPT.
Gambar 6 Reaksi antiserum ToCV [As] terhadap antigen (partikel virus dalam sap tanaman tomat [Ag]) melalui agarose gel pricipitation test pada pengenceran 1/1 [Lajur a]; 1/2 [Lajur b]; dan (c) 1/4 [Lajur c].
13
Gambar 7 Reaksi antiserum ToCV terhadap antigen (partikel virus dalam sap tanaman tomat) melalui dot immunobinding assay pada pengenceran 1/1000 [Membran a]; 1/10000 [Membran b]; dan 1/100000 [Membran c].
Menggunakan kedua metode serologi (AGPT dan DIBA) dapat terlihat bahwa antiserum poliklonal yang digunakan mampu mendeteksi keberadaan ToCV dalam jaringan tanaman tomat. Tingginya konsentrasi antiserum yang digunakan dalam metode AGPT (titer 1/2) membuat metode ini menjadi tidak efisien. Untuk menimbulkan sinyal positif pada metode AGPT diperlukan konsentrasi antigen dan antibodi yang sangat tinggi karena sensitivitasnya yang sangat rendah (Sere et al. 2005). Berbeda dengan penggunaan antiserum dalam metode DIBA yang hanya diperlukan dalam konsentrasi yang sangat rendah (titer 1/10000). DIBA memiliki tingkat sensitivitas lebih tinggi jika dibandingkan dengan AGPT. Hal ini dikarenakan membran nitroselulosa yang digunakan sangat baik untuk blotting protein. Antigen yang mengandung protein ToCV yang ditetesi di atas membran dapat terikat dengan sangat baik di membran tersebut. Hal ini ditunjukkan dengan tingginya titer antiserum yang didapatkan dari metode DIBA jika dibandingkan dengan AGPT. Walaupun DIBA memiliki sensitivitas yang lebih tinggi dibandingkan AGPT, tidak berarti metode AGPT harus ditinggalkan karena metode ini merupakan satu-satunya metode serologi yang dapat membedakan isolat virus yang berbeda tipe serologinya.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan pengujian melalui AGPT dan DIBA terlihat bahwa antiserum ToCV poliklonal yang diuji pada penelitian ini bereaksi secara spesifik dengan partikel ToCV dan tidak terjadi reaksi silang dengan komponen protein jaringan tanaman tomat. Titer antiserum yang diuji mencapai 1/2 pada AGPT dan 1/10000 pada DIBA, sehingga kedua metode ini sangat layak digunakan sebagai sarana deteksi ToCV pada tanaman tomat.
Saran
DAFTAR PUSTAKA
Adnyani NNP. 2012. Uji serologi Tomato infectious chlorosis virus (TICV) pada tanaman tomat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Agrios GN. 2005. Plant Pathology. 5th Ed. New York (US): Academic Press. Alvarez-Ruiz P, Jimenez CG, Leyva-Lopez NE, Mendez-Lozano J. 2007. First
report of Tomato chlorosis virus infecting tomato crops in Sinaloa, Mexico. Plant Pathol. 56(6):1043. doi: 10.1111/j.1365-3059.2007.01626. [BPS] Badan Pusat Statistik. 2012. Produksi buah-buahan di Indonesia. [Internet].
Badan Pusat Statistik; [diunduh pada 2013 Apr 17]. Tersedia pada: http://www.bps.go.id.
Cevik B, Erki G. 2008. First report of Tomato chlorosis virus in Turkey. Plant Pathol. 57(4):767. doi: 10.1111/j.1365-3059.2007.01795.
Fitriasari ED. 2010. Keefektifan kutukebul dalam menularkan virus penyebab penyakit kuning pada tanaman tomat [tesis]. Bogor (ID): Intitut Pertanian Bogor.
Hartono S, Wijonarko A. 2007. Karakterisasi biologi molekuler Tomato infectious chlorosis virus penyebab penyakit kuning pada tanaman tomat di Indonesia.
Akta Agrosia. 2(11/12):139-146.
Kurniawati F. 2012. Karakterisasi dan ekspresi gen coat protein Tomato infectious chlorosis virus pada Escherichia coli [tesis]. Bogor (ID): Institut Pertanian Bogor.
Mahmood T, Hein GL, French RC. 1997. Development of serological procedures for rapid and reliable detection of Wheat streak mosaic virus in a single wheat curl mite. Plant Dis. 81(3):250-253.
Massea D, Lefeuvre P, Delatte H, Karime ALA, Hostachy B, Reynaud B, Lett JM. 2008. Tomato chlorosis virus: first report in Mayotte Island. Plant Pathol. 57(16):388. doi: 10.1111/j.1365-3059.2007.01760.
Naidu RA, Hughes Jd’A. 2003. Methods for the detection of plant viral diseasesin plan virology in sub-Saharan Africa, Proceedings of plant virology. IITA, Ibadan, Nigeria. Eds. Hughes JDA, Odu B, pp. 233-260.
Natih KKN, Soejoedono RD, Wibawan IWT, Pasaribu FH. 2010. Preparasi imunoglobulin G kelinci sebagai antigen penginduksi antibodi spesifik terhadap virus Avian Influenza H5N1 strain Legok. J Veter. 11(2):99-106. Navas-Castillo J, Camero R, Bueno M, Moriones E. 2000. Severe yellowing
outbreaks in tomato in Spain associated with infections of Tomato chlorosis virus. Plant Dis. 84(8):835-837.
Noordam D. 1973. Identification of Plant Viruses Methods and Experiments.
Wageningen: Center for Agricultural Publishing and Documentation.
Papayiannis LC, Ioannou N , Dovas CI , Maliogka VI,Katis NI. 2006. First report of Tomato chlorosis virus on tomato crops in Cyprus. Plant Pathol. 55(4):567. doi: 10.1111/j.1365-3059.2006.01423.
16
Sere Y, Onasanya A, Afolabi AS, Abo EM. 2005. Evaluation and potential of double immunodifusion gel assay for serological characterization of Rice yellow mottle virus isolates in West Africa. Afric J of Biotec. 4(2):197-205. Suastika G, Hartono S, Nishigawa H, Natsuaki T. 2010. Yellowing disease
outbreaks in tomato in Indonesia associated with infection of Tomato chlorosis virus and Tomato infectious chlorosis virus. [abstract]ISSAAS International Congress 2010: Agricultural Adaptation in Response to Climate Change; 2010 Nov 14-18; Denpasar (ID).
Widodo E, Aulianni’am. 2005. Spesifitas antibodi BovineZona Pellusida 3 (Anti-bZP3) terhadap ZP3 kelinci berbasis bZP3 sebagai antigen kontraseptif. J Chem. u5(2):182 – 187.
Wintermantel WM, Wisler GC. 2006. Vector specificity, host range, and genetic diversity of Tomato chlorosis virus. Plant Dis. 90(6):814-819.
Wisler GC, Li RH, Liu HY, Lowry DS, Duffus JE. 1998a. Tomato chlorosis virus: a new whitefly-transmitted, phloem-limited, bipartite closterovirus of tomato. Phytopathology. 88(5):402-409.
Wisler GC, Duffus JE, Liu HY, Li RH. 1998b. Ecology and epidemiology of whitefly-transmitted closteroviruses. Plant Dis. 82(3):270-280.
RIWAYAT HIDUP
Penulis dilahirkan di Surakarta pada tanggal 26 Desember 1990 sebagai anak pertama dari tiga bersaudara pasangan Bapak Samsul Rizal dan Ibu Yulizar. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 112 Jakarta Barat, DKI Jakarta .
Penulis melanjutkan pendidikan di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2009. Penulis diterima dengan mayor Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Untuk mendukung mata kuliah mayor yang penulis ambil, penulis juga mengambil berbagai mata kuliah dari beberapa mayor departemen lain sebagai supporting course, seperti Ekonomi Sumberdaya (Departemen Ekonomi dan Sumberdaya Lingkungan, Fakultas Ekonomi dan Manajemen), Silvika dan Silvikultur (Departemen Silvikultur, Fakultas Kehutanan), Manajemen Keuangan Konsumen (Departemen Ilmu Keluarga dan Konsumen, Fakultas Ekologi Manusia), Metode Penangkapan Ikan (Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan).

![Gambar 4 Reaksi antigen (sap tanaman terinfeksi ToCV [AgTo]) atau sap](https://thumb-ap.123doks.com/thumbv2/123dok/458208.423124/29.595.247.344.84.191/gambar-reaksi-antigen-tanaman-terinfeksi-tocv-agto-atau.webp)