CUT DARA PERMATA SARI. Pengaruh Pemberian Ekstrak Minyak Jintan Hitam (Nigella sativa) Terhadap Organ Limfoid Sekunder Mencit (Mus musculus). Dibimbing oleh SRI ESTUNINGSIH dan MAWAR SUBANGKIT
Alasan dilakukannya penelitian ini menggunakan jintan hitam (Nigella sativa) adalah mendukung peningkatan minat masyarakat terhadap hidup sehat dan kembali ke alam. Tujuan dari penelitian ini adalah untuk mempelajari pengaruh pemberian ekstrak minyak jintan hitam terhadap organ limfoid sekunder mencit (Mus musculus). Sebanyak 24 ekor mencit berumur empat minggu dibagi menjadi dua kelompok berdasarkan jenis kelaminnya. Kelompok pertama adalah kelompok jantan dan kelompok lainnya adalah kelompok betina. Kedua kelompok ini kemudian dibagi lagi menjadi empat kelompok perlakuan, masing-masing kelompok terdiri atas tiga ekor mencit. Kelompok I adalah kontrol (diberikan aquades 0,1 ml), kelompok II (diberikan 0,1 ml ekstrak minyak jintan hitam), kelompok III (diberikan 0,2 ekstrak minyak jintan hitam), kelompok IV (diberikan 0,3 ml formulasi ekstrak minyak jintan hitam dan madu). Perlakuan ini dilakukan selama dua bulan, kemudian mencit dieuthanasi. Organ limfonodus dan limpa diambil sebagai preparat histopatologi. Preparat organ ini diproses sampai menjadi slide histopatologi dan diwarnai dengan pewarnaan Haematoxilyn Eosin. Parameter pengamatan pada penelitian ini adalah rataan jumlah dan luas folikel limfoid pada kedua organ limpa dan limfonodus. Data kuantitatif yang diperoleh dianalisis dengan menggunakan uji ANOVA dan dilanjutkan dengan uji Duncan. Kesimpulan yang diperoleh dari penelitian ini adalah mencit yang telah diberikan ekstrak minyak mengalami peningkatan rataan luas folikel limfoid dari limpa dan limfonodus pada kelompok II, III, dan IV berbeda nyata (p<0,05) dibandingkan dengan kelompok kontrol.
SEKUNDER MENCIT (Mus musculus)
CUT DARA PERMATA SARI
FAKULTAS KEDOKTERAN HEWAN
INSTUTUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi dengan judul Pengaruh Pemberian Ekstrak Minyak Jintan Hitam (Nigella sativa) Terhadap Organ Limfoid Sekunder Mencit (Mus musculus) adalah karya saya dengan arahan dari Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2012
CUT DARA PERMATA SARI. Pengaruh Pemberian Ekstrak Minyak Jintan Hitam (Nigella sativa) Terhadap Organ Limfoid Sekunder Mencit (Mus musculus). Dibimbing oleh SRI ESTUNINGSIH dan MAWAR SUBANGKIT
Alasan dilakukannya penelitian ini menggunakan jintan hitam (Nigella sativa) adalah mendukung peningkatan minat masyarakat terhadap hidup sehat dan kembali ke alam. Tujuan dari penelitian ini adalah untuk mempelajari pengaruh pemberian ekstrak minyak jintan hitam terhadap organ limfoid sekunder mencit (Mus musculus). Sebanyak 24 ekor mencit berumur empat minggu dibagi menjadi dua kelompok berdasarkan jenis kelaminnya. Kelompok pertama adalah kelompok jantan dan kelompok lainnya adalah kelompok betina. Kedua kelompok ini kemudian dibagi lagi menjadi empat kelompok perlakuan, masing-masing kelompok terdiri atas tiga ekor mencit. Kelompok I adalah kontrol (diberikan aquades 0,1 ml), kelompok II (diberikan 0,1 ml ekstrak minyak jintan hitam), kelompok III (diberikan 0,2 ekstrak minyak jintan hitam), kelompok IV (diberikan 0,3 ml formulasi ekstrak minyak jintan hitam dan madu). Perlakuan ini dilakukan selama dua bulan, kemudian mencit dieuthanasi. Organ limfonodus dan limpa diambil sebagai preparat histopatologi. Preparat organ ini diproses sampai menjadi slide histopatologi dan diwarnai dengan pewarnaan Haematoxilyn Eosin. Parameter pengamatan pada penelitian ini adalah rataan jumlah dan luas folikel limfoid pada kedua organ limpa dan limfonodus. Data kuantitatif yang diperoleh dianalisis dengan menggunakan uji ANOVA dan dilanjutkan dengan uji Duncan. Kesimpulan yang diperoleh dari penelitian ini adalah mencit yang telah diberikan ekstrak minyak mengalami peningkatan rataan luas folikel limfoid dari limpa dan limfonodus pada kelompok II, III, dan IV berbeda nyata (p<0,05) dibandingkan dengan kelompok kontrol.
CUT DARA PERMATA SARI. The Effect of Black Seed (Nigella sativa) Oil Extracts on Secondary Lymphoid Organ of Mice (Mus musculus). Under direction of SRI ESTUNINGSIH and MAWAR SUBANGKIT
Concerning to the people who were realized the importance of returning to a healthy lifestyle and back to nature was the reason of this research done using black seed (Nigella sativa). The purpose of this research was to study the effect of black seed oil extracts in secondary lymphoid organ of mice (Mus musculus). Twenty four of 4 weeks age mice were divided into 2 groups by gender. First group was male group and the other was female group. Both male and female groups were subdivided into 4 groups, each group consisted of three mice. Group I was control (received aquadest 0,1 ml), Group II (received 0,1 ml black seed oil Extracts), Group III (received 0,2 ml black seed oil extracts), and Group IV (received 0,3 ml combination of black seed oil Extracts and honey). This treatment were done for two months, the mice were then euthanized. The lymph node and spleen were collected as histopathological samples. Samples were processed routinely to prepare histopathology slide stained with Haematoxylin Eosin. The parameters observed were the number and width of lymphoid follicle on both spleen and lymph node. Quantitative data were analyzed with ANOVA test and followed by Duncan test. The observation results of that the mice given black seed oil extracts showed increased of lymphoid follicle wide of spleen and lymph node on group II, III, and IV which are significant (p<0,05) compare to the control group.
© Hak Cipta Milik IPB, Tahun 2012
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SEKUNDER MENCIT
(Mus musculus)
CUT DARA PERMATA SARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTUTUT PERTANIAN BOGOR
(Mus musculus) Nama Mahasiswa : Cut Dara Permata Sari
NRP : B04070028
Program Studi : Kedokteran Hewan
Fakultas Kedokteran Hewan Institut Pertanian Bogor
Menyetujui, Pembimbing I
Dr. drh. Sri Estuningsih, M.Si, APVet
Pembimbing II
drh. Mawar Subangkit NIP. 19600629.199002.2.001 NIP. 19850522.201012.1.006
Mengetahui, Wakil Dekan
Fakultas Kedokteran Hewan Institut Pertanian Bogor
drh. H. Agus Setiyono, MS, PhD, APVet NIP. 19630810.198803.1.004
Penulis yang bernama lengkap Cut Dara Permata Sari dilahirkan di Tanjung Karang, Bandar Lampung pada tahun 1990 yang merupakan anak ketiga dari pasangan ayah TM. Nur dan ibu Elisabeth Agustina.
Pendidikan formal penulis dimulai dari SDN 1 Labuan Ratu, Bandar Lampung sampai kelas 6, namun pada akhir cawu 1 kelas 6 hingga lulus pada tahun 2001 di lanjutkan di SDN 14 Meulaboh, Aceh Barat. Kemudian dilanjutkan ke SMPN 2 Meulaboh dan lulus pada tahun 2004. Pendidikan SMA penulis selesaikan di SMAN 5 Wira Bangsa, Aceh Barat dan lulus pada tahun 2007, kemudian melanjutkan pendidikan ke IPB pada tahun yang sama melalui jalur Undangan Seleksi Masuk IPB (USMI). Mayor yang dipilih penulis adalah Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (FKH IPB).
SWT atas segala rahmat dan hidayah-Nya yang senantiasa dilimpahkan berupa kekuatan lahir batin sehingga skripsi ini dapat diselesaikan.
Dengan segala keikhlasan hati, penulis mengucapkan terima kasih kepada: 1. Papa (TM. Nur) dan Mama (Ellisabeth Agustina) tercinta serta Bapak (T.
Usman TM.) dan Ibu (Darmi) tersayang, yang senantiasa memberikan kasih sayang dan dorongan dalam bentuk doa, motivasi, dan materi. Kalian adalah anugerah terbaik dalam hidup.
2. Kakak dan Abang serta adik-adik yang terus memberikan semangat dan keceriaan sehingga membuat penulis dapat selalu tersenyum. Semoga kalian menjadi manusia yang lebih baik dari penulis.
3. Ibu Dr. drh. Sri Estuningsih, M.Si, APVet, dan Bapak drh. Mawar Subangkit, selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dan masukan dalam menyelesaikan skripsi ini. Beliau adalah sumber motivasi penulis dalam menyelesaikan skripsi ini.
4. Dr. drh. Eko S Pribadi, M.Si sebagai pembimbing penulis selama menuntut ilmu di Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
5. Keluarga besar Laboratorium Bagian Patologi, Fakultas Kedokteran Hewan IPB yang membantu penulis selama penelitian: Pak Endang, Pak Kasnadi, Pak Soleh, Mbak Kiki dan Bibi.
6. Sahabat-sahabat seperjuangan penulis ―Habbatussauda Team‖: Agung Sudomo, Annisa Rahmi, Dian Mayasafira, Niken Rostika, Nova Febrina, Ornella Zynesha atas kerjasamanya dalam melakukan penelitian hingga titik darah penghabisan mencit, dan ―Patologi Team‖: Auliya Indiarti Zen, Astri, Endah Mulia, Gita A, Kenyo Palupi, Larassati PR, yang telah membantu selama penelitian (terutama menunggu, mengambil foto preparat serta curhat bareng).
Loch‖.
9. Keluarga kecil Asrama Malahayati dan Loser: Meutia, Maya, Icha, Vera, Imel, K.Mala, Ana, Maida, Siti, nyak Alvi n Nyak Kandi, Kak Desna, Husnul, Fahrul, Aed, Aris yang selalu memberikan arti penting persaudaraan. 10. Keluarga besar Himpro Satwa Liar FKH IPB yang banyak memberikan
pengetahuan tentang dunia luar. Salam Lestari.
11. Keluarga Ikatan Mahasiswa Tanah Rencong (IMTR) Bogor yang selalu mengingatkan penulis pada kesederhanaan.
12. Semua pihak yang telah terlibat dalam pengerjaan penelitian dan penulisan skripsi yang tidak dapat disebutkan satu per satu.
Penulis sadar bahwa skripsi ini masih jauh dari sempurna, akan tetapi penulis berharap skripsi ini dapat memberikan manfaat kepada pihak yang membutuhkan. Amin.
Bogor, Februari 2012
DAFTAR ISI
Halaman
DAFTAR ISI ... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
1. PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Tujuan ... 2
1.3Manfaat ... 2
1.4Hipotesa ... 3
2. TINJAUAN PUSTAKA ... 4
2.1Jintan Hitam ... 4
2.1.1 Kegunaan Jintan Hitan Secara Umum ... 6
2.1.2 Kegunaan Jintan Hitam Berasarkan Kandungan ... 8
2.2Mencit (Mus musculus) ... 13
2.3Sistem Organ Imun ... 15
2.3.1 Organ Limfosid Primer ... 16
2.3.2 Organ Limfosid Sekunder ... 16
2.3.2.1Limfonodus ... 17
2.3.2.2Limpa ... 18
3. METODOLOGI ... 22
3.1Waktu dan Tempat penelitian ... 22
3.2Bahan Dan Alat ... 22
3.3Metode Penelitian ... 23
3.3.1 Persiapan ... 23
3.3.1.1Persiapan kandang dan laboraturium ... 23
3.3.1.2Persiapan Pakan dan Minum ... 23
3.3.1.3 Adaptasi Mencit dan Pre Treatment ... 24
3.4Penelitian ... 25
3.4.1 Perlakuan Pada Kelompok Penelitian ... 25
3.4.2 Sampling Organ Limfoid Sekunder ... 26
3.4.4 Pengamatan Preparat Histopatologi ... 28
3.4.5 Analisis Data ... 29
4. HASIL DAN PEMBAHASAN ... 30
4.1 Perubahan Gambaran Histopatologis Pada Limfonodus ... 30
4.2 Perubahan Gambaran Histopatologis Pada limpa ... 39
5. KESIMPULAN DAN SARAN ... 49
5.1 Kesimpulan ... 49
5.2 Saran ... 49
6. DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Tabel Halaman
DAFTAR GAMBAR
Gambar Halaman
1. Bunga Jintan Hitam (Nigella sativa) ... 5
2. Biji Jintan Hitam ... 6
3. Limfonodus ... 18
4. Struktur Limpa... 19
5. Pulpa Merah Dan Pulpa Putih Pada Limpa ... 20
6. Ekstrak Minyak Jintan Hitam Dan Formulasi Dengan Madu ... 22
7. Kandang Mencit ... 24
8. Pencekokan Pada Mencit ... 25
9. Histopatologi Limfonodus ... 31
10. Diagram Perbandingan Rataan Jumlah Folikel limfoid ... 32
11. Diagram Perbandingan Rataan Luas Folikel limfoid ... 34
12. Gambaran Histopatologi Sel-Sel Limfonodus Perbesaran 400x ... 35
13. Gambaran Histopatologi Folikel Limfoid Perbesaran 1000x ... 36
14. Histopatologi Limpa ... 40
15. Diagram Perbandingan Jumlah Rataan Pulpa Putih ... 42
16. Diagram Perbandingan Luas Rataan Pulpa Putih ... 44
17. Gambaran Histopatologi Sel-Sel Limpa Perbesaran 400x ... 46
1.1 Latar Belakang
Sejak lahir setiap individu sudah dilengkapi dengan sistem pertahanan, sehingga tubuh dapat mempertahankan keutuhannya dari berbagai gangguan yang datang dari luar maupun dari dalam tubuh (Clark 2007). Dengan kata lain, sistem imun ini harus mampu melawan patogen intraseluler seperti virus, beberapa bakteri dan protozoa maupun patogen ekstraseluler seperti bakteri dan toksinnya, parasit, dan virus bebas (Baratawidjaja 2002).
Sistem imun merupakan suatu sistem yang rumit, tetapi strategi dasarnya sangat sederhana, yaitu mengenali musuh, mengerahkan kekuatan, dan menyerang. Perjalanan dari sistem imun dimulai dari pembuluh getah bening, yang masuk ke setiap organ tubuh, kecuali otak. Pembuluh getah bening mengandung cairan kental (getah bening) yang terdiri atas cairan yang mengandung lemak dan sel-sel darah putih. Selain pembuluh getah bening, terdapat daerah khusus di mana limfosit bisa diambil, diangkut, dan disebarkan ke bagian yang memerlukannya sebagai bagian dari respon kekebalan. Daerah khusus tersebut adalah kelenjar getah bening, amandel (tonsil), sumsum tulang, limpa, hati, paru-paru, dan usus. Rancangan yang jenius dari sistem ini menjamin ketersediaan dan penyusunan respon kekebalan dengan segera, di manapun diperlukan.
Peningkatan minat masyarakat dunia termasuk Indonesia menuju konsep kembali ke alam (back to nature) serta gaya hidup sehat (healty lifestyle) merupakan salah satu alasan yang dapat digunakan dalam penggunaan obat herbal sebagai alternatif pengobatan. Pemanfaatan obat herbal sebagai pilihan pengobatan dan diet makanan sehari-hari kembali mengemuka karena obat herbal terbukti relatif aman jika cara penggunaannya benar dengan dosis dan indikasi yang tepat serta sangat jarang menimbulkan efek samping. Salah satu tanaman obat tradisional yang akhir-akhir ini mendapatkan perhatian dengan manfaat yang sangat banyak adalah jintan hitam (Nigella sativa).
Jintan hitam merupakan salah satu bahan alami yang telah lama digunakan sebagai bahan peningkatan sistem kekebalan oleh masyarakat di negara Timur Tengah (Al-Saleh et al. 2006). Selain itu jintan hitam juga dapat digunakan untuk pengobatan kanker, AIDS, dan penyakit lain yang berhubungan dengan penurunan tingkat kekebalan tubuh (Luetjohann 1998). Namun baru sedikit penelitian dan karya tulis ilmiah yang telah dikembangkan untuk membuktikan kebenaran bahwa jintan hitam itu mampu meningkatkan sistem imun, karena itu dilakukan penelitian tentang pengaruh pemberian ekstrak jintan hitam terhadap sistem imun mencit (Mus musculus) dengan kajian khusus pengamatan histopatologi organ-organ yang berperan dalam sistem imun.
1.2 Tujuan
Penelitian ini bertujuan untuk mempelajari dan mengetahui pengaruh pemberian ekstrak minyak jintan hitam terhadap gambaran histopatologi organ-organ limfoid sekunder mencit serta membuktikan pemanfaatan jintan hitam sebagai bahan alami yang merupakan salah satu imunomodulator.
1.3 Manfaat
1.4 Hipotesis
H0 : Tidak terdapat peningkatan rataan jumlah dan luas folikel limfoid pada
organ limfoid sekunder mencit yang diberi perlakuan (diberi ekstrak jintan hitam) dibandingkan dengan kelompok mencit kontrol (tidak diberi ekstrak minyak jintan hitam).
H1 : Terdapat peningkatan rataan jumlah dan luas folikel limfoid pada organ
BAB 2
TINJAUAN PUSTAKA
2.1 Jintan Hitam
Jintan hitam atau yang dikenal dengan nama black cumin merupakan tanaman asli Eropa selatan dan banyak ditemukan di India (Luetjohann 1998). Tanaman jintan hitam merupakan jenis tanaman rempah yang tergolong dalam famili Ranunculaceae. Tanaman ini tumbuh di berbagai daerah di dunia, khususnya di negara-negara Timur Tengah (Nergiz dan Otles 1993).
Menurut Hutapea (1994), jintan hitam termasuk ke dalam marga Nigella dengan nama latin Nigella sativa. Spesies ini termasuk ke dalam suku Ranunculaceae, bangsa Ranunculales, kelas Dicotyledoneae, subdivisi Angiospermae, dan divisi Spermatophyta. Secara sistematis klasifikasi jintan hitam dapat dituliskan sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Ranunculales Suku : Ranunculaceae Marga : Nigella
Jenis : Nigella sativa
Nigella sativa mempunyai beberapa nama lain, yaitu kolonji, karijirigi, black cumin, black seed, karun jiragam, tikur azmud, kalonji, fitch, fennel flower, smartkarve, habat et baraka, habbatus sauda, love in a mist, onion seed, czanuzka siewna, mustkoomen, kalongi, black caraway, roman coriander, neidonkuka, charnushka, corekotu, faux cumin, cheveux de venus, nigelle, kaluduru, schwarzkummel, zwiebelsame, nidella, niguilla, pasionara, kalounji, munga realael, nutmeg flower, svartkummin, jintan hitam, karun jiragam, nigella, dan corekotu siyah (Susilo 2006).
Pembudidayaan tanaman jintan hitam sudah menyebar di berbagai belahan dunia, seperti di benua Asia, Afrika, serta beberapa daerah di benua Eropa (Schleiche dan Saleh 2000). Budidaya perbanyakan tanaman dilakukan dengan biji (Hutapea 1994). Jintan hitam merupakan spesies tumbuhan semak rendah yang termasuk famili Racunculaceae (Mansi 2006) dan (Ramdan 2001). Pada Gambar 1 dapat dilihat bunga jintan hitam yang merupakan salah satu tanaman semak.
Gambar 2 Biji Jintan Hitam.
(Sumber: http://en.wikipedia.org/wiki/file:Nigella_sativa_seed.jpg).
2.1.1 Kegunaan Jintan Hitam Secara Umum
Jintan hitam umumnya digunakan di Timur Tengah sebagai obat tradisional untuk memperbaiki berbagai kondisi kesehatan manusia (Al-Saleh et al. 2009). Biji jintan hitam berkhasiat sebagai obat cacing (Hutapea 1994). Menurut Hargono (1985), biji jintan hitam berguna sebagai pelancar ASI, peluruh kentut, pencegah muntah, pencahar, penguat, dan pengobatan pasca persalinan.
Jintan hitam memiliki banyak kegunaan berdasarkan berbagai penelitian yang telah dilakukan. Beberapa kegunaan jintan hitam manurut El-Kadi dan Kandil (1987) adalah sebagai berikut:
a. Memperkuat Sistem Kekebalan Tubuh
b. Antihistamin
Histamin adalah zat yang diproduksi oleh jaringan tubuh yang dapat menyebabkan reaksi alergi dan berhubungan dengan suatu kondisi seperti asma cabang tenggorokan. El-Din (1960) mengemukakan bahwa nigellone (dimer dari dithymoquinone) yang diisolasi dari minyak atsiri jintan hitam dapat menekan gejala dari asma cabang tenggorokan. Minyak yang dibuat dari Nigella dapat mengisolasi dithymoquinone, minyak ini sering disebut nigellone yang berasal dari Volatile Nigella. Pemberian minyak ini berpengaruh positif terhadap penderita asma bronchial.
Chakravarty (1993) mengemukakan bahwa kristal nigellone merupakan agen penghambat histamin. Cara kerjanya adalah dengan menghambat protein kinase C yang dikenal sebagai zat yang memacu pelepasan histamin. Kristal nigellone juga menurunkan pelepasan kalsium pada sel-sel penyanggah yang juga melepaskan histamin.
c. Antitumor
Jintan hitam mengandung thymoquinone, dithymoquinone, dan sponin yang berkhasiat sebagai antitumor. Hal ini disebabkan kemampuan ekstrak jintan hitam dalam menghambat aktivitas enzim siklooksigenase dan enzim liposigenase, sehingga memiliki khasiat antiinflamasi yang sangat poten (Mangan 2003).
d. Anti Peradangan
El-Dakhakhny (1965), mengemukakan bahwa minyak jintan hitam berguna untuk mengurangi efek radang sendi. Cara kerja minyak ini dengan menghambat pertumbuhan eicosanoid dan menunjukkan adanya aktifitas sel antioksidan. Asam lemak tak jenuh C20:2 (asam eicosadienoat) yang terkandung di dalam jintan hitam memungkinkan efektifitas minyak tersebut.
e. Meningkatkan Laktasi
menurunkan tingkat gula darah, menstimulasi periode menstruasi, meningkatkan aliran susu ibu, dan meningkatkan jumlah sperma. Jintan hitam juga dapat menghilangkan cacing dan parasit dalam usus, meredakan bronkhitis dan batuk, menurunkan demam, menenangkan jaringan syaraf, mendorong pertumbuhan rambut, mencegah kerontokan rambut, dan mencegah pengriputan dan iritasi kulit.
f. Antimikroba
Hasil penelitian Asniyah (2009) menunjukkan bahwa jintan hitam memiliki fungsi sebagai antimikroba yang ditunjukkan dari penurunan jumlah pertumbuhan Escherichia coli yang diamati secara in vitro. Penelitian ini diperkuat dengan adanya penelitian Mashhadian dan Rakhsandeh (2005) yang menyatakan bahwa salah satu kandungan jintan hitam adalah minyak volatil. Minyak volatil ini mengandung komponen yang mampu menghambat pertumbuhan bakteri dan fungi, meskipun mekanisme aksi dari senyawa ini belum jelas.
2.1.2 Kegunaan Jintan Hitam Berdasarkan Kandungan
Komponen alkaloid dalam jintan hitam adalah nigellone. Zat yang menyebabkan rasa pahit ini berfungsi menurunkan demam, membersihkan dan mengeringkan pengeluaran ekskresi, menguatkan jaringan, mencegah iritasi kulit, meningkatkan nafsu makan dan metabolisme, membantu masalah pencernaan, dan mengurangi kelebihan asam.
Menurut Houghton (1995), thymoquinone yang terkandung dalam minyak Nigella sativa dapat menghambat jalur siklooksigenase dan lipooksigenase dari metabolisme arakhidat. Lipooksigenase dapat mengkatalisis pembentukan leukotrienes dari asam arakhidat yang berfungsi sebagai mediator dari alergi dan peradangan. Siklooksigenase adalah enzim yang pertama dalam metabolisme siklooksigenase yang dihasilkan dari asam arakhidat yang akhirnya menghasilkan prostaglandin dan trombosit. Prostaglandin juga merupakan mediator peradangan. Selain itu thymoquinone juga dapat menghambat peroksidasi non-enzimatis. Asam lemak tidak jenuh C20:2 yang mirip dengan asam arakhidat juga berperan dalam penghambatan substrat. Dengan demikian hasil penelitian mendukung fakta bahwa minyak Nigella sativa dapat melawan rematik dan peradangan.
Chakhravarty (1993) menemukan bahwa nigellone yang diisolasi dari minyak Nigella sativa lebih tidak beracun dibandingkan dengan thymoquinone tetapi masih mempunyai efek farmasi. Nigellone menghambat pelepasan histamin dari sel penyanggah tikus. Mekanisme dari penghambatan ini berdasarkan penurunan konsentrasi kalsium intraseluler. Kalsium berguna untuk fungsi fosfolipase A2 essensial, enzim tersebut memecah asam arakhidat dari pembentukan fosfolipid yang juga terjadi pada metabolisme prostaglandin. El-Tahir (1993) menemukan bahwa pemberian thymoquinone secara intravena akan menurunkan tekanan darah. Selain itu ekstrak biji Nigella sativa L. mempunyai efek cytostatic terhadap sel tumor yang dilakukan dengan menggunakan metode secara in vivo dan in vitro.
Komposisi (Kandungan) Kimia Jintan Hitam
Tabel 1 Komposisi Biji Jintan Hitam.
Komposisi Jumlah (mg/100g)
Air (moisture) Lemak Serat Kasar Protein Abu Karbohidrat
6.4 ± 0.15 32.0 ± 0.54
6.6 ± 0.69 20.2 ± 0.82
4.0 ± 0.29 37.4 ± 0.87 Sumber: Nergiz dan Ötles (1993)
Komposisi yang banyak terdapat pada biji jintan hitam adalah karbohidrat, lemak, dan protein. Ketiga komposisi tersebut merupakan komponen yang sangat dibutuhkan oleh tubuh. karbohidrat memegang peranan penting sebagai sumber energi di dalam tubuh, lemak sebagai cadangan energi, sedangkan protein berfungsi sebagai komponen utama dalam proses pertumbuhan. Lemak mempunyai fungsi selular dan komponen struktural pada membran sel yang berkaitan dengan karbohidrat dan protein demi menjalankan aliran air, ion, dan molekul lain keluar dan masuk ke dalam sel. Hal ini yang akan membantu tubuh dalam melakukan sistem pertahanan terhadap benda asing (Winarno 2008).
Manusia tidak dapat memproduksi mineral di dalam tubuhnya. Kebutuhan mineral ini didapatkan dengan cara mengkonsumsi daging dan tumbuh-tumbuhan (Tsabita 2011). Biji jintan hitam mengandung logam yang berjumlah sekitar 1510.8 mg per 100 g biji. Kandungan logam biji jintan hitam tersaji pada Tabel 2. Kandungan logam ini merupakan beberapa kandungan mineral yang sangat dibutuhkan oleh tubuh manusia. Tubuh manusia memerlukan sekitar 1000 mg kalsium, 18 mg zat besi, maksimal 2.5 gram natrium, dan kalium sebanyak 3500 mg per hari (Tsabita 2011).
Tabel 2 Kandungan Logam dalam Biji Jintan Hitam.
Komposisi Jumlah (mg/100g)
Kalsium Besi Natrium Kalium
Biji jintan hitam mengandung asam lemak tak jenuh dalam jumlah yang cukup berarti. Secara lengkap komposisi asam lemak dan sterol biji jintan hitam tersaji pada Tabel 3.
Tabel 3 Komposisi Asam Lemak dan Sterol Dari Biji Jintan Hitam.
Asam lemak Jumlah (mg/100g)
Miristat (C14:0) Palmitat (C16:0) Stearat (C18:0) Oleat (C18:1) Linoleat (C18:2) Arakhidat (C20:0) Eicosadienoat (C20:2)
1.2 ± 0.04 11.4 ± 1.00
2.9 ± 0.24 21.9 ± 1.00 60.8 ± 2.67
Sedikit 1.7 ± 0.11
Sterol Jumlah (mg/100g)
Campesterol Stigmasterol β-sitosterol
11.9 ± 0.99 18.6 ± 1.52 69.4 ± 2.78 Sumber : Nergiz dan Ötles (1993)
Kandungan tokoferol dan polifenol dalam biji jintan hitam menunjukkan adanya senyawa fenolik yang merupakan faktor utama yang berkhasiat sebagai obat dan zat pembentuk rasa. Kandungan tokoferol dan polifenol dari minyak biji jintan hitam tersaji pada Tabel 4.
Tabel 4 Kandungan Tokoferol dan Polifenol dari Minyak Biji Jintan Hitam.
Komposisi Jumlah (µg/g)
Total tokoferol Alfa-tokoferol Beta-tokoferol Gamma-tokoferol Total polifenol
340 ± 8.66 40 ± 10.00 50 ± 15.00 250 ± 13.00 1744 ± 10.60 Sumber : Nergiz dan Ötles (1993)
kerusakan akibat reaksi oksidasi pada makanan (Barus 2009). Zat aktif tokoferol berfungsi hampir sama dengan polifenol, yaitu sebagai antioksidan. Selain itu tokoferol juga berfungsi sebagai pencegah penyakit degeneratif, perbaikan sistem kekebalan tubuh, mengatasi pembentukan karsinogen atau menghambat karsinogen sel sasaran sehingga akan dapat menghambat terjadinya kasus kanker.
Biji jintan hitam dapat direkomendasikan sebagai makanan tambahan yang cukup bergizi. Kandungan vitamin biji jintan hitam tersaji pada Tabel 5.
Tabel 5 Komposisi Vitamin dari Biji Jintan Hitam.
Vitamin (µg per 100g)
B1(Thamin) B2(Riboflavin) B6(Pyridoxin) PP(Niasin) Asam Folat
831 ± 11.36 63 ± 3.32 789 ± 8.89 6311 ± 16.52
42 ± 4.58 Sumber : Nergiz dan Ötles (1993)
Selain itu jintan hitam mengandung 8 jenis dari 10 asam amino essensial dan 7 jenis dari 10 asam amino non-essensial. Komposisi asam amino biji jintan hitam tersaji pada Tabel 6.
Tabel 6 Komposisi Asam Amino Biji Jintan Hitam.
Asam amino Persentase (%) Asam amino Persentase (%)
2.2 Mencit (Mus musculus)
Mencit adalah hewan pengerat (rodensia) yang cepat berkembang biak dan mudah dipelihara dalam jumlah banyak. Pemeliharaannya ekonomis dan efisien dalam hal tempat dan biaya. Variasi genetiknya cukup besar serta sifat anatominya terkarakteristik dengan baik. Hewan ini paling kecil di antara jenisnya dan memiliki galur mencit yang berwarna putih. Mencit hidup di daerah yang cukup luas penyebarannya mulai dari iklim dingin, sedang, dan panas, serta dapat terus-menerus di dalam kandang atau secara bebas sebagai hewan liar (Malole dan Pramono 1989).
1. Taksonomi
Sistem taksonomi mencit menurut Malole dan Pramono (1989) adalah sebagai berikut:
Kingdom : Animalia Filum : Chordata Subfilum : Vertebrata Kelas : Mamalia Ordo : Rodensia Subordo : Myomorfa Famili : Muridae Subfamili : Murinae Genus : Mus
Spesies : Mus musculus
2. Biologi Normal
karena itu, mencit banyak digunakan dalam berbagai bidang penelitian medis, biomedis, dan obat-obatan herbal karena memiliki arti penting pada penelitian berbasis genetik.
Mencit laboratorium mempunyai berat badan kira-kira sama dengan mencit liar yang banyak ditemukan di dalam gedung dan rumah yang dihuni oleh manusia, dengan berat badan bervariasi 18-20 gram pada umur empat minggu. Tetapi setelah diternakkan secara selektif selama delapan puluh tahun yang lalu, sekarang ada berbagai warna rambut dan timbul banyak galur dengan berat badan berbeda-beda (Smith dan Mangkoewidjojo 1988).
Data biologis mencit menurut Malole dan Pramono (1989) adalah sebagai berikut:
Berat badan dewasa : jantan 20-40 gram, betina 25-40 gram
Berat lahir : 0.5-1.5 gram
Temperatur : 36.5-38C
Konsumsi makan : 15 gram/100 gram BB/hari
Konsumsi minum : 115 mL/100 gram BB/hari
Jumlah anak/kelahiran : 10-12 ekor
Umur sapih : 21-28 hari
Pernapasan : 94-163/menit
Detak jantung : 325-780/menit
Volume darah : 76-80 mL/kg
Tekanan darah : 113-147/81-105 mgHg
Menurut Malole dan Pramono (1989) mencit merupakan salah satu hewan laboratorium atau hewan percobaan, berdasarkan lingkungan hidupnya mencit dibagi dalam 4 kategori, yaitu 1) Mencit yang bebas hama (germ free, axenic mice), yaitu mencit yang bebas dari mikroorganisme yang dapat dideteksi; 2) Mencit yang hanya mengandung mikroorganisme tertentu (define flora, gnotobiotik); 3) Mencit yang bebas mikroorganisme patogen tertentu (Specific pathogen free); dan 4) Mencit biasa (konventional).
ini merupakan turunan dari mencit liar sesudah melalui peternakan selektif (Smith dan Mangkoewidjojo 1988). Mencit dimasukkan ke dalam ordo rodensia karena memiliki sepasang gigi seri yang berbentuk pahat yang sangat tajam yang senantiasa tumbuh terus (Sigit 2004). Mencit yang digunakan dalam penelitian ini adalah jenis mencit biasa yang diberikan perlakuan khusus sehingga lebih baik dari mencit konvensional.
2.3 Sistem Organ Imun
Sistem organ imun disebut sebagai sistem organ limfoid. Hal ini dikarenakan pusat dari sistem ini adalah limfosit, sel darah putih yang berperan penting dalam imun sistem. Sistem organ imun pada mamalia terdiri atas organ limfoid primer dan organ limfoid sekunder. Organ limfoid primer terdiri atas timus dan sumsum tulang, sedangkan organ limfoid sekunder terdiri atas jaringan limfoid mukosa, limfonodus, dan limpa (Kuby 1997).
Sistem imun diklasifikasikan sebagai sistem imun bawaan (innate immune system) atau sering juga disebut respon atau sistem nonspesifik serta sistem imun adaptif (adaptive immune system) atau respon atau sistem spesifik, bergantung pada derajat selektivitas mekanisme pertahanan (Sherwood 2001; Katzung 2004). Komponen dari sistem imun yang terlibat dalam kekebalan bawaan adalah makrofag, neutrofil, serta komplemen. Komponen tersebut akan menunjukkan reaksi dan pengenalan antigen yang sama terhadap semua benda asing (Widianto 2008). Pada saat lahir tentunya sistem kekebalan seseorang belum bertemu dengan dunia luar atau belum membangun arsip memorinya.
kedua kalinya, maka limfosit dengan segera akan memberikan respon spesifik terhadap antigen tersebut.
Sistem imun merupakan sebuah jaringan yang terdiri atas beberapa sel, jaringan, dan organ yang bekerja bersama untuk mempertahankan serangan yang terjadi pada tubuh oleh benda asing. Sistem organ imun seluruhnya terdapat di dalam tubuh. Sistem organ ini disebut sebagai sistem organ limfoid, hal ini dikarenakan pusat dari sistem ini pada limfosit, sel darah putih yang berperan penting dalam imun sistem. Sistem organ imun pada mamalia terdiri atas organ limfoid primer dan organ limfoid sekunder. Organ limfoid primer terdiri atas timus dan sumsum tulang, sedangkan organ limfoid sekunder terdiri atas megakariosit, limfonodus dan limpa. Struktur dan fungsi dari organ limfoid ini berbeda-beda. Dalam menjalankan tugas dan fungsinya organ limfoid selalu berhubungan dengan pembuluh darah dan pembuluh limfe. Kedua pembuluh ini merupakan tempat sirkulasi dan transportasi dari sel-sel limfoid, yaitu sel T dan sel B (Kuby 1997).
2.3.1 Organ Limfoid Primer
Organ yang berfungsi mengatur produksi dan diferensiasi limfosit dikenal sebagai organ limfoid primer (Tizard 1988). Organ limfoid primer akan menghasilkan sel-sel limfoit yang akan dimatangkan di organ limfoid sekunder. Organ limfoid primer terdiri atas timus dan sumsum tulang. Sel-sel limfosit ini disebut limfosit B dan T, karena berturut-turut mengalami proses pemasakan pada bone marrow (sumsum tulang) dan thymus (timus). Sel-sel limfosit yang telah mengalami pematangan akan segera memasuki peredaran darah untuk menuju organ limfoid sekunder (Stewart 2004).
2.3.2 Organ Limfoid Sekunder
menyediakan tempat untuk pematangan sel yang akan digunakan dalam melawan benda-benda asing serta menghasilkan reaksi sistem kekebalan (Stewart 2004).
Organ limfoid sekunder ini imunitas adaptif dimulai. Setiap saat tubuh kita selalu berhadapan dengan patogen yang masuk. Patogen memasuki tubuh kita dengan berbagai cara, misalnya dari makanan, minuman, udara, dan luka. Antigen dan limfosit akhirnya akan bertemu pada organ limfoid peripheral, yaitu pada limfonodus, limpa, dan jaringan limfoid mukosa. Organ-organ ini menangkap mikroorganisme dan bahan-bahan asing lain dan menyediakan tempat untuk pematangan sel untuk melawan benda-benda asing serta menghasilkan reaksi sistem kekebalan.
2.3.2.1 Limfonodus
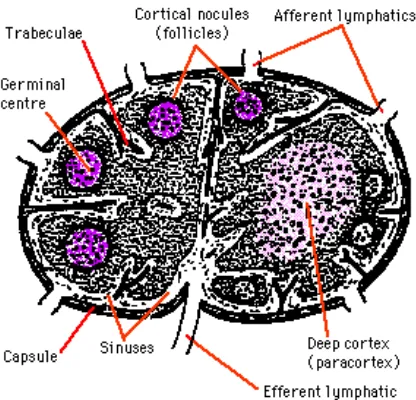
Limfonodus merupakan organ limfoid sekunder yang secara makroskopik memiliki struktur seperti biji buncis. Pada bagian luar diselubungi oleh kapsula jaringan ikat (Kuby 1997). Limfonodus terdiri atas jaringan retikuler yang berisi sel limfosit, makrofag, dan sel dendrit yang berhubungan dengan pembuluh limfe. Fungsi utama limfonodus adalah menyaring antigen yang dibawa oleh cairan limfe (Tizard 1988).
Secara mikroskopik limfonodus terbagi atas tiga bagian, yaitu korteks, parakorteks, dan medula (Gambar 3). Medula merupakan lapisan paling dalam dari struktur limfonodus yang berisi sel plasma dan makrofag. Parakorteks merupakan lapisan di bawah korteks yang berisi sel limfosit T dan sel dendrit interdigital (Lahr 2004).
Gambar 3 Limfonodus (sumber: Cann 2011).
Fungsi limfonodus sebagai bagian dari sistem imun telah dibuktikan melalui beberapa percobaan. Anak-anak yang mengalami defisiensi sel B akan mengalami pengurangan jumlah folikel primer dan germinal center. Seekor mencit yang ditimektomi memperlihatkan deplesi yang hebat pada sel di dalam limfonodus (Kuby 1997).
2.3.2.2Limpa
Limpa merupakan organ terbesar pada sistem limfatik yang biasanya di bagian kranial dari abdomen dan di sisi kiri lambung (Aughey dan Frye 2001). Pada mencit limpa dibentuk dari mesenkim pada dorsal mesogastrikum (Ward et al. 1999). Berdasarkan sifat anatomisnya limpa pada mencit jantan 50% lebih besar dibandingkan dengan mencit betina (Malole dan Pramono 1989). Berbeda dengan limfonodus yang berfungsi untuk menyaring antigen dari cairan limfe, limpa berfungsi untuk menyaring darah (Tizard 1988). Menurut Jungueira dan Carneiro (1989) limpa mempunyai 4 fungsi utama, yaitu pembentukan eritrosit, destruksi eritrosit, organ pertahanan terhadap partikel-partikel asing yang masuk ke dalam aliran darah, serta cadangan darah.
pada bagian medial limpa terdapat hilus (Gambar 4). Jaringan penyambung kapsula dan trabekula limpa mengandung sedikit sel-sel otot polos. Namun pada mamalia tertentu seperti kuda, kucing, dan anjing terdapat sel-sel otot polos yang banyak, sehingga kontraksinya dapat menyebabkan pengeluaran darah yang tersimpan dalam limpa dalam jumlah banyak, sedangkan struktur limpa yang seperti spons berperan sebagai penyimpan sel-sel darah merah. Selain itu, struktur limpa juga terdiri atas sel darah merah dan sel darah putih yang menyerupai kelenjar limfe.
Gambar 4 Struktur Limpa (Sumber:
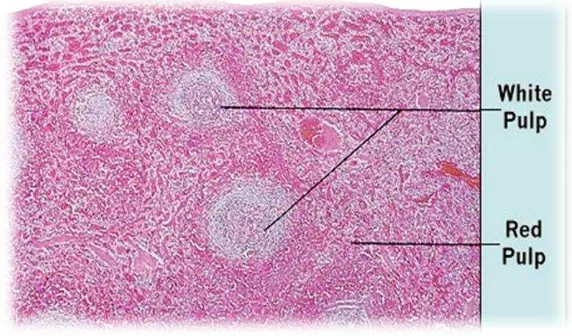
Gambar 5 Pulpa Merah dan Pulpa Putih pada Limpa.
(sumber: http://www.deltagen.com/target/histologyatlas/HistologyAtlas.html). Pulpa putih limpa terdiri atas jaringan limfoid yang berhubungan langsung dengan pembuluh darah arteri sentralis yang membentuk periarteriolar lymphoid sheath (PALS) dan nodulus limfatikus yang ditambah pada selubung. PALS atau sarung limfoid periarteriolar sebagian besar terdiri atas sel T (Anonim 2006b). Daerah pulpa putih terdapat folikel primer yang berisi sel limfosit B. Apabila terjadi respon terhadap antigen maka akan terbentuk germinal center pada pulpa putih dan disebut dengan folikel sekunder. Setiap folikel sekunder yang terbentuk dikelilingi oleh selapis sel T yang disebut dengan marginal zone (Messika et al. 1998).
Proliferasi limfosit merupakan penanda adanya fase aktivasi dari respon imun tubuh. Proliferasi limfosit ini berupa peningkatan produksi limfoblas yang kemudian menjadi limfosit. Secara mikroskopis dapat terlihat pembesaran organ-organ limfoid (Ganong 2003). Aktivitas limpa dalam menghasilkan sel limfosit pada saat terjadi respon imun dapat mengakibatkan pembesaran limpa. Pembesaran limpa bisa disebabkan karena peningkatan respon imun tubuh. Peningkatan respon imun dapat terjadi karena adanya infeksi maupun setelah imunisasi atau adanya gangguan sirkulasi maupun tumor.
hitam merupakan salah satu herbal yang potensial sebagai imunomodulator. Beberapa senyawa yang terkandung pada jintan hitam dapat meningkatkan aktifitas respon imun dalam organ limpa. Peningkatan respon imun dalam organ limpa dapat dilihat dengan mengukur bagian folikel limfoid (pulpa putih) atau menghitung jumlah sel limfosit (Tan dan Vanitha 2004).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Bagian Patologi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian ini dilakukan pada bulan Juni 2010 sampai dengan Februari 2011.
3.2 Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah 24 ekor mencit (12 ekor mencit jantan dan 12 ekor mencit betina) dengan umur rata-rata mencit 4 minggu, pakan mencit, Aqua® (minum mencit), Albendazole® (anthelmentik), Clavamox® (antibiotik), Flagyl® (antiprotozoa), ekstrak minyak jintan hitam komersil, campuran ekstrak minyak jintan hitam dan madu komersil, serta aquades.
Bahan yang digunakan untuk pewarnaan histopatologi adalah buffer neutral formalin (BNF) 10%, xylol I, xylol II, xylol III, alkohol 70%, alkohol 80%, alkohol 90%, alkohol 96%, alkohol absolut I, alkohol absolut II, parafin, Mayer΄s Haematoxyllin, lithium karbonat, dan Eosin, larutan albumin, Bayclin® (disinfektan), detergen, dan air hangat dengan suhu 45˚C.
Gambar 6 Ekstrak minyak jintan hitam (A) dan ekstrak jintan hitam yang diformulasikan dengan madu siap pakai (B).
Alat-alat yang digunakan adalah kandang mencit dimodifikasi (Kotak plastik dengan ukuran panjang 40 cm, lebar 29 cm, dan tinggi 12 cm dengan tutup yang terbuat dari anyaman kawat untuk tempat pemeliharaan mencit selama
penelitian berlangsung; botol yang dilengkapi dengan saluran air sebagai tempat minum mencit), kertas label, kain katun perca, tissue gulung, timbangan digital, sarung tangan, syring 1ml, sonde lambung, kapas, dispenser, jarum pentul, sterofoam, alumunium foil, scalpel, gunting, kotak, tissue basket, gelas objek, cover glass, spidol, label, tissue casset, tissue processor, inkubator, mikrotom, mikroskop cahaya, plastik ukuran 0.5 kg, pensil, penghapus, kantung plastik, spidol kedap air, pencetak parafin, parafin block console, cover glass, dan kamera fotografi mikro (digital eyepiece camera)
3.3 Metode Penelitian 3.3.1 Persiapan
3.3.1.1 Persiapan Kandang dan Laboratorium
Persiapan kandang dimulai dengan pembersihan kotoran dan debu menggunakan pembersih lantai dan Bayclin® sebagai disinfektan, sedangkan seluruh peralatan seperti kotak dan botol dicuci dengan menggunakan air sabun dan Bayclin®. Botol-botol tersebut kemudian diisi dengan air minum yang diberikan kepada mencit. Kotak plastik juga diisi dengan kain perca agar dapat menyerap urin dan feses mencit di dalamnya dan agar mencit tidak kedinginan pada malam hari. Kandang dan kain perca yang digunakan dibersihkan setiap hari dengan menggunakan detergen dan disinfektan serta dikeringkan dengan cara dijemur.
Persiapan laboratorium untuk proses pembuatan sediaan histopatologi dan pengamatan yaitu dengan membersihkan dari kotoran dan debu. Kemudian alat yang digunakan untuk pengamatan juga dibersihkan agar mempermudah dalam penggunaan. Selain itu dilanjutkan dengan mendata bahan dan alat yang tersedia agar tidak terjadi kerusakan ataupun hilang dapat diketahui dengan cepat.
3.3.1.2 Persiapan Pakan dan Minum
dalam plastik transparan untuk memudahkan dalam pemberian pakan setiap harinya. Aqua® sebagai air minum diberikan secara ad libitum.
3.3.1.3 Adaptasi Mencit dan Pretreatment
Mencit yang digunakan dalam penelitian sebanyak 24 ekor yang terdiri dari 12 ekor mencit jantan dan 12 ekor mencit betina dengan rata-rata berumur 4 minggu dan mempunyai berat rata-rata ±18 gram. Mencit dimasukkan ke dalam kandang kotak plastik modifikasi dengan alas kain perca dan tutup kandang yang terbuat dari anyaman kawat dengan bingkainya terbuat dari kayu sehingga tidak melukai mencit (Gambar 6). Kandang diletakkan dalam ruangan dalam suhu ruangan yang memadai (27˚C) dengan dilengkapi ventilasi di kedua sisi kandang dan ditambah fan serta exhausefan untuk pertukaran udara. Mencit betina dan jantan diletakkan dalam kandang yang terpisah agar tidak terjadi perkawinan dan diberi label tiap kandangnya. Mencit diberi makan sebanyak 5 g/hari/mencit dan minum secara ad libitum. Adaptasi pada mencit dilakukan selama dua hari.
Gambar 7. Kandang Mencit
menggunakan sonde lambung. Selama masa pemeliharaan dan perlakuan, mencit diberi pakan sebanyak 5 gram/ekor/hari dengan air minum yang ad libitum.
3.4 Penelitian
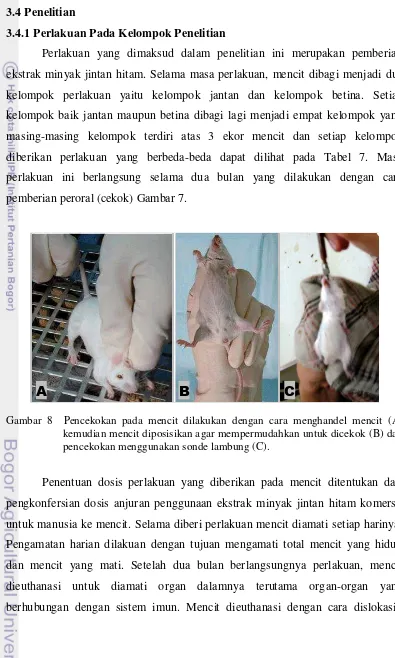
3.4.1 Perlakuan Pada Kelompok Penelitian
Perlakuan yang dimaksud dalam penelitian ini merupakan pemberian ekstrak minyak jintan hitam. Selama masa perlakuan, mencit dibagi menjadi dua kelompok perlakuan yaitu kelompok jantan dan kelompok betina. Setiap kelompok baik jantan maupun betina dibagi lagi menjadi empat kelompok yang masing-masing kelompok terdiri atas 3 ekor mencit dan setiap kelompok diberikan perlakuan yang berbeda-beda dapat dilihat pada Tabel 7. Masa perlakuan ini berlangsung selama dua bulan yang dilakukan dengan cara pemberian peroral (cekok) Gambar 7.
Gambar 8 Pencekokan pada mencit dilakukan dengan cara menghandel mencit (A) kemudian mencit diposisikan agar mempermudahkan untuk dicekok (B) dan pencekokan menggunakan sonde lambung (C).
Penentuan dosis perlakuan yang diberikan pada mencit ditentukan dari pengkonfersian dosis anjuran penggunaan ekstrak minyak jintan hitam komersil untuk manusia ke mencit. Selama diberi perlakuan mencit diamati setiap harinya. Pengamatan harian dilakuan dengan tujuan mengamati total mencit yang hidup dan mencit yang mati. Setelah dua bulan berlangsungnya perlakuan, mencit dieuthanasi untuk diamati organ dalamnya terutama organ-organ yang berhubungan dengan sistem imun. Mencit dieuthanasi dengan cara dislokasio
[image:40.595.107.502.142.800.2]atlanto occipitale menarik dari bagian leher ke kranial dan bagian bahu ke kaudal. Perlakuan dilaksanakan selama dua bulan dengan pertimbangan dari pemberian herbal yang tidak bisa menunjukan efek cepat seperti bahan kimia, namun diperlukan waktu agar efek pemberian ekstrak minyak jintan hitam terlihat.
Tabel 7 Kelompok Perlakuan pada Mencit Jantan dan Betina dalam Penelitian
Kelompok Perlakuan
Kontrol Cekok aqua sebanyak 0.1 ml/ekor/hari
Preventif Cekok habbatussauda sebanyak 0.1 ml/ekor/hari Kuratif Cekok habbatussauda sebanyak 0.2 ml/ekor/hari Habatussauda+Madu Cekok campuran habbatussauda+madu sebanyak 0.3
ml/ekor/hari
Ket: Perhitungan dosis penggunaan ekstrak minyak jintan hitam dan campuran dari ekstrak minyak jintan hitam dan madu dapat dilihat pada lampiran
Mencit yang telah dieuthanasi, dibuka bagian abdomennya dimulai dari hipogastrium hingga bagian symphysis pubis. Namun jika dalam waktu dua bulan masa perlakuan terdapat mencit yang mati maka mencit akan dinekropsi untuk didiagnosa penyebab kematian mencit tersebut.
3.4.2 Sampling Organ Limfoid Sekunder
dipilih untuk pemeriksaan mikroskopis organ yang telah difiksasi, kemudian dipotong dengan ketebalan 0,5 cm.
3.4.3 Pembuatan Preparat Histopatologi
Pembuatan preparat histopatologi dimulai dengan tahap pemotongan organ yang telah difiksasi dengan ketebalan 0,5 cm dan kemudian ditempatkan pada tissue casset. Tissue casset diatur ke dalam tissue basket untuk proses dehidrasi dan direndam kembali di dalam larutan BNF 10% sampai diproses. Organ yang dijadikan preparat dipilih untuk digunakan dalam pengamatan, proses ini disebut proses trimming. Tahapan berikutnya dilakukan dehidrasi dengan cara merendam sediaan tersebut berturut-turut ke dalam alkohol 70%, 80%, 90%, 96%, alkohol absolut I, alkohol absolut II masing-masing selama 60 menit, kemudian clearing dalam larutan xylol I, xylol II dan xylol III masing-masing selama 40 menit, serta proses embedding dalam parafin I, II, III, dan IV dalam automatic tissue processor masing-masing selama 30 menit.
Tahapan selanjutnya adalah proses embedding atau penanaman jaringan ke dalam blok parafin. Jaringan diletakkan di tengah cetakan blok parafin yang telah diisi sedikit parafin cair. Setelah mulai membeku, parafin ditambahkan kembali sampai alat pencetak penuh, lalu dibiarkan sampai parafin mengeras dan blok disimpan di refrigerator sampai dipotong dengan mikrotom. Potongan organ awalnya dimasukkan ke dalam alat pencetak berisi parafin cair dengan memperhatikan posisi organ agar tetap berada di tengah blok parafin. Blok parafin dipotong dengan ketebalan 5µm dengan menggunakan mikrotom. Hasil pemotongan yang berbentuk pita (ribbon), diletakkan di atas permukaan air
hangat (45˚C) pada waterbath dengan tujuan untuk menghilangkan lipatan akibat pemotongan. Sediaan diangkat dari permukaan air dengan gelas objek yang telah diulasi larutan albumin yang berfungsi sebagai perekat. Selanjutnya sediaan dikeringkan di dalam inkubator suhu 60˚C selama satu malam.
dengan air mengalir dan dikeringkan. Sediaan yang telah kering diwarnai dengan pewarnaan Mayer΄s Hematoksilin selama delapan menit, dibilas dengan air mengalir, dicuci dengan lithium karbonat selama 15-30 detik, dibilas dengan air, dan diwarnai dengan pewarna Eosin selama 2 menit. Selanjutnya, sediaan dicuci dengan air mengalir untuk menghilangkan warna Eosin yang berlebih sebelum akhirnya dikeringkan.
Setelah kering, sediaan dicelupkan ke dalam alkohol 90% sebanyak 10 kali celupan, alkohol absolut I sebanyak 10 kali celupan, alkohol absolut II selama 2 menit, xylol I selama satu menit, xylol II selama dua menit. Sediaan ditetesi perekat permount, ditutup dengan cover glass, dan dibiarkan kering sesuai dengan metode Bagian Patologi Fakultas Kedokteran Hewan IPB. Sediaan siap dilihat dan setelah perekat kering diamati dengan menggunakan mikroskop cahaya.
3.4.4 Pengamatan Preparat Histopatologi
Pengamatan histopatologi diawali dengan pemotretan menggunakan kamera fotografi mikro (digital eyepiece camera) untuk setiap preparat organ dari masing-masing perlakuan. Gambar yang diambil dari preparat yaitu dimulai dengan gambaran histopatologi preparat menggunakan mikroskop perbesaran 10x pada lensa okuler dan perbesaran 4x, 40x, dan 100x pada lensa objektif. Gambar yang telah diperoleh dilanjutkan dengan penghitung jumlah dan luas. Penghitungan jumlah dan luas ini dilakukan dengan menghitung banyaknya jumlah dan luasan menggunakan software Image J® Launcher pada folikel limfoid yang terdapat pada organ limpa dan limfonodus dari gambaran histopatologi organ pada mikroskop dengan perbesaran 40x.
3.4.5 Analisis Data
Data pengamatan yang diperoleh adalah data kuantitatif yang disajikan dalam bentuk rataan dan simpangan baku. Setiap data yang diperoleh dari masing-masing perlakuan dibandingkan dengan data yang diperoleh dari kontrol yaitu mencit yang hanya dicekok dengan Aqua® sebanyak 0.1 ml/ekor/hari. Pembandingan yang dilakukan bertujuan untuk menganalisis perubahan yang terjadi pada pulpa putih yang terdapat pada limpa dan folikel limfoid dari limfonodus mencit kelompok kontrol dengan kelompok lainya. Data kuantitatif yang diperoleh juga dibandingkan antara jantan dan betina untuk melihat keefektifan antara kedunya.
BAB 4
HASIL DAN PEMBAHASAN
Peningkatan respon imun dapat terjadi karena adanya infeksi maupun setelah imunisasi atau adanya gangguan sirkulasi maupun tumor. Selain itu peningkatan respon imun juga dipengaruhi oleh imunomodulator. Salah satu herbal yang potensial sebagai imunomodulator adalah jintan hitam.
Pemberian jintan hitam secara teratur dengan dosis bertingkat (kontrol, dosis prevetif, dosis kuratif dan capuran jintan hitam dengan madu) menunjukkan gambaran histopatologi yang berbeda-beda. Data kuantitatif yang diperoleh dari perhitungan rataan jumlah dan luas folikel menunjukkan nilai rataan yang berbeda berdasarkan dosis pemberiannya. Selain gambaran histopatologi, hasil pengamatan pada slide organ limfoid sekunder tidak ditemukan adanya edema, kongesti, dan hemoragi. Hal ini disebabkan manfaat dari jintan hitam yang dapat memperlancar peredaran darah (El-Dakhakhny 2002). Peredaran darah yang lancar dapat menghindari terjadinya kongesti, edema, dan hemoragi pada organ limfoid sekunder.
4.1 Perubahan Gambaran Histopatologis Pada Limfonodus
Limfonodus (kelenjar getah bening) adalah satu-satunya jaringan limfoid, yang terdapat di antara aliran limfe menyaring limfe sebelum memasuki aliran darah. Organ ini paling teroganisasi dari seluruh organ limfatik, dan hanya satu-satunya yang memiliki pembuluh limfe eferen, dan sinus (Dellman 1989).
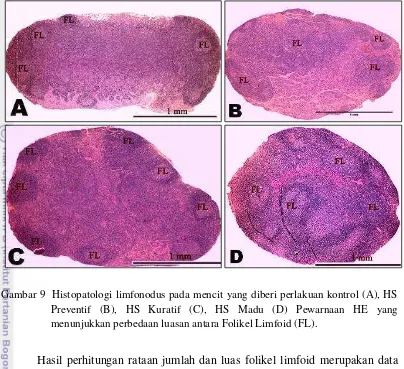
Gambar 9 Histopatologi limfonodus pada mencit yang diberi perlakuan kontrol (A), HS Preventif (B), HS Kuratif (C), HS Madu (D) Pewarnaan HE yang menunjukkan perbedaan luasan antara Folikel Limfoid (FL).
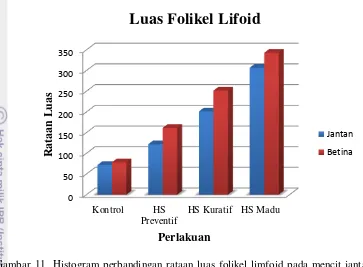
Hasil perhitungan rataan jumlah dan luas folikel limfoid merupakan data kuantitatif dalam bentuk hasil uji statistik yang disajikan pada Tabel 8, sedangkan perbandingan gambaran perbedaan rataan jumlah dan luas dari folikel limfoid antara mencit jantan dan betina dapat dilihat pada Gambar 9 dan Gambar10.
Tabel 8 Rataan Jumlah dan Luas Folikel Limfoid Mencit Jantan dan Betina
Organ yang diamati
Parameter Folikel
(Rata-rata)
Perlakuan
Kontrol HS Preventif HS Kuratif HS Madu
Limfonodus Jantan
Jumlah 6,5 ± 0,70a 6,67 ± 2,89a 4,0 ± 0,0a 4,33 ± 1,53a
Luas (μm) 71,5 ± 1,48a 121,67 ±
1,25ab 201 ± 3,12
bc
306,67 ± 6,8c Limfonodus
Betina
Jumlah 5,5 ± 0,70a 6,67 ± 1,53a 6,0 ± 2,65a 6,0 ± 3,51a
Luas (μm) 78,0 ± 1,13a 161 ± 6,83ab 251,33 ±
8,27bc 342,67 ± 1,02
c
[image:46.595.109.513.549.700.2]Hasil perhitungan rataan jumlah folikel limfoid setelah dilakukan uji statistik menunjukkan tidak adanya perbedaan yang nyata (p>0.05) dari masing-masing perlakuan baik yang diberikan jintan hitam secara rutin (Hs preventif, Hs kuratif dan Hs madu) maupun yang tidak diberikan jintan hitam (kontrol). Namun, jika dilihat dari gambaran histogram perbedaan raatan jumlah folikel limfoid antara jantan dan betina pada Gambar 10 menunjukkan bahwa rataan jumlah folikel limfoid betina lebih banyak dibandingkan dengan rataan jumlah folikel limfoid jantan.
Gambar histogram rataan jumlah folikel limfoid betina menunjukkan jumlah terbanyak pada perlakaun Hs preventif. Rataan jumlah pada mencit yang diberikan perlakuan preventif maupun kuratif serta campuran jintan hitam dengan madu menunjukkan rataan jumlah yang lebih tinggi dibandingkan dengan kelompok kontrol. Rataan jumlah folikel limfoid pada jantan menunjukkan penurunan pada dosis kuratif maupun pada pemberian campuran ekstrak minyak jintan hitam dengan madu.
Gambar 10 Histogram perbandingan rataan jumlah folikel limfoid pada mencit jantan dan betina yang diberikan jintan hitam selama dua bulan
Perbandingan rataan jumlah folikel limfoid betina dan jantan pada mencit yang diberikan jintan hitam menunjukkan jumlah yang lebih tinggi dibandingkan dengan jantan kecuali pada dosis preventif. Hal ini kemungkinan dapat terjadi karena adanya peningkatan luas folikel limfonodus, sehingga beberapa folikel
0 1 2 3 4 5 6 7
Kontrol HS
Preventif
HS Kuratif HS Madu
R at aan Jum lah Perlakuan
Jumlah Folikel Limfoid
Jantan
[image:47.595.107.511.61.842.2]bergabung menjadi satu. Menurut Searcy (1995), limfonodus berperan penting dalam pertahanan tubuh dan fungsi imun. Limfonodus bisa mengalami atrofi maupun hipertrofi, atau bisa juga menjadi tempat dari inflamasi lokal maupun umum. Penyakit inflamasi selalu berhubungan dengan perubahan pada aliran limfatik dan daerah disekitar limfonodus (Cheville 2006).
Hasil pengukuran luas folikel limfoid pada setiap perlakuan terlihat pada tabel rataan luas yang menunjukkan kelompok yang diberikan ekstrak minyak jintan hitam dosis kuratif, dan kombinasi dengan madu memiliki rataan luas folikel yang berbeda nyata (p<0.05) bila dibandingkan dengan kontrol. Pemberian jintan hitam dengan dosis preventif tidak menunjukkan ukuran luas folikel yang berbeda nyata (p>0.05) dengan kontrol dan dosis kuratif. Hal ini kemungkinan karena mencit yang digunakan dalam penelitian ini bukan mencit jenis SPF (Specific Pathogen Free). Meskipun mencit yang digunakan sudah diberikan perlakuan khusus sehingga lebih baik dari mencit konvensional, namun masih adanya peluang ketidakseragaman kondisi imunitas antara mencit sebelum diberikan asupan ektrak minyak jintan hitam. Hasil perlakuan pada kelompok dosis kuratif dan madu menunjukkan perbedaan yang nyata berdasarkan uji statistik jika dibandingkan dengan kontrol.
Gambar 11 Histogram perbandingan rataan luas folikel limfoid pada mencit jantan dan betina yang diberikan jintan hitam selama dua bulan
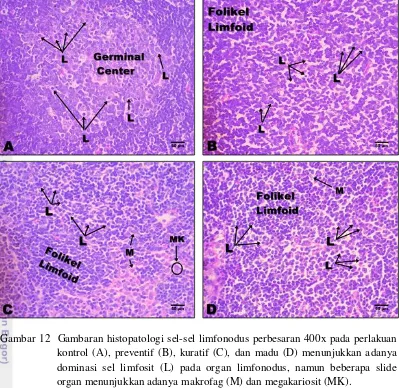
Sel-sel yang terdapat pada organ limfonodus yang telah diberi perlakuan ditunjukkan pada Gambar 12 dan Gambar 13. Folikel limfoid menunjukkan dominasi dari sel-sel limfosit. Peningkatan ini tidak selalu menjadi prognosis yang baik. Namun, peningkatan limfosit pada folikel limfoid dari hewan yang sehat menunjukkan peningkatan kemapuan hewan dalam melawan penyakits (Chao et al. 2004).
Hasil pengamatan pada gambaran histopatologi sel-sel yang terdapat pada organ limfonodus mencit yang diberikan jintan hitam maupun campuran jintan hitam dan madu menunjukkan adanya proliferasi sel limfosit, folikel limfoid sebagian besar di dominasi oleh sel-sel limfosit (Gambar 13). Gambaran folikel limfoid menjadi lebih besar dibandingkan dengan normal akibatnya gambaran limfonodus terlihat lebih besar juga. Namun, folikel limfoid yang besar tidak hanya disebabkan oleh proliferasi sel limfosit. Hewan yang folikel limfoidnya lebih besar dibandingan dengan normal dapat dikarenakan hewan tersebut mengalami hiperplasia maupun tumor (Carlton dan McGavin 1998).
0 50 100 150 200 250 300 350
Kontrol HS Preventif
HS Kuratif HS Madu
Rat
aan
L
u
as
Perlakuan
Luas Folikel Lifoid
Jantan
Gambar 12 Gambaran histopatologi sel-sel limfonodus perbesaran 400x pada perlakuan kontrol (A), preventif (B), kuratif (C), dan madu (D) menunjukkan adanya dominasi sel limfosit (L) pada organ limfonodus, namun beberapa slide organ menunjukkan adanya makrofag (M) dan megakariosit (MK).
Perbedaan yang diperoleh dari penelitian ini dengan perbesaran yang terjadp pada tumor yaitu adanya keseragaman sel limfosit pada folikel limfoid mencit perlakuan, sedangkan jika hewan mengalami hiperplasia maupun tumor terdapat infiltrasi dari sel neutrofil maupun eritrosit. Adanya perbesaran dari nukleus dengan nukleokromatin yang homogen serta bentuk nuklear yang ireguler juga merupakan gambaran histopatologi pada limfonodus yang mengalami tumor (Carlton dan McGavin 1998).
dasar imunitas dapatan yang saling berhubungan. Salah satunya, tubuh mampu membentuk antibodi yang bersirkulasi, yaitu molekul globulin dalam darah yang mampu menyerang antigen spesifik.
Gambar 13 Gambaran histopatologi folikel limfoid perbesaran 1000x pada limfonodus yang telah diberikan perlakuan jintan hitam selama dua bulan menunjukkan adanya proliferasi sel limfosit (L) pada organ limfonodus.
Pemberian jintan hitam berpengaruh pada jumlah dan luas dari folikel limfoid. Jintan hitam berfungsi sebagai imunomodulator yang di dalamnya sebagian besar terdiri dari karbohidrat dan lemak. Lemak mempunyai fungsi selular dan komponen struktural pada membran sel yang berkaitan dengan karbohidrat dan protein demi menjalankan aliran air, ion, dan molekul lain keluar dan masuk ke dalam sel. Hal ini yang akan membantu tubuh dalam melakukan sistem pertahanan terhadap benda asing (Winarno 2008). Menurut Jones et al. (2006), stimulasi antigen dapat menyebabkan hiperplasia reaktif yang dicirikan dengan pembesaran limfoid. Umumnya, pada kondisi hiperplasia yang aktif akan terjadi peningkatan plasma sel, namun karena tidak ditemukan adanya plasma sel pada gambaran sel maka dapat dikatakan bahwa pemberian jintan hitam menyebabkan hiperplasia reaktif pada organ limfonodus.
pertumbuhan sel B melalui peningkatan IL-3 (interleukin-3), serta merangsang makrofag dengan peningkatn IL-1ß (Subijanto 2008).
Peningkatan sel B akibat pemberian jinten hitam akan terlihat melalui folikel limfoid yang di dalamnya kaya akan sel B. Menurut Fawcett (2002) folikel limfoid terlibat dalam perkembangan fungsional sel B. Semakin sedikit jumlah sel B menandakan semakin sedikit juga folikel dan Germinal center pada limfonodus berarti limfonodus mengalami deplesi (Kuby 1997). Semakin luas folikel dan Germinal center pada limfonodus menandakan adanya peningkatan jumlah sel B yang matang dan siap untuk melakukan respon imun terhadap benda asing. Tipe imunitas ini disebut imunitas humoral atau imunitas sel-B (karena limfosit membentuk antibodi). Tipe kedua dari imunitas dapat diperoleh melalui pembentukan limfosit teraktivasi dalam jumlah besar yang dirancang untuk menghancurkan antigen. Tipe imunitas ini disebut imunitas yang diperantarai sel atau imunitas sel-T (karena limfosit yang teraktivasi adalah limfosit T) (Guyton dan Hall 2005). Seperti yang terlihat pada Gambar 8 pemberian jintan hitam yang dicampur dengan madu menunjukkan folikel limfoid yang lebih luas dibandingkan dengan kontrol.
Secara mikroskopik limfonodus terbagi atas tiga bagian, yaitu korteks, parakorteks, dan medula. Korteks merupakan lapisan paling luar yang berisi sel limfosit B, sel dendrit folikular, dan makrofag yang tersusun dalam nodul yang disebut folikel limfoid. Folikel limfoid merupakan sebutan dari kumpulan sel-sel yang terdapat pada bagian kortek ini dan terkadang dilengkapi dengan germinal center. Folikel limfoid yang tidak dilengkapi dengan germinal center disebut folikel primer sedangkan yang dilengkapi dengan germinal center disebut folikel sekunder (Rao 2010). Germinal center merupakan tempat terjadinya poliferasi dan diferensiasi sel B menjadi sel plasma dan sel memory (Messika 1998). Struktur folikel ini akan meluas pada saat terjadi respon antigen (Douglas 2006).
Jintan hitam yang digunakan sebagai suplemen dalam kehidupan sehari-hari sering dikombinasikan dengan madu yang berfungsi sebagai antioksidan juga dapat mempengaruhi sistem imun. Kombinasi antara jintan hitam dengan madu menunjukkan gambaran rataan luas folikel limfoid yang lebih luas (Gambar 9) dan jumlah folikel menjadi lebih sedikit dibandingkan dengan control hal ini disebabkan karena kandungan utama madu yaitu antioksidan fenolat yang memiliki daya aktif tinggi serta bisa meningkatkan perlawanan tubuh terhadap tekanan oksidasi (oksidative stress) (Sirisinghe et al. 2006).
Proliferasi sel limfosit pada limfonodus mencit merupakan akibat dari pemberian jintan hitam. Kandungan thymoquinone yang terdapat pada jintan hitam berfungsi sebagai anti depresan melalui mekanisme penghambatan dari pelepasan histamin yang nantinya akan mereduksi nilai cyclic Adenosine Monophosphate (cAMP) (Abdel-Sater 2009). Stres menginduksi kenaikan cAMP intraseluler yang menyebabkan adanya penekanan sistem imun, contohnya dengan menghambat proliferasi limfosit dan antibodi (Glaser et al. 1990). Penggunaan jintan hitam secara rutin yang menyebabkan adanya proliferasi limfosit pada organ limfonodus. Tingginya kadar asam linoleat dan asam linolenic di dalam jintan hitam juga berpengaruh terhadap proliferasi sel limfosit. Menurut Schleicher dan Saleh (2000), kandungan asam lemak yang tinggi terutama asam linoleat dan asam linolenic dalam jintan hitam mampu meningkatkan sistem imun tubuh dengan cara meningkatkan proliferasi limfosit untuk menghasilkan antibodi. Limfonodus akan mengarahkan limfosit muda yang terdapat pada folikel limfoid untuk menjadi limfosit dipredaran darah yang akan melakukan fungsinya sebagai pendeteksi antigen. Kebanyakan limfosit yang terdapat pada superfisial korteks adalah sel B. Sel B ini dapat masuk ke peredaran darah sebagai sel memori (Sari 2010).
Limfosit yang sudah ada di dalam organ limfoid sekunder akan bergerak dari organ limfoid yang satu ke organ limfoid yang lain, saluran limfe dan darah. Dari sirkulasi tersebut limfosid akan kembali memasuki limfoid sekunder atau rongga-rongga jaringan dan kelenjar getah bening (Baratawidjaja 2002).
betina, yang berpengaruh pada respon imun mencit. Pada saat estrus kondisis fisiologis mencit akan berubah karena terjadinya peradangan fisiologis pada mencit (Gyuton dan Hall 2005). Kondisi estrus juga menyebabkan serviks pada mencit betina dalam keadaan terbuka sehingga memungkinkan terjadinya introduksi mikroorganisme ke dalam saluran reproduksi (Lestari 2006). Selain itu kondisi estrus mencit juga sangat berhubungan dengan keadaan hormon di dalam tubuh.
Mencit yang digunakan dalam penelitian ini merupakan mencit yang sudah dewasa. Pada mencit betina dewasa yang mengalami estrus akan menyebabkan adanya perubahan secara hormonal terutama pada hormon progesteron yang akan meningkat pada saat terjadinya estrus. Sebagian besar hormon yang mengatur sistem imun dalam saluran reproduksi adalah estradiol-17β dan progesterone (Washburn et al. 1982).
Estradiol-17β dapat memfasilitasi pembersihan mikroorganisme, sementara treatment dengan progesteron sering menyebabkan adanya infeksi uterus. Perubahan pada hormon ini yang akan memicu terjadinya peningkatan kerja organ sistem imun terutama pada mencit betina, sehingga pada folikel limfoid yang terdapat pada limfonodus mencit betina menunjukkan luasan yang lebih tinggi dibandingkan dengan folikel limfoid pada limfonodus jantan.
4.2 Perubahan Gambaran Histopatologis Pada Limpa
Gambar 14 Histopatologi limpa pada mencit yang diberi perlakuan kontrol (A), Hs preventif (B), Hs kuratif (C), Hs madu (D) menggunakan pewarnaan HE yang menunjukkan perbedaan rataan jumlah dan luasan pulpa putih (PP) mengakibatkan luasan pulpa merah (PM) menjadi berbeda tiap perlakuan.
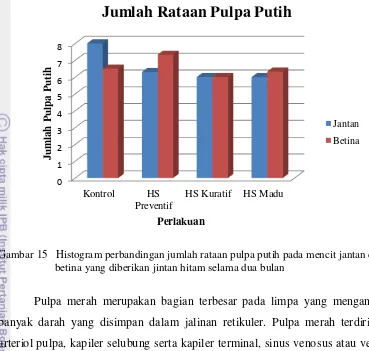
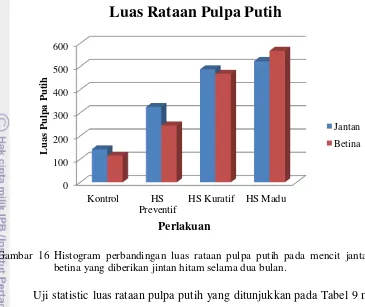
Hasil penelitian pada organ limpa yang telah diberi jintan hitam menunjukkan hasil uji statistik perhitungan rataan jumlah dan luasan pulpa putih dari masing-masing perlakuan yang dapat dilihat pada Tabel 9 dan gambaran histogram rataan jumlah dan luas pulpa putih antara mencit jantan dan berina, serta gambaran histopatologi organ limpa dengan perbesaran 400x (Gambar 14, 15, dan 16).
[image:55.595.110.511.98.397.2]Tabel 9 Rataan Jumlah dan Luas Pulpa Putih Mencit Jantan dan Betina.
Organ
yang
diamati
Parameter
Folikel
(Rata-rata)
Perlakuan
Kontrol HS Preventif HS Kuratif HS Madu
Limpa Jantan
Jumlah 6,5 ± 2,12a 7,33 ± 1,15a 6,0 ± 2,65a 6,33 ± 1,53a
Luas (μm) 142,5 ± 4,60a 325 ± 4,67bc 487,67 ± 7,41bc 523,33 ± 1,33 c
Limpa Betina
Jumlah 8,0 ± 0,0a 6,3 ± 2,08a 6,0 ± 1,0a 6,0 ± 3,46 a
Luas (μm) 115 ± 7,02a 245,55 ±
7,25ab 468,33 ± 1,98
bc 567,67 ± 1,67 c
Keterangan : Huruf superscript yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (p<0.05)
Gambar 15 Histogram perbandingan jumlah rataan pulpa putih pada mencit jantan dan betina yang diberikan jintan hitam selama dua bulan
Pulpa merah merupakan bagian terbesar pada limpa yang mengandung banyak darah yang disimpan dalam jalinan retikuler. Pulpa merah terdiri dari arteriol pulpa, kapiler selubung serta kapiler terminal, sinus venosus atau venula, dan bingkai limpa (Dellmann 1989). Berneda dengan pulpa merah, pulpa putih merupakan jaringan limfatik yang menyebar di seluruh limpa sebagai folikel limfoid limpa dan seperti selubung limfatik periarterial. Pada kedua lokasi, serabut retikuler dan sel retikuler membentuk jalinan stroma dalam tiga dimensi mengandung pecahan limfosit, makrofag, dan sel-sel aksesoris lain mirip dengan yang terlihat pada limfonodus. Sel-sel utama dalam folike