PERBANYAKAN TUNAS Boesenbergia flava DENGAN PEMBERIAN BAP DAN NAA SECARA IN VITRO
SKRIPSI
Oleh :
LYLI HERAWATI SIREGAR 070307006
BDP – PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
PERBANYAKAN TUNAS Boesenbergia flava DENGAN PEMBERIAN BAP DAN NAA SECARA IN VITRO
SKRIPSI
Oleh :
LYLI HERAWATI SIREGAR 070307006
BDP – PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
Judul Skripsi : Perbanyakan Tunas Boesenbergia flava Dengan Pemberian BAP dan NAA Secara In Vitro Nama : Lyli Herawati Siregar
NIM : 070307006
Program Studi : Pemuliaan Tanaman
Disetujui oleh, Komisi Pembimbing
(Luthfi Aziz Mahmud Srg, SP, MSc, PhD) Ketua
Mengetahui,
Ir. T. Sabrina, M. Agr,Sc. Phd Ketua Program Studi Agroekoteknologi
ABSTRAK
LYLI HERAWATI SIREGAR : Perbanyakan Tunas Boesenbergia flava dengan Pemberian BAP dan NAA Secara In Vitro, dibimbing oleh Luthfi Aziz Mahmud Siregar dan Lollie Agustina P. Putri.
Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi BAP dan NAA terhadap perbanyakan tunas Boesenbergia flava secara in vitro. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian Universitas Sumatera Utara, Medan yang dimulai pada bulan Maret sampai dengan Mei 2012. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan. Faktor pertama adalah konsentrasi NAA yang terdiri dari 4 taraf yaitu 0 mg/l; 1 mg/l; 2 mg/l; 3 mg/l. Faktor kedua adalah konsentrasi BAP meliputi 0 mg/l; 1,5 mg/l; 3 mg/l; 4,5 mg/l.
Hasil penelitian menunjukkan bahwa konsentrasi NAA berpengaruh nyata terhadap panjang akar dan tinggi tanaman dan konsentrasi BAP berpengaruh nyata terhadap parameter panjang akar, tinggi tanaman tetapi tidak berpengaruh nyata terhadap jumlah akar dan jumlah daun. Demikian juga Interaksi konsentrasi NAA dan BAP berpengaruh nyata pada panjang akar dan jumlah akar namun tidak berpengaruh nyata tinggi tanaman dan jumlah daun.
ABSTRACT
LYLI HERAWATI SIREGAR : The Micropropagation of Boesenbergia flava bud by BAP and NAA for in vitro, guided by oleh Luthfi Aziz Mahmud Siregar dan Lollie Agustina P. Putri.
The research aimed to know the influence of BAP and NAA concentration on micropropagation of Boesenbergia flava bud for in vitro. The research was carried out in the Tissue Culture Laboratory, Agriculture’s facuity of Nort Sumatera University from March to May 2012. This research used Completely Randomezed Design with two treatment factors. First factor was NAA concentration consist of four level; 0 mg/l; 1 mg/l; 2 mg/l; 3 mg/l. The second factor was BAP concentration consist of four level are 0 mg/l; 1,5 mg/l; 3 mg/l; 4,5 mg/l.
The results of research showed that NAA concentration give significantly affected on long of roots and plant height and BAP concentration give significantly affected on long of roots and plant height but that was not significantly affected on roots number and leaves number. Similarly to interaction of concentration NAA dan BAP give significantly affected on long of roots and roots number butth at was not significantly affected on plant height and leaves number.
RIWAYAT HIDUP
Penulis dilahirkan di Siunggam Tap-Sel pada tanggal 21 Desember 1987 dari ayahanda Syahrun Siregar dan Ibunda Nursaima Harahap. Penulis merupakan putri keempat dari tujuh bersaudara.
Pendidikan formal yang pernah dijalani adalah SD inpres 142746 siunggam, Tapsel lulus pada tahun 2001, MTS Negri Sigama, Tapsel lulus pada tahun 2004 dan SMA Negri 1 Sipupus, Tapsel lulus pada tahun 2007. Tahun 2007 diterima sebagai mahasiswa Universitas Sumatera Utara, Fakultas Pertanian dengan program studi Pemuliaan Tanaman.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas
berkat dan Rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Perbanyakan Tunas Boesenbergia flava Dengan Pemberian BAP dan NAA
Secara In Vitro”.
Terima kasih kepada Bapak Luthfi Aziz Mahmud Srg, SP, MSc, PhD dan Dr. Ir. Lollie Agustina P. Putri MSi selaku ketua dan anggota komisi pembimbing yang telah membimbing dan memberikan berbagai masukan berharga kepada penulis dalam menyelesaikan skripsi ini
Ucapan terima kasih yang tak terhingga saya persembahkan kepada
Ayahanda Syahrun Siregar dan Ibunda Nursaima Harahap. Juga kepada abangku Agus Hidayat Siregar ST, Ali Hendra Siregar S.pi dan kakak Astati Atmajaya Siregar Amd beserta adik-adikku Ramsona Dewi Siregar Amkeb,
Anna Sari Siregar dan Elman Rajagoda Siregar yang memberikan dukungan, semangat dan motivasi yang tak terhingga kepada penulis. Selain itu penulis ucapkan terima kasih kepada Pantas Pandapotan Hasibuan yang juga memberi dukungan dan motivasi, dan kak Asni SP beserta sahabat-sahabat angkatan 2007 atas segala perhatian dan bantuannya.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan dan jauh dari sempurna. Oleh sebab itu, penulis mengharapkan kritik dan saran yang bersipat membangun. Akhir kata penulis ucapkan terima kasih.
Tinggi Tanaman (cm) ... 23
Jumlah Akar (buah) ... 23
Panjang akar (cm) ... 23
Jumlah Daun ... 23
HASIL DAN PEMBAHASAN Hasil ... 24
Pembahasan ... 30
KESIMPULAN DAN SARAN Kesimpulan ... 34
Saran ... 34
DAFTAR TABEL
No. Hal
1. Pengaruh konsentrasi BAP dan NAA terhadap Persentase Eksplan Yang Hidup (%) ... 24 2. Pengaruh konsentrasi BAP dan NAA terhadap Persentase Eksplan
membentuk tunas (%) ... 25 3. Pengaruh konsentrasi BAP dan NAA terhadap tinggi tanaman (cm) . 25
DAFTAR GAMBAR
No. Hal
1. Boesenbergia flava ... 5
2. Hubungan konsentrasi NAA terhadap tinggi tanaman ... 26
3. Hubungan konsentrasi NAA terhadap panjang akar...28
4. Hubungan konsentrasi BAP terhadap panjang akar...29
5. Foto perlakuan (N0B0) ... 50
6. Foto perlakuan (N0B1) ... 50
7. Foto perlakuan (N0B2) ... 50
8. Foto perlakuan (N0B3) ... 50
9. Foto perlakuan (N1B0) ... 50
10.Foto perlakuan (N1B1) ... 50
11.Foto perlakuan (N1B2) ... 50
12.Foto perlakuan (N1B3) ... 50
13.Foto perlakuan (N2B0) ... 51
14.Foto perlakuan (N2B1) ... 51
15.Foto perlakuan (N2B2) ... 51
16.Foto perlakuan (N2B3) ... 51
17.Foto perlakuan (N3B0) ... 51
18.Foto perlakuan (N3B1) ... 51
19.Foto perlakuan (N3B2) ... 51
DAFTAR LAMPIRAN
No. Hal
1. Bagan penelitian ... 35
2. Tabel kegiatan penelitian ... 36
3. Komposisi media murashige dan skoog (MS) ... 37
4. Persentase eksplan yang hidup (%) ... 38
5. Persentase eksplan membentuk tunas (%) ... 39
6. Tinggi planlet (cm) ... 41
7. Sidik ragam tinggi tanaman (cm) ... 41
8. Jumlah akar (buah) ... 42
9. Panjang akar (cm) ... 42
10.Jumlah daun (helai) ... 43
11.Sidik ragam jumlah daun (helai) ... 42
ABSTRAK
LYLI HERAWATI SIREGAR : Perbanyakan Tunas Boesenbergia flava dengan Pemberian BAP dan NAA Secara In Vitro, dibimbing oleh Luthfi Aziz Mahmud Siregar dan Lollie Agustina P. Putri.
Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi BAP dan NAA terhadap perbanyakan tunas Boesenbergia flava secara in vitro. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian Universitas Sumatera Utara, Medan yang dimulai pada bulan Maret sampai dengan Mei 2012. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan. Faktor pertama adalah konsentrasi NAA yang terdiri dari 4 taraf yaitu 0 mg/l; 1 mg/l; 2 mg/l; 3 mg/l. Faktor kedua adalah konsentrasi BAP meliputi 0 mg/l; 1,5 mg/l; 3 mg/l; 4,5 mg/l.
Hasil penelitian menunjukkan bahwa konsentrasi NAA berpengaruh nyata terhadap panjang akar dan tinggi tanaman dan konsentrasi BAP berpengaruh nyata terhadap parameter panjang akar, tinggi tanaman tetapi tidak berpengaruh nyata terhadap jumlah akar dan jumlah daun. Demikian juga Interaksi konsentrasi NAA dan BAP berpengaruh nyata pada panjang akar dan jumlah akar namun tidak berpengaruh nyata tinggi tanaman dan jumlah daun.
ABSTRACT
LYLI HERAWATI SIREGAR : The Micropropagation of Boesenbergia flava bud by BAP and NAA for in vitro, guided by oleh Luthfi Aziz Mahmud Siregar dan Lollie Agustina P. Putri.
The research aimed to know the influence of BAP and NAA concentration on micropropagation of Boesenbergia flava bud for in vitro. The research was carried out in the Tissue Culture Laboratory, Agriculture’s facuity of Nort Sumatera University from March to May 2012. This research used Completely Randomezed Design with two treatment factors. First factor was NAA concentration consist of four level; 0 mg/l; 1 mg/l; 2 mg/l; 3 mg/l. The second factor was BAP concentration consist of four level are 0 mg/l; 1,5 mg/l; 3 mg/l; 4,5 mg/l.
The results of research showed that NAA concentration give significantly affected on long of roots and plant height and BAP concentration give significantly affected on long of roots and plant height but that was not significantly affected on roots number and leaves number. Similarly to interaction of concentration NAA dan BAP give significantly affected on long of roots and roots number butth at was not significantly affected on plant height and leaves number.
PENDAHULUAN
Latar Belakang
Boesenbergia flava merupakan tanaman yang berasal dari famili zingiberaceae. Spesies Boesenbergia sangat langka dibandingkan dengan genera lain. Sebagian besar, Boesenbergia ditemukan dalam area sangat lembab, area teduh dan biasanya dekat dengan sungai atau dalam kondisi berawa, yang keberadaannya masih susah ditemukan karena tanaman ini langka, boesenbergia adalah genus dari tumbuh-tumbuhan rhizomatus kecil, sebagian besar tumbuh di hutan (Sirirugsa, 1992).
Zingiberaceae merupakan tanaman herba tropis yang mempunyai 47 genus dan 1400 spesies dan pada umumnya banyak digunakan sebagai obat-obatan, bahan kosmetik maupun bumbu masak (Yunira dkk, 2008).
Perkembangan industri berbahan baku tanaman obat dalam 5 tahun terakhir menunjukkan pertumbuhan yang signifikan dan omset produksinya selama kurun waktu tersebut meningkat sebesar 2,5 – 30% /tahun. Pada tahun 2000 nilai perdagangan tanaman obat di Indonesia mencapai Rp.1,5 trilyun rupiah setara dengan US $ 150 juta, masih jauh di bawah nilai perdagangan herbal dunia yang mencapai US $ 20 milyar; US $ 8 milyar dikuasai oleh produk herbal dari China (Rini, 2009).
akhir ini, kendala dalam memperbanyak beberapa jenis tanaman dapat diatasi (Wattimena dkk, 1992).
Masalah yang dihadapi dalam pengembangan tanaman penghasil obat dan pada umumnya adalah merupakan tanaman musiman atau tahunan sehingga membutuhkan waktu yang cukup lama untuk mendapatkan hasilnya. Berbagai kendala dijumpai dalam perbanyakan temu-temuan antara lain : budidaya, pasca panen, mutu dan fluktuasi harga. Di sisi lain, desakan penduduk dan perkembangan industri yang semakin menyempitkan ketersediaan lahan-lahan pertanian. Penggunaan teknik kultur jaringan jadi lebih menarik dari pada menumbuhkan di lapangan yang mempunyai banyak hambatan. Perbanyakan dan pengembangan temu-temuan dengan teknik kultur jaringan mulai dilirik untuk
mempercepat proses dalam mengatasi berbagai kendala tersebut di atas (Kristina dkk, 2002).
Dengan teknik in vitro mampu memproduksi bibit dalam jumlah besar dengan waktu yang relatif singkat, bebas patogen, identik dengan induknya dan tidak dipengaruhi musim. Teknik ini memerlukan media buatan yang dibuat dari beberapa komponen utama yaitu gula, air, unsur hara makro dan mikro, vitamin, asam amino, serta zat pengatur tumbuh. Gula sangat diperlukan sebagai sumber energi dalam kultur jaringan karena tanaman bersifat heterotrof (Sastra, 2005).
Perbanyakan tanaman secara in vitro bertujuan untuk memperoleh
bahan tanaman steril yang akan digunakan untuk perbanyakan bibit.
Oleh karena itu, diperlukan proses sterilisasi yang tepat untuk mematikan
mikroorganisme yang terdapat pada eksplan sehingga tidak mengganggu
(tanaman), seperti tanaman herbal atau berkayu, dan kondisi lingkungan
(Aisyah dan Dedi, 2011).
Media yang biasa adalah media Murashige & Skoog (MS). Media MS digunakan untuk hampir semua macam tanaman, terutama tanaman herbasius. Media ini mempunyai konsentrasi garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4
-Penelitian ini bertujuan untuk mengetahui pengaruh NAA dan BAP serta
interaksi keduanya terhadap pertumbuhan tunas Boesenbergia flava secara in vitro.
Hipotesis Penelitian
Ada pengaruh interaksi antara tingkat konsentrasi NAA dan BAP terhadap jumlah tunas perbanyakan Boesenbergia flava.
(Hendaryono dan Wijayani, 1994).
Salah satu alternatif metode perbanyakan yang dapat ditempuh adalah melalui kultur in vitro. Metode ini diharapkan mampu menghasilkan tanaman dalam skala besar dengan waktu yang relatif cepat serta kualitas tanaman yang dihasilkan menjadi lebih baik melalui kultur jaringan kebutuhan ketersediaan bibit tanaman dalam jumlah yang banyak dapat terpenuhi (Gunawan, 1992).
Penelitian tentang perbanyakan Boesenbergia flava hingga saat ini masih sangat kurang, mengingat keterbatasan informasi tentang perbanyakannya secara
in vitro pun masih sangat terbatas. Berdasarkan uraian di atas, maka dipandang perlu untuk melakukan penelitian mengenai pengaruh pemberian NAA dan BAP terhadap perbanyakan Boesenbergia flava secara in vitro.
Kegunaan Penelitian
TINJAUAN PUSTAKA
Berdasarkan (2012) klasifikasi tanaman
Boesenbergia flava Holttum adalah Kingdom: Class:
Ordo: Zingiberales, Family: Genus: , spesies: Boesenbergia flava Holttum.
Batang yang berdaun pendek dengan masing-masing 4 daun dan pelepah merah di pangkalnya. Helaian daun yang ke 20 dengan panjang 6 cm, agak simetris, berbentuk bulat panjang hijau dengan tanda keperak-perakan ditengah (dengan pelepah dan sebuah tanda di kedua sisi itu) panjang tangkai daun 2-4 cm. Panjang ligula-lobus 1 cm, tipis, merah muda: pelepah memerah atau belang-belang dengan warna merah hampir seluruhnya. Perbungaan seluruhnya di sembunyikan oleh daun seperti dalam B. Pandurata dan dengan bentuk yang
mirip. Panjang bracts sekitar 5 cm dan kemerah-merah mudaan. Panjang corolla – tube 1- 1,5 cm lebih panjang dari bracts. Panjang lobus kuning 2-2,5 cm,
lebarnya 2 cm, hampir datar kekuning-kuningan menempel di dekat pucuk dan bercak merah di kedua sisi garis tengah menuju pangkal. Panjang serabut hampir 1-5 cm, pucat kekuning-kuningan ± sedikit merah ke merah mudaan: panjang anther sekitar 5 mm, kantung serbuk sari agak di pucuk. Sambungan di perpanjang menjadi 1 mm panjangnya tidak lebih lebar dari pada anther, sedikit melipat dengan ujung yang sangat pendek (Bulletin, 1950).
Spesies ini awalnya di kenalkan oleh Ridley dari sebuah tanaman yang di budidayakan di Penang, di bawa dari kabupaten Batang Padang (perak) gambar yang berwarna ada di Singapura dan juga contoh keringnya di buat dari gambar tanaman. Bunga dari Boesenbergia flava besar dan warnanya kuning dengan tanda merah khusus (Bulletin, 1950).
Kultur Jaringan
bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap (Hartman dkk, 2002).
Berbeda dengan teknik perbanyakan vegetatif konvensional, kultur jaringan melibatkan pemisahan komponen-komponen biologis dan tingkat pengendalian yang tinggi dalam memacu proses regenerasi dan perkembangan jaringan. Setiap urutan proses dapat dimanipulasi melalui seleksi bahan tanaman, medium kultur dan faktor-faktor lingkungan, termasuk eliminasi mikroorganisme seperti jamur dan bakteri. Semua itu dimaksudkan untuk memaksimalkan produk akhir dalam bentuk kuantitas dan kualitas propagula berdasarkan prinsip totipotensi sel (Zulkarnain, 2009).
Dibanding dengan perbanyakan tanaman secara konvensional, perbanyakan tanaman secara kultur jaringan mempunyai beberapa kelebihan sebagai berikut:
1. Untuk memperbanyak tanaman tertentu yang sulit atau sangat lambat diperbanyak secara konvensional. Perbanyakan tanaman secara kultur jaringan menawarkan peluang besar untuk menghasilkan jumlah bibit tanaman yang banyak dalam waktu relatif singkat sehingga lebih ekonomis. 2. Perbanyakan tanaman secara kultur jaringan tidak memerlukan tempat yang
luas.
3. Teknik perbanyakan tanaman secara kultur jaringan dapat dilakukan sepanjang tahun tanpa bergantung pada musim.
4. Bibit yang dihasilkan lebih sehat.
Pada dasarnya kultur in vitro merupakan suatu proses perbanyakan sel, jaringan, organ atau protoplasma dengan teknik steril. Keberhasilan teknologi in vitro masih terbatas pada beberapa tanaman tertentu saja. Kultur in vitro juga memberikan pengertian tentang studi fisiologi, biokimia, genetika pertumbuhan dan perkembangan spesies tanaman pada tingkat molekuler (Nasir, 2000)
Eksplan
Kondisi fisiologis eksplan memiliki peranan penting bagi keberhasilan teknik kultur jaringan. Pierik (1997) menyatakan bahwa pada umumnya bagian-bagian vegetatif lebih siap beregenerasi daripada bagian-bagian-bagian-bagian generatif. Eksplan mata tunas yang diperoleh dari tanaman yang sedang istirahat, lebih sulit berpoliferasi daripada mata tunas yang diperoleh dari tanaman yang sedang aktif tumbuh. Hal itu sama halnya dengan kasus dormansi pada eksplan biji. Kondisi fisiologis dari suatu tanaman bervariasi secara alami, sejalan dengan pertumbuhan tanaman yang melewati fase-fase yang berbeda dan perubahan kondisi lingkungan (Zulkarnain, 2009).
Dalam pemilihan bagian tanaman, perlu juga dipertimbangkan tujuan dari kulturnya. Bagian-bagian tertentu akan memberikan variasi dalam jumlah kromosom maupun variasi dalam beberapa gen. Endosperma hanya digunakan untuk mendapatkan kultur yang triploid. Selain bagian tanaman, genotip atau
varietas yang digunakan juga ikut menentukan keberhasilan regenerasi (Gunawan, 1995).
tergantung pada faktor yang meliputi genotif eksplan, umur fisiologis juga sumber jaringan (Hughes, 1982).
Pada tanaman herba, eksplan diambil baik dari pucuk apikal maupan lateral yang mengambil jaringan meristematik namun sering kali digunakan mata tunas yang diharapkan akan berkembang membentuk daun dan batang sempurna. Bagian tanaman yang digunakan sebagai eksplan adalah tunas lateral atau terminal yang panjangnya kurang lebih 20 mm. Pengaruh dominasi apikal dapat dihilangkan dengan menambahkan zat pengatur tumbuh (terutama sitokinin) kedalam medium. Sebagai hasilnya adalah tunas dengan jumlah cabang yang banyak (Wattimena, 1992).
Media Kultur
Sebelum membuat medium, maka terlebih dahulu kita harus menentukan medium apa yang akan kita buat. Jenis medium dengan komposisi unsur kimia yang berbeda dapat digunakan untuk media tumbuh dari jaringan tanaman yang berbeda pula (Hendaryono dan Wijayani, 1994).
Medium yang digunakan untuk kultur in vitro tanaman dapat berupa medium padat atau cair. Medium padat digunakan untuk menghasilkan kalus yang selanjutnya diinduksi membentuk tanaman yang lengkap (disebut sebagai planlet), sedangkan medium cair biasanya digunakan untuk kultur sel. Medium yang digunakan mengandung lima komponen utama yaitu senyawa anorganik, sumber karbon, vitamin, zat pengatur tumbuh dan suplemen organik (Yuwono, 2008). Media yang digunakan secara luas adalah media MS yang dikembangkan
makro yang digunakan (1/2 MS) atau menggunakan komposisi garam makro berdasarkan MS tetapi mikro dan vitamin berdasarkan komposisi Heller. Zat pengatur tumbuh yang akan digunakan disesuaikan dengan tujuan inisiasi kultur (Gunawan, 1995).
Jenis dan komposisi media sangat memerlukan biaya produksi dan keberhasilan perbanyakan tanaman secara in vitro. Teknik perbanyakan bibit secara in vitro dapat di lakukan setiap waktu tanpa dipengaruhi oleh musim. Walaupun demikian, biaya produksi bibit jahe dengan teknik kultur jaringan sangat mahal, karena pada umumnya di gunakan Murashige dan skoog (MS) yang merupakan media pertumbuhan dengan bahan pemadat agar yang diperkaya
dengan berbagai senyawa organik, vitamin dan zat pengatur tumbuh (Sutarto dkk, 2003).
Lingkungan In Vitro
Lingkungan tumbuh yang dapat mempengaruhi regenerasi tanaman meliputi: Temperatur, Penyinaran: panjang penyinaran, intensitas penyinaran, dan kualitas sinar, serta ukuran wadah kultur (Gunawan, 1995).
Temperatur di dalam ruang kultur jaringan diharapkan dapat diatur. Banyak laporan mengatakan bahwa temperatur yang baik untuk pertumbuhan tanaman dalam in vitro antara 20-280
Zat pengatur tumbuh memegang peranan penting dalam pertumbuhan dan perkembangan kultur. Faktor yang perlu mendapat perhatian dalam penggunaan c yang merupakan suhu ruangan normal. Suhu ruangan untuk negara tropis dapat diturunkan dengan pemasangan AC. Pemakaian AC mutlak karena ruang kultur merupakan ruangan tertutup yang sedikit sekali mempunyai aliran udara bebas (Gunawan, 1987).
Pengaruh intensitas cahaya terhadap pembentukan akar bergantung pada cara pemberian cahaya tersebut. Protokorm Cymbidium yang berwarna hijau akan membentuk akar dan tunas bila diberi intensitas cahaya 2200 sampai 2500 lux. Namun, bila disimpan dalam gelap hanya membentuk tunas. Pembentukan akar disini diduga ada kaitannya dengan metabolism nitrogen yang terjadi dengan adanya cahaya. Untuk keperluan kultur jaringan cahaya putih dari lampu flourscent dengan intensitas 1000 lux untuk fase inisiasi dan subkultur, sedangkan untuk fase pengakaran dan persiapan planlet sebelum dilakukan aklimatisasi menggunakan intensitas 3000 sampai 10000 lux. Intensitas yang lebih rendah akan menghasilkan planlet yang mengalami etiolasi dengan daun yang berwarna
pucuk. Lama penyinaran yang dianjurkan adalah 16 jam per hari (Wattimena dkk, 1992).
zat pengatur tumbuh antara lain jenis zat pengatur tumbuh yang akan digunakan, konsentrasi, urutan penggunaan, dan periode masa induksi dalam kultur tertentu (Gunawan, 1995).
Pierik (1997) mengemukakan bahwa fitohormon adalah senyawa-senyawa yang dihasilkan oleh tanaman tingkat tinggi secara endogen. Senyawa tersebut berperan merangsang dan meningkatkan pertumbuhan serta perkembangan sel, jaringan dan organ tanaman menuju arah diferensiasi tertentu. Senyawa-senyawa lain yang memiliki karakteristik yang sama dengan hormone, tetapi diproduksi secara eksogen, dikenal sebagai zat pengatur tumbuh.
Untuk meningkatkan daya regenerasi dari eksplan tunas diperlukan
penambahan zat pengatur tumbuh dalam media tanam. Kebutuhan nutrisi dan zat
pengatur tumbuh untuk memacu proses morfogesis pada kultur in vitro akan
berbeda untuk setiap jenis tanaman dan eksplan yang digunakan ( Marlin, 2005)
Naftalen asam asetat (NAA)
Auksin adalah sekelompok senyawa yang fungsinya merangsang pemanjangan sel-sel pucuk yang spektrum aktivitasnya menyerupai IAA (indole-3-acetic-acid). Pierik (1997) menyatakan bahwa pada umumnya auksin
Pertumbuhan dari kultur jaringan atau organ dan In vitro morfogenesis lebih dipengaruhi oleh genotipe sumber jaringan atau organ yang digunakan dibandingkan dengan faktor lainnya. Media dan kondisi fisik lingkungan tumbuh kultur sering kali berbeda satu genus dengan genus yang lain, atau spesies tanaman tertentu dengan spesies lain. Tidak jarang antar varietas yang memiliki sifat dekat namun kebutuhannya akan lingkungan dan media berbeda (Wattimena, dkk, 1992).
Naphthalene Acetic Acid (NAA) adalah auksin sintetik yang sering ditambahkan dalam media tanam karena mempunyai sifat lebih stabil dari pada Indol Acetic Acid (IAA). IAA dapat mengalami degradasi yang disebabkan adanya cahaya atau enzim oksidatif. Oleh karena sifatnya yang labil IAA jarang
digunakan dan hanya merupakan hormon alami yang ada pada jaringan tanaman yang digunakan sebagai eksplan. Sedangkan NAA tidak mudah terurai oleh enzim yang dikeluarkan sel atau pemanasan pada proses sterilisasi (Wulandari dkk, 2004).
Benzil aminopurin (BAP)
Sifat paling karakteristik yang berkaitan dengan sitokinin adalah perangsangan hormon terhadap pembelahan sel pada kultur jaringan tanaman. Satu dari reaksi yang benar-benar dramatis terhadap sitokinin adalah pembentukan organ-organ yang terjadi di bawah kondisi yang tepat dalam berbagai kultur jaringan. Dengan pemprosesan sitokinin mengeluarkan pembentukan tunas yang melimpah (Wilkins, 1989).
sendiri, sebab sitokinesis hanya merupakan proses pembelahan saja sitokinin berfungsi untuk memacu pembelahan sel dan pembentukan organ, menunda penuaan dan meningkatkan aktifitas wadah penampung hara, memacu perkembangan pucuk dan di dukung oleh Dwidjoseputro (1980) yang menyatakan sitokinin bukan senyawa tunggal melainkan kumpulan senyawa yang berfungsi mirip satu dengan yang lain. Zat ini menggiatkan pembelahan sel jelas juga pengaruhnya terhadap pertumbuhan tunas dan akar (Salisbury dan Ross, 1995).
Zat pengatur tumbuh yang diberikan harus dapat diabsorbsi dan ditranslokasikan ke jaringan target. Hal ini tentu tergantung dari formulasi dan konsentrasi zat pengatur tumbuh sehingga dapat dikatakan bahwa pada konsentrasi tersebut belum dapat diabsorbsi dan ditranslokasikan oleh tanaman untuk pertumbuhan dan perkembangan. Peningkatan konsentrasi auksin akan menghambat inisiasi akar, pembelahan sel dan pemanjangan akar menambahkan konsentrasi NAA yang ditingkatkan ke media pengakaran akan meningkatkan auksin endogen sehingga terjadi akumulasi auksin. Akumulasi auksin ini akan menghambat pemajangan akar. Konsentrasi auksin endogen yang tinggi dapat menyebabkan pemendekan sel-sel. konsentrasi zat pengatur tumbuh untuk
pembesaran sel-sel pada batang menjadi penghambat pada pembentukan sel-sel akar. Interaksi BAP dan NAA mempengaruhi aktivitas sel sel di batang
untuk memunculkan tunas sehingga aktivitas sel-sel di akar terhambat (Wattimena, dkk, 1992).
dikulturkan. Pengulturan dalam media yang ditambah dengan sitokinin bertujuan untuk merangsang pecah dan tumbuhnya mata tunas samping dan mencegah dominansi tunas apikal yang mengakibatkan terbentuknya tunas samping (Yusnita, 2003).
Zat pengatur tumbuh pada tanaman adalah senyawa organik yang bukan hara yang dalam jumlah sedikit dapat mendukung (promote), menghambat dan merubah proses fisiologi tumbuhan. Auksin dan sitokinin adalah zat pengatur tumbuh yang sering ditambahkan dalam media tanam karena mempengaruhi pertumbuhan dan organogenesis dalam kultur jaringan dan organ. Auksin sintetik perlu ditambahkan karena auksin yang terbentuk secara alami sering tidak mencukupi untuk pertumbuhan jaringan eksplan. Auksin mempunyai peranan
terhadap pertumbuhan sel, dominasi apikal dan pembentukan kalus. Kisaran konsentrasi auksin yang biasa digunakan adalah 0,01-10 ppm.
(Wulandari dkk, 2004)
BAP (6-Benzyl Amino Purine) merupakan golongan sitokinin sintetik yang paling sering digunakan dalam perbanyakan tanaman secara kultur in vitro. Hal ini karena BAP mempunyai efektifitas yang cukup tinggi untuk perbanyakan tunas, mudah didapat dan relatif lebih murah dibandingkan dengan kinetin (Kurnianingsih dkk, 2009).
merangsang pembentukan akar. Jika konsentrasi auksin dalam media kultur tinggi maka akan menghambat pertumbuhan tunas (Kurnianingsih 2009).
Menurut Wiendi dkk (1991) menyatakan bahwa pada beberapa tanaman membutuhkan waktu yang lama untuk beregenerasi. Kemungkinan sitokinin endogen tidak mencukupi untuk pembentukan tunas berarti selain auksin zat pengatur tumbuh sitokinin juga perlu ditambahkan ke dalam media. Pierik (1987) menyatakan bahwa sitokinin berperan dalam memacu pertumbuhan dan perkembangan tanaman khususnya tunas adventif yang di kutip dari Azriati (2005) menyebutkan tanpa adanya penambahan sitokinin ke dalam media tanam menyebabkan eksplan tidak mampu berorganogenesis membentuk tunas karena belum adanya interaksi dan keseimbangan antara auksin dan sitokinin endogen dengan auksin dan sitokinin eksogen. Menurut Evans, dkk (1986) yang dikutip oleh Sobardini, dkk (2006) yang menyatakan bahwa tunas yang sedang berkembang dapat memproduksi auksin dalam jumlah yang cukup untuk perakaran
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian Universitas Sumatera Utara, Medan yang dimulai pada bulan Maret sampai dengan Mei 2012.
Bahan dan Alat Penelitian
Bahan tanaman yang digunakan dalam penelitian ini adalah planlet
Boesenbergia flava yang berasal dari PT. Tamora Stakindo dan dipelihara dalam media MS dengan penambahan zat pangatur tumbuh NAA dan BAP. Bahan tanaman Boesenbergia flava diperoleh dari kawasan hutan di Batang Padang, Malaysia. Bahan untuk media meliputi larutan stok media MS, NAA, BAP, agar-agar, NaOH 1 N, HCl, pH meter/kertas lakmus, aluminium foil dan aquades. Bahan sterilisasi yang digunakan dalam penelitian ini adalah alkohol 96%.
Alat-alat yang digunakan adalah autoklaf, Laminar Air Flow (LAF), botol kultur, erlenmeyer, pipet skala, gelas ukur, petridis, skalpel, gunting, bunsen, timbangan analitik, hot plate, batang pengaduk, lemari es, kertas milimeter, pinset, oven, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Percobaan ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial dengan dua perlakuan, yaitu:
Faktor I : Tingkat konsentrasi Pemberian NAA dengan 4 taraf :
N1 = 1 mg/l N2 = 2 mg/l
N3 = 3 mg/l
Faktor II : Tingkat Konsentrasi Pemberian BAP dengan 4 taraf : B0 = 0 mg/l
B1 = 1,5 mg/l B2 = 3 mg/l B3 = 4,5 mg/l Kombinasi perlakuan ada 16, yaitu:
N0B0 N1B0 N2B0 N3B0
N0B1 N1B1 N2B1 N3B1
N0B2 N1B2 N2B2 N3B2
N0B3 N1B3 N2B3 N3B3
Jumlah ulangan : 4 ulangan Jumlah Kombinasi : 16 kombinasi Jumlah Tanaman/botol : 1 tanaman Jumlah sampel/botol : 1 tanaman Jumlah seluruh botol : 64 botol kultur Jumlah seluruh tanaman : 64 tanaman
Data hasil penelitian dianalisi dengan sidik ragam model linier sebagai berikut:
dengan:
Yijk = Hasil pengamatan dari konsentrasi pada taraf ke-i dan konsentrasi pada taraf ke-j dalam ulangan ke-k
µ = Efek dari nilai tengah
αi = Efek dari konsentrasi NAA pada taraf ke-i βj = Efek konsentrasi BAP pada taraf ke-j
(αβ)ij = Interaksi antara konsentrasi NAA dan BAP pada taraf ke-i dengan konsentrasi BAP pada taraf ke-j
εijk = Galat dan konsentrasi NAA pada taraf ke-i dengan konsentrasi BAP pada taraf ke-j dalam ulangan ke-k
PELAKSANAAN PENELITIAN
Pembuatan Larutan Stok
Pembuatan larutan stok bertujuan untuk memudahkan pekerjaan dalam membuat media. Larutan stok dibuat sesuai dengan komposisi media Murashige dan Skoog (MS) (Lampiran 3) yang diaduk dalam erlenmeyer dengan konsentrasi yang lebih pekat. Pembuatan larutan stok bahan kimia hara makro dengan pemekatan 20x, hara mikro dengan pemekatan 200x, larutan iron dengan pembesaran 100x, larutan vitamin dengan pembesaran 200x. Kemudian stok disimpan di dalam lemari es.
Sterilisasi Alat
Sterilisasi bermanfaat untuk membersihkan seluruh alat-alat yang digunakan dalam kultur jaringan sehingga terbebas dari hal-hal yang dapat menimbulkan kontaminasi. Alat-alat tersebut dicuci dengan deterjen, kemudian dibilas dengan air, setelah itu dikeringkan. Kemudian alat seperti skalpel, pipa skala, pinset dan cawan petri dibungkus dengan kertas, sedang untuk erlenmeyer dan gelas ukur permukaannya ditutup dengan aluminium foil. Setelah itu, semua botol kultur dan alat-alat dimasukkan ke dalam autoklaf pada tekanan 17,5 psi, dengan suhu 1210
Subkultur merupakan salah satu tahap dalam perbanyakan tanaman melalui kultur jaringan. Untuk subkultur bahan tanaman yang diperoleh dari tanaman steril. Subkultur dalam penelitian ini dilakukan untuk menjaga agar C selama 60 menit. Kemudian alat-alat tersebut dimasukkan ke dalam oven kecuali botol kultur.
tanaman tidak kekurangan hara. Cara kerja subkultur yaitu dengan cara planlet dikeluarkan dari botol kultur lalu di masukkan ke dalam cawan petri, planlet di potong-potong dengan menggunakan scalpel streril. Potongan tadi dimasukkan ke dalam media yang baru (MS + 0,5 mg/NAA + 1 mg/BAP) kemudian dipelihara selama 8 minggu.
Pembuatan Media
Media ini selanjutnya disterilkan dengan autoklaf pada suhu 121°C, tekanan 17,5 psi, selama 30 menit. Setelah itu, media diletakkan kedalam ruang kultur.
Pemotongan Eksplan
Eksplan yang digunakan adalah tunas aksilar dari planlet yang disubkulturkan ke dua kalinya dalam media MS dengan menggunakan dua zat pengatur tumbuh NAA dan BAP. Planlet dikeluarkan dari botol kultur dengan menggunakan pinset setelah itu tunas-tunas aksilar dipisahkan dengan menggunakan skalpel. Kemudian tunas-tunas yang memiliki ukuran 0,5 cm dipotong akarnya dengan menggunakan gunting yang steril. Pemotongan dilakukan di LAF.
Penanaman Eksplan
Penanaman eksplan dilakukan di LAF yang telah disterilkan dengan alkohol 96%. Eksplan yang telah dipotong kemudian diletakkan di petridis. Diambil botol media lalu di dekatkan dengan api bunsen kemudian eksplan ditanam ke dalam botol media sesuai dengan perlakuan, setiap botol media terdapat 1 eksplan. Setelah itu botol media dikembalikan ke dalam ruang kultur. Pemeliharaan
Pengamatan Parameter
Persentase eksplan yang hidup (%)
Pengamatan dilakukan pada minggu ke-4 dan minggu ke-8 dengan rumus sebagai berikut :
Persentase eksplan yang hidup = Jumlah eksplan yang hidup x 100% Jumlah eksplan seluruhnya
Persentase eksplan membentuk tunas (%)
Pengamatan eksplan membentuk tunas dilakukan pada minggu ke-4 dan minggu ke-8 dengan rumus sebagai berikut :
Persentase eksplan membentuk tunas = Jumlah eksplan yang membentuk tunas x Jumlah eksplan seluruhnya
Tinggi planlet (cm)
Diukur pada akhir penelitian dengan menggunakan kertas milimeter mulai dari tempat munculnya batang (pangkal) sampai ujung daun tertinggi.
Jumlah akar (buah)
Dihitung pada akhir penelitian dengan menghitung jumlah akar yang muncul.
Panjang akar (cm)
Di ukur pada akhir penelitian dengan menggunakan kertas milimeter mulai dari tempat munculnya akar (pangkal) sampai ujung akar.
Jumlah daun
Dihitung pada akhir penelitian dengan menghitung jumlah daun yang muncul.
HASIL DAN PEMBAHASAN
Hasil
Dari analisa data yang di lakukan diperoleh hasil bahwa pemberian NAA berpengaruh nyata terhadap parameter panjang akar dan tinggi tanaman sedangkan pemberian BAP berpengaruh nyata terhadap parameter panjang akar, tinggi tanaman dan tidak berpengaruh nyata terhadap parameter jumlah akar dan jumlah daun. Adapun interaksi antara NAA dan BAP berpengaruh nyata pada parameter panjang akar dan jumlah akar namun tidak berpengaruh nyata pada parameter tinggi tanaman dan jumlah daun.
Perlakuan
Persentase Eksplan Yang Hidup (%)
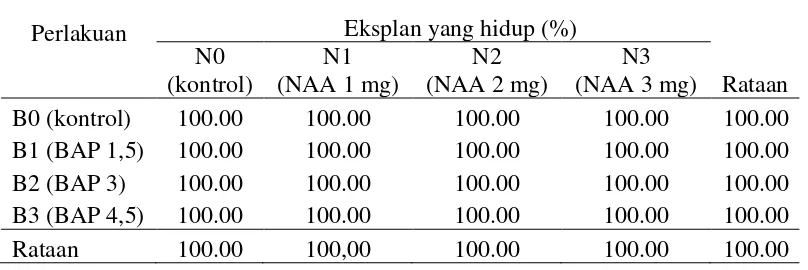
Dari data pengamatan persentase eksplan yang hidup (Lampiran 4) rataan persentase eksplan yang hidup dari perlakuan konsentrasi NAA dan BAP pada 4 dan 8 minggu setelah inokulasi menunjukkan 100 % hidup (tabel 1). Persentase eksplan yang hidup pada 8 minggu setelah inokulasi dapat dilihat pada Tabel 1. Tabel 1. Pengaruh konsentrasi NAA dan BAP terhadap persentase eksplan yang
Dari Tabel 1 di atas menunjukkan bahwa persentase eksplan yang hidup untuk semua perlakuan konsentrasi NAA dan BAP sebesar 100%.
Perlakuan
Persentase Eksplan Membentuk Tunas (%)
Dari pengamatan persentase eksplan membentuk tunas menunjukkan bahwa semua perlakuan konsentrasi NAA, BAP dan interaksi antara kedua perlakuan tidak terjadi pembentukan tunas.
Tinggi tanaman (cm)
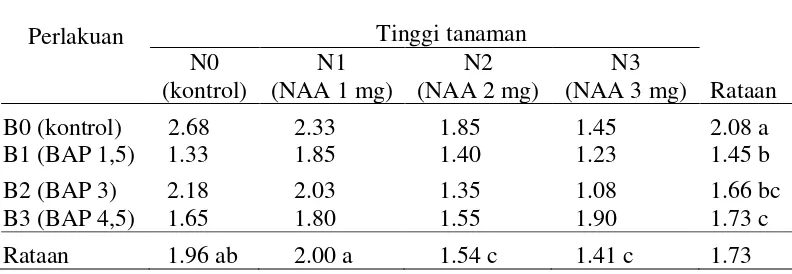
Hasil pengamatan tinggi tanaman pada akhir penelitian disajikan pada Lampiran 6 dan sidik ragamnya disajikan pada Lampiran 8 yang menunjukan bahwa pemberian perlakuan NAA berpengaruh nyata dan pemberian perlakuan BAP berpengaruh nyata serta interaksi kedua perlakuan tidak berpengaruh nyata pada parameter tinggi tanaman.
Rataan tinggi tanaman pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 2. Keterangan: angka-angka yang diikuti huruf yang tidak sama pada kolom atau baris yang sama
menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 %
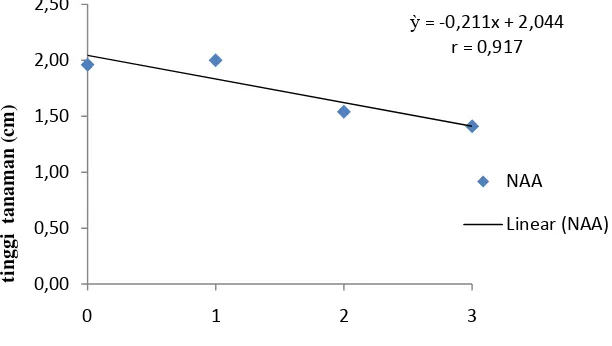
berpengaruh nyata pada perlakuan yang lainnya dan paling rendah pada N3 yaitu sebesar 1.41 cm. Tinggi tanaman tertinggi pada perlakuan BAP pada perlakuan B0 yaitu sebesar 2.08 cm berbeda nyata dengan perlakuan yang lain dan paling rendah pada perlakuan B1 yaitu sebesar 1.45 cm. Sedangkan kombinasi kedua perlakuan, tinggi tanaman tertinggi pada perlakuan N0BO yaitu sebesar 2.68 cm sedangkan paling rendah pada perlakuan N3B2 yaitu sebesar 1.08 cm. Pengaruh perlakuan NAA terhadap tinggi tanaman dapat dilihat pada Gambar 2.
Gambar 2. Hubungan konsentrasi NAA terhadap tinggi tanaman Jumlah Akar (buah)
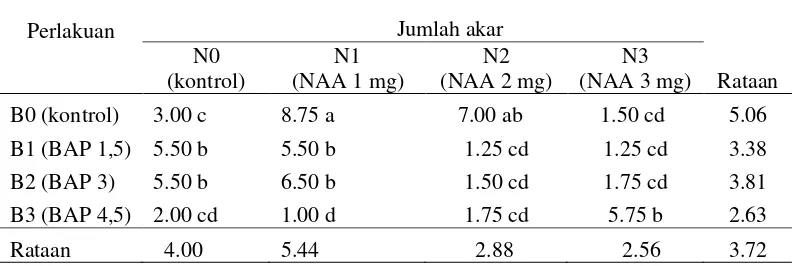
Hasil pengamatan jumlah akar pada akhir penelitian disajikan pada Lampiran 9 dan sidik ragamnya disajikan pada lampiran 11 yang menunjukan bahwa pemberian perlakuan NAA berpengaruh tidak nyata dan pemberian perlakuan BAP tidak berpengaruh nyata namun interaksi kedua perlakuan berpengaruh nyata pada parameter jumlah akar.
Tabel 3. Pengaruh konsentrasi NAA dan BAP terhadap jumlah akar (buah)
Keterangan: angka-angka yang diikuti huruf yang tidak sama pada kolom atau baris yang sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 %
Untuk perlakuan NAA, jumlah akar tertinggi terdapat pada perlakuan N1 yaitu sebesar 5.44 cm dan paling rendah pada perlakuan N3 yaitu sebesar 2.56 cm. Jumlah akar tertinggi pada perlakuan BAP pada perlakuan B0 yaitu sebesar 5.06 cm dan paling rendah pada perlakuan B3 yaitu sebesar 2.63 cm. Sedangkan kombinasi kedua perlakuan, jumlah akar tertinggi pada perlakuan N1BO yaitu sebesar 8.75 cm yang berbeda nyata dengan semua kombinasi sedangkan paling rendah pada perlakuan N1B3 yaitu sebesar 1.00 cm.
Panjang Akar (cm)
Hasil pengamatan panjang akar pada akhir penelitian disajikan pada Lampiran 12 dan sidik ragamnya disajikan pada lampiran 14 yang menunjukan bahwa pemberian perlakuan NAA dan pemberian perlakuan BAP serta interaksi kedua perlakuan berpengaruh nyata pada parameter panjang akar.
Tabel 4. Pengaruh konsentrasi NAA dan BAP terhadap panjang akar (cm) Keterangan: angka-angka yang diikuti huruf yang tidak sama pada kolom atau baris
menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 %
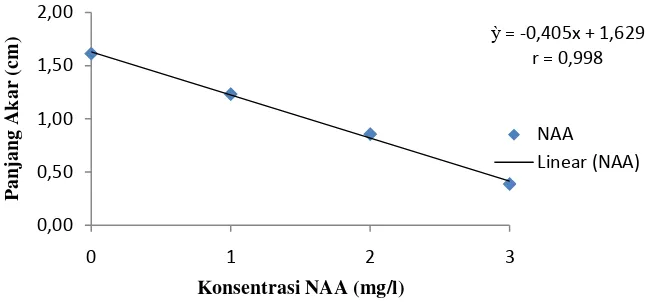
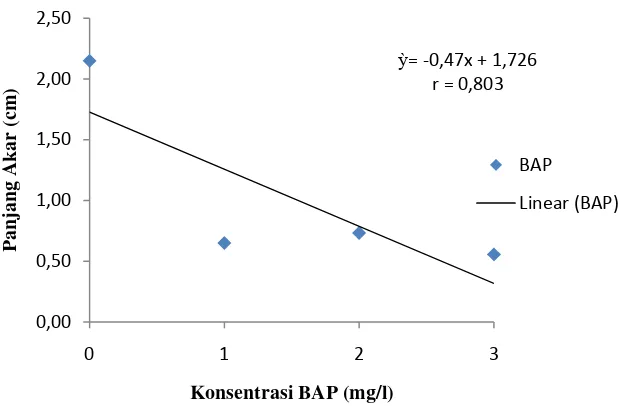
Untuk perlakuan NAA, panjang akar tertinggi terdapat pada perlakuan N0 yaitu sebesar 1.61 cm dan paling rendah pada perlakuan N3 yaitu sebesar 0.39 cm. Panjang akar tertinggi pada perlakuan BAP pada perlakuan B0 yaitu sebesar 2.15 cm dan paling rendah pada perlakuan B3 yaitu sebesar 0.56 cm Sedangkan kombinasi kedua perlakuan, panjang akar tertinggi pada perlakuan N0BO yaitu
sebesar 4.25 cm yang berbeda nyata pada semua kombinasi sedangkan paling rendah pada perlakuan N3B0 yaitu sebesar 0.30 cm berbeda nyata dengan N0B0, N1B1 tetapi tidak berbeda nyata pada kombinasi yang lainnya. Pengaruh
perlakuan NAA dan BAP terhadap panjang akar dapat dilihat pada gambar 3 dan 4.
Gambar 3. Hubungan konsentrasi NAA terhadap panjang akar
Gambar 4. Hubungan konsentrasi BAP terhadap panjang akar Jumlah daun (helai)
Hasil pengamatan jumlah daun pada akhir penelitian disajikan pada Lampiran 15 dan sidik ragamnya disajikan pada lampiran 17 yang menunjukan bahwa pemberian perlakuan NAA dan pemberian perlakuan BAP serta interaksi kedua perlakuan tidak berpengaruh nyata pada parameter jumlah daun.
Rataan jumlah daun pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 5.
Tabel 5. Pengaruh konsentrasi NAA dan BAP terhadap jumlah daun (helai)
Untuk perlakuan NAA, jumlah daun tertinggi terdapat pada perlakuan N0 yaitu sebesar 2.56 cm dan paling rendah pada perlakuan N2 dan N3 yaitu sebesar 2.00 cm. Jumlah daun tertinggi pada perlakuan BAP pada perlakuan B2 yaitu sebesar 2.69 cm dan paling rendah pada perlakuan B1 yaitu sebesar 1.36 cm. Sedangkan kombinasi kedua perlakuan, panjang akar tertinggi pada perlakuan N0B2 yaitu sebesar 3.50 cm sedangkan paling rendah pada perlakuan N2B1 dan N3B1 yaitu sebesar 1.25 cm.
Pembahasan
Pengaruh NAA terhadap perbanyakan tunas Boesenbergia flava
Dari hasil analisis data diketahui bahwa pemberian NAA tidak berpengaruh nyata terhadap jumlah akar dan jumlah daun. Hal ini diduga karena kebutuhan auksin eksogen tidak diperlukan karena kebutuhan hormon sudah tercukupi dari eksplan tersebut yang merupakan tunas yang sedang berkembang. Tunas yang sedang berkembang itu dapat memproduksi auksin yang cukup untuk memacu pertumbuhan. Hal ini sesuai dengan literatur Evans, dkk (1986) yang dikutip oleh Dobardini, dkk (2006) yang menyatakan bahwa tunas yang sedang berkembang dapat memproduksi auksin dalam jumlah yang cukup untuk perakaran
maka penambahan auksin eksogen tidak diperlukan. Jadi tanpa pemberian NAA pun,
eksplan dapat menginisiasi pertumbuhan akar.
Hasil pengamatan terhadap persentase eksplan membentuk tunas menyatakan bahwa penambahan NAA dan BAP ke dalam media ternyata belum dapat menyokong eksplan untuk membentuk tunas. Hal ini diduga karena
diperlukan waktu yang lebih lama lagi untuk proses pembentukan tunas. Wiendi et all (1991) menyatakan bahwa pada beberapa tanaman membutuhkan
waktu yang lama untuk beregenerasi. Kemungkinan sitokinin endogen tidak mencukupi untuk pembentukan tunas berarti selain auksin zat pengatur tumbuh sitokinin juga perlu ditambahkan ke dalam media. Sesuai pendapat Gunawan (1988) bahwa penambahan auksin dan sitokinin eksogen akan merubah level zat pengatur tumbuh endogen sel. Pembentukan tunas secara in vitro baik melalui multipikasi langsung dan tak langsung sangat tergantung pada jenis dan konsentrasi yang tepat dari senyawa organik, inorganik dan zat pengatur tumbuh.
sel, tetapi tidak terjadi perbanyakan atau multiplikasi tunas sehingga eksplan yang ditanam hanya terlihat bertambah tinggi. Selain itu, pada perlakuan ini juga terlihat adanya pembentukan akar. Hal ini mungkin disebabkan eksplan tunas samping yang ditanam pada media kultur menghasilkan auksin endogen dengan konsentrasi yang cukup tinggi sehingga pertumbuhan eksplan lebih diarahkan pada pemanjangan sel dan pembentukan akar. Menurut Widyastuti (2004) bahwa akar yang tumbuh pada media tanpa zat pengatur tumbuh kemungkinan diinduksi oleh auksin endogen.Rahardja (1989) dan Cleland (1995) yang dikutip dari Kurnianingsih (2009) menyebutkan bahwa dalam kultur jaringan auksin merupakan zat pengatur tumbuh yang dapat menyebabkan terjadinya pemanjangan sel pada jaringan tunas muda dan merangsang pembentukan akar. Jika konsentrasi auksin dalam media kultur tinggi maka akan menghambat pertumbuhan tunas.
Pengaruh BAP terhadap perbanyakan tunas Boesenbergia flava
telah mengalami perubahan yang stabil, yaitu terbentuk akar. Jika signal lingkungan maupun harmonal tidak ada lagi, perkembangan akar tetap terjadi. Pengaruh interaksi konsentrasi NAA dan BAP terhadap perbanyakan tunas
Boesenbergia flava
Dari hasil analisis data diketahui bahwa interaksi NAA dan BAP tidak berpengaruh nyata terhadap jumlah daun dan tinggi planlet. Hal ini diduga karena interaksi konsentrasi NAA dan BAP yang diberikan belum mampu mencapai taraf keseimbangan untuk pertumbuhan dan perkembangan tanaman. Wattimena, dkk (1992) menyatakan bahwa di dalam kultur jaringan pertumbuhan dari eksplan selalu tergantung dari interaksi antara auksin dan sitokinin.
1. Perlakuan NAA berpengaruh nyata terhadap tinggi tanamn dengan hasil yang terbaik pada konsentrasi 1 mg NAA.
KESIMPULAN
Kesimpulan
2. Interaksi NAA dan BAP berpengaruh nyata terhadap jumlah akar dengan hasil yang terbaik pada kombinasi N1B0
3. Interaksi antara NAA dan BAP belum menunjukan pengaruh yang nyata pada jumlah daun.
4. Perlakuan BAP menunjukkan pengaruh yang nyata untuk panjang akar, dengan hasil yang terbaik pada konsentrasi 0 mg/l (kontrol).
Saran
DAFTAR PUSTAKA
Aisyah, S. dan Dedi S. 2011. Teknik Sterilisasi Rimpang Jahe Sebagai Bahan Perbanyakan Tanaman Jahe Secara In Vitro. Buletin Teknik Pertanian Vol. 16. No 1. Halaman 34-36
Azriati Eva, Asmeliza, Nelfa Yurmita. 2005. Respon Regenerasi Eksplan Kalus Kedelai (Glycine max (L.) Merrill) Terhadap Pemberian NAA Secara in Vitro. Biologi FMIPA Universitas Negeri Padang, Padang.
Dwidjoseputro, D. 1981. Pengantar Fisiologi Tumbuhan. Penerbit PT Gramedia: Jakarta.
Evan, D. A.,W. R. Sharp, D. V. Ammirato. 1986. Handbook of Plant Cell Culture:
Techniques and Application Vol I. Macmitlan Publishing Company. New York.
Gunawan, L.W. 1995. Teknik Kultur Jaringan In Vitro dalam Hortikultura. Penebar Swadaya: Jakarta.
Hartmann, H.T., D.E. Kester, F.T. Davies and R.L. Geneve. 2002. Plant Propagation Principles and Practiese, 6th Ed. New Delhi: Prentice Hall of Insia Private Limited.
Hendaryono, D.P.S. dan A. Wijayani. 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan secara vegetatip. Jogjakarta: Kanisius.
Hughes, K. W., 1982. Ornamental Spesies in Cloning agricultur plant invitro technigues. Conger B.V.CRC Boca Raton, flodia.
Kristina. N. N, Rita N, Siti F. S dan Molide Rizal. 2002. Peluang Peningkatan Kadar Kurkumin Pada Tanaman Kunyit Dan Temulawak. Balai Penelitian Tanaman Obat dan Aromatik. Hlm 1-13.
Kurnianingsih. R, Marfuah, Ikhsan Matondang. 2009. Pengaruh Pemberian BAP (6-Benzyl Amino Purine) Pada Media Multiplikasi Tunas Anthurium hookerii Kunth. Enum. Secara In Vitro. Vis Vitalis, Vol. 02 No. 2.
Marlin. 2005. Regenerasi In Vitro Planlet Jahe Bebas Penyakit Layu Bakteri Pada Beberapa Taraf Konsentrasi 6-Benzil Amino Purine (BAP) Dan 1-Naphtalene Acetic Acid (NAA). Jurnal Ilmu-Ilmu Pertanian Indonesia. Volume 7, No 1. Hlm 8-14.
Pierik, R. I. M., 1987. In Vitro Culture of Higer Plans. Martinus Nijhoff Publishers Dordrecht, The Netherland.
Rini, P.E. 2009. Pasokan dan Permintaan Tanaman Obat Indonesia Serta Arah Penelitian dan Pengembangannya. Balai Penelitian Tanaman Obat dan Aromatik Indonesian Medicinal and Aromatic Crops Research Institute Jalan Tentara Pelajar No. 3, Bogor. Hlm 52-64
Salisbury, F.B. dan Ross, W.C., 1995. Fisiologi Tumbuhan Jilit Tiga. Penerjemah. Lukman, D. R. Dan Sumaryono. Penerbit ITB: Bandung.
Sastra. D. R., 2005. Multipikasi In Vitro Tanaman Jahe (Zingiber officinale Rosc var. amarun) Pada Berbagai Level Sukrosa Pusat Pengkajian dan Penerapan Teknologi Budidaya Pertanian, Badan Pengkajian dan Penerapan Teknologi Volume X No.1 Jurnal Agrotropika X(1): 9 – 14.
Sirirugsa, P. 1992.A Revision Of The Genus Boesenbergia Kunt (Zingiberaceae) In Thailand. nat. Hist. bull. siam soc. 40: 67-90.
Steel, R.G.D dan J.H. Torrie. 1995. Prinsip dan Prosedur Statistik. Gramedia, Pustaka Utama, Jakarta.
Sutarto. I. Nana. S. Yuliasti., 2003. Penggunaan Media Alternatif Pada Kultur In Vitro Jahe (Zingiber officinale Rosc.) Varietas Gajah. Bul. Agron. (31) (1) 1-7.
Sobardini, D.,E. Suminar dan Mugayanti., 2006. Perbanyakan Cepat Tanaman Nilam (Pogostemon cablin Benth.) Secara Kultur Jaringan. Universitas Padjadjaran.
The Gardens' Bulletin Singapore 13:
Wattimena, G.A., L.W. Gunawan, N.A. Mattjik, E. Syamsudin, N.M.A. Wiendi, A. Ernawati. 1992. Bioteknologi Tanaman. Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas Bioteknologi IPB – Lembaga Sumberdaya Informasi IPB. Bogor.
Wiendi NMA, GA Wattimena, LW Gunawan. 1991. Bioteknologi Tanaman. Bogor: Pusat Antar Universitas (PAU) Bioteknologi. IPB.
Wilkins, M.B., 1992. Fisiologi Tanaman. Penerjemah Sutedjo M.M dan Kartasapoetra A.G. penerbit Bumi Aksara: Jakarta.
Yunira, T. Dini, R. Doppy, H. Asri, F. 2008. Zingiberaceae Primadona Baru Tanaman Hias. IPB. Bogor. 38 hlm.
Yusnita, 2003. Kultur Jaringan. Cara Memperbanyak Tanaman Secara Efisien. Agromedia Pustaka: Jakarta. 105 hlm.
Yuwono, T. 2008. Bioteknologi Pertanian. Gadjah Mada University Press: Yogyakarta. 277 hlm.
2012.