(Skripsi)
Oleh
Junaidi Permana
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
ISOLATION AND CHARACTERIZATION OF ANTHOCYANINS FROM ADAM HAWA (Rhoeo discolor L. Her) LEAVES
By
Junaidi Permana
Anthocyanins has been isolated from adam hawa (Rhoeo discolor L. Her) leaves, using maceration method with water : HCl (100: 0.1 v/v) as a solvent. Extract was concentrated using freeze drying method, and it was separated on Sephadex LH-20 coloumn. Fraction 2-5 from elution showed one spot on TLC chromatogram using silica GF245 as adsorbent, and buthanol: acetic acid: water (4: 1: 5 v/v) as eluent at Rf 0.42. This fraction was analized with UV-Vis and it was found that the spot has maximum wavelength at 535.0 nm, and it predicted as cyanidin-3-galactose or peonidin-3-glucose. The compound was found to exhibit 80.23891% antioxidant activity based on DPPH (2,2-diphenyl-1-picrylhydrazil) method. Key Words : Anthocyanins, Rhoeo discolor L. Her, Sephadex LH-20, Antioxidant,
Oleh
Junaidi Permana
Antosianin telah diisolasi dari daun adam hawa (Rhoeo discolor L. Her), menggunakan metode maserasi dengan pelarut akuades : HCl (100: 0,1 v/v). Ekstrak dipekatkan dengan menggunakan metode freeze drying, kemudian dilakukan pemisahan menggunakan metode kromatografi kolom sefadeks LH-20. Hasil elusi pada fraksi 2-5 menunjukkan adanya 1 noda pada kromatogram KLT dengan menggunakan adsorben silika GF245, eluen butanol: asam asetat: air (4: 1: 5 v/v) pada Rf 0,42. Fraksi tersebut kemudian dianalisis menggunakan spektrofotometri UV-Vis, diperoleh panjang gelombang maksimal pada 534.0 nm, dan diperkirakan sebagai sianidin-3-galaktosa atau peonidin-3-glukosa. Fraksi antosianin hasil isolasi juga memiliki aktivitas antioksidan sebesar 80,23891% berdasarkan metode DPPH (2,2-difenil-1-pikrilhidrazil).
ISOLASI DAN KARAKTERISASI SENYAWA ANTOSIANIN DARI DAUN ADAM HAWA (Rhoeo discolor L. Her)
Oleh
Junaidi Permana
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika Dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Penulis bernama lengkap Junaidi Permana, lahir di
Fajarbulan pada tanggal 25 Juni 1993 merupakan anak
pertama dari tiga bersaudara. Penulis lahir dari pasangan
suami istri Bapak Jejen dan Ibu Eka Sari Permana. Penulis
sekarang bertempat tinggal di Jl. Lintas Liwa RT 02 RW 02
Kelurahan Fajarbulan, Lampung Barat.
Penulis menyelesaikan pendidikan mulai dari SD Negeri 4 Fajarbulan Lampung
Barat lulus pada tahun 2005, SMP Negeri 1 way Tenong Lampung Barat lulus
pada tahun 2008, SMA Negeri 1 Way Tenong Lampung Barat lulus tahun 2011
dan mulai tahun 2011 sampai penulisan skripsi ini, penulis melanjutkan ke
pendidikan tinggi di Jurusan S1 Kimia FMIPA Universitas Lampung melalui
jalur undangan SNMPTN 2011.
Selain belajar di bangku kuliah, penulis juga aktif berorganisasi. Organisasi yang
pernah penulis ikuti adalah Himpunan Mahasiswa Kimia (Himaki) FMIPA
Universitas Lampung sebagai Kader Muda Himaki tahun 2011 – 2012, anggota
Bidang Sosial dan Masyarakat tahun 2012 – 2013, dan Ketua Bidang Sosial dan
Hanya ikan mati yang mengikuti arus air, jadilah ikan hidup yang hidup untuk melawan arus air (Anonim)
Lebih mudah terlihat bodoh daripada terlihat pintar ( Junaidi Permana)
Waktu itu bagaikan sebilah pedang, kalau engkau tidak memanfaatkannya, maka ia akan memotongmu (Ali bin Abu
Kupersembahkan karya ini sebagai wujud bakti dan tanggung jawab kepada :
Kedua orang tuaku,
Bapak Jejen dan Ibu Eka Sari Permana yang telah memberikan cinta kasih, dukungan, dan doa untukku.
Adik – adikku
Nurdiansyah Permana dan Sofian Adi Permana.
Pembimbing Penelitianku, Ibu Prof. Dr. Tati Suhartati, M.S.
Orang terkasih, Sahabat, Kerabat, dan Teman.
SANWACANA
Puji syukur penulis haturkan kepada Allah SWT atas segala rahmat, karunia dan
kasih sayang-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini.
Sholawat serta salam kepada Nabi Muhammad SAW, keluarga, sahabat, dan
seluruh umatnya yang selalu taat mengamalkan ajaran dan sunnahnya.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar Sarjana
Sains pada Jurusan Kimia FMIPA Unila. Pada kesempatan ini, penulis
mengucapkan terima kasih kepada:
1. Kedua orang tua dan tiga adik penulis yang selalu memberi cinta kasih,
motivasi, dukungan, dan doa untuk penulis.
2. Ibu Prof. Dr. Tati Suhartati, M.S. selaku pembimbing pertama penelitian
atas segala bimbingan, motivasi, bantuan, nasihat, dan saran hingga
penulis dapat menyelesaikan penulisan skripsi ini.
3. Ibu Dra. Husniati, M.Si. selaku pembimbing Kedua penelitian atas
bimbingan, bantuan, nasihat, dan saran hingga penulis dapat
menyelesaikan penulisan skripsi ini
4. Ibu Dr. Noviany, M.Si. selaku Pembahas atas segala saran dan kritik yang
sangat membangun dalam penulisan skripsi ini
5. Ibu Prof. Dr. Tati Suhartati, M.S. selaku pembimbing akademik atas saran
dana yang telah diberikan dan kerjasama litbang untuk melaksanakan
penelitian ini.
9. Endah Pratiwi, terima kasih atas segala doa, dukungan, motivasi, saran,
kritik, nasihat, dan bantuannya hingga penulis dapat menyelesaikan skripsi
ini.
10.Partner penelitian penulis; Mirfat Salim Abdat dan Rio Febriansyah yang
selalu membantu, menasehati dan memberikan motivasi kepada penulis.
11.Rekan-rekan di Laboratorium Kimia Organik Jurusan Kimia FMIPA
Unila; Mba Resca, Kak Awan, Mba Teta, Mbak Mardiyah, Mbak Neneng,
Kak Heri, Kak Fajri, Mba Cintia, Yulia, Ridho, Lili, Andri, Ismi, Susi,
Ajeng, Dona, Yepi, Tiara, Arif, Tazkiya, dan Ningrum atas semangat,
saran, dan bantuan yang diberikan.
12.Sahabat Clan COC Meong Gede: Yusri , Nico, MJ, Datuk, Kak Dani,
Takim, Acul, Yudha, Revi, Anggi, dan Arik yang telah membantu,
mendukung, dan memberi saran atas segala keluh kesah penulis.
13.Pimpinan Himaki FMIPA Unila periode kepengurusan 2013 -2014 atas
segala dukungan dan doa kepada penulis.
15.Teman – teman angkatan 2011; Asti, Nopi, Dewi, Tamara, Rina, Rio W,
Yunia, Irkham, Mely A, Melly N, Nico, Daniar, Fani, Mila, Anggino, Ayu
F, Lewi, Ari, Cindy, Nira, Mega, Mardian, Ajeng, April, Aziz, Ay-Ay,
Ghani, Ana, Windi, Jj, Uswah, Vevi, Umi, Tatak, Lusi, Yusri, Eva, Fatma,
Yudha, Ramos, dan Ivan.
16.Himaki FMIPA Unila yang telah memberikan pengalaman yang luar biasa
kepada penulis.
17.Kakak dan adik tingkat penulis kimia angkatan 2002, 2004, 2005, 2006,
2007, 2008, 2009, 2010, 2012, 2013, dan 2014.
Atas segala kebaikan yang telah diberikan, semoga Allah SWT membalasnya
dengan pahala yang berlipat ganda, Aamiin. Penulis menyadari bahwa skripsi ini
masih terdapat kekurangan, namun penulis berharap skripsi ini dapat bermanfaat
dan berguna bagi rekan – rekan khususnya mahasiswa kimia dan pembaca pada
umumnya.
Bandar lampung, November 2015
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 3
II. TINJAUAN PUSTAKA A. Favonoid ... 4
B. Antosianin ... 6
C. Isolasi Antosinin ... 8
D. Kromatografi ... 9
1. Kromatografi kolom ... 10
2. Kromatografi lapis tipis ... 11
3. Sefadeks LH-20 ... 12
E. Analisis Menggunakan Spektrofotometri ... 13
1. Spektrofotometri UV-Vis ... 15
F. Uji Aktivitas Antioksidan ... 16
ii
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian ... 21
B. Alat dan Bahan ... 21
1. Alat – alat yang digunakan ... 21
2. Bahan – bahan yang digunakan ... 21
C. Prosedur Penelitian ... 22
1. Persiapan sampel ... 22
2. Ekstraksi dengan berbagai pelarut ... 22
3. Kromatografi kolom (KK) ... 23
4. Kromatografi lapis tipis (KLT) ... 23
5. Spektofotometri UV-Vis ... 24
6. Uji antioksidan ... 24
IV. HASIL DAN PEMBAHASAN A. Persiapan Sampel ... 26
B. Kromatografi Kolom ... 28
C. Kromatografi Lapis Tipis (KLT) ... 29
D. Analisis Menggunakan Spektrofotometri UV-Vis ... 31
E. Uji Aktivitas Antioksidan ... 32
V. SIMPULAN DAN SARAN A. Kesimpulan ... 35
B. Saran ... 36
DAFTAR PUSTAKA ... 37
LAMPIRAN ... 40
1. Perhitungan Uji Kuantitatif Aktivitas Antioksidan Antosianin Daun Adam Hawa ... 41
2. Diagram Kerja ... 42
DAFTAR TABEL
Tabel Halaman
1. Kandungan Antosianin dalam Berbagai Tumbuhan dan Buah-Buahan ... 7
2. Klasifikasi Kromatografi dan Tipe Pemisahannya ... 11
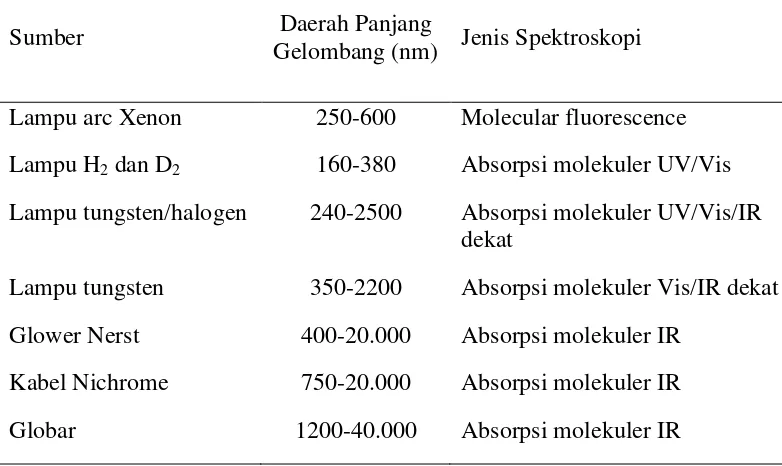
3. Sumber Radiasi Gelombang Elektromagnetik untuk Spektroskopi Optik .... 15
4. Panjang Gelombang Maksimum Beberapa Senyawa Organik ... 17
5. Taksonomi Tumbuhan Adam Hawa ... 26
i
DAFTAR GAMBAR
Gambar Halaman
1. Struktur Umum Flavonoid, Isoflavonoid, dan Neoflavonoid ... 4
2. Mekanisme Sintesis Flavonoid dengan Melibatkan Calkon dan Dehidrocalkon Sebagai Senyawa Antara ... 5
3. Struktur Umum Antosianin dan Turunannya ... 6
4. Kesetimbangan Antosianin Pada Berbagai Kondisi pH ... 9
5. Struktur Sefadeks LH-20 ... 13
6. Jenis Radiasi Elektromagnetik dan Panjang Gelombangnya ... 14
7. Tanaman Adam Hawa ... 19
8. Ekstrak Daun Adam Hawa ... 28
9. Kromatografi Kolom Saat Pemisahan Senyawa Pada Ekstrak Daun Adam Hawa ... 29
10.Kromatogram KLT Fraksi Hasil Kromatografi Kolom ... 30
11.Perbandingan Kromatogram KLT Antara Ekstrak Kasar (K) dan Ekstrak Antosianin Daun Adam Hawa (M) ... 30
12.Spektogram UV-Vis Senyawa Antosianin Daun Adam Hawa; atas, pelarut 0,1% HCl dalam Etanol; bawah, pelarut 0,1% HCl dalam Metanol ... 32
13.Struktur Antosianin dalam Daun Adam Hawa ... 32
I. PENDAHULUAN
A. Latar Belakang
Antosianin merupakan salah satu senyawa hasil metabolisme sekunder yang
paling melimpah sebagai pigmen warna pada tumbuhan (Grotewold, 2006).
Senyawa ini termasuk dalam jenis senyawa flavonoid dan merupakan salah satu
senyawa flavonoid yang berwarna. Senyawa antosianin biasanya akan mengikat
beberapa molekul gula seperti glukosa, fruktosa, galaktosa, arabinosa, dan jenis
gula lainnya, baik disakarida ataupun polisakarida (Markakis, 1982).
Antosianin banyak dimanfaatkan sebagai senyawa antioksidan (Braunlich dkk.,
2013), antiangiogenik, antikarsinogenik (Bagchi dkk., 2004), antikanker,
antialzhemeir (Andersen dan Markham, 2006), dan dapat pula digunakan sebagai
indikator pH (Padmaningrum, 2011). Antosianin sering juga digunakan sebagai
senyawa penambah nilai gizi pada makanan (Andersen dan Markham, 2006).
Selain bermanfaat bagi manusia, antosinin juga bermanfaat bagi
tumbuh-tumbuhan itu sendiri. Senyawa antosianin memberikan pigmen pada beberapa
bagian tumbuhan, mulai dari warna merah, ungu, dan kuning (Markakis, 1982).
Dengan adanya pigmen warna tersebut, beberapa tumbuhan dapat menarik
serangga atau hewan kecil lainnya dalam membantu proses penyerbukan
2
Senyawa antosianin dapat terkandung dalam tanaman yang berwarna merah,
ungu, dan biru (Andrawulan dan Farailla, 2012). Senyawa ini terkandung dalam
berbagai jenis berry seperti blueberry, raspberry, strawberry, cranberry,
blackberry,black currants, ceri dan buah-buahan lain seperti anggur, apel, kiwi,
serta terdapat pada beberapa sayuran seperti kol merah dan bawang merah
(Giusty dan Wrostald, 2011) dan terkandung dalam tanaman non pangan seperti
tumbuhan adam hawa (Rhoeo discolor) (Sitorus dkk., 2011).
Tanaman adam hawa merupakan tanaman hias yang sering kita jumpai di
berbagai taman maupun pekarangan. Tanaman ini kurang digunakan sebagai
bahan obat tradisional di Indonesia. Di negara lain seperti Meksiko, tanaman
adam hawa telah digunakan sebagai tanaman obat untuk mengobati berbagai
macam penyakit (Rosales-Reyes, 2007). Dengan adanya penelitian ini,
diharapkan agar adanya penggunaan dan pemanfaatan tanaman adam hawa lebih
lanjut dan tidak hanya digunakan sebagai tanaman hias saja.
Penelitian terdahulu memaparkan bahwa daun tanaman adam hawa memiliki
senyawa antosianin (Sitorus dkk., 2011), daun tanaman adam hawa dapat
digunakan sebagai sumber antioksidan yang cukup baik dan cukup melimpah di
Indonesia. Senyawa antosianin yang dihasilkan dari daun tanaman adam hawa
dapat digunakan pula sebagai penambah suplemen pada makanan atau menjadi
bahan makanan yang cukup menyehatkan.
Antosianin dalam tumbuhan memiliki karakter yang berbeda-beda untuk setiap
tumbuhan yang berbeda pula. Untuk daun tanaman adam hawa tidak ada
berbeda untuk tiap tumbuhan (Andersen dan Markham, 2006). Sehingga
dibutuhkan karakterisasi senyawa antosianin yang terkandung dalam daun
tanaman adam hawa untuk menentukan jenis antosianin yang terkandung
didalamnya.
Telah dilakukan penelitian isolasi senyawa antosianin dari daun tanaman adam
hawa (Rhoeo discolor L. Her) dengan metode maserasi mengunakan pelarut
akuades + 0,1 % HCl. Dilakukan pemisahan dengan mtode kromatografi kolom
menggunkan sefadeks LH-20, analisis menggunakan KLT dan spektrofotometri
UV-Vis, serta diuji sifat antioksidannya menggunakan metode DPPH.
B. Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah:
1. Mengisolasi senyawa antosianin dari daun tanaman adam hawa (Rhoeo
discolor)
2. Menentukan jenis antosianin yang terdapat pada daun tanaman adam hawa
3. Menentukan persentase aktivitas antioksidan senyawa antosianin yang telah
diisolasi
C. Manfaat Penelitian
Manfaat dari penelitian ini diharapkan agar adanya senyawa antioksidan yang
dapat digunakan dari daun tumbuhan adam hawa sebagai pengganti antioksidan
4
II.TINJAUAN PUSTAKA
A. Flavonoid
Kata dari “flavonoid” merupakan kata yang merujuk pada senyawa bahan alam
yang mengandung dua cincin aromatik benzena yang dihubungkan oleh 3 atom
karbon, atau suatu fenilbenzopiran (C6-C3-C6). Bergantung pada posisi ikatan dari cincin aromatik benzena pada rantai penghubung tersebut, kelompok flavonoid
dibagi menjadi 3 kelas utama, flavonoid, isoflavonoid, dan neoflavonoid.
Perbedaan struktur kelas utama tersebut dapat dilihat pada Gambar 1.
Gambar 1. Struktur umum flavonoid, isoflavonoid, dan neoflavonoid (Grotewold, 2006).
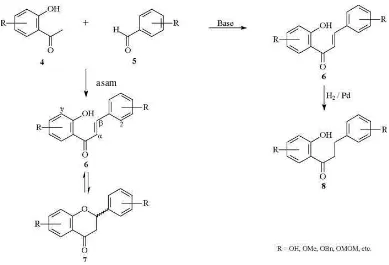
Flavonoid dapat disintesis melalui jalur fenol dengan melibatkan calkon dan
dihidrocalkon sebagai senyawa antaranya. Bahan awal yang direasikan dengan
adanya asam dapat membentuk senyawa flavonoid dengan melibatkan calkon
Gambar 2. Mekanisme sintesis Flavonoid dengan melibatkan calkon dan dehidrocalkon sebagai senyawa antara (Grotewold, 2006)
Flavonoid merupakan senyawa metabolit tumbuhan yang sangat melimpah di
alam. Fungsi senyawa flavonoid sangatlah penting bagi tanaman pada
pertumbuhan dan perkembangannya. Fungsi tersebut seperti penarik perhatian
hewan pada proses penyerbukan dan penyebaran benih, stimulan fiksasi nitrogen
pada bakteri Rhizobium, peningkat pertumbuhan tabung serbuk sari, serta
resorpsi nutrisi dan mineral dari proses penuaan daun.senyawa flavonoid juga
dipercaya memiliki kemampuan untuk pertahanan tanaman dari herbivora dan
penyebab penyakit, serta senyawa ini membentuk dasar untuk melakukan
interaksi alelopati antar tanaman (Andersen dan Markham, 2006). Selain itu,
6
senyawa flavonoid memiliki aktivitas antioksidan yang cukup tinggi (Zuhra dkk.,
2008).
B. Antosianin
Antosianin merupakan senyawa larut dalam air turunan flavonoid yang dhasilkan
dari metabolit sekunder tanaman. Senyawa ini bertanggung jawab untuk warna
biru, jingga, dan merah pada banyak jaringan tumbuhan, termasuk bunga, jenis
berry, dan pada sedikit bahan makanan umum seperti kubis merah, selada merah,
bawang putih, kentang berkulit merah dan ubi jalar ungu. Contoh tanaman yang
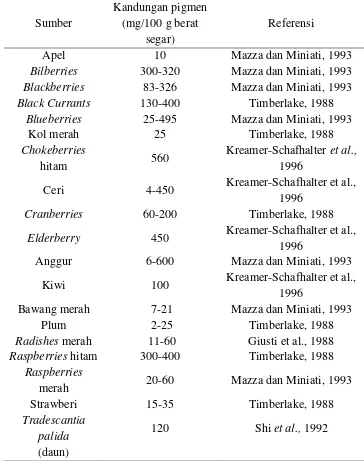
mengandung antosianin disajikan pada Tabel 1.
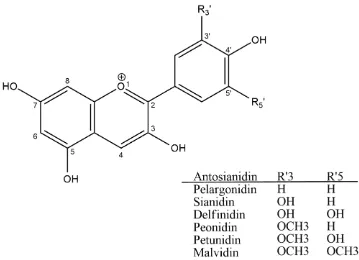
Antosianin merupakan turunan senyawa flavonoid yang bermuatan positif pada
atom oksigennya. Struktur umum antosianin dan turunannya disajikan pada
Gambar 3.
segar)
Apel 10 Mazza dan Miniati, 1993
Bilberries 300-320 Mazza dan Miniati, 1993
Blackberries 83-326 Mazza dan Miniati, 1993
Black Currants 130-400 Timberlake, 1988
Blueberries 25-495 Mazza dan Miniati, 1993
Kol merah 25 Timberlake, 1988
Chokeberries
hitam 560
Kreamer-Schafhalter et al., 1996
Ceri 4-450 Kreamer-Schafhalter et al., 1996
Cranberries 60-200 Timberlake, 1988
Elderberry 450 Kreamer-Schafhalter et al.,
1996
Anggur 6-600 Mazza dan Miniati, 1993
Kiwi 100 Kreamer-Schafhalter et al.,
1996
Bawang merah 7-21 Mazza dan Miniati, 1993
Plum 2-25 Timberlake, 1988
Radishes merah 11-60 Giusti et al., 1988
Raspberries hitam 300-400 Timberlake, 1988
Raspberries
merah 20-60 Mazza dan Miniati, 1993
Strawberi 15-35 Timberlake, 1988
Tradescantia
palida 120 Shi et al., 1992
(daun)
Di alam, biasanya senyawa antosianin akan membentuk ikatan glikosida pada
karbon 5 dan 5’ cincin A dan C. Glikosida tersebut dapat berupa monosakarida,
disakarida, serta polisakarida (Markakis, 1982). Antosianin dapat ditemukan
dalam plasma tubuh manusia sebagai bentuk utuh dari glukosida, rutinosida,
8
dan Markham, 2006). Senyawa antosianin memiliki potensial sebagai suplemen
nutrisi untuk manusia. Konsumsi senyawa antosianin yang terkandung dalam
buah-buahan, sayur-sayuran, anggur, selai dan manisan dapat mengurangi resiko
terkena penyakit yang berbahaya seperti kanker, penyakit jaringan pembuluh
darah, inhibisi virus, dan penyakit alzhemeir. Antosianin dan flavonoid lain
dibutuhkan karena kemampuannya sebagai antioksidan yang berpotensi dapat
menyebabkan pencegahan berbagai penyakit yang berhubungan dengan tekanan
oksidatif (Andersen dan Markham, 2006).
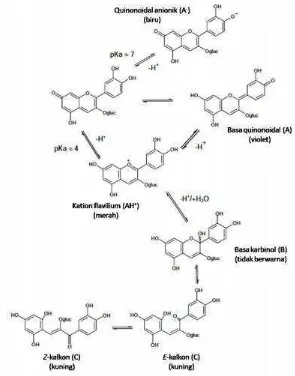
Antosianin akan membentuk keseimbangan bergantung pada pH (derajat
keasaman) dari senyawa tersebut. Pada keadaan sangat asam (pH 1-2) antosianin
akan dominan berbentuk kation flavilium, pada keadaan ini antosianin berada
pada kondisi paling stabil dan paling berwarna. Ketika tingkat keasaman menurun
(pH > 4), senyawa antosianin akan berwarna kuning (bentuk calkon), biru (bentuk
quinouid), atau tidak berwarna (basa karbinol). Kesetimbangan antosianin pada
berbagai pH disajikan pada Gambar 4. Oleh karena itu, senyawa antosianin
sebagai pigmen warna akan lebih stabil pada keadaan asam atau sangat asam (pH
rendah) (Andrawulan dkk., 2012).
C. Isolasi Antosinin
Antosianin dapat diambil dari tanaman maupun buah-buahan menggunakan teknik
maserasi dengan menggunakan pelarut yang bersifat polar . Antosianin dapat
diekstrak dengan menggunakan 0,01% HCl (v/v) dalam aseton berair 70%, 0,01
% HCl (v/v) dalam metanol (Rodriguez-Saona dan Wrostald, 2001), dan etanol
Gambar 4. Kesetimbangan antosianin pada berbagai kondisi pH (Andrawulan dkk., 2012).
D. Kromatografi
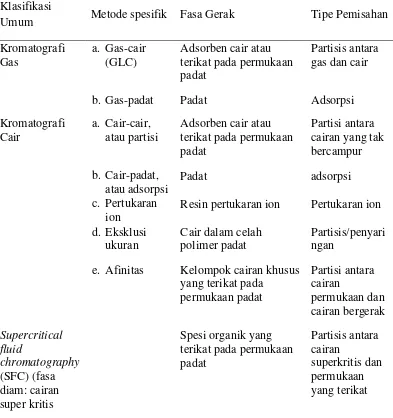
Kromatografi merupakan suatu metode pemisahan senyawa yang didasarkan atas
perbedaan laju perpindahan dari komponen dalam campuran. Pemisahan dengan
10
campuran tersebut, seperti kelarutan, sampel, adsorbs, dan kepolaran (Skoog,
dkk., 2014). Klasifikasi kromatografi berdasarkan fasa diam dan fasa geraknya
disajikan pada Tabel 2.
Antosianin dapat dimurnikan dengan metode kromatografi (Rodriguez-Sauna dan
Wrostald, 2001), secara kromatografi kolom menggunakan fasa gerak sefadeks
LH-20 (Lee, 2013), resin AB-8 berpori (Hua dkk., 2013), dan dapat juga
menggunakan HPLC preparatif dengan menggunakan kolom C18 (Syukri dkk., 2013).
1. Kromatografi Kolom
Kromatografi kolom merupakan jenis kromatografi padat cair berdasarkan
serapan yang dilakukan di dalam kolom (fasa diam), metode ini merupakan
metode yang paling banyak digunakan dan terbaik dalam pemisahan campuran
dalam jumlah besar. Campuran yang akan dipisahkan diletakan pada bagian atas
penyerap (fasa diam) yang berada dalam tabung kaca (kolom). Fasa gerak yang
merupakan campuran pelarut (eluen) dibiarkan mengalir melalui kolom yang
disebabkan oleh gaya gravitasi bumi. Senyawa yang terlarut akan bergerak
melalui kolom dengan laju berbeda, perbedaan laju dikarenakan adanya interaksi
antara senyawa terlarut, penyerap (fasa diam), dan pelarut (fasa gerak). Hasil
pemisahan kemudian dikumpulkan berupa fraksi-fraksi pada saat keluar dari
bawah kolom (Gritter dkk., 1991).
Dalam pemurnian antosianin yang diperoleh dari ekstrak kasar yang telah
dipekatkan dapat menggunakan fasa diam silika gel atau dengan menggunakan
Klasifikasi
Umum Metode spesifik Fasa Gerak Tipe Pemisahan
Kromatografi Gas
a. Gas-cair (GLC)
Adsorben cair atau terikat pada permukaan padat
Partisis antara gas dan cair
b. Gas-padat Padat Adsorpsi
Kromatografi Cair
a. Cair-cair, atau partisi
Adsorben cair atau terikat pada permukaan padat
Partisi antara cairan yang tak bercampur
b. Cair-padat, atau adsorpsi
Padat adsorpsi
c. Pertukaran ion
Resin pertukaran ion Pertukaran ion
d. Eksklusi ukuran
Cair dalam celah polimer padat
Partisis/penyari ngan
e. Afinitas Kelompok cairan khusus yang terikat pada
permukaan padat Partisi antara cairan permukaan dan cairan bergerak Supercritical fluid chromatography (SFC) (fasa diam: cairan super kritis
Spesi organik yang terikat pada permukaan padat Partisis antara cairan superkritis dan permukaan yang terikat
2. Kromatografi Lapis Tipis
kromatografi lapis tipis merupakan jenis kromatografi padat cair yang
menggunakan bahan padat sebagai fasa diam dan pelarut sebagai fasa geraknya.
12
berupa pelat gelas, logam, atau lapisan yang cocok. Campuran yang akan
dipisahkan, yang berupa larutan, kemudian ditotolkan pada pelat KLT (fasa
diam). Kemudian pelat diletakan dalam bejana tertutup yang telah terisi larutan
eluen (fasa gerak). Pemisahan terjadi berdasarkan perbedaan laju alir dari
senyawa terhadap fasa diamnya. Selanjutnya, senyawa yang tidak berwarna harus
ditampakan dengan disinari UV atau disemprotkan larutan kromium sulfat (Stahl,
1985). Kromatografi lapis tipis merupakan cara analisis cepat dengan
penggunaan bahan yang relatif sedikit.
Untuk meneliti kandungan flavonoid dan turunannya dari suatu ekstrak, sudah
menjadi kebiasaan umum untuk menggunakan eluen beralkohol pada eluen
pertama kromatografi lapis tipis, misalnya butanol-asam asetat-air (Markham,
1988). Senyawa antosianin akan memisah dengan baik pada penggunakan
kromatografi lapis tipis bila digunakan eluen butanol-asam asetat-air/BAA
(4:1:5) (Sitorus dkk., 2011).
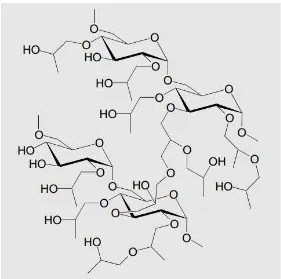
3. Sefadeks LH-20
Sefadeks LH-20 merupakan suatu resin yang biasa digunakan untuk memisahkan
zat-zat terlarut yang terkandung dalam suatu sistem pelarut. Pemisahan
menggunakan sefadeks LH-20 sama seperti pemisahan yang dilakukan pada
kromatografi kolom menggunakan fasa diam silika gel. Namun, sefadeks LH-20
memisahkan berdasarkan berat molekul zat-zat terlarut. Zat-zat dengan berat
molekul besar akan mengelusi (keluar) dari kolom terlebih dahulu. Ini
dikarenakan molekul-molekul kecil akan masuk dalam pori-pori sefadeks LH-20
Gambar 5. Struktur sefadeks LH-20 (Hagerman, 2002).
E. Analisis Menggunakan Spektrofotometri
Spektroskopi/ spektrofotometri merupakan suatu jenis analisis kualitatif dan
kuantitatif terbaru yang berdasarkan interaksi antara radiasi elektromagnetik dan
materi untuk mendapatkan informasi mengenai materi tersebut (Skoog, 2014).
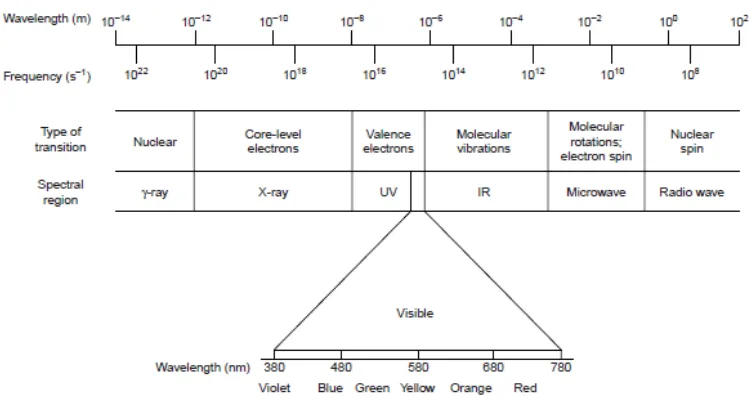
Radiasi elektromagnetik tersebut dapat berupa radiasi sinar γ, sianar-X ( X-ray),
UV-Vis (ultra ungu-tampak), infra merah (IR), gelombang mikro, dan gelombang
radio (Harvey, 2000). Pembagian jenis radiasi elektromagnetik berdasarkan
14
Gambar 6. Jenis radiasi elektromagnetik dan panjang gelombangnya (Harvey, 2000).
Gelombang elektromagnetik tersebut dapat digunakan untuk analisis, baik analisis
kualitatif dan kuantitatif. Dalam aplikasinya gelombang elektromagnetik dapat
dihasilkan dengan berbagai sumber radiasi, bergantung pada instrumenasi dan
jenis gelombang elektromagnetik yang akan digunakan. Sumber-sumber radiasi
gelombang elektromagnetik disajikan pada Tabel 3.
Untuk membedakan jenis antosianin yang diperoleh dari ekstrak daun adam hawa
dengan jenis antosianin yang lainnya haruslah dilakukan karakterisasi dengan
menggunakan metode spektroskopi. Metode yang biasa digunakan untuk
karakterisasi senyawa bahan alam adalah spektrofotometri UV-Vis untuk
mengetahui serapan maksimal senyawa antosianin yang diperoleh, spektrometri
IR untuk mengetahui gugus fungsi yang terdapat dalam senyawa antosianin,
spektrometri LC-MS untuk mengetahui fragmentasi senyawa antosianin dan
spektrometri NMR untuk mengetahui letak atom hidrogen dan atom karbon pada
Sumber
Gelombang (nm) Jenis Spektroskopi
Lampu arc Xenon 250-600 Molecular fluorescence
Lampu H2 dan D2 160-380 Absorpsi molekuler UV/Vis Lampu tungsten/halogen 240-2500 Absorpsi molekuler UV/Vis/IR
dekat
Lampu tungsten 350-2200 Absorpsi molekuler Vis/IR dekat
Glower Nerst 400-20.000 Absorpsi molekuler IR
Kabel Nichrome 750-20.000 Absorpsi molekuler IR
Globar 1200-40.000 Absorpsi molekuler IR
1. Spektrofotometri UV-Vis
Spektrofotometri UV-Vis merupakan instrumen analisis spektroskopi yang
menggunakan gelombang elektromagnetik pada panjang gelombang 190-400
(UV) dan 400-780 (Visible/ tampak). Analisis dengan metode ini didasarkan pada
absorpsi gelombang elektromagnetik yang menyebabkan terjadinya transisi
elektrtronik dari keadaan dasar menjadi keadaan yang tereksitasi. Transisi terkuat
adalah transisi dari σ→σ*
yang menyerap energi elektromagnetik dibawah
panjang gelombang 200 nm. Contoh dari transisi ini adalah transisi pada ikatan
C-C dan C-C-H, kedua ikatan ini memiliki elektron orbital σ. Senyawa yang tak jenuh
yang memiliki sepasang elektron bebas akan mengalami transisi elektron dari
n→σ*
yang akan menyerap energi pada panjang gelombang 150-250 nm. Pada
[image:31.595.109.500.142.375.2]16
π→π*
yang merupakan orbital pada ikatan senyawa tak jenuh (Gauglitz dan
Vo-Dinh, 2003).
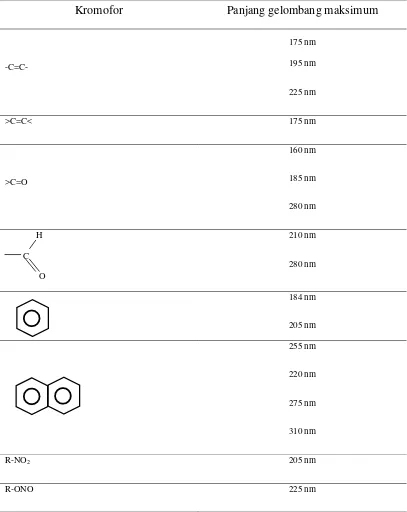
Panjang gelombang maksimum untuk setiap senyawa akan berbeda dengan
senyawa lainnya bergantung pada jenis transisi yang terjadi pada senyawa
tersebut. Semakin banyak ikatan rangkap yang terdapat pada zat tersebut, maka
panjang gelombang maksimum zat tersebut akan lebih besar (bergeser ke kanan).
Seperti benzena akan memiliki panjang gelombang maksimum yang lebih rendah
daripada suatu naftalena. Serapan maksimal beberapa senyawa organik disajikan
pada Tabel 4 (Gauglitz, dan Vo-Dinh, 2003).
Antosianin akan menyerap spektra UV-Vis pada panjang gelombang sekitar
500-560 nm untuk berbagai macam pelarut. Pelarut yang biasa digunakan dalam
analisis antosianin menggunakan UV-Vis adalah 0,1% HCl dalam etanol; 0,1%
HCl dalam metanol; larutan buffer pH 0,9; HCl 0,1 N; serta 0,1 N HCl/etanol
(15:85)(Giusty dan Wrostald, 2001).
F. Uji Aktivitas Antioksidan
Senyawa antioksidan memiliki kapasitas antioksidan yang berbeda-beda.
Kapasitas antioksidan dapat diukur dengan berbagai cara, salah satu yang paling
sering dihunakan adalah dengan metode DPPH (2,2-difenil-1-pikrilhidrazil).
DPPH merupakan senyawa yang dapat membentuk radikal dan elektron radikal
tersebut akan memberikan serapan maksimal pada panjang gelombang 517 nm
dan akan berwarna ungu. Setelah elektron radikal mengikat hidrogen dari suatu
antioksidan menjadi keadaan tereduksi DPPH-H, akan menyebabkan absortivitas
molar dari senyawa DPPH turun dari 9660 menjadi 1640 dan warna larutan akan
Tabel 4. Panjang gelombang maksimum beberapa senyawa organik (Gauglitz, dan Vo-Dinh, 2003).
Kromofor Panjang gelombang maksimum
-C=C-
175 nm
195 nm
225 nm
>C=C< 175 nm
>C=O
160 nm
185 nm
280 nm
H
C
O
210 nm
280 nm
184 nm
205 nm
255 nm
220 nm
275 nm
310 nm
R-NO2 205 nm
18
Persentasi dari aktivitas antioksidan dapat dilakukan dengan menyiapkan radikal
DPPH yang stabil dalam pelarut etanol. Kemudian 0,5 mL sampel, 3 mL etanol
absolut (> 99%), dan larutan radikal DPPH dalam etanol 0,5 mM dicampurkan.
Dengan bereaksinya radikal DPPH dan antioksidan akan menyebabkan perubahan
warna dari ungu menjadi kuning terang. Kemudian diuji absorbansinya pada
panjang gelombang 517 nm setelah larutan bereaksi selama 100 menit. Campuran
kedua antara 3,3 mL etanol absolut dan 0,5 mL sampel sebagai larutan blanko,
dan campuran ketiga antara 3,5 mL etanol absolut dan 0,3 mL larutan radikal
DPPH dalam etanol sebagai control. Persentase aktivitas antioksidan (AA%)
ditentukan dengan rumus:
(Garcia dkk., 2012).
G. Tanaman Adam Hawa
Tanaman adam hawa (Rhoeo discolor L. Her) atau tumbuhan Nanas Kerang
(Jawa) merupakan sejenis tumbuhan liar yang hidup di hutan atau di pekarangan
rumah. Tumbuhan ini memiliki daun tunggal yang berbentuk panjang melebar,
tepinya merata atau bergigi kasar yang tak teratur, rapuh, meruncing pada bagian
ujungnya, permukaan atas daun berwarna hijau dan merah pada permukaan
Kedudukan tumbuhan adam hawa pada taksonomi tumbuhan adalah sebagai
berikut :
Kingdom : Plantarum
Divisio : Spermatophyta
Kelas : Monocotyledoneae
Ordo : Rhizophorales
Famili : Rhizophoraceae
Genus : Rhoeo
[image:35.595.189.437.445.634.2]Spesies : Rhoeo discolor (Kadowangko dkk., 2011)
Gambar 7. Tanaman adam hawa
Ekstrak air dan alkohol dari daun tanaman adam hawa dapat digunakan sebagai
indikator pada titrasi asam basa. Perubahan warna yang terjadi pada senyawa
20
berubah warna dari coklat ke hijau atau merah ke hijau. Ekstrak air daun tanaman
adam hawa memiliki trayek pH (derajat keasaman) antara 7,0-8,6, sedangkan
ekstrak alkohol memiliki trayek pH antara 6,3-7,0. Indikator dari ekstrak daun
tumbuhan Adam Hawa memiliki ketepatan dan kecermatan yang cukup tinggi bila
digunakan pada proses titrasi asam cuka dengan natrium hidroksida
(Padmaningrum, 2011).
Daun tanaman adam hawa memiliki kandungan senyawa flavonoid jenis
antosianidin, yang ditunjukkan dengan hasil kromatogram KLT yang dihasilkan
memiliki nilai Rf (retention factor) 0,09 (merah jingga); 0,36 (merah jingga); 0,71
(merah muda); dan 0,64 (kuning). Noda yang berwarna merah pada kromatogram
KLT menunjukan adanya senyawa antosianin (Sitorus, 2011).
Ekstrak daun adam hawa memiliki berbagai manfaat bagi kesehatan manusia.
Tanaman ini telah digunakan oleh masyarakat Meksiko sebagai tanaman obat
untuk mengatasi berbagai penyakit (Rosales-Reyes dkk., 2007). Ekstrak etanol
daun adam hawa memiliki kemampuan sebagai antigenotoksik, antimutagenik,
dan memiliki aktivitas antioksidan yang mirip dengan α-tokoferol serta lebih
tinggi dari asam askorbat (Gonzalez-Avila, 2002). Sedangkan, ekstrak air dari
daun adam hawa memiliki kemampuan sebagai antikanker pada hati tikus
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari sampai dengan September 2015 di
Laboratorium Kimia Organik Jurusan Kimia FMIPA Universitas Lampung.
Analisis taksonomi tumbuhan dilakukan di Herbarium Bogorinse bidang Botani
Pusat Penelitian Biologi, Bogor. Analisis spektroskopi yang digunakan adalah
spektroskopi ultraungu-tampak (UV-Vis) dilakukan di Laboratorium Biokimia
Jurusan Kimia FMIPA Unila, pemekatan secara freeze drying Laboratorium
Terpadu dan Sentra Inovasi dan Teknologi (LT-SIT) Unila, Bandar Lampung.
B. Alat dan Bahan
1. Alat-Alat yang Digunakan
Alat yang digunakan pada penelitian ini adalah alat-alat gelas, penguap putar
vakum (Vacuum Rotary Evaporator) merek Heidholp, satu set alat Kromatografi
Kolom (KK), lampu UV, pipa kapiler, dan spektrofotometer ultraungu-tampak
(UV-VIS) merk Agilent Technologies.
2. Bahan-Bahan yang Digunakan
Bahan yang digunakan adalah daun tumbuhan Adam Hawa (Rhoeo discolor L.
Her) yang diperoleh dari sekitaran FMIPA yang telah diiris kecil. Pelarut yang
22
teknis yang telah didestilasi, sedangkan pelarut yang digunakan pada proses
analisis spektofotometri digunakan pelarut berkualitas Pro-Analisis (p.a). bahan
kimia yang digunakan meliputi metanol, asam klorida (HCl), butanol, akuades,
asam asetat, Sefadeks LH-20 yang digunakan pada kromatografi kolom serta
untuk KLT digunakan plat KLT silika gel Merck kiesegal 60 F254 0,25 mm.
C. Prosedur Penelitian
1. Persiapan Sampel
Daun tumbuhan Adam Hawa (Rhoeo discolor) diperoleh dari lingkungan kampus
FMIPA Universitas Lampung, Lampung. Selanjutnya, dilakukan determinasi
untuk menentukan Spesies di Herbarium Bogoriensis bidang Botani Pusat
Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Jawa
Barat.
Daun tumbuhan Adam Hawa yang telah dikumpulkan kemudian dicuci bersih
dengan menggunakan air keran, setelah itu ditiriskan, kemudian daun diiris kecil.
Sampel yang telah diiris kecil ini yang kemudian digunakan pada proses
penelitian.
2. Ekstraksi dengan Berbagai Pelarut
Daun tumbuhan Adam Hawa (Rhoeo discolor) yang telah didiamkan ditimbang
sebanyak 1000 g, kemudian direndam (maserasi) dengan menggunakan metanol:
HCl (100: 0,1 v/v), akuades: asam asetat (100: 0,1 v/v), akuades: HCl (100: 0,1
v/v), dan akuades: metanol: HCl (50: 50: 0,05 v/v) selama 48 jam. Ekstrak hasil
perendaman kemudian disaring dengan kertas saring. Filtrat yang didapat lalu
3. Kromatografi Kolom (KK)
Setelah dihasilkan fraksi-fraksi dengan jumlah yang lebih sedikit, tahapan
fraksinasi selanjutnya dilakukan menggunakan teknik kromatografi kolom.
Adsorben Sefadeks LH-20 dilarutkan dalam pelarut yang akan digunakan dalam
proses pengelusian. Sefadeks LH-20 dimasukkan ke dalam kolom, kemudian
didiamkan hingga fasa diam rapat (tidak berongga) dan rata. Selanjutnya
masukkan sampel langsung ke dalam kolom yang telah berisi fasa diam. Pada saat
sampel dimasukkan, usahakan agar kolom tidak kering/kehabisan pelarut karena
akan mengganggu fasa diam yang telah dikemas rapat, sehingga proses elusi tidak
akan terganggu. Fraksi-fraksi yang terbentuk kemudian diuji dengan
menggunakan Kromatografi Lapis Tipis (KLT), dan fraksi yang memiliki nilai Rf
sama dikumpulkan menjadi satu.
4. Kromatografi Lapis Tipis (KLT)
Uji KLT juga dilakukan terhadap fraksi-fraksi yang akan difraksinasi dan juga
fraksi-fraksi yang didapat setelah perlakuan fraksinasi. Uji KLT dilakukan
menggunakan sistem campuran eluen menggunakan pelarut n-butanol: asam
asetat: air (5: 1: 4). Ketika diperoleh fraksi yang lebih sedikit bercak/noda dilihat
dibawah lampu UV setelah dilakukan elusi terhadap plat KLT. Setiap fraksi yang
24
kromatogram, digabung dan dipekatkan sehingga diperoleh beberapa fraksi
gabungan yang akan difraksinasi lebih lanjut.
Cara pembuatan eluen BAA mula-mula butanol, asam asetat, dan air dicampurkan
dalam corong pisah dengan perbandingan 4: 1: 5. Kemudian larutan dalam corong
pisah dikocok selama 10 menit, selama pengocokan gas hasil pengocokan
dikeluarkan. Selanjutnya larutan dibiarkan memisah membentuk dua fasa. Fasa
bawah merupakan campuran air dan etil asetat, dan fasa atas merupakan campuran
butanol, asam asetat, dan air. Fasa atasa yang digunakan sebagai eluen pada
penelitian ini.
5. Spektofotometri UV-Vis
Ekstrak kasar hasil pemurnian diuji dengan spektrofotometri UV-Vis untuk
menentukan jenis antosianin yang terkandung dalam daun tanaman Adam Hawa.
Fraksi kromatografi kolom yang mengandung antosianin dilarutkan dengan 0,1%
HCl dalam metanol dan 0,1% HCl dalam etanol kemudian ditentukan panjang
gelombang maksimum dari ekstrak tersebut dan dibandingkan dengan data
spektrum UV-Vis senyawa antosianin (Giusty dan Wrostald, 2001).
6. Uji Antioksidan
Ekstrak hasil kromatografi kolom yang mengandung senyawa antosianin
kemudian dilakukan uji kualitatif dan kuantitatif kapasitas antioksidan dengan
menggunakan DPPH. Untuk uji kualitatif, eksrak yang mengandung senyawa
antosianin dilakukan KLT, kemudian setelah terjadi proses elusi, kromatogram
yang masih basah disemprotkan larutan 0,5 mM DPPH. Uji positif jika terbentuk
berubah menjadi berwarna kuning. Kemudian larutan sampel diuji absorbansi
UV-Vis pada panjang gelombang 517 nm. Campuran antara sampel dan etanol
digunakan sebagai blanko, sedangkan campuran antara etanol (3,5 mL) dan
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan pembahasan hasil penelitian yang telah dilakukan dapat diperoleh
kesimpulan sebagai berikut:
1. Antosianin yang terkandung dalam daun adam hawa telah diisolasi yang
berdasarkan spektrum UV-Vis.
2. Hasil pemisahan mengunakan kromatografi kolom sefadeks LH-20
menunjukan adanya satu spot berwarna merah pada fraksi 2-5 dengan Rf 0,42
yang berdasarkan KLT.
3. Diperkirakan antosianin yang terkandung dalam daun adam hawa
berdasarkan analisis spektrofotometri UV-Vis menggunakan pelarut 0,1 %
HCl dalam metanol yang memiliki panjang gelombang 534,0 nm adalah jenis
sianidin-3-galaktosa atau peonidin-3-glukosa.
4. Fraksi antosianin hasil isolasi memiliki aktivitas antioksidan sebesar
2. Menggunakan adsorben lain selain sefadeks LH-20 pada proses pemisahan
seperti adsorben C18.
3. Dilakukan pemurnian dengan metode spektrofotometri LC-MS menggunakan
sistem gradien yang sesuai.
4. Menggunakan metode baru utuk uji aktivitas antioksidan antosianin daun
adam hawa menggunkan metode lain selain DPPH dan Spektrofotometri
37
DAFTAR PUSTAKA
Andersen, Oyvind M., and Kenneth R. Markham.2006. Flavonoids: Chemistry,
Biochemistry, and Applications. CRC Press .Boca Raton, Florida, USA .
Pp. 328; 397-398; and 473.
Andrawulan, Nuri, dan R. H. F. Farailla. 2012. Pewarna Alami Untuk Pangan. SEAFAST Center IPB. Bogor, Indonesia. Hlm 23-27.
Bagchi, D., C. K. Sen, M. Bagchi, and M. Atalay. 2004. Anti-angiogenic, Antioxidant, amd Anti-carcinogenic Properties of a Novel Anthocyanin-Rich Berry Extract Formula. (Review). J. Biochem.LXIX (1). Pp.75-80.
Braunlich, M., R. Slimsestad, H.Wangensteen, C. Brede, K. E. Malterud, and H. Barsett. 2013. Extract, Anthocyanins and Procyanidins from Aronia melanocarpa as Radical Scavengers and Enzyme Inhibitors. Nutrients J. (5). Pp.663-678.
Einbond, L. S., K. A. Reynertson, X. D. Luo, M. J. Basile, and E. J. Kennelly. 2004. Anthocyanins Antioxsidants From Edible Fruits. J. Food Chemistry. (84). Pp. 23-28.
Garcia, E. Jose, T. L. C. Oldoni, S. M. de Alencar, A. Reis, A. D. Loguercio, and R. H. M. Grande. 2012. Antioxidant Activity by DPPH Assay of Potential Solution to be Appliaed on Bleached Teeth. Bra.. Dent J. XXII (1). Pp. 22-27.
Gauglitz, G., and T. Vo-Dinh. 2003. Handbook of Spectroscopy. Wiley-VCH. Weinheim, Jerman. Pp. 89;125;129; and 347.
Giusty, M. M., and R. E. Wrolstad. 2001. Characterization and Measurment of Anthocyanin by UV-Visible spectroscopy. J. Current Protocol in Food
Analytycal Chemistry. University of Maryland College Park. Maryland,
USA.
Gonzalez-Avila, M., M. Arriaga-Alba, M. de la Garza, M. del Carmen Hernandez Pretelin, M. A. Dominguez-Ortiz, S. Fattel-Fazenda, and S. Villa-Trevino. 2002. Antigenotoxic, Antimutagenic and ROS Scavenging Activities of A Rhoeo discolor Ethanolic Crude Extract. J. Tox in Vitro .(17). Pp. 77-83.
372; dan 402.
Hostettman, K., M. Hostettman, dan A. Manson. 1995. Cara kromatografi
Preparatif Penggunaan pada Senyawa Bahan Alam. Alih bahasa Kosasih
Padmawinata. Institut Teknologi Bandung. Bandung. Hlm. 27-34.
Hua, Z., D. Yuesheng, Xu Ge, L. Menglu, D. Liya, A. L. Jia, and X. Zhilong. 2013. Extraction and Purification of Anthocyanins from the Fruit Residues of Vaccinium uliginosum Linn. J. Chroma Sep, Tech. IV (2).
Kadowangko, N. Y., M. Solang, dan J. Ahmad. 2011. Kajian Etnobotani Tanman
Obat Oleh Masyarakat Kabupaten Bonebolango Provinsi Gorontalo.
(Laporan Penelitian). Universitas Negeri Gorontalo. Gorontalo.
Lee, Jungmin. 2013. Proanthocyanidin A2 Purification and Quantification of American Cranberry (Vaccinium macrocarpon Ait.) products. J. Func.
Food. V. Pp. 144-153.
Markakis, Pericles. 1982. Anthocyanins as Food Colors. Academic Press. New York, USA. Pp. 3-7
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid. Alih Bahasa Kosasih Padmawinata. Institut Teknologi Bandung. Bandung. Hlm. 117.
Padmaningrum, R. Tutik. 2011. Karakter Ekstrak Zat Warna Daun Rhoeo
discolor Sebagai Indikator Titrasi Asam Basa. (Skripsi). Universitas
Negeri Yogyakarta. Yogyakarta.
Prakash, Aruna, F. Rigelholf, and E. Miller. 2013. Antioxidaant Activity. Medallion Labs. Minnesota, USA.
Rodriguez-Saona., Luis E., dan R. E. Wrostald. 2001. Current Protocol:
Extraction, Isolaton, and Purification of Anthocyanins. J. Current
Protocol in Food Analytycal Chemistry. University of Maryland College
Park. Maryland, USA.
Rohmatussolihat. 2009. Antioksidan, Penyelamat Sel-Sel Tubuh Manusia. (Jurnal). Bio-Trends Vol. 4. Pusat Penelitian Bioteknologi-LIPI. Jakarta, Indonesia.
39
Sastrohamidjojo, H. 2002. Kromatografi. Liberty. Yogyakarta. Hlm 35-36.
Silverstein, B., dan Morcill. 1986. Penyelidikan Spektrometrik Senyawa Organik. ITS. Semarang. Hlm. 191-195.
Sitorus, R. M. H., Adeanne C. Wullur, dan P. V. Y.Yamlean. 2011. Isolasi dan Identifikasi Senyawa Flavonoid pada Daun Adam Hawa (Rhoe discolor). (Skripsi).FMIPA Universitas Sam Ratulangi. Makassar.
Skoog, D. A., D. M. West, F. J. Holler, and S. R. Crouch. 2014. Fundamentals of
Analitical Chemistry, Ninth Edition. Brooks/Cole, Cengage Learning.
Belmont, USA. Pp. 562; 655; 712; and 920.
Stahl, E. 1985. Analisis Obat Secara kromatografi dan Mikroskopi. Institut Teknologi Bandung. Bandung. Hlm. 3-17.
Sudjadi. 1983. Penentuan Struktur Senyawa Organik. Ghalia Indonesia. Jakarta. Hlm. 283.
Supiyanti, W., Endang D.W., dan Lia K. 2010. Uji Aktivitas Antioksidan dan Penentuan Kandungan Antosianin Total Kulit Buah Manggis (Garciana
mangostana L). Majalah Obat Tradisional. XV (2). 64-70
Syukri, D., Darwis D., dan Santoni A. 2013. Preparative HPLC for the
Purification of major Anthocyanins from Ficus padana burm. L. J. Chem. Sci. II (12). Pp. 60-64.
Walujo, E. B. 2011. Keanekaragaman Hayati Untuk Pangan. (Jurnal). Herbarium Bogorinse, Pusat Penelitian Lembaga Ilmu pengatahuan Indonesia.
Jakarta, Indonesia.
Zuhra, C. F., J. Br. Tarigan, dan H. Sihotang. 2008. Aktivitas Antioksidan
Senyawa Flavonoid Dari Daun Katuk (Sauropus androgunus (L) Merr.). J.
41
Lampiran 1. Perhitungan Uji Kuantitatif Aktivitas Antioksidan Antosianin Daun
Adam Hawa
Absorbansi sampel = 0,0976
Absorbansi blanko = 0,1929
Absorbansi kontrol = 0,4939
[ ]
[ ]
[ ]
Jika diasumsikan absorbansi blanko = 0
[ ]
[ ]
-dibersihkan dengan menggunakan air keran
-ditiriskan selama 1 malam dan dicincaang
-dipekatkan dengan menggunakan metode freeze drying
-dipisahkan dengan menggunakan kromatografi kolom sefadeks LH-20
-dilakukan KLT pada tiap fraksi
-fraksi yang memiliki Rf yang sama dikumpulkan
-dimaserasi dengan menggunakan pelarut akuades : HCl (100: 0,1 v/v)
Dilakukan uji spektroskopi
UV-Vis
Dilakukan uji KLT dengan eluen BAA (4:1:5)
Uji aktivitas antioksidan secara
kualitatif dan kuantitatif 1 Kg potongan daun
Ekstrak air (800 mL)
Ekstrak air pekat (50 mL)
43