INDUKSI PROLIFERASI TUNAS ADVENTIF KENAF
(Hibiscus cannabinus L.) SECARA IN VITRO MELALUI
PENAMBAHAN ZAT PENGATUR TUMBUH 2.4-D dan BAP
MUKHLIS WAHYUDI
A24060234
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Induction of Kenaf (Hibiscus cannabinus L.) Adventitious Shoots Proliferation In Vitro by 2.4-D and BAP Growth Hormones
Abstract
This research aimed to study the response of plant growth hormones 2.4-D and BAP to stimulate shoot proliferation initiation from three type of explants (meristem, meristem with cotyledon, and cotyledon) of kenaf. The research performed at Tissue Culture Research Laboratory, Agronomy and Horticulture Department, Agriculture Faculty, Bogor Agriculture University, from February to November 2010. Adventitious shoot formation on MS media supplemented with combinations of 2,4-D (0.0, 0.5, 1.0 mg/l) and BAP (0.0, 2.0, 4.0, 8.0, 10.0 mg/l). Callus began to appear in 2 weeks for all treatments on meristem and meristem with cotyledon. Results of this research showed that the medium composition without the 2.4-D + BAP had the highest number of adventitious shoots from meristem with cotyledon explants. Adventitious shoots formed after 11 weeks in culture without callus formation. The highest number of adventitious shoots resulted from the medium composition without 2.4-D +10.0 mg/l BAP. The medium composition without the 2.4-D +4.0 mg / l BAP resulted the highest number of roots from cotyledon explants. The roots of kenaf formed after 3 weeks which is marked by the emergence of roots from callus that formed on cotyledon explants.
RINGKASAN
MUKHLIS WAHYUDI. Induksi Proliferasi Tunas Adventif Kenaf
(Hibiscus cannabinus L.) Secara In Vitro Melalui Penambahan Zat Pengatur
Tumbuh 2.4-D dan BAP. (Dibimbing oleh NI MADE ARMINI WIENDI).
Penelitian ini bertujuan untuk mempelajari pengaruh kombinasi zat pengatur
tumbuh 2.4-D dan BAP pada berbagai konsentrasi terhadap daya proliferasi tunas
adventif pada tanaman kenaf (Hibiscus cannabinus L.). Penelitian ini dilakukan di
Laboratorium Bioteknologi Tanaman, Departemen Agronomi dan Hortikultura,
Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan
Februari 2010 sampai dengan November 2010.
Pengamatan meliputi persentase kultur yang terkontaminasi dan penyebab
kontaminasi, persentase kultur yang hidup, persentase benih berkecambah,
persentase kultur yang mengalami proliferasi tunas adventif, persentase kultur
yang membentuk kalus, waktu terbentuknya kalus, dan bentuk kalus. Kalus yang
dihasilkan berwarna cokelat muda dan merupakan tipe kalus friable yang
dicirikan dengan struktur kalus yang remah. Kalus mulai muncul pada 1 MST
untuk semua perlakuan.
Pada percobaan I, persentase hidup rata-rata tertinggi pada eksplan pucuk
yaitu 95.69 %. Persentase kontaminasi rata-rata per perlakuan tertinggi dan
terendah berturut-turut adalah 33.33 %. Perlakuan 2.4-D dengan eksplan pucuk
berpengaruh sangat nyata terhadap jumlah tunas adventif pada minggu ke 11 MST
sampai 16 MST. Perlakuan BAP dengan eksplan pucuk berpengaruh sangat nyata
terhadap jumlah tunas adventif pada minggu ke-12, 14, 15, dan 16 MST. Pelakuan
BAP berpengaruh nyata terhadap jumlah tunas adventif pada minggu ke-13 MST
tetapi tidak berpengaruh nyata terhadap jumlah tunas adventif pada minggu ke-
Pada percobaan II, persentase hidup rata-rata tertinggi pada eksplan pucuk
dengan kotiledon yaitu 92%. Persentase kontaminasi rata-rata per perlakuan
tertinggi pada eksplan pucuk dengan kotiledon yaitu 100 % dan terendah yaitu
8.33 %. Perlakuan 2.4-D dengan eksplan pucuk dengan kotiledon memberikan
pengaruh sangat nyata terhadap jumlah tunas adventif kenaf pada 11 MST sampai
16 MST. Perlakuan BAP dengan eksplan pucuk dengan kotiledon berpengaruh
sangat nyata terhadap jumlah tunas adventif pada minggu ke-11, 12, 13, 15, dan
16 MST dan berpengaruh nyata terhadap jumlah tunas adventif hanya pada
minggu ke-14 MST.
Percobaan III, persentase hidup rata-rata tertinggi pada eksplan kotiledon
yaitu 97 %. Persentase kontaminasi rata-rata eksplan kotiledon per perlakuan
tertinggi dan terendah berturut-turut adalah 75 % dan 20.83 %. Pengaruh interaksi
2.4-D dan BAP menunjukkan pengaruh yang sangat nyata terhadap jumlah tunas
adventif. Jumlah tunas adventif paling tinggi dihasilkan dari kombinasi tanpa
2.4-D + 10.0 mg/l BAP yaitu 2.33, sedangkan jumlah tunas adventif paling rendah
dihasilkan dari kombinasi 2.4-D pada konsentrasi 1.0 mg/l dengan BAP yaitu
0.08.
Organogenesis akar hanya terbentuk dari eksplan kotiledon yang didahului
pembentukan kalus. Akar yang terbentuk berwarna putih dan cokelat dengan
banyak cabang akar. Perlakuan 2.4-D berpengaruh sangat nyata terhadap jumlah
akar dan tidak berpengaruh nyata terhadap perlakuan BAP. Interaksi zat pengatur
tumbuh 2.4-D dan BAP terhadap jumlah akar pada eksplan kotiledon kenaf
memberikan pengaruh yang sangat nyata.
Akar kenaf mulai muncul pada 3MST yang ditandai dengan munculnya
radikula. Jumlah rata-rata akar tertinggi dihasilkan dari perlakuan tanpa
2.4-D + 4.0 mg/l BAP yaitu 7.37, sedangkan terendah dihasilkan dari perlakuan
1.0 mg/l 2.4-D + 8.0mg/l BAP yaitu 0.0. Pada konsentrasi 2.4-D yang semakin
tinggi cenderung menghasilkan jumlah rata-rata akar yang tinggi. Jumlah kalus
berkorelasi positif dengan jumlah akar yang terbentuk, jika jumlah kalus yang
INDUKSI PROLIFERASI TUNAS ADVENTIF KENAF
(Hibiscus cannabinus L.) SECARA IN VITRO MELALUI
PENAMBAHAN ZAT PENGATUR TUMBUH 2.4-D dan BAP
Skripsi
Sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
MUKHLIS WAHYUDI
A24060234
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul :
INDUKSI PROLIFERASI TUNAS ADVENTIF KENAF
(Hibiscus cannabinus L.) SECARA IN VITRO MELALUI
PENAMBAHAN ZAT PENGATUR TUMBUH 2.4-D dan
BAP
Nama : MUKHLIS WAHYUDI
NIM : A24060234
Menyetujui,
Dosen Pembimbing
Dr. Ir. Ni Made Armini Wiendi, MS NIP. 19610412 1987 03 2 003
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura
Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, M.Sc.Agr NIP. 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi, Propinsi Sumatera Barat pada tanggal
30 Juli 1987. Penulis merupakan anak kelima dari enam bersaudara dari Bapak
H. Tasnim dan Ibu Hj. Samsunir.
Penulis menyelesaikan pendidikan formal di SDN 07 Batu Taba IV Angkat
Candung pada tahun 1993, SMP Negeri 1 Bukittinggi pada tahun 1999, dan SMA
Negeri 5 Bukittinggi pada tahun 2002. Penulis kemudian melanjutkan studi ke
pendidikan tinggi di Institut Pertanian Bogor (IPB) melalui jalur Seleksi
Penerimaan Mahasiswa Baru (SPMB) pada tahun 2006 dan diterima sebagai
mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Selama perkuliahan penulis berpartisipasi dalam kegiatan kemahasiswaan di
Ikatan Pelajar dan Mahasiswa Minang (IPMM) dan Forum Komunikasi Rohis
Departemen (FKRD), penulis pernah mengikuti magang di ICDF (International
Cooperation and Development Fund) Taiwan, dan menjadi asisten praktikum
untuk mata kuliah Pembiakan Tanaman Perkebunan (S0), Dasar-Dasar
Bioteknologi Tanaman (S1), Bioteknologi Tanaman (S2). Selain itu, penulis juga
pernah menjadi panitia dalam acara MPD (Masa Perkenalan Departemen)
Departemen Agronomi dan Hortikultura.
Penulis menyelesaikan studi di Departemen Agronomi dan Hortikultura
Fakultas pertanian Institut Pertanian Bogor dan menyelesaikan skripsi berjudul:
“Induksi Proliferasi Tunas Adventif Kenaf (Hibiscus cannabinus L.) Secara In
Vitro Melalui Penambahan Zat Pengatur Tumbuh 2.4-D dan BAP” dibawah
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah
memberikan rahmat dan kemudahan sehingga penulis dapat menyelesaikan skripsi
yang berjudul Induksi Proliferasi Tunas Adventif Kenaf (Hibiscus cannabinus
L.) Secara In Vitro Melalui Penambahan Zat Pengatur Tumbuh 2.4-D dan
BAP. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan program
sarjana pada Fakultas Pertanian, Institut Pertanian Bogor. Penelitian bertujuan
untuk mengetahui kombinasi zat pengatur tumbuh (2.4-D dan BAP) pada berbagai
kombinasi terhadap daya proliferasi tunas adventif pada tanaman kenaf (Hibiscus
cannabinus L.) agar diperoleh planlet yang seragam secara genetik, bermutu,
jumlahnya cukup, dan bebas penyakit terutama bakteri dan cendawan.
Pada kesempatan ini, penulis menyampaikan terima kasih kepada berbagai
pihak yang telah memberikan bimbingan dan motivasi selama kegiatan penelitian
dan penulisan skripsi ini:
1. Dr. Ir. Ni Made Armini Wiendi, MS sebagai dosen pembimbing skripsi dan
dosen pembimbing akademik yang telah memberikan bimbingan dan arahan
dari awal sampai terselesaikannya skripsi ini.
2. Ir. Adolf Pieter Lonto, MS dan Dr. Dewi Sukma, SP, MSi selaku dosen
penguji yang memberikan saran dan masukan dalam pembuatan skripsi.
3. Bapak H. Tasnim dan Ibu Hj. Syamsunir serta keluarga besar penulis yang
telah memberikan doa dan dorongan yang tulus baik moril maupun materil.
4. Teknisi lab, Pak Wasil dan rekan-rekan satu lab (Tante Okti, Tante Ai, Kak
Asep, Kak Yogo, Teh Neng, Kak Seri, Kak Lina, Kiki, Limpi, dan Bang
Monje) serta Raisa Baharuddin atas bantuannya, diskusi, dan
kebersamaannya selama ini.
Bogor, Mei 2011
DAFTAR TABEL
Nomor Halaman
1. Ukuran Serat Kenaf ... 7
2. Komposisi Kimia Serat Kenaf ... 7
3. Kombinasi Perlakuan 2.4-D dan BAP pada Percobaan Proliferasi
Tunas Adventif Kenaf... 14
4. Rekapitulasi Hasil Uji F Pengaruh 2.4-D, BAP, dan Interaksinya
terhadap Jumlah Tunas Adventif pada Eksplan Pucuk Kenaf ... 18
5. Rekapitulasi Hasil Uji F Pengaruh 2.4-D, BAP, dan Interaksinya
terhadap Jumlah Tunas Adventif pada Eksplan Pucuk dengan Kotiledon Kenaf... 19
6. Pengaruh 2.4-D terhadap Jumlah Tunas Adventif pada Eksplan Pucuk
Kenaf... 27
7. Pengaruh BAP terhadap Jumlah Tunas Adventif pada Eksplan Pucuk
Kenaf... 28
8. Pengaruh 2.4-D terhadap Jumlah Tunas Adventif pada Eksplan Pucuk
dengan Kotiledon Kenaf ... 29
9. Pengaruh BAP terhadap Jumlah Tunas Adventif pada Eksplan Pucuk
dengan Kotiledon Kenaf ... 30
10. Interaksi 2.4-D dan BAP terhadap Jumlah Tunas Adventif Kenaf pada Eksplan Pucuk dengan Kotiledon ... 31
DAFTAR GAMBAR
Nomor Halaman
1. Tanaman Kenaf (Hibiscus cannabinus L.): (A) Morfologi Daun
Menjari Penuh, (B) Bunga ... 5
2. Planlet Kenaf yang Berumur 7 Hari pada Media Preconditioning MS ½ Sebagai Sumber Eksplan... 12
3. Perbandingan Persentase (%) Hidup Rata-Rata Eksplan Pucuk, Pucuk
dengan Kotiledon, dan Kotiledon Kenaf ... 20
4. Perbandingan Persentase (%) Kontaminasi Eksplan Pucuk, Pucuk
dengan Kotiledon, dan Kotiledon Kenaf ... 21
5. Kontaminasi yang Terjadi pada Kultur Kenaf: (A) Kontaminasi
Disebabkan oleh Cendawan (tanda panah), dan (B) Kontaminasi Disebabkan oleh Bakteri (tanda panah) ... 22
6. Persentase (%) Rata-Rata Eksplan Berkalus pada Ketiga Jenis Eksplan
Kenaf ... 23
7. Kalus yang Terbentuk pada Kultur Kenaf dari Eksplan: (A) Pucuk, (B) Kotiledon, (C) Pucuk dengan Kotiledon. ... 24
8. Pengaruh 2.4 D dan BAP terhadap Waktu Muncul Tunas Adventif
pada Kenaf Secara In vitro ... 26
9. Jumlah Rata-Rata Tunas Adventif pada Eksplan Pucuk Kenaf... 27
10. Tunas Adventif dari Eksplan Pucuk Kenaf pada Perlakuan Tanpa 2.4-D + 4.0 mg/l BAP Umur 16 MST ... 28
11. Jumlah Rata-Rata Tunas Adventif pada Eksplan Pucuk dengan Kotiledon Kenaf... 29
12. Tunas Adventif Kenaf dari Eksplan Pucuk dengan Kotiledon pada Perlakuan Tanpa 2.4-D + 10.0 mg/l BAP ... 30
13. Pembentukan Akar dari Eksplan Kotiledon dari Perlakuan: (A) Tanpa 2.4-D + 4.0 mg/l BAP, (B) Tanpa 2.4 D + 10.0 mg/l BAP ... 35
14. Jumlah Rata-Rata Akar pada Organogenesis Kenaf dengan Eksplan Kotiledon pada Semua Perlakuan ... 35
DAFTAR LAMPIRAN
Nomor Halaman
1. Komposisi Media MS (Murashige dan Skoog) ... 44
2. Persentase Perkecambahan Kenaf ... 45
3. Sidik Ragam Pengaruh 2.4-D, BAP, dan Interaksinya terhadap
Jumlah Tunas Adventif Eksplan Pucuk Kenaf ... 46
4. Sidik Ragam Pengaruh 2.4-D, BAP, dan Interaksinya terhadap
Jumlah Tunas Adventif Eksplan Pucuk dengan Kotiledon Kenaf... 47
5. Persentase (%) Hidup Rata-Rata per Perlakuan pada Eksplan Pucuk
Kenaf... 48
6. Persentase (%) Hidup Rata-Rata per Perlakuan pada Eksplan Pucuk
dengan Kotiledon Kenaf ... 48
7. Persentase (%) Hidup Rata-Rata per Perlakuan pada Eksplan
Kotiledon Kenaf... 48
8. Pesentase (%) Rata-Rata Kontaminasi per Perlakuan pada Eksplan
Pucuk Kenaf... 51
9. Pesentase (%) Rata-Rata Kontaminasi per Perlakuan pada Eksplan
Pucuk dengan Kotiledon Kenaf ... 52
10. Pesentase (%) Rata-Rata Kontaminasi per Perlakuan pada Eksplan
Kotiledon Kenaf... 53
11. Sidik Ragam Hasil Uji Lanjut DMRT Interaksi 2.4-D dan BAP
pada Eksplan Pucuk dan Kotiledon Kenaf ... 54
12. Sidik Ragam Pengaruh 2.4-D, BAP, dan Interaksinya terhadap
PENDAHULUAN
Latar Belakang
Tanaman kenaf (Hibiscus cannabinus L.) merupakan tanaman semusim
yang batangnya dapat diambil seratnya. Pada saat ini kenaf menjadi alternatif
sumber serat, tidak hanya digunakan sebagai bahan baku karung goni, tetapi dapat
diolah menjadi bahan baku industri yang lebih prospektif dan bernilai ekonomi
tinggi. Penggunaan komoditas kenaf untuk berbagai industri di beberapa negara
seperti: Malaysia, China, Amerika Serikat dan Jepang, telah menggunakan
teknologi dan mesin-mesin modern, antara lain: fiber board, particle board, pulp,
kertas, doortrim (lapisan interior mobil), pelapis dinding, tekstil, geo-tekstil, dan
lain-lain (Sudjindro, 2003).
Menurut Badan Penelitian dan Pengembangan Tanaman Industri (1990)
keunggulan dari serat kenaf terdapat pada kandungan pentosa yang tinggi, yaitu
21.1 %, jauh melebihi kandungan pentosa pinus yang hanya 10.25 %. Selain itu,
kandungan alfa selulosanya mencapai 39.3 %, lebih baik dibandingkan bagas dan
pinus. Dalam upaya penghematan kayu hutan, serat kenaf beserta batangnya telah
dikembangkan untuk pembuatan pulp dengan kualitas yang cukup baik. Liu
(1999) dalam Lokakarya Internasional Kenaf di China memaparkan bahwa kenaf
prospektif dalam pengembangan alternatif pulp berbasis non-kayu.
Kenaf adalah tanaman semusim yang dapat dipanen pada umur 150 hari
dengan produktivitas rata-rata bobot kering berkisar antara 20-40 ton/ha/tahun
dengan hasil serat rata-rata 12 ton/ha. Produksitivitas serat tanaman berkayu
berkisar antara 8-12 ton/ha/tahun dan membutuhkan setidaknya 10-14 tahun untuk
dapat dipanen. Efisiensi biologis kenaf jauh lebih tinggi dibandingkan dengan
tanaman berkayu. Daya adaptasi ekologis yang luas membuat kenaf dapat ditanam
pada lahan-lahan marjinal yaitu tanah yang miskin kandungan hara atau kondisi
stres seperti kekeringan, garam, dan pH rendah.
Pengembangan kenaf di Indonesia sudah berlangsung sejak tahun
1979/1980 melalui program Intensifikasi Serat Karung Rakyat (ISKARA), namun
dalam perjalanannya mengalami pasang surut. Hasil survei Sastrosupadi et al.
cenderung mengalami penurunan. Salah satu permasalahan yang dihadapi dalam
pengembangan tanaman kenaf di Indonesia adalah tingkat kompetisi dengan
komoditas lain dalam memperoleh lahan yang potensial atau subur dan tergeser
oleh komoditas pangan. Liu (2000) melaporkan bahwa dalam rentang tahun
tersebut terjadi penurunan produksi kenaf dunia karena permintaan serat kenaf di
pasar dunia menurun.
Produksi kenaf dunia berfluktuasi setiap tahun yang sebagian besar
dipengaruhi oleh permintaan kenaf di pasar dunia, kondisi iklim, dan kultur
agronomi di negara-negara produsen kenaf. Menurut Liu (2000) pada Simposium
Internasional Kenaf di Hiroshima, total produksi kenaf dunia pada 1999/2000
adalah 0.51 juta ton yang didominasi oleh China sebesar 44 %, diikuti India dan
Thailand masing-masing sebesar 39 % dan 12 %, serta sisanya berasal dari
Indonesia, Vietnam dan negara-negara lain.
Kebutuhan serat nasional rata-rata 60 000 ton per tahun. Dari total
kebutuhan tersebut, produksi serat nasional hanya mampu menyediakan serat
kering sebesar 3 750 ton per tahun atau hanya 6 % dari kebutuhan nasional,
sedangkan kekurangannya 56 430 ton atau sekitar 94 %, masih harus diimpor
(Nurheru, Isdijoso, dan Sastrosupadi, 1994). Rendahnya tingkat produktivitas ini
antara lain dipengaruhi oleh terbatasnya ketersediaan benih (utamanya varietas
unggul), mutu benih rendah, dan cara bercocok tanam yang tidak mengacu pada
petunjuk teknis.
Masalah yang mendapat perhatian utama adalah ketersediaan dan
kontinuitas benih, sehingga didapatkan benih yang bermutu dalam jumlah yang
cukup, kontinuitas terjamin, dan tepat waktu. Kebutuhan benih unggul kenaf di
petani masih sangat tinggi 0.7-1.0 ton/ha, sedangkan produktivitas masih rendah
yaitu 0.3-0.5 ton/ha (Badan Penelitian dan Pengembangan Pertanian, 2003). Benih
untuk musim tanam berikutnya tidak dapat dipanen karena kenaf telah lebih
dahulu dipanen untuk diambil seratnya. Hal ini merupakan peluang pengadaan
benih untuk menjaga konsistensi ketersediaan benih dipetani. Salah satu kendala
teknis yang menyebabkan rendahnya produktivitas serat kenaf, yute, dan rosela
adalah terbatasnya varietas unggul sehingga varietas yang ada digunakan secara
Kultur jaringan merupakan suatu metode untuk mengisolasi bagian tanaman
seperti: protoplasma, sel, kelompok sel, jaringan, dan organ, serta
menumbuhkannya dalam lingkungan aseptik. Pemanfaatan teknologi kultur
jaringan dalam produksi bahan tanaman bermutu, jumlah yang cukup, dan bebas
penyakit sangat mungkin untuk dilakukan. Kultur jaringan dapat memproduksi
planlet (bahan tanam ukuran kecil) yang seragam secara genetik dan tidak
memerlukan tempat yang luas karena perbanyakan dilakukan di laboratorium
dalam kondisi aseptik yang terjaga sehingga bahan tanaman bebas dari penyakit
terutama bakteri dan cendawan. Bahan tanaman dapat diproduksi setiap saat tanpa
tergantung musim karena dilakukan di dalam ruangan (Gunawan, 1992).
Didalam kultur jaringan tanaman, zat pengatur tumbuh pada umumnya
digunakan secara kombinasi. Auksin dalam kultur jaringan berperan dalam
pembentukan kalus, morfogenesis akar dan tunas, dan embriogenesis. Salah satu
jenis auksin yang banyak dipergunakan untuk induksi kalus adalah 2.4-D.
Wattimena (1988) menulis 3 keuntungan penggunaan senyawa 2.4-D jika dilihat
dari segi aktivitasnya yaitu: (1) dibanding IAA, senyawa 2.4-D menunjukkan
aktivitas auksin yang lebih tinggi, (2) kelarutan lemak dan air sama dengan
senyawa IAA, (3) 2.4-D resisten terhadap IAA oksidase. McLean, Lawrence, dan
Reichert(1992) melaporkan bahwa 2.4 D digunakan dalam multiplikasi kalus dan
rhizogenesis dari eksplan internodal batang kenaf. Penelitian lain oleh
Srivatanakul et al. (2000) melaporkan bahwa medium yang menginisiasi
multiplikasi tunas adventif dari eksplan tunas apex kenaf merupakan kombinasi
antara 2.4-D dan Thidiazuron.
Pengaruh sitokinin di dalam kultur jaringan tanaman antara lain
berhubungan dengan proses pembelahan sel, proliferasi tunas ketiak, dan
penghambat tumbuhnya akar. Sitokinin juga mempengaruhi proliferasi kalus pada
beberapa tanaman. Pada umumnya di dalam suatu percobaan kultur jaringan
dipergunakan BAP karena jauh lebih murah dan tahan terhadap degradasi.
Purwati, Sudjindro, dan Sudarmadji (1999) melaporkan penggunaan BAP dalam
induksi kalus kenaf menggunakan kotiledon beserta plumulanya sebagai eksplan.
Lebih lanjut McLean, Lawrence, dan Reichert (1992) melaporkan bahwa tunas
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh kombinasi zat pengatur
tumbuh (2.4-D dan BAP) pada berbagai konsentrasi terhadap daya proliferasi
tunas adventif pada tanaman kenaf (Hibiscus cannabinus L.) agar diperoleh
planlet yang seragam secara genetik, bermutu, jumlahnya cukup, dan bebas
penyakit terutama bakteri dan cendawan.
Hipotesis
1. Zat pengatur tumbuh 2.4-D pada berbagai konsentrasi berpengaruh nyata
terhadap daya proliferasi tunas adventif tanaman kenaf (Hibiscus cannabinus
L.).
2. Zat pengatur tumbuh BAP pada berbagai konsentrasi berpengaruh nyata
terhadap daya proliferasi tunas adventif tanaman kenaf (Hibiscus cannabinus
L.).
3. Terdapat interaksi antara 2.4-D dan BAP berpengaruh nyata terhadap daya
Tanaman ini me
merupakan tanaman herba semusim dengan tipe
emak tegak (Balittas 1996). Kenaf termasuk
dan duCellier, 1993). Selanjutnya Ochse
a kenaf termasuk dalam genus Hibiscus ya
diantaranya: okra (Hibiscus esculentus L.),
bang sepatu (Hibiscus rosasinensis L.), ke
osela (Hibiscus sabdariffa L.), (Ochse et al., 1961)
nurut Ben Hill et al. (1960), sebagai berikut:
: Plant Kingdom
anaman Kenaf (Hibiscus cannabinus L.): (A) M
Kenaf (Hibiscus cannabinus L.) adalah tanaman herba setahun yang
berbentuk lurus, ramping, batang bulat, dan berbatang halus atau berduri dengan
tinggi mencapai 2.4-3.6 m atau lebih. Daun yang paling bawah berbentuk
chordata dan daun yang paling atas menjari berbentuk oblong, lancip. Bentuk
bunga aksilar, besar (diameter 3-4 inchi), berwarna kuning atau dengan pusat
berwarna merah tua. Buah berbentuk bulat, meruncing dan berbulu, benih kecil,
berwarna abu-abu dan berbentuk seperti ginjal. Benih berbentuk triangular,
dengan sudut yang lancip, berwarna abu-abu dengan titik kekuningan. Hilum
berwarna coklat, dan secara umum berbentuk kecil (Badan Penelitian dan
Pengembangan Tanaman Industri, 1990). Menurut Sobhan (1983), daun kenaf
terdiri atas tiga bentuk daun: tunggal (unlobed), semi menjari (partially lobed),
dan menjari penuh (deeply lobed). Daun menjari ada yang berjari lima dan berjari
tujuh. Selain itu, ada juga yang merupakan campuran daun tunggal dan menjari.
Daun tunggal biasanya terletak pada bagian bawah, sedangkan yang menjari
letaknya di bagian tengah dan atas.
Kenaf dapat tumbuh hampir pada semua tipe tanah, tetapi tipe tanah yang
ideal untuk kenaf yaitu tanah lempung berpasir atau lempung liat berpasir dengan
drainase yang baik (Dempsey dalam Balittas 1996). Kebutuhan air untuk kenaf
sebesar 600 mm. Tanaman semakin tua semakin tahan terhadap genangan
(Iswindoyono dan Sastrosupadi dalam Balittas 1996). Kisaran pH cukup luas
antara 4.5-6.5 sehingga kenaf dapat tumbuh baik di tanah agak masam seperti di
lahan gambut. Curah hujan yang dikehendaki selama pertumbuhan sebesar
500-750 mm atau curah hujan setiap bulan 125-150 mm (Berger 1969, Sinha dan
Guharoy 1987, Dempsey 1963 dalam Balittas 1996).
Liu (2004) menyatakan bahwa serat kenaf terdiri atas serat bagian luar dan
dalam. Serat bagian luar terdapat pada kulit sebesar 35 % bobot kering dan serat
bagian dalam terdapat pada inti sebesar 65 % bobot kering. Dimensi dan
komposisi kimia serat kenaf masing-masing dapat dilihat pada Tabel 1 dan 2.
Tabel 1. Ukuran Serat Kenaf
Tabel 2. Komposisi Kimia Serat Kenaf
Tipe serat Kadar abu (%) α-selulosa (%) Lignin (%)
Kulit 5.5-8.3 53-57.4 5.9-9.3
Core 2.9-4.2 51.2 17.0
Sumber: Liu (2004)
Keunggulan komoditas kenaf adalah berumur pendek (4-5 bulan), mampu
beradaptasi di berbagai lingkungan marjinal, seperti: lahan banjir, podsolik merah
kuning, gambut, dan tadah hujan (Direktorat Budidaya Tanaman Semusim
Direktorat Jendral Perkebunan, 2007).
Kultur Jaringan
Kultur jaringan merupakan teknik mengisolasi bagian-bagian tanaman (sel,
protoplasma, tepung sari, ovari, dan sebagainya) ditumbuhkan secara tersendiri,
dipacu untuk memperbanyak diri, dan akhirnya diregenerasikan kembali menjadi
tanaman lengkap dalam suatu lingkungan yang aseptik dan terkendali (Gunawan,
1992). Pengertian lain menerangkan bahwa kultur jaringan merupakan teknik
perbanyakan bagian tanaman, sel, jaringan, dan organ dibawah kondisi
lingkungan yang terkontrol atau aseptik (Evans et. al, 2003).
Teknik kultur jaringan pada awalnya untuk membuktikan kebenaran teori
totipotensi kemudian berkembang dalam bidang penelitian fisiologi tanaman dan
biokimia. Acquah (2004) melaporkan bahwa teknik kultur jaringan didasarkan
pada konsep totipotensi yaitu setiap sel hidup memiliki informasi genetik yang
diperlukan untuk pembentukan organ dan fungsi hidup.
Menurut Gunawan (1992) perbanyakan tanaman dengan teknik ini memiliki
kelebihan yaitu: tanaman dapat diperbanyak setiap saat tanpa tergantung musim
tanaman yang kecil, tanaman yang dihasilkan seragam dan bebas penyakit
terutama bakteri dan cendawan.
Media Kultur
Keberhasilan dalam teknologi serta penggunaan metode kultur jaringan
terutama didukung oleh pengetahuan yang baik mengenai komposisi hara sel
tanaman dan jaringan yang akan dikulturkan (Gamborg, 1981). Media kultur
jaringan tanaman menyediakan tidak hanya unsur hara makro dan mikro, tetapi
juga karbohidrat yang pada umumnya berupa gula untuk menggantikan karbon
yang biasanya didapat dari atmosfer melalui fotosintesis.
Media yang dipakai dalam kultur jaringan telah banyak dikembangkan
beberapa peneliti. Didalam media tersebut terkandung senyawa-senyawa kimia
yang diperlukan oleh jaringan tanaman untuk tumbuh. Wetherel (1982)
melaporkan bahwa media kultur yang memenuhi syarat adalah media yang
mengandung hara makro dan mikro dalam kadar perbandingan tertentu, serta
sukrosa sebagai sumber karbohidrat utama. Menurut Wetherel dan Constabel
(1991) hara yang terdapat di dalam media kultur jaringan terdiri dari komponen
utama (garam mineral, sumber karbon, zat pengatur tumbuh, dan vitamin) dan
komponen tambahan (nitrogen organik, berbagai asam organik, dan senyawa
metabolit).
Media kultur jaringan dibedakan menjadi media dasar dan media perlakuan.
Formulasi media dasar adalah kombinasi zat yang mengandung hara-hara esensial
(makro dan mikro), sumber energi dan vitamin. Media dasar yang banyak
digunakan antara lain media Murashige dan Skoog (MS), media B5, dan media
WPM (Gunawan, 1992).
Media yang dikembangkan oleh Murashige dan Skoog (MS) telah
digunakan secara luas pada kultur sel dan kultur suspensi sel. Keuntungan
penggunaan medium MS adalah kandungan nitrat, kalium, dan amoniumnya
yang tinggi (Wetherel dan Constabel, 1991). Collin dan Edwards (1998)
menambahkan bahwa media MS merupakan media yang umum digunakan dan
dengan kandungan hara makro yang tinggi. Menurut Gunawan (1992) media MS
Unsur-unsur makro dalam media MS dibuat untuk kultur kalus tembakau, tetapi
komposisi MS pada umumnya juga mendukung kultur jaringan tanaman lain.
Zat Pengatur Tumbuh
Konsep zat pengatur tumbuh (ZPT) didasari pada konsep hormon, dimana
senyawa-senyawa organik tanaman yang dalam konsentrasi rendah mempengaruhi
proses fisiologi. Zat pengatur tumbuh adalah senyawa organik bukan nutrisi yang
dalam konsentrasi rendah (< 1mM) dapat mendorong, menghambat atau secara
kualitatif mengubah pertumbuhan dan perkembangan tanaman (Wiendi et al.,
1992). Dua golongan zat pengatur tumbuh yang sangat penting adalah sitokinin
dan auksin. Sitokinin sangat penting dalam pengaturan pembelahan sel dan
morfogenesis, sedangkan auksin dalam kultur jaringan digunakan untuk
merangsang pertumbuhan kalus, suspensi sel, dan organ.
Menurut Hopkins dan Huner (2004), auksin terdapat pada semua bagian
tanaman, tetapi dominan di jaringan pucuk dan organ tanaman yang aktif tumbuh
seperti koleoptil, ujung akar, tunas apikal batang, dan benih yang berkecambah.
Konsentrasi auksin yang tinggi juga terdapat pada daun yang sedang tumbuh,
proses pembungaan, dan fertilisasi. Gaba (2005) melaporkan bahwa pada
umumnya penggunaan auksin dengan konsentrasi tinggi dapat menginduksi
embriogenesis somatik. Fungsi auksin adalah untuk menginduksi sel-sel menjadi
embriogenik.
Berdasarkan laporan-laporan penelitian, pertumbuhan dan perkembangan
kultur in vitro memerlukan komposisi dan konsentrasi zat pengatur tumbuh yang
berbeda untuk suatu varietas dengan varietas lain dari satu jenis tanaman. Jenis
ZPT yang digunakan juga memiliki respon yang bervariasi antar varietas (Wiendi
et al., 1992). Konsentrasi auksin yang digunakan akan memberikan pengaruh
yang berbeda terhadap berbagai spesies. Konsentrasi yang tinggi akan
mengakibatkan abnormalitas kalus dan menghambat pertumbuhan kalus itu
sendiri (Evans et al., 2003).
Auksin sangat luas penggunaanya dalam kultur jaringan tanaman sebagai
media tumbuh. Auksin dapat dibedakan lagi menjadi auksin endogen (IAA) yang
fisiologis dan biokimia yang serupa dengan hormon tanaman. Salah satu auksin
sintetik yang sering digunakan adalah 2.4-D, 2.4-5 T, Dicamba, dan Picloram.
Wiendi et al. (1992) melaporkan bahwa penggunaan auksin terutama untuk
induksi kalus, suspensi sel, dan pertumbuhan akar.
Sitokinin adalah kelompok senyawa organik yang menyebabkan
pembelahan sel yang dikenal sebagai sitokinesis. Sitokinin yang terdapat dalam
tanaman adalah zeatin yang secara biologis sangat aktif. Menurut Wiendi et al.
(1992) bahwa zat yang analog dengan sitokinin antara lain: Kinetin, BAP
(6-benzyl amino purin), dan BA (6-(6-benzyl adenine). Pengaruh sitokinin di dalam
kultur jaringan tanaman antara lain berhubungan dengan proses pembelahan sel,
proliferasi, penghambatan pertumbuhan akar, proliferasi kalus dan induksi umbi
mikro.
Wiendi et al. (1992) melaporkan bahwa dalam aplikasinya di dalam kultur
jaringan tanaman, konsentrasi efektif untuk masing-masing zat pengatur tumbuh
berbeda. Penentuan taraf konsentrasi disesuaikan dengan tipe organ atau eksplan,
metode kultur jaringan, dan tingkat kultur jaringan (pembuatan kalus, induksi
tunas, induksi akar, dan lain-lain).
Kultur Jaringan Kenaf
McLean, Lawrence, dan Reichert(1992) melaporkan bahwa bahan tanaman
yang digunakan dalam multiplikasi kalus dan induksi rhizogenesis kenaf berasal
dari eksplan internodal batang kenaf (Hibiscus cannabinus L.). Waktu yang
dibutuhkan dari awal inisiasi sampai munculnya kalus adalah 4 minggu. Media
yang baik untuk produksi kalus dan induksi rhizogenesis adalah media MS
dengan kombinasi zat pengatur tumbuh 2.4-D/Kinetin dan NAA/BAP. Jumlah
kalus tertinggi dihasilkan pada kombinasi konsentrasi 0.3/3.0 dan 1.0/3.0 mg/l
2.4-D/kinetin, dan kombinasi konsentrasi 1.0/1.0 dan 3.0/1.0 mg/l NAA/BAP.
Rhizogenesis tertinggi dihasilkan pada kombinasi konsentrasi 0.1/3.0 dan
0.3/3.0 mg/l NAA/BAP. Lebih lanjut McLean, Lawrence, dan Reichert
melaporkan bahwa tunas adventif dapat dikembangkan pada zat pengatur tumbuh
2.4-D/Kinetin dan NAA/BAP dengan masing-masing konsentrasi besar atau sama
Purwati, Sudjindro, dan Sudarmadji (1999) melaporkan metode regenerasi
yang sesuai untuk kenaf dengan menggunakan kotiledon beserta plumulanya
sebagai eksplan. Media yang digunakan untuk induksi kalus adalah MS dasar
dengan BAP (2mg/l) dan NAA (0.5 mg/1). Kalus yang dihasilkan pada media ini
kemudian dipindahkan ke media inisiasi tunas yaitu MS dasar yang mengandung
BAP (2.0 mg/1) dan GA3 (5.0 mg/1). Tunas yang diperoleh kemudian
disub-kultur ke media MS dasar tanpa zat pengatur tumbuh untuk pembentukan akar.
Tunas yang telah berakar kemudian diaklimatisasi pada media pasir steril dan
ditanam pada tanah steril di rumah kaca.
Penelitian lain melaporkan bahwa media yang menginisiasi multiplikasi
tunas adventif dari eksplan tunas apex kenaf merupakan kombinasi antara 2.4-D
(0.0, 0.5, dan 2.3 mg/l) dan Thidiazuron (0.0, 1.0, 5.0, dan 20.0 mg/l). Regenerasi
tunas adventif tertinggi per eksplan dari ketiga kultivar kenaf yang diuji (Tainung
1, Tainung 2, dan Everglades 71) dihasilkan dari konsentrasi 1.0 mg/l
Thidiazuron. Tunas dibentuk setelah 2 minggu tanpa pembentukan kalus. Tunas
memanjang dan berakar dalam waktu 2 minggu setelah inisiasi (Srivatanakul et
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Bioteknologi Tanaman,
Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian
Bogor. Penelitian dilaksanakan dari bulan Februari 2010 sampai dengan
November 2010.
Bahan Tanaman dan Media
Penelitian ini menggunakan tiga jenis eksplan yaitu: pucuk, pucuk dengan
kotiledon, dan kotiledon dari kecambah kenaf (Hibiscus cannabinus L.) varietas
KR 14 (Karang Ploso 14). Benih kenaf diperoleh dari Balai Penelitian Tanaman
Tembakau dan Serat (Balittas) Malang. Eksplan berasal dari benih kenaf umur
120-130 hari dan dikecambahkan secara in vitro pada tanggal 6 Juli 2010 dengan
menggunakan media preconditioning MS ½ kemudian diinokulasi ke media
perlakuan pada tanggal 12 Juli 2010.
Gambar 2 menunjukkan sumber eksplan yang digunakan dalam kultur kenaf
diperoleh dari kecambah umur 7 hari media MS setengah konsentrasi tanpa zat
pengatur tumbuh. Bagian kecambah yang digunakan adalah pucuk pucuk ukuran
0.5 cm, pucuk dengan kotiledon dengan panjang 1.5-2.0 cm, dan kotiledon kenaf
yang terlebih dahulu dipotong agar memberikan respon lebih cepat. Eksplan
kotiledon ditanam secara horizontal sehingga kontak dengan media kultur lebih
luas.
Media dasar yang digunakan adalah MS (Murashige dan Skoog), dengan
tambahan zat pengatur tumbuh yang digunakan adalah 2.4-D (auksin) dan BAP
(sitokinin). Bahan pemadat media menggunakan agar-agar, dan gula pasir sebagai
sumber karbohidrat. Pengaturan pH menggunakan KOH 1 N dan HCL 1 N pada
waktu semua komponen media telah dicampur. Bahan sterilan untuk benih kenaf
menggunakan chlorox, Agrept, Dithane, Benlate, Amoxycyline (antibiotik) dan
aquades steril dan tisu steril. Bahan sterilan ruang kultur dan alat menggunakan
alkohol 70 %. Bahan pengemasan untuk penyimpanan kultur terdiri dari plastik
tahan panas dan karet gelang. Bahan lainnya yang diperlukan yaitu: deterjen,
korek api, dan spritus.
Alat-Alat
Alat yang digunakan untuk sterilisasi alat maupun media meliputi autoclave
dan oven. Alat untuk membuat media kultur terdiri dari labu takar, gelas piala,
gelas ukur, pipet volumetrik, magnetic styrer, pengaduk kaca, botol kultur ukuran
kecil, corong, timbangan digital, dan pH meter. Tempat inokulasi kultur dilakukan
didalam laminar air flow cabinet (LAFC). Alat-alat diseksi (pinset, gunting, dan
scapel), bunsen, cawan petri, dan hand sprayer. Alat untuk penyimpanan terdiri
dari botol kultur dan rak yang dilengkapi dengan lampu fluorescent dengan
intensitas cahaya 1000 lux.
Metodologi Penelitian
Penelitian ini terdiri dari 3 percobaan terpisah berdasarkan jenis eksplan
yaitu: percobaan I: eksplan pucuk, percobaan II: eksplan pucuk dengan kotiledon,
dan percobaan III: eksplan kotiledon. Masing-masing percobaan ini disusun
menggunakan metode Rancangan Acak Lengkap (RAL) faktorial dengan dua
faktor. Faktor I adalah zat pengatur tumbuh 2.4-D dengan taraf 0.0, 0.5 dan 1.0
mg/l dan faktor II adalah BAP dengan taraf 0.0, 2.0, 4.0, 8.0, dan 10.0 mg/l.
Terdapat 15 kombinasi perlakuan dan setiap kombinasi perlakuan terdiri dari tiga
ulangan sehingga terdapat 45 satuan percobaan. Pada eksplan pucuk dan pucuk
dengan kotiledon, setiap satuan percobaan terdiri dari empat eksplan sebagai
terdiri dari delapan eksplan sehingga terdapat 360 satuan amatan. Eksplan
merupakan unit terkecil percobaan yang diamati.
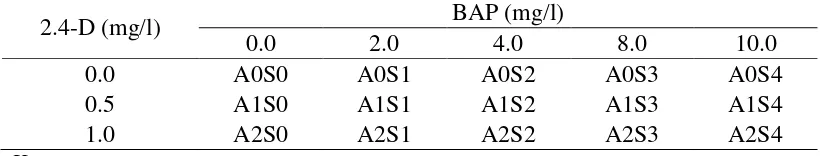
Tabel 3. Kombinasi Perlakuan 2.4-D dan BAP pada Percobaan Proliferasi Tunas Adventif Kenaf
2.4-D (mg/l) BAP (mg/l)
0.0 2.0 4.0 8.0 10.0
0.0 A0S0 A0S1 A0S2 A0S3 A0S4
0.5 A1S0 A1S1 A1S2 A1S3 A1S4
1.0 A2S0 A2S1 A2S2 A2S3 A2S4
Keterangan :
A = 2.4-D (A0 = 0.0 mg/l, A1 = 0.5 mg/l, A2 = 1.0 mg/l)
S = BAP (S0 = 0.0 mg/l, S1 = 2.0 mg/l, S2 = 4.0 mg/l, S3 = 8.0 mg/l, S4 = 10.0 mg/l)
Model rancangan yang digunakan adalah:
Y ijk = µ + αi + βj + (αβ)ij + ijk
Keterangan:
Yijk = Hasil pengamatan pada perlakuan 2.4-D konsentrasi ke i, BAP
konsentrasi ke j dan ulangan ke k
µ = Rataan umum hasil pengamatan untuk setiap satuan percobaan
i = Pengaruh pada perlakuan 2.4-D konsentrasi ke i (i = 1, 2, 3)
j = Pengaruh pada perlakuan BAP konsentrasi ke j (j = 1, 2, 3, 4, 5)
ijk = Pengaruh pada interaksi 2.4-D konsentrasi ke i, BAP konsentrasi ke j
ijk = Pengaruh galat pada perlakuan 2.4-D konsentrasi ke i, BAP
konsentrasi ke j dan ulangan ke k
Analisis statistik terhadap data yang diperoleh dilakukan dengan uji F
menggunakan program SAS (Statistical Analysis System). Perlakuan yang
berpengaruh nyata pada uji F kemudian diuji lanjut menggunakan metode DMRT
(Duncan Multiple Range Test) pada taraf uji 5 %.
Pelaksanaan Penelitian
Persiapan dan Sterilisasi Peralatan
Botol kultur, cawan petri, dan alat tanam dicuci dengan deterjen sampai
bersih dan disterilisasi. Sterilisasi menggunakan autoclave pada temperatur
persiapan inokulasi eksplan, alat-alat diseksi dibuka di Laminar Air Flow Cabinet
(LAFC).
Pembuatan Larutan Stok
Pembuatan larutan stok bertujuan untuk memudahkan pekerjaan menimbang
bahan-bahan kimia yang berulang-ulang dalam pembuatan media dan zat pengatur
tumbuh. Stok yang dibuat sesuai dengan komposisi media perlakuan MS yang
disimpan dalam tabung Erlenmeyer. Pembuatan larutan stok zat pengatur tumbuh
2.4-D dilarutkan menggunakan larutan KOH 1 N sedangkan BAP dilarutkan
menggunakan HCL 1 N. Zat pengatur tumbuh dibuat sesuai dengan
masing-masing taraf percobaan. Selanjutnya ditambahkan air steril sesuai volume yang
diinginkan. Larutan stok ini disimpan di tempat yang bertemperatur rendah dan
gelap. Komposisi media MS (Murashige dan Skoog) disajikan pada Lampiran 1.
Pembuatan Media Kultur
Pembuatan media kultur dibuat dengan memipet sejumlah volume tertentu
larutan stok media ke dalam labu takar dengan penambahan 2.4-D dan BAP sesuai
dengan masing-masing taraf percobaan. Gula dilarutkan sebanyak 30 g/l dengan
air steril, kemudian ditambahkan air steril ke dalam larutan sampai tanda tera.
Tingkat kemasaman media (pH) dipertahankan pada pH 5.9 sebelum di-autoclave
dengan menambahkan HCL 1 N atau KOH 1 N. Agar-agar 7 g/l ditambahkan
kedalam media kemudian dimasak sampai mendidih. Media tersebut kemudian
dituangkan kedalam botol kultur yang telah disterilisasi sebanyak 25 ml per botol.
Volume botol kultur yang digunakan adalah 200 ml. Setelah itu media disterilisasi
dengan menggunakan autoclave pada temperatur 121°C dengan tekanan 17.5 psi
selama 20 menit.
Sterilisasi Biji Sebagai Sumber Eksplan
Sterilisasi bahan tanam dimulai dengan pencucian benih kenaf
menggunakan aquades. Selanjutnya benih direndam selama 60 menit dalam air
panas yang sebelumnya telah ditambah deterjen. Kemudian benih dibilas dengan
Sterilisasi di dalam laminar air flow cabinet dimulai dengan membilas benih
kenaf sebanyak dua kali dalam aquades steril selama 5 menit untuk tiap
pembilasan. Benih kenaf disterilkan dengan menggunakan chlorox 30 % selama
20-30 menit. Setelah itu benih kenaf dibilas satu kali dalam aquades steril.
Prosedur ini diulang dengan menggunakan chlorox 10 % selama 5-10 menit,
kemudian dibilas dalam aquades steril satu kali. Selanjutnya benih kenaf direndam
dalam larutan 2 g/l Dithane + 2 g/l Agrept + 2 g/l Benlate + Amoxycyline dan
diaduk dengan menggunakan shaker selama 60 menit
Benih secara aseptik diletakkan di permukaan tisu steril dalam cawan petri.
Kenaf yang telah steril ditanam di dalam media MS ½ konsentrasi. Setiap botol
kultur ditanami dengan 20-25 benih kenaf. Setelah semua prosedur tersebut
dijalankan, bahan tanam disimpan di dalam ruang kultur untuk perkecambahan.
Penanaman eksplan
Laminar air flow cabinet yang akan digunakan sebelum penanaman eksplan
terlebih dahulu dibersihkan dengan akohol 70 %. Eksplan yang digunakan adalah
pucuk, pucuk dengan kotiledon, dan kotiledon.
Kecambah yang telah berumur 7 hari dikeluarkan dari kultur dan diletakkan
dalam cawan petri steril. Dengan scalpel, bagian pucuk, pucuk dengan kotiledon,
dan kotiledon dipotong. Setelah semua media perlakuan dan semua peralatan
tanam disiapkan, bahan tanam dapat segera ditanam dibotol kultur. Eksplan pucuk
dan pucuk dengan kotiledon, pada setiap botol kultur ditanam 4 eksplan kenaf
sedangkan eksplan kotiledon, setiap botol kultur ditanam 8 eksplan. Setelah
penanaman, botol kultur diletakkan di ruang kultur.
Inkubasi kultur
Kultur kenaf untuk semua jenis eksplan tersebut ditumbuhkan di ruang
kultur yang ada di laboratorium. Pada ruang kultur terdapat rak-rak kultur dengan
sumber cahaya dari lampu flourescens 20 watt untuk menyinari kultur. Suhu
Pengamatan
Pengamatan dilakukan terhadap beberapa peubah dengan frekuensi
pengamatan sekali seminggu selama 16 minggu mulai dari 1 MST-16 MST :
1. Persentase kultur yang terkontaminasi dan penyebab kontaminasi
% kontaminasi = jumlah eksplan kontam
jumlah eksplan × 100 %
2. Persentase kultur yang hidup.
% eksplan hidup = jumlah eksplan hidup
jumlah total eksplan
×
100 %3. Persentase benih berkecambah.
% daya berkecambah = jumlah benih berkecambah
jumlah total benih × 100 %
4. Persentase kultur mengalami proliferasi tunas adventif.
5. Persentase eksplan yang membentuk embrio somatik.
6. Persentase kultur yang membentuk kalus.
7. Waktu terbentuk kalus.
HASIL DAN PEMBAHASAN
Kondisi Umum
Eksplan berasal dari benih kenaf umur 120-130 hari dan dikecambahkan
secara in vitro pada media MS ½. Waktu untuk perkecambahan adalah 1 HST
(Hari Setelah Tanam) yang ditandai dengan munculnya akar radikula sedangkan
kotiledon mulai muncul pada 2 HST. Persentase perkecambahan rata-rata adalah
91.70 %. Data dan persentase perkecambahan kenaf disajikan pada Lampiran 2.
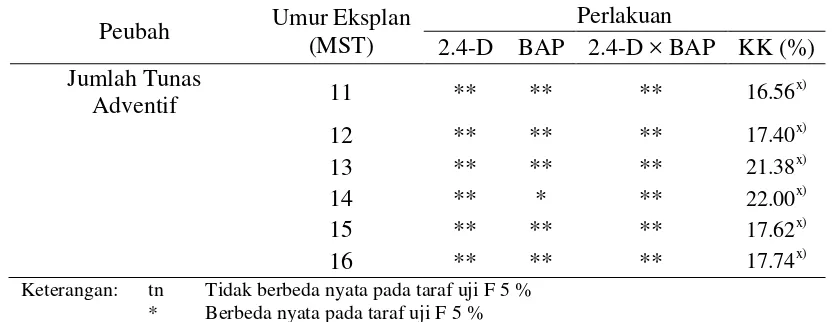
Hasil rekapitulasi sidik ragam pada Tabel 4 dan Tabel 5 menunjukkan
pengaruh perlakuan terhadap jumlah tunas adventif kenaf dari eksplan pucuk dan
pucuk dengan kotiledon. Sidik ragam disajikan pada Lampiran 3 dan 4. Tunas
adventif kenaf muncul dari kalus pada 11 MST melalui organogenesis tidak
langsung.
Tabel 4 menunjukkan perlakuan 2.4-D untuk eksplan pucuk memberikan
pengaruh sangat nyata terhadap jumlah tunas adventif pada 11-16 MST. Perlakuan
BAP berpengaruh sangat nyata terhadap jumlah tunas adventif pada 12, 14, 15,
dan 16 MST (Minggu Setelah Tanam) dan perlakuan BAP berpengaruh nyata
pada 13 MST. Perlakuan BAP tidak berpengaruh nyata terhadap jumlah tunas
adventif pada 11 MST. Interaksi 2.4-D dan BAP tidak memberikan pengaruh
nyata terhadap jumlah tunas adventif kenaf. Sidik ragam analisis statistik disajikan
pada lampiran 3.
Tabel 4. Rekapitulasi Hasil Uji F Pengaruh 2.4-D, BAP, dan Interaksinya terhadap Jumlah Tunas Adventif pada Eksplan Pucuk Kenaf
Peubah Umur Eksplan (MST) Perlakuan
Tabel 5 menunjukkan pada perlakuan 2.4-D dan interaksi 2.4-D dan BAP
untuk eksplan pucuk dengan kotiledon memberikan pengaruh sangat nyata
terhadap jumlah tunas adventif pada 11-16 MST. Namun, pada perlakuan BAP
memberikan pengaruh sangat nyata terhadap jumlah tunas adventif pada 11, 12,
13, 15, dan 16 MST dan berpengaruh nyata pada14 MST. Sidik ragam analisis
statistik disajikan pada lampiran 4.
Tabel 5. Rekapitulasi Hasil Uji F Pengaruh 2.4-D, BAP, dan Interaksinya terhadap Jumlah Tunas Adventif pada Eksplan Pucuk dengan Kotiledon Kenaf
Keterangan: tn Tidak berbeda nyata pada taraf uji F 5 % * Berbeda nyata pada taraf uji F 5 % ** Berbeda nyata pada taraf uji F 1 %
x)
Hasil transformasi √x + 0.5 MST Minggu Setelah Tanam
Persentase Hidup Eksplan
Pada percobaan pertama, penurunan persentase hidup rata-rata eksplan
pucuk mulai terjadi pada 5 MST pada perlakuan 0.5 mg/l 2.4-D + 2.0 mg/l BAP.
Persentase hidup rata-rata eksplan pucuk terendah yaitu 33.33 % pada perlakuan
tanpa 2.4-D + 2.0 mg/l BAP. Data dan persentase hidup rata-rata per perlakuan
pada eksplan pucuk kenaf disajikan pada lampiran 5.
Pada percobaan kedua, persentase hidup rata-rata eksplan pucuk dengan
kotiledon terendah yaitu pada perlakuan 0.5 mg/l 2.4-D + 2.0 mg/l BAP dan
0.5 mg/l 2.4-D + 2.0 mg/l BAP sebesar 33.33 %. Penurunan persentase hidup
rata-rata eksplan pucuk dengan kotiledon terjadi pada 6 MST pada perlakuan tanpa
2.4-D + 2.0 mg/l BAP. Data dan persentase hidup rata-rata per perlakuan pada
Percobaan ketiga menunjukkan persentase hidup rata-rata eksplan kotiledon
per perlakuan terendah yaitu pada perlakuan kontrol mencapai 0.00 %. Hal ini
disebabkan ukuran eksplan kotiledon yang besar dan jumlah eksplan yang terlalu
padat yaitu 8 eksplan kotiledon per botol kultur, sehingga apabila terjadi
kontaminasi akan cepat menyebar ke eksplan lain yang steril. Penurunan
persentase eksplan hidup rata-rata pada perlakuan kontrol terjadi pada 11 MST. .
Data dan persentase hidup rata-rata per perlakuan pada eksplan kotiledon kenaf
disajikan pada lampiran 7.
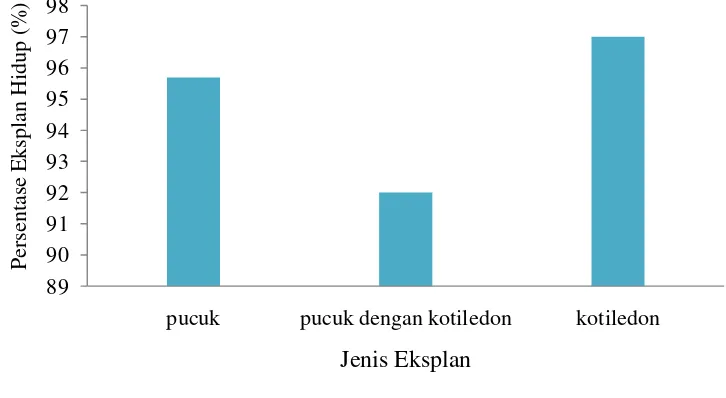
Gambar 3 menunjukkan perbandingan persentase hidup rata-rata pada
masing-masing eksplan. Persentase hidup rata-rata tertinggi pada eksplan
kotiledon yaitu 97 %, diikuti eksplan pucuk dan pucuk dengan kotiledon
masing-masing 95.69 % dan 92 %.
Gambar 3. Perbandingan Persentase (%) Hidup Rata-Rata Eksplan Pucuk, Pucuk dengan Kotiledon, dan Kotiledon Kenaf
Kontaminasi
Pada percobaan pertama menunjukkan kontaminasi pada eksplan pucuk
mulai muncul pada 5 MST. Persentase kontaminasi rata-rata per perlakuan
tertinggi dan terendah berturut-turut adalah 33.33 % pada perlakuan tanpa 2.4-D +
2.0 mg/l BAP, tanpa 2.4-D + 4.0 mg/l BAP, dan 0.5 mg/l 2.4-D + 10.0 mg/l BAP
dan 8.33 % pada perlakuan 1.0 mg/l 2.4-D + 4.0 mg/l BAP. Data dan persentase
rata-rata kontaminasi per perlakuan pada eksplan pucuk kenaf disajikan pada
Pada percobaan kedua, persentase kontaminasi rata-rata per perlakuan
tertinggi dan terendah pada eksplan pucuk dengan kotiledon berturut-turut adalah
100 % pada perlakuan 1.0 mg/l 2.4-D + 2.0 mg/l BAP dan 8.33 % pada perlakuan
0.5 mg/l 2.4-D + 2.0 mg/l BAP. Kontaminasi mulai muncul pada 4 MST. Data
dan persentase rata-rata kontaminasi per perlakuan pada eksplan pucuk dengan
kotiledon kenaf disajikan pada lampiran 9.
Percobaan ketiga, kontaminasi pada eksplan kotiledon mulai muncul pada
10 MST. Persentase kontaminasi rata-rata eksplan kotiledon per perlakuan
tertinggi dan terendah berturut-turut adalah 75 % pada perlakuan kontrol dan
20.83 % pada perlakuan 0.5 mg/l 2.4-D + 2.0 mg/l BAP. Data dan persentase
rata-rata kontaminasi per perlakuan pada eksplan kotiledon kenaf disajikan pada
lampiran 10.
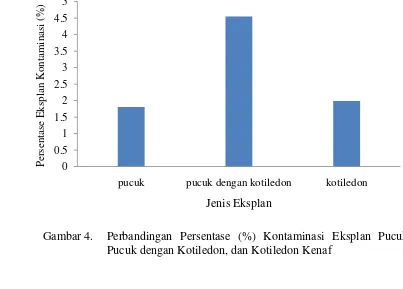
Gambar 4 menunjukkan perbandingan persentase kontaminasi rata-rata pada
masing-masing eksplan. Persentase kontaminasi tertinggi pada eksplan pucuk
dengan kotiledon yaitu 4.55 %, diikuti eksplan kotiledon dan pucuk
masing-masing 1.99 % dan 1.81 %.
Gambar 4. Perbandingan Persentase (%) Kontaminasi Eksplan Pucuk, Pucuk dengan Kotiledon, dan Kotiledon Kenaf
Jenis kontamina
ua perlakuan. Ukuran eksplan yang digunakan
i. Eksplan dengan ukuran yang lebih besar tern
kedalam kondisi in vitro, dan pertumbuhann
nnya, menggunakan eksplan dengan ukuran le
n kultur yang aseptik, dan memerlukan bahan
aktor pembatas dalam keberhasilan kultur j
dapat terjadi setiap saat dalam masa inkubasi kul
kultur jaringan dapat berupa cendawan, bakteri
kungan kerja, alat-alat dan media kultur jaringa
cendawan dicirikan adanya benang hi
i ditandai adanya lapisan lendir di permukaan
ksplan yang tertutup kontaminan akhirnya mat
ri serangan cendawan dan bakteri atau secara
senyawa toksik yang diproduksi oleh cendawan a
gan kontaminasi yang disebabkan cendawa
bar 5.
Pembentukan Kalus
Kalus mulai muncul pada 1 MST untuk semua perlakuan pada eksplan
pucuk dan pucuk dengan kotiledon karena konsentrasi 2.4-D dan BAP yang
digunakan cukup tinggi. Percobaan pertama dengan eksplan pucuk menunjukkan
persentase rata-rata eksplan berkalus tertinggi yaitu 91.56 % kemudian diikuti
percobaan kedua dan ketiga dengan eksplan pucuk dengan kotiledon dan eksplan
kotiledon dengan persentase rata-rata masing-masing yaitu 81.89 % dan 66.24 %.
Persentase rata-rata eksplan berkalus pada ketiga jenis eksplan kenaf disajikan
pada Gambar 6.
Gambar 6. Persentase (%) Rata-Rata Eksplan Berkalus pada Ketiga Jenis Eksplan Kenaf
Kalus yang dihasilkan merupakan tipe kalus friable atau remah yang
dicirikan oleh struktur kalus yang remah. Warna kalus coklat muda dan kalus
tumbuh dari bagian eksplan yang dipotong atau dilukai. Gambar 7 menunjukkan
kalus dari tiga jenis eksplan pucuk, pucuk dengan kotiledon, dan kotiledon.
Gambar 7. Ka Pucuk, (B) Kotiledon, (C) Pucuk dengan Kotile
n kalus pada tanaman dikotil memerlukan auks
i tinggi. McLean, Lawrence, dan Reichert (1992)
ul pada 4 MST dari eksplan internoda batang m
penambahan zat pengatur tumbuh NAA/BAP da
n 3.0 mg/l). Lebih lanjut Purwati, Sudjindro,
bahwa media MS + 0.5 mg/l NAA + 2 mg
Kalus adalah suatu kumpulan sel amorphous yang terjadi dari sel-sel
jaringan yang membelah diri secara terus menerus. Dalam keadaan in vivo, kalus
pada umumnya terbentuk dari bagian luka akibat serangan infeksi
mikroorganisme: Agrobacterium tumifaciens, gigitan atau tusukan serangga dan
nematoda. Kalus juga dapat terbentuk sebagai akibat stres (George & Sherrington,
1984 dalam Gunawan, 1988).
Sel-sel penyusun kalus adalah sel-sel parenkima yang mempunyai ikatan
yang renggang dengan sel-sel lain. Dalam kultur in vitro, kalus dapat dihasilkan
dari potongan organ yang telah steril, didalam media yang mengandung auksin
dan terkadang sitokinin. Kalus dapat diinisiasi dari hampir semua bagian tanaman.
Organ tanaman yang berbeda menunjukkan kecepatan pembelahan sel yang
berbeda pula. Bagian tanaman seperti embrio muda, hipokotil, kotiledon, dan
batang muda, merupakan bagian yang mudah untuk mengalami proses
dediferensiasi dan menghasilkan kalus.
Pembentukan Tunas Adventif
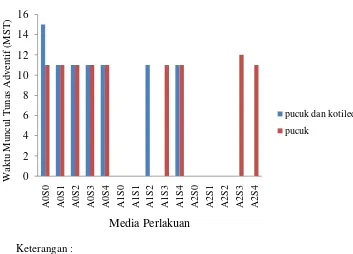
Tunas adventif kenaf dari eksplan pucuk mulai terbentuk pada 11 MST pada
semua perlakuan kecuali 0.5 mg/l 2.4-D + tanpa BAP, 0.5 mg/l 2.4-D + 2.0 mg/l
BAP, 0.5 mg/l D + 4.0 mg/l BAP, 1.0 mg/l D + tanpa BAP, 1.0 mg/l
2.4-D + 2.0 mg/l BAP, 1.0 mg/l 2.4-2.4-D + 4.0 mg/l, tetapi tunas adventif terbentuk pada
12 MST pada perlakuan 1.0 mg/l 2.4-D + 8.0 mg/l BAP.
Tunas adventif kenaf dari eksplan pucuk dengan kotiledon mulai terbentuk
pada 15 MST dari perlakuan kontrol, sedangkan pada perlakuan tanpa 2.4-D +
2.0 mg/l BAP, tanpa 2.4-D + 4.0 mg/l BAP, tanpa 2.4-D + 8.0 mg/l BAP, tanpa
2.4-D + 10.0 mg/l BAP, 0.5 mg/l 2.4-D + 4.0 mg/l BAP, dan 0.5 mg/l 2.4-D +
10.0 mg/l BAP tunas adventif mulai terbentuk 11 MST. Pengaruh zat pengatur
tumbuh 2.4-D dan BAP terhadap waktu muncul tunas adventif kenaf disajikan
Keterangan :
A = 2.4-D (A0 = 0.0 mg/l, A1 = 0.5 mg/l, A2 = 1.0 mg/l)
S = BAP (S0 = 0.0 mg/l, S1 = 2.0 mg/l, S2 = 4.0 mg/l, S3 = 8.0 mg/l, S4 = 10.0 mg/l)
Gambar 8. Pengaruh 2.4 D dan BAP terhadap Waktu Muncul Tunas Adventif pada Kenaf Secara In vitro
Percobaan I. Eksplan Pucuk
Tunas adventif kenaf pada percobaan pertama dihasilkan dari semua
perlakuan kecuali pada perlakuan 0.5 mg/l 2.4-D + tanpa BAP, 0.5 mg/l 2.4-D +
2.0 mg/l BAP, 0.5 mg/l 2.4-D + 4.0 mg/l BAP, 1.0 mg/l 2.4-D + tanpa BAP, 1.0
mg/l 2.4-D + 2.0 mg/l BAP, dan 1.0 mg/l 2.4-D + 4.0 mg/l BAP. Jumlah rata-rata
tunas adventif tertinggi dihasilkan pada perlakuan tanpa 2.4-D + 8.0 mg/l BAP,
yaitu 2.92, sedangkan jumlah rata-rata tunas adventif terendah dihasilkan dari
perlakuan 1.0 mg/l 2.4-D + 8.0 mg/l BAP, yaitu 0.08. Jumlah rata-rata tunas
adventif kenaf eksplan pucuk kenaf disajikan pada Gambar 9.
Keterangan :
A = 2.4-D (A0 = 0.0 mg/l, A1 = 0.5 mg/l, A2 = 1.0 mg/l)
S = BAP (S0 = 0.0 mg/l, S1 = 2.0 mg/l, S2 = 4.0 mg/l, S3 = 8.0 mg/l, S4 = 10.0 mg/l)
Gambar 9. Jumlah Rata-Rata Tunas Adventif pada Eksplan Pucuk Kenaf
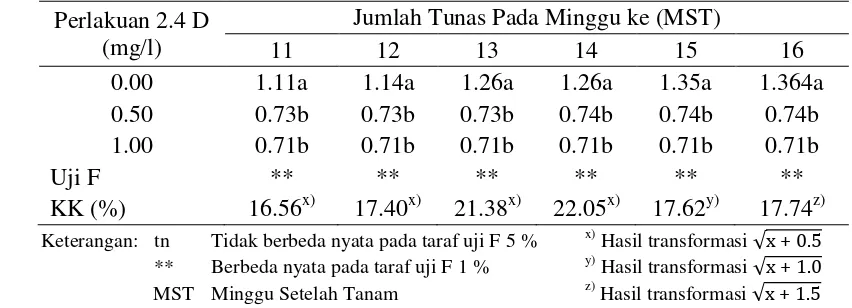
Perlakuan 2.4-D dengan eksplan pucuk berpengaruh sangat nyata terhadap
jumlah tunas adventif pada minggu ke 11 MST sampai 16 MST. Jumlah tunas
adventif terbanyak dihasilkan dari perlakuan tanpa 2.4-D. Pengaruh 2.4-D
terhadap jumlah tunas adventif disajikan pada Tabel 6, hasil sidik ragam disajikan
pada lampiran 3.
Tabel 6. Pengaruh 2.4-D terhadap Jumlah Tunas Adventif pada Eksplan Pucuk Kenaf
Perlakuan 2.4-D (mg/l)
Jumlah Tunas Pada Minggu ke (MST)
11 12 13 14 15 16
Perlakuan BAP dengan eksplan pucuk berpengaruh sangat nyata terhadap
jumlah tunas adventif pada minggu ke-12, 14, 15, dan 16 MST. Pelakuan BAP
berpengaruh nyata terhadap jumlah tunas adventif pada minggu ke-13 MST tetapi
tidak berpengaruh nyata terhadap jumlah tunas adventif pada minggu ke-11 MST.
Pengaruh BAP terhada
hadap jumlah tunas adventif disajikan pada Tab
da lampiran 3.
ngaruh BAP terhadap Jumlah Tunas Adventi ucuk Kenaf
menunjukkan bahwa tunas adventif terbentuk
alus yang terbentuk berasal dari jaringan
uka kemudian kontak dengan media.
Tunas Adventif dari Eksplan Pucuk Kenaf Tanpa 2.4-D + 4.0 mg/l BAP Umur 16 MST
plan Pucuk dengan Kotiledon
ntif kenaf pada percobaan kedua dihasilkan
+ 2.0 mg/l BAP, tanpa 2.4-D + 4.0 mg/l BAP
npa 2.4-D + 10.0 mg/l BAP, 0.5 mg/l 2.4-D + 4.0
10.0 mg/l BAP. Jumlah rata-rata tunas adv
rlakuan tanpa 2.4-D + 10.0 mg/l BAP, yaitu 2.33
unas adventif terendah dihasilkan dari perla
2.4-D + 4.0 mg/l BAP dan 1.0 mg/l 2.4-D + 10.0 mg/l BAP, yaitu 0.08. Jumlah
rata-rata tunas adventif kenaf eksplan pucuk dengan kotiledon kenaf disajikan
pada Gambar 11.
Keterangan :
A = 2.4-D (A0 = 0.0 mg/l, A1 = 0.5 mg/l, A2 = 1.0 mg/l)
S = BAP (S0 = 0.0 mg/l, S1 = 2.0 mg/l, S2 = 4.0 mg/l, S3 = 8.0 mg/l, S4 = 10.0 mg/l)
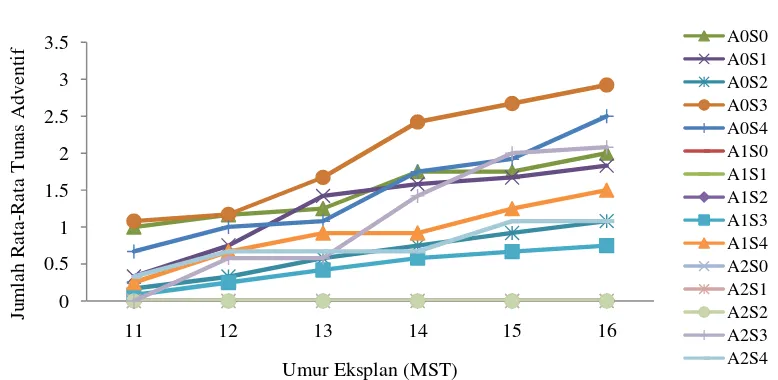
Gambar 11. Jumlah Rata-Rata Tunas Adventif pada Eksplan Pucuk
dengan Kotiledon Kenaf
Perlakuan 2.4-D terhadap eksplan pucuk dengan kotiledon memberikan
pengaruh sangat nyata terhadap jumlah tunas adventif kenaf pada 11 MST sampai
16 MST. Jumlah tunas adventif terbanyak dihasilkan pada perlakuan tanpa 2.4-D.
Pengaruh 2.4-D terhadap jumlah tunas adventif disajikan pada Tabel 8, hasil sidik
ragam disajikan pada lampiran 4.
Tabel 8. Pengaruh 2.4-D terhadap Jumlah Tunas Adventif pada Eksplan Pucuk dengan Kotiledon Kenaf
Perlakuan 2.4 D (mg/l)
Jumlah Tunas Pada Minggu ke (MST)
Perlakuan BAP dengan eksplan pucuk dengan kotiledon berpengaruh sangat
nyata terhadap jumlah tunas adventif pada minggu ke-11, 12, 13, 15, dan 16 MST
dan berpengaruh nyata terhadap jumlah tunas adventif hanya pada minggu ke-14
MST. Jumlah tunas adventif terbanyak dihasilkan pada perlakuan 2.0 mg/l BAP.
Pengaruh BAP terhadap jumlah tunas adventif disajikan pada Tabel 9. Sidik
ragam analisis statistik disajikan pada lampiran 4.
Tabel 9. Pengaruh BAP terhadap Jumlah Tunas Adventif pada Eksplan Pucuk dengan Kotiledon Kenaf
Perlakuan BAP (mg/l)
Jumlah Tunas Pada Minggu ke (MST)
11 12 13 14 15 16
0.00 0.71b 0.71c 0.71c 0.71c 0.71d 0.73d
2.00 0.85ab 0.89ab 1.12ab 1.22a 1.39a 1.39a
4.00 0.85ab 0.86abc 0.92bc 0.95bc 0.99bc 0.99bc
8.00 0.82b 0.82bc 0.84c 0.84c 0.84cd 0.84cd
10.00 0.99a 1.00a 1.15a 1.15ab 1.15b 1.15b
Uji F ** ** ** * ** **
KK (%) 16.56x) 17.40x) 21.38x) 22.05x) 17.62y) 17.74z)
Keterangan: tn Tidak berbeda nyata pada taraf uji F 5 % x) Hasil transformasi √x + 0.5 ** Berbeda nyata pada taraf uji F 1 % y) Hasil transformasi √x + 1.0 MST Minggu Setelah Tanam z) Hasil transformasi √x + 1.5
Gambar 12 menunjukkan bahwa tunas adventif terbentuk dari jaringan
eksplan pucuk dengan kotiledon. Kalus yang terbentuk berasal dari jaringan
tanaman yang terpotong atau terluka kemudian kontak dengan media. Terdapat
daun pada tunas adventif yang mengalami senescence.
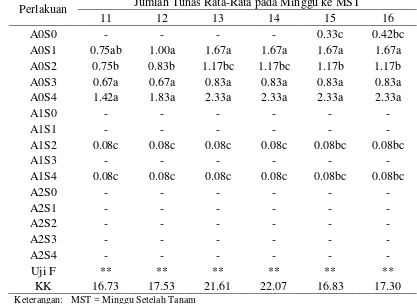
Tabel 10. Interaksi 2.4-D dan BAP terhadap Jumlah Tunas Adventif Kenaf pada Eksplan Pucuk dengan Kotiledon
Perlakuan Jumlah Tunas Rata-Rata pada Minggu ke MST
11 12 13 14 15 16
Keterangan: MST = Minggu Setelah Tanam
** Berbeda nyata pada uji lanjut DMRT pada taraf 1 % A = 2.4-D (A0 = 0.0 mg/l, A1 = 0.5 mg/l, A2 = 1.0 mg/l)
S = BAP (S0 = 0.0 mg/l, S1 = 2.0 mg/l, S2 = 4.0 mg/l, S3 = 8.0 mg/l, S4 = 10.0 mg/l)
Interaksi 2.4-D dan BAP menunjukkan pengaruh yang sangat nyata terhadap
jumlah tunas adventif. Hasil analisis menunjukkan bahwa interaksi tanpa 2.4-D
dengan BAP pada konsentrasi yang semakin tinggi menghasilkan jumlah tunas
adventif per eksplan yang tinggi. Jumlah tunas adventif paling tinggi dihasilkan
dari kombinasi tanpa 2.4-D + 2.0 mg/l BAP yaitu 2.33. Hal sebaliknya terjadi
apabila interaksi 2.4-D pada konsentrasi tinggi yaitu 1.0 mg/l dengan BAP pada
konsentrasi yang semakin tinggi cenderung menghasilkan jumlah tunas adventif
yang rendah. Jumlah tunas adventif paling rendah dihasilkan adalah 0.08.
Interaksi 2.4-D dan BAP terhadap jumlah tunas adventif kenaf pada eksplan
pucuk dengan kotiledon disajikan pada Tabel 10, sedangkan hasil sidik ragam
Percobaan III. Eksplan Kotiledon
Tunas adventif tidak terbentuk dari percobaan ketiga menggunakan
eksplan kotiledon kenaf sampai minggu ke-16.
Pengaruh faktor tunggal 2.4-D atau BAP terhadap jumlah tunas adventif
kenaf menunjukkan kontradiksi. Peningkatan jumlah konsentrasi 2.4-D pada
berbagai perlakuan, cenderung menurunkan jumlah tunas adventif kenaf.
Sementara itu, peningkatan konsentrasi BAP memiliki korelasi positif dengan
peningkatan jumlah tunas adventif kenaf. Jumlah tunas adventif kenaf meningkat
seiring dengan penambahan konsentrasi BAP.
Dalam percobaan ini, tunas adventif hanya terbentuk pada eksplan pucuk
dan pucuk dengan kotiledon. Tunas adventif langsung terbentuk dari jaringan
eksplan dan tidak berkembang dari kalus. Pembentukan tunas secara langsung dari
jaringan umumnya terjadi pada tanaman dikotil, namun tidak umum pada tanaman
monokotil (Gunawan, 1992). Pembentukan tunas secara langsung ini bergantung
pada bagian tanaman yang digunakan sebagai eksplan dan spesies tanaman yang
dikulturkan. Pada beberapa spesies, tunas adventif dapat terbentuk dari berbagai
organ tanaman seperti daun, batang, petal, atau akar; sementara pada spesies yang
lainnya dari organ-organ tertentu seperti embrio atau kecambah.
Pembentukan tunas adventif memerlukan sitokinin dalam konsentrasi yang
tinggi tetapi diperlukan juga auksin dalam konsentrasi yang rendah. Morfogenesis
akar dan tunas dipengaruhi oleh nisbah auksin dan sitokinin. Nisbah
auksin-sitokinin yang tinggi akan mendorong organogenesis akar, sebaliknya nisbah
sitokinin yang tinggi akan mendorong pembentukan tunas. Konsentrasi yang
diperlukan dari masing-masing ZPT tersebut (auksin dan sitokinin) tergantung
dari: jenis eksplan, genotipe, kondisi kultur serta jenis auksin dan sitokinin yang
dibutuhkan.
Multiplikasi tunas merupakan salah satu metode yang dapat dilakukan
dalam perbanyakan tanaman secara in vitro. Multiplikasi tunas dapat diinduksi
dari mata tunas aksilar ataupun dari benih yang ditanam pada media yang
mengandung sitokinin. Tahapan dalam perbanyakan melalui multiplikasi tunas
secara langsung diawali dengan tahap inisiasi yang dilanjutkan dengan tahap
tanpa melalui pemindahan ke media yang baru. Tahap selanjutnya adalah
pengakaran tunas adventif yang telah dihasilkan untuk mendapatkan planlet.
Perbanyakan melalui multiplikasi tunas merupakan metode yang paling banyak
digunakan dalam perbanyakan tanaman secara in vitro karena selain cepat juga
memiliki peluang yang kecil untuk terjadinya penyimpangan secara genetik
(Wiendi et al., 1992).
Perbanyakan tanaman secara in vitro terdapat faktor-faktor yang
mempengaruhi pertumbuhan dan morfogenesis tanaman, diantaranya:
1. Genotipe dari sumber bahan tanaman yang digunakan.
2. Fisiologi jaringan tanaman yang digunakan sebagai eksplan.
3. Media yang mencakup unsur makro dan mikro serta zat pengatur
tumbuh yang diperlukan tanaman.
4. Lingkungan tumbuh, yaitu keadaan fisik tempat kultur ditumbuhkan.
Keempat faktor tersebut saling berinteraksi dan harus bersinergi satu dengan
lainnya sehingga dapat menghasilkan pertumbuhan dan perkembangan optimal
dan diperoleh tanaman lengkap (Wiendi et al., 1992).
Induksi tunas adventif secara langsung dari akar, daun, dan organ lain dari
tanaman merupakan metode yang umum digunakan dalam perbanyakan tanaman
secara in vitro. Eksplan hasil pemotongan bagian tanaman mampu diinduksi
membentuk tunas adventif. Tunas adventif dapat berkembang secara langsung
dari eksplan itu sendiri atau secara tidak langsung melalui pembentukan kalus
terlebih dahulu. Pembentukan tunas adventif secara umum menghasilkan rataan
multiplikasi yang lebih tinggi dibandingkan dari tunas samping (Hartmann dan
Kester, 1983).
Multiplikasi merupakan suatu tahap dalam perbanyakan tanaman secara in
vitro yang bertujuan meningkatkan jumlah propagula tanaman yang kemudian
diakarkan sehingga menghasilkan tanaman lengkap. Multiplikasi tunas vegetatif
bergantung pada pembentukan tunas samping atau tunas adventif dari jaringan
bagian dasar tunas yang membentuk kalus. Multiplikasi akan terus terjadi dengan
interval yang tetap dan pada tahap yang berurutan. Kemampuan untuk
multiplikasi tunas dipengaruhi spesies tanaman dan metode perbanyakan tanaman