EFEKTIVITAS STERILISASI AUTOKLAF PADA
PENGGUNAAN INSTRUMEN MEDIS DI
DEPARTEMEN BEDAH MULUT
FKG USU PERIODE
JANUARI – MARET
2015
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi
syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh:
AYESHA ADISTI ASBI NIM: 110600048
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
Fakultas Kedokteran Gigi
Departemen Bedah Mulut dan Maksilofasial
Tahun 2015
Ayesha Adisti Asbi
Efektivitas Sterilisasi Autoklaf Pada Penggunaan Instrumen Medis di
Departemen Bedah Mulut FKG USU Periode Januari – Maret 2015
x + 48 halaman
Sterilisasi merupakan tindakan untuk membunuh dan menghilangkan segala
bentuk mikroorganisme termasuk spora dengan prosedur fisik atau kimia. Salah satu
tujuan sterilisasi di bidang kesehatan adalah untuk mencegah terjadinya infeksi silang
melalui mikroorganisme yang terdapat pada darah, saliva dan plak gigi yang dapat
mengkontaminasi instrumen. Instrumen bedah yang sering secara langsung berkontak
dengan bagian dalam tubuh manusia memiliki risiko menularkan penyakit oleh
mikroorganisme yang sangat tinggi sehingga sangat penting untuk menjaga sterilitas
dari instrumen tersebut. Tujuan dari penelitian ini adalah untuk mengetahui
efektivitas sterilisasi melalui perbedaan jumlah bakteri pada instrumen medis di
Departemen Bedah Mulut FKG USU dengan menggunakan autoklaf.
Penelitian ini merupakan penelitian eksperimental yang dilakukan dengan cara
memberikan perlakuan terhadap sampel yang akan digunakan yaitu terhadap
instrumen medis sebelum digunakan, perlakuan terhadap instrumen medis setelah
digunakan, dan perlakuan terhadap instrumen medis setelah disterilisasi dengan
menggunakan autoklaf. Hasil penelitian menunjukkan bahwa pertumbuhan bakteri
meningkat setelah selesai digunakan dan mengalami penurunan kembali setelah
tindakan sterilisasi instrumen medis dengan menggunakan autoklaf efektif dalam
menurunkan jumlah bakteri pada instrumen.
EFEKTIVITAS STERILISASI AUTOKLAF PADA
PENGGUNAAN INSTRUMEN MEDIS DI
DEPARTEMEN BEDAH MULUT
FKG USU PERIODE
JANUARI – MARET
2015
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi
syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh:
AYESHA ADISTI ASBI NIM: 110600048
Pembimbing:
RAHMI SYAFLIDA, drg., Sp.BM
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
PERNYATAAN PERSETUJUAN
Skripsi ini telah disetujui untuk dipertahankan
di hadapan tim penguji skripsi
Medan, 24 April 2015
Pembimbing : Tanda Tangan
Rahmi Syaflida, drg., Sp.BM ……….
TIM PENGUJI SKRIPSI
Skripsi ini telah dipertahankan di hadapan tim penguji
pada tanggal 24 April 2015
TIM PENGUJI
KETUA : Abdullah, drg
ANGGOTA : 1. Rahmi Syaflida, drg., Sp.BM
2. Indra Basar Siregar, drg., M.Kes
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah atas segala rahmat dan karunia
yang tak terhingga yang diberikan kepada penulis sehingga dapat menyelesaikan
skripsi yang merupakan salah satu syarat untuk mendapatkan gelar Sarjana
Kedokteran Gigi di Fakultas Kedokteran Gigi Universitas Sumatera Utara.
Rasa terima kasih yang tak terhingga penulis sampaikan kepada kedua orang
tua tersayang, Ayahanda Edy Effendy dan Ibunda Indrati Asbi, yang senantiasa
menyayangi, mendoakan dan mendukung penulis sehingga penulis dapat mengecap
masa pendidikan hingga selesai di Fakultas Kedokteran Gigi Univesitas Sumatera
Utara Medan.
Dalam penulisan skripsi ini, penulis juga telah banyak mendapat bimbingan,
bantuan, motivasi, saran-saran serta doa dari berbagai pihak. Oleh karena itu, dengan
kerendahan hati serta penghargaan yang tulus penulis mengucapkan terima kasih
kepada:
1. Eddy A. Ketaren, drg., Sp.BM selaku Ketua Departemen Bedah Mulut dan
Maksilofasial Fakultas Kedokteran Gigi Universitas Sumatera Utara atas segala
dukungan dan bantuan yang diberikan kepada penulis
2. Rahmi Syaflida, drg., Sp.BM selaku dosen pembimbing skripsi yang telah
berbaik hati meluangkan banyak waktu, tenaga dan pikirannya dalam memberikan
bimbingan, arahan, saran dan motivasi kepada penulis selama proses penyelesaian
skripsi ini.
3. Rehulina Ginting, drg., M.Si selaku dosen pembimbing akademik atas
segala bantuan yang diberikan kepada penulis selama menjalani pendidikan di FKG
USU.
4. M. Zulkarnain, drg., M.Kes., selaku Pembantu Dekan I FKG USU yang
5. Abang – adik yang disayangi, Ardiansyah Asbi dan Aisha Anindi Asbi serta
keluarga besar Syahrial dan Asbi yang selalu menghibur dan membantu dengan
penuh keikhlasan.
6. Terima kasih kepada seluruh teman yang sudah memberi dukungan selama
penulis menjalani pendidikan dan selama menyelesaikan penelitian ini.
Penulis menyadari penulisan skripsi ini masih jauh dari sempurna karena
keterbatasan ilmu yang penulis miliki, namun penulis mengharapkan kiranya hasil
karya sederhana ini dapat memberikan sumbangan pikiran yang berguna bagi
fakultas, pengembangan ilmu dan masyarakat.
Medan, 24 April 2015 Penulis,
DAFTAR ISI
Halaman
HALAMAN JUDUL……… i
HALAMAN PERSETUJUAN………. ii
HALAMAN TIM PENGUJI SKRIPSI……… iii
KATA PENGANTAR……….. iv
DAFTAR ISI……… vi
DAFTAR TABEL……… viii
DAFTAR GAMBAR………... ix
DAFTAR LAMPIRAN……… xi
BAB 1 PENDAHULUAN 1.1 Latar Belakang..……… 1
1.2 Rumusan Masalah……..………... 3
1.3 Tujuan Penelitian……...………... 3
1.4 Manfaat Penelitian………...………. 3
BAB 2 TINJAUAN PUSTAKA 2.1 Pendahuluan………... 5
2.2 Infeksi Silang dalam Kedokteran Gigi………..……. 5
2.2.1 Jalur Penyebaran Infeksi………….…….……… 5
2.2.2 Kontrol Infeksi di Kedokteran Gigi…..……….. 7
2.2.3 Instrumen Kedokteran Gigi...……….. 7
2.3 Sterilisasi Dalam Kedokteran Gigi……...……….. 9
2.3.1 Definisi Sterilisas.…..……….. 9
2.3.2 Metode Sterilisasi……...……… 9
2.3.2.1 Autoklaf…...……… 10
2.3.2.2 Dry-heat ...……….. 11
2.3.2.3 Khemiklaf……….. 11
2.3.2.4 Etilen Oksida ... 12
2.5 Mikroorganisme dalam Rongga Mulut... 15
2.5.1 Streptokokus mutans ………....………... 16
2.5.2 Stafilokokus sp... ………....………... 16
2.5.3 Laktobasilus sp …...………....………... 17
2.5.4 Kandida albikans.... ………....………... 17
2.6 Kerangka Teori ...………....………... 18
2.7 Kerangka Konsep ...………....………... 19
BAB 3 METODOLOGI PENELITIAN 3.1 Jenis Rancangan Penelitian……….……… 20
3.2 Lokasi dan Waktu Penelitian………..……… 20
3.2.1 Lokasi…...…………..……… 20
3.2.2 Waktu Penelitian………...……… 20
3.3 Sampel Penelitian…...………... 20
3.4 Variabel Penelitian dan Definisi Operasional………. 21
3.5 Alat dan Bahan Penelitian...………... 22
3.5.1 Alat...………... 22
3.5.2 Bahan Penelitian...………...…………... 23
3.6 Prosedur Penelitian...………. 23
3.6.1 Prosedur Pengambilan Sampel...……….………. 23
3.6.2 Prosedur Pembuatan Media PCA...……...………. 27
3.6.3 Prosedur Pembuatan Garam Fisiologis...…..………. 28
3.6.4 Sterilisasi Petri...………...….………. 29
3.6.5 Pengenceran dan Persiapan Media...……….………. 29
3.6.6 Perhitungan Jumlah Mikroorganisme. …..……….………. 33
3.6.7 Pembuatan Biakan Murni... ……….………. 33
3.6.8 Pewarnaan dan Pengamatan Bakteri... 34
3.7 Alur Penelitian...……….………. 36
DAFTAR PUSTAKA……..……….. 45
DAFTAR TABEL
Tabel Halaman
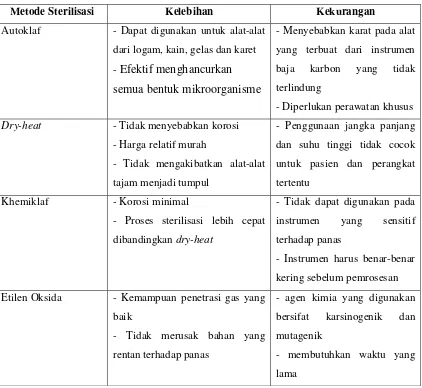
1. Kelebihan dan kekurangan metode sterilisasi ………... 13
2. Jumlah koloni bakteri sebelum dan sesudah autoklaf... 39
3. Sterilitas sampel instrumen bedah mulut dengan autoklaf... 39
4. Hasil perhitungan uji normalitas... 40
DAFTAR GAMBAR
Gambar Halaman
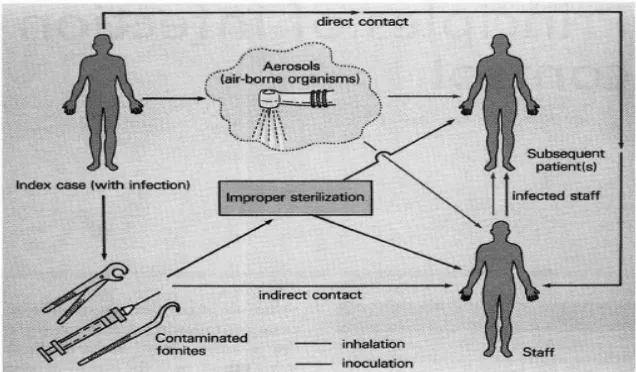
1. Jalur penularan infeksi yang dapat terjadi di klinik... 6
2. Instrumen yang digunakan sebagai sampel ... 24
3. Bulyon dimasukkan kedalam pot sebanyak 10ml... 24
4. Instrumen dicelup ke bulyon sebelum digunakan ... 25
5. Bulyon diberi label A... ... 25
6. Instrumen yang selesai digunakan dicelup ke bulyon ... 25
7. Bulyon diberi label B ... ... 25
8. Instrumen dicuci bersih ... 26
9. Instrumen dibungkus rapat di medi-pack... 26
10.Instrumen disterilkan menggunakan autoklaf... 26
11.Instrumen dikeluarkan dari medi-pack... 26
12.Instrumen dicelup ke bulyon setelah diautoklaf... 27
13.Bulyon diberi label C... 27
14.PCA dipanaskan diatas hotplate sambil diaduk... 27
15.Penimbangan NaCl... 28
16.Pelarutan bubuk NaCl... 28
17.Penuangan Nacl ke masing-masing tabung reaksi... 28
18.Tabung reaksi setelah ditutup kapas dan plastic wrap... 28
19.Sterilisasi bahan di autoklaf... 29
20.Cawan petri dibungkus kertas ... 29
21.Sterilisasi cawan petri menggunakan oven... 29
22.Pengambilan sampel... 30
23.Sampel dicampur ketabung rekasi... 30
25.Tabung reaksi dengan pengenceran 10-1, 10-2, 10-3... 31
26.Ujung petri dibakar dengan spiritus... 31
27.Masukkan 10ml sampel kedalam petri... 31
28.Tuang media PCA kedalam petri... 32
29.Petri digerak melingkar perlahan agar tercampur rata... 32
30.Petri yang sudah diberi label... 33
31.Petri dibungkus rapat dengan menggunakan plastic-wrap... 33
32.Petri di inkubasi didalam inkubator selama 24 jam... 33
33.NA... 34
34.Pengambilan bakteri menggunakan ose... 34
35.Hasil biakan murni dengan teknik goresan ... 34
36.Pembuatan preparat ulas... 35
37.Pemberian Kristal Violet... 35
38.Pemberian Iodin... 35
39.Pembilasan dengan Aseton Alkohol... 35
40.Pemberian Safranin... 35
41.Koloni bakteri pada instrumen... 38
42.Bakteri gram negatif... 43
DAFTAR LAMPIRAN
Lampiran
1. Daftar Riwayat Hidup
2. Biaya Penelitian
3. Jadwal Kegiatan
4. Gambar Hasil Penelitian
BAB 1 PENDAHULUAN
1.1 Latar Belakang Masalah
Penularan infeksi dapat terjadi melalui kontak langsung dengan pasien
maupun tidak langsung. Udara merupakan salah satu agen infeksi yang menyebabkan
infeksi silang.1 Infeksi silang dalam kedokteran gigi secara tidak langsung dapat melalui mikroorganisme yang terdapat pada darah, saliva, dan plak gigi yang dapat
mengkontaminasi tangan dari orang-orang yang bekerja dalam bidang kedokteran
gigi. Mikroorganismeini juga dapat mengkontaminasi instrumen dan menyebabkan
infeksi silang pada peralatan kedokteran gigi yang telah digunakan, akan tetapi
instrumen tersebut disterilisasi dengan cara yang tidak tepat dan digunakan
kembali.2,3
Dalam penggunaannya instrumen dental sering berkontaminasi dengan saliva
maupun darah.4 Selain itu dalam menjalankan profesinya dokter gigi juga tidak terlepas dari kemungkinan untuk berkontak secara langsung maupun tidak langsung
dengan mikroorganisme dan saliva dalam darah penderita.5 Instrumen bedah yang sering secara langsung berkontak dengan bagian dalam tubuh manusia memiliki
resiko menularkan penyakit oleh mikroorganisme yang sangat tinggi sehingga sangat
penting untuk menjaga sterilitas dari instrumen tersebut.6,7 Setiap instrumen dan peralatan kedokteran gigi yang telah digunakan sebaiknya disterilisasi setiap selesai
melakukan prosedur perawatan.3
Sterilisasi merupakan tindakan untuk membunuh dan menghilangkan segala
bentuk mikroorganisme termasuk spora dengan prosedur fisik atau kimia.3Salah satu tujuan sterilisasi di bidang kesehatan adalah untuk mencegah terjadinya infeksi
silang. Dalam kedokteran gigi, hal itu penting untuk mencegah infeksi silang terkait
pada potensi risiko infeksi yang terkait dengan tujuan penggunaannya.Instrumen
kritis yang digunakan menembus jaringan lunak atau tulang memiliki risiko terbesar
penularan infeksi dan harus disterilisasi dengan panas. Sedangkan instrumen
semikritis yang menyentuh selaput lendir atau kulit memiliki risiko penularan yang
lebih rendah sehingga minimal dapat diproses dengan disinfeksi tingkat tinggi.9 Semua instrumen gigi terdiri dari tiga bagian yaitu pegangan, tangkai dan sisi aktif
alat. Dimana bagian yang berpaparan langsung pada jaringan lunak ataupun selaput
yaitu pada bagian aktif alat seperti beak pada tang ataupun blade pada elevator.10 Menurut Schrock pada tahun 1991, metode lengkap suatu sterilisasi dengan
penggunaan luas hanya gas dengan tekanan (autoklaf), pemanasan kering dan gas
etilen oksida. Perebusan serta perendaman dalam antiseptika dapat dilakukan bila
alat-alat tak dapat disterilkan dengan autoklaf, pemanasan kering, dan sterilisasi
dengan gas.11 Pertimbangan dalam memilih metode pembersihan dan peralatan mencakup efisiensi metode, proses, dan peralatan, kompatibilitas dengan barang yang
akan dibersihkan dan pekerjaan kesehatan dan risiko terpapar.9
Proses sterilisasi dan penyimpanan alat yang digunakan untuk perawatan gigi
penting untuk diperhatikan. Perlu dilakukan uji sterilitas secara berkala untuk melihat
terdapatnya kontaminasi pada instrumen yang sudah disterilisasi terutama yang
digunakan berulang kali. Instrumen yang sudah disterilisasi dapat dikatakan
benar-benar steril jika dilakukan uji sterilitas yang menunjukkan bahwa proses sterilisasi
dapat membunuh seluruh bakteri dan spora.12
Beberapa penelitian berpendapat bahwa autoklafmerupakan metode sterilisasi
yang banyak dipilih oleh tenaga kesehatan karena memberikan hasil yang paling baik
dalam menghilangkan segala bentuk mikroorganisme. Penelitian yang dilakukan oleh
Anggia di Universitas Indonesia tahun 2012 mengenai efektivitas berbagai metode
sterilisasi menunjukkan bahwa autoklaf merupakan metode sterilisasi terbaik karena
memberikan hasil dengan jumlah bakteri yang paling minimal.13 Selain itu dalam penelitian yang dilakukan oleh Florence dalam sterilisasi alat bedah mulut di bagian
Bedah Mulut dan Maksilofasial Rumah Sakit Hasan Sadikin Bandung menunjukkan
sterilisasi dengan menggunakan autoklaf masih memiliki kelemahan seperti membuat
korosi alat yang terbuat dari logam non stainless steel serta tidak bisa membunuh bakteri berukuran lebih kecil yang melekat di alat kedokteran gigi. Dibutuhkan
penggunaan sinar gamma untuk membunuh mikroorganisme yang berukuran lebih
kecil dan resisten terhadap panas seperti nanobakteri.15
Departemen Bedah Mulut FKG USU memiliki tenaga kesehatan yang terdiri
dari dokter gigi spesialis, dokter gigi umum, dan ko-as. Instrumen yang digunakan
merupakan alat yang dapat dipakai berulang kali. Sebagai suatu tindakan kontrol
infeksi, alat-alat tersebut harus disterilisasi sebagai prosedur standard precaution
setiap selesai digunakan. Berdasarkan hasil uraian di atas, peneliti tertarik untuk
melakukan penelitian mengenai efektivitas sterilisasi autoklaf pada penggunaan
instrumen medis di Departemen Bedah Mulut FKG USU periode Januari - Maret
2015.
1.2 Perumusan Masalah
Berdasarkan latar belakang yang telah diuraikan, maka dapat dirumuskan
permasalahanyaitu apakah ada perbedaan efek sterilisasi pada instrumen medis yang
digunakan di Departemen Bedah Mulut FKG USU sebelum dan setelah menggunakan
autoklaf.
1.3 Tujuan Penelitian
Tujuan yang ingin dicapai dari penelitian ini yaitu untuk mengetahui
efektivitas sterilisasi melalui perbedaan jumlah bakteri pada instrumen sebelum
1.4 Manfaat Penelitian
Dengan mengetahui perbedaan efek sterilisasi autokklaf pada instrumen medis
yang digunakan di Departemen Bedah Mulut FKG USU, maka diharapkan:
1. Hasil penelitian diharapkan dapat memberikan informasi dan sumbangan
ilmu pengetahuan khususnya kepada Departemen Bedah Mulut FKG-USU mengenai
efektivitas dari sterilisasi dengan autoklaf.
2. Hasil penelitian ini diharapkan dapat memberi kontribusi dalam ilmu
pengetahuan sebagai usaha pencegahan infeksi silang di Departemen Bedah Mulut
FKG USU.
3. Dapat memberikan manfaat perlindungan bagi pasien dan tenaga medis
untuk mencegah terjadinya kontaminasi silang.
4. Dapat menambah wawasan bagi peneliti pada khususnya bagi para dokter
gigi dan instansi lainnya berkaitan dengan berbagai macam teknik sterilisasi alat
BAB 2
TINJAUAN PUSTAKA
2.1 Pendahuluan
Adanya penyakit infeksi yang disebabkan mikroorganisme tentunya
menimbulkan keinginan manusia untuk meneliti dan berusaha mencegah atau
mengurangi angka kejadiannya, salah satu cara yang dikembangkan adalah melalui
prosedur sterilisasi. Prosedur ini merupakan suatu kewajiban dirumah sakit. Melalui
prosedur ini diharapkan mikroorganisme yang terdapat pada alat-alat kedokteran gigi
yang digunakan dapat dihilangkan atau diminimalkan jumlahnya.11 Sehingga, hal ini dapat menjadi salah satu usaha pencegahan infeksi silang di bidang medis.
2.2 Infeksi Silang dalam Kedokteran Gigi
Infeksi dapat timbul dikarenakan beberapa penyebab salah satunya
mikroorganisme yang bersifat patogen seperti bakteri, virus, jamur, dan lain-lain.
Mikroorganisme sebagai makhluk hidup harus terus berkembang biak, dan berpindah
tempat untuk bertahan hidup.16 Infeksi silang adalah transmisi dari agen infeksi dan operator dalam lingkungan klinis. Infeksi silang dapat terjadi melalui jalur sebagai
berikut yaitu antara pasien, dokter gigi beserta staf, instrumen dan udara.
Mikroorganisme banyak sekali terdapat dirumah sakit atau klinik, karena disanalah
pusat orang sakit yang mungkin saja membawa mikroorganisme yang
membahayakan. Rumah sakit sebagai unit pelayanan medis tentu tak lepas dari
2.2.1 Jalur Penyebaran Infeksi
Apabila tindakan kontrol infeksi tidak dilakukan maka akan terjadi penularan
infeksi melalui jalur penularan infeksi sebagai berikut:
Gambar 1.Jalur penularan infeksi yang dapat terjadi di klinik3
Cara penularan infeksi seperti pada gambar:3
1. Kontak langsung dari jaringan dengan cairan atau darah
2. Droplets yang mengandung mikroorganisme infeksi
3. Terkontaminasi benda tajam dan instrumen yang disterilkan dengan cara
yang tidak benar.
Transmisi bisa terjadi dari kontak antar orang atau melalui objek yang
terkontaminasi.3 Umumnya suatu infeksi terjadi apabila terdapat inang yang sensitif, adanya mikroorganisme patogen dengan daya infeksi yang cukup dan jalur masuk
yang sesuai.3 Menurut Miller dan Palenik pada tahun 2010, infeksi tidak akan terjadi bila daya tahan tubuh tinggi, virulensi dan jumlah bakteri rendah. Penularan
mikroorganisme penyebab infeksi terbagi tiga yaitu infeksi silang yang disebabkan
karena mikroorganisme yang didapat dari orang lain secara langsung atau tidak
disebabkan oleh bakteri dari benda atau instrumen di lingkungan klinik serta air yang
digunakan dan infeksi dari diri sendiri ( self infection).1
2.2.2 Kontrol infeksi di kedokteran gigi
Dokter gigi dan semua tenaga kesehatan di bidang kedokteran gigi diharapkan
selalu mengasumsikan bahwa setiap pasien yang datang berpotensi membawa suatu
infeksi.12 Rongga mulut pasien merupakan sumber utama penyebab infeksi. Berbagai jenis bakteri, virus dan jamur berpotensi ditularkan dalam prosedur perawatan gigi.
Cara yang paling aman untuk mencegah penyebaran infeksi adalah dengan
melakukan tindakan standard precautions untuk kontrol infeksi. Kontrol infeksi adalah semua cara yang dilakukan untuk mencegah penularan mikroorganisme yang
berpotensi patogen.12
Pelaksanaan pencegahan infeksi ini dilakukan dengan prosedur:3 1. Evaluasi pasien
2. Perlindungan pribadi
3. Membersihkan perlengkapan
4. Penggunaan barang sekali pakai
f5. Disinfeksi
6. Pembuangan sampah dengan aman
7. Teknik asepsis dalam menangani pasien dan pekerjaan di laboratorium
8. Pelatihan staff
Terjadinya infeksi berbahaya dapat dicegah dengan cara melakukan suatu
tindakan pencegahan dan kontrol infeksi.3Tujuan kontrol infeksi adalah untuk menghilangkan atau mengurangi jumlah jumlah mikroorganisme antar-individu atau
antara individu dengan permukaan yang terkontaminasi. Salah satu upaya kontrol
infeksi adalah dengan mensterilisasi alat atau instrumen serta tindakan asepsis selama
perawatan hingga mencegah dapat terjadinya infeksi silang. Mensterilisasi instrumen
akan menghilangkan dan mengurangi jumlah mikroba yang dapat menyebar dari satu
pasien pada pasien berikutnya. Sterilisasi merupakan bagian integral dari pelayanan
2.2.3 Instrumen kedokteran gigi
Beberapa alat pencabutan gigi meliputi: tiga serangkai (sonde, pinset dan kaca
mulut), elevator bein, tang, jarum suntik dan karpul. Untuk menentukan tingkat sterilisasi yang sesuai, maka alat pencabutan gigi tersebut digolongkan sesuai dengan
penggunaannya. Berikut ini merupakan penggolongan alat-alat tersebut:17
1. Peralatan kritis
Alat-alat yang langsung berkontak dengan daerah steril tubuh seperti semua
struktur atau jaringan yang tertutup mukosa atau kulit, karena daerah tersebut rawan
infeksi, contohnya jarum suntik. Sebaiknya peralatan yang termasuk dalam peralatan
kritis disterilisasi dengan autoklaf sebelum dibuang.
2. Peralatan semikritis
Peralatan yang bisa bersentuhan akan tetapi tidak sampai menembus membran
mukosa,contohnyasonde, pinset, kaca mulut, tang, elevator bein, kuret dan karpul.
Peralatan yang termasuk dalam alat-alat semikritis dapat disterilisasi dengan
menggunakan sabun yang mengandung detergen, kemudian direndam dengan
menggunakan Chloroxylenol 0,5% selama 10 menit dan bilas dengan air mengalir.
Setelah dilap dengan menggunakan kain steril, alat kemudian dimasukkan ke dalam
autoklaf.
3. Peralatan nonkritis:
Peralatan medis dan peralatan perawatan yang digunakan untuk kontak
dengan kulit saja, contohnya stetoskop. Peralatan ini cukup didesinfeksi dengan
desinfeksi tingkat menengah atau tingkat rendah.16
Instrumen-instrumen yang terkontaminasi atau berkontak dengan saliva dan
darah harus segera dibersihkan (pre-cleaning) atau direndam (pre-soaking) dalam larutan jika instrumen tidak dapat langsung dibersihkan. Setelah itu tahap selanjutnya
Terdapat beberapa cara untuk dekontaminasi alat-alat bekas pakai yaitu :3
1. Sterilisasi adalah proses membunuh dan menghilangkan semua
mikroorganisme dan spora dalam suatu material atau objek
2. Desinfeksi yaitu proses membunuh atau menghilangkan sel-sel vegetatif
yang menyebabkan infeksi namun tidak mematikan sporanya
3. Antiseptis yaitu merupakan pengaplikasian bahan kimia secara eksternal
pada permukaan benda hidup (kulit atau mukosa) untuk menghancurkan
mikroorganisme atau menghambat pertumbuhannya, oleh karena itu semua agen
antiseptik dapat digunakan untuk desinfeksi, tetapi tidak semua desinfektan dapat
digunakan sebagai antiseptik karena toksisitasnya. Prinsip pekerjaan aseptik adalah
dengan meminimalkan jumlah mikroorganisme patogen atau oportunistik dengan
menggunakan bahan-bahan kimia yang aman untuk jaringan hidup.
2.3 Sterilisasi dalam Kedokteran Gigi
Banyak penyakit yang disebabkan oleh infeksi mikroorganisme, dan
mikroorganisme yang bersifat patogen. Jika terdapat mikrorganisme pada daerah
bekas pencabutan, maka luka bekas pencabutan akan bertambah parah dan proses
penyembuhan menjadi tertunda. Dokter gigi umumnya mencegah terjadinya
komplikasi pasca pencabutan ini dengan mengunakan teknik aseptik dan dengan
melakukan sterilisasi pada instrumen yang digunakan selama operasi.19
2.3.1 Definisi Sterilisasi
Sterilisasi merupakan tindakan untuk membunuh dan menghilangkan segala
bentuk mikroorganisme dan spora yang melekat pada peralatan medis dengan
prosedur fisik atau kimia.3,18Secara fisika sterilisasi di kedokteran gigi dapat dilakukan dengan pemanasan. Sedangkan secara kimia sterilisasi dilakukan dengan
menggunakan bahan yang bersifat bakteriostatik dan bakterisid seperti etilena oksida,
detergen, formaldehid, alkohol dan sodium hipoklorit.3
Langkah-langkah presterilisasi sendiri terdiri dari membersihkan instrumen
dengan ultrasonic cleaner untuk menghilangkan debris yang telah lengket dan darah yang mengering, setelah itu menggunakan disinfektan yaitu cairan pembersih enzym-based dan selanjutnya dikeringkan di udara yang panas atau dengan spons di bawah udara yang mengalir, langkah ini penting untuk menghindari kerusakan instrumen
selama proses sterilisasi.18
2.3.2 Metode Sterilisasi
Ada 3 macam proses sterilisasi yang digunakan di kedokteran gigi yaitu
sterilisasi panas, sterilisasi gas dan sterilisasi dengan cairan kimia. Metode sterilisasi
fisika terdiri dari metode yang melibatkan pemanasan dan paling sering digunakan.
Metode sterilisasi ini digunakan untuk bahan yang tahan panas. Metode sterilisasi
kimia dilakukan untuk bahan-bahan yang rusak bila disterilkan pada suhu tinggi,
misalnya bahan-bahan yang terbuat dari plastik.Metode sterilisasi gas yaitu metode
sterilisasi yang akurat terutama untuk benda-benda yang dapat rusak akibat panas dan
cairan.20
Semua tindakan sterilisasi harus dilakukan menggunakan alat-alat sterilisasi
yang didesain khusus untuk mensterilisasi instrumen dental. Frekuensi dilakukannya
sterilisasi, temperatur dan parameter operasi lainnya harus dilakukan sebagaimana
direkomendasikan (disarankan) oleh produsen alat tersebut.9
2.3.2.1 Autoklaf (Pemanasan dengan menggunakan uap bertekanan)
Sterilisasi uap adalah sterilisasi dengan memaparkan uap jenuh pada tekanan
tertentu pada suhu dan waktu tertentu terhadap suatu objek sehingga terjadi pelepasan
energi laten uap yang mengakibatkan pembunuhan mikroorganisme secara
irreversibel akibat denaturasi atau koagulasi protein sel.18 Sterilisasi dapat dilakukan pada suhu 121oCelcius pada 15psi selama 15 menit atau 132oC pada 30psi selama 3-7 menit untuk mensterilkan instrumen yang tidak dibungkus, serta tambahan 5 menit
untuk instrumen yang dibungkus.2Selama proses sterilisasi, dilakukan pengaturan suhu dan waktu disesuaikan dalam suatu tahap yang disebut siklus sterilisasi.
period, holding period dan cooling period.3 Selama waktu sterilisasi dilakukan alat tidak boleh dibuka walaupun untuk mengambil atau menambahkan instrumen.
Gangguan yang terjadi selama siklus sterilisasi akan menyebabkan instrumen menjadi
tidak steril yang akan membahayakan jika digunakan kepada pasien nantinya.20,21 Penggunaan autoklaf merupakan metode yang paling efektif dilakukan karena
bersifat nontoksik, mudah diperoleh, dan relatif mudah dikontrol. Selain itu autoklaf
juga merupakan pembawa energi termal paling efektif dan semua lapisan pelindung
luar mikroorganisme dapat dilunakkan, sehingga memungkinkan terjadinya
koagulasi. Kebanyakan jenis mikroorganisme pada alat kedokteran gigi tidak tahan
panas terhadap suhu yang tinggi sehingga mikroorganisme tersebut akan mati bila
melalui proses sterilisasi menggunakan autoklaf. Agar sterilisasi berjalan efektif, uap yang dihasilkan harus bisa mendorong keluar udara yang ada didalam ruang
sterilisasi.3
2.3.2.2 Sterilisasi panas kering (dry-heat)
Pada sterilisasi panas kering pembunuhan mikroorganisme terjadi melalui
mekanisme oksidasi hingga terjadinya koagulasi protein sel. Proses sterilisasi panas
kering terjadi melalui mekanisme konduksi panas. Panas akan diserap oleh
permukaan luar alat yang disterilkan, lalu merambat ke bagian dalam permukaan
sampai akhirnya suhu sterilisasi tercapai. Sterilisasi panas kering biasa digunakan
pada alat-alat yang tidak mudah menyerap uap, atau pada peralatan yang terbuat dari
kaca.18
Pada sterilisasi panas kering menggunakan temperature 160oC (320oF) selama 1 hingga 2 jam untuk mencegah terjadinya korosi untuk alat logam dan alat gelas.18,22 Temperatur yang lebih tinggi memungkinkan waktu sterilisasi yang lebih singkat dari
waktu yang ditentukan oleh peraturan. Sebaliknya temperatur yang lebih rendah
membutuhkan waktu yang lebih lama.
Sterilisasi panas kering digunakan untuk mensterilkan bahan yang mungkin
biaya operasional yang rendah dan tidak berkarat. Penggunaan jangka panjang dan
suhu tinggi tidak baik untuk perawatan pada pasien tertentu.9
2.3.2.3 Sterilisasi menggunakan uap kimia (khemiklaf)
Kombinasi dari formaldehid, alkohol, aseton, keton dan uap pada tekanan 138
kPa menghasilkan agen sterilisasi yang efektif. Secara umum, penggunaan uap kimia
mensterilkan lebih lambat dari autoklaf(30 menit dibandingkan 15-20 menit), tetapi
lebih cepat dari dry-heat. Temperatur dan kombinasi tekanan yang biasa yaitu 127-132°C pada138-176 kPa selama 30 menit.3
Proses sterilisasi ini tidak dapat digunakan untuk bahan atau benda yangdapat
dirusak oleh bahan kimia ataupun yang terbuat dari bahan yang peka terhadap panas.
Umumnya karat tidak terjadi jika instrumen telah dikeringkan sebelum sterilisasi
dilakukan karena kelembaban yang relatif rendah pada proses ini sekitar 7-8%.
Keuntungan utama dari khemiklaf adalah membutuhkan proses sterilisasi yang lebih
cepatdibandingkan sterilisasi dry-heat, tidak menimbulkan korosi pada instrumen atau bur dan instrumen langsung kering segera setelahsiklus sterilisasi berakhir.
Instrumen harus dikeringkanuntuk menghilangkan asap sisa pada pembukaan
ruanganpada akhir siklus.3Pembungkusan instrumen yang dianjurkan pada metode ini adalah kain muslin, kertas dan plastik yang dapat menembus uap atau nilon.2
2.3.2.4 Sterilisasi dengan Etilen Oksida
Sterilisasi ini adalah alternatif lain untuk alat yang sensitif terhadap panas.
Sterilisasi gas digunakan dalam pemaparan gas atau uap untuk membunuh
mikroorganisme dan sporanya.23
Etilen oksida merupakan senyawa organik kelompok epoksida dari golongan
eter. Beberapa parameter untuk sterilisasi dengan etilen oksida :
a. Konsentrasi, makin tinggi konsentrasi gas, waktu yang diperlukan makin
tinggi. Konsentrasi dinyatakan dalam mg/liter ruang chamber.
b. Semakin tinggi suhu, waktu yang diperlukan makin rendah, biasanya
c. Kelembaban untuk meningkatkan daya penetrasi gas
d. Waktu siklus 2-6 jam tergantung suhu dan konsentrasi.
Adapun keuntungan dari metode ini adalah menggunakan temperatur rendah
dan memiliki kemampuan penetrasi gas yang baik. Sedangkan kerugiannya adalah
agen kimia yang digunakan bersifat karsinogenik dan mutagenik. Metode sterilisasi
gas biasa diaplikasikan untuk mensterilkan materi yang sensitif terhadap panas seperti
sediaan enzim, antibiotik, obat-obatan lain, serta alat-alat endoskopi yang terbuat dari
kaca atau kateter.23
Tabel 1. Kelebihan dan Kekurangan Metode Sterilisasi26
Metode Sterilisasi Kelebihan Kekurangan
Autoklaf - Dapat digunakan untuk alat-alat
dari logam, kain, gelas dan karet - Efektif menghancurkan semua bentuk mikroorganisme
- Menyebabkan karat pada alat yang terbuat dari instrumen baja karbon yang tidak terlindung
- Diperlukan perawatan khusus
Dry-heat - Tidak menyebabkan korosi - Harga relatif murah
- Tidak mengakibatkan alat-alat tajam menjadi tumpul
- Penggunaan jangka panjang dan suhu tinggi tidak cocok untuk pasien dan perangkat tertentu
Khemiklaf - Korosi minimal
- Proses sterilisasi lebih cepat dibandingkan dry-heat
- Tidak dapat digunakan pada instrumen yang sensitif terhadap panas
- Instrumen harus benar-benar kering sebelum pemrosesan
Etilen Oksida - Kemampuan penetrasi gas yang
baik
- Tidak merusak bahan yang rentan terhadap panas
- agen kimia yang digunakan bersifat karsinogenik dan mutagenik
2.4. Prosedur Sterilisasi
Prosedur sterilisasi atau desinfeksi instrumen dalam kedokteran gigi terdiri
dari beberap tahapan, yaitu:12
1. Penerimaan, pembersihan dan dekontaminasi
Instrumen yang digunakan ulang, perlengkapan dan peralatan harus diterima,
disusun, dibersihkan dan didekontaminasi dalam satu bagian pada suatu area.
Pembersihan harus melalui semua proses desinfeksi dan proses sterilisasi harus
mengeliminasi debris. Kontaminasi dicapai baik dengan menggosok menggunakan
surfaktan, deterjen, air atau dengan proses otomatis dengan menggunakan bahan
kimia. Jika debris masih terlihat, baik materi organik atau anorganik, tidak
disingkirkan maka akan menggangu inaktivasi mikroba dan dapat membahayakan
proses desinfeksi dan sterilisasi.
Setelah dibersihkan instrumen harus dibilas dengan air untuk menghilangkan
residu kimia atau deterjen. Percikan harus diminimalisasi sewaktu pembersihan dan
pembilasan. Sebelum desinfeksi akhir atau sterilisasi, instrumen harus ditangani
seolah-olah instrumen terkontaminasi.9
Terdapat dua sistem pembersihan kedokteran gigi yang telah disetujui oleh
Food and Drug Administration (FDA) karena keamanan dan keefektifannya yaitu pembersih ultrasonik dan instrument washer.Penggunaan pembersih ultrasonik dapat mengurangi kontak langsung dengan instrumen yang terkontaminasi dibandingkan
dengan menyikat instrumen dengan tangan. Pembersih ultrasonik menghasilkan
gelembung gelembung yang menghasilkan turbulensi tinggi pada permukaan
instrumen sehingga dapat melunturkan debris yang terdapat dalam instrumen atau
melarutkannya dalam larutan.24
Prosedur pembersihan awal juga dapat dilakukan tanpa menggunakan kedua
alat sebelumnya, yaitu dengan melakukan penyikatan manual. Metode dengan
penyikatan juga dapat efektif jika dilakukan dengan benar. Gunakan sikat dengan
gagang yang panjang untuk menjaga tangan sejauh mungkin dari instrumen yang
Jika instrumen tidak dapat langsung dibersihkan, instrumen tersebut harus
dimasukkan kedalam larutan penahan (holding solution). Tujuannya adalah untuk mencegah saliva atau darah mengering. Prosedur perendaman instrumen didalam
larutan penahan yang terlalu lama dapat menyebabkan korosi pada beberapa
instrumen sehingga hal ini tidak direkomendasikan. Larutan penahan dapat berupa
detergen yang biasa digunakan untuk prosedur pembersihan, air, atau larutan
enzimatik.24Perendaman instrumen yang terlalu lama tidak dianjurkan karena dapat menyebabkan karat pada beberapa instrumen. Larutan desinfektan yang digunakan
untuk merendam harus diganti sekurang-kurangnya sehari sekali atau apabila larutan
deterjen terlihat kotor.25Setelah dilakukan perendaman peralatan dan barang yang akan dipakai kembali haruslah dibersihkan dengan air mengalir, kemudian dibilas lalu
dikeringkan.26
2. Pengemasan
Pemrosesan instrumen yang baik tidak hanya sterilisasi instrumen tetapi juga
pengambilan instrumen steril dari sterilisator ke kursi pasien yang dirawat. Untuk ini
petugas harus dapat mempertahankan sterilitas instrumen setelah diproses melalui
sterilisator. Pengemasan alat sebelum diproses dalam sterilisator mencegah
terkontaminasi instrumen ketika didistribusikan ke kursi perawatan. Instrumen yang
tidak dikemas akan langsung terpapar oleh debu atau aerosol di udara. Sebelum
dikemas instrumen terlebih dahulu harus dicek kembali apakah masih terdapat
debris.24
Setelah dilakukan sterilisasi instrumen harus tetap dalam keadaan steril hingga
digunakan kembali. Instrumen steril harus ditempatkan dalam tempat yang kering,
tertutup dan terlindung dari debu dan sumber kontaminasi lainnya. Penyimpanan
instrumen sangat penting seperti halnya proses sterilisasi. Hal ini dikarenakan
2.5 Mikroorganisme dalam rongga mulut
Berbagai spesies mikroorganisme yang terdapat dalam rongga mulut dapat
digolongkan menjadi flora normal dan sementara. Flora normal adalah sekumpulan
mikroorganisme yang hidup pada kulit dan selaput lendir/mukosa manusia yang sehat
maupun sakit. Pertumbuhan flora normal pada bagian tubuh tertentu dipengaruhi oleh
suhu, kelembaban, nutrisi dan adanya zat penghambat. Keberadaan flora normal pada
bagian tubuh tertentu mempunyai peranan penting dalam pertahanan tubuh karena
menghasilkan suatu zat yang menghambat pertumbuhan mikroorganisme lain.
Adanya flora normal pada bagian tubuh tidak selalu menguntungkan, dalam kondisi
tertentu flora normal dapat menimbulkan penyakit, misalnya bila terjadi perubahan
substrat atau berpindah dari habitat yang semestinya.27
Flora normal dalam rongga mulut terdiri dari Streptokokus mutans/
Streptokokus viridans, Stafilokokus sp. dan Laktobasilus sp. Meskipun sebagai flora
normal dalam keadaan tertentu bakteri-bakteri tersebut bisa berubah menjadi patogen
karena adanya faktor predisposisi yaitu kebersihan rongga mulut.
2.5.1 Streptokokus mutans/Streptkokus viridans
Streptokokus adalah bakteri yang heterogen, selain dapat digolongkan
berdasarkan sifat pertumbuhan koloni, juga dapat dibedakan dari susunan antigen
pada zat dinding sel yang spesifik untuk golongan tertentu, dan reaksi-reaksi
biokimia.16
Morfologi sel berbentuk kokus, susunan berderet, tidak berflagel, tidak
berspora, tidak berkapsul, Gram positif.
Morfologi koloni pada media agar darah berbentuk koloni bulat, ukuran 1 - 2
mm, tidak berwarna/jernih, permukaan cembung, tepi rata, membentuk hemolisa α (
disekitar koloni terdapat zona hijau ), dibedakan dengan Streptokokus pneumoni
dengan optokin dan kelarutannya dalam empedu, Streptokokus viridans resisten
terhadap optokin dan tidak larut dalam empedu sedangkan Streptokokus
Fisiologi bersifat anaerob fakultatif, tumbuh baik pada suasana CO2 10 % dan
suhu 370C, resisten terhadap optokin, sel tidak larut dalam empedu. Contoh spesies
Streptokokus yang lain adalah Streptokokus β hemolitikus dan Streptokokus γ
hemolitikus.
2.5.2 Stafilokokus sp.
Stafilokokus dapat menimbulkan penyakti melalui kemampuan berkembang
biak dan menyebar luas dalam jaringan dan melalui pembentukan berbagai zat
ekstraseluler, seperti enzim dan toksin.Stafilokokus aureus dapat menyebabkan
infeksi pada kulit dan infeksi secara sistemik. Beberapa penyakit yang dapat
disebabkan oleh Stafilokokus aureus diantaranya abses, konjungtivitis, sindroma syok
toksis, osteomielitis dan pneumonia.3
Morfologi sel berbentuk kokus, susunan bergerombol, tidak berflagel, tidak
berspora, tidak berkapsul, Gram positif.
Morfologi koloni pada media agar darahberbentuk koloni bulat, ukuran 2 – 4
mm, membentuk pigmen kuning emas (Stafilokokus aureus), pigmen kuning jeruk dibentuk oleh Stafilokokussaprofitikus dan pigmen putih porselin dihasilkan oleh
Stafilokokus epidermis, permukaan cembung, tepi rata dan hemolisa bervareasi alfa,
beta dan gama.
Fisiologi bersifat aerob, tumbuh optimal pada suhu 370oC dan pembentukan pigmen paling baik pada suhu 200oC, memerlukan NaCl sampai 7,5 %, resisten terhadap pengeringan dan panas.
2.5.3Laktobasilus sp
Morfologi sel berbentuk batang pendek, tidak berspora, tidak berflagel, tidak
berkapsul, Gram positif.
Morfologi koloni pada media agar darahberbentuk koloni bulat kecil, warna
putih susu, cembung, tepi rata, permukaan mengkilap.
enzim katalase. Contoh spesiesnya adalah Laktobasilus bulgarius, Laktobasilus laktis,
Laktobasilus kasei.
2.5.4 Kandida albikans
Kandida albikans merupakan flora normal yang terdapat pada mukosa saluran
pernapasan, saluran pencernaan dan genitalia wanita. Jamur ini dapar menyebabkan
infeksi dalam rongga mulut seperti kandidiasis oral dan denture stomatitis. Kandida albikans biasanya menimbulkan infeksi ketika sudah bermultipikasi dan pada host
2.6 Kerangka Teori
Standard Precaution
Metode
Sterilisasi
• Perendaman • Pembersihan
Awal
• Pengemasan Kimia
Fisika
• Etilen Oksida • Autoklaf
• Pemanasan Kering (dry-heat)
• Khemiklaf
2.7 Kerangka Konsep
Kontaminasi: • Bakteri • Jamur • Virus Instrumen bedah mulut
Bakteri Pre-sterilisasi
Dekontaminasi→ Jumlah bakteri ↓
Sterilisasi
BAB 3
METODOLOGI PENELITIAN
3.1 JenisRancangan Penelitian
Penelitian ini merupakan penelitian eksperimental, yaitu penelitian yang
didalamnya melibatkan perlakuan pada kondisi subjek yang diteliti serta diikuti
usaha kontrol yang ketat pada faktor-faktor luar.28
3.2Lokasi dan Waktu Penelitian 3.2.1 Lokasi
Penelitian ini dilakukan dengan mengambil sampel penelitian di
Departemen Bedah Mulut FKG USU, sterilisasi dengan autoklaf dilakukan di
Rumah Sakit Pelabuhan Belawan dan pemeriksaan dilakukan di Laboratorium
Mikrobiologi Fakultas MIPA USU.
3.2.2 Waktu Penelitian
Penelitian ini dilakukan pada 12Januari 2015 – 10 Maret 2015
3.3 Sampel Penelitian
Jumlah sampel yang digunakan ditentukan besarnya dengan rumus Federer
n > 8.5 n> 9
Dalam penelitian ini jumlah perlakuan adalah 3 yaitu perlakuan terhadap
instrumen medis sebelum digunakan yang telah dilakukan sterilisasi dengan
perendaman di larutan disinfektan, perlakuan terhadap instrumen medis setelah
digunakan untuk pencabutan dan perlakuan terhadap instrumen medis setelah
disterilisasi dengan menggunakan autoklaf. Sehingga didapatkan sampel yang
diperlukan untuk eksperimen ini sebanyak 9 buah instrumen. Untuk menghindari
terjadinya error maka sampel ditambahkan menjadi 13. Sampel pada penelitian ini
adalahinstrumen pencabutan gigi yang dipergunakan pada Departemen Bedah
Mulut FKG USU.
3.4 Variabel Penelitiandan Definisi Operasional
NNo. Variabel Definisi Operasional
1
Suatu cara untuk membunuh semua mikroorganisme dan spora yang melekat pada peralatan medis yang meliputi prosedur sterilisasi seperti mencuci instrumen dengan air dan sabun yang mengandung detergen dan alat-alat seperti autoklaf dan dry-heat.
Alat-alat yang digunakan dalam pencabutan gigi di Departemen Bedah Mulut FKG USU.
4 Jumlah Bakteri pada
Instrumen
bersuhu 121oC dalam waktu 15 menit
Banyaknya bakteri baik gram positif maupun gram negatif yang terdapat pada instrumen bedah mulut yang diukur menggunakan Bacteria Colony Counter
-Object Glass
3.6.1 Prosedur Pengambilan Sampel
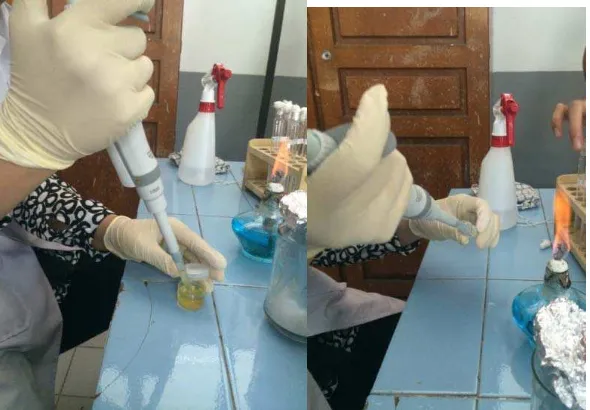
Instrumen yang akan digunakan disiapkan terlebih dahulu. Sampel didapatkan
dari mikroorganisme yang berasal dari instrumen medis yang ditempatkan kedalam
bulyon cair. Sebanyak 10 ml cairan bulyon dimasukkan kedalam pot yang telah diberi
label. Label A untuk mikroorganisme (m.o) pada instrumen sebelum dilakukan
pencabutan yang telah dicuci bersih dan direndam dalam cairan desinfektan, label B
untuk m.o pada instrumen yang telah digunakan untuk pencabutan dan label C untuk
m.o pada instrumen setelah disterilisasi dengan menggunakan autoklaf.
Instrumen yang akan digunakan untuk pencabutan sebelumnya dicelupkan
terlebih dahulu pada bagian sisi aktifnya selama 15 detik pada bulyon berlabel A agar
bakteri yang terdapat pada instrumen dapat lepas ke bulyon. Setelah instrumen selesai
bulyon yang berlabel B. Instrumen dibersihkan dengan menggunakan cairan
desinfektan dan dibilas dibawah air mengalir. Setelah kering instrumen dimasukkan
kedalam medi-pack dan dikemas rapat.
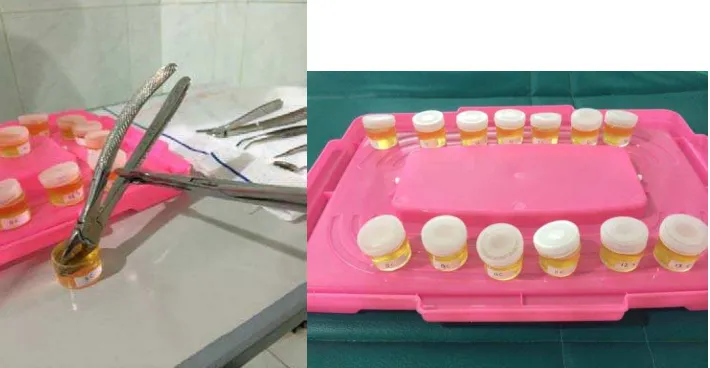
Instrumen disterilkan dengan menggunakan autoklaf pada suhu 121oC selama 15 menit. Instrumen yang telah steril dikeluarkan dari medi-packdengan hati-hati, kemudian dengan menggunakan bantuan penjepit alat bagian sisi aktif instrumen
kembali dicelupkan kedalam bulyon pada pot berlabel C. Semua pot berisi cairan
bulyon ditutup rapat untuk menghindari kontaminasi dari luar.
Gambar 2. Instrumen yang digunakan sebagai sampel
Gambar 4. Instrumen dicelup Gambar 5. Bulyon diberi label A kedalam bulyon sebelum
digunakan
Gambar 6. Instrumen yang telah Gambar 7. Bulyon diberi label B selesai digunakan dicelupkan
Gambar 8. Instrumen dicuci bersih Gambar 9. Instrumen dibungkus rapat di medi-pack
Gambar 12. Instrumen kembali Gambar 13. Bulyon diberi label C dicelupkan kedalam bulyon
3.6.2 Prosedur Pembuatan Media PCA
Semua alat dan bahan disiapkan. Tangan operator dan meja kerja disterilkan
dengan menggunakan alkohol 97% lalu dikeringkan. PCA (Plate Count Agar)
ditimbang pada neraca analitik sehingga didapat berat 4,4 gr. PCAdilarutkan kedalam 250 ml aquadest pada tabung erlenmeyer. Campuran dihomogenkan sambil dipanaskan diatas hotplate sambil diaduk sehingga tidak ada gumpalan. Media ditutup rapat dengan menggunakan plastic wrap. Kemudian dimasukkan kedalam autoklaf untuk disterilkan pada suhu 121oC selama 1 jam.
3.6.3 Prosedur Pembuatan Garam Fisiologis
NaCl ditimbang pada neraca analitik sehingga didapat berat 2,2 gr. NaCl
dilarutkan kedalam 250 ml aquadest pada beaker glass. Aduk dengan menggunakan spatel. Masukkan 10 ml kedalam masing-masing tabung reaksi dengan menggunakan
gelas ukur. Mulut tabung reaksi ditutup dengan menggunakan kapas dan plastic wrap.
Kemudian dimasukkan kedalam autoklaf untuk disterilkan pada suhu 121oC selama 1 jam.
Gambar 15. Penimbangan NaCl Gambar 16. Pelarutan bubuk NaCl
Gambar 19. Sterilisasi bahan denganautoklaf
3.6.4 Strerilisasi Petri
Petri dipastikan telah bersih dan kering. Petri kemudian dibungkus rapat
dengan menggunakan kertas. Petri dimasukkan kedalam oven selama lebih kurang 3
jam untuk disterilkan.
Gambar 20. Cawan petri dibungkus kertas Gambar 21. Sterilisasi cawan petri menggunakan oven
3.6.5 Pengenceran dan Persiapan Media
Tujuan daripada pengenceran adalah untuk memperluas bidang hidup sampel
dilakukan pengenceran sampai dengan 10-3. Pengenceran dilakukan dengan mengambil 1 ml bulyon dari sampel untuk dimasukkan kedalam tabung pertama
dengan menggunakan mikropipet. Kemudian tabung reaksi diforteks. Dari tabung
pertama diambil sebanyak 1 ml untuk dimasukkan kedalam tabung kedua. Kemudian
tabung reaksi diforteks. Dari tabung kedua diambil sebanyak 1 ml untuk dimasukkan
kedalam tabung ketiga. Kemudian tabung reaksi diforteks. Sampel dengan
pengenceran 10-3diambil sebanyak 1 ml untuk dimasukkan kedalam petri yang berisi medium PCA dengan metode agar tuang. Tutup petri tidak boleh dibuka terlalu lebar
karena akan menimbulkan masuknya bakteri dari luar kedalam media. Semua tahap
dilakukan didekat bunsen dan dengan menggunakan pipet ukur yang berbeda agar
pengenceran tidak saling tercampur atau terkontaminasi satu sama lain. Cawan petri
kemudian digoyangkan perlahan agar media merata diseluruh permukaan, selanjutnya
petri didiamkan hingga media membeku (10-15 menit). Kemudian petri dilapis
dengan plastic-wrap agar tertutup rapat. Petri selanjutnya diinkubasi dalam inkubator selama 1 hari pada suhu 37oC
Gambar 24. Tabung reaksi Gambar 25. Tabung reaksi dengan diforteks pengenceran 10-1, 10-2, 10-3
Gambar 28. Tuang media PCA Gambar 29. Petri digerak melingkar Kedalam petri perlahan agar sampel tercampur
rata
Gambar 32. Petri di inkubasi didalam inkubator selama 24 jam
3.6.6 Perhitungan Jumlah Mikroorganisme
Koloni yang ada ditandai dengan menggunakan spidol dan kemudian dihitung
dengan menggunakan bacteria colony counter. Jumlah bakteri yang ada dikalikan 1000 CFU/ml.
3.6.7 Pembuatan Biakan Murni
Siapkan sebuah cawan petri steril, kemudian dituang media NA kedalam petri
lalu dibiarkan memadat. Diambil 1 ose bakteri yang telah ditentukan dari biakan
campuran, kemudian diinokulasikan ke dalam media NA yang telah memadat dengan
cara digores. Lalu diinkubasi selama 1x24 jam didalam inkubator.
Gambar 35. Hasil biakan murni dengan teknik goresan
3.6.8 Pewarnaan dan Pengamatan Bakteri
Preparat ulas dibuat dengan mengambil kultur biakan 1-2 ose steril ke
permukaan objek glass. Dengan ose disebarkan merata membentuk bujur sangkar.
Slide tersebut difiksasi hingga terlihat kering. Setelah kering diberi zat warna kristal
violet dan dibiarkan selama 1 menit, bilas dengan aquades lalu dikeringanginkan.
Diberi iodine 1-2 tetes selama 30 detik, bilas dengan menggunakan aseton alkohol selama 15 detik, lalu dibilas dengan aquades. Diberi 1 tetes larutan safranin selama 1
menit, bilas dengan aquades dan dikeringkan. Setelah itu preparat bisa diamati
dibawah mikroskop.
Gambar 36. Pembuatan preparat Gambar 37. Pemberian Crystal
Gambar 38. Pemberian Iodin Gambar 39. Pembilasan dengan
aseton alkohol
3.7 Alur Penelitian
Pengambilan Sampel
Perhitungan jumlah bakteri Pembuatan media PCA
Pembuatan garam fisiologis
Sterilisasi alat dan bahan
Pengenceran
Persiapan media
Pembuatan biakan bakteri
Pewarnaan dan pengamatan bakteri
3.8 Analisis Data
Data hasil penelitian diperoleh dari perhitungan jumlah bakteri yang telah
diberi perlakuan dengan media Plate Count Agar.
Data hasil dianalisis dengan memakai uji statistik sebagai berikut :
- Uji yang digunakan adalah uji analisis Wilcoxon, karena uji ini digunakan
untuk mengetahui ada atau tidaknya perbedaan antar dua pengamatan sebelum dan
BAB 4
HASIL PENELITIAN
Penelitian ini bertujuan untuk melihat efektivitas sterilisasi autoklaf pada
penggunaan instrumen medis di Departemen Bedah Mulut FKG USU. Subjek
penelitian yang digunakan adalah instrumen bedah mulut yang digunakan untuk
pencabutan gigi di Departemen Bedah Mulut FKG USU. Instrumen yang digunakan
untuk pencabutan gigi diberi tiga perlakuan yaitu pemeriksaan bakteri sebelum
instrumen digunakan, pemeriksaan bakteri setelah instrumen digunakan untuk
pencabutan dan pemeriksaan bakteri setelah instrumen disterilisasi dengan melalui
penurunan jumlah koloni bakteri yang dilihat melalui media plate count agar.Penurunan jumlah koloni bakteri plak dalam penelitian ini diukur dengan menggunakan metode hitungan cawan dalam satuan colony forming unit per mililiter
(CFU/ml). Hasil penelitian ditampilkan dalam tabel sebagai berikut
A B C
Gambar 41.Koloni bakteri pada instrumen sebelum digunakan untuk pencabutan (A),
setelah digunakan untuk pencabutan (B) dan setelah dilakukan sterilisasi dengan
Tabel 2.Jumlah koloni bakteri sebelum dan sesudah penggunaan autoklaf
Tabel 2 memperlihatkan penurunan jumlah koloni bakteri yang terdapat pada
instrumen bedah mulut.Kolom A menunjukkan jumlah bakteri pada instrumen bedah
sebelum dilakukan pencabutan dan telah didesinfeksi dengan menggunakan cairan
desinfektan.Kolom B menunjukkan jumlah bakteri pada instrumen bedah setelah
digunakan untuk pencabutan.Kolom C menunjukkan jumlah bakteri pada instrumen
bedah setelah dilakukan sterilisasi dengan autoklaf.
Tabel 3. Sterilitas sampel instrumen bedah mulut dengan penggunaan autoklaf
Tabel 3 memperlihatkan bahwa tidak didapatkan bakteri pada semua
instrumen semi kritis, sedangkan ditemukan adanya pertumbuhan bakteri pada 5
buah instrumen kritis yang telah disterilisasi dengan autoklaf.
Data penurunan jumlah bakteri sebelum dan sesudah perlakuan di uji
normalitasnya menggunakan Uji Shapiro-Wilk.
Tabel 4. Hasil Perhitungan Uji Normalitas
Shapiro-Wilk
Statistic df Sig.
Sebelumdigunakan ,675 13 ,000
Sesudahdigunakan ,803 13 ,007
Sesudahautoclave ,579 13 ,000
Berdasarkan hasil uji normalitas dengan menggunakan uji
Shapiro-Wilk,diperoleh distribusi data jumlah bakteri pada kelompok perlakuan tidak
normal (p<0,05). Sebaran data yang tidak normal ini diusahakan menjadi normal
dengan melakukan transformasi data dengan menggunakan uji Wilcoxon.
Tabel 5. Hasil perhitungan Uji Wilcoxon
Sesudah digunakan–
Hasil uji Wilcoxon, diperoleh nilai p<0,05 yang menunjukkan adanya
perbedaan yang bermakna pada seluruh kelompok perlakuan. Hal ini berarti
sterilisasi dengan penggunaan autoklaf memiliki efek sterilitas yang baik
BAB 5 PEMBAHASAN
Penelitian yang dilakukan ini adalah penelitian untuk mengetahui efektivitas sterilisasi menggunakan autoklafdengan cara membandingkan jumlah bakteri
sebelum dan sesudah digunakan.Penggunaan autoklaf merupakan metode yang dianggap paling efektif karena dapat merusak spora-spora yang resisten serta
jamur.Penggunaan panas yang lembab dengan tekanan tinggi menghasilkan kekuatan
penghancur bakteri yang efektif terhadap semua bentuk mikroorganisme.Penelitian
yang dilakukan oleh Anggia telah menunjukkan bahwa autoklafmerupakan metode
sterilisasi yang terbaik karena memberikan hasil dengan jumlah bakteri yang paling
minimal.14
Penelitian ini menggunakan sampel dari instrumen medis yang digunakan di
Departemen Bedah Mulut FKG USU. Terdapat 3 kelompok perlakuan pada penelitian
ini yaitu kelompok A pada instrumen medis sebelum digunakan untuk pencabutan
yang telah didesinfeksi menggunakan cairan desinfektan, kelompok B pada instrumen
medis setelah dilakukan untuk pencabutan dan kelompok C pada instrumen medis
yang telah disterilisasi dengan menggunakan autoklaf.
Data deskriptif yang dapat dilihat dari penelitian ini pada instrumen sebelum
digunakan dijumpai jumlah bakteri minimal sebesar 0 CFU/ml, sedangkan maksimal
sebesar 56.103 CFU/ml. Jumlah bakteri pada instrumen setelah digunakan untuk pencabutan paling minimal adalah 0 CFU/ml, sedangkan maksimal sebesar
264.103CFU/ml. Sedangkan jumlah bakteri pada instrumen yang telah disterilisasi dengan menggunakan autoklaf paling minimal adalah 0 CFU/ml sedangkan maksimal
sebesar 14.103 CFU/ml. Perhitungan ini dilakukan untuk mengetahui peningkatan jumlah bakteri pada instrumen setelah digunakan dan penurunan bakteri pada
dijumpai jumlah bakteri minimal pada molar band sebelum digunakan adalah 0
CFU/ml, sedangkan maksimal sebesar 2 CFU/ml. Jumlah bakteri pada molar band
sebelum digunakan adalah sebesar 32 CFU/ml, sedangkan maksimal sebesar 49
CFU/ml. Sedangkan jumlah bakteri pada molar band setelah disterilisasi dengan
autoklafpaling minimal adalah 0 CFU/ml dan maksimal adalah 7 CFU/ml. Hasil
penelitian menunjukkan bahwa adanya perbedaan yang signifikan antara jumlah
bakteri pada instrumen sebelum dan setelah disterilisasi.
Pada kelompok A terlihat jumlah bakteri minimal yaitu 0 CFU/ml didapatkan
pada kaca mulut, tang, dan pinset. Sedangkan jumlah bakteri maksimal dari kelompok
A terdapat pada Bein yaitu 56.103 CFU/ml. Pada kelompok B terlihat jumlah bakteri minimal didapatkan pada pinset yaitu 0 CFU/ml dan bakteri maksimal sebanyak
264.103CFU/ml pada tang. Pada kelompok C terlihat jumlah bakteri pada seluruh instrumen semi-kritis yaitu 0 CFU/ml sedangkan jumlah bakteri maksimal didapatkan
pada isntrumen kritis tang yaitu sebanyak 14. 103 CFU/ml.
Hasil analisis uji statistik dengan menggunakan Wilcoxon signed rank testmenunjukkan perbedaan yang bermakna (p<0,05) pada jumlah bakteri di instrumen sebelum dan setelah perlakuan yang menunjukkan efektivitas penggunaan
autoklaf sebagai alat sterilisasi untuk menurunkan jumlah bakteri pada instrumen
bedah mulut.
Dapat disimpulkan bahwa autoklaf merupakan metode sterilisasi yang efektif
dalam penurunan jumlah bakteri. Hal ini berkaitan dengan beberapa penelitian yang
berpendapat bahwa autoklaf merupakan metode sterilisasi yang banyak digunakan
oleh tenaga kesehatan karena memberikan hasil yang paling baik dalam
menghilangkan segala bentuk mikroorganisme.14
Dalam penelitian ini juga dilakukan pemeriksaan untuk melihat jenis bakteri
yang terdapat pada instrumen bedah apakah bakteri tersebut gram positif atau
negatif.Setelah dilihat menggunakan mikroskop hasil yang diperoleh dari 6 sampel
adalah 1 sampel berwarna merah dan 5 sampel berwarna biru. Warna merah terjadi
karena bakteri mengikat cairan sel safranin yang artinya jenis bakteri tersebut adalah
Gambar 42. Bakteri gram negatif setelah dilakukan pewarnaan dengan cairan safranin
Sedangkan warna biru terjadi karena bakteri mengikat cairan kristal violet
yang artinya jenis bakteri tersebut adalah bakteri gram positif seperti Streptokokus
mutans, Stafilokokus sp. dan Laktobasilus sp.Berdasarkan sampel penelitian ini
terlihat mayoritas jenis bakteri merupakan bakteri gram positif.
BAB 6
KESIMPULAN DAN SARAN
6.1Kesimpulan
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa:
1. Tindakan sterilisasi instrumen pencabutan gigi dengan menggunakan
autoklaf efektif dalam menurunkan jumlah bakteri pada instrumen.
2. Terdapat perbedaan yang signifikan antara jumlah bakteri pada
instrumen sebelum dan setelah penggunaan autoklaf.
3. Pada instrumen kritis masih ditemukan adanya pertumbuhan bakteri
pada 5 instrumen, sedangkan pada instrumen semi kritis tidak ada sama sekali
pertumbuhan bakteri atau dengan kata lain semuanya sudah steril
4. Mayoritas bakteri gram positif yang terdapat pada instrumen
pencabutan gigi. Dimana pada pemeriksaan menggunakan mikroskop diperoleh 5
sampel berwarna biru dan 1 sampel berwarna merah.
6.2Saran
Masih banyak terdapat kekurangan pada penelitian ini :
1. Diharapkan adanya penelitian selanjutnya tentang efektivitas
masing-masing teknik sterilisasi.
2. Diharapkan hasil penelitian ini dapat digunakan sebagai informasi untuk
tenaga medis agar mengaplikasikan proses sterilisasi pada aktifitas
DAFTAR PUSTAKA
1. Wray D, Stenhouse D, Lee D, and Clark AJE. Textbook of general and oral
surgery. Churchill. Livingstone, 2003: 46-47.
2. Sunoto RI. Tindakan pencegahan penularan penyakit infeksi pada praktek
dokter gigi. Jurnal PDGI, 55th ed.2004:12.
3. Samaranayake, L.P. Essential microbiology for dentistry, 3rd ed.,Churchill.
Livingstone.,2006: 337-339.
4. Australian Dental Association Inc. Guidelines for infection control. 2nd
ed.,Australian Dent Assoc Inc, 2012: 10.
5. Wibowo T, Parisihni K, Haryanto D. Proteksi dokter gigi sebagai pemutus
rantai infeksi silang. Jurnal PDGI 209;58(2):6-7.
6. Rahardja F, Widura, Suryadarma DA. Uji sterilitas instrumen bedah terhadap
bakteri aerob penyebab infeksi di rumah sakit Immanuel Bandung. JKM.
2004;3(2): 71.
7. Meliawaty F. Efisiensi sterilisasi alat bedah mulut melalui inovasi oven
dengan ozon dan infrared. JKM. Vol.11 2012; 148: 147-167.
8. Mallick A, Khaliq SA, Nasir M, Qureshi R. Practices of sterilization
techniques at dental clinics of Karachi, Pakistan. Int J Pharm 2014; 4(1):
108-109
9. Centers for Disease Control and Prevention. Guidelines for infection control
in dental health-care settings . MMWR, 2003;52(No. RR-17):21.
10.Ridha F. Instrumentasi.
(April 14, 2014)
11.Rahman R. Gambaran pengetahuan mahasiswa fakultas kedokteran
universitas sumatera utara tentang sterilisasi peralatan bedah minor. Skripsi.
12.Viana AC, Gonzalez BM, Buono VT, Bahia MG. Influence of sterilization on
mechanical properties and fatigue resistance of nickel-titanium rotary
endodontic instruments.International Endodontic J 2006: 709-712.
13.Tridianti A. Efektivitas berbagai metode sterilisasi molar band yang
terkontaminasi pasca proses fitting band (uji hitung bakteri). Tesis. Jakarta:
Program spesialis ortodonti Fakultas Kedokteran Gigi UI, 2012: 13-14.
14.Florence M. Efisiensi sterilisasi alat bedah mulut melalui inovasi oven dengan
ozon dan infrared. JKM. Vol. 11 2012: 147.
15.Karla MW, Rinezia RN, Kurniasari RN. Pemanfaatan sinar gamma sebagai
solusi sterilisasi efektif alat kedokteran gigi.
http://www.bimkes.org/pemanfaatan-sinar-gamma-sebagai-solusi-sterilisasi-efektif-alat-kedokteran-gigi/ (Maret 20, 2014)
16.Darmadi. Infeksi nosokomial : Problematika dan pengendaliannya. Jakarta:
Penerbit Salemba Medika, 2008: 77-81.
17.Pedersen GW. Buku ajar praktis bedah mulut. Alih bahasa: Purwanto,
Basoesono. Jakarta: EGC, 1996: 2-3.
18.Nurhasanah. Tindakan sterilisasi alat pencabutan gigi dan dental unit oleh
mahasiswa kepaniteraan klinik di departemen bedah mulut FKG USU tahun
2012. Skripi. Medan: Departemen Bedah Mulut dan Maksilofasial FKG USU,
2012: 10.
19.Saheeb BDO, Offor E, Okojie OH. Cross infection control methods adopted
by medical and dental practitioner in Benin City, Nigeria. Vol.2., Nigeria:
Annals of African Medicine., 2003: 72.
20.Sumawinata N. Senarai istilah kedokteran gigi. Jakarta: EGC, 2004: 44.
21.Eve C, Helene B. Instrument sterilization in dentistry. RDH. Vol.27. 2007:
67-75.
22.American Dental Association. Sterilization and disinfection of dental
23.Sultana Y, Hamdard J,Nagar H. Pharmaceuticalmicrobiology and
biotechnology sterilization methods and principles. New Delhi: Department of
Pharmaceutics Faculty of Pharmacy, 2007: 5.
24.Miller CH, Palenik CJ. Infection control and management of hazardous
materials for the dental team. 4th ed., Philadelphia: Elsevier's., 2010: 175-180
25.Mulyanti S, Putri MH. Pengendalian infeksi silang di klinik gigi. Jakarta:
EGC, 2011: 1-4.
26.Departemen Kesehatan R.I. Pedoman pencegahan dan pengendalian infeksi di
rumah sakit dan fasilitas pelayanan kesehatan lainnya, kesiapan menghadapi
emerging infectius disease. Cetakan kedua. Jakarta: Departemen Kesehatan
RI, 2008: 3-2, 4-25-31.
27.Brooks GF,Butel JS,Morse SA.Mikrobiologi kedokteran.Alih Bahasa.
Mudihardi E, Kuntaman,WasitoEB et al. Jakarta: Salemba Medika,2005: 124.
28.Budiharto. Metodologi penelitian kesehatan (dengan contoh bidang ilmu
kesehatan gigi.Jakarta: EGC, 2008: 46.
29.Anwar H. Wilcoxon signed rank test dengan spss