SKRIPSI
PROFIL DAN PEROKSIDASI LIPID TIKUS PERCOBAAN SETELAH PEMBERIAN TEPUNG TEMPE KACANG KOMAK
(Lablab purpureus (L.) Sweet)
Oleh
RH. FITRI FARADILLA F24053375
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PROFIL DAN PEROKSIDASI LIPID TIKUS PERCOBAAN SETELAH PEMBERIAN TEPUNG TEMPE KACANG KOMAK
(Lablab purpureus (L.) Sweet)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
RH. FITRI FARADILLA F24053375
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
RH. Fitri Faradilla. F24053375. Profil dan Peroksidasi Lipid Tikus Percobaan Setelah Pemberian Tepung Tempe Kacang Komak (Lablab purpureus (L.) Sweet). Di bawah bimbingan Dr. Ir. Nurheni Sri Palupi, M.Si dan Arif Hartoyo, STP, M.Si. 2010.
RINGKASAN
Penyakit jantung koroner (PJK) merupakan penyakit yang menyebabkan kematian sekitar 15 juta jiwa atau sekitar 30% dari total penyebab kematian dan diperkirakan meningkat mencapai 40% pada tahun 2020 (WHO 2001). Salah satu penyebab terjadinya PJK adalah kondisi hiperkolesterolemia yang sangat mendukung terbentuknya aterosklerosis. Tempe kedelai telah diketahui bersifat hipokolesterolemik dan memiliki antioksidan yang tinggi sehingga dapat mencegah PJK (Brata-Arbai 2001). Namun setiap tahunnya Indonesia selalu mengimpor kedelai (Sawit et al. 2006), sehingga dibutuhkan alternatif kacang lain untuk membuat tempe.
Kacang komak merupakan kacang yang berpotensi menyubtitusi kacang kedelai. Nugroho (2007) telah membuktikan bahwa kacang komak bersifat hipokolesterolemik seperti halnya kedelai. Namun sifat fungsional tempe kacang komak belum diketahui. Oleh karena itu dibutuhkan uji in vivo untuk mengetahuinya. Akan tetapi uji in vivo tempe kacang komak segar akan mengalami kesulitan pada persiapan sampel. Untuk meningkatkan umur simpan dan memermudah dalam persiapan sampel maka pada penelitian ini tempe kacang komak segar ditepungkan sehingga didapat tepung tempe kacang komak.
Tujuan dari penelitian ini adalah untuk mengevaluasi pengaruh tepung tempe kacang komak terhadap profil dan peroksidasi lipid. Profil lipid tersebut mencakup total kolesterol, trigliserida, HDL, dan LDL. Peroksidasi lipid meliputi kadar malonaldehida pada hati dan limpa tikus.
Tahap pertama penelitian ini adalah persiapan sampel, yaitu tepung tempe kacang komak. Tepung tempe dianalisis nilai gizinya yang terdiri dari kadar protein, lemak, karbohidrat, air, abu, dan serat kasar. Data tersebut digunakan untuk merancang komposisi ransum tikus. Setelah sampel disiapkan, tikus mulai dipelihara. Masa adaptasi tikus adalah 1 minggu. Masa perlakuan selama 36 hari. Selama masa perlakuan, secara berkala dilakukan penghitungan jumlah konsumsi ransum dan pengukuran berat badan. Pada akhir perlakuan, dilakukan pembedahan tikus. Serum darah tikus digunakan untuk menentukan total kolesterol, HDL, trigliserida, LDL, dan indeks aterogenik (IA). Hati dan limpa digunakan untuk analisis malonaldehida (MDA). Organ hati, ginjal, dan limpa ditimbang sebagai data pendukung.
Berat hati relatif kontrol negatif, kontrol positif, dan tempe secara berturut-turut adalah 0,030; 0,032; dan 0,044. Berat organ ginjal relatif semua perlakuan tidak berbeda nyata secara statistik pada α=0,1. Kontrol negatif memiliki berat ginjal relatif 0,006, kontrol positif 0,0056, dan tempe 0,007. Seperti halnya berat ginjal relatif, berat limpa relatif ketiga kelompok juga tidak berbeda nyata, yaitu kontrol negatif 0,0030, kontrol positif 0,0026, dan tempe 0,0026.
Total kolesterol kontrol positif (143,45 mg/dl) paling tinggi, diikuti tempe (122,18 mg/dl), dan paling rendah kontrol negatif (60,23 mg/dl). Kadar trigliserida serum darah tikus kontrol negatif, kontrol positif, dan tempe secara berturut-turut adalah 42,45 mg/dl, 27,73 mg/dl, dan 19,51 mg/dl. Nilai HDL kontrol negatif, kontrol positif, dan tempe berturut-turut adalah 27,28 mg/dl, 23,50 mg/dl, dan 19,02 mg/dl. Kadar LDL kontrol negatif paling rendah dan berbeda nyata, yaitu 24,45 mg/dl. Kadar LDL tempe lebih rendah dari pada kontrol positif, walau tidak berbeda nyata. Kadar LDL kontrol positif adalah 114,39 mg/dl dan tempe adalah 99,26 mg/dl. Nilai IA tempe paling tinggi, walau tidak berbeda nyata dengan kontrol positif. Kontrol negatif merupakan kelompok tikus yang memiliki nilai IA paling rendah. Nilai IA kontrol negatif, kontrol positif, dan tempe secara berturut-turut adalah 1,26; 5,14; dan 5,99.
Kadar MDA hati pada kelompok tikus kontrol negatif, kontrol positif, dan tempe secara berturut-turut adalah 0,04 pmol/ml, 0,02 pmol/ml, dan 0,04 pmol/ml. Kadar MDA limpa pada kelompok tikus kontrol negatif, kontrol positif, dan tempe secara berturut-turut adalah 0,10 pmol/g, 0,09 pmol/g, dan 0,10 pmol/g. Secara statistik, α=0,1, kadar MDA limpa ketiga kelompok tikus ini tidak berbeda nyata.
RIWAYAT HIDUP PENULIS
Penulis dilahirkan pada tanggal 10 Juni 1988 di Pekanbaru dari pasangan Drs. Yufrizal, M.Si dan Ir. Henni Syawal, M.Si. Penulis merupakan anak kedua dari tiga bersaudara.
Tahun 1999 penulis menamatkan sekolah dasar di SDN 006 Pekanbaru. Setelah itu penulis melanjutkan pendidikan ke SLTPN 21 Pekanbaru dan lulus pada tahun 2002. Selama tiga tahun kemudian penulis menimba ilmu di SMAN 4 Pekanbaru dan lulus dengan predikat juara umum pada tahun 2005. Pada tahun itu juga, penulis melanjutkan pendidikan tinggi di Institut Pertanian Bogor melalui jalur seleksi penerimaan mahasiswa baru (SPMB). Setelah satu tahun di tingkat persiapan bersama (TPB), penulis diterima di Departemen Ilmu dan Teknologi Pangan (ITP).
Selama berkuliah di IPB, penulis aktif dalam berbagai kegiatan organisasi. Penulis pernah menjadi pengurus aktif Ikatan Keluarga Pelajar dan Mahasiswa Pekanbaru (IKPMR) Bogor, klub fotografi LENSA, Himpunan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA), Food Chat Club (FCC), dan majalah peduli pangan dan gizi EMULSI. Penulis juga aktif dalam kegiatan program kreativitas mahasiswa (PKM). Penulis pernah melakukan tiga judul kegiatan penelitian yang didanai DIKTI. Satu di antaranya membawa penulis bersama tim PKM menjadi salah satu delegasi IPB dalam PIMNAS XXI dan mendapatkan penghargaan setara perunggu dalam presentasi poster. Selain itu, pada PKM bidang penulisan ilmiah, tim penulis pernah menjadi tim yang didanai untuk dua judul karya tulis. Kompetisi non PKM juga pernah penulis ikuti. Penulis bersama tim menjadi juara ke-3 dalam acara National Student Paper Competition.
Penulis tergabung dalam tim penerima dana bantuan usaha dari DPKHA IPB. Penulis bersama tim membuka usaha café di sekitar kampus. Nama café
tersebut adalah Friends 24.
i KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT yang telah memberikan rahmat dan karunia sehingga penulis dapat menyelesaikan skripsi dengan judul Profil dan Peroksidasi Lipid Tikus Percobaan Setelah Pemberian Tepung Tempe Kacang Komak (Lablab purpureus (L.) Sweet)..
Secara khusus penulis mengucapkan terima kasih kepada kedua pembimbing dan penguji penulis. Terima kasih kepada Ibu Dr. Ir. Nurheni Sri Palupi M.Si yang telah dengan sabar membimbing penulis sejak semester tiga. Terima kasih kepada Bapak Arif Hartoyo, STP, M.Si yang telah memberi penulis kesempatan untuk melakukan penelitian ini sehingga banyak pengalaman dan ilmu yang penulis dapatkan. Terima kasih kepada Bapak Dr. Sukarno yang telah bersedia menjadi dosen penguji pada ujian akhir penulis. Penulis juga mengucapkan terima kasih kepada:
1. Papa, Mama, Aal, dan Uta yang selalu menjadi bagian terpenting dalam hidup penulis.
2. Tante rina, Tante ridha, Om Yudi, Nantan, Nenek, Uncu, Apuk, Puti, Izza, Tante Mimi, Om Hendro, Inez, dan Alif yang telah menjadi keluarga terdekat penulis selama berkuliah di IPB.
3. Ayah, almarhumah Ibu, Nenek, Buya, Etek Nan, dan keluarga besar penulis lainnya yang selalu mendoakan penulis.
4. Guru-guru dan dosen-dosen penulis yang telah mewariskan ilmunya kepada penulis. Semoga penulis dapat mewariskannya kembali dan menerapkannya. 5. Sahabat-sahabat terbaik yang selalu mewarnai hidup penulis, Diana, Secha,
Dini, Wina, Ami, Fani, Nutri, Iin, Susan, Septi, Rika, Riri, Era, Mrs. Umar, Iwik, Resti, Santhy, Nola, Noli, dan Fifi.
6. Sahabat sepenelitian, Rika, yang telah berjuang bersama dalam semangat dan keceriaan.
7. Iin untuk bertumpuk bahan kuliah yang rapi dan sangat bermanfaat.
ii 9. Arya untuk sekantong energinya, Ari untuk motor dan seliter bensinnya, Arya, Ari, Riza, dan Adi Leo untuk tenaga dalam mengangkut ransum dan kacang komak.
10. Laboran-laboran yang selalu sabar membantu penulis, Pak Adi, Pak Jun, Pak Deni, Pak Wachid, Pak Rojak, Pak Gatot, Mas Edi, Pak Taufik, dan Bu Dewi, serta Pak Ganda yang telah membantu dalam eutanasia tikus.
11. Mbak rini untuk baju bersih dan wangi selama tiga tahun.
12. Cocoguters (Iin, Muji, Kak Tomi, Kak Tuko) yang membawa penulis dalam pengalaman-pengalaman baru yang menyenangkan.
13. Keluarga belalang (Nutri, Dita Hui, Kocan, Kak Rahmat) untuk keceriaan dan pengalaman penelitian pertama penulis.
14. Keluarga Friends 24, Fahmi, Risma, Tiwi, Riza, Widya, Widi, Jali, Zul, Tito, dan Rina untuk pengalaman bisnisnya, semoga F24 sukses selalu.
15. Sahabat-sahabat LENSA, IKPMR, EMULSI, dan Himitepa. Dari mereka penulis belajar banyak tentang berorganisasi.
16. Sahabat-sahabat satu kamar penulis di asrama TPB (Ijup, Puti, Satya) yang telah satu tahun menjadi keluarga penulis di asrama.
17. Saudari-saudari sekelompok liqoq penulis (mba Yana, Ike, Galih, Reriel, Retno, Susan, Fitri, Ica, Mike, Upik, dll).
18. Pegawai-pegawai UPT yang sangat baik.
19. Keluarga ITP 42 yang telah memberikan semangat untuk terus maju, memberikan atmosfer kehidupan untuk terus berkarya, dan memberikan arti tanggung jawab dan etos kerja. Semoga angka 42 menjadi doa bagi kebersamaan kita (42 = 4ever 2gether).
Bogor, Januari 2010
iii DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan ... 2
BAB II. TINJAUAN PUSTAKA ... 3
A. Kacang Komak ... 3
B. Tempe ... 4
C. Tepung Tempe ... 6
D. Metabolisme Lipid ... 6
E. Kolesterol ... 8
F. Malonaldehida ... 9
G. Tikus Percobaan ... 10
BAB III. METODOLOGI PENELITIAN ... 12
A. Bahan dan Alat ... 12
1. Bahan ... 12
2. Alat ... 12
B. Metoda Penelitian ... 13
1. Tahap 1 Persiapan Sampel ... 13
a. Pembuatan Tempe Kacang Komak ... 13
b. Pembuatan Tepung Tempe Kacang Komak ... 16
c. Analisis Proksimat Tepung Tempe Kacang Komak ... 17
2. Tahap 2 Pengujian In Vivo ... 20
a. Persiapan dan Pembuatan Ransum ... 20
b. Masa Adaptasi Tikus ... 20
c. Masa Perlakuan ... 22
d. Persiapan Sampel Darah dan Organ ... 22
iv
BAB IV HASIL DAN PEMBAHASAN ... 27
A. Tempe dan Tepung Tempe ... 27
B. Pertumbuhan dan Konsumsi Ransum ... 27
C. Berat Organ ... 32
D. Profil Lipid Tikus ... 34
1. Total Kolesterol Serum Darah ... 34
2. Kadar Trigliserida Serum Darah ... 37
3. Kadar High Density Lipoprotein (HDL) Serum Darah ... 39
4. Kadar Low Density Lipoprotein (LDL) Serum Darah ... 42
5. Indeks Aterogenik (IA) ... 44
E. Peroksidasi Lipid (Malonaldehida (MDA)) ... 45
BAB V KESIMPULAN DAN SARAN ... 48
DAFTAR PUSTAKA ... 50
v DAFTAR TABEL
Tabel 1 Komposisi Kimia Kacang Komak Dibandingkan Kacang Kedelai
(per 100 g Berat Basah) ... 3
Tabel 2 Nilai Gizi Kedelai dan Tempe Kedelai ... 5
Tabel 3 Potensi Senyawa Aktif pada Tempe Kedelai ... 6
Tabel 4 Komposisi Lipoprotein Plasma Darah (%) ... 7
Tabel 5 Komposisi Ransum Tikus ... 21
Tabel 6 Komposisi VitaminFitkom ... 21
Tabel 7 Komposisi Campuran Mineral ... 21
Tabel 8 Komposisi Reagen Kolesterol ... 23
Tabel 9 Komposisi Reagen Presepitasi ... 24
Tabel 10 Komposisi Reagen Trigliserida ... 25
Tabel 11 Kandungan Gizi Tepung Tempe Kacang Komak ... 28
vi DAFTAR GAMBAR
Gambar 1 Kerangka Pemikiran Penelitian ... 14
Gambar 2 Prosedur Pembuatan Tempe Kacang Komak ... 16
Gambar 3 Prosedur Pembuatan Tepung Tempe Kacang Komak ... 17
Gambar 4 Prosedur Analisis Total Kolesterol ... 23
Gambar 5 Prosedur Persiapan Sampel Analisis Kadar HDL ... 24
Gambar 6 Prosedur Analisis Total HDL ... 24
Gambar 7 Prosedur Analisis Total Trigliserida Standar ... 25
Gambar 8 Prosedur Analisis MDA pada Organ Hati dan Limpa ... 26
Gambar 9 Kurva Pertumbuhan Berat Badan Tikus Selama Perlakuan ... 28
Gambar 10 Berat Organ Relatif (A) Berat Hati Relatif, (B) Berat Ginjal Relatif, (C) Berat Limpa Relatif Tikus Percobaan ... 33
Gambar 11 Total Kolesterol Tikus Percobaan ... 35
Gambar 12 Kadar Trigliserida Tikus Percobaan ... 38
Gambar 13 Kadar HDL Serum Darah Tikus Percobaan ... 40
Gambar 14 Kadar LDL Serum Darah Tikus Percobaan ... 42
Gambar 15 Indeks Aterogenik Tikus Percobaan ... 44
vii DAFTAR LAMPIRAN
Lampiran 1 Contoh Perhitungan Penyusunan Ransum Tempe ... 56
Lampiran 2 Analisis Sidik Ragam Pertambahan Berat Badan ... 57
Lampiran 3 Analisis Sidik Ragam Konsumsi Ransum ... 58
Lampiran 4 Analisis Sidik Ragam Berat Hati Relatif ... 59
Lampiran 5 Analisis Sidik Ragam Berat Ginjal Relatif ... 60
Lampiran 6 Analisis Sidik Ragam Berat Limpa Relatif ... 61
Lampiran 7 Analisis Sidik Ragam Total Kolesterol Serum Darah ... 62
Lampiran 8 Analisis Sidik Ragam Kadar Trigliserida Serum Darah ... 63
Lampiran 9 Analisis Sidik Ragam Kadar HDL Serum Darah ... 64
Lampiran 10 Analisis Sidik Ragam Kadar LDL Serum Darah Tikus ... 65
Lampiran 11 Analisis Sidik Ragam Indeks Aterogenik ... 66
Lampiran 12 Kurva Standar TEP ... 67
Lampiran 13 Analisis Sidik Ragam MDA Hati ... 68
1 BAB I
PENDAHULUAN
A. Latar Belakang
Penyakit jantung koroner (PJK) merupakan penyakit yang menyebabkan kematian sekitar 15 juta jiwa atau sekitar 30% dari total penyebab kematian dan diperkirakan meningkat mencapai 40% pada tahun 2020 (WHO 2001). Salah satu penyebab terjadinya PJK adalah kondisi hiperkolesterolemia yang sangat mendukung terbentuknya aterosklerosis. Hiperkolesterolemia adalah kondisi kolesterol di dalam darah meningkat melebihi batas ambang normal yang ditandai dengan meningkatnya kadar kolesterol LDL (low density lipoprotein) dan kolesterol total (Montgomery et al. 1993). Beberapa penelitian telah membuktikan bahwa LDL yang teroksidasi berperan pada terjadinya aterosklerosis (Langseth 1995).
Fenomena PJK dan hubungannya dengan distribusi kolesterol dalam lipoprotein sangat penting untuk diketahui karena konsentrasi total kolesterol yang tinggi belum tentu menyebabkan aterosklerosis bila diimbangi dengan peningkatan jumlah HDL (high density lipoprotein). Sitepoe (1993) menyatakan bahwa nisbah LDL/HDL dapat digunakan sebagai indikator untuk mengetahui tingkat aterosklerosis. Rekomendasi diet anti aterogenik menurut Wolf (1996) hendaknya lebih ditekankan pada penurunan LDL daripada menghindari penurunan HDL, karena pemberian diet rendah lemak dan rendah kolesterol tidak hanya menurunkan LDL tetapi juga menurunkan HDL dan demikian juga sebaliknya.
Tempe kedelai telah diketahui dapat menurunkan kolesterol dan LDL serta dapat meningkatkan HDL darah dan status antioksidan tubuh (Brata-Arbai 2001). Namun kedelai yang merupakan bahan baku tempe kedelai merupakan tanaman subtropis yang tidak dapat tumbuh optimum di Indonesia, sehingga Indonesia harus mengimpor kedelai. Setiap tahunnya, Indonesia
rata-rata mengimpor kedelai sebanyak 2,3 juta ton (1996-2005). Hampir 50% dari total impor kedelai Indonesia didominasi oleh Amerika Serikat (Sawit et al.
2 morfologi maupun fungsional dan merupakan tanaman tropis untuk menyubtitusi kedelai agar mengurangi jumlah impor kedelai.
Kacang komak merupakan kacang yang berpotensi menyubtitusi kacang kedelai. Kacang komak yang dapat tumbuh optimal di Indonesia, selain memiliki penampakan seperti kedelai, juga telah dibuktikan dapat menurunkan kadar kolesterol, LDL, dan trigliserida serum darah tikus seperti halnya kedelai (Nugroho 2007).
Kacang komak juga dapat dijadikan tempe (tempe kacang komak). Namun sifat fungsionalnya, terutama kemampuan dalam memperbaiki profil lipid darah dan status antioksidan tubuh belum diketahui. Oleh karena itu dibutuhkan uji in vivo untuk mengetahuinya. Namun uji in vivo tempe kacang komak segar akan mengalami kesulitan pada persiapan sampel. Hal ini karena tempe kacang komak belum dijual di pasaran dan umur simpannya singkat. Untuk meningkatkan umur simpan dan mempermudah dalam persiapan sampel maka pada penelitian ini tempe kacang komak segar ditepungkan sehingga didapat tepung tempe kacang komak.
B. Tujuan
Tujuan penelitian ini adalah sebagai berikut:
1. Mengevaluasi pengaruh konsumsi tepung tempe kacang komak terhadap profil lipid darah tikus, yaitu total kolesterol, trigliserida, HDL, dan LDL. 2. Mengevaluasi pengaruh konsumsi tepung tempe kacang komak terhadap
3 BAB II
TINJAUAN PUSTAKA
A. Kacang Komak
Kacang komak (Lablab purpureus (L.) Sweet) termasuk ordo leguminoseae dan sub kelas dikotiledon. Kacang komak diduga berasal dari India, Asia Tenggara, dan Afrika. Kacang komak diyakini dapat membantu dalam usaha mengatasi kekurangan protein, karena kacang komak mempunyai nilai gizi yang cukup tinggi, berupa protein, lemak, zat-zat gizi lainnya dan komposisi asam amino yang baik. Kadar protein kacang komak sebesar 21,5% dengan susunan asam amino yang mendekati pola protein kedelai (Martoyuwono 1984).
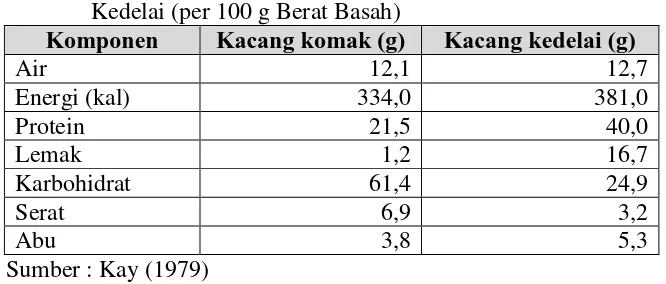
Nilai gizi kacang komak menempati urutan ketiga setelah kacang tanah dan kedelai. Kandungan lemak dan serat biji kacang komak terendah di antara kacang-kacangan yang banyak ditanam di Indonesia. Hal tersebut membuat kacang komak berpotensi menggantikan sebagian atau seluruh bahan baku pangan, misalnya kedelai. Tempe, tauco, kecap, tepung komposit, makanan bayi, dan konsentrat protein adalah produk yang dapat dihasilkan dari kacang komak (Utomo et al. 1991). Tabel 1 menunjukkan perbedaan komposisi kacang komak dan kacang kedelai.
Tabel 1. Komposisi Kimia Kacang Komak Dibandingkan Kacang Kedelai (per 100 g Berat Basah)
Komponen Kacang komak (g) Kacang kedelai (g)
Air 12,1 12,7
Energi (kal) 334,0 381,0
Protein 21,5 40,0
Lemak 1,2 16,7
Karbohidrat 61,4 24,9
Serat 6,9 3,2
Abu 3,8 5,3
Sumber : Kay (1979)
4 macam (fraksi) protein yaitu albumin, globulin, glutelin, dan prolamin. Albumin adalah protein yang larut dalam air dan garam encer serta dapat terkoagulasi karena panas. Globulin adalah protein yang tidak larut air tetapi larut dalam garam encer dan juga terkoagulasi bila dipanaskan. Glutein adalah protein yang tidak larut dalam semua pelarut yang netral, tetapi larut dalam asam dan basa yang sangat encer. Prolamin adalah protein yang tidak larut dalam air tetapi larut dalam etanol 70-80%. Penggolongan protein tersebut termasuk jenis protein sederhana yaitu protein yang bila dihidrolisis hanya menghasilkan asam amino α. Berdasarkan golongan protein konjugasi, protein kacang-kacangan termasuk anak golongan glikoprotein karena bila terhidrolisis menghasilkan karbohidrat sebagai gugus prostetik selain asam amino. Berdasarkan fungsi atau sifat fisiologinya, protein kacang-kacangan yang dimasukkan dalam anak golongan glikoprotein dikelompokkan lagi menjadi protein simpanan (Robinson 1995). Protein yang dikategorikan protein simpanan adalah protein yang terakumulasi pada waktu proses pembentukan biji, kaya kandungan nitrogen, dan tersimpan dalam protein bodies pada sel kotiledon. Protein simpanan utama pada tanaman leguminosae adalah globulin (Ersland et al. 1983).
Kacang komak kering umumnya mengandung protein sebesar 21-29 g per 100 g (Tabel 1). Komposisi asam amino esensial kacang komak bila dibandingkan dengan pola FAO/WHO kaya asam amino lisin dan defisiensi asam amino metionin dan sistin, seperti kebanyakan tanaman leguminosae. Protein utama kacang komak adalah globulin, yaitu dolichosin (Kay 1979; Duke 1983).
B. Tempe
Tempe di Indonesia biasa diidentikkan dengan kacang kedelai. Syarief
5 bongkrek, dan tempe gude (Sapuan dan Sutrisno 1996). Tempe yang dibuat dari bahan baku kacang komak dapat pula disebut sebagai tempe kacang komak atau tempe komak.
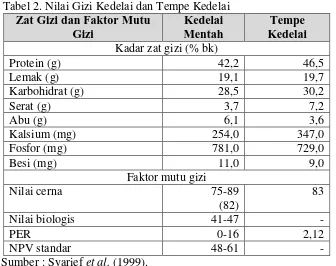
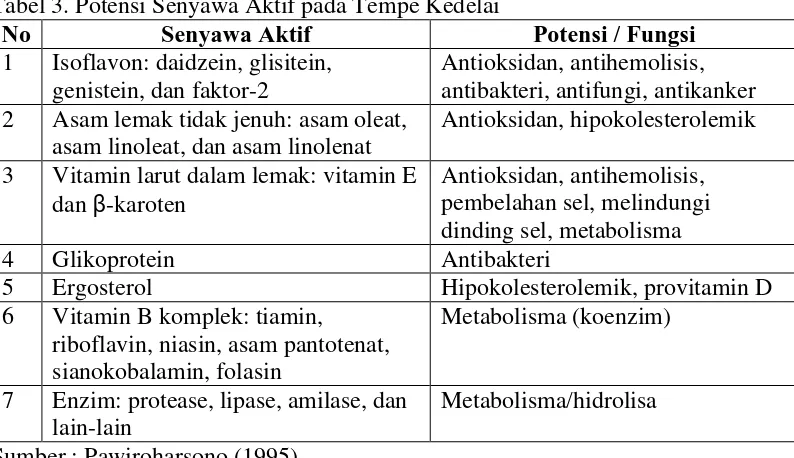
Proses fermentasi pada tempe menyebabkan komponen-komponen kacang dihidrolisa menjadi senyawa-senyawa yang lebih sederhana dan mudah dicerna. Pengolahan kacang-kacangan menjadi tempe akan meningkatkan kandungan protein, asam amino esensial, mutu protein, dan kandungan zat gizi lainnya, seperti terlihat pada Tabel 2. Selain itu tempe juga mengandung beberapa senyawa aktif. Senyawa-senyawa tersebut dihasilkan melalui proses transformasi dan sintesa oleh mikroorganisme pada proses pembuatan tempe dan khususnya pada perendaman dan proses pemeraman. Tabel 3 menunjukkan hasil identifikasi sejumlah senyawa aktif pada tempe, baik menurut jenis maupun potensinya (Syarief et al. 1999).
Tabel 2. Nilai Gizi Kedelai dan Tempe Kedelai Zat Gizi dan Faktor Mutu
Gizi
6 Tabel 3. Potensi Senyawa Aktif pada Tempe Kedelai
No Senyawa Aktif Potensi / Fungsi
1 Isoflavon: daidzein, glisitein, genistein, dan faktor-2
Antioksidan, antihemolisis, antibakteri, antifungi, antikanker 2 Asam lemak tidak jenuh: asam oleat,
asam linoleat, dan asam linolenat
Antioksidan, hipokolesterolemik
3 Vitamin larut dalam lemak: vitamin E dan β-karoten
Antioksidan, antihemolisis, pembelahan sel, melindungi dinding sel, metabolisma
4 Glikoprotein Antibakteri
5 Ergosterol Hipokolesterolemik, provitamin D
6 Vitamin B komplek: tiamin, riboflavin, niasin, asam pantotenat, sianokobalamin, folasin
Metabolisma (koenzim)
7 Enzim: protease, lipase, amilase, dan lain-lain
Metabolisma/hidrolisa
Sumber : Pawiroharsono (1995)
kesehatan, (2) dapat tumbuh dengan cepat, dan (3) tahan terhadap kontaminan. Jenis kapang yang biasa ada pada tempe adalah R. oligosporus, R. oryzae, R. stolonifer, dan R. Arrhizus (Syarief et al. 1999).
C. Tepung Tempe
Tempe merupakan produk fermentasi yang tidak dapat bertahan lama. Setelah dua hari, tempe akan mengalami pembusukan sehingga tidak dapat dikonsumsi oleh manusia. Tempe yang sudah busuk masih bisa dimanfaatkan sebagai bahan masakan namun fungsinya telah banyak mengalami penurunan (Syarief et al. 1999).
Salah satu cara untuk memperpanjang umur simpan tempe adalah dengan mengolahnya menjadi tepung tempe. Manfaat pembuatan tepung ini antara lain mudah dicampur dengan tepung lain untuk meningkatkan nilai gizinya dan mudah disimpan dan diolah menjadi makanan yang cepat dihidangkan (Syarief et al. 1999). Hasil penelitian secara in vivo menunjukkan nilai gizi protein tepung tempe hampir sama dengan kasein (Mardiah 1994).
D. Metabolisme Lipid
7 lipoprotein (Soetardjo 1990) sehingga dapat didistribusikan dalam fluida tubuh.
Lipoprotein adalah partikel berbentuk sferis yang terdiri dari ratusan molekul lipid dan protein. Lipid utama dalam lipoprotein adalah kolesterol, trigliserida, dan fosfolipid. Trigliserida dan bentuk esterifikasi kolesterol adalah lemak non polar yang tidak larut air (hidrofobik) yang membentuk inti lipoprotein. Fosfolipid dan sejumlah kecil kolesterol bebas yang larut dalam lipid dan air, menutupi permukaan partikel dan bertindak sebagai pembatas antara komponen inti dan plasma. Apolipoprotein menempati permukaan lipoprotein dan berfungsi sebagai pemisah antara lipid dengan lingkungan berair, serta mempunyai peran sangat penting dalam pengaturan transpor lipid dan metabolisme protein (Ginsberg dan Goldberg 1998).
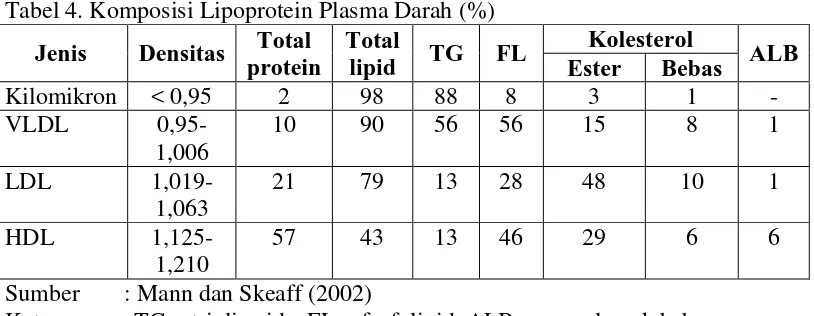
Berdasarkan densitasnya, lipoprotein dikelompokkan menjadi empat yaitu: kilomikron, very low density lipoprotein (VLDL), low density lipoprotein (LDL), dan high density lipoprotein (HDL). Komposisi lipoprotein dapat dilihat pada Tabel 4.
Tabel 4. Komposisi Lipoprotein Plasma Darah (%)
Jenis Densitas Total protein
Keterangan : TG = trigliserida, FL = fosfolipid, ALB = asam lemak bebas
Kilomikron terbentuk dalam mukosa usus halus dari trigliserida yang dipecah melalui metabolisme dalam usus. Kilomikron berfungsi membawa trigliserida ke jaringan tubuh sebagai sumber asam lemak yang dapat segera digunakan atau untuk disimpan sebagai cadangan (Soetardjo 1990).
8 Trigliserida diambil dari VLDL dengan bantuan enzim lipoprotein lipase, kemudian masuk ke dalam jaringan sebagai sumber energi yang dapat segera dipakai atau disimpan kembali (Mann dan Skeaff 2002).
LDL adalah produk akhir dari metabolisme VLDL, namun terdapat bukti bahwa sebagian diproduksi langsung oleh hati (Mayes 1996). LDL berfungsi membawa kolesterol dari hati ke jaringan perifer yang akan digunakan untuk konstruksi membran atau untuk pembentukan hormon steroid. LDL membawa sekitar 70% kolesterol dalam plasma (Mann dan Skeaff 2002).
HDL disintesis di hati dan usus halus. HDL berperan dalam membawa kolesterol dari jaringan tubuh ke hati untuk kemudian diubah menjadi asam empedu dan selanjutnya disimpan atau dibuang melalui empedu ke usus besar sebagai rute utama mekanisme pembuangan dari tubuh. Sehingga, HDL memegang peranan penting dalam mengatur jumlah kolesterol yang tinggal dalam jaringan tubuh, termasuk dalam dinding arteri (Soetardjo 1990).
E. Kolesterol
Kolesterol merupakan komponen esensial dari membran sel dan merupakan komponen utama sel-sel otak dan jaringan syaraf (Krause dan Mahan 1984). Sedangkan menurut Mayes et al. (1987) kolesterol adalah produk khas dari metabolisme hewan dan oleh karenanya terdapat dalam makanan yang berasal dari hewan seperti daging, hati, otak, dan kuning telur. Sebagian besar kolesterol berasal dari sintesis (kira-kira 1 g/hari) sedangkan sekitar 0.3 g/hari dilengkapi dari konsumsi makanan. Menurut Sitepoe (1993) bila ditinjau dari sudut kimiawi, kolesterol diklasifikasikan ke dalam golongan lipid (lemak), berkomponen alkohol steroid, sebagian besar berfungsi sebagai sumber kalori serta memberikan nilai tambah terhadap cita rasa makanan.
9 semua sel yang mengandung nukleus, tetapi yang terbesar terjadi pada hati, usus, korteks, adrenal, dan jaringan produktif. Pada kondisi normal kolesterol disintesa di dalam tubuh sebanyak dua kali dari kadar kolesterol di dalam makanan yang dimakan (Sitepoe 1993). Jumlah laju sintesis kolesterol de novo berhubungan dengan jumlah kolesterol yang berasal dari makanan, jika jumlah kolesterol di dalam diet meningkat maka sintesis kolesterol di dalam hati dan usus akan menurun. Sebaliknya jika jumlah kolesterol dari makanan berkurang maka sintesis kolesterol di dalam hati dan usus akan meningkat (Muchtadi et al. 1993).
Kolesterol yang disintesa diubah menjadi jaringan, hormon, dan vitamin yang kemudian beredar ke dalam tubuh melalui darah (Sitepoe 1993). Namun demikian kolesterol ada yang kembali ke hati untuk diubah menjadi asam empedu dan garam. Dalam keadaan normal bila terjadi gangguan konsumsi kolesterol, maka akan terjadi mekanisme untuk mempertahankan keseimbangan kolesterol dengan semua faktor sebagai mekanisme pertahanan.
Linder (1992) menyatakan kadar kolesterol normal dalam plasma pada orang dewasa normal sebesar 3,1-5,7 mmol/l (120-220 mg/dl). Biasanya kadar kolesterol yang melebihi batas ini dianggap sebagai hiperkolesterolemia.
Terdapat beberapa faktor yang dapat menurunkan kolesterol dalam darah. Beberapa faktor tersebut di antaranya adalah penurunan kalori yang dikonsumsi, penurunan konsumsi lemak jenuh dan lemak tidak jenuh, penurunan konsumsi kolesterol, penurunan kadar lipoprotein, konsumsi serat pangan larut air (SDF), dan konsumsi beberapa jenis bahan kimia. Beberapa bahan kimia yang diindikasikan memiliki potensi hipokolesterolemik tersebut adalah sitosterol, niasin, vitamin C, vitamin E, dan karoten (Sitepoe 1993).
F. Malonaldehida
10 kebocoran sistem mitokondria, oksidasi lipida, exercise (olah raga), dan dekomposisi asam amino serta komponen karbohidrat.
Salah satu metode pengukuran MDA adalah dengan thiobarbituric acid reactivity test. Metode ini didasarkan pada reaksi antara MDA dan TBA (thiobarbituric acid) dalam suasana asam. MDA dapat melakukan reaksi penambahan nukleofilik dengan TBA membentuk kompleks MDA-TBA. Kompleks MDA-TBA yang terbentuk memiliki warna merah jambu dan absorbansinya dapat diukur pada panjang gelombang 532 nm (Conti et al.
1991).
Menurut Nawar (1985), metode uji TBA merupakan metode yang paling banyak digunakan untuk mengukur keberadaan radikal bebas dan peroksida lipid dikarenakan mempunyai kepekaan yang cukup tinggi, mudah diaplikasikan untuk berbagai sampel pada berbagai tahap oksidasi lipid, dan biayanya tidak mahal.
G. TIKUS PERCOBAAN
Tikus atau rat (Rattus norvegicus) telah diketahui sifat-sifatnya dengan sempurna, mudah dipelihara, merupakan hewan yang relatif sehat dan cocok untuk berbagai macam penelitian. Terdapat beberapa galur atau varietas tikus yang memiliki kekhususan tertentu, salah satunya adalah galur spargue-dawley. Spargue-dawley memiliki ciri-ciri berwarna albino putih, berkepala kecil, dan ekornya lebih panjang dari pada badannya (Malole dan Pramono 1989).
Tikus tidak memiliki kantong empedu. Seperti rodentia lainnya, tikus terutama yang muda memiliki jaringan lemak berwarna coklat di bagian leher sampai scapula yang jumlahnya berkurang setelah dewasa. Tikus dapat dikandangkan bersama dalam satu kelompok besar yang terdiri dari jantan dan betina dari berbagai tingkat tanpa terjadinya perkelahian yang berarti. Tikus yang lepas dari kandang umumnya akan kembali ke kandangnya. Tikus dapat hidup lebih dari tiga tahun (Malole dan Pramono 1989).
11 cm2/ekor (berat tikus sekitar 300 g). Tinggi kandang harus lebih dari 18 cm. Temperatur kandang yang ideal adalah 18-27oC dengan rata-rata 22oC dan kelembaban relatif 40-70%. Pemberian penerangan cukup selama 12 jam/hari, karena bila lebih dari 12 jam akan mempengaruhi siklus birahi. Rodensia umumnya, terutama rodensia yang aktif di malam hari (nocturnal) seperti tikus, senang pada cahaya remang-remang. Perlu diperhatikan agar alas kandang selalu kering dan tidak berbau untuk mencegah gangguan respirasi serta alat-alat dalam kandang harus dibersihkan 1-2 kali seminggu (Malole dan Pramono 1989).
12 BAB III
METODOLOGI PENELITIAN
A. Bahan dan Alat 1. Bahan
a. Bahan Baku
Bahan baku yang digunakan yaitu kacang komak (Lablab purpureus (L.) Sweet) yang didapat dari petani di Probolinggo, Jawa Timur.
b. Tikus Percobaan
Tikus percobaan yang digunakan merupakan tikus jantan jenis spargue dawley umur 40 hari.
c. Bahan Makanan Tikus
Bahan yang digunakan sebagai makanan tikus dalam penelitian ini adalah pati jagung, kasein, sukrosa, minyak kedelai, CMC, mineral mix, vitamin mix, kolesterol, PTU (propiltiourasil), dan tepung tempe kacang komak.
d. Bahan Analisis
Bahan-bahan untuk analisis proksimat antara lain K2SO4, HgO,
H2SO4 pekat, NaOH-Na2S2O3, H3BO3, indikator biru metilen, HCl, dan
pelarut n-heksana. Bahan untuk analisis total kolesterol dan HDL yaitu reagen kit cholesterol FS dan HDL precipitant FS dengan metode CHOD-PAP. Bahan analisis trigliserida yaitu tryglyserides FS dengan metode GPO-PAP. Bahan-bahan untuk analisis malonaldehida yaitu larutan PBS, larutan TCA 15%, dan larutan TBA 0,37% dalam HCl 0,25 N.
2. Alat
a. Alat Pemeliharaan Tikus
13 b. Alat Pembedah Tikus
Alat yang digunakan dalam pembedahan tikus adalah gunting, pinset, jarum suntik, papan pembedahan, dan alat-alat gelas.
c. Alat Analisis
Alat yang digunakan untuk analisis proksimat antara lain oven, tanur, ekstraktor soxhlet, labu kjeldahl, alat-alat gelas, cawan aluminium, cawan porselen. Alat-alat yang digunakan untuk analisis kolesterol, trigliserida, HDL, LDL, dan malonaldehida meliputi spektrofotometer, sentrifuse, penangas air, tabung reaksi, tabung sentrifuse, pipet mikro, kuvet, dan kuvet mikro.
B. Metoda Penelitian
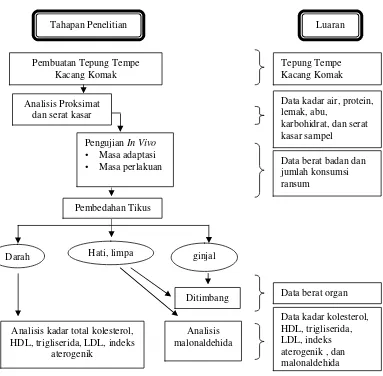
Tahap pertama penelitian ini adalah persiapan sampel, yaitu tepung tempe kacang komak. Tepung tempe dianalisis nilai gizinya yang terdiri dari kadar protein, lemak, karbohidrat, air, abu, dan serat kasar. Data tersebut digunakan untuk merancang komposisi ransum tikus. Setelah sampel disiapkan, tikus mulai dipelihara. Masa adaptasi tikus adalah 1 minggu. Masa perlakuan selama 36 hari. Selama masa perlakuan, secara berkala dilakukan penghitungan jumlah konsumsi ransum dan pengukuran berat badan. Pada akhir perlakuan, dilakukan pembedahan tikus. Serum darah tikus digunakan untuk menentukan total kolesterol, HDL, trigliserida, LDL, dan indeks aterogenik. Hati dan limpa digunakan untuk analisis MDA (malonaldehida). Organ tikus hati, ginjal, dan limpa ditimbang sebagai data pendukung. Secara garis besar, rancangan penelitian yang dilakukan beserta output yang diharapkan dapat dilihat pada Gambar 1.
1. Tahap 1 Persiapan Sampel
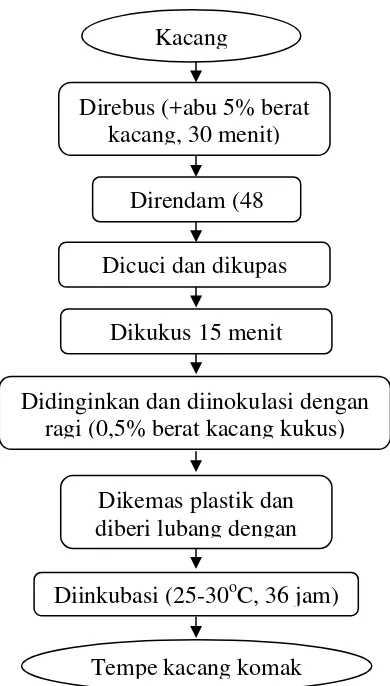
a. Pembuatan Tempe Kacang Komak (Harnani 2009)
14
Gambar 1. Kerangka Pemikiran Penelitian.
Tahapan Penelitian Luaran
Tujuan
Mengetahui profil lipid darah tikus. Profil lipid tersebut mencakup total kolesterol, trigliserida, HDL, dan LDL.
16 didinginkan pada suhu ruang. Kacang komak yang sudah dingin kemudian diinokulasi dengan ragi tempe RAPRIMA sebanyak 0,5% dari berat kacang kukus. Kacang komak yang telah diinokulasi tersebut kemudian dibungkus dalam plastik dan diberi lubang dengan jarak 2 cm. Kacang komak yang telah dikemas tersebut kemudian diinkubasi pada suhu kamar (25-30oC) selama 36 jam sehingga dihasilkan tempe kacang komak segar. Prosedur pembuatan tempe kacang komak disajikan pada Gambar 2.
Gambar 2. Prosedur Pembuatan Tempe Kacang Komak
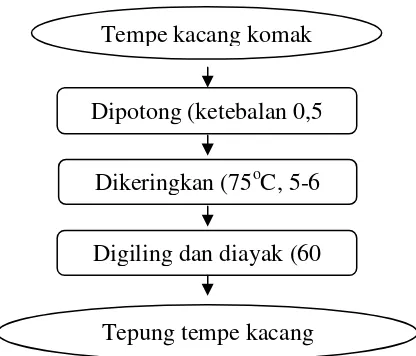
b. Pembuatan Tepung Tempe Kacang Komak (Harnani 2009)
Tempe segar dipotong dengan ketebalan sekitar 0,5 cm, kemudian dikeringkan selama 5-6 jam pada suhu 75oC. Tempe kering ini kemudian digiling dengan pin disc mill dan diayak dengan ayakan berukuran 60 mesh sehingga dihasilkan tepung tempe. Prosedur pembuatan tempe kacang komak disajikan pada Gambar 3.
Kacang
Direbus (+abu 5% berat kacang, 30 menit)
Direndam (48
Dicuci dan dikupas
Dikukus 15 menit
Didinginkan dan diinokulasi dengan ragi (0,5% berat kacang kukus)
Dikemas plastik dan diberi lubang dengan
Diinkubasi (25-30oC, 36 jam)
17 Gambar 3. Prosedur Pembuatan Tepung Tempe Kacang Komak
c. Analisis Proksimat Tepung Tempe Kacang Komak 1) Analisis Kadar Air Metode Oven (AOAC 1995)
Kadar air diukur dengan metode oven biasa karena kandungan bahan volatil pada sampel rendah dan sampel tidak terdegradasi pada suhu 100oC. Cawan aluminium kosong dikeringkan dalam oven suhu 105oC selama 15 menit lalu didinginkan dalam desikator selama 5 menit atau sampai tidak panas lagi. Cawan ditimbang dan dicatat beratnya. Lalu ditimbang sampel sebanyak 5 g di dalam cawan tersebut. Sampel dikeringkan dalam oven sampai beratnya konstan (perubahan berat tidak lebih dari 0,003 g). Setelah itu cawan didinginkan di dalam desikator. Ditimbang berat akhirnya. Dihitung kadar air dengan persamaan berikut:
Kadar air (% b/b) = 100%
Keterangan :
x = berat cawan dan sampel sebelum dikeringkan (g) y = berat cawan dan sampel setelah dikeringkan (g) a = berat cawan kosong (g)
2) Analisis Kadar Abu (AOAC 1995)
Cawan porselen dibakar dalam tanur selama 15 menit kemudian didinginkan di dalam desikator. Setelah dingin ditimbang. Kemudian sampel sebanyak 5 g ditimbang di dalam cawan lalu
Dipotong (ketebalan 0,5
Dikeringkan (75oC, 5-6
Digiling dan diayak (60 Tempe kacang komak
18 diabukan di dalam tanur hingga diperoleh abu berwarna putih dan beratnya tetap. Setelah itu, cawan didinginkan di dalam desikator lalu ditimbang.
Perhitungan :
Kadar abu (%b/b) = W2
W1
×100%
Keterangan :
W1 = berat sampel (g)
W2 = berat abu (g)
3) Analisis Kadar Protein (AOAC 1995)
Sampel sebanyak 0,1-0,2 g dimasukkan ke dalam labu
kjedahl 100 ml, lalu ditambahkan 2 g K2SO4, 40 mg HgO, dan 2,5
ml H2SO4 pekat. Setelah itu, didestruksi selama 30 menit sampai
cairan berwarna jernih dan dibiarkan sampai dingin. Selanjutnya ditambahkan air suling secukupnya dan 10 ml NaOH pekat sampai berwarna coklat kehitaman dan didestilasi. Hasil destilasi ditampung dalam erlenmeyer 125 ml yang berisi H2BO3 dan indikator,
kemudian dititrasi dengan HCl 0,02 N. Larutan blanko juga dianalisis seperti sampel. Kadar nitrogen dihitung berdasarkan rumus
% Nitrogen = V HCl – V blanko ml N HCl 14,007 faktor konversi
mg contoh ×100%
4) Analisis Kadar Lemak Metode Soxhlet (AOAC 1995)
19 Perhitungan :
Kadar lemak (%b/b) = W2
W1×100%
Keterangan :
W2 = Berat sampel (g)
W1 = Berat lemak (g)
5) Analisis Kadar Karbohidrat By Difference (AOAC 1995)
Pengukuran kadar karbohidrat menggunakan metode by difference dengan rumus :
Kadar karbohidrat (%b/b) = 100% - (k.air + k.protein + k.lemak + k.abu) (%)
6) Analisis Serat Kasar (Apriyantono et al. 1989)
Sebanyak 2 g sampel bebas lemak dimasukkan ke dalam erlenmeyer dan ditambahkan 0,5 g asbes yang telah dipijarkan dan 2 tetes zat anti buih. Setelah itu 200 ml H2SO4 mendidih ditambahkan
ke dalam erlenmeyer. Erlenmeyer kemudian diletakkan di dalam pendingin balik. Sampel di dalam erlenmeyer didihkan selama 30 menit dengan sesekali digoyang. Setelah selesai, suspensi disaring dengan kertas saring. Residu dicuci dengan air mendidih hingga air cucian tidak bersifat asam (diuji dengan kertas lakmus). Residu dipindahkan secara kuantitatif ke dalam erlenmeyer dengan cara mencuci residu dengan 200 ml NaOH mendidih. Larutan tersebut kemudian didihkan kembali selama 30 menit dengan pendingin balik. Setelah itu larutan disaring dengan kertas saring yang diketahui beratnya sambil dicuci dengan K2SO4 10%, air mendidih,
kemudian dengan alkohol 95%. Kertas saring dikeringkan di dalam oven hingga berat konstan. Setelah didinginkan di desikator, residu ditimbang. Serat kasar didapat dari rumus
Kadar serat kasar 100g contohg W WW 100
Keterangan :
W2 = Berat residu dan kertas saring kering (g)
W1 = Berat kertas saring (g)
20 2. Tahap 2 Pengujian In Vivo
Penelitian tahap 2 dilakukan untuk melihat pengaruh pemberian tepung tempe kacang komak terhadap profil lipid darah dan peroksidasi lipid tikus dengan melakukan pengukuran kandungan total kolesterol, trigliserida, LDL, dan HDL dalam serum darah. Tikus yang digunakan sebanyak 15 ekor jenis spargue dawley jantan. Tikus tersebut dibagi ke dalam tiga kelompok. Kelompok pertama adalah kontrol positif, kelompok kedua kontrol negatif, dan kelompok ketiga adalah kelompok tempe (diberi tepung tempe kacang komak). Rancangan penelitian utama dapat dilihat pada Gambar 1.
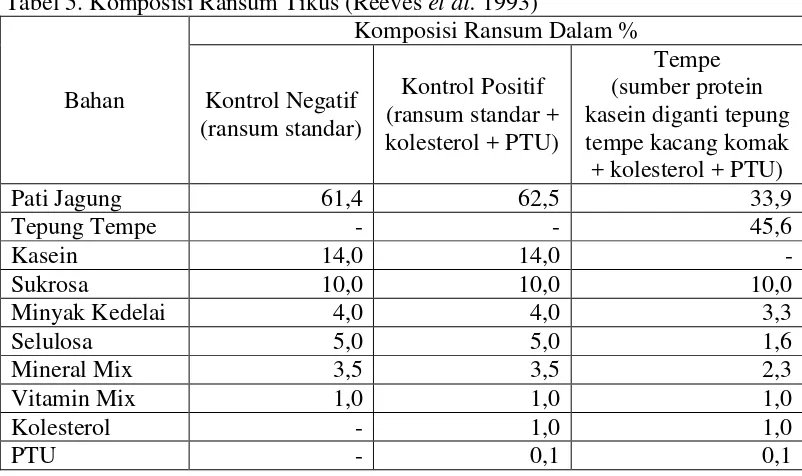
a. Persiapan dan Pembuatan Ransum
Ransum yang diberikan kepada tikus percobaan mengacu pada AIN (American Institute of Nutrition) (Reeves et al. 1993). Komposisi ransum tikus setiap perlakuan dapat dilihat pada Tabel 5, perhitungan komposisi ransum kelompok tempe dapat dilihat pada Lampiran 1. Ransum standar terdiri atas pati jagung, kasein, sukrosa, minyak kedelai, CMC, vitamin mix merek Fitkom (Tabel 6), dan mineral mix (Tabel 7). Kelompok kontrol positif diberi ransum standar dengan penambahan kolesterol 1% dan PTU (propiltiourasil). Kelompok kontrol negatif hanya diberi ransum standar. Kelompok tempe diberi ransum standar dengan penambahan kolesterol dan PTU serta mengganti kasein ransum standar dengan sampel (tepung tempe kacang komak).
b. Masa Adaptasi Tikus (Arafah 1994)
Lama masa adaptasi adalah tujuh hari dengan pemberian ransum standar (komposisi sama dengan kontrol negatif). Air diberikan secara
21 Tabel 5. Komposisi Ransum Tikus (Reeves et al. 1993)
Bahan
Jenis Vitamin Jumlah (g/500g)
22 c. Massa Perlakuan
Masa perlakuan adalah 36 hari. Selama masa perlakuan, tikus diberi ransum sesuai dengan kelompok perlakuannya (Tabel 5) dan pemberian air minum diberikan secara ad libitum. Pengamatan yang dilakukan yaitu jumlah konsumsi ransum dan berat badan tikus percobaan. Banyaknya ransum yang dikonsumsi dihitung setiap hari dengan menimbang sisa ransum yang tidak dikonsumsi oleh tikus. Pengamatan berat badan masing-masing tikus dalam tiga kelompok perlakuan dilakukan tiga hari sekali selama perlakuan. Hasil yang diperoleh kemudian dibandingkan antar kelompok.
d. Persiapan Sampel Darah dan Organ
Pengambilan sampel darah dan organ dilakukan pada hari ke-37. Sebelum dibedah, selama 12 jam tikus dipuasakan agar data yang dihasilkan tidak dipengaruhi oleh konsumsi terakhir.
Tikus yang akan dibedah harus dalam keadaan hidup. Eutanasia dilakukan dengan cara menarik ekor tikus sehingga tulang belakangnya lepas. Cara ini dapat menghilangkan rasa sakit tikus, namun jantung masih tetap berdetak selama beberapa menit. Tikus kemudian dipindahkan ke papan pembedahan yang dialasi aluminium foil. Kemudian tikus ditelentangkan dan digunting bagian perutnya secara vertikal ke arah leher sampai jantung tikus terlihat.
23 e. Analisis Serum Darah dan Organ Tikus
1) Analisis Total Kolesterol (Metode CHOD-PAP)
Prinsip pengujian ini adalah mereaksikan kolesterol secara hidrolisis enzimatis dan oksidasi. Hasil reaksi tersebut menghasilkan senyawa quinine yang berwarna merah, sehingga dapat dibaca absorbansinya pada panjang gelombang 500 nm. Prosedur analisis disajikan pada Gambar 2. Komposisi reagen kolesterol terdapat di Tabel 8. Nilai kadar kolesterol didapat dari persamaan berikut :
Kadar kolesterol !mgdl # A standar 200A sampel mgdl
Gambar 4. Prosedur Analisis Total Kolesterol. Tabel 8. Komposisi Reagen Kolesterol
Komposisi Jumlah
Good’s buffer pH 6,7 50 mmol/l
Phenol 5 mmol/l
4-aminoantipyrine 0,3 mmol/l Kolesterol esterase >_ 200 U/I Kolesterol oksidase >_50 U/I
Poroksidase >_ 3 kU/I
Standar 200 mg/dl (5,2 mmol/l)
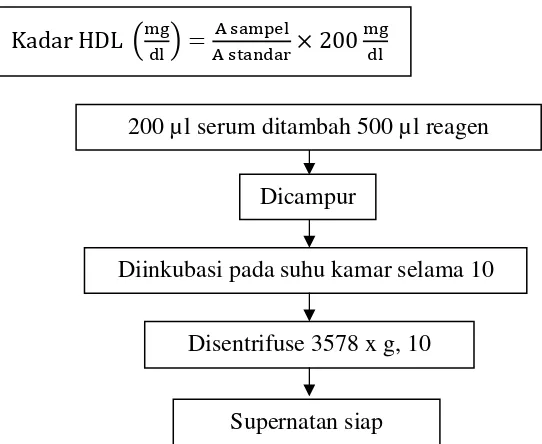
2) Analisis High Density Lipoprotein (HDL) (Metode CHOD-PAP) Prinsip penentuan HDL yaitu mengendapkan kilomikron, VLDL, dan LDL dengan menambahkan asam fosfotungstat dan ion Mg. Proses sentrifugasi akan menghasilkan hanya HDL dalam supernatan yang kemudian ditentukan secara enzimatis menggunakan DSI cholesterol FS. Prosedur analisis disajikan pada Gambar 3 dan Gambar 4. Komposisi reagen presepitasi terdapat di Tabel 9. Nilai kadar HDL didapat dari persamaan berikut :
0,01 ml serum/standar ditambah 1 ml reagen kolesterol
Dicampur
Diinkubasi pada suhu 37 oC, 5
24 Kadar HDL !*+,-# . /2 3, 4. / *01- 200*+
,-Gambar 5. Prosedur Persiapan Sampel Analisis Kadar HDL.
Gambar 6. Prosedur Analisis Total HDL. Tabel 9. Komposisi Reagen Presepitasi
Komposisi Jumlah
Asam fosfotungstat 1,4 mmol/l Magnesium klorida 8,6 mmol/l Standar kolesterol 0,3 mmol/l
Standar kolesterol 200 mg/dl (5,2 mmol/l)
3) Analisis Trigliserida (Metode GPO-PAP)
Analisis kandungan trigliserida dapat dilihat pada Gambar 5. Komposisi reagen trigliserida yang digunakan tertera pada Tabel 10. Kadar trigliserida didapat dari hasil perhitungan berikut :
Kadar TG !*+,-# . /2 3, 4. / *01- 200*+
,-4) Analisis Low Density Lipoprotein (LDL) (Friedward et al. 1972) Kadar LDL dihitung secara langsung menggunakan rumus :
200 µl serum ditambah 500 µl reagen
Dicampur
Diinkubasi pada suhu kamar selama 10
Disentrifuse 3578 x g, 10
Supernatan siap
100 µl supernatan/standar ditambahkan 1 ml pereaksi
Dicampur
Diinkubasi pada suhu 37 oC, 5
25 Kadar LDL !*+,-# total kolesterol !HDL 789: #
Asumsi: TG/5 merupakan VLDL.
Gambar 7. Prosedur Analisis Total Trigliserida Standar.
Tabel 10. Komposisi Reagen Trigliserida
Komposisi Jumlah
Good’s buffer pH 7,2 50 mmol/l
4-klorofenol 4 mmol/l
ATP 2 mmol/l
Mg 2+ 15 mmol/l
glycerokinase ≥0,4 kU/I
peroksidase ≥2 kU/I
Lipoprotein lipase ≥2 kU/I 4-Aminoantipyrine 0,5 mmol/l Glycerol-3-phosphate-oxidase ≥ 0,5 kU/I
Standar 200 mg/dl (2,3 mmol/l)
5) Indeks Aterogenik (Balsinska 1998)
Indeks Aterogenik (IA) dihitung dengan rumus :
IA total kolesterol HDLHDL
6) Analisis Malonaldehida (MDA) (Conti et al. 1999)
Analisis MDA ini dilakukan pada organ hati dan limpa tikus. Prinsip analisis MDA yaitu bahwa pemanasan akan menghidrolisis peroksida lipid sehingga MDA yang terikat akan dibebaskan dan akan bereaksi dengan TBA dalam suasana asam membentuk kompleks MDA-TBA yang berwarna merah. Intensitas warna merah tersebut dapat diukur pada panjang gelombang 532 nm. Prosedur analisis MDA pada hati dan limpa dapat dilihat pada Gambar 6.
0,01 ml Serum/standar trigliserida ditambah 1 ml reagen
Dicampur
Diinkubasi pada suhu 37 oC, 5
26
Gambar 8. Prosedur Analisis MDA pada Organ Hati dan Limpa.
Sebagai standar MDA digunakan 1,1,3,3 tetraetoksipropana (TEP). Pada suasana asam, TEP terhidrolisis dan menghasilkan hemiasetal dan etanol. Hemiasetal yang terbentuk kemudian terdekomposisi menjadi etanol dan malonaldehida. Penentuan kurva standar dilakukan sama dengan penentuan sampel. Perhitungan kadar MDA sampel berdasarkan hasil ploting nilai absorbansi pada kurva standar. Konsentrasi TEP yang digunakan yaitu 0,0; 1,2; 2,4; 3,6; 4,8; 6,0; 7,2; 15,0; dan 24,0 x10-3 pmol/ml.
Organ hati ditimbang sebanyak
Ditambah larutan PBS dingin sebanyak 9
Dihancurkan dengan cara
Disentrifuse pada 2012 x g selama 15
Diambil supernatan 4
Ditambah 1 ml larutan TCA
Ditambah 1 ml TBA 0,37% dalam HCL 0,25 N
Dipanaskan di dalam penangas airpada suhu 80 oC selama 15
Didinginkan sampai suhu ruang
Disentrifuse pada 2012 x g selama 15
Diukur absorbansi supernatan pada λ 532
27 BAB IV
HASIL DAN PEMBAHASAN
A. Tempe dan Tepung Tempe
Pembuatan tempe kacang komak dilakukan dengan merujuk Syarif et al. (1999) yang telah dimodifikasi oleh Harnani (2009). Pembuatan tempe dengan prosedur ini menghasilkan rendemen tempe segar sebanyak 115-140%. Modifikasi dilakukan pada penambahan abu. Penambahan abu sebanyak 5g/100g bahan dilakukan untuk mengurangi aroma langu. Aroma langu disebabkan oleh kerja enzim lipoksigenase. Enzim tersebut menghidrolisis asam lemak tidak jenuh yang menghasilkan senyawa yang mudah menguap seperti keton (Sugiyono 2008). Enzim lipoksigenase merupakan suatu protein yang dapat didegradasi dengan pemanasan. Pengggunaan larutan abu yang bersifat basa dapat meregangkan struktur protein sehingga lebih mudah didegradasi (Kinsella 1979).
Tempe kacang komak kemudian dijadikan tepung tempe kacang komak sebagai sampel dan diberikan kepada tikus percobaan. Prosedur pembuatan tepung tempe kacang komak memodifikasi prosedur Harnani (2009). Tahapan yang dimodifikasi yaitu suhu pengeringan. Harnani (2009) melakukan pengeringan pada suhu 50oC selama 24 jam. Pada penelitian ini, tempe kacang komak dikeringkan pada suhu 75oC selama 5-6 jam. Suhu dan waktu pengeringan tersebut dipilih dengan mempertimbangkan ketersediaan alat di laboratorium. Rendemen tepung tempe kacang komak dengan metode Harnani (2009) adalah 50%, sedangkan dengan metode yang telah dimodifikasi adalah 49,6%.
Kandungan gizi tepung tempe kacang komak dianalisis untuk menyusun komposisi ransum yang akan diberikan kepada tikus. Tabel 11 menyajikan data kandungan gizi tepung tempe kacang komak.
B. Pertumbuhan dan Konsumsi Ransum
28 Tabel 5. Gambar 9 menggambarkan pertumbuhan tikus yang terjadi selama masa perlakuan
Tabel 11. Kandungan Gizi Tepung Tempe Kacang Komak Zat Gizi Jumlah (%BB) Jumlah (%BK)
Protein 30,68 32,81
Air 6,49 6,94
Abu 2,67 2,86
Lemak 1,62 1,74
Karbohidrat 58,53 63,28
Serat kasar 7,50 8,03
.
Gambar 9. Kurva Pertumbuhan Berat Badan Tikus Selama Perlakuan.
Gambar 9 menunjukkan baik kelompok kontrol negatif maupun kontrol positif mengalami kenaikan berat badan. Artinya terjadi pertumbuhan yang positif pada kedua kelompok tersebut. Sebaliknya, kelompok tempe mengalami penurunan berat badan selama masa perlakuan. Besarnya kenaikan maupun penurunan berat badan tikus disajikan pada Tabel 12. Kontrol negatif mengalami pertambahan berat badan paling tinggi, yaitu 65 g. Kontrol positif mengalami kenaikan berat badan sebesar 30 g atau lebih kecil dari pada kontrol negatif. Tempe mengalami penurunan berat badan sebesar 11 g selama perlakuan.
Kenaikan dan penurunan berat badan tikus selaras dengan tingkat konsumsi ransum. Kontrol negatif yang mengalami pertambahan berat badan paling tinggi, mengonsumsi ransum paling banyak, yaitu 10,37 g. Sebaliknya,
29 tempe yang mengalami penurunan berat badan mengonsumsi ransum paling rendah, yaitu 5,79 g.
Tabel 12. Pertambahan Berat Badan dan Konsumsi Ransum Tikus Kelompok Pertambahan berat
Keterangan: superscript yang berbeda, menunjukkan nilai yang berbeda nyata secara statistik pada α=0,1 (Lampiran 2 dan Lampiran 3).
Lebih rendahnya konsumsi kontrol positif dan tempe apabila dibandingkan kontrol negatif, kemungkinan disebabkan terdapatnya PTU (propiltiourasil) pada ransum kontrol positif dan tempe. PTU ditambahkan untuk meningkatkan kadar kolesterol tikus dengan cara menghambat sintesis hormon tiroid (Mahfouz dan Kummerow 2000). Rasa PTU yang pahit kemungkinan merupakan penyebab rendahnya konsumsi ransum.
Penurunan berat badan akibat pemberian PTU juga terjadi pada beberapa penelitian terdahulu. Hasil penelitian Joyce et al. (1993) menunjukkan tikus yang diberi PTU memiliki berat badan 57% lebih rendah daripada kontrol yang tidak diberi PTU. Demikian juga penelitian yang dilakukan oleh Cooke dan Meisami (1991), terjadi penurunan berat badan tikus sebesar 15% pada tikus yang diberi PTU.
30 Konsumsi ransum pada kelompok tempe lebih kecil dari pada kontrol positif diduga karena tepung tempe juga menyumbangkan rasa pahit pada ransum. Hal ini karena pengeringan tempe dengan suhu di atas 80oC dapat menimbulkan rasa pahit. Rasa pahit timbul akibat pembebasan asam amino dan interaksi antara asam amino dengan karbohidrat sederhana (Syarief et al.
1999).
Hasil penelitian Nugroho (2007) menunjukkan terjadi penurunan berat badan sebesar 39% pada tikus yang diberi fraksi protein kacang komak dan kenaikan berat badan sebesar 7% pada tikus yang diberi fraksi non protein kacang komak. Tingkat konsumsi kedua kelompok tersebut juga berbeda. Konsumsi ransum fraksi protein kacang komak lebih rendah dari pada fraksi non protein kacang komak. Fenomena ini menunjukkan bahwa protein pada kacang komak kemungkinan dapat menurunkan selera makan tikus. Hal ini dapat dijelaskan dari uraian Nishi et al. (2003) bahwa fraksi 7S globulin (β -conglicinin) dapat menekan konsumsi ransum dan pengosongan lambung dengan cara meningkatkan level plasma kolesistokinin (CCK) pada tikus. Kolesistokinin (CCK) adalah mediator fisiologis yang penting dalam mengatur kepuasan dan pengosongan lambung. Kacang komak mengandung fraksi globulin sebanyak 55,2%. Fraksi globulin tersebut terdiri atas sebagian besar 7S globulin (β-conglicinin) yaitu sebesar 20,5% (Subagio 2006).
31 Tabel 12 juga memperlihatkan rasio konsumsi ransum terhadap kenaikan berat badan (B/A). Nilai ini menunjukkan efisiensi dari ransum tersebut. Tepung tempe kacang komak memiliki nilai B/A negatif. Hal ini menunjukkan bahwa tepung tempe kacang komak tidak efisien dalam mendukung pertumbuhan. Kemungkinan penyebabnya adalah karena kacang komak kekurangan asam amino esensial, yaitu metionin, dan masih terdapat zat anti nutrisi yang tidak hilang secara sempurna selama pengolahan. Menurut Murphy dan Colucci (1999), kacang komak memiliki anti nutrisi tanin, fitat, dan anti tripsin. Ory (1981) menambahkan, kacang komak juga memiliki hemaglutinin sebagai anti nutrisi.
Tanin telah diketahui dapat menghambat pertumbuhan tikus percobaan. Pengaruh tersebut disebabkan karena terjadinya penurunan availabilitas karbohidrat, protein, dan lipid akibat penghambatan aktivitas enzim tripsin, kimotripsin, amilase, dan lipase. Fitat dapat menurunkan availabilitas makanan karena dapat membentuk senyawa kompleks dengan protein sehingga protein sulit dicerna oleh enzim pencernaan. Selain itu fitat juga dapat mengikat mineral-mineral seperti kalsium, magnesium, besi, dan seng. Seperti halnya tanin dan fitat, anti tripsin juga dapat menurunkan bioavailabilitas protein. Anti tripsin mampu membentuk ikatan dengan enzim tripsin sehingga enzim ini tidak dapat memecah protein (Muchtadi 1989). Nafi et al. (2007) menduga kadar anti tripsin kacang komak lebih tinggi dibandingkan kacang kedelai. Hal ini berdasarkan pada hasil penelitian yang menunjukkan tidak terdeteksinya daya cerna tepung kaya protein kacang komak terhadap enzim tripsin.
Hemaglutinin tersebar pada berbagai tanaman, terutama kacang-kacangan. Telah dibuktikan bahwa hemaglutinin yang telah diisolasi dari bermacam-macam kacang-kacangan bersifat toksik bila diinjeksikan pada hewan percobaan. Bila dicampur dalam ransum, senyawa ini dapat menghambat pertumbuhan hewan percobaan (Muchtadi 1989).
32 mendapatkan hasil bahwa kacang komak Saudi Arabia yang direndam selama satu hari dapat menurunkan fitat sebesar 22,19%. Selama fermentasi, kapang tempe juga memproduksi fitase yang dapat mereduksi asam fitat (Pawiroharsono 2001). Pada contoh kacang hijau, proses perebusan selama 25 menit mampu menurunkan tanin sebesar 67,36% dan anti tripsin sebesar 85,62% (Estiasih 1993). Selain itu Koswara (1989) menyebutkan, perebusan pada suhu 100oC selama 15 menit pada kacang jogo dan tunggak dapat menghilangkan aktivitas hemaglutinin hingga tidak terdeteksi secara in vitro
dengan darah sapi.
C. Berat Organ
Organ hati, ginjal, dan limpa ditimbang pada akhir masa perlakuan. Nilai berat organ tersebut kemudian dibandingkan dengan bobot tubuh untuk mendapatkan berat relatif.
Gambar 10 (A) memperlihatkan rasio berat hati terhadap berat badan tikus. Dari gambar tersebut tampak berat hati relatif tempe mempunyai nilai paling besar dan berbeda nyata apabila dibandingkan dengan kedua kontrol. Nilai berat hati relatif kontrol negatif, kontrol positif, dan tempe secara berturut-turut adalah 0,030; 0,032; dan 0,044. Gambar 10 (B dan C) memperlihatkan berat relatif organ ginjal dan limpa. Dari data tersebut terlihat bahwa semua kelompok tikus memiliki nilai berat ginjal dan limpa relatif yang tidak berbeda nyata secara statistik.
0
perscript yang berbeda, menunjukkan nilai yang berbed tistik pada α=0,1 ((A) Lampiran 4, (B) Lampiran 5, (C)
Berat Organ Relatif (A) Berat Hati Relatif, (B) Relatif, (C) Berat Limpa Relatif Tikus Percoba
hasil penelitian Nugroho (2007) dibandingk terlihat bahwa proses pembuatan tepung tempe
34 dapat mengurangi kandungan zat non gizi. Hal ini berdasarkan pada kenyataan bahwa ginjal tikus tempe tidak dipengaruhi oleh tepung tempe kacang komak. Namun pengurangan ini tidak cukup besar untuk tidak mempengaruhi organ hati tikus.
D. Profil Lipid Tikus
1. Total Kolesterol Serum Darah
Total kolesterol serum darah tikus dianalisis pada akhir perlakuan . Berdasarkan penelitian Mahfouz dan Kummerow (2000), tikus percobaan tidak sensitif terhadap efek aterogenik akibat diet tinggi kolesterol dibandingkan dengan kelinci. Oleh karena itu, selain ditambahkan kolesterol murni pada ransum kontrol positif dan tempe, ditambahkan juga PTU (propiltiourasil) yang berfungsi meningkatkan kadar kolesterol dengan cara menghambat sintesis hormon tiroid. Peningkatan hormon tiroid dapat menurunkan kadar kolesterol dengan cara meningkatkan tingkat sekresi kolesterol menuju empedu dan selanjutnya dibuang bersama feses. Mekanisme penurunan kadar kolesterol oleh hormon tiroid yaitu hormon tiroid menginduksi peningkatan jumlah reseptor LDL pada sel-sel hati menyebabkan pembuangan yang cepat (rapid removal) LDL dari plasma oleh hati, dimana kolesterol yang tadinya ada pada LDL disekresi lewat empedu menuju feses (Guyton dan Hall 2006).
Gambar 11 memperlihatkan total kolesterol serum darah tikus masing-masing kelompok. Dari gambar tersebut terlihat bahwa total kolesterol kontrol positif (143,45 mg/dl) paling tinggi, diikuti tempe (122,18 mg/dl), dan paling kecil kontrol negatif (60,23 mg/dl). Dari data tersebut, dapat diketahui bahwa pemberian tepung tempe kacang komak mengakibatkan penghambatan kenaikan total kolesterol serum sebesar 21,27 mg/dl (14,82%).
Hal ini karena
na pada penelitian Nugroho (2007) waktu per 75 hari, sehingga tikus kelompok kontro hiperkolesterol hingga 204 mg/dl.
superscript yang berbeda, menunjukkan nilai yang secara statistik pada α=0,1(Lampiran 7).
Gambar 11. Total Kolesterol Tikus Percobaa
yrani (2008) juga membuktikan bahwa tikus terol dan ditambah konsentrat protein kacan t kenaikan kolesterol sebesar 41,94 mg/dl (4 n dengan kontrol. Pengahambatan kolesterol dibandingkan hasil penelitian Brata-Arbai rsebut, manusia yang mengalami hiperlipidemi pe kedelai selama dua minggu. Hasilnya
besar 8,38%. Penurunan total kolesterol ya kelompok manusia yang diberi tepung temp
difikasi, yaitu 18,59%. Modifikasi yang di buat minuman yang mengandung tepung temp inyak sayur, dan aspartam.
36 menunjukkan bahwa penurunan kolesterol akibat pemberian konsentrat protein kacang komak tidak melalui pembuangan feses.
Chen et al. (2008) menyatakan bahwa terdapat lima kemungkinan cara suatu pangan atau obat-obatan menurunkan kolesterol. Empat diantaranya adalah melalui penghambatan enzim HMG-CoA (3-hidroksi-3-metilglutaril-CoA) reduktase, aktivasi reseptor LDL, penghambatan ACAT (asil-koenzim A kolesterol asiltransferase), dan penghambatan penyerapan asam empedu. Salah satu atau beberapa dari keempat mekanisme itu kemungkinan yang menjadi cara tepung tempe kacang komak dalam menghambat kenaikan kolesterol serum.
Enzim HMG-CoA reduktase merupakan enzim yang dibutuhkan dalam pembuatan kolesterol. Oleh karena itu, jika kerja enzim ini dihambat maka sintesis kolesterol pun dapat dihambat. Aktivasi LDL reseptor dapat menurunkan kolesterol serum karena reseptor LDL membantu dalam pembuangan LDL-C dari darah. Fitoesterogen yang terdapat dalam tanaman dapat mengaktivasi reseptor ini. Di dalam tubuh, ACAT berfungsi membantu penyerapan kolesterol di usus dan sekresi VLDL dari hati ke darah. Artinya, penghambatan aktivitas ACAT akan menurunkan kolesterol plasma dengan menurunkan absorpsi kolesterol di usus dan produksi VLDL di hati (Chen et al. 2008).
Asam empedu merupakan hasil metabolisme utama kolesterol. Pengikatan asam empedu di usus mencegah asam empedu diserap kembali, pada akhirnya asam empedu ini dibuang ke feses. Ekskresi ini memicu hati untuk membuat asam empedu baru dari kolesterol yang diambil dari darah, sehingga kolesterol darah menurun (Chen et al. 2008). Serat dalam bahan pangan dapat berperan dalam pengikatan asam empedu di usus (Walker 1994).
Merujuk pada tempe kedelai, Brata-Arbai (2001) menyatakan bahwa terdapat beberapa komponen tempe kedelai yang memiliki efek menurunkan kolesterol. Komponen tersebut antara lain protein,
37 penyerapan asam empedu di usus. Selain itu protein dan PUFA juga meningkatkan aktivasitas reseptor LDL. Niasin dapat menurunkan kolesterol karena dapat meningkatkan katabolisme VLDL oleh enzim lipoprotein lipase dan menghambat lipolisis jaringan adiposa yang merupakan bahan baku VLDL. Vitamin E, karetonoid, dan isoflavon merupakan antioksidan yang dapat menjaga sel dari serangan radikal bebas. Hal ini membuat sel dapat bekerja dengan baik, sehingga dapat menjaga metabolisme lipid tubuh tetap dalam kondisi normal. Selain itu vitamin E juga dapat menghambat kerja HMG-CoA reduktase.
Komponen-komponen pada tempe kedelai yang dapat menurunkan kolesterol tersebut kemungkinan juga terdapat pada kacang komak. Syarifudin (2003) telah membuktikan bahwa kacang komak memiliki fraksi protein globulin 7S dan 11S yang mirip dengan kacang kedelai. Untuk mengetahui ada atau tidak komponen lainnya di kacang komak atau di tepung tempe kacang komak, perlu dilakukan analisis lebih lanjut.
Zat anti nutrisi yang terdapat pada kacang komak kemungkinan juga memiliki peran dalam penghambatan kenaikan kolesterol serum. Anti nutrisi yang terdapat di kacang komak antara lain tanin, fitat, dan anti tripsin (Colucci 1999). Ketiga anti nutrisi tersebut memiliki kemampuan dalam mengikat asam empedu di usus dan dibuang melalui feses. Hal ini dapat menurunkan total kolesterol darah (Johansson et al. 1992; Nakamura
et al. 2001; Hyeon Lee et al. 2007).
2. Kadar Trigliserida Serum Darah
protein kacang
ng komak lebih besar walau tidak berbeda nya f.
superscript yang berbeda, menunjukkan nilai yang secara statistik pada α=0,1(Lampiran 8).
Gambar 12. Kadar Trigliserida Tikus Percoba
runan yang tidak signifikan terjadi pada hiperlipidemia yang diberi 150 g tempe ked nurunan yang terjadi sebesar 9,19% (Brat ain menunjukkan bahwa protein kacang kede
t kenaikan trigliserida plasma darah tikus p 11 minggu) apabila dibandingkan kontrol yan
trol negatif memiliki kandungan trigliserida pa l. Nilai ini juga tidak berbeda nyata terhadap
Nugroho (2007) mendapatkan kadar trig paling tinggi dibandingkan kelompok tikus lain
ginya kadar trigliserida kontrol negatif kemu elompok tikus ini paling tinggi. Tingginya ko an semakin besarnya lemak yang disimpan
Selain itu, jika terdapat kelebihan karbohid diubah juga menjadi trigliserida. Trigliserida ngkut melalui darah menuju jaringan adiposa yang menjadi kemungkinan penyebab tinggi
39 Alasan yang sama juga menjadi kemungkinan rendahnya trigliserida kelompok tikus tempe. Tikus kelompok tempe memiliki tingkat konsumsi paling rendah, sehingga penyimpanan lemak, karbohirat, dan protein dalam bentuk trigliserida juga kecil.
Kemungkinan lain penyebab rendahnya trigliserida tempe adalah karena kemampuan protein tepung tempe kacang komak dalam menghambat penyerapan asam empedu. Merujuk pada hasil penelitian Syarifudin (2003) yang mendapatkan hasil bahwa protein kacang komak mirip dengan protein kedelai. Yu-Hsin (2008) menyatakan bahwa protein kacang kedelai dapat mengikat asam empedu di usus. Pengikatan asam empedu ini mengakibatkan penyerapan lemak melalui kilomikron terhambat. Kilomikron itu sendiri kaya akan trigliserida (Marinetti 1990).
Tanin dan fitat yang terdapat pada kacang komak kemungkinan juga berperan dalam menurunkan kadar trigliserida serum. Park et al.
(2002), melaporkan bahwa tanin dapat menurunkan kadar trigliserida plasma darah. Tanin dapat menghambat kerja HMG–CoA dan asil-koenzim A kolesterol asiltransferase (ACAT) yang merupakan enzim untuk mensintesis kolesterol dan absorpsi kolesterol serta pelepasannya ke darah.
Hasil penelitian Hyen Lee et al. (2007), menunjukkan kadar trigliserida serum darah tikus tua (umur 15 bulan) yang diberi fitat
tidak berbeda nyata dengan kontrol, namun kadar trigliserida di hati
turun secara signifikan. Mekanisme penurunan kadar trigliserida ini
melalui sekresi asam empedu melalui feses. Hal ini terbukti dari
tingginya kadar trigliserida feses tikus yang diberi fitat apabila
dibandingkan dengan kontrol.
3. Kadar High Density Lipoprotein (HDL) Serum Darah
positif, dan te
tempe berturut-turut adalah 27,28 mg/dl, 23 l. Gambar 13 menyajikan data Kadar HDL se kuan tersebut.
superscript yang berbeda, menunjukkan nilai yang secara statistik pada α=0,1 (Lampiran 9).
mbar 13. Kadar HDL Serum Darah Tikus Perc
l penelitian ini senada dengan hasil penelitian K
et al. (1994). Pada penelitian Khayrani an tikus diabetes, tikus yang diberi protein DL serum 37,65% lebih rendah dari pada kontr ) meneliti protein kacang komak dari Cina, has
ng komak dapat menurunkan kolesterol tetapi menaikkan kadar HDL.
il yang berbeda didapat oleh Nugroho (2007). etahui bahwa tikus yang diberi ransum protein DL serum 44,2% lebih banyak dari pada yang terjadi menunjukkan bahwa kondisi kacang komak yang berbeda akan menghasi da kadar HDL serum. Tikus dengan kondis
konsentrat protein metode Khayrani (2008), ak menjadi tepung tempe kacang komak pad meningkatkan kadar HDL serum darah tikus.