IDENTIFIKASI KOMPONEN KIMIA MINYAK ATSIRI BUAH
KECOMBRANG
(Etlingera elatior)
DAN UJI AKTIVITAS
ANTIOKSIDAN MINYAK ATSIRI SERTA EKSTRAK
AIR DAN EKSTRAK ETANOLDENGAN
METODE DPPH
SKRIPSI
MUTIARA SARAGIH
080802056
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
IDENTIFIKASI KOMPONEN KIMIA MINYAK ATSIRI BUAH KECOMBRANG (Etlingera elatior) DAN UJI AKTIVITAS ANTIOKSIDAN MINYAK ATSIRI
SERTA EKSTRAK AIR DAN EKSTRAK ETANOL DENGAN METODE DPPH
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
MUTIARA SARAGIH
080802056
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : IDENTIFIKASI KOMPONEN KIMIA MINYAK
ATSIRI BUAH KECOMBRANG (Etlingera elatior) DAN UJI AKTIVITAS ANTIOKSIDAN MINYAK ATSIRI SERTA EKSTRAK AIR DAN EKSTRAK ETANOL DENGAN METODE DPPH
Kategori : SKRIPSI
Nama : MUTIARA SARAGIH
Nomor Induk Mahasiswa : 080802056
Program : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Januari 2013
Komisi Pembimbing
Pembimbing II Pembimbing I
Dra. Herlince Sihotang, M.Si Prof. Dr. Jamaran Kaban, M.Sc
NIP: 195503251986012002 NIP: 195106301980021001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU
Ketua,
Dr. Rumondang Bulan Nst, MS
PERNYATAAN
IDENTIFIKASI KOMPONEN KIMIA MINYAK ATSIRI BUAH KECOMBRANG
(Etlingera elatior) DAN UJI AKTIVITAS ANTIOKSIDAN MINYAK ATSIRI SERTA EKSTRAK AIR DAN EKSTRAK ETANOL DENGAN METODE DPPH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2013
PENGHARGAAN
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus, sang Juruselamat yang telah memberi segalanya dan juga memampukan penulis untuk menyelesaikan skripsi ini sebagai salah satu syarat untuk menyelesaikan pendidikan sarjana sains di Fakultas MIPA USU. Adapun judul skripsi ini adalah “Identifikasi Komponen Kimia Minyak Atsiri Buah Kecombrang (Etlingera elatior) dan Uji Aktivitas Antioksidan Minyak Atsiri dan Ekstrak Air dengan Metode DPPH”.
Adapun rasa terima kasih yang ingin penulis sampaikan kepada : Bapak Prof. Dr. Jamaran Kaban, M,Sc selaku pembimbing I dan Ibu Dra. Herlince Sihotang, M,Si selaku pembimbing II yang telah meluangkan waktu selama penulis melakukan penelitian dan penyusunan skripsi ini hingga selesai. Bapak dan Ibu Dosen/Staff Pengajar di Laboratorium Kimia Organik FMIPA USU yang telah membimbing penulis selama masa perkuliahan dan penelitian. Dr. Rumondang Bulan, MS dan Bapak Albert Pasaribu, M,Sc selaku Ketua dan Sekretaris Departemen Kimia, serta seluruh staff pengajar Departemen Kimia FMIPA USU yang telah membimbing penulis selama perkuliahan. Teman-teman satu tim di Laboratorium Kimia Organik : k’silo, b’christy, deny, sion, Samuel, bayu, egi, despita, naomi, rimenda, yabes, sophia dan dian. Sahabat serta keluarga keduaku Micomie : b’donald, k’dewi, sondang, defi, cristin serta adik-adik kelompokku nia, yuni, ruth, indayana, hotlan, yuanda, malem, dan nora yang selalu memberi semangat buat penulis. Teman-teman yang banyak membantu penulis selama penelitian : noaksen, b’edi tantono, k’vasca, b’frans serta teman-teman stambuk 2008 yang tidak dapat disebutkan satu persatu. Akhirnya, penulis mengucapkan terimakasih yang sebesar-besarnya kepada Bapak dan Ibu tercinta Ir. S. Saragih dan N. Purba serta kakak Andina S. Saragih. Penulis menyadari bahwa skripsi ini masih jauh dari sempurna karena keterbatasan penulis. Semoga skripsi ini bermanfaat bagi penelitian dan ilmu pengetahuan.
Medan, Penulis
ABSTRAK
ABSTRACT
DAFTAR ISI
Halaman
PERSETUJUAN iii
PERNYATAAN iv
PENGHARGAAN v
ABSTRAK vi
ABSTRACT vii
DAFTAR ISI viii
DAFTAR GAMBAR xi
DAFTAR TABEL xii
DAFTAR LAMPIRAN xiii
BAB 1. PENDAHULUAN
1.1Latar Belakang 1
1.2Permasalahan 2
1.3Pembatasan Masalah 2
1.4Tujuan Penelitian 2
1.5Manfaat Penelitian 2
1.6Metodologi Penelitian 3
1.7Lokasi Penelitian 3
BAB 2. TINJAUAN PUSTAKA
2.1 Tumbuhan Kecombrang 4
2.1.1 Sifat Antioksidan 7
2.1.2 Sifat Antimikroba 11
2.2 Minyak Atsiri 12
2.2.1 Metode Isolasi 14
2.2.2 Komposisi Kimia 17
2.2.3 Biosintesis 18
2.3 Analisis Komponen Minyak Atsiri 21
2.3.1 Gas Kromatografi – Spektroskopi Massa 21 Instrumen
Metode
2.3.2 Spektroskopi Infra Merah 26
BAB 3. METODE PENELITIAN
3.1 Alat-alat 28
3.2 Bahan-bahan 29
3.3 Prosedur Penelitian 30
3.3.1 Penyediaan Sampel 30
3.3.2.2 Pembuatan Ekstrak Air Buah Kecombrang 30 3.3.2.3 Pembuatan Ekstrak Etanol Buah Kecombrang 31
3.3.3 Skrining Fitokimia 31
3.3.4 Analisis Minyak Atsiri Buah Kecombrang dengan GC-MS 32
3.3.4.1 Analisis GC-MS 32
3.3.4.2 Analisis FT-IR 33
3.3.5 Uji Aktivitas Antioksidan Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang dengan Metode DPPH 33
3.3.5.1 Pembuatan Larutan DPPH 33
3.3.5.2 Pembuatan Variasi Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang 33
3.3.5.3 Uji Aktivitas Antioksidan 34
3.3.5.3.1 Larutan Blanko 34
3.3.5.3.2 Uji Aktivitas Antioksidan Sampel 34
3.4 Bagan Penelitian 35
3.4.1 Isolasi Minyak Atsiri Buah Kecombrang Dengan Destilasi Stahl 35
3.4.2 Skrining Fitokimia 36
3.4.3 Uji Sifat Antioksidan Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah 36 Kecombrang dengan Metode DPPH
3.4.3.1 Pembuatan Larutan DPPH 0,03 mM 36
3.4.3.2 Pembuatan Variasi Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang 37
3.4.3.3 Uji Aktivitas Antioksidan 38
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 40
4.1.1 Ekstraksi Buah Kecombrang 40
4.1.1.1 Penentuan Kadar Minyak Atsiri 40
4.1.1.2 Penentuan Kadar Ekstrak Air dan Ekstrak Etanol 40
4.1.2 Hasil Analisa Dengan GC-MS 42
4.1.3 Hasil Analisa FT-IR 44
4.1.4 Hasil Uji Aktivitas Antioksidan 45
4.2 Pembahasan 46
4.2.1 Minyak Atsiri Hasil Proses Destilasi dengan Alat Stahl 46 4.2.2 Ekstrak Air dan Ekstrak Etanol Buah Kecombrang 47 4.2.3 Analisis Minyak Atsiri Buah Kecombrang 50 4.2.4 Hasil Uji Antioksidan Minyak Atsiri, Ekstrak air dan Ekstrak etanol 64
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan 66
5.2 Saran 66
DAFTAR PUSTAKA 67
DAFTAR GAMBAR
Gambar 2.1. Batang Tanaman Kecombrang 6
Gambar 2.2. Bunga Kecombrang 7
Gambar 2.3. Buah Kecombrang 8
Gambar 2.4. Biji Kecombrang 8
Gambar 2.5. Biosintesis Terpenoid 20
Gambar 2.6. Perubahan Senyawa Monoterpen 21
Gambar 2.7. Reaksi Biogenetik Beberapa Seskuiterpena 22
Gambar 2.8. Skema Alat Gas Kromatografi 24
Gambar 2.9. Skema Alat Spektroskopi Massa 25
DAFTAR TABEL
Tabel 4.1. Minyak Atsiri Buah Kecombrang Segar yang Diperoleh dengan Metode
Hidrodestilasi 40
Tabel 4.2. Hasil Ekstraksi Ekstrak Air Buah Kecombrang 40 Tabel 4.3. Hasil Ekstraksi Ekstrak Etanol Buah Kecombrang 41 Tabel 4.4. Senyawa Hasil Analisa GC-MS Minyak Atsiri Buah Kecombrang yang tergolong
minyak atsiri 43
Tabel 4.5. Senyawa Hasil Analisa GC-MS Minyak Atsiri Buah Kecombrang yang tergolong
sebagai senyawa volatile 43
DAFTAR LAMPIRAN
ABSTRAK
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Tanaman kecombrang (Etlingera elatior) adalah sejenis tanaman rempah dan merupakan tumbuhan tahunan yang berbentuk terna (tumbuhan yang batangnya lunak dan tidak membentuk kayu) dimana bunga, buah serta bijinya dapat dimanfaatkan sebagai bahan sayuran. Kecombrang mempunyai nama lain cekala (Medan), Siantan (Melayu), Honje (Sunda), Bongkot (Bali), Kantan (Malaysia) (Wikipedia, 2008).
Tanaman kecombrang tumbuh pada iklim tropis basah dan lembab. Komposisi kimiawi kecombrang antara lain polifenol, alkaloid, flavonoid, minyak atsiri, dan saponin. Manfaat bunga kecombrang diantaranya untuk menghilangkan bau badan, sebagai obat penyakit kulit dan sebagai antimikroba (Ngening, 2011).
Orang tua zaman dahulu memanfaatkan kecombrang untuk membersihkan darah. Untuk itu biasanya bunganya dimakan sebagai pecal atau dibuat masakan seperti sering dilakukan orang-orang Tapanuli Selatan. Di Malaysia air rebusan bunga kecombrang dipakai mengobati sakit telinga sedang daunnya dipakai sebagai pencuci luka (Trubus, 1988).
Penelitian terhadap minyak atsiri kecombrang sudah dilakukan oleh Naufalin, (2005) mengamati aktivitas antibakteri dan antikapang serta menentukan nilai MIC (Minimum Inhibition Concentration) dari ekstrak bunga kecombrang, Sukandar et al (2011) juga meneliti aktivitas antibakteri dari ekstrak air daun kecombrang, Wijekoon et al (2009) juga meneliti tentang ekstraksi senyawa fenolik yang terdapat dalam bunga kecombrang dan menguji aktivitas antioksidannya, serta Perangin-angin, (2012) juga meneliti aktivitas antibakteri dari minyak atsiri bunga kecombrang.
Akan tetapi penelitian terhadap komponen minyak atsiri buah kecombrang masih terbatas. Oleh sebab itu peneliti tertarik untuk menganalisis komponen minyak atsiri dari buah kecombrang serta menguji aktivitas antioksidan dari minyak atsiri buah kecombrang dan juga aktivitas antioksidan ekstrak air dan ekstrak etanol dari buah kecombrang tersebut.
1.2Permasalahan
1. Komponen Senyawa Kimia apa sajakah yang terdapat pada minyak atsiri yang diperoleh dari buah Kecombrang.
2. Bagaimanakah aktivitas antioksidan dari minyak atsiri, ekstrak air, dan ekstrak etanol buah Kecombrang.
1.3. Pembatasan Masalah
Permasalahan dalam penelitian ini dibatasi pada :
1. Penentuan komponen minyak atsiri dari buah kecombrang dilakukan dengan analisa GC-MS dan analisa FT-IR sebagai data pendukung.
2. Ekstrak air buah kecombrang diperoleh dengan metode perendaman dan ekstrak etanolnya diperoleh dengan metode sokletasi.
3. Pengujian aktivitas antioksidan dari buah kecombrang dilakukan dengan metode DPPH. 4. Perlakuan terhadap buah kecombrang dilakukan sebatas pengujian aktivitas antioksidannya.
1. Untuk mengetahui komponen kimia minyak atsiri yang terkandung di dalam buah Kecombrang dengan analisa GC-MS dan FT-IR.
2. Untuk menguji aktivitas antioksidan dari minyak atsiri, ekstrak air, dan ekstrak etanol buah Kecombrang dengan metode DPPH (2,2’-diphenyl-1-picrylhydrazyl).
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi di bidang kimia organik mengenai komponen kimia minyak atsiri serta sifat antioksidan minyak atsiri, ekstrak air dan ekstrak etanol dari buah Kecombrang.
1.6. Metodologi Penelitian
Buah kecombrang yang diambil dari Pasar Sore Padang bulan dicuci bersih dan dipisahkan antara kulit dan bijinya. Kemudian kulitnya dihaluskan kemudian minyak atsiri didestilasi dengan metode hidrodestilasi dengan menggunakan alat Stahl. Minyak atsiri yang diperoleh dipisahkan dari lapisan airnya kemudian ditambahkan Na2SO4 anhidrous untuk menghilangkan kandungan airnya, kemudian disaring setelah dibiarkan selama satu malam. Minyak atsiri yang diperoleh dianalisa dengan metode FT-IR dan GC-MS untuk mengetahui komponen kimianya, serta dilakukan pengujian aktivitas antioksidan dari minyak atsiri, ekstrak air dan ekstrak etanol buah kecombrang dengan metode DPPH.
1.7. Lokasi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Kecombrang (Etlingera elatior)
Berdasarkan taksonominya, tumbuhan kecombrang termasuk dalam:
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Zingiberales
Famili : Zingiberaceae
Genus : Etlingera
Species : Etlingera elatior
Etlingera elatior dikenal sebagai ‘jahe obor’ atau ‘jahe merah’ yang termasuk dalam family Zingiberaceae dan merupakan tumbuhan herba yang tumbuh hampir di seluruh daratan Asia Tenggara. Disebut sebagai kecombrang atau honje di Indonesia, dan kantan di Malaysia (Chan, 2007).
Ada beberapa manfaat dari tumbuhan kecombrang antara lain : kelopak bunga kecombrang dijadikan lalap atau direbus lalu dimakan bersama sambal di Jawa Barat. Kadang-kadang kelopak bunganya juga dijadikan bagian dari pecal. Di tanah karo, buah kecombrang muda disebut asam cekala, kuncup bunga serta bijinya menjadi bagian pokok dari sayur asam Karo, juga menjadi peredam bau amis sewaktu memasak ikan masakan Batak popular (arsik ikan mas) juga menggunakan asam cekala ini. Di Malaysia dan Singapura kecombrang menjadi unsur penting dalam pembuatan makanan laksa (Anonym, 2009).
mengandung senyawa yang bersifat sebagai antimikroba, sitotoksin dan anti tumor (Haleagrahara, 2005).
Adapun morfologi dari tanaman kecombrang: a. Batang
Tanaman kecombrang (Etlingera elatior) mempunyai batang berbentuk semu bulat membesar dipangkalanya. Tumbuh tegak dan banyak. Batang saling berdekat-dekatan membentuk rumpun.
Gambar 2.1 Batang Tanaman Kecombrang b. Akar
Tanaman Kecombrang mempunyai akar berbentuk serabut dan berwarna kuning gelap.
c. Daun
Tanaman kecombrang mempunyai daun 15-30 helai tersusun dalam dua baris berselang-seling, di batang semu helaian daun berbentuk lonjong dengan ukuran 20-90 cm x 10-20 cm dengan pangkal dengan pangkal membulat atau membentuk jantung. Tepinya bergelombang dan ujungnya meruncing pendek gundul namun dengan bintik-bintik halus dan rapat berwarna hijau mengkilap sering dengan sisi bawah yang keunguan ketika muda.
d. Bunga
bunga mekar maka bunga tersebut akan melengkung dan membalik. Kelopak berbentuk tabung berwarna merah jambu berukuran 4 cm.
Berdasarkan hasil penelitian, kecombrang bermanfaat sebagai antimikroba. Antimikroba adalah bahan yang bisa mencegah pertumbuhan bakteri, kapang dan khamir pada makanan. Hal ini menunjukkan bahwa ekstrak bunga kecombrang dari etil asetat dan etanol yang telah mampu menghambat pertumbuhan bakteri. Faktor-faktor yang mempengaruhi aktivitas antibakteri bunga kecombrang antara lain pH, garam dan pemanasan. Pada pH asam aktivitas anti bakteri bunga kecombrang lebih ampuh dibandingkan pH basa. Penambahan garam dalam jumlah tertentu akan meningkatkan aktivitas antibakterinya dan meskipun dipanaskan pada suhu 100oC sampai 30 menit antibakteri pada kecombrang masih aktif. Bunga kecombrang juga dapat digunakan sebagai pengawet alami untuk makanan tetapi masih memerlukan penelitiaan yang lebih lanjut (Naufalin, 2005).
Gambar 2.2. Bunga Kecombrang e. Buah
Gambar 2. 3 Buah Kecombrang f. Biji
Tanaman kecombrang mempunyai biji banyak berwarna coklat kehitaman dan diselubungi selaput biji (arilus) berwarna putih bening atau kemerahan yang berasa asam (wikipedia, 2008).
Gambar 2.4 Biji Kecombrang
2.1.1 Sifat Antioksidan
Menurut Hudson (1990) definisi antioksidan secara umum adalah suatu senyawa yang dapat memperlambat atau mencegah terjadinya proses oksidasi. Antioksidan dapat menghambat laju oksidasi bila bereaksi dengan radikal bebas. Secara alami beberapa jenis tumbuhan merupakan sumber antioksidan, hal ini dapat ditemukan pada beberapa jenis sayuran, buah-buahan segar, beberapa jenis tumbuhan dan rempah-rempah (Dalimarta dan Soedibyo, 1998).
Selain itu antioksidan juga dapat menetralisir radikal bebas sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron sehingga tidak reaktif lagi (Kosasih et al, 2004).
Radikal bebas merupakan suatu molekul yang sangat reaktif karena mempunyai satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif karena kehilangan satu atau lebih elektron yang bermuatan listrik, dan untuk mengembalikan keseimbangannya maka radikal bebas berusaha mendapatkan elektron dari molekul lain atau melepas elektron yang tidak berpasangan tersebut. Radikal bebas dalam jumlah berlebih di dalam tubuh sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein dan jaringan lemak. Radikal bebas terbentuk di dalam tubuh akibat produk sampingan proses metabolisme ataupun karena tubuh terpapar radikal bebas melalui pernafasan (Dalimartha dan Soedibyo, 1998).
Radikal bebas ialah atom atau molekul dengan susunan elektron tidak lengkap atau tidak berpasangan sehingga bersifat tidak stabil dan kecenderungan kuat untuk berpasangan. Radikal bebas bertendensi kuat memperoleh elektron dari atom lain, sehingga atom lain yang kekurangan satu elektron ini menjadi radikal bebas pula yang disebut radikal bebas sekunder. Proses ini akan berlangsung secara berantai dan menyebabkan kerusakan biologik. radikal bebas dapat terbentuk akibat hilangnya maupun penambahan elektron di lintasannya pada saat terputusnya ikatan kovalen atom dan molekul bersangkutan sehingga menyebabkan instabilitas dan bersifat sangat reaktif. Susunan elekton yang tidak lengkap menyebabkan atom atau molekul sangat terpengaruh oleh medan magnet. Energi untuk memutuskan ikatan kovalen berasal dari panas, radiasi elektromagnetik atau reaksi redoks berlebihan. Hilang atau bertambahnya satu elektron pada molekul lain menyebabkan terjadinya radikal bebas baru dan mengakibatkan perubahan dramatis secara fisik dan kimiawi pada tubuh manusia. Mula-mula dirangsang (initiation) terjadinya radikal bebas, kemudian radikal bebas cenderung bertambah banyak membentuk (propagasi) rantai reaksi dengan molekul lain. Senyawa reaksi berantai ini mempunyai massa paruh yang lebih panjang dan potensial menyebabkan kerusakkan sel. Fase inisiasi dan propagasi dapat dinetralisir oleh antioksidan yang berasal dari endogen maupun eksogen (Kosasih et al, 2004).
Berdasarkan fungsinya, senyawa antioksidan di klasifikasikan dalam tiga tipe antioksidan, yaitu:
1. Primary Antioxidants (Antioksidan Utama / Antioksidan Primer) Termasuk di sini:
- SOD (Superoxide Dismutase) - GPx (Glutathion Peroxidase)
- Metalbinding protein seperti Ferritin atau Ceruloplasmin.
Antioksidan primer ini bekerja untuk mencegah terbentuknya senyawa radikal bebas baru. Ia mengubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi. Contoh Antioksidan ini adalah enzim SOD yang berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh serta mencegah proses peradangan karena radikal bebas.
2. Secondary Antioxidants (Antioksidan Kedua/ Antioksidan Sekunder)
Antioksidan ini berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai. Contoh: antioksidan sekunder : vitamin E, vitamin C, betakaroten, asam urat, bilirubin dan albumin.
3. Tertiary antioxidants (Antioksidan Ketiga / Antioksidan Tersier)
Antioksidan jenis ini memperbaiki kerusakan sel-sel dan jaringan yang disebabkan radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah metionin sulfoksidan reduktase. Adanya enzim-enzim perbaikan DNA ini berguna untuk mencegah penyakit misalnya kanker (Kosasih et al, 2004).
Pengujian antiradikal bebas senyawa-senyawa bahan alam atau hasil sintesis secara UV-Tampak dapat dilakukan secara kimia menggunakan DPPH (difenilpikril hidrazil). DPPH berfungsi sebagai senyawa radikal bebas stabil yang ditetapkan secara spektrofotometri melalui persen peredaman absorbansi. Peredaman warna ungu merah pada panjang
gelombang (λ) 517 nm dikaitkan dengan kemampuan minyak atsiri sebagai antiradikal bebas.
Kereaktifan dari golongan senyawa-senyawa yang berfungsi sebagai antiradikal bebas ditentukan adanya gugus fungsi –OH (hidroksil) bebas dan ikatan rangkap karbon-karbon,
seperti flavon, flavanon, skualen, tokoferol, β-karoten, Vitamin C dan lain-lain (Rahmawati, 2004).
Alpa-tokoferol : 7,3 +/- 0,308
Sayur-sayuran : 4,7
Gamma oryzanol : 50 +/-0,408 Pohon pinus OPC : 4,0 – 13,5
Quercetin : 2,457 +/-0,192
Asam Ferulat (FRAC) : 31,3 +/-0,327
Hesperidin : >500 (Ronald, 2004).
Penggunaan senyawa alami sebagai antioksidan sudah sangat lama. Hal itu meliputi pengasapan dan pembumbuan untuk pengawetan daging, ikan, dan makanan lain yang kaya lemak. Perlakuan tersebut diakui dapat memberi efek penghambat tengik. Hal ini tidak lazim untuk mencoba mendefenisikan antioksidan alami dapat mempengaruhi zat yang terbentuk sebagai konsekuensi dari memasak atau pengolahan bahan nabati atau hewani untuk makanan. Antioksidan alami hampir ditemukan pada semua mikroorganisme, jamur, dan bahkan di jaringan hewan dan tumbuhan ini sebagian besar adalah senyawa fenolik dan yang merupakan beberapa dari kelompok antioksidan alami adalah flavonoid, asam fenolik dan minyak atsiri (Pokornya, 2001).
Kebanyakan komponen minyak atsiri merupakan kelompok besar dari terpen (Hamid, 2011). Terpen yang juga dikenal sebagai terpenoid atau isoprenoid membentuk kelompok terbesar dari produk tanaman alam. Dalam ilmu medis, terpen biasanya digunakan sebagai agen antiseptik, anti-flamasi, untuk penyakit kanker dan malaria serta antioksidan (Degenhardt, 2003).
Komponen senyawa yang tidak jenuh dan teroksigenasi lebih stabil dalam melawan pengaruh oksidasi dibandingkan komponen lainnya, yakni golongan monoterpen dan seskui terpen (Handa, 2008). Monoterpen juga merupakan komponen primer dari minyak atsiri dan mempunyai pengaruh medis didalamnya. Beberapa komponen senyawa yang mempunyai yaitu karvakrol, timol, α-terpinen (Bakkali, 2008), α-pinen, α-tujon, kamfor, 1,8-sineol, β -tujon dan borneol (Kadri, 2011).
Jafar et al., (2007) mengatakan kecombrang mengandung minyak esensial yang bersifat bioaktif (daun 0,0735%; bunga 0,0334%; batang 0,0029% dan rhizome 0,0021%).
2.1.2 Sifat Antimikroba
Kelompok mikroorganisme yang paling penting dan beraneka ragam, yang berhubungan dengan makanan dan manusia adalah bakteri. Adanya bakteri dalam bahan pangan dapat mengakibatkan pembusukan yang tidak diinginkan atau menimbulkan penyakit yang ditularkan melalui makanan (Buckle, 2007). Bakteri merupakan organisme yang sangat kecil (berukuran mikroskopi). Bakteri rata-rata berukuran lebar 0,5-1 mikron dan panjang hingga 10 mikron (1mikron = 10-3 mm). Itu berarti pula bahwa jasad renik ini tipis sekali sehingga tembus cahaya. Akibatnya pada mikroskop tidak tampak jelas dan sukar untuk melihat bagian-bagiannya. Untuk melihat bakteri dengan jelas, tubuhnya perlu diisi dengan zat warna, pewarnaan ini disebut pengecatan bakteri.
Cat yang umum dipakai adalah cat Gram. Diantara bermacam-macam bakteri yang dicat, ada yang dapat menahan zat warna ungu dalam tubuhnya meskipun telah didekolorisasi dengan alkohol atau aseton. Dengan demikian tubuh bakteri itu tetap berwarna ungu meskipun disertai dengan pengecatan oleh zat warna kontras, warna ungu itu tetap dipertahankan. Bakteri yang memberi reaksi semacam ini dinamakan bakteri Gram positif. Sebaliknya , bakteri yang tidak dapat menahan zat warna setelah didekolorisasi dengan alkohol akan kembali menjadi tidak berwarna dan bila diberikan pengecatan dengan zat warna kontras, akan berwarna sesuai dengan zat warna kontras. Bakteri yang memperlihatkan reaksi semacam ini dinamakan bakteri Gram negatif (Irianto, 2006).
Naufalin et al (2005) melaporkan bahwa zat antibakteri dari ekstrak etanol dan etil asetat dari bunga kecombrang dapat menghambat berbagai bakteri seperti Bacillus cereus,
P.aeroginosa, S.typhimurium, E.coli, L.monocytogenes, S. aureus dan
A.hydrophilia.Sedangkan ekstrak airnya bersifat antibakteri terhadap S. aureus dan E.coli
(Hudaya, 2010).
maupun yang sudah lepas tandan. Untuk lebih efektifnya, aplikasi ekstrak bunga kecombrang dengan air dapat disemprotkan pada buah salak yang masih menempel pada tanaman sebelum Dipanen (Pramoto, 2011).
2.2 Minyak Atsiri
Minyak atsiri lazim juga dikenal dengan nama minyak mudah menguap atau minyak terbang. Minyak atsiri merupakan senyawa, yang pada umumnya berwujud cairan, yang diperoleh dari bagian tanaman, akar, kulit, batang, buah, daun, biji maupun bunga dengan cara penyulingan dengan uap. Meskipun kenyataannya minyak atsiri juga dapat diperoleh dengan cara ekstraksi dengan menggunakan pelarut organik maupun dengan cara dipres atau dikempa dan secara enzimatik. Minyak atsiri dapat dibagi menjadi dua kelompok. Pertama, minyak atsiri yang dengan mudah dapat dipisahkan menjadi komponen-komponen atau penyusun murninya. Komponen-komponen ini dapat menjadi bahan dasar untuk diproses menjadi produk-produk lain. Biasanya komponen utama yang terdapat dalam minyak atsiri tersebut dipisahkan atau diisolasi dengan penyulingan bertingkat atau dengan proses kimia sederhana. Pada saat isolasi dengan penyulingan bertingkat selalu dilakukan dalam keadaan vakum. Hal ini dikerjakan untuk menghindari terjadinya isomerisasi, polimerisasi atau penguraian. Kelompok kedua adalah minyak atsiri yang sukar dipisahkan menjadi komponen murninya. Lazimnya minyak atsiri tersebut langsung digunakan, tanpa diisolasi komponen-komponennya sebagai pewangi berbagai produk (Sastrohamidjojo, 2004).
Minyak atsiri merupakan salah satu senyawa organik yang banyak ditemukan di alam dan berasal dari jaringan tumbuhan. Minyak atsiri merupakan salah satu senyawa metabolit sekunder yang mudah menguap (volatile) dan bukan merupakan senyawa murni tetapi tersusun atas beberapa komponen yang mayoritas berasal dari golongan terpenoid (Guenther,2006).
Minyak atsiri dikenal dengan nama minyak eteris atau minyak terbang (essential oil, volatile) yang merupakan salah satu hasil metabolisme tanaman. Bersifat mudah menguap pada suhu kamar, mempunyai rasa getir serta berbau wangi sesuai dengan bau tanaman penghasilnya. Minyak atsiri larut dalam pelarut organik dan tidak larut dalam air (Sudaryani.1990).
Minyak atsiri pada industri banyak digunakan sebagai bahan pembuat kosmetik, parfum, antiseptik dan lain-lain. Beberapa jenis minyak atsiri mampu bertindak sebagai bahan terapi (aromaterapi) atau bahan obat suatu jenis penyakit. Fungsi minyak atsiri sebagai bahan obat tersebut disebabkan adanya bahan aktif sebagai contoh bahan anti radang, hepatoprotektor, analgetik, anestetik, antiseptik, psikoaktif dan anti bakteri (Agusta,200).
2.2.1 Metode Isolasi
Minyak atsiri umumnya diisolasi dengan empat metode yang lazim digunakan sebagai berikut :
1. Metode Destilasi
Diantara metode-metode isolasi yang paling lazim dilakukan adalah metode destilasi. Beberapa metode destilasi yang popular dilakukan di berbagai perusahaan industri penyulingan minyak atsiri, antara lain sebagai berikut :
a. Metode destilasi kering (langsung dari bahannya tanpa menggunakan air). Metode ini paling sesuai untuk bahan tanaman yang kering dan untuk minyak-minyak yang tahan pemanasan (tidak mengalami perubahan bau dan warna saat dipanaskan).
kering. Seluruh bahan dihaluskan kemudian dimasukkan ke dalam bejana yang bentuknya mirip dandang. Dalam metode ini ada beberapa versi perlakuan :
- Bahan tanaman langsung direbus dalam air.
- Bahan tanaman langsung masuk air, tetapi tidak direbus. Dari bawah dialirkan uap air panas.
- Bahan tanaman ditaruh di bejana bagian atas, sementara uap air dihasilkan oleh air mendidih dari bawah dandang.
- Bahan tanaman ditaruh di dalam bejana tanpa air dan disemburkan uap air dari luar bejana (Gunawan, 2004).
2. Metode penyarian
Metode penyarian digunakan untuk minyak-minyak atsiri yang tidak tahan pemanasan seperti cendana. Kebanyakkan dipilih metode ini karena kadar minyaknya di dalam tanaman sangat rendah/kecil. Bila dipisahkan dengan metode lain, minyaknya akan hilang selama proses pemisahan. Pengambilan minyak atsiri menggunakan cara ini diyakini sangat efektif karena sifat minyak atsiri yang larut sempurna di dalam bahan pelarut organik non polar (Gunawan, 2004).
Ekstraksi digunakan untuk mengisolasi produk reaksi kimia organik . sebagai contoh, sejumlah campuran senyawa organik yang larut dalam air dan beberapa garam anorganik yang semuanya larut dalam air. Untuk mengisolasi senyawa organik tersebut, maka campuran diatas dituang dalm corong pisah dan dengan menambahkan pelarut organik, misalnya eter. Lalu dikocok sehingga senyawa-senyawa organik akan terdistribusi pada eter karena lebih mudah larut dalam eter dibandingkan dalam air. Sementara garam anorganik berada pada lapisan air karena tidak larut dalam eter. Dengan demikian sudah terjadi pemisahan dan eter dapat dibebaskan dengan penguapan (Williamson, 1987).
3. Metode Pengepresan dan Pemerasan
penyari. Metode ini juga hanya cocok untuk minyak atsiri yang rendemennya relatif besar (Gunawan, 2004).
4. Metode Enfleurage
Metode enfleurage adalah metode penarikan bau minyak atsiri yang dilekatkan pada media lilin. Metode ini digunakan karena diketahui ada beberapa jenis bunga yang setelah dipetik, enzimnya masih menunjukkan kegiatan dalam menghasilkan minyak atsiri sampai beberapa hari/minggu, misalnya bunga melati, jasminum sambac, sehingga perlu perlakuan yang tidak merusak aktivitas enzim tersebut secara langsung (Gunawan, 2004).
Pada proses ini absorbsi minyak atsiri oleh lemak dilakukan pada suhu rendah (keadaan dingin) sehingga minyak terhindar dari kerusakan yang disebabkan oleh panas. Metode ini masih diterapkan di daerah grasse di Perancis selatan dengan peralatan sederhana, praktis dan berkapasitas kecil (Ketaren, 1985).
Adapun metode- metode penyulingan minyak atsiri dapat dibagi menjadi : 1. Penyulingan dengan air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak langsung dengan air mendidih. Bahan dapat mengapung di atas air atau terendam secara sempurna, tergantung pada berat jenis dan jumlah bahan yang disuling. Ciri khas model ini yaitu adanya kontak langsung antara bahan dan air mendidih. Oleh karena itu, sering disebut penyulingan langsung. Penyulingan dengan cara langsung ini dapat menyebabkan banyaknya rendemen minyak yang hilang (tidak tersuling) dan terjadi pula penurunan mutu minyak yang diperoleh.
2. Penyulingan dengan uap
Model ini disebut juga penyulingan uap atau penyulingan tak langsung. Pada pronsipnya, model ini sama dengan penyulingan langsung. Hanya saja air penghasil uap tidak diisikan bersama-sama dalam ketel penyulingan. Uap yang digunakan berupa uap jenuh atau uap lewat panas dengan tekanan lebih dari 1 atmosfer.
3. Penyulingan dengan uap dan air
sampai permukaannya tidak jauh dari bagian bawah saringan. Ciri khas model ini yaitu uap selalu dalam keadaan basah, jenuh, dan tidak terlalu panas. Bahan tanaman yang akan disuling hanya berhubungan dengan uap dan tidak dengan air panas (Lutony, 1994).
2.2.2 Komposisi Kimia Minyak Atsiri
Pada umumnya perbedaan minyak atsiri komposisi minyak atsiri disebabkan perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia yang terbentuk dari unsur Karbon (C), Hidrogen (H), dan Oksigen (O). pada umumnya komponen kimia minyak atsiri dibagi menjadi dua golongan yaitu : 1) Hidrokarbon yang terutama terdiri dari persenyawaan terpen dan 2) Hidrokarbon teroksigenasi.
1. Golongan hidrokarbon yang terdiri dari persenyawaan Terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur karbon (C) dan Hidrogen (H). Jenis hidrokarbon yang terdapat dalam minyak atsiri sebagian besar terdiri dari monoterpen ( 2 unit isoprene), sesquiterpen ( 3 unit isoprene), diterpen ( 4 unit isoprene) dan politerpen.
2. Golongan hidrokarbon teroksigenasi
Komponen kimia dari golongan persenyawaan ini terbentuk dari unsur Karbon (C), Hidrogen (H), dan Oksigen (O). persenyawaan yang termasuk dalam golongan ini adalah persenyawaan alkohol, aldehid, keton, ester, eter, dan fenol. Ikatan karbon yang terdapat dalam molekulnya dapat terdiri dari ikatan tunggal, ikatan rangkap tiga. Terpen mengandung ikatan tunggal dan ikatan rangkap dua (Ketaren, 1985).
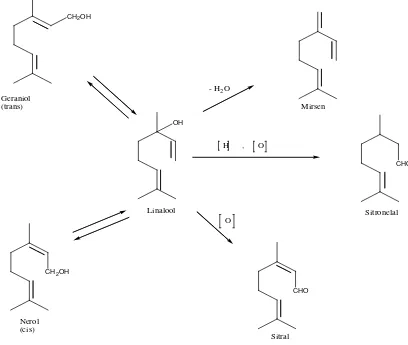
Berdasarkan proses biosintesisnya atau pembentukan komponen minyak atsiri di dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan. Golongan pertama adalah turunan terpena yang terbentuk dari asam asetat melalui jalur biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang terbentuk dari biosintesis asam sikimat melalui jalur fenil propanoid (Agusta, 2000). Mekanisme dari tahap-tahap reaksi biosintesis terpenoid yaitu asam asetat yang telah diaktifkan oleh koenzim A melakukan kondensasi jenis Claisen menghasilkan asam asetoasetat. Senyawa yang dihasilkan ini dengan asetil koenzim A melakukan kondensasi jenis aldol menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat. Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi asam fosfat dan dekarboksilasi menghasilkan IPP yang selanjutnya berisomerisasi menjadi DMAPP oleh enzim isomerase. IPP sebagai unit isopren aktif bergabung secara kepala ke ekor dengan DMAPP dan penggabungan ini merupakan langkah pertama dari polimerisasai isopren untuk menghasilkan terpenoid. Penggabungan ini terjadi karena serangan elektron dari ikatan rangkap IPP terhadap atom karbon dari DMAPP yang kekurangan elektron diikuti oleh penyingkiran ion pirofosfat. Serangan ini menghasilkan geranil pirofosfat (GPP) yakni senyawa antara bagi semua senyawa monoterpen.
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan senyawa-senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi sekunder pula. Reaksi-reaksi sekunder ini lazimnya adalah hidrolisa, siklisasi, oksidasi, reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarbosilasi, dan sebagainya
CH3 C SCoA
Asetil koenzim A Asetoasetil koenzim A
CH3 C
Isopentenil pirofosfat (IPP) CH3 C
CH3
CH CH2 OPP
Dimetilalil pirofosfat (DMAPP)
OPP
Untuk menjelaskan hal diatas dapat diambil beberapa contoh monoterpen. Dari segi biogenetik, perubahan geraniol, nerol dan linalool dari yang satu menjadi yang lain berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari hidrolisa geranil pirofosfat (GPP) dapat menjalani reaksi-reaksi sekunder berikut, misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi menghasilkan sitronelal. Berikut ini adalah contoh perubahan senyawa monoterpen
CH2OH
Geraniol
(trans) Mirsen
OH
Linalool
CHO
Sitronelal
CH2OH
Nerol (cis)
CHO
Sitral - H2O
O H , O
Gambar 2.6. Perubahan senyawa monoterpen
(Achmad, 1986).
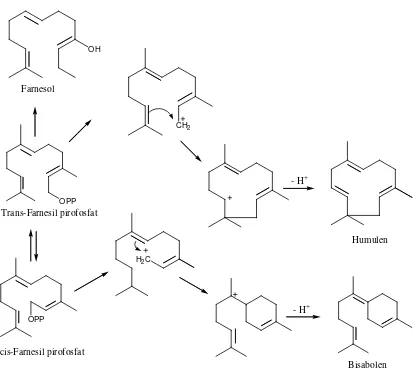
OH
Farnesol
OPP
CH2
Humulen
OPP
H2C Trans-Farnesil pirofosfat
cis-Farnesil pirofosfat
- H+
- H+
Bisabolen
Gambar 2.7. Reaksi biogenetik beberapa seskuiterpena
2.3 Analisa Komponen Kimia Minyak atsiri
2.3.1 Kromatografi Gas – Spektroskopi Massa (GCMS)
GCMS merupakan metode pemisahan senyawa organik yang menggunakan dua metode analisis senyawa yaitu Kromatografi gas (GC) untuk menganalisis jumlah senyawa secara kuantitatif dan Spektrometri Massa (MS) untuk menganalisis struktur molekul senyawa analit.
Spektroskopi massa adalah suatu metode untuk mendapatkan berat molekul dengan cara mencari perbandingan massa terhadap muatan dari ion yang muatannya diketahui dengan mengukur jari-jari orbit melingkarnya dalam medan magnetik seragam.
Penggunaan kromatografi gas dapat dipadukan dengan spektroskopi massa. Paduan keduanya dapat menghasilkan data lebih akurat dalam mengidentifikasi senyawa yang dilengkapi dengan struktur molekulnya.
Kromatografi gas ini juga mirip dengan destilasi fraksinasi, karena kedua proses memisahkan komponen dari campuran terutama berdasarkan pada perbedaan titik didih atau tekanan uap. Namun destilasi fraksional biasanya digunakan untuk memisahkan komponen-komponen dari campuran pada skala besar sedangkan GC dapat digunakan pada skala yang lebih kecil (Pavia, 2006).
Sekarang ini sistem GC-MS sebagian digunakan sebagai peran utama untuk analisa makanan dan aroma, petroleum, petrokimia dan zat-zat kimia di laboratorium. Kromatografi gas merupakan kunci dari suatu teknik anlitik dalam pemisahan komponen mudah menguap, yaitu dengan mengkombinasikan secara cepat analisa sehingga pemecahan yang tinggi mengurangi pengoperasian. Keuntungan dari kromatografi gas adalah hasil kuantitatif yang bagus dan harganya lebih murah. Sedangkan kerugiannya tidak dapat memberikan indentitas atau struktur untuk setiap puncak yang dihasilkan dan pada saat proses karakteristik yang didefenisikan sistem tidak bagus (Mcnair, 2009).
Adapun prinsip kerja dari alat GC-MS adalah sebagai berikut a. Kromatografi Gas
Kromatografi gas (GC) merupakan jenis kromatografi yang digunakan dalam kimia organik untuk pemisahan dan analisis. GC dapat digunakan untuk menguji kemurnian dari bahan tertentu, atau memisahkan berbagai komponen dari campuran. Dalam beberapa situasi, GC dapat membantu dalam mengidentifikasi sebuah senyawa kompleks. Dalam kromatografi gas, fase yang bergerak atau mobile phase adalah sebuah operator gas, yang biasanya gas murni seperti helium atau yang tidak reaktif seperti gas nitrogen. Fasa diam atau stationary phase merupakan tahap mikroskopis lapisan cair atau polimer yang mendukung gas murni, di dalam bagian dari system pipa-pipa kaca atau logam yang disebut kolom. Instrument yang digunakan untuk melakukan kromatografi gas disebut gas chromatograph (Fowlis,1998).
Instrumentasi dari alat GC antara lain : a. Gas Pembawa
Gas pembawa harus memenuhi persyaratan antara lain harus inert, murni, dan mudah diperoleh. Pemilihan gas pembawa tergantung pada detektor yang dipakai. Keuntungannya adalah karena semua gas ini harus tidak reaktif, dapat dibeli dalam keadaan murni dan kering yang dapat dikemas dalam tangki bertekanan tinggi. Gas pembawa yang sering digunakan adalah Helium (He), Argon (Ar), Nitrogen (N), Hidrogen (H), dan karbon dioksida (CO2) (Agusta, 2000).
b. Injeksi Sampel
Cuplikan dimasukkan ke dalam ruang suntikk melalui gerbang suntik, biasanya berupa lubang yang ditutupi dengan septum atau pemisah karet. Ruang suntik harus dipanaskan tersendiri, terpisah dari kolom dan biasanya pada suhu 10-15oC lebih tinggi dari suhu maksimum. Jadi seluruh cuplikan diuapkan segera setelah disuntikkan dan dibawa ke kolom (Gritter et al,1991).
c. Kolom
1. Molekul dapat berkondensasi pada fase diam.
2. Molekul dapat larut dalam cairan pada permukaan fase diam. 3. Molekul dapat tetap pada fase gas.
b. Spektoskopi Massa
Gambar 2.9 Skema Alat Spektroskopi Massa
Umumnya spektrum massa diperoleh dengan mengubah senyawa suatu sampel menjadi ion-ion yang bergerak cepat yang dipisahkan berdasarkan perbandingan massa terhadap muatan.
Spektroskopi massa mampu menghasilkan berkas ion dari suatu zat uji, memilah ion tersebut menjadi spektrum yang sesuai dengan perbandingan massa terhadap muatan dan merekam kelimpahan relative tiap jenis ion yang ada. Umumnya hanya ion positif yang dipelajari karena ion negative yang dihasilkan dari sumber tumbukan umumnya sedikit (Pavia, 2006).
Adapun instrumentasi dari alat spektroskopi massa sebagai berikut : a. Sumber Ion
b. Filter
Selama ion melalui rangkaian spektroskopi massa, ion-ion ini melalui rangkaian elektromagnetik yang menyaring ion berdasarkan perbedaan massa. Para ilmuwan memisahkan komponen-komponen massa untuk kemudian dipilih yang mana yang boleh melanjutkan yang mana yang tidak (prinsip penyaringan). Filter ini terus menyaring ion-ion yang berasal dari sumber ion untuk kemudian diteruskan ke detektor.
c. Detektor
Ada beberapa tipe detektor yang biasa digunakan. Dalam mekanisme reaksi, pembakaran senyawa organik merupakan hal yang sangat kompleks. Selama proses, sejumlah ion-ion dan elektron-elektron dihasilkan dalam nyala. Kehadiran ion dan elektron dapat dideteksi. Seluruh detektor ditutup dalam oven yang lebih panas disbanding dengan temperatur kolom. Hal ini menghentikan kondensasi dalam detektor.
Hasil detektor akan direkam sebagai urutan puncak-puncak, setiap puncak mewakili satu senyawa dalam campuran yang melalui detektor.
Pada metode analisis GCMS (Gas Chromatography Mass Spectroscopy) adalah dengan membaca spektra yang terdapat pada kedua metode yang digabung tersebut. Pada spektra GC jika terdapat bahwa dari sampel mengandung banyak senyawa, terlihat dari banyaknya puncak (peak) dalam spektra GC tersebut. Berdasarkan data waktu retensi yang sudah diketahui dari literatur, bisa diketahui senyawa apa saja yang ada dalam sampel.
Selanjutnya adalah dengan memasukkan senyawa yang diduga tersebut ke dalam instrument spektroskopi massa. Hal ini dapat dilakukan karena salah satu kegunaan dari kromatografi gas adalah untuk memisahkan senyawa-senyawa dari suatu sampel. Setelah itu, didapat hasil dari spektra spektroskopi massa pada grafik yang berbeda.
2.3.2 Spektroskopi Inframerah
Alat instrumen yang digunakan untuk mengukur resapan radiasi inframerah pada pelbagai panjang gelombang absorpsi masing-masing gugus fungsi disebut Spektroskopi inframerah. Suatu spektrum inframerah ialah suatu grafik dari panjang gelombang atau frekuensi, yang secara berkesinambungan berubah sepanjang suatu daerah sempit dari spektrum elektromagnetik, versus transmisi-persen (%T) atau absorbansi (A) (Fessenden, 1986). Spektroskopi inframerah digunakan untuk penentuan gugus fungsi, khususnya senyawa organik dan juga dapat digunakan untuk analisis kuantitatif. Spektrum inframerah memberikan puncak-puncak maksimal yang jelas sebaik puncak minimumnya (Khopkar, 2003). Identifikasi pita absorpsi khas yang disebabkan oleh berbagai gugus fungsi merupakan dasar penafsiran spektrum inframerah (Creswell, 2005).
Pancaran inframerah pada umumnya mengacu pada bagian spektrum elektromagnet yang terletak di antara daerah tampak dan daerah gelombang mikro. Pancaran inframerah yang kerapatannya kurang daripada 100 cm-1 diserap oleh sebuah molekul organik dan diubah menjadi energi putaran molekul. Penyerapan ini tercatu dan dengan demikian spektrum rotasi molekul terdiri dari garis-garis yang tersendiri (Silverstein, 1981).
BAB 3
METODE PENELITIAN
3.1 Alat-alat
Alat stahl
GC-MS Shimadzu
Spektrofotometri Inframerah (FT-IR) Shimadzu
Belender National
Gelas ukur 100 ml Pyrex
Gelas ukur 25 ml Pyrex
Gelas Erlenmeyer 250 ml Pyrex
Labu destilasi 2000 ml Pyrex
Labu Alas 250 ml Pyrex
Alat Soklet
Pipet tetes
Tabung reaksi Pyrex
Hot plate stirrer Cimarrex
Aluminium foil
Neraca analitis Mettler AE 2000
Spatula
UV- Visible SP-300
Botol Vial Jarum Suntik
Beaker Glass 250 mL Pyrex
Kondensor
3.2 Bahan-bahan
Buah Kecombrang
Na2SO4 anhidrus p.a. Merck
Etanol absolut p.a. Merck
Aquadest
2,2-diphenyl-1-picrylhydrazyl (DPPH) p.a. Aldrich
Pereaksi Bouchardat p.a. Merck
Pereaksi CeSO4 1% dalam H2SO4 10% p.a. Merck
Pereaksi Dragendorf p.a. Merck
Pereaksi Lieberman-Bouchard p.a. Merck
Pereaksi Maeyer p.a. Merck
Pereaksi Wagner p.a. Merck
Pereaksi Salkowsky p.a. Merck
Pereaksi FeCl3 1% Pereaksi H2SO4 pekat Pereaksi NaOH 10% Pereksi Mg-HCl
3.3.1 Penyediaan Sampel
Bahan yang digunakan dalam penelitian adalah buah kecombrang yang diperoleh dari Pasar sore Padang Bulan, Medan.
3.3.2 Ekstraksi Buah Kecombrang
3.3.2.1 Isolasi Minyak Atsiri Buah Kecombrang dengan Alat Destilasi Stahl
Buah kecombrang dipisahkan antara biji dan kulit buahnya. Kemudian ditimbang kulit buahnya sebanyak 600 g, kemudian dihaluskan dengan blender dimasukkan kedalam labu alas 2000 mL ditambahkan air secukupnya, dipasang pada alat penyuling stahl, dan dipanaskan selama ± 4-5 jam hingga minyak atsiri menguap sempurna. Destilat yang diperoleh merupakan campuran minyak dengan air yang selanjutnya dipisahkan dengan corong pisah. Kemudian ditambahkan Na2SO4 anhidrous pada botol vial untuk memastikan minyak atsiri bebas dari air dan disimpan ditempat sejuk, dalam botol dan ditutup rapat. Minyak yang diperoleh dianalisa kandungan kimianya menggunakan alat GC-MS dan analisis FT-IR dan diuji aktivitas antioksidan.
3.3.2.2 Pembuatan Ekstrak Air Buah Kecombrang
Campuran residu dan esktrak air dari hasil isolasi minyak atsiri buah Kecombrang kemudian dipisahkan. Ekstrak airnya dipekatkan.
3.3.2.3 Pembuatan Ekstrak Etanol Buah Kecombrang
3.3.3 Skrining Fitokimia
Dilakukan skrining fitokimia untuk ekstrak etanol dan ekstrak air ampas buah kecombrang kering :
- Golongan Alkaloid
- Pereaksi wagner - Pereaksi maeyer - Pereaksi bouchardat - Pereaksi dragendorf - Golongan flavonoid
- Pereaksi FeCl3 1% - Pereaksi NaOH 10% - Pereaksi H2SO4
- Golongan steroid/terpenoid
- Pereaksi Lieberman-bouchard
- Pereaksi CeSO4 1% dalam H2SO4 10% - Pereaksi Salkowsky
3.3.4Analisis Minyak Atsiri Buah Kecombrang dengan GC-MS dan Analisis
FT-IR
3.3.4.1 Analisis GC-MS
Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS. Selanjutnya kondisi disesuaikan dengan kondisi dibawah ini kemudian diamati kromatogram yang dihasilkan oleh recorder dan mass recorder serta mass spektra masing-masing senyawa.
Kondisi alat GC-MS yaitu:
Panjang : 30 meter Gas Pembawa : Helium
Pengion : EI
GC-2010
Column Oven Temperatur : 60oC Injection Temperature : 215 oC Injection Mode : Split Flow Control Mode : Pressure
Pressure : 12 kPa
Total Flow : 81,5 mL/min Column Flow : 0,51 mL/min Linear Velocity : 26 cm/sec Purge Flow : 0,3 mL/min Split Ration : 158,4 Equilibrium Time : 0,5 min GCMS-QP2010
Ion Source Temperature : 250 oC Interface Temperature : 215 oC Solvent Cut Time : 1 min Detector Gain Mode : Relative Detector Gain : 0,00 kV MS
Start Time : 1,20
End Time : 38 min
ACQ Mode : Scan
Event Time : 0,50 sec
Scan Speed : 1250
Start m/z : 28
3.3.4.2 Analisis FT-IR
Minyak atsiri dioleskan pada plat KBr hingga terbentuk lapisan tipis transparan dan diukur spektrumnya dengan alat spektrofotometer FT-IR model I.R-420.
3.3.5 Uji Sifat Antioksidan Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang Dengan Metode DPPH
3.3.5.1 Pembuatan Larutan DPPH 0,03 mM
Larutan DPPH 0,3mM dibuat dengan melarutkan 11,85 mg serbuk DPPH dalam etanol p.a dalam labu takar 100 mL, kemudian dihomogenkan.
3.3.5.2 Pembuatan Variasi Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang
Minyak Atsiri Buah Kecombrang dibuat larutan induk 1000 ppm ; dengan melarutkan 0,025 g minyak atsiri dengan pelarut etanol p.a dalam labu takar 25 mL. Kemudian dari larutan induk 1000 ppm dibuat larutan 100 ppm. Kemudian dari larutan 100 ppm dibuat lagi variasi konsentrasi 10, 20, 30, dan 40 ppm untuk uji aktivitas antioksidan. Dilakukan perlakuan yang sama untuk ekstrak air dan ekstrak etanol dari buah kecombrang.
3.3.5.3 Uji Aktivitas Antioksidan
3.3.5.3.1 Larutan Blanko
Sebanyak 1 mL larutan DPPH 0,3 mM ditambahkan 2,5 mL Etanol absolut, dihomogenkan dalam tabung reaksi dan dibiarkan selama 30 menit pada ruang gelap. Setelah itu, diukur absorbansi dengan panjang gelombang maksimum 515 nm
3.4 Bagan Penelitian
3.4.1 Isolasi Minyak Atsiri Buah Kecombrang Dengan Destilasi Stahl
Buah Kecombrang Segar
dicuci bersih
dipisahkan kulit dengan bijinya
kulit buah biji buah
dihaluskan
ditimbang sebanyak 600 g
dimasukkan ke dalam labu Stahl 2 L
ditambahkan air suling secukupnya
dipasang alat destilasi Stahl
dipanaskan selama 4-5 jam
minyak atsiri dan sedikit air residu dan ekstrak air
dimasukkan ke dalam botol vial
ditambahkan Na2SO4 anhidrous
minyak atsiri
ditutup rapat dan disimpan dalam lemari pendingin
disaring
GC-MS FT-IR uji aktivitas antioksidan residu
ekstrak air
dipekatkan
dikeringkan disokletasi
dipekatkan ekstrak pekat etanol
uji aktivitas antioksidan uji aktivitas antioksidan
3.4.2 Skrining Fitokimia
ekstrak air buah kecombrang
dimasukkan ke dalam tabung reaksi secukupnya
diskrining fitokimia dengan penambahan pereaksi untuk masing-masing golongan
golongan alkaloid golongan flavonoid golongan steroid/terpenoid
dengan pereaksi wagner
dengan pereaksi maeyer
dengan pereaksi bouchardart dengan pereaksi dragendorf
dengan pereaksi FeCl3 1% dengan pereaksi NaOH 10% dengan pereaksi H2SO4
dengan pereaksi Lieberman-bouchard dengan pereaksi
CeSO4 1% dalam H2SO4 10% dengan pereaksi
Salkowsky
Hasil
Hasil Hasil
Dilakukan perlakuan yang sama untuk ekstrak etanol dari buah kecombrang
3.4.3 Uji Sifat Antioksidan Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang Dengan Metode DPPH
3.4.3.1 Pembuatan Larutan DPPH 0,03 mM
11,85 mg serbuk DPPH
dimasukkan ke dalam labu takar 100mL
ditambahkan etanol p.a hingga garis batas
dihomogenkan
3.4.3.2 Pembuatan Variasi Minyak Atsiri, Ekstrak Air dan Ekstrak Etanol Buah
Kecombrang
0,025 g Minyak Atsiri
dimasukkan ke dalam labu takar 25 ml ditambahkan etanol p.a hingga garis tanda
dihomogenkan 25 mL larutan induk 1000 ppm
dipipet 2,5 mL larutan induk 1000 ppm dimasukkan ke dalam labu takar 25 mL
ditambahkan etanol p.a hingga garis tanda dihomogenkan
25 mL larutan induk 100 ppm
dibuat variasi konsentrasi 10,20,30, dan 40 ppm dipipet 2,5 mL
dengan pipet volume dimasukkan ke dalam
labu takar 25 mL diencerkan dengan etanol p.a hingga garis tanda
dihomogenkan
dipipet 5 mL dengan pipet volume dimasukkan ke dalam
labu takar 25 mL diencerkan dengan etanol p.a hingga garis tanda
dihomogenkan
dipipet 7,5 mL dengan pipet volume dimasukkan ke dalam
labu takar 25 mL diencerkan dengan etanol p.a hingga garis tanda
dihomogenkan
dipipet 10 mL dengan pipet volume dimasukkan ke dalam
labu takar 25 mL diencerkan dengan etanol p.a hingga garis tanda
dihomogenkan
larutan 10 ppm larutan 10 ppmlarutan 20 ppm larutan 10 ppmlarutan 30 ppm larutan 10 ppmlarutan 40 ppm
3.4.3.3 Uji Aktivitas Antioksidan
a. Uji Blanko
b. Uji Sampel
1 mL larutan DPPH 0,3 mM
dimasukkan ke dalam tabung reaksi
ditambahkan 2,5 mL sampel
dihomogenkan
dibiarkan selama 30 menit pada ruang gelap
diukur absorbansi pada panjang gelombang maksimum 515 nm
Hasil
Dilakukan perlakuan yang sama untuk variasi konsentrasi Minyak atsiri, ekstrak etanol, dan ekstrak air
1 mL larutan DPPH 0,3 mM
dimasukkan ke dalam tabung reaksi ditambahkan 2,5 mL etanol p.a dihomogenkan
dibiarkan selama 30 menit pada ruang gelap
diukur absorbansi pada panjang gelombang maksimum 515 nm
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Ekstraksi Buah Kecombrang
4.1.1.1 Penentuan Kadar Minyak Atsiri
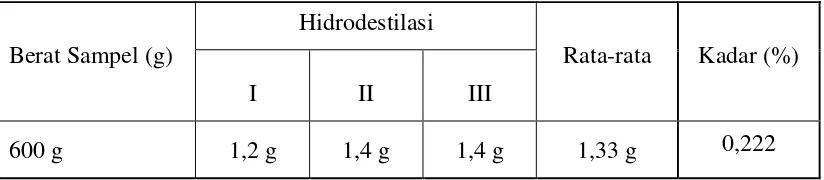
Minyak atsiri buah kecombrang diperoleh dengan metode hidrodestilasi menggunakan alat Stahl. Proses ini dilakukan secara triplo. Hasilnya seperti ditunjukkan pada tabel 4.1. Hasil Hidrodestilasi Minyak Atsiri buah kecombrang
Berat Sampel (g)
Hidrodestilasi
Rata-rata Kadar (%)
I II III
600 g 0,13 mL 0,14 mL 0,16 mL 0,143 mL 0,023
4.1.1.2 Penentuan Kadar Ekstrak Air dan Ekstrak Etanol
a. Ekstrak Air
Tabel 4.2. Hasil Ekstraksi Ekstrak Air
Berat Sampel (g)
Hidrodestilasi
Rata-rata Kadar (%)
I II III
c. Ekstrak Etanol
Tabel 4.3. Hasil Ekstraksi Ekstrak Etanol
Berat Sampel (g)
Hidrodestilasi
Rata-rata Kadar (%)
I II III
15 g 1,6 g 1,8 g 1,6 g 1,667 g 11,113
4.1.2 Hasil Analisa Minyak Atsiri Buah Kecombrang dengan GC-MS
Tabel 4.4. Senyawa Hasil Analisa GC-MS minyak atsiri buah kecombrang yang tergolong dalam sebagai minyak atsiri
No Rumus
Nama Senyawa yang diduga
1 C15H24 0,14 13,058 204, 189, 161, 147, 136, 121, 107, 93, 80, 67, 53, 41
Alpha humulene
2 C15H26O 0,21 14,592 189, 161, 148, 136, 123,107, 93, 71, 69, 41, 43
1, 6, 10 – Dodecatrien – 3 – ol
Tabel 4.5. Senyawa Hasil Analisa GC-MS minyak atsiri buah kecombrang yang tergolong sebagai senyawa steam volatile selain minyak atsiri
No Rumus
Nama Senyawa yang diduga 1 C10H20O 1,41 8,667 128, 110, 95,
55, 41
5 C14H28O2 4,54 15,113 171, 157, 140, 129, 111, 97, 83, 69, 43, 41
Dodecyl ester
4.1.3 Hasil Analisa Minyak Atsiri Buah Kecombrang dengan FT-IR
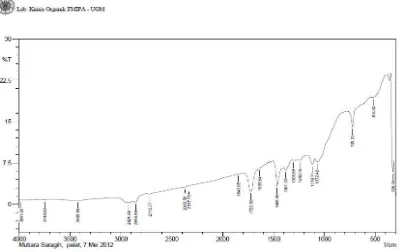
Gambar 4.2 : Spektrum FT-IR Minyak Atsiri Buah Kecombrang
Hasil analisis spektrofotometri inframerah (FT-IR) dari minyak atsiri buah kecombrang menghasilkan puncak-puncak serapan pada daerah bilangan gelombang (cm-1) sebagai berikut :
1. Puncak serapan pada bilangan gelombang 3425,58 cm-1 menunjukkan vibrasi stretching O-H, didukung oleh puncak vibrasi C-O dari senyawa Alkohol pada bilangan gelombang1072,42 cm-1.
3. Pada bilangan gelombang 1720,50 cm-1 puncak tajam menunjukkan adanya vibrasi ikatan rangkap C=O dari Aldehida
4. Pada bilangan gelombang 725,23 cm-1 puncak tajam menunjukkan adanya vibrasi ikatan –(CH2)n dengan n ≥ 4.
4.1.4 Hasil Uji Aktivitas Antioksidan Minyak Atsiri, Ekstrak Air, dan Ekstrak Etanol
Buah Kecombrang
Minyak atsiri, ekstrak air, dan ekstrak etanol buah kecombrang dilakukan uji aktivitas antioksidan dengan metode DPPH radikal bebas untuk diperoleh nilai IC50 dengan dilakukan pengamatan secara spektrofotometer UV-Visible pada panjang gelombang 515 nm. Kemampuan antioksidan diukur sebagai penurunan serapan larutan DPPH (peredaman warna ungu DPPH).
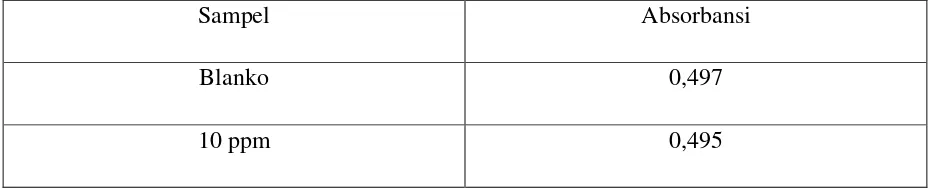
Tabel 4.6 Hasil Pengukuran Absorbansi Minyak Atsiri Buah Kecombrang
Sampel Absorbansi
Blanko 0,497
10 ppm 0,459
20 ppm 0,449
30 ppm 0,436
40 ppm 0,410
Dari persamaan regresi linier diperoleh nilai IC50 = 122,51 mg/L Tabel 4.7 Hasil Pengukuran Absorbansi Ekstrak Air Buah Kecombrang
Sampel Absorbansi
Blanko 0,497
20 ppm 0,493
30 ppm 0,490
40 ppm 0,486
Dari persamaan regresi linier diperoleh nilai IC50 = 922,69 mg/L
Tabel 4.8 Hasil Pengukuran Absorbansi Ekstrak Etanol Buah Kecombrang
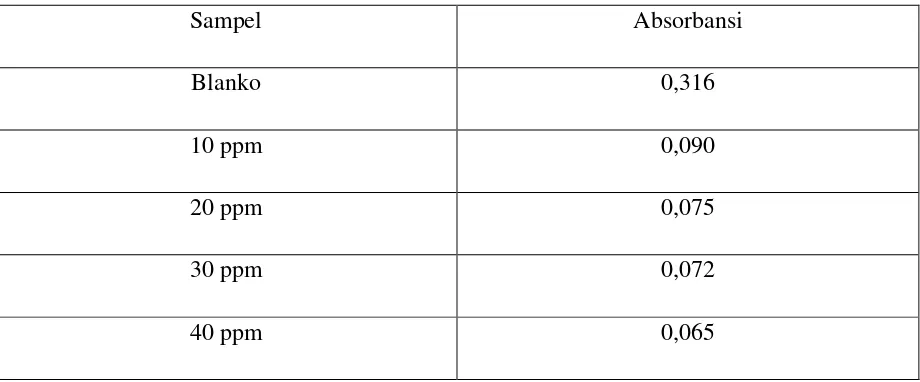
Sampel Absorbansi
Blanko 0,316
10 ppm 0,090
20 ppm 0,075
30 ppm 0,072
40 ppm 0,065
Dari persamaan regresi linear diperoleh nilai IC50 = 13,39 mg/L
4.2. Pembahasan
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Sthal
Dari hasil penelitian yang telah dilakukan diperoleh minyak atsiri buah kecombrang rata-rata sebanyak 0,143 mL dari 600 gram buah kecombrang. Jadi kadar minyak atsiri adalah 0,023 % (v/b) yang diperoleh dari perhitungan berikut:
% kadar minyak atsiri = minyak x100% kecombrang
buah berat
atsiri volume
= 100%
600 143 , 0
x g mL
Minyak atsiri buah kecombrang yang diperoleh berwarna putih. Kadar minyak atsiri yang diperoleh lebih kecil dibandingkan dengan minyak atsiri bunga kecombrang 0,14% (Perangin-angin, 2012). Jika dilakukan perbandingan dengan penelitian sebelumnya diduga kadar minyak atsiri dari bunga kecombrang lebih besar dibandingkan dengan kadar minyak atsiri pada buah kecombrang. Selain itu dari segi komponen senyawa yang diduga terdapat perbedaan pada beberapa jenis senyawa yang terkandung di antara bunga dan buah kecombrang seperti kandungan α-pinene yang terdapat pada bunga kecombrang sedangkan senyawa ini tidak terdapat pada buah kecombrang dan ada beberapa senyawa lain yang berbeda.
4.2.2 Ekstrak Air dan Ekstrak Etanol Buah Kecombrang
a. Ekstrak Air
Dari hasil penelitian yang telah dilakukan diperoleh ekstrak air buah kecombrang rata-rata sebanyak 1,333 g dari 600 gram buah kecombrang. Jadi kadar ekstrak air buah kecombrang adalah 0,222 % (b/b) yang diperoleh dari perhitungan berikut :
% kadar ekstrak air = x100% kecombrang
buah berat
air ekstrak volume
= 100%
600 333 , 1
x g
g
b. Ekstrak Etanol
Dari hasil penelitian yang telah dilakukan diperoleh ekstrak etanol buah kecombrang rata-rata sebanyak 1,667 g dari 15 gram buah kecombrang. Jadi kadar ekstrak etanol buah kecombrang adalah 11,113 % (b/b) yang diperoleh dari perhitungan berikut :
% kadar ekstrak etanol = tan x100% rang
buahkecomb berat
ol ekstrake volume
= 100%
15 667 , 1
x g
g
= 11,113 %
Tabel 4.9. Hasil Skrining Fitokimia Ekstrak air dan Ekstrak Etanol Buah Kecombrang
Golongan Pereaksi Hasil Skrining
Ekstrak air Ekstrak etanol
Alkaloida Dragendorf - -
Bouchardart - -
Maeyer - -
Wagner - -
Terpenoida/ Steroida Salkowsky - -
Lieberman-Bouchard - -
CeSO4 1% dalam H2SO4 10% - -
Flavonoida NaOH 10% - -
FeCl3 1% + +
4.2.3 Analisis Minyak Atsiri Buah Kecombrang
1. Puncak dengan RT 8,667 menit merupakan senyawa dengan rumus molekul C10H20O. Data spektrum menunjukkan puncak ion molekul pada m/e 128 diikuti puncak-puncak fragmentasi pada m/e 110, 95, 82, 57, 43, 41. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah senyawa N-Decanal sebanyak 1,41% dengan spektrum seperti gambar 4.3
a.
b.
Gambar 4.3 Spektrum massa senyawa N-Decanal dengan RT 8,675 Keterangan : a. Senyawa N-decanal dari sampel
b. Standart Library
H3C
2. Puncak dengan waktu retensi (RT) 12,457 menit merupakan senyawa dengan rumus molekul C14H28O. Data spektrum massa menunjukkan puncak ion molekul pada m/e 156 diikuti dengan puncak-puncak fragmentasi pada m/e 138, 110, 96, 82, 57, 43, 41. Denga membandingkan data spektrum yang diperoleh dengan spektrum library yang lebih mendekati adalah senyawa Myristaldehida sebanyak 41,04 % dengan spektrum seperti gambar 4.5
a.
b.
Gambar 4.5 Spektrum massa senyawa Myristaldehida dengan RT 12,458 Keterangan a. Senyawa Myristaldehida dari sampel
b. Standart Library
H3C
3. Puncak dengan waktu retensi (RT) 13,467 menit merupakan senyawa dengan rumus molekul C12H26O. Data spektrum massa menunjukkan puncak ion molekul pada m/e 140 diikuti puncak-puncak fragmentasi pada m/e 126, 112, 111, 97, 83, 69, 55, 41. Dengan membandingkan data spektrum yang diperoleh dengan spektrum pada library yang lebih mendekati adalah senyawa 1-Dodecanol sebanyak 33,07 % dengan spektrum seperti pada gambar 4.7
a
b.
Gambar 4.7 Spektrum massa senyawa 1-Dodecanol dengan RT 13,467 Keterangan a. Senyawa 1-Dodecanol
b. Standart Library
H3C
1 - Dodecanol
m/e = 186
4. Puncak dengan waktu retensi (RT) 15,042 menit merupakan senyawa dengan rumus molekul C12H24O2. Data spektrum massa menunjukkan puncak ion molekul pada m/e 200 diikuti puncak-puncak fragmentasi pada m/e 171, 157, 143, 129, 115, 98, 85, 73, 60, 55, 41. Dengan membandingkan data spektrum yang diperoleh dengan spektrum pada library yang lebih mendekati adalah senyawa Asam Dodecanoat sebanyak 8,67 dengan spektrum seperti gambar 4.9
a.
b.
Gambar 4.9 Spektrum massa senyawa Asam Dodecanoat Keterangan a. Senyawa Asam Dodecanoat
b. Standart Library
H3C
5. Puncak dengan waktu retensi (RT) 15,113 menit merupakan senyawa dengan rumus molekul C14H28O2. Data spektrum massa menunjukkan puncak ion molekul pada m/e 171 diikuti puncak-puncak fragmentasi pada m/e 157, 140, 129, 111, 97, 83, 69, 43, 41. Dengan membandingkan data spektrum yang diperoleh dengan spektrum pada library yang lebih mendekati adalah senyawa Dodecyl Ester sebanyak 4,54% dengan spektrum seperti gambar 4.11
a. a.
b
b. b
Gambar 4.11 Spektrum massa senyawa Dodecyl Ester Keterangan a. Senyawa Dodecyl ester
b. Standart library
6. Puncak dengan RT 13,058 menit merupakan senyawa dengan rumus molekul C15H24. Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti puncak-puncak fragmentasi pada m/e 204, 189, 161, 147, 136, 121, 107, 93, 80, 67, 53, 41. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah senyawa Alpha-humulene sebanyak 0,14% dengan spektrum seperti gambar 4.13
a.
b.
Gambar 4.13 Spektrum massa senyawa Alpha-humulene dengan RT 13,058 Keterangan : a. Senyawa Alpha-humulene
b. Standart library
CH3
7. Puncak dengan RT 14,592 menit merupakan senyawa dengan rumus molekul C15H26O. Data spektrum menunjukkan puncak ion molekul pada m/e 189 diikuti puncak-puncak fragmentasi pada m/e 189, 161, 148, 136, 123, 107, 71, 69, 43, 41. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah senyawa 1,6,10-dodecatrien-3-ol sebanyak 0,21% dengan spektrum seperti gambar 4.15
a.
b.
Gambar 4.15 Spektrum massa senyawa Alpha-humulene dengan RT 14,592 Keterangan : a. Senyawa 1,6,10-Dodecatrien-3-ol
b. Standart library
H3C
4.2.4 Uji Aktivitas Antioksidan Minyak Atsiri, Ekstrak Air, dan Ekstrak Etanol
Uji aktivitas antioksidan dari minyak atsiri, ekstrak air, dan ekstrak etanol buah kecombrang dapat dilakukan terhadap DPPH dengan metode spektrofotometri visible.
Peredaman warna DPPH terjadi karena adanya senyawa yang dapat memberikan radikal hidrogen kepada radikal DPPH sehingga tereduksi menjadi DPPH-H (1,1-difenil-2-pikrilhidrazin). Reaksi reduksi DPPH dapat dilihat sebagai berikut ini :
N
N
NO2
NO2 O2N
DPPH
+ RH
N
N
NO2
NO2 O2N
H
+ R
DPPH-H
Minyak atsiri, ekstrak air dan ekstrak etanol dari buah kecombrang dilakukan uji aktivitas antioksidan dengan metode DPPH radikal bebas untuk diperoleh nilai IC50 dengan dilakukan pengamatan secara spektrofotometri UV-Visible pada panjang gelombang maksimum 518 nm (Ramawasmy, 2011).
Pada uji DPPH, peredaman radikal DPPH diikuti dengan pemantauan penurunan absorbansi pada panjang gelombang maksimum yang terjadi karena pengurangan oleh antioksidan AH atau reaksi dengan spesi radikal (R .). data yang sering dilaporkan sebagai IC50, merupakan konsentrasi antioksidan yang dibutuhkan untuk 50% peredaman radikal DPPH pada periode waktu tertentu (15 – 30 menit) (Pokornya, 2001).
BAB 5
KESIMPULAN DAN SARAN
7.1Kesimpulan
- Hasil analisa GC-MS menunjukkan komponen utama minyak atsiri buah kecombrang adalah N-decanal (1,41%), Myristaldehida (41,04%), 1-dodecanol (33,07%), Asam dodecanoat (8,67%), Dodecyl ester (4,54%), Alpha-humulene (0,14%) dan 1,6,10-dodecatrien-3-ol (0,21%).
- Urutan kekuatan aktivitas antioksidan dengan metode DPPH adalah ekstrak etanol (IC50 13,39 mg/L), minyak atsiri (IC50 122,48 mg/L) dan ekstrak air (IC50 922,69 mg/L).
7.2Saran
- Perlu diteliti lebih lanjut senyawa yang bersifat antioksidan yang terdapat dalam minyak atsiri, ekstrak air dan ekstrak etanol dari buah kecombrang.
DAFTAR PUSTAKA
Achmad, S. 1986. Kimia Organik Bahan Alam. Jakarta : Universitas Terbuka. Agusta, A. 2000. Minyak Atsiri Tumbuhan Tropika Indonesia. Bandung : ITB. Bakkali,F.S.,Averbeck S.A, Averback D and Idaomar, M. 2008. Biological Effects of
Essential Oils. Food and Chemical toxicology 46.
Chan. 2007. Antioxidant and Antibacterial Activity of Leaves of Etlingera Elatior Species (Zingeberaceae). (In pescular Malaysia : Food Chem 104:1586 – 93).
Creswell, C. J. 2005. Analisis Spektrum Senyawa Organik. Bandung : Penerbit ITB.
Dalimartha, S dan Soedibyo, M. 1998. Awet Muda dengan Tumbuhan Obat dan Diet Suplemen. Jakarta : Trubus Agriwidya.
Degenhardt,J., J. Gershenzon. 2003. Genetic Modification of Secondary Metabolism.
Germany : Elsevier Ltd. Page 500.
Fowlis, I.A. 1998. Gas Chromatography Analytical Chemistry by Open Learning. Chiester : John Wiley and Sons.
Fessenden, R. J. 1986. Kimia Organik. Penerjemah Aloysis Hadyana Pudjaatmaka. Jakarta : Penerbit Erlangga.
Fuadrofiqi. 2012. (http ://blogspot.com/2012/02/definisi-instrumentasi-prinsip-kerja.html). Gritter, R. J. 1991. Pengantar Kromatografi. Bandung : Penerbit ITB.
Guenther, E. 2006. Minyak Atsiri. Jilid I. Penerjemah Ketaren. S. Jakarta : Penerbit UI Press. Gunawan, D dan Mulyani, S. 2004. Ilmu Obat Alam (Farmakologi). Jilid I. Jakarta : Penerbit
Penebar Swadaya.
Habsah, M. 2005. Antitumor Promoting and Cytotoxic Constituents of Etlingera elatior.
Malaysian J. Med 12 : 6-12.