PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Preparasi Imunoglobulin Yolk (IgY) Spesifik Rabies untuk Pengembangan Kit Diagnostik adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SUWARNY RUHI. Preparasi Imunoglobulin Yolk (IgY) Spesifik Rabies untuk Pengembangan Kit Diagnostik. Dibimbing oleh SRI MURTINI dan OKTI NADIA POETRI.
Rabies adalah penyakit yang disebabkan oleh virus neurotropik genus Lyssavirus famili Rhabdoviridae dan dapat ditularkan dari hewan ke hewan lain maupun hewan ke manusia melalui saliva.Penyakit ini bersifat zoonosis dan berakibat fatal pada manusia, sehingga semua material yang dicurigai terinfeksi virus rabies harus ditangani dengan memperhatikan aspek keamanan sesuai dengan spesifikasi World Health Organization(WHO). Diagnosis penyakit rabies di Indonesia selama ini hanya berdasarkan gejala klinis dan pemeriksaan histopatologis preparat otak yang berasal dari hewan tersangka.Teknik diagnosa untuk mendeteksi virus rabies harus terus dikembangkan. Antigen dan antibodi standar sangat diperlukan untuk diagnosa rabies. Penelitian ini bertujuan untuk memproduksi antibodi standar terhadap virus rabies yang nantinya dapat di gunakan sebagai antibodi standar dan membandingkan dua metode purifikasi imunoglobulin yolk(IgY) spesifik rabies asal kuning telur.
Kegiatan penelitian yang dilakukan meliputi produksi antibodi pada ayam petelur yang telah divaksinasi menggunakan antigen rabies terinaktivasi, pengukuran konsentrasi IgY dalam kuning telur, pemurnian IgY dari kuning telur, pengukuran konsentrasi total protein IgY, karakterisasi antibodi spesifik rabies, penentuan titer IgY anti rabies menggunakan ELISA. Kuning telur yang diketahui positif mengandung IgY spesifik rabies dimurnikan menggunakan dua metode yaitu : 1) pengendapan dengan NaCl; 2) teknik Water Soluble Fraction (WSF), dilanjutkan pengendapan dengan PEG 6000-amonium sulfat. Titer IgY spesifik di tentukan dengan uji ELISA dan karakterisasi protein dengan metode SDS-PAGE.
Hasil penelitian menunjukkan bahwa antibodi anti-rabies dapat dideteksi pada kuning telur pada minggu kedua setelah vaksinasi pertama. Purifikasi IgY dengan NaCl menghasilkan konsentrasi 331 µg/ml dan teknik WSF 184 µg/ml. Karakterisasi protein menggunakan SDS-PAGE menghasilkan pita protein pada teknik NaCl dengan berat molekul 164,16 kDa, 126,43 kDa, 97,36 kDa, 68,73 kDa, 40,76 kDa, 28,77 kDa dan teknik WSF dengan berat molekul 94,03 kDa, 65,61 kDa, dan 31,94 kDa. Titer antibodi spesifik menggunakan teknik NaCl lebih besar dari 0,5 EU/ml dan teknik WSF dengan titer antibodi di bawah 0,5 EU/ml . Berdasarkan hasil penelitian, dapat disimpulkan bahwa IgY spesifik rabies dapat diproduksi pada ayam petelur dan menghasilkan antibodi yang titernya cukup tinggi
SUMMARY
SUWARNY RUHI. Preparation of Rabies Virus-Specific Yolk Imunoglobulin (IgY) for The Development of Diagnostic Kits. Supervised by SRI MURTINI and OKTI NADIA POETRI.
Rabies is a disease caused by neurotropic viruses belong to the genus Lyssavirus and family Rhabdoviridae and can be transmitted from animal to animal or animal to human through saliva. Rabies is zoonotic and can be fatal in humans. All material from suspected animal should be treated in accordance with World Health Organization (WHO) safety aspect. Currently, diagnosis of rabies in Indonesia were based on clinical symptoms and histopathological examination of suspected animal brain. Diagnosis of rabies virus required antigen and antibody standard. Our study aims to produce rabies specific immunoglobulin yolk (IgY) and comparing two methods of IgY purification from egg yolks.
Laying hen were vaccinated twice using inactivated rabies antigen emulsified with adjuvant. The interval between vaccination were four weeks. Eggs were collected and tested using Enzyme Linked Immunosorbent Assay (ELISA) to detect the presence of rabies specific IgY in the egg yolk. Egg yolks known positve for rabies specific IgY was purified using methods: 1) precipitation by NaCl, PEG 6000-ammonium sulfate; 2) Water Soluble Fraction (WSF)techniques, followed by precipitation with ammonium sulfate and polyethilene glycol (PEG) 6000. Rabies specific IgY titers were determined by ELISA and IgY characterization determined using Sodium Dodecyl Sulfate-Polyacrilamide Gel Electrophoresis (SDS-PAGE).
Our results showed that rabies specific IgY were detected in egg yolk two weeks after the first vaccination. Immunoglobulin Y purified with NaCl presipitation resulting concentration of 331 µg/ml and WSF techniques resultingconcentration of 184 µg/ml. Immunoglobulin Y purified with NaCl precipitation produces protein with molecular weight at164.16 kDa, 126.43 kDa, 97.36 kDa, 68.73 kDa, 40.76 kDa, 28.77 kDa, whilst WSF technique produces protein molecular weight at 94.03 kDa, 65.61 kDa and 31.94 kDa. Immunoglobulin Y purified with NaCl precipitation has titre greater than 0.5 EU/ml and IgY purified with WSF techniques has titre below 0.5 EU/ml. Our conclusion would be that the rabies specific IgY can be produced in laying hens and produce high antibody titers.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
PREPARASI IMUNOGLOBULIN YOLK (IgY) SPESIFIK
RABIES UNTUK PENGEMBANGAN KIT DIAGNOSTIK
Judul Tesis : Preparasi Imunoglobulin Yolk (IgY) Spesifik Rabies untuk Pengembangan Kit Diagnostik
Nama : Suwarny Ruhi
NIM :
B253140071
DisetujuiOleh Komisi Pembimbing
Dr Drh Sri Murtini, MSi Ketua
Dr Drh Okti Nadia Poetri, Msi MSc Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof Dr Drh Fachriyan H Pasaribu
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: (28 Oktober 2016)
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak Juli 2015 sampai Juni 2016 ini ialah Preparasi Imunoglobulin Yolk (Igy) Spesifik Rabies Untuk Pengembangan Kit Diagnostik.
Terima kasih penulis ucapkan kepada IbuDr. Drh. Sri Murtini, M.Si.dan Ibu Dr. Drh. Okti Nadia Poetri, M.Si, M.Sc. selaku pembimbing, serta Ibu Prof. Dr. Drh. Retno D. Soejoedono, MS. yang telah banyak memberi saran, arahan dan semangat kepada penulis selama persiapan dan pelaksanaan penelitian hingga penyusunan tesis ini.Penghargaan penulis sampaikan kepada Bapak Prof.Dr.Drh. Fachriyan H. Pasaribudan Dr. Drh. Agustin Indrawati, M. Biomed. selaku Ketua dan Sekretaris Program Studi Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor. Kepada Prof. Dr. Ir. C. Hanny Wijaya. M.Agr. yang telah memberikan kesempatan untuk mengikuti dan mempresentasikan karya ilmiah pada penyelenggaraan The 3rd International Postgraduate Symposium on Food Agriculture & Biotechnology in ASEAN (IPSFAB2016) yang diselenggarakan di Universitas Mahasharaskham, Bangkok. Tidak lupa penulis juga mengucapkan banyak terimakasih kepada panitia penyelenggara penerimaan bantuan beasiswa tesis/disertasi Lembaga Pengelola Dana Pendidikan (LPDP) 2016 atas bantuan dana penelitian sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini.
Kepada Ayahanda Drs. La Ode Ruhi dan Ibunda Asmawati, serta seluruh keluarga, penulis menyampaikan terimakasih yang sedalam-dalamnya atas segala doa, dorongan semangat dan kasih sayangnyayang tak pernah berhenti diberikan kepada penulis. Terimakasih kepada teman-teman MKM 2014, Pondok Harum dan Forum Wacana Sulawesi Tenggara, semoga silaturahim tetap terjalin. Terimakasih pula kepada Doddy Ismunandar, S.P, M.P, Setya Indra Padma Putri, S.Kel, M.Si, Retia Revany, S.Pi, M.Si, Herlina Adelina Meria Uli Sagala, S.Pi, M.Si dan Bunga Anggraeny, S.I.K, M.Si yang selalu memberikan dorongan dan membantu penulis dalam penelitian, sehingga penulis dapat menyelesaikan penelitian dan tesis ini.
Penulis menyadari, bahwa karya ilmiah ini belum sempurna. Oleh karena itu, dengan rendah hati penulis memohon maaf dan berharap semoga karya kecil ini dapat bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 2
Penyakit Rabies 2
Imunoglobulin (Ig) 3
Enzyme Linked Immunosorbent Assay (ELISA) 5
3 METODE 6
Waktu dan Tempat Penelitian 6
Bahan 6
Alat 6
Prosedur 6
4 HASIL DAN PEMBAHASAN 10
Produksi dan Deteksi IgYspesifik rabies dalam Kuning Telur 10 Konsentrasi dan Karakterisasi IgY spesifik rabies hasil pemurnian 12
Titrasi IgY spesifik rabies 14
5 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
DAFTAR TABEL
1 Deteksi dan pengukuran konsentrasi IgY dalam kuning telur 11 2 Berat molekul komponen-komponen protein
dan masing-masingpita penyusunnya 12
3 Titer IgY spesifik rabies 14
DAFTAR GAMBAR
1 Struktur virus rabies 32 Struktur imunoglobulin G 4
3 Struktur imunoglobulin Y 5
4 Uji ELISA IgY pada kuning telur 11
1 PENDAHULUAN
Latar Belakang
Rabies adalah penyakit yang disebabkan oleh virus neurotropik genus Lyssavirus famili Rhabdoviridae dan dapat ditularkan dari hewan ke hewan lain maupun hewan ke manusia melalui saliva. Virus rabies dapat menginfeksi hewan peliharaan (anjing, kucing, dan primata/kera), hewan ternak (sapi, kambing, domba, babi, dan kuda) hewan liar (tikus, serigala, musang dan bison) dan manusia. Rabies merupakan salah satu penyakit zoonosis dan berakibat fatal pada manusia, sehingga semua material yang dicurigai terinfeksi virus rabies harus ditangani dengan memperhatikan aspek keamanan sesuai dengan spesifikasi World Health Organization (WHO 1992). Diagnosis penyakit rabies di Indonesia selama ini hanya berdasarkan gejala klinis dan pemeriksaan histopatologis preparat otak yang berasal dari hewan tersangka.
Penyakit rabies bersifat enzootik di beberapa provinsi di Indonesia. Pengendalian penyakit rabies umumnya dilakukan dengan vaksinasi, sosialisasi, eliminasi anjing tidak berpemilik/diliarkan, pengawasan lalulintas hewan penular rabies (HPR). Upaya pemerintah untuk mengendalikan rabies melalui vaksinasi dan eliminasi anjing tidak berpemilik belum optimal, bahkan di beberapa daerah tertentu kasus rabies semakin meningkat (Adjid et al, 2005). Kondisi ini meningkatkan kewaspadaan masyarakat dalam upaya pengendalian penyakit. Salah satu bentuk kewaspadaan adalah dengan pengembangan teknis diagnosa laboratorium terhadap rabies yang cepat dan akurat.
Berbagai uji dapat dilakukan untuk diagnosa penyakit rabies. Pengujian dapat berupa uji deteksi antigen maupun antibodi dengan uji serologis. Beberapa metode uji serologis yang sering digunakan dalam mendeteksi keberadaan antibodi terhadap rabies adalah serum netralisasi test (SNT), Rapid Fluorescent Focus Inhibition Test (RFFIT) dan Fluorescent Antibodi Virus Neutralisation (FAVN). Pada kedua metode uji, digunakan virus rabies hidup, sehingga dalam pelaksanaannya memerlukan laboratorium dengan fasilitas biosekuriti level 3 serta staf yang telah terlatih dan telah divaksinasi rabies. Uji Enzym Linked Immunosorbent Assay (ELISA) juga digunakan untuk mendeteksi antibodi spesifik rabies. ELISA digunakan untuk mendeteksi antibodi rabies pada serum hewan (anjing dan kucing) serta pada serum manusia (Meslin & Kaplan 1996).
Teknik diagnosa untuk mendeteksi virus rabies harus terus dikembangkan. Pengujian untuk diagnosa virus rabies, memerlukan antigen serta antibodi standar. Penelitian ini bertujuan untuk memproduksi antibodi standar terhadap virus rabies pada ayam petelur yang nantinya dapat digunakan dalam pengembangan kit diagnostik rabies serta membandingkan dua metode purifikasi IgY spesifik rabies asal kuning telur.
Tujuan Penelitian
2
Manfaat Penelitian
Antibodi yang di peroleh pada penelitian ini, diharapkan dapat digunakan sebagai antibodi standar dalam pengembangan kit diagnostik rabies.
Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan yaitu produksi antibodi spesifik rabies pada ayam petelur. Imunoglobulin Ydimurnikan dari kuning telurmenggunakan dua metode yaitu : 1) pengendapan dengan NaCl; 2) teknik Water Soluble Fraction (WSF), dilanjutkan pengendapan dengan PEG 6000-amonium sulfat. Titer IgY spesifik di tentukan dengan uji ELISA dan karakterisasi protein dengan metode SDS-PAGE.
2 TINJAUAN PUSTAKA
Penyakit Rabies
Penyakit rabies disebabkan oleh virus dari genus Lyssavirus, famili Rhabdoviridae. Struktur virus rabies berbentuk batang seperti peluru dengan ukuran panjang rata-rata 180 nm dan lebar 75 nm dengan ukuran spike 10 nm. Virus rabies (Gambar 1) tersusun dari Ribose Nucleid Acid (RNA) (2-3%), protein (67-74%), lemak (20-26%) dan karbohidrat (3%) yang menyatu menjadi struktur utamanya (Wunner 2007). Penyakit rabies atau penyakit anjing gila dikenal juga dengan nama Lyssa (Inggris), Rage (Perancis), Tolwut (Jerman) dan Hydrophobia, penyakit ini menyebabkan infeksi viral akut pada susunan saraf pusat, gejala klinis ditandai dengan kelumpuhan yang progresif dan berakhir dengan kematian. Penyakit ini menyerang hewan berdarah panas dan manusia. Secara umum, anjing merupakan penular terpenting kasus rabies pada manusia yang biasanya terjadi melalui gigitan hewan terinfeksi rabies (WHO 2002).
Gambar 1 Struktur virus rabies
3 yang diinokulasikan per oral pada marmut dapat menyebabkan terjadinya infeksi dan virus terisolasi di berbagai organ, seperti otak, paru-paru dan lambung, namun tidak ditemukan adanya antibodi yang mampu terinduksi akibat infeksi peroral.
Virus hanya dapat bereplikasi dalam sel–sel hidup karena virus menggunakan energi dan komponen sel inang untuk mensintesis protein dan asam nukleat virus yang diperlukan. Virus akan mengalami replikasi di sel otot sampai dapat memenuhi konsentrasi yang cukup untuk mencapai ujung saraf motoris terdekat (Lewis et al, 2000). Protein G pada virus berikatan dengan reseptor nikotinik asetilkolin, neural cell adhesion molecule (NCAM) reseptor, dan p75 neurotrophin reseptor pada neuromuscular junction dan menginfeksi sistem saraf (Jackson 2007). Virus selanjutnya akan mengalami endositosis dan akan melepaskan asam inti (RNA) dari amplop dan nukleokapsid di sitoplasma. Masing-masing RNA ditranskripsi ke mRNA dan kemudian ditranslasi menjadi protein (Wunner 2007)
Imunoglobulin (Ig)
Imunoglobulin (Ig) merupakan substansi pertama yang diidentifikasi sebagai molekul dalam serum dengan kemampuan menetralkan sejumlah benda asing atau mikroorganisme penyebab infeksi. Imunoglobulin dalam serum manusia terdiri dari 5 bentuk yaitu IgG, IgA, IgM, IgD, dan IgE (Tizard 2004). Klasifikasi ini berdasarkan atas perbedaan struktur kimia yang mengakibatkan perubahan terhadap sifat biologik maupun sifat fisika imunoglobulin.
Imunoglobulin G merupakan antibodi yang paling berlimpah dalam sirkulasi. Imunoglobulin ini dengan mudah melewati pembuluh darah dan memasuki jaringan. Imunoglobulin G juga menembus blood placenta barrier sehingga imunoglobulin ini ditransfer dari ibu ke janin. IgG juga berperan serta dalam melindungi tubuh dari bakteri, virus, dan toksin yang beredar di dalam pembuluh darah dan limfa, dan memicu kerja sistem komplemen (Campbellet al, 2004).
Berat molekul IgG sekitar 160 kDa dan memiliki dua rantai berat serta dua rantai ringan yang identik. Dengan mikroskop elektron, ImunoglobulinG terlihat berupa molekul berbentuk Y dan bagian lengan tersebut yang mampu mengikat antigen (Gambar 2). Kedua fragmen lengan dari molekul uji identik dan masih memiliki kemampuan untuk mengikat antigen. Bagian hipervariabel pada rantai ringan dan rantai berat bersama-sama membentuk suatu tempat pengikatan antigen tunggal. Kekhususan interaksi antara antigen dan antibodi berdasarkan susunan asam amino pada bagian hipervariabelnya. Bentuk konformasi dari tempat pengikatan antigen dengan immunoglobulin itulah yang menentukan determinan antigen khusus yang akan bereaksi dengan Ig G (Tizard 2004).
6
3 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Unit Pelayanan Terpadu Bagian Mikrobiologi Medis, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, dan Unit Pelayanan Hewan Laboratorium Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Waktu penelitian dilakukan selama 10 bulan dimulai dari bulan Juli 2015 sampai Juni 2016.
Bahan
Penelitian ini menggunakan 3 ekor ayam petelur yang berumur 24 minggu. Vaksin inaktif rabies (Verorab®), phosphat buffer saline(PBS) pH 7,2 dan pH 8, Na azide 0.1%, poly etylene glycol(PEG) 6000, agarose, amonium sulfat 40%, akuabides, carbonat bicarbonat buffer pH 9.6, bovine serum albumin(BSA), alkohol 70%, NaOH, HCl, asam fosfat, comassie blue(Sigma® Chemical Co), asam asetat glacial, metanol, acrylamide, Tris-HCl pH, NaCl, sodium dodecyl sulfate (SDS), ammonium perosulfat (APS), tetrametilen diamina (TEMED), coating buffer, substrat tetramethylbenzidine (TMB), skim milk, horse reddish peroxydase (HRP), PBS tween (PBST), kit platelia II (Biorad®), marker umum protein, IgY standar (PROMEGA®).
Alat
Alat yang digunakan adalah tabung reaksi, kaca objek, gelas ukur,mikrotube, kertas saring, spoit, tabung mikro bersumur 96 (microplate U bottom 96 wells), pipet mikro, vortex, magnetic stirer (Luchi HSD-4P), refrigerator (Sanyo), deep freezer -80 (Sanyo Ultralow), inkubator, sentrifus, spektrofotometer (Hitachi U-20), vertikal elektroforesis, microwave, ELISA reader,dan kamera digital
Prosedur
Produksi Antibodi
Produksi antibodi terhadap virus rabies menggunakan dua ekor ayam petelur berumur 24 minggu. Vaksinasi pertama dilakukan dengan menyuntikkan 1 dosis (0,5 ml) vaksin inaktif rabies yang telah dicampur dengan complete adjuvant melalui rute intramuskular pada otot dada. Penyuntikan diulang kembali dua minggu kemudian dengan dosis dan rute yang sama menggunakan vaksin rabies inaktif yang telah dicampur dengan incomplete adjuvant. Satu ekor ayam petelur digunakan sebagai ayam kontrol yang tidak divaksin. Telur dikoleksi setiap hari satu minggu setelah vaksinasi pertama.
Deteksi Keberadaan IgY Spesifik Rabies pada Kuning Telur
7 menggunakan sonikator. Antigen yang telah disonikasi diukur konsentrasi proteinnya dengan metode Braddford. Antigen kemudian diencerkan 1:50 menggunakan coating buffer (0,05 M carbonate-bicarbonate pH 9,5) sehingga konsentrasi akhir yang digunakan adalah 5 µg/ml. Antigen yang telah diencerkan kemudian dimasukkan ke dalam masing-masing sumur dari mikroplate sebanyak 100 µl/sumur dan diinkubasi pada suhu 4 ºC selama semalam. Plate selanjutnya dicuci lima kali menggunakan PBS-T (PBS p-H 7,4 + 0,05% Tween-20) sebanyak 300 µl tiap sumur. Masing-masing sumur pada plate uji di-blocking menggunakan larutan skim milk 5% sebanyak 100 µl dan diinkubasi pada suhu 37 ºC selama 2 jam. Plate kemudian dicuci seperti pada langkah sebelumnya. Sampel kuning telur dan IgY kontrol positif diencerkan 1:1000 kemudian ditambahkan pada masing-masing sumur sebanyak 100 µl dan diinkubasi pada suhu 37 ºC selama 1 jam. Anti IgY yang telah dikonjugasikan dengan Horse Reddish Peroxydase (HRP) (pengenceran 1:10.000) ditambahkan pada tiap sumur sebanyak 100 µl dan diinkubasi pada suhu 37 ºC selama 1 jam.Plate kemudian dicuci dan selanjutnya ditambahkan substrat TMB pada tiap sumur sebanyak 100 µl dan didiamkan selama 20-30 menit. Reaksi ELISA dihentikan dengan menambahkan 50 µl H2SO4 3M dan dilakukan pembacaan optical density (OD) pada 655 nm. Nilai cut of value (CV) pada uji ini diperoleh dengan persamaan :
CV = Rataan kontrol negatif + (1 × standar deviasi)
Hasil dinyatakan positif jika nilai absorbansi lebih besar atau sama dengan nilai cut off.
Pengukuran Konsentrasi IgY dalam Kuning Telur
Anti-chicken IgY diencerkan dalam larutan buffer karbonat pH 9,6 dengan konsentrasi 1µg/ml Anti-chicken IgY kemudian dimasukkan ke dalam semua µl/sumur. Cawan diinkubasi selama satu jam pada suhu 37 ºC selanjutnya dicuci
kembali lima kali dengan PBS Tween˗20. Sebanyak 100 µl larutan standar dengan
8
konsentrasi IgY total dalam kuning telur menggunakan persamaan regresi linear dengan nilai absorbansi Y dan X sebagai konsentrasi.
Ekstraksi dan Pemurnian IgY dari Kuning Telur
Ekstraksi dan pemurnian IgY dilakukan dengan dua metode, yaitu pengendapan dengan NaCl (Hodek et al., 2013) dan teknik Water Soluble Fraction (WSF), hasil dari kedua metode masing-masing dilanjutkan pengendapan dengan PEG 6000-amonium sulfat (Jenseniuset al, 1981 ; Akita dan Nakai, 1992 ; Polson et al, 1980).
Pengendapan NaCl (Hodek et al., 2013) dilakukan dengan cara: kuning telur di pisahkan dari putih telur, kemudian diencerkan dengan PBS yang mengandung 0,1 % Na azid dengan perbandingan 1:1, kemudian ditambahkan 0,5M HCl hingga pH campuran menjadi 5.0 dan dibekukan pada suhu -20 °C. Kuning telur kemudian dicairkan dan disentrifus pada 13.500 g selama 15 menit pada suhu 4 ºC. Supernatan yang diperoleh dikumpulkan untuk uji selanjutnya.
Supernatan ditambahkan dengan NaCl, sehingga mengandung 2M NaCl. Selanjutnya pH campuran disesuaikan menjadi 4 sambil dihomogenkan menggunakan magnet pengaduk selama 2 jam pada suhu ruangan. Campuran tersebut disentrifus 3700 g selama 20 menit pada suhu 4 ºC. Supernatan dibuang dan endapannya dilarutkan dalam PBS.
Ekstraksi IgY menggunakan teknik WSF dilakukan dengan cara memisahkan kuning telur dari bagian putihnya, kemudian diletakkan di atas kertas saring untuk menghilangkan putih telur yang melekat. Membran kuning telur dilubangi dengan cara diangkat dengan pinset, cairan kuning telur ditampung pada gelas beker dan dilarutkan secara perlahan dalam milli-Q pH 4 dengan perbandingan 1: 4. Setelah homogen ditambahkan lagi milli-Q pH 2 hingga pH suspensi mencapai 5.0 sampai 5.2 dan di simpan pada suhu 4 oC minimal 12 jam. Suspensi disentrifugasi dengan kecepatan 3125 g pada suhu 4 oC selama 20 menit dan supernatannya dikoleksi yang disebut dengan WSF.
Pemurnian IgY dari hasil ekstraksi menggunakan pengendapan NaCl dan teknik WSF, dimurnikan lebih lanjut menggunakan PEG 6000 dan amonium sulfat 40% seperti yang dilakukan oleh Polson et al. (1980). Hasil ekstraksi IgY yang berupa pelet dilarutkan dalam PBS sampai volume 1 ml kemudian diendapkan dengan PEG 6000 3,5% dan dilanjutkan dengan pengendapan dengan PEG 6000 12%. Kemudian di dialisis dalam dalam PBS pH 8 selama 24 jam dengan perbandingan 1:150.
Pengukuran Konsentrasi Total IgY yang Telah Dimurnikan
9 dan Y adalah konsentrasi data lalu diperoleh persamaan linier Y=a+bx, nilai a dan b dihitung dari konsentrasi protein masing-masing sampel.
Karakterisasi IgY Spesifik Rabies
Karakterisasi IgY dilakukan dengan menghitung berat molekul (BM) yang dianalisis dengan teknik Sodium Deodecyl Sulphate-Poly Acrilamide (SDS-PAGE) (Gordon, 1975). Gel yang digunakan terdiri atas dua bagian, yaitu gel pengumpul (stacking gel) dan gel pemisah (running gel) (Laemmli 1970). Larutan gel pemisah 12% dimasukkan ke dalam 2 lempeng kaca elektroforesis, yang sebelumnya telah dibersihkan dengan alkohol 70% dan pada kedua sisi tepi bagian dalam diberi spacer kemudian lempeng kaca dihimpitkan dan selanjutnya dijepit. Gel pemisah segera dilapisi dengan penambahan air. Setelah gel pemisah membeku, lapisan air dibuang dan gel pengumpul 4% dimasukkan hingga mencapai permukaan lempeng kaca dan terbentuk gel elektroforesis. Sisir kemudian segera dimasukkan dan diangkat setelah gel pengumpul membeku sehingga tercetak sumur-sumur.
Preparasi sampel menggunakan buffer sample yaitu dengan mencampur 5 µl buffer sample dengan 5 µl sampel IgY spesifik rabies hasil pemurnian kemudian dipanaskanpada suhu 60 °C selama 5 menit sebelum dimasukkan ke dalam sumur gel elektroforesis. Sebanyak 10 µl sampel dimasukkan ke dalam masing-masing sumur gel elektroforesis, kemudian perangkat elektroforesis dijalankan dengan arus 50 mA dengan voltase 100 V selama 3 jam. Elektroforesis berakhir apabila pewarna sampel mencapai batas 0.5 cm dari bagian bawah gel. Setelah elektroforesis beakhir kemudian gel diangkat dari lempeng kaca direndam di dalam pewarnaan Commasie Blue (Sigma® Chemical Co) selama 30 menit pada suhu ruang sambil diagitasi perlahan. Pewarna yang tidak terikat pada protein dihilangkan dengan merendam gel pada larutan pemucat (campuran metanol dan asam asetat glasial) sehingga gel tampak bening atau pita-pita protein yang terbentuk terlihat jelas.
Pengukuran Titer IgY Spesifik Rabies Menggunakan ELISA
10
pembacaan optical density pada panjang gelombang 450 nm sampai 620 nm (Biorad 2009). Penghitungan titer hasil pembacaan absorbansi masing-masing sampel dengan menggunakan rumus yang sudah disediakan dalam KIT interpretasi hasil dari titer ditentukan berdasarkan manual kit Platelia II(Biorad 2009, OIE 2007)
Analisis Data
Data hasil penelitian dianalisa secara deskriptif (Montgomery 2001) serta menggunakan metode One Way Analyzed of Variance (ANOVA).
4 HASIL DAN PEMBAHASAN
Produksi dan Deteksi IgY Spesifik Rabies dalam Kuning Telur
Antigen rabies inaktif dengan konsentrasi 1.33 mg/ml yang digunakan dalam penelitian ini merupakan antigen yang baik karena terbukti dapat menggertak sistem imunitas ayam petelur untuk menghasilkan antibodi spesifik terhadap virus rabies dalam kuning telur. Mekanisme transfer IgY dari serum ke dalam kuning telur sama seperti proses kelangsungan transfer antibodi lintas plasenta pada mamalia. IgY diproduksi oleh limfosit B yang mengalami pematangan dalam bursa Fabricius ayam. IgY akan mengalir ke dalam pembuluh darah dan beredar ke seluruh bagian tubuh termasuk ke dalam ovarium. Imunoglobulin yolk didepositkan melalui jaringan arteri kecil ovarium˗oosit ke dalam kuning telur sebagai bahan perlindungan bagi embrio ayam untuk berkembang (Carlander 2002).
Penelitian Paryati (2006) menggunakan IgY yang merupakan antibodi
anti˗idiotipe (Ab2) terhadap rabies sebagai antigen dengan konsentrasi 0.940
mg/ml dapat memicu terbentuknya antibodi pada hewan coba. Liddell dan Weeks (1995) menyatakan, bahwa pembentukan antibodi dengan afinitas tinggi dapat diinduksi melalui imunisasi dengan dosis antigen relatif rendah. Pada penelitian ini digunakan dosis 0.665 mg/ml/ekor ayam membuktikan bahwa dengan dosis antigen tersebut dapat memicu pembentukan antibodi hewan yang divaksin. Pembentukan sistem imun pada hewan tergantung pada kondisi dan spesies hewan yang diimunisasi, pada hewan tertentu dosis imunogen umumnya berkisar antara
10˗100 μg. Namun, untuk sebagian besar antigen protein, karbohidrat dan asam
nukleat dianjurkan memakai dosis antara 50˗1000 μg (Leenaars et a,1994).
11 larutan akan mempengaruhi kekuatan warna yang terbentuk. Kekuatan warna menunjukkan jumlah ikatan antigen dan antibodi primer (Indardi 2005).
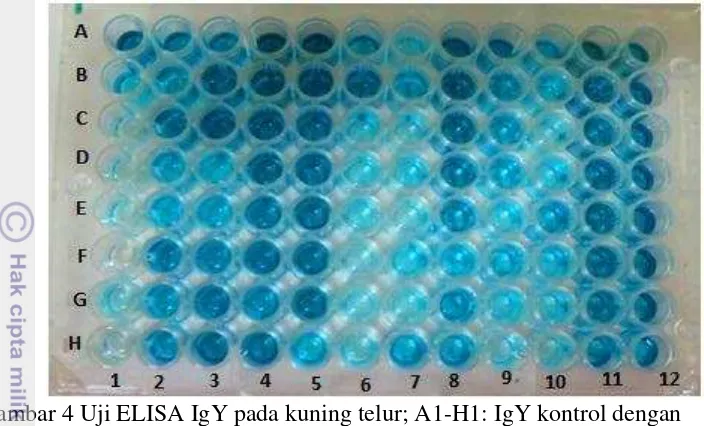
Gambar 4 Uji ELISA IgY pada kuning telur; A1-H1: IgY kontrol dengan konsentrasi bertingkat (0 s/d 10 µg/ml); A2-12 s/d H2-12 : sampel kuning telur dari ayam yang divaksinasi antigen rabies
Berdasarkan nilai absorbansi IgY kontrol dengan konsentrasi bertingkat, ditentukanlah nilai cut off sebesar 0.779, sehingga apabila kuning telur memiliki nilai absorbansi di atas nilai cut off, maka kuning telur tersebut positif mengandung antibodi terhadap virus rabies. Kuning telur positif mengandung IgY spesifik rabies sejak minggu kedua setelah vaksinasi pertama hingga minggu ke 6 setelah vaksinasi kedua (Tabel 1 ).
Tabel 1 Deteksi dan pengukuran konsentrasi IgY dalam kuning telur Minggu
(+)positif IgY spesifik rabies pada kuning telur jika rata-rata nilai absorbansi ≥ cut off (0.779); (-) negatif IgY spesifik rabiesjika rata-rata nilai absorbansi ≤ cut off (0.779)
a, b
12
Konsentrasi IgY dalam kuning telur sebelum vaksinasi adalah 0.377±0.010mg/ml. Namun konsentrasi IgY menunjukkan peningkatan yang signifikan pada minggu ke 2 setelah vaksinasi pertama 2.965±0.409 mg/ml (Tabel 1).Berdasarkan hasil pengukuran konsentrasi IgY kuning telur setiap minggunya menunjukkan bahwa konsentrasi IgY mengalami penurunan dari minggu ketiga2.840± 0.784 mg/ml hingga minggu kesepuluh 2.198 ± 0.393 mg/ml, kecuali pada minggu ketujuh IgY mengalami kenaikan 2.782 ± 0.509 mg/ml dibandingkan minggu kelima dan keenam (2.612 ± 0.562 mg/ml dan 2.304 ± 0.227 mg/ml). Penurunan IgY setelah vaksinasi ulang mulai terlihat pada minggu ke 8 (2.591 ± 0.601mg/ml) hingga minggu ke 10 (2.198 ± 0.393 mg/ml), dimana penurunan ini merupakan cermin dari hilangnya populasi sel plasma penghasil antibodi spesifik. Sekali berdiferensiasi penuh, sel plasma mati setelah tiga sampai enam hari dan imunoglobulin yang dihasilkan ini menurun perlahan-lahan karena terjadi proses katabolisme (Tizard 2004).
Konsentrasi dan Karakterisasi IgY Spesifik Rabies Hasil Pemurnian
Pemurnian dengan pengendapan NaCl menghasilkan konsentrasi protein total IgY 331 µg/ml, sedangkan pemurnian dengan teknik WSF menghasilkan konsentrasi 184 µg/ml. Berdasarkan hasil penelitian ini menunjukkan bahwa pemurnian dengan NaCl menghasilkan konsentrasi IgY yang lebih tinggi daripada pemurnian dengan teknik WSF. Perbedaan konsentrasi IgY hasil pemurnian dipengaruhi oleh metode pemurnian yang digunakan, menurut Shimizu et al. (1988) dan Sunwoo et al. (1996), perbedaan cara pemurnian IgY akan menghasilkan perbedaan konsentrasi, kemurnian, stabilitas dan aktivitas IgY. Konsentrasi IgY dari pemurnian kuning telur sangat dipengaruhi oleh tingkat kelarutan kuning telur pada saat pemisahan lemak telur dan pH larutan (Akita & Nakai 1992).
Prosedur kerja dari pemurnian menggunakan teknik WSF lebih rumit dan membutuhkan waktu yang relatif lebih lama dibandingkan pemurnian dengan pengendapan NaCl. Dalam pemilihan metode pemurnian sebaiknya perlu dipikirkan juga faktor biaya dan waktu yang dibutuhkan, sehingga metode yang kita gunakan lebih efisien.
13
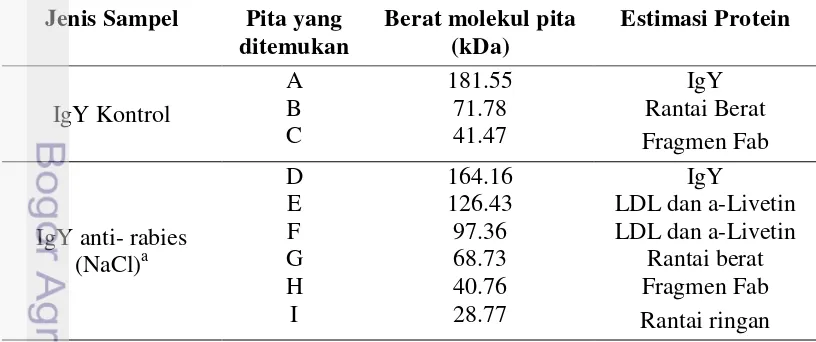
Kuning telur yang telah dimurnikan diukur berat molekulnya menggunakan teknik SDS-PAGE. Hasil elektroforesis tersaji pada Gambar 5 dan Tabel 2. Hasil pemurnian IgY menggunakan metode pengendapan NaCl menghasilkan 6 pita protein pada berat molekul 164.16 kDa, 126.43 kDa, 97.36 kDa, 68.73 kDa, 40.76 kDa, 28.77 kDa sedangkan pemurnian IgY menggunakan teknik WSF menghasilkan 3 pita protein pada berat molekul 94. 03 kDa, 65.61 kDa, dan 31.94 kDa.
IgY kontrol adalah IgY standar (PROMEGA®). Susunan protein pada IgY kontrol terdiri atas 3 pita protein yaitu 181.55 kDa, 71.78 kDa dan 41.47 kDa. Protein dengan berat molekul 181.55 kDa pada IgY kontrol dan 164,16 kDa pada IgY spesifik rabies (kolom A) diduga merupakan IgY utuh. Sun et al. (2001) menyatakan bahwa berat molekul IgY sebesar 167.25 kDa dan Narat (2003) menyatakan bahwa IgY mempunyai berat molekul yang lebih besar dibandingkan IgG (160 kDa), yaitu sekitar 180 kDa atau lebih. Pita protein dengan berat molekul 68.73 kDa (pita G) untuk NaCl dan 65.61 kDa (pita K) untuk WSF diduga sebagai rantai berat IgY, sedangkan pita protein dengan berat molekul 28.77 kDa (Pita I) pada kolom B merupakan rantai ringan IgY. Beberapa peneliti melaporkan bahwa ukuran berat molekul dari rantai berat IgY adalah 65-70 kDa, sedangkan untuk rantai ringan 20-30 kDa (Yokohama et al. 1993; Hatta et a1. 1993; Bhanushali et al. 1994; Schade et al. 1996).
14
Gambar 5 Profil pita protein (dalam kDa) IgY spesifik rabies yang telah dipurifikasi. Keterangan; (1) IgY kontrol, (2) IgY spesifik rabies yang dipurifikasi dengan metode NaCl, (3) IgY spesifik rabies yang dipurifikasi dengan metode WSF, dan (4) Marker protein
Titrasi IgY Spesifik Rabies
Uji ELISA terhadap IgY hasil pemurnian pengendapan NaCl dan WSF menunjukkan bahwa titer IgY spesifik rabies yang dimurnikan dengan pengendapan NaCl adalah lebih besar dari 0.5 EU/ml, sedangkan dengan teknik WSF lebih rendah dari ≤ 0.5 EU/ml. Berdasarkan acuan dari WHO (1992), titer antibodi rabies dikatakan protektif apabila nilainya ≥ 0.5 EU/ml dengan uji ELISA. Hal ini berarti bahwa hewan atau orang yang divaksinasi rabies paling tidak harus mempunyai antibodi terhadap rabies sebesar 0.5 EU/ml untuk dapat terlindung dari penyakit rabies (OIE 2007). Titer IgY spesifik rabies yang dihasilkan pada penelitian ini di tunjukkan pada Tabel 3. Hasil penelitian ini menunjukkan bahwa bahwa ayam mampu merespon virus rabies dan dapat memproduksi IgY spesifik rabies yang titernya cukup tinggi. Perbedaan titer antibodi dari IgY yang diuji diduga akibat adanya perbedaan teknik pemurnian, seperti yang disampaikan Shimizu et al. (1988) dan Sunwoo et al. (1996).
Tabel 3 Titer IgY spesifik rabies
Metode pemurnian Titer IgY spesifik rabies (EU)
15 SIMPULAN DAN SARAN
Simpulan
Hasil penelitian ini menunjukkan bahwa IgY spesifik rabies dapat diproduksi pada ayam petelur, dan memiliki titer yang protektif. IgY spesfik rabies hasil pemurnian dengan pengendapan NaCl menghasilkan konsentrasi (331
µg/ml) dan titer (≥ 0.5 EU/ml) yang lebih tinggi dibandingkan IgY hasil
pemurnian dengan WSF (konsentrasi 184 µg/ml; titer ≤ 0.5 EU/ml). Pemurnian IgY dengan pengendapan NaCl membutuhkan waktu yang relatif lebih singkat dibandingan pemurnian dengan WSF.
Saran
16
DAFTAR PUSTAKA
Adjid RMA, Sarosa A, Syapriati T, dan Yuningsih. 2005. Penyakit rabies di Indonesia dan pengembangan teknik diagnosisnya. Wartazoa. 15(4): 165- 172. Akita EM, Nakai S. 1992. Comparision of Four Purification Methods for The
Production of Imunoglobulin from Eggs Laid by Hens Immunized with Enterotoxigenic E.coli Strain. J Immunol Method. 160:207-214.
Alves LM, Soares RM,Cortez A, Richtzenhain LJ, dan Ito FN. 2003. Pathogenesis of rabies virus by ERA and PV strains administered orally in hamsters (M. auratus).Braz J Ve Res Anim Sci. 40(1): 811-816
Awad WS, Ibrahim AK, Salib FA. 2009. Using Indirect ELISA to Assess Different Antigens for The Serodiagnosis of Fasciola gigantica Infection in Cattle,Sheep, and Donkeys. Res Vet Sci 86:466-471.
Baer GM. 1991. The Natural History of Rabies. [Internet]. [diunduh 2016 Mei 31]. Terdapat pada:
http://www.cdc.gov/ncidod/dvrd/rabies/Epidemiology/racoon_map_I.htm. Bhanushali JK, Gilbert JM, Mc Dougald LR. 1994. Simple Method to Purify
Chicken Immunoglobulin G. Poultry Sci. 73:1158-1161.
[Biorad]. 2009. User's manual Platelia Rabies II Kit. [Internet]. [diunduh 2016Maret 13].
Terdapatpada:http://web.oie.int/VCDA/eng/Registre/User's%20manual_Platel iaRabiesII.pdf
Bogoyavlensky AP, Bersin VE, Tolmachva VP. 1999. Immunogenicity of
influenza glycoprotein with different forms of supermolecular organization in hens. J Lab Anim Sci. 4: 99-105
Burgess GW. 1995. Teknologi ELISA dalam Diagnosis dan Penelitian. Artama WT, penerjemah. Yogyakarta (ID): Gadjah Mada University Press.
Campbell JB, Reece LG dan Mitchell. 2004. Biologi. Ed ke-5. Jilid 3. Jakarta (ID). Penertbit Erlangga.
Carlander D. 2002. Avian Immunoglobulin Y Antibody in Vitro and in Vivo. [disertations]. Swedia (SE): Faculty of Medicine Uppsala University.
Gassmann M, Thommes P, Weiser T, Hubscher U. 1990. Efficient production of chicken egg yolk antibodies againts a conserved mammalian protein. FASEB J. 4: 2528-2532.
Gordon AH. 1975. Laboratory Techniques in Biochemistry and Molecular Biology Vol.1 Ed-2. Electrophoresis of Protein in Polyacrilamide and Starch Gels. Amsterdams (NL): North Holland Press Publishers.
Haak-Frendscho M. 1994. Why IgY? Chicken Polyclonal Antibody, an Appealing Alternative. Promega Notes Magazine.(46): 11.
Hassl AH, Aspock H, Flamm. 1987. Comparative stuideis on the purity and specifity of yolk immunoglobulin Y isolated from eggs laid by hens immunized with Toxoplasma gondii. Zentralbl Bakteriol Mikrobiol Hyg. 2: 247-253.
17 Hodek P, Pavel T, Jiri S, Jiri H, Marie S. 2013. Optimized Protocol of Chicken Antibody (IgY) Purification Providing Electrophoretically Homogenous Preparations. Int J Electrochem Sci. 8:113 – 124.
Indardi. 2005. Efek Sistemik Pemberian Imunoglobulin Y (IgY) anti Enteropathogenic Escherichia coli (EPEC) peroral pada mencit. [Skripsi] Bogor (ID): Institut Pertanian Bogor.
Jackson A. 2007. Pathogenesis dalam Rabies. Ed ke-2. Edited by Alan C. Jackson and William H. Wunner. Elsevier Inc.
Jensenius JC, Andersen I, Hau J, Crone M, Koch C. 1981. Eggs: Conveniently Packaged Antibodies Methods for Purification of Yolk IgG. J Immunol Methods.46(1): 63–68.
Kermani-Arab, Moll VT, Cho BR, Davis WC, Lu YS. 2001. Effects of IgY
antibodiy on the development of marek’s disease. J Avian Dis. 20: 32-41.
Laemmli UK. 1970. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. The Nature. 227: 680 – 685.
Larsson A, Wejaker PE, Forsberg PO, Lindahl T. 1993. Chicken antibodies taking advantage of evolution : A review. Poultry sci.
Leenaars PPAM, Claassen E, Boersma WJA. 1997. Antigen and Antigen Presentation. In: Immunology Methods Manual, I. Lefkovits (Ed.). London (GB). Akademic Press Ltd.
Lewis P, Fu Y, and Lentz TL. 2000. Rabies Virus Entry At The Neuromuscular Junction In Nerve–Muscle Cocultures. Mucle and Nerve. John Wiley & Sons, Inc.
Liddell E, Weeks I. 1995. Antibody Technology. Oxford (UK). Bios Scientific Publisher Ltd.
Makoto SCF, Robert N, Shuryo. 1998. Anti-E.coli immunoglobulin Y isolated from egg yolk of immunized chickens as a potential food ingredient. J Food Sci. 53: 1361-1365.
Meslin FX, Kaplan MM. 1996. An Overview of Laboratory Techniques in The Diagnosis and Prevention of Rabies and in Rabies Research . Chapter 2 in Laboratory Techniques in Rabies Ed-4. Geneva (CH): WHO Pr.
Narat M. 2003. Production of antibodies in chickens. Food Technol Biotechnol.41(3):259-267.
[OIE] Office International des Epizootis. 2007. Kit for In Vitro Detection and Titration of IgG anti Rabies Virus Glycoprotein in Dogs, Cats and Foxes Serum. User’s manual. Biorad.
Paryati, SPY. 2006. Antibodi Anti-Idiotipe Sebagai Kandidat Vaksin Rabies. [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Polson A, Von Wechmar MB, Van Regen-mortel MHV. 1980. Isolation of viral IgY anti-bodies from yolks of immunized hens. Immunol Commun.9(5): 475– 493.
Priadi. 2002. Prinsip Dasar Reaksi Imunologi Dalam Uji Serologi. Pelatihan Internal Teknisi Bakteriologi. Balai Penelitian Veteriner: Bogor.
18
Scott RW. 1997. Financial Accounting Theory. New Jersey (US). Prentice Hall International Inc.
Shimizu M, Fotzsimmons RC, Nakai S. 1988. Anti-E.coli Immunoglobulin Y Isolated From Egg Yolk of Immunized Chicken as Potential Food Ingredient. J Food Sci. 53: 1360
Siles-Lucas, Cuesta-Bandera C. 1996. Echinococcus granulosus in Spain: Strain Differentiation by SDS-PAGE of Somatic and Excretory/Secretory Proteins. J Helminthol. 70(3): 253-257.
Sun S, Mo W, Ji Y, Liu S. 2001. Preparation and Mass Spectrometric Study of Egg Yolk Antibody (IgY) Againts Rabies Virus. Rapid Commun. Mass Spedtrom. 15:708-712.
Sunwoo HH, Nakano T, Dixon WT, Sim JS. 1996. Immune Responses in Chickens Against Lipopolysccharide of Escherichiacoli and Salmonella typhimurium. Poultry Sci. 75:342-345.
Suwarno. 2003. Prinsip Dasar, Optimalisasi, dan Interpretasi Hasil Uji ELISA.Surabaya (ID): Lab Virology dan Immunologi FKH Unair
Tizard.2004. Pengantar Imunologi Veteriner. Edisi II. Partodiredjo M, penerjemah. Surabaya (ID): Airlangga University Pr.
[WHO] World Health Organization. 1992. WHO Expert Consultation on Rabies. Geneva (CH):WHO Pr.
[WHO]World Health Organization. 2002. Rabies vaccines. In : Immunization, Vaccines and Biologicals.Weekly Epidemiological Record.77:109-120.
Wunner WH. 2007. Rabies Virusin Rabies. Ed Ke-2. Edited by Alan C. Jackson and William H. Wunner. Elsevier Inc
Yokohama H, Peralta RC, Horikoshi T, Hiraoka J, Ikemori Y, Kuroki M, Kodama Y. 1993. A Two-step Procedure for Purification of Hen Egg Yolk Immunoglobulin G : Utilization of Hydroxypropylmethylcellulose Phthalate and Synthetic Affinity Ligand Gel (Avil ALB). Poultry Sci. 72: 275-281. Yokohama H, Peralta RC, Umeda K, Hashi T, Icalto FC, Kuroki M. 1998.
19
RIWAYAT HIDUP
Penulis dilahirkan di Kendari, Sulawesi Tenggara pada tanggal 7 Maret 1987 sebagai anak kedua dari empat bersaudara dari ayah Drs. La Ode Ruhi dan seorang ibu Asmawati.
Penulis menamatkan Sekolah Menengah Atas Negeri (SMAN) 1 Kendari tahun 2005 dan ditahun yang sama diterima di Fakultas Matematika dan Ilmu Pengetahuan Alam di jurusan Biologi Universitas Halu Oleo, Sulawesi Tenggara dan lulus pada tahun 2009. Pada tahun 2014 penulis lulus seleksi program pascasarjana Institut Pertanian Bogor (IPB) di Program Studi Mikrobiologi Medik.