SKRINING FITOKIMIA DAN KARAKTERISASI
SIMPLISIA SERTA UJI EFEK ANTIDIARE EKSTRAK
ETANOL MAJAKANI (Quercus infectoria G. Olivier)
TERHADAP TIKUS
SKRIPSI
OLEH:
EKO RAMADHANI
NIM 101524066
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
SKRINING FITOKIMIA DAN KARAKTERISASI
SIMPLISIA SERTA UJI EFEK ANTIDIARE EKSTRAK
ETANOL MAJAKANI (Quercus infectoria G. Olivier)
TERHADAP TIKUS
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
EKO RAMADHANI
NIM 101524066
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2013
SKRINING FITOKIMIA DAN KARAKTERISASI
SIMPLISIA SERTA UJI EFEK ANTIDIARE EKSTRAK
ETANOL MAJAKANI (Quercus infectoria G. Olivier)
TERHADAP TIKUS
OLEH:
EKO RAMADHANI
NIM 101524066
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 2 Pebruari 2013
Pembimbing I, Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. Dr. M. Pandapotan Nasution, M.P.S., Apt.
NIP 195709091985112001 NIP 194908111976031001
Pembimbing II, Dr. Marline Nainggolan, M.S., Apt.
NIP 195709091985112001
Dr. Edy Suwarso, S.U., Apt. Drs. Rasmadin Mukhtar, M.S., Apt.
NIP 130935857 NIP 194909101980031002
Dra. Herawaty Ginting, M.Si., Apt. NIP 195112231980032002
Medan, April 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Segala puji dan syukur penulis ucapkan kehadirat Allah SWT atas segala
nikmat dan rahmat-Nya yang tak terhingga sehingga penulis dapat melaksanakan
penelitian dan menyelesaikan skripsi yang berjudul ”Skrining Fitokimia dan
Karakterisasi Simplisia serta Uji Efek Antidiare Ekstrak Etanol Majakani
Terhadap Tikus”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh
gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih yang tulus dan
ikhlas kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga penulis
dapat menyelesaikan pendidikan. Ibu Dr. Marline Nainggolan, M.S., Apt., dan
Bapak Dr. Edy Suwarso, S.U., Apt., selaku pembimbing yang telah memberikan
waktu, bimbingan, dan nasehat selama penelitian hingga selesainya penyusunan
skripsi ini serta kepada Ibu Yuandani, S.Farm., Apt., selaku penasehat akademis
yang telah memberikan bimbingan kepada penulis. Bapak Dr. M. Pandapotan
Nasution, M.P.S., Apt., Bapak Drs. Rasmadin Mukhtar, M.S., Apt., dan Ibu Dra.
Herawaty Ginting, M.Si., Apt., selaku dosen penguji yang telah memberikan saran
dan arahan kepada penulis dalam menyelesaikan skripsi ini. Kepada Bapak dan
Ibu staf pengajar Fakultas Farmasi USU yang telah mendidik selama perkuliahan
serta Ibu kepala Laboratorium Fitokimia dan Farmakologi yang telah memberikan
bantuan dan fasilitas selama penulis melakukan penelitian.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda dan Ibunda tercinta, Alm Drs. Mahdali dan Walseria
ikhlas bagi kesuksesan penulis, juga kepada adik-adik dan teman-temanku yang
selalu setia memberi doa, dukungan dan motivasi selama melakukan penelitian.
Penulis menyadari skripsi ini masih belum sempurna, oleh karena itu
diharapkan kritik dan saran yang membangun untuk penyempurnaannya. Harapan
saya semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan kefarmasian.
Medan, April 2013
Penulis
SKRINING FITOKIMIA DAN KARAKTERISASI SIMPLISIA SERTA UJI EFEK ANTIDIARE EKSTRAK ETANOL MAJAKANI
(Quercus infectoria G. Olivier) TERHADAP TIKUS
ABSTRAK
Majakani atau disebut gal majakani (Quercus infectoria G. Olivier) adalah hasil pertumbuhan abnormal (pembesaran menjadi seperti bongkol) pada ranting muda tumbuhan. Majakani (Quercus infectoria G. Olivier) digunakan sebagai bahan adstringen alami. Tujuan penelitian untuk mengetahui kandungan senyawa kimia, karakteristik serbuk simplisia dan efek antidiare dari ekstrak etanol majakani (Quercus infectoria G. Olivier) pada tikus yang sebelumnya diinduksi oleh oleum ricini.
Terhadap serbuk simplisia majakani (Quercus infectoria G. Olivier) dilakukan karakterisasi dan skrining fitokimia serta uji efek antidiare ekstrak etanol majakani terhadap tikus. Pengujian efek antidiare pada tikus dilakukan dengan cara memberikan oleum ricini sebagai penginduksi diare. Ekstrak etanol majakani diberikan secara oral dengan dosis 75, 100, 125 dan 150 mg/kg bb dengan pembanding loperamid HCl dosis 0,9 mg/kg bb kemudian dilakukan pengamatan terhadap saat mulai terjadinya diare, frekuensi defekasi, konsistensi feses, bobot feses selang 30 menit sampai 4 jam dan selang 1 jam sampai 6 jam.
Hasil karakterisasi serbuk simplisia majakani adalah kadar air 7,97%, kadar sari yang larut air 56,46%, kadar sari larut etanol 60,59%, kadar abu total 1,60% dan kadar abu tidak larut asam 0%. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol majakani mengandung senyawa alkaloid, glikosida, flavanoid, dan tanin. Hasil analisis statistik varian (ANAVA) dengan p < 0,05 menunjukkan adanya perbedaan yang signifikan antar perlakuan dan dilanjutkan dengan uji Duncan untuk mengetahui perbedaan yang bermakna antar perlakuan dengan beberapa parameter pengamatan, hasilnya menunjukkan dosis yang sudah dapat memberikan efek pada setiap parameter adalah waktu saat mulai terjadinya diare, memberikan efek pada dosis 125 mg/kg bb, frekuensi defekasi memberikan efek pada dosis 75 mg/kg bb, konsistensi feses memberikan efek pada dosis 100 mg/kg bb dan bobot total feses memberikan efek pada dosis 100 mg/kg bb, ini menunjukkan bahwa dari keempat parameter tersebut diperoleh dosis rata-rata yang sudah mampu menunjukkan efek sebagai antidiare yaitu dosis 100 mg/kg BB.
PHYTOCEMICAL SCREENING AND SIMPLEX CHARACTERIZATION WITH ANTI DIARRHEAL ACTIVITY TEST OF THE ETHANOLIC
EXTRACT OF MAJAKANI (Quercus infectoria G.Olivier) TO RATS
ABSTRACT
Majakani or also called gall of majakani (Quercus infectoria G. Olivier) is the result of abnormal growth of young twigs of plants. Majakani (Quercus infectoria G. Olivier) is naturally used as astringents. The purpose of this research was to determine the chemical compounds content, the characteristic of simplex powder and the anti-diarrheal effect of the ethanolic extract of majakani (Quercus infectoria G. Olivier) to laboratory rats that were induced with castor oil beforehand.
To the majakani (Quercus infectoria G. Olivier) simplex powder characterization and phytochemical screening has been done and testing antidiarrheal effects ethanol extract of majakani on rats. The anti-diarrheal activity test was done by firstly giving the rats castor oil as diarrhea inducer. The majakani ethanolic extract was given orally with doses of 75, 100, 125, and 150 mg/kg bw respectively with 0,9 mg/kg bw loperamid HCl as control then observed included the starting point of diarrhea, frequency of defecation, faeces consistency and faeces weight, for 30 minutes to 4 hours initially, and 1 to 6 hours.
The result of characterization of majakani simplex powder are water content 7.97%, water-soluble extract content 56.46%, ethanol-soluble extract content 60.59%, total ash content 1.60%, and acid-insoluble ash content 0%. The result of phytochemical screening of majakani simplex powder and ethanolic contains alkaloids, glycosides, flavanoids, and tannins. The result of statistical analysis of variance (ANAVA) whit p< 0,05 showed there is a significant difference between each treatment continued with Duncan test to determine the significant difference between treatments with several observation parameters, the doses that was able to show effects at every parameters were found which were, the starting point of diarrhea showed effect at 125 mg/kg bw, frequency of defecation at 75 mg/kg bw, faeces consistency at 100 mg/kg bb and total faeces weight at 100 mg/kg bw, thus it can be concluded that from all four parameters the average dosage was found which was 100 mg/kg bw that is able to begin showing anti-diarrheal effect .
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan penelitian ... 3
1.5 Manfaat penelitian ... 3
1.6 Kerangka pikir penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Karakteristik makroskopik ... 5
2.1.2 Karakteristik mikroskopik ... 6
2.1.4 Kegunaan ... 6
2.2 Simplisia dan Ekstrak ... 7
2.2.1 Simplisia ... 7
2.2.2 Ekstrak ... 7
2.3 Uraian Diare ... 9
2.3.1 Klasifikasi diare ... 10
2.3.2 Pengobatan diare ... 10
2.3.3 Obat-obat diare ... 11
2.4 Loperamid Hidrokloridum ... 12
2.5 Minyak Jarak ... 12
BAB III METODE PENELITIAN ... 13
3.1 Alat dan Bahan ... 13
3.1.1 Alat-alat ... 13
3.1.2 Bahan-bahan ... 13
3.2 Pengumpulan dan Pengolahan Sampel ... 14
3.2.1 Pengumpulan Sampel ... 14
3.2.2 Identifikasi Sampel ... 14
3.2.3 Pengolahan Sampel ... 14
3.3 Pembuatan Pereaksi ... 14
3.3.1 Besi (III) klorida 1% b/v ... 14
3.3.2 Larutan asam klorida (HCl) 2 N ... 15
3.3.3 Timbal (II) asetat 0,4 M ... 15
3.3.4 Pereaksi Mayer ... 15
3.3.5 Pereaksi Molish ... 15
3.3.7 Pereaksi Kloralhidrat ... 15
3.3.8 Larutan pereaksi asam sulfat 2 N ... 16
3.3.9 Pereaksi Bouchardat ... 16
3.3.10 Pereaksi Liebermann-Burchard ... 16
3.4 Pemeriksaan Karakterisasi Simplisia ... 16
3.4.1 Makroskopik ... 16
3.4.2 Mikroskopik ... 16
3.4.3 Penetapan kadar air ... 17
3.4.4 Penetapan kadar abu total ... 17
3.4.5 Penetapan kadar abu tidak larut asam ... 18
3.4.6 Penetapan kadar sari larut etanol ... 18
3.4.7 Penetapan kadar sari larut air ... 18
3.5 Skrining Fitokimia ... 19
3.5.1 Pemeriksaan alkaloida ... 19
3.5.2 Pemeriksaan flavonoida ... 20
3.5.3 Pemeriksaan glikosida ... 20
3.5.4 Pemeriksaan antrakinon ... 20
3.5.5 Pemeriksaan saponin ... 21
3.5.6 Pemeriksaan tanin ... 21
3.5.7 Pemeriksaan steroida/ triterpenoida ... 21
3.6 Pembuatan Ekstrak Etanol Majakani (EEM) ... 21
3.7 Percobaan Efek Antidiare ... 22
3.7.1 Penyiapan hewan percobaan ... 22
3.7.2 Penyiapan bahan ... 22
3.7.2.2 Pembuatan suspensi Loperamid HCl
dari Tablet Imodium® ... 23
3.7.2.3 Pembuatan suspensi ekstrak etanol majakani ... 23
3.7.3 Prosedur percobaan ... 23
3.8 Analisis data ... 24
BAB IV HASIL DAN PEMBAHASAN ... 25
4.1 Hasil pemeriksaan tumbuhan ... 25
4.1.1 Hasil identifikasi tumbuhan ... 25
4.1.2 Hasil karakterisasi simplisia... 25
4.1.3 Hasil skrining fitokimia ... 26
4.2 Hasil pengujian andidiare ... 27
4.2.1 Penentuan saat mulai terjadinya diare ... 28
4.2.2 Penentuan frekuensi defekasi ... 30
4.2.3 Penentuan konsistensi feses ... 32
4.2.3 Bobot total feses ... 34
BAB V KESIMPULAN DAN SARAN ... 37
5.1 Kesimpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Tabel Halaman
4.1 Hasil karakterisasi serbuk simplisia majakani ... 25
4.2 Hasil skrining fitokimia serbuk simplisia majakani dan ekstrak etanol majakani ... 27
4.3 Hasil pengamatan saat mulai terjadinya diare ... 28
4.4 Hasil pengamatan frekuensi defekasi ... 30
4.5 Hasil pengamatan konsistensi feses normal ... 32
DAFTAR GAMBAR
Gambar Halaman
1.1 Kerangka pikir penelitian ... 4
4.1 Grafik hasil pengamatan saat mulai terjadinya diare ... 29
4.2 Grafik hasil pengamatan frekuensi defekasi ... 30
4.3 Grafik hasil pengamatan konsistensi feses normal ... 32
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tumbuhan ... 41
2 Gambar pohon majakani (Quercus infectoria G.Olivier) ... 42
3 Gambar simplisia dan serbuk simplisia majakani ... 43
4 Gambar mikroskopik serbuk simplisia majakani dalam akuades ... 44
5 Gambar mikroskopik serbuk simplisia majakani dalam kloralhidrat ... 45
6 Bagan kerja penelitian ... 46
7 Perhitungan penetapan kadar air serbuk simplisia majakani ... 48
8 Perhitungan penetapan kadar sari larut air serbuk simplisia majakani ... 49
9 Perhitungan penetapan kadar sari larut etanol serbuk simplisia majakani ... 50
10 Perhitungan penetapan kadar abu total serbuk simplisia majakani ... 51
11 Perhitungan penetapan kadar abu tidak larut asam serbuk simplisia majakani ... 52
12 Gambar neraca hewan,spuit dan oral sonde ... 53
13 Gambar tikus ... 54
14 Gambar feses tikus ... 55
15 Volume maksimum larutan sediaan uji yang dapat diberikan pada hewan uji ... 56
16 Konversi dosis antara jenis hewan dengan manusia ... 56
17 Perhitungan konversi dosis ... 57
19 Hasil pengujian efek antidiare ... 61
20 Hasil analisis statistik anava ... 67
SKRINING FITOKIMIA DAN KARAKTERISASI SIMPLISIA SERTA UJI EFEK ANTIDIARE EKSTRAK ETANOL MAJAKANI
(Quercus infectoria G. Olivier) TERHADAP TIKUS
ABSTRAK
Majakani atau disebut gal majakani (Quercus infectoria G. Olivier) adalah hasil pertumbuhan abnormal (pembesaran menjadi seperti bongkol) pada ranting muda tumbuhan. Majakani (Quercus infectoria G. Olivier) digunakan sebagai bahan adstringen alami. Tujuan penelitian untuk mengetahui kandungan senyawa kimia, karakteristik serbuk simplisia dan efek antidiare dari ekstrak etanol majakani (Quercus infectoria G. Olivier) pada tikus yang sebelumnya diinduksi oleh oleum ricini.
Terhadap serbuk simplisia majakani (Quercus infectoria G. Olivier) dilakukan karakterisasi dan skrining fitokimia serta uji efek antidiare ekstrak etanol majakani terhadap tikus. Pengujian efek antidiare pada tikus dilakukan dengan cara memberikan oleum ricini sebagai penginduksi diare. Ekstrak etanol majakani diberikan secara oral dengan dosis 75, 100, 125 dan 150 mg/kg bb dengan pembanding loperamid HCl dosis 0,9 mg/kg bb kemudian dilakukan pengamatan terhadap saat mulai terjadinya diare, frekuensi defekasi, konsistensi feses, bobot feses selang 30 menit sampai 4 jam dan selang 1 jam sampai 6 jam.
Hasil karakterisasi serbuk simplisia majakani adalah kadar air 7,97%, kadar sari yang larut air 56,46%, kadar sari larut etanol 60,59%, kadar abu total 1,60% dan kadar abu tidak larut asam 0%. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol majakani mengandung senyawa alkaloid, glikosida, flavanoid, dan tanin. Hasil analisis statistik varian (ANAVA) dengan p < 0,05 menunjukkan adanya perbedaan yang signifikan antar perlakuan dan dilanjutkan dengan uji Duncan untuk mengetahui perbedaan yang bermakna antar perlakuan dengan beberapa parameter pengamatan, hasilnya menunjukkan dosis yang sudah dapat memberikan efek pada setiap parameter adalah waktu saat mulai terjadinya diare, memberikan efek pada dosis 125 mg/kg bb, frekuensi defekasi memberikan efek pada dosis 75 mg/kg bb, konsistensi feses memberikan efek pada dosis 100 mg/kg bb dan bobot total feses memberikan efek pada dosis 100 mg/kg bb, ini menunjukkan bahwa dari keempat parameter tersebut diperoleh dosis rata-rata yang sudah mampu menunjukkan efek sebagai antidiare yaitu dosis 100 mg/kg BB.
PHYTOCEMICAL SCREENING AND SIMPLEX CHARACTERIZATION WITH ANTI DIARRHEAL ACTIVITY TEST OF THE ETHANOLIC
EXTRACT OF MAJAKANI (Quercus infectoria G.Olivier) TO RATS
ABSTRACT
Majakani or also called gall of majakani (Quercus infectoria G. Olivier) is the result of abnormal growth of young twigs of plants. Majakani (Quercus infectoria G. Olivier) is naturally used as astringents. The purpose of this research was to determine the chemical compounds content, the characteristic of simplex powder and the anti-diarrheal effect of the ethanolic extract of majakani (Quercus infectoria G. Olivier) to laboratory rats that were induced with castor oil beforehand.
To the majakani (Quercus infectoria G. Olivier) simplex powder characterization and phytochemical screening has been done and testing antidiarrheal effects ethanol extract of majakani on rats. The anti-diarrheal activity test was done by firstly giving the rats castor oil as diarrhea inducer. The majakani ethanolic extract was given orally with doses of 75, 100, 125, and 150 mg/kg bw respectively with 0,9 mg/kg bw loperamid HCl as control then observed included the starting point of diarrhea, frequency of defecation, faeces consistency and faeces weight, for 30 minutes to 4 hours initially, and 1 to 6 hours.
The result of characterization of majakani simplex powder are water content 7.97%, water-soluble extract content 56.46%, ethanol-soluble extract content 60.59%, total ash content 1.60%, and acid-insoluble ash content 0%. The result of phytochemical screening of majakani simplex powder and ethanolic contains alkaloids, glycosides, flavanoids, and tannins. The result of statistical analysis of variance (ANAVA) whit p< 0,05 showed there is a significant difference between each treatment continued with Duncan test to determine the significant difference between treatments with several observation parameters, the doses that was able to show effects at every parameters were found which were, the starting point of diarrhea showed effect at 125 mg/kg bw, frequency of defecation at 75 mg/kg bw, faeces consistency at 100 mg/kg bb and total faeces weight at 100 mg/kg bw, thus it can be concluded that from all four parameters the average dosage was found which was 100 mg/kg bw that is able to begin showing anti-diarrheal effect .
BAB I PENDAHULUAN
1.1 Latar Belakang
Bangsa Indonesia telah lama mengenal dan menggunakan tumbuhan
berkhasiat obat sebagai salah satu upaya dalam menanggulangi masalah
kesehatan. Penggunaan tumbuhan sebagai obat di Indonesia telah dilakukan oleh
nenek moyang kita sejak berabad-abad berdasarkan pengalaman atau secara turun
temurun yang diwariskan dari satu generasi ke generasi berikutnya (Sari, 2006).
Para ahli berbagai negara tidak pernah berhenti melakukan penelitian dan
pengujian berbagai tumbuhan yang secara tradisional dipakai untuk penyembuhan
penyakit tertentu. Menurut WHO, negara-negara di Afrika, Asia dan Amerika
Latin telah menggunakan obat herbal sebagai pelengkap pengobatan primer.
Faktor pendorong terjadinya peningkatan penggunaan obat herbal di negara maju
adalah usia harapan hidup yang lebih panjang pada saat prevalensi penyakit
kronik meningkat dan adanya kegagalan penggunaan obat modern (Haryanto,
2009; Sari, 2006).
Tanaman obat telah banyak digunakan sebagai obat diare secara empiris
oleh masyarakat. Karena kandungan tanin yang terdapat pada tanaman
mempunyai efek sebagai adstringen yaitu dapat mengerutkan selaput lendir usus
sehingga mengurangi pengeluaran cairan diare dan disentri, juga sebagai
antiradang dan antibakteri (Tan dan Raharja, 2002).
Majakani (Quercus infectoria G. Olivier) telah digunakan secara luas
sebagai bahan obat tradisional oleh orang Arab, Parsi, India, China dan Melayu
Quercus infectoria G. Olivier atau dikenal dengan gal majakani, merupakan obat
tradisional sebagai astringen alami yang terdiri atas komponen-komponen
antiseptik dan antioksidan (Pratt dan Herber, 1956).
Diare merupakan salah satu penyakit yang disebabkan oleh meningkatnya
peristaltik usus sehingga pelintasan kimus sangat dipercepat dan tidak cukup
waktu untuk absorpsi, hal ini dapat menyebabkan dehidrasi dan
ketidakseimbangan elektrolit (Tan dan Rahardja 2002; Adnyana, dkk., 2004).
Diare merupakan salah satu gangguan kesehatan yang umum terjadi dilingkungan
kita. Diare sering dianggap gangguan penyakit yang ringan, namun penanganan
yang tidak tepat dan atau terlambat dapat dan sering kali menimbulkan kematian.
Diare dapat disebabkan oleh berbagai jenis virus dan bakteri (Anonimc, 2012).
Cairan usus kaya akan air, natrium, kalium dan bikarbonat, diare dapat
menyebabkan kehilangan elektrolit dan dehidrasi ringan sampai berat.
Berkurangnya bikarbonat menyebabkan penderita berada dalam resiko timbulnya
asidosis metabolik. Penderita yang mengalami diare harus menjauhi makanan
yang banyak mengandung lemak (Kee dan Evelyn, 1996).
Menurut Rangari (2007), komponen kimia dalam majakani adalah
50-70% tanin terutama asam galotanin yang merupakan asam tanin. Selain itu juga
terdapat 2-4% asam galat, pati dan gula (Dayang, 2012). Kandungan tanin dapat
bersifat sebagai antibakteri dan adstringen atau menciutkan dinding usus yang
rusak (Nurdjanah dan Christina, 2005).
Berdasarkan uraian di atas maka penulis tertarik melakukan penilitian
skrining fitokimia dan karakterisasi serta uji efek antidiare ekstrak etanol
majakani terhadap tikus dengan menggunakan oleum ricini sebagai penginduksi
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka perumusan masalah pada
penelitian ini adalah:
a. Apakah simplisia majakani dapat ditentukan karakteristiknya.
b. Apakah simplisia majakani dapat ditentukan golongan senyawa kimianya.
c. Apakah ekstrak etanol majakani (EEM) mempunyai efek antidiare.
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian
ini adalah:
a. Karakteristik simplisia majakani dapat detentukan dengan melakukan
karakterisasi.
b. Golongan senyawa kimia simplisia majakani dapat ditentukan dengan
melakukan skrining fitokimia.
c. Ektrak etanol majakani (EEM) mempunyai efek antidiare.
1.4 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk mengetahui:
a. Karakteristik simplisia majakani.
b. Golongan senyawa kimia yang terkandung di dalam simplisia majakani.
c. Efek antidiare ekstrak etanol majakani (EEM).
1.5 Manfaat
Manfaat yang diperoleh dalam penelitian adalah dapat memberikan
majakani (Quercus infectoria G. Olivier) dan menambah data penelitian dalam
usaha pemanfaatan tumbuhan majakani sebagai obat antidiare pada manusia.
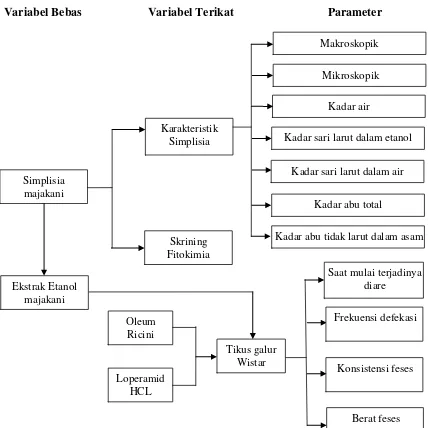
1.6 Kerangka Pikir Penelitian
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka pikir penelitian
Simplisia majakani
Karakteristik Simplisia
Kadar air
Kadar sari larut dalam etanol
Kadar sari larut dalam air
Kadar abu total
Kadar abu tidak larut dalam asam
Oleum
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Majakani dalam bahasa Inggris dikenal dengan nama Oak Gal telah
digunakan secara meluas sebagai bahan obat sejak 2.725 SM oleh orang Mesir
dan Arab, Parsi, serta China (Anonima, 2010). Majakani bukan merupakan jenis
buah-buahan tetapi merupakan pertumbuhan abnormal dari ranting tumbuhan
Quercus infectoria G. Olivier (Rangari, 2007).
Banyak yang beranggapan bahwa majakani adalah sejenis buah yang
dihasilkan oleh pohon majakani. Sebenarnya majakani adalah sejenis biji atau
benjolan yang terdapat pada kulit batang pohon akibat tusukan serangga Cynips
galae tintctoria. Akibat dari tusukan ini akan menyebabkan kulit pohon bertunas
dan mengeluarkan larva yang akan merangsang pertumbuhan biji. Majakani
dapat ditemui dihutan-hutan atau ditanam untuk tujuan pengobatan. Di India
pohon Oak digunakan untuk menghasilkan majakani yang bermutu tinggi
(Anonimb, 2010).
Gal majakani pada dasarnya berasal dari daerah Allepo di Asia Turki
(Claus, E.P.,1962) namun dapat juga ditemukan di India, Arab, Parsi China dan
Malaysia (Anonima, 2010).
2.1.1 Karakteristik makroskopik
Gal majakani berbentuk bulat bergerigi sebesar biji guli. Warna hijau
kebiruannya akan berubah menjadi warna putih atau kelabu apabila kering, bagian
dalamnya berwarna putih kekuningan. Gal majakani berdiameter 10-25 mm,
tonjolan pada permukaanya. Gal ini berat dan biasanya tenggelam dalam air.
Memliki lubang yang melingkar untuk serangga keluar (Anonimb, 2010).
2.1.2 Karakteristik mikroskopik
Penampang melintang gal menunjukkan parenkim berdinding tipis di
sebelah luar yang lebih besar dibandingkan sebelah dalam. Setelah parenkim,
kemudian diikuti oleh sebuah cincin sklerenkim yang terdiri atas satu atau dua
lapis sel. Bagian dalam terdiri atas parenkim berdinding tebal yang mengelilingi
rongga tengah. Sel parenkim menunjukkan adanya sejumlah besar pati,
sekelompok kalsium oksalat, dan tanin. (Rangari, 2007).
2.1.3 Kandungan kimia
Kandungan utama dari majakani terdiri atas 50 – 70% tanin terutama asam
galotanin yang merupakan asam tanin, Asam tanin adalah tannin terhidrolisa yang
menghasilkan asam galat dan glukosa yang memiliki kompleksitas minimum
pentadigalloyl glukosa. 2 – 4% asam galat, pati dan gula (Dayang, 2012; Ahmad,
2011). Penelitian baru-baru ini menunjukkan bahwa majakani juga mengandung
asam syring yang memiliki efek sebagai SSP (Ahmad, 2011)
2.1.4Kegunaan
Berbagai penelitian telah dilakukan untuk menguji manfaat gal majakani
seperti khasiatnya sebagai obat luka atau luka bakar akibat infeksi bakteri
(Umachigi,et al, 2008). Di India digunakan sebagai obat tradisional untuk
pengobatan penyakit mulut. Selain itu gal majakani digunakan untuk mengobati
diare, antibakteri, antijamur, antivirus dan antiinflamasi (Dayang, 2012). Secara
tradisional gal majakani digunakan sebagai bahan astringen alami yang
2.2Simplisia dan Ekstrak
2.2.1 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa
bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia
hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia yang
berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan (Depkes, 2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan
(Depkes, 2000).
Ekstraksi adalah kegiatan penarikan zat aktif dengan menggunakan pelarut
yang sesuai. Metode ekstraksi dengan menggunakan pelarut dapat dibagi kedalam
dua cara yaitu:
a. Cara dingin:
1. Maserasi, adalah proses pengekstraksi simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada
temperatur ruangan (kamar). Secara teknologi termasuk ekstraksi dengan
prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi
kinetik berarti dilakukan pengadukan yang kontinu (terus-menerus).
Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah
2. Perkolasi, adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umunya dilakukan pada temperatur
ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi
antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus
menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali
bahan.
b. Cara Panas
1. Refluks adalah ektraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik. Umunya dilakukan pengulangan proses
pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses
ekstraksi sempurna.
2. Soxhlet, adalah ekstraksi menggunakan pelarut yang selalu baru umumnya
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan
jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti, adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara
umum dilakukan pada temperatur 40-50oC.
4. Infus, adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur
96-98oC) selama waktu tertentu (15-20 menit).
5. Dekok, adalah infus pada waktu yang lebih lama (≥30oC) dan temperatur
2.3Uraian diare
Diare adalah keadaan dimana tinja menjadi lebih encer konsistensinya dan
frekuensi defekasi lebih sering dari keadaan normal. Diare merupakan gejala dari
suatu penyakit tertentu atau gejala-gejala lainnya. Secara umum diare terjadi
karena meningkatnya motilitas usus dan gangguan absorbsi yang menyebabkan
tinja menjadi encer (Nuratmi, dkk., 2006; Tan dan Raharja, 2002).
Secara fisiologi, dalam lambung makanan dicerna menjadi bubur
(chymus), kemudian diteruskan ke usus halus untuk diuraikan lebih lanjut oleh
enzim-enzim. Setelah terjadi absorpsi, sisa chymus tersebut yang terdiri dari 90%
air dan sisa-sisa makanan yang sukar dicerna, diteruskan ke usus besar (colon).
Bakteri-bakteri yang biasanya selalu berada disini mencernakan lagi sisa-sisa
makanan tersebut, sehingga sebagian besar makanan dapat diserap pula selama
perjalanan melalui usus besar. Airnya juga direabsorpsi kembali, sehingga lama
kelamaan isi usus menjadi lebih padat. Tetapi kadang terjadi peristaltik usus yang
meningkat sehingga pelintasan chymus sangat dipercepat dan masih mengandung
banyak air pada saat meninggalkan tubuh sebagai tinja. Penyebab utamanya
adalah bertumpuknya cairan di usus akibat terganggunya resorpsi air dan atau
terjadinya hipersekresi. Makanan yang tidak dicerna dan tidak diserap usus akan
menarik air dari dinding usus. Di lain pihak, pada keadaan ini proses transit di
usus menjadi sangat singkat sehingga air tidak sempat diserap oleh usus besar.
Hal inilah yang menyebabkan tinja berair pada diare (Tan dan Rahardja, 2002;
anonimd, 2013).
Sebenarnya usus besar tidak hanya mengeluarkan air secara berlebihan
dapat menimbulkan dehidrasi. Dehidrasi inilah yang mengancam jiwa penderita
diare (anonimd, 2013).
2.3.1 Klasifikasi diare
Berdasarkan klasifikasinya, diare dibagi kedalam tiga kelompok yaitu:
1. Berdasarkan adanya infeksi, dibagi atas:
a. Diare infeksi enteral, yaitu diare karena infeksi di usus, misalnya infeksi
bakteri (Vibrio cholera, Eschericia coli, Salmonella dan Shigella), infeksi
virus (Rotavirus dan Enterovirus) dan infeksi parasit (cacing, protozoa dan
jamur).
b. Diare infeksi parenteral atau diare karena infeksi di luar usus (otitis,
media, infeksi saluran pernafasan, infeksi saluran urin, dan lainnya).
2. Berdasarkan lamanya diare, dibagi atas:
a. Diare akut, yaitu diare yang terjadi secara mendadak yang segera
berangsur sembuh pada seseorang yang sebelumnya sehat. Diare akut
biasanya berlangsung dalam waktu kurang dari 2 minggu.
b. Diare kronis, yaitu diare yang timbul perlahan-lahan berlangsung 2
minggu atau lebih, baik menetap atau bertambah hebat (Sriyanto, 2004).
3. Berdasarkan penyebab terjadinya diare, dibagi atas:
a. Diare spesifik, yaitu diare yang disebabkan oleh adanya infeksi misalnya
infeksi yang disebabkan oleh virus, bakteri, parasit dan enterotoksin.
b. Diare non spesifik, yaitu diare yang tidak disebabkan oleh adanya infeksi
misalnya alergi makanan atau minuman (intoleransi), gangguan gizi,
kekurangan enzim dan efek samping obat (Tjay dan Raharja, 2002).
2.3.2 Pengobatan diare
a. Pengobatan spesifik, dilakukan dengan memberikan obat-obat
kemoterapeutik setelah diketahui penyebab yang pasti melalui
pemeriksaan laboratorium. Diberikan pada keadaan infeksi.
b. Pengobatan non spesifik, dilakukan dengan mengurangi peristaltik otot
polos usus, menciutkan selaput lender usus (adstringensia), menyerap
racun dan toksin (absorbensia) dan memberikan cairan elektrolit (Tan dan
Rahardja, 2002).
2.3.3 Obat-obat diare
Kelompok obat yang sering digunakan pada keadaan diare, yaitu:
1. kemoterapeutik, untuk terapi kausal yakni memberantas bakteri penyebab
diare, seperti antibiotik, sulfonamid, kinolon dan furazolidon.
2. obstipansia, yang dibagi menjadi:
a. zat-zat penekan peristaltik, candu dan alkaloidnya, derivat petidin
(difenoksilat dan loperamid), dan antikolinergik (atropine dan ekstrak
belladonna).
b. adstringen, yang menciutkan selaput lendir usus, misalnya asam samak
(tanin) dan tanalbumin, garam-garam bismuth dan aluminium.
c. adsorbensia, misalnya carbo adsorbens yang pada permukaannya dapat
menyerap zat-zat beracun yang dihasilkan oleh bakteri. Yang termasuk
juga dalam golongan ini, antara lain adalah pektin, garam-garam bismuth
dan aluminium.
3. spasmolitik, yakni zat-zat yang dapat melepaskan kejang-kejang otot yang
2.4Loperamid Hidrokloridum
Loperamid merupakan derivat difenoksilat dengan khasiat obstipasi yang
dua sampai tiga kali lebih kuat tetapi tanpa khasiat terhadap susunan saraf pusat
sehingga tidak menimbulkan ketergantungan. Zat ini mampu menormalkan
keseimbangan resorpsi-sekresi dari sel-sel mukosa, yaitu memulihkan sel-sel yang
berada dalam keadaan hipersekresi ke keadaan resorpsi normal kembali (Tan dan
Rahardja, 2002).
2.5Minyak Jarak
Oleum ricini atau castor oil atau minyak jarak berasar dari biji Ricinus
communis L, suatu trigliserida risinoleat dan asam lemak tidak jenuh. Di dalam
usus halus minyak jarak dihidrolisis oleh enzim lipase menjadi gliserol dan asam
risinoleat. Asam risinoleat inilah yang merupakan bahan aktif sebagai pencahar.
Minyak jarak juga bersifat emolien. Sebagai pencahar obat ini tidak banyak
digunakan lagi karena banyak obat yang lebih aman. Minyak jarak menyebabkan
kolik, dehidrasi yang disertai gangguan elektrolit. Obat ini merupakan bahan
induksi diare pada penelitian diare secara eksperimental pada hewan percobaan
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara ekperimental berdasarkan
rancangan acak lengkap. Penelitian ini meliputi pengumpulan tumbuhan,
identifikasi tumbuhan, pengolahan tumbuhan, karakterisasi simplisia, pembuatan
ekstrak, penyiapan hewan percobaan dan pengujian efek antidiare secara oral pada
hewan percobaan. Data hasil penelitian akan dianalisis secara ANOVA (analisis
variansi) dan dilanjutkan dengan uji beda rata-rata Duncan menggunakan program
SPSS (Statistical Product and service solution) versi 16.
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat alat yang digunakan dalam penelitian ini meliputi alat-alat gelas
laboratorium, alat perkolator, blender (Panasonik), freeze dryer (Edward), rotary
evaporator (Buchi), oven listrik (Fischer scientific), mikroskop (Olimpus),
kandang tikus, lemari pengering, neraca kasar (Ohaus), neraca listrik (Chyo
JP2-600), kandang tikus, neraca hewan (Presica Geniweigher GW-1500), oral sonde,
seperangkat alat destilasi, stopwatch, spuit 1 ml , spuit 3 ml (Terumo).
3.1.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan
tumbuhan dan bahan kimia. Bahan tumbuhan yang digunakan adalah majakani.
Bahan kimia yang digunakan dalam penelitian kecuali dinyatakan lain adalah
berkualitas pro analisis, amil alkohol, asam asetat anhidrida, asam klorida pekat,
asam nitrat pekat, asam sulfat pekat, benzene, besi (III) klorida, bismuth (III)
hidroksida, karboksi metil selulosa (CMC), loperamid HCl (tablet Imodium® ;
Jansen-Cilag), oleum ricini.
3.2 Pengumpulan dan Pengolahan sampel 3.2.1 Pengumpulan sampel
Pengambilan sampel majakani dilakukan secara purposif yang dibeli dari
toko obat tradisional di Pasar Sambu, Medan. Gambar simplisia dapat dilihat
pada Lampiran 3, halaman 43.
3.2.2 Identifikasi sampel
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani
Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor.
Identifikasi bertujuan untuk memastikan kebenaran tumbuhan yang akan
digunakan dalam penelitian. Hasil Identifikasi dapat dilihat pada Lampiran 1,
halaman 41.
3.2.3 Pengolahan sampel
Majakani yang diperoleh sudah berupa sampel kering, kemudian
dibersihkan dari kotoran dengan menggunakan kain basah, kemudian dikeringkan
di dalam lemari pengering dan ditimbang. Sampel kering diserbukkan/
dihaluskan dan ditimbang berat serbuk keringnya. Bagan kerja penelitian dapat
dilihat pada Lampiran 6, halaman 46-47.
3.3 Pembuatan Pereaksi 3.3.1 Besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai 100 ml
3.3.2 Larutan asam klorida (HCl) 2N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai 100 ml (Ditjen POM, 1979).
3.3.3 Timbal (II) asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas CO2
hingga 100 ml (Depkes, 1995).
3.3.4 Pereaksi Mayer
Sebanyak 1,36 g raksa (II) klorida, kemudian dilarutkan dalam air suling hingga 60 ml. Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu
dilarutkan dalam 20 ml air suling. Kedua larutan dicampurkan dan ditambahkan
air suling hingga diperoleh larutan 100 ml (Depkes, 1995).
3.3.5 Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga 100 ml (Depkes, 1995).
3.3.6 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat dilarutkan dalam asam nitrat pekat 20 ml kemudian dicampurkan dengan larutan kalium iodida sebanyak 27,2 g dalam 50
ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih
diambil dan diencerkan dengan air suling secukupnya hingga 100 ml (Depkes,
1995).
3.3.7 Larutan kloralhidrat
3.3.8 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga diperoleh 100 ml (Depkes, 1995).
3.3.9 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya kemudian ditambahkan 2 g iodida sedikit demi sedikit, cukupkan dengan air
suling sampai 100 ml (Depkes, 1995).
3.3.10 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrida dengan 5 ml asam
sulfat pekat tambahkan etanol hingga 50 ml (Merck, 1978).
3.4 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakterisasi simplisia meliputi makroskopik, mikroskopik,
penetapan kadar air, penetapan kadar sari yang larut dalam etanol, penetapan
kadar sari yang larut dalam air, penetapan kadar abu total, dan pemeriksaan kadar
abu yang tidak larut dalam asam (Depkes, 1995; WHO, 1992).
3.4.1 Makroskopik
Pemeriksaan makroskopik dilakukan terhadap simplisia majakani meliputi
bentuk, bau, warna dan rasa. Gambar simplisia dapat dilihat pada Lampiran 3,
halaman 43.
3.4.2 Mikroskopik
Pemeriksaan mikroskopik terhadap simplisia dilakukan dengan cara
menaburkan serbuk simplisia di atas kaca objek yang telah diteteskan dengan
mikroskop. Dilakukan juga pemeriksaan mikroskopik dengan menggunakan
akuades.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi
toluene). Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin,
tabung penyambung dan tabung penerima 10 ml.
Cara penetapan:
Toluena sebanyak 200 ml dan air suling sebanyak 2 ml dimasukkan ke
dalam labu alas bulat, kemudian di destilasi selama 2 jam. Setelah itu toluena
didinginkan selama 30 menit dan dibaca volume air pada tabung penerima dengan
ketelitian 0,05 ml (volume I). Kemudian ke dalam labu alas bulat tersebut
dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan
hati-hati selama 15 menit. Setelah toluena mulai mendidih, destilasi dengan
kecapatan 2 tetes tiap detik, hingga sebagian besar air terdestilasi. Kemudian
kecepatan destilasi ditingkatkan hingga 4 tetes tiap detik. Setelah 2 jam didestilasi
(semua air terdestilasi), bagian dalam pendingin dibilas dengan toluena yang telah
dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima
dibiarkan mendingin sampai suhu kamar. Setelah air dan toluena memisah
sempurna, volume air dibaca dengan ketelitian 0,05 ml (Volume II). Selisih kedua
volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan
yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992). Hasil Perhitungan
kadar air dapat dilihat pada Lampiran 7, halaman 48.
3.4.4 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran
dilakukan pada suhu 600oC selama 3 jam. Kemudian didinginkan dan ditimbang
sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah
dikeringkan di udara (Depkes, 1995). Hasil penetapan kadar abu total dapat
dilihat pada Lampiran 10, halaman 51.
3.4.5 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan abu didinginkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring dengan kertas masir atau kertas saring bebas abu, cuci
dengan air panas, dipijarkan sampai bobot tetap, kemudian didinginkan dan
ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bobot yang
dikerignkan di udara (Depkes, 1995). Hasil penetapan kadar abu tidak larut asam
dapat dilihat pada Lampiran 11, halaman 52.
3.4.6 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia yang telah dikeringkan dimaserasi selama
24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali
selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring, 20
ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah
ditara dan sisanya dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari
larut dalam etanol dihitung terhadap bahan yang telah dikeringkan (Depkes,
1995). Hasil penetapan kadar sari larut etanol dapat dilihat pada Lampiran 9,
halaman 50.
3.4.7 Penetapan kadar sari larut air
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama
dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, dibiarkan
selama 18 jam, kemudian disaring. Diuapkan 20 ml filtrat sampai kering dalam
cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa
dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang
larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Depkes,
1995). Hasil penetapan kadar sari larut air dapat dilihat pada Lampiran 8,
halaman 49.
3.5 Skrining Fitokimia
Skrining fitokimia simplisia meliputi golongan senyawa alkaloida, glikosida, glikosida antrakinon, saponin, tanin, dan steroida/triterpenoida. Dimana
dilakukan skrining fitokimia dilakukan terhadap simplisia majakani dan ekstrak
etanol majakani.
3.5.1 Pemeriksaan alkaloida
Serbuk simplisia dan ekstrak etanol majakani ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan
diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang
diperoleh dipakai untuk uji alkaloida: diambil 3 tabung reaksi, lalu kedalamnya
dimasukkan 0,5 ml filtrat.
Pada masing-masing tabung reaksi;
1. ditambahkan 2 tetes pereaksi Mayer
2. ditambahkan 2 tetes pereaksi Bouchardat
3. ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhkan pada paling sedikit
3.5.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia dan ekstrak etanol majakani ditambahkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam
keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1
ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah.
Flavonoida positif jika terjadi warna merah atau kuning atau jingga pada lapisan
amil alkohol (Farnsworth, 1966).
3.5.3 Pemeriksaan glikosida
Serbuk simplisia dan ekstrak etanol majakani ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol 95% dengan air (7:3) dan 10 ml asam
klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml
filrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok,
didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol
dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan
dan diuapkan pada temperatur tidak lebih dari 50٥C. Sisanya dilarutkan dalam 2
ml metanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan
percobaan dimasukan dalam tabung reaksi dan diuapkan diatas penangas air. Pada
sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Kemudian secara
perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya
cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Depkes,
1995).
3.5.4 Pemeriksaan antrakinon
Serbuk simplisia dan ekstrak etanol majakani ditimbang sebanyak 0,2 g,
kemudian ditambahkan 5 ml asam sulfat 2 N, dipanaskan sebentar, setelah dingin
dipisahkan dan disaring, kocok lapisan benzena dengan 2 ml NaOH 2 N,
didiamkan. Lapisan air berwarna merah dan lapisan benzena tidak berwarna
menunjukkan adanya antrakinon (Depkes, 1995).
3.5.5 Pemeriksaan saponin
Serbuk simplisia dan ekstrak etanol majakani ditimbang sebanyak 0,5 g dan dimasukan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas,
dinginkan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa
setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan
penambahan 1 tetes asam klorida 2N menunjukan adanya saponin (Depkes, 1995).
3.5.6 Pemeriksaan tanin
Serbuk simplisia dan ekstrak etanol majakani ditimbang sebanyak 1 g, dididihkan selama 3 menit dalam 100 ml air suling lalu didinginkan dan disaring.
Pada filtrat ditambahkan 1-2 tetes peraksi besi (III) klorida 1%. Jika terjadi warna
biru kehitaman atau hijau kehitaman menunjukan adanya tanin (Farnsworth,
1966).
3.5.7 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g serbuk simplisia dan ekstrak etanol majakani dimaserasi dengan 20 ml eter selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan
penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard.
Apabila terbentuk warna ungu atau merah yang berubah menjadi biru atau biru
hijau menunjukan adanya steroida/ triterpenoida (Depkes, 1995).
3.6 Pembuatan Ekstrak Etanol Majakani (EEM)
Pembuatan ekstrak etanol majakani dilakukan secara maserasi
Cara kerja:
Sebanyak 1800 g serbuk simplisia majakani dimasukkan ke dalam wadah
kaca berwarna gelap, kemudian dituangi dengan 7500 ml etanol 80%. Ditutup dan
dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, disaring
hingga didapat maserat. Ampas dicuci dengan 1500 ml etanol 80%, dipindahkan
ke dalam bejana tertutup, dibiarkan ditempat sejuk, terlindung dari cahaya selama
2 hari, selanjutnya disaring. Maserat etanol yang diperoleh diuapkan dengan
menggunakan rotary evaporator pada temperatur ± 400C sampai diperoleh
ekstrak kental kemudian dikeringkan menggunakan freeze dryer.
3.7 Percobaan Efek Antidiare
Percobaan efek antidiare meliputi penyiapan hewan percobaan, bahan uji,
obat pembanding (loperamid HCl), oleum ricini dan pengujian efek antidiare.
3.7.1 Penyiapan hewan percobaan
Hewan percobaan yang digunakan adalah tikus jantan putih galur Wistar
dengan berat badan 200-250 g sebanyak 36 ekor, dibagi dalam 6 kelompok
dimana setiap kelompok terdiri dari 6 ekor tikus. Dua minggu sebelum pengujian
dilakukan, tikus diadaptasikan dengan lingkungan percobaan.
3.7.2 Penyiapan bahan
Penyiapan bahan-bahan meliputi larutan suspensi CMC 1%, air suling,
ekstrak etanol majakani (Quercus infectoria G. Olivier), loperamid HCl (tablet
Imodium®).
3.7.2.1 Pembuatan suspensi CMC Na 1% (b/v)
Sebanyak 1 g CMC Na ditaburkan ke dalam lumpang berisi air suling
massa yang transparan, digerus lalu diencerkan dengan air suling hingga 100 ml
(Anief, 1999).
3.7.2.2 Pembuatan suspensi loperamid HCl dari tablet imodium®
Satu tablet Imodium® mengandung 2 mg loperamid HCL. Berat satu
tablet Imodium® adalah 162 mg. Sebanyak satu tablet Imodium® digerus halus
dalam lumpang kemudian ditambah suspensi CMC Na 1% sedikit demi sedikit
sambil digerus homogen lalu diencerkan dengan suspensi CMC 1% hingga 10 ml.
3.7.2.3 Pembuatan suspensi ekstrak etanol majakani
Ekstrak etanol majakani dibuat pada satu konsentrasi, yaitu ditimbang
sebanyak 500 mg EEM, kemudian digerus dalam lumpang, lalu ditambahkan
suspensi CMC 1% sedikit demi sedikit sambil digerus homogen lalu diencerkan
dengan suspensi CMC 1% hingga 10 ml. Di setiap melakukan penelitian suspensi
EEM dibuat baru dengan konsentrasi yang sama.
3.7.3 Prosedur percobaan
Pelaksanaan percobaan ini menggunakan 36 ekor tikus putih yang dibagi
secara acak ke dalam 6 kelompok. Sebelum percobaan dimulai, tikus dipuasakan
terlebih dahulu selama 16 jam. Kelompok I sebagai kontrol negatif diberi
suspensi CMC Na 1%, kelompok II diberi suspensi Loperamid HCl 0,9 mg/kg
BB, kelompok III, IV, V, dan VI diberi suspensi EEM masing-masing dengan
dosis 75, 100, 125 dan 150 mg/kg BB. Satu jam setelah perlakuan tikus diberi
oleum ricini 2 ml/ekor, lalu tikus ditempatkan dalam wadah pegamatan.
Pengamatan dimulai 30 menit setelah pemberian oleum ricini.
Parameter yang diamati meliputi saat mulai terjadinya diare, frekuensi
defekasi, konsistensi feses dan berat feses. Respon tiap tikus diamati pada menit
ricini. Parameter konsistensi feses dibagi menjadi 0= tidak defekasi, 1= feses
normal, 2= feses lembek, 3= feses berair/ berlendir membentuk massa feses, 4=
feses berair/ berlendir tidak membentuk massa feses (Adnyana, dkk., 2004;
Sa’roni, dkk., 1996; Wien dan Dian, 1996).
3.8 Analisis Data
Data hasil pengamatan konsistensi feses dianalisis secara statistic dengan
metode Anava (analisis variansi) pada tingkat kepercayaan 95%, dilanjutkan
dengan uji Duncan untuk melihat perbedaan nyata antar kelompok perlakuan.
Analisis statistik ini menggunakan program SPSS (Statistical Product and Service
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pemeriksaan Tumbuhan 4.1.1 Hasil identifikasi tumbuhan
Hasil identifikasi sampel yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
(LIPI) Bogor menunjukkan bahwa sampel adalah benar majakani suku Fagaceae.
4.1.2 Hasil karakterisasi simplisia
Hasil pemeriksaan makroskopik dari simplisia majakani diperoleh bahwa
majakani berwarna coklat muda dan memiliki permukaan sedikit bergerigi.
Berbentuk bulat dan kecil, berdiameter 1,5-2,5 cm, memiliki aroma yang khas dan
rasa kelat/sedikit pahit. Hasil pemeriksaan mikroskopik dari serbuk simplisia
majakani memperlihatkan adanya sel parenkim berisi tetes minyak yang berwarna
merah dengan Sudan III, sel rambut biasa, kristal kalsium oksalat berbentuk
prisma, sel batu dan butir pati.
Karakteristik serbuk simplisia majakani yang diperoleh dapat dilihat pada
Tabel 4.1.
Tabel 4.1 Hasil karakterisasi serbuk simplisia majakani
No. Karakteristik Hasil pemeriksaan (% b/v) 1
Kadar sari larut air
Kadar sari larut etanol
Kadar abu total
Kadar abu tidak larut asam
7,97
56,46
60,59
1,60
Karakteristik dari serbuk simplisia majakani tidak tercantum di buku
Materia Medika Indonesia. Namun kadar air simplisia memenuhi syarat
berdasarkan persyaratan umum pada Materi Medika Indonesia, dimana kadar air
tidak lebih dari 10%. Penetapan kadar air dilakukan untuk memberikan batasan
kandungan air yang masih dapat ditolerir, karena air merupakan media yang baik
untuk pertumbuhan mikroba dan jamur. Penetapan kadar sari yang larut dalam air
dilakukan untuk mengetahui kadar sari yang larut dalam air. Senyawa-senyawa
yang dapat larut dalam air adalah glikosida, gula, protein, enzim dan zat warna.
Penetapan kadar sari yang larut dalam etanol untuk mengetahui kadar sari yang
larut dalam pelarut polar. Senyawa-senyawa yang dapat larut dalam etanol adalah
glikosida, antrakinon, steroid, flavonoid, klorofil, dan dalam jumlah sedikit yang
larut yaitu lemak dan saponin (Depkes, 1986). Tujuan penetapan kadar abu
adalah untuk memberikan gambaran kandungan mineral internal dan eksternal
yang berasal dari proses awal sampai terbentuknya abu (Depkes, 2000).
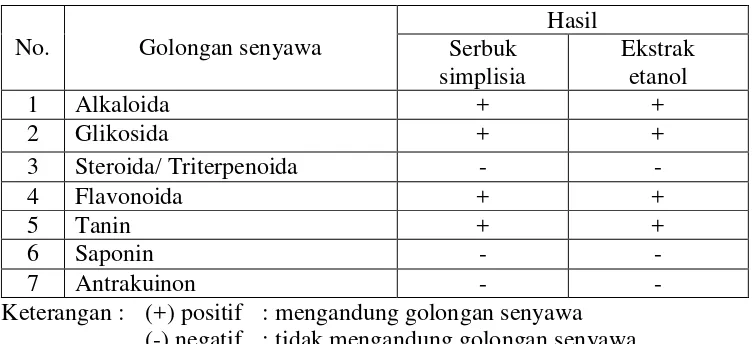
4.1.3 Hasil skrining fitokimia
Hasil skrining fitokimia terhadap serbuk simplisia majakani dan ekstrak
etanol majakani menunjukkan bahwa majakani mengandung senyawa kimia
golongan alkaloida, glikosida, flavanoida, dan tanin seperti yang terlihat pada
Tabel 4.2.
Pada skrining alkaloida, penambahan Mayer terbentuk endapan putih
kekuningan, dengan Bouchardat terbentuk endapan berwarna coklat sampai hitam,
dan dengan Dragendroff terbentuk endapan jingga. Sampel dikatakan positif
alkaloida apabila 2 dari 3 reaksi tersebut memberikan reaksi positif. Penambahan
serbuk Mg dan asam klorida pekat dan amil alkohol memberikan warna merah
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol majakani
Keterangan : (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Skrining glikosida ditunjukkan dengan terbentuknya cincin ungu dengan
penambahan Molish dan asam sulfat pekat. Penambahan FeCl3 1% memberikan
warna biru kehitaman yang menunjukkan adanya tanin yaitu 3 buah gugus
hidroksil. Hasil skrining fitokimia menunjukkan adanya senyawa tanin yang
bersifat astringen dan adanya senyawa ini pada majakani menunjukkan bahwa
majakani memiliki potensi sebagai antidiare.
4.2 Hasil Pengujian Antidiare
Pada pengujian efek antidiare dari suspensi ekstrak etanol majakani
(EEM) dosis yang digunakan yaitu 75, 100, 125, dan 150 mg/kg BB.
Masing-masing tikus yang telah dipuasakan 16 jam sebelum penelitian
dikelompokkan menjadi 6 kelompok dan kemudian diberikan perlakuan yaitu
kelompok kontrol negatif diberikan suspensi CMC Na dosis 1% bb, kelompok
pembanding diberikan suspensi loperamid HCl dosis 0,9 mg/kg BB dan kelompok
uji diberikan suspensi EEM yang terdiri dari empat dosis yaitu 75, 100, 125, dan
oleum ricini sebanyak 2 ml setiap ekornya. Penentuan efek antidiare dari ekstrak
etanol majakani dilakukan dengan cara mengamati saat mulai terjadinya diare,
frekuensi defekasi dan bobot total feses.
4.2.1 Penentuan saat mulai terjadinya diare
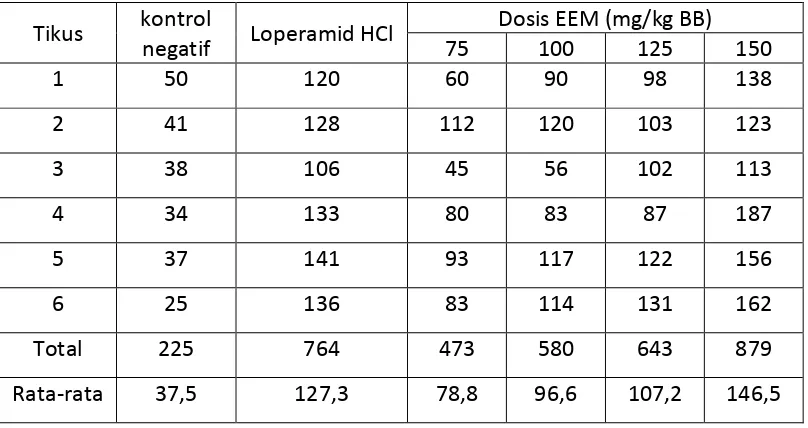
Penentuan saat mulai terjadinya diare dapat dilihat pada Tabel 4.3 dan
Gambar 4.1.
Tabel 4.3 Hasil pengamatan saat mulai terjadinya diare (menit ke-) pada tikus setelah pemberian oleum ricini secara oral
Tikus kontrol
negatif Loperamid HCl
Dosis EEM (mg/kg BB)
masing kelompok perlakuan yaitu: kelompok kontrol negatif mulai terjadinya
diare pada menit ke-37,5; kelompok loperamid mulai terjadinya diare pada menit
127,3; kelompok EEM 75 mg/kg BB mulai terjadinya diare pada menit
ke-78,8; kelompok EEM 100 mg/kg BB mulai terjadinya diare pada menit ke-96,6;
kelompok EEM 125 mg/kg BB mulai terjadinya diare pada menit ke-107,2 dan
kelompok EEM 150 mg/kg bb mulai terjadinya diare pada menit ke-146,5. Hasil
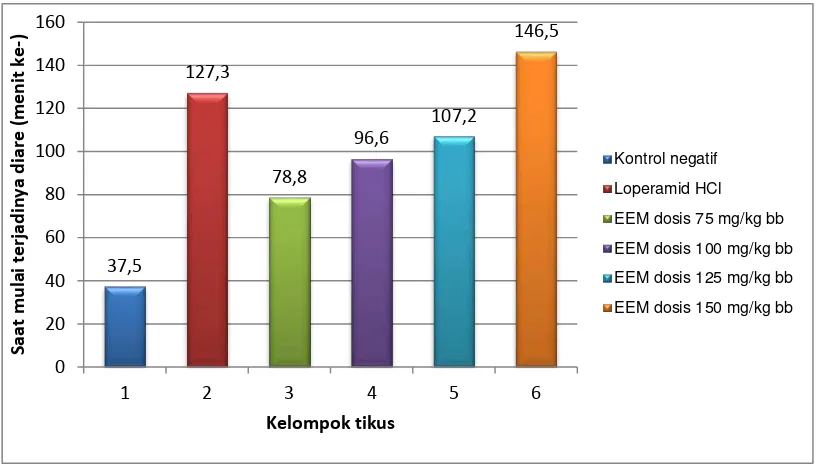
yang diperoleh menunjukkan bahwa semakin cepat terjadinya diare maka efek
Gambar 4.1. Grafik hasil pengamatan saat mulai terjadinya diare (menit ke-) pada tikus setelah pemberian oleum ricini secara oral
Hasil analisis statistik analisis variansi (ANAVA) dimana p < 0,05 yang
berarti adanya perbedaan yang signifikan antar perlakuan dan dilanjutkan dengan
uji beda rata-rata Duncan untuk mengetahui perbedaan yang bermakna antar
perlakuan. Hasil analisis statistik uji beda rata-rata Duncan menunjukkan bahwa
pemberian EEM dosis 75 mg/kg bb dibandingkan dengan kontrol negatif
menunjukkan perbedaan yang nyata, dan tidak berbeda nyata dengan EEM dosis
100 mg/kg BB. Pemberian EEM 100 mg/kg bb tidak berbeda nyata dengan EEM
dosis 125 mg/kg bb. Pemberian EEM 125 dan 150 mg/kg bb tidak berbeda nyata
dengan loperamid HCl artinya dosis 125 mg/kg bb sudah menunjukkan efek
dalam meningkatkan waktu saat mulai terjadinya diare yang sebanding dengan
loperamid HCl. Sedangkan dosis 150 mg/kg bb waktu saat mulai terjadinya diare
yang diperoleh lebih lama dibandingkan dengan loperamid HCl. Ini menunjukkan
bahwa semakin tinggi dosis EEM yang diberikan maka semakin lama waktu saat
mulai terjadinya diare.
EEM dosis 75 mg/kg bb
EEM dosis 100 mg/kg bb
EEM dosis 125 mg/kg bb
4.2.2 Penentuan frekuensi defekasi
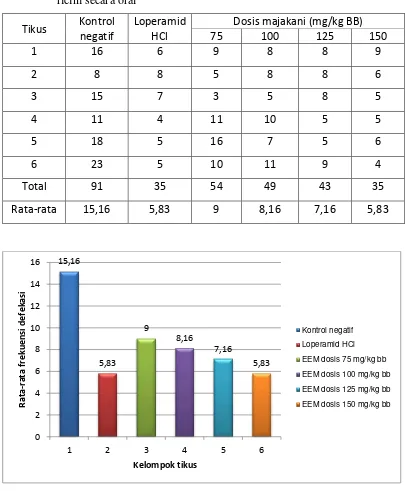
Penentuan frekuensi defekasi tikus dapat dilihat pada Tabel 4.4 dan
Gambar 4.2.
Tabel 4.4 Hasil pengamatan frekuensi defekasi tikus setelah pemberian oleum ricini secara oral
Tikus Kontrol negatif
Loperamid HCl
Dosis majakani (mg/kg BB) 75 100 125 150
Gambar 4.2. Grafik hasil pengamatan frekuensi defekasi tikus setelah pemberian oleum ricini secara oral
Pada Tabel 4.4 dan Gambar 4.2, diperoleh nilai rata-rata dari
masing-masing kelompok perlakuan yaitu, kelompok kontrol negatif mempunyai nilai
15,16
EEM dosis 75 mg/kg bb
EEM dosis 100 mg/kg bb
EEM dosis 125 mg/kg bb
rata-rata frekuensi defekasi sebanyak 15,16 kali; kelompok loperamid mempunyai
nilai rata-rata frekuensi defekasi sebanyak 5,83 kali; kelompok EEM 75 mg/kg
BB mempunyai nilai rata-rata frekuensi defekasi sebanyak 9 kali; kelompok EEM
100 mg/kg BB mempunyai nilai rata-rata frekuensi defekasi sebanyak 8,16 kali;
kelompok EEM 125 mg/kg BB mempunyai nilai rata-rata frekuensi defekasi
sebanyak 7,16 kali dan kelompok EEM 150 mg/kg BB mempunyai nilai rata-rata
frekuensi defekasi sebanyak 5,83 kali. Dari hasil yang diperoleh menunjukkan
dengan semakin tinggi frekuensi defekasi maka efek antidiare akan semakin
lemah.
Hasil analisis statistik analisis variansi (ANAVA) dimana p < 0,05 yang
berarti adanya perbedaan yang signifikan antar perlakuan dan dilanjutkan dengan
uji beda rata-rata Duncan untuk mengetahui perbedaan yang bermakna antar
perlakuan. Hasil analisis statistik uji beda rata-rata Duncan menunjukkan bahwa
pemberian EEM dosis 75, 100, 125 dan 150 mg/kg bb dibandingkan dengan
kontrol negatif menunjukkan perbedaan yang nyata, dan tidak berbeda nyata
dengan loperamid HCl, artinya pada dosis 75 mg/kg bb sudah memberikan efek
yang sebanding dengan loperamid HCl dalam mengurangi jumlah frekuensi
defekasi.
4.2.3 Penentuan konsistensi feses
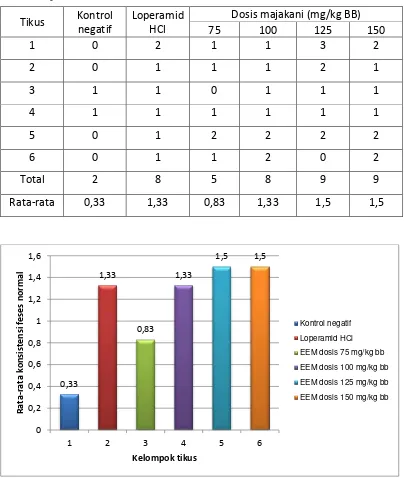
Penentuan konsistensi feses tikus dapat dilihat pada Tabel 4.5 dan
Tabel 4.5 Hasil pengamatan jumlah konsistensi feses normal pada tikus setelah pemberian oleum ricini secara oral
Tikus Kontrol negatif
Loperamid HCl
Dosis majakani (mg/kg BB) 75 100 125 150
Gambar 4.3. Grafik hasil pengamatan jumlah konsistensi feses tikus normal setelah pemberian oleum ricini secara oral
Pada Tabel 4.5 dan Gambar 4.3, diperoleh nilai rata-rata dari
masing-masing kelompok perlakuan yaitu, kelompok kontrol negatif mempunyai nilai
rata-rata konsistensi feses normal adalah 0,33; kelompok loperamid mempunyai
nilai rata-rata konsistensi feses normal adalah 1,33; kelompok EEM 75 mg/kg BB
0,33
EEM dosis 75 mg/kg bb
EEM dosis 100 mg/kg bb
EEM dosis 125 mg/kg bb
mempunyai nilai rata-rata konsistensi feses normal adalah 0,83; kelompok EEM
100 mg/kg BB mempunyai nilai rata-rata konsistensi feses normal adalah 1,33;
kelompok EEM 125 mg/kg BB mempunyai nilai rata-rata konsistensi feses
normal adalah 1,5 dan kelompok EEM 150 mg/kg BB mempunyai nilai rata-rata
konsistensi feses normal adalah 1,5. Dari hasil yang diperoleh menunjukkan
dengan semakin tinggi nilai pengeluaran konsistensi feses normal pada tikus maka
efek antidiare akan semakin kuat.
Hasil analisis statistik analisis variansi (ANAVA) dimana p < 0,05 yang
berarti adanya perbedaan yang signifikan antar perlakuan dan dilanjutkan dengan
uji beda rata-rata Duncan untuk mengetahui perbedaan yang bermakna antar
perlakuan.
Hasil analisis statistik uji beda rata-rata Duncan menunjukkan bahwa
pemberian EEM dosis 100, 125 dan 150 mg/kg bb dibandingkan dengan kontrol
negatif menunjukkan perbedaan yang nyata dan tidak berbeda nyata dengan
loperamid HCl, artinya EEM dengan dosis 100 mg/kg bb sudah memberikan efek
dalam memperbaiki profil konsistensi feses yang sebanding dengan loperamid
HCl.
4.2.4 Bobot total feses
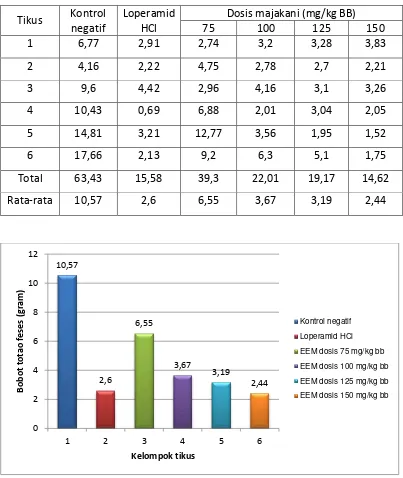
Bobot total feses tikus yang diperoleh dapat dilihat pada Tabel 4.6 dan
Gambar 4.4 di bawah ini.
Tikus Kontrol negatif
Loperamid HCl
Dosis majakani (mg/kg BB)
75 100 125 150
Gambar 4.4. Grafik hasil pengamatan bobot total feses (gram) pada tikus setelah pemberian oleum ricini secara oral bobot total feses
Pada Tabel 4.6 dan Gambar 4.4, diperoleh bobot feses dari masing-masing
kelompok perlakuan yaitu, kelompok kontrol negatif mempunyai bobot total feses
sebanyak 63,43 g; kelompok loperamid mempunyai bobot total feses sebanyak
15,58 g; kelompok EEM 75 mg/kg BB mempunyai bobot total feses sebanyak
EEM dosis 75 mg/kg bb
EEM dosis 100 mg/kg bb
EEM dosis 125 mg/kg bb