PERTUMBUHAN DAN KERAGAAN PLANLET SAGU
(Metroxylon sagu Rottb.) PADA MEDIUM DENGAN BERBAGAI SUMBER KARBOHIDRAT DAN INTENSITAS CAHAYA YANG BERBEDA
WIRDHATUL MUSLIHATIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb.) pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yang Berbeda adalah karya saya dengan arahan dari komisi pembimbing yang belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 17 Juli 2009
ABSTRACT
WIRDHATUL MUSLIHATIN. Growth and Performance of Plantlets of Sago (Metroxylon sagu Rottb.) on Medium with Different Sources of Carbohydrate and Different Levels of Light Intensity. Under direction of DIAH RATNADEWI and SUMARYONO.
Plantlets of sago derived from somatic embryos usually are weak with few leaves and roots, resulted in a low survival rate during plantlet acclimatization. Essential factors for vigorous plantlets are carbohydrate and light intensity. Carbohydrate is added into a culture medium as energy source and osmotic agent. Light intensity influences plant growth and development because it is directly related to photosynthesis and morphogenic process. Research was conducted to determine a suitable carbohydrate and light intensity for plantlets growth in order to produce vigorous plantlets of sago. The basal medium used was modified MMS (Murashige & Skoog) medium with a half strength salts. The first experiment was the application of different types of carbohydrate (sucrose, maltose, glucose, and fructose) at various concentrations (30, 45, and 60 g/L) into the medium. A single 1-2 cm plantlet was cultured on a culture tube. Each treatment consisted of 15 plantlets. In the second experiment, plantlets were cultured on the basal medium with sucrose 30 g/L. The cultures were incubated in a light room culture with different light intensities (10, 20, 30, and 40 µmol/m2/sec). Parameters observed were plantlet height, leaf number, leaf color, stem diameter, biomass fresh weight and rooting percentage. Relative growth rate (RGR) of plantlet height and leaf number was also calculated. Histology of leaf, leaf sheath and root was conducted according to modified Nakamura method. Leaf stomata density was observed using whole mount preparatory. The results show that different types and concentrations of carbohydrate influenced sago plantlet growth. Medium with sucrose 30 g/L gave the best growth of sago plantlet based on RGR plantlet height, RGR leaf number, biomass fresh weight, stem diameter, and rooting percentage. However, the greenest leaf color was found on a medium added with glucose 60 g/L. Light intensity did not affect plantlet growth and performance except stem diameter. Higher density and smaller size of stomata was observed on leaf of non vigorous plantlets than those of vigorous plantlets. Anatomy of leaf sheath of vigorous and non vigorous plantlets reveals different patterns, where shoot apical meristem (SAM) was found in vigorous plantlets. It can be concluded that plantlets of sago palm cultured on a medium added with sucrose 30 g/L under light intensity of 10 µmol/m2/sec grew better than on medium with other carbohydrate sources and light intensities.
RINGKASAN
WIRDHATUL MUSLIHATIN. Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb.) pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yang Berbeda. Dibimbing oleh DIAH RATNADEWI dan SUMARYONO.
Sagu merupakan tanaman asli Indonesia yang memiliki potensi sebagai sumber bahan pangan dan industri. Kebutuhan dan permintaan sagu semakin besar sehingga perlu dilakukan peningkatan produksi. Pertumbuhan populasi sagu secara alami dikhawatirkan tidak mampu mengimbangi laju penebangan untuk memenuhi kebutuhan. Salah satu cara untuk menghasilkan bahan tanam yang seragam dengan jumlah besar dalam waktu yang relatif singkat adalah dengan teknik kultur jaringan atau kultur in vitro. Planlet sagu hasil kultur in vitro pada umumnya masih sangat lemah dengan jumlah daun dan akar yang sedikit. Hal ini menyebabkan pertumbuhan dan daya hidup bibit saat aklimatisasi sangat rendah. Komposisi medium kultur dan intensitas cahaya merupakan penentu utama bagi pertumbuhan tanaman in vitro. Karbohidrat merupakan komponen yang sangat penting untuk pertumbuhan dan perkembangan tanaman in vitro yang terjadi pada kondisi yang tidak cocok untuk fotosintesis atau tanpa fotosintesis. Intensitas cahaya juga mempengaruhi keberhasilan kultur in vitro. Selain berperan dalam proses fotosintesis planlet, cahaya mempengaruhi perkembangan dan pertumbuhan atau morfogenesis tanaman. Modifikasi jenis dan komposisi medium serta faktor lingkungan seperti intensitas cahaya merupakan cara-cara yang dapat dilakukan untuk menghasilkan planlet yang vigor.
Tujuan dari penelitian ini adalah 1) mendapatkan jenis dan konsentrasi karbohidrat yang tepat untuk menghasilkan planlet sagu yang vigor; 2) mendapatkan intensitas cahaya yang sesuai untuk menghasilkan planlet sagu yang vigor dan 3) membandingkan kerapatan stomata, anatomi daun, pelepah dan akar planlet sagu yang vigor dan tidak vigor hasil kultur in vitro. Informasi yang diperoleh diharapkan mampu meningkatkan produksi bibit unggul sagu Indonesia secara klonal.
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Data yang dihasilkan dianalisis dengan General Linear Model (GLM) 2 faktor yaitu jenis dan konsentrasi karbohidrat, dilanjutkan dengan uji Duncan pada taraf kepercayaan 95% menggunakan program SAS ver 9.1.
Hasil penelitian ini menunjukkan bahwa jenis dan konsentrasi karbohidrat berpengaruh nyata terhadap pertumbuhan dan keragaan planlet sagu. Medium dengan sukrosa 30 g/L memberikan pengaruh terbaik terhadap pertumbuhan planlet sagu berdasarkan parameter tinggi, jumlah daun, diameter, bobot basah dan persentase perakaran kecuali warna daun. Dalam penelitian ini perbedaan intensitas cahaya yang diberikan tidak berpengaruh nyata terhadap pertumbuhan dan keragaan planlet sagu kecuali pada diameter planlet. Intensitas cahaya 10 µmol/m2/detik menghasilkan planlet vigor lebih banyak daripada intensitas cahaya yang lebih tinggi.
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa planlet sagu yang dikultur pada media yang mengandung sukrosa 30 g/L dan intensitas cahaya 10 µmol/m2/detik menghasilkan planlet yang lebih vigor. Kerapatan stomata planlet tidak vigor lebih tinggi dengan ukuran stomata lebih kecil daripada planlet vigor. Secara anatomi tidak terdapat perbedaan antara daun dan akar planlet sagu vigor dan tidak vigor, namun pelepah planlet sagu vigor dan tidak vigor menunjukkan perbedaan secara histologi. meristem apikal pucuk (SAM) ditemukan pada planlet sagu vigor.
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PERTUMBUHAN DAN KERAGAAN PLANLET SAGU
(Metroxylon sagu Rottb.) PADA MEDIUM DENGAN BERBAGAI SUMBER KARBOHIDRAT DAN INTENSITAS CAHAYA YANG BERBEDA
WIRDHATUL MUSLIHATIN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Biologi Tumbuhan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb.) pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yang Berbeda
Nama : Wirdhatul Muslihatin N I M : G353070061
Disetujui
Komisi Pembimbing
Dr. Ir. Diah Ratnadewi Ir. Sumaryono, M.Sc Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pascasarjana IPB Biologi Tumbuhan
Dr. Ir. Miftahudin, M.Si Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Alhamdulillah, puji dan syukur penulis sampaikan kepada Allah SWT atas segala karunia NYA sehingga penulis dapat menyelesaikan penelitian dan penyusunan tesis. Penulis menyampaikan terima kasih dan penghargaan yang tinggi kepada semua pihak yang telah membantu dalam penyelesaian penelitian dan penyusunan tesis ini yaitu,
1. Dr. Ir. Diah Ratnadewi selaku ketua komisi pembimbing atas waktu, kesabaran, ilmu dan kemudahan yang telah diberikan selama memberikan bimbingan.
2. Ir. Sumaryono, M. Sc selaku anggota komisi pembimbing sekaligus kepala Laboratorium Biak Sel dan Mikropropagasi, Balai Penelitian Perkebunan Indonesia atas waktu, kesabaran, ilmu dan kemudahan selama penelitian sampai tersusunnya tesis ini.
3. Dr. Ir. Ence Darmo Jaya Supena, M. Si selaku penguji luar komisi atas ilmu dan saran yang telah diberikan untuk kesempurnaan tesis ini.
4. Ketua program studi, seluruh dosen dan karyawan biologi tumbuhan atas ilmu, bantuan dan kerjasamanya sehingga penelitian dan penyusunan tesis ini berjalan lancar.
5. Seluruh peneliti, teknisi dan pembantu teknisi Laboratorium Biak Sel dan Mikropropagasi, Balai Penelitian Perkebunan Indonesia atas semua bantuan, kerjasama dan kemudahan yang telah diberikan selama penelitian dan penyusunan tesis ini.
6. Program Riset Insentif Terapan Kementerian Negara Riset dan Teknologi atas nama Ir. Sumaryono, M.Sc yang telah mendanai penelitian ini sampai selesai.
7. Drs. Bachsis Aminullah M.Pd, Indah Ermawati, S.Pd, Adkhiatul Muslihatin dan Fahmi Iskandar Aminullah, atas nasehat, kepercayaan, doa dan semangat yang telah diberikan sehingga penulis dapat menyelesaikan penelitian dan penyusunan tesis ini tepat waktu.
8. Rekan-rekan Pascasarjana Biologi IPB tahun 2007 atas kerjasama dan kebersamaannya selama menyelesaikan studi.
9. Seluruh pihak yang telah terlibat dan membantu penelitian dan penyusunan tesis ini.
Penulis berharap semoga tesis ini bermanfaat khususnya untuk perkembangan sagu di Indonesia.
Bogor, 17 Juli 2009
PERTUMBUHAN DAN KERAGAAN PLANLET SAGU
(Metroxylon sagu Rottb.) PADA MEDIUM DENGAN BERBAGAI SUMBER KARBOHIDRAT DAN INTENSITAS CAHAYA YANG BERBEDA
WIRDHATUL MUSLIHATIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb.) pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yang Berbeda adalah karya saya dengan arahan dari komisi pembimbing yang belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 17 Juli 2009
ABSTRACT
WIRDHATUL MUSLIHATIN. Growth and Performance of Plantlets of Sago (Metroxylon sagu Rottb.) on Medium with Different Sources of Carbohydrate and Different Levels of Light Intensity. Under direction of DIAH RATNADEWI and SUMARYONO.
Plantlets of sago derived from somatic embryos usually are weak with few leaves and roots, resulted in a low survival rate during plantlet acclimatization. Essential factors for vigorous plantlets are carbohydrate and light intensity. Carbohydrate is added into a culture medium as energy source and osmotic agent. Light intensity influences plant growth and development because it is directly related to photosynthesis and morphogenic process. Research was conducted to determine a suitable carbohydrate and light intensity for plantlets growth in order to produce vigorous plantlets of sago. The basal medium used was modified MMS (Murashige & Skoog) medium with a half strength salts. The first experiment was the application of different types of carbohydrate (sucrose, maltose, glucose, and fructose) at various concentrations (30, 45, and 60 g/L) into the medium. A single 1-2 cm plantlet was cultured on a culture tube. Each treatment consisted of 15 plantlets. In the second experiment, plantlets were cultured on the basal medium with sucrose 30 g/L. The cultures were incubated in a light room culture with different light intensities (10, 20, 30, and 40 µmol/m2/sec). Parameters observed were plantlet height, leaf number, leaf color, stem diameter, biomass fresh weight and rooting percentage. Relative growth rate (RGR) of plantlet height and leaf number was also calculated. Histology of leaf, leaf sheath and root was conducted according to modified Nakamura method. Leaf stomata density was observed using whole mount preparatory. The results show that different types and concentrations of carbohydrate influenced sago plantlet growth. Medium with sucrose 30 g/L gave the best growth of sago plantlet based on RGR plantlet height, RGR leaf number, biomass fresh weight, stem diameter, and rooting percentage. However, the greenest leaf color was found on a medium added with glucose 60 g/L. Light intensity did not affect plantlet growth and performance except stem diameter. Higher density and smaller size of stomata was observed on leaf of non vigorous plantlets than those of vigorous plantlets. Anatomy of leaf sheath of vigorous and non vigorous plantlets reveals different patterns, where shoot apical meristem (SAM) was found in vigorous plantlets. It can be concluded that plantlets of sago palm cultured on a medium added with sucrose 30 g/L under light intensity of 10 µmol/m2/sec grew better than on medium with other carbohydrate sources and light intensities.
RINGKASAN
WIRDHATUL MUSLIHATIN. Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb.) pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yang Berbeda. Dibimbing oleh DIAH RATNADEWI dan SUMARYONO.
Sagu merupakan tanaman asli Indonesia yang memiliki potensi sebagai sumber bahan pangan dan industri. Kebutuhan dan permintaan sagu semakin besar sehingga perlu dilakukan peningkatan produksi. Pertumbuhan populasi sagu secara alami dikhawatirkan tidak mampu mengimbangi laju penebangan untuk memenuhi kebutuhan. Salah satu cara untuk menghasilkan bahan tanam yang seragam dengan jumlah besar dalam waktu yang relatif singkat adalah dengan teknik kultur jaringan atau kultur in vitro. Planlet sagu hasil kultur in vitro pada umumnya masih sangat lemah dengan jumlah daun dan akar yang sedikit. Hal ini menyebabkan pertumbuhan dan daya hidup bibit saat aklimatisasi sangat rendah. Komposisi medium kultur dan intensitas cahaya merupakan penentu utama bagi pertumbuhan tanaman in vitro. Karbohidrat merupakan komponen yang sangat penting untuk pertumbuhan dan perkembangan tanaman in vitro yang terjadi pada kondisi yang tidak cocok untuk fotosintesis atau tanpa fotosintesis. Intensitas cahaya juga mempengaruhi keberhasilan kultur in vitro. Selain berperan dalam proses fotosintesis planlet, cahaya mempengaruhi perkembangan dan pertumbuhan atau morfogenesis tanaman. Modifikasi jenis dan komposisi medium serta faktor lingkungan seperti intensitas cahaya merupakan cara-cara yang dapat dilakukan untuk menghasilkan planlet yang vigor.
Tujuan dari penelitian ini adalah 1) mendapatkan jenis dan konsentrasi karbohidrat yang tepat untuk menghasilkan planlet sagu yang vigor; 2) mendapatkan intensitas cahaya yang sesuai untuk menghasilkan planlet sagu yang vigor dan 3) membandingkan kerapatan stomata, anatomi daun, pelepah dan akar planlet sagu yang vigor dan tidak vigor hasil kultur in vitro. Informasi yang diperoleh diharapkan mampu meningkatkan produksi bibit unggul sagu Indonesia secara klonal.
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Data yang dihasilkan dianalisis dengan General Linear Model (GLM) 2 faktor yaitu jenis dan konsentrasi karbohidrat, dilanjutkan dengan uji Duncan pada taraf kepercayaan 95% menggunakan program SAS ver 9.1.
Hasil penelitian ini menunjukkan bahwa jenis dan konsentrasi karbohidrat berpengaruh nyata terhadap pertumbuhan dan keragaan planlet sagu. Medium dengan sukrosa 30 g/L memberikan pengaruh terbaik terhadap pertumbuhan planlet sagu berdasarkan parameter tinggi, jumlah daun, diameter, bobot basah dan persentase perakaran kecuali warna daun. Dalam penelitian ini perbedaan intensitas cahaya yang diberikan tidak berpengaruh nyata terhadap pertumbuhan dan keragaan planlet sagu kecuali pada diameter planlet. Intensitas cahaya 10 µmol/m2/detik menghasilkan planlet vigor lebih banyak daripada intensitas cahaya yang lebih tinggi.
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa planlet sagu yang dikultur pada media yang mengandung sukrosa 30 g/L dan intensitas cahaya 10 µmol/m2/detik menghasilkan planlet yang lebih vigor. Kerapatan stomata planlet tidak vigor lebih tinggi dengan ukuran stomata lebih kecil daripada planlet vigor. Secara anatomi tidak terdapat perbedaan antara daun dan akar planlet sagu vigor dan tidak vigor, namun pelepah planlet sagu vigor dan tidak vigor menunjukkan perbedaan secara histologi. meristem apikal pucuk (SAM) ditemukan pada planlet sagu vigor.
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PERTUMBUHAN DAN KERAGAAN PLANLET SAGU
(Metroxylon sagu Rottb.) PADA MEDIUM DENGAN BERBAGAI SUMBER KARBOHIDRAT DAN INTENSITAS CAHAYA YANG BERBEDA
WIRDHATUL MUSLIHATIN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Biologi Tumbuhan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb.) pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yang Berbeda
Nama : Wirdhatul Muslihatin N I M : G353070061
Disetujui
Komisi Pembimbing
Dr. Ir. Diah Ratnadewi Ir. Sumaryono, M.Sc Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pascasarjana IPB Biologi Tumbuhan
Dr. Ir. Miftahudin, M.Si Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Alhamdulillah, puji dan syukur penulis sampaikan kepada Allah SWT atas segala karunia NYA sehingga penulis dapat menyelesaikan penelitian dan penyusunan tesis. Penulis menyampaikan terima kasih dan penghargaan yang tinggi kepada semua pihak yang telah membantu dalam penyelesaian penelitian dan penyusunan tesis ini yaitu,
1. Dr. Ir. Diah Ratnadewi selaku ketua komisi pembimbing atas waktu, kesabaran, ilmu dan kemudahan yang telah diberikan selama memberikan bimbingan.
2. Ir. Sumaryono, M. Sc selaku anggota komisi pembimbing sekaligus kepala Laboratorium Biak Sel dan Mikropropagasi, Balai Penelitian Perkebunan Indonesia atas waktu, kesabaran, ilmu dan kemudahan selama penelitian sampai tersusunnya tesis ini.
3. Dr. Ir. Ence Darmo Jaya Supena, M. Si selaku penguji luar komisi atas ilmu dan saran yang telah diberikan untuk kesempurnaan tesis ini.
4. Ketua program studi, seluruh dosen dan karyawan biologi tumbuhan atas ilmu, bantuan dan kerjasamanya sehingga penelitian dan penyusunan tesis ini berjalan lancar.
5. Seluruh peneliti, teknisi dan pembantu teknisi Laboratorium Biak Sel dan Mikropropagasi, Balai Penelitian Perkebunan Indonesia atas semua bantuan, kerjasama dan kemudahan yang telah diberikan selama penelitian dan penyusunan tesis ini.
6. Program Riset Insentif Terapan Kementerian Negara Riset dan Teknologi atas nama Ir. Sumaryono, M.Sc yang telah mendanai penelitian ini sampai selesai.
7. Drs. Bachsis Aminullah M.Pd, Indah Ermawati, S.Pd, Adkhiatul Muslihatin dan Fahmi Iskandar Aminullah, atas nasehat, kepercayaan, doa dan semangat yang telah diberikan sehingga penulis dapat menyelesaikan penelitian dan penyusunan tesis ini tepat waktu.
8. Rekan-rekan Pascasarjana Biologi IPB tahun 2007 atas kerjasama dan kebersamaannya selama menyelesaikan studi.
9. Seluruh pihak yang telah terlibat dan membantu penelitian dan penyusunan tesis ini.
Penulis berharap semoga tesis ini bermanfaat khususnya untuk perkembangan sagu di Indonesia.
Bogor, 17 Juli 2009
RIWAYAT HIDUP
Penulis dilahirkan di Situbondo, Jawa Timur 20 Juni 1984, sebagai anak pertama dari tiga bersaudara pasangan Drs. Bachsis Aminullah M. Pd dengan Indah Ermawati, S. Pd.
DAFTAR ISI
Halaman DAFTAR TABEL ... viii DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x PENDAHULUAN
Latar Belakang ... 1 Permasalahan ……….………. …….. 3 Tujuan Penelitian ... 3
Manfaat Penelitian………... 3 TINJAUAN PUSTAKA
Taksonomi dan Morfologi Sagu ... 4 Habitat Sagu ... 5
Pertumbuhan dan Siklus Hidup Sagu ... 6 Potensi dan Manfaat Sagu ... 8 Kultur In vitro Sagu. ... 9 Peranan Karbohidrat dalam Kultur In vitro ... 10 Intensitas Cahaya dalam Kultur In vitro. ... 11 METODE PENELITIAN
Waktu dan Tempat Penelitian ... 13 Bahan Tanam dan Medium ... 13 Perlakuan Karbohidrat ... 13
Perlakuan Intensitas Cahaya ... 13 Parameter Pertumbuhan Planlet Sagu ... 14 Kerapatan Stomata ... 14
Anatomi Daun, Pelepah dan Akar ... 15 Rancangan Penelitian dan Analisis Statistik. ... 15 Hipotesis Penelitian ... 16 HASIL DAN PEMBAHASAN
Pengaruh Jenis dan Konsentrasi Karbohidrat terhadap Pertumbuhan Planlet Sagu
Pertumbuhan Tinggi Planlet . ... 17 LPR untuk Tinggi Planlet... 19 LPR untuk Jumlah Daun Planlet ... 20 Warna Daun Planlet ... 21 Bobot Basah Planlet ... 23 Diameter Planlet. ... 23
Pengaruh Intensitas Cahaya terhadap Pertumbuhan Planlet Sagu
Pertumbuhan Tinggi Planlet . ... 26 LPR untuk Tinggi dan Jumlah Daun Planlet... 27 Warna Daun Planlet ... 28 Bobot Basah, Diameter, dan Persentase Perakaran Planlet... 28 Struktur, Kerapatan dan Ukuran Stomata Daun Planlet Sagu
Vigor dan Tidak Vigor ... 29 Struktur Anatomi Daun, Pelepah dan Akar Planlet Sagu
Vigor dan Tidak Vigor ... 32
Perlakuan Karbohidrat... .31 Perlakuan Intensitas Cahaya ... 34
Pembahasan Umum ... 35 SIMPULAN DAN SARAN
DAFTAR TABEL
Halaman
1 Pengaruh jenis dan konsentrasi karbohidrat terhadap
bobot basah planlet sagu (g)...23 2 Pengaruh jenis dan konsentrasi karbohidrat terhadap
diameter planlet sagu (mm)...24 3 Pengaruh jenis dan konsentrasi karbohidrat terhadap
persentase perakaran planlet sagu (%)...25 4 Pengaruh intensitas cahaya terhadap LPR untuk tinggi dan
jumlah daun planlet sagu...27 5 Pengaruh intensitas cahaya terhadap bobot basah, diameter
DAFTAR GAMBAR
Halaman 1 Populasi sagu di alam ... 5
2 Skema pola tumbuh sagu membentuk rumpun . ... 6
3 Siklus hidup sagu ... 7
4 Kurva pertumbuhan planlet sagu pada berbagai jenis karbohidrat ... 17
5 Kurva pertumbuhan planlet sagu pada berbagai konsentrasi karbohidrat ... 18
6 Pengaruh jenis dan konsentrasi karbohidrat terhadap LPR untuk tinggi ... planlet sagu ... 20
7 Pengaruh jenis dan konsentrasi karbohidrat terhadap LPR untuk jumlah ... daun planlet sagu ... 21
8 Pengaruh jenis dan konsentrasi karbohidrat terhadap warna daun ... planlet sagu. ... 22
9 Kurva pertumbuhan planlet sagu pada berbagai intensitas cahaya. ... 26
10 Pengaruh intensitas cahaya terhadap warna daun planlet sagu ... 28
11 Susunan dan struktur stomata daun planlet sagu ... 30
12 Kerapatan stomata daun planlet sagu ... 30
13 Sayatan melintang daun planlet sagu ... 32
14 Sayatan melintang akar planlet sagu ... 33
15 Sayatan melintang pelepah planlet sagu perlakuan karbohidrat ... 34
DAFTAR LAMPIRAN
Halaman
1 Komposisi dehidran metode paraplas...45
2 Metode pewarnaan ganda safranin 2% dan
fast green
1%...46
3 Analisis sidik ragam pengaruh jenis dan konsentrasi karbohidrat...47
4 Analisis sidik ragam pengaruh intensitas cahaya...49
PENDAHULUAN
Latar Belakang
Sagu (Metroxylon sagu Rottb.) merupakan tumbuhan asli Indonesia yang diperkirakan berasal dari daerah Sentani Papua, karena keragaman plasma nutfah sagu di daerah tersebut paling tinggi. Daerah sebaran sagu meliputi wilayah tropika basah Asia Tenggara dan Oceania. Sagu tumbuh terutama di daerah rawa, payau atau daerah yang sering tergenang air. Indonesia memiliki areal sagu yang cukup luas. Areal sagu terluas terdapat di Papua yakni 1,2 juta hektar dan Papua Nugini seluas 1,0 juta hektar yang merupakan 90% dari total areal sagu dunia (Flach 1997). Dengan luasnya areal sagu, Indonesia memiliki kesempatan besar untuk mengembangkan komoditas ini. Namun, sampai saat ini perkembangan sagu Indonesia masih dalam tahap pengolahan secara tradisional menjadi bahan pangan dengan bahan baku bergantung hasil alam.
Sagu memiliki potensi sebagai sumber bahan pangan dan non pangan Semua bagian tumbuhan yaitu daun, batang dan pelepah dapat dimanfaatkan. Sagu sebagai bahan pangan dimanfaatkan sebagian besar dalam bentuk aci sagu yang dapat diolah menjadi berbagai jenis makanan seperti mie, roti dan sirup. Pemanfaatan sagu sebagai bahan non pangan yaitu bioetanol, biodegradable plastic, bahan perekat, briket, bahan bangunan dan lainnya. Kandungan sagu yang
paling banyak dimanfaatkan adalah karbohidrat yang terdapat dalam batang. Sagu merupakan tananaman penghasil karbohidrat yang memiliki produktivitas tinggi. Kandungan karbohidrat sagu dapat mencapai 700 kg pati basah per batang yang berumur 10-11 tahun atau 15-25 ton pati kering per hektar per tahun (Flach 1997). Kandungan karbohidrat sagu lebih tinggi daripada beras (Djoefrie 1999). Aci sagu mengandung amilosa 27% dan amilopektin 73% (Flach 1997).
Sagu merupakan tumbuhan Palmae tahunan yang umumnya diperbanyak secara vegetatif dengan tunas anakan yang tumbuh di sekitar batang utama (induk). Perbanyakan sagu dapat dilakukan secara generatif yaitu dengan biji. Namun perbanyakan dengan biji jarang terjadi karena pada umumnya sagu dipanen sebelum masa reproduktif. Persediaan tunas anakan yang seragam merupakan hambatan utama dalam pembukaan perkebunan sagu (Jong 1995).
Salah satu cara untuk memproduksi bahan tanam yang seragam dengan jumlah besar dalam waktu yang relatif singkat adalah dengan teknik kultur jaringan atau kultur in vitro. Teknik in vitro sagu yang telah dilakukan adalah melalui embriogenesis somatik. Embriogenesis somatik merupakan salah satu aplikasi penting dalam propagasi tumbuhan secara vegetatif dalam skala besar. Penelitian kultur in vitro sagu secara bertahap dan berkelanjutan telah dilakukan. Tahardi et al. (2002) berhasil mendapatkan embriogenesis somatik sagu menggunakan eksplan berupa jaringan muda dari tunas apikal anakan.
Riyadi et al. (2005) telah menemukan komposisi medium untuk induksi embrio somatik, pendewasaan embrio dan pembentukan planlet. Dalam fase perkembangan embrio somatik sagu menunjukkan keragaman morfologi, meliputi bentuk, ukuran dan warna (Kasi & Sumaryono 2006). Keragaman morfologi embrio somatik yang tinggi dapat menghambat propagasi tumbuhan secara in vitro dalam jumlah besar (Riyadi et al. 2005). Komposisi medium kultur
merupakan penentu utama untuk pertumbuhan tumbuhan in vitro. Garam mineral dan karbohidrat sebagai sumber karbon merupakan komponen utama dalam medium kultur in vitro (Gamborg & Phillips 1995).
3
Cahaya dapat mendorong pembentukan dan pertumbuhan tunas selain berperan dalam membantu proses fotosintesis planlet. Modifikasi jenis dan komposisi medium serta faktor lingkungan seperti intensitas cahaya merupakan cara-cara yang perlu dilakukan untuk menghasilkan planlet yang vigor.
Permasalahan
Planlet sagu hasil kultur in vitro sagu pada umumnya masih sangat lemah dengan jumlah daun dan akar yang sedikit. Hal ini menyebabkan daya hidup bibit sagu saat aklimatisasi sangat rendah.
Tujuan Penelitian Tujuan dari penelitian ini adalah
1. mendapatkan jenis dan konsentrasi karbohidrat yang tepat untuk menghasilkan planlet sagu yang vigor.
2. mendapatkan intensitas cahaya yang sesuai untuk menghasilkan planlet sagu yang vigor.
3. membandingkan kerapatan stomata, anatomi daun, pelepah dan akar planlet sagu yang vigor dan tidak vigor.
Manfaat Penelitian
TINJAUAN PUSTAKA
Taksonomi dan Morfologi Sagu
Sagu merupakan tumbuhan Palmae asli Indonesia yang diduga berasal dari sekitar daerah Sentani Papua. Sagu dikenal hampir oleh seluruh masyarakat Indonesia, tetapi nama atau sebutannya berbeda di setiap daerah. Sagu dikenal dengan nama rumpia di Minangkabau; kirai di Jawa Barat; bulung, rembulu, ambulung atau kresula di Jawa Tengah; lapia atau nampia di Ambon; bak sagee
di Aceh dan sebutan lainnya (Haryanto & Pangloli 1992).
Nama Metroxylon berasal dari bahasa Yunani yang terdiri dari dua kata yaitu metra dan xylon. Metra berarti isi batang atau empulur dan xylon berarti xilem (Flach 1997). Sagu dari genus Metroxylon terbagi menjadi dua yaitu tumbuhan yang berbuah atau berbunga dua kali (pleonanthic) dan tumbuhan yang berbunga atau berbuah hanya sekali (hepaxanthic). Hepaxanthic memiliki nilai ekonomis penting karena kandungan karbohidratnya lebih banyak daripada pleonanthic. Metroxylon sagu Rottb atau dikenal dengan sagu Tuni tergolong
dalam hepaxanthic (Haryanto & Pangloli 1992).
Metroxylon sagu Rottb banyak ditemui di Sumatra, Jawa, Kalimantan,
Sulawesi, Maluku dan Papua dengan ciri-ciri: tinggi batang sekitar 10-14 meter, berbentuk silinder dengan diameter 40-60 cm atau bahkan 80 cm dan bobot batang mencapai 1,2 ton atau lebih. Ukuran batang sagu sebenarnya berbeda-beda tergantung dari jenis, umur dan lingkungan atau tempat tumbuhnya. Umumnya diameter batang bagian bawah lebih besar daripada bagian atas. Batang sagu terdiri dari lapisan kulit bagian luar yang keras dan bagian dalam mengandung empulur yang berserat. Tebal kulit luar yang keras sekitar 3-5 cm. Lapisan kulit paling luar berupa lapisan sisa-sisa daun dari sebagian pelepah daun yang terlepas (Haryanto & Pangloli 1992; Flach 1997).
5
[image:31.612.196.482.137.293.2]menjadi coklat kemerah-merahan apabila sudah matang atau tua (Gambar 1) (Haryanto & Pangloli 1992; Flach 1997).
Gambar 1 Populasi sagu di alam (Sumaryono 2007)
Bunga sagu merupakan bunga majemuk yang keluar dari ujung atau pucuk sagu berwarna merah kecoklatan. Bunga sagu bercabang banyak, terdiri dari cabang primer, sekunder dan tersier. Pada cabang tersier terdapat sepasang bunga jantan dan betina. Bunga jantan mengeluarkan tepung sari sebelum bunga betina terbuka. Putik pada bunga betina mengandung tiga sel induk telur tetapi hanya satu yang dapat berkecambah dan dua lainnya bersifat rudimenter (Haryanto & Pangloli 1992; Flach 1997).
Habitat Sagu
Sagu memiliki daya adaptasi yang tinggi pada lahan marginal dan kritis yang tidak memungkinkan pertumbuhan optimal bagi tumbuhan pangan dan perkebunan lain (Suryana 2007). Sagu banyak dijumpai di daerah-daerah dataran rendah dengan ketinggian 0-700 m di atas permukaan air laut, suhu di atas 25 °C dan kelembaban udara lebih dari 70%. Sagu tumbuh di daerah rawa berair tawar atau daerah bergambut, di sepanjang aliran sungai atau daerah tropis basah yang banyak digenangi air (Flach 1997).
Habitat tersebut cocok untuk pertumbuhan mikroorganisme yang sangat berguna bagi pertumbuhan sagu. Selain itu pertumbuhan sagu dipengaruhi oleh adanya unsur hara yang disuplai oleh air tawar terutama unsur kalium, fosfat, kalsium dan magnesium (Haryanto & Pangloli 1992). Di beberapa daerah Melanesia, penduduk menanam sagu di tanah rawa, aluvial dan gambut tanpa drainase dan pengolahan tanah terlebih dahulu (Ehara et al. 2007). Namun berdasarkan penelitian Yamamoto et al. (2003b), sagu dapat tumbuh dengan baik di tanah gambut yang memiliki karakteristik tanah ber pH rendah, tergenang air sepanjang tahun dan miskin hara mineral.
Pertumbuhan dan Siklus Hidup Sagu
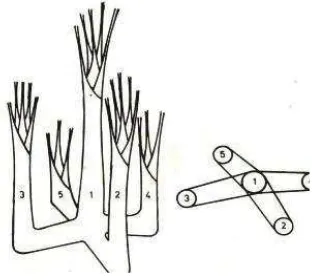
[image:32.612.259.415.516.656.2]Sagu adalah tumbuhan tahunan yang dapat berkembang biak atau dikembangbiakkan dengan tunas anakan dan biji. Tunas anakan muncul pada pangkal batang induk dan mulai membentuk batang pada umur 3 tahun. Anakan sagu memperoleh nutrisi dari batang induk sampai akar-akarnya mampu untuk menyerap unsur hara sendiri dan daunnya mampu melakukan fotosintesis (Flach 1997). Dalam setiap rumpun sagu terdiri dari beberapa tingkat pertumbuhan yaitu: 1) tingkat semai atau anakan berukuran 0-0,5 m; 2) tingkat sapih (apling) berukuran 0,5-1,5 m; 3) tingkat tiang (pole) berukuran 1,5-5 dan 4) tingkat pohon berukuran di atas 5 m (Gambar 2). Penggolongan tingkat pertumbuhan sagu didasarkan pada tinggi batang sagu tanpa daun atau pelepah (BPP Teknologi 1982, diacu dalam Haryanto & Pangloli 1992).
7
Gambar 3 Siklus hidup sagu (Flach 1997).
Sagu memiliki siklus hidup dengan waktu relatif panjang yaitu sekitar 11-12 tahun. Sagu tumbuh dan berkembang dalam beberapa tahap atau fase (Gambar 3). Tahap awal, tumbuhan membentuk roset daun (rossette stage), belum membentuk batang dan daun melebar (Flach 1997). Tinggi rata rata tumbuhan 6,7-8,5 meter dengan umur tumbuhan sekitar 2-6 tahun. Rata-rata jumlah daun pada tahap ini adalah 5,5 dan 6,7 (Ando et al. 2007). Daun sagu memiliki jumlah stomata sekitar 1000 stomata per mm2 luas daun sehingga sagu memiliki kemampuan fotosintesis yang tinggi. Tumbuhan sagu memfiksasi CO2 secara terus menerus dalam siklus hidupnya dengan jumlah besar dan menghasilkan karbohidrat yang akan diubah dan disimpan dalam bentuk pati di batang sagu (Jong 2006).
1
Tahap kedua, tumbuhan membentuk batang (bole formation stage) dan daun terus tumbuh di pucuk batang. Kandungan karbohidrat pada batang sangat tinggi sehingga batang ditebang untuk dimanfaatkan dan diolah menjadi aci sagu (Flach 1997). Proses akumulasi karbohidrat pada empulur sagu dimulai dari bawah ke atas, bagian pusat ke tepi empulur atau secara longitudinal dan radial pada batang (Yamamoto et al. 2003a). Bobot kulit batang sagu berkisar 17-25% sedangkan bobot empulurnya 75-83%. Kandungan empulur batang sagu berbeda-beda tergantung pada umur, jenis dan lingkungan tempat tumbuh. Makin tua umur tumbuhan sagu kandungan pati dalam empulur makin besar dan pada umur tertentu kandungan aci akan menurun. Peningkatan kadar pati terjadi sampai fase pembentukan primordia bunga. Setelah lewat fase primordia kandungan pati mulai menurun karena dipergunakan sebagai energi untuk proses pembentukan bunga dan buah. Setelah pembungaan dan pembentukan buah, batang akan menjadi gabug atau kosong kemudian sagu akan mati (Haryanto & Pangloli 1992).
Tahap ketiga, tumbuhan mengalami pembungaan (inflorescence stage). Munculnya bunga menandakan bahwa sagu mendekati akhir fase pertumbuhannya. Fase ini di dahului dengan munculnya daun bendera yang berukuran lebih pendek dari daun yang lain dan tahap keempat adalah pematangan buah (fruit ripening stage) yang merupakan masa akhir pertumbuhannya (Flach 1997).
Potensi dan Manfaat Sagu
9
amilopektin 73%. Kandungan kalori, karbohidrat, protein dan lemak sagu setara dengan tepung tumbuhan penghasil karbohidrat lainnya (Tarigans 2001).
Hampir seluruh bagian tumbuhan sagu telah dimanfaatkan untuk bahan non pangan secara tradisional oleh masyarakat. Pelepah pohon dimanfaatkan sebagai dinding dan pagar rumah, daun sebagai atap, kulit dan batang digunakan sebagai kayu bakar, serat sagu dimanfaatkan sebagai hardboard atau briket bangunan bila dicampur semen. Selain itu, aci sagu diolah menjadi perekat atau lem, bahan bakar atau bioetanol dan lain sebagainya (Prihatman 2000).
Kandungan karbohidrat sagu lebih tinggi daripada tumbuhan penghasil karbohidrat lainnya. Karena kandungan karbohidratnya, sagu dimanfaatkan sebagai bahan pangan utama oleh masyarakat di beberapa daerah, misalnya Papua dan Maluku. Pemanfaatan aci sagu dalam industri makanan sangat luas. Sagu dapat diolah menjadi sirup, campuran penyedap rasa, biskuit, cracker dan makanan pelengkap seperti kerupuk dan jajanan tradisional lainnya, seperti papeda, soun dan ongol-ongol. Sebagian besar jenis makanan yang berbahan baku sagu berasal dari wilayah Indonesia bagian Timur seperti Maluku dan Papua (Tarigans 2001). Sagu merupakan tumbuhan penghasil karbohidrat yang perlu diperhatikan dalam rangka diversifikasi pangan (Djoefrie 1999).
Kultur In vitro Sagu
Kemampuan satu sel tumbuhan menjadi tumbuhan yang lengkap atau totipotensi dapat dimanfaatkan untuk melakukan regenerasi tumbuhan secara in vitro dari sumber yang berupa protoplas, sel, jaringan maupun organ. Secara
umum sumber yang digunakan dalam perbanyakan mikro (micropropagation) untuk menghasilkan planlet yaitu meristem, apeks dan nodus. Eksplan dapat ditumbuhkan sebagai kalus yang selanjutnya diinduksi sehingga terbentuk tunas adventif atau embrio somatik (Yuwono 2006).
tersebut membuktikan bahwa embrio berkembang menjadi planlet pada medium kultur dengan setengah unsur hara makro tanpa penambahan zat pengatur tumbuh. Kasi dan Sumaryono (2006) mengamati bahwa ukuran embrio tidak berubah secara signifikan selama masa kultur. Jumlah embrio meningkat tetapi komposisi warna embrio mengalami perubahan selama masa kultur. Dalam penelitian selanjutnya, embrio berhasil berkembang menjadi kotiledon dan beberapa menjadi kecambah (Kasi & Sumaryono 2007).
Peranan Karbohidrat dalam Kultur In Vitro
Medium kultur in vitro dapat berupa medium padat atau cair. Medium yang digunakan mengandung lima komponen utama yaitu senyawa anorganik, sumber karbon yaitu karbohidrat, vitamin, zat pengatur tumbuh dan suplemen organik. Karbohidrat yang digunakan dapat berupa glukosa, fruktosa, maltosa atau sukrosa. Sumber karbon yang umum digunakan dalam kultur in vitro tumbuhan adalah sukrosa (Pierik 1997; Yuwono 2007).
Karbohidrat memberikan pengaruh yang berbeda terhadap tingkat dan jenis diferensiasi dan morfologi dalam kultur in vitro. Ketersediaan karbohidrat dalam medium tidak hanya berperan sebagai sumber karbon dan energi tetapi juga sebagai osmoregulator (osmotic agent) selama organogenesis (Huang & Liu 2002). Karbohidrat bersama dengan protein, lipid dan asam nukleat merupakan bahan pembangun dasar sel organisme, karbohidrat dimetabolismekan melalui respirasi selular. Selain itu karbohidrat juga berperan dalam mengatur ekspresi gen tumbuhan dan hubungannya dengan metabolisme serta perkembangan (Koch 1996). Ketersediaan karbohidrat yang terus menerus sangat penting dalam kultur in vitro tumbuhan karena aktivitas fotosintesis tumbuhan kultur in vitro sangat
rendah sebagai akibat dari intensitas cahaya rendah, kelembaban tinggi dan terbatasnya pertukaran gas (Kozai & Kobuta 2005b).
11
energi. Di dalam sel tumbuhan fruktosa dan glukosa dapat dengan mudah diubah menjadi sukrosa melalui reaksi enzimatis dalam sitoplasma (Wang 2006).
Maltosa dan sukrosa tergolong dalam disakarida yang memiliki 2 unit enam atom karbon (Dwidjoseputro 1984). Sukrosa sering ditambahkan pada medium kultur in vitro sebagai sumber karbon atau energi. Penggunaan sukrosa di atas 3% menyebabkan terjadinya penebalan dinding sel. Pemilihan karbohidrat dan konsentrasi tergantung dari jaringan tumbuhan yang akan dikulturkan dan tujuan yang ingin dicapai (Hendaryono & Ari 1994; Dodds & Lorin 1995). Organogenesis dalam kultur in vitro dipengaruhi oleh kandungan karbohidrat media. Organogenesis akan terjadi secara optimal seiring dengan ketersediaan karbohidrat yang optimal dan cahaya hanya sebagai regulator (George 1993). Inisiasi akar dan pertumbuhan membutuhkan sumber karbon yang besar (Al-Khateeb 2001).
Intensitas Cahaya dalam Kultur In Vitro
Cahaya didefinisikan sebagai radiasi elektromagnetik yang dapat dilihat oleh mata manusia dengan panjang gelombang 380-780 nm. Cahaya didefinisikan sebagai radiasi elektromagnetik yang menyebabkan reaksi fotokimia pada tumbuhan yaitu fotosintesis dan fotomorfogenesis yang meliputi, perkecambahan, inisiasi akar dan pucuk, perpanjangan batang dan sebagainya. Reaksi fotosintesis pada tumbuhan terjadi karena adanya cahaya dengan panjang gelombang 400-700 nm yang disebut sebagai photosynthetically active radiation (PAR). Cahaya sebagai partikel kecil disebut foton dengan satuan unit µmol/m2/detik (Kozai & Kubota 2005a).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Laboratorium Biak Sel dan Mikropropagasi, Balai Penelitian Bioteknologi Perkebunan Indonesia di Bogor pada bulan Desember 2008 sampai dengan Juni 2009. Penelitian terbagi menjadi dua tahap perlakuan yaitu perlakuan karbohidrat dan intensitas cahaya.
Bahan Tanam dan Medium
Penelitian menggunakan planlet tanpa akar dengan tinggi 1-2 cm yang terbentuk dari kultur embrio somatik. Medium kultur yang digunakan adalah medium padat MS (Murashige & Skoog 1962) yang telah dimodifikasi (MMS) ditambah GA3 0,5 mg/L, IBA 2 mg/L, NAA 3 mg/L, sukrosa 30 g/L, arang aktif 1 g/L dan gelrite 2,8 g/L. Tingkat pH medium diatur menjadi 5,7 sebelum medium diautoklaf pada suhu 121° C dan tekanan 1 kg/cm2 selama 20 menit. Kultur ditempatkan pada ruang bersuhu 27°C, intensitas cahaya 10 µmol/m2/detik dengan periode pencahayaan 14 jam.
Perlakuan Karbohidrat
Perlakuan yang diberikan pada medium tumbuh adalah penggunaan jenis dan konsentrasi karbohidrat yang berbeda. Jenis karbohidrat yang digunakan adalah sukrosa, maltosa, fruktosa, dan glukosa, masing-masing dengan konsentrasi 30, 45 dan 60 g/L. Setiap perlakuan diulang sebanyak 15 kali, 1 ulangan terdiri atas 1 tabung dengan 1 planlet. Komposisi karbohidrat terbaik yang menghasilkan planlet sagu vigor selanjutnya digunakan sebagai medium untuk penelitian intensitas cahaya.
Perlakuan Intensitas Cahaya
Parameter Pertumbuhan Planlet Sagu
Parameter pertumbuhan yang diamati antara lain tinggi planlet, jumlah daun, warna daun, diameter planlet, persentase perakaran, bobot basah, kerapatan stomata, serta anatomi daun, pelepah dan akar planlet. Tinggi planlet, jumlah dan warna daun diamati setiap 2 minggu sampai dengan umur 12 minggu.
Tinggi planlet awal yang digunakan dalam penelitian ini tidak seragam sehingga dilakukan pengukuran Laju Pertumbuhan Relatif (LPR) agar didapatkan nilai pertambahan tinggi yang lebih akurat. LPR menyatakan pertambahan tinggi planlet per tinggi awal per satuan waktu (cm/cm/minggu). LPR dihitung untuk tinggi planlet dan jumlah daun. Nilai LPR tinggi diperoleh dari tinggi akhir dikurangi tinggi awal dibagi tinggi awal dibagi waktu kultur. LPR jumlah daun diperoleh dari jumlah daun akhir dikurangi jumlah daun awal dibagi jumlah daun awal dibagi waktu kultur.
Warna daun diukur berdasarkan bagan warna daun IRRI (International Research Rice Institute) dengan skala 2 (hijau muda) sampai 5 (hijau tua).
Diameter planlet diukur dari 5 mm di atas pangkal planlet pada akhir penelitian.
Kerapatan Stomata
15
Anatomi Daun, Pelepah dan Akar
Irisan anatomis menggunakan metode Nakamura (1995) yang telah dimodifikasi. Sampel daun, pelepah dan akar difiksasi dalam larutan FAA (5 ml formalin 37%, 5 ml asam asetat glasial, 90 ml etil alkohol 50%) selama 24 jam. Selanjutnya direndam dalam larutan dehidran berseri I sampai IV masing-masing selama 1 jam kecuali dehidran terakhir diulang satu kali (Lampiran 1). Setelah itu diinfiltrasi dengan paraplas dan dehidran IV sebanyak 1:1 selama 8 jam pada suhu kamar, lalu dipindahkan ke oven 58ºC semalam. Selanjutnya campuran paraplas dan dehidran VII dibuang dan diganti paraplas murni, infiltrasi dilakukan selama 3 malam dalam oven 58ºC. Berikutnya sampel dalam paraplas dicetak ke dalam wadah khusus. Hasil cetakan (blok) direndam dalam larutan Gifford selama 5 x 24 jam. Larutan gifford mengandung 20 ml asam asetat glasial, 80 ml etanol 60% dan 5 ml gliserin. Selanjutnya blok sampel ditempelkan pada pemegang (holder) mikrotom. Blok sampel diiris melintang dengan ketebalan 10 µm menggunakan mikrotom putar Yamato RV-240. Pita paraplas hasil irisan ditempel pada gelas objek yang telah ditetesi gliserin-albumin (1:1) dan akuades lalu dikeringkan di atas warming tray semalam. Preparat dilalukan pada seri larutan pewarnaan alkohol-xilol. Pewarnaan dilakukan dengan metode pewarna ganda menggunakan safranin 2% dalam aquades selama 3 malam dan fastgreen 1% dalam alkohol selama 2 menit (Lampiran 2). Sebelum diamati, preparat ditetesi entelan lalu ditutup dengan gelas penutup. Preparat daun, pelepah dan akar diamati menggunakan mikroskop cahaya dengan pembesaran 100x dan 400x.
Rancangan Penelitian dan Analisis Statistik
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL). Data yang dihasilkan dianalisis dengan General Linear Model (GLM). Percobaan dengan perlakuan karbohidrat menggunakan 2 faktor yaitu jenis dan konsentrasi karbohidrat dan percobaan intensitas cahaya dengan satu faktor. Bila terdapat data yang berbeda nyata maka dilanjutkan dengan uji Duncan Multiple Range Test (DMRT) pada taraf kepercayaan 95% menggunakan program SAS ver
Hipotesis Penelitian
Hipotesis yang diuji dalam penelitian sumber karbohidrat adalah:
1. pengaruh jenis karbohidrat terhadap pertumbuhan dan keragaan planlet sagu.
2. pengaruh konsentrasi karbohidrat terhadap pertumbuhan dan keragaan planlet sagu.
3. pengaruh interaksi jenis dan konsentrasi karbohidrat terhadap pertumbuhan dan keragaan planlet sagu.
HASIL DAN PEMBAHASAN
Pengaruh Jenis dan Konsentrasi Karbohidrat terhadap Pertumbuhan Planlet Sagu
Pertumbuhan Tinggi Planlet
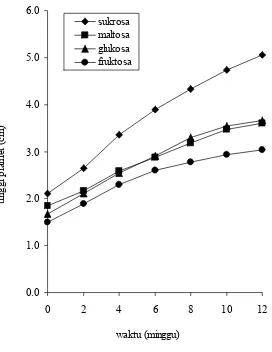
[image:43.612.191.463.315.667.2]Planlet sagu yang dikultur selama 12 minggu menunjukkan pertumbuhan tinggi yang semakin meningkat pada setiap jenis dan konsentrasi karbohidrat. Planlet yang dikultur pada medium mengandung sukrosa memiliki pertumbuhan lebih tinggi mencapai 2,4 kali dari tinggi awal daripada medium dengan jenis karbohidrat lain (Gambar 4).
Gambar 4 Kurva pertumbuhan tinggi planlet sagu pada berbagai jenis karbohidrat. 0.0
1.0 2.0 3.0 4.0 5.0 6.0
0 2 4 6 8 10 12
waktu (minggu)
ti
nggi
pl
anl
et
(
cm
)
Sukrosa merupakan jenis karbohidrat yang umum digunakan sebagai sumber karbon dan energi dalam kultur in vitro. Hal ini dikarenakan sukrosa adalah disakarida yang berperan sebagai molekul transporter yang memiliki kelarutan tinggi dalam air dan efisien dalam melewati membran plasma (Javed & Ikram 2008; Baskaran & Jayabalan 2005).
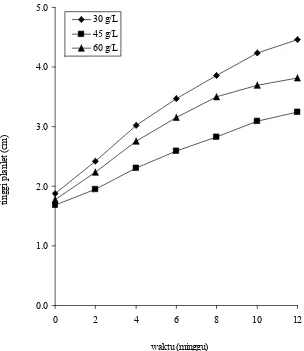
Konsentrasi karbohidrat 30 g/L pada medium menghasilkan pertumbuhan planlet paling tinggi selama masa kultur namun konsentrasi 60 g/L menghasilkan pertumbuhan lebih tinggi daripada 45 g/L. Pertumbuhan tinggi planlet pada medium 30 g/L mencapai 2,4 kali sedangkan 45 g/L menghasilkan pertumbuhan tinggi paling rendah yaitu 1,9 kali dari planlet awal yang digunakan (Gambar 5).
Gambar 5 Kurva pertumbuhan tinggi planlet sagu pada berbagai konsentrasi karbohidrat.
0.0 1.0 2.0 3.0 4.0 5.0
0 2 4 6 8 10 12
waktu (minggu)
ti
nggi
pl
an
le
t (
cm
)
30 g/L
[image:44.612.168.472.299.650.2]19
Pemberian karbohidrat pada medium kultur in vitro diyakini meningkatkan pertumbuhan tumbuhan. Aktivitas fotosintesis tumbuhan kultur in vitro sangat rendah yang disebabkan oleh rendahnya intensitas cahaya, kelembaban nisbi udara tinggi dan kurangnya pertukaran gas sehingga membutuhkan sumber energi yaitu karbohidrat (Kozai et al. 1997). Karbohidrat memberikan pengaruh terhadap induksi batang dan regenarasi tumbuhan (Gubis et al. 2005). Dari hasil penelitian ini diketahui bahwa pertumbuhan planlet terbaik dihasilkan pada medium dengan pemberian sukrosa 30 g/L. Hasil yang sama diperoleh Al- Khateeb (2008) yang menunjukkan bahwa sukrosa 30 g/L memberikan pengaruh pertumbuhan tertinggi pada planlet tumbuhan kurma (Phoenix dactylifera) cv. Khanezi.
LPR untuk Tinggi Planlet
Hasil penelitian ini menunjukkan bahwa jenis dan konsentrasi karbohidrat berpengaruh nyata terhadap LPR tinggi planlet sagu. Medium yang mengandung sukrosa menghasilkan rerata LPR paling tinggi (0,12). Konsentrasi karbohidrat 30 g/L menghasilkan rerata LPR tertinggi (0,12) dibandingkan dengan 45 dan 60 g/L (0,08 dan 0,09). Namun interaksi antara kedua faktor tersebut tidak nyata. LPR tertinggi dan terendah dihasilkan pada medium yang mengandung glukosa 30 g/L (0,13) dan 60 g/L (0.06) (Gambar 6).
Penelitian yang telah dilakukan oleh Yildirim et al (2007) pada kultur aprikot (Prunus armeniaca L ) cv. Hacihaliloglu membuktikan bahwa medium yang mengandung glukosa menghasilkan planlet tertinggi walaupun tidak berbeda nyata dengan medium sukrosa. Penelitian lain membuktikan bahwa medium yang mengandung glukosa 30 g/L menghasilkan LPR planlet tertinggi pada kultur lingonberry (Vaccinium vitis-idaea L) cv Regal (Debnath 2005) dan Eclipta alba
(Baskaran & Jayabalan 2005).
*
b
Gambar 6 Pengaruh jenis dan konsentrasi karbohidrat terhadap LPR untuk tinggi planlet sagu. Jenis karbohidrat yang diikuti dengan huruf yang sama menunjukkan tidak berbeda secara nyata pada taraf 5% dengan uji DMRT.
Walaupun medium yang mengandung glukosa 30 g/L menghasilkan planlet sagu tertinggi tetapi medium yang mengandung sukrosa menghasilkan rerata LPR tertinggi dan terlihat lebih vigor. Hasil yang sama ditunjukkan oleh Gubis et al. (2005), medium yang mengandung sukrosa 30 g/L menghasilkan planlet tomat (Lycopersicon esculentum.) yang lebih sehat dan vigor daripada jenis dan konsentrasi karbohidrat lain.
LPR untuk Jumlah Daun Planlet
Jenis dan interaksi karbohidrat berpengaruh pada LPR jumlah daun planlet sagu. Medium yang mengandung sukrosa menghasilkan rerata LPR lebih besar (0,09) dibandingkan dengan jenis karbohidrat lain. Glukosa dan fruktosa memberikan pengaruh yang sama. LPR tertinggi dan terendah dihasilkan pada medium yang mengandung sukrosa 30 g/L (0,14) dan glukosa 60 g/L (0,02) (Gambar 7).
Hasil penelitian ini menunjukkan bahwa semakin tinggi konsentrasi karbohidrat menyebabkan LPR jumlah daun cenderung semakin rendah.
a b ab ab
0.00 0.05 0.10 0.15 0.20
Sukrosa Maltosa Glukosa Fruktosa
L P R tin g g i p la n le t (c m /c m /m ingg u)
21
Karbohidrat mempengaruhi respon molekuler dan fisiologis. Karbohidrat merupakan sinyal kimia bagi sel yang dalam konsentrasi tinggi menyebabkan stres kimiawi (Steimitz 1999, diacu dalam Tiexeira da Silva 2004).
Gambar 7 Pengaruh jenis dan konsentrasi karbohidrat terhadap LPR untuk jumlah daun planlet sagu. Jenis karbohidrat yang diikuti dengan huruf yang sama menunjukkan tidak berbeda secara nyata pada taraf 5% dengan uji DMRT.
Buah et al. (2000) membuktikan bahwa planlet pisang (Musa spp. cv. Shima) pada medium yang mengandung sukrosa menghasilkan jumlah daun terbanyak dibandingkan pada medium yang mengandung glukosa dan fruktosa. Dari penelitian tersebut juga diketahui bahwa fruktosa pada suhu tinggi dapat membebaskan senyawa racun 5-hydroxymethyl-2-furaldehyde yang mendorong hyperhydrocity dan menyebabkan menurunnya potensial air daun. Hal tersebut
menghambat perluasan dan jumlah daun.
Warna Daun Planlet
Jenis karbohidrat berpengaruh nyata terhadap warna daun planlet sagu namun konsentrasi dan interaksi antar kedua faktor tersebut tidak berpengaruh. Medium yang mengandung sukrosa menghasilkan planlet yang daunnya lebih hijau muda dibandingkan dengan jenis karbohidrat lain. Walaupun konsentrasi karbohidrat tidak berpengaruh nyata tetapi semakin tinggi konsentrasi karbohidrat
a ab b b
0.00 0.04 0.08 0.12 0.16 0.20
Sukrosa Maltosa Glukosa Fruktosa
LP
R j
u
m
la
h
d
au
n
.
menyebabkan warna daun planlet semakin hijau yang menunjukkan bahwa kandungan klorofil semakin banyak (Gambar 8).
Gambar 8 Pengaruh jenis dan konsentrasi karbohidrat terhadap warna daun planlet sagu. Jenis karbohidrat yang diikuti dengan huruf yang sama menunjukkan tidak berbeda secara nyata pada taraf 5% dengan uji DMRT.
Baskaran & Jayabalan (2005) melaporkan bahwa pemberian sukrosa pada medium menyebabkan klorosis pada daun planlet Eclipta alba dibandingkan dengan medium yang mengandung fruktosa dan glukosa. Penelitian lain membuktikan bahwa sukrosa dapat menghambat aktivitas fotosintesis dan greening pada jaringan. Menurun atau hilangnya kandungan klorofil pada jaringan
dapat disebabkan oleh adanya sukrosa pada medium (Rashid 1987).
Karbohidrat dapat mempengaruhi sintesis protochlorophyllade yang akan tereduksi menjadi klorofil. Pada prinsipnya, sukrosa dan glukosa merupakan jenis karbohidrat yang dapat menstimulasi biosintesis klorofil, namun glukosa menghasilkan konsentrasi klorofil dalam jaringan planlet yang lebih tinggi daripada sukrosa (Pamplin & Chapman 1975 diacu dalam Buah et al. 2000). Hasil penelitian tersebut didukung oleh Wolff dan Price (1960) yang menunjukkan bahwa glukosa merupakan jenis karbohidrat yang dapat meningkatkan pembentukan atau sintesis protochlorophyllade dibandingkan dengan jenis karbohidrat lain. Glukosa dapat dioksidasi lebih cepat daripada sukrosa sehingga glukosa lebih efektif dalam biosintesis pigmen.
b a a a 1.0
2.0 3.0 4.0
Sukrosa Maltosa Glukosa Fruktosa
sk
al
a w
ar
n
a d
au
n
23
Bobot Basah Planlet
Jenis dan konsentrasi karbohidrat berpengaruh secara nyata terhadap bobot basah planlet sagu tetapi tidak ada interaksi antar kedua faktor tersebut. Medium yang mengandung sukrosa dan konsentrasi karbohidrat 30 g/L menghasilkan rerata bobot basah terbesar. Medium dengan sukrosa 30 g/L menghasilkan bobot basah planlet terbesar dibandingkan dengan kombinasi jenis dan konsentrasi karbohidrat lainnya (Tabel 1).
Tabel 1 Pengaruh jenis dan konsentrasi karbohidrat terhadap bobot basah planlet sagu (g)
Jenis karbohidrat Konsentrasi karbohidrat (g/L) Rerata 30 45 60
Sukrosa 0.40 0.33 0.35 0.36 a
Maltosa 0.27 0.23 0.22 0.24 b
Glukosa 0.29 0.21 0.19 0.23 b
Fruktosa 0.32 0.24 0.22 0.26 b
Rerata 0.32 a 0.25 b 0.25 b
Keterangan : angka yang diikuti dengan huruf yang sama menunjukkan tidak berbeda secara nyata pada taraf 5% dengan uji DMRT.
Sukrosa berpengaruh terhadap bobot basah planlet yang digunakan sebagai sumber energi untuk mempercepat pembelahan sel guna meningkatkan penambahan volume dan bobot planlet (Gurel & Gulsen 1998). Selain itu Jain et al. (1997) menyebutkan bahwa sukrosa merupakan disakarida yang menghasilkan
bobot basah tumbuhan secara optimal. Namun, Javed & Ikram (2008) melaporkan bahwa semakin tinggi konsentrasi sukrosa menyebabkan semakin rendahnya bobot basah planlet gandum. Semakin tinggi konsentrasi karbohidrat dalam medium tumbuh menyebabkan semakin rendahnya bobot basah planlet sagu sebagai akibat terjadinya stres osmosis.
Diameter Planlet
60 g/L menghasilkan rerata diameter yang sama sedangkan 45 g/L menghasilkan diameter yang lebih kecil. Sukrosa 30 g/L menghasilkan planlet dengan diameter terbesar (7,3 mm) (Tabel 2).
Tabel 2. Pengaruh jenis dan konsentrasi karbohidrat terhadap diameter planlet sagu (mm)
Jenis karbohidrat Konsentrasi karbohidrat (g/L) Rerata 30 45 60
Sukrosa 7,3 5,1 7,2 6,5 a
Maltosa 5,6 5,9 5,8 5,7 ab
Glukosa 5,7 3,7 5,3 4,9 b
Fruktosa 6,1 5,0 6,3 5,8 ab
Rerata 6,2 a 4,9 b 6,1 a
Keterangan : angka yang diikuti dengan huruf yang sama menunjukkan tidak berbeda secara nyata pada taraf 5% dengan uji DMRT.
Diameter merupakan parameter pertumbuhan lateral tumbuhan yang menandakan pertambahan ukuran. Karbohidrat mengendalikan morfogenesis yang berperan dalam perluasan, pengerasan dan komposisi penyusun dinding sel (Baskaran & Jayabalan 2005). Sukrosa penting untuk membesaran sel dan memelihara tekanan osmosis sel (Jeffs & Northcote 1967) sehingga meningkatkan diameter planlet sagu.
Persentase Perakaran Planlet
Dari penelitian ini diketahui bahwa persentase planlet yang berakar paling banyak dihasilkan pada medium yang mengandung sukrosa 30 g/L (40,0 %). Tidak ada planlet pada medium dengan fruktosa 45 g/L yang berakar (0,0%) (Tabel 3).
25
Tabel 3 Pengaruh jenis dan konsentrasi karbohidrat terhadap persentase perakaran planlet sagu (%)
Jenis karbohidrat Konsentrasi karbohidrat Rerata 30 45 60
Sukrosa 40,0 13,3 6,7 20,0
Maltosa 20,0 33,3 26,7 26,7
Glukosa 26,7 26,7 6,7 20,0
Fruktosa 20,0 0,0 13,3 11,1
Rerata 26,7 18,3 13,3
Sukrosa mempengaruhi pembesaran sel dengan cara memelihara tekanan osmosis dalam sel sehingga menyebabkan pertumbuhan atau pertambahan ukuran planlet baik tinggi, diameter, bobot basah dan jumlah daun. Maltosa dihidrolisis 20 kali lebih lambat daripada sukrosa sehingga penyerapan dan metabolisme maltosa lebih lama daripada sukrosa (Blanc et al. 2002). Fruktosa dan glukosa merupakan monosakarida yang lebih mudah didekomposisi daripada sukrosa. Namun fruktosa merupakan hasil sementara dari katabolisme glukosa yang mempengaruhi perkembangan tumbuhan kultur in vitro secara lambat. Fruktosa merupakan heksosa yang tergolong dalam monosakarida yang tidak menstimulasi diferensiasi jaringan tetapi mempengaruhi aktivitas sukrosa. Glukosa meningkatkan perkembangan batang, fruktosa meningkatkan perkembangan akar dan sukrosa dapat meningkatkan perkembangan keduanya yaitu akar dan batang (Tiexeira da Silva 2004).
sel dan menekan dinding sel akibat adanya tekanan turgor. Tekanan turgor menyebabkan terjadinya pertumbuhan dengan cara mendorong dinding dan membran sel untuk melar.
Pengaruh Intensitas Cahaya terhadap Pertumbuhan Planlet Sagu Penelitian intensitas cahaya menggunakan medium sukrosa 30 g/L yang merupakan medium terbaik hasil dari penelitian karbohidrat.
Pertumbuhan Tinggi Planlet
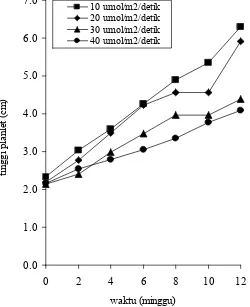
[image:52.612.195.445.365.672.2]Intensitas cahaya berpengaruh terhadap pertumbuhan tinggi planlet sagu. Hasil penelitian menunjukkan bahwa kurva pertumbuhan tinggi planlet semakin meningkat pada setiap perlakuan intensitas cahaya. Intensitas cahaya paling rendah yaitu 10 µmol/m2/detik menghasilkan pertambahan paling tinggi selama masa kultur (Gambar 9).
Gambar 9 Kurva pertumbuhan tinggi planlet sagu pada berbagai intensitas cahaya. 0.0
1.0 2.0 3.0 4.0 5.0 6.0 7.0
0 2 4 6 8 10 12
waktu (minggu)
ti
ng
gi
pl
anl
et
(
cm
)
27
LPR untuk Tinggi dan Jumlah Daun Planlet
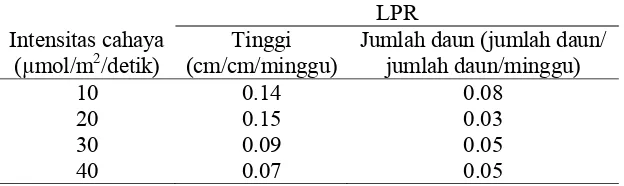
Intensitas cahaya berpengaruh terhadap pertambahan tinggi planlet sagu. Intensitas cahaya 20 dan 10 µmol/m2/detik menghasilkan LPR tinggi yang tidak berbeda yaitu 0,15 dan 0,14. LPR tinggi terkecil dihasilkan pada 40 µmol/m2/detik (0,07) (Tabel 4).
[image:53.612.165.477.424.517.2]Hasil penelitian ini didukung oleh Soontornchainaksaeng et al. (2001) yang melaporkan bahwa planlet Vanda coerulea tertinggi dihasilkan pada intensitas cahaya lebih rendah. Intensitas cahaya yang berlebih mengakibatkan kekerdilan pada batang dan daun tumbuhan alpin (Datta 1994 diacu dalam Soontornchainaksaeng et al. 2001). Tinggi planlet meningkat pada intensitas cahaya yang lebih rendah disebabkan oleh hormon auksin. Auksin merupakan hormon tumbuhan yang mempengaruhi pemanjangan sel, bersifat sensitif yang akan mengalami kerusakan atau degradasi pada intensitas cahaya tinggi. Pada intensitas cahaya rendah auksin bekerja lebih optimal sehingga mengakibatkan pemanjangan batang planlet sagu.
Tabel 4 Pengaruh intensitas cahaya terhadap LPR tinggi dan jumlah daun planlet sagu
Intensitas cahaya (µmol/m2/detik)
LPR Tinggi
(cm/cm/minggu)
Jumlah daun (jumlah daun/ jumlah daun/minggu)
10 0.14 0.08
20 0.15 0.03
30 0.09 0.05
40 0.07 0.05
Intensitas cahaya berpengaruh terhadap LPR jumlah daun planlet sagu. Intensitas cahaya 10 µmol/m2/detik menghasilkan LPR jumlah daun paling besar (0,08). LPR jumlah daun paling sedikit (0,03) dihasilkan pada kultur dengan cahaya 20 µmol/m2/detik (Tabel 4).
Warna Daun Planlet
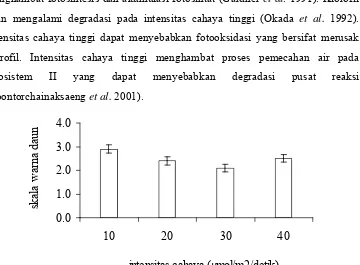
Intensitas cahaya berpengaruh terhadap warna daun planlet sagu. Intensitas cahaya 10 µmol/m2/detik menyebabkan warna daun lebih hijau dibandingkan dengan intensitas yang lebih tinggi (Gambar 10).
[image:54.612.147.507.205.470.2]Tidak semua tumbuhan membutuhkan cahaya yang tinggi untuk fotosintesis karena cahaya yang terlalu tinggi dapat merusak klorofil sehingga menghambat fotosintesis dan akumulasi fotosintat (Gardner et al. 1991). Klorofil akan mengalami degradasi pada intensitas cahaya tinggi (Okada et al. 1992). Intensitas cahaya tinggi dapat menyebabkan fotooksidasi yang bersifat merusak klorofil. Intensitas cahaya tinggi menghambat proses pemecahan air pada fotosistem II yang dapat menyebabkan degradasi pusat reaksi (Soontorchainaksaeng et al. 2001).
Gambar 10 Pengaruh intensitas cahaya terhadap warna daun planlet sagu.
Bobot Basah, Diameter, dan Persentase Perakaran Planlet
Dari penelitian ini diketahui bahwa Intensitas cahaya 20 µmol/m2/detik menghasilkan bobot basah paling besar (Tabel 5). Intensitas cahaya berperan dalam morfologi dan pertumbuhan tumbuhan khususnya bobot basah (Begna et al. 2002). Intensitas cahaya 20 µmol/m2/detik merupakan intensitas yang paling baik untuk pertambahan bobot basah planlet sagu. Peningkatan bobot basah dan tinggi tumbuhan terjadi pada intensitas cahaya rendah (Clayton et al. 2003). Intensitas cahaya yang lebih tinggi cenderung mengakibatkan penurunan bobot basah tumbuhan karena menghambat proses fotosintesis sehingga mengurangi
0.0
1.0
2.0
3.0
4.0
10
20
30
40
intensitas cahaya (µmol/m2/detik)
sk
al
a w
ar
n
29
akumulasi fotoasimilat pada jaringan tumbuhan (Soontornchainaksaeng et al. 2001).
Intensitas cahaya berpengaruh nyata terhadap diameter planlet sagu. Diameter paling besar dihasilkan oleh planlet yang dikultur pada intensitas cahaya 30 µmol/m2/detik (Tabel 5).
Tabel 5 Pengaruh intensitas cahaya terhadap bobot basah, diameter, dan persentase perakaran planlet sagu
Intensitas cahaya (µmol/m2/detik)
Bobot basah (g)
Diameter planlet (mm)
Perakaran (%)
10 0.32 4.8 b 50,0
20 0.42 5.6 b 12,5
30 0.33 7.3 a 0,0
40 0.41 6.1 ab 12,5
Keterangan : angka yang diikuti dengan huruf yang sama menunjukkan tidak berbeda secara nyata pada taraf 5% dengan uji DMRT.
Intensitas cahaya 10 µmol/m2/detik menghasilkan planlet berakar paling banyak (50%) daripada intensitas cahaya lain sedangkan intensitas 30 µmol foton/m2/detik tidak menghasilkan perakaran pada planlet sagu.
Struktur, Kerapatan dan Ukuran Stomata Daun Planlet Sagu Vigor dan Tidak Vigor
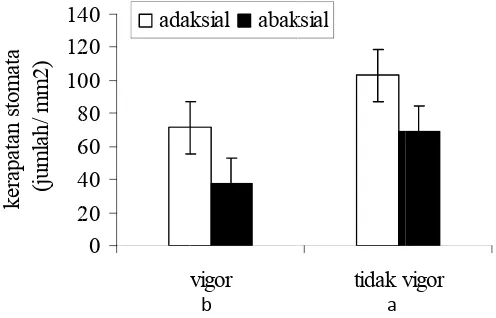
p m m u s G v v m b p b Stom planlet sagu merata dan t memanjang, ujung. Sel p sisinya. Susu Gambar 11 Dari vigor secara vigor merup membuka se berskala 3-4 penelitian in berbeda den mata sebagai u yang diseb tersusun me , menyempi penjaga dida unan stomat Susunan da dengan sel perlakuan a nyata lebih
pakan planl empurna, bob
4 dan berak ni menunjuk ngan abaksial Gambar 2 4 6 8 10 12 14 ke ra pat an s tom at a (j um la h/ m m 2 ) AA
i derivat ep but daun am enurut alur te it pada bag ampingi oleh
a teratur dan
an struktur s epidermis;
karbohidrat h rendah dib let yang m bot basah ≥ kar, sedangk kkan bahwa l (Gambar 1
r 12 Kerapat 0 20 40 60 80 00 20 40 ada pidermis ter mfistomatik. ertentu deng gian tengah h dua sel tet n sejajar den
stomata dau B. Struktur , kerapatan bandingkan d memiliki jum 0,350 g, dia kan planlet
kerapatan s 2). tan stomata vigor aksial abak b BA
rdapat di ke Stomata pa gan bentuk h
dan mengg tangga yang gan panjang
un planlet sa r stomata dau
stomata pa dengan plan mlah daun ≥
ameter ≥ 5,5 tidak vigo stomata pad daun planlet tidak v ksial a A 1 edua permu ada daun sag
halter yaitu s gembung pa g sejajar den g daun (Gam
agu. A. Stom un planlet.
ada daun pl nlet tidak vig ≥ 3 helai y
mm, warna r kebalikan da permukaa
t sagu. vigor
18,5 µm
31
Rerata kerapatan stomata dari permukaan adaksial dan abaksial planlet vigor (54,6/mm2) lebih rendah dibandingkan dengan planlet yang tidak vigor (86,0/mm2). Namun ukuran stomata planlet vigor (37,5 µm) lebih besar daripada planlet tidak vigor (25,0 µm). Stomata yang berukuran besar memiliki kerapatan yang rendah sedangkan stomata yang berukuran kecil memiliki kerapatan yang tinggi (Metcalfe & Chalk 1990 diacu dalam Abdulrahaman & Oladele 2009). Perbedaan kerapatan stomata pada abaksial dan adaksial berhubungan dengan aktivitas transpirasi daun planlet sagu. Hal ini didukung oleh penelitian Abdulrahaman & Oladele (2009), menunjukkan bahwa kerapatan stomata daun Borassus aethiopum pada permukaan adaksial lebih tinggi daripada abaksial. Hal
ini menunjukkan bahwa transpirasi pada permukaan daun adaksial lebih tinggi daripada abaksial. Mekanisme pembukaan stomata berhubungan dengan tekanan turgor akibat masuknya air ke dalam sel penjaga secara osmosis. Karbohidrat selain berperan sebagai sumber karbon dan energi juga berperan sebagai osmoregulator.
Struktur Anatomi Daun, Pelepah dan Akar Planlet Sagu Vigor dan Tidak Vigor
Perlakuan Karbohidrat
Hasil pengamatan pada helai daun planlet yang dilakukan menunjukkan bahwa tidak ada perbedaan irisan histologi daun dan akar planlet vigor dan tidak vigor (Gambar 13). Ketebalan daun planlet vigor dan tidak vigor relatif seragam yaitu 175-200 µm.
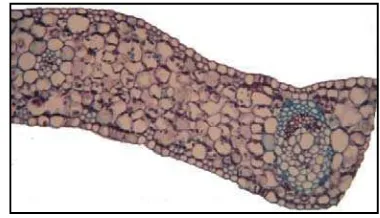
Gambar 13 Sayatan melintang daun planlet sagu (ep:epidermis; st: stomata; sl: sel seludang; pa: parenkim; sk: sklerenkim; xl: xilem; fl: floem).
Akar sagu tersusun atas epidermis, eksodermis, korteks, endodermis dan silinder pembuluh atau silinder tengah. Jaringan epidermis tersusun atas selapis sel yang tersusun rapat dengan dinding sel bagian luar yang tebal. Jaringan epidermis biasanya ditemukan pada jaringan akar yang masih muda. Apabila akar telah dewasa, epidermis akan mengalami kerusakan dan fungsinya digantikan oleh eksodermis (Nugroho et al. 2006). Jaringan eksodermis tersusun atas sel-sel yang berukuran kecil dan disertai sel sklerenkim. Jaringan eksodermis sering disebut sebagai jaringan subepidermal atau lapisan terluar korteks yang berfungsi sebagai jaringan pelindung. Korteks akar tersusun atas sel-sel parenkim yanng berukuran besar dan tersusun radial. Jaringan endodermis akar sagu tersusun atas dua lapis sel-sel yang berukuran lebih kecil membentuk silinder yang merupakan batas dalam korteks akar. Jaringan paling dalam dari akar adalah silinder pembuluh atau pusat yang sering disebut dengan stele. Silinder pembuluh dikelilingi atau dilindungi oleh selapis sel parenkim ysng disebut jaringan perisikel. Silinder pembuluh tediri dari floem dan xilem. Xilem pada akar sagu terdiri dari metaxilem dan protoxilem (Gambar 14). Struktur anatomi akar planlet sagu vigor dan tidak vigor tidak menunjukkan perbedaan. Diameter keduanya adalah 650 -700 µm.
xl fl sl
sk ep
st pa
abaksial
adaksial
33
[image:59.612.169.497.76.205.2]
Gambar 14 Sayatan melintang akar planlet sagu (ep: epidermis; eks: eksodermis; ko: kortek; en: endodermis; ps: perisiklus; mxl: metaxilem; pxl: ptotoxilem; fl: floem).
Pada tahap planlet, batang sejati sagu belum terbentuk sehingga bagian yang dianggap batang merupakan pelepah atau seludang daun. Sayatan pelepah planlet sagu menunjukkan perbedaan secara anatomis dan ketebalan. Irisan anatomis pelepah menunjukkan perbedaan antara planlet vigor dan tidak vigor. Planlet vigor memiliki beberapa pelepah yang dilengkapi dengan lapisan primordia daun dan meristem apikal pucuk (SAM: shoot apical meristem) (Gambar 15).
Tebal pelepah planlet vigor mencapai 600-620 µm dan planlet tidak vigor 1000-1200 µm. Pada planlet vigor, primordia daun akan tumbuh dan berkembang menjadi daun sehingga jumlah daun planlet vigor akan terus bertambah. Jaringan meristem pada irisan melintang pelepah planlet vigor diketahui dengan adanya sel-sel muda yang ditandai dengan tidak adanya ruang antar sel dan padat. Namun planlet tidak vigor hanya membentuk selapis pelepah. Tidak terlihatnya primordia daun dan SAM pada planlet tidak vigor menunjukkan bahwa tahap pertumbuhan selanjutnya, pertambahan daun daun akan lambat atau tidak terjadi sama sekali. Dari pengamatan anatomis dapat diasumsikan bahwa pertumbuhan planlet vigor berbeda dengan planlet tidak vigor.
ep eks
ko
fl mxl
en ps
pxl
Gambar 15 Sayatan melintang pelepah planlet sagu perlakuan karbohidrat. A. pelepah planlet vigor; B. pelepah planlet tidak vigor, (pr: primordia daun; SAM: meristem apikal pucuk (shoot apical meristem).
Perlakuan Intensitas Cahaya
Berdasarkan pengamatan sayatan anatomis, tidak terdapat perbedaan histologis dan ketebalan antara daun planlet sagu vigor dan tidak vigor. Ketebalan daun planlet vigor dan tidak vigor adalah 134,4-137,5 µm. Sayatan anatomis akar tidak menunjukkan perbedaan histologis antara akar planlet vigor dan tidak vigor. Namun diameter akar planlet vigor lebih kecil (500 µm) dibandingkan dengan planlet tidak vigor (780 µm). Perbedaan diameter akar dapat disebabkan oleh fungsi akar dalam mengabsorbsi nutrien medium.
Sayatan melintang pelepah planlet sagu menunjukkan perbedaan susunan dan ketebalan antara planlet sagu vigor dan tidak vigor (Gambar