BAB II
TINJAUAN PUSTAKA
2.1 Ester
Ester adalah kelas penting dari bahan kimia, memiliki aplikasi dalam berbagai bidang seperti perlarut, plastik, obat-obatan dan sebagai zat antara (intermediate) untuk industri. Ester memiliki struktuk kimia R-COOR’, dimana R dan R’ adalah kelompol alkil ataupun aril. Metode khusus yang digunakan untuk memproduksi ester adalah dengan memanaskan asam karboksilat R-COOH dengan alkohol R-OH dengan memisahkan air yang terrbentuk (Zeki, dkk., 2010). Ester merupakan salah satu senyawa devirat asam karboksilat dimana gugus hidroksil (-OH) digantik oleh gugus alkoksi (-OR) dari alkohhol. Senyawa yang dikategorikan sebagai devirat asam karboksilat adalah senyawa-senyawa yang apabila dihidrolisis akan menghasilkan asam karboksilat seperti ester, halida asam, anhidrida asam dan amida (Ali, 2008).
Berat molekul ester yang rendah memiliki bau yang harum dan ditemukan pengaplikasiannya dalam industri makanan dan parfum. Reaksi esterifikasi adalah reaksi yang sering digunakan terutama dalam industri farmasi, industri parfum dan industri polimer dimana katalis heterogen dan homogen digunakan luas (Patil dan Bhaskar, 2014). Ester juga digunakan sebagai produk konsumsi seperti minuman ringan, permen karet, permen dan keju. Dan juga ester banyak digunakan sebagai pelarut (Khire, dkk., 2012).
Kebanyakan ester merupakan zat yang berbau enak dan menyebabkan cita rasa dan harum dari banyak buah-buahan dan bunga. Senyawa ester juga memiliki hubungan sintetik dengan senyawa lain. Diantaranya ester dapat dibuat dari senyawa andrihida asam, asam karboksilat, ataupun halida asam. Selain itu dari senyawa ester juga dapat dihasilkan senyawa asam karboksilat, amida, poliester, dan alkohol (Ali, 2008).
2.2 Esterifikasi
Esterifikasi adalah proses kimia untuk membuat ester, yang merupakan senyawa dari struktur kimia R-COOR', di mana R dan R' adalah kelompok alkil atau aril. Metode yang paling umum untuk menyiapkan ester adalah dengan memanaskan asam karboksilat dengan alkohol dan mengeluarkan air yang terbentuk. Suatu katalis asam mineral biasanya diperlukan untuk membuat reaksi terjadi pada tingkat yang berguna. Ester juga dapat dibentuk oleh berbagai reaksi lainnya. Ini termasuk reaksi alkohol dengan asam klorida atau anhidrida. Struktur kimia dari alkohol, asam, dan katalis asam yang digunakan dalam reaksi esterifikasi semua mempengaruhi laju. Alkohol sederhana seperti metanol dan etanol bereaksi sangat cepat karena mereka relatif kecil dan tidak mengandung rantai samping atom karbon yang akan menghambat reaksi mereka (Yadaw, 2010).
Reaksi esterifikasi bersifat reversible (bolak-balik) dan terdapat produk samping berupa air. Oleh sebab itu reaksi kesetimbangan dapat digeser kearah pembentukan ester dengan cara melebihkan jumlah mol salah satu reaktan atau memisahkan air yang terbentuk agar reaksi sebaliknya tidak berlangsung. Pada reaksi esterifikasi umumnya digunakan katalis asam untuk mempercepat reaksi. Katalis berguna untuk menurunkan energi aktivasi dengan cara mengubah mekanisme reaksi yaitu menambah tahap-tahap reaksi. Dengan rendahnya nilai energi aktivasi, tumbukan efektif yang menghasilkan produk akan lebih sering terjadi sehingga reaksi berjalan lebih cepat (Ali, 2008).
Secara umum reaksi esterifikasi digambarkan sebagai berikut RCOOH + R’OH RCOOR’ + H2O
Asam karboksilat Alkohol Ester Air Gambar 2.1 Reaksi Esterifikasi
(Ali, 2008)
Esterifikasi dapat dilakukan dengan katalis asam seperti HCl dan H2SO4,
namun dengan pertimbangan kemudahan pemisahan dan ekonomis maka perlu dicara katalis alternatif menggunakan katalis heterogen seperti clay dan zeolit (Kartika dan Senny, 2012)
2.3 Faktor-Faktor yang Mempengaruhi Reaksi Esterifikasi
1. Waktu Reaksi
Makin lama waktu reaksi, makin besar konversi reaksi, ini disebabkan kesempatan zatzat pereaksi untuk saling bertumbukan makin besar. Tetapi apabila konversi tidak berubah, waktu reaksi tidak menguntungkan.
2. Temperatur
Semakin tinggi temperatur (sampai pada batas tertentu), makin cepat jalannya reaksi. Pengaruh temperatur terhadap kecepatan reaksi dipengaruhi oleh katalisator yang digunakan
3. Katalisator
Makin kecil tenaga aktivasi, konstanta kecepatan reaksi makin besar. Tenaga aktivasi dapat diperkecil dengan mengaktifkan reaktan, yaitu dengan cara menambah katalisator, sehingga menyebabkan tumbukan antara zat-zat pereaksi makin besar. Katalisator yang digunakan bisa berupa asam, atau basa.
4. Pengadukan
Agar reaksi dapat berjalan dengan baik, diperlukan pencampuran sebaik- baiknya, yakni dengan cara pengadukan agar menaikkan frekuensi tumbukan sehingga kecepatan reaksi akan bertambah besar. Frekuensi tumbukan yang semakin besar menyebabkan konstanta kecepatan reaksi makin besar pula .
5. Konsentrasi
Kecepatan reaksi sebanding dengan besarnya konsentrasi reaktan. Bila konsentrasi zat pereaksi diperbesar, maka kecepatan reaksi akan meningkat. Jumlah molekul yang bertumbukan akan bertambah, apabila zat pereaksi yang digunakan semakin murni, sehingga mempercepat terjadinya reaksi.
2.4 Mekanisme Reaksi Esterifikasi
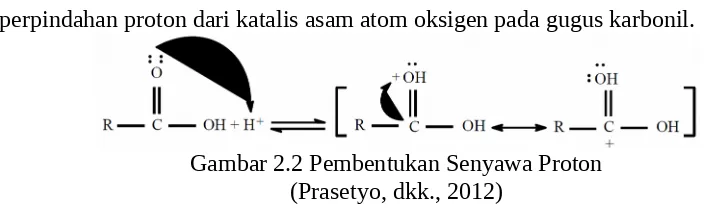
Mekanisme reaksi esterifikasi dapat dijelaskan melalui tahap reaksi berikut ini : a) Pembentukan senyawa proton pada asam karboksilat. Pada proses ini terjadi
perpindahan proton dari katalis asam atom oksigen pada gugus karbonil.
Gambar 2.2 Pembentukan Senyawa Proton (Prasetyo, dkk., 2012)
b) Alkohol nukleofilik menyerang karbon positif, dimana atom karbon karbonil kemudian diserang oleh atom oksigen dari alkohol, yang bersifat nukleofilik sehingga terbentuk ion oksonium. Pada proses ini terjadi pelepasan proton atau deprotonasi dari gugus hidroksil milik alkohol, menghasilkan senyawa kompleks teraktivasi.
Gambar 2.3 Reaksi Pelepasan Proton (Prasetyo, dkk., 2012)
c) Protonasi terhadap salah satu gugus hidroksil yang diikuti pelepasan molekul air menghasilkan ester