DINAMIKA SPORULASI GENUS FUNGI MIKORIZA
ARBUSKULA HASIL PENANGKARAN DARI BAWAH
TEGAKAN HUTAN TANAMAN JABON
(Anthocephalus cadamba Roxb Miq.)
ERFAN HANDANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Dinamika Sporulasi Genus Fungi Mikoriza Arbuskula Hasil Penangkaran dari Bawah Tegakan Hutan Tanaman Jabon (Anthocephalus cadamba Roxb Miq.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
ABSTRAK
ERFAN HANDANI. Dinamika Sporulasi Genus Fungi Mikoriza Arbuskula Hasil Penangkaran dari Bawah Tegakan Hutan Tanaman Jabon (Anthocephalus cadamba Roxb Miq.). Dibimbing oleh IRDIKA MANSUR dan SRI WILARSO BUDI R.
Lahan yang terdegradasi umumnya tidak produktif sehingga perlu upaya untuk perbaikan lahan, salah satunya yaitu dengan membangun hutan tanaman. Hutan tanaman yang banyak dikembangkan adalah hutan tanaman jabon (Anthocephalus cadamba Roxb Miq.). Upaya untuk meningkatkan pertumbuhan tanaman jabon selain pupuk yaitu dengan penggunaan fungi mikoriza arbuskula (FMA). Informasi mengenai keanekaragaman dan sporulasi genus FMA pada jabon masih terbatas. Oleh karena itu, penelitian mengenai dinamika sporulasi genus FMA pada hutan tanaman jabon perlu dilakukan. Metode penelitian ini dilakukan dengan pengambilan sampel tanah dari rizosfer jabon dan penangkaran pada media pot kultur. Hasil penelitian menunjukkan bahwa kepadatan spora bulan November sampai Desember meningkat dan bulan Desember sampai Januari menurun pada Sorgum bicolor dan Pueraria javanica. Genus FMA yang ditemukan yaitu Glomus, Acaulospora dan Scutellospora dengan genus yang dominan yaitu Glomus. Jenis tanaman inang yang efektif untuk penangkaran FMA yaitu Sorgum bicolor.
Kata kunci: dinamika sporulasi, fungi mikoriza arbuskula, jabon, Pueraria javanica, Sorgum bicolor
ABSTRACT
ERFAN HANDANI. Sporulation Dynamics Genus Arbuscular Mycorrhizal Fungi of Under Jabon Stand Plant Forest (Anthocephalus cadamba Roxb Miq.). Supervised by IRDIKA MANSUR and SRI WILARSO BUDI R.
The degraded land generally is not productive so land reparation is needed, one of them is establishing forest plant. Developed many forest plants are planted forests jabon (Anthocephalus cadamba Roxb Miq.). Arbuscular myccorhizal fungi (AMF) could increase jabon growth besides fertilizing. Information about AMF diversity and sporulation genus in jabon is still limited. Therefore, the study of AMF sporulation genus dynamics of jabon forest plants needs to be done. The method of this research is picking by sampling the soil from jabon rizosfer and culture pot media. The results showed that the spores density in November until Desember were increased and Desember until January were decreased on Sorgum bicolor and Pueraria javanica. AMF genus that found was Glomus, Acaulospora, and Scutellospora with main genus was Glomus. Effective types of host plants for trapping AMF is Sorgum bicolor.
1
Makalah ini disampaikan dalam seminar hasil penelitian pada Hari Rabu, 19 Juni 2013 di ruang ABT 2
2 Mahasiswa Departemen Silvikultur Fakultas Kehutanan IPB (E44090011) 3
Dosen Pembimbing Departemen Silvikultur Fakultas Kehutanan IPB (Dr. Ir. Irdika Mansur, M.For.Sc)
4
Dosen Pembimbing Departemen Silvikultur Fakultas Kehutanan IPB (Dr. Ir. Sri Wilarso Budi R, MS)
DINAMIKA SPORULASI GENUS FUNGI MIKORIZA
ARBUSKULA HASIL PENANGKARAN DARI BAWAH
TEGAKAN HUTAN TANAMAN JABON
(Anthocephalus cadamba Roxb Miq)
1Oleh :
Erfan Handani2, Irdika Mansur3 dan Sri Wilarso Budi R4 Departemen Silvikultur Fakultas Kehutanan IPB
ABSTRAK
Degradasi lahan adalah proses penurunan produktivitas lahan yang sifatnya sementara maupun tetap dicirikan dengan penurunan sifat fisik, kimia dan biologi. Lahan
kritis merupakan salah satu bentuk lahan terdegradasi (Dariah et al. 2004). Menurut
Dariah et al. (2004), penyebab utama degradasi lahan di Indonesia adalah erosi air
sebagai akibat curah hujan dengan jumlah dan intensitas yang tinggi terutama di Indonesia Bagian Barat. Lahan yang terdegradasi umumnya menjadi tidak produktif sehingga perlu upaya untuk perbaikan lahan. Salah satu upaya untuk memperbaiki lahan yang terdegradasi dapat dengan dibangunnya hutan tanaman agar lahan menjadi produktif. Dalam membangun hutan tanaman perlu adanya pertimbangan tentang jenis
tanaman cepat tumbuh (fast growing species) salah satunya yaitu Jabon (Anthocephalus
cadamba Roxb Miq). Upaya yang dapat dilakukan untuk meningkatkan pertumbuhan tanaman jabon yaitu dengan pemberian pupuk. Namun pemupukan dalam areal yang luas memerlukan biaya yang cukup besar sehingga diperlukan alternatif lain. Penggunaan fungi mikoriza arbuskula (FMA) merupakan alternatif yang lebih baik dibandingkan penggunaan pupuk buatan (Nusantara 2011). Hampir kurang dari 15% penelitian yang
mempelajari keanekaragaman FMA pada suatu tegakan (Mansur et al. 2002). Informasi
mengenai keanekaragaman dan sporulasi FMA pada jabon masih terbatas. Oleh karena itu, penelitian mengenai dinamika sporulasi FMA pada pohon jabon perlu dilakukan.
Hasil penelitian menunjukkan bahwa kepadatan spora bulan November‒Desember
meningkat dan Desember‒Januari menurun pada Sorgum serta P. javanica. Pada
penelitian ini, infeksi akar lebih besar pada P. javanica dibanding Sorgum. Genus FMA
yang ditemukan yaitu Glomus, Acaulospora dan Scutellospora dengan genus spora yang
dominan yaitu Glomus.
Kata kunci : FMA, jabon, mikoriza, Pueraria javanica, Sorgum
PENDAHULUAN
Degradasi lahan adalah proses penurunan produktivitas lahan yang sifatnya sementara maupun tetap dicirikan dengan penurunan sifat fisik, kimia dan biologi. Lahan kritis merupakan salah satu bentuk lahan terdegradasi (Dariah et al. 2004).
lahan. Salah satu upaya untuk memperbaiki lahan yang terdegradasi dapat dengan dibangunnya hutan tanaman agar lahan menjadi produktif. Dalam membangun hutan tanaman perlu adanya pertimbangan tentang jenis tanaman cepat tumbuh (fast growing species) salah satunya yaitu Jabon (Anthocephalus cadamba Roxb Miq). Hutan tanaman yang banyak dikembangkan belakangan ini yaitu hutan tanaman jabon. Jabon (Anthocephalus cadamba Roxb Miq) merupakan jenis pohon pionir asli Indonesia yang memiliki penyebaran alami yang luas dari Aceh sampai Papua (Mansur 2010). Selain itu, jabon dikembangkan karena memiliki nilai komersial yang tinggi. Salah satu upaya yang dapat dilakukan untuk meningkatkan pertumbuhan tanaman jabon yaitu dengan pemberian pupuk. Namun pemupukan dalam areal yang luas memerlukan biaya yang cukup besar sehingga diperlukan alternatif lain.
Penggunaan fungi mikoriza arbuskula (FMA) merupakan alternatif yang lebih baik dibandingkan penggunaan pupuk buatan (Nusantara 2011). Penggunaan FMA tidak membutuhkan biaya yang besar karena teknologi produksinya murah, dapat diproduksi dengan mudah di lapangan, pemberian cukup sekali seumur hidup tanaman, tidak menimbulkan polusi dan tidak merusak struktur tanah (Mansur 2003).
Fungi mikoriza arbuskula dapat ditemukan hampir pada semua ekosistem, termasuk pada lahan masam (Kartika 2006) dan alkalin (Swasono 2006). Dalam hal ini termasuk juga di dalamnya ekosistem jabon. Menurut Smith dan Read (2008), FMA dapat berasosiasi dengan hampir 90% jenis tanamanMenurut Mansur et al. (2002) kurang dari 15% yang mempelajari
keanekaragaman FMA pada suatu ekosistem atau tegakan. Sejauh ini, informasi mengenai keanekaragaman dan sporulasi genus FMA pada jabon masih terbatas. Keanekaragaman spora FMA selalu berubah dengan perubahan waktu pengamatan, jenis inang dan tingkat salinitas (Delvian 2003). Oleh karena itu, penelitian mengenai dinamika sporulasi genus FMA pada pohon jabon perlu dilakukan.
Penelitian ini bertujuan untuk mengetahui keanekaragaman FMA di rizosfir pohon Jabon, dinamika sporulasi FMA, serta menguji jenis tanaman inang yang efektif untuk penangkaran FMA dari rizosfir jabon.
Hasil penelitian ini diharapkan mampu menambah pengetahuan mengenai dinamika sporulasi FMA berdasarkan interval waktu, serta genus-genus spora indigenous yang dapat dikembangkan sebagai sumber inokulum untuk meningkatkan pertumbuhan Jabon.
METODE Waktu dan Lokasi Penelitian
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah sampel tanah dari sekitar perakaran Jabon di Desa Sukaresmi Kecamatan Mega Mendung Kabupaten Bogor dan Desa Pamijahan Gunung Bunder Kabupaten Bogor, kantong plastik, benih P. javanica, benih Sorgum, zeolit, pupuk Terabuster, Sunclin. Sementara itu untuk ekstraksi dan identifikasi spora FMA dibutuhkan larutan glukosa 60%,
larutan Melzer’s sebagai bahan
pewarna spora. Untuk pewarnaan akar dibutuhkan bahan-bahan kimia seperti KOH 10%, HCL 2%, larutan Trypan Blue 0.05% (campuran lactic acid 40 ml, glyceryn 40 ml dan aquades 20 ml).
Alat-alat yang digunakan untuk pengambilan sampel tanah dan akar tanaman adalah cangkul, spidol dan kertas label. Sedangkan untuk pengamatan di laboratorium adalah saringan spora (saringan bertingkat dua yaitu 710 µm, dan 45 µm), sentrifuse, pipet plastik, pinset spora, kaca preparat, pipet, timbangan analitik, gunting akar, mikroskop dissecting dan binokuler, cover glass, Petri dish, sprayer dan pot plastik berdiameter 20 cm.
Prosedur Penelitian Pengambilan Sampel Tanah
Pengambilan sampel tanah dilakukan di Desa Sukaresmi Kecamatan Mega Mendung Kabupaten Bogor (3 sampel tanah) dan Desa Pamijahan Gunung Bunder Kabupaten Bogor (3 sampel tanah). Masing-masing daerah tersebut diambil sampel tanah dari 3 plot, dengan memilih 1 pohon Jabon yang memiliki pertumbuhan paling baik dari tiap plotnya. Penentuan plot dibuat dengan metode Purposive sampling berdasarkan umur tegakan. Ukuran plot yang dibuat yaitu 20 x 20m. Pemilihan
jabon dilihat berdasarkan diameter dan tinggi terbesar diantara pohon jabon yang ada dalam plot.
Pengambilan sampel tanah dari lapangan diambil sebanyak ± 500 gram pada zona rizosfir dengan kedalaman 5-20 cm secara komposit dari 3 titik sekitar perakaran Jabon dengan mengikuti akar jabon, sehingga tanah yang diambil benar-benar dari rizosfir jabon.
Persiapan Tanaman Inang
Tanaman inang yang digunakan untuk trapping yaitu benih P. javanica dan Sorgum. Benih-benih P. javanica terlebih dahulu direndam dalam larutan Sunclin sebanyak satu sendok makan selama 5-10 menit, kemudian dibilas dengan air sampai tidak berbau dan direndam air hangat selama 10 menit untuk mematahkan dormansinya. Setelah itu, benih P. javanica dapat langsung ditanam.
Penangkaran Mikoriza (Trapping)
Pemeliharaan Tanaman Inang
Pemeliharaan yang dilakukan adalah penyiraman, pemupukan dan pengendalian terhadap hama penyakit. Penyiraman dilakukan sebanyak satu kali sehari di pagi hari. Pemupukan dilakukan satu kali pada awal penanaman dengan menggunakan pupuk Terabuster dengan dosis 100 ml per tanaman untuk membantu pertumbuhan tanaman inang. Pengendalian hama dan penyakit dilakukan dengan membebaskan tanaman dari serangga dan membersihkan bagian dasar tanaman dari dedaunan yang masuk ke dalam pot.
Pengamatan Spora dan Infeksi Akar
Pengamatan spora dilakukan dengan mengambil sampel tanah hasil trapping pada tanaman inang. Pengambilan sampel tanah untuk pengamatan, dilakukan dengan cara memisahkan zeolit bagian atas dari media penangkaran, kemudian tanah yang ada pada bagian tengah diambil sebanyak 10 gram disertai dengan pengambilan akarnya. Kegiatan pengambilan sampel tanah ini dilakukan secara periodik dengan interval waktu 1 bulan yang dimulai pada November 2012 - Januari 2013.
Pengamatan infeksi akar dapat dilihat dengan cara pewarnaan akar. Pewarnaan akar dilakukan dengan metode Phyllip dan Hyman (1970. Langkah awal dalam pewarnaan akar yaitu dengan mengambil akar serabut pada samping kiri dan samping kanan dari batang pokok. Akar yang akan diamati dicuci dengan air mengalir hingga kotoran dan tanah yang menempel hilang. Akar kemudian direndam dalam larutan KOH 10% sampai akar berwarna putih atau kuning bening selama ± 48 jam. Akar tersebut kemudian dibilas dengan air
bersih agar KOH-nya hilang. Selanjutnya, akar direndam dalam larutan HCL 2% selama ± 24 jam dan dibilas dengan air bersih agar HCL-nya hilang. Perendaman selanjutnya yaitu dengan larutan staining trypan blue 0.05% sampai akar berwarna biru ± 24 jam.
Sedangkan untuk pengamatan akar, dilakukan dengan memotong akar yang telah diwarnai sepanjang 1 cm, kemudian akar ditata di atas preparat dan ditutup dengan cover glass, jumlah akar tiap preparat sebanyak 10 potong. Infeksi akar dapat dilihat melalui adanya vesikula, arbuskula, hifa maupun spora yang menginfeksi akar. Perhitungan infeksi akar menggunakan rumus sebagai berikut :
Akar
Perhitungan spora dilakukan untuk mengetahui kepadatan spora. Kepadatan spora adalah banyaknya spora tiap sampel tanah yang dianalisis. Kepadatan spora dihitung dengan rumus :
Kepadatan spora = jumlah spora / berat tanah yang dianalisis
Sehingga untuk menghitung kepadatan spora pada analisis sampel tanah sebanyak 10 gram adalah : Kepadatan spora = jumlah spora / 10 gram
Ekstraksi dan Identifikasi Spora
dengan saringan bertingkat ukuran 710 µm dan 45 µm secara berurutan dari atas ke bawah. Saringan bagiaan atas disemprot dengan air kran untuk memudahkan bahan saringan lolos. Selanjutnya saringan paling atas dilepas dan pada saringan kedua tersisa sejumlah tanah yang tertinggal yang kemudian dipindahkan ke dalam tabung sentrifuse. Kemudian dilanjutkan dengan metode sentrifugasi (Brundrett et al. 1996) yaitu hasil saringan tanah dimasukkan ke dalam tabung sentrifuse ditambahkan larutan glukosa 60% sebanyak 2/3 isi tabung dan di sentrifuse selama 3-5 menit dengan kecepatan 2500 rpm. Cairan yang agak bening dibagian tengah tabung merupakan peralihan antara larutan gula dengan air yang merupakan kumpulan partikel-partikel yang mengandung spora FMA. Cairan tersebut selanjutnya dituangkan ke dalam saringan ukuran 45µm dan dicuci dengan air mengalir untuk menghilangkan glukosa. Endapan yang tersisa dalam saringan dituangkan ke dalam Petri dish dan diamati di bawah mikroskop binokuler untuk perhitungan kepadatan spora dan pembuatan preparat spora. Preparat spora dibuat untuk melakukan identifikasi spora FMA yang ditemukan.
Preparat spora dibuat menggunakan bahan pewarna Melzer’s untuk membantu dalam mempercepat identifikasi spora sampai tingkatan genus. Spora-spora FMA yang diperoleh dari isolasi diletakkan dalam larutan Melzer’s. Selanjutnya spora -spora tersebut dipecahkan secara hati-hati dengan cara menekan kaca penutup preparat menggunakan ujung lidi. Perubahan warna spora dalam larutan Melzer’s adalah salah satu indikator untuk menentukan genus spora yang ada.
HASIL DAN PEMBAHASAN Kepadatan spora
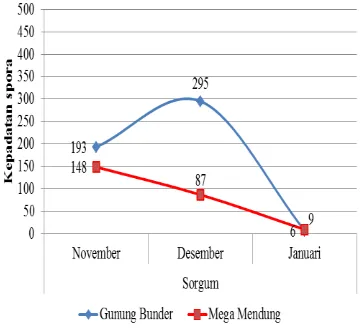
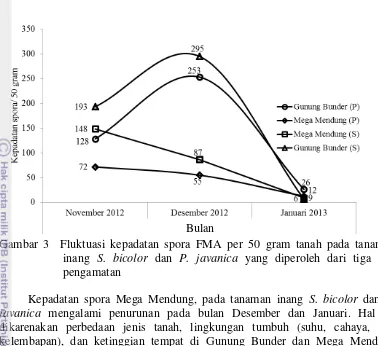
Isolasi tanah pada rizosfer jabon dari dua lokasi pengambilan sampel menghasilkan beberapa spora FMA. Nilai kepadatan spora FMA bervariasi dan berfluktuasi pada setiap tanaman dalam setiap pengambilan sampel tanah. Setiap tanaman mempunyai pola fluktuasi yang berbeda yang menunjukkan tidak adanya suatu kecenderungan tertentu terhadap perbedaan waktu pengamatan. Fluktuasi kepadatan spora pada tanaman Sorgum dan P. javanica dalam tiga kali pengamatan dapat dilihat pada Gambar 1 dan Gambar 2.
Gambar 2 Fluktuasi kepadatan spora FMA per 50 gram tanah pada tanaman inang P. javanica yang diperoleh dari tiga kali pengamatan Gambar 1 dan Gambar 2 menunjukkan bahwa kepadatan spora pada masing-masing tanaman inang terdapat perbedaan. Kepadatan spora Gunung Bunder pada tanaman inang Sorgum, bulan November sebanyak 193 spora/50 gram tanah, bulan Desember kepadatan spora sebanyak 295 spora/50 gram tanah dan bulan Januari kepadatan spora sebanyak 9 spora/50 gram tanah. Sedangkan kepadatan spora Mega Mendung pada tanaman inang Sorgum, bulan November sebanyak 148 spora/50 gram tanah, bulan Desember sebanyak 87 spora/50 gram tanah dan bulan Januari 6 spora/50 gram tanah. Hasil ini jauh lebih tinggi dibandingkan dengan kepadatan spora hasil pemerangkapan Rainiyati (2007) 2-57 spora/50 gram tanah pada rizosfer pisang. Kepadatan spora Gunung Bunder pada tanaman inang P. javanica, bulan November sebanyak 128 spora/50 gram tanah, bulan Desember sebanyak 253 spora/50 gram dan bulan Januari sebanyak 26 spora/50 gram tanah. Sedangkan kepadatan spora Mega Mendung pada tanaman inang P. javanica, bulan
November sebanyak 72 spora/50 gram tanah, bulan Desember sebanyak 55 spora/50 gram tanah dan bulan Januari sebanyak 12 spora/50 gram tanah. Hasil ini jauh lebih tinggi dibandingkan penelitian Karepesina (2007) yang menemukan 24-40 spora/50 gram tanah dari bawah tegakan jati ambon di lokasi Salahutu. Pada gambar 1 dan 2 terlihat bahwa kepadatan spora Gunung Bunder, pada tanaman inang Sorgum dan P. javanica bulan Desember mengalami peningkatan dan mengalami penurunan pada bulan Januari. Menurut Delvian (2003) bahwa adanya perubahan kepadatan spora dalam setiap pengamatan menunjukkan bahwa setiap jenis FMA membentuk spora pada saat yang berbeda, tergantung fenologi dan responnya terhadap tanaman inang. Berbeda dengan kepadatan spora Mega Mendung, pada tanaman inang Sorgum dan P. javanica mengalami penurunan pada bulan Desember dan Januari. Hal ini dikarenakan perbedaan jenis tanah, lingkungan tumbuh (suhu, cahaya, dan kelembapan), dan ketinggian tempat di Gunung Bunder dan Mega Mendung sebagai salah satu faktor yang berpengaruh terhadap penyebaran jenis FMA dan kepadatan spora. Menurut Rainiyati (2007) bahwa perbedaan kepadatan spora kemungkinan dipengaruhi oleh perbedaan lingkungan (jenis tanah, hara tanaman, ketinggian tempat, cahaya). Selain itu, Corryanti et al. (2008) menyatakan bahwa adanya perbedaan keanekaragaman dan jumlah spora ditentukan oleh lingkungan dan tata kelola lahan serta tipe lahan.
Gambar 3 Fluktuasi kepadatan spora tanaman inang Sorgum menghasilkan kepadatan spora yang lebih tinggi dibandingkan dengan P. javanica. Hal ini dikarenakan Sorgum memiliki sistem perakaran yang baik untuk pembentukan mikoriza, selain itu Sorgum merupakan salah satu tanaman serelia yang mengandung karbonhidrat cukup tinggi (Sirappa 2003). Selain itu, gambar 3 menunjukkan bahwa Sorgum lebih efektif untuk pemerangkapan spora dibandingkan P. javanica. Menurut Patriyasari (2006) jumlah spora tidak hanya dipengaruhi oleh satu faktor saja, tetapi juga dipengaruhi oleh akumulasi dari beberapa faktor, diantaranya mikoriza itu sendiri, varietas tanaman inang dan kondisi lingkungan, seperti cahaya dan suhu, karena cahaya matahari berperan dalam pembentukan karbohidrat melalui asimilasi karbon yang selanjutnya FMA akan menggunakan karbon tersebut sebagai sumber energi bagi pertumbuhannya. Hasil penelitian Delvian (2003) menunjukkan bahwa keanekaragaman spora FMA selalu berubah dengan perubahan waktu
pengamatan, jenis inang dan tingkat salinitas. Hasil penelitian ini lebih komprehensif karena data diperoleh dari tiga kali pengamatan dan menunjukkan adanya perubahan kepadatan spora pada setiap pengamatan. Selama ini informasi tentang keanekaragaman FMA pada suatu ekosistem atau tegakan diperoleh hanya dari satu kali pengamatan, seperti yang dilakukan oleh Purwanto (1999) pada ekosistem hutan pantai dan Maryadi (2002) pada tegakan jati. Perbedaan kepadatan spora pada tiga kali pengamatan menginformasikan bahwa keanekaragaman FMA pada suatu lokasi tergantung pada jenis FMA yang bersporulasi pada saat tersebut. Hal ini sesuai dengan Delvian (2003) bahwa adanya perubahan kepadatan spora dalam setiap pengamatan menunjukkan bahwa setiap jenis FMA membentuk spora pada saat yang berbeda, tergantung fenologi dan responnya terhadap tanaman inang.
Persen Kolonisasi Akar
yang kompleks, tampak seperti pohon kecil yang mempunyai cabang-cabang (Gunawan 1993), struktur ini berperan sebagai tempat pertukaran unsur hara dan karbon (Hudson 1989). Adanya satu atau lebih struktur FMA tersebut, maka dapat dikatakan terjadi infeksi oleh FMA. Hasil pengamatan infeksi akar hanya ditemukan struktur hifa dan vesikula saja sedangkan struktur arbuskula tidak ditemukan. Hal ini dikarenakan siklus hidup dari arbuskula relatif pendek yakni berkisar 4-6 hari dan setelah itu arbuskula akan mengalami degenerasi kemudian dicerna oleh sel tanaman inang (Srivastava et al., 1996 dalam Hapsoh, 2008). Struktur hifa dan vesikula dapat dilihat pada Gambar 4.
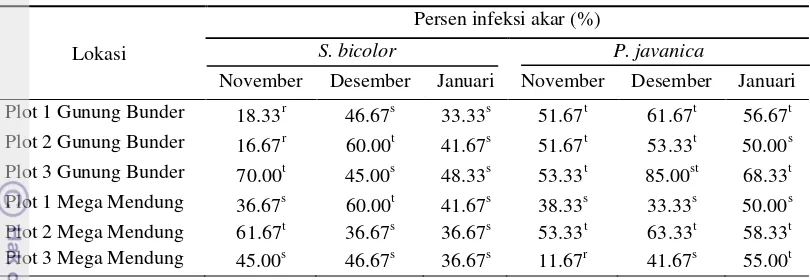
Kolonisasi akar dihitung berdasarkan jumlah bidang pandang terinfeksi terhadap total bidang pandang yang diamati. Tingkat infeksi pada akar diklasifikasikan menurut The Instate of Mycorrhizal Research and Development, USDA Forest Service, Athena Georgia (Setiadi 1992) sebagai berikut : bahwa telah terjadi asosiasi antara FMA dengan akar tanaman inang. Namun, persentase infeksi akar pada tiap tanaman inang berbeda-beda. Adapun persentase infeksi akar dapat dilihat pada Tabel 1.
Tabel 1 Persentase infeksi akar pada tanaman inang Sorgum dan P. javanica bulan November ‒ Januari
No Lokasi
Persen infeksi akar (%)
Sorgum P. javanica
November Desember Januari November Desember Januari
1 Gunung huruf di belakang angka menunjukkan tingkat infeksi FMA pada akar
Pada tiap tanaman memiliki persentase infeksi yang berbeda-beda, hal ini kemungkinan disebabkan oleh perbedaan faktor yang mempengaruhi infeksi mikoriza terhadap tanaman, a
antara lain yaitu kebergantungan tanaman terhadap mikoriza, efektifitas isolat maupun kondisi nutrisi terutama unsur P (Setiadi 1995). Selain itu, perbedaan tempat asal pengambilan tanah juga mempengaruhi terhadap variasi infeksi akar oleh FMA. Hal ini dipertegas oleh Fitter & Merryweather (1992) bahwa variasi infeksi akar tumbuhan oleh FMA di alam berbeda dengan berbedanya tempat dan waktu.
Persentase infeksi akar pada tanaman inang Sorgum Gunung Bunder bulan November - Januari sebesar 35% - 50.56% dengan kriteria infeksi akar sedang-tinggi. Pada tanaman inang P. javanica persentase infeksi akar bulan November - Januari sebesar 52.22% - 66.67% dengan kriteria infeksi akar tinggi. Sedangkan persentase infeksi akar pada tanaman inang Sorgum Mega Mendung bulan November - Januari sebesar 38.34% - 47.78% dengan kriteria infeksi akar sedang. Pada tanaman inang P. javanica persentase infeksi akar bulan November - Januari sebesar 34.44% - 54.44% dengan kriteria infeksi akar sedang-tinggi. Secara umum, infeksi akar pada Sorgum dan P. javanica meningkat pada bulan Desember dan menurun pada bulan Januari. Hal ini dikarenakan pada bulan Desember spora sedang berkecambah sehingga infeksi meningkat. Laju kolonisasi akar, selain ditentukan oleh respon tanaman inang dan lingkungan tumbuh, ditentukan juga oleh dormansi, tingkat kematangan atau umur spora, dan kerapatan inokulum (Abbot & Gazey 1994). Dormansi merupakan waktu yang diperlukan oleh spora untuk berkecambah dan kemudian mengkolonisasi akar, adanya dormansi spora dengan demikian dapat menurunkan laju kolonisasi akar (Gemma & Koske 1988).
Dalam penelitian ini, persen kolonisasi akar lebih besar pada P. javanica dibandingkan dengan Sorgum karena memiliki sedikit bulu akar sehingga akan berupaya untuk memperluas eksploitasi akar dengan mikoriza. Simanungkalit (1998) menyatakan bahwa sistem perakaran seperti serabut yang memiliki rambut akar yang banyak umumnya dianggap kurang bergantung pada infeksi mikoriza dibanding tanaman dengan sistem perakaran yang kasar dan memiliki sedikit atau tanpa rambut akar. Persen kolonisasi akar tidak berhubungan erat dengan kepadatan spora. Hal ini terlihat pada masing-masing lokasi, infeksi akar yang meningkat tidak selalu diikuti dengan meningkatnya kepadatan spora. Hal ini sesuai dengan Tuheteru (2003) bahwa antara infeksi akar dan jumlah spora yang dihasilkan tidak memiliki korelasi yang erat, sehingga spora yang banyak belum tentu persentase infeksi akar akan tinggi pula.
Identifikasi dan Karakterisasi Spora FMA
Gambar 5 Spora yang ditemukan pada rizosfer jabon antara lain Glomus (a), Scutellospora (b) dan Acaulospora (c) Karakteristik morfologi yang ditemukan pada penelitian ini, umumnya spora Glomus berbentuk bulat hingga bulat lonjong berwarna kuning muda, kuning kemerahan, coklat dan hitam, permukaan relatif halus, dinding spora tipis. Hal ini sesuai dengan Puspitasari et al (2012), spora Glomus rata-rata memiliki bentuk bulat sampai bulat lonjong, memiliki dinding spora mulai dari kuning bening sampai coklat kemerahan, permukaan dinding spora relatif halus dan memiliki dinding spora tipis. Selain Glomus, genus lain yang ditemukan
yaitu Acaulospora dan Scutellospora. Acaulospora yang ditemukan memiliki karakteristik spora bulat, berwarna kuning kemerahan, dinding spora relatif tebal dan ketika bereaksi dengan larutan Melzer’s, bagian tengah spora berubah warna menjadi merah kecoklatan. Menurut Hall (1984) dalam Patriyasari, spora Acaulospora memiliki bentuk bulat lonjong, dinding spora yang relatif tebal dan berwarna orange kemerahan. Sedangkan Scutellospora yang ditemukan memiliki karakteristik spora bulat, berwarna kuning muda hingga kuning kemerahan, dinding spora relatif tebal berwarna coklat dan ketika bereaksi dengan larutan Melzer’s warna spora menjadi coklat tua hingga merah coklat seluruhnya. Menurut INVAM (2008), spora Scutellospora bereaksi dengan larutan Melzer’s secara menyeluruh. Warna sporanya merah coklat ketika bereaksi dengan larutan Melzer’s.
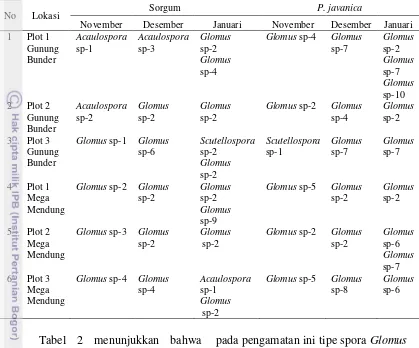
Hasil identifikasi spora yang diperoleh dari setiap pengamatan menunjukkan bahwa terjadinya perubahan tipe spora yang terbentuk, dapat dilihat pada Tabel 2.
a b
c 80 µm
Tabel 2 Dinamika genus FMA yang diperoleh pada setiap lokasi dalam tiga kali pengamatan
No Lokasi Sorgum P. javanica
November Desember Januari November Desember Januari 1 Plot 1 termasuk dalam genus Acaulospora pada dua lokasi pengambilan sampel tanah yang berbeda. Terlihat bahwa dinamika spora pada setiap pengamatan berbeda-beda, tipe spora yang ditemukan cenderung hanya satu kali dalam tiga kali pengamatan. Tipe spora yang paling dominan ditemukan pada masing-masing lokasi adalah Glomus sp. Menurut INVAM (2008), Glomus adalah jenis yang paling dominan (52.3%), diikuti Acaulospora (20.9%), Scutellospora (16.9%), Gigaspora (4.7%), Entrophospora (2.3%), Arcaheospora (1.7%) dan Paraglomus (1.2%). Penyebaran genus Glomus di alam tergolong sangat tinggi sehingga
pada pengamatan ini tipe spora Glomus selalu ditemukan. Ragupathy dan Mahadevan (1991) dalam Delvian (2006) mempelajari FMA pada hutan pantai juga menyimpulkan bahwa Glomus adalah jenis FMA yang paling dominan penyebarannya, dari 25 spesies dari 37 spesies yang ditemukan adalah tipe Glomus. Jumlah tipe spora yang diperoleh dari setiap lokasi berbeda, baik antar lokasi dalam waktu pengamatan yang sama maupun dalam lokasi yang sama dengan waktu pengamatan yang berbeda. Secara umum, dalam tiga kali pengamatan jumlah tipe spora pada lokasi Plot 1 Gunung Bunder lebih banyak daripada lima lokasi lainnya.
Bunder, dari tiga kali pengamatan ditemukan tipe spora Acaulospora sp-1 pada pengamatan pertama dan Acaulospora sp-3 pada pengamatan kedua. Sedangkan pada pengamatan ketiga, tipe spora yang ditemukan yaitu Glomus sp-2 dan Glomus sp-4 dengan tanaman inang Sorgum. Pada pengamatan pertama dengan tanaman inang P. javanica tipe spora yang ditemukan yaitu Glomus sp-4, Glomus sp-7 pada pengamatan kedua dan Glomus 2, Glomus 7, Glomus sp-10 pada pengamatan ketiga. Tipe spora yang dapat ditemukan pada setiap waktu pengamatan yaitu Glomus sp-2
dan ada yang hanya ditemukan dalam satu kali pengamatan yaitu Acaulospora sp-1, Acaulospora sp-2, Acaulospora sp-3, Glomus sp-1, Glomus sp-3, Glomus sp-5, Glomus sp-6, Glomus sp-8, Scutellospora sp-1 dan Scutellospora sp-2.
Analisis Tanah
Kondisi lingkungan sangat mempengaruhi keberadaan spora FMA didalam tanah, seperti kondisi fisik dan kimia tanah. Hasil analisis tanah pada kedua lokasi pengambilan sampel ditunjukkan pada Tabel 3.
Tabel 3 Hasil analisis tanah
Gunung Bunder yaitu liat sedangkan tekstur tanah pada Desa Mega Mendung yaitu lempung berpasir. Analisis tanah pada Desa Mega Mendung hanya satu, karena kondisi umur tegakan yang sama sehingga sampel tanah dari tiga plot pengamatan dikompositkan untuk kemudian dianalisis. Hasil analisis tanah menunjukkan bahwa kedua lokasi memiliki pH berkisar antara 4.6-5.5, menurut Hardjowigeno (2010) kriteria pH pada kedua lokasi pengamatan tergolong masam. Menurut Lembaga Penelitian Tanah (1983), pada plot 1 Gunung Bunder nilai hara P tergolong rendah (4.4 ‒ 6.6) dan nilai K tergolong tinggi. Plot 2 Gunung Bunder nilai hara P tergolong rendah (4.4 ‒ 11.00) dan nilai K tergolong sangat tinggi (> 1.0). Sedangkan pada plot 3 Gunung
Bunder, nilai hara P tergolong rendah dan nilai K tergolong sedang (0.3 ‒ 0.5). Kandungan C-organik dan K pada Desa Mega Mendung lebih tinggi dibandingkan Desa Gunung Bunder yaitu sebesar 3.82% dan 1.53 Me/100g. Kriteria sifat kimia tanah menurut Hardjowigeno (2010), nilai C-organik dan K di Desa Mega Mendung tergolong tinggi dan sangat tinggi. Sedangkan di Desa Gunung Bunder nilai C-organik pada tiga lokasi tergolong rendah yaitu 1.00 ‒ 2.00.
Perkembangan FMA
13
mendominasi dibandingkan dengan genus lainnya. Selain karena penyebarannya yang luas, keberadaan Glomus berkaitan dengan tekstur tanah pada masing-masing lokasi. Tekstur tanah pada Gunung Bunder yaitu liat, penyebaran Glomus pada lokasi ini mendominasi karena sesuai dengan penyebaran spora Glomus. Hal ini sesuai dengan Baon (1998) dalam Hapsoh (2008) bahwa tanah yang didominasi oleh fraksi liat (clay) merupakan kondisi yang sesuai untuk perkembangan spora Glomus. Sedangkan pada Mega Mendung dengan tekstur tanah lempung berpasir, didominasi juga oleh Glomus meskipun ditemukan juga genus lain yaitu Acaulospora. Jika dilihat nilai pH lokasi pengamatan berkisar antara 4.6 ‒ 5.5, individu yang ditemukan tidak hanya Glomus tetapi juga Acaulospora dan Scutellospora. Perkembangan FMA optimum pada pH 5.6 ‒ 7 untuk Glomus sp, 4 ‒ 6 untuk Gigaspora sp dan 4 ‒ 5 Acaulospora sp (Setiadi 1992; Gunawan 1993; Hepper 1984 dalam Tuheteru 2003). Penelitian ini menunjukkan bahwa Glomus mampu berkembang pada berbagai kondisi fisik dan kimia tanah.
Ketersediaan hara berkaitan dengan keberadaan spora, pada Mega Mendung kepadatan spora cenderung lebih sedikit dibandingkan Gunung Bunder baik pada tanaman inang Sorgum maupun P. javanica. Kepadatan spora cenderung tinggi pada plot 2 Gunung Bunder, karena kadar P yang rendah dapat meningkatkan perkembangan FMA. Perkembangan FMA dibatasi oleh ketersediaan hara unsur P, sampai batas tertentu peningkatan kadar P dapat meningkatkan perkembangan FMA, namun pada kadar yang semakin tinggi
justru berpengaruh negatif terhadap FMA (Feldmann et al. 2009). Apabila dilihat dari sifat fisik tanahnya, diketahui bahwa tanah Mega Mendung bertekstur lempung berpasir. Tanah lempung memiliki aerasi yang buruk sehingga konsentrasi oksigen pada tanah akan berkurang. Setiadi (1992) penurunan konsentrasi oksigen dapat menghambat perkecambahan spora FMA dan kolonisasi akar.
SIMPULAN DAN SARAN
Simpulan
Keanekaragaman FMA pada rizosfir jabon yang berhasil diidentifikasi terdapat 3 genus yaitu Glomus, Acaulospora dan Scutellospora. Keanekaragaman tipe spora FMA dipengaruhi oleh lingkungan, salah satunya sifat tanah dari masing-masing sampel, tipe spora yang ditemukan paling dominan adalah Glomus. Pembentukan spora (sporulasi) FMA memberikan respon yang berbeda terhadap perbedaan waktu pengamatan. Sporulasi FMA lebih berkaitan dengan respon tanaman inang dan ketersediaan unsur hara pada media tumbuh. Tanaman inang yang efektif untuk pemerangkapan spora pada penelitian ini yaitu Sorgum sp karena dari tiga kali pengamatan, kepadatan spora yang dihasilkan lebih tinggi dibandingkan P. javanica.
Saran
14
beragam dan periode pengamatan yang lebih panjang. Dengan demikian, diharapkan data dan informasi tentang dinamika sporulasi FMA yang diperoleh lebih komprehensif. Agric. Res. 33: 389-395.
Abbott LK dan Gazey C. 1994. An ecological view of the formation of VA mycorrhizas. Plant and Soil 159 : 69-78
Baon JB. 1998. Peranan Mikoriza VA Pada Kopi dan Kakao. Makalah disampaikan dalam workshop aplikasi fungi mikoriza arbuskula pada tanaman pertanian, perkebunan dan kehutanan. Bogor Bertham YH. 2006. Pemanfaatan CMA dan Bradyrhizobium Dalam Meningkatkan Produktivitas Kedelai Pada Sistem Agroforestri Kayu Bawang (Scorodocarpus borneensis, Burm. F) di Ultisol. [Disertasi]. Bogor: Sekolah PascaSarjana, IPB.
Brundrett MC, N. Melville and L. Peterson. 1994. Practical Methods in Mycorrhiza Research. Mycologue Publications. Ontario, Canada. 161p.
Brundrett MC, N. Bougher, B Dells, T. Grove, and N. Malajczuk.
1996. Working with
Mycorrhizas in Forestry and Agriculture. ACIAR, Canberra. 374p. Konservasi Tanah pada Lahan Berlereng. Pusat Penelitian dan Pengembangan Tanah dan Agroklimat. Bogor.
Delvian. 2003. Keanekaragaman cendawan mikoriza arbuskula (CMA) di hutan pantai dan potensi pemanfaatannya (Studi kasus di hutan cagar alam Leuweung Sancang Kabupaten Garut, Jawa Barat). [disertasi]. Bogor : Program Pascasarjana, Institut Pertanian Bogor.
Delvian. 2006. Peranan Ekologi dan Agronomi Cendawan Mikoriza Arbuskula. USU Repositor : Sumatera Utara
Feldman F, Hutter I, Schneider C. 2009. Best production practice of arbuscular mycorrhizal inoculum. Soil Biol 18: 319‒335
15
Gunawan AW. 1993. Mikoriza Arbuskula. Pusat Antar Universitas Ilmu Hayat. Institut Pertanian Bogor. Bogor
Hall IR. 1984. Taxonomy of VA
Mikoriza Arbuskula Pada Budidaya Kedelai Di Lahan Kering. Pidato Pengukuhan Guru Besar Fakultas Pertanian Universitas Sumatera Utara. Medan
http://invam.caf.wvu.edu/ [20 Mei 2013].
INVAM [International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi]. 2008. Reference Cultures Of Species (vesicular) arbuscular
mycorrhizal fungi.
File://D:/draft%202/species%20IN
Karepesina S. 2007. Keanekaragaman fungi mikoriza arbuskula dari bawah tegakan jati ambon (Tectona grandis Linn. f.) dan potensi pemanfaatannya. [Tesis]. Bogor: Sekolah PascaSarjana IPB Kartika E. 2006. Tanggap
pertumbuhan, serapan hara dan karakter morfofisiologi terhadap
cekaman kekeringan pada bibit kelapa sawit yang bersimbiosis dengan CMA. [Disertasi]. IPB. 188 hal.
Lembaga Penelitian Tanah. 1983. Sistem Klasifikasi Tanah Definisi dan Kriteria, Istilah serta Perubahan-perubahan terhadap TOR Tipe A 1981. Lembaga Penelitian Tanah. Bogor
Mansur I, Setiadi Y dan Primaturi R. 2002. Status of research on mycorrhiza arbuscula associated with tropical tree species. Paper presented at the Fourth International Wood Science Symposium (4th IWSS) LIPI-JSPS Core University program in the Field of Wood Science. 2-3 September 2002. Research Center for Physics Indonesian Institute of Science, Serpong, Tangerang, Indonesia.
Mansur I. 2003. Gambaran umum cendawan mikoriza arbuskula (CMA). Tidak dipublikasikan. Makalah pada “Teknikal Asistensi
dalam Penelitian Mikoriza”.
Fakultas Pertanian Universitas Haluoleo. Kendari.
Mansur I, Tuheteru DF. 2010. Kayu Jabon. Jakarta: Penebar Swadaya
Maryadi F. 2002. Status dan keragaman CMA di bawah tegakan klonal Jati (Tectona grandis L.f) pada umur 4-7 tahun di kebun benih klonal Padangan [skripsi]. Fakultas Kehutanan Institut Pertanian Bogor. 53 hal.
16
grandis L.f). [Disertasi]. Bogor: Sekolah PascaSarjana IPB
Pacioni G. 1992. Wet sieving and decanting techniques for the extraction of spores of VA mycorrhizal fungi. Hal : 317-322. Di dalam : Norris, J.R., D.J. Read and A.K. Varma (Eds). Methods in Microbiology. Vol. 24. Academic Press Inc. San Diego. Patriyasari T. 2006. Efektivitas
Cendawan Mikoriza Arbuskula (CMA) terhadap pertumbuhan dan produktivitas Dactylon cynodon (L.) Pers yang diberi level salinitas berbeda. [Skripsi]. Bogor : Institut Pertanian Bogor
Phillips J.M. and D.S. Hayman. 1970. Improved procedures for clearing roots and staining parasitic and salinitas dengan kelimpahan cendawan mikoriza arbuskula (CMA) pada lahan hutan pantai dan hutan mangrove di cagar alam Leuweung Sancang, Kabupaten Garut, Jawa Barat. [skripsi]. Bogor : Fakultas Kehutanan Institut Pertanian Bogor. 33 hal. Puspitasari et al. 2012. Eksplorasi
Vesicular Arbuscular Mycorrhiza (VAM) Indigenous pada Lahan Jagung di Desa Torjun, Sampang Madura. Jurnal Sains dan Seni ITS Vol. 1. ISSN: 2301-928X Ragupathy S & Mahadevan A. 1991.
VAM distribution influenced by salinity gradient in coastal tropical forest. Di dalam : Soerjanegara I & Supriyanto, editor. Proceeding of second Asian Conference on
Mycorrhiza. Bogor : BIOTROP Special Publication. No. 42. SEAMEO BIOTROP. Hlm 91‒97 Rainiyati. 2007. Status dan
Keanekaragaman Cendawan Mikoriza Arbuskula (CMA) Pisang Raja Nangka dan Potensi
Pemanfaatannya untuk
Peningkatan Produksi Pisang Asal Kultur Jaringan di Kabupaten Merangin, Jambi. [disertasi]. Sekolah Pascasarjana IPB, Bogor. 140p. (tidak dipublikasikan)
Setiadi Y. 1992. Mikoriza dan Pertumbuhan Tanaman. Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi Pusat Antar Universitas IPB. Bogor
Setiadi Y. 1995. The Practical Application of Arbuscular Mycorrizhae Fungi for Reforestation in Indonesia. [Thesis]. Kent: Reseacrh School of Biosciences, University of Kent. Simanungkalit RDM. 2000.
Pemanfaatan jamur mikoriza arbuskular sebagai pupuk hayati untuk memberlanjutkan produksi
pertanian. Makalah “Seminar
Sehari”, Peranan Mikoriza Dalam
Pertanian yang Berkelanjutan. Universitas Padjadjaran, Bandung. Smith SE & DJ Read. 1997.
Mycorrhizal symbiosis. Second edition. Academic Press. Harcourt Brace & Company Publisher. London. Hal 32-79 Smith SE & DJ Read. 2008.
Mycorrhizal Symbiosis. Third edition : Academic Press. Elsevier Ltd. New York, London, Burlington, San Diego. 768 p. Srivastava, D., R. Kapoor, S.K.
17
Mycorrhiza – an overview. Dalam: Mukerji, K.G (Ed). Concepts in Mycorrhizal Research. Kluwer Academic Publishers. Netherlands Swasono DH. 2006. Peranan Mikoriza Arbuskular dalam Mekanisme Adaptasi Beberapa Varietas Bawang Merah Terhadap Cekaman Kekeringan Di Tanah Pasir Pantai. [Disertasi]. Bogor: Sekolah Pasaca Sarjana, Institut Pertanian Bogor.
Tawaraya K, Watanabe S, Yoshida E, Wagatsuma T. 1996. Effect of onion root exudates on the hypal growth of Gigaspora margarita. Mycorrhiza 6:57-59
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
DINAMIKA SPORULASI GENUS FUNGI MIKORIZA
ARBUSKULA HASIL PENANGKARAN DARI BAWAH
TEGAKAN HUTAN TANAMAN JABON
(Anthocephalus cadamba Roxb Miq.)
ERFAN HANDANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Dinamika Sporulasi Genus Fungi Mikoriza Arbuskula Hasil Penangkaran Dari Bawah Tegakan Hutan Tanaman Jabon (Anthocephalus cadamba Roxb Miq.)
Nama : Erfan Handani NIM : E44090011
Disetujui oleh
Dr Ir Irdika Mansur, MForSc Pembimbing I
Dr Ir Sri Wilarso Budi R, MS Pembimbing II
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
PRAKATA
Puji syukur kehadirat Allah SWT atas segala rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Dinamika Sporulasi Genus Fungi Mikoriza Arbuskula Hasil Penangkaran dari Bawah Tegakan Hutan Tanaman Jabon (Anthocephalus cadamba Roxb Miq.)”. Penelitian ini merupakan salah satu syarat dalam memperoleh gelar Sarjana Kehutanan pada Fakultas Kehutanan Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr Ir Irdika Mansur, MForSc dan Bapak Dr Ir Sri Wilarso Budi R, MS selaku dosen pembimbing yang telah memberikan arahan dan bimbingan kepada penulis dalam pelaksanaan dan penyelesaian skripsi ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga atas doa dan semangatnya. Selain itu, penghargaan penulis sampaikan kepada seluruh staf Laboratorium Silvikultur, Bapak Dr Ir Yadi Setiadi, MSc, Ibu Nana, beserta staf Laboratorium Bioteknologi Hutan PPSHB IPB, Bapak Dr Ir Maman Turjaman, DEA, Bapak Sugeng beserta staf Laboratorium Mikrobiologi Tanah Pusat Penelitian dan Pengembangan Sumber Daya Hutan Bogor dan staf Laboratorium Tanah SEAMEO BIOTROP. Terima kasih juga kepada Bapak Faisal Danu Tuheteru SHut MSi, Ibu Ir Husna Faad, MP, Bapak Ir Suheri, Jinwon Seo Bachelor of Agriculture MSi, teman-teman satu bimbingan (Dewi, Destia, Azzam dan Panji), Agustina, Devi, Artha, Memet serta teman-teman Silvikultur 46 yang telah memberi semangat dan dukungannya kepada penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Penulis mengharapkan kritik dan saran yang membangun dari pembaca dan semoga skripsi ini dapat bermanfaat bagi semua pihak.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL iv
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN iv
PENDAHULUAN 1
Latar Belakang 1
Tujuan 1
METODE 2
Waktu dan Lokasi Penelitian 2
Bahan dan Alat 2
Prosedur Penelitian 2
Pengambilan Sampel Tanah 2
Persiapan Tanaman Inang 3
Penangkaran Mikoriza (Trapping) 3
Pemeliharaan Tanaman Inang 3
Pengamatan Spora dan Infeksi Akar 4
Perhitungan Spora 4
Ekstraksi dan Identifikasi Spora 4
HASIL DAN PEMBAHASAN 5
Kondisi Umum Pengambilan Sampel Tanah 5
Kepadatan Spora 5
Persentase Kolonisasi Akar 7
Identifikasi dan Karakterisasi Spora FMA 8
Analisis Tanah 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR TABEL
1 Persentase infeksi akar pada tanaman inang S. bicolor dan P. javanica bulan November 2012 sampai dengan Januari 2013 8 2 Dinamika genus FMA yang diperoleh pada setiap lokasi dalam tiga kali
pengamatan 11
DAFTAR GAMBAR
1 Sampel tanah yang diambil dari rizosfer jabon dan pohon jabon yang memiliki pertumbuhan paling baik dari plot pengamatan 3 2 Media tumbuh berupa zeolit, tanah, zeolit dan penangkaran mikoriza
serta penanaman benih tanaman inang 4
3 Fluktuasi kepadatan spora FMA per 50 gram tanah pada tanaman inang S. bicolor dan P. javanica yang diperoleh dari tiga kali pengamatan 6 4 Infeksi FMA yang ditemukan pada akar P. javanica dengan perbesaran
400 x 7
5 Genus Glomus yang ditemukan pada tanaman inang S. bicolor dalam
tiga kali pengamatan dengan perbesaran 400 x 9
6 Genus Glomus yang ditemukan pada tanaman inang P. javanica dalam
tiga kali pengamatan dengan perbesaran 400 x 9
7 Genus Acaulospora yang ditemukan pada tanaman inang S. bicolor dalam tiga kali pengamatan dengan perbesaran 400 x 10 8 Genus Scutellospora yang ditemukan pada tanaman inang S. bicolor
dan P. javanica dalam tiga kali pengamatan dengan perbesaran 400 x 10
DAFTAR LAMPIRAN
1 Kepadatan spora per 50 gram tanah pada tanaman inang S. bicolor 15 2 Kepadatan spora per 50 gram tanah pada tanaman inang P. javanica 15
1
PENDAHULUAN
Latar Belakang
Degradasi lahan adalah proses penurunan produktivitas lahan yang sifatnya sementara maupun tetap dicirikan dengan penurunan sifat fisik, kimia dan biologi. Lahan kritis merupakan salah satu bentuk lahan terdegradasi (Dariah et al. 2004). Lahan yang terdegradasi umumnya menjadi tidak produktif sehingga perlu upaya untuk perbaikan lahan, salah satunya yaitu dengan membangun hutan tanaman. Pemilihan jenis cepat tumbuh merupakan pertimbangan dalam membangun hutan tanaman. Hutan tanaman yang banyak dikembangkan belakangan ini yaitu hutan tanaman jabon. Jabon (Anthocephalus cadamba Roxb Miq) merupakan jenis pohon pionir asli Indonesia yang memiliki penyebaran alami yang luas dari Aceh sampai Papua (Mansur 2010). Salah satu upaya untuk meningkatkan pertumbuhan jabon yaitu dengan pemberian pupuk. Namun pemupukan dalam areal yang luas memerlukan biaya yang cukup besar sehingga diperlukan alternatif lain yaitu dengan penggunaan fungi mikoriza arbuskula (FMA). Fungi mikoriza arbuskula termasuk ke dalam golongan endomikoriza. Endomikoriza merupakan suatu bentuk fungi yang banyak didapat pada jaringan dalam akar. Tipe fungi ini selalu ditemukan pada lapisan tanah yang subur dan memiliki karakteristik khas yang meliputi tempat penyimpanan dan transfer makanan antara jamur dan tumbuhan inangnya (Mier et al. 2000).
Penggunaan FMA merupakan alternatif yang lebih baik dibandingkan dengan penggunaan pupuk buatan (Nusantara 2011). Penggunaan FMA sebagai pupuk hayati diperkirakan akan menjadi alternatif teknologi masa depan karena tidak menyebabkan polusi dan tidak adanya pengaruh negatif terhadap ekosistem dan lingkungan (Umam 2008). Fungi mikoriza arbuskula dapat ditemukan hampir pada semua ekosistem, termasuk pada lahan masam (Kartika 2006) dan alkalin (Swasono 2006). Menurut Smith dan Read (2008), FMA dapat berasosiasi dengan hampir 90% jenis tanaman. Keanekaragaman spora FMA selalu berubah dengan perubahan waktu pengamatan, jenis inang dan tingkat salinitas (Delvian 2003). Sejauh ini, informasi mengenai keanekaragaman dan sporulasi FMA pada hutan tanaman jabon masih terbatas. Oleh karena itu, penelitian mengenai dinamika sporulasi FMA pada hutan tanaman jabon perlu dilakukan.
Tujuan
2
METODOLOGI
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan November 2012 sampai dengan Januari 2013. Lokasi pengambilan sampel tanah dilakukan di Desa Sukaresmi Kecamatan Mega Mendung Kabupaten Bogor dan Desa Pamijahan Gunung Bunder Kabupaten Bogor. Penangkaran mikoriza dilakukan di rumah kaca Departemen Silvikultur, Laboratorium Silvikultur Fakultas Kehutanan IPB, sedangkan untuk mengidentifikasi FMA dilakukan di Laboratorium Bioteknologi Hutan, PPSHB IPB dan Laboratorium Mikrobiologi Tanah Pusat Penelitian dan Pengembangan Sumber Daya Hutan Bogor. Analisis tanah dilakukan di Laboratorium Tanah SEAMEO BIOTROP.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah sampel tanah, kantong plastik, benih Pueraria javanica, benih Sorgum bicolor, zeolit, pupuk Terabuster, NaOCl 5.25%. Ekstraksi dan identifikasi spora FMA dibutuhkan larutan glukosa 60%, larutan Melzer’s sebagai bahan pewarna spora. Pewarnaan akar dibutuhkan bahan-bahan kimia seperti KOH 10%, HCL 2%, larutan Trypan Blue 0.05% (campuran lactic acid 40 mL, glyceryn 40 mL dan aquades 20 mL).
Alat-alat yang digunakan untuk pengambilan sampel tanah dan akar tanaman adalah cangkul, spidol dan kertas label. Pengamatan di laboratorium menggunakan saringan spora (saringan bertingkat dua yaitu 710 µm, dan 45 µm), sentrifuse, pipet plastik, pinset spora, kaca preparat, pipet, timbangan analitik, gunting akar, mikroskop dissecting dan binokuler, cover glass, cawan petri, sprayer dan pot plastik berdiameter 20 cm.
Prosedur Penelitian
Pengambilan Sampel Tanah
3 gram pada zona rizosfer dengan kedalaman 5‒20 cm secara komposit dari 3 titik sekitar perakaran jabon dengan mengikuti akar jabon, sehingga tanah yang diambil benar-benar dari rizosfer jabon.
Gambar 1 Sampel tanah yang diambil dari rizosfer jabon (a) dan pohon jabon yang memiliki pertumbuhan paling baik dari plot pengamatan (b)
Persiapan Tanaman Inang
Tanaman inang yang digunakan untuk penangkaran yaitu benih P. javanica dan S. bicolor. Benih-benih P. javanica terlebih dahulu direndam dalam larutan NaOCl 5.25% sebanyak satu sendok makan selama 5‒10 menit, kemudian dibilas dengan air sampai tidak berbau dan direndam air hangat selama 10 menit untuk mematahkan dormansinya. Setelah itu, benih P. javanica dapat langsung ditanam.
Penangkaran Mikoriza (Trapping)
Teknik penangkaran yang digunakan mengikuti metode Brundrett et al. (1996) dengan menggunakan pot-pot kecil. Menurut INVAM (2012a) kultur paling tidak berumur 4 bulan untuk dapat dipanen dan diamati sporanya. Media tanam yang digunakan berupa sampel tanah sebanyak 100 gram (masing-masing 50 gram untuk tiap tanaman inang) dan batuan zeolit sebanyak 150 gram. Zeolit yang akan digunakan sebagai media penangkaran, dicuci terlebih dahulu untuk memisahkan kotoran yang ada pada zeolit. Media penangkaran (Gambar 2) dibuat dengan cara pot berdiameter 20 cm diisi dengan zeolit hingga setengah volume pot, kemudian disi dengan sampel tanah, dan terakhir ditutup kembali dengan zeolit, sehingga media akan tersusun atas zeolit - sampel tanah - zeolit (Delvian 2006).
Pemeliharaan Tanaman Inang
Pemeliharaan yang dilakukan adalah penyiraman, pemupukan dan pengendalian terhadap hama penyakit. Penyiraman dilakukan sebanyak satu kali sehari di pagi hari. Pemupukan dilakukan satu kali pada awal penanaman dengan menggunakan pupuk Terabuster dengan dosis 100 mL per tanaman untuk membantu pertumbuhan tanaman inang. Pengendalian hama dan penyakit dilakukan dengan membebaskan tanaman dari serangga dan membersihkan bagian dasar tanaman dari dedaunan yang masuk ke dalam pot.
4
Gambar 2 Media tumbuh berupa zeolit - tanah - zeolit (a) dan penangkaran mikoriza serta penanaman benih tanaman inang (b)
Pengamatan Spora dan Infeksi Akar
Pengamatan spora dilakukan dengan mengambil sampel tanah hasil penangkaran pada tanaman inang. Pengambilan sampel tanah untuk pengamatan, dilakukan dengan cara memisahkan zeolit bagian atas dari media penangkaran, kemudian tanah yang ada pada bagian tengah diambil sebanyak 50 gram disertai dengan pengambilan akarnya. Kegiatan pengambilan sampel tanah ini dilakukan secara periodik dengan interval waktu 1 bulan yang dimulai pada November 2012 sampai dengan Januari 2013.
Pengamatan infeksi akar dapat dilihat dengan cara pewarnaan akar. Pewarnaan akar dilakukan dengan metode Phyllip dan Hyman (1970). Pengamatan akar dilakukan dengan memotong akar yang telah diwarnai sepanjang 1 cm, kemudian akar ditata di atas preparat dan ditutup dengan cover glass, jumlah akar tiap preparat sebanyak 10 potong. Infeksi akar dapat dilihat melalui adanya vesikula, arbuskula, hifa maupun spora yang menginfeksi akar. Perhitungan infeksi akar menggunakan rumus sebagai berikut:
∑ bidang pandang terinfeksi
Akar terinfeksi (%) = X 100% ∑ bidang pandang keseluruhan
Perhitungan Spora
Kepadatan spora adalah banyaknya spora tiap sampel tanah yang dianalisis. Kepadatan spora dapat dihitung dengan rumus:
Kepadatan spora = jumlah spora/berat tanah yang dianalisis
Ekstraksi dan Identifikasi Spora
Ekstraksi spora dilakukan dengan mengikuti teknik tuang saring dari Pacioni (1992) dan metode sentrifugasi mengikuti Brundrett et al. (1996). Preparat spora dibuat untuk melakukan identifikasi spora FMA yang ditemukan. Preparat spora dibuat menggunakan bahan pewarna Melzer’s untuk membantu dalam mempercepat identifikasi spora sampai tingkatan genus. Spora-spora FMA yang diperoleh dari isolasi diletakkan dalam larutan Melzer’s. Spora dipecahkan secara hati-hati dengan cara menekan kaca penutup preparat menggunakan ujung
5 lidi. Perubahan warna spora dalam larutan Melzer’s adalah salah satu indikator untuk menentukan genus spora yang ada.
HASIL DAN PEMBAHASAN
Kondisi Umum Wilayah Pengambilan Sampel Tanah
Pengambilan sampel tanah didapatkan dari dua lokasi yang berbeda yaitu Desa Sukaresmi Kecamatan Mega Mendung Kabupaten Bogor dan Desa Pamijahan Gunung Bunder Kabupaten Bogor. Kondisi umum pada Desa Sukaresmi yaitu tegakan jabon dikombinasikan dengan tanaman bunga dan pisang, tegakan jabon pada lokasi ini berumur 2 tahun 5 bulan. Secara geografis lokasi ini berada pada ketinggian 900 m dpl dengan curah hujan tahunan sebesar 3178.8 mm/tahun dan rata-rata temperatur 17.8‒23.91 oC (Seo 2013).
Desa Pamijahan berada di ketinggian 435 m dpl dengan curah hujan tahunan antara 2500‒3000 mm/tahun dan rata-rata temperatur 24‒28 oC (Seo 2013). Desa Pamijahan memiliki kondisi umum yang berbeda, terdapat kombinasi antara tanaman jabon dengan tanaman lainnya. Umur tegakan jabon pada lokasi ini berbeda-beda, yaitu umur 7 bulan, 11 bulan, dan 17 bulan.
Tegakan jabon yang berumur 7 bulan dikombinasikan dengan ubi dengan jarak tanam antar pohon 2 x 2,5 m. Umur tegakan jabon 11 bulan dikombinasikan dengan tanaman suren dengan jarak tanam yang digunakan yaitu 2 x 2.5 m, sedangkan pada tegakan jabon yang berumur 17 bulan dikombinasikan dengan dua jenis tanaman lainnya yaitu sengon dan suren dengan jarak tanam yaitu 3 x 2.5 m.
Kepadatan spora
Isolasi tanah pada rizosfer jabon dari dua lokasi pengambilan sampel memiliki nilai kepadatan spora FMA bervariasi dan berfluktuasi pada setiap tanaman. Kepadatan spora per 50 gram tanah pada tanaman inang S. bicolor dan P. javanica dapat dilihat pada Lampiran 1 dan 2. Dinamika kepadatan spora pada tanaman S. bicolor dan P. javanica dalam tiga kali pengamatan dapat dilihat pada Gambar 3.
6
Gambar 3 Fluktuasi kepadatan spora FMA per 50 gram tanah pada tanaman inang S. bicolor dan P. javanica yang diperoleh dari tiga kali pengamatan
Kepadatan spora Mega Mendung, pada tanaman inang S. bicolor dan P. javanica mengalami penurunan pada bulan Desember dan Januari. Hal ini dikarenakan perbedaan jenis tanah, lingkungan tumbuh (suhu, cahaya, dan kelembapan), dan ketinggian tempat di Gunung Bunder dan Mega Mendung sebagai salah satu faktor yang berpengaruh terhadap penyebaran jenis FMA dan kepadatan spora. Menurut Rainiyati (2007) bahwa perbedaan kepadatan spora kemungkinan dipengaruhi oleh perbedaan lingkungan (jenis tanah, hara tanaman, ketinggian tempat, cahaya).
Kepadatan spora pada tanaman inang S. bicolor dan P. javanica Gunung Bunder pada bulan Desember mengalami peningkatan dimungkinkan karena spora sedang berkecambah. Bulan Januari kepadatan spora pada S. bicolor dan P. javanica mengalami penurunan karena tanaman inang S. bicolor mati dan media penangkaran basah karena disiram, sehingga spora yang sudah terbentuk menjadi berkecambah yang menyebabkan kepadatan spora turun secara drastis. Kepadatan spora Gunung Bunder pada tanaman inang P. javanica, bulan November 2012 sebanyak 128 spora/50 gram tanah, bulan Desember 2012 sebanyak 253 spora/50 gram dan bulan Januari 2013 sebanyak 26 spora/50 gram tanah. Kepadatan spora Mega Mendung pada tanaman inang P. javanica, bulan November 2012 sebanyak 72 spora/50 gram tanah, bulan Desember 2012 sebanyak 55 spora/50 gram tanah dan bulan Januari 2013 sebanyak 12 spora/50 gram tanah. Hasil ini jauh lebih tinggi dibandingkan dengan penelitian Karepesina (2007) yang menemukan 24‒40 spora/50 gram tanah dari bawah tegakan jati ambon di lokasi Salahutu.
Gambar 3 juga menunjukkan bahwa kepadatan spora pada tanaman inang S. bicolor dan P. javanica terlihat berbeda. Kepadatan spora pada tanaman inang S. bicolor menghasilkan kepadatan spora yang lebih tinggi dibandingkan dengan P. javanica, sehingga S. bicolor lebih efektif untuk pemerangkapan spora dibandingkan P. javanica. Hal ini dikarenakan S. bicolor memiliki sistem perakaran yang baik untuk pembentukan mikoriza (Sirappa 2003). Menurut
7 Patriyasari (2006) jumlah spora dipengaruhi oleh mikoriza itu sendiri dan varietas tanaman inang. Perbedaan kepadatan spora pada tiga kali pengamatan menginformasikan bahwa keanekaragaman FMA pada suatu lokasi tergantung pada jenis FMA yang bersporulasi pada saat tersebut. Menurut Delvian (2003) bahwa adanya perubahan kepadatan spora dalam setiap pengamatan menunjukkan bahwa setiap jenis FMA membentuk spora pada saat yang berbeda, tergantung responnya terhadap tanaman inang.
Persentase Kolonisasi Akar
Infeksi akar dicirikan oleh adanya asosiasi antara FMA dengan akar yang membentuk struktur-struktur yang dihasilkan oleh FMA seperti hifa, vesikula, arbuskula maupun spora. Adanya satu atau lebih struktur FMA tersebut, maka dapat dikatakan terjadi infeksi oleh FMA. Hasil pengamatan infeksi akar hanya ditemukan struktur hifa dan vesikula saja sedangkan struktur arbuskula tidak ditemukan. Struktur hifa dan vesikula dapat dilihat pada Gambar 4.
Gambar 4 Infeksi FMA yang ditemukan pada akar P. javanica berupa hifa (a) dan vesikula (b) dengan perbesaran 400 x
Kolonisasi akar dihitung berdasarkan jumlah bidang pandang terinfeksi terhadap total bidang pandang yang diamati. Tingkat infeksi pada akar diklasifikasikan menurut The Instate of Mycorrhizal Research and Development, USDA Forest Service, Athena Georgia (Setiadi 1992) sebagai berikut:
Kelas 1, bila infeksinya 0%‒5%, sangat rendah, kelas 2 bila infeksinya 6%‒25%, rendah, kelas 3 bila infeksinya 26%‒50%, sedang, kelas 4 bila infeksinya 51%‒75%, tinggi, kelas 5 bila infeksinya 76%‒100%, sangat tinggi.
Hasil pengamatan menunjukkan bahwa telah terjadi asosiasi antara FMA dengan akar tanaman inang. Persentase infeksi akar pada tiap tanaman inang berbeda-beda yang dapat dilihat pada Tabel 1.
8 Tabel 1 Persentase infeksi akar pada tanaman inang S. bicolor dan P. javanica
bulan November 2012 sampai dengan Januari 2013
Lokasi
Persen infeksi akar (%)
S. bicolor P. javanica
November Desember Januari November Desember Januari Plot 1 Gunung Bunder 18.33r
46.67s 33.33s 51.67t 61.67t 56.67t Plot 2 Gunung Bunder 16.67r 60.00t 41.67s 51.67t 53.33t 50.00s Plot 3 Gunung Bunder 70.00t
45.00s 48.33s 53.33t 85.00st 68.33t Plot 1 Mega Mendung 36.67s 60.00t 41.67s 38.33s 33.33s 50.00s Plot 2 Mega Mendung 61.67t 36.67s 36.67s 53.33t 63.33t 58.33t Plot 3 Mega Mendung 45.00s
46.67s 36.67s 11.67r 41.67s 55.00t r = rendah, s = sedang, t = tinggi, st = sangat tinggi, huruf di belakang angka menunjukkan tingkat infeksi FMA pada akar S. bicolor dan P. javanica.
Tabel 1 menunjukkan bahwa persentase infeksi akar pada tanaman inang S. bicolor bulan November sebesar 16.67‒70.00% dengan kriteria infeksi akar rendah-tinggi. Bulan Desember sebesar 36.67‒60.00% dengan kriteria sedang -tinggi dan bulan Januari sebesar 33.33‒48.33% dengan kriteria sedang. Persentase infeksi akar pada tanaman inang P. javanica bulan November berkisar antara 11.67‒53.33% dengan kriteria rendah-tinggi. Bulan Desember berkisar antara 33.33‒85.00% dengan kriteria sedang-sangat tinggi dan bulan Januari berkisar antara 50.00‒68.33% dengan kriteria sedang-tinggi.
Infeksi akar pada bulan November‒Desember cenderung meningkat baik pada tanaman S. bicolor dan P. javanica. Infeksi akar pada bulan
Desember‒Januari cenderung menurun baik tanaman inang S. bicolor maupun P.
javanica. Menurut Fitter dan Merryweather (1992) bahwa variasi infeksi akar tumbuhan oleh FMA di alam berbeda dengan berbedanya tempat dan waktu.
Persentase infeksi akar dalam penelitian ini lebih besar pada P. javanica dibandingkan dengan S. bicolor karena memiliki sedikit bulu akar sehingga akan berupaya untuk memperluas eksploitasi akar dengan mikoriza. Simanungkalit (2000) menyatakan bahwa sistem perakaran seperti serabut yang memiliki rambut akar yang banyak umumnya dianggap kurang bergantung pada infeksi mikoriza dibandingkan dengan tanaman dengan sistem perakaran yang kasar dan memiliki sedikit atau tanpa rambut akar. Persentase infeksi akar tidak berhubungan erat dengan kepadatan spora. Hal ini sesuai dengan Tuheteru (2003) bahwa antara infeksi akar dan jumlah spora yang dihasilkan tidak memiliki korelasi yang erat, sehingga spora yang banyak belum tentu persentase infeksi akar akan tinggi pula.
Identifikasi dan Karakterisasi Spora FMA
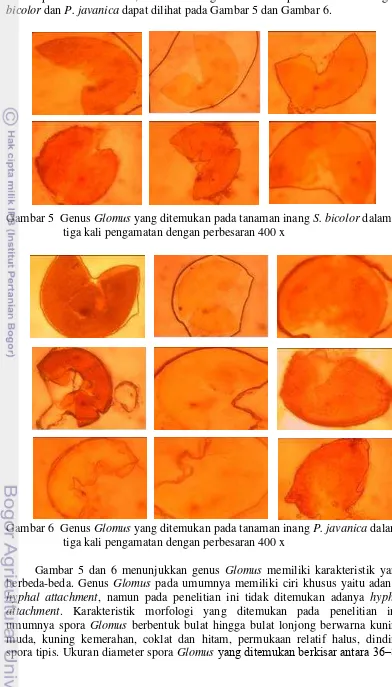
9 terhadap larutan Melzer’s, karakteristik genus Glomus pada tanaman inang S. bicolor dan P. javanica dapat dilihat pada Gambar 5 dan Gambar 6.
Gambar 5 Genus Glomus yang ditemukan pada tanaman inang S. bicolor dalam tiga kali pengamatan dengan perbesaran 400 x
Gambar 6 Genus Glomus yang ditemukan pada tanaman inang P. javanica dalam tiga kali pengamatan dengan perbesaran 400 x
10 µm. Hal ini sesuai dengan Puspitasari et al. (2012), spora Glomus rata-rata memiliki bentuk bulat sampai bulat lonjong, memiliki dinding spora mulai dari kuning bening sampai coklat kemerahan, permukaan dinding spora relatif halus dan memiliki dinding spora tipis. Selain Glomus, ditemukan juga genus Acaulospora yang dapat dilihat pada Gambar 7 dan genus Scutellospora yang dapat dilihat pada Gambar 8.
Gambar 7 Genus Acaulospora yang ditemukan pada tanaman inang S. bicolor dalam tiga kali pengamatan dengan perbesaran 400 x
Gambar 7 menunjukkan genus Acaulospora yang ditemukan memiliki karakteristik spora bulat, berwarna kuning kemerahan, dinding spora relatif tebal dan ketika bereaksi dengan larutan Melzer’s, bagian tengah spora (germination wall) berubah warna menjadi merah kecoklatan. Ukuran diameter spora Acaulospora yang ditemukan berkisar antara 60‒100 µm. Menurut Hall (1984) dalam Patriyasari (2006), spora Acaulospora memiliki bentuk bulat lonjong, dinding spora yang relatif tebal dan berwarna orange kemerahan.
Gambar 8 Genus Scutellospora yang ditemukan pada tanaman inang S. bicolor (a) dan P. javanica (b) dalam tiga kali pengamatan dengan perbesaran 400 x
Gambar 8 menunjukkan bahwa genus Scutellospora yang ditemukan memiliki memiliki karakteristik spora bulat, berwarna kuning muda hingga kuning kemerahan, dinding spora relatif tebal berwarna coklat dan ketika bereaksi dengan larutan Melzer’s warna spora menjadi coklat tua hingga merah coklat seluruhnya. Ukuran rata-rata diameter spora Scutellospora yang ditemukan yaitu 160 µm. Menurut INVAM (2012b), spora Scutellospora bereaksi dengan larutan Melzer’s secara menyeluruh. Warna sporanya merah coklat ketika bereaksi dengan larutan Melzer’s. Hasil identifikasi spora yang diperoleh dari setiap pengamatan dapat dilihat pada Tabel 2.
Tabel 2 menunjukkan bahwa dinamika spora pada setiap pengamatan berbeda-beda, genus yang paling dominan ditemukan pada masing-masing lokasi adalah Glomus. Frekuensi perubahan tipe spora yang terdapat pada suatu lokasi antar waktu pengamatan bervariasi. Terlihat pada lokasi plot 1 Gunung Bunder, dari tiga kali pengamatan ditemukan genus Acaulospora pada pengamatan
11 pertama dan kedua. Pengamatan ketiga, genus yang ditemukan yaitu Glomus dengan tanaman inang S. bicolor. Pada tiga kali pengamatan dengan tanaman inang P. javanica genus yang ditemukan yaitu Glomus. Lokasi plot 1 dan plot 2 Mega Mendung, hanya genus Glomus yang ditemukan pada kedua tanaman inang. Hal ini menunjukkan bahwa Glomus memiliki penyebaran yang paling luas dibandingkan dengan genus lainnya. Menurut INVAM (2012b), Glomus adalah jenis yang paling dominan (52.3%), diikuti Acaulospora (20.9%), Scutellospora (16.9%), Gigaspora (4.7%), Entrophospora (2.3%), Arcaheospora (1.7%) dan Paraglomus (1.2%).
Tabel 2 Dinamika genus FMA yang diperoleh pada setiap lokasi dalam tiga kali pengamatan
Lokasi S. bicolor P. javanica
November Desember Januari November Desember Januari Plot 1
Gunung Bunder
Acaulospora Acaulospora Glomus Glomus Glomus Glomus
Plot 2 Gunung Bunder
Acaulospora Glomus Glomus Glomus Glomus Glomus
Plot 3 Gunung Bunder
Glomus Glomus Scutellospora
Glomus
Scutellospora Glomus Glomus
Plot 1 Mega Mendung
Glomus Glomus Glomus Glomus Glomus Glomus
Plot 2 Mega Mendung
Glomus Glomus Glomus Glomus Glomus Glomus
Plot 3 Mega Mendung
Glomus Glomus Acaulospora
Glomus
Glomus Glomus Glomus
Analisis Tanah
Kondisi lingkungan sangat mempengaruhi keberadaan spora FMA didalam tanah, seperti kondisi fisik dan kimia tanah. Penelitian Seo (2013) menunjukkan bahwa pH Gunung Bunder berkisar antara 4.60‒4.80, unsur P 4.73‒10.34 ppm, unsur K 0.50‒1.48 me/100g, C-organik 1.16‒1.62% dengan tekstur liat. Mega Mendung memiliki pH 5.50, unsur P 3.14 ppm, unsur K 1.53 me/100g, C-organik 3.82% dengan tekstur lempung berpasir. Menurut Hardjowigeno (2010) pH kedua lokasi tergolong masam (Lampiran 3).