AKTIVITAS EKSTRAK ETANOL BATANG SIPATAH-PATAH
(Cissus quadrangula Salisb) SEBAGAI
ANTIOSTEOPOROSIS PADA TIKUS (Rattus norvegicus)
MUSTAFA SABRI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Aktivitas Ekstrak Etanol Batang Sipatah-patah (Cissus quadrangula Salisb) sebagai Antiosteoporosis pada Tikus (Rattus norvegicus) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, 17 Februari 2011
iii
ABSTRACT
Mustafa Sabri. The Activity of Ethanol-extract of Sipatah-patah (Cissus quadrangula Salisb) as an Antiosteoporosis on Female Rats (Rattus norvegicus). Under the supervision of Nurhidayat as chairman, Koeswinarning Sigit, Wasmen Manalu, and Bambang Pontjo Priosoeryanto as members of the Supervisory Committee.
Osteoporosis relates to characteristic and microscopic structural changes of bones. An experiment was conducted to study the effect of sipatah-patah extract (ESP) on the prevention and treatment of osteoporosis. In this study, forty female rats were divided into two groups: nonovariectomized group (NOV group) (20 rats) used to study the ability of ESP in preventing osteoporosis and ovariectomized group (OV group) (20 rats) used to study the effect of ESP in treating osteoporosis. Nonovariectomized (NOV) and OV rats were adapted for 10 days before treatment. Nonovariectomized group was divided into five groups: control group (NOV-0) and groups given ESP at the age of 30 days (NOV-1), 60 days (NOV-2), 90 days (NOV-3), and 120 days (NOV-4) with dose 750 mg/kg body weight/day orally. Ovariectomized group was also divided into five groups: sham group (OV-0) consisted of rats that only sliced skin without ovariectomy and ESP administration, control group was ovarietomized group without ESP administration (OV-1), and ovariectomized groups given ESP at the age of 90 days (OV-2), 120 days (OV-3), and 150 days (OV-4) with dose 750 mg/kg body weight/day orally. All treatments were within 180 days period. Weighing was done every 15 days (twice a month), and blood samples were drawn every 30 days via coccygeal vein approximately 2 ml for analizing calcium and phosphate concentrations. At the end of treatment, rats were euthanized and, subsequently, radiography examination was done to observe bone mass. Then, necropsy was done to observe the histology of bone, liver, kidney, and parathyroid gland. Right tibio-fibula bones, kidney, liver, and parathyroid were sampled and fixated using Buffered Neutral Formalin 10%. Furthermore, left radio-ulna bones and lumbar vertebrae II-V bones were taken to analyze the calcium and phosphorous bone concentrations. The kidney, liver, and parathyroid gland tissues were stained using hematoxylin-eosin (HE) (Humason 1967) to observe the toxicity effect of ESP. The bones were stained with HE to count the osteoblast and the osteoclast, and also stained with Masson Trichrome staining (Kiernan 1990) to observe the trabecular changes.
The result showed that ESP administration for 150 days in nonovariectomized rats (NOV-1) optimized calcium and phosphate concentrations, solid trabeculae, and had an effect on increasing the active osteoblast without toxic effects on the liver and kidney. Meanwhile, ESP administration on ovariectomized rats for 120 days (OV-2) was able to maintain calcium and phosphate homeostasis, improved the density and solidity of microscopic image of trabecular bone, and histological examination showed that ESP inhibited the formation of the osteoclast. Both observations showed no toxicity effect on liver and kidney.
v
RINGKASAN
MUSTAFA SABRI. Aktivitas Ekstrak Etanol Batang Sipatah-patah (Cissus quadrangula Salisb) sebagai Antiosteoporosis pada Tikus (Rattus norvegicus). Di bawah bimbingan Nurhidayat sebagai ketua, Koeswinarning Sigit, Wasmen Manalu, dan Bambang Pontjo Priosoeryanto masing-masing sebagai anggota komisi pembimbing.
Osteoporosis pada wanita lanjut usia sulit disembuhkan secara sempurna. Berbagai risiko dapat timbul akibat terapi hormonal sintetis, sehingga usaha pengobatan osteoporosis dialihkan kepada pemberian kalsium dan fosfor dalam makanan disertai dengan peningkatan aktivitas fisik serta penggunaan bahan-bahan yang berasal dari tanaman. Salah satu tanaman yang telah digunakan secara tradisional oleh masyarakat di Aceh untuk mengobati fraktur tulang dan sakit sendi adalah sipatah-patah (Cissus quadrangula Salisb). Oleh karena itu, perlu dilakukan penelitian tentang khasiat sipatah-patah pada tikus masa pertumbuhan (prepubertas) untuk mencegah kejadian osteoporosis pada masa tua dan mengobati tikus osteoporosis yang diinduksi melalui ovariektomi. Dalam pelaksanaan penelitian ini batang tanaman sipatah-patah diekstraksi dengan etanol sehingga diperoleh ekstrak etanol batang sipatah-patah (ESP).
Penelitian ini menggunakan 40 ekor tikus betina galur Spraque Dawley
umur 20 hari yang dibagi menjadi dua kelompok masing-masing 20 ekor. Tikus-tikus penelitian ini diadaptasikan di dalam kandang selama 10 hari. Kelompok pertama nonovariektomi (NOV) untuk menguji aktivitas ESP dalam mencegah osteoporosis, sedangkan 20 ekor lainnya diovariektomi pada umur 50 hari (OV) untuk menguji aktivitas ESP dalam mengobati osteoporosis. Tikus kelompok NOV dibagi menjadi lima grup masing-masing empat ekor tikus, yang terdiri atas grup kontrol (NOV-0) tanpa ESP, sedang empat grup lainnya masing-masing diberi ESP mulai umur 30 hari (NOV-1), 60 hari (NOV-2), 90 hari (NOV-3), dan 120 hari (NOV-4). Tikus kelompok OV juga dibagi menjadi lima grup yaitu dua grup kontrol OV-0 (sham) dan kontrol OV-1 (osteoporosis), keduanya tidak diberi ESP. Tiga grup lainnya adalah tikus ovariektomi yang diberi ESP masing-masing mulai umur 90 hari (OV-2), 120 hari (OV-3), dan 150 hari (OV-4). Masa penyembuhan luka operasi tikus ovariektomi dilakukan selama sepuluh hari.
Dosis ESP adalah 750 mg/kgBB/24 jam/per oral. Penimbangan bobot badan dilakukan setiap 15 hari, dan pengambilan darah setiap 30 hari. Semua tikus NOV dieutanasi pada umur 180 hari sedangkan tikus OV pada umur 210 hari. Selanjutnya dilakukan pemeriksaan radiografi untuk menganalisis kondisi tulang. Sementara itu tulang radius-ulna kiri serta tulang vertebra lumbalis II-V diambil untuk analisis kadar kalsium dan fosfor. Dilakukan pula pengukuran panjang tulang femur. Sayatan tulang tibia-fibula diwarnai dengan Hematosilin-eosin (HE) dan Masson trichrome (MT) untuk menganalisis densitas osteoblas dan osteoklas, serta kepadatan trabekula tulang.
vi
Selain itu, perbedaan panjang tulang femur tikus NOV-1 sebesar 10,76 %, yang diikuti NOV-2 3,17 %, NOV-3 2,47 %, dan NOV-4 1,84 % lebih panjang dibanding kontrol (P<0,05). Hal ini menandakan bahwa ukuran kerangka tubuh semakin besar dan disertai peningkatan bobot badan.
Dari hasil pemeriksaan kadar kalsium darah tikus NOV-1 menunjukkan peningkatan dibandingkan pada tikus NOV-0 yang justru menurun. Peningkatan kadar kalsium tikus NOV-1 pada akhir perlakuan meningkat sebesar 4,49% yang dikuti NOV-2, NOV-3, dan NOV-4 masing-masing 4,92%, 4,89% dan 0,26% dibanding tikus kontrol (P <0,05). Peningkatan kadar kalsium darah tertinggi selama masa pemberian ESP ditunjukkan tikus NOV-2 dan NOV-3, pada tikus tersebut masing dalam periode peningkatan. Pada tikus NOV-1 kadar kalsium sudah mencapai level optimum sehingga pemberian ESP secara terus menerus tidak meningkat, melainkan dideposit ke dalam tulang atau kelebihan kalsium diekskresikan melalui ginjal, oleh mekanisme homeostasis. Pada tikus NOV-4 diduga karena rentang waktu pemberian ESP terlalu singkat untuk dapat meningkatkan kadar kalsium darah. Berbeda dari hasil yang diperoleh pada pengukuran kadar kalsium darah, pemberian ESP tidak memberikan pengaruh nyata pada kadar fosfor darah, karena kemungkinan kadar fosfor dalam darah sudah berada dalam level optimum. Pada gambaran mikroskopis sayatan memanjang tulang tibia masih ditemukan adanya sasaran epifisis disertai adanya sel-sel kondrosit yang sedang berproliferasi dan proses osifikasi pada trabekula. Hal ini menunjukkan bahwa tikus ini masih dalam masa pertumbuhan dan belum mencapai dewasa tubuh. Pada gambaran mikroskopis tulang tibia tikus dengan pewarnaan MT, tikus NOV-1 memiliki gambaran sasaran epifisis, substansia kompakta, dan trabekula dengan warna biru lebih pekat dibandingkan pada tikus NOV-0. Hal ini menandakan bahwa proses osifikasi sedang berlangsung.
Di samping itu, pada gambaran mikroskopis tulang tibia tikus juga ditemukan osteoblas aktif lebih padat dan densitas osteoklas lebih rendah dibandingkan pada tikus NOV-0, maupun tikus perlakuan lainnya. Sementara itu aktivitas osteoblas dan osteoklas di daerah metafisis lebih dominan ditemukan pada substansia spongiosa bagian sentral, dibandingkan dengan bagian tepi, sebagai akibat tenaga tarik oleh tendo dan ligamentum yang bertaut di bagian tepi metafisis tulang tersebut. Pembuluh darah juga banyak ditemukan di daerah metafisis yang berdekatan dengan keberadaan osteoklas dalam proses resorbsi tulang untuk sarana transportasi hasil metabolisme tulang. Walaupun analisis terhadap kadar kalsium dan fosfor tulang tikus perlakuan memberikan hasil yang sama dengan tikus kontrol (P>0,05), kerangka tubuh tikus-tikus perlakuan lebih besar dibandingkan tikus kontrol, sehingga kadar kalsium total tulang perlakuan relatif lebih tinggi dibandingkan pada tikus kontrol. Kondisi ini dapat dilihat dari gambaran radiografi tulang tibia tikus yang diberi ESP selama 150, 120, dan 90 hari menunjukkan densitas yang lebih radiopaque pada bagian epifisis, metafisis, dan diafisis dibandingkan pada tikus NOV-0. Dengan demikian, pemberian ESP di awal dan lama waktu pemberian ESP diduga berperan dalam peningkatan pertumbuhan bobot badan, ukuran tulang femur, kalsium dan fosfor, osteoblas aktif yang meningkat dan menekan keberadaan osteoklas sehingga terjadi perbaikan kualitas tulang yang ditunjukkan dengan kepadatan trabekula tulang yang meningkat.
vii
peningkatan bobot badan sejalan dengan lamanya waktu pemberian ESP dibandingkan pada tikus kontrol (OV-1) (P<0,05). Bobot badan OV-2 meningkat sebesar 26,13 g (16,99 %) yang diikuti oleh OV-3 dan OV-4 masing-masing sebesar 20,43 g (13,28 %) dan 17,85 g (11,6 %) dibandingkan pada tikus OV-1. Sementara itu tikus ovariektomi yang diberi ESP secara umum mengalami pertambahan panjang tulang femur. Panjang tulang femur tikus OV-2, OV-3, dan OV-4 di akhir penelitian masing-masing lebih panjang 4,11 %, 3,70 %, dan 2,12 % dibandingkan pada tikus OV-1 (P<0,05). Dengan demikian nutrisi yang terkandung dalam ESP yaitu kalsium, fosfor, dan fitoestrogen secara langsung dapat meningkatkan pertumbuhan tulang dan secara tidak langsung dapat meningkatkan bobot badan akibat peningkatan pertumbuhan tulang.
Kadar kalsium darah pada tikus OV-2, OV-3, dan OV-4 meningkat selama masa pemberian ESP, walaupun pada akhir perlakuan kadar kalsium tikus OV-2, OV-3, dan OV-4 tidak setinggi kadar kalsium tikus sham (P>0,05) tetapi lebih tinggi dari OV-1 (P<0,05). Hasil ini mengindikasikan bahwa pemberian ESP dapat meningkatkan kadar kalsium darah pada tikus ovariektomi walaupun tidak setinggi pada tikus sham. Kondisi yang sama juga ditemukan pada kadar fosfor darah yang diberi ESP meningkat sejalan dengan lama pemberian ESP dibandingkan dengan tikus OV-1, walaupun belum dapat menyamai kadar fosfor pada tikus sham. Keadaan yang sama juga ditemukan pada kadar kalsium tulang. Pada tikus OV-2 peningkatan kadar kalsium tulang adalah sebesar 2,68 % dibandingkan pada tikus OV-1 yang diikuti OV-3 dan OV-4 masing-masing sebesar 2,32 % dan 1.97 % (P<0,05), walaupun kadar kalsium tulang tikus ovariektomi yang diberi ESP tidak setinggi pada tikus sham. Pola yang mirip ditemukan juga pada kadar fosfor. Peningkatan kadar fosfor tulang OV-2 sebesar 0,25 %, yang dikuti OV-3 dan OV-4 masing-masing 0,14 % dan 0,24 % dibandingkan pada tikus OV-1. Pada gambaran radiografi, tulang tibia tikus OV-2 terlihat lebih radiopaque dibandingkan tikus OV-1, gambaran tingkat kepadatan tulang ini dikuti oleh tikus OV-3 dan OV-4. Walau demikian gambaran radiografi tulang tibia tikus ovariektomi menunjukkan densitas yang lebih radiolucent
dibandingkan pada tikus sham. Sementara itu, pada tikus OV-2 densitas osteoblas aktif lebih padat dan densitas osteoklas lebih rendah dibandingkan pada tikus OV-1 dan tikus perlakuan lainnya. Dengan demikian, ESP memengaruhi homeostasis kalsium dan fosfor darah. Hal ini terlihat pada peningkatan kadar kalsium tikus OV-2 yang meningkat pada level optimal walaupun produksi estrogen diduga sangat menurun. Waktu pemberian ESP yang lebih lama mampu mensubstitusi defisiensi kadar kalsium, fosfor, dan estrogen akibat ovariektomi. Tikus OV-2 menunjukkan densitas trabekula yang lebih rapat dibandingkan pada tikus OV-1 maupun pada tikus OV-3 dan OV-4. Pemberian ESP yang lebih lama pada tikus OV-2 dapat mengurangi kehilangan massa tulang yang ditunjukkan dengan mikrostruktur trabekula yang lebih rapat, dan juga mengurangi aktivitas osteoklas serta merangsang osteoblas dalam pembentukan massa tulang dibandingkan dengan tikus OV-1. Efek ini diduga erat hubungannya dengan interaksi fitoestrogen dalam ESP dengan reseptor estrogen alpha atau beta (ER-α, ER-β) pada osteoblas seperti halnya aktivitas estrogen endogen pada osteoblas. Dengan demikian pemberian ESP asal Aceh dapat mencegah osteoporosis pada tikus betina nonovariektomi prepubertas dan mengobati osteoporosis pada tikus ovariektomi dengan cara mempertahankan kadar kalsium darah, peningkatan densitas osteoblas aktif, dan penurunan densitas osteoklas sehingga terjadi peningkatan kepadatan trabekula tulang.
viii
©Hak cipta milik IPB, tahun 2010 Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
ix
AKTIVITAS EKSTRAK ETANOL BATANG SIPATAH-PATAH
(
Cissus quadrangula
Salisb) SEBAGAI
ANTIOSTEOPOROSIS PADA TIKUS (
Rattus norvegicus
)
MUSTAFA SABRI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
x
Penguji pada Ujian Tertutup : 1. Dr. Nastiti Kusumorini
(Dosen pada Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, IPB, Bogor)
2. Dr. drh. Chairun Nisa’, MSi, PAVet
(Dosen pada Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, IPB, Bogor)
Penguji pada Ujian Terbuka : 1. Drh. Yulvian Sani, Ph.D.
(Kepala Bidang Program dan Evaluasi pada Balai Besar Penelitian Veteriner (BALITVET) Kementerian Pertanian Republik Indonesia di Bogor)
2. Dr. drh. Hera Maheshwari, M.Sc.
xi
Judul Penelitian : Aktivitas Ekstrak Etanol Batang Sipatah-patah (Cissus quadrangula Salisb) sebagai Antiosteoporosis pada Tikus (Rattus norvegicus)
Nama : Mustafa Sabri
NIM : B 161060021
Disetujui : Komisi Pembimbing
Ketua
Dr. drh. Nurhidayat, MS, PAVet
Anggota
Prof. Dr. drh. Koeswinarning Sigit, MS
Anggota
Prof. Dr. Ir. Wasmen Manalu
Anggota
Prof. Dr. drh. Bambang P. Priosoeryanto, MS, APVet
Mengetahui:
Ketua Program Studi Sains Veteriner
Prof. Dr. drh. Bambang P. Priosoeryanto, MS, APVet
Dekan Sekolah Pascasarjana IPB
Prof. Dr. Ir. Khairil A. Notodiputro, MS
xiii
PRAKATA
Bismillahirrahmanirrahiim.
Segala puji bagi Allah SWT, Tuhan semesta alam, yang telah menurunkan Al Qu’ran yang suci dan mulia sebagai penerang dan petunjuk bagi seluruh umat manusia. Shalawat dan salam kepada Baginda Rasulullah SAW, yang telah membawa risalah kebenaran Islam kepada umatnya, juga kepada keluarga, para sahabat, dan pengikut beliau hingga akhir zaman. Alhamdulilah atas rahmat dan karunia Allah SWT, penulis dapat menyelesaikan penelitian yang dilaksanakan sejak bulan Agustus 2008 dengan judul Aktivitas Ekstrak Etanol Batang Sipatah-patah (Cissus quadrangula Salisb) sebagai Antiosteoporosis pada Tikus (Rattus norvegicus).
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih yang setinggi-tingginya kepada Bapak Dr. drh. Nurhidayat, MS, PAVet sebagai ketua komisi pembimbing, Prof. Dr.drh. Koeswinarning Sigit, MS, Prof. Dr. Ir. Wasmen Manalu, dan Prof. Dr. drh. Bambang Pontjo Priosoeryanto, MS, APVet masing-masing sebagai anggota komisi pembimbing, atas bimbingan, saran, dan arahan mulai dari penulisan proposal, pelaksanaan penelitian, hingga penyempurnaan penulisan ini sehingga dapat menambah wawasan penulis dalam berbagai hal yang tertuang dalam disertasi ini.
Penulis juga mengucapkan terima kasih kepada Rektor Universitas Syiah Kuala dan Dekan Fakultas Kedokteran Hewan, Universitas Syiah Kuala atas izinnya yang telah memberikan kesempatan penulis untuk melanjutkan pendidikan Doktor, pada Program Studi Sains Veteriner di Sekolah Pascasarjana IPB. Ucapan terima kasih disampaikan juga kepada Departemen Klinik, Reproduksi dan Patologi, Laboratorium Riset Anatomi AFF FKH-IPB, Laboratorium Patologi KRP-FKH-IPB beserta seluruh staf, atas kesempatan dan segala fasilitas yang diberikan selama penulis menempuh pendidikan, sehingga penelitian ini dapat berlangsung dengan baik. Kepada Direktur Jenderal Pendidikan Tinggi penulis mengucapkan terima kasih atas pemberian dana dari Beasiswa Pendidikan Pascasarjana (BPPS), Program Sandwich, dan Program Hibah Doktor. Tak lupa juga ucapan terima kasih yang sebesar-besarnya disampaikan kepada Pemerintah Aceh Darussalam atas Beasiswa NAD selama tiga tahun mengikuti pendidikan S3 di IPB.
Penulis juga menyampaikan terima kasih dan penghargaan kepada
Dr. drh. Heru Setijanto, PAVet (K), Dr. drh. Srihadi Agungpriyono, PAVet (K), Dr. drh. Chairun Nisa’, MSi, PAVet, Dr. drh. Savitri Novelina, MSi, PAVet,
drh. Supratikno, MSi, PAVet, yang senantiasa memberikan dukungan dan semangat.
Penulis juga menyampaikan terima kasih dan penghargaan kepada rekan-rekan mahasiswa seangkatan yang setia dan penuh pengorbanan Dr. drh. I Nyoman Suarsana, MSi (FKH-UNUD), Dr. Ir. Najamuddin, MSi, (Universitas Tadulako), Dr. Muharram Saipulloh, SSi, MSc, drh. Sutiastuti, MSi. (BALIVET), Dr. drh. Sophia Setiawati, MP (Karantina Jakarta), Dr. drh. Ni Ketut Natih Karuni, MSi. (BPMSOH), drh. Sri Wahyuni, MSi, Harry, SSi, drh. Mawar Subangkit, drh. Faisal, drh. Siti Asyiah, yang dengan setia menemani penulis di perantauan. Rasanya tidak cukup ucapan terima kasih yang dapat penulis sampaikan di tulisan ini, hanya Allah SWT yang dapat membalasnya.
xiv
Hj. Katidjah Main atas kasih sayang dan doa restunya, dan juga kepada kakak Maryani, SPd, Dra Nuraini, Ir. Drs. Hasan Basri, SpI. MSi, MT, Sofiati, SPd, Nurlaili, SH, SP, Rahmad Fadli, SE, MSi, dan adik Fauzi Helmi, ST, MT, Bambang Yusri, ST, MT, Yeni Yusraini, SP, MP, atas doanya serta kepada istri yang tercinta Safrida Afriana, ST, MSc, ananda Alya Kurnila Ramazani, atas kasih sayang, kesabaran, pengorbanan dan dorongannya yang telah mengantar penulis hingga dapat menyelesaikan studi S-3 saya.
Terima kasih kepada Ibu Nurtamani, Mas Bayu, Pak Holid, Pak Soleh, Pak Kasnadi, Pak Ngdang, Mas Koko yang sangat banyak membantu selama penelitian berlangsung, juga Pak Hasanuddin, Pak Sayuti, Pak Ali, dan kawan-kawan di FORKUB dan IKAMAPA Universitas Syiah Kuala di Bogor serta kepada berbagai pihak atas bantuan dan kerja samanya selama penulis mengikuti pendidikan di Sekolah Pascasarjana IPB Bogor.
Semoga karya ilmiah ini bermanfaat dan semoga Allah SWT memberi rahmat bagi kita semua. Amin
Bogor, 17 Februari 2011
xv
RIWAYAT HIDUP
Penulis dilahirkan di Sigli pada tanggal 10 April 1969 sebagai putera ketujuh (dari sepuluh bersaudara) dari pasangan H.Yacub Hasan, SH (Alm) dan Hj. Sawiyah Puteh. Penulis diterima pada Fakultas Kedokteran Hewan, Universitas Syiah Kuala melalui SIPENMARU pada tahun 1988, lulus Sarjana Kedokteran Hewan pada tahun 1994 dan memperoleh gelar Dokter Hewan pada tahun 1995. Pada tahun 1998 penulis diterima di Program Studi Sains Veteriner Pascasarjana Universitas Gadjah Mada Yogyakarta dan memperoleh gelar Magister Pertanian pada tahun 2000. Kesempatan melanjutkan pendidikan pada jenjang program Doktor pada program Sains Veteriner Sekolah Pascasarjana Institut Pertanian Bogor diperoleh pada tahun 2006 yang dibiayai oleh BPPS, Departemen Pendidikan Tinggi Republik Indonesia.
Sejak tahun 1997 sampai sekarang, penulis bekerja sebagai dosen tetap di Bagian Anatomi, Fakultas Kedokteran Hewan Universitas Syiah Kuala Darussalam Banda Aceh.
Selama mengikuti program S-3, penulis telah menghasilkan beberapa artikel. Artikel yang sudah diterbitkan dengan judul: “Analysis of Phytochemical and Mineral Content of Sipatah-patah Plant (Cissus quandrangula Salisb) from Aceh as Osteoporosis Premedication” pada Jurnal Rona Lingkungan Volume 1, No 2, September 2009. Artikel lain yang akan diterbitkan berjudul: “Kualitas Tulang Tikus Betina Normal yang diberi Ekstrak Sipatah-patah (Cissus quadrangula Salisb) pada Masa Pertumbuhan” pada Jurnal Veteriner (In press). Adapun artikel dengan judul: “The Effect of Sipatah-patah (Cissus quadrangula
xvi
DAFTAR ISI
Halaman
DAFTAR ISI ... xvi
DAFTAR TABEL ... xviii
DAFTAR GAMBAR ... xix
DAFTAR LAMPIRAN ... xxi
I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian ... 5
1.3. Manfaat Penelitian ... 5
1.4. Hipotesis ... 5
II. TINJAUAN PUSTAKA ... 7
2.1. Struktur Tulang ... 7
2.1.1. Komposisi Tulang. ... 10
2.1.2. Metabolisme Tulang ... 11
2.1.3. Modeling dan Remodeling Tulang ... 16
2.2. Osteoporosis ... 18
2.2.1. Kalsium ... 21
2.2.2. Fosfor ... 23
2.2.3. Vitamin D ... 24
2.2.4. Hormon Paratiroid ... 26
2.2.5. Estrogen ... 28
2.2.6. Fitoestrogen ... 29
2.3. Ovariektomi ... 31
2.4. Aplikasi Pengobatan Osteoporosis ... 31
2.5. Tanaman Sipatah-patah (Cissus quadrangula Salisb) ... 32
III. BAHAN DAN METODE ... 37
3.1. Tempat dan Waktu Penelitian ... 37
3.2. Materi ... 37
3.2.1. Tanaman Sipatah-patah (Cissus quadrangula Salisb) ... 37
3.2.2. Hewan Coba ... 37
3.2.3. Bahan Penelitan ... 38
3.2.4. Alat Penelitian ... 38
3.3. Metode ... 39
3.3.1. Pembuatan Ekstrak Batang Sipatah-patah (ESP) ... 39
3.3.2. Analisis Kandungan Kalsium dan Fosfor Bahan Aktif dan Analisis Senyawa Fitokimia Batang Sipatah-patah ... 39
3.3.3. Pembagian Kelompok Tikus ... 39
3.3.4. Kelompok Tikus Nonovariektomi (NOV) ... 39
3.3.5. Kelompok Tikus Ovariektomi (OV) ... 41
3.4. Parameter ... 42
3.5. Analisis Hasil ... 42
IV. HASIL DAN PEMBAHASAN ... 46
4.1. Hasil ... 46
xvii
4.1.2. Identifikasi Kandungan ESP ... 46
4.2. Pengaruh Pemberian ESP Kelompok Tikus Nonovariektomi ... 48
4.2.1. Pertumbuhan Bobot Badan Tikus ... 48
4.2.2. Pengukuran Panjang Tulang Femur ... 49
4.2.3. Kadar Kalsium dan Fosfor Darah ... 50
4.2.4. Gambaran Radiografi Tulang ... 53
4.2.5. Gambaran Mikroskopis Trabekula dan Buluh Darah Tulang Tibia ... 54
4.2.6. Aktivitas Osteoblas dan Osteoklas ... 58
4.2.7. Gambaran Mikroskopis Kelenjar Paratiroid ... 63
4.2.8. Gambaran Mikroskopis Hati dan Ginjal ... 65
4.3. Pengaruh Pemberian ESP Kelompok Tikus Ovariektomi ... 67
4.3.1. Bobot Badan Tikus ... 67
4.3.2. Panjang Tulang Femur ... 68
4.3.3. Kadar Kalsium dan Fosfor Darah ... 68
4.3.4. Gambaran Radiografi Tulang ... 71
4.3.5. Densitas Osteoblas dan Osteoklas ... 71
4.3.6. Gambaran Mikroskopis Trabekula dan Buluh Darah Tulang Tibia ... 73
4.3.7. Gambaran Mikroskopis Kelenjar Paratiroid ... 78
4.3.8. Gambaran Mikroskopis Hati dan Ginjal ... 79
4.4. Pembahasan ... 81
4.4.1. Hasil Analisis Batang Sipatah-patah ... 81
4.4.2. Hasil Kelompok Tikus Nonovariektomi ... 82
4.4.3. Hasil Kelompok Tikus Ovariektomi ... 85
V. KESIMPULAN DAN SARAN ... 93
DAFTAR PUSTAKA ... 95
xviii
DAFTAR TABEL
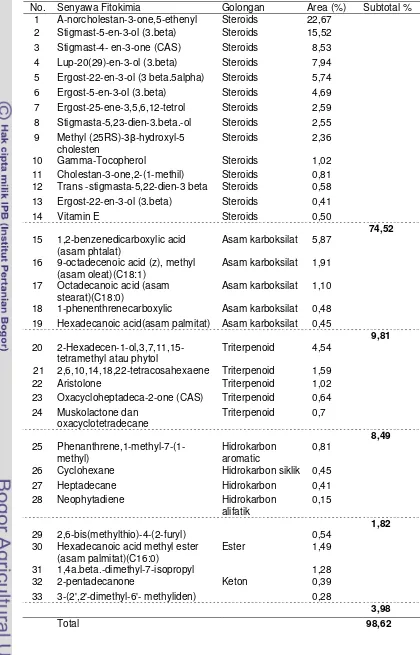
Halaman Tabel 1. Komponen fitokimia ESP ... 46 Tabel 2. Komposisi kimia ekstrak etanol batang sipatah-patah
berdasarkan GC-MS . ... 47 Tabel 3. Persentase perubahan kadar kalsium dan fosfor serum darah
tikus di awal dan di akhir pemberian ESP……….. ... 52 Tabel 4. Persentase kadar kalsium dan fosfor tulang tikus selama
masa pemberian ESP . ... 53 Tabel 5. Densitas osteoblas aktif dan pasif, osteoklas, dan buluh darah
pada tulang tibia tikus yang diberi ESP pada umur 30,60,90
dan 120 hari ... 63 Tabel 6. Persentase perubahan kadar kalsium dan fosfor serum darah
tikus ovariektomi di awal dan di akhir pemberian ESP . ... 70 Tabel 7. Persentase kadar kalsium dan fosfor tulang tikus ovariektomi
selama masa pemberian ESP ... 71 Tabel 8. Densitas osteoblas aktif dan pasif, osteoklas, dan buluh darah
pada tulang tibia tikus ovariektomi yang diberi ESP
xix
DAFTAR GAMBAR
Halaman
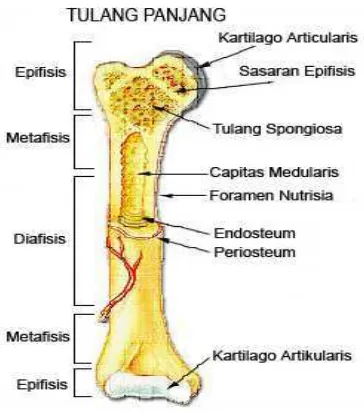
Gambar 1. Struktur tulang panjang ... 9
Gambar 2. Gambaran substansia kompakta dan substansia spongiosa (trabekula) di metafisis bagian proksimal tulang panjang ... 10
Gambar 3. Gambaran sel osteogenik, osteoblas, osteosit, dan osteoklas .... 13
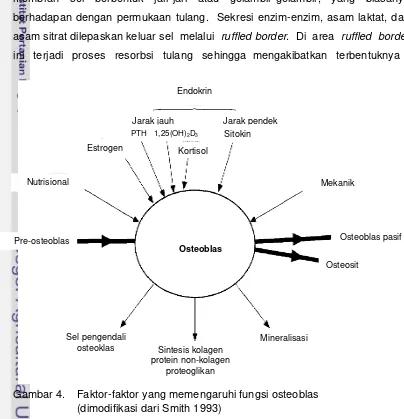
Gambar 4. Faktor-faktor yang memengaruhi fungsi osteoblas ... 14
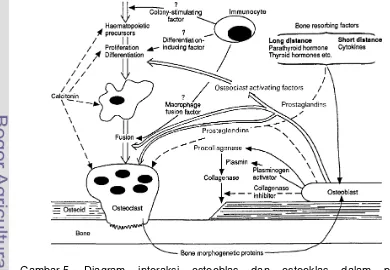
Gambar 5. Diagram interaksi dari osteoblas dan osteoklas dalam proses remodeling pada permukaan tulang ... 15
Gambar 6. Perubahan massa tulang berdasarkan umur pada manusia ... 16
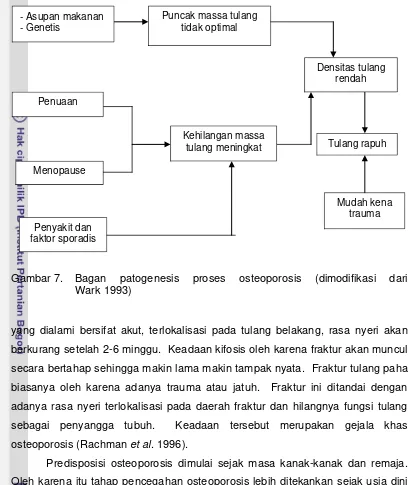
Gambar 7. Bagan patogenesis proses osteoporosis ... 20
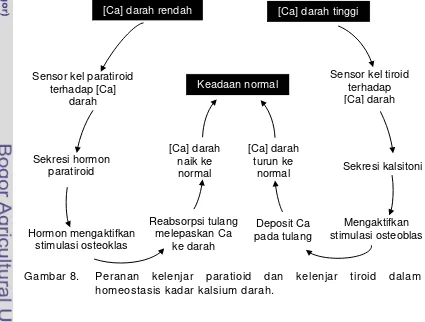
Gambar 8. Peranan kelenjar paratiroid dan kelenjar tiroid dalam homeostasis kadar kalsium darah ... 27
Gambar 9. Bangun struktur kimia estrogen endogen dan fitoestrogen
...
30Gambar 10. Morfologi tanaman sipatah-patah (Cissus quadrangula Salisb) dari Aceh dan Cissus quadrangularis Linn. dari India ... 34
Gambar 11. Skema alur penelitian ... 43
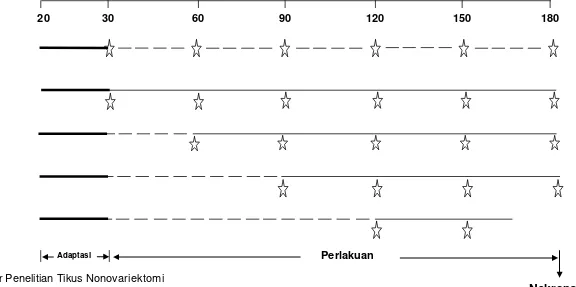
Gambar 12. Alur penelitian tikus nonovariektomi ... 44
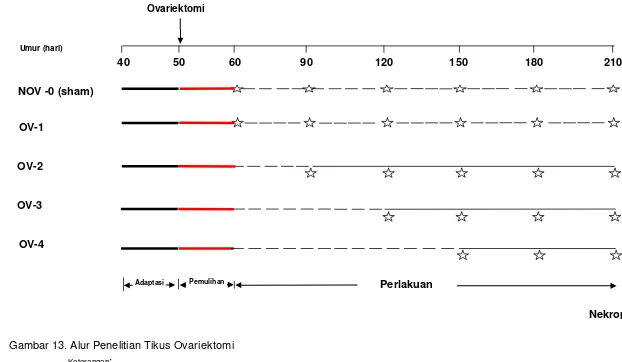
Gambar 13. Alur penelitian tikus ovariektomi ... 45
Gambar 14. Gambaran pertumbuhan bobot badan tikus yang ditimbang setiap 15 hari sekali dari umur 30 hingga 180 hari pada grup NOV-0,NOV-1, NOV-2, NOV-3, dan NOV-4... 49
Gambar 15. Diagram ukuran panjang tulang femur tikus setelah masa perlakuan selama 180 hari ... 50
Gambar 16. Gambaran kadar kalsium serum darah tikus yang diberi ESP mulai umur 30, 60, 90, dan 120 hari ... 51
Gambar 17. Gambaran kadar fosfor serum darah tikus yang diberi ESP mulai umur 30,60,90, dan 120 hari ... 51
Gambar 18. Gambaran radiografi tulang tibia tikus dengan perlakuan pemberian ESP mulai umur 30, 60, 90, dan 120 hari ... 54
Gambar 19. Gambaran umum tulang tibia ... 55
Gambar 20. Gambaran trabekula pada potongan memanjang tulang tibia tikus ... 56
Gambar 21. Gambaran sketsa densitas trabekula pada tulang tibia setelah pembuangan sumsum tulang ... 57
Gambar 22. Osteoblas pada tulang tibia tikus ... 59
Gambar 23. Gambaran osteoklas yang sedang merusak trabekula ... 59
Gambar 24. Distribusi osteoblas aktif dan pasifpada tulang tibia tikus umur 180 hari pada tikus kontrol dan yang diberi ESP pada umur 30, 60, 90, dan 120 hari ... 61
Gambar 25. Densitas osteoklas tulang tibia tikus yang diberi ESP mulai umur 30,60,90, dan 120 hari ... 63
Gambar 26. Gambaran mikroskopis kelenjar paratiroid tikus yang diberi ESP mulai umur 30, 60, 90, dan 120 hari ... 64
Gambar 27. Gambaran mikroskopis hati ... 65
xx
Gambar 29. Gambaran pertumbuhan bobot badan tikus ovariektomi yang ditimbang setiap 15 hari sekali dari umur 60 hingga 210 hari
pada OV-0, OV-1, OV-2, OV-3, dan OV-4 ... 67 Gambar 30. Diagram ukuran panjang tulang femur tikus ovariektomi
setelah masa perlakuan selama 180 hari ... 68 Gambar 31. Gambaran kadar kalsium serum darah tikus ovariektomi yang
diberi ESP pada umur 90, 120, dan 150 hari ... 69 Gambar 32. Gambaran kadar fosfor serum darah tikus ovariektomi yang
diberi ESP pada umur 90, 120, dan 150 hari ... 69 Gambar 33. Gambaran radiografi tulang tibia tikus ovariektomi
dengan perlakuan pemberian ESP pada umur 90,120, dan
150 hari ... 72 Gambar 34. Distribusi osteoblas aktif dan pasif pada tulang tibia tikus
ovariektomi umur 210 hari pada tikus kontrol dan yang diberi
ESP pada umur 90,120, dan 150 hari ... 74 Gambar 35. Densitas osteoklas tulang tibia tikus ovariektomi yang diberi
ESP pada umur 90,120, dan 150 hari ... 75 Gambar 36. Gambaran trabekula pada potongan memanjang dan sketsa
densitas trabekula tulang tibia setelah pembuangan bone marrow dari tikus ovariektomi yang diberi ESP selama 120, 90, dan 60 hari ... 77 Gambar 37. Gambaran mikroskopis kelenjar paratiroid tikus yang diberi
xxi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat identifikasi sipatah-patah ... 106 Lampiran 2. Komposisi makanan tikus... 107 Lampiran 3. Penapisan fitokimia tanaman sipatah-patah ... 108 Lampiran 4. Metode analisis proksimat ... 104 Lampiran 5. Metode ekstraksi ... 110 Lampiran 6. Metode kromatografi gas ... 111 Lampiran 7. Prosedur analisis kadar kalsium dan fosfor ... 111 Lampiran 8. Metode pewarnaan ... 114 Lampiran 9. Rerata berat badan kelompok pencegahan yang
ditimbang 15 hari sekali dari awal pemeliharaan ... 115 Lampiran 10. Panjang tulang femur ... 115 Lampiran 11. Rerata kadar kalsium darah kelompok pencegahan
yang diukur 1 bulan sekali dari awal pemeliharaan ... 116 Lampiran 12. Rerata kadar fosfor darah pada grup percobaan sebelum
dan sesudah pemberian ekstrak etanol sipatah-patah ... 116 Lampiran 13. Kadar kalsium dan fosfor tulang pada masa pencegahan
yang diberi ekstrak etanol sipatah-patah selama 180 hari
pada tikus putih ... 116 Lampiran 14. Rerata bobot badan kelompok pengobatan yang
ditimbang 2 minggu sekali dari awal pemeliharaan ... 117 Lampiran 15. Panjang tulang femur tikus perlakuan ovariektomi ... 117 Lampiran 16. Rerata kadar kalsium darah grup ovariektomi yang
diukur 1 bulan sekali dari awal pemeliharaan ... 117 Lampiran 17. Rerata kadar fosfor tikus ovariektomi yang diukur
1 bulan sekali dari awal pemeliharaan ... 118 Lampiran 18. Rerata kadar kalsium dan fosfor tulang pada grup
ovariektomi yang diberi ekstrak etanol sipatah-patah
I.
PENDAHULUAN
1.1. Latar Belakang
Tulang adalah organ keras yang berfungsi sebagai alat gerak pasif dan
menjadi tempat pertautan otot, tendo, dan ligamentum. Tulang juga berfungsi
sebagai penopang tubuh, melindungi organ tubuh yang lunak dan mudah rusak,
memberi bentuk tubuh serta juga sebagai tempat hemopoiesis darah (Favus
1993; Leeson et al. 1996). Tulang menjadi keras dan kuat karena dibentuk oleh kristal kalsium yang padat serta serabut kolagen yang lentur (Stevenson dan
Marsh 1992), sehingga tulang juga berfungsi sebagai deposit mineral, khususnya
kalsium, fosfat, dan magnesium dengan kepadatan tertentu melalui pengaturan
sistem homeostasis tubuh (Burger et al. 1995).
Tulang skeletal dewasa secara umum memiliki dua bagian, yaitu bagian
kompakta yang mencapai proporsi sekitar 80 % dan bagian spongiosa sekitar
20 % (Stevenson dan Marsh 1992). Bagian kompakta bersifat lebih padat dan
terletak di bagian tepi tulang sehingga dinamakan juga bagian korteks, yaitu
bagian yang padat dan tebal sesuai dengan fungsinya sebagai penyangga tubuh.
Bagian spongiosa disebut juga bagian trabekula karena bentuknya yang
berongga atau lamelar yang tersusun dalam garis-garis trayektori dengan arah
sesuai dengan tuntutan gerakan yang ditimbulkan oleh tarikan otot-otot dan
ligamentum yang bertaut padanya. Pada tulang panjang, bagian korpus
sebagian besar terdiri atas bagian tulang kompakta yang mengelilingi sumsum
tulang dan pada kedua ujungnya (metafisis) mengandung bagian spongiosa yang dikelilingi oleh tulang kompakta. Seluruh permukaan tulang, kecuali pada
permukaan persendian, dibungkus oleh lapisan jaringan ikat khusus yang disebut
periosteum, sedang bagian dalam dilapisi oleh selapis endosteum yang
membatasi rongga-rongga di bagian spongiosa, yaitu suatu lapisan jaringan ikat
yang fungsinya sama dengan periosteum, yaitu menjadi tempat sel-sel osteoblas
(Carola et al. 1990).
Jaringan tulang dibentuk oleh sel-sel tulang, yaitu osteosit, osteoblas, dan
osteoklas. Osteosit adalah sel osteoblas yang terpendam di dalam matriks
2
penghancur tulang. Dalam keadaan normal, osteoblas dan osteoklas bekerja
sama dalam pembentukan struktur tulang yang mencakup proses modeling dan
remodeling (Smith 1993).
Faktor yang memengaruhi kepadatan tulang adalah cara hidup (pola
makan, aktivitas fisik, merokok, asupan kalsium), obesitas, paritas (jumlah anak),
Iaktasi, usia yang masih terlalu muda pada saat pertama kali hamil, penyakit
kelenjar tiroid, dan penggunaan obat-obat kontrasepsi hormonal (Winarno 1998).
Secara normal, puncak kepadatan tulang pada manusia dicapai pada usia
tiga puluhan. Setelah itu akan terjadi proses penurunan kepadatan tulang yang
biasanya disertai dengan atau tanpa kerusakan arsitektur tulang, sehingga
kekuatan tulang akan menurun yang mengarah kepada kerapuhan tulang
(porous) atau dikenal sebagai osteoporosis. Secara umum keadaan ini dijumpai pada manusia lanjut usia, terutama pada wanita (Ott 1990). Satu dari tiga wanita
yang berumur lebih dari 55 tahun akan terkena osteoporosis, sedangkan pada
pria, satu dari 12 pria di atas umur 55 tahun akan terkena osteoporosis. Pada
wanita kejadian ini menyebabkan kehilangan massa tulang yang lebih besar
dibandingkan pria, sehingga risiko terjadinya osteoporosis dan patah tulang akan
lebih tinggi pada wanita (Dawson-Hughes 1996; Magetsari 1999).
Kepadatan tulang yang didapat selama masa pertumbuhan merupakan
faktor yang menentukan terjadinya kasus osteoporosis di kemudian hari
(Karlson et al. 1995). Kepadatan tulang yang tinggi pada masa premenopause dapat mempertahankan deposit kalsium tulang sehingga mengurangi kehilangan
atau penurunan kalsium pada masa menopause. Dengan demikian, individu
dengan kepadatan tulang yang tinggi pada masa pertumbuhan sampai masa
premenopause akan terhindar dari osteoporosis pada masa pascamenopause
(Compston et al. 1993). Apabila kekurangan kalsium pada usia awal, maka dapat mengalami patah tulang pada usia 57-58 tahun (Nguyen et al. 1995).
Pada saat tulang yang mengalami osteoporosis mencapai puncaknya,
maka tulang tersebut akan menjadi rapuh dan mudah patah. Hal ini merupakan
konsekuensi dari berkurangnya jumlah kalsium dalam massa tulang yang
merupakan faktor risiko untuk terjadinya osteopenia dan osteoporosis
(Rachman et al. 1996; Ott 2002). Kondisi demikian akan sangat berbahaya karena apabila berlanjut dalam jangka waktu yang cukup lama, tulang sebagai
3 patah tulang maka akan sulit untuk sembuh seperti sediakala. Studi epidemiologi
menunjukkan banyaknya cedera pada penderita osteoporosis adalah pada ossa
vertebrae, ossa coxae, dan collum femoris. Tulang-tulang ini lebih banyak mengandung trabekula dibandingkan tulang kompakta (Favus 1993).
Bukti substansial mengindikasikan bahwa osteoporosis merupakan
masalah kesehatan global dengan ciri kerusakan mikroarsitektur massa tulang,
dan terjadi pada 150 juta orang di seluruh dunia per tahun. Proses osteoporosis
terjadi karena berkurangnya kadar estrogen pascamenopause pada wanita.
Estrogen merupakan salah satu faktor yang sangat diperlukan dalam
mengaktifkan osteoblas di jaringan endosteum di sekitar jaringan mieloid
sumsum merah pada individu dewasa. Faktor lain yang memengaruhi aktivitas
osteoblas adalah nutrisi, hormon paratiroid, vitamin D, sitokin, kortisol, dan
aktivitas individu (Smith 1993). Osteoblas ini berfungsi untuk sintesis unsur
organik matriks tulang (osteoid), yaitu kolagen, proteoglikan, dan glikoprotein
(Carola et al. 1990; Telford dan Bridgman 1995; Leeson et al. 1996). Memasuki usia 40 tahun, secara fisiologis produksi estrogen mulai berkurang hingga
konsentrasinya hanya mencapai 10 % saat wanita memasuki masa
pascamenopause (Smith 1993) yang dihasilkan oleh kelenjar adrenal
(Guyton 1996).
Secara medis beberapa jenis preparat hormon estrogen sintetis dapat
dipakai untuk mengobati osteoporosis, namun dalam praktiknya hal ini sangat
berat karena harus diberikan seumur hidup (Gass dan Neff 1995). Selain itu
pengobatan hormonal memiliki banyak kelemahan, misalnya meningkatkan risiko
kanker payudara, karsinoma endometrium, perdarahan per vagina,
tromboflebitis, dan tromboemboli (Nguyen et al. 1995; Genant et al. 1998). Oleh karena itu, kini fokus penelitian dan pengobatan osteoporosis diarahkan melalui
pengobatan lain dengan risiko yang lebih rendah terhadap tubuh, antara lain
memberikan penambahan dosis asupan mineral, khususnya imbangan kalsium
fosfat di dalam makanan, pemberian vitamin A, vitamin C, vitamin D, peningkatan
aktivitas fisik, dan penggunaan bahan alami dari tanaman yang mengandung
fitoestrogen. Bahan alami tanaman ini telah lama digunakan secara tradisional
oleh masyarakat untuk mengobati penyakit (Tiangburanatham 1996;
Dalimartha 2003). Sementara itu Rachman et al. (1996) menyatakan penggunaan fitoestrogen memiliki efek keamanan yang lebih baik dibandingkan
4
Sejak dahulu, masyarakat telah mengenal beberapa tanaman untuk
mengobati berbagai macam penyakit. Akhir-akhir ini hal tersebut semakin
gencar didengungkan dengan slogan back to nature. Di Afrika, India, Sri Lanka, Malaysia, dan Jawa, Cissusqudrangularis Linn. banyak dipakai untuk mengatasi sakit sendi, sipilis, penyakit kelamin, dan osteoporosis (Shirwaikar et al. 2003). Studi literatur menunjukkan bahwa batang Cissus qudrangularis Linn.
mengandung triterpen seperti α- dan β-amirin, β-sitosterol, ketosteroid, β -karoten, dan vitamin C (Attawish et al. 2002), γ-amirin, δ-amiron (Mehta et al. 2001). Semua senyawa ini mempunyai potensi efek metabolik dan fisiologik
yang berbeda (Shirwaikar et al. 2003; Combaret et al. 2004) dan diketahui memberikan perlindungan terhadap kerusakan lambung pada hewan model
(Navarrete et al. 2002; Sairam et al. 2002). Studi fitokimia pada Cissus qudrangularis Linn. menunjukkan adanya kandungan flavonoid seperti kuersetin dan vitamin C serta resveratrol, piceatannol, palidol, asam askorbat, ketosteroid,
dan karoten (Tiangburanatham 1996; Swamy et al. 2006). Di India dan Sri Langka, Cissusqudrangularis Linn. dikenal dapat mengobati patah tulangkarena kemampuannya mempertautkan tulang (Sivarajan dan Balachandran 1994).
Nadkarni (1954) menjelaskan bahwa akar Cissus qudrangularis Linn. sangat berguna untuk pengobatan retak tulang baik diminum maupun digunakan
sebagai plester eksternal.
Di Aceh tanaman sipatah-patah telah lama dikenal sangat mujarab
dipakai sebagai obat patah tulang dengan cara memakai tumbukan batangnya
yang dibalutkan pada daerah yang patah. Sipatah-patah mempunyai bentuk
struktur yang hampir sama dengan Cissus quadrangularis Linn. Tanaman ini tumbuh di Kecamatan Lam Nga, Kabupatan Aceh Besar, dan tanaman
sipatah-patah ini telah diidentifikasi sebagai Cissus quadrangula Salisb oleh Herbarium Bogorinsis. Mengingat besarnya potensi tanaman sipatah-patah dan khasiat
yang dikandungnya sebagai obat patah tulang, besar kemungkinan tanaman
sipatah-patah yang ada di Aceh juga berpotensi sebagai antiosteoporosis. Oleh
karena itu, perlu dilakukan penelitian mengenai peranan sipatah-patah sebagai
antiosteoporosis. Tanaman sipatah-patah ini belum pernah diteliti dan juga
belum diketahui kandungan fitokimia yang terdapat di dalamnya. Oleh karena itu
5 Predisposisi osteoporosis dimulai sejak masa kanak-kanak dan remaja. Oleh karena itu tahap pencegahan osteoporosis lebih ditekankan sejak usia dini
melalui perbaikan proses fisiologi seperti peningkatan massa tulang selama pertumbuhan sampai mencapai puncak massa tulang (Karlson et al. 1995). Untuk itu maka perlu diteliti pengaruh sipatah-patah pada hewan percobaan yang diberi ekstrak sipatah-patah pada masa pertumbuhan dan menopause. Hewan
percobaan yang akan dipakai adalah tikus sesuai dengan penelitian Shirwaikar et al. (2003). Dengan demikian maka diperlukan dua kelompok penelitian, yaitu untuk mengetahui kemampuan sipatah-patah dalam mencegah
osteoporosis pada tikus betina normal masa pertumbuhan dan mengobati osteoporosis pada tikus betina yang dikondisikan mengalami menopause melalui
ovariektomi.
1.2. Tujuan Penelitian
Berdasarkan latar belakang tersebut di atas, maka penelitian ini dilakukan
melalui tiga hal yaitu:
1). Mengetahui kandungan mineral kalsium dan fosfat serta komposisi
fitokimia tanaman sipatah-patah (Cissus quadrangula Salisb) asal Aceh. 2). Menguji kemampuan ekstrak etanol batang sipatah-patah dalam
mencegah osteoporosis pada tikus betina normal masa pertumbuhan. 3). Mengobati osteoporosis pada tikus betina yang dikondisikan mengalami
menopause melalui ovariektomi.
1.3. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberi informasi kandungan mineral
dan bahan fitokimia tanaman sipatah-patah (Cissus quadrangula Salisb) asal Aceh dalam rangka memperkaya data biologi sumber daya alam hayati tanaman
asli Indonesia dan memperteguh keyakinan kearifan lokal masyarakat dalam
pemanfaatan tanaman asli Indonesia, khususnya sipatah-patah dalam mencegah dan mengobati osteoporosis pada tikus melalui proses kajian ilmiah.
1.4. Hipotesis
Hipotesis yang akan dibuktikan dalam penelitian ini adalah:
1. Komponen utama sipatah-patah mengandung kalsium, fosfat, dan fitoestrogen.
2. Pemberian ekstrak etanol batang sipatah-patah asal Aceh dapat :
a. Mencegah kejadian osteoporosis pada tikus betina prepubertas
7
II.
TINJAUAN PUSTAKA
2.1. Struktur Tulang
Tulang adalah organ keras yang berfungsi sebagai alat gerak pasif,
menjadi tempat pertautan otot, tendo, dan ligamentum. Tulang juga berfungsi
sebagai penopang tubuh, memberi bentuk tubuh, dan melindungi organ tubuh
yang lunak dan mudah rusak, serta menjadi tempat terjadinya proses
hemopoiesis darah (Favus 1993; Leeson et al. 1996). Tulang-tulang membentuk kerangka (skeleton). Kerangka manusia dibentuk oleh 206 buah tulang
(Akers dan Denbow 2008) sedangkan kerangka kuda mempunyai 208 buah
tulang (Getty 1975). Tulang berfungsi sebagai alat gerak pasif karena gerakan
tulang dilakukan oleh kontraksi otot yang bertaut ke tulang melalui tendo-tendo
(Leeson et al. 1996).
Tulang kerangka secara garis besar dapat diklasifikasikan menjadi ossa longa (tulang panjang), ossa plana (tulang pipih), ossa brevia (tulang pendek), dan ossa irregularia (tulang tidak beraturan). Tulang panjang (ossa tibia-fibula, ossa radius-ulna) bentuknya silindris dan panjang dengan kedua ujungnya membesar. Tulang panjang berfungsi untuk menahan beban tubuh dan di
daerah metafisis bagian dorsal terdapat sumsum merah. Berbeda dengan tulang
panjang, tulang pipih seperti os ilium dan ossa cranii bertugas untuk melindungi
bagian tubuh yang lunak. Tulang pendek (ossa carpi, ossa tarsi, dan ossa sesamoidea) mempunyai panjang, lebar, dan tinggi yang hampir sama dan
berfungsi untuk menahan benturan atau mengurangi pergeseran dan perubahan
arah dari tendo. Ossa vertebrae termasuk tulang tidak beraturan, yang terbagi dalam segmen-segmen yang terletak pada sumbu tubuh sehingga sangat
fleksibel dipakai untuk pergerakan tulang belakang dan menjadi tempat
beradanya sumsum merah (Carola et al. 1990).
Tulang tersusun atas tulang kompakta pada bagian luar dan tulang
trabekula pada bagian dalam (Smith 1993). Dengan susunan seperti ini massa
tulang menjadi lebih ringan tanpa mengurangi tingkat kekuatannya sehingga
fungsinya menjadi optimal (Fleisch 1993).
Bagian luar dari tulang berbentuk lapisan padat yang disebut tulang
kompakta (substansia compacta), sedangkan bagian dalamnya merupakan lempeng-lempeng tipis tersusun seperti bunga karang (kasau-kasau tulang yang
8
(substansia spongiosa) (Stevenson dan Marsh 1992; Carola et al. 1990). Proporsi substansia kompakta dan spongiosa masing-masing sekitar 80 % dan
20 % (Goldberg 2004), namun ditemukan banyak variasi sesuai dengan jenis
tulang dan dipengaruhi oleh daya tekan dan tarik yang dialami tulang tersebut
(Stevenson dan Marsh 1992; Leeson et al. 1996). Dengan struktur seperti ini, tulang mempunyai kekuatan yang optimum dengan bobot yang minimal sehingga
dapat menahan bobot badan maupun beban kerja (Parfitt 1984;
Carola et al. 1990).
Tulang kompakta terdiri atas jaringan kolagen dan hidroksiapatit yang
membentuk 3 lapisan, yaitu lapisan periosteum, intrakompakta, dan endosteum
(Rachman 1999). Periosteum adalah selubung fibrosa yang membungkus
tulang, kecuali pada permukaan sendi (Leeson et al. 1996). Periosteum pada hewan dewasa terdiri atas dua lapisan, tanpa batasan yang jelas. Lapisan luar
terdiri atas jaringan ikat padat fibrosa yang mengandung anyaman pembuluh
darah. Lapisan dalam terdiri atas jaringan ikat yang lebih longgar, mempunyai
sedikit unsur kolagen yang memasuki tulang sebagai serat Sharpey
(Carola et al. 1990), mengandung banyak sel jaringan ikat berbentuk gelondong yang disebut lapisan kambium, lapisan ini mengandung sel-sel osteoprogenitor
dan disebut periosteum. Sel-sel osteoprogenitor adalah sel-sel yang berfungsi
untuk membentuk jaringan tulang. Pada tulang yang sedang tumbuh, lapisan
kambium aktif membentuk tulang sehingga dinding tulang menjadi tebal. Dalam
keadaan normal, periosteum lebih tipis, kurang vaskularisasi dan berada dalam
keadaan istirahat, tetapi masih berpotensi osteogenik. Jika tulang mengalami
fraktura (retak), maka lapisan kambium dari periosteum akan aktif kembali dalam
usahanya mengadakan regenerasi tulang (Leeson et al. 1996).
Bagian intrakompakta merupakan bagian utama dari tulang kompakta
yang dibentuk oleh sistem Haver, membentuk bangun berupa tabung dengan
panjang 2 mm dan diameter 22 µm yang terdiri atas lapisan konsentrik dengan
osteosit yang berada di antaranya. Pada bagian tengah tulang kompakta
terdapat saluran Volkmann berisi pembuluh darah, pembuluh limfe, dan saraf
yang berperan mengangkut nutrisi dan sebagai alat sensoris (Carola et al. 1990). Dari periosteum dan endosteum akan masuk saluran Volkman atau saluran
nutrien secara tegak lurus ke dalam tulang dan berhubungan dengan saluran
9 Gambar 1. Struktur tulang panjang
(dimodifikasi dari Warwick dan Williams 1973).
dan saling berhubungan antara pembuluh darah, pembuluh limfe, dan saraf
untuk tulang (Carola et al. 1990; Leeson et al. 1996). Setiap saluran Haver memiliki sejumlah lamel konsentris (5 sampai 20 lamel). Lamel matriks tulang,
sel-sel dan saluran pusatnya membentuk sistem Haver. Kanalikuli pada sistem
Haver akan berhubungan langsung dengan saluran Haver sehingga semua
lakuna akan berhubungan langsung dengan saluran Haver. Kanalikuli pada tepi
sistem Haver biasanya tidak berhubungan dengan kanalikuli yang berasal dari
sistem sebelahnya, melainkan membentuk lengkungan dan kembali ke
lakunanya sendiri. Sistem Haver terutama tersusun menurut sumbu panjang
tulang, sehingga pada potongan melintang terlihat sebagai lubang bulat yang
dikelilingi oleh lamel-lamel yang melingkar (Gambar 2), sedangkan pada
potongan memanjang sistem Haver terlihat sebagai celah memanjang yang
dibatasi kolom-kolom lamel (Leeson et al. 1996).
Bagian trabekula mengandung lempeng-lempeng yang saling
berhubungan dengan pola tertentu yang membentuk garis trayektori spesifik
menurut fungsi mekanis tulang tersebut. Tulang trabekula terdiri atas lamel-
lamel, di dalamnya terdapat lakuna yang mengandung osteosit dan sistem
kanalikuli yang saling berhubungan. Pada masa prenatal, pada tulang spongiosa
belum terlihat jelas adanya lamel-lamel karena serat-serat kolagen tulang
terdapat dalam anyaman tidak beraturan. Hal ini terlihat khas untuk tulang yang
[image:31.595.219.401.86.292.2]10
Gambar 2. Gambaran substansia kompakta dan substansia spongiosa (trabekula) di metafisis bagian proksimal tulang panjang (dimodifikasi dari Leeson et al. 1996)
Endosteum adalah lapisan halus yang membatasi rongga sumsum dan meluas sebagai pelapis sistem saluran tulang kompakta. Endosteum terdiri atas
jaringan retikular padat yang memiliki kemampuan osteogenik dan hemopoetik
(Carola et al. 1990).
Endosteum merupakan permukaan dalam dari tulang yang terdiri atas sel osteoprogenitor dan hanya sebagian kecil jaringan ikat yang
melapisi permukaan trabekula dan permukaan medulla tulang kortikal serta kanal Harvesian. Endosteum menyediakan sel osteoprogenitor atau sel osteoblas
secara kontinyu untuk perbaikan dan pertumbuhan tulang yang berfungsi untuk
remodeling tulang (Einhorn 1996; Leeson et al. 1996).
2.1.1 Komposisi Tulang
Tulang terbentuk dari unsur mineral kira-kira 65 %, matriks organik ekstraseluler 30 %, sel-sel osteoblas, osteoklas, osteosit, serta air (sekitar 5 %).
Sebagian besar (95 %) dari mineral tulang merupakan kristal hidroksiapatit dan 5 % sisanya terdiri atas bahan organik (Favus 1993; Guyton 1996; Ott 2002).
Mineral tulang merupakan bentuk anorganik dari tulang, dengan campuran utamanya kristal kalsium fosfat atau kristal kalsium hidroksiapatit
[3Ca3(P04)2Ca(OH)2]. Kalsium hidroksiapatit berbentuk piringan kristal tajam
seperti jarum di dalam dan di antara serat kolagen dengan panjang 20-80 nm dan tebal 2-5 nm (Puzas 1993; Leeson et al. 1996). Selain komponen tersebut, kalsium hidroksiapatit juga mengandung komponen lain seperti karbonat, sitrat, magnesium, natrium, fluor, dan strontium yang terdapat pada kisi dari kristal atau
[image:32.595.92.463.85.519.2]11 Bahan organik dari mineral tulang terdiri atas 98 % jaringan kolagen dan
2 % sisanya terdiri atas beberapa protein nonkolagen. Kolagen adalah protein
dengan daya larut yang sangat rendah, terdiri atas 3 rantai polipeptida
(triple helix) yang pada setiap rantai terdapat seribu (1000) asam amino (Shenk et al. 1993).
Protein nonkolagen tulang terdiri atas osteonektin, osteokalsin,
osteopentin, dan sialoprotein (Favus 1993). Osteonektin adalah protein besar
dengan bobot molekul 320 KDa yang disintesis oleh osteoblas. Protein ini
berfungsi untuk mengikat kolagen hidroksiapatit. Osteokalsin adalah protein kecil
dengan bobot molekul 5.8 KDa dan berjumlah sekitar 10-12 % dari total protein
nonkolagen, protein ini berhubungan erat dengan fase mineralisasi tulang
(Rachman 1999). Beberapa protein tulang yang lain seperti trombopontin, asam
glikoprotein, dan fibronektin merupakan protein yang mengandung asam
arginin-glisin aspartat yang bersifat asam dan berafinitas besar terhadap kalsium.
Protein-protein ini mempunyai kemampuan untuk diikat oleh reseptor integrin.
Growth factor dan sitokin seperti transforming growth factor beta (TGFβ), insulin growth factor (IGF), interleukin (IL), bone morphogenic protein (BMP) terdapat dalam jumlah kecil di matriks tulang (Shenk et al. 1993). Protein-protein tadi mengikat mineral tulang dan matriks dan dilepaskan saat terjadi proses resorbsi
tulang oleh osteoklas (Favus 1993).
2.1.2 Metabolisme Tulang
Metabolisme tulang diatur oleh osteoblas, osteosit, dan osteoklas
terhadap respons dari berbagai rangsangan di sekelilingnya termasuk
rangsangan kimia dan mekanik (Erickson et al. 1992; Puzas 1993). Rangsangan spesifik diatur oleh reseptor sel yang ditemukan pada membran sel atau di dalam
sel. Reseptor yang berada di membran sel menerima rangsangan dari luar dan
mengirimkan informasi tersebut ke inti menyeberangi sitoplasma sel melalui
mekanisme transduksi. Sementara itu reseptor dalam sel (di sitoplasma atau
di inti) mengikat rangsangan (biasanya hormon steroid) yang melewati membran
sel dan masuk ke dalam sel untuk memindahkan efektor ke nukleus yang di
dalamnya terdapat reseptor steroid kompleks yang terikat pada asam
12
Pada tulang dapat dibedakan tiga jenis sel tulang, yaitu osteoblas,
osteosit, dan osteoklas (Rachman 1999) (Gambar 3). Osteoblas merupakan sel
yang berhubungan dengan pembentukan tulang dan ditemukan pada permukaan
tulang, yaitu periosteum dan endosteum. Osteoblas dibentuk dari sel stroma
dari mesoderm (totipotent mesenchymal stem cell) (Smith 1993; Ott 2002). Pembentukan osteoblas dimulai dari prekusor sel stroma menjadi preosteoblas
yang kemudian berkembang menjadi osteoblas yang dapat diaktifkan sehingga
akhirnya dapat membentuk osteosit (Erickson et al. 1992; Puzas 1993). Osteoblas merupakan sel berinti tunggal yang terdapat di permukaan luar
(periosteum) dan di dalam tulang (endosteum). Sitoplasmanya bersifat basofil
karena mengandung nukleoprotein. Apabila sel ini berada dalam keadaan aktif
berbentuk kuboid, sedangkan dalam keadaan tidak aktif, osteoblas berbentuk
pipih (Einhorn 1996). Dalam proses perbaikan kondisi tulang setelah adanya
perombakan tulang oleh osteoklas, biasanya ditemukan adanya osteoblas aktif di
tempat itu untuk mensintesis matriks tulang baru yang diawali dengan proses
mineralisasi dan kolagenasi matriks tulang (Price 1995; Lian dan Stein 1996).
Osteoblas berfungsi menghasilkan kolagen, proteoglikan, dan glikoprotein untuk
pembuatan dan pertumbuhan tulang baru pada daerah permukaan tulang dan
juga untuk pembentukan tulang pada kartilago (Telford dan Bridgman 1995).
Proses perkembangan dan pembentukan tulang oleh osteoblas
dipengaruhi oleh faktor yang bersifat lokal maupun sistemik. Faktor lokal yang
berpengaruh dalam meningkatkan pembentukan tulang adalah BMP (bone morphogenic protein), TGF-β, IGF (insulin-like growth factor-1), estrogen, triiodotironin (T3), tetraiodotironin (T4), kalsitriol [1,25-(OH)2D3
Saat menjalankan fungsinya, osteoblas juga memproduksi enzim alkalin
fosfatase. Enzim ini mempunyai sifat spesifik dibandingkan dengan alkalin
fosfatase yang dihasilkan oleh jaringan lainnya. Fungsi alkalin fosfatase ini
bekerja dengan cara membebaskan protein nonkolagen osteokalsin dalam
proses pembentukan tulang. Aktivitas osteoblas dapat dipantau secara biokimia ], dan
prostaglandin E2 (PGE2). Faktor sistemik yang meningkatkan pembentukan
tulang adalah fluorida, PTH (hormon paratiroid) nutrisi, vitamin D, sitokin, kortisol,
dan aktivitas individu (Gambar 4). Faktor sistemik lainnya yang bekerja dengan
menghambat formasi tulang adalah hormon kortikosteroid yang dihasilkan oleh
13 Gambar 3. Gambaran sel osteogenik, osteoblas, osteosit, dan osteoklas
(dimodifikasi dari Leeson et al. 1996).
dengan menilai kadar enzim alkalin fosfatase tulang dan kadar osteokalsin dalam
serum (Price 1995). Dalam perkembangan penelitian selanjutnya telah
ditemukan reseptor estrogen dan reseptor kalsitriol di osteoblas (Gallaher 1986;
Reid 1996).
Tipe sel tulang yang kedua adalah osteosit, yaitu osteoblas yang sudah
menetap dalam lakuna pada saat pembentukan lapisan permukaan tulang
berlangsung. Osteosit merupakan sel peralihan dari sel-sel osteoblas yang
berhenti membentuk matriks tulang dan terperangkap di dalam tulang. Sel ini
memiliki peran dalam memelihara matriks tulang sehingga tersimpan di dalam
tulang (Erickson et al. 1992; Puzas 1993). Sel tersebut berhubungan satu dengan yang lainnya melalui penjuluran sitoplasma yang melewati kanalikuli dan
berperan dalam membantu koordinasi respons tulang terhadap stres atau
deformasi (Stevenson dan Marsh 1992). Tidak semua osteoblas berkembang
menjadi osteosit (hanya 10-12 %), hal ini disebabkan oleh kegagalan difusi
nutrisi. Pembuluh darah masuk melalui kanal kecil yang dikenal sebagai
kanalikuli. Kanalikuli adalah satu-satunya saluran untuk nutrisi dan pertukaran
gas yang akan digunakan oleh osteosit. Bentuk kanalikuli beraturan seperti
tubulus penghubung (Lian dan Stein 1996). Osteosit juga diduga memiliki
kemampuan merespons mekanisme rangsangan gaya mekanik dan neuroelektrik
yang berhubungan dengan aktivitas individu. Gaya fisioelektrik ini diduga
merangsang pengeluaran IGF-1 untuk mengaktifkan osteoblas dan juga
14
Sel ketiga pada tulang adalah osteoklas yang bertanggung jawab
terhadap resorbsi kalsium tulang dan kartilago (Ott 2002). Osteoklas memiliki
progenitor yang berbeda dari sel tulang lainnya karena tidak berasal dari sel
mesenkim, melainkan dari jaringan mieloid, yaitu monosit atau makrofag pada
sumsum tulang (Smith 1993; Ott 2002). Osteoklas ini bersifat mirip dengan sel
fagositik lainnya dan berperan aktif dalam proses resorbsi tulang. Osteoklas
merupakan sel fusi dari beberapa monosit sehingga bersifat multinukleus
(10-20 nuklei) dengan ukuran besar dan berada di tulang kortikal atau tulang
trabekular (Marcus et al. 1996). Di dalam menjalankan tugasnya, osteoklas mensekresi enzim kolagenase dan proteinase lainnya, asam laktat, serta asam
sitrat yang dapat melarutkan matriks tulang. Enzim-enzim ini memecah atau
melarutkan matriks organik tulang sedangkan asam akan melarutkan
garam-garam tulang. Osteoklas mempunyai ruffled border yaitu daerah spesifik dari membran sel berbentuk jari-jari atau gelambir-gelambir, yang biasanya
berhadapan dengan permukaan tulang. Sekresi enzim-enzim, asam laktat, dan
asam sitrat dilepaskan keluar sel melalui ruffled border. Di area ruffled border ini terjadi proses resorbsi tulang sehingga mengakibatkan terbentuknya
Gambar 4. Faktor-faktor yang memengaruhi fungsi osteoblas (dimodifikasi dari Smith 1993)
Osteoblas
Kortisol
Osteosit
Pre-osteoblas Osteoblas pasif
Sintesis kolagen protein non-kolagen
proteoglikan
Sitokin
Sel pengendali osteoklas
Mineralisasi
PTH 1,25(OH)2D3
Jarak jauh
Estrogen
Nutrisional Mekanik
Endokrin
[image:36.595.72.476.340.759.2]15 cekungan sebagai akibat hilangnya matriks di daerah itu, dan cekungan yang
terbentuk ini dinamakan lakuna Howship (Telford dan Bridgman 1995; Leeson et al. 1996).
Interaksi antara osteoklas dan osteoblas (Gambar 5) secara normal selalu
terjadi pada proses remodeling tulang. Osteoblas diduga mengambil bone morphogenetic protein (BMP) sebelum osteoklas merusak tulang. Resorbsi tulang akan membebaskan protein tulang yang berpengaruh timbal balik yaitu
dapat menstimulasi aktivitas osteoblas. Proses remodeling ini masih belum diketahui dengan pasti (Smith 1993). Sel-sel osteoklas menangkap
partikel-partikel matriks tulang dan kristal melalui fagositosis yang akhirnya melarutkan
benda-benda tersebut dan melepaskannya ke dalam darah (Guyton 1996;
Smith 1993). Proses ini selalu dalam keadaan seimbang dalam mengatur
formasi dan resorbsi tulang sehingga dikenal dengan istilah berpasangan atau
coupling (Suda et al. 1992; Smith 1993). Dalam proses peningkatan aktivitas osteoklas, osteoblas menghasilkan beberapa sitokin seperti tumor necrosis factor beta(TNF β), IL-1, dan IL- 6,sehingga dapat dikatakan terdapat poros osteoblas-osteoklas dalam pengendalian densitas tulang. Sebaliknya, aktivitas osteoblas-osteoklas
dihambat oleh estrogen, kalsitonin, TGF β, interferon gamma (IFN- ), dan
prostaglandin (PGE2) (Suda et al. 1992).
Gambar 5. Diagram interaksi osteoblas dan osteoklas dalam proses
[image:37.595.93.483.466.736.2]16
Bone morphogenetic protein merupakan pemicu osteoblastogenesis dengan merangsang osteoblastic specific factor-2 (OSF-2) atau core binding factor A1 (Cbf A1) yang berfungsi mengaktifkan gen spesifik osteoblas, seperti osteokalsin, osteopontin, sialoprotein, dan kolagen tipe I. Selain hormon sistemik
dan sinyal mekanis, perkembangan dan diferensiasi osteoblas dan osteoklas diatur juga oleh growth factor (GF) dan sitokin (Manolagas 2000).
2.1.3 Modeling dan Remodeling Tulang
Carola et al. 1990 menyatakan bahwa tulang merupakan suatu organ yang mengalami metabolisme aktif berupa proses penyerapan dan pembentukan
tulang. Proses ini berlangsung secara simultan dan menyangkut semua perubahan yaitu modeling dan remodeling.
Modeling adalah perubahan struktur atau bentuk pada jaringan tulang akibat formasi dan resorbsi matriks tulang dalam proses pertumbuhan (contoh:
perubahan bentuk tulang kepala dari bayi sampai tua). Pada manusia, memasuki usia 20 sampai 30 tahun (Gambar 6) terjadi peningkatan
pembentukan massa tulang dengan tercapainya massa tulang puncak (Goldberg 2004). Proses modeling terjadi pada bagian growth plate (lempengan tulang rawan yang aktif berproliferasi atau disebut juga sasaran epifise) atau
pada lokasi perubahan tulang rawan menjadi tulang termineralisasi (Eriksen et al. 1994). Selama proses pertumbuhan terjadi pemisahan badan tulang (corpus) dengan area ujung tulang (epifisis) oleh sasaran epifise.
17 Pertumbuhan memanjang terjadi karena sasaran epifise tersebut terisi oleh
tulang baru pada ujung badan tulang. Lebar sasaran epifise sebanding dengan
kecepatan pertumbuhan tubuh dan dipengaruhi oleh sejumlah hormon terutama
hormon pertumbuhan yang dihasilkan oleh hipofisa dan insulin growth factor-1 (IGF-1) (Ganong 1995). Sementara itu Goldberg (2004) menyatakan bahwa
modeling dimulai sejak di dalam kandungan sampai mencapai puncak massa tulang yang dipengaruh oleh faktor-faktor fisiologis dan mekanis. Pembentukan
tulang terjadi melalui mekanisme pengerasan tulang endokondrial. Hal itu
termasuk perubahan dari garis turunan sel mesenkim menjadi kondroblas
selanjutnya menjadi kondrosit dengan mensintesis proteoglikan sebagai dasar
dari matriks ekstraseluler. Ketika terjadi kalsifikasi matriks ekstraseluler,
berlangsung juga invasi pembuluh darah termasuk prekursor osteoklas (yang
menurunkan kalsifikasi tulang rawan) dan prekursor osteoblas. Proses kalsifikasi
tulang rawan menghasilkan the primary spongiosum, sedangkan tulang yang terbentuk di antara jaringan disebut the secondary spongiosum yang nantinya dikenal sebagai tulang woven (Leeson et al. 1996).
Remodeling adalah proses yang berlangsung terus-menerus secara aktif dengan membangun dan memperbaiki pembentukan tulang yang dilakukan oleh
osteoklas (resorbsi tulang) dan osteoblas (formasi tulang). Proses remodeling
pada kondisi normal adalah massa tulang yang diresorbsi seimbang dengan
jumlah massa tulang yang diformasi, terutama pada individu berusia sekitar
30-40 tahun (Goldberg 2004). Remodeling juga berfungsi untuk mempertahankan keseimbangan biokimia tulang, memelihara dan memperbaiki kerusakan tulang
(Rachman 1999). Keseimbangan ini mulai terganggu melewati usia 40 tahun.
Pada usia tersebut proses remodeling tulang mulai tidak seimbang yaitu, kecepatan formasi tulang tidak sama dengan resorbsi tulang dan lebih cenderung
ke arah penyerapan tulang ketika wanita mencapai menopause. Pada saat ini
terjadi proses uncoupling, yaitu awal proses penuaan (Goldberg 2004). Menurut Leeson et al. (1996) dan Rodan (1996) tahapan proses remodeling tulang normal meliputi enam tahap, yaitu quiescence (istirahat), aktivasi, resorbsi, proses balik (reversal), formasi, dan berakhir pada tahap istirahat.
Remodeling tulang dipengaruhi oleh beberapa hormon seperti hormon paratiroid (PTH), kalsitonin, sitokin, kalsitriol dan faktor-faktor lokal nutrisi, faktor
18
remodeling tulang masih berjalan normal dengan jumlah massa tulang yang masih stabil. Memasuki usia 40 tahun atau tepatnya memasuki usia menopause,
proses remodeling mulai berjalan tidak seimbang (Rachman 1999).
Secara fisiologis, pada wanita pascamenopause karena kadar estrogen
yang mulai menurun akan mengakibatkan gangguan keseimbangan antara sel
osteoklas dan osteoblas (Mizuno et al. 1995). Kekurangan estrogen akan menyebabkan menurunnya kadar kalsium darah sehingga akan memacu kelenjar
paratiroid untuk meningkatkan sekresi PTH dan memengaruhi osteoblas untuk
merangsang pembentukan sitokin (IL-1, IL-6, dan TNF). Sitokin mengaktivasi
osteoklas untuk merangsang resorbsi tulang (Potu et al. 2009).
Secara mikroskopis, proses remodeling tulang dimulai dengan sekresi kolagen, glikoprotein, dan proteoglikan oleh osteoblas. Kolagen mengalami
polimerisasi membentuk serabut kolagen atau semacam tulang rawan yang
belum mengalami proses mineralisasi yang disebut osteoid. Osteoblas yang
terperangkap di dalam osteoid akan menjadi osteosit dan berperan dalam
regulasi mineral tulang (Favus 1993). Penumpukan mineral terjadi beberapa hari
setelah terbentuknya osteoid dengan susunan berselang seling dengan serabut
kolagen menjadi kristal hidroksiapatit. Pada remodeling proses pembentukan mineral diikuti juga oleh proses penyerapan mineral dan berlangsung dalam
keseimbangan yang dinamis di dalam tulang (Leeson et al. 1996).
2.2. Osteoporosis
Osteoporosis merupakan suatu kondisi atau perubahan yang terjadi pada
tulang sebagai akibat pengurangan massa tulang, mineral maupun matriks tulang
(Sabri 2000; Anderson et al. 2008), sehingga kepadatan tulang berkurang atau tulang menjadi keropos. Pengurangan massa tulang tersebut dapat terjadi
sebagai akibat ketidakseimbangan antara resorbsi dan pembentukan tulang
(Palmer 1993; Shin et al. 2007).
Beberapa faktor yang diduga dapat menyebabkan terjadinya osteoporosis
ialah faktor umur, kurangnya aktivitas fisik, jenis kelamin, nutrisi, kelaparan,
hormonal, genetik, kebiasaan hidup, individu seperti perokok, dan peminum
alkohol, serta warna kulit (Lane, 2001
Setelah mencapai usia 30 tahun pada puncak massa tulang, maka massa
19 hilang menjadi lebih banyak daripada yang dibentuk. Pada usia remaja,
pertumbuhan tulang wanita menjadi semakin cepat dengan meningkatnya
produksi hormon estrogen dan progesteron. Massa tulang yang didapat selama
masa pertumbuhan merupakan faktor yang menentukan akan terjadinya
osteoporosis dalam masa kehidupan selanjutnya (Karlson et al. 1995). Setelah usia antara 35-40 tahun penyerapan tulang sedikit melebihi pembentukan tulang
sehingga diperkirakan kehilangan massa tulang sebesar 1 % per tahun. Wanita
pada masa pascamenopause mengalami peningkatan kehilangan tulang sampai
2% per tahun akibat peningkatan penyerapan tulang (Endris dan Rude 1994).
Osteoporosis mencakup dua mekanisme perubahan mikroanatomi
trabekula, yaitu proses penipisan dan erosi tulang trabekula. Kedua proses
tersebut bergantung pada perubahan yang mendasari proses remodeling
(Eriksen et al. 1994). Selanjutnya Croucher et al. (1994) menegaskan bahwa struktur trabekula tulang ilium wanita pascamenopause menunjukkan adanya
perubahan mikrostruktur, berupa penurunan massa tulang dan matriks tulang.
Pada penelitian lain, Kalu et al. (1993) menyatakan bahwa penentuan dasar proses remodeling tulang berupa penipisan tulang trabekula menuju pada perubahan arsitektur tulang dan erosi tulang sehingga kehilangan tulang
trabekula dapat secara keseluruhan atau proporsional.
Pada penelitian yang dilakukan pada tikus, osteoporosis dapat bertambah
parah tidak hanya disebabkan oleh rendahnya konsumsi dan absorbsi kalsium
tetapi juga disebabkan oleh terlalu tingginya rasio fosfat dan kalsium dalam diet
(Sabri 2000). Tingginya konsumsi fosfat mengakibatkan terjadinya
hiperparatiroidisme sekunder sehingga mengga