ANALISIS KANDUNGAN NATRIUM BENZOAT DAN
ASAM SITRAT PADA MINUMAN ISOTONIK
SECARA SIMULTAN DENGAN METODE
SPEKTROFOTOMETRI ULTRAVIOLET
SKRIPSI
OLEH:
NOVITA SARI
NIM 101501103
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KANDUNGAN NATRIUM BENZOAT DAN
ASAM SITRAT PADA MINUMAN ISOTONIK
SECARA SIMULTAN DENGAN METODE
SPEKTROFOTOMETRI ULTRAVIOLET
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
NOVITA SARI
NIM 101501103
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ANALISIS KANDUNGAN NATRIUM BENZOAT
DAN ASAM SITRAT PADA MINUMAN ISOTONIK
SECARA SIMULTAN DENGAN METODE
SPEKTROFOTOMETRI ULTRAVIOLET
OLEH: NOVITA SARI NIM 101501103
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 9 Mei 2014
Pembimbing I, Panitia Penguji,
Dr. Muchlisyam, M.Si., Apt. Dr. Ginda Haro, M.Sc., Apt. NIP 195006221980021001 NIP 195108161980031002
Pembimbing II, Dr. Muchlisyam, M.Si., Apt. NIP 195006221980021001
Drs. Syahrial Yoenoes, S.U., Apt. Drs. Immanuel S. Meliala, M.Si., Apt.
NIP 195112061983031001 NIP 195001261983031002
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Medan, 10 Juni 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur penulis ucapkan ke Hadirat Tuhan Yang Maha Esa atas berkat dan rahmatNya penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul Analisis Kandungan Natrium Benzoat dan Asam Sitrat pada Minuman Isotonik secara Simultan dengan Metode Spektrofotometri Ultraviolet.
Pada kesempatan ini dengan segala kerendahan hati dan hormat, penulis mengucapkan terimakasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan dan penasehat akademis penulis, yang telah yang telah memberikan bimbingan dan penyediaan fasilitas sehingga penulis dapat menyelesaikan pendidikan. Bapak Dr. Muchlisyam, M.Si., Apt. dan Bapak Drs. Syahrial Yoenoes, S.U., Apt., selaku pembimbing yang telah membimbing dengan sangat baik, memberikan petunjuk, perhatian, saran, dan motivasi selama penelitian hingga selesainya skripsi ini. Bapak Dr. Ginda Haro, M.Sc., Apt., Bapak Drs. Immanuel S. Meliala, M.Si., Apt., dan Ibu Dra. Sudarmi, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik selama perkuliahan.
materil kepada penulis dan kepada Felicia Christine dan Cut Shafa Safira yang telah banyak mendukung dan membantu penulis dalam menyelesaikan skripsi ini. Serta seluruh pihak dan teman-teman yang telah ikut membantu penulis namun tidak tercantum namanya.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, dengan segala kerendahan hati, penulis menerima kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya dalam bidang farmasi.
Medan, Mei 2014 Penulis,
ANALISIS KANDUNGAN NATRIUM BENZOAT DAN ASAM SITRAT PADA MINUMAN ISOTONIK
SECARA SIMULTAN DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
ABSTRAK
Natrium benzoat merupakan pengawet yang banyak dijual di pasaran dan digunakan untuk mengawetkan berbagai bahan pangan. Penambahan asam sitrat sebagai pengatur keasaman pada penggunaan natrium benzoat bertujuan untuk meningkatkan efektifitas natrium benzoat sebagai bahan pengawet. Tujuan penelitian ini adalah untuk melakukan analisis kandungan natrium benzoat dan asam sitrat pada minuman isotonik secara simultan dengan spektrofotometri ultraviolet.
Metode penelitian ini dilakukan dengan metode spektrofotometri ultraviolet menggunakan perhitungan persamaan regresi yang diukur absorbansinya pada panjang gelombang asam benzoat 229 nm dan asam sitrat 208 nm. Penelitian ini terlebih dahulu dilakukan dengan penetapan kadar campuran bahan baku asam benzoat dan asam sitrat, selanjutnya dilakukan analisis kandungan natrium benzoat dan asam sitrat secara simultan pada minuman isotonik.
Hasil penetapan kadar natrium benzoat pada sampel A adalah sebesar 260,7816 ± 2,8096 mg/kg, sampel B sebesar 278,5271 ± 4,1238 mg/kg, sampel C sebesar 129,4119 ± 2,5809 mg/kg, sampel D sebesar 175,6334 ± 1,2820 mg/kg dan hasil penetapan kadar asam sitrat pada sampel A sebesar 19603,2026 ± 995,8723 mg/kg, sampel B sebesar 12238,2021 ± 452,3898 mg/kg, sampel C sebesar 11403,5265 ± 575,6900 mg/kg, sampel D sebesar 1673,1440 ± 286,8816 mg/kg. Hal ini menunjukkan bahwa minuman isotonik yang dianalisis memenuhi persyaratan kadar yang tercantum dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 722/MenKes/Per/IX/88 tentang Bahan Tambahan Makanan, yaitu tidak lebih dari 600 mg/kg. Sedangkan penggunaan asam sitrat dalam minuman ringan sampai saat ini belum dibatasi kadar penggunaannya oleh badan pengawas obat dan makanan.
Hasil uji validasi metode yang dilakukan memberikan akurasi dan presisi yang memenuhi syarat yaitu 85,26% recovery dengan RSD 1,20%, batas deteksi (LOD) 0,4231 µg/ml (λ229); 0,4563 µg/ml (λ208) dan batas kuantitasi (LOQ) 1,4104 µg/ml (λ229); 1,5209 µg/ml (λ208) untuk asam benzoat. Sedangkan untuk asam sitrat, hasil uji validasi metode yang dilakukan juga memberikan akurasi dan presisi yang memenuhi syarat yaitu 86,33% recovery dengan RSD 0,52%, batas deteksi (LOD) 36,8571 µg/ml (λ229); 40,8000 µg/ml (λ208) dan batas kuantitasi (LOQ) 122,8571 µg/ml (λ229); 136 µg/ml (λ208). Berdasarkan hasil penelitian tersebut dapat disimpulkan bahwa metode spektrofotometri ultraviolet secara simultan dengan metode perhitungan persamaan regresi memberikan ketepatan dan ketelitian yang baik.
CONTENT ANALYSIS OF SODIUM BENZOATE
AND CITRIC ACID IN ISOTONIC DRINKS SIMULTANEOUSLY BY SPECTROPHOTOMETRY ULTRAVIOLET METHOD
ABSTRACT
Sodium benzoate is a preservative that is commonly sold in the market and also used as food preservative. The addition of citric acid as acidity regulator on the sodium benzoate usage served a purpose to enhance the effectiveness of sodium benzoate as a preservative. The purpose of this study is to do a content analysis of sodium benzoate and citric acid in isotonic drinks simultaneously by ultraviolet spectrophotometry.
This study method is done by spectrophotometry ultraviolet using calculation of regression equation that measured at wavelength of benzoic acid 229 nm and citric acid 208 nm. Firstly, this study conducted by assay mixture of benzoic acid and citric acid as material strandard, then we do content analysis of sodium benzoate and citric acid simultaneously in isotonic drinks.
The result of sodium benzoate assay in sample A is 260.7816 ± 2.8096 mg/kg, sample B is 278.5272 ± 4.1238 mg/kg, sample C is 129.4118 ± 2.5810 mg/kg, sample D is 175.6335 ± 1.2295 mg/kg and the result of citric acid in sample A is 19603.2026 ± 995.8722 mg/kg, sample B is 12238.2022 ± 452.3898 mg/kg, sample C is 11403.5265 ± 575.6899 mg/kg, sample D is 1673.1440 ± 286.8719 mg/kg. This result indicate that sodium benzoate concentration of the analyzed isotonic drink meet the requirements stated in the Regulation of the Minister of Health of the Republic of Indonesia 722/Menkes/Per/IX/88 on Food Additives, that is not exceed 600 mg/kg. While the use of citric acid in soft drinks is not limited to use in current levels by National Agency by Drug and Food Controls.
The results of test method validation that was conducted provide eligible accuracy and precision such as 85.26% recovery with RSD 1.20%, the limit of detection (LOD) 0.4231 µg/ml (λ229); 0.4563 µg/ml (λ208) and the limit of quantitation (LOQ) 1.4104 µg/ml (λ229); 1.5209 µg/ml (λ208) for benzoic acid. While for citric acid, the results of test method validation provide eligible accuracy and precision that is 86.33% recovery with RSD 0.52%, the limit of detection (LOD) 36.8571 µg/ml (λ229); 40.8000 µg/ml (λ208) and the limit of quantitation (LOQ) 122.8571 µg/ml (λ229); 136 µg/ml (λ208). Based on these results can be concluded that ultraviolet spectrophotometric method with the calculation of regression equation method provide good accuracy and precision. Key word: isotonic, sodium benzoate, citric acid, spectrophotometry ultraviolet,
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Minuman Isotonik ... 5
2.2 Cairan dan Elektrolit ... 5
2.3 Bahan Tambahan Pangan ... 6
2.3.1 Bahan Pengawet ... 6
2.3.1.2 Bahan Pengawet Anorganik ... 7
2.3.2 Pengatur Keasaman ... 8
2.4 Natrium Benzoat ... 9
2.4.1 Sifat Fisikokimia ... 9
2.4.2 Aktivitas ... 9
2.5 Asam Sitrat ... 10
2.5.1 Sifat Fisikokimia ... 10
2.5.2 Aktivitas ... 11
2.6 Spektrofotometri Ultraviolet ... 11
2.6.1 Hukum Lambert Beer ... 12
2.6.2 Kegunaan Spektrofotometri Ultraviolet ... 12
2.6.2.1 Analisis Kualitatif ... 13
2.6.2.2 Analisis Kuantitatif ... 13
2.7 Validasi Metode ... 17
BAB III METODE PENELITIAN ... 21
3.1 Tempat dan Waktu Penelitian ... 21
3.2 Bahan-bahan ... 21
3.2.1 Sampel ... 21
3.2.2 Pereaksi ... 21
3.3 Alat-alat ... 21
3.4 Pembuatan Pereaksi ... 22
3.4.1 Larutan HCl 0,1 N ... 22
3.4.2 Larutan Natrium Hidroksida 0,05 N ... 22
3.4.4 Larutan Besi (III) Klorida b/v ... 22
3.4.5 Larutan Deniges ... 22
3.5 Pengambilan Sampel ... 22
3.6 Analisis Kualitatif ... 23
3.6.1 Analisis Kualitatif Natrium Benzoat ... 23
3.6.2 Analisis Kualitatif Asam Sitrat ... 23
3.7 Penentuan Kadar Baku Pembanding ... 23
3.7.1 Penentuan Kadar Baku Pembanding Asam Benzoat . 23 3.7.2 Penentuan Kadar Baku Pembanding Asam Sitrat ... 24
3.8 Pembuatan Larutan Induk Baku ... 24
3.8.1 Pembuatan Larutan Induk Baku Asam Benzoat ... 24
3.8.2 Pembuatan Larutan Induk Baku Asam Sitrat ... 25
3.9 Penentuan Panjang Gelombang Maksimum ... 25
3.9.1 Penentuan Panjang Gelombang Maksimum Asam Benzoat ... 25
3.9.2 Penentuan Panjang Gelombang Maksimum Asam Sitrat ... 25
3.10 Pembuatan Kurva Serapan Gabungan (Overlap) Asam Sitrat dan Asam Benzoat (50:1) ... 26
3.11 Pembuatan Kurva Kalibrasi ... 26
3.11.1 Pembuatan Kurva Kalibrasi Asam Benzoat ... 26
3.11.2 Pembuatan Kurva Kalibrasi Asam Sitrat ... 26
3.12 Penetapan Kadar Campuran Baku Asam Benzoat dan Asam Sitrat ... 27
3.13.1 Penetapan Kadar Natrium Benzoat dan Asam Sitrat
dalam Sampel A ... 27
3.13.2 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel B ... 28
3.13.3 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel C ... 28
3.13.4 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel D ... 28
3.14 Analisis Data Secara Statistik ... 29
3.15 Validasi Metode Analisis ... 30
3.15.1 Uji Perolehan Kembali (Recovery) ... 30
3.15.2 Simpangan Baku Relatif ... 31
3.15.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation) ... 31
BAB IV HASIL DAN PEMBAHASAN ... 33
4.1 Analisis Kualitatif Benzoat dan Sitrat pada Sampel ... 33
4.2 Penentuan Kadar Baku Pembanding ... 33
4.2.1 Penentuan Kadar Baku Pembanding Asam Benzoat . 33 4.2.2 Penentuan Kadar Baku Pembanding Asam Sitrat ... 34
4.3 Penentuan Panjang Gelombang Maksimum ... 34
4.4 Pembuatan Kurva Serapan Gabungan (Overlap) Asam Sitrat dan Asam Benzoat (50:1) ... 35
4.5 Kurva Kalibrasi ... 37
4.5.1 Kurva Kalibrasi Asam Benzoat ... 37
4.5.2 Kurva Kalibrasi Asam Sitrat ... 38
4.6 Penetapan Kadar Campuran Baku Asam Benzoat dan Asam Sitrat ... 39
4.8 Validasi Metode Analisis ... 41
4.8.1 Uji Perolehan Kembali (Recovery) ... 41
4.8.2 Simpangan Baku Relatif ... 42
4.8.3 Batas Deteksi dan Batas Kuantitasi ... 43
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Halaman Tabel 1. Hasil Analisis Kualitatif Benzoat dan Sitrat pada Sampel ... 33 Tabel 2. Hasil Analisis Kadar Natrium Benzoat dan Asam Sitrat pada
Minuman Isotonik ... 41 Tabel 3. Persen Uji Perolehan Kembali (recovery) Asam Benzoat dan
DAFTAR GAMBAR
Halaman Gambar 1. Spektrum absorpsi senyawa X dan Y (tidak terjadi
tumpang tindih pada kedua panjang gelombang yang
digunakan) ... 15 Gambar 2. Spektrum absorpsi senyawa X dan Y (tumpang tindih
satu arah; X dapat diukur tanpa gangguan Y, tetapi X
mengganggu pada pengukuran langsung dari Y) ... 16 Gambar 3. Spektrum absorpsi senyawa X dan Y (tumpang tindih
dua arah. Tidak ada panjang gelombang dimana
masing-masing senyawa dapat diukur tanpa mengalami
gangguan oleh yang lainnya) ... 17 Gambar 4. Kurva Serapan Baku Pembanding Asam Benzoat ... 35 Gambar 5. Kurva Serapan Baku Pembanding Asam Sitrat ... 35 Gambar 6. Kurva Serapan Gabungan (Overlap) Baku Pembanding
Asam Sitrat dan Baku Pembanding Asam Benzoat (50:1) ... 36 Gambar 7. Kurva Kalibrasi Asam Benzoat pada Panjang Gelombang 229 nm ... 37 Gambar 8. Kurva Kalibrasi Asam Benzoat pada Panjang Gelombang 208 nm ... 37 Gambar 9. Kurva Kalibrasi Asam Sitrat pada Panjang Gelombang
208 nm ... 38 Gambar 10. Kurva Kalibrasi Asam Sitrat pada Panjang Gelombang
229 nm ... 39
DAFTAR LAMPIRAN
Halaman Lampiran 1. Perhitungan Konsentrasi Pengukuran Asam Benzoat ... 48 Lampiran 2. Perhitungan Hasil Kadar Baku Pembanding Asam
Benzoat ... 49 Lampiran 3. Perhitungan Hasil Kadar Baku Pembanding Asam Sitrat 51 Lampiran 4. Data Kalibrasi Asam Benzoat pada Panjang Gelombang
229 nm dengan Spektrofotometri Ultraviolet, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 53 Lampiran 5. Data Kalibrasi Asam Benzoat pada Panjang Gelombang
208 nm dengan Spektrofotometri Ultraviolet, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 55 Lampiran 6. Data Kalibrasi Asam Sitrat pada Panjang Gelombang
208 nm dengan Spektrofotometri Ultraviolet, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 57 Lampiran 7. Data Kalibrasi Asam Sitrat pada Panjang Gelombang
229 nm dengan Spektrofotometri Ultraviolet, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 59 Lampiran 8. Contoh Perhitungan Campuran Baku Asam Benzoat dan
Asam Sitrat ... 61 Lampiran 9. Hasil Analisis Kadar Natrium Benzoat dan Asam Sitrat
Dalam Sampel ... 64 Lampiran 10. Contoh Perhitungan Kadar Natrium Benzoat dan Asam
Sitrat dalam Sampel A ... 66 Lampiran 11. Contoh Perhitungan Kadar Natrium Benzoat dan Asam
Sitrat dalam Sampel B ... 69 Lampiran 12. Contoh Perhitungan Kadar Natrium Benzoat dan Asam
Sitrat dalam Sampel C ... 72 Lampiran 13. Contoh Perhitungan Kadar Natrium Benzoat dan Asam
Sitrat dalam Sampel D ... 75 Lampiran 14. Perhitungan Statistik Kadar Natrium Benzoat dan Asam
Sitrat dalam Sampel A ... 78 Lampiran 15. Perhitungan Statistik Kadar Natrium Benzoat dan Asam
Lampiran 16. Perhitungan Statistik Kadar Natrium Benzoat dan Asam
Sitrat dalam Sampel C ... 86
Lampiran 17. Perhitungan Statistik Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel D ... 90
Lampiran 18. Perhitungan Batas Deteksi dan Batas Kuantitasi ... 94
Lampiran 19. Hasil Uji Perolehan Kembali Asam Benzoat dan Asam Sitrat Setelah Penambahan Masing-Masing Larutan Standar pada Sampel ... 98
Lampiran 20. Contoh Perhitungan Uji Perolehan Kembali Asam Benzoat dan Asam Sitrat pada Sampel ... 99
Lampiran 21. Perhitungan Simpangan Baku Relatif (RSD) Kadar Asam Benzoat dan Asam Sitrat pada Sampel ... 103
Lampiran 22. Perhitungan Pembuatan HCl 0,1 N ... 105
Lampiran 23. Perhitungan Pembuatan NaOH 0,05 N ... 105
Lampiran 24. Daftar Nilai Distribusi t ... 106
Lampiran 25. Gambar Sampel Minuman Isotonik ... 107
Lampiran 26. Komposisi Sampel Minuman Isotonik ... 108
Lampiran 27. Gambar Hasil Analisis Kualitatif Benzoat dan Sitrat ... 109
Lampiran 28. Gambar Asam Benzoat dan Asam Sitrat Pro Analis ... 110
ANALISIS KANDUNGAN NATRIUM BENZOAT DAN ASAM SITRAT PADA MINUMAN ISOTONIK
SECARA SIMULTAN DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
ABSTRAK
Natrium benzoat merupakan pengawet yang banyak dijual di pasaran dan digunakan untuk mengawetkan berbagai bahan pangan. Penambahan asam sitrat sebagai pengatur keasaman pada penggunaan natrium benzoat bertujuan untuk meningkatkan efektifitas natrium benzoat sebagai bahan pengawet. Tujuan penelitian ini adalah untuk melakukan analisis kandungan natrium benzoat dan asam sitrat pada minuman isotonik secara simultan dengan spektrofotometri ultraviolet.
Metode penelitian ini dilakukan dengan metode spektrofotometri ultraviolet menggunakan perhitungan persamaan regresi yang diukur absorbansinya pada panjang gelombang asam benzoat 229 nm dan asam sitrat 208 nm. Penelitian ini terlebih dahulu dilakukan dengan penetapan kadar campuran bahan baku asam benzoat dan asam sitrat, selanjutnya dilakukan analisis kandungan natrium benzoat dan asam sitrat secara simultan pada minuman isotonik.
Hasil penetapan kadar natrium benzoat pada sampel A adalah sebesar 260,7816 ± 2,8096 mg/kg, sampel B sebesar 278,5271 ± 4,1238 mg/kg, sampel C sebesar 129,4119 ± 2,5809 mg/kg, sampel D sebesar 175,6334 ± 1,2820 mg/kg dan hasil penetapan kadar asam sitrat pada sampel A sebesar 19603,2026 ± 995,8723 mg/kg, sampel B sebesar 12238,2021 ± 452,3898 mg/kg, sampel C sebesar 11403,5265 ± 575,6900 mg/kg, sampel D sebesar 1673,1440 ± 286,8816 mg/kg. Hal ini menunjukkan bahwa minuman isotonik yang dianalisis memenuhi persyaratan kadar yang tercantum dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 722/MenKes/Per/IX/88 tentang Bahan Tambahan Makanan, yaitu tidak lebih dari 600 mg/kg. Sedangkan penggunaan asam sitrat dalam minuman ringan sampai saat ini belum dibatasi kadar penggunaannya oleh badan pengawas obat dan makanan.
Hasil uji validasi metode yang dilakukan memberikan akurasi dan presisi yang memenuhi syarat yaitu 85,26% recovery dengan RSD 1,20%, batas deteksi (LOD) 0,4231 µg/ml (λ229); 0,4563 µg/ml (λ208) dan batas kuantitasi (LOQ) 1,4104 µg/ml (λ229); 1,5209 µg/ml (λ208) untuk asam benzoat. Sedangkan untuk asam sitrat, hasil uji validasi metode yang dilakukan juga memberikan akurasi dan presisi yang memenuhi syarat yaitu 86,33% recovery dengan RSD 0,52%, batas deteksi (LOD) 36,8571 µg/ml (λ229); 40,8000 µg/ml (λ208) dan batas kuantitasi (LOQ) 122,8571 µg/ml (λ229); 136 µg/ml (λ208). Berdasarkan hasil penelitian tersebut dapat disimpulkan bahwa metode spektrofotometri ultraviolet secara simultan dengan metode perhitungan persamaan regresi memberikan ketepatan dan ketelitian yang baik.
CONTENT ANALYSIS OF SODIUM BENZOATE
AND CITRIC ACID IN ISOTONIC DRINKS SIMULTANEOUSLY BY SPECTROPHOTOMETRY ULTRAVIOLET METHOD
ABSTRACT
Sodium benzoate is a preservative that is commonly sold in the market and also used as food preservative. The addition of citric acid as acidity regulator on the sodium benzoate usage served a purpose to enhance the effectiveness of sodium benzoate as a preservative. The purpose of this study is to do a content analysis of sodium benzoate and citric acid in isotonic drinks simultaneously by ultraviolet spectrophotometry.
This study method is done by spectrophotometry ultraviolet using calculation of regression equation that measured at wavelength of benzoic acid 229 nm and citric acid 208 nm. Firstly, this study conducted by assay mixture of benzoic acid and citric acid as material strandard, then we do content analysis of sodium benzoate and citric acid simultaneously in isotonic drinks.
The result of sodium benzoate assay in sample A is 260.7816 ± 2.8096 mg/kg, sample B is 278.5272 ± 4.1238 mg/kg, sample C is 129.4118 ± 2.5810 mg/kg, sample D is 175.6335 ± 1.2295 mg/kg and the result of citric acid in sample A is 19603.2026 ± 995.8722 mg/kg, sample B is 12238.2022 ± 452.3898 mg/kg, sample C is 11403.5265 ± 575.6899 mg/kg, sample D is 1673.1440 ± 286.8719 mg/kg. This result indicate that sodium benzoate concentration of the analyzed isotonic drink meet the requirements stated in the Regulation of the Minister of Health of the Republic of Indonesia 722/Menkes/Per/IX/88 on Food Additives, that is not exceed 600 mg/kg. While the use of citric acid in soft drinks is not limited to use in current levels by National Agency by Drug and Food Controls.
The results of test method validation that was conducted provide eligible accuracy and precision such as 85.26% recovery with RSD 1.20%, the limit of detection (LOD) 0.4231 µg/ml (λ229); 0.4563 µg/ml (λ208) and the limit of quantitation (LOQ) 1.4104 µg/ml (λ229); 1.5209 µg/ml (λ208) for benzoic acid. While for citric acid, the results of test method validation provide eligible accuracy and precision that is 86.33% recovery with RSD 0.52%, the limit of detection (LOD) 36.8571 µg/ml (λ229); 40.8000 µg/ml (λ208) and the limit of quantitation (LOQ) 122.8571 µg/ml (λ229); 136 µg/ml (λ208). Based on these results can be concluded that ultraviolet spectrophotometric method with the calculation of regression equation method provide good accuracy and precision. Key word: isotonic, sodium benzoate, citric acid, spectrophotometry ultraviolet,
BAB I
PENDAHULUAN
1.1 Latar Belakang
Minuman isotonik seringkali digunakan untuk larutan atau minuman yang memiliki nilai osmolaritas yang mirip dengan cairan tubuh (darah), sekitar 280 mOsm/kg H2O. Minuman isotonik juga dikenal dengan sport drink yaitu minuman yang berfungsi untuk mempertahankan cairan dan garam tubuh serta memberikan energi karbohidrat ketika melakukan aktivitas (Stofan dan Murray, 2001).
Pada berbagai pangan dan minuman ringan seperti minuman isotonik, bahan tambahan pangan yang sering digunakan sebagai pengawet ialah asam benzoat. Asam benzoat merupakan pengawet yang banyak dijual di pasaran dan digunakan untuk mengawetkan berbagai bahan pangan, yang umumnya terdapat dalam bentuk garamnya yaitu natrium benzoat atau kalium benzoat yang bersifat lebih mudah larut (Cahyadi, 2012).
Berdasarkan Peraturan Menteri Kesehatan Republik Indonesia Nomor 722/MenKes/Per/IX/88 tentang Bahan Tambahan Makanan, batas penggunaan natrium benzoat pada minuman ringan yaitu 600 mg/kg. Sedangkan, batas penggunaan asam sitrat pada minuman ringan yaitu secukupnya, dalam arti jumlah yang ditambahkan tidak melebihi jumlah wajar yang diperlukan sesuai dengan tujuan penggunaan bahan tambahan pangan tersebut. Penumpukan asam benzoat ataupun garamnya di dalam tubuh menyebabkan reaksi yang sangat sensitif pada penderita asma (pseudoalergi) dan penderita urticaria, selain itu jika dikonsumsi dalam jumlah besar akan menyebabkan iritasi lambung (Afrianti, 2010).
Natrium benzoat dan asam sitrat memiliki struktur molekul kimia yang mengandung gugus kromofor dan ausokrom. Kedua senyawa tersebut mempunyai sifat fisika kimia yang hampir sama, atau profil kurva serapan masing-masing komponen saling tumpang tindih pada daerah tertentu sehingga serapan yang diperoleh merupakan jumlah serapan dari masing-masing komponen tersebut.
Berdasarkan uraian di atas maka penulis tertarik untuk menetapkan kadar campuran natrium benzoat dan asam sitrat pada minuman isotonik dengan menggunakan metode spektrofotometri ultraviolet secara simultan. Perhitungan secara simultan dapat dilakukan dengan beberapa cara, yaitu dengan persamaan multikomponen, matriks dan persamaan regresi. Pada saat ini, perhitungan dengan metode persamaan regresi belum pernah dilakukan untuk penentuan kadar campuran natrium benzoat dan asam sitrat.
Untuk menguji validasi metode, dilakukan uji akurasi (ketepatan) dengan parameter persen perolehan kembali dengan metode penambahan baku (standard addition method) dan uji presisi (ketelitian) dengan parameter Relatif Standard Deviasi (RSD).
1.2 Perumusan Masalah
1. Apakah campuran natrium benzoat dan asam sitrat dapat dianalisis secara simultan dengan metode persamaan regresi?
2. Apakah kandungan natrium benzoat dan asam sitrat dalam minuman isotonik dapat dianalisis secara simultan yang memenuhi uji validasi metode?
3. Apakah jumlah pengawet natrium benzoat dalam minuman isotonik yang beredar di kota Medan sesuai dengan standar yang ditetapkan oleh Peraturan Menteri Kesehatan RI No. 722 tentang bahan tambahan pangan (yaitu tidak lebih dari 600 mg/kg)?
1.3 Hipotesis
1. Dapat dilakukan analisis campuran natrium benzoat dan asam sitrat secara simultan dengan metode persamaan regresi.
2. Dapat dilakukan analisis kandungan natrium benzoat dan asam sitrat dalam minuman isotonik secara simultan dan memenuhi uji validasi metode. 3. Jumlah pengawet natrium benzoat dalam minuman isotonik yang beredar
Menteri Kesehatan RI No. 722 tentang bahan tambahan pangan (yaitu tidak lebih dari 600 mg/kg).
1.4 Tujuan Penelitian
1. Untuk menetapkan kadar campuran natrium benzoat dan asam sitrat secara simultan dengan metode persamaan regresi.
2. Untuk menentukan validasi spektrofotometri ultraviolet pada penetapan kadar kombinasi natrium benzoat dan asam sitrat pada minuman isotonik. 3. Untuk mengetahui kesesuaian jumlah pengawet natrium benzoat dalam
minuman isotonik yang beredar di kota Medan dengan standar yang ditetapkan oleh Peraturan Menteri Kesehatan RI No. 722 tentang bahan tambahan pangan (yaitu tidak lebih dari 600 mg/kg).
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Minuman Isotonik
Minuman isotonik merupakan minuman yang memiliki osmolaritas yang mirip dengan cairan tubuh (darah), sekitar 280 mOsm/kg H2O. Minuman isotonik sering juga disebut sebagai sport drinks, carbohydrate-electrolite atau electrolite replacement drinks yang umumnya mengandung air, karbohidrat dan sejumlah kecil mineral (elektrolit) seperti natrium, kalium, klorida dan fosfat (Stofan dan Murray, 2001). Selain itu, juga ditambahkan flavoring agent yang berfungsi dalam memberikan dan memperbaiki cita rasa pada produk serta menambahkan bahan pengawet yang mencegah aktivitas mikroba, kapang, maupun khamir yang dapat menyebabkan kebusukan, fermentasi, pengasaman, maupun dekomposisi dalam bahan pangan (Koswara, 2009).
Menurut Stofan dan Murray (2001), minuman isotonik di formulasi untuk memberikan manfaat yang yang berarti dalam berbagai keadaan, seperti:
1. Merangsang penyerapan cairan dengan cepat 2. Asupan karbohidrat
3. Meningkatkan respon fisiologis 4. Mempercepat rehidrasi
2.2 Cairan dan Elektrolit
membutuhkan perubahan yang tetap dalam berespons terhadap stressor fisiologis dan lingkungan. Dengan kemampuannya yang sangat besar untuk menyesuaikan diri, tubuh mempertahankan keseimbangan biasanya dengan proses-proses fisiologis yang terintegrasi mengakibatkan adanya lingkungan sel yang relatif konstan. Kemampuan tubuh untuk mempertahankan keseimbangan cairan ini dinamakan “homeostasis”. Menurut Wiarto (2013), kekurangan cairan tubuh dapat mengakibatkan hal-hal, seperti:
1. Metabolisme tubuh akan terganggu 2. Urine tidak dapat diproduksi 3. Kurang berkeringat
4. Volume darah berkurang 5. Suhu tubuh akan meningkat 6. Menyebabkan kelelahan
Elektrolit adalah substansi yang berupa ion kation dan anion. Tiga cairan elektrolit yang paling essensial adalah natrium, kalium dan kalsium. Kekurangan elektrolit dapat menimbulkan gejala-gejala yang serius, bahkan dapat menyebabkan pingsan. Faktor-faktor yang mengakibatkan kebutuhan cairan tubuh meningkat yaitu usia, temperatur lingkungan, aktifitas, diet dan sakit (Wiarto, 2013).
2.3 Bahan Tambahan Pangan
2.3.1 Bahan Pengawet
terhadap pangan yang disebabkan oleh mikroorganisme. Kerusakan tersebut dapat disebabkan oleh fungi, bakteria dan mikroba lainnya (Afrianti, 2010).
Tanpa bahan tambahan pangan, khususnya bahan pengawet maka bahan pangan yang tersedia di pasar atau swalayan akan menjadi kurang menarik, tidak dapat dinikmati secara layak dan tidak awet (Cahyadi, 2012).
Pengawet makanan dibedakan menjadi tiga jenis, yaitu pertama, GRAS (Generally Recognized as Safe), yang biasanya bersifat alami sehingga tidak menimbulkan efek racun pada tubuh. Kedua, pengawet yang ditentukan pemakaiannya oleh ADI (Acceptable Daily Intake), yang disesuaikan dengan batas penggunaan hariannya untuk kesehatan konsumen. Ketiga, zat pengawet yang tidak layak dikonsumi sama sekali (Afrianti, 2010).
Berdasarkan bahan asalnya maka bahan pengawet dibagi menjadi dua jenis, yaitu bahan pengawet organik dan bahan pengawet anorganik (Cahyadi, 2012).
2.3.1.1 Bahan Pengawet Organik
Zat pengawet organik lebih banyak digunakan daripada zat pengawet anorganik karena bahan ini lebih mudah larut. Bahan organik digunakan baik dalam bentuk asam maupun dalam bentuk garamnya. Zat kimia yang sering digunakan sebagai bahan pengawet adalah asam sorbat, asam propionat, asam benzoat, asam asetat dan epoksida (Cahyadi, 2012).
2.3.1.2 Bahan Pengawet Anorganik
pada proses curing daging untuk memperoleh warna yang baik dan mencegah pertumbuhan mikroba. Selain digunakan pada produk daging, nitrat dan nitrit juga digunakan pada ikan dan keju (Cahyadi, 2012).
2.3.2 Pengatur Keasaman
Pengatur keasaman (asidulan) merupakan senyawa kimia yang bersifat asam dan merupakan salah satu dari bahan tambahan pangan yang sengaja ditambahkan ke dalam pangan dengan berbagai tujuan. Penggunaan pengatur keasaman di dalam pangan, yaitu untuk memperoleh rasa asam yang tajam, sebagai pengontrol pH atau sebagai bahan pengawet (Cahyadi, 2012).
Keadaan yang bersifat asam mudah dicapai dengan penambahan asam. Dari sejumlah pengatur keasaman pada umumnya terdapat delapan jenis asam organik yang lebih sering digunakan untuk memperoleh/ memberikan rasa asam pada bahan pangan, diantaranya adalah asam sitrat, asam asetat, asam laktat, asam fumarat, asam malat, asam suksinat, asam tartrat dan asam fosfat (Cahyadi, 2012).
2.4 Natrium Benzoat
2.4.1 Sifat Fisikokimia
Menurut Ditjen POM (1995), sifat fisikokimia natrium benzoat adalah sebagai berikut:
Rumus struktur :
Rumus Molekul : C7H5NaO2 Berat Molekul : 144,12
Nama Kimia : Natrium benzoat
Kandungan : Tidak kurang dari 99,5% dan tidak lebih dari 100,5% C7H5NaO2, dihitung terhadap zat anhidrat. Pemerian : Granul atau serbuk hablur; putih; tidak berbau atau
praktis tidak berbau; stabil di udara.
Kelarutan : Mudah larut dalam air; agak sukar larut dalam etanol, dan lebih mudah larut dalam etanol 90%.
2.4.2 Aktivitas
benzoat dan garamnya (Na dan K) relatif kurang efektif sebagai bahan pengawet pada pH lebih besar, tetapi kerjanya sebagai pengawet akan naik dengan turunnya pH sampai di bawah pH 5 (Cahyadi, 2012). Penggunaan asam benzoat dalam sediaan obat luar sering dikombinasikan dengan asam salisilat yang memiliki kerja fungistatis maupun bakteriostatis (Tan dan Rahardja, 2007).
2.5 Asam Sitrat
2.5.1 Sifat Fisikokimia
Menurut Ditjen POM (1995), sifat fisikokimia asam sitrat adalah sebagai berikut:
Rumus struktur :
Rumus Molekul : C6H8O7 Berat Molekul : 192,12 Nama Kimia : Asam sitrat
Kandungan : Tidak kurang dari 99,5% dan tidak lebih dari 100,5% C6H8O7, dihitung terhadap zat anhidrat.
Pemerian : Hablur bening; tidak berwarna atau serbuk hablur granul sampai halus, putih; tidak berbau atau praktis tidak berbau; rasa sangat asam.
2.5.2 Aktivitas
Asam sitrat termasuk dalam kelompok pengasaman jika ditinjau dari fungsi pengatur keasaman (Cahyadi, 2012). Penambahan asam sitrat akan menurunkan pH larutan menjadi pH asam sehingga dapat meningkatkan proporsi asam yang tidak terdisosiasi yang berperan dalam pengawetan (Afrianti, 2010).
2.6 Spektrofotometri Ultraviolet
Spektrofotometer ultraviolet adalah alat yang digunakan dalam pengukuran panjang gelombang dan intensitas sinar ultraviolet yang diabsorpsi oleh sampel. Sinar ultraviolet memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi (Dachriyanus, 2004).
Radiasi ultraviolet diabsorpsi oleh molekul organik aromatik, molekul yang mengandung elektron-π terkonjugasi dan/ atau atom yang mengandung elektron-n, menyebabkan transisi elektron di orbit terluarnya dari tingkat energi elektron dasar ke tingkat energi tereksitasi lebih tinggi (Satiadarma, 2004).
pergeseran batokromik) disertai dengan peningkatan intensitas (efek hiperkromik) (Rohman, 2007).
2.6.1 Hukum Lambert-Beer
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Rohman, 2007). Menurut Denney dan Sinclair (1991), dalam hukum Lambert-Beer terdapat beberapa pembatasan, yaitu:
1. Larutan yang menyerap cahaya adalah campuran yang homogen 2. Menggunakan sinar monokromatis
3. Rendahnya konsentrasi dari senyawa yang menyerap cahaya
Hukum Lambert-Beer umumnya dikenal dengan persamaan sebagai berikut: A = abc
Dimana: A= absorbansi a = absorptivitas b = tebal kuvet (cm) c = konsentrasi
Absorptivitas (a) merupakan suatu konstanta yang tidak tergantung pada konsentrasi, tebal kuvet dan intensitas radiasi yang mengenai larutan sampel. Absorptivitas tergantung pada suhu, pelarut, struktur molekul dan panjang gelombang radiasi. Satuan a ditentukan oleh satuan b dan c (Rohman, 2007).
2.6.2 Kegunaan Spektrofotometri Ultraviolet
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa
3. Mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer
2.6.2.1 Analisis Kualitatif
Kegunaan spektrofotometri ultraviolet dalam analisis kualitatif sangat terbatas karena rentang daerah radiasi yang relatif sempit hanya dapat mengakomodasi sedikit sekali puncak absorpsi maksimum dan minimum, karena itu identifikasi senyawa yang tidak diketahui tidak memungkinkan untuk dilakukan (Satiadarma, dkk, 2004).
Akan tetapi, jika digabung dengan cara lain seperti spektroskopi inframerah, resonansi magnet inti dan spektroskopi massa, maka dapat digunakan untuk identifikasi atau analisis kualitatif senyawa tersebut (Rohman, 2007).
2.6.2.2 Analisis Kuantitatif
struktur kromofor atau mengandung gugus kromofor, serta mengabsorpsi radiasi ultraviolet penggunaanya cukup luas (Satiadarma, dkk, 2004).
Analisis kuantitatif dengan metode spektrofotometri ultraviolet dapat digolongkan menjadi analisis zat tunggal atau analisis satu komponen dan analisis kuantitatif dua macam zat atau lebih (analisis multikomponen).
1. Analisis kuantitatif zat tunggal (analisis satu komponen)
Terdapat dua metode penggunan pengukuran spektofotometri dalam analisis senyawa, yaitu metode penetapan kadar absolut dan komparatif. Metode penetapan kadar komparatif lebih disukai. Pada jenis penetapan kadar ini, larutan standar obat yang akan dianalisis disiapkan, serapan sampel dan standar ditentukan pada kondisi yang sama (Cairns, 2009), dimana menurut Holme dan Hazel (1983), konsentrasi sampel dihitung dengan rumus sebagai berikut:
Ct
Cs At As =
Keterangan: As = Absorbansi baku pembanding At = Absorbansi sampel
Cs = Konsentrasi baku pembanding Ct = Konsentrasi sampel
(2002), ada tiga kemungkinan analisis campuran dua komponen atau lebih, yaitu:
a. Spektrum tanpa tumpang tindih (overlap)
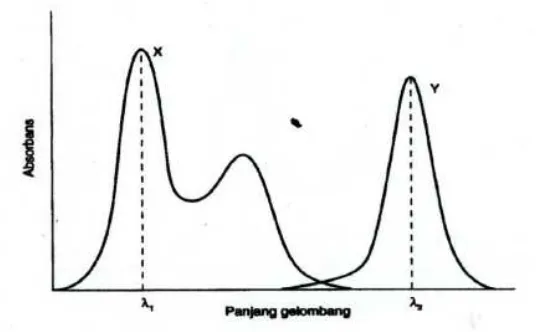
[image:33.595.174.443.320.486.2]Spektrum tidak saling tumpang tindih memungkinkan untuk menemukan suatu panjang gelombang dimana X menyerap dan Y tidak menyerap, serta panjang gelombang serapan maksimum dimana Y menyerap dan X tidak menyerap (Gambar 1). Komponen X dan Y masing-masing diukur pada λ1 dan λ2.
Gambar 1. Spektrum absorpsi senyawa X dan Y (tidak terjadi tumpang tindih pada kedua panjang gelombang yang digunakan)
b. Spektrum tumpang tindih satu arah
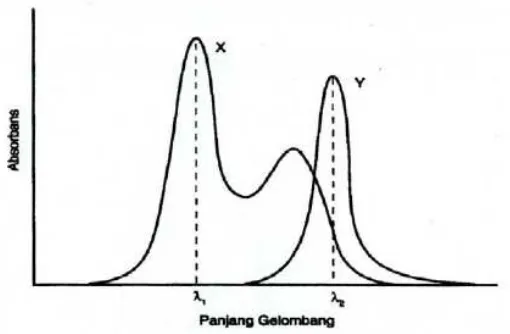
Spektrum dari X dan Y tumpang tindih satu arah (Gambar 2). Y tidak mengganggu pengukuran X pada λ1 tetapi X menyerap cukup banyak
yang sebelumnya telah diketahui. Serapan ini dikurangkan dari serapan terukur larutan pada λ2 sehingga diperoleh serapan yang disebabkan
[image:34.595.173.428.213.380.2]oleh komponen Y. Kemudian konsentrasi Y dapat dihitung dengan cara yang biasa.
Gambar 2. Spektrum absorpsi senyawa X dan Y (tumpang tindih satu arah; X dapat diukur tanpa gangguan Y, tetapi X mengganggu pada pengukuran langsung dari Y)
c. Spektrum tumpang tindih dua arah
Gambar 3. Spektrum absorpsi senyawa X dan Y (tumpang tindih dua arah. Tidak ada panjang gelombang dimana masing-masing senyawa dapat diukur tanpa mengalami gangguan oleh yang lainnya)
2.7 Validasi Metode
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kerjanya cukup mampu untuk mengatasi masalah analisis dan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang dianalisis (Rohman, 2007).
validasi adalah akurasi, presisi, spesifisitas, limit deteksi, limit kuantitasi, kelinieran dan rentang (Rohman, 2007).
Akurasi (kecermatan) adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan dan dapat ditentukan melalui dua cara yaitu metode simulasi (spiked placebo recovery) dan metode penambahan bahan baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan murni (senyawa pembanding kimia) ditambahkan kedalam campuran bahan sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar standar yang ditambahkan (kadar sebenarnya). Dalam metode adisi (penambahan bahan baku), sejumlah sampel yang dianalisis ditambah analit dengan konsentrasi tertentu (biasanya 80% sampai 120% dari kadar analit yang diperkirakan), dicampur dan dianalisis kembali. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan). Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya (Harmita, 2004):
% Perolehan Kembali= CF- CA
CA* ×100%
Keterangan: CF = Kadar sampel setelah penambahan larutan baku CA = Kadar sampel sebelum penambahan larutan baku C A * = Kadar larutan baku yang ditambahkan
standar relatif. Presisi dapat diartikan pula sebagai reprodusibilitas (reproducibility) atau keterulangan (repeatability) dari prosedur analisis pada kondisi kerja normal (Satiadarma, dkk, 2004). Parameter-parameter seperti standar deviasi, simpangan baku relatif dan derajat kepercayaan haruslah dikalkulasi untuk mendapatkan tingkat presisi tertentu. Nilai RSD dinyatakan memenuhi persyaratan jika < 10 - 20% (Ermer dan Miller, 2005).
Simpangan baku relatif (RSD) = ×100%
X SD
Batas deteksi adalah nilai parameter, yaitu konsentrasi analit terendah yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004). Batas deteksi merupakan batas uji yang secara spesifik menyatakan apakah analit yang dianalisis berada di atas atau di bawah nilai tertentu (Rohman, 2007). Menurut Harmita (2004), batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas deteksi (LOD) =
slope SB x
3
Batas kuantitasi adalah jumlah analit terkecil dalam sampel yang masih dapat diukur dalam kondisi percobaan yang sama dan memenuhi kriteria ceermat dan seksama (Harmita, 2004).
Batas kuantitasi (LOQ) =
slope SB x
10
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Sumatera Utara dan di Laboratorium Kimia Farmasi Kualitatif Fakultas Farmasi Universitas Sumatera Utara, dimulai dari Desember 2013 sampai Februari 2014.
3.2 Bahan-bahan
3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah minuman isotonik yang diperoleh dari pusat perbelanjaan Carrefour, Jalan Jenderal Gatot Subroto. 3.2.2 Pereaksi
Bahan-bahan yang digunakan dalam penelitian ini adalah bahan yang berkualitas pro analis dari E. Merck yaitu asam benzoat, asam sitrat, natrium hidroksida, kalium hidrogen ftalat, fenoftalein kecuali aquadest (CV. Rudang Jaya). Digunakan asam benzoat dan asam sitrat berkualitas pro analis karena tidak tersedianya asam benzoat dan asam sitrat Baku Pembanding Farmakope Indonesia (BPFI).
3.3 Alat-alat
indikator universal, tabung reaksi, penjepit tabung, penangas air dan alat-alat gelas.
3.4 Pembuatan Pereaksi
3.4.1 Larutan HCl 0,1 N
Diencerkan 8,5 ml HCl 37% dengan 1 liter aquadest (Ditjen POM, 1979). 3.4.2 Larutan Natrium Hidroksida 0,05 N
Ditimbang 2,1 gram NaOH pellet kemudian larutkan NaOH pellet dalam aquadest bebas CO2 sampai volume 1 liter (Ditjen POM, 1979).
3.4.3 Larutan Indikator Fenolftalein b/v
Larutkan 200 mg fenolftalein dalam 60 ml etanol 96%. Tambahkan aquadest sampai 100 ml (Ditjen POM, 1979).
3.4.4 Larutan Besi (III) Klorida b/v
Larutkan 9 gram besi (III) klorida dalam air hingga 100 ml (Ditjen POM, 1995).
3.4.5 Larutan Deniges
Ditambahkan 10 ml asam sulfat pekat secara perlahan-lahan dalam 50 ml air, kemudian dilarutkan 2,2 gram merkurium (II) oksida dalam larutan tersebut (Vogel, 1985).
3.5 Pengambilan Sampel
menyediakan semua sampel yang digunakan dalam penelitian ini. Metode pengambilan sampel dilakukan secara purposif, yaitu metode pengambilan sampel ditentukan atas dasar pertimbangan bahwa sampel yang tidak terambil mempunyai karakteristik yang sama dengan sampel yang diteliti (Sudjana, 2005).
Pengambilan sampel didasarkan atas pertimbangan dimana produk yang beredar dipasaran yang mengandung natrium benzoat dan asam sitrat pada komposisinya. Diperoleh 4 (empat) sampel dan diberi penanda sebagai sampel A, sampel B, sampel C dan sampel D.
3.6 Analisis Kualitatif
3.6.1 Analisis Kualitatif Natrium Benzoat
Larutan sampel sebanyak 2 ml dimasukkan ke dalam tabung reaksi, kemudian ditetesi dengan larutan besi (III) klorida maka akan terbentuk endapan jingga-kekuningan (Vogel, 1985). Hasil analisis dapat dilihat pada Tabel 1, halaman 33.
3.6.2 Analisis Kualitatif Asam Sitrat
3.7 Penentuan Kadar Baku Pembanding
3.7.1 Penentuan Kadar Baku Pembanding Asam Benzoat
Ditimbang 50 mg baku pembanding asam benzoat. Dimasukkan dalam erlenmeyer, ditambahkan 2 ml etanol, aduk hingga larut. Tambahkan 25 ml aquadest. Tambahkan 3 tetes indikator fenolftalein. Titrasi dengan NaOH 0,05 N hingga titik akhir titrasi. Dicatat volume titrasi yang digunakan. Perlakuan diulang sebanyak tiga kali (Ditjen POM, 1995).
3.7.2Penentuan Kadar Baku Pembanding Asam Sitrat
Ditimbang 50 mg baku pembanding asam sitrat. Dimasukkan ke dalam erlenmeyer. Tambahkan 25 ml aquadest, aduk hingga larut. Tambahkan 3 tetes indikator fenolftalein. Titrasi dengan NaOH 0,05 N hingga titik akhir titrasi. Dicatat volume titrasi yang digunakan. Perlakuan diulang sebanyak tiga kali (Ditjen POM, 1995).
Kadar baku (%) = (Vt-Vb) x N NaOH x BE
Berat Sampel (mg) x 100%
Keterangan : Vt = Volume titrasi Vb = Volume blanko N = Normalitas BE = Berat Ekivalen
3.8 Pembuatan Larutan Induk Baku
3.8.1 Pembuatan Larutan Induk Baku Asam Benzoat
Ditimbang dengan seksama 50 mg baku pembanding asam benzoat kemudian dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan HCl 0,1 N hingga larut, dicukupkan volume dengan HCl 0,1 N sampai garis tanda (LIB I).
Konsentrasi LIB I : 50 mg
Dari larutan LIB I dipipet 5 ml dimasukkan ke dalam labu tentukur 50 ml, dicukupkan dengan HCl 0,1 N sampai garis tanda (LIB II).
Konsentrasi LIB II : 5 ml
50 ml x 500 μg/ml = 50 μg/ml 3.8.2Pembuatan Larutan Induk Baku Asam Sitrat
Ditimbang dengan seksama 100 mg baku pembanding asam sitrat kemudian dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan HCl 0,1 N hingga larut, dicukupkan volume dengan HCl 0,1 N sampai garis tanda.
Konsentrasi LIB : 100 mg
100 ml x 1000 μg/ml = 1000 μg/ml
3.9 Penentuan Panjang Gelombang Maksimum
3.9.1 Penentuan Panjang Gelombang Maksimum Asam Benzoat
Dipipet sebanyak 2,5 ml dari LIB II asam benzoat (50 µg/ml), dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan volume dengan HCl 0,1 N sampai garis tanda. Diperoleh konsentrasi 5 µg/ml. Kemudian diukur serapannya pada panjang gelombang 200 - 400 nm sehingga diperoleh panjang gelombang maksimum (hasil pengukuran dapat dilihat pada Gambar 4, halaman 35).
3.9.2 Penentuan Panjang Gelombang Maksimum Asam Sitrat
3.10 Pembuatan Kurva Serapan Gabungan (Overlap) Asam Sitrat dan Asam Benzoat (50 : 1)
Larutan baku pembanding asam sitrat dan asam benzoat dibuat dengan konsentrasi masing-masing 200 µg/ml dan 4 µg/ml (50 : 1) dengan cara dipipet sebanyak 5 ml dari LIB asam sitrat (1000 µg/ml), dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan volume dengan HCl 0,1 N sampai garis tanda dan diperoleh konsentrasi 200 µg/ml. Selanjutnya, dipipet sebanyak 2 ml dari LIB II asam benzoat (50 µg/ml), dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan volume dengan HCl 0,1 N sampai garis tanda. Diperoleh konsentrasi 4 µg/ml. Kemudian diukur serapan masing-masing pada rentang panjang gelombang 200 - 400 nm. Kurva serapan yang diperoleh masing-masing dibuat dengan cara tumpang tindih pada kerangka yang sama (hasil pengukuran dapat dilihat pada Gambar 6, halaman 36).
3.11 Pembuatan Kurva Kalibrasi
3.11.1 Pembuatan Kurva Kalibrasi Asam Benzoat
Dari LIB II dipipet 1,5 ml; 2 ml; 2,5 ml; 3 ml dan 3,5 ml, masing-masing dimasukkan ke dalam labu tentukur 25 ml, kemudian dicukupkan dengan HCl 0,1 N hingga garis tanda sehingga konsentrasi asam benzoat yang diperoleh adalah 3 µg/ml, 4 µg/ml, 5 µg/ml, 6 µg/ml dan 7 µg/ml. Diukur serapannya pada panjang gelombang maksimum asam benzoat dan asam sitrat yang telah diperoleh.
3.11.2 Pembuatan Kurva Kalibrasi Asam Sitrat
adalah 300 µg/ml, 400 µg/ml, 500 µg/ml, 600 µg/ml dan 700 µg/ml. Diukur serapannya pada panjang gelombang maksimum asam benzoat dan asam sitrat yang telah diperoleh.
3.12 Penetapan Kadar Campuran Baku Asam Benzoat dan Asam Sitrat
Untuk larutan baku asam benzoat dipipet sebanyak 2,5 ml dari LIB II asam benzoat (50 µg/ml), dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan volume dengan HCl 0,1 N sampai garis tanda. Diperoleh konsentrasi 5 µg/ml. Sedangkan untuk larutan baku asam sitrat dipipet sebanyak 12,5 ml dari LIB asam sitrat (1000 µg/ml), dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan volume dengan HCl 0,1 N sampai garis tanda. Diperoleh konsentrasi 500 µg/ml. Masing-masing larutan baku diukur serapannya pada panjang gelombang 229 nm untuk asam benzoat dan 208 nm untuk asam sitrat. Kemudian masing-masing larutan dipipet sebanyak 5 ml dan dicampur dalam labu tentukur. Diukur serapannya pada panjang gelombang 229 nm dan 208 nm.
3.13 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel
3.13.1 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel A
3.13.2 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel B
Dipipet 0,5 ml larutan sampel, dimasukkan dalam labu tentukur 25 ml. Ditambahkan 2 ml HCl 0,1 N hingga suasana asam kemudian pH diperiksa dengan menggunakan indikator universal (pH = 2). Volume dicukupkan dengan aquadest hingga garis tanda. Diukur serapannya pada panjang gelombang maksimum asam benzoat dan asam sitrat yang telah diperoleh. Perlakuan diulang sebanyak 6 kali. 3.13.3 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel C
Dipipet 0,5 ml larutan sampel, dimasukkan dalam labu tentukur 25 ml. Ditambahkan 2 ml HCl 0,1 N hingga suasana asam kemudian pH diperiksa dengan menggunakan indikator universal (pH = 2). Volume dicukupkan dengan aquadest hingga garis tanda. Diukur serapannya pada panjang gelombang maksimum asam benzoat dan asam sitrat yang telah diperoleh. Perlakuan diulang sebanyak 6 kali. 3.13.4 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel D
Dipipet 0,9 ml larutan sampel, dimasukkan dalam labu tentukur 25 ml. Ditambahkan 3 ml HCl 0,1 N hingga suasana asam kemudian pH diperiksa dengan menggunakan indikator universal (pH = 2). Volume dicukupkan dengan aquadest hingga garis tanda. Diukur serapannya pada panjang gelombang maksimum asam benzoat dan asam sitrat yang telah diperoleh. Perlakuan diulang sebanyak 6 kali.
Konsentrasi asam benzoat dan asam sitrat dapat dihitung dengan rumus:
Konsentrasi (µg/ml)=
(ml) Sampel
Volume
n Pengencera F.
x (ml) Volume x
(µg/ml) awal
Kons.
Kadar natrium benzoat dapat ditentukan dari berat molekulnya (BM).
Kadar natrium benzoat (µg/g) = kadar asam benzoat x BM natrium benzoat
BM asam benzoat
Kadar natrium benzoat dan asam sitrat sebenarnya dalam sampel dapat dihitung dengan rumus (Walpole, 1995):
µ = x ± ((t(α/2),dk) x SD/ √n)
Keterangan: x : kadar rata-rata sampel SD : Standar Deviasi
dk : derajat kebebasan ( dk = n-1) α : tingkat kepercayaan
n : jumlah pengulangan
3.14 Analisis Data Secara Statistik
Kadar natrium benzoat dan asam sitrat yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis untuk mengetahui data ditolak atau diterima menggunakan uji distribusi t. Menurut Sudjana (2005), uji distribusi t dapat dihitung dengan rumus:
t hitung =
n SD
X Xi
/
−
Data ditolak jika t hitung > t tabel. Tabel distribusi t dapat dilihat pada Lampiran 24,
halaman 106.
SD =
(
)
1 -n
X
-Xi 2
∑
Keterangan : Xi = Kadar sampel
X = Kadar rata-rata sampel n = jumlah pengulangan
dan untuk menentukan kadar natrium benzoat dan asam sitrat dalam sampel dengan interval kepercayaan 99%, ɑ= 1%, dk= n-1, menurut Sudjana (2005), dapat digunakan rumus:
Kadar : µ = x ± ((t(α/2),dk) x SD/ √n)
Keterangan : µ = interval kepercayaan x = kapasitas rata-rata sampel SD = standar deviasi
t = harga t tabel sesuai dengan dk = n-1 α = tingkat kepercayaan
n = jumlah perlakuan
3.15 Validasi Metode Analisis
3.15.1 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali dilakukan dengan metode penambahan larutan baku (standard addition method). Dalam metode ini, kadar asam benzoat dan asam sitrat dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan kadar asam benzoat dan asam sitrat dalam sampel setelah penambahan larutan standar dengan konsentrasi tertentu (Harmita, 2004).
Menurut Harmita (2004), persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
% Perolehan Kembali= CF- CA
CA* ×100%
Keterangan: CF = Kadar sampel setelah penambahan larutan baku CA = Kadar sampel sebelum penambahan larutan baku C A * = Kadar larutan baku yang ditambahkan
3.15.2 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
Menurut Harmita (2004), simpangan baku relatif dapat dihitung dengan rumus di bawah ini:
RSD = ×100%
X SD
Keterangan :
−
X = Kadar rata-rata sampel SD = Standar Deviasi
RSD = Relative Standard Deviation
3.15.3 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation)
Menurut Harmita (2004), batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Batas deteksi (LOD) =
slope X SY x
3
Batas kuantitasi (LOQ) =
slope X SY x
BAB IV
HASIL DAN PEMBAHASAN
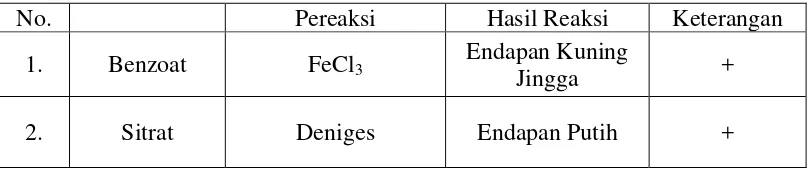
4.1 Analisis Kualitatif Benzoat dan Sitrat pada Sampel
[image:51.595.114.519.288.374.2]Analisis kualitatif dilakukan untuk mengetahui ada atau tidaknya benzoat dan sitrat dalam sampel. Data dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1. Hasil Analisis Kualitatif Benzoat dan Sitrat pada Sampel
No. Pereaksi Hasil Reaksi Keterangan
1. Benzoat FeCl3
Endapan Kuning
Jingga +
2. Sitrat Deniges Endapan Putih +
Pada Tabel 1 dapat dilihat hasil pengujian kualitatif bahwa sampel positif mengandung natrium benzoat karena menghasilkan endapan kuning jingga dengan penambahan besi (III) klorida dan mengandung asam sitrat karena menghasilkan endapan putih dengan penambahan reagensia deniges (Vogel, 1985). Gambar hasil analisis dapat dilihat pada Lampiran 27, halaman 109.
4.2 Penentuan Kadar Baku Pembanding
4.2.1 Penentuan Kadar Baku Pembanding Asam Benzoat
adalah fenolftalein karena pH pada ti tik ekivalen > 8 (Ditjen POM, 1995). Contoh perhitungan dapat dilihat pada Lampiran 2, halaman 49.
4.2.2 Penentuan Kadar Baku Pembanding Asam Sitrat
Hasil penetapan kadar asam sitrat p.a dengan metode titrasi alkalimetri diperoleh kadar rata-rata sebesar 99,50%. Penetapan kadar dilakukan dengan metode titrasi alkalimetri karena asam sitrat merupakan asam lemah yang larut dalam air. Pentiter yang digunakan adalah larutan NaOH 0,05 N dalam air dan indikator yang digunakan adalah fenolftalein karena pH pada titik ekivalen > 8 (Ditjen POM, 1995). Contoh perhitungan dapat dilihat pada Lampiran 3, halaman 51.
4.3 Penentuan Panjang Gelombang Maksimum
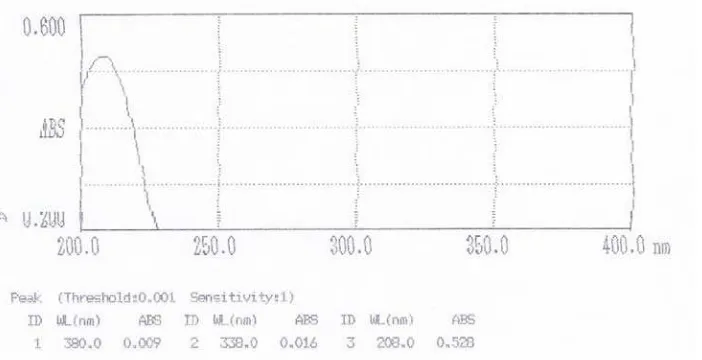
Penentuan panjang gelombang maksimum asam benzoat dan asam sitrat dilakukan dengan mengukur absorbansi masing-masing komponen dari larutan baku dengan konsentrasi asam benzoat 5 µg/ml dan asam sitrat 500 µg/ml pada rentang panjang gelombang 200 - 400 nm dengan menggunakan spektrofotometer ultraviolet. Dari pengukuran yang dilakukan, didapat absorbansi maksimum asam benzoat pada panjang gelombang 229 nm dan absorbansi maksimum asam sitrat pada panjang gelombang 208 nm.
Gambar 4. Kurva Serapan Baku Pembanding Asam Benzoat, konsentrasi 5 µg/ml
dalam larutan HCl 0,1 N. Panjang gelombang maksimum 229 nm.
Gambar 5. Kurva Serapan Baku Pembanding Asam Sitrat, konsentrasi 500 µg/ml dalam larutan HCl 0,1 N. Panjang gelombang maksimum 208 nm.
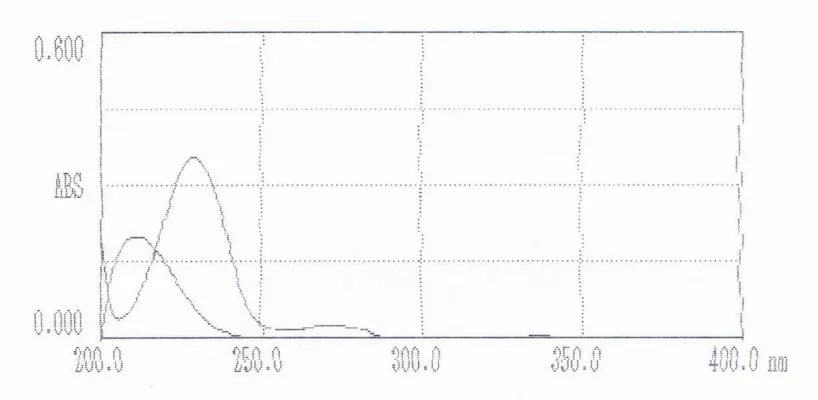
4.4 Pembuatan Kurva Serapan Gabungan (Overlap) Asam Sitrat dan Asam Benzoat (50 : 1)
[image:53.595.140.491.328.508.2]tumpang tindih dimana spektra absorpsi asam benzoat mempengaruhi spektra absorpsi asam sitrat dan spektra absorpsi asam sitrat juga mempengaruhi spektra absorpsi asam benzoat sehingga serapan yang terukur pada panjang gelombang maksimum asam benzoat merupakan serapan asam benzoat dan asam sitrat. Begitu juga sebaliknya serapan yang terukur pada panjang gelombang maksimum asam sitrat merupakan serapan asam benzoat dan asam sitrat. Kurva serapan dapat dilihat pada Gambar 6 di bawah ini.
Gambar 6. Kurva Serapan Gabungan (Overlap) Baku Pembanding Asam Sitrat dan Baku Pembanding Asam Benzoat (50:1).
4.5 Kurva Kalibrasi
4.5.1 Kurva Kalibrasi Asam Benzoat
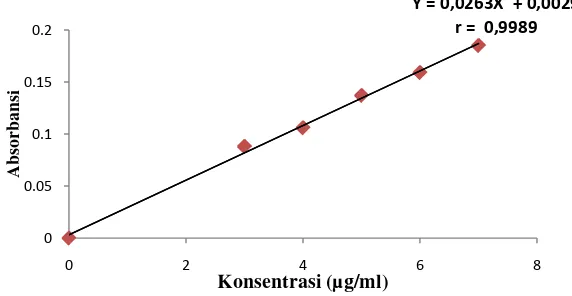
Kurva kalibrasi asam benzoat diperoleh dengan cara mengukur absorbansi larutan baku dengan konsentrasi 3; 4; 5; 6; dan 7 µg/ml pada panjang gelombang 229 nm dan 208 nm. Dari pengukuran ini didapat persamaan regresi pada panjang gelombang 229 nm yaitu Y = 0,0943X + 0,0089 dengan koefisien korelasi (r) 0,9987 dan persamaan regresi pada panjang gelombang 208 nm yaitu Y = 0,0263X + 0,0029 dengan koefisien korelasi (r) 0,9989.
[image:55.595.141.427.382.527.2]Kurva kalibrasi asam benzoat yang didapat dapat dilihat pada Gambar 7 dan Gambar 8 berikut ini.
Gambar 7. Kurva Kalibrasi Asam Benzoat pada Panjang Gelombang 229 nm
Gambar 8. Kurva Kalibrasi Asam Benzoat pada Panjang Gelombang 208 nm
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
0 2 4 6 8
A
bs
or
ban
si
Konsentrasi (µg/ml)
Y = 0,0943X + 0,0089 r = 0,9987
0 0.05 0.1 0.15 0.2
0 2 4 6 8
A
bs
or
ban
si
Konsentrasi (µg/ml)
[image:55.595.142.428.575.723.2]Berdasarkan kurva di atas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi. Nilai r > 0,99 menunjukkan adanya korelasi linier hubungan antara X dan Y (Watson, 2010). Data dan hasil perhitungan dapat dilihat pada Lampiran 4 dan Lampiran 5, halaman 53 dan halaman 55.
4.5.2 Kurva Kalibrasi Asam Sitrat
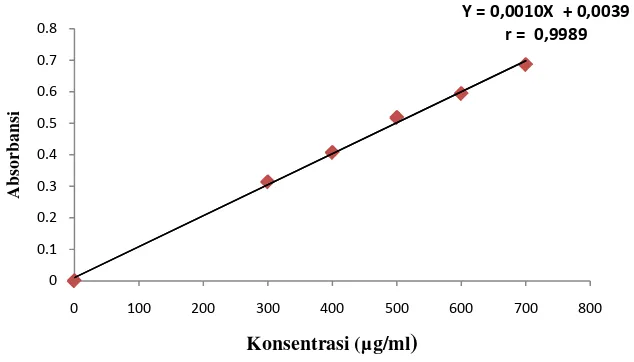
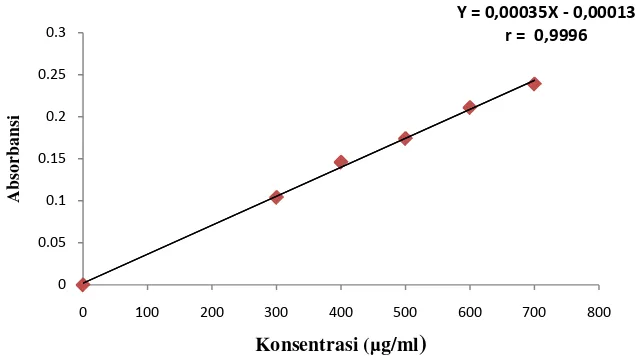
Kurva kalibrasi asam sitrat diperoleh dengan cara mengukur absorbansi larutan baku dengan konsentrasi 300; 400; 500; 600; dan 700 µg/ml pada panjang gelombang 229 nm dan 208 nm. Dari pengukuran ini didapat persamaan regresi pada panjang gelombang 229 nm yaitu Y = 0,00035X - 0,00013 dengan koefisien korelasi (r) 0,9996 dan persamaan regresi pada panjang gelombang 208 nm yaitu Y = 0,0010X + 0,0039 dengan koefisien korelasi (r) 0,9991.
[image:56.595.142.459.463.644.2]Kurva kalibrasi asam sitrat yang didapat dapat dilihat pada Gambar 9 dan Gambar 10 berikut ini.
Gambar 9. Kurva Kalibrasi Asam Sitrat pada Panjang Gelombang 208 nm
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
0 100 200 300 400 500 600 700 800
A
bs
or
ban
si
Konsentrasi (µg/ml)
Gambar 10. Kurva Kalibrasi Asam Sitrat pada Panjang Gelombang 229 nm Berdasarkan kurva di atas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi. Nilai r > 0,99 menunjukkan adanya korelasi linier hubungan antara X dan Y (Watson, 2010). Data dan hasil perhitungan dapat dilihat pada Lampiran 6 dan Lampiran 7, halaman 57 dan halaman 59.
4.6 Penetapan Kadar Campuran Baku Asam Benzoat dan Asam Sitrat
Hasil pengukuran untuk masing-masing larutan baku diperoleh konsentasi sebesar 4,929 µg/ml untuk asam benzoat dan 517,8320 µg/ml untuk asam sitrat. Kemudian setelah pencampuran larutan baku, konsentrasi asam benzoat dan asam sitrat yang diperoleh dengan metode persamaan regresi yaitu sebesar 5,0944 µg/ml dan 531,5946 µg/ml. Hasil perhitungan menunjukkan bahwa persen kesalahan yaitu 3,35% untuk asam benzoat dan 2,66% untuk asam sitrat dan kadar ini masih di dalam batas kadar yang diijinkan dalam Farmakope Indonesia untuk sediaan sirup (Ditjen POM, 1979). Berdasarkan hal tersebut dapat dinyatakan bahwa metode perhitungan persamaan regresi dapat digunakan untuk penetapan
0 0.05 0.1 0.15 0.2 0.25 0.3
0 100 200 300 400 500 600 700 800
A
bs
or
ban
si
Konsentrasi (µg/ml)
campuran kadar natrium benzoat dan asam sitrat. Contoh perhitungan dapat dilihat pada Lampiran 8, halaman 61.
4.7 Penetapan Kadar Natrium Benzoat dan Asam Sitrat dalam Sampel
Pada penetapan kadar natrium benzoat dan asam sitrat pada sampel dilakukan pemipetan larutan sampel dengan volume yang berbeda-beda. Hal ini disebabkan setelah dilakukan orientasi dengan volume yang sama, hasil yang diperoleh diluar dari nilai kurva kalibrasi.
Penetapan kadar natrium benzoat dan asam sitrat dilakukan secara spektrofotometri sinar ultraviolet. Natrium benzoat dalam sampel akan bereaksi dengan asam klorida membentuk asam benzoat dalam suasana asam. Dengan menggunakan dua panjang gelombang yaitu masing-masing 229 nm untuk asam benzoat dan 208 nm untuk asam sitrat dilakukan perhitungan kadar untuk kedua senyawa secara persamaan regresi. Sampel diukur pada kedua panjang gelombang tersebut.
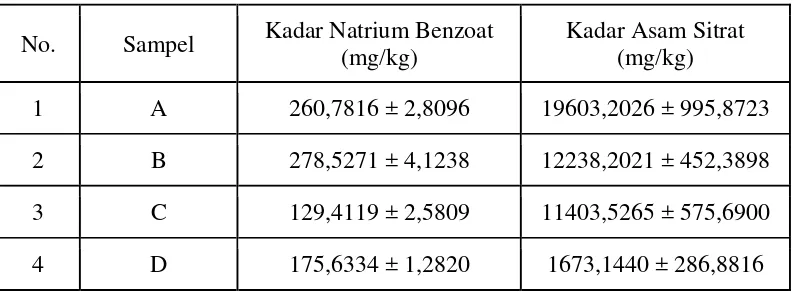
Tabel 2. Hasil Analisis Kadar Natrium Benzoat dan Asam Sitrat pada Minuman Isotonik
No. Sampel Kadar Natrium Benzoat (mg/kg)
Kadar Asam Sitrat (mg/kg)
1 A 260,7816 ± 2,8096 19603,2026 ± 995,8723 2 B 278,5271 ± 4,1238 12238,2021 ± 452,3898 3 C 129,4119 ± 2,5809 11403,5265 ± 575,6900
4 D 175,6334 ± 1,2820 1673,1440 ± 286,8816
Berdasarkan Tabel 2 diatas ternyata bahwa semua minuman isotonik yang dianalisis memenuhi persyaratan kadar natrium benzoat dalam minuman ringan yang tercantum dalam Peraturan Menteri Kesehatan Republik Indonesia Nomor 722/MenKes/Per/IX/88 tentang Bahan Tambahan Makanan yaitu tidak lebih dari 600 mg/kg. Sedangkan, penggunaan asam sitrat dalam minuman ringan sampai saat ini belum dibatasi kadar penggunaannya oleh badan pengawas obat dan makanan. Contoh perhitungan dapat dilihat pada Lampiran 10-13, halaman 66-75.
4.8 Validasi Metode Analisis
4.8.1 Uji Perolehan Kembali (Recovery)
[image:59.595.115.512.132.278.2]Tabel 3. Persen Uji Perolehan Kembali Asam Benzoat dan Asam Sitrat pada Sampel
No. Persen perolehan
kembali
Syarat rentang persen perolehan kembali
1 Asam Benzoat 85,26%
80-120%
2 Asam sitrat 86,33%
Berdasarkan Tabel 3, dapat dilihat bahwa rata-rata hasil uji perolehan kembali untuk asam benzoat 85,26% dan untuk asam sitrat 86,33%. Persen perolehan kembali tersebut menunjukkan kecermatan atau akurasi yang baik pada saat pemeriksaan kadar asam benzoat dan asam sitrat dalam sampel secara simultan dengan metode perhitungan secara persamaan regresi. Hasil uji perolehan kembali ini memenuhi syarat akurasi yang telah ditetapkan, yaitu berada pada rentang 80 - 120% (Ermer dan Miller, 2005).
4.8.2Simpangan Baku Relatif
[image:60.595.114.516.135.195.2]4.8.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi untuk asam benzoat dan asam sitrat ditentukan berdasarkan data kurva kalibrasi kedua komponen tersebut. Dari hasil perhitungan diperoleh batas deteksi asam benzoat dan asam sitrat pada panjang gelombang 229 nm masing-masing sebesar 0,4231 µg/ml dan 36,8571 µg/ml. Sedangkan, batas kuantitasinya sebesar 1,4104 µg/ml untuk asam benzoat dan 122,8571 µg/ml untuk asam sitrat. Dan batas deteksi asam benzoat dan asam sitrat pada panjang gelombang 208 nm masing-masing sebesar 0,4563 µg/ml dan 40,8000 µg/ml. Sedangkan, batas kuantitasinya sebesar 1,5209 µg/ml untuk asam benzoat dan 136 µg/ml untuk asam sitrat.
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat diambil kesimpulan: 1. Hasil pengujian terhadap bahan baku campuran asam benzoat dan asam
sitrat menunjukkan bahwa perhitungan dengan metode persamaan regresi menghasilkan perbedaan konsentrasi sebelum dan sesudah pencampuran yaitu konsentrasi asam benzoat dan asam sitrat sebelum pencampuran adalah 4,929 µg/ml dan 517,8320 µg/ml, sedangkan konsentrasi asam benzoat dan asam sitrat setelah pencampuran adalah 5,0944 µg/ml dan 531,5946 µg/ml dan ini masih memenuhi persyaratan kadar secara umum terhadap sediaan sirup dalam Farmakope Indonesia edisi ketiga.
3. Kandungan natrium benzoat pada minuman isotonik yang dianalisis memenuhi persyaratan kadar yang tercantum dalam Peraturan Menteri Kesehatan RI No. 722 tentang bahan tambahan pangan yaitu sebesar (260,7816 ± 2,8096) mg/kg untuk sampel A, (278,5271 ± 4,1238) mg/kg untuk sampel B, (129,4119 ± 2,5809 mg/kg) untuk sampel C dan (175,6334 ± 1,2820) mg/kg untuk sampel D.
5.2Saran
DAFTAR PUSTAKA
Afrianti, L.H. (2010). Pengawetan Makanan Alami dan Sintetis. Bandung: Alfabeta. Halaman 33, 35, 57, 68.
Cahyadi, W. (2012). Analisis dan Aspek Kesehatan: Bahan Tambahan Pangan. Edisi Kedua. Jakarta: Bumi Aksara. Halaman 5-8, 193-194.
Cairns, D. (2003). Essentials of Pharmaceutical Chemistry. Edisi Kedua. Penerjemah: Puspita, R.M. (2009). Intisari Kimia Farmasi. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 150.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik secara Spektrofotometri. Padang: Andalas University Press. Halaman 1.
Day, R.A., dan Underwood, A.L. (1998). Quantitative Analysis. Edisi Keenam. Penerjemah: Sopyan, I. (2002). Analisis Kimia Kuantitatif. Jakarta: Erlangga. Halaman 412-414.
Denney, R.C., dan Sinclair, R. (1991). Visible and Ultraviolet Spectroscopy: Analytical Chemistry by Open Learning. Singapore: John Wiley & Sons. Halaman 84-85.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 675, 744, 748.
Ditjen POM. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 48, 584.
Ermer, J., dan Miller, J.H.M. (2005). Method Validation in Pharmaceutical Analysis. A Guide to Best Practice. Weinheim: Wiley-VCH. Halaman 89. Harmita. (2004). Petunjuk Pelaksanaan Validasi Metoda dan Cara
Perhitungannya. Jakarta: Departemen Farmasi FMIPA UI. Halaman 121, 123, 130-131.
Holme, D.J., dan Peck, H. (1983). Analytical biochemistry. New York: Longman Inc. Halaman 42.
Koswara, S. (2009). Minuman Isotonik. Tanggal akses 14 November 2013.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 240-243, 235-236, 464.
Satiadarma, K., Mulja, M., Tjahjono, D.H., dan Kartasasmita, R.E. (2004). Asas Pengembangan Prosedur Analisis. Edisi Pertama. Surabaya: Airlangga University Press. Halaman 49, 87-90.
Stofan, J.R., dan Murray, R. (2001). Formulating Carbohydrate-Electrolyte Drinks for Optimal Efficacy dalam Sports Drinks: Basic Science and Practical Aspects. London: CRC Press. Halaman 200, 210.
Sudjana. (2005). Metode Statistika. Bandung: Penerbit Tarsito. Halaman 93, 145, 201, 225.
Tan, H.T., dan Rahardja, K. (2007). Obat-Obat Penting. Edisi Keenam. Cetakan Pertama. Jakarta: PT Elex Media Komputindo. Halaman 105.
Vishnoi, N.K. (2009). Advanced Practical Organic Chemistry. New Delhi: Vikas Publishing House. Halaman 75.
Vogel, A.I. (1979). Textbook of Macro and Semimicro Qualitative Inorganic Analysis. Edisi Kelima. Bagian II. Penerjemah: Setiono, L., dan Pudjaatmaka, A.H. (1985). Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: Kalman Media Pustaka. Halaman 400, 403, 496.
Walpole, R.E. (1995). Pengantar