LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI
di
PT. INDOFARMA (Persero) Tbk.
Jalan Indofarma No. 1, Cikarang Barat 17530, Bekasi
Disusun oleh:
Winda Gusti Enda, S. Farm NIM 093202158
PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI
di
PT. INDOFARMA (Persero) Tbk.
Jalan Indofarma No. 1, Cikarang Barat 17530, Bekasi (1 November – 30 November 2010)
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara
Disusun oleh:
Winda Gusti Enda, S.Farm 093202158
Pembimbing,
(Dra. Sya Indradewi, Apt.) Manager Pemastian Mutu PT. Indofarma (Persero) Tbk.
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Segala puji dan syukur kehadirat Allah SWT atas rahmat yang diberikan dan
shalawat beserta salam untuk Rasul Allah Muhammad SAW yang telah membawa kita ke
alam yang berilmu pengetahuan, sehingga penulis dapat menyelesaikan Praktek Kerja
Profesi (PKP) dan penyusunan laporan di PT. Indofarma (Persero) Tbk.
Dengan segala kerendahan hati penulis mengucapkan terima kasih yang
sebesar-besarnya kepada keluarga besar kami atas semangat, do’a dan
dukungannya kepada penulis selama ini. Pelaksanaan PKP dan penyusunan
laporan ini dapat berjalan lancar tidak terlepas dari bantuan dan dukungan dari
berbagai pihak. Dengan segala ketulusan hati penulis juga menyampaikan rasa
terima kasih yang sebesar-besarnya kepada kepada:
1. Ibu Dra. Sya Indradewi, Apt., selaku Manager Pemastian Mutu PT. Indofarma
(Persero) Tbk dan pembimbing tugas umum yang telah memberikan bimbingan
selama penulis melaksanakan PKP sampai penyusunan laporan ini selesai.
2. Bapak Hugo Koen Christanto, S.Farm, Apt., selaku Asisten Manager Seksi
Formulasi Bidang Litbang PT. Indofarma (Persero) Tbk dan pempimbing tugas
khusus yang telah memberikan arahan, masukan dan saran selama penulis
melaksanakan PKP sampai penyusunan laporan ini selesai.
3. Bapak Drs. Probo Winanto selaku Koordinator PKP di PT. Indofarma (Persero)
Tbk.
4. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi
USU Medan.
5. Bapak Drs. Wiryanto, SU, Apt. selaku Koordinator Program Pendidikan Profesi
6. Bapak dan Ibu staf Pengajar Program Pendidikan Profesi Apoteker Fakultas
Farmasi USU Medan yang tidak dapat disebutkan satu persatu yang selalu
memberikan bimbingan, pengetahuan dan bantuan kepada penulis.
7. Seluruh karyawan di PT. Indofarma (Persero) Tbk atas ilmu, pengalaman, kerja
sama dan bantuan yang diberikan selama penulis melakukan PKP.
8. Kepada rekan-rekan mahasiswa PKP PT. Indofarma (Persero) Tbk angkatan 62
dari Universitas Pancasila, Universitas Muhammadiah Dr. Hamka, ISTN ,
Universitas Islam Indonesia, Universitas Ahmad Dahlan dan Universitas
Muhammadiah Purwokerto, atas kerja samanya selama ini.
9. Kepada rekan-rekan mahasiswa Program Pendidikan Profesi Apoteker dan
mahasiswa Farmasi yang tidak dapat disebutkan satu persatu yang selalu
memberikan bantuan dan semangat selama ini sehingga laporan ini dapat selesai.
Penulis menyadari sepenuhnya bahwa laporan ini masih jauh dari sempurna, oleh
karena itu penulis mengharapkan saran dan kritik yang membangun. Dan semoga laporan
ini dapat memberikan manfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, Februari 2011 Penulis
Winda Gusti Enda, S. Farm 093202158
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di industri farmasi PT.
Indofarma (Persero) Tbk yang merupakan salah satu program dalam pendidikan
profesi apoteker, yang bertujuan agar mahasiswa mengetahui dan memahami
tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai
bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa juga
diharuskan dapat memperoleh wawasan dan pengetahuan yang lebih luas,
memahami penerapan Cara Pembuatan Obat yang Baik di PT. Indofarma
(Persero) Tbk, serta mengetahui gambaran tentang situasi dan kondisi kerja PT.
Indofarma (Persero) Tbk. PKP di Industri Farmasi PT. Indofarma (Persero) Tbk
dilaksanakan pada tanggal 1 November – 30 November 2010. Kegiatan yang
dilakukan selama PKP di industri antara lain membuat catatan kegiatan harian,
tutorial, tinjauan lapangan, pelaksanaan tugas khusus dan presentasi hasil tugas
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
RINGKASAN ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
1.3 Pelaksanaan Kegiatan ... 3
1.4 Manfaat Kegiatan ... 3
BAB II TINJAUAN PT. Indofarma (Persero) Tbk ... 4
2.1 Sejarah dan Perkembangan ... 4
2.2 Struktur Organisasi PT. Indofarma (Persero) Tbk ... 8
2.3 Visi dan Misi PT. Indofarma (Persero) Tbk ... 10
2.4 Moto PT. Indofarma (Persero) Tbk ... 10
2.5 Logo PT. Indofarma (Persero) Tbk ... 10
2.6 Kebijakan Mutu ... 11
2.7 Kedudukan, Fungsi dan Peranan ... 12
2.8 Lokasi dan Fasilitas ... 14
2.9 Produk PT. Indofarma (Persero) Tbk ... 15
2.10.1.1 Bidang Produksi I ... 16
2.10.1.2 Bidang Produksi II ... 25
2.10.1.3 Bidang Pengadaan/ Procurement ... 32
2.10.1.4 Bidang Teknik dan Pemeliharaan ... 34
2.10.1.5 Bidang PPPP ... 36
2.10.1.6 Bidang Penelitian dan Pengembangan ... 39
2.10.1.7 Bidang QC/ QA ... 45
2.10.2 Direktorat Umum dan Sumber Daya Manusia ... 53
2.10.2.1 Bidang Sumber Daya Manusia ... 54
2.10.2.2 Bidang Logistik Bahan Awal ... 55
2.10.2.3 Bidang Logistik Produk Jadi ... 58
2.10.2.4 Bidang Umum ... 59
2.10.2.5 Bidang PKBL ... 62
2.10.3 Direktorat Pemasaran ... 63
2.10.4 Direktorat Keuangan ... 64
2.10.5 Non Direktorat ... 65
2.11 Sertifikasi PT. Indofarma (Persero) Tbk ... 67
BAB III PEMBAHASAN ... 68
3.1 Manajemen Mutu ... 69
3.2 Personalia ... 70
3.3 Bangunan dan Fasilitas ... 73
3.4 Peralatan ... 75
3.5 Sanitasi dan Higiene ... 77
3.6 Personalia ... 78
3.7 Pengawasan Mutu ... 81
Penarikan Kembali Produk dan Produk Kembalian ... 84
3.10 Dokumentasi ... 84
3.11 Pembuatan dan Analisa Berdasarkan Kontrak ... 85
3.12 Kualifikasi dan Validasi ... 86
BAB IV KESIMPULAN DAN SARAN ... 87
4.1 Kesimpulan ... 87
4.2 Saran ... 88
DAFTAR TABEL
Halaman
Tabel 1. Ukuran ruangan masing-masing bagian di
PT. Indofarma (Persero) Tbk ... 14
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur Organisasi PT. Indofarma (Persero) Tbk ... 9
Gambar 2.2 Logo PT. Indofarma (Persero) Tbk ... 11
Gambar 2.3 Struktur Organisasi Direktorat Produksi PT. Indofarma (Persero) Tbk ... 16
Gambar 2.4 Struktur Organisasi Bidang Produksi I PT. Indofarma (Persero) Tbk ... 16
Gambar 2.5 Skema Kegiatan Seksi Solid I ... 20
Gambar 2.6 Skema Kegiatan Seksi Solid II ... 20
Gambar 2.7 Skema Kegiatan Seksi Pengemasan ... 21
Gambar 2.8 Struktur Organisasi Bidang Produksi II PT. Indofarma (Persero) Tbk ... 25
Gambar 2.9 Struktur Organisasi Bidang Pengadaan/ Procurement PT. Indofarma (Persero) Tbk ... 32
Gambar 2.10 Struktur Organisasi Bidang Teknik dan Pemeliharaan PT. Indofarma (Persero) Tbk ... 34
Gambar 2.11 Struktur Organisasi Bidang PPPP PT. Indofarma (Persero) Tbk ... 36
Gambar 2.12 Hubungan Kerja Bidang PPPP dengan Bagian Lain di PT. Indofarma (Persero) Tbk ... 37
Gambar 2.13 Struktur Organisasi Bidang Penelitian dan Pengembangan PT. Indofarma (Persero) Tbk ... 39
PT. Indofarma (Persero) Tbk ... 54
Gambar 2.16 Struktur Organisasi Direktorat Pemasaran
DAFTAR LAMPIRAN
Halaman
Lampira 1. Denah Lokasi PT. Indofarma (Persero) Tbk ... 91
Lampiran 2. Tata Letak Bangunan di PT. Indofarma (Persero) Tbk ... 92
Lampiran 3. Bagan Sistem Pengolahan Air
PT. Indofarma (Persero) Tbk ... 93
Lampiran 4. Bagan Sistem Pengaturan Udara
PT. Indofarma (Persero) Tbk ... 95
Lampiran 5. Bagan Sistem Instalasi Pengolahan Air Limbah (IPAL)
PT. Indofarma (Persero) Tbk ... 96
Lampiran 6. Alur Proses Produksi Sediaan Tablet Cetak Langsung
Secara Vertical Close System... 97 Lampiran 7. Alur Proses Produksi Sediaan Tablet Granulasi Basah
Secara Vertical Close System... 98 Lampiran 8. Alur Proses Produksi Sediaan Kapsul
Secara Vertical Close System ... 99 Lampiran 9. Alur Proses Produksi Sediaan Herbal
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di industri farmasi PT.
Indofarma (Persero) Tbk yang merupakan salah satu program dalam pendidikan
profesi apoteker, yang bertujuan agar mahasiswa mengetahui dan memahami
tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai
bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa juga
diharuskan dapat memperoleh wawasan dan pengetahuan yang lebih luas,
memahami penerapan Cara Pembuatan Obat yang Baik di PT. Indofarma
(Persero) Tbk, serta mengetahui gambaran tentang situasi dan kondisi kerja PT.
Indofarma (Persero) Tbk. PKP di Industri Farmasi PT. Indofarma (Persero) Tbk
dilaksanakan pada tanggal 1 November – 30 November 2010. Kegiatan yang
dilakukan selama PKP di industri antara lain membuat catatan kegiatan harian,
tutorial, tinjauan lapangan, pelaksanaan tugas khusus dan presentasi hasil tugas
BAB I PENDAHULUAN
1.1Latar Belakang
Pembangunan kesehatan secara berkesinambungan telah dimulai sejak
dicanangkannya rencana pembangunan lima tahun I pada tahun 1969. Tujuan
umum Pembangunan Kesehatan Nasional adalah tercapainya mutu hidup dan
lingkungan hidup yang optimal bagi setiap penduduk serta tercapainya derajat
kesehatan yang setinggi-tingginya, meliputi kesehatan badaniah, rohaniah, sosial,
dan bukan hanya keadaan bebas dari penyakit, cacat dan kelemahan. Tujuan
tersebut telah diwujudkan secara nyata dengan adanya berbagai pelayanan
kesehatan yang berdampak pada peningkatan derajat kesehatan masyarakat.
Industri farmasi mempunyai peranan penting dalam upaya peningkatan
derajat kesehatan masyarakat yaitu dengan memproduksi obat yang bermutu dan
berkualitas. Untuk menjamin tercapainya pemenuhan obat yang berkualitas,
pemerintah melalui Departemen Kesehatan telah berupaya memberikan suatu
Cara Pembuatan Obat yang Baik (CPOB) yang mutlak harus diterapkan oleh
semua industri farmasi.
Sesuai dengan pedoman CPOB, mutu obat bergantung pada bahan awal,
proses pembuatan dan pengawasan mutu, peralatan, bangunan dan personalia
yang terlibat. Berdasarkan hal tersebut, maka seorang apoteker diperlukan untuk
mengawasi seluruh kegiatan produksi dan berperan untuk meningkatkan
kesadaran penuh personalia dalam CPOB agar dapat berperan aktif sesuai dengan
PT. Indofarma (Persero) Tbk merupakan Perusahaan Farmasi Nasional
milik Negara yang telah memiliki sertifikat CPOB dan ISO 9001. Penerapan
CPOB dan ISO 9001 dalam proses dan kegiatan di PT. Indofarma (Persero) Tbk
ini, terkait dengan adanya kesadaran bahwa sebuah perusahaan farmasi memiliki
tanggung jawab moral pada masyarakat untuk menghasilkan obat yang aman,
bermutu serta terjangkau oleh semua lapisan masyarakat. Apoteker dalam industri
farmasi mempunyai tugas untuk melakukan pekerjaan kefarmasian yang meliputi
pembuatan dan pengendalian mutu obat, pengadaan, penyimpanan, distribusi obat,
serta pengembangan obat modern maupun obat tradisional.
Berdasarkan pertimbangan diatas, seorang apoteker dalam industri farmasi
harus memiliki pengetahuan, keterampilan, dan pengalaman berkaitan dengan
pekerjaan kefarmasian di industri farmasi. Salah satu cara untuk mencapai tujuan
tersebut adalah dengan diadakannya Praktek Kerja Profesi (PKP) bagi mahasiswa
Program Pendidikan Profesi Apoteker Fakultas Farmasi, sehingga diharapkan
mahasiswa dapat mengenal, mengetahui, memperdalam fungsi dan peran apoteker
di industri farmasi. Dengan demikian calon Apoteker mendapatkan bekal
ketrampilan dan pengalaman praktis yang kelak akan membantu ketika memasuki
dunia kerja terutama di industri farmasi.
1.2Tujuan
Tujuan diadakannya Praktek Kerja Profesi (PKP) di PT. Indofarma
(Persero) Tbk adalah:
a. Melihat gambaran nyata peran apoteker dan penerapan CPOB di industri
b. Mengetahui dan memahami dasar-dasar pengelolaan industri farmasi dan
keterkaitannya dengan profesi lain.
c. Membantu mahasiswa dalam membekali diri dengan pengetahuan dan
ketrampilan untuk memasuki dunia kerja, khusunya di industri farmasi.
1.3Pelaksanaan Kegiatan
Praktek Kerja Profesi (PKP) di PT. Indofarma (Persero) Tbk dilaksanakan
selama satu bulan dari tanggal 1 November – 30 November 2010. Kegiatan yang
dilakukan berupa:
a. Tutorial yang diadakan oleh bidang Umum, Perencanaan Produksi dan
Pengendalian Persediaan (PPPP), Strategi, Pengembangan Produk dan Bisnis
(Strategic Business Development/ SBD), Lingkungan dan Keselamatan, Kesehatan Kerja (LK-3), Produksi, Pelaksanaan Program Kemitraan dan Bina
Lingkungan (PKBL), Logistik Bahan Awal (LBA), Sumber Daya Manusia
(SDM), Pengadaan (Procurement), Teknik dan Pemeliharaan/ Utilities. b. Tinjauan ke Lapangan.
c. Pelaksanaan Tugas Khusus pada salah satu bidang.
d. Presentasi hasil tugas khusus.
1.4Manfaat Kegiatan
Melalui materi dan praktek yang diperoleh selama PKP, diharapkan dapat
memantapkan pemahaman serta penerapan ilmu yang telah diperoleh
BAB II
TINJAUAN UMUM PT. INDOFARMA (Persero) Tbk.
2.1 Sejarah dan Perkembangan
PT. Indofarma (Persero) Tbk merupakan Badan Usaha Milik Negara
(BUMN) yang berada di bawah Departemen Kesehatan, berdiri pada tahun 1918
berupa unit produksi kecil dari Rumah Sakit Pusat Pemerintah Belanda dengan
kegiatan pembuatan salep dan pemotongan kain kasa pembalut yang dilakukan di
Centrale Burgelijke Zienkeninrichring (CBZ), yang sekarang dikenal dengan Rumah Sakit Dr. Cipto Mangunkusumo di Jakarta. Pada tahun 1931, pabrik
berkembang dengan bertambahnya jenis produksi, yaitu obat suntik dan tablet.
Sejalan dengan itu pada tahun 1935 lokasi pabrik dipindahkan ke Jalan Tambak
No. 2 Manggarai, Jakarta sehingga dikenal dengan sebutan ”Pabrik Obat
Manggarai”.
Semenjak berakhirnya penjajahan Belanda dan masuknya Jepang ke
Indonesia, pada tahun 1942 pabrik obat Manggarai diambil alih dan dikelola oleh
perusahaan farmasi Jepang (dibawah manajemen Takeda). Selama masa tersebut
kegiatan produksi tidak banyak mengalami perkembangan. Pada saat penyerahan
kedaulatan dari pemerintah Jepang kepada pemerintah Republik Indonesia pada
tahun 1950, pabrik obat Manggarai diambil alih oleh pemerintah Indonesia yaitu
Departemen Kesehatan melalui Direktorat Jenderal Farmasi. Pada tahun
1960-1967, pabrik tersebut berada di bawah naungan Badan Perlengkapan Kesehatan
Farmakoterapi, pada perkembangan selanjutnya disebut Lembaga Farmasi
Nasional kemudian menjadi Pusat Pemeriksaan Obat dan Makanan (PPOM).
Pada tanggal 14 Februari 1967, melalui Surat Keputusan Menteri Kesehatan
Republik Indonesia No.008/III/AM/67, nama Pabrik Obat Manggarai diubah
menjadi Pusat Produksi Farmasi Departemen Kesehatan dan ditetapkan sebagai
Unit Operatif setingkat Direktorat Jenderal Farmasi. Tugas pokok dari pabrik ini
adalah memproduksi obat–obatan berdasarkan pesanan dari Departemen
Kesehatan RI. Pada tahun 1969-1975 pabrik direnovasi dan tahun 1975
dikeluarkan Surat Keputusan Menteri Kesehatan Republik Indonesia
No.125/IV/KAB/BU/75 tentang struktur organisasi Departemen Kesehatan yang
merupakan pelaksanaan lebih lanjut dari Keputusan Presiden Republik Indonesia
No. 44 dan 45 tahun 1974. Namun pabrik farmasi Departemen Kesehatan ini tidak
tercakup dalam keputusan tersebut sehingga statusnya tidak jelas. Hal ini
berlangsung hingga tahun 1978.
Dengan adanya kebijaksanaan pemerintah tanggal 15 November 1978
dalam hal ekonomi dan keuangan, harga obat mendadak melambung tinggi
sehingga persediaan obat terutama di puskesmas mengalami kekosongan karena
sulit mendapatkan obat. Peristiwa ini menyadarkan pemerintah untuk
menyediakan peralatan dan sarana yang dibutuhkan agar dapat mengendalikan
mekanisme pengadaan obat dalam jumlah yang cukup serta memenuhi
persyaratan mutu, keamanan dan distribusi yang merata serta harga terjangkau
sesuai kemampuan dan daya beli masyarakat. Maka pabrik farmasi ini diaktifkan
kembali sesuai dengan fungsinya, berdasarkan SK Menteri Kesehatan Republik
Pada tahun 1979, pabrik ini ditetapkan sebagai Pusat Produksi Farmasi
Departemen Kesehatan Republik Indonesia. Dalam keputusan tersebut disebutkan
pula bahwa Pusat Produksi Farmasi bertugas membantu usaha pemerintah dalam
meningkatkan kesejahteraan masyarakat di bidang kesehatan, yaitu memproduksi
obat-obat untuk rumah sakit pemerintah dan pusat kesehatan masyarakat.
Obat-obatan yang dimaksud bersifat esensial, artinya bahwa obat tersebut banyak
dibutuhkan oleh masyarakat. Untuk memenuhi kebutuhan tersebut, maka
diputuskan untuk didirikannya sebuah pabrik yang sekaligus untuk memperluas
pelayanan Pusat Produksi Farmasi Departemen Kesehatan. Pada tahun 1980 mulai
dilakukan studi kelayakan untuk pembangunan pabrik ini.
Pada tanggal 11 Juli 1981, berdasarkan PP No.20 tahun 1981, Pusat
Produksi Farmasi diubah menjadi Perusahaan Umum dengan nama Indonesia
Farma (Perum Indofarma) yang direalisasikan pada tanggal 1 April 1988 dengan
mulai dibangunnya pabrik baru yang modern seluas 20 hektar sesuai dengan
konsep dan persyaratan CPOB yang berlokasi di desa Gandasari, Cibitung, Bekasi
dengan bantuan alat dan teknologi dari Italia.
Mulai pertengahan tahun 1991, hampir seluruh kegiatan produksi telah
menempati lokasi di Cibitung, kecuali sediaan steril. Tanggal 31 Januari 1995
fasilitas produksi steril diresmikan oleh Menteri Kesehatan Republik Indonesia
dengan dana pembangunan seluruhnya ditanggung oleh Perum Indofarma.
Pada tanggal 2 Januari 1996 Perum Indonesia Farma diubah menjadi
Perseroan Terbatas Indofarma (PT. Indofarma (Persero)) melalui PP No.34
tanggal 20 September 1995. Perubahan status ini bertujuan untuk mengantisipasi
renovasi pada bagian Litbang. Tahun 1999 dibangun Extraction Plant dan selesai awal tahun 2000, serta pendirian anak perusahaan PT. Indofarma Global Medika
(PT. IGM) sebagai distributor dan pemasaran produk farmasi termasuk alat
kesehatan dengan 30 cabang di seluruh Indonesia. Tahun 2000 dibangun pabrik
makanan bayi di Lippo Cikarang Industrial Estate Jawa Barat.
Mulai tanggal 17 April 2001, PT. Indofarma melakukan penawaran saham
perdana kepada masyarakat dan mendaftarkan seluruh saham perseroan di Bursa
Efek Jakarta dan Bursa Efek Surabaya dengan kode saham INAF serta resmi
menjadi sebuah perusahaan terbuka dengan nama PT. Indofarma (Persero) Tbk.
Dalam rangka untuk merealisasikan visi dan misi perusahaan, maka mulai
dikembangkan kerjasama dengan patner-patner strategi yang dirintis sejak
Oktober 2001 telah dilaksanakan antara lain dengan Oxford Natural Product (England), Praporn Darsut Ltd (Thailand), Lupin (India), Guangda Produksi (Cina), Cowick (Polandia), Nowicky Pharma (Austria) dan lain-lain.
Dengan stuktur permodalan yang kuat, PT. Indofarma (Persero) Tbk
mengembangkan produksi sehingga bukan hanya membuat obat-obat esensial dan
generik, melainkan juga obat dengan nama dagang baik etikal maupun OTC (Over The Counter), obat tradisional (herbal) dan makanan kesehatan. Manajemen PT. Indofarma (Persero) Tbk yakin bahwa kunci keberhasilan untuk memenangkan
persaingan di era globalisasi adalah operational execellence. Guna memperkuat struktur bisnis, pada tahun 2007 perusahaan mengoptimalkan fungsi bisnis yang
ada melalui restrukturisasi lanjutan yang memberikan otonomi luas kepada PT.
IGM, terutama dalam hal penggarapan penjualan. Dengan demikian PT.
sedangkan PT. IGM pada kegiatan distribusi/ penjualan produk farmasi dan alat
kesehatan.
Guna meletakkan fondasi bisnis yang kuat PT. Indofarma (Persero) Tbk
senantiasa berupaya menerapkan Tata Kelola Perusahaan yang Baik (Good Corporate Governance). Pada 22 Februari 2007 organ utama perusahaan telah bersama-sama menandatangani pernyataan komitmen implementasi GCG. Selain
itu, PT. Indofarma (Persero) Tbk membangun kompetensi personil yang
profesional melalui program pembangunan sumber daya manusia yang terarah,
agar mampu membawa perusahaan memasuki era perdagangan bebas.
Dalam rangka meningkatkan fasilitas produksi guna memenuhi ketentuan
standar Cara Pembuatan Obat yang Baik (CPOB) terkini, PT. Indofarma (Persero)
Tbk sejak tahun 2008 mulai melaksanakan renovasi fasilitas produksi di Cibitung.
Pada tahun 2009, telah masuk pada tahap penyelesaian. Dampak positif renovasi
adalah peningkatan kapabilitas untuk menciptakan kondisi yang ideal guna
terjaminnya kualitas dan stabilitas produk yang baik.
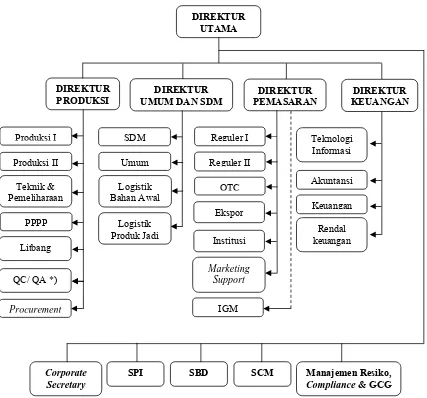
2.2 Struktur Organisasi PT. Indofarma (Persero) Tbk
PT. Indofarma (Persero) Tbk dipimpin oleh seorang Direktur Utama yang
dibantu oleh empat orang staf direksi, yaitu Direktur Produksi, Direktur Umum
dan SDM, Direktur Pemasaran dan Direktur Keuangan. Masing-masing direktur
membawahi bidang dan tiap bidang membawahi beberapa seksi. Selain itu, ada
beberapa bagian yang bertanggung jawab langsung kepada Direktur Utama (non
Pengawasan Internal (SPI) dan Supply Chain Management (SCM). Struktur organisasi dapat dilihat pada bagan dibawah ini.
DIREKTUR
Gambar 2.1 Struktur Organisasi PT. Indofarma (Persero) Tbk.
Keterangan:
PPPP (Perencanaan Produksi dan Pengendalian Persediaan) Litbang (Penelitian dan Pengembangan)
QC/ QA (Quality Control/ Quality Assurance) SDM (Sumber Daya Manusia)
2.3 Visi dan Misi PT. Indofarma (Persero) Tbk
Visi PT. Indofarma (Persero) Tbk adalah menjadi perusahaan yang berperan
secara signifikan pada perbaikan kualitas hidup manusia dengan memberi solusi
terhadap masalah kesehatan dan kesejahteraan masyarakat.
Misi PT. Indofarma (Persero) Tbk adalah:
a. Menyediakan produk dan layanan berkualitas dengan harga terjangkau untuk
masyarakat.
b. Melakukan penelitian dan pengembangan produk yang inovatif dengan
prioritas untuk mengobati penderita penyakit dengan tingkat prevalensi tinggi.
c. Mengembangkan kompetensi sumber daya manusia sehingga memiliki
kepedulian, profesionalisme dan kewirausahaan yang tinggi.
2.4 Moto PT. Indofarma (Persero) Tbk
Motto PT. Indofarma (Persero) Tbk adalah insan Indofarma dalam
menjalankan visi dan misi tersebut yaitu “dilandasi ketaqwaan kepada Tuhan
Yang Maha Esa, kita tingkatkan kualitas kesehatan bangsa”. Insan Indofarma
memiliki nilai-nilai inti yang telah disepakati bersama dan dianut serta
mencerminkan budaya korporat yang membentuk filosofi bisnis dan budaya kerja
“Compassionate, Professional, Entrepreneurshi“ disingkat “CPE”, untuk mewujudkan visi dan misi perseroan.
2.5 Logo PT. Indofarma (Persero) Tbk
Perusahaan memiliki logo ”INF” yang melambangkan kependekan nama
kesehatan masyarakat. Warna biru melambangkan sifat pengabdian perseroan
yang tidak terbatas. Keluasan pengabdian diperluas dengan gradasi warna yang
memiliki dimensi yang luas. Upaya pelayanan perseroan pada masyarakat tersirat
pada ritme dari garis luas dan lengkung. Kesatuan garisnya memberikan kesan
melindungi dan saling mendukung, artinya perseroan siap melindungi masyarakat
dari penyakit dan mendukung masyarakat untuk mewujudkan kesehatan. Posisi
miring melambangkan dinamika perseroan yaitu tidak terpaku pada
konvensi-konvensi yang sudah ada, mengikuti perkembangan zaman dan inovatif tetapi
mengikuti gerak laju teknologi.
Gambar 2.2 Logo PT. Indofarma ( Persero ) Tbk.
2.6 Kebijakan Mutu
Kebijakan mutu yang ditetapkan oleh perusahaan, adalah:
a. Mutu dijadikan prioritas utama demi kepuasan pelanggan eksternal dan
internal.
b. Mutu mencakup seluruh kegiatan perusahaan, mulai dari penelitian dan
c. Mutu dibangun dalam Sistem Manajemen Mutu terpadu oleh semua pihak
melalui perencanaan, pelaksanaan, dan pengendalian yang efektif dan efisien.
d. Mutu terutama ditentukan oleh faktor manusia, oleh karena itu pendidikan
dan pelatihan bagi karyawan terus dikembangkan sesuai kebutuhan dan
perkembangan ilmu pengetahuan dan teknologi.
e. Mutu selalu dijaga dan ditingkatkan sesuai kebutuhan pelanggan dengan
memperhatikan kemampuan daya saing melalui proses yang menekan biaya
mutu.
2.7 Kedudukan, Fungsi dan Peranan
PT. Indofarma (Persero) Tbk adalah suatu Badan Usaha Milik Negara
(BUMN) yang memproduksi obat-obat esensial dan merupakan produsen obat
generik berlogo yang terbesar di Indonesia.
PT. Indofarma (Persero) Tbk sebagai suatu BUMN mempunyai fungsi
antara lain sebagai berikut:
a. Menyelenggarakan kemanfaatan umum dibidang farmasi dalam arti yang
seluas-luasnya terutama dalam bidang pengadaan produk farmasi yang sangat
diperlukan oleh sarana kesehatan pemerintah maupun masyarakat umum.
b. Mendapatkan keuntungan berdasarkan prinsip pengelolaan perusahaan untuk
membiayai serta mengembangkan perusahaan dan untuk disumbangkan bagi
pembangunan nasional sesuai dengan kemampuan perusahaan.
c. Memperluas pemerataan penyediaan obat khususnya bagi masyarakat
d. Mencukupi kebutuhan obat yang dibutuhkan bagi Puskesmas dan Rumah
Sakit Pemerintah serta penyediaan obat di desa untuk mendukung Pos
Pelayanan Terpadu (POSYANDU)
e. Sebagai Price Leader terhadap obat-obat yang beredar di masyarakat melalui program Obat Generik Berlogo.
f. Meningkatkan penerapan CPOB sebagaimana direkomendasikan oleh WHO
sebagai hasil produksi berstandar internasional.
Peranan PT. Indofarma (Persero) Tbk antara lain dapat dilihat dari setiap
kebijakan yang operasional maupun arah pengembangan perusahaan, yaitu:
a. Andalan utama produsen obat esensial bermutu, dengan demikian PT.
Indofarma (Persero) Tbk merupakan pemasok terbesar obat esensial dan
menggunakan sebagian besar kapasitas produksinya untuk memproduksi obat
esensial.
b. Adanya motto perusahaan yaitu “Untuk Kehidupan yang Lebih Baik”, yang
artinya bahwa PT. Indofarma (Persero) Tbk akan selalu berusaha
meningkatkan derajat kesehatan masyarakat menjadi lebih baik. PT.
Indofarma (Persero) Tbk sebagai Badan Usaha Milik Negara membantu
memenuhi upaya kesehatan yang bersifat menyeluruh dan terpadu termasuk
pemerataan penyediaan obat yang bermutu dengan harga yang terjangkau.
c. PT. Indofarma (Persero) Tbk menjadi tempat pelatihan tenaga farmasis dan
profesi lain dalam rangka meningkatkan kualitas sumber daya manusia di
2.8 Lokasi dan Fasilitas
Seluruh fasilitas produksi farmasi dan obat herbal dirancang sesuai konsep
CPOB dan CPOTB dimana dibangun diatas tanah seluas ± 20 hektar di Cibitung,
Bekasi, Jawa Barat. Pabrik lainnya yaitu pabrik makanan bayi seluas ± 0,25 hektar
di Cikarang. Pabrik dan kantor pusat PT. Indofarma (Persero) Tbk terletak di
Jalan Indofarma No. 1, Desa Gandasari, Kecamatan Cikarang Barat, Bekasi,
dengan luas tanah 2.000.000 m2 dan luas bangunan 28.035 m2. Bagian-bagian
tersebut dapat dilihat pada tabel berikut:
Tabel 1. Ukuran ruangan masing-masing bagian PT. Indofarma (Persero) Tbk
No. Ruang Ukuran (m2)
10. Unit produksi parenteral 2.330
11. Unit produsi obat tradisional dan gudang 5.250
12. Bangunan utilities 898
13. Gudang bahan kimia 216
14. Instalasi pengolahan limbah cair 204
15. Instalasi limbah padat 44
16. Menara air 100
17. Cylinder gas chamber 66
18. Rumah jaga 128
19. Lapangan 1.548
20. Unit penelitian dan pengembangan 700
Sistem tata ruang produksi non steril dibagi dua, yaitu kelas empat dan
produk jadi dan daerah pengemasan sekunder. Daerah ini ditandai dengan lantai
yang dicat epoksi agar kotoran tidak mudah melekat dan dinding mudah
dibersihkan. Kelas tiga merupakan daerah yang terkait langsung dengan proses
produksi, misalnya daerah proses pengolahan, pengemasan primer, hingga koridor
yang berhubungan. Sedangkan produksi steril dibagi dalam empat kelas.
2.9 Produk PT. Indofarma (Persero) Tbk
Produk yang dihasilkan oleh PT. Indofarma (Persero) Tbk dikelompokkan
berdasarkan produk etikal, OTC dan alat kesehatan. Produk-produk tersebut
antara lain:
a. Generik pharma product (Obat Generik berlogo)
b. Health foods (suplemen kesehatan)
c. Branded generic (obat generik dengan nama dagang)
d. Branded OTC (obat bebas)
e. Herbal product (obat herbal)
f. Exported pharma product (obat diekspor)
g. New product 2009 (produk baru 2009)
h. Spesial product 2009 (produk khusus 2009)
2.10 Pelaksanaan Kegiatan di PT. Indofarma (Persero) Tbk
PT. Indofarma (Persero) Tbk merupakan perusahaan farmasi yang
memproduksi obat generik etikal sebagai produk utama disamping memproduksi
lainnya. Dalam menjalankan perusahaan, PT. Indofarma (Persero) Tbk menitik
dan kepedulian. Dari segi profesional, perusahaan menjunjung tinggi integritas,
komitmen seluruh insan dan kepurnaan. Dari segi kewirausahaan, dimana
perusahaan berpandangan visioner, inovasi untuk pertumbuhan dan fokus kepada
pelanggan. Dari segi kepedulian, perusahaan menghargai sikap dan pandangan
orang lain, kerja sama tim serta kesetaraan atas kesempatan dan penghargaan.
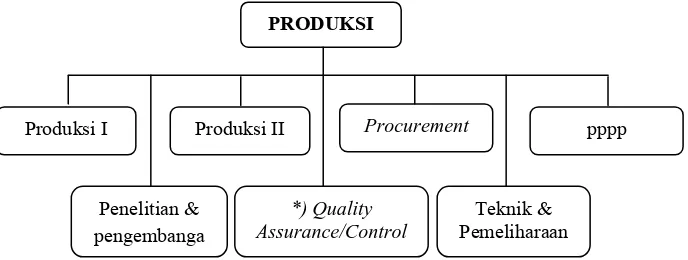
2.10.1 Direktorat Produksi
Direktorat Produksi PT. Indofarma (Persero) Tbk dipimpin oleh seorang
direktur yang membawahi tujuh bidang, dimana setiap bidang dipimpin oleh
seorang manajer yang dibantu oleh asisten manajer dan supervisor. Struktur
organisasi direktorat produksi sebagai berikut:
PRODUKSI
Procurement
Penelitian & pengembanga
Teknik & Pemeliharaan
Produksi I Produksi II pppp
*) Quality Assurance/Control
Gambar 2.3 Struktur Organisasi Direktorat Produksi PT. Indofarma (Persero) Tbk.
2.10.1.1 Bidang Produksi I
Bidang Produksi I dipimpin oleh seorang manajer yang membawahi empat
seksi Seksi Solid I, Seksi Solid II, Seksi Pengemasan dan Seksi Herbal. Struktur
organisasi bidang produksi I sebagai berikut:
PRODUKSI I
Pengemasan
Gambar 2.4 Struktur Organisasi Bidang Produksi I PT. Indofarma (Persero) Tbk. Tanggung jawab masing-maing seksi dibidang produksi I sebagai berikut:
a. Seksi Solid I, bertanggung jawab dalam pembuatan massa tablet dan kapsul.
b. Seksi SolidII, bertanggung jawab dalam pencetakan tablet/ filling kapsul. c. Seksi Pengemasan, bertanggung jawab dalam pengemasan tablet dan kapsul
non ß-laktam.
d. Seksi Herbal , bertanggung jawab dalam produksi herbal.
Visi dari bidang Produksi I adalah commit to SQC (Supply, Quality and Cost). Bidang Produksi I dalam menjalankan kegiatannya selalu berkomiten bahwa penyediaan bahan yang sesuai rencana dan tepat waktu akan menjamin
kualitas produk yang dihasilkan sesuai dengan spesifikasinya sehingga efisiensi
biaya tercapai dan keuntungan juga tercapai.
Ukuran kinerja bidang Produksi I ditentukan dengan menggunakan
indikator kunci/ Key Performance Indicator, yaitu:
a. Monthly production achievement (produksi bulanan yang tercapai). b. Process cycle time meet standart (waktu tunggu/ lead time). c. Yield (hasil akhir).
d. Succesfull batch (produk yang berhasil diproduksi). e. Effective machine hour (jam kerja mesin efektif).
Untuk dapat mencapai keberhasilan diatas, maka perlu diperhatikan
faktor-faktor yang menentukan, yaitu perencanaan produksi yang baik, formula, metode,
proses produksi yang handal dan tervalidasi, mesin-mesin yang terkualifikasi dan
terawat, personil yang kompeten, bahan baku yang tersandarisasi dan lingkungan
Fungsi dan tugas dari bidang Produksi I adalah:
a. Merencanakan produksi.
b. Mengkoordinir pelaksanaan produksi.
c. Mengendalikan pelaksanaan produksi dan sumber daya manusia sebagai
pelaksanaannya.
d. Mengawasi pelaksanaan produksi.
Perencanaan produksi dilakukan berdasarkan rencana penjualan, kemudian
disusun RPB (Rencana Produksi Bulanan) oleh bidang PPPP (Perencanaan
Produksi dan Pengendalian Persediaan) yang berisi item produk dan jumlahnya.
Bidang produksi mengkonfirmasi kesanggunpan RPB dengan memperhitungkan
kapasitas mesin, personel dan waktu kerja. RPB selanjutnya di break down menjadi RPM (Rencana Produksi Mingguan). RPB maupun RPM yang telah
disetujui oleh PPPP selanjutnya direalisasikan dengan penerbitan PP (Perintah
Produksi) dan PK (Perintah Kemas). PP dan CPB (Catatan Produksi Bets) digunakan sebagai bon permintaan bahan baku kepada bagian penyimpanan/ LBA
(Logistik Bahan Awal). Di gudang, bahan yang diminta bidang Produksi I
dipersiapkan untuk diproses. Penimbangan dilakukan oleh petugas dispensing
dengan disaksikan oleh petugas IPC (In Proces Control), kemudian dilakukan serah terima bahan baku kepada bidang Produksi I. Proses produksi dilaksanakan
sesuai persyaratan CPOB. Dokumen yang menyertai proses produksi yaitu CPB,
pengolahan dan pengemasan. Setelah diperoleh produk ruahan, bidang Produksi I
membuat Bukti Penyerahan Produk Ruahan (BPPR) untuk bidang PPPP sebagai
dasar untuk dibuat PK (Perintah Kemas). BPPR dibuat setelah produk ruahan
berdasarkan prosedur tetap yang berlaku dan setiap tahap dilakukan IPC, baik
oleh personel produksi maupun personel bidang Pemastian Mutu.
Proses produksi tablet dibidang Produksi I dilakukan dengan metode
Vertical Closed Sistem, yaitu sistem vertikal tertutup dimana proses produksi dilakukan dengan memanfaatkan gaya gravitasi. Metode ini dilaksanakan
dibidang Produksi I karena bentuk bangunan memungkinkan metode tersebut
dilakukan (tiga lantai) dan produksinya besar sehingga efisiensi tenaga tercapai.
Keuntungan sistem ini adalah dapat meminimalkan terjadinya kontaminasi silang,
bets dapat dibuat dalam kapasitas besar, efisiensi dari segi waktu, tenaga, tempat maupun energi.
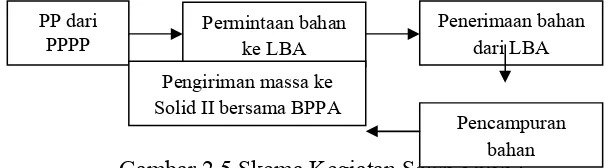
Seksi Solod I
Seksi ini bertugas dalam persiapan pengolahan, penyiapan bahan awal, dan
pembuatan massa. Pembuatan massa meliputi pembuatan massa tablet dan kapsul
non β laktam. Bahan yang telah ditimbang dibawa ke lantai tiga bersama CPB
(Catatan Pengolahan Bets) kemudian dilakukan penimbangan ulang (sebagai recheck). Bahan aktif dan bahan penolong tersebut dipindahkan dengan menggunakan pipa penyedot vakum (azo) yang didalamnya dilengkapi ayakan berputar (rotatif sieve) dan filter untuk memisahkan partikel besar. Kemudian dimasukkan ke dalam bin sebagai penampung. Bahan dalam bin dibawa dengan forklift dan siap dibuat massa melalui proses mixing yang dilakukan dengan menggunakan mixer diosna di lantai II. Setelah homogen, campuran diperiksa oleh petugas IPC, sementara menunggu hasil uji, wadah campuran diberi label
Skema kegiatan dapat dilihat pada bagan berikut:
Gambar 2.5 Skema Kegiatan Seksi Solid I Permintaan bahan LBA (Logistik Bahan Awal)
BPPA (Bukti Penyerahan Produk Antara)
Seksi Solid II
Seksi ini berada di lantai II, bertugas melakukan pencetakan massa tablet
dan pengisian kapsul dari seksi solid I (pembuatan massa) yang telah dinyatakan
lolos uji, sampai menjadi produk ruahan yang lolos uji dan siap dikemas.
Tahap-tahap yang dilakukan oleh seksi pencetakan dapat dilihat pada skema berikut:
Pencetakan
Gambar 2.6 Skema Kegiatan Seksi Solid II
Keterangan:
Pemeriksaan kualitas produk antara dan produk ruahan oleh operator
dilakukan selama proses berlangsung dan sewaktu-waktu oleh IPC agar produk
yang dihasilkan senantiasa memenuhi persyaratan mutu yang ditetapkan. Produk
ruahan yang sudah lolos uji diserahkan ke seksi pengemasan dari seksi Solid II
untuk dikemas menjadi produk jadi.
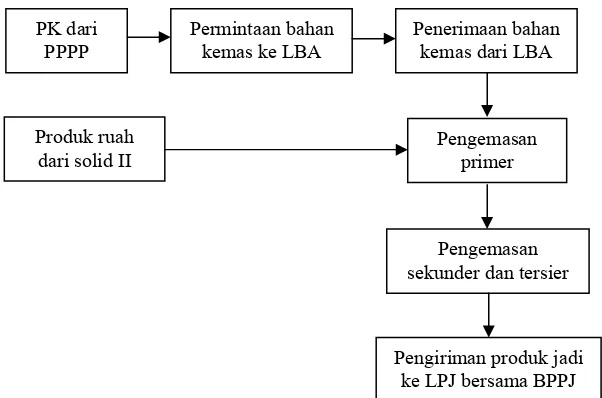
Seksi Pengemasan
Proses pengemasan adalah bagian siklus produksi yang dilakukan terhadap
produk ruahan untuk menghasilkan produk jadi. Pengemasan berhubungan
dengan stabilitas obat yang berfungsi melindungi obat terhadap kelembaban,
suhu, cahaya, iklim, dan benturan. Selain itu kemasan juga mempengaruhi daya
tarik produk terhadap konsumen. Skema kegiatan seksi pengemasan dapat dilihat
dibawah ini: ke LPJ bersama BPPJ
Gambar 2.7 Skema Kegiatan Seksi Pengemasan
Keterangan:
PK (Perintah Kemas)
Jika ditinjau dari waktu dikeluarkannya PP dan PK, dikenal dua proses
yaitu:
a. In line process yaitu proses dimana hasil produksi langsung dikemas dalam wadah pengemasnya, PP dan PK dikeluarkan bersamaan. Jadi mulai dari
bahan awal sampai menjadi produk dalam kemasan akhir, proses tidak
terputus. Proses ini diterapkan dalam sirup cair, sirup kering, salep dan oralit.
b. Non in line process, PP dan PK tidak dikeluarkan bersamaan. Setelah PP dikeluarkan, dilakukan penyiapan bahan awal sampai menjadi produk yang
siap dikemas. Produk ini dikarantina menunggu dikeluarkannya PK. Proses
ini diterapkan dalam pembuatan tablet, kapsul dan produk steril.
Pengemasan merupakan terminal akhir produksi sebelum dipasarkan,
sehingga suatu produk harus memenuhi syarat-syarat pengemasan yang baik,
yaitu:
a. Melindungi produk.
b. Inert, spesifik bahan pengemasnya.
c. Harus aman, tidak mudah dibuka oleh anak-anak.
d. Menarik terutama untuk kemasan obat bebas.
Tujuan dilakukan perubahan kemasan adalah:
a. Untuk memberikan proteksi obat yang lebih baik.
b. Image baru.
c. Menonjolkan produk tersebut dari produk lainnya (competitor). d. Promosi.
Bahan pengemas dibedakan menjadi tiga macam yaitu:
a. Bahan pengemas primer, yaitu bahan pengemas yang langsung berhubungan
dengan produk, misalnya tube, botol, ampul, stripping, dan blister.
b. Bahan pengemas sekunder, yaitu bahan pengemas yang tidak berhubungan
langsung dengan produk obat, tetapi berhubungan dengan pengemas primer
misalnya kotak untuk ampul/ strip/ blister/ salep.
c. Bahan pengemas tersier, yaitu bahan pengemas yang berhubungan langsung
dengan pengemas sekunder, misalnya karton.
Bahan pengemas dari gudang bila berupa karton akan dilakukan
penyablonan yang berisi nama produk, nomor bets, expired date, sedangkan untuk etiket dan kotak akan dilakukan coding (pemberian code) antara lain nomor bets, manufacturing date, expired date, dan HET (Harga Eceran Tertinggi).
Produk ruahan yang akan dikemas dan bahan kemas yang diterima dari
gudang/ LBA semuanya sudah diluluskan oleh quality control. Proses pengemasan dapat berupa pengisian ke botol, stripping, blistering dan sacheting. Jenis pengemasan yang digunakan disesuaikan dengan sifat produk ruahan dan
permintaan pasar. Selama proses pengemasan dilakukan pengujian oleh IPC,
misalnya uji kebocoran strip, blister, dan pengisian kedalam sachet. Selanjutnya dilakukan proses dokumentasi untuk bidang pengemasan meliputi Catatan
Pengolahan Bets, catatan sanitasi, catatan produksi harian yang terdiri dari kontrol
harian mesin, pengepakan dan laporan bulanan.
Seksi Herbal
tradisional yang bahan bakunya dapat berasal dari dalam negeri maupun dari luar
negeri. Obat tradisional yang bahan bakunya berasal dari dalam negeri nama
produk berawal “Pro”, misalnya Prolipid, Probagin dan Prouric. Obat tradisional
yang bahan baku yang diimpor nama produknya berawalan “Bio”, misalnya
Biovision, Bioginko dan lain-lain.
Kegiatan produksi diseksi herbal meliputi sortasi, pencucian simplisia,
ekstraksi, formulasi dan pengemasan. Proses pengolahan ekstrak dimulai dari
perajangan kemudian ekstraksi (penyarian), pengentalan, pengeringan kering yang
kemudian menghasilkan ekstrak kering. menggunakan metode ekstraksi berupa
maserasi, perkolasi dan gabungan keduanya. Pengeringan ekstrak menggunakan
tiga metode yaitu spray dryer, dehumidifier, dan vaccum dryer. Sistem produksi sesuai dengan CPOTB (Cara Pembuatan Obat Tradisional yang Baik). Produksi
herbal di PT. Indofarma (Persero) Tbk berupa horizontal close system.
Bahan baku dipenuhi dengan cara membeli langsung dari supplier, melalui petani binaan atau bekerja sama dengan institusi lain. Bahan baku tersebut harus
memenuhi spesifikasi yang ditetapkan oleh PT. Indofarma (Persero) Tbk seperti
kadar air (lebih kecil dari 10%), kadar sari larut dalam air dan kadar sari larut
dalam alkohol (tergantung simplisia) mengacu kepada buku resmi yang ditetapkan
yaitu Materia Medika Indonesia. Bahan pendukung produksi terdiri dari pelarut
seperti etanol dan air yang digunakan untuk ektraksi, bahan penolong (aerosil,
2.10.1.2 Bidang Produksi II
Bidang Produksi II dipimpin oleh seorang manager. Bidang ini membawahi
tiga seksi, yaitu Seksi β laktam, Seksi Salep, Sirup, Serbuk (SSS) dan Seksi
Produksi Steril. Struktur organisasi bidang produksi II dapat dilihat pada bagan
dibawah ini:
Produksi steril
Sediaan β
laktam
Sediaan salep, sirup serbuk
PRODUKSI II
Gambar 2.8 Struktur Organisasi Bidang Produksi II PT. Indofarma (Persero) Tbk.
Bidang Produksi II bertugas untuk memastikan tersedianya produk tablet,
kapsul dan sirup kering β laktam, salep, sirup, serbuk, dan produk steril sesuai
dengan target dengan cara merencanakan, mengkoordinasi, dan mengendalikan
aktivitas pengolahan, pengemasan dan kegiatan lainnya yang terkait. Pelaksanaan
proses produksi dibidang Produksi II menggunakan vertical closed system untuk menghindari kontak dengan lingkungan. Sistem ini diterapkan untuk produksi
serbuk seperti oralit. Sedangkan untuk produksi sediaan β-laktam, salep dan sirup
menggunakan horizontal closed system, dimana penyiapan bahan awal sampai produk akhir diproses dalam lantai yang sama, karena sediaan yang diproduksi
dalam jumlah yang relatif kecil.
Seksi Sediaan β Laktam
Seksi sediaan β laktam bertugas memproduksi sediaan antibiotika yang
produksi lain (non β laktam). Pembuatan sediaan β laktam dibedakan sebagai
berikut:
a. Sediaan sirup kering
Produksi sirup kering di seksi β laktam meliputi sirup kering Ampisilin 125
mg/5 ml dan sirup kering Amoksisilin 125 mg/5 ml. Proses produksi sirup kering
dilakukan secara In Line Process, yaitu proses produksi yang menjadi satu kesatuan proses mulai dari pengisian sampai pengemasan. Alur proses pembuatan
sediaan sirup kering derivat β laktam adalah sebagai berikut:
1. Penimbangan bahan aktif di lakukan di LBA β laktam dan untuk bahan bahan
penolong dilakukan di LBA non β laktam/ dispensing.
2. Persiapan pembuatan massa, dilakukan penimbangan ulang.
3. Pencampuran akhir dalam mixer. 4. Penimbangan massa sirup siap isi.
5. Pengisian massa sirup kering dalam botol.
6. Petugas IPC mengambil sampel untuk diuji.
7. Pengemasan.
Botol yang datang dari supplier terlebih dahulu dicuci dan dikeringkan.
Ruang tempat pengisian massa sirup kering memerlukan kelembaban tertentu,
yaitu tidak boleh lebih dari 50%. Hal ini untuk menjaga kualitas massa serbuk
kering agar mempunyai aliran yang baik, menjaga kestabilan zat aktif dan
mengendalikan keseragaman bobot. Operator mesin melakukan pengontrolan
terhadap bobot sirup kering dalam botol setiap 15 menit sejumlah masing-masing
Bets. Bagian IPC juga melakukan kontrol produk. Dalam satu rangkaian proses
setelah pengisian, dilanjutkan dengan penutupan botol (capping). b. Sediaan tablet dan kapsul
Proses produksi dilakukan secara In Line Process, yaitu proses produksi yang menjadi satu kesatuan proses mulai dari pengisian sampai pengemasan. Alur
proses pembuatan sediaan sediaan tablet dan kapsul derivat β laktam hampir sama
dengan produksi tablet dan kapsul non β laktam.
Seksi Sediaan Salep, Sirup dan Serbuk
Seksi Salep, Sirup dan Serbuk memproduksi sediaan salep kulit, krim,
serbuk, sirup cair dan sirup kering. Pembuatan sediaan sebagai berikut:
a. Salep
Alur proses produksi sediaan salep kulit adalah sebagai berikut:
1. Penimbangan bahan awal yang telah lolos uji.
2. Pelelehan basis di dalam vessel tanpa pengaduk.
3. Basis dipindahkan ke dalam vessel yang dilengkapi pengaduk melalui pompa dengan filter, kemudian dilakukan pengeringan basis. Massa basis selanjutnya
didinginkan dan dilakukan pemeriksaan kadar air oleh bagian IPC.
4. Bahan aktif, penolong dan pengawet ditambahkan ke dalam massa basis
sambil diaduk.
5. Massa salep dihomogenkan dengan menggunakan homogenizer dan
kemudian divakumkan untuk mengusir udara yang terperangkap.
dengan penimbangan 20 tube setiap 15 menit dan dibuat peta kendalinya.
Petugas IPC akan melakukan sampling untuk diuji.
b. Krim
Alur proses sediaan krim adalah sebagai berikut:
1. Penimbangan bahan awal yang telah lolos uji.
2. Pembuatan fase minyak dan fase air, menurut sifat kelarutan masing–masing
bahan penolongnya.
3. Kemudian dilakukan pencampuran fase minyak dan fase air di dalam vessel untuk pembentukan emulsi. Pada tahap ini proses dilakukan secara hati–hati
agar krim tidak pecah. Setelah ditambahkan bahan aktif kedalamnya.
4. Massa krim yang terbentuk ini divakumkan untuk menghilangkan udara yang
terperangkap.
5. Bila hasil pengujian IPC memenuhi syarat maka massa krim siap untuk
diisikan kedalam tube dan dikemas. Proses selanjutnya sama seperti proses
produksi salep.
c. Serbuk
Oralit merupakan contoh sedian padat (serbuk) berbentuk granul yang
dikemas dalam sachet kedap udara. Pengadukan oralit dilakukan dalam mixer diosna. Pemeriksaan kualitas terhadap massa oralit dilakukan oleh bagian Quality Control yang meliputi kadar, warna, homogenitas, distribusi partikel, dan kadar air. Untuk oralit kelembaban udara ruangan harus rendah karena produk
mempunyai sifat sangat higroskopis. Pengendalian proses yang dilakukan antara
Alur proses produksinya adalah sebagai berikut:
1. Penimbangan bahan awal yang telah lolos uji.
2. Setelah penimbangan, bahan–bahan dari mesin penyedot vakum (azo) ditransfer ke dalam bin. Selanjutnya bin dipasang pada loading station di lantai III dan massa dialirkan ke lantai II untuk dilakukan proses pengadukan
dengan menggunakan mixer diosna. Massa hasil pengadukan tersebut kemudian dilakukan uji kadar air dan homogenitas.
3. Apabila massa telah homogen maka dilakukan proses pengisian. Untuk oralit
proses pengisiannya dilakukan dengan menggunakan sachet filling machine. Selama proses pengisian, dilakukan pengawasan mutu terhadap keseragaman
bobot dan dilakukan pengujian.
4. Pengemasan kedalam pengemas sekunder dan tersier.
d. Sirup cair
Tahap–tahap produksi sediaan sirup cair:
1. Pembuatan sirup cair diawali dengan pemeriksaan air/ DIW yang akan
digunakan sebagai bahan baku.
2. Dispensing bahan–bahan awal yang telah dinyatakan memenuhi syarat. 3. Pembuatan larutan bahan dalam DIW dan pembuatan suspensi induk.
4. Pencampuran larutan bahan dan suspensi induk dalam vessel yang dilengkapi pengaduk, kemudian dilakukan sirkulasi dengan menggunakan pompa,
flavouring agent ditambahkan pada suhu massa suspensi 40ºC kemudian dilakukan pengecekan oleh IPC terhadap massa suspensi.
penutup botol dan mesin penempel etiket. Selama proses pengisian dilakukan,
pengawasan terhadap keseragaman bobot dengan pemeriksaan bobot 6 botol
setiap 15 menit dan dibuat peta kendalinya. Petugas IPC akan melakukan
sampling untuk diuji.
6. Pengemasan ke dalam wadah pengemas sekunder dan tersier.
e. Sirup kering
Tahap-tahap proses sesiaan sirup kering:
1. Proses diawali dengan pengayakan dan granulasi.
2. Penimbangan kemudian pencampuran dengan bahan tambahan didalam
diosna.
3. Dilanjutkan dengan pengisian dan pengemasan. Pada semua proses dilakukan
kontrol oleh IPC.
Untuk pembuatan sirup kering ini, kelembaban udara diatur sedemikian
rupa sehingga kurang dari 50%, menggunakan alat dehumiditifier. Massa sirup kering yang telah memenuhi syarat dimasukkan kedalam botol, pengisian sirup
kering ini masih dilakukan secara manual. Setelah dilakukan pengisian, botol
ditutup, diberi etiket dan dikemas.
Seksi Produksi Steril
Seksi produk steril bertanggung jawab dalam memproduksi sediaan steril,
dipimpin oleh seorang asisten manager yang membawahi dua subseksi, yaitu:
a. Subseksi pengolahan (penimbangan dan pelarutan, pengisian, sterilisasi,
pengolahan cepalosporin dan dokumentasi).
b. Subseksi pengemasan (pengepakan, pemeriksaan kejernihan sediaan ampul,
Produk yang dihasilkan antara lain:
a. Sedian steril cairan, seperti injeksi vitamin B12, deksametason, diazepam,
lidokain compositum, papaverin HCl, atropine sulfat dan aqua PI, furosemid
injeksi dan metoklopramida (dibuat dengan cara sterilisasi akhir). Sedangkan
gentamicin dan ranitidine injeksi (dibuat secara aseptis).
b. Tetes mata, seperti gentamicin 40 mg/ml.
c. Sediaan steril powder, seperti injeksi derivat sefalosporin yang dibuat secara aseptis yaitu Cefotaxim, Ceftriaxon.
Ruang produksi steril dibagi menjadi beberapa kelas sesuai dengan
persyaratan CPOB. Pembagian ini didasarkan kepada derajat kebersihannya,
yaitu:
a. Ruang kelas I merupakan ruang kelas di bawah LAF (Laminar Air Flow) yang dilengkapi dengan HEPA (High Efficiency Particulare Air) filter berefisiensi 99,995%. Besarnya pertukaran udara adalah 20–40 kali/jam.
Jumlah cemaran partikel dengan diameter kurang dari 0,5 µm tidak boleh
lebih dari 100 partikel/feet kubik.
b. Ruang kelas II sama dengan ruang kelas I tetapi tanpa LAF. Jumlah cemaran
partikel dengan diameter kurang dari 0,5 µm tidak boleh lebih dari 10.000
partikel/ feet kubik.
c. Ruang kelas III dilengkapi dengan filter berefisiensi 95%. Jumlah cemaran
partikel dengan diameter kurang dari 0,5 µm tidak boleh lebih dari 100.000
partikel/ feet kubik, ruangan ini digunakan untuk pencucian.
d. Ruang kelas IV dengan persyaratan harus bersih secara visual, jumlah partikel
Keempat ruangan di atas, masing-masing dipisahkan dengan ruang antara
dan dilengkapi dengan sistem air lock, air shower, pass box dan sistem air handling unit (AHU) yang memiliki peranan dalam pengaturan suhu, kelembaban, tekanan dan sirkulasi udara. Aliran udara diatur berdasarkan perbedaan tekanan,
dimana ruangan dengan kelas yang lebih tinggi memiliki tekanan yang lebih
tinggi dari pada kelas yang lebih rendah.
2.10.1.3 Bidang Pengadaan/ Procurement
Bidang Pengadaan/ Procurement dipimpin oleh seorang manajer yang membawahi dua seksi, yaitu seksi Pengadaan Bahan I dan seksi Pengadaan Bahan
II. Struktur organisasi dapat dilihat pada bagan dibawak ini:
Procurement
Pegadaan bahan I
Pengadaan bahan II
Gambar 2.9 Struktur Organisasi Bidang Procurement PT. Indofarma (Persero) Tbk.
Tugas masing-masing seksi sebagai berikut:
a. Seksi Pengadaan Bahan I bertugas mengadakan barang impor yaitu bahan
baku (bahan aktif dan bahan penolong) baik yang dibeli dari luar negeri,
maupun dalam negeri.
b. Seksi Pengadaan Bahan II bertugas mengadakan bahan pengemas dan barang
umum non-farmasi seperti peralatan laboratorium, produksi, peralatan umum,
Pengadaan dihadapkan pada dua hal yang berbeda, yaitu mutu dan harga.
Dapat dikatakan bahwa mutu hasil produksi dapat tergantung pada mutu bahan
awalnya. Demikian pula mengenai harga jual produk sangat dipengaruhi oleh
harga perolehannya. Pada umumnya mutu dan harga berbanding lurus, mutu
bahan awal yang baik akan mempunyai harga yang tinggi. Dengan demikian
menjadi suatu tantangan untuk mendapatkan bahan bermutu baik dengan harga
relatif rendah. Terlebih lagi bagi PT. Indofarma (Persero) Tbk yang mengemban
misi sebagai produsen utama obat generik berlogo yang ditujukan untuk konsumsi
masyarakat luas. Bidang Pengadaan melayani permintaan bahan farmasi dan
non-farmasi yang sangat kompleks. Oleh karena itu tanpa adanya spesifikasi yang
jelas, prosedur dan sistem administrasi yang baik, maka akan sulit mencapai hasil
yang diinginkan.
Prosedur dalam pengadaan/ procurement, meliput pengadaan bahan awal, seleksi dan evaluasi rekanan, pengadaan barang non bahan awal dan investasi dan
pengadaan sampel bahan awal dan suplies khusus. Bidang pembelian dan pengadaan memperhatikan masalah QCD (Quality, Cost, Delivery). Upaya yang dilakukan dalam pengadaan barang/ bahan berkualitas dengan cara membeli
sesuai spesifikasi dan membuat daftar approved supplier/ producers. Untuk bahan aktif, bahan pengemasan dan bahan penolong mengikuti spesifikasi yang telah
dibuat bidang Pemastian Mutu dan Litbang, sedangkan untuk mesin dan
pemeliharaan dilakukan oleh bagian teknik dalam mengendalikan harga
2.10.1.4 Bidang Teknik dan Pemeliharaan
Bidang Teknik dan Pemeliharaan dipimpin oleh seorang menejer yang
membawahi empat seksi yaitu seksi Perencanaan, evaluasi dan workshop, seksi Pemeliharaan, seksi Rekayasa dan seksi Utilities. PT. Indofarma (Persero) Tbk bertugas melakukan pengawasan dan pemeliharaan terhadap seluruh mesin dan
peralatan produksi. Struktur organisasi dapat dilihat pada pagan dibawah ini:
Teknik dan pemeliharaan
Pemeliharaan Perencanaan
evaluasi & workshop
Utilities Rekayasa
Gambar 2.10 Struktur Organisasi Bidang Teknik dan Pemeliharaan PT. Indofarma (Persero) Tbk.
Sarana pendukung pabrik yang digunakan di PT. Indofarma (Persero) Tbk,
antara lain:
a. Listrik
Sistem kelistrikan di PT. Indofarma (Persero) Tbk, menggunakan sumber
kelistrikan dari PLN dan generator milik perusahaan sendiri.
b. Air
Sistem pengelolaan air di PT. Indofarma (Persero) Tbk, menggunakan
sumber air tanah (sumur dalam ± 150 meter), dimana perusahaan memiliki empat
sumur air. Tujuan pengelolaan air ini adalah untuk menghilangkan cemaran
sesuai standar kualitas air yang ditetapkan. Air dihilangkan dari pengaruh zat besi
dan ditampung didalam bak penampung yang berisi kaporit untuk menghilangkan
menggunakan multimedia filter, dimana filter-filter ini tersusun dalam suatu
tabung (vessel) dengan bagian bawah tabung diberikan pasir sebagai alas tabung, filter ini sering juga disebut send filter. Selanjutnya air saring dengan karbon aktif, berfungsi sebagai pre-treatment sebelum proses deionisasi untuk menghilangkan klorin, kloramin, pestisida, bahan-bahan organik, warna, bau dan
rasa dalam air. Selanjutnya air dihilangkan kation dan anionnya (water softener filter) dengan menggunakan resin untuk menghilangkan atau menurunkan kesadahan air dengan cara mengikat calsium dan magnesium yang menyebabkan
tingginya tingkat kesadahan air. Selanjutnya air dialirkan ke gedung water system. Air yang digunakan untuk produksi disirkulasikan selama 24 jam, untuk itu dalam purified water system dilengkapi dengan looping system sehingga dapat memungkinkan air tersebut disirkulasi selama 24 jam. Sistem ini juga dilengkai
dengan filter ultraviolet dan ozonasi.
c. Tata udara (Air Handling Unit)
Sistem tata udara untuk mengontrol suhu, kelembaban, tekanan udara,
jumlah partikel dan pola aliran udara sesuai dengan yang dibutuhkan untuk setiap
ruangan. Dilengkapi dengan cooling coil/ evaporator yang berfungsi untuk mengontrol suhu dan kelembaban relatif udara yang akan didistribusikan ke
ruangan produksi. Udara yang dialirkan berasal dari campuran udara balik (return air) dan udara luar (fresh air). Blower/ static pressure fan berfungsi menggerakkan udara disepanjang sistem distribusi udara yang terhubung
dengannya. Filter berfungsi untuk mengendalikan dan mengontrol jumlah
partikel dan mikroorganisme yang mengkontaminasi udara yang masuk ke dalam
dibagi dalam beberapa tipe berdasarkan efisiensinya, yaitu prefilter (efisiensi penyaringan 35%), medium filter (efisiensi penyaringan 95%) dan high effisiency particulate air/ HEPA filter (efisiensi penyaringan 99,997%). Ducting berfungsi sebagai saluran tertutup tempat mengalirnya udara.
d. Penanganan terhadap debu
Sistem penanganan debu dilakukan dengan menggunakan dust collector dimana dilengkapi dengan filter/ penyaringan.
e. Uap air (steam)
Uap air diperoleh melalui unit steam boiler, digunakan sebagai sumber panas pada pengeringan granul (dengan oven atau fluid bed dryer) sterilisasi dengan autoclav dan lain-lain.
2.10.1.5 Bidang Perencanaan Produksi dan Pengendalian Persediaan (PPPP)
Bidang Perencanaan dan Pengendalian Produksi dan Persediaan (PPPP)
dipimpin oleh seorang manajer yang membawahi empat seksi, yaitu seksi
Perencanaan dan Pengendalian Bahan Baku dan Pengemas, seksi Perencanaan dan
Pengendalian Produksi I, seksi Perencanaan dan Pengendalian Produksi II dan
Herbal serta seksi Toll Manufacturing dan Pelayanan Produk. Struktur organisasi dapat dilihat pada bagan dibawah ini:
PPPP
PPPP mempunyai peranan strategis dalam peningkatan efisiensi dan
produktifitas, proses pabrikasi, pengendalian persediaan sehingga diharapkan
dapat menghasilkan produk dengan mutu, harga, jumlah, dan waktu serta
pelayanan yang tepat.
Seksi Perencanaandan pengendalian mempunyai dua fungsi, yaitu fungsi
perencanaan dan fungsi pengendalian. Fungsi perencanaan, merupakan landasan
umum dalam penentuan permintaan marketing dan langkah-langkah yang diperlukan untuk memastikan tercapainya permintaan tersebut. Fungsi
pengendalian, merupakan alat manajemen untuk memastikan tersedianya bahan
awal, produk ruah, dan produk jadi untuk terpenuhinya permintaan marketing, serta pengaturan agar tidak terjadi over stock atau out of stock.
Hubungan kerja PPPP dengan berbagai bidang lain:
Perencanaan produk Supply product Marketing
Permintaan bahan awal Pengendalian persediaan
PPPP Logistik
Produksi
Pengadaan
Gambar 2.12 Hubungan Kerja Bidang PPPP dengan Bidang lain di PT. Indofarma (Persero) Tbk.
Alur proses kegiatan bidang PPPP dibagi menjadi dua tahap, yaitu alur
proses perencanaan dan alur proses pengendalian bahan. Alur proses perencanaan
dimulai dari bidang Pemasaran menyerahkan rencana penjualan satu tahun kepada
Direktur Produksi. Kedua rencana tersebut digunakan sebagai dasar pembuatan
Rencana Kerja dan Anggaran Perusahaan (RKAP) yang disusun setiap tahun
kemudian dijabarkan dalam Konsep Rencana Produksi Periodik (KRPP) dan
Konsep Rencana Kedatangan Bahan (KRKB) perkuartal. Berdasarkan KRPP dan
KRKB perkuartal dibuat Rencana Produksi Bulanan (RPB). RPB ini digunakan
untuk menyiapkan Perintah Produksi (PP) dan Perintah Kemas (PK) serta
penyiapan Surat Pesanan Permintaan Barang (SPPB) untuk dimintakan
persetujuan Direktur Produksi.
Alur proses pengendalian bahan dimulai dari diterbitkannya Perintah
Pengolahan (PP) sekaligus berlaku sebagai bon permintaan bahan ke gudang
penyimpanan bahan baku dan bahan penolong. Kemudian diterbitkannya Bukti
Penyerahan Produk Ruah (BPPR), selanjutnya keluar Perintah Kemas (PK) dan
Bukti Penyerahan Produk Jadi (BPPJ). Berdasarkan PP dan PK bidang Produksi
membuat Rencana Produksi Mingguan (RPM) yang selanjutnya digunakan
sebagai pedoman proses produksi. Proses produksi dilaporkan dalam bentuk
laporan produksi dan ditujukan antara lain kepada bidang PPPP sebagai informasi
untuk fungsi pengendalian produksi. Bidang Pengadaan kemudian memberikan
informasi kemajuan proses pengadaan kepada PPPP untuk fungsi pengendalian
bahan.
Seksi perencanaan produksi mempunyai fungsi, antara lain mengumpulkan
data dan analisa (ramalan penjualan, kapasitas produksi, stok produk antara, ruah
dan jadi), menyusun rencana produksi, evaluasi rencana produksi secara periodik,
evaluasi efisiensi dan produkrifitas, evaluasi kendala-kendala produksi dan
Seksi Toll Manufacturing dibagi menjadi dua, toll out (dimana perusahaan membuat produk ke pabrik farmasi lain) dan toll in (dimana perusahaan menerima pembuatan produk dari pabrik farmasi lain).
2.10.1.6 Bidang Penelitian dan Pengembangan
Bagian Penelitian dan Pengembangan dipimpin oleh seorang manajer yang
membawahi lima seksi, yaitu seksi Formulasi, seksi Metode Analisa, seksi Herbal,
seksi Registrasi dan seksi Pengembangan Kemasan. Struktur organisasi dapat
dilihat pada bagan berikut ini:
Pengembangan
kemasaan
Formulasi Metode Analisa Herbal Registrasi
Litbang
Gambar 2.13 Struktur Organisasi Bidang Litbang PT. Indofarma (Persero) Tbk.
Bidang Penelitian dan Pengembangan berperan dalam pengembangan
produk baru, peningkatan daya saing produk existing dan upaya peningkatan daya saing dengan perusahaan farmasi lain. Tugas bidang ini, antara lain:
a. Meneliti dan mengembangkan produk.
b. Mengoptimalkan produk, yang meliputi optimasi formula termasuk optimasi
dan substitusi bahan.
c. Pengembangan metode analisis.
d. Penyiapan dokumen registrasi lokal dan ekspor.
e. Desain kemasan.
g. Mengadakan kerja sama di bidang penelitian dengan instansi lain seperti LIPI
(Lembaga Ilmu Pengetahuan Indonesia) dan perguruan tinggi.
Seksi Formulasi
Seksi formulasi bertugas menyiapkan formula dan proses pembuatan obat
baru, mendesain formula, merancang metode pembuatan, pengembangan bahan
substitusi dan reformulasi dan reproses.
Penelitian formulasi meliputi:
a. Penelitian spesifikasi produk.
b. Penentuan bahan yang akan dipakai.
c. Penelitian formula.
d. Pembuatan master formula.
e. Pembuatan alur proses.
f. Merencanakan dan mengusahakan proses produksi yang pendek.
g. Persyaratan obat yang sama atau lebih ketat dari farmakope.
h. Mendesain formula yang mudah dianalisis.
i. Produk yang dihasilkan mempunyai stabilitas yang baik.
j. Efek farmakologi yang baik dan efek samping yang minimal.
k. Validasi formula dengan cara:
1.Prospektif : 3 bets pertama divalidasi 2.Retrospektif : 20 bets produksi
l. Melakukan efisiensi formula.
Bagian Formulasi bertugas mengembangkan formula untuk produk baru,
melakukan reformulasi, yaitu memperbaiki formula dari produk yang sudah ada
mengembangkan cara produksi untuk mempersingkat dan memperkecil biaya
produksi, menguji stabilitas produk baru serta membuat prosedur kerja tetap untuk
bagian produksi.
Bagian pengembangan produk harus mengembangkan produk-produk baru,
sehingga dapat dipertimbangkan oleh direksi. Marketing, SBD, proses pengembangan formula tersebut meliputi studi literatur, penetapan spesifikasi
produk, seleksi bahan baku aktif dan penolong, trial uji stabilitas, scalling up ke skala produksi.
Proses lahirnya produk baru dimulai dengan adanya usulan dari bagian
pemasaran atau divisi lain. Usulan tersebut dibahas oleh tim produk baru yang
terdiri antara lain dari bidang SBD, Litbang, PPPP, Produksi, Pemastian Mutu dan
Pemasaran. Tim produk baru mendiskusikan mengenai bentuk sediaan, dosis,
rencana kemasan dan rencana peluncuran produk. Selain itu bagian Litbang juga
bertugas memilih spesifikasi bahan, trial formula, desain kemasan, penyiapan alat, dokumen registrasi dan uji stabilitas. Produk baru yang telah siap didaftarkan
ke Badan POM disertai dokumen-dokumen yang diperlukan untuk memperoleh
nomor registrasi. Dengan adanya nomor regristrasi, produk baru tersebut dapat
diproduksi. Produksi skala besar dilakukan bidang produksi bersama-sama dengan
bidang Litbang dan Pemastian Mutu.
Kegiatan pengembangan produk baru dilakukan selama tiga tahun, meliputi:
a. Studi Pustaka.
Mencari spesifikasi bahan aktif, bahan pembantu dan obat tidak tercampurkan
yang baik sesuai dengan bentuk sediaan dan kapasitas produksi yang tersedia
serta menentukan peralatan yang akan digunakan.
b. Screening Bahan.
c. Trial Formulasi I dan Analisa.
Membuat formula yang aman, berkhasiat, bermutu, efektif dan efisien dari
segi proses dan biaya serta mempunyai nilai kompetitif dari kompetitor.
d. Penyediaan Bahan
Bagian Litbang berhubungan dengan bagian Purchasing untuk kesediaan bahan.
e. Trial Formulasi II.
f. Kemas dan Uji Stabilitas.
g. Praregistrasi.
h. Uji BE.
i. Registrasi.
Bidang penelitian dan pengembangan juga melakukan reformulasi terhadap
produk-produk yang sudah diproduksi. Reformulasi adalah memperbaiki formula
yang sudah ada hal ini terjadi karena adanya masalah yang timbul pada produk
tersebut baik permasalahan pada formula, proses produksi dan proses
penyimpanan. Usulan reformulasi biasanya berasal dari pemasaran, pengawasan
mutu, produksi serta bagian penelitian dan pengembangan itu sendiri.
Seksi Metode Analisis dan Stabilitas Tugas-tugas seksi ini adalah:
a. Memilih dan mempersiapkan metode analisis untuk bahan aktif, bahan baku