PT. INDOFARMA (Persero) Tbk.
Jalan Indofarma No. 1, Cikarang Barat 17530, Bekasi ( 1 Maret 2008 – 31 Maret 2008 )
Disusun oleh :
Ruth Sufari Mariganto, S.Farm NIM. 073202090
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
di
PT. INDOFARMA (PERSERO) Tbk. Tanggal 3 Maret – 31 Maret 2008
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun oleh :
RUTH SUFARI MARIGANTO, S.Farm 073202090 NAITI ROFIYA, S.Farm 073202063
PT. INDOFARMA (PERSERO) Tbk. Cikarang Barat, Bekasi
Pembimbing,
Eko Dodi Santosa
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala berkat dan rahmatNya sehingga pelaksanaan Pelatihan Praktek Kerja Profesi Apoteker (PPKPA) di PT. Indofarma (Persero) Tbk. yang dilaksanakan pada tanggal 1 Maret 2008 sampai 31 Maret 2008 dapat terselesaikan dengan baik.
Praktek Kerja Profesi di PT.Indofarma (Persero) Tbk. ini sangat bermanfaat bagi penulis untuk mendapatkan pengetahuan tentang kegiatan yang ada di industri farmasi secara menyeluruh dan terpadu. PPKPA ini juga merupakan salah satu syarat yang harus dipenuhi oleh mahasiswa Program Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara.
Dalam pelaksanaan dan penyusunan Laporan Praktek Kerja Profesi Apoteker ini penulis banyak mendapatkan bantuan dan dukungan dari berbagai pihak, untuk itu penulis ingin mengucapkan terima kasih yang sebesar–besarnya kepada :
1. Bapak Placidius Sudibyo sebagai Direktur Utama PT Indofarma (Persero) Tbk. yang telah memberikan kesempatan kepada kami untuk melaksanakan PPKPA.
4. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan kesempatan kepada penulis dalam melaksanakan PPKPA ini.
5. Seluruh staf & karyawan di PT. Indofarma (Persero) Tbk. atas kerjasamanya selama penulis mengikuti kegiatan PPKPA.
6. Bapak dan ibu dosen Fakultas Farmasi yang telah memberikan pembekalan dalam rangka pelaksanaan PPKPA di Industri Farmasi.
7. Seluruh keluarga, terutama papa dan mama yang selalu berdoa untuk penulis, memberikan semangat dan dukungan.
8. Rekan–rekan PPKPA angkatan 60 dari Universitas Pancasila, Universitas Islam Indonesia Yogyakarta, Universitas Indonesia, Universitas 17 Agustus, Universitas Padjajaran dan Universitas Widya Mandala Surabaya, terima kasih untuk kerjasama dan kenangannya.
Penulis berharap semoga pengetahuan dan pengalaman yang didapat selama PPKPA di Industri Farmasi yaitu di PT. Indofarma (Persero) Tbk. ini bermanfaat sebagai bekal untuk menjalankan pengabdian profesi Apoteker khususnya di Industri Farmasi dan juga bermanfaat bagi para pembaca.
Cikarang Barat, Maret 2008
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI... v
DAFTAR TABEL... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix
RINGKASAN ... x
BAB I PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Pelatihan Praktek Kerja Profesi Apoteker (PPKPA) 2 1.3 Kegiatan Pelatihan Praktek Kerja Profesi Apoteker (PPKPA) 3 BAB II TINJAUAN dan RUANG LINGKUP PT.INDOFARMA (Persero) Tbk ... 4
2.1 Sejarah dan Perkembangan PT.Indofarma (Persero) Tbk... 4
2.2 Visi, Misi, Motto, dan Logo PT.Indofarma (Persero) Tbk . 7 2.2.1 Visi PT.Indofarma (Persero) Tbk ... 8
2.2.2 Misi PT.Indofarma (Persero) Tbk... 8
2.2.3 Motto PT.Indofarma (Persero) Tbk ... 8
2.2.4 Logo PT.Indofarma (Persero) Tbk... 8
2.3 Nilai budaya yang dikembangkan PT. Indofarma (Persero) Tbk... 9
2.4 Kebijakan Mutu Perusahaan ... 11
2.5 Kedudukan, Fungsi dan Peranan... 12
2.5.1 Kedudukan ... 12
2.5.2 Fungsi... 12
2.8 Penerapan CPOB di PT. Indofarma (Persero) Tbk. ... 16
BAB III. KEGIATAN DI INDUSTRI FARMASI PT. INDOFARMA (Persero) Tbk... 32
3.1 Keterlibatan dalam Proses Produksi ... 32
3.2 Tinjauan Kebagian-bagian Lain... 34
3.2.1 Direktorat Keuangan dan Sumber Daya Manusia... 34
3.2.2 Direktorat pemasaran dan Umum ... 40
3.2.3 Direktorat Produksi ... 45
BAB IV PEMBAHASAN ……….. 54
4.1.Organisasi dan Personalia ... 57
4.2 Bangunan dan Peralatan... 58
4.3.Sanitasi dan Higiene ... 59
4.4.Produksi ... 60
4.5.Pemastian Mutu ... 63
4.6.Penanganan Keluhan Tehadap Obat, Penarikan Kembali obat dan Obat kembalian serta Dokumentasi 64
4.7.Inspeksi Diri ... 66
4.8.Sistem Pengelolaan Lingkungan ... 66
BAB V KESIMPULAN DAN SARAN ... 67
5.1 Kesimpulan ... 67
5.2 Saran... 67
DAFTAR PUSTAKA ... 68
1 Denah lokasi PT. Indofarma (Persero) Tbk ... 69 2 Denah PT. Indofarma (Persero) Tbk... 70 3 Struktur Organisasi Direktorat Utama PT.Indofarma
(Persero) Tbk ... 71 4 Struktur Organisasi Direktorat Produksi PT.Indofarma
(Persero) Tbk ... 72 5 Struktur Organisasi Direktorat Pemasaran dan Umum
PT.Indofarma (Persero) Tbk ... 73 6 Struktur Organisasi Direktorat Keuangan & SDM PT.Indofarma (Persero) Tbk ... 74 7 Struktur Organisasi Staff Direksi PT.Indofarma
Maret 2008. Praktek Kerja Profesi ini bertujuan untuk mengetahui dan memahami tugas dan tanggung jawab seorang apoteker di industri farmasi; memberi gambaran mengenai struktur organisasi, situasi dan kondisi kerja di industri farmasi; memperoleh pengetahuan, wawasan dan pengalaman tentang penerapan CPOB di PT. Indofarma (Persero) Tbk. Kegiatan Praktek Kerja Profesi (PKP) meliputi pembuatan catatan kegiatan harian, pembuatan draft laporan dan tugas khusus.
BAB I PENDAHULUAN
1.1 Latar Belakang
Pembangunan kesehatan secara berkesinambungan telah dimulai sejak dicanangkannya rencana pembangunan lima tahun I pada tahun 1969. Tujuan umum Pembangunan Kesehatan Nasional adalah tercapainya mutu hidup dan lingkungan hidup yang optimal bagi setiap penduduk serta tercapainya derajat kesehatan yang setinggi-tingginya, meliputi kesehatan badaniah, rohaniah, sosial, dan bukan hanya keadaan bebas dari penyakit, cacat dan kelemahan. Tujuan tersebut telah diwujudkan secara nyata dengan adanya berbagai pelayanan kesehatan yang berdampak pada peningkatan derajat kesehatan masyarakat.
Pelayanan kesehatan tersebut dapat diselenggarakan oleh pemerintah atau swasta. Industri farmasi merupakan salah satu sarana pelayanan kesehatan yang memegang peranan penting dalam pengadaan obat yang bermutu. Untuk menjamin tercapainya pemenuhan obat yang bermutu, pemerintah melalui Departemen Kesehatan telah berupaya memberikan suatu pedoman Cara Pembuatan Obat yang Baik (CPOB). CPOB ini mutlak harus diterapkan oleh industri farmasi baik PMA atau PMDN agar dihasilkan obat yang bermutu dan berkualitas bagi masyarakat.
mengawasi seluruh kegiatan produksi dan berperan untuk meningkatkan kesadaran penuh personalia dalam CPOB agar dapat berperan aktif sesuai dengan fungsinya masing-masing.
PT. Indofarma (Persero) Tbk., merupakan perusahaan farmasi nasional milik Negara yang telah memiliki sertifikat CPOB dan ISO 9001. Penerapan CPOB dan ISO 9001 dalam seluruh proses dan kegiatan di PT. Indofarma (Persero) Tbk. ini, terkait dengan adanya kesadaran bahwa sebuah perusahaan farmasi memiliki tanggung jawab moral pada masyarakat untuk menghasilkan obat yang aman, bermutu serta terjangkau.
Apoteker dalam industri farmasi mempunyai tugas untuk melakukan pekerjaan kefarmasian yang meliputi pembuatan dan pengendalian mutu obat, pengadaan, penyimpanan, distribusi obat, serta pengembangan obat dan obat tradisional.
1.2 Tujuan Pelatihan Praktek Kerja Profesi Apoteker (PPKPA)
Tujuan diadakan Pelatihan Praktek Kerja Profesi Apoteker (PPKPA) di PT. Indofarma (Persero) Tbk. adalah :
1. Melihat gambaran nyata peran Apoteker, penerapan CPOB dan mencari bekal yang cukup untuk memasuki dunia kerja yang sesungguhnya, khususnya di industri farmasi.
2. Mengetahui dan memahami dasar-dasar pengelolaan industri farmasi dan keterkaitan dengan profesi lain.
3. Mahasiswa termotivasi untuk membekali diri dengan pengetahuan dan ketrampilan sebagai dasar pengembangan diri di industri farmasi.
1.3 Pelaksanaan Pelatihan Praktek Kerja Profesi Apoteker (PPKPA)
Pelatihan Praktek Kerja Profesi Apoteker (PPKPA) di PT. Indofarma (Persero) Tbk., dilaksanakan selama sebulan dari tanggal 1 Maret – 31 Maret 2008. Kegiatan yang dilakukan berupa :
1. Tutorial yang diadakan oleh bidang Pemastian Mutu, Bidang Umum, Sistem Mutu, SDM, Litbang, Pemasaran Produk, Perencanaan Produksi dan Pengendalian Persediaan (PPPP), Lingkungan dan Kesehatan Keselamatan Kerja (LK-3), Produksi, Logistik Bahan Awal, Bidang Teknik & Utilities dan Bidang Herbal.
2. Tinjauan ke Lapangan
3. Pelaksanaan Tugas Khusus pada salah satu bidang di PT. Indofarma (Persero) Tbk.
BAB II
TINJAUAN DAN RUANG LINGKUP PT. INDOFARMA (Persero) Tbk.
2.1 Sejarah dan Perkembangan PT. Indofarma (Persero) Tbk.
PT. Indofarma (Persero) Tbk., merupakan Badan Usaha Milik Negara (BUMN) yang berada di bawah Departemen Kesehatan, berdiri pada tahun 1918 berupa unit produksi kecil dari Rumah Sakit Pusat Pemerintah Belanda dengan kegiatan pembuatan salep dan pemotongan kain kasa pembalut yang dilakukan di Centrale Burgelijke Zienkeninrichring (CBZ), yang sekarang dikenal dengan
Rumah Sakit Dr. Cipto Mangunkusumo di Jakarta.
Pada tahun 1931, pabrik berkembang dengan bertambahnya jenis produksi, yaitu obat suntik dan tablet. Sejalan dengan itu pada tahun 1935 lokasi pabrik dipindahkan ke Jalan Tambak No. 2 Manggarai, Jakarta sehingga dikenal dengan sebutan ”Pabrik Obat Manggarai”.
pada perkembangan selanjutnya disebut Lembaga Farmasi Nasional kemudian menjadi Pusat Pemeriksaan Obat dan Makanan (PPOM).
Pada tanggal 14 Februari 1967, melalui Surat Keputusan Menteri Kesehatan RI No.008/III/AM/67, nama Pabrik Obat Manggarai diubah menjadi Pusat Produksi Farmasi Departemen Kesehatan dan ditetapkan sebagai Unit Operatif setingkat Direktorat Jenderal Farmasi. Tugas pokok dari pabrik ini adalah memproduksi obat–obatan berdasarkan pesanan dari Departemen Kesehatan RI. Pada tahun 1969-1975 pabrik direnovasi dan tahun 1975 dikeluarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.125/IV/KAB/BU/75 tentang struktur organisasi Departemen Kesehatan yang merupakan pelaksanaan lebih lanjut dari Keputusan Presiden Republik Indonesia No. 44 dan 45 tahun 1974. Namun pabrik farmasi Departemen Kesehatan ini tidak tercakup dalam keputusan tersebut sehingga statusnya tidak jelas. Hal ini berlangsung hingga tahun 1978.
dengan fungsinya, berdasarkan SK Menteri Kesehatan Republik Indonesia No.418/MenKes/SK/XII/78 tanggal 6 Desember 1978.
Pada tahun 1979, pabrik ini ditetapkan sebagai Pusat Produksi Farmasi Departemen Kesehatan Republik Indonesia. Dalam keputusan tersebut disebutkan pula bahwa Pusat Produksi Farmasi bertugas membantu usaha pemerintah dalam meningkatkan kesejahteraan masyarakat di bidang kesehatan, yaitu memproduksi obat-obat untuk rumah sakit pemerintah dan pusat kesehatan masyarakat. Obat-obatan yang dimaksud bersifat essensial, artinya bahwa obat tersebut banyak dibutuhkan oleh masyarakat. Untuk memenuhi kebutuhan tersebut, maka diputuskan untuk didirikannya sebuah pabrik yang sekaligus untuk memperluas pelayanan Pusat Produksi Farmasi Departemen Kesehatan. Pada tahun 1980 mulai dilakukan studi kelayakan untuk pembangunan pabrik ini.
Pada tanggal 11 Juli 1981, berdasarkan PP No.20 tahun 1981, Pusat Produksi Farmasi diubah menjadi Perusahaan Umum dengan nama Indonesia Farma (Perum Indofarma) yang direalisasikan pada tanggal 1 April 1988 dengan mulai dibangunnya pabrik baru yang modern seluas 20 hektar sesuai dengan konsep dan persyaratan CPOB yang berlokasi di desa Gandasari, Cibitung, Bekasi dengan bantuan alat dan teknologi dari Italia.
Pada tanggal 2 Januari 1996 Perum Indonesia Farma diubah menjadi Perseroan Terbatas Indofarma (PT.Indofarma (Persero)) melalui PP No.34 tanggal 20 September 1995. Perubahan status ini bertujuan untuk mengantisipasi perubahan dan meningkatkan daya saing. Pada tahun tersebut juga dilakukan akuisisi dengan PT. Riasima Abadi Farma yang merupakan produsen bahan baku farmasi, dilakukan renovasi pada bagian Litbang pada tahun 1996-1997. Tahun 1999 dibangun Extraction Plant dan selesai awal tahun 2000, serta pendirian anak perusahaan PT.Indofarma Global Medika (PT.IGM) sebagai distributor dan pemasaran produk farmasi termasuk alat kesehatan dengan 23 cabang di seluruh Indonesia. Tahun 2000 dibangun pabrik makanan bayi di Lippo Cikarang Industrial Estate Jawa Barat.
Pada tahun 2000 unit produksi memperoleh sertifikat ISO 9002 dan pada tahun 2001 ditingkatkan lagi menjadi ISO 9001 untuk seluruh unit produksi termasuk unit produksi Herbal Medicine dan Litbang.
Mulai tanggal 17 April 2001, PT.Indofarma melakukan penawaran saham perdana kepada masyarakat dan mendaftarkan seluruh saham perseroan di Bursa Efek Jakarta dan Bursa Efek Surabaya dengan kode saham INAF. Status Indofarma selanjutnya berubah menjadi PT.Indofarma (Persero) Tbk.
2.2 Visi, Misi, Motto dan Logo PT. Indofarma (Persero) Tbk. 2.2.1 Visi PT. Indofarma (Persero) Tbk.
Visi PT.Indofarma (Persero) Tbk. adalah menjadi perusahaan yang berperan secara signifikan pada perbaikan kualitas hidup manusia dengan memberi solusi
2.2.2 Misi PT.Indofarma (Persero) Tbk.
Selain visi PT.Indofarma (persero) Tbk. juga mempunyai misi yaitu :
1. Menyediakan produk & layanan yang berkualitas dengan harga terjangkau untuk masyarakat.
2. Melakukan penelitian & pengembangan produk yang inovatif dengan prioritas untuk mengobati penyakit dengan tingkat prevalensi tinggi.
3. Mengembangkan kompetensi SDM sehingga memiliki kepedulian,
profesionalisme & kewirausahaan yang tinggi. 2.2.3 Motto PT.Indofarma (Persero) Tbk
Motto PT.Indofarma (Persero) Tbk. adalah Insan Indofarma dalam menjalankan visi dan misi tersebut yaitu “dilandasi ketaqwaan kepada Tuhan Yang Maha Esa, kita tingkatkan kualitas kesehatan bangsa”.
2.2.4 Logo PT.Indofarma (Persero) Tbk
konvensi-konvensi yang sudah ada, mengikuti perkembangan zaman dan inovatif tetapi mengikuti gerak laju teknologi.
Gambar 1. Logo PT.Indofarma ( Persero ) Tbk
2.3 Nilai budaya yang dikembangkan PT. Indofarma (Persero) Tbk.
Untuk mewujudkan visi dan misi, PT. Indofarma (Persero) Tbk. memiliki inti yang telah disepakati bersama dan dianut, serta mencerminkan budaya korporat, dalam hal ini adalah budaya PT. Indofarma (Persero) Tbk. Nilai-nilai ini membentuk filosofi bisnis dan budaya kerja “Professional, Entrepreneurshuip, Compassionate” yang disingkat “PEC”.
Professional memiliki rti yaitu senantiasa bekerja secara profesional yang
dilandasi integritas, komitmen dan selalu berupaya memberikan hasil yang terbaik. Nilai inti profesional dijabarkan dalam bentuk :
a) Integrity sebagai input, mengandung pengertian satunya pikiran, kata dan perbuatan dengan selalu mengatakan kebenaran dan mengikuti aturan yang berlaku, dengan memegang teguh prinsip-prinsip etika sehingga menjadi insan Indofarma yang dapat dipercaya dan amanah.
c) Strive for excellent sebagai output, mengandung pengertian bahwa insan indofarma senantiasa berupaya memberikan yang terbaik bagi stakeholder’s perseroan dengan bekerja secara efektif, efisien, dan akurat.
Entrepreneurship memiliki arti bahwa insan indofarma senantiasa memilki
jiwa kewirausahaan berdasarkan pemikiran jauh ke depan, inovatif dan fokus terhadap kepuasan pelanggan. Nilai Entrepreneurship dijabarkan dalam bentuk : a) Visionary sebagai input, mengandung pengertian bahwa insan indofarma
memiliki pandangan jauh ke depan disertai kemampuan untuk menyesuaikan diri terhadap perubahan lingkungan .
b) Innovation sebagai proses, mengandung pengetian bahwa insan indofarma memiliki penyesuaian diri terhadap perubahan diwujudkan dengan menciptakan produk baru, proses atau metode baru dan melakukan perbaikan dalam lingkup tanggung jawabnya.
c) Customer focus sebagai output, mengandung pengetian bahwa insan indofarma memberikan yang terbaik dan perhatian pennuh terhadap pelanggan dan stakeholder’s perseoan dengan berorientasi hasil namun tetap mengutamakan proses dan memberikan perhatian penuh terhadap pelanggan.
Commpassionate berarti insan indofarma memiliki rasa peduli terhadap
sesama, yang dijabarkan dalam bentuk :
baik individu, rekan kerja (atasan, bawahan, setingkata), mitra kerja maupun stakeholder’s secara umum.
b) Cooperative sebagai proses, mengandung pengetian bahwa insan indofarma selalu bekerja sama dalam suatu sinergi yang harmonis dengan mengedapankan rasa tanggung jawab dan suasana kekeluargaan.
c) Fairness (keadilan) mengandung pengetian adanya kesetaraan didalam memenuhi hak – hak stakeholder’s yang timbul berdasarkan perjanjian dan peraturan perundang- undangan yng berlaku. Nilai ini diwujudkan dengan meritocracy (sejajar/sama kedudukannya), keterbukaan (saling terbuka) dalam setiap pengambilan keputusan sesuai batasan, ketentuan dan perundangan yang berlaku.
2.4. Kebijakan Mutu Perusahaan
Kebijakan mutu yang ditetapkan oleh perusahaan, yaitu :
1. Mutu dijadikan prioritas utama demi kepuasan pelanggan eksternal maupun internal.
2. Mutu mencakup seluruh kegiatan perusahaan, mulai dari penelitian dan pengembangan, produksi, sampai dengan pemasaran.
3. Mutu dibangun oleh semua pihak melalui perencanaan, pelaksanaan dan pengendalian yang efektif dan efisien.
5. Mutu selalu dijaga dan ditingkatkan sesuai dengan kebutuhan pelanggan dengan memperhatikan kemampuan daya saing melalui proses yang dapat menekan biaya mutu.
2.5 Kedudukan, Fungsi dan Peranan 2.5.1 Kedudukan
Kedudukan atau status PT.Indofarma (Persero) Tbk. adalah sebagai suatu Badan Usaha Milik Negara (BUMN) yang memproduksi obat-obatan penting dan merupakan produsen obat generik berlogo yang terbesar di Indonesia.
2.5.2 Fungsi
PT.Indofarma (Persero) Tbk. sebagai suatu BUMN mempunyai fungsi antara lain sebagai berikut:
1. Menyelenggarakan kemanfaatan umum di bidang farmasi dalam arti yang seluas-luasnya terutama dalam bidang pengadaan produk farmasi yang sangat diperlukan oleh sarana kesehatan pemerintah maupun masyarakat umum. 2. Mendapatkan keuntungan berdasarkan prinsip pengelolaan perusahaan untuk
membiayai serta mengembangkan perusahaan dan untuk disumbangkan bagi pembangunan nasional sesuai dengan kemampuan perusahaan.
2.5.3 Peranan
Peranan PT.Indofarma (Persero) Tbk., antara lain dapat dilihat dari setiap kebijakan yang operasional maupun arah pengembangan perusahaan, yaitu:
menggunakan sebagian besar kapasitas produksinya untuk memproduksi obat essensial.
2. Adanya kebijakan sekaligus motto perusahaan yaitu ”Untuk Kehidupan Yang Lebih Baik”, yang artinya bahwa PT.Indofarma (Persero) Tbk., akan selalu berusaha meningkatkan derajat kesehatan masyarakat menjadi lebih baik. PT.Indofarma (Persero) Tbk., sebagai Badan Usaha Milik Negara membantu memenuhi upaya kesehatan yang bersifat menyeluruh dan terpadu termasuk pemerataan penyediaan obat yang bermutu dengan harga yang terjangkau. 3. PT.Indofarma (Persero) Tbk. menjadi tempat pelatihan tenaga farmasis dan
profesi lain dalam rangka meningkatkan kualitas sumber daya manusia di industri farmasi.
2.6 Lokasi dan Fasilitas Produksi PT.Indofarma (Persero) Tbk.
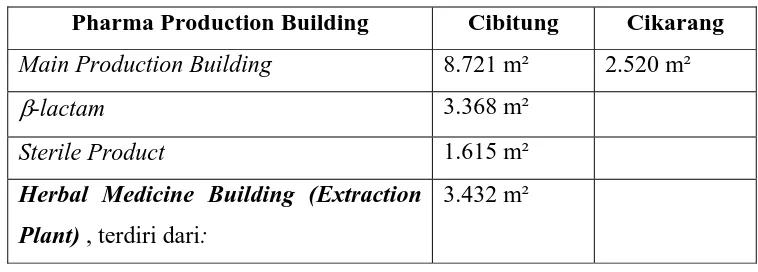
Seluruh fasilitas produksi farmasi dan obat herbal dirancang sesuai konsep CPOB dan dibangun diatas tanah seluas ± 20 hektar di Cibitung, Bekasi, Jawa Barat. Pabrik lainnya yaitu pabrik makanan bayi seluas ± 0,25 hektar di Cikarang.
[image:23.595.121.500.607.743.2]Fasilitas produksi yang tersedia di PT.Indofarma (Persero) Tbk. dijelaskan pada tabel di bawah ini :
Tabel 1. Lokasi dan Fasilitas Produksi PT.Indofarma (Persero) Tbk. Pharma Production Building Cibitung Cikarang Main Production Building 8.721 m² 2.520 m²
β-lactam 3.368 m²
Sterile Product 1.615 m²
Herbal Medicine Building (Extraction
Plant) , terdiri dari:
R & D, QC, Extraction, Formulation, Packaging, Warehouse
Research and development Building 1.326 m²
QC Laboratory 1.020 m² 140 m²
Warehouse 5.346 m² 924 m²
Supporting Facilities , terdiri dari:
Head Office Workshop Untilities
Training an Meeting Hall Others 2.000 m² 360 m² 720 m² 675 m² 3.680 m² 420 m² 42 m² 48 m² 40 m² 2.676 m²
Total 32.254 m² 4.401 m²
2.7 Produk PT.Indofarma (Persero) Tbk
Produk yang dihasilkan oleh PT.Indofarma (Persero) Tbk., antara lain sebagai berikut:
2.7.1 Produk Ethical ( OGB, Lisensi, Nama Dagang )
PT.Indofarma (Persero) Tbk. memproduksi obat generic ethical sebagai produk utama di samping memproduksi obat dengan nama dagang dan lisensi.
Untuk merealisasikan program pemerintah dalam perluasan penyediaan obat bagi masyarakat, PT.Indofarma (Persero) Tbk. mulai memperluas target pasar dengan memproduksi obat branded generic atau nama dagang dengan harga terjangkau.
salut, Ineuron® 3 g/15mL injeksi dan ampul, Infix® 100 mg kapsul, Insetron® 8 mg/4mL injeksi dan ampul, Insetron® 4 mg/4mL injeksi dan ampul, Insetron 8 mg tablet salut, Insetron® 4 mg tablet salut, Inacid® 500 mg tablet, Nausin® 10 mg tablet).
2.7.2 OTC dan Herbal Medicines
Untuk mengembangkan sumber daya alam di Indonesia PT.Indofarma (Persero) Tbk., telah mengembangkan Obat Asli Indonesia (OAI) seperti Prolipid®, Pro Uric® Prorhoid, dan lain–lainnya. Selain itu diproduksi pula makanan kesehatan (supplemen food) seperti Biovision®, Bioprost®, dan lainnya. Obat OTC yang diproduksi antara lain OBH plus®, Proflu®, Ferrolat 200 mg®, Indomaag Suspensi®, Indomaag tablet®, Bioralit®.
2.7.3 Makanan Bayi
Untuk mendukung program pemerintah dalam penanggulangan masalah kekurangan gizi khususnya bagi anak-anak usia dini, diproduksi makanan pendamping ASI. Di samping itu pada tahun 2000 PT.Indofarma (Persero) Tbk. juga mendapat kepercayaan dari WFP (World Food Program) untuk memproduksi makanan sejenis yaitu Delvita®. Selama tahun 2004, PT.Indofarma (Persero) Tbk., telah berhasil mengembangkan dan meluncurkan produk baru Blended food (Protamil rasa mocca, Protamil rasa coklat, Protamil rasa vanilla, Protakid rasa coklat, Protakid rasa vanilla).
2.7.4 Alat Kesehatan
negeri untuk memasarkan dan mendistribusikan alat-alat kesehatan cateter, urin bag, blood bag, disposibble syringe dan lain-lain.
2.8 Penerapan CPOB di PT Indofarma Tbk. A. Manajemen Mutu
Menurut CPOB, industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan manajemen mutu yang didesain secara menyeluruh dan diterapkan secara benar.
Pemastian mutu (Quality Assurance) adalah suatu konsep luas yang mencakup semua hal baik secara tersendiri maupun secara kolektif yang akan mempengaruhi mutu dari obat yang dihasilkan. Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya.
tidak digunakan serta produk yang belum diluluskan tidak dijual atau dipasok sebelum mutunya dinilai dan dinyatakan.
B. Personalia
Ditinjau dari struktur organisasi, PT. Indofarma (Persero) Tbk telah berusaha untuk menerapkan CPOB dalam pelaksanaannya. Hal tersebut dapat dilihat dari pemisahan kepemimpinan antara bagian Produksi dan bagian Pemastian Mutu. Pemisahan tersebut dimaksudkan agar masing-masing bidang dapat menjalankan fungsinya dengan semestinya secara objektif. Dengan adanya pemisahan tersebut diharapkan juga dapat menghasilkan produk (obat) yang memenuhi persyaratan khasiat (efficacy), mutu (quality), dan keamanan (safety).
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Dalam CPOB disebutkan bahwa personal yang dimiliki oleh perusahaan harus memiliki kemampuan, keterampilan dan pengetahuan sesuai dengan tugasnya. Maka dari itu, PT. Indofarma (Persero) Tbk secara rutin melakukan pelatihan dan pendidikan kepada karyawannya untuk meningkatkan pengetahuan dan keterampilan serta meningkatkan produktivitasnya, terutama yang berkaitan dengan CPOB.
C. Bangunan dan Fasilitas
dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil resiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Salah satu syarat rancang bangun dan tata letak ruang menurut CPOB adalah pemisahan bangunan untuk pembuatan obat yang mengandung bahan-bahan beracun, bahan-bahan yang dapat menimbulkan sensitifisasi seperti hormon, bahan sitostatika, dan antibiotik tertentu termasuk sediaan penisilin dan turunannya. Hal tersebut dilakukan untuk mencegah tercampurnya obat atau komponen obat yang berbeda serta menghindari kontaminasi silang dengan produk lain.
D. Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan.
Masing-masing alat dilakukan kalibrasi secara berkala untuk menjamin keseragaman mutu produk dari waktu ke waktu. Setiap alat diberi nomor identitas dan catatan waktu kapan kalibrasi dilaksanakan dan kapan harus dikalibrasi kembali sehingga fungsi alat selalu terkontrol dengan baik.
Setiap mesin produksi memiliki seorang operator yang bertanggung jawab atas kelancaran fungsi mesin. Operator ini sebelumnya ditraining khusus mengenai CPOB dan tanggung jawabnya serta berkoordinasi dengan bagian teknik dalam perawatan mesin tersebut.
Setiap peralatan produksi yang dimiliki oleh PT. Indofarma (Persero) Tbk telah memiliki prosedur tetap yang ditulis dengan rinci untuk pembersihan dan sanitasi peralatan dan prosedur ini diletakkan di ruangan alat itu berada sehingga operator dapat mengerjakan prosedur ini dengan tepat dan benar. Peralatan yang digunakan setelah produksi harus segera dibersihkan baik bagian luar maupun bagian dalam sesuai dengan prosedur tetap yang ada. Sebelum dipakai, kebersihan alat diperiksa lagi untuk memastikan bahwa seluruh produk atau bahan dari batch sebelumnya telah dihilangkan. Setelah proses pembersihan maka operator tersebut harus menulis apa yang sudah dilaksanakan dan catatan ini disimpan sebagai dokumen. Prosedur pembersihan ini secara rutin divalidasi pada periode-periode tertentu sehingga selalu sesuai dengan ketentuan CPOB.
E. Sanitasi dan Higiene
Selama proses produksi berlangsung, para karyawan harus selalu memperhatikan sanitasi dan higiene untuk keamanan diri sendiri dan untuk menjamin perlindungan produk dari pencemaran. Oleh karena itu, sebaiknya karyawan yang berada di ruang produksi harus mengenakan pakaian kerja yang disediakan lengkap dengan topi, masker, sarung tangan dan sepatu karet. Sebaiknya supervisor atau tingkatan yang lebih tinggi senantiasa memperhatikan dan mengawasi serta melakukan pendekatan kepada karyawan agar memakai perlengkapan kerja yang lengkap untuk mencegah kontaminasi dan melindungi karyawan dari bahaya obat yang merupakan racun bagi manusia.
Kebersihan mesin dan peralatan yang akan digunakan dalam proses produksi harus dipastikan baik sebelum maupun sesudah proses produksi dilaksanakan untuk menjamin bahwa mesin atau peralatan terkait sudah terbebas dari bahan-bahan atau produk hasil proses produksi sebelumnya. Untuk itu, maka setiap mesin dan peralatan yang telah dibersihkan diberi label yang menandakan bahwa mesin dan peralatan tersebut sudah dibersihkan dan diperbolehkan kembali untuk pelaksanaan proses produksi.
F. Produksi
Produksi harus dilaksanakan sesuai dengan prosedur yang telah ditetapkan sehingga menghasilkan produk yang memenuhi persyaratan. Proses produksi dilakukan berpedoman pada Perintah Pengolahan (PP) dan Catatan Produksi Bets yang dikeluarkan oleh PPPP, dimana formula dan proses telah divalidasi melalui pelaksanaan trial produksi dari Litbang.
proses produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan yang dapat menjamin dan senantiasa menghasilkan obat jadi yang memenuhi spesifikasi yang ditentukan.
1. Bahan Awal
Mulai dari pemasukan, pengeluaran dan sisa bahan dicatat dalam suatu catatan harian (log book) yang meliputi keterangan mengenai persediaan, nomor batch atau lot, tanggal penerimaan atau pengeluaran, tanggal diluluskan dan
tanggal daluarsa dari suatu bahan awal. Setiap bahan awal sebelum dinyatakan lulus untuk digunakan, dikarantina terlebih dahulu untuk diperiksa oleh bagian pengawasan mutu (Quality Control) agar memenuhi spesifikasi bahan awal yang sudah ditetapkan. Bahan awal yang tidak diluluskan diberi label “DITOLAK”, diletakkan di tempat terpisah, untuk kemudian dikembalikan kepada pemasok atau dimusnahkan.
2. Validasi Proses
PT. Indofarma (Persero) Tbk melakukan validasi seluruh proses produksi yang dilakukan oleh tim validasi dan dilaksanakan sesuai prosedur yang telah ditetapkan serta didokumentasikan dengan baik.
3. Pencegahan Pencemaran Silang
Pencemaran bahan awal atau produk oleh bahan atau produk lain harus dihindarkan. Pencemaran kimiawi atau mikroba terhadap suatu obat mempengaruhi kualitas suatu produk tidak dapat diterima. Resiko pencemaran silang ini dapat timbul akibat tidak terkendalinya debu, gas, uap, percikan atau organisme dari bahan atau produk yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator. Cemaran dapat dicegah dengan cara pembersihan setiap selesai melakukan proses produksi. Dan untuk mencegah kontaminasi silang akibat penggunaan peralatan, maka pada setiap ruangan hanya terdapat satu alat untuk melakukan satu tahapan produksi.
4. Sistem Penomoran Batch atau Lot
Sesuai dengan ketentuan CPOB, PT. Indofarma (Persero) Tbk memiliki sistem penomoran batch yang rinci untuk memastikan bahwa produk antara, produk ruahan atau obat jadi dapat dikenali dengan mengetahui nomor batchnya, dan dengan sistem penomoran tersebut tidak akan terdapat produk lain yang memiliki nomor batch yang sama dan pemberian nomor batch ini selalu segera dicatat dalam buku catatan harian yang mencakup pemberian nomor, identitas produk dan besarnya suatu batch. Seluruh kegiatan produksi selalu mengikuti prosedur yang ditetapkan dalam CPOB sehingga dapat menjamin mutu bahan awal dan produk yang dihasilkan sesuai dengan spesifikasi yang telah ditentukan.
5. Penimbangan dan Penyerahan
produksi dan didokumentasikan secara lengkap. Prosedur penanganan, penimbangan, perhitungan, dan penyerahan bahan baku, bahan pengemas, produk antara dan produk jadi dilakukan sesuai dengan prosedur tertulis. Bahan baku, bahan pengemas, produk antara dan produk jadi yang diserahkan harus telah diluluskan oleh bagian pengawasan mutu.
Sebelum dilakukan penimbangan, pengawas produksi melaksanakan pemeriksaan ulang terhadap kebenaran penandaan bahan baku, termasuk label kelulusan dari bagian pengawasan mutu.
Alat timbang dan alat ukur senantiasa diukur kapasitas, ketepatan, dan ketelitian sebelum digunakan dengan melakukan verifikasi harian sesuai dengan instruksi pada prosedur tertulis. Tempat penimbangan dan penyerahan harus dibersihkan setelah selesai dilakukan kegiatan dengan metode yang sesuai dengan prosedur tertulis. Wadah dan peralatan yang digunakan untuk menimbang harus diperiksa terlebih dahulu kebersihannya oleh pengawas.
6. Pengembalian
Bahan awal, bahan pengemas, produk antara dan produk ruahan yang dikembalikan ke gudang penyimpanan harus diperiksa kebenaran jumlah dan identitasnya oleh bagian IPC (In Process Control). Penyimpanan barang-barang tersebut dilakukan pada kondisi yang sesuai dengan stabilitas bahan.
7. Pengolahan
sediaan dan kode-kode bahan baku. Semua wadah dan peralatan yang berisi produk antara diberi label yang menyatakan tahap pengolahannya dan label tersebut berisi keterangan tentang nama produk, nomor batch, jumlah, tanggal kadaluarsa dan tanggal dilakukannya proses. Semua produk antara dan produk ruahan diberi label yang tepat, bila belum diluluskan oleh bagian pengawasan mutu maka diberi label “KARANTINA” yang berwarna kuning dan setelah diluluskan diberi label “DITERIMA” berwarna hijau.
8. Pengemasan
Semua kegiatan pengemasan dilaksanakan sesuai dengan instruksi yang diberikan dan menggunakan bahan pengemas yang tercantum dalam prosedur pengemasan induk. Rincian pelaksanaan pengemasan dicatat dalam catatan pengemasan batch.
Sebelum prapenandaan dimulai, pengawas memeriksa kebenaran bahan pengemas yang diperlukan, nomor batch, tanggal kadaluarsa, dan informasi lain yang diperlukan. Pengawas melakukan pemeriksaan berdasarkan instruksi pengemasan secara ketat pada tiap tahap proses pengemasan.
9. Pengawasan Selama Proses
Pengawasan dalam proses meliputi pemeriksaan volume atau unit dosis, kebenaran dan kelengkapan isi dari produk yang dikemas serta kesesuaian hasil kemasan dengan spesifikasi yang telah ditentukan dalam prosedur pengemasan induk. Hasil pengujian dan pemeriksaan selama proses dicatat dalam catatan pengemasan batch.
10. Bahan dan Produk yang Ditolak, Dipulihkan, dan Dikembalikan Bahan atau produk dapat diolah ulang atau dipulihkan jika bahan atau produk tersebut memenuhi persyaratan untuk diolah ulang dengan prosedur yang telah ditetapkan dan tidak terjadi perubahan yang berarti terhadap mutu. Prosedur pengolahan ulang tersebut dicatat dan didokumentasikan.
11. Karantina dan Penyerahan Produk Jadi
Setelah bagian pengawasan mutu meluluskan suatu batch, produk jadi dipindahkan dari daerah karantina ke gudang produk jadi .
G. Pengawasan Mutu (Quality Control/QC)
Pengawasan mutu adalah bagian yang esensial dari CPOB untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk.
Pengawasan Mutu (QC) bertugas melakukan pemeriksaan terhadap bahan awal, pengujian mikrobiologi dan In Process Control (IPC) dan melakukan pengujian produk jadi.
1. Seksi pemeriksaan bahan awal
Seksi ini bertanggung jawab atas pemeriksaan kualitas bahan baku dan bahan pengemas yang akan digunakan dalam proses produksi.
2. Seksi pemeriksaan produk jadi
untuk sediaan setengah padat dilakukan pemeriksaan terhadap pH, homogenitas, dan kadar zat aktif.
Pemeriksaan poduk ruahan tablet dilakukan sesuai spesifikasi yang meliputi pemerian tablet, kekerasan tablet, keseragaman bobot, friabilitas dan kadar zat aktif. Selama proses pengisian sediaan cair dilakukan pemeriksaan awal proses dan selama berlangsungnya proses pengisian. Pengisian sediaan cair dilakukan pemeriksaan terhadap volume pengisian dan kejernihan sediaan sedangkan pada pengisian semi solid dilakukan pemeriksaan berupa keseragaman bobot, kualitas lipatan tube dan penandaan kemasan. Pada pengisian serbuk ke dalam sachet dilakukan pemeriksaan keseragaman bobot dalam sachet dan uji kebocoran sachet. Retained sample dimaksudkan untuk pembanding obat jadi yang dipasarkan dan untuk memudahkan penelusura kembali apabila terdapat keluhan terhadap obat jadi yang telah dipasarkan. Sampel diambil setelah selesai proses pengemasan dan diperiksa sesuai spesifikasi yang telah ditetapkan
3. Seksi pemeriksaan mikrobiologi dan IPC
Bagian ini bertugas melakukan pemeriksaan secara mikrobiologi terhadap bahan baku, produk jadi, alat dan ruang produksi, potensi antibiotika serta mengontrol air yang digunakan dalam proses produksi. Seksi ini juga bertanggung jawab terhadap IPC. IPC dilakukan terhadap produk antara dan produk ruahan. H. Inspeksi Diri dan Audit Mutu
(Persero) Tbk. dibentuk komisi khusus CPOB yaitu IQA (Internal Quality Audit) yang bertujuan untuk menilai seluruh kegiatan produksi yang berlangsung agar senantiasa memenuhi persyaratan CPOB dan ISO. Program inspeksi diri dirancang untuk mendeteksi kelemahan-kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan selain itu juga untuk menilai apakah seluruh aspek produksi dan pengendalian mutu selalu memenuhi pedoman CPOB. I. Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan
Produk Kembalian
J. Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi pembuatan obat merupakan bagian dari sistem informasi manajemen yang meliputi spesifikasi, prosedur, metode dan instruksi, perencanaan, pelaksanaan, pengendalian serta evaluasi seluruh rangkaian pembuatan obat. Dokumentasi sangat penting untuk memastikan setiap operator mendapat instruksi secara rinci dan jelas mengenai bidang tugas yang dilaksanakan, sehingga memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan.
dokumen untuk peralatan khusus, prosedur dan catatan inspeksi diri, dan pedoman catatan pelatihan CPOB bagi karyawan. PT. Indofarma Tbk. telah melengkapi semua dokumen yang dipersyaratkan CPOB.
K. Pembuatan dan Analisis berdasarkan Kontrak
Menurut CPOB, pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindaari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat secara jelas menentukan tanggungjawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu).
L. Kualifikasi dan Validasi
Kualifikasi dan validasi menguraikan prinsip kualifikasi dan validasi yang dilakukan di industri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi.
yang dapat mempengaruhi mutu produk harus divalidasi dan direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara.
BAB III
KEGIATAN DI INDUSTRI FARMASI PT. INDOFARMA (Persero) Tbk.
3.1. Keterlibatan Dalam Proses Produksi
Produksi hendaklah dilaksanakan menurut prosedur yang telah ditetapkan,
sehingga dapat menjamin produk yang dihasilkan selalu memenuhi spesifikasi
yang ditentukan. Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan,
hendaklah memenuhi spesifikasi bahan awal yang sudah ditetapkan dan diberi
label dengan nama yang dinyatakan dalam spesifikasi.
Kegiatan produksi PT. Indofarma (Persero) Tbk meliputi sediaan kapsul,
tablet, salep, krim, serbuk, sirup, obat tetes mata dan injeksi. Dan salah satu
proses produksi yang berlangsung adalah tabletting metode cetak langsung
dengan tahapan-tahapan proses produksi sebagai berikut:
a. Penerimaan bahan awal
Dimulai dari penerimaan bahan baku dan bahan pengemas (primer dan
sekunder) dari supplier, yang kemudian dilakukan pemeriksaan oleh petugas dan
ditandatangani oleh manager produksi dan manager QA
b. Pemeriksaan alat-alat dan ruangan untuk proses produksi
Sebelum proses produksi dimulai, maka seluruh peralatan dan ruangan
yang akan digunakan dalam proses produksi sudah benar-benar diperiksa
c. Penimbangan
Proses produksi ini diawali dengan penimbangan bahan baku yang terdiri
dari bahan berkhasiat dan bahan-bahan tambahan (bahan pengisi, bahan pengikat,
bahan pengembang, serta bahan lubrikan) di suatu ruangan khusus penimbangan
yang dilakukan oleh petugas dari gudang bahan baku dan dicek oleh petugas dari
bagian produksi. Penimbangan dilakukan satu persatu sesuai dengan batch record.
d. Pencampuran (Mixing)
- Setelah dilakukan penimbangan, maka dilakukan pencampuran pada
suatu ruangan khusus. Seluruh bahan baku yang terdiri dari bahan berkhasiat dan
bahan-bahan tambahan yang telah ditimbang akan dimixing di ruangan ini.
Sebelum melakukan mixing maka seluruh ruangan yang telah diperiksa
sebelumnya, harus dalam keadaan bersih dan bebas dari sisa produk sebelumnya.
Di dalam poses pencampuran ini, dilakukan pencatatan berapa hasil yang
diperoleh, kapan dilaksanakan setiap tahapan pencampuran dan ditandatangani
oleh petugas yang bertanggung jawab.
e. Pencetakan
Setelah release dari QC, maka dilakukan pencetakan tablet dengan
menggunakan mesin cetak di ruang pencetakan. Sebelum memulai pencetakan,
ruangan diperiksa terlebih dahulu. Harus bersih dan bebas dari produk
sebelumnya. Tablet ditampung dalam suatu kontainer dan dilakukan
pengambilan sampel untuk pemeriksaan oleh bagian QC. Sambil menunggu
telah memenuhi syarat sesuai dengan monografinya maka tablet akan release
dari QC.
f. Pengemasan
Sebelum dilakukan pengemasan primer, maka ruangan diperiksa terlebih
dahulu. Harus bersih dan bebas dari sisa produk sebelumnya. Hasil stripping
ditampung dalam container bertutup, lalu ditimbang dan dihitung hasilnya.
Sambil menunggu pelulusan dari pihak QC maka tablet yang telah distrip
disimpan di dalam ruang karantina. Setelah diperoleh pelulusan dari bagian QC,
maka dilanjutkan ke pengemasan sekunder berupa kotak obat dan diberi brosur
tablet. Proses pengemasan sekunder ini dilakukan secara manual. Hasil
pengemasan disimpan di Ruang Karantina Produk Jadi untuk menunggu
diluluskan oleh bagian QC sebelum dikirim ke gudang produk jadi. Dan setelah
mendapat release dari bagian QC maka label karantina yang terdapat pada
produk diganti dengan label release, dan produk akhir dikirim ke gudang
produk jadi untuk menunggu pendistribusian selanjutnya.
3.2. Tinjauan Kebagian-bagian Lain
3.2.1 Direktorat Keuangan dan Sumber Daya Manusia
Pada Direktorat Keuangan dan Sumber Daya Manusia, terdapat 6 bidang
yang masing-masing bidang dipimpin oleh seorang manajer, yaitu :
a. Bidang Teknologi Informasi
Bidang Teknologi Informasi bertanggung jawab dalam penyelenggaraan
sistem pengolahan data berbasis teknologi informasi, pengembangan aplikasi
Mulai tahun 2003 PT. Indofarma Tbk. memakai sistem ERP (Enterprise
Resourt Planning), dimana semua data terintegrasi dalam satu sistem sehingga
memudahkan dalam koordinasi dengan berbagai bidang dalam perusahaan.
b. Bidang Akuntansi
Bidang Akuntansi bertugas dalam hal verifikasi pengeluaran, pencatatan
transaksi keuangan, perhitungan harga pokok produksi, dan budgeting.
c. Bidang Keuangan
Bidang Keuangan bertanggungjawab dalam pengendalian Pajak dan
Asuransi, serta Treasury.
d. Bidang Rendal Keuangan
Bidang Rendal Keuangan bertanggung jawab dalam pengendalian
anggaran dan pelaporan manajemen.
e. Bidang SDM
Berdasarkan data bidang SDM, karyawan PT. Indofarma (Persero) Tbk.
baik karyawan tetap maupun karyawan ikatan kerja waktu tertentu (IKWT)
jumlahnya adalah lebih dari 900 orang. Perusahaan mempunyai program
pelatihan kerja yang teratur dalam bentuk seminar, kursus, pengiriman
karyawan berprestasi ke perguruan tinggi terbaik di dalam dan di luar negeri.
Bidang SDM ini menangani tentang Industrial Relation, People Development,
HR System, Compensation & Benefits
f. Bidang Office Support
Bidang ini bertanggungjawab dalam pelayanan operasional, pelayanan
Bagian ini meliputi : kopama, poliklinik dan apotek, program kemitraan
dan bina lingkungan (PKBL), dan keselamatan dan kesehatan kerja dan
analisis mengenai dampak lingkungan (K3 dan Amdal). LK3 langsung
bertanggung jawab kepada Direktur Utama. Diperlukan kewaspadaan terhadap
keselamatan kerja dan kesehatan kerja serta menganalisis dampak lingkungan
di lingkungan kerja, sehingga kecelakaan dalam kerja bisa dihindarkan atau
diminimalkan. Dalam upaya untuk mewujudkan hal tersebut maka dibutuhkan
suatu tindakan-tindakan nyata untuk menciptakan kondisi kerja yang aman
dan sehat yang jauh dari kemungkinan-kemungkinan buruk yang akan terjadi.
Bidang ini juga bertanggung jawab atas penyediaan kebutuhan sarana
produksi yang meliputi listrik, sistem pengaturan udara dan air. Untuk
mendukung proses produksi PT. Indofarma Tbk. menggunakan sumber
kelistrikan dari PLN dan generator milik PT. Indofarma Tbk., sistem AHU
untuk pengaturan udara, sistem pengolahan air (Water treatment), laundry,
dan Instalasi Pengolahan Air Limbah (IPAL). Selain itu bidang ini juga
membawahi bidang utilities, perawatan dan pemeliharaan, tata udara, air dan
listrik .
1) Sistem Pengolahan Air
PT. Indofarma mempunyai lima sumur artesis sebagai sumber air.
Kelima sumur tersebut memiliki kedalaman +150 m, air melalui proses
wats treatment. Air ini digunakan untuk seluruh kegiatan di industri
2) Sistem Air Handling Unit (AHU)
Sistem AHU adalah suatu sistem pengendalian udara yang masuk
dan keluar ruangan produksi. Sistem ini mengatur suhu, tekanan,
kelembaban dan kebersihan udara. Sistem ini berfungsi :
a) Mencegah kontaminasi dalam proses pembuatan obat
b) Mengatur tekanan, suhu dan kelembaban relatif ruangan
3) Instalasi Pengolahan Limbah (IPAL)
Limbah yang dihasilkan oleh PT. Indofarma berupa limbah cair,
padat dan gas. Untuk menjaga kelestarian lingkungan maka limbah
tersebut harus ditangani dengan sebaik-baiknya. IPAL berfungsi untuk
mencegah pencemaran lingkungan oleh produksi. Berikut penanganan
limbah berdasarkan jenisnya :
a) Limbah Padat
Limbah padat berupa drum-drum kosong, tong-tong plastik, kertas,
karton bekas, kayu-kayu bekas, powder hasil tangkapan dust collector
engine, filter yang kotor, botol-botol pecah, dan lain-lain. Sebelum
dimasukkan dalam proses selanjutnya limbah tersebut dipilah-pilah,
sebagian dibakar di incenerator dan didaur ulang oleh pihak kedua diluar
pabrik. Pihak luar tersebut adalah PPLI (Perusahaan Pamunah limbah
Industri). Pihak luar yang legal adalah suatu perusahaan/institusi yang
telah mendapat izin dari Kementriaan Lingkungan Hidup, misalnya Dinas
Kebersihan Bagian Pengelolaan Limbah B3 DKI dan PPLI yang berlokasi
limbah padat yang sudah terkontaminasi dengan bahan baku atau proses
produksi, seperti plastik, karton, kemasan primer dan sebagainya. Limbah
padat yang masih dapat didaur ulang diserahkan penanganannya pada
koperasi pegawai Indofarma.
b) Limbah Cair
Untuk menangani limbah cair di Indofarma dipisah atas 3 bagian,
yaitu :
i. Sewer System Instalation
Upaya pengolahan limbah cair yang telah dilakukan ialah
dengan memisahkan saluran pembuangan, antara buangan produksi
dengan limbah cair dari sanitasi/domestik dan air hujan, sehingga
masing-masing menempati satu saluran khusus.
Untuk limbah cair yang berasal dari pencucian alat-alat dan
ruang produksi obat, sisa produksi dan sisa pereaksi kimia pada
kegiatan QC yang mengandung zat-zat yang bersifat toksik dan
mengandung antibiotik dialirkan melalui saluran khusus sebelum
diolah pada satu unit IPAL.
Khusus untuk produksi -laktam sebelum dialirkan ke IPAL,
dilakukan pre-threatment terlebih dahulu yang meliputi :
1. Air cucian mesin dari proses produksi -laktam dikumpulkan
pada drum yang telah disediakan.
2. Dilakukan penambahan NaOH sambil diaduk sampai diperoleh
3. Larutan tersebut didiamkan selama 2x24 jam.
4. Kemudian pada larutan diatas ditambahkan H2SO4 sambil
dikocok sampai diperoleh pH netral.
5. Larutan dengan pH netral tersebut dialirkan ker saluran limbah
yang telah disediakan menuju IPAL.
ii. Sanitary System Instalation (Saluran Air Limbah Rumah Tangga)
Air yang berasal dari kamar mandi termasuk kloset
dimasukkan kedalam septic tank untuk mengendapkan kotoran
yang berupa partikel padat dan airnya dialirkan kerembesan yang
terletak di belakang pabrik.
iii. Drainase System Instalation (Saluran Air Hujan)
Air hujan yang turun di lokasi pabrik dialirkan melalui
inspection fit agar partikel padatnya, seperti tanah, pasir dan
lumpur dapat tertampung, sebelum air tersebut dialirkan ke sungai
kebelakang pabrik.
c) Limbah Gas
Upaya pengelolaan yang dilakukan untuk menangani limbah gas dan
partikulat dari hasil pembakaran solar diboiler ialah dengan menyalurkan
melalui ceroobong asap sebanyak 2 buah. Untuk gas buang dan partiker
hasil pembakaran sebuah obat dilakukan upaya pengelolaan pada
incenerator menggunakan satu buah burner (alat pembakar). Temperatur
pembakaran dikontrol dengan pengaturan laju limbah konstan dan diatur
berdasarkan laju alir limbah, kemudian aliran gas diemisi kan ke udar luar
melalui cerobong gas yang mempunyai ketinggian 7 m dari permukaan
tanah, dengan suhu burner 500-600 °C dan suhu cerobong sekitar 350 °C.
Suhu pembakaran dapat mencapai 900 °C. Pengelolaan debu yang timbul
pada pembuatan obat jadi dilakukan melalui sistem AHU. Pada prinsipnya
sistem ini mengatur sirkulasi udara disetiap ruangan produksi melalui
fan-fan yang dapat menyedot debu-debu yang berterbangan untuk dipisahkan
atau disaring dalam beberapa konteplar dust box yang terletak diruangan
teratas dari berbagai macam serbuk obat ditampung dalam
kantong-kantong plastik sebelum dibakar pada unit incenerator. Khusus untuk debu
yang berasal dari -laktam dilakukan penyaringan debu dalam ruangan
tersendiri. Udara hasil penyedotan dibuang ke udara bebas melaui
cerobong dengan ketinggian 2 m dari atap.
Bidang usaha dari PT. Indofarma Tbk. adalah menufaktur (produk
farmasi dan herbal, serta makanan bayi), toll manufacturing, dan distribusi
(produk farmasi dan alat kesehatan). Sumber pendapatan PT. Indofarma Tbk.
berasal dari penjualan produk sendiri dan produk pihak lain, penjualan jasa
toll manufacturing, serta hasil investasi dan jasa giro.
3.2.2 Direktorat Pemasaran dan Umum
Bidang ini menangani Pemasaran Ethikal, Pemasaran OTC, Bussines
Reguler, Bussines Institusi, dan Procurement.
PT. Indofarma Tbk. memproduksi obat generik berlogo, nama dagang,
ditujukan terutama untuk kalangan menengah ke bawah dan mempunyai pangsa
pasar yang cukup besar yaitu 80% dari jumlah penduduk di Indonesia.
Unsur-unsur pemasaran yang meliputi produk, harga, promosi dan
personalia harus diperhatikan untuk memperoleh strategi yang paling tepat dalam
kebijakan yang diambil di bidang pemasaran. Dari segi produk, PT. Indofarma
(Persero) Tbk. menghasilkan obat sangat essensial bagi pola penyakit yang
sekarang ada di Indonesia. PT. Indofarma (Persero) Tbk. memproduksi obat
dalam skala besar yang memungkinkan dapat menurunkan biaya produksi
sehingga harga jual dapat ditekan.
Kondisi pangsa pasar obat generik di Indonesia (6,8%) memang sangat jauh
berada di bawah negara di luar negeri seperti Amerika (35%), Kanada (15%), dan
Inggris (30%). Hal ini disebabkan karena dianggap obat generik adalah obat
rakyat yang murahan sehingga kurang bermutu. Kesalahpahaman ini terjadi
karena pada awal pengenalan obat generik kepada masyarakat dikatakan bahwa
obat generik adalah obat murah untuk rakyat. Oleh karena itu, hingga sekarang
kesan yang timbul adalah bahwa obat generik kurang bermutu. Untuk mengatasi
hal ini, PT Indofarma (Persero) Tbk. berusaha memasyarakatkan obat generik
bermutu namun terjangkau harganya melalui upaya-upaya pemasaran misalnya
melalui promosi sosial (Social Promotion). PT Indofarma (Persero) Tbk. adalah
satu-satunya perusahaan farmasi yang mempunyai Medical Sales Representative
untuk obat generik.
a. Bidang Pemasaran Institusi (Bussines Institusi)
Bidang Pemasaran Institusi berada dibawah Direktur Pemasaran dan
Umum, dipimpin oleh Manager Pemasaran Institusi. Pada awalnya pendirian
PT. Indofarma Tbk. bertujuan untuk membantu pemerintah dalam
meningkatkan kesejahteraan masyarakat di bidang kesehatan, yaitu dengan
memproduksi obat-obat essensial untuk Rumah Sakit Pemerintah dan
Puskesmas. Sampai saat ini PT. Indofarma Tbk. masih memproduksi
obat-obat tersebut sehingga obat-obat tersedia dalam jumlah yang cukup sesuai dengan
kebutuhan masyarakat.
Adanya kasus flu burung yang merebak diberbagai wilayah di
Indonesia, pemerintah bekerjasama dengan PT. Indofarma Tbk untuk
memproduksi Oseltamivir generik yang saat ini merupakan satu-satunya obat
yang diakui WHO sebagai obat pilihan untuk penyakit flu burung. Bidang
Pemasaran Institusi bertugas untuk memasarkan, memantau, dan memastikan
ketersediaan obat-obat produksi PT. Indofarma Tbk. di Puskesmas dan
Rumah Sakit Pemerintah.
Bussines Institusi dibagi menjadi dua bagian, yaitu Institusi Wilayah
Barat dan Institusi Wilayah Timur.
b. Bidang Pemasaran Ethikal
Bidang Pemasaran Ethikal berada dibawah Direktur Pemasaran dan
Ethikal adalah obat keras yang penyerahannya dengan resep dokter.
Pemasaran Ethikal dibagi menjadi dua seksi, yaitu Seksi Penjualan dan Seksi
Produk.
Divisi Ethikal dipimpin oleh dua Manager yaitu Sales Manager dan
Product Manager. Sales Manager bertugas untuk mengelola anak buahnya
(Medical Representatif) agar dapat mencapai target pemasaran perusahaan
yang telah ditetapkan. Sedangkan Product Manager bertugas untuk membuat
strategi pemasaran agar perusahaan dapat mencapai sasaran yang telah
ditetapkan.
c. Bidang Procurement (Pengadaan)
Pengadaan dihadapkan pada dua hal yang berbeda, yaitu mutu dan harga.
Dapat dikatakan bahwa mutu hasil produksi dapat tergantung pada mutu
bahan awalnya. Demikian pula mengenai harga jual produk sangat
dipengaruhi oleh harga bahan baku. Pada umumnya mutu dan harga
berbanding lurus, mutu bahan awal yang baik akan mempunyai harga yang
tinggi. Dengan demikian menjadi suatu tantangan untuk mendapatkan bahan
bermutu baik dengan harga relatif rendah. Terlebih lagi bagi Indofarma yang
mengemban misi sebagai produsen utama Obat Generik Berlogo yang
ditujukan untuk konsumsi masyarakat luas. Bidang Pengadaan melayani
permintaan bahan farmasi dan non farmasi yang sangat kompleks. Oleh
karena itu, tanpa adanya spesifikasi yang jelas, prosedur dan sistem
administrasi yang baik maka akan sulit mencapai hasil yang diinginkan.
Seksi Pengadaan Bahan II. Seksi Pengadaan Bahan I bertugas mengadakan
barang lokal maupun impor, yaitu bahan baku, bahan penolong, dan
bahan-bahan lain. Seksi Pengadaan Bahan II bertugas mengadakan barang umum
non farmasi seperti peralatan laboratorium, produksi, peralatan umum, ATK
(Alat Tulis Kantor), dan lain-lain.
d. Bidang Pemasaran OTC
Bidang Pemasaran OTC berada dibawah Direktur Pemasaran dan Umum
yang dipimpin oleh Manager Pemasaran OTC. Bidang Pemasaran OTC
bertugas untuk menginformasikan produk OTC yang di produksi PT.
Indofarma Tbk. kepada konsumen antara lain obat bebas dengan nama
dagang, obat herbal, dan MP-ASI.
e. Bidang Bussines Reguler
Bidang ini terbagi menjadi dua bagian, yaitu Logistik Produk jadi serta
CRM dan Database yang masing-masing bagian dipimpin oleh seorang
Asisten Manager.
Bidang Bussines Reguler berada di bawah Direktur Pemasaran dan
Umum yang dipimpin oleh Manager Bussines Reguler. Logistik Produk Jadi
yang telah dikemas dalam kemasan tersier (karton) akan diserahkan oleh
bagian pengemasan ke gudang produk jadi disertai Bukti Penyerahan Produk
Jadi (BPPJ). Di Gudang, produk jadi yang telah dikemas dalam karton
tersebut akan dikarantina untuk diperiksa secara random tentang kelengkapan
didistribusikan dan diambil contoh pertinggal untuk tiap batchnya sebagai
bahan penelusuran apabila ada keluhan/komplain di kemudian hari.
3.2.3 Direktorat Produksi
Direktorat Produksi PT. Indofarma (Persero) Tbk. membawahi bidang
sebagai berikut : Bidang Produksi I (seksi solid I, seksi solid II, dan seksi
pengemasan), Bidang Produksi II (seksi beta laktam, seksi salep, sirup, dan serbuk
/semi solid SSS, dan seksi steril), Bidang Produksi Herbal dan Makanan Bayi,
Bidang Litbang, Bidang Teknik dan Pemeliharaan, Bidang Quality Assurance,
Bidang Quality Control, Bidang Perencanaan dan Pengendalian Produksi dan
Persediaan (PPPP) dan Bidang Logistik Bahan Awal. Masing-masing bidang
dikepalai oleh seorang manajer.
a. Bidang Produksi I
Bidang produksi I dipimpin oleh Manager produksi I, yang membawahi
3 seksi yaitu seksi solid I, solid II, dan pengemasan. Produksi I meliputi
sediaan tablet dan kapsul non -laktam. Seksi solid I mengawasi proses mulai
dari dispensing sampai produk antara (pembuatan massa tablet). Seksi solid II
mengawasi proses mulai dari produk antara sampai menjadi produk ruah yang
siap dikemas (pencetakan tablet / filling kapsul). Seksi pengemasan
mengawasi proses pengemasan sampai menjadi produk jadi yang diserahkan
ke bagian gudang produk jadi untuk didistribusikan.
b. Bidang Produksi II
Bidang Produksi II dipimpin oleh seorang manager produksi. Bidang ini
Seksi Produksi Steril. Bidang produksi II berfungsi merencanakan,
mengkoordinasikan, dan mengendalikan produksi salep, sirup, serbuk,
betalaktam dan steril.
c. Bidang Herbal dan Makanan Pendamping ASI (MP-ASI)
PT. Indofarma (Persero) Tbk. Mendirikan Extract Center yang khusus
memproduksi obat tradisional. Extract Center ini kemudian disebut Bidang
Herbal yang dipimpin oleh seorang manajer. Manajer ini membawahi dua
seksi, yaitu :
1) Seksi Ekstraksi, melakukan penyiapan nabati (penyortiran, pencucian
dan pengeringan) sampai dengan proses ekstraksi.
2) Seksi Formulasi, melakukan pencampuran, proses pengolahan sampai
dengan pengemasan produk.
Produksi Herbal memproduksi obat-obat tradisional yang bahan bakunya
dapat berasal dari dalam negeri ataupun luar negeri. Obat tradisional yang
bahan bakunya berasal dari dalam negeri nama produk berawal “Pro”,
misalnya Prolipid, Prouric, Proasi, dan prodiab. Sedangkan obat tradisional
yang bahan bakunya berasal dari luar negeri nama produknya berawal “Bio”,
misalnya Bioginko, Biovision, Bioprost.
Untuk mendukung program pemerintah dalam penanggulangan
kekurangan gizi khususnya bagi anak-anak pada usia dini, PT. Indofarma
(Persero) Tbk. memproduksi Makanan Pendamping ASI (MP-ASI). Bidang
Produksi Makanan (MP-ASI) dipimpin oleh seorang manajer. Pabrik
dengan peralatan modern. Bidang ini memproduksi makanan tambahan
pendamping Air Susu Ibu atau MP-ASI.
d. Bidang Penelitian dan Pengembangan (Litbang) Produk
Bangunan pengembangan produk PT. Indofarma (Persero) Tbk.
merupakan unit fungsional yang berkedudukan di bawah Direktur Produksi.
Bagian ini dipimpin oleh seorang manajer (apoteker). Bagian pengembangan
produk bertugas meneliti dan mengembangkan produk serta mengoptimasi
proses sesuai dengan CPOB.
Kegiatan lainnya adalah membuat publikasi ilmiah dengan mengatur
perpustakaan. Bagian pengembangan produk harus mengembangkan
produk-produk baru, sehingga dapat dipertimbangkan oleh direksi.
Dalam melaksanakan tugasnya, bagian ini dibagi menjadi lima seksi,
yaitu:
1) Seksi Formulasi
Seksi ini bertugas menyiapkan formula dan proses pembuatan obat
baru, medesain formula, merancang metode pembuatan,
pengembangan bahan substitusi dan reformulasi atau reproses.
2) Seksi Metode Analisa
Tugas-tugas seksi ini adalah Memilih dan mempersiapkan
metode analisis untuk bahan aktif, bahan baku penolong, produk
ruahan dan IPC, yang prosedurnya mengacu pada CPOB. Metode
tersebut harus mempunyai ketepatan, ketelitian yang tinggi, sama atau
peralatan dan reagensia yang efisiensinya lebih tinggi. Penelitian
stabilitas produk terutama dilakukan untuk produk baru dan produk
reformulasi. Uji stabilitas produk dapat dilakukan pada suhu kamar
maupun pada suhu lingkungan/ udara.
3) Seksi Registrasi
Seluruh bagian pengembangan produk bekerja sama menyiapkan
data registrasi obat ke Badan Pengawas Obat dan Makanan (BPOM).
4) Seksi Herbal dan Makanan Bayi
Seksi ini bertugas menyiapkan formula dan proses pembuatan
produk baru sediaan herbal dan makanan, medesain formula,
merancang metode pembuatan, pengembangan bahan substitusi dan
reformulasi atau reproses.
5) Pengembangan Kemasan.
e. Bidang Teknik dan Pemeliharaan
Bidang Teknik PT. Indofarma (Persero) Tbk. melakukan pengawasan
dan pemeliharaan terhadap semua fasilitas dan peralatan pabrik untuk menjaga
kelancaran proses produksi. Bidang teknik ini berperan dalam memperbaiki,
merawat atau merekayasa mesin peralatan produksi, peralatan laboratorium,
peralatan kantor dan alat-alat telekomunikasi.
Secara struktural Bidang Teknik dan Pemeliharaan berada di bawah
Direktur Produksi yang dipimpin oleh seorang manager yang membawahi
1) Seksi Pemeliharaan yang menangani perawatan dan perbaikan
mesin-mesin produksi
2) Seksi Perencanaan, Evaluasi dan Workshop, merupakan bagian yang
bertanggung jawab dalam menunjang kegiatan Seksi Pemeliharaan.
3) Seksi Rekayasa (Indomach), merupakan bagian yang bertanggung
jawab dalam pembuatan alat dan modifikasi/pengembangan
rancangan.
4) Seksi Utilities.
f. Perencanaan dan Pengendalian Produksi dan Persediaan (PPPP)
Bidang Perencanaan Pengendalian Produksi dan Persediaan (PPPP)
mempunyai peranan strategis dalam peningkatan efisiensi dan produktifitas,
proses pabrikasi, pengendalian persediaan dan stok sehingga diharapkan
produk yang dihasilkan tetap terjaga secara ekonomis.
Fungsi bidang PPPP adalah menyusun perencanaan dan pengendalian
produksi dan persediaan, serta sebagai sumber informasi yang berkaitan
dengan produksi dan persediaan. Penyusunan ini dimaksudkan agar produk
yang dihasilkan tetap dapat memenuhi permintaan pasar, tetapi persediaan
barang tidak terlalu tinggi.
g. Bidang Quality Assurance
Tugas dan tanggung jawab bidang Quality Assurance :
a. Mengelola dan mengembangkan manajemen pemastian sistem mutu
b. Berperan aktif dalam melaksanakan program validasi, dimulai dari
pembuatan protokol validasi hingga proses validasi, kualifikasi, dan
kalibrasi bekerja sama dengan Bidang Litbang Produk.
c. Pengelolaan Self Inspection (ISO dan GMP)
d. Pengelolaan dan perencanaan training mutu.
Quality Assurance adalah tindakan pembuktian bahwa sistem yang
mendukung proses produksi telah sesuai dengan yang ditetapkan.
Pengendalian sistem meliputi pengendalian penerapan sistem CPOB dan
penerapan ISO. Proses validasi penting dilakukan agar dapat menghasilkan
produk berkualitas. Validasi dilakukan terhadap bahan baku, alat, prosedur,
lingkungan, sistem penunjang, manusia, metode analisa dan spesifikasinya.
Bidang Quality Assurance terdiri dari tiga seksi :
1) Seksi kalibrasi dan validasi
Seksi validasi dan kalibrasi bertugas untuk mengaudit metode validasi
& kalibrasi baik peralatan maupun bangunan sehingga proses produksi
berjalan dengan lancar.
2) Seksi pengendalian sistem
Seksi pengendalian sistem bertugas untuk mengaudit sistem atau
metode produksi yang digunakan di PT Indofarma (Persero) Tbk.
3) Seksi Pengendalian Proses dan Evaluasi Pasca Produksi
Evaluasi pasca produksi memiliki tugas, evaluasi produk yang telah
penanganan klaim, evaluasi change control dan Catatan Penyimpangan
Produksi (CPP), serta evaluasi batch record.
h. Bidang Quality Control
Bidang Quality Control merupakan bidang baru dalam struktur
organisasi PT. Indofarma (Persero) Tbk.Bidang ini berada di bawah Direktur
Produksi dengan tugas utamanya berkaitan dengan pemeriksaan Bahan Awal,
Pengujian Mikrobiologi & IPC dan Pengujian Produk Jadi..
Bidang Quality control merupakan bidang terpenting dari proses
produksi, yang bertanggung jawab terhadap mutu dari bahan baku sampai
dihasilkan obat jadi dan melakukan evaluasi terhadap contoh pertinggal
(retained sample). Secara sederhana dapat dikatakan bahwa Bidang ini bekerja
sebelum, selama dan setelah proses produksi. Oleh karena itu, Bidang ini juga
mempunyai beberapa seksi, yaitu Seksi Pemeriksaan Bahan Awal, Seksi
Pengujian Produk Jadi, Seksi Pengujian Mikrobiologi.
i. Bidang Logistik Bahan Awal
Kedudukan Bidang Logistik Bahan Awal berada di bawah Direktur
Produksi, dipimpin oleh seorang manajer. Bidang Logistik Bahan Awal dibagi
menjadi 3 divisi, yaitu : Divisi bahan baku dan Adm Gudang, Divisi bahan
pengemas dan Spare Part dan Divisi dispensing. Kegiatan utama dari bidang
penyimpanan adalah penerimaan barang, penyimpanan barang, pengeluaran
barang dan sistem komputer. Gudang penyimpanan terbagi menjadi empat
a) Gudang utama yaitu gudang berkondisi suhu kamar, digunakan
untuk menyimpan bahan-bahan yang relatif stabil pada suhu
tersebut. Gudang ini meliputi gudang bahan baku, pengemas,
penolong, alat tulis, spare part dan perlengkapan, etiket, ruang
penimbangan dan karantina.
b) Gudang bersuhu dingin yaitu gudang bersuhu 18-220 C berada di
dalam gudang utama, digunakan untuk menyimpan barang-barang
yang tidak stabil pada suhu kamar, contoh : vitamin, hormon,
antibiotik, bahan pengemas (aluminium foil) dan lain-lain.
c) Gudang β-laktam dimana gudang ini terletak dalam satu bangunan
yang terpisah dari gudang utama. Ruangan bersuhu 29-300 C.
Gudang ini khusus digunakan untuk menyimpan antibiotik
golongan β-laktam seperti penisilin, ampisilin, amoksisilin dan
lain–lain.
d) Gudang solven yaitu gudang yang berlokasi di luar gudang utama
ini khusus digunakan untuk menyimpan bahan-bahan yang mudah
terbakar dan korosif seperti alkohol, methanol, metilen klorida dan
lain-lain.
Dokumen untuk penerimaan bahan awal yaitu, berupa SP untuk
bahan baku dari dalam negeri, LC (Letter Of Credit) untuk bahan baku
import dan DO (Delivery Order surat dari supplier). Sedangkan untuk
dokumen produk jadi yaitu BPPJ (Bukti Penyerahan Produk Jadi).
meliputi nama barang, nomor bets, jumlah kemasan, keadaan kemasan,
tanggal kadaluwarsa,