LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. Kimia Farma (Persero) Tbk.
Plant Bandung
Disusun Oleh:
Riza Fahlevi Wakidi, S. Farm. Nim: 073202155
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji syukur kami panjatkan kepada Allah SWT atas limpahan rahmat dan karunia-Nya sehingga Praktek Kerja Profesi (PKP) di industri farmasi PT. Kimia Farma (Persero) Tbk. Plant Bandung dapat berjalan dengan baik.
PT. Kimia Farma Plant Bandung bagian dari PT. Kimia Farma (Persero) Tbk. merupakan salah satu industri farmasi BUMN yang mempunyai komitmen terhadap mutu. Seluruh proses produksi tidak hanya telah diakui oleh pemerintah dengan diberikannya sertifikat CPOB tetapi juga telah memperoleh sertifikat ISO 9001 versi 2000 yang merupakan pengakuan internasional atas dijalankannya sistem manajemen mutu yang dari penerapannya diharapkan terwujud suatu produk yang bermutu.
Penyusunan laporan Praktek Kerja Profesi ini merupakan salah satu syarat untuk memperoleh gelar apoteker di Fakultas Farmasi Universitas Sumatera Utara, Medan. Pelaksanaan PKP ini berlangsung sejak tanggal 13 Oktober – 28 November 2008. Dalam menjalankan Praktek Kerja Profesi, banyak pihak yang membantu dan membimbing kami dalam melaksanakan PKP tersebut. Pada kesempatan ini, kami memberikan penghargaan dan ucapan terima kasih kepada: 1. Bapak Prof. Dr. Sumadio Hadisahputra., Apt. selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara, Medan.
3. Bapak Drs. Abdullah Basuki, Apt. selaku Plant Manager PT. Kimia Farma (Persero) Tbk Plant Bandung yang telah memberikan kesempatan mengizinkan Plant Bandung sebagai tempat Praktek Kerja Lapangan.
4. Ibu Dra. Wartiyas Tuti, Apt. selaku pembimbing dari PT. Kimia Farma (Persero) Tbk Plant Bandung yang telah memberikan bimbingan, arahan, dan pengetahuan selama pelaksanaan Praktek Kerja Lapangan.
5. Bapak Drs. Yanyan Solehuddin, Apt. yang banyak memberikan bimbingan dalam menyelesaikan tugas khusus.
6. Semua Manager, Asisten Manager beserta staf dan karyawan PT. Kimia Farma (Persero) Tbk. Plant Bandung, khususnya bagian Produksi I: Pak Sony, Pak Ade, Pak Supandi, dan Pak Wawan yang telah membimbing dan membantu kami selama menjalankan Praktek kerja Lapangan.
7. Seluruh dosen Fakultas Farmasi dan Program Profesi apoteker Universitas Sumatera Utara Medan yang telah memberikan ilmu pengetahuan bagi kami. 8. Kedua orang tua atas semangat, bantuan moril dan materil yang tak ternilai. 9. Teman senasib seperjuangan Peppi dan Aulia (UNPAD Bandung), Wati dan
Radis (UGM Yogyakarta), Sherly dan Yuli (UBAYA Surabaya), Veny dan Tyas (UNAIR Surabaya), Mas Kobo dan Adhi (SADAR Yogyakarta), atas kerja sama dalam Praktek Kerja Profesi ini.
Sepenuhnya kami menyadari bahwa penyusunan laporan Praktek Kerja Profesi ini masih terdapat banyak kekurangan sehingga masih banyak memerlukan perbaikan - perbaikan. Karena itu kami sangat mengharapkan kritik dan saran yang membangun demi kebaikan bersama.
Akhir kata, semoga laporan Praktek Kerja Profesi ini dapat bermanfaat dan menambah pengetahuan bagi pembaca serta bermanfaat bagi perkembangan industri farmasi.
Bandung, November 2008
DAFTAR ISI
Lembar Pengesahan ... ii
Kata Pengantar ... iii
Daftar Isi ... vi
Daftar Gambar... viii
Daftar Tabel ... ix
Ringkasan... x
BAB I Pendahuluan ... 1
1.1Latar Belakang... 1
1.2Tujuan ... 3
BAB II Tinjauan Tentang PT. Kimia Farma (Persero) Tbk. ... 4
2.1 Sejarah PT. Kimia Farma (Persero) Tbk... 4
2.2 Struktur Organisasi ... 7
2.3 Tinjauan Umum P.T. Kimia Farma ... 9
BAB III Kegiatan Praktek Kerja Profesi di PT. Kimia Farma (Persero) Tbk Plant Bandung ... 12
3.1 Umum dan Personalia ... 14
3.2 Bagian PPPI ... 16
3.3 Bagian Pembelian... 20
3.4 Bagian Produksi... 26
3.4.1 Bagian Produksi I ... 29
3.4.2 Bagian Produksi II ... 35
3.4.2.1 Produksi Serbuk Oralit ... 35
3.4.2.2 Produksi Sirup ... 37
3.4.2.3 Produksi Suspensi... 39
3.4.2.4 Produksi Fitofarmaka ... 42
3.4.2.5 Pembuatan Aqua Demineralisata ... 44
3.4.3.1 Tablet Hormon... 46
3.4.3.2 Alat Kontrasepsi Dalam Rahim (AKDR).... 52
3.4.3.3 Produksi Kina ... 55
3.5 Bagian Teknik dan Pemeliharaan ... 57
3.6 Bagian Gudang ... 59
3.7 Bagian Pengelolaan Mutu... 63
3.7.1 Bagian Pemastian Mutu... 64
3.7.2 Bagian Laboratorium Pengujian... 69
3.7.3 Bagian Teknologi Formulasi ... 73
3.8 Instalasi Pengolahan Air Limbah ... 75
3.9 Sistem Managemen Mutu... 78
BAB IV Pembahasan ... 81
BAB V Kesimpulan dan Saran ... 89
5.1 Kesimpulan... 89
5.2 Saran ... 89
Daftar Pustaka ... 90
DAFTAR GAMBAR
Gambar 2.1. Sruktur Organisasi PT. Kimia Farma... 8
Gambar 3.1. Struktur Organisasi Perencanaan Produksi dan pengendalian Inventori 16 Gambar 3.2 Sruktur Organisasi Bagian Pembelian ... 20
Gambar 3.3 Skema Pengadaan Bahan Produksi ... 23
Gambar 3.4 Skema Pengadaan Barang Teknik... 25
Gambar 3.5 Skema Alur Produksi Tablet Non Hormon... 34
Gambar 3.6 Skema Alur produksi Serbuk Oralit... 36
Gambar 3.7 Skema alur Produksi sirup ... 38
Gambar 3.8 Skema Alur Produksi suspensi... 41
Gambar 3.9 Skema Alur Produksi Batugin Elixir ... 42
Gambar 3.10 Skema Alur Pembuatan Aqua Demineralisata... 45
Gambar 3.11 Skema Alur Produksi Tablet Hormon... 50
Gambar 3.12 Skema Alur Produksi Tablet Placebo ... 51
Gambar 3.13 Skema Alur Proses Pembuatan AKDR ... 54
Gambar 3.14 Struktur Organisasi bagian Teknik dan Pemeliharaan ... 57
Gambar 3.15 Struktur Organisasi Penyimpanan... 59
Gambar 3.16 Struktur Organisasi Pengelolaan Mutu ... 63
TABEL
Tabel 3.1 Parameter Pemeriksaan Air Limbah ... 76
BAB I PENDAHULUAN
1.1 Latar Belakang
Kesehatan merupakan salah satu indikator tingkat kesejahteraan manusia sehingga menjadi prioritas dalam pembangunan nasional suatu bangsa. Hal ini terkait dengan upaya peningkatan kualitas sumber daya bangsa tersebut. Dengan sumber daya manusia yang berkualitas maka akan semakin meningkatkan daya saing bangsa dalam era persaingan global saat ini.
Salah satu tujuan dari pembangunan nasional adalah pembangunan di bidang kesehatan dengan mewujudkan dan meningkatkan derajat kesehatan seluruh masyarakat Indonesia. Beberapa langkah kerja yang dilakukan pemerintah dalam rangka pembangunan nasional di bidang kesehatan meliputi tercukupinya ketersediaan obat, meratanya pendistribusian obat, serta terjangkaunya harga obat oleh masyarakat. Oleh karena itu, pengadaan dan produksi obat yang dalam hal ini dilakukan oleh industri farmasi akan mempengaruhi ketersediaan obat yang dibutuhkan masyarakat.
bermutu yaitu dengan CPOB (Cara Pembuatan Obat yang Baik). Pada tahun 2006, pemerintah telah memperbarui CPOB ini, yang kemudian lebih dikenal dengan CPOB Terkini atau cGMP (Current GMP).
Di sisi lain, pemberlakuan c-GMP bagi industri farmasi di Indonesia ternyata membawa berbagai konsekuensi, salah satunya adalah meningkatnya peran apoteker (pharmacist) di industri farmasi. Hal ini tentunya harus diimbangi dengan kesiapan dan profesionalisme para apoteker itu sendiri.
Dalam era perdagangan bebas dimana industri farmasi di Indonesia akan bersaing dengan industri farmasi dari negara lain maka penerapan CPOB saja belum cukup maka dari itu dituntut untuk memenuhi persyaratan sistem mutu yang berlaku secara internasional, salah satunya dengan mendapatkan sertifikat International Organization for Standardization (ISO).
Sertifikat ISO 9000 merupakan jaminan sistem pengelolaan mutu dan memberikan kerangka kerja untuk pengolahan yang efektif dan dengan seri ISO 9000 sekaligus merupakan promosi pengembangan perdagangan. Sedangkan sistem manajemen lingkungan, sistem ramah lingkungan yang menekankan pada dokumentasi dan penerapannya sebagai bukti obyektif dari jaminan mutu diatur dalam seri ISO 14000. Dengan memperoleh pengakuan ISO maka akan meningkatkan kredibilitas perusahaan dalam hal kemudahan memasuki pasar bebas dan sekaligus merupakan kemajuan perusahaan.
Calon apoteker yang ingin terjun di industri farmasi perlu melihat langsung penerapan dari konsep-konsep farmasi industri yang ada di lapangan dan mengetahui aplikasi ilmu selain ilmu kefarmasian yang tidak didapat di pendidikan formal kuliah.
Untuk mendukung tercapainya hal tersebut, Program Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara bekerja sama dengan industri farmasi PT. Kimia Farma (Persero) Plant Bandung melaksanakan kegiatan Praktek Kerja Profesi (PKP) bagi peserta program profesi yang telah memilih bidang industri farmasi.
1.1 Tujuan PKP
Setelah mengikuti Praktek Kerja Profesi diharapkan peserta program profesi mampu:
1. Memahami peran dan tanggung jawab apoteker di industri farmasi.
2. Mengetahui pelaksanaan CPOB yang telah dilaksanakan oleh industri farmasi.
3. Mengetahui kegiatan yang dilakukan di industri farmasi secara utuh dan terpadu.
BAB II
TINJAUAN TENTANG PT. KIMIA FARMA (PERSERO) Tbk
2.1 Sejarah PT Kimia Farma (Persero) Tbk
PT Kimia Farma (Persero) Tbk merupakan salah satu Badan Usaha Milik Negara (BUMN) yang bergerak di bidang kefarmasian, mulai dari produksi bahan baku obat, produksi obat jadi, sampai pada pemasaran yang meliputi Apotek dan Pedagang Besar Farmasi (PBF).
Pada tahun 1896, melalui akte notaris B.V. Houthuisen No. 12 tanggal 29 Juni 1896 di Bandung, didirikan sebuah pabrik kina oleh pemerintah Hindia Belanda dengan nama Bandoengsche Kinine Fabriek N. V, yang mula-mula hanya menghasilkan garam kina dari kulit kina. Pengolahan pabrik kina ini kemudian diserahkan pada Indische Combinatie Voor Chemische Industrie (Inschen) pada tanggal 14 Januari 1939 dan Inschen sendiri telah memiliki pabrik yodium di Watudakon yang didirikan pada tahun 1926.
Setelah Jepang dikalahkan Sekutu pada tahun 1945, pabrik kina diambil alih oleh pemiliknya, yaitu perusahaan swasta Belanda dengan nama Bandoengsche Fabriek N. V pada tahun 1955, pabrik kina ini diserahkan pada Combinatie Voor Chemische Industrie dengan akte Mr. R. Soewardi No. 47/1954 tanggal 3 November 1954.
Tahun 1958, berhubung adanya sengketa Irian Barat antara Indonesia dan Belanda, maka semua perusahaan Belanda yang ada di Indonesia dikuasai oleh pemerintah RI dengan membentuk Badan Pimpinan Umum (BPU) berdasarkan PP No. 23 tahun 1958. Berdasarkan UU No. 86 tahun 1958, perusahaan di bawah BPU ini menjadi milik RI yang pelaksanaannya diserahkan kepada Badan Nasionalisasi Perusahaan-perusahaan Belanda (BANAS). Pada tahun 1960, pabrik kina diberi nama Perusahaan Negara (PN) Farmasi dan Alat Kesehatan Bhinneka Kina Farma berdasarkan SP Menkes No. 57/959/BPK/Kob tanggal 18 Juli 1960. Pada tahun 1961, berdasarkan PP No. 85 tanggal 17 April 1961, namanya diubah menjadi Perusahaan Negara Farmasi (PNF) dan Alat-alat Kesehatan Bhinneka Kina Farma yang meliputi pabrik Yodium di Watudakon Mojokerto, Jawa Timur.
Produksi Jakarta, PNF Bhinneka Kina Farma (Bandung) menjadi PNF Bhinneka Kimia Farma Unit III Bidang Produksi Bandung, dan PNF Sari Husada (Yogyakarta) menjadi PNF Bhinneka Kimia Farma Unit IV Bidang Produksi Yogyakarta.
Pada tahun 1971, berdasarkan PP No. 16 tahun 1971 dalam lembaran negara RI No. 18 tahun 1971, PNF dan Alat-alat Kesehatan Bhinneka Kimia Farma unit I sampai unit IV diubah menjadi PT (Persero) Kimia Farma terhitung mulai bulan Agustus 1971 melalui Akte Notaris Sulaeman Ardjasasmita tanggal 16 Agustus 1971 dan mengganti nama semua unit perusahaan yaitu Unit I menjadi Unit Perdagangan, Unit II menjadi Unit Produksi Jakarta, Unit III menjadi Unit Produksi Bandung, Unit IV menjadi Unit Produksi Yogyakarta. Pada pertengahan 1974, PNF Sari Husada (PT Kimia Farma Unit Produksi Yogyakarta) memisahkan diri dari PT (Persero) Kimia Farma.
Tahun 1990, Unit Produksi Bandung menjadi tiga unit yaitu Unit Formulasi Bandung, Unit Produksi Manufaktur Bandung, dan Unit Produksi Manufaktur Watudakon. Pemisahaan unit ini diikuti dengan penggabungan pabrik pil KB ke dalam Produksi Formulasi Bandung.
efisiensi dan efektivitas untuk meningkatkan kempetensi guna pengembangan perusahaan.
2.2 Struktur Organisasi
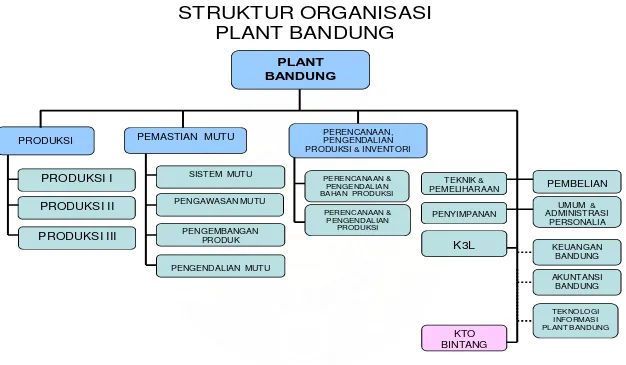
Manager Plant Bandung membawahi tiga manager yaitu Manager Produksi, Manager Pemastian Mutu dan Manajer PPPI, serta tujuh bagian yang dikepalai oleh Asisten Manager yaitu Bagian Teknik dan Pemeliharaan, Bagian Penyimpanan, Bagian Pembelian, K3L, Bagian Umum & Administrasi Personalia, Bagian Akuntansi Bandung, Bagian Keuangan Bandung, Bagian Teknologi Informasi plant Bandung. Bagian lainnya dikepalai oleh supervisor yaitu Bagian KTO Bintang.
STRUKTUR ORGANISASI
2.3 Tinjauan Umum PT kimia Farma (Persero) Tbk Plant Bandung
Plant Bandung merupakan penggabungan dari Unit Produksi Formulasi Bandung, dan Unit Produksi Manufaktur Bandung. Semula Unit Produksi Formulasi Bandung melakukan pengelolaan tablet non hormon, serbuk, liquid (sirup, suspensi) serta tablet hormon (pil KB). Sedangkan Unit Produksi Manufaktur Bandung melakukan pengelolaan produk kina, produk AKDR (Alat Kontrasepsi Dalam Rahim), serta produk fitofarmaka. Sebelum penggabungan, kedua unit tersebut sejak tanggal 2 Desember 1999 telah berhasil mendapatkan sertifikat ISO 9002 untuk penerapan sistem manajemen mutu sehingga mempermudah pabrik bila mengadakan ekspor produk jadinya. Namun setelah penggabungan, seluruh bagian tersebut tercakup dalam satu Plant Bandung. Jadi jenis produksi yang dihasilkan oleh PT Kimia Farma (Persero) Tbk Plant Bandung berdasarkan jenis dan bentuk sediaan adalah sebagai berikut:
1. Produksi bahan baku obat yang menghasilkan: - Kina Sulfat
- Kina HCl
2. Produksi formulasi obat yang menghasilkan: - Tablet non hormon
- Tablet hormon Mikrodiol (Pil KB)
- AKDR : Copper T Limas Safe Load, Copper T Libi Safe Load, Copper T BKKBN.
- Serbuk : Garam oralit
- Suspensi: Kloramfenikol, Kotrimosazol. - Fitofarmaka : Enkasari, Batugin.
Sebagai penunjang pelaksanaan kegiatan perusahaan, terdapat sarana-sarana yang digunakan dalam produksi di Bandung, antara lain:
1. Bangunan yang mendukung produksi yang dikondisikan sesuai dengan sediaan yang akan dibuat. Sistem sarana penunjang produksi, misalnya sumber air dari PDAM, sumber listrik dari PLN, pengolahan air demineralisata, sistem uap atau steam untuk pemanasan, udara bertekanan untuk kompresor, sarana penunjang perbaikan alat-alat.
2. Alat-alat yang digunakan, baik itu alat- alat produksi misalnya Fluid Bed Dryer, Super Mixer, Granulator Diosna, Ultra Turax, maupun alat-alat laboratorium misalnya HPLC, Spektrofotometer dan Polarimeter.
BAB III
KEGIATAN PRAKTEK KERJA PROFESI DI PT. KIMIA FARMA (Persero) Tbk
PLANT BANDUNG
PT. KIMIA FARMA (PERSERO) Tbk Visi :
Perusahaan farmasi utama di Indonesia dan berdaya saing di pasar global. Misi :
Menyediakan, mengadakan dan menyalurkan sediaan farmasi, alat kesehatan dan jasa kesehatan lainnya, yang berkualitas dan bernilai tambah untuk memenuhi kebutuhan masyarakat.
Mengembangkan bisnis farmasi dan jasa kesehatan lainnya untuk meningkatkan nilai perusahaan bagi pemegang saham, karyawan dan pihak lain yang berkepentingan, tanpa meninggalkan prinsip-prinsip Good Corporate Governance.
Mengembangkan SDM perusahaan untuk meningkatkan kompetensi dan komitmen guna pengembangan perusahaan serta dapat berperan aktif dalam pengembangan industri farmasi nasional.
PT. KIMIA FARMA (PERSERO) Tbk terdiri dari 2 bidang usaha: Holding Kantor Pusat
Plant Semarang
Plant Watudakon, Mojokerto Plant Tanjung Morawa, Medan Unit Riset dan Pengembangan Unit Logistik Sentral
Anak perusahaan Trading and Distribution (PBF) Apotek
3.1 Umum dan Administrasi Personalia
STRUKTUR ORGANISASI UMUM & ADMINISTRASI PERSONALIA
PLANT BANDUNG
-Direktur Umum & SDM………. -Tanggal : 22 November 2007 UMUM & ADMINISTRASI
PERSONALIA
UMUM RUMAH TANGGAPELAYANAN ADMINISTRASI PERSONALIA PELATIHAN
Gambar 3.1 Struktur Organisasi Umum & Administrasi Personalia Plant Bandung
bertanggung jawab langsung kepada Plant Manager. Secara umum tugas dan wewenang dari Asisten Manajer adalah:
a. Mengawasi kebenaran laporan absensi dan penilaian prestasi kerja pegawai. b. Mengusulkan kenaikan pangkat dan golongan pegawai atas rekomendasi dari
pemimpin setiap bagian.
c. Menyelenggarakan kegiatan rekruitmen dan seleksi pegawai baru. d. Mengawasi kegiatan identifikasi kebutuhan pelatihan bagi pegawai. e. Mengawasi kegiatan penggantian pengobatan pegawai.
Asisten manajer Bagian Personalia dalam menjalankan tugas dan wewenangnya dibantu oleh 4 orang supervisor, yaitu:
1. Supervisor bagian Administrasi 2. Supervisor bagian Pelatihan 3. Supervisor bagian Rumah tangga 4. Supervisor bagian Umun
Saat ini PT. Kimia Farma (Persero) Tbk. Plant Bandung mempunyai tenaga kerja yang dapat dikategorikan sebagai berikut:
1. Pegawai Struktural
Pegawai struktural mempunyai status kepangkatan, seperti di Plant Bandung terdapat tiga pangkat struktural di bawah Plant Manager yaitu: Manajer, Asisten Manajer dan Supervisor.
2. Pegawai Non Struktural
Pegawai non struktural adalah pegawai yang secara struktur tidak mempunyai status kepangkatan dan tidak dibebani tanggung jawab secara struktural kepada atasannya (tidak diwajibkan untuk membuat laporan tertulis kepada atasannya sebagai bentuk pertanggung jawaban tugasnya).
Sistem rekruitmen pegawai dilakukan melalui 2 jalur yaitu untuk lulusan Sarjana dilaksanakan di Kantor Pusat Jakarta dan penempatannya dilaksanakan oleh Pusat sesuai dengan kebutuhan masing-masing unit. Sedangkan yang berasal dari lulusan Program Diploma III kebawah dapat dilakukan rekruitmen pada unit produksi setempat setelah mendapat izin prinsip dari pusat.
Pembagian gaji dilakukan 2 kali dalam sebulan yang terdiri dari gaji pokok, tunjangan jabatan, tunjangan perusahaan dan upah lembur. Selain penghasilan tersebut perusahaan juga memberikan tunjangan lainnya, misal tunjangan hari raya (THR), tunjangan hari tua, tunjangan intensif lainnya dan pensiun.
Bagian) yang selanjutnya ilmu yang diperoleh dapat diinduksi kepada pegawai-pegawal lainnya. Masa kerja pegawai sampai usia 55 tahun.
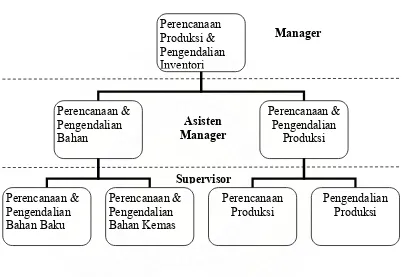
3.2 Bagian PPPI
Gambar 3.2 Struktur Organisasi Perencanaan, Pengendalian Produksi & Inventori Plant Bandung
Bagian PPPI bertanggung jawab memenuhi pesanan pemasaran secara tepat, baik tepat mutu, tepat jumlah maupun tepat waktu. Fungsi dari PPPI antara lain adalah:
1. Menerima target pesanan dari pemasaran sesuai dengan Prosedur Sistem Mutu Penanganan Pesanan
3. Evaluasi kapasitas produksi
4. Melakukan pemesanan bahan baku/bahan kemas 5. Melakukan perencanaan dan pengendalian produksi 6. Monitoring kedatangan bahan dan pengendalian bahan
PPPI terdiri dari dua bagian yang ditangani oleh Asisten Manager dan mempunyai rincian tugas masing-masing, yaitu:
1. Bagian Perencanaan dan Pengendalian Bahan (Rendal Bahan) a. Perencanaan dan Pengendalian bahan baku
b. Perencanaan dan Pengendalian bahan kemas
Bagian Rendal Bahan bertugas menjamin ketersediaan bahan baku maupun kemas sehingga tidak terjadi kekosongan bahan maupun kelebihan stok untuk proses produksi. Rincian tugasnya antara lain:
1) Merencanakan kebutuhan bahan baku/bahan kemas 2) Melakukan pemesanan bahan baku/bahan kemas 3) Melakukan evaluasi stok bahan
2. Bagian Perencanaan dan Pengendalian Produksi (Rendal Produksi) a. Perencanaan produksi
b. Pengendalian produksi
Rincian tugas bagian ini meliputi : 1) Penjadwalan produksi
2) Penerbitan SPK produksi, SPK coating dan SPK kemas 3) Evaluasi hasil produksi
Evaluasi produksi meliputi:
1. Ketepatan waktu pengiriman ke Unit Logistik Sentral (ULS) 2. Nilai pesanan
3. Evaluasi mutu
4. Evaluasi Harga Pokok Produksi (HPP), yaitu total biaya yang diperlukan untuk jadinya suatu produk.
SPK yang dikeluarkan oleh PPPI ada 3 macam:
1. Untuk bagian produksi: mengolah bahan baku menjadi produk ruahan. SPK ini disertai dengan CPB dan BSTBB
2. Untuk bagian pengemasan: mengolah produk ruahan sampai produk jadi yang sudah dikemas. SPK ini disertai dengan CKB dan BSTBK.
3. Untuk bagian coating: mengolah tablet inti menjadi tablet salut.
berbeda, tergantung dari rata-rata pemakaian per bulan dan lead time bahan tersebut. Buffer stock untuk bahan baku fast moving atau lead time-nya lama biasanya lebih banyak daripada barang yang slow moving atau lead time-nya pendek. Untuk bahan baku lokal, lead time-nya 1-2 bulan, sedangkan untuk bahan baku impor lead time-nya sekitar 3-4 bulan.
Selanjutnya PPPI akan melakukan pesanan bahan baku/kemas dengan mengeluarkan Bon Pembelian Bahan Baku (BPBB) dan Bahan Kemas (BPBK), yang disahkan oleh Plant Manager. Setelah barang yang dipesan datang kemudian diperiksa oleh Bagian Pengawasan Mutu sesuai dengan spesifikasi, jika memenuhi persyaratan maka dapat dimasukkan stok dalam gudang , kemudian dilakukan rencana produksi.
Bagian PPPI akan mengeluarkan Surat Perintah Kerja Produksi (SPK Produksi) disertai Bon Serah Terima Bahan Baku (BSTBB) dan Catatan Pengolahan Batch (CPB). Setelah proses produksi berakhir kemudian PPPI akan mengeluarkan Surat Perintah Kerja Pengemasan disertai Bon Serah Terima Bahan Kemas (BSTBK) dan Catatan Pengemasan Batch (CKB) untuk selanjutnya dilakukan proses pengemasan. Setelah proses pengemasan selesai, obat jadi diserahkan ke gudang obat jadi yang selanjutnya akan dikirim ke Unit Logistik Sentral (ULS).
Perencanaan produksi dapat dibagi menjadi 4 triwulan per tahun, yaitu: 1. Triwulan I : Januari – Maret
2. Triwulan II : April – Juni 3. Triwulan III : Juli – September 4. Triwulan IV : Oktober – Desember
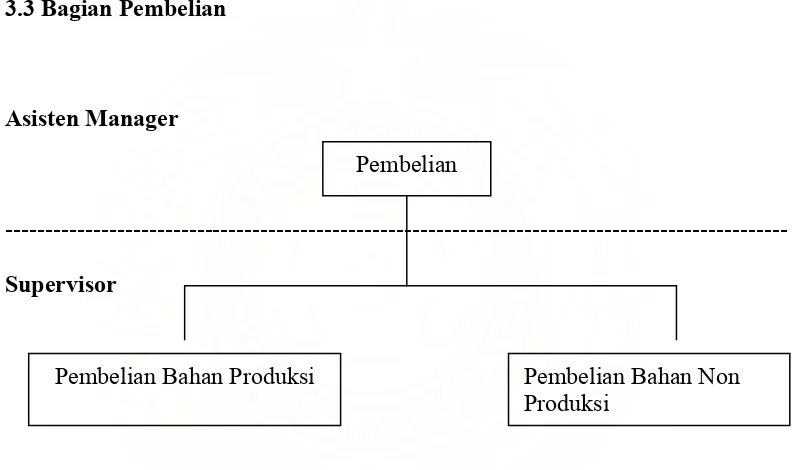
3.3 Bagian Pembelian
Asisten Manager
--- Pembelian
Supervisor
pembe Pembelian Bahan Produksi Pembelian Bahan Non Produksi
Gambar 3.3 Struktur Organisasi Bagian Pembelian Plant Bandung
Tugas Bagian Pembelian adalah:
1. Melakukan pembelian bahan produksi yaitu bahan baku dan bahan kemas 2. Melakukan pembelian bahan non produksi yang meliputi alat-alat teknik, alat
Ada 2 jenis kegiatan permintaan barang yang dilakukan oleh PT. Kimia Farma:
1. Permintaan bahan baku utama, bahan baku pendukung dengan jumlah kebutuhan besar dan bahan kemas primer seperti botol, polycel, dimana pengadaannya ditangani oleh Bagian Pengadaan di kantor pusat, Jakarta.
2. Permintaan bahan baku dengan jumlah kebutuhan kecil, bahan alam dan bahan kemas sekunder dimana pengadaannya ditangani sendiri oleh Bagian Pembelian PT. Kimia Farma Plant Bandung.
Bagian Pembelian harus dapat menjamin bahwa bahan dan jasa yang dibeli memenuhi persyaratan yang telah ditentukan dan pengadaannya dilakukan dari supplier handal yang telah diaudit dan dipercaya oleh PT. Kimia Farma. Supplier dikatakan mempunyai kinerja baik apabila memenuhi persyaratan kualitas barang yang ditawarkan, waktu pengiriman yang tepat, serta harga yang kompetitif. Bagian pembelian juga melakukan penilaian terhadap supplier dalam hal ketepatan waktu dan mutu. Jika nilainya:
> 85% : Predikat Baik sekali < 85%-70% : Predikat baik < 70%-55% : Predikat sedang < 55%-20% : Predikat kurang baik < 20% : Predikat buruk
oleh Plant Manager dan ditujukan ke Manajer Pengadaan Produksi, selanjutnya kantor pusat akan memesan bahan ke supplier dan menerbitkan Surat Pesanan (SP) yang juga dikirimkan ke Plant Bandung.
3.3.1 Pembelian Bahan Produksi
spesifikasi atau tidak) melalui Laporan Analisis yang diterbitkan oleh Bagian Laboratorium Pengujian. Jika barang diterima akan disimpan di gudang penyimpanan dan jika ditolak akan dikembalikan ke supplier.
3.3.2 Pembelian Bahan Non Produksi
Alur Pengadaan Bahan Produksi Oleh Bagian Pembelian
Bagian PPPI membuat BPPBB/K
Dilampirkan spesifikasi BB/BK. Untuk BK disertai contoh
Disahkan Plant Manager
Bagian Pembelian mengundang supplier untuk mendapatkan penawaran harga (yang diundang dari daftar supplier handal)
Evaluasi : harga murah, sesuai spesifikasi, barang tersedia.
Terbit Surat Pesanan : 7 rangkap. 3 lembar : Bag Keuangan.
1 lembar : Asli supplier. 1 lembar : Gudang.
1 lembar : PPPI. 1 arsip pembelian.
SP disahkan Plant Manager
Monitoring (minimal ± seminggu sebelum jadwal)
Barang datang (diterima gudang)
Terbit LA (MPM) – diterima/ditolak
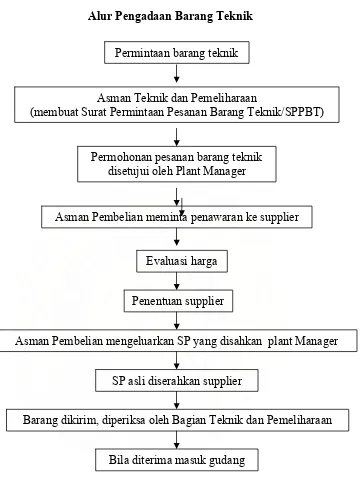
Alur Pengadaan Barang Teknik
Permintaan barang teknik
Asman Teknik dan Pemeliharaan
(membuat Surat Permintaan Pesanan Barang Teknik/SPPBT)
Permohonan pesanan barang teknik disetujui oleh Plant Manager
Asman Pembelian meminta penawaran ke supplier
Evaluasi harga
Penentuan supplier
Asman Pembelian mengeluarkan SP yang disahkan plant Manager
SP asli diserahkan supplier
Barang dikirim, diperiksa oleh Bagian Teknik dan Pemeliharaan
Bila diterima masuk gudang
3.4 Bagian Pemastian Mutu
STRUKTUR ORGANISASI PEMASTIAN MUTU
PLANT BANDUNG
PEMASTIAN MUTU
SISTEM MUTU PENGAWASAN MUTU
PENGAWASAN PRODUK ANTARA & RUAHAN
PENGEMBANGAN PRODUK -Tanggal : 22 November 2007
PENGENDALIAN
Gambar 3.6 Struktur Organisasi Pemastian Mutu Plant Bandung
(Hardware); dan juga personel yang terlibat (Brainware) dapat menghasilkan mutu produk yang diinginkan dan sesuai spesifikasi.
3.4.1 Sistem Mutu
Sistem Mutu adalah bagian dari seluruh sistem manajemen yang mencakup struktur organisasi, kegiatan perencanaan, tanggung jawab dan wewenang, proses, prosedur dan sumber daya untuk menerapkan, mengembangkan, mencapai, meninjau dan memelihara kebijakan mutu.
Sistem mutu terdiri dari : validasi & kualifikasi, regulasi & dokumentasi, dan inspeksi & audit.
1. Validasi & Kualifikasi Tugas :
• Menyusun Rencana Induk Validasi (RIV)
• Memonitor pelaksanaan validasi
• Bersama dengan team validasi melaksanakan validasi yang dikoordinator supervisor validasi yang terdiri dari validasi proses, analisa, pembersihan, instalasi.
• Melaporkan dan menindak lanjuti hasil validasi
• Mendokumentasikan dan meregistrasi seluruh dokumen & validasi 2. Regulasi & Dokumentasi
Tugas :
• Pengawasan dan membuat dokumen
• Merevisi peraturan yang berlaku
• Mengarsipkan
• Pengarsipan pengujian produk tahunan 3. Inspeksi & Audit
Tugas :
• Mengkoordinasikan pelaksanaan dan perencanaan audit internal dan eksternal
• Membuat rencana tindak lanjut hasil audit
• Bersama dengan asman sistem mutu menyiapkan RTM (Rapat Tinjauan Manajemen)
• Membuat notulen hasil RTM dan mendokumentasikannya
• Melaporkan tindak lanjut dari RTM Adapun tujuan penerapan Sistem Mutu adalah:
1. Secara konsisten menyediakan produk yang memenuhi persyaratan pelanggan dan memenuhi peraturan-peraturan perundangan dalam hal mutu.
2. Meningkatkan kepuasan pelanggan melalui penerapan yang efektif dari sistem, termasuk melakukan perbaikan terus menerus.
Manfaat dari Sistem Mutu ini adalah: Bagi karyawan:
- Kejelasan tugas dan wewenang
- Peningkatan prestasi kerja dan kepuasan kerja karena system dan prosedur kerja yang baik.
Bagi pelanggan:
- Menumbuhkan rasa yakin bahwa mereka telah berurusan dengan perusahaan yang terpercaya
- Akan mendapatkan pelayanan sesuai dengan yang diharapkan atau yang telah dijanjikan
- Menumbuhkan kepuasan pelanggan
3.4.2 Bagian Pengawasan Mutu
Bagian Pengawasan Mutu terdiri dari 8 supervisor yang bertanggung jawab terhadap:
1. Pemeriksaan Bahan Baku
Tugasnya melakukan pemeriksaan terhadap bahan baku yang datang secara organoleptis dan kimia. Bahan baku datang akan diterima oleh Bagian Gudang, kemudian akan disampling untuk diuji di Pengawasan Mutu. Bagian Pengawasan Mutu akan mengetahui ada bahan baku datang melalui BTBS yang diberi oleh Bagian Gudang. Pedoman untuk spesifikasi pemeriksaan bahan baku ini diambil dari berbagai macam buku, misalnya Farmakope Indonesia dan USP.
Sebagai tanda bahan masih diperiksa akan diberi label kuning, label hijau berarti telah lulus pemeriksaan dan label merah berarti bahan ditolak karena out of spesification. Sebagai bukti kalau Bagian Pengawasan Mutu telah memeriksa,
maka diterbitkan Laporan Analisa (LA). Semua bahan baku baik bahan aktif obat maupun bahan pembantunya, akan diperiksa oleh seksi ini kecuali kina dan bahan pembantu proses pembuatan kina. Jumlah yang disampling √N+1 untuk masing-masing batch dan bila yang datang hanya 3 batch atau kurang maka akan disampling semua. Jika ada bahan baku tertentu yang masih disimpan dalam gudang dalam waktu relatif lama maka akan disampling ulang. Contohnya untuk vitamin tiap 6 bulan sekali akan diperiksa ulang, bahan aktif setahun sekali dan bahan pembantu 2 tahun sekali.
2. Pemeriksaan Bahan Kemas
sampling √N+1 dalam kardus-kardus yang datang itu. Bila dalam kardus tersebut bila terdapat dus yang lebih kecil lagi dalam bentuk ikatan maka akan disampling sebanyak √N+1, pemeriksaan meliputi jumlah, estetika, penampilan sesuai apa tidak dengan spesifikasi, berfungsi tidaknya bahan kemas tersebut pada peralatan produksi. Bahan kemas yang disimpan dalam waktu tertentu di gudang juga akan diperiksa ulang tiap 2 tahun sekali. Contoh bahan kemas yang juga diperiksa oleh seksi ini : aluminium foil, leaflet, botol.
3. Pemeriksaan Produk Ruahan dan Pemeriksaan Produk Jadi
Pemeriksaan yang dilakukan oleh kedua seksi ini adalah pemeriksaan produk ruahan dan produk jadi dari sediaan yang diproduksi. Tiap produk mempunyai spesifikasi tersendiri dengan mengacu pada pustaka resmi. Bila hasilnya memenuhi spesifikasi akan direalese untuk mengikuti proses selanjutnya, jika tidak lulus uji akan diinvestigasi kesalahannya untuk menentukan langkah perbaikan.
4. Pemeriksaan Kina
5. Pemeriksaan Mikrobiologi dan Limbah Cair Tugas dari seksi ini adalah melakukan:
1. Pemeriksaan bahan baku yang memerlukan pemeriksaan mikrobiologi. 2. Pemeriksaan produk jadi yang memerlukan pemeriksaan mikrobiologi,
contoh AKDR, Fitofarmaka.
3. Pemeriksaan air yang dipergunakan untuk proses produksi.
4. Pemantauan ruang proses produksi (pada saat bekerja) apakah memenuhi syarat mikrobiologi meliputi angka kuman dan angka jamur serta bakteri patogen.
5. Pemantauan terhadap air limbah. Limbah yang diperiksa hanya cair saja apakah sesuai dengan Standar Kementerian Lingkungan Hidup. Pemeriksaan meliputi bakteri pencemar dan bakteri patogen serta pemeriksaan fisik meliputi keasaman, amoniak, BOD, COD.
6. Pengawasan Dalam Proses Produksi
Supervisor ini melakukan pengawasan selama proses produksi, yaitu:
1. Pengecekan bahan sebelum proses menjadi produk ruahan yang siap kemas.
2. Hasil proses pencampuran menjadi massa cetak atau cairan (produk ruahan atau produk antara) diperiksa di Pengawasan Mutu.
dengan CPB, pemeriksaan fisik granul, pemeriksaan uji kekerasan dan bobot tablet.
4. Pada proses produksi cairan dan serbuk, pemeriksaannya meliputi kebenaran bahan dan jumlah sesuai CPB, tes kebocoran, volume untuk sediaan cair, pemeriksaan berat untuk serbuk dan penandaannya (ED dan no. Batch).
7. Pengawasan Dalam Proses Pengemasan
Supervisor ini melakukan pengawasan selama proses pengemasan, yaitu: 1. Pengecekan bahan kemas sebelum dan sesudah proses pengemasan.
3.4.3 Pengembangan Produk
Teknologi Formulasi merupakan bagian dari Pengelolaan Mutu yaitu unit kerja teknologi produksi dan pengembangan dalam skala kecil. Bagian ini bertanggung jawab terhadap pengembangan produk baru dan produk lama di lingkungan Plant Bandung.
Pengembangan produk terdiri dari 2 supervisor yaitu pengembangan formula dan pengembangan bahan pengemas.
1. Pengembangan Formula Tugas & tanggung jawab :
1. Bersama dengan RISBANG melakukan trial produksi 2. Mengatasi permasalahan produk lama
4. Membuat formula bahan baku yang diusulkan CPB 5. Melakukan perbaikan metode analisa yang tidak valid 2. Pengembangan Bahan Kemas
Tugas & tanggung jawab :
1. Menyiapkan rancangan kemasan produk baru sampai spesifikasinya 2. Melakukan revisi kemasan
3. Membuat formula bahan kemas dan diusulkan ke CKB
4. Melakukan trial bahan kemas design baru atau dari suplier baru
3.4.4 Pengendalian Mutu
Pengendalian mutu terdiri dari 3 supervisor yaitu: penanganan keluhan, stabilitas, dan kalibrasi.
1. Penanganan Keluhan
Penangana keluhan pelanggan dilakukan oleh regulasi pelaksanaan CPOB. Tugas :
1. Menangani keluhan pelanggan, meliputi: mutu & kemasan 2. Sampling pasar
3. Evaluasi CKB & CPB 4. Inspeksi diri
a. Menangani keluhan pelanggan
eksternal yaitu keluhan dari pelanggan meliputi: keluhan mutu baik secara lisan maupun tertulis melalui plan Manager
b. Sampling pasar
Sampling pasar dilakukan melelui otlet–otlet apotek Kimia Farma seindonesia kemudian dilakukan pemeriksaan spesifikasi masing–masing produk. Jika tidak memenuhi syarat maka sampel petinggal diperiksa. Jika tidak ada tanggapan dari ULS maka dianggap nihil.
c. Evaluasi CKB & CPB
Pemantauan produk yang tidak sesuai bertujuan untuk menyelidiki kemungkinan kegagalan pembuatan.
2. Stabilitas
Uji stabilitas dilakukan untuk produk baru dan produk lama. Alat uji stabilitas yaitu Chemetric Chambers dengan cara dipercepat dan jangka panjang.
3. Kalibrasi
Kalibrasi merupakan pengujian suatu alat ukur dengan cara membandingkan alat ukur dengan alat pembanding (standar).
Tujuan dilakukan kalibrasi :
1. Menjamin pengendalian kalibrasi dan pemeliharaan serta perawatan peralatan pengukuran sehingga selalu dalam kondisi yang siap pakai dan sesuai standart.
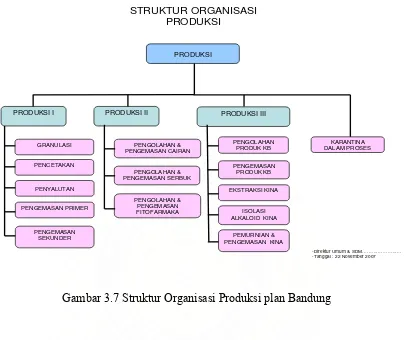
3.5 Bagian Produksi -Tanggal : 22 November 2007 PENGEMASAN PRIMER
Gambar 3.7 Struktur Organisasi Produksi plan Bandung
Manager produksi berada langsung dibawah Plant Manager Bandung, yang membawahi tiga bagian:
1. Bagian Produksi I : Tablet
2. Bagian Produksi II : Suspensi, Sirup, Oralit serbuk, Fitofarmaka 3. Bagian Produksi III :
Produksi Kina Tablet Hormon
Tugas dan tanggung jawab Manager Produksi adalah sebagai berikut:
1. Bertanggung jawab atas terlaksananya pembuatan obat mulai dari perolehan bahan baku, pengolahan, pengemasan, sampai pengiriman obat ke gudang jadi.
2. Memberikan pengarahan teknis dan administratif untuk pelaksanaan pengolahan produksi dan pengemasan.
3. Bertanggung jawab untuk memeriksa catatan pengolahan batch serta menjamin bahwa produksi dilaksanakan sesuai prosedur pengolahan dan pengemasan batch.
4. Bertanggung jawab menyiapkan mesin yang dipakai, SDM yang terlatih dan terampil.
Alur kegiatan Bagian Produksi:
1. Bagian produksi bekerja berdasarkan SPK produksi dari PPPI yang disahkan oleh Plant Manager yang disertai CPB dan BSTBB.
2. Bagian Penimbangan Sentral (PS) merekap kebutuhan bahan baku dan meminta gudang, kemudian bahan baku ditimbang.
3. Proses produksi dimulai:
o Selama proses produksi dilakukan IPC (oleh bagian produksi) pada titik kritis.
beserta Catatan Kemasan Batch (CKB) dan Bon Serah Terima Bahan Kemas (BSTBK).
4. Produk Jadi yang dihasilkan akan dikirim ke gudang obat jadi.
3.5.1 Produksi I
Bagian produksi I dikepalai oleh seorang Asisten Manajer yang mempunyai tugas dan tanggung jawab sebagai berikut:
a. Mengelola kegiatan proses pelaksanaan SPK. b. Mengelola kegiatan proses granulasi tablet. c. Mengelola kegiatan proses pencetakan tablet. d. Mengelola kegiatan proses penyalutan tablet.
e. Mengelola kegiatan penerimaan, penyimpanan dan penyerahan barang karantina. Mengelola pembinaan SDM di lingkungan bagian produksi tablet.
f. Mengusulkan rencana kerja dan mengkonsultasikan rencana pelaksanaan tugas serta melaporkan hasilnya kepada Manajer Produksi.
Bagian Produksi I membawahi lima supervisor yaitu: a. Supervisor Granulasi
b. Supervisor Pencetakan
Berikut adalah alur produksi tablet non hormon:
1. PPPI menurunkan SPK produksi beserta CPB dan BSTBB. SPK yang dikeluarkan oleh PPPI berisi target kapan produksi tersebut harus sudah selesai.Karena itu bagian produksi harus dapat merencanakan jadwal produksi dengan baik, mengecek jadwal pemakaian mesin dan merencanakan kapasitas mesin yang akan dipakai serta merencanakan lead time proses.
2. Penimbangan Sentral menimbang bahan kemudian dikirim ke Bagian Granulasi.
Penimbangan dilakukan untuk bahan tambahan terlebih dahulu, sedangkan untuk bahan aktif ditimbang terakhir. Hal ini ditujukan untuk mencegah kontaminasi silang karena dalam satu hari penimbangan sentral dapat menimbang untuk produksi lebih dari satu produk.
3. Pelaksanaan proses granulasi atau pembuatan granul dengan pola/sistem granulasi basah.
a) Pengawas produksi memeriksa kebersihan alat, ruangan dan memastikan tidak ada bahan lain yang tidak berhubungan dengan proses granulasi. Jika memenuhi persyaratan diberi label hijau yang artinya ‘setuju pakai’ dan melakukan pemeriksaan kebenaran nama produk, nama bahan, nomor batch, nomor LA dan berat bahan baku semuanya harus sesuai dengan
CPB.
c) Pencampuran fase dalam dengan menggunakan mesin Diosna V 250 atau dengan supermixer. Bahan aktif dan bahan pengisi dicampur terlebih dahulu kemudian ditambahkan larutan pengikat.
d) Pengeringan granul.
• Dilakukan dengan Fluid Bed Dryer (FBD) atau lemari pengering (oven). Bila pengeringan dilakukan dengan FBD maka granul diayak kasar terlebih dahulu karena bila ukuran granul terlalu besar, saat ditarik granul yang besar tidak dapat terikut sehingga pengeringan tidak merata. Pengeringan menggunakan oven dilakukan untuk bahan yang lengket atau mudah menggumpal dan bahan yang higroskopis sekali.
• Pelaksana Produksi (PP) melakukan pemeriksaan Loss On Drying (LOD) granul yang telah dikeringkan dengan alat moisture balance.
• Pengeringan granul merupakan titik kritis sehingga pada saat pengeringan tidak boleh terlalu kering agar pada saat pencetakan tidak terjadi capping, dan tidak boleh terlalu basah agar tablet tidak lengket pada mesin pencetak.
e) Pengayakan kering granul.
• Menggunakan alat Fitzmill atau Cadmill dengan ukuran mesh dan kecepatan tertentu.
f) Pencampuran akhir.
• Mencampur granul dengan lubrikan atau pelincir (Mg stearat, talkum), disintegran/penghancur (amilum yang dikeringkan) dan flavouring agent.
• Pencampuran granul dengan talkum dalam Double Cone Blender (DCB) selama 25 menit kemudian pencampuran dengan Mg stearat selama 5 menit.
• Setelah pencampuran selesai, masa cetak yang telah terbentuk dikarantina untuk diambil sampling oleh bagian PDPP dan kemudian dilakukan pemeriksaan kadar dan homogenitas oleh Laboratorium Pengujian.
4. Proses pencetakan
a) Penyerahan masa cetak dari karantina ke bagian pencetakan b) Sebelum proses pencetakan dimulai, dilakukan set up mesin
c) Selama proses pencetakan, Pelaksana Produksi melakukan pemeriksaan bobot tablet setiap 15 menit dan pemeriksaan kekerasan tablet setiap 1 jam. d) Hasil cetak dikarantina untuk menunggu hasil pemeriksaan dari
Laboratorium Pengujian, meliputi berat, kekerasan, keregasan, keseragaman kandungan dan disolusi. Laboratorium akan mengeluarkan Laporan Analisis (LA) produk jadi untuk tablet yang dikemas tanpa penyalutan.
5. Proses penyalutan/coating
b) Salut film dilakukan dengan menggunakan mesin Acella Cota dan prosesnya terdiri dari dua tahap yaitu penyalutan dan polishing.
c) Proses penyalutan salut gula terdiri dari enam tahap yaitu protecting dengan mesin Acella Cota, subcoating, coating, smoothing, colouring dan polishing.
d) Penyalutan dilakukan untuk tablet yang tidak tahan cahaya, mudah teroksidasi, tidak tahan kelembaban dan untuk menutupi bau serta rasa yang tidak enak dari tablet.
6. Proses pengemasan.
a) PPPI mengeluarkan SPK pengemasan untuk tablet.
b) Macam pengemas primer yang digunakan adalah strip, blister dan botol. c) Untuk blister dan strip dilakukan pemeriksaan oleh Supervisor Dalam
Proses Pengemasan (SPDPK) meliputi estetika, tanggal kadaluwarsa, nomor batch sehari satu kali dan tes kebocoran sebanyak tiga kali yaitu awal, tengah dan akhir proses kemas oleh pelaksana produksi. Jumlah sampel yang diambil sesuai dengan row mesin striping, bila mesin memiliki 4 row (satu kali striping menghasilkan 4 strip) maka yang diuji sebanyak 4 strip.
d) Untuk kemasan botol, dilakukan pemeriksaan jumlah/isi botol.
7. Pemeriksaan akhir
a) Dilakukan oleh SPA dengan sampling sejumlah √n + 1
b) Pemeriksaan dilakukan dengan menimbang dus oleh pelaksana produksi, apabila terdapat nilai penimbangan terkecil maka dus tersebut dibongkar dan dilihat kesesuaian isinya, apabila jumlah/isi telah sesuai maka nilai penimbangan terkecil digunakan sebagai patokan untuk produk tersebut. c) Pemeriksaan oleh SPA meliputi pemeriksaan penandaan nama dan no
batch, isi/jumlah, tanda pengepakan, dan pemeriksaan fisik box seperti
kerusakan/kotor.
d) Distempel ‘setuju keluar’ oleh SPA, merupakan jaminan bahwa produk dapat dikirim ke gudang.
8. Produk dikirim ke gudang dan selanjutnya dikirim ke Unit Logistik Sentral
3.5.2 Produksi II
Bagian Formulasi II merupakan bagian yang memproduksi sediaan serbuk, liquida dan produk fitofarmaka. Sediaan serbuk yang diproduksi adalah serbuk oralit, sedangkan yang termasuk sediaan likuida adalah adalah sirup dan suspensi. Sediaan sirupnya adalah Dekstrometorfan, sirup Parasetamol, sedang sediaan suspensi diantaranya suspensi Kotrimoksazole. Contoh produk Fitofarmaka yang dihasilkan plant Bandung adalah Batugin Eliksir dan Enkasari.
a. Alur Produksi Serbuk Oralit
Bahan untuk produksi oralit bersifat higroskopis, yaitu NaCl dan KCl, oleh karena itu sebelum ditimbang bahan–bahan tersebut dikeringkan sehingga diperoleh kadar air kurang dari 0,1%. Setelah proses pengeringan, kemudian digiling menggunakan Fitzmill agar didapat ukuran partikel yang kurang lebih sama. Selanjutnya bahan–bahan tersebut ditimbang sesuai dengan jumlah yang dibutuhkan, pada tahap ini juga ditimbang bahan tambahan yang lain dalam formula.
b. Alur Produksi Sirup
Proses produksi sediaan sirup dimulai dari penimbangan bahan aktif dan bahan tambahan di Penimbangan Sentral. Kemudian dilakukan pembuatan sirupus
simplex dalam Melting Tank pada suhu 80o-90oC dengan putaran 200–250 rpm
selama kurang lebih 4 jam. Pembuatan sirupus simplex yaitu air dipanaskan, lalu dimasukkan gula, diaduk, lalu didinginkan sampai suhu 28o–30oC, kemudian disaring masuk ke Mixing Tank.
Bahan aktif maupun bahan tambahan dilakukan pelarutan dalam Mixer berkapasitas 200 L. Kemudian dilakukan pencampuran antara bahan aktif, bahan tambahan dan sirupus simplex dalam Mixing Tank dengan kecepatan 150–200 rpm selama 0,5–1 jam. Dari Mixing Tank kemudian dipindahkan ke Storage Tank untuk dikarantina dan dilakukan pemeriksaan oleh Laboratorium Pengujian meliputi pemerian, BJ, kadar dan pH. Jika telah dinyatakan lulus uji, larutan sirup siap untuk proses pengisian. Sebelum proses pengisian, botol dan pilferproof cap yang akan digunakan dicuci lalu dikeringkan pada suhu 34o – 35oC selama 10 jam, kemudian didinginkan pada suhu kamar selama minimal 1 jam.
c. Alur Produksi suspensi
Sediaan suspensi yang diproduksi antara lain suspensi kotrimosazole dan kloramphenicole. Proses dimulai dengan pengayakan bahan aktif dan CMC, kemudian dilakukan penimbangan di Penimbangan Sentral. Bahan tambahan yang dibutuhkan untuk proses produksi juga ditimbang sesuai dengan kebutuhan.
Dalam pembuatan suspensi, diperlukan sirupus simplex dan suspending agent. Pembuatan sirupus simplex dilakukan seperti pada sirup, sedangkan untuk
pembuatan suspending agent, dibuat dengan cara, menaburkan CMC Na pada air panas dalam Mixing Tank, dicampur selama 30 menit dan diputar dengan kecepatan 150–200 rpm lalu didinginkan di Ultra Turax.
Zat aktif setelah diayak dan ditimbang, selanjutnya dibasahkan dengan cara dimasukkan dalam campuran air dan surfaktan. Kemudian dilakukan penghalusan partikel dengan Colloid Mill. Sementara itu juga dilakukan pelarutan zat tambahan dengan pelarut sesuai, kemudian baru dicampur antara larutan zat tambahan, bahan aktif yang sudah dihaluskan dan campuran suspending agent– sirupus simplex pada mesin Ultra Turax selam 1 jam pada kecepatan 200 rpm.
Hasil pencampuran disimpan di Storage Tank dan dikarantina untuk dilakukan pemeriksaan yang meliputi pemerian, berat jenis, viskositas, pH dan kadar. Setelah lulus uji maka dilakukan proses pengisian ke dalam botol maka dilakukan proses pengisian ke dalam botol maka dilakukan penutupan botol dengan Cap Sealing Machine. Pemeriksaan IPC dilakukan terhadap kekencangan penutupan.
etiket ini akan dikemas dalam kemasan sekunder dan akan dikemas lagi dalam kardus/box. Pada proses ini dilakukan IPC estetika, kelengkapan etiket dan penandaan. Jika sudah dinyatakan memenuhi syarat maka akan dikirim ke Gudang Obat Jadi.
d. Produksi Fitofarmaka 1) Batugin Elixir
Batugin Elixir 300 ml
Besar batch 3000 L untuk 10.000 botol
Bahan yang digunakan : Tempuyung dan Keji Beling.
2) Enkasari
Enkasari:120 ml
Besar batch:3000 L, 25000 botol
Bahan yang digunakan untuk pembuatan Enkasari adalah Tingtur sirih, Saga dan Succus Liquiritae. Proses pembuatan didahului oleh proses pencucian dan perajangan daun. Daun sirih yang digunakan adalah daun segar sedangkan daun saga yang digunakan adalah daun kering.
Cara pembuatan tingtur saga : air aqua DM dipanaskan sampai suhu 95-100ºC, didinginkan sampai suhu 30-40ºC, ditambah alkohol 95% sama banyak, ditambah daun saga kering yang sudah dicuci dilakukan proses maserasi selama minimal 5 hari lalu disaring.
Cara pembuatan tingtur sirih : air aqua DM dipanaskan sampai suhu 95-100ºC , dinginkan sampai suhu 30-40ºC, ditambah alkohol, ditambah daun sirih yang sudah dicuci dan dirajang, dimaserasi selama minimal 5 hari lalu disaring.
Cara pembuatan tingtur Succus Liquiritae : air aqua DM dipanaskan sampai suhu 95-100ºC , ditambah succus, didinginkan, ditambah alkohol 95% lalu dimaserasi selama minimal 5 hari lalu disaring dan diuji. Pemeriksaan Ph, BJ, sisa penguapan.
penyaringan dengan plat berlubang diameter 5 mm yang dilapisi dengan Seitz Filter K200 sebanyak 31 lapis. Pada proses ini dilakukan pemeriksaan meliputi BJ, pH, kejernihan dan pemeriksaan mikrobiologi. Setelah di ACC lalu disalurkan lewat pipa ke tempat pengisian. Selanjutnya dilakukan proses filling (pengisian) ke dalam botol 120 ml. Pada proses ini dilakukan IPC keseragaman volume rentang 120-122 ml. Selanjutnya dilakukan proses packaging. Pada proses ini pemeriksaan IPC kemasan, penandaan etiket dos dan botol, tanda pengepakan serta estetica etiket pada botol. Estetika itu produk diperiksa lagi oleh pemeriksa produk akhir meliputi pemeriksaan fisik. Jika sudah memenuhi syarat oleh SPA ditempel setuju dikeluarkan, kemudian dikirim ke gudang obat jadi dengan disertai bon 5. Pada akhir proses dilakukan pemeriksaan jumlah botol dalam box (1 box 48 botol) dan kelengkapan kesesuaian kemasan.
3.5.3 Produksi III 1. Tablet Hormon
Hasil produksi : Mikrodiol Limas dan Mikrodiol Program (program pemerintah) Satu blister isinya :
- 21 tablet Oral kontrasepsi yang isinya Ethynilestradiol 0,03 mg dan Levonorgestrel 0,15 mg per tablet
- 7 tablet placebo yang isinya amilum maydis dan saccharum lactis (bahan pengisi) serta bahan pengikat, bahan penghancur dan bahan pelincir.
ruang produksinya pun terdiri dari dua bagian yang terpisah, yaitu untuk pembuatan tablet placebo dan untuk pembuatan tablet OC. Ruang penyimpanan bahan dan ruang penimbangannya pun tersendiri untuk menghindari adanya kontaminasi silang. Ruang produksi tablet OC merupakan ruang abu-abu khusus yang memiliki pengaturan sistem tekanan udara yang khusus, yaitu tekanan di dalam ruang produksi tablet OC dibuat lebih negatif dibanding tekanan koridor, yang bertujuan untuk mencegah keluarnya udara dari dalam ruang produksi OC. Selain itu pada pintu keluar dilengkapi dengan air shower untuk menghilangkan partikel-partikel serbuk hormon.
Penimbangan hormon dilakukan didalam Laminar Air Flow (LAF) karena jumlah yang ditimbang sangat kecil serta untuk menghindari kontaminasi hormon dalam ruangan.Terdapat juga dust collector yang digunakan untuk menghisap dan menampung debu, caranya debu yang terhisap akan disaring, kemudian debu ditampung ke bawah dan udara yang tidak mengandung debu dibuang keluar.
Bagian Produksi akan memeriksa apakah sudah sesuai dengan CPB. Bahan yang telah ditimbang dibawa ke ruang produksi untuk kemudian diproses.
Sedangkan untuk produksi tablet OC, setelah bahan ditimbang di LAF, kemudian dilakukan proses granulasi basah dimana zat aktif dilarutkan larutan pengikat (di dalam Super Mixer) kemudian hasilnya disemprotkan ke Fluid bed Granulator secara bertahap selama 54 menit. Selanjutnya dilakukan
pengeringan. Pada proses pengeringan ini dilakukan pemeriksaan IPC susut pengeringan (LOD) untuk mengetahui kadar air dalam granul kering. Selanjutnya granul diayak kering dengan mesin Fitz Mill. Massa granul yang yang dihasilkan kemudian dicampur dengan fasa luar (bahan pelincir) dengan mesin Double Cone Blender. Kemudian dilakukan proses pencetakan dengan mesin Killian. Selama proses pencetakan dilakukan pemeriksaan IPC yang meliputi keseragaman bobot, ketebalan, diameter tablet, kekerasan, kerapuhan. Saat tablet telah dicetak juga dilakukan pemeriksaan oleh Laboratorium Pengujian yang meliputi kadar, keseragaman kandungan, disolusi, pemerian, keseragaman bobot, ketebalan, diameter tablet, kekerasan, kerapuhan, waktu hancur.
Setelah tablet plasebo dan tablet OC dinyatakan lulus uji, selanjutnya memasuki proses pengemasan blistering dengan mesin Blister Uhlmann. Disini dilakukan IPC meliputi uji kebocoran, estetika, dan kelengkapan penandaan pada kemasan. Selanjutnya dilakukan pengemasan sekunder dengan IPC meliputi estetika dan perhitungan jumlah blister.
2. Alat Kontrasepsi Dalam Rahim (AKDR)
program pemerintah, Copper T ekspor, yang diekspor ke luar negeri terutama negara asia seperti Korea.
Bagian-bagian yang menyusun Copper : Flange, Copper T 380 A, Copper wire, Copper collar, Frame T (dari Polietilen Barium Blended)
Alur pembuatan AKDR:
1. Produksi AKDR pertama kali dilakukan adalah membuat frame T. Frame T berasal dari bahan Polietilen Barium Blended. Pencetakan frame T dilakukan pada ruang moulding. Sekali cetak menghasilkan 4 buah frame T. Satu batch dapat menghasilkan 12.000 frame T. Kemudian dimasukkan ruang karantina untuk pemeriksaan kelenturan/ flexibility.
2. Selanjutnya pemasangan Copper Collar pada frame T. Cu yang digunakan 99.99% murni.
3. Pada ruang Copper Wiring untuk pemasangan copper wire. IPC yang dilakukan adalah kerapian dan berat Cu wire.
4. Pada ruang Copper Sleaving dan Weaging untuk pengencangan wire. 5. Pada ruang Suture Tying dilakukan pemasangan tali. Dilakukan IPC :
panjang tali, kerapian (tali warna hitam untuk diekspor, sedangkan tali putih untuk lokal).
6. Pada ruang Tubing inserting dilakukan penambahan tube plastik. 7. Pada ruang Prepacking dilakukan pengemasan sebelum disterilkan
9. Pada ruang sterilisasi, dilakukan sterilisasi produk yang sudah dikemas primer dengan menggunakan gas etilen oksida selama 1 jam 45 menit pada suhu 130 ºF pada tekanan 8 mmHg. Kemudian diaerasi 7 jam agar kadar etilen dioksida tidak boleh lebih dari 5 ppm. Kemudian dilakukan uji mikrobiologi.
3. Produksi Kina
Di bagian produksi kina ada tiga seksi, yaitu bagian ekstraksi kina, bagian isolasi alkaloid kina dan bagian pemurnian dan pengemasan kina.
Contoh alkaloid kina diantaranya Quinine, Quinidine. Derivat-derivat kina yang diproduksi antara lain Quinine Sulphate, Quinine Hydrochloride. Sumber bahan untuk produksi kina berasal dari kulit kina tanaman Cinchona succirubra
dan Cinchona ledgeriana. Kedua jenis tanaman tersebut memiliki kandungan
yang berbeda, untuk tanaman Cinchona succirubra lebih banyak mengandung alkaloid cinchonidine sedangkan tanaman Cinchona ledgeriana lebih banyak mengandung alkaloid quinine.
bentuk gilingan kasar. Selanjutnya dilakukan penggilingan halus dan siap untuk diekstraksi.
Alur produksi kina dimulai dengan ekstraksi padat-cair, yaitu 1 ton kulit kina halus diekstraksi dengan pelarut SGO (Special Gas Oil) dalam kondisi basa pada suhu 90º-95º C dalam ekstraktor. Untuk membasakan ke dalam ekstraktor ditambahkan NaOH. Diaduk selama kurang lebih 35 menit sambil ditekan. Setelah itu SGO dikeluarkan (±15.000 liter), sedangkan ampas tetap di dalam. SGO yang ditampung ini mengandung garam kina dan pada tahapan ini dilakukan IPC terhadap kadar total alkaloid menggunakan titrasi.
Selanjutnya SGO dipindahkan ke reaktor kerucut untuk dilakukan ekstraksi cair-cair dengan cara ditambahkan H2SO4 12 N dan Natrium Sulfat Water (NSW) dengan BJ 1,12-1,15, diaduk 5-10 menit. Setelah itu didiamkan 10 menit agar memisah, lapisan atas merupakan SGO sedang lapisan bawah adalah H2SO4, keduanya dipisahkan dan alkaloid yang tertarik ke fase polar H2SO4 didiamkan selama 3-5 malam (kristalisasi). Setelah itu disaring dan disentrifuse, hasilnya akan diperoleh kristal B1 (kina bisulfat 1) dan Mlq (mother liquor). Kristal yang didapat dikarantina untuk diperiksa kadarnya, sedang Mlq (bisulfat) diolah jadi sulfat dengan meningkatkan pH dan ditambah NaHCO3, disentrifuge, didapat Mlq dan kristal S1.
sedang Mlq ditingkatkan pH nya dan ditambah NaHCO3, disentrifuge, didapat Mlq dan kristal S2. Mlq ditransfer ke pemurnian alkaloid kina untuk pengambilan Cd, sedang kristal S2 diperlakukan sama seperti perlakuan terhadap kristal S1. Hasil kristalisasi dari kristal S1 diperoleh kristal B3 dan Mlq. Mlq ini langsung dibuat cd tetrasulfat (bahan untuk cd base murni) dengan cara ditambah H2SO4 pekat 36 N, untuk Mlq dari proses sebelumnya yang telah dikumpulkan, ditambah asam tartrat sehingga jadi Qn, Cd tartrat, lalu dibasakan sehingga menjadi Qn dan Cd (dominan Cd). Selanjutnya ditambahkan H2SO4 18 N sampai kondisi bisulfat pH 2,8 dan ditambah H2SO4 pekat 36 N sehingga jadi Cd tetrasulfat. Kristal B1, B2, B3 dikumpulkan untuk dilakukan pemurnian dan diproses menjadi kina sulfat dan kina HCl.
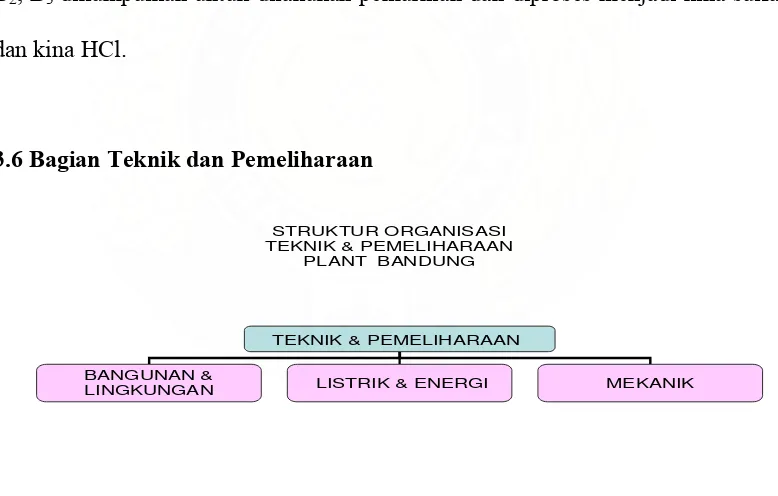
3.6 Bagian Teknik dan Pemeliharaan
STRUKTUR ORGANISASI TEKNIK & PEMELIHARAAN
PLANT BANDUNG
-Direktur Umum & SDM………. -Tanggal : 22 November 2007
TEKNIK & PEMELIHARAAN
MEKANIK BANGUNAN &
LINGKUNGAN LISTRIK & ENERGI
Secara struktural, BagianTeknik dan Pemeliharaan berada langsung di bawah Plant Manager yang mempunyai tugas :
1. Menunjang keberadaan pabrik sehingga produksi dapat berjalan dengan lancar.
2. Pemeliharaan mesin-mesin, listrik dan bangunan.
3. Pemeliharaan rumah dinas baik listrik dan bangunannya.
Bagian Teknik dan Pemeliharaan membawahi 3 seksi , yaitu:
1. Seksi Bangunan dan Lingkungan yang berhubungan dengan perbaikan prasarana gedung yaitu perawatan bangunan pabrik, peralatan kantor dan pengecatan.
2. Seksi Elektrik dan Instalasi Energi yang berhubungan dengan instalasi listrik, instalasi pipa, telepon, kompresor, AC, komponen elektronik maupun komputer.
3. Seksi Mekanik yang berhubungan dengan mesin-mesin produksi.
Sumber daya manusia yang ada pada bagian ini ada 29 orang yang terdiri 3 supervisor, 11 pelaksana listrik, 10 pelaksana mekanik, 4 orang sipil bangunan, 1 orang bagian administrasi.
Alur kerja teknik dan Pemeliharaan:
1. Dimulai apabila ada kerusakan atau gangguan pada salah satu bagian. Bagian tersebut akan membuat Surat Perintah Perbaikan Teknik (SPPT) yang ditujukan ke Bagian Teknik dan Pemeliharaan.
3. Seksi akan menulis kebutuhan barang untuk perbaikan sarana. Jika sparepart tersebut sudah ada di gudang teknik maka Bagian Teknik dan Pemeliharaan dapat langsung memperbaiki peralatan tersebut dengan mengirim Surat Pemintaan Barang Teknik (SPBT) ke gudang teknik. Apabila dibutuhkan sparepart dan di gudang tidak tersedia (habis) maka diterbitkan Surat Permintaan Pesanan Barang oleh Gudang Teknik yang disahkan oleh AMTP dan disetujui oleh Plant Manager kemudian diserahkan ke AMB.
Apabila kerusakan tidak dapat diperbaiki oleh Bagian teknik dan Pemeliharaan maka dapat melibatkan pihak ketiga.
1. Bagian Pemeliharaan akan mencari pihak ketiga dan meminta penawaran terlebih dahulu dan dilaporkan kepada bagian terkait.
2. Apabila Plant Manager setuju maka bagian pemeliharaan akan membuat SPK kepada pihak ketiga.
Jika peralatan tersebut telah diperbaiki (SP), maka bagian teknik akan memeriksa peralatan tersebut dan bila sudah sesuai, maka Kepala Bagian terkait akan menandatangani SPK di kolom persetujuan dan kolom mengetahui untuk ditandatangani oleh Plant Manajer
3.7 Bagian Penyimpanan
STRUKTUR ORGANISASI PENYIMPANAN PLANT BANDUNG
-Direktur Umum & SDM………. -Tanggal : 22 November 2007 PENYIMPANAN
SENTRAL PENANDAAN BAHAN KEMAS
Gambar 3.18 Struktur Organisasi Penyimpanan Plant Bandung
diketahui barang yang dikirim ternyata etiketnya berbeda dengan pesanan, atau kemasan yang diterima dalam keadaan tidak baik, maka bagian Gudang akan menolak barang tersebut.
Bila barang yang datang sesuai dengan pesanan maka pihak gudang akan mengeluarkan Bukti Terima Barang Sementara (BTBS) yang diberikan kepada pemasok atau supplier dan ditembuskan ke bagian PPPI, Pembelian, Laboratorium Pengujian dan pada gudang sendiri yang akan disimpan sebagai arsip. Selanjutnya Bagian Laboratorium Pengujian melakukan sampling terhadap barang yang baru datang tersebut untuk dilakukan serangkaian pemeriksaan dan pengujian apakah barang tersebut sesuai dengan spesifikasi atau tidak. Sehingga Bagian Laboratorium Pengujian yang menyatakan barang tersebut diterima atau ditolak. Bila barang tersebut ditolak maka akan diserahkan ke supplier lagi, dan bila diterima akan disimpan dibagian gudang. Bagian Laboratorium Pengujian akan memberikan Laporan Analisa (LA) sebagai bukti bahwa barang telah diuji dan memenuhi spesifikas yang ditentukan. Selanjutnya pihak gudang akan mengeluarkan Bukti Penerimaan Barang (BPB) rangkap enam, lembar pertama, ketiga, kelima diserahkan ke bagian pembelian yang akan diteruskan ke supplier, lembar kedua, keempat diserahkan ke bagian keuangan dan lembar keenam digunakan sebagai arsip gudang. Kemudian petugas gudang akan memindahkan barang atau bahan pesanan ke tempatnya.
3.8 Bagian Keselamatan, Kesehatan Kerja dan Lingkungan (K3L)
Bagian K3L bertanggung jawab terhadap keselamatan dan kesehatan tenaga kerja dan masalah pengelolaan limbah industri. Untuk menjamin keselamatan dan kesehatan tenaga kerja, serta menciptakan lingkungan kerja yang aman diterapkan sistem manajemen keselamatan dan kesehatan kerja sesuai dengan peraturan Depnaker. Pengelolaan limbah di Kimia Farma dilakukan sesuai dengan jenis limbahnya. Untuk limbah padat berupa ampas kina, diolah menjadi briket, dan limbah B3 pemusnahan dengan menggunakan incinerator oleh pihak III, sedangkan untuk limbah cair diolah di Instalasi Pengolahan Air Limbah (IPAL).
Pada Instalasi Pengolahan Air Limbah (IPAL) sebagian besar mengelola limbah yang berasal dari proses kulit kina dan sebagian lagi dari limbah formulasi. Limbah yang dihasilkan dibedakan menjadi limbah padat dan limbah cair. Limbah ini akan diolah yang melibatkan proses fisika, kimia dan biologi.
Proses fisika
Proses kimia
Pada proses ini dilakukan penambahan asam fosfat untuk menetralkan limbah cair yang bersifat basa. Selanjutnya limbah diproses secara biologi. Fungsi dari asam fosfat disini juga untuk menurunkan COD
Proses biologi
Tabel 3.1 Parameter Pemeriksaan Air Limbah
Parameter Kadar maksimal (ppm) BOD
COD TSS Total N
Fenol PH Debit
100 300 100 30 1,0 6,0-9,0
BAB IV PEMBAHASAN
Sesuai dengan Surat Keputusan Menteri Kesehatan RI No. 43/ Menkes/ II/1988 pada tanggal 2 Februari 1988. Pada tahun 2006, pemerintah Indonesia telah memperbarui CPOB ini yang kemudian lebih dikenal dengan CPOB Terkini atau cGMP (Current GMP). Penerapan CPOB menyangkut seluruh aspek produksi dan mengendalikan mutu dan bertujuan untuk menjamin bahwa setiap produk obat yang dibuat senantiasa akan memenuhi persyaratan mutu yang telah ditentukan sesuai dengan tujuan penggunaannya.
Aspek CPOB Terkini (CPOB: 2006) terdiri atas Sistem Manajemen Mutu, Personalia, Bangunan dan Sarana Penunjang, Peralatan, Sanitasi dan Higiene, Produksi, Pengawasan Mutu, Inspeksi diri dan Audit Mutu, Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian, Dokumentasi, Pembuatan dan Analisis berdasarkan Kontrak, Kualifikasi dan Validasi.
termasuk pemilihan fasilitas produksi yang paling layak untuk dikembangkan sehingga produk obat industri farmasi Indonesia mampu menembus pasar dunia karena khasiat dan mutu obat lebih terjamin, (3) peningkatan company image dan volume pasar, (4) menghindari produk yang tidak memenuhi syarat dan pemborosan biaya, (5) menghindari resiko regulasi serta, (6) lebih menjamin waktu pemasaran. Diharapkan dengan penerapan CPOB yang terbaru ini industri farmasi di Indonesia akan siap menghadapi globalisasi pasar farmasi yang sudah di depan mata.
PT. Kimia Farma (Persero) Tbk Plant Bandung merupakan salah satu BUMN dalam bidang kesehatan yang memproduksi obat dengan tujuan meningkatkan derajat kesehatan masyarakat secara optimal. Sebagai suatu industri yang memproduksi obat, maka seluruh aspek CPOB harus diterapkan. Aspek-aspek tersebut meliputi personalia, peralatan, bangunan, sanitasi dan hygiene, produksi, pengawasan mutu, inspeksi diri, penanganan terhadap keluhan dan penarikan kembali produk yang telah beredar serta dokumentasi.
Secara struktur organisasi, PT. Kimia Farma Plant Bandung telah terstruktur dengan baik. Ada pembagian tugas yang jelas antara tiap bagian dan seksi. Juga telah sesuai dengan peraturan CPOB bahwa bagian produksi dan bagian pengawasan mutu dipimpin oleh seorang yang berlainan yang tidak saling bertanggung jawab satu terhadap yang lain.
bagian pengawasan mutu dipimpin oleh seorang yang berlainan yang tidak saling bertanggung jawab satu terhadap yang lain.
Personalia atau SDM memegang peranan yang penting dalam suatu perusahaan sehingga harus dikelola dengan baik dengan tujuan untuk meningkatkan produktivitas dan kemampuan kerja. PT. Kimia Farma Plant Bandung juga melakukan pelatihan-pelatihan bagi karyawan-karyawannya sesuai dengan tugasnya ataupun mengenai CPOB. Tujuan dari pelatihan ini adalah untuk menjamin agar karyawan terbiasa bekerja dengan persyaratan CPOB yang berkaitan dengan tugasnya. Catatan pelatihan karyawan mengenai CPOB disimpan dan efektivitas program pelatihan dinilai untuk menentukan prestasi karyawan tersebut, apakah mereka telah memiliki kualifikasi yang memadai dan berpengaruh terhadap kenaikan jabatan bagi karyawan tersebut. Penerapan falsafah ‘Kerjakan apa yang tertulis dan tulis apa yang dikerjakan’ terus ditekankan pada seluruh karyawan terutama yang bekerja di Bagian Produksi dan Pengawasan Mutu.
Ruangan dalam gedung produksi telah memenuhi persyaratan CPOB meliputi dinding, lantai dan langit-langit terbuat dari epoxy dengan permukaan yang halus, rata dan licin serta pertemuan antara dinding dengan lantai tidak membentuk sudut sehingga lebih mudah dibersihkan, tidak menyerap lembab serta tidak menahan debu. Ruang produksi juga telah dilengkapi dengan system sirkulasi udara yang dapat mengurangi debu dengan pengaturan tekanan udara sehingga dapat menekan kontaminasi silang. Selain itu terdapat juga ruang antara yang memisahkan Grey Area dan Black Area. Pada pelaksanaannya ruang antara masih memungkinkan terjadinya kontaminasi silang karena kedua pintu dibuka bersamaan. Hal ini terjadi karena kedisiplinan karyawan yang kurang. Idealnya adanya air lock antar ruang yang berbeda area, apabila salah satu pintu terbuka, maka pintu lain tidak terbuka sehingga mengurangi debu yang lolos ke ruang sebelahnya. Bangunan produksi tablet hormon dipisahkan dengan produksi yang lain karena sangat berbahaya efeknya jika terjadi kontaminasi silang.
ketelitiannya secara teratur serta dikalibrasi secara periodik. Hasil pemeriksaan dan kalibrasi dicatat dan disimpan untuk mengetahui pemeriksaan berikutnya. Dalam hal ini Plant Bandung mempunyai supervisor kalibrasi untuk melakukan kalibrasi seluruh peralatan pengujian yang ada di Plant Bandung dan mengendalikan semua alat di laboratorium pengujian baik masalah kalibrasi maupun kerusakan.
Tingkat sanitasi dan hygiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan hygiene meliputi personalia, bangunan, peralatan, perlengkapan, bahan produksi dan wadahnya dan setiap hal dapat merupakan sumber pencemaran produk. Sumber pencemaran hendaklah dihilangkan melalui suatu program sanitasi dan hygiene yang menyeluruh dan terpadu. Sanitasi dan hygiene di lingkungan Plant Bandung telah dilaksanakan cukup baik dan dapat dilihat dari kebersihan lingkungan yang selalu terjaga. Selain itu, untuk mendukung terciptanya hygiene maka karyawan yang memasuki ruang produksi menggunakan pakaian khusus yang disediakan, sarung tangan, masker, tutup kepala dan sepatu khusus. Pembersihan ruangan dilakukan secara rutin setiap hari sesuai protap yang ada. Pembersihan peralatan, perlengkapan dan ruangan produksi dilakukan sebelum dan sesudah proses produksi. Fasilitas pendukung sanitasi seperti ventilasi, toilet dan tempat sampah sudah cukup memadai.
memenuhi standar baku buangan industri yang sesuai dengan peraturan pemerintah yang berlaku. Air buangan hasil pengolahan limbah dialirkan ke sungai Cikapundung. Limbah padat ampas kina yang telah dihilangkan SGO nya dibuang ke Tempat pembuangan Akhir (TPA), sedangkan limbah padat sisa produksi obat dimusnahkan di Prasarana Pemusnah Limbah Industri.
Proses pelaksanaan produksi di PT. Kimia Farma Plant bandung telah memenuhi aturan CPOB serta memiliki alur kerja yang tersusun rapi, sehingga memudahkan penelusuran jika ada ketidaksesuaian yang timbul. Sesuai dengan filosofi ”Kerjakan apa yang tertulis dan tulis apa yang dikerjakan” maka seluruh proses produksi dituangkan dan ditulis dalam CPB/CKB yang menjamin adanya konsistensi cara dan pelaksanaan produksi. CPB dan CKB merupakan panduan bagi pelaksana produksi dan memuat seluruh catatan pembuatan produk dalam satu batch. Selain itu dengan adanya In Process Control (IPC) pada tiap tahap produksinya akan memungkinkan meminimalisasi kesalahan yang terjadi serta meningkatkan mutu produk yang dihasilkan. Proses produksi dan pengolahan telah memenuhi aturan CPOB yaitu antara lain pelaksanaan produksi sesuai prosedur tertulis yang ditetapkan CPB, bahan baku yang digunakan diperiksa terlebih dahulu identitasnya, dan jumlah yang digunakan untuk produksi sesuai dengan yang tertera pada CPB.