Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
PT. Kimia Farma (Persero) Tbk. Plant Bandung
Disusun oleh:
Beby Amelia Rangkuti S. Farm. 083202005
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
KATA PENGANTAR
Puji syukur kami panjatkan kepada Allah SWT atas limpahan rahmat dan karunia-Nya sehingga Praktek Kerja Profesi (PKP) di indu stri farmasi PT. Kimia Farma (Persero) Tbk. Plant Bandung dapat berjalan dengan baik.
PT. Kimia Farma Plant Bandung bagian dari PT. Kimia Farma (Persero) Tbk. merupakan salah satu industri farmasi BUMN yang mempunyai komitmen terhadap mutu. Seluruh proses produksi tidak hanya telah diakui oleh pemerintah dengan diberikannya sertifikat CPOB tetapi juga telah memperoleh sertifikat ISO 9001 versi 2000 yang merupakan pengakuan internasional atas dijalankannya sistem manajemen mutu yang dari penerapannya diharapkan terwujud suatu produk yang bermutu.
Penyusunan laporan Praktek Kerja Profesi ini merupakan salah satu syarat untuk memperoleh gelar apoteker di Fakultas Farmasi Universitas Sumatera Utara, Medan. Pelaksanaan PKP ini berlangsung sejak tanggal 13 April – 29 Mei 2009. Dalam menjalankan Praktek Kerja Profesi, banyak pihak yang membantu dan membimbing kami dalam melaksanakan PKP tersebut. Pada kesempatan ini, kami memberikan penghargaan dan ucapan terima kasih kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra., Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara, Medan.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
3. Bapak Drs. Abdullah Basuki, Apt. selaku Plant Manager PT. Kimia Farma (Persero) Tbk.. Plant Bandung yang telah memberikan kesempatan dan izin kepada kami untuk melaksanakan Praktek Kerja Lapangan.
4. Bapak Drs. Beben Budiman, Apt. selaku pembimbing dari PT. Kimia Farma (Persero) Tbk.. Plant Bandung yang telah memberikan bimbingan, arahan dan pengetahuan selama pelaksanaan Praktek Kerja Lapangan.
5. Seluruh Manager, Asisten Manager beserta staf dan karyawan PT. Kimia Farma (Persero) Tbk. Plant Bandung, khususnya bagian Pemurnian Kina: Bu Nia Banyuniasih, Pak Samingan, Pak Ipul dan seluruh staf pemurnian kina yang telah membimbing dan membantu kami selama menjalankan Praktek kerja Lapangan.
6. Seluruh dosen Fakultas Farmasi dan Program Profesi apoteker Universitas Sumatera Utara Medan yang telah memberikan ilmu pengetahuan bagi kami. 7. Kedua orang tua atas semangat, bantuan moril dan materil yang tak ternilai. 8. Teman senasib seperjuangan Fitri dan Ike (UNPAD Bandung), Beti dan Friesa
(UGM Yogyakarta), Deva dan Hendri (UNAIR Surabaya), Budi dan Ganjar (UNJANI Cimahi), atas kerja sama dalam Praktek Kerja Profesi ini.
9. Rekan-rekan Program Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara Medan yang saling mendukung dalam pelaksanaan Program Profesi Apoteker.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
Akhir kata, semoga laporan Praktek Kerja Profesi ini dapat bermanfaat dan menambah pengetahuan bagi pembaca serta bermanfaat bagi perkembangan industri farmasi.
Bandung, Mei 2009 Penulis,
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
DAFTAR ISI
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... vi
DAFTAR GAMBAR ... ix
DAFTAR TABEL ... x
DAFTAR LAMPIRAN ... xi
RINGKASAN ... xii
BAB I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 3
BAB II. TINJAUAN UMUM INDUSTRI FARMASI ... 4
2.1 Sejarah PT Kimia Farma (Persero) Tbk ... 4
2.1.1 Tinjauan Umum PT Kimia Farma (Persero) Tbk Plant Bandung ... 7
2.2 Visi dan Misi ... 10
2.2.1 Visi ... 10
2.2.2 Misi ... 10
2.3 Lokasi dan Sarana Produksi ... 10
2.3.1 Lokasi ... 10
2.3.2 Sarana Produksi ... 11
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
2.4.1 Manajemen Mutu ... 12
2.4.2 Personalia ... 13
2.4.3 Bangunan dan Fasilitas ... 14
2.4.4 Peralatan ... 14
2.4.5 Sanitasi dan Higiene ... 15
2.4.6 Produksi ... 15
2.4.7 Pengawasan Mutu ... 17
2.4.8 Inspeksi Diri dan Audit Mutu ... 18
2.4.9 Penanganan Keluhan terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian ... 18
2.4.10 Dokumentasi ... 19
2.4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 20
2.4.12 Kualifikasi dan Validasi ... 20
BAB III. KEGIATAN DI INDUSTRI FARMASI PT KIMIA FARMA (PERSERO) Tbk PLANT BANDUNG .... 22
3.1 Keterlibatan dalam Produksi... 22
3.2 Tinjauan ke Bagian-Bagian Lain ... 22
3.2.1 Umum dan Administrasi Personalia ... 22
3.2.2 Bagian PPPI ... 23
3.2.3 Bagian Pembelian ... 24
3.2.4 Bagian Pemastian Mutu ... 25
3.2.5 Bagian Produksi ... 26
3.2.6 Bagian Teknik dan Pemeliharaan ... 28
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
3.2.8 Bagian Keselamatan, Kesehatan Kerja dan
Lingkungan (K3L) ... 30
BAB IV. PEMBAHASAN ... 33
BAB V. KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
LAMPIRAN ... 45
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Organisasi Plant Bandung ... 9
Gambar 2. Struktur Organisasi Umum dan AdministrasiPersonalia Plant Bandung ... 22
Gambar 3. Struktur Organisasi Perencanaan, Pengendalian Produksi dan Inventori Plant Bandung ... 23
Gambar 4. Struktur Organisasi Bagian Pembelian Plant Bandung ... 24
Gambar 5. Struktur Organisasi Bagian Pemastian Mutu Plant Bandung ... 25
Gambar 6. Struktur Organisasi Produksi Plant Bandung ... 26
Gambar 7. Struktur Organisasi Bagian Teknik dan Pemeliharaan Plant Bandung ... 28
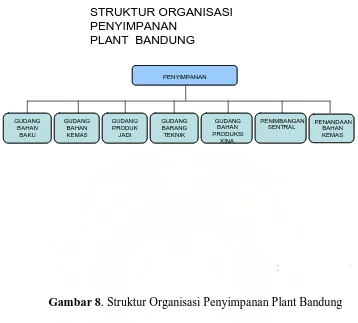
Gambar 8. Struktur Organisasi Bagian Penyimpanan Plant Bandung ... 29
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
DAFTAR TABEL
Halaman
Tabel 1. Perbandingan Spesifikasi Kina Sulfat dari Beberapa Monografi ... 64
Tabel 2. Perbandingan Spesifikasi Sinkonidin dari Beberapa Monografi. ... 69
Tabel 3. Kapasitas Produksi Kina Sulfat dan Sinkonidin ... 88
Tabel 4. Jadwal Proses Kina Sulfat ... 89
Tabel 5. Jadwal Proses Sinkonidin ... 90
Tabel 6. Pengamatan Proses Pembersihan (Cleaning) di Gedung Pemurnian Kina. ... 91
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alur Pengadaan Bahan Produksi Oleh Bagian Pembelian ... 45
Lampiran 2. Alur Pengadaan Barang Teknik ... 46
Lampiran 3. Alur Produksi Serbuk Oralit Plant Bandung ... 47
Lampiran 4. Alur Produksi Sirup Plant Bandung ... 48
Lampiran 5. Alur Produksi Suspensi Plant Bandung ... 49
Lampiran 6. Alur Produksi Batugin Elixir Plant Bandung ... 50
Lampiran 7. Alur Produksi Enkasari Plant Bandung ... 51
Lampiran 8. Alur Produksi Tablet Plasebo Plant Bandung ... 52
Lampiran 9. Alur Pengemasan Tablet Hormon Plant Bandung ... 53
Lampiran 10. Alur Proses Pembuatan AKDR Plant Bandung ... 54
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
RINGKASAN
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kesehatan merupakan salah satu indikator tingkat kesejahteraan manusia sehingga menjadi prioritas dalam pembangunan nasional suatu bangsa. Hal ini terkait dengan upaya peningkatan kualitas sumber daya bangsa tersebut. Dengan sumber daya manusia yang berkualitas maka akan semakin meningkatkan daya saing bangsa dalam era persaingan global saat ini.
Salah satu tujuan dari pembangunan nasional adalah pembangunan di bidang kesehatan dengan mewujudkan dan meningkatkan derajat kesehatan seluruh masyarakat Indonesia. Beberapa langkah kerja yang dilakukan pemerintah dalam rangka pembangunan nasional di bidang kesehatan meliputi tercukupinya ketersediaan obat, meratanya pendistribusian obat, serta terjangkaunya harga obat oleh masyarakat. Oleh karena itu, pengadaan dan produksi obat yang dalam hal ini dilakukan oleh industri farmasi akan mempengaruhi ketersediaan obat yang dibutuhkan masyarakat.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
bermutu yaitu dengan CPOB (Cara Pembuatan Obat yang Baik). Pada tahun 2006, pemerintah telah memperbarui CPOB ini, yang kemudian lebih dikenal dengan CPOB Terkini atau cGMP (Current GMP).
Di sisi lain, pemberlakuan c-GMP bagi industri farmasi di Indonesia ternyata membawa berbagai konsekuensi, salah satunya adalah meningkatnya peran apoteker (pharmacist) di industri farmasi. Hal ini tentunya harus diimbangi dengan kesiapan dan profesionalisme para apoteker itu sendiri.
Dalam era perdagangan bebas dimana industri farmasi di Indonesia akan bersaing dengan industri farmasi dari negara lain maka penerapan CPOB saja belum cukup maka dari itu dituntut untuk memenuhi persyaratan sistem mutu yang berlaku secara internasional, salah satunya dengan mendapatkan sertifikat
International Organization for Standardization (ISO).
Sertifikat ISO 9000 merupakan jaminan sistem pengelolaan mutu dan memberikan kerangka kerja untuk pengolahan yang efektif dan dengan seri ISO 9000 sekaligus merupakan promosi pengembangan perdagangan. Sedangkan sistem manajemen lingkungan, sistem ramah lingkungan yang menekankan pada dokumentasi dan penerapannya sebagai bukti obyektif dari jaminan mutu diatur dalam seri ISO 14000. Dengan memperoleh pengakuan ISO maka akan meningkatkan kredibilitas perusahaan dalam hal kemudahan memasuki pasar bebas dan sekaligus merupakan kemajuan perusahaan.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
penerapan dari konsep-konsep farmasi industri yang ada di lapangan dan mengetahui aplikasi ilmu selain ilmu kefarmasian yang tidak didapat di pendidikan formal kuliah.
Untuk mendukung tercapainya hal tersebut, Program Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara bekerja sama dengan industri farmasi PT. Kimia Farma (Persero) Plant Bandung melaksanakan kegiatan Praktek Kerja Profesi (PKP) bagi peserta program profesi yang telah memilih bidang industri farmasi.
1.2 Tujuan PKP
Setelah mengikuti Praktek Kerja Profesi diharapkan peserta program profesi mampu:
1. Memahami peran dan tanggung jawab apoteker di industri farmasi.
2. Mengetahui pelaksanaan CPOB yang telah dilaksanakan oleh industri farmasi.
3. Mengetahui kegiatan yang dilakukan di industri farmasi secara utuh dan terpadu.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
BAB II
TINJAUAN TENTANG PT. KIMIA FARMA (PERSERO) Tbk
2.1 Sejarah PT Kimia Farma (Persero) Tbk
PT Kimia Farma (Persero) Tbk merupakan salah satu Badan Usaha Milik Negara (BUMN) yang bergerak di bidang kefarmasian, mulai dari
produksi bahan baku obat, produksi obat jadi, sampai pada pemasaran yang meliputi Apotek dan Pedagang Besar Farmasi (PBF).
Pada tahun 1896, melalui akte notaris B.V. Houthuisen No. 12 tanggal 29 Juni 1896 di Bandung, didirikan sebuah pabrik kina oleh pemerintah Hindia Belanda dengan nama Bandoengsche Kinine Fabriek N. V, yang mula-mula hanya menghasilkan garam kina dari kulit kina. Pengolahan pabrik kina ini kemudian diserahkan pada Indische Combinatie Voor Chemische Industrie (Inschen) pada tanggal 14 Januari 1939 dan Inschen sendiri telah memiliki pabrik yodium di Watudakon yang didirikan pada tahun 1926.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
Setelah Jepang dikalahkan Sekutu pada tahun 1945, pabrik kina diambil alih oleh pemiliknya, yaitu perusahaan swasta Belanda dengan nama Bandoengsche Fabriek N. V pada tahun 1955, pabrik kina ini diserahkan pada Combinatie Voor Chemische Industrie dengan akte Mr. R. Soewardi No. 47/1954 tanggal 3 November 1954.
Tahun 1958, berhubung adanya sengketa Irian Barat antara Indonesia dan Belanda, maka semua perusahaan Belanda yang ada di Indonesia dikuasai oleh pemerintah RI dengan membentuk Badan Pimpinan Umum (BPU) berdasarkan PP No. 23 tahun 1958. Berdasarkan UU No. 86 tahun 1958, perusahaan di bawah BPU ini menjadi milik RI yang pelaksanaannya diserahkan kepada Badan Nasionalisasi Perusahaan-perusahaan Belanda (BANAS). Pada tahun 1960, pabrik kina diberi nama Perusahaan Negara (PN) Farmasi dan Alat Kesehatan Bhinneka Kina Farma berdasarkan SP Menkes No. 57/959/BPK/Kob tanggal 18 Juli 1960. Pada tahun 1961, berdasarkan PP No. 85 tanggal 17 April 1961, namanya diubah menjadi Perusahaan Negara Farmasi (PNF) dan Alat-alat Kesehatan Bhinneka Kina Farma yang meliputi pabrik Yodium di Watudakon Mojokerto, Jawa Timur.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
Kimia Farma Unit III Bidang Produksi Bandung, dan PNF Sari Husada (Yogyakarta) menjadi PNF Bhinneka Kimia Farma Unit IV Bidang Produksi Yogyakarta.
Pada tahun 1971, berdasarkan PP No. 16 tahun 1971 dalam lembaran negara RI No. 18 tahun 1971, PNF dan Alat-alat Kesehatan Bhinneka Kimia Farma unit I sampai unit IV diubah menjadi PT (Persero) Kimia Farma terhitung mulai bulan Agustus 1971 melalui Akte Notaris Sulaeman Ardjasasmita tanggal 16 Agustus 1971 dan mengganti nama semua unit perusahaan yaitu Unit I menjadi Unit Perdagangan, Unit II menjadi Unit Produksi Jakarta, Unit III menjadi Unit Produksi Bandung, Unit IV menjadi Unit Produksi Yogyakarta. Pada pertengahan 1974, PNF Sari Husada (PT Kimia Farma Unit Produksi Yogyakarta) memisahkan diri dari PT (Persero) Kimia Farma.
Tahun 1990, Unit Produksi Bandung menjadi tiga unit yaitu Unit Formulasi Bandung, Unit Produksi Manufaktur Bandung, dan Unit Produksi Manufaktur Watudakon. Pemisahaan unit ini diikuti dengan penggabungan pabrik pil KB ke dalam Produksi Formulasi Bandung.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
2.2 Struktur Organisasi
Manager Plant Bandung membawahi tiga manager yaitu Manager Produksi, Manager Pemastian Mutu dan Manajer PPPI, serta tujuh bagian yang dikepalai oleh Asisten Manager yaitu Bagian Teknik dan Pemeliharaan, Bagian Penyimpanan, Bagian Pembelian, K3L, Bagian Umum & Administrasi Personalia, Bagian Akuntansi Bandung, Bagian Keuangan Bandung, Bagian Teknologi Informasi plant Bandung. Bagian lainnya dikepalai oleh supervisor yaitu Bagian KTO Bintang.
Beby Amelia Rangkuti : Laporan Praktek Kerja Profesi Farmasi Industri Di PT. Kimia Farma (Persero) Tbk.Plant Bandung, 2009.
STRUKTUR ORGANISASI
PLANT BANDUNG
PLANT BANDUNG
PRODUKSI PEMASTIAN MUTU
PRODUKSI I
PENGAW ASAN MUTU PENGEMBANGAN
PENGENDALIAN MUTU
22 2.2 Visi dan Misi
2.2.1 Visi
Visi :
Perusahaan farmasi utama di Indonesia dan berdaya saing di pasar global.
2.2.2 Misi :
Menyediakan, mengadakan dan menyalurkan sediaan farmasi, alat
kesehatan dan jasa kesehatan lainnya, yang berkualitas dan bernilai tambah untuk memenuhi kebutuhan masyarakat.
Mengembangkan bisnis farmasi dan jasa kesehatan lainnya untuk
meningkatkan nilai perusahaan bagi pemegang saham, karyawan dan pihak lain yang berkepentingan, tanpa meninggalkan prinsip-prinsip Good Corporate Governance.
Mengembangkan SDM perusahaan untuk meningkatkan kompetensi
dan komitmen guna pengembangan perusahaan serta dapat berperan aktif dalam pengembangan industri farmasi nasional.
2.3 Lokasi dan Sarana Produksi
2.3.1 Lokasi
Industri Kimia Farma Plant Bandung berlokasi di Jl. Padjajaran no 29-31 Bandung.
2.3.2 Sarana Produksi
Sarana produksi di Industri Kimia Farma Plant Bandung terdiri atas :
• Peralatan dan mesin untuk produksi I (tablet).
• Peralatan dan mesin untuk produksi II (serbuk oralit, sirup, suspense dan
23
• Peralatan dan mesin untuk produksi III (kina, hormone dan AKDR).
2.4 Aspek CPOB
CPOB merupakan bagian dari sistem Pemastian Mutu yang mengatur dan memastikan obat diproduksi dan mutunya dikendalikan secara konsisten sehingga produk yang dihasilkan memenuhi persyaratan mutu yang telah ditetapkan sesuai dengan tujuan penggunaan produk disamping persyaratan lainnya, sehingga produk tersebut aman dikonsumsi dan diterima oleh masyarakat. Penerapan CPOB di industri farmasi dimaksudkan untuk menghindari terjadinya kesalahan dalam proses produksi obat sehingga tidak membahayakan jiwa manusia.
Perkembangan yang sangat pesat dalam teknologi farmasi dewasa ini mengakibatkan perubahan yang sangat cepat dalam konsep serta persyaratan CPOB. Sebagai upaya untuk meningkatkan kualitas dan kemampuan industri farmasi nasional, Badan POM RI selaku regulator industri farmasi nasional, telah memberlakukan CPOB edisi tahun 2006 (CPOB Terkini/cGMP).
Dalam Pedoman CPOB tahun 2006, terdapat dua belas aspek yang harus dipenuhi dalam penerapan CPOB, yaitu:
2.4.1 Manajemen Mutu
24
dan komitmen dari semua jajaran di semua departemen dalam perusahaan, para pemasok dan para distributor.
Unsur dasar manajemen mutu adalah sistem mutu dan pemastian mutu. Sistem mutu mencakup struktur organisasi, prosedur, proses dan sumber daya. Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan penggunaanya. Sedangkan pengawasan mutu adalah bagian dari CPOB yang berhubungan dengan pengambilan sampel, spesifikasi, dan pengujian, serta dengan organisasi, dokumentasi dan prosedur pelulusan. Setiap industri farmasi hendaklah mempunyai fungsi pengawasan mutu.
Dalam bab manajemen mutu, dijelaskan pula mengenai pengkajian mutu produk. Pengakajian mutu produk dilakukan secara berkala terhadap semua obat terdaftar, termasuk ekspor dengan tujuan membuktikan konsistensi proses, kesesuaian dari spesifikasi bahan awal, bahan pengemas dan obat jadi untuk melihat tren dan mengidentifikasi perbaikan yang diperlukan untuk produk dan proses.
2.4.2 Personalia
25
awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan.
Personil kunci mencakup kepala bagian produksi, kepala bagian pengawasan mutu dan kepala bagian manajemen mutu (pemastian mutu). Kepala produksi dan manajeman mutu hendaklah seorang apoteker yang terdaftar dan terkualifikasi dan memiliki pengalaman praktis. Kepala bagian pengawasan mutu hendaklah diutamakan seorang terkualifikasi dan lebih diutamakan seorang apoteker. Dalam CPOB 2006 dijelaskan bahwa dalam struktur organisasi industri farmasi bagian produksi, manajemen mutu atau pengawasan mutu dipimpin oleh orang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Mengenai pelatihan, industri farmasi hendaklah memberikan pelatihan bagi seluruh karyawan yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk karyawan teknik, perawatan, dan petugas kebersihan) dan karyawan lain yang kegiatannya akan berdampak pada mutu produk. Pelatihan diberikan secara berkesinambungan dan efektif penerapannya serta dinilai secara berkala.
2.4.3 Bangunan dan Fasilitas
26
pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil resiko terjadinya kekeliruan, kontaminasi silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat. Serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari kontaminasi silang.
2.4.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan. Peralatan yang bersentuhan dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi, absorbsi yang dapat mempengaruhi identitas, mutu atau kemurnian. Peralatan ditempatkan sedemikian rupa untuk memperkecil kemungkinan terjadinya pencemaran silang antar bahan di area yang sama. Peralatan satu sama lain ditempatkan pada jarak yang cukup untuk menghindari kesesakan serta memastikan tidak terjadi kekeliruan dan campur-baur produk. Peralatan dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang bisa mempengaruhi identitas, mutu atau kemurnian dari produk.
2.4.5 Sanitasi dan Higiene
27
pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
Untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan karyawan, maka karyawan diharuskan mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya. Tersedia dalam jumlah cukup, sarana toilet dengan ventilasi yang baik dan sarana memadai untuk penyimpanan pakaian karyawan.
2.4.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan, dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Produksi hendaklah dilakukan dan diawasi oleh karyawan yang kompeten.
Aspek produksi mencakup: perlakuan terhadap bahan awal, validasi proses, pencegahan pencemaran silang, sistem penomoran bets atau lot, penimbangan dan penyerahan serta pengembalian, pengolahan bahan dan produk kering, bahan pengemas, kegiatan pengemasan, pengawasan selama proses, bahan dan produk yang ditolak, dipulihkan dan dikembalikan, karantina dan penyerahan produk jadi.
28
tersebut meliputi keterangan mengenai persediaan, nomor bets atau lot, tanggal penerimaan dan pengeluaran, tanggal diluluskan dan tanggal daluawarsa.
Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan hendaknya dikarantina dan diberi label dengan nama yang dinyatakan dalam spesifikasi bahan awal yang sudah ditetapkan. Pada saat penerimaan terhadap setiap kiriman dilakukan pemeriksaan secara visual tentang kondisi umum, keutuhan wadah dan segelnya, kebocoran dan kemungkinan adanya kerusakan bahan.
Sistem yang menjabarkan penomoran bets dan lot secara rinci diperlukan untuk memastikan bahwa produk antara, produk ruahan atau produk jadi suatu bets atau lot dapat dikenali dengan nomor bets dan lots tertentu. Penomoran bets dan lot yang digunakan pada tingkat pengolahan dan pengemasan selanjutnya hendaknya saling berkaitan. Pemberian nomor bets atau lot yang dialokasikan segera di catat dalam suatu buku catatan harian.
Penimbangan dan penyerahan bahan baku, bahan pengemas, produk antara dan produk ruahan dianggap suatu bagian dari siklus produksi dan memerlukan dokumentasi dan rekonsiliasi yang lengkap. Sebelum melakukan penimbangan dilakukan pemeriksaan kebenaran penandaan bahan baku termasuk label pelulusan. Kapasitas, ketepatan dan ketelitian alat timbangan dan alat ukur yang digunakan harus sesuai dengan jumlah bahan yang ditimbang.
29
dan penghisap udara. Kondisi daerah pengolahan dipantau dan dikendalikan sampai tingkat yang disyaratkan. Sebelum pengolahan dimulai ditempuh langkah yang menjamin bahwa daerah pengolahan dan peralatan bebas dari bahan, produk yang tidak diperlukan.
Pada validasi proses, prosedur produksi hendaknya divalidasi dengan tepat. Validasi hendaknya dilaksanakan menurut prosedur yang telah ditentukan dan catatan hasilnya disimpan. Luas serta tingkat validasi yang dilakukan tergantung dari sifat dan kerumitan produk dan proses yang bersangkutan. Perubahan yang berarti dalam proses, peralatan, atau bahan hendaknya disertai dengan tindakan ulang, untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang memenuhi spesifikasi yang telah ditetapkan.
2.4.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari CPOB untuk memberikan kepastian mutu bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada setiap tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan pengawasan mutu dari produksi dianggap hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan yang memuaskan.
30
produk antara, produk ruahan dan produk jadi), uji stabilitas, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
2.4.8 Inspeksi Diri dan Audit Mutu
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi kriteria Cara Pembuatan Obat yang Baik (CPOB). Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Tim inspeksi ditunjuk oleh manajemen perusahaan terdiri dari sekurang-kurangnya tiga orang yang ahli dibidang pekerjaannya dan paham mengenai CPOB. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Inspeksi diri hendaklah dilakukan secara rutin, di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
2.4.9 Penanganan Keluhan terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian
31
yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, daluarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat yang bersangkutan. Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran dilakukan. Penarikan kembali produk dilakukan apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta beresiko terhadap kesehatan. Penarikan kembali produk dari peredaran dan dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut.
Keluhan terhadap obat mencakup keluhan terhadap mutu (keadaan fisik, kimia dan biologi), reaksi yang merugikan atau masalah efek terapetik (tidak berkhasiat). Semua keluhan dan laporan keluhan hendaklah diteliti dan dievaluasi dengan cermat, kemudian diambil tindak lanjut yang sesuai (diproses kembali atau dimusnahkan) dan dibuatkan laporan.
2.4.10 Dokumentasi
32
harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
2.4.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan setiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu (pemastian mutu). Bagian ini meliputi tanggung jawab industri farmasi terhadap Otoritas Pengawasan Obat (OPO) dalam hal pemberian izin edar dan pembuatan obat.
2.4.12 Kualifikasi dan Validasi
33
Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasi di dalam Rencana Induk Validasi (RIV) atau dokumen setara.
34 BAB III
KEGIATAN DI INDUSTRI FARMASI
PT. KIMIA FARMA (Persero) Tbk
PLANT BANDUNG
3.1 Keterlibatan dalam Produksi
Mahasiswa terlibat dalam proses pemurnian kina sulfat dan sinkonidin serta pemeriksaan produk jadi kina sulfat dan sinkonidin.
3.2 Tinjauan Ke Bagian-Bagian Lain
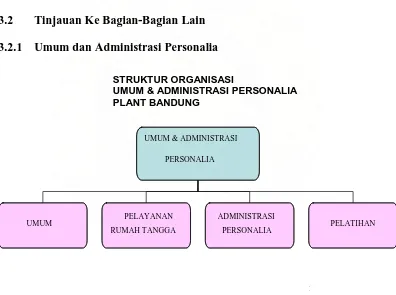
3.2.1 Umum dan Administrasi Personalia
Gambar 2. Struktur Organisasi Umum & Administrasi Personalia Plant
Bandung
Bagian Personalia secara struktural dibawah langsung oleh Plant
Manager, oleh karena itu dalam tugasnya, Asisten Manajer Bagian STRUKTUR ORGANISASI
UMUM & ADMINISTRASI PERSONALIA PLANT BANDUNG
- .
-UMUM & ADMINISTRASI
PERSONALIA
UMUM PELAYANAN
RUMAH TANGGA
ADMINISTRASI
35
Personalia bertanggung jawab langsung kepada Plant Manager. Secara umum tugas dan wewenang dari Asisten Manajer adalah:
a. Mengawasi kebenaran laporan absensi dan penilaian prestasi kerja pegawai. b. Mengusulkan kenaikan pangkat dan golongan pegawai atas rekomendasi dari
pemimpin setiap bagian.
c. Menyelenggarakan kegiatan rekruitmen dan seleksi pegawai baru. d. Mengawasi kegiatan identifikasi kebutuhan pelatihan bagi pegawai. e. Mengawasi kegiatan penggantian pengobatan pegawai.
Asisten manajer Bagian Personalia dalam menjalankan tugas dan wewenangnya dibantu oleh 4 orang supervisor, yaitu:
36 3.2.2 Bagian PPPI
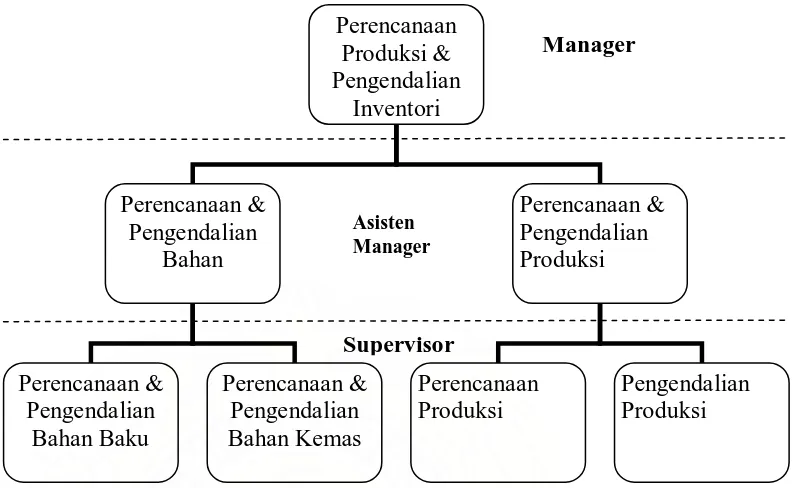
Gambar 3. Struktur Organisasi Perencanaan, Pengendalian Produksi & Inventori
Plant Bandung
Bagian PPPI bertanggung jawab memenuhi pesanan pemasaran secara tepat, baik tepat mutu, tepat jumlah maupun tepat waktu. Fungsi dari PPPI antara lain adalah:
1. Menerima target pesanan dari pemasaran sesuai dengan Prosedur Sistem Mutu Penanganan Pesanan
2. Menyusun bahan kebutuhan bahan sesuai dengan pesanan 3. Evaluasi kapasitas produksi
4. Melakukan pemesanan bahan baku/bahan kemas 5. Melakukan perencanaan dan pengendalian produksi 6. Monitoring kedatangan bahan dan pengendalian bahan
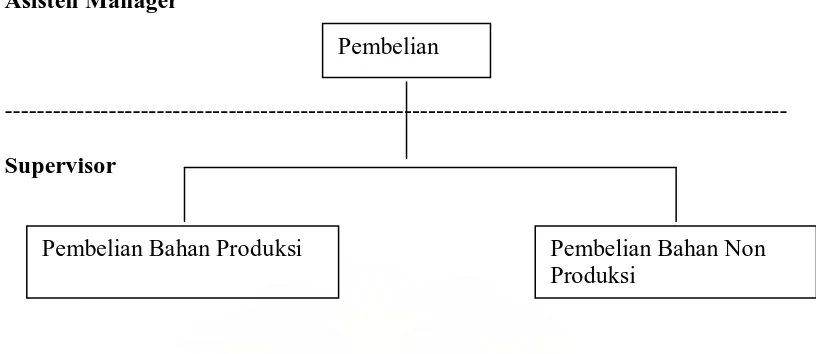
37 3.2.3 Bagian Pembelian
Asisten Manager
---
Supervisor
pembe
Gambar 4. Struktur Organisasi Bagian Pembelian Plant Bandung
Tugas Bagian Pembelian adalah:
1. Melakukan pembelian bahan produksi yaitu bahan baku dan bahan kemas 2. Melakukan pembelian bahan non produksi yang meliputi alat-alat teknik, alat
tulis kantor, alat-alat penunjang produksi, alat laboratorium dan keperluan laboratorium.
Bagian Pembelian harus dapat menjamin bahwa bahan dan jasa yang dibeli memenuhi persyaratan yang telah ditentukan dan pengadaannya dilakukan dari supplier handal yang telah diaudit dan dipercaya oleh PT. Kimia Farma. Supplier dikatakan mempunyai kinerja baik apabila memenuhi persyaratan kualitas barang yang ditawarkan, waktu pengiriman yang tepat, serta harga yang kompetitif. Bagian pembelian juga melakukan penilaian terhadap supplier dalam hal ketepatan waktu dan mutu.
Pembelian
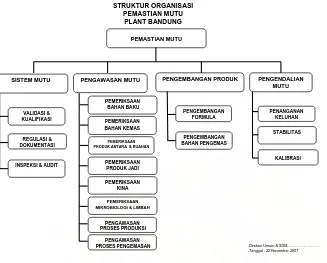
38 3.2.4 Bagian Pemastian Mutu
STRUKTUR ORGANISASI PEMASTIAN MUTU
PLANT BANDUNG
PEMASTIAN MUTU
SISTEM MUTU PENGAWASAN MUTU
PENGAWASAN PRODUK ANTARA & RUAHAN
PENGEMBANGAN PRODUK
INSPEKSI & AUDIT
KALIBRASI PENGEMBANGAN
BAHAN PENGEMAS
-Direktur Umum & SDM………. -Tanggal : 22 November 2007
PENGENDALIAN
Gambar 5. Struktur Organisasi Pemastian Mutu Plant Bandung
39 3.2.5 Bagian Produksi
STRUKTUR ORGANISASI PRODUKSI
PRODUKSI
PRODUKSI I PRODUKSI II
GRANULASI ALKALOID KINA
PEMURNIAN & PENGEMASAN KINA
Gambar 6. Struktur Organisasi Produksi Plant Bandung
Manager produksi berada langsung dibawah Plant Manager Bandung, yang membawahi tiga bagian:
1. Bagian Produksi I : Tablet
2. Bagian Produksi II : Suspensi, Sirup, Oralit serbuk, Fitofarmaka 3. Bagian Produksi III :
Produksi Kina
Tablet Hormon
AKDR (Alat Kontrasepsi Dalam Rahim)
Tugas dan tanggung jawab Manager Produksi adalah sebagai berikut:
40
2. Memberikan pengarahan teknis dan administratif untuk pelaksanaan pengolahan produksi dan pengemasan.
3. Bertanggung jawab untuk memeriksa catatan pengolahan batch serta menjamin bahwa produksi dilaksanakan sesuai prosedur pengolahan dan pengemasan batch.
4. Bertanggung jawab menyiapkan mesin yang dipakai, SDM yang terlatih dan terampil.
Alur kegiatan Bagian Produksi:
1. Bagian produksi bekerja berdasarkan SPK produksi dari PPPI yang disahkan oleh Plant Manager yang disertai CPB dan BSTBB.
2. Bagian Penimbangan Sentral (PS) merekap kebutuhan bahan baku dan meminta gudang, kemudian bahan baku ditimbang.
3. Proses produksi dimulai:
o Selama proses produksi dilakukan IPC (oleh bagian produksi) pada titik kritis.
o Setelah produksi selesai dan bagian laboratorium pengujian telah menyatakan produk ruahan tersebut memenuhi spesifikasi dan mengeluarkan Laporan Analisa (LA), maka PPPI akan menurunkan SPK pengemasan yang disahkan Plant Manager beserta Catatan Kemasan Batch (CKB) dan Bon Serah Terima Bahan Kemas (BSTBK).
41 3.2.6 Bagian Teknik dan Pemeliharaan
STRUKTUR ORGANISASI TEKNIK & PEMELIHARAAN
PLANT BANDUNG
TEKNIK & PEMELIHARAAN
MEKANIK BANGUNAN &
LINGKUNGAN LISTRIK & ENERGI
Gambar 7. Struktur Organisasi Bagian Tehnik dan Pemeliharaan Plant Bandung
Secara struktural, BagianTeknik dan Pemeliharaan berada langsung di bawah Plant Manager yang mempunyai tugas :
1. Menunjang keberadaan pabrik sehingga produksi dapat berjalan dengan lancar.
2. Pemeliharaan mesin-mesin, listrik dan bangunan.
42 3.2.7 Bagian Penyimpanan
Gambar 8. Struktur Organisasi Penyimpanan Plant Bandung
Alur barang dimulai dari bagian PPPI dimana PPPI menyusun perencanaan pengadaan barang berdasarkan data dari pihak pemasaran dan stok barang (produk) yang tersisa di ULS. Susunan perencanaan pengadaan barang tersebut selanjutnya diserahkan ke Bagian Pembelian untuk dilakukan pemesanan kepada pemasok. Pihak pembelian akan mengeluarkan Surat Pesanan (SP) kepada supplier dan ditembuskan pada bagian bagian PPPI, pergudangan dan keuangan. Selanjutnya, pihak gudang akan mencatat pesanan barang dalam KKPB (Kartu Kontrol Pesan Barang). Barang dikirim oleh supplier dan diterima oleh Bagian Gudang untuk diperiksa kesesuaian dengan SP. Pemeriksaan di sini meliputi pemeriksaan kemasan, label, etiket, tanggal ED, dan nomer batch. Apabila diketahui barang yang dikirim ternyata etiketnya berbeda dengan pesanan, atau
43
kemasan yang diterima dalam keadaan tidak baik, maka bagian Gudang akan menolak barang tersebut.
Bila barang yang datang sesuai dengan pesanan maka pihak gudang akan mengeluarkan Bukti Terima Barang Sementara (BTBS) yang diberikan kepada pemasok atau supplier dan ditembuskan ke bagian PPPI, Pembelian, Laboratorium Pengujian dan pada gudang sendiri yang akan disimpan sebagai arsip. Selanjutnya Bagian Laboratorium Pengujian melakukan sampling terhadap barang yang baru datang tersebut untuk dilakukan serangkaian pemeriksaan dan pengujian apakah barang tersebut sesuai dengan spesifikasi atau tidak. Sehingga Bagian Laboratorium Pengujian yang menyatakan barang tersebut diterima atau ditolak. Bila barang tersebut ditolak maka akan diserahkan ke supplier lagi, dan bila diterima akan disimpan dibagian gudang. Bagian Laboratorium Pengujian akan memberikan Laporan Analisa (LA) sebagai bukti bahwa barang telah diuji dan memenuhi spesifikas yang ditentukan. Selanjutnya pihak gudang akan mengeluarkan Bukti Penerimaan Barang (BPB) rangkap enam, lembar pertama, ketiga, kelima diserahkan ke bagian pembelian yang akan diteruskan ke supplier, lembar kedua, keempat diserahkan ke bagian keuangan dan lembar keenam digunakan sebagai arsip gudang. Kemudian petugas gudang akan memindahkan barang atau bahan pesanan ke tempatnya.
3.2.8 Bagian Keselamatan, Kesehatan Kerja dan Lingkungan (K3L)
44
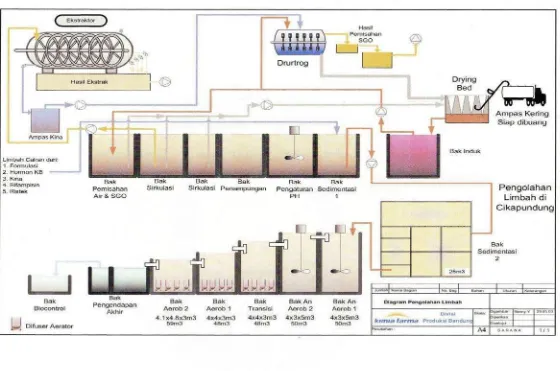
sistem manajemen keselamatan dan kesehatan kerja sesuai dengan peraturan Depnaker. Pengelolaan limbah di Kimia Farma dilakukan sesuai dengan jenis limbahnya. Untuk limbah padat berupa ampas kina, diolah menjadi briket, dan limbah B3 pemusnahan dengan menggunakan incinerator oleh pihak III, sedangkan untuk limbah cair diolah di Instalasi Pengolahan Air Limbah (IPAL).
45
BAB IV
PEMBAHASAN
Sesuai dengan Surat Keputusan Menteri Kesehatan RI No. 43/ Menkes/ II/1988 pada tanggal 2 Februari 1988. Pada tahun 2006, pemerintah Indonesia telah memperbarui CPOB ini yang kemudian lebih dikenal dengan CPOB Terkini atau cGMP (Current GMP). Penerapan CPOB menyangkut seluruh aspek produksi dan mengendalikan mutu dan bertujuan untuk menjamin bahwa setiap produk obat yang dibuat senantiasa akan memenuhi persyaratan mutu yang telah ditentukan sesuai dengan tujuan penggunaannya.
Aspek CPOB Terkini (CPOB: 2006) terdiri atas Sistem Manajemen Mutu, Personalia, Bangunan dan Sarana Penunjang, Peralatan, Sanitasi dan Higiene, Produksi, Pengawasan Mutu, Inspeksi diri dan Audit Mutu, Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian, Dokumentasi, Pembuatan dan Analisis berdasarkan Kontrak, Kualifikasi dan Validasi.
menembus pasar dunia karena khasiat dan mutu obat lebih terjamin, (3) peningkatan
company image dan volume pasar, (4) menghindari produk yang tidak memenuhi syarat
dan pemborosan biaya, (5) menghindari resiko regulasi serta, (6) lebih menjamin waktu pemasaran. Diharapkan dengan penerapan CPOB yang terbaru ini industri farmasi di Indonesia akan siap menghadapi globalisasi pasar farmasi yang sudah di depan mata.
PT. Kimia Farma (Persero) Tbk Plant Bandung merupakan salah satu BUMN dalam bidang kesehatan yang memproduksi obat dengan tujuan meningkatkan derajat kesehatan masyarakat secara optimal. Sebagai suatu industri yang memproduksi obat, maka seluruh aspek CPOB harus diterapkan. Aspek-aspek tersebut meliputi personalia, peralatan, bangunan, sanitasi dan hygiene, produksi, pengawasan mutu, inspeksi diri, penanganan terhadap keluhan dan penarikan kembali produk yang telah beredar serta dokumentasi.
Secara struktur organisasi, PT. Kimia Farma Plant Bandung telah terstruktur dengan baik. Ada pembagian tugas yang jelas antara tiap bagian dan seksi. Juga telah sesuai dengan peraturan CPOB bahwa bagian produksi dan bagian pengawasan mutu dipimpin oleh seorang yang berlainan yang tidak saling bertanggung jawab satu terhadap yang lain.
Personalia atau SDM memegang peranan yang penting dalam suatu perusahaan sehingga harus dikelola dengan baik dengan tujuan untuk meningkatkan produktivitas dan kemampuan kerja. PT. Kimia Farma Plant Bandung juga melakukan pelatihan-pelatihan bagi karyawan-karyawannya sesuai dengan tugasnya ataupun mengenai CPOB. Tujuan dari pelatihan ini adalah untuk menjamin agar karyawan terbiasa bekerja dengan persyaratan CPOB yang berkaitan dengan tugasnya. Catatan pelatihan karyawan mengenai CPOB disimpan dan efektivitas program pelatihan dinilai untuk menentukan prestasi karyawan tersebut, apakah mereka telah memiliki kualifikasi yang memadai dan berpengaruh terhadap kenaikan jabatan bagi karyawan tersebut. Penerapan falsafah ‘Kerjakan apa yang tertulis dan tulis apa yang dikerjakan’ terus ditekankan pada seluruh karyawan terutama yang bekerja di Bagian Produksi dan Pengawasan Mutu.
yang dapat mengurangi debu dengan pengaturan tekanan udara sehingga dapat menekan kontaminasi silang. Selain itu terdapat juga ruang antara yang memisahkan Grey Area dan Black Area. Pada pelaksanaannya ruang antara masih memungkinkan terjadinya kontaminasi silang karena kedua pintu dibuka bersamaan. Hal ini terjadi karena kedisiplinan karyawan yang kurang. Idealnya adanya air lock antar ruang yang berbeda area, apabila salah satu pintu terbuka, maka pintu lain tidak terbuka sehingga mengurangi debu yang lolos ke ruang sebelahnya. Bangunan produksi tablet hormon dipisahkan dengan produksi yang lain karena sangat berbahaya efeknya jika terjadi kontaminasi silang.
Tingkat sanitasi dan hygiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan hygiene meliputi personalia, bangunan, peralatan, perlengkapan, bahan produksi dan wadahnya dan setiap hal dapat merupakan sumber pencemaran produk. Sumber pencemaran hendaklah dihilangkan melalui suatu program sanitasi dan hygiene yang menyeluruh dan terpadu. Sanitasi dan hygiene di lingkungan Plant Bandung telah dilaksanakan cukup baik dan dapat dilihat dari kebersihan lingkungan yang selalu terjaga. Selain itu, untuk mendukung terciptanya
hygiene maka karyawan yang memasuki ruang produksi menggunakan pakaian khusus
yang disediakan, sarung tangan, masker, tutup kepala dan sepatu khusus. Pembersihan ruangan dilakukan secara rutin setiap hari sesuai protap yang ada. Pembersihan peralatan, perlengkapan dan ruangan produksi dilakukan sebelum dan sesudah proses produksi. Fasilitas pendukung sanitasi seperti ventilasi, toilet dan tempat sampah sudah cukup memadai.
Limbah hasil kegiatan produksi sebagian besar berupa limbah cair yang diolah oleh Instalasi Pengolahan Air Limbah (IPAL). Proses pengolahan limbah yang dilakukan meliputi proses kimia, fisika, dan biologi sehingga hasil akhir memenuhi standar baku buangan industri yang sesuai dengan peraturan pemerintah yang berlaku. Air buangan hasil pengolahan limbah dialirkan ke sungai Cikapundung. Limbah padat ampas kina yang telah dihilangkan SGO nya dibuang ke Tempat pembuangan Akhir (TPA), sedangkan limbah padat sisa produksi obat dimusnahkan di Prasarana Pemusnah Limbah Industri.
penelusuran jika ada ketidaksesuaian yang timbul. Sesuai dengan filosofi ”Kerjakan apa yang tertulis dan tulis apa yang dikerjakan” maka seluruh proses produksi dituangkan dan ditulis dalam CPB/CKB yang menjamin adanya konsistensi cara dan pelaksanaan produksi. CPB dan CKB merupakan panduan bagi pelaksana produksi dan memuat seluruh catatan pembuatan produk dalam satu batch. Selain itu dengan adanya In
Process Control (IPC) pada tiap tahap produksinya akan memungkinkan
meminimalisasi kesalahan yang terjadi serta meningkatkan mutu produk yang dihasilkan. Proses produksi dan pengolahan telah memenuhi aturan CPOB yaitu antara lain pelaksanaan produksi sesuai prosedur tertulis yang ditetapkan CPB, bahan baku yang digunakan diperiksa terlebih dahulu identitasnya, dan jumlah yang digunakan untuk produksi sesuai dengan yang tertera pada CPB.
Ketidaksesuaian selama proses produksi dicatat di catatan produk tidak sesuai (Non
Conforming Product) dan ditelusuri penyebab ketidaksesuaian serta merekomendasikan
tindak perbaikannya sehingga kesalahan yang sama tidak terulang kembali.
Bagian yang memegang peranan penting dalam pelaksanaan CPOB adalah Pengelolaan Mutu, karena bagian inilah yang menentukan kelayakan setiap produk apakah memenuhi persyaratan atau tidak untuk dilepas kepasaran. Untuk menjamin kebenaran hasil pengujian, maka Bagian Teknologi Formulasi melakukan validasi metode analisis untuk mendapatkan hasil pengujian yang memiliki tingkat kepercayaan yang tinggi. Sesuai dengan CPOB terkini, produk-produk yang beredar harus sudah divalidasi metode analisisnya. Namun, belum semua produk di PT. Kimia Farma sudah divalidasi. Pengawasan mutu dilakukan terhadap bahan baku, bahan kemas, produk antara, produk ruahan serta produk jadi. Untuk menjamin keseragaman dan keutuhan batch, dilakukan pengawasan dalam proses dengan sampling produk antara, produk jadi, produk yang sudah dikemas primer maupun sekunder yang mewakili setiap batch dan dilakukan pemeriksaan yang sesuai persyaratan yang telah ditetapkan.
Apoteker dengan dasar ilmu kefarmasian dan manajerial yang dimilikinya hendaknya dapat memahami seluruh kegiatan kefarmasian di Industri Farmasi dan aspek-aspek manajemen sehubungan dengan tugas dan tanggung jawabnya untuk mengelola perusahaan, baik dalam hal sumber daya manusia, maupun yang berkaitan dengan kegiatan perusahaan dalam hal ini proses produksi sediaan farmasi.
BAB V
KESIMPULAN
5.1 Kesimpulan
1. PT. Kimia Farma (Persero) Tbk Plant Bandung dalam kegiatan produksi dan pengawasan mutunya telah melaksanakan CPOB dengan tujuan untuk menjamin bahwa produk yang dihasilkan senantiasa memenuhi persyaratan mutu yang telah ditentukan sesuai dengan tujuan penggunaannya.
2. Peran apoteker di industri farmasi adalah melakukan kegiatan managerial baik dalam hal perencanaan dan pengendalian produksi, perencanaan dan pengendalian bahan, pelaksanaan proses produksi, serta pelaksanaan kegiatan pengawasan mutu yang menjamin mutu dari produk yang dihasilkan.
5.2 Saran
DAFTAR PUSTAKA
Anonima, (2001), Pedoman Cara Pembuatan Obat yang Baik, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonimb, (2001), Petunjuk Operasional Penerapan Cara Pembuatan Obat yang Baik, Departemen Kesehatan Republik Indonesia, Badan POM, Jakarta.
Departemen Kesehatan Republik Indonesia. 1995. Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal 730-731.
Department of Health. 2003. British Pharmacopoeia. Volume II. London: The Stationery Office. Page 1605-1607.
Department of Health. 2009. British Pharmacopoeia. London: The Stationery Office. Page 1757-1758.
Directorate for The Quality of Medicines & HealthCare of the Council of Europe (EDQM). European Pharmacopoeia. 2008. 6.0 Ed. Volume 1. Strasbourg: Council of Europe. Pages 414.
Directorate for The Quality of Medicines & HealthCare of the Council of Europe (EDQM). European Pharmacopoeia. 2008. 6.0 Ed. Volume 2. Strasbourg: Council of Europe. Pages 1540, 2802-2803.
Ditjen POM. 1980. Materia Medika Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Hal 7, 13-15, 18-23, 25-28.
Hunter, C. S. 1988. Cinchona spp. : Micropropagation, and the In Vitro Production of
Quinine and Quinidine. Biotechnology in Agriculture and Foresty. Volume 4.
Medicinal and Aromatic Plants I (ed. By Y. P. S. Bajaj). Berlin: Springer-Verlag. Page 370.
Mardiningsih. 2005. Evaluasi Korelasi Linier Kandungan Kina pada Cinchona
Succirubrra antara Titrasi SGO I dengan output B1. Yogyakarta: Laporan Tugas
Khsus Praktek Kerja Profesi Apoteker. Universitas Sanata Dharma. Hal 1-3.
Pharmaceutical Inspection Convention. 2007. Guide to Good Manufacturing Practice
for Medicinal Products Part II. Geneva: pages 7-10.
Priyambodo, B. 2007. Manajemen Farmasi Industri. Edisi Pertama. Yogyakarta: Global Pustaka Utama. Hal 46-58.
PT Kimia Farma Plant Bandung. Prosedur Tetap Pemeriksaan Produk Jadi
Cinchonidine Base.
PT Kimia Farma Plant Bandung. Prosedur Tetap Pemeriksaan Produk Jadi Quinine
Sulphate.
Ronni, W and friends. 2006. International Journal of Dermatology. 45(6):661-663, June 2006. www3.interscience.wiley.com/journal/119920747/abstract. Tanggal akses 2 Mei 2009.
Tan H. T dan Kirana R. 2002. Obat-Obat Penting Khasiat, Penggunaan dan Efek-Efek
Sampingnya. Edisi Kelima. Cetakan Kedua. Jakarta : PT Elex Media
Komputindo. Hal 165-166, 170.
Tarigan, J. 2003. Kombinasi Kina Tetrasiklin pada Pengobatan Malaria Falciparum
Tanpa Komplikasi di Daerah Resisten. Bagian Ilmu Penyakit Dalam Fakultas
Kedokteran Universitas Sumatera Utara. Digitized by USU digital library. Tanggal akses 14 Mei 2009.
The United States Pharmacopeial Convention. 2008. USP 31 NF 26 The Official
Compendia of Standards. Volume 1. Baltimore: Port City Press. Page 766.
The United States Pharmacopeial Convention. 2008. USP 31 NF 26 The Official
Compendia of Standards. Volume 3. Baltimore: Port City Press. Pages
The United States Pharmacopeial Convention. 2008. USP 30 NF 25 The Official
Compendia of Standards. Volume 3. Baltimore: Port City Press. Pages
2009.
tanggal akses 2 Mei 2009.
Lampiran 1. Alur Pengadaan Bahan Produksi Oleh Bagian Pembelian
Bagian PPPI membuat BPPBB/K
Dilampirkan spesifikasi BB/BK. Untuk BK disertai contoh
Disahkan Plant Manager
Bagian Pembelian mengundang supplier untuk mendapatkan penawaran harga (yang diundang dari daftar supplier handal)
Evaluasi : harga murah, sesuai spesifikasi, barang tersedia.
Terbit Surat Pesanan : 7 rangkap. 3 lembar : Bag Keuangan.
1 lembar : Asli supplier. 1 lembar : Gudang. 1 lembar : PPPI. 1 arsip pembelian.
SP disahkan Plant Manager
Monitoring (minimal ± seminggu sebelum jadwal)
Barang datang (diterima gudang)
Lampiran 2. Alur Pengadaan Barang Teknik
Permintaan barang teknik
Ka. Bag Teknik dan Pemeliharaan
(membuat Surat Permintaan Pesanan Barang Teknik/SPPBT)
Permohonan pesanan barang teknik disetujui oleh Plant Manager
Ka. Bag Pembelian meminta penawaran ke supplier
Evaluasi harga
Penentuan supplier
Ka. Bag pembelian mengeluarkan SP yang disahkan plant Manager
SP asli diserahkan supplier
Barang dikirim, diperiksa oleh Bagian Teknik dan Pemeliharaan
Lampiran 3. Alur Produksi Serbuk Oralit Plant Bandung
Sampai kadar air < 0,1% NaCl dan KCl dikeringkan
Lab pengujian : Pemerian, pH, kadar air, kadar ion.
IPC : kebocoran, bobot sachet.
IPC : estetika,
kelengkapan ,
penandaan, jumlah. Zat tambahan
Penimbangan
Pencampuran (Super mixer)
Karantina Pengisian (Filling Sachet Machine)
Karantina
Pengemasan sekunder
Lampiran 4. Alur Produksi Sirup Plant Bandung
Pencampuran
Karantina
(Storage tank)
Lab Pengujian : Pemerian, kadar, pH
IPC : Volume
IPC : Kekencangan
IPC : Estetika penandaan etiket Pengisian dalam botol
(Filling machine)
Penutupan
(Cap sealing Machine)
Penempelan etiket
Pengemasan
Gudang Obat Jadi
IPC : Estetika, jumlah kemasan
Penimbangan zat aktif dan zat tambahan
Pembuatan Sirupus simplex Mesin : Melting tank
Lampiran 5. Alur Produksi Suspensi Plant Bandung
Pembuatan
Suspending Agent (Mixing Tank)
Pembuatan Sirupus Simplex (Melting tank)
Pencampuran Suspending Agent dan Syrupus Simplex
(Mixing Tank)
Pendinginan (Ultra Turax) Zat aktif diayak
Pembasahan
Penghalusan Partikel (Colloid Mill)
Pelarutan bahan tambahan dengan pelarut yang sesuai
IPC : Pemerian, Bj, pH, viskositas, kadar
IPC : Volume Pencampuran
(Ultra Turax)
Karantina (Storage Tank)
Pengisian ke dalam botol (Filling Machine)
Penutupan (Cap sealing)
IPC : Kekencangan penutupan
Penempelan etiket
Pengemasan
Lampiran 6. Alur Produksi Batugin Elixir Plant Bandung
Penimbangan daun Tempuyung dan Keji Beling
Daun tersebut dicuci
Pembuatan infus
Infuse dipompakan ke reaktor
Ditambahkan bahan tambahan lain seperti gula dan pengawet
Dipanaskan 100oC
Didinginkan sampai suhu 25oC – 38oC
Ditambah menthol dan alkohol
Sampling mikrobiologi Sedimentasi
Penyaringan
Packaging / pengemasan
IPC : estetika, jumlah botol dalam box, kelengkapan kemasan.
Filling / pengisian
Mulai Tingtur : sirih, succus, saga
Penambahan tingtur sirih, Tingtur saga dan tingtur glycirrhizae
Volume, daya cengkram PP cap. Estetika PP cap
Penempelan Gudang obat jadi
Selesai
Penimbangan Penimbangan
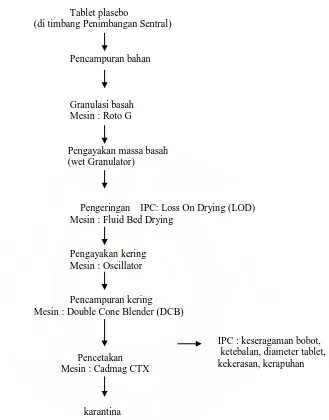
Lampiran 8. Alur Produksi Tablet Plasebo Plant Bandung
Tablet plasebo
(di timbang Penimbangan Sentral)
Pencampuran bahan
Granulasi basah Mesin : Roto G
Pengayakan massa basah (wet Granulator)
Pengeringan IPC: Loss On Drying (LOD)
Mesin : Fluid Bed Drying
Pengayakan kering Mesin : Oscillator
Pencampuran kering Mesin : Double Cone Blender (DCB)
Pencetakan Mesin : Cadmag CTX
IPC : keseragaman bobot, ketebalan, diameter tablet, kekerasan, kerapuhan
Lampiran 9. Alur Pengemasan Tablet Hormon Plant Bandung
Tablet OC Tablet Placebo
Mesin : blister
Pengemasan sekunder
Pengiriman ke Gudang Obat Jadi
Lampiran 10. Alur Proses Pembuatan AKDR Plant Bandung
Pembuatan Frame T di ruang Moulding IPC : kelenturan/ flexibility
Pemasangan Copper Collar Pemasangan Copper wire
Pengencangan wire di ruang Sleaving dan Weaging
IPC kerapian, berat Cu wire
Pemasangan tali di ruang Suture Tying
Penambahan tube plastik di ruang Tubing Inserting IPC : panjang tali, kerapian
Ruang Repacking (pengemasan primer sebelum disterilkan) Penutupan kemasan primer di ruang Heat Sealing
IPC : uji kebocoran
Sterilisasi dengan menggunakan gas etilen oxid
IPC : uji mikrobiologi
Lampiran 11. Alur Pengadaan Barang Teknik dari Gudang
SPP Teknik yang dibuat oleh user dilanjutkan
Permintaan barang teknik ke bagian Gudang teknik (SPBT)
Gudang Teknik
(membuat Surat Permintaan Pesanan Barang Teknik/SPPBT)
Surat Permintaan ke Gudang teknik yang disetujui oleh Bag. Teknik dan Pemeliharaan
Permohonan pesanan barang teknik disetujui oleh Plant Manager Ka. Bag Pembelian meminta penawaran ke supplier
Evaluasi harga Penentuan supplier
Ka bag pembelian mengeluarkan SP yang disahkan Plant Manager SP asli diserahkan supplier
Barang dikirim dan dimasukkan gudang
TUGAS KHUSUS
PENGENDALIAN PROSES PRODUKSI
KINA SULFAT DAN SINKONIDIN
Disusun oleh :
Beby Amelia Rangkuti, S. Farm. 083202005
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
BAB I
PENDAHULUAN
1.1 Latar Belakang
Tanaman kina (Cinchona spp.) dari famili Rubiaceae terdiri atas 15-40 spesies yang tersebar dari Pegunungan Andes hingga Amerika Selatan. Dari jumlah tersebut yang memiliki nilai ekonomis dan paling banyak dibudidayakan ialah Chinchona
succirubra dan Chinchona ledgeriana dengan kandungan total alkaloid berturut-turut
3-10% dan 0,5-5% (Hunter, 1988). Chinchona ledgeriana mengandung 12,00 kinin, 0,44% kinidin, 0,25% sinkonin dan 0,36% sinkonidin sedangkan Chinchona ledgeriana mengandung 1,14% kinin, 1,73% sinkonin dan 1,43% sinkonidin (Mardiningsih, 2005). Komoditi utama dari kulit kayu Cinchona ini adalah kina sulfat, kina dihidroklorida, sinkonin dan sinkonidin.
gedung pemurnian kina. Jadwal proses produksi disusun berdasarkan pengamatan langsung penulis pada setiap tahapan produksi. Metode yang dipakai untuk mengetahui proses cleaning ialah dengan membandingkan antara prosedur tetap pembersihan ruangan dan alat pada setiap tahapan produksi dengan kegiatan pembersihan yang dilakukan di pemurnian kina. Sedangkan untuk mengetahui perbandingan persyaratan GMP dengan existing di pemurnian kina, penulis mengamati aspek personalia dan design/konstruksi bangunan pemurnian kina lalu membandingkannya dengan persyaratan GMP manufacture oleh Pharmaceutical Inspecion Convention (PIC’s).
Penulis berharap semoga tulisan ini dapat memberikan manfaat bagi para pembaca dan khusunya dapat meningkatkan kualitas produksi jadi kina sulfat dan sinkonidin di PT. Kimia Farma Plant Bandung.
1.2 Tujuan
1. Untuk mengetahui perbandingan monografi produk jadi kina sulfat dan sinkonidin.
2. Untuk mengetahui pengujian parameter spesifikasi produk jadi kina sulfat dan sinkonidin.
3. Untuk mengetahuiproses pemurnian kina sulfat dan sinkonidin. 4. Untuk mengetahui jadwal proses produksi kina sulfat dan sinkonidin
5. Untuk mengetahui proses pembersihan (cleaning) pada setiap tahapan proses pemurnian kina sulfat dan sinkonidin.
BAB II
TINJAUAN PUSTAKA
2.1 Sejarah Singkat
Menurut Baillon, genus kina memiliki dua puluh spesies yang semuanya berasal dari Amerika Selatan merupakan di sepanjang pegunungan Andes yang meliputi wilayah Venezuela, Colombia, Equador, Peru sampai Bolivia. Daerah tersebut meliputi hutan-hutan pada ketinggian 5000-7000 kaki. Pada ketinggian ini iklimnya lembab dan hangat. Pohon-pohon kina umumnya tumbuh tunggal dan tidak berkelompok membentuk hutan. Mereka tumbuh sebagai semak belukar yang hijau dengan ketinggian mencapai 100 kaki. Kina masuk ke Eropa melalui Jesuit, seorang yang memperkenalkan obat-obat baru. Sejak itu kina dikenal dengan Countess bark, Jesuit's bark atau Peruvian bark. Pada tahun 1736, Akademi Ilmu Paris mengirim ekspedisi ke khatulistiwa dan menemukan tiga spesies pohon kina yaitu Cinchona ledgeriana oleh Mutis (1760), Cinchona calisaya oleh Ruiz dan Pavon (1778-1788) , Cinchona
succirubra oleh Weddell (1845-1848). Ketiga spesies ini kaya akan kinin
ke Indonesia tahun 1852 berasal dari Bolivia, tetapi tanaman kina yang tumbuh dari biji tersebut akhirnya mati. Pada tahun 1854 sebanyak 500 bibit kina dari Bolivia ditanam di Cibodas dan tumbuh 75 pohon yang terdiri atas 10 klo akses 27 April 2009).
kulit kayu kina dari penghasil yang berbeda ialah 3% - 7%. Pada negara tertentu seperti Kenya, kulit kina mengandung kinin sampai 10% (Hunter, 1988).
2.2 Kina Sulfat
2.2.1 Sifat Fisika Kimia Kina Sulfat
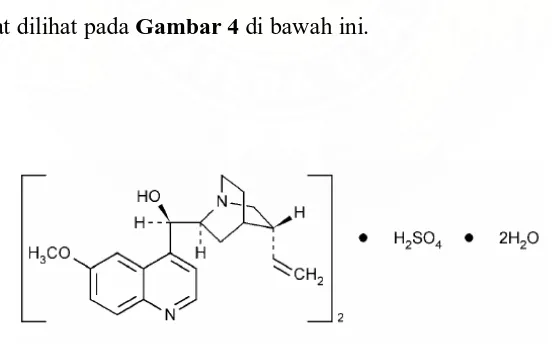
Kina sulfat ialah garam sulfat yang mengandung alkaloid yang ditemukan dari kulit kayu tanaman Cinchona. Mengandung tidak kurang dari 99,0% dan tidak lebih dari 101,0% dari garam alkaloid total, dihitung sebagai (C20H24N2O2)2. H2SO4 terhadap zat yang telah dikeringkan (USP 31 NF 26, 2008;Farmakope Indonesia, 1995). Menurut British Pharmacopoeia (2003) dan European Pharmacopoeia (2008), kina sulfat mengandung tidak kurang dari 99,0% dan tidak lebih dari 101,0% alkaloid monosulfat, dihitung sebagai bis [(R)-[(2S,4S,5R)-5-ethenyl-1-azabiccyclo [2.2.2] oct-2-yl] (6-methoxyquinolin-4-yl)methanol] sulfat terhadap zat yang dikeringkan. Struktur molekul kina sulfat dapat dilihat pada Gambar 4 di bawah ini.
Gambar 4. Struktur Molekul Kina Sulfat
2.2.2 Identifikasi
B. Larutan (1:50) dengan penambahan beberapa tetes asam klorida akan menunjukkan reaksi sulfat.
C. Pada uji kemurnian kromatografi, harga Rf bercak utama Larutan uji sesuai dengan harga Rf bercak utama Larutan baku.
D. Susut pengeringan : 3,0% - 5,0%, dihitung dengan menggunakan 1,000 g dengan mengeringkan zat dalam oven pada suhu 105°C.
E. Abu sulfat : maksimal 0,1 %, dihitung dengan menggunakan 1,0 g zat.
F. Kromatografi Lapis Tipis, kromatogram yang dihasilkan memiliki letak, warna dan ukuran yang sama seperti yang dihasilkan Larutan baku.
G. Larutkan 5 mg dalam 5 ml air P. tambahkan 0,2 ml air brom P dan 1 ml ammonia encer P. Terbentuk warna hijau.
H. pH : 5,7 – 6,6 untuk 10 g/l suspensi dalam air P.
Identifikasi yang dilakukan menurut,
a) Farmakope Indonesia (1995) ialah A, B dan C. b) Menurut USP 31 (2008) ialah A, B dan C.
2.3 Sinkonidin
2.3.1 Sifat Fisika Kimia Sinkonidin
Gambar 6. Struktur Molekul Sinkonidin
2.3.2 Identifikasi
BAB III
HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Perbandingan Spesifikasi Kina Sulfat dan Sinkonidin dari Beberapa Monografi
3.1.1.1 Perbandingan Spesifikasi Kina Sulfat dari Beberapa Monografi
Spesifikasi kina sulfat dari berbagai monografi dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1. Perbandingan Spesifikasi Kina Sulfat dari Beberapa Monografi
FINISHED PRODUCT SPECIFICATION OF QUININE SULPHATE
2. Molecullar weight powder or fine, colourless powder or fine, colourless pahit yang lama. Menjadi ethanol (96 per cent) and in ethanol (96 per cent)
Sukar larut dalam air, dalam etanol, dalam
campuraan kloroform-etanol mutlak (2:1); agak sukar larut dalam air pada suhu 100°
5. Identification Test Method by :
a. Chromatogram TLC The principal spot in the colour and size to the principal spot in the colour and size to the principal spot in the colour and size to the principal spot in the chromatogram obtained with the reference solution
Harga Rf bercak utama Larutan
uji sesuai
dengan harga Rf bercak utama
Larutan baku.
Bercak larutan uji tidak lebih besar atau lebih intensif dari
b. Bromine and Ammonia
c. Fluorescens
d. Characteristics of Sulphates
− BaCl2
− Pb(NO3)2
− HCl
A green colour develops the addition of HCl
White White
Not form white precipitate
A green colour develops the addition of HCl
White White
Not form white precipitate
A green colour develops the addition of HCl
White White
Not form white precipitate
6. Appearance of solution Solution S is clear and not
2008 11. Other cinchona alkaloids :
− Dihydroquinine
− Any impurity eluted before quinine (Cinchonidine)
− Any other related substances
Tidak lebih dari 10%
16. Organic volatile impurities - - - - Meets the
requirements ?
17. Assay 99,0% -
Keterangan : - = tidak tercantum padamonografi
? = Kimia Farma belum mengacu terhadap monografi tertentu Larutan Y6 = 5 ml larutan standar Y + 95 ml HCl 1%
3.1.1.2 Perbandingan Spesifikasi Sinkonidin dari Beberapa Monografi
Spesifikasi sinkonidin dari berbagai monografi dapat dilihat pada Tabel 2 di bawah ini.
Tabel 2. Perbandingan Spesifikasi Sinkonidin dari Beberapa Monografi
FINISHED PRODUCT SPECIFICATION OF CINCHONIDINE
No Parameter European
Pharmacopoeia USP 30 USP 31
Kimia Farma Refers to
1. Molecullar formula C19H22N2O C19H22N2O C19H22N2O USP 31
2. Molecullar weight 294,4 294,39 294,39 USP 31
crystalline or granular powder
USP 30, PT Kimia Farma 4. Solubility Very slightly soluble
in water and in light petroleum, soluble in alcohol
Soluble in alcohol and in chloroform; practically insoluble in water
Soluble in alcohol and in chloroform;
practically insoluble in water
?
5. Specific optical rotation Between -105° to -110°
Between -105° to
- 115° - USP 30
− Other cinchona alkaloids
- - - PT Kimia Farma
Farma 11. Assay
- Not less than 99,0% Not less than 99,0% USP 30, PT Kimia Farma
12. Storage Protected from light - - ?
Keterangan : - = tidak tercantum pada monografi
? = Kimia Farma belum memiliki acuan terhadap monografi tertentu
3.1.2 Pengujian Parameter Spesifikasi Produk Jadi Kina Sulfat dan Sinkonidin 3.1.2.1 Flow Process Pemeriksaan Produk Jadi Kina Sulfat
1. Pemerian
1.1Syarat : serbuk kristal warna putih atau hampir putih, bentuk jarum tidak berwarna.
1.2Cara kerja
diamati secara visual
2. Kelarutan
2.1Syarat : sukar larut dalam air, agak sukar larut dalam air mendidih dan dalam alkohol.
2.2 Cara kerja a.
Dilarutkan dalam 100 – 1000 ml aqua DM dalam gelas kimia 1000 ml
Diamati pemerian larutan
Referensi : Prosedur Tetap Pemeriksaan Produk Jadi Quinine Sulphate b.
Dilarutkan dalam 30 – 100 ml aqua DM mendidih dan alkohol
Diamati pemerian larutan Serbuk kina sulfat
serbuk kristal warna putih atau hampir putih, bentuk jarum tidak berwarna
Larutan jernih 1 g Serbuk kina sulfat
3. Identifikasi
3.1 Syarat : positif terhadap quinine dan sulfat 3.2 Cara Kerja
3.2.1 KLT
Ditotolkan di atas plat silika gel G Dielusi hingga jarak elusi 15 cm dari tempat penotolan sampel
Dikeluarkan plat dari chamber
Diamkan plat hasil elusi di udara kering (± 15 menit)
Dielusi kembali dengan eluent yang sama hingga eluent naik 15 cm dari tempat penotolan sampel
Dikeringkan plat elusi ± 10 menit
Dipanaskan dalam oven pada temperatur 105°C selama 30 menit
Diamati noda yang diperoleh di bawah sinar UV
Dibandingkan letak, warna dan ukuran noda zat uji dengan noda baku pembanding 5 µL Larutan baku dan 5 µL larutan uji
3.2.2
Dilarutkan dalam 5 ml aqua DM Ditambahkan 0,2 ml air brom Ditambahkan 1 ml NH4OH Diamati pemerian larutan
3.2.3
Dilarutkan dalam 3 ml H2SO4 dalam gelas kimia 250 ml
Ditambahkan aqua DM hingga 100 ml Dilihat di bawah sinar UV 366 nm
ditambah 1 ml HCl pekat
3.2.4
Dilarutkan dalam 5 ml HCl 2 M Ditambahkan 1 ml BaCl2 25% 5 mg serbuk kina sulfat
Larutan hijau
0,1 g serbuk kina sulfat
Larutan berfluoresensi biru
Fluoresensi hilang
45 mg serbuk kina sulfat