SELEKSI ISOLAT AKTINOMISET UNTUK DEGRADASI
BIOMASSA LIGNOSELULOSA
IKE APRIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Seleksi Isolat Aktinomiset untuk Degradasi Biomassa Lignoselulosa adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013 Ike Apriani
NIM G351100151
RINGKASAN
IKE APRIANI. Seleksi Aktinomiset untuk Degradasi Biomassa Lignoselulosa. Di bawah bimbingan ANJA MERYANDINI dan TITI CANDRA SUNARSIH.
Lignoselulosa merupakan komponen utama penyusun struktur tumbuhan dan sumber bahan organik terbarukan. Lignoselulosa terdiri atas 40%-50% selulosa, 20%-30% hemiselulosa, 10%-25% lignin dan komponen ekstraktif. Komponen biomassa lignoselululosa berpotensi untuk diubah menjadi beragam produk yang memiliki nilai tambah diantaranya biofuel, bahan kimia organik, sumber energi murah untuk fermentasi, makanan hewan dan nutrisi manusia. Komponen lignoselulosa sulit untuk dihidrolisis karena adanya ikatan dengan hemiselulosa dan lignin serta keberadaan struktur kristalin yang memberikan kekompakkan struktur. Proses delignifikasi perlu dilakukan untuk meningkatkan area selulosa dengan menghilangkan lignin, melarutkan hemiselulosa, merusak kristalin dan meningkatkan pori volume.
Penelitian ini dilakukan dengan tujuan untuk mendapatkan isolat aktinomiset yang menghasilkan enzim lignin peroksidase dan mengaplikasikannya untuk delignifikasi bagas tebu, tongkol jagung, tandan kosong kelapa sawit (TKKS), dan serbuk gergaji. Penelitian terbagi menjadi beberapa tahap yaitu seleksi isolat aktinomiset yang mensekresikan lignin peroksidase, karakterisasi isolat terpilih dan aplikasi pada substrat lignoselulosa.
Seleksi kualitatif dengan menggunakan merah kongo menghasilkan 11 isolat yang membentuk zona bening di sekitar koloni. Seleksi dengan menggunakan fuchsin didapatkan satu isolat terpilih yaitu isolat 42. Isolat ini mensekresikan enzim lignin peroksidase dengan aktivitas tertinggi pada hari ke 8 sebesar 24.46 U/mg, dan enzim xilanase dengan aktivitas tertinggi pada hari ke 10 sebesar 0.055 U/ml.
Hasil analisis komponen serat menunjukkan persentase susut bobot sebesar 2.14%-13.8%, dengan persentase tertinggi pada substrat tebu. Penurunan lignin tertinggi sebesar 7.45% pada tongkol jagung, hemiselulosa sebesar 9.93% pada TKKS, dan 10.69% pada tongkol jagung. Delignifikasi tertinggi terjadi pada substrat tongkol jagung.
SUMMARY
IKE APRIANI. Selection of Actinomycetes for Degradation Lignocellulosic Biomass. Supervised by ANJA MERYANDINI and TITI CANDRA SUNARSIH.
Lignocellulose is the major structural component of woody plants and non-woody plants which represents a major source of renewable organic matter. The structural component lignocelluloses consist of 40% to 50% cellulose, 20% to 30% hemicellulose, 10% to 25% lignin and extractable components. The component of lignocellulose biomass can potentially be converted into various different valuable products including biofuels, organic chemicals, cheap energy sources for fermentation, and improving animal feeds and human nutrients. Lignocellulose components are difficult to hydrolyze because cellulose is associated with hemicellulose, their fiber surrounded by a lignin seal and much of it has a crystalline structure, giving it a highly ordered, tightly packed structure. Delignification should be done for increasing the surface area of cellulose by removing the lignin seal, solubilizing hemicellulose, disrupting crystallinity, and increasing pore volume.
This study aims to obtain isolates of actinomycetes that produce lignin peroxidase enzyme and applied it for delignification agricultural biomass such as sugarcane bagasse, corn cobs, oil palm empty fruit bunch (OPEFB), and sawdust. The study was conducted into three main steps as the following: selection of actinomycet isolate that produce lignin peroxidase, characterization of selected isolate, and applied it for delignification agricultural biomass.
Qualitative observations using congo red and fuchsin were conducted as the initial screening. Screening by congo red revealed 11 isolates that produce clear zone, while only one isolate (isolate 42) obtained Fuchsin screening. This isolate secreted lignin peroxidase enzymes with the highest activities after 8 days as 24.46 U/mg, and xylanase enzyme after 10 days as 0.055 U/ml.
Actinomycetes isolate 42 can grow on all lignocelullose substrates, and degraded all components in the substrates. After 6 weeks cultivation, degradation caused 2.14-13.8% lossed weight, with the highest weight loss from sugar cane substrate. Isolate 42 has highest delignification capability (7.45%) and cellulose degradation (10.69%) on corncobs and, highest hemicelullose solubilization capability on OPEFB (9.93%)
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SELEKSI ISOLAT AKTINOMISET UNTUK DEGRADASI
BIOMASSA LIGNOSELULOSA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Seleksi Isolat Aktinomiset untuk Degradasi Biomassa Lignoselulosa. Nama : Ike Apriani
NIM : G351100151
Disetujui oleh Komisi Pembimbing
Prof. Dr. Anja Meryandini, M.S. Ketua
Dr. Ir. Titi Candra Sunarti,M.Si Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof. Dr. Anja Meryandini, M.S.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
PRAKATA
Puji syukur penulis hanturkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Oktober 2012 ini berjudul Seleksi Isolat Aktinomiset untuk Degradasi Biomassa Lignoselulosa. Penelitian didanai oleh Prof. Dr. Anja Meryandini, M.S. dan Dr. Ir.Titi Candra Sunarti, M.Si.
Terima kasih penulis ucapkan kepada Prof. Dr. Anja Meryandini, M.S. selaku ketua komisi pempimbing dan Dr. Ir.Titi Candra Sunarti, M.Si selaku anggota pembimbing. Ucapan terima kasih penulis sampaikan kepada Dr. Ir. Hj. Liesbetini Hartoto, MS sebagai penguji ujian tesis atas saran dan masukan yang diberikan.
Penghargaan penulis sampaikan kepada staf dan laboran di laboratorium Bioteknologi Hewan dan Biomedis, PPSHB IPB dan laboratorium Mikrobiologi IPB yang telah membantu selama penelitian. Terima kasih kepada Mikrotropisian yang telah banyak membantu dalam pelaksanaan penelitian.
Terima kasih tak terhingga penulis sampaikan kepada Papa (Alm.), Mama, Ayuk dan Adik yang dengan tulus dan sabar memberikan do’a, motivasi maupun semangat dalam terwujudnya tesis ini. Terima kasih pula penulis hanturkan kepada keluarga besar, kerabat dekat dan sahabat yang turut memberikan semangat dan inspirasi dalam menjalani perkuliahan.
Penulisan tesis ini masih jauh dari sempurna, sehingga saran dan kritik yang membangun sangat diharapkan. Semoga tesis ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
Biomassa Lignoselulosa 4
Delignifikasi 4
Degradasi Lignin oleh Aktinomiset 5
Enzim Lignin Peroksidase 6
Jalur Degradasi Lignin 6
3 METODE 9 Bahan 9 Alat 9 Prosedur 9 4 HASIL DAN PEMBAHASAN 15 Hasil 15
Seleksi Kemampuan Lignolitik Isolat Aktinomiset 15
Karakteristik Enzim Isolat 42 17
Delignifikasi Substrat Lignoselulosa oleh Aktinomiset Isolat 42 18
Perubahan Komponen Serat Substrat setelah Kultivasi 20
Pembahasan 26
5 SIMPULAN 37
DAFTAR PUSTAKA 39
LAMPIRAN 45
DAFTAR TABEL
1 Persentase komponen organik pada masing-masing substrat 4
2 Seleksi aktinomiset dengan merah kongo 15
3 Seleksi aktinomiset dengan fuchsin 16
4 Komposisi komponen substrat sebelum dan setelah kultivasi 20
DAFTAR GAMBAR
1 Unit pembentuk lignin 4
2 Praperlakuan merusak lignin untuk konversi biomassa lignoselulosa 5 3 Skema degradasi lignin oleh aktinomiset 6 4 Pemutusan senyawa model lignin β-aril eter oleh DypB 7 5 Respon isolat Aktinomiset terhadap pewarna merah kongo 16
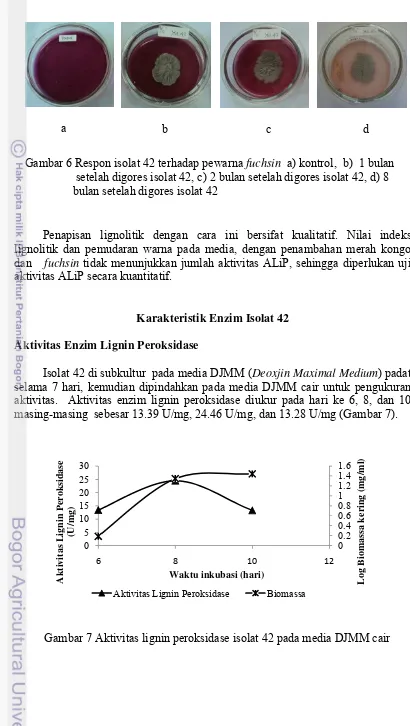
6 Respon isolat Aktinomiset terhadap pewarna fuchsin 17
7 Aktivitas lignin peroksidase isolat 42 pada media DJMM cair 17 8 Aktivitas xilanase isolat 42 pada media xilan cair 18 9 Kultivasi biomassa oleh isolat 42 sebelum diinkubasi pada suhu ruang
(a-d) dan setelah inkubasi 6 minggu (e-f) 19
10 Persentase susut bobot substrat setelah kultivasi 19 11 Penurunan lignin setelah kultivasi pada masing-masing substrat yang di
inkubasi selama 6 minggu pada suhu ruang 20
12 Penurunan hemiselulosa setelah kultivasi pada masing-masing substrat yang di inkubasi selama 6 minggu pada suhu ruang 21 13 Penurunan selulosa setelah kultivasi pada masing-masing substrat yang
di inkubasi selama 6 minggu pada suhu ruang 21 14 Peningkatan ekstraktif setelah kultivasi pada masing-masing substrat
yang di inkubasi selama 6 minggu pada suhu ruang 22 15 Struktur mikroskopis serbuk gergaji perbesaran 200x 23 16 Struktur mikroskopis TKKS perbesaran 200x 23 17 Struktur mikroskopis tongkol jagung perbesaran 200x 24 18 Struktur mikroskopis bagas tebu perbesaran 200x 25 19 Struktur mikroskopis tongkol jagung dengan SEM 25
DAFTAR LAMPIRAN
1 Komposisi R2YE trace mineral (g/l) 45
2 Kurva standar protein HRP 45
3 Kurva standar xilosa dengan metode DNS (Miller 1959) 45
4 Analisis kadar air 46
I PENDAHULUAN
Latar Belakang
Lignoselulosa merupakan komponen utama penyusun struktur tumbuhan. Lignoselulosa terdiri atas 40%-50% selulosa, 20% - 30% hemiselulosa, 10%-25% lignin dan komponen ekstraktif (Menon & Rao 2012). Selulosa terdiri atas unit monomer D-glukosa yang terikat pada ikatan 1,4-glikosidik. Selulosa terkemas dalam mikrofibril yang terdiri atas struktur kristalin dan amorf. Selulosa diselubungi oleh hemiselulosa dan lignin. Hemiselulosa memiliki rantai samping pendek yang tersusun atas gula berbeda. Monosakarida terdiri atas pentosa (xilosa, rhamnosa dan arabinosa), heksosa (glukosa, manosa dan galaktosa) dan asam uronat (4-o-metillglukoronat, D-glukoronat, dan asam D-galakturonat). Hemiselulosa dapat berupa homopolimer atau heteropolimer dengan percabangan pendek yang dihubungkan oleh ikatan β-1,4 glikosidik dan adakalanya ikatan β -1,3 glikosidik. Hemiselulosa lebih mudah larut dibandingkan selulosa (Kumar et al. 2009). Lignin merupakan recalcitrant yang sulit didegradasi karena tersusun dari struktur kompleks yang merupakan gabungan senyawa oksidatif dari monolignol (monomer lignin, dan monomer prekusor) (Wong 2009).
Komponen biomassa lignoselulosa berpotensi untuk diubah menjadi beragam produk yang memiliki nilai tambah di antaranya biofuel, bahan kimia organik, sumber energi murah untuk fermentasi, makanan hewan dan nutrisi manusia (Howard et al. 2003). Permasalahan dalam pemanfaatan biomassa lignoselulosa telah diketahui sejak lama. Komponen ini sulit untuk dihidrolisis karena adanya ikatan antara hemiselulosa dan lignin serta keberadaan struktur kristalin yang memberikan kekompakkan struktur (Weil et al. 1994). Mosier et al.
(2005) menambahkan bahwa ikatan lignin yang kuat menghalangi penetrasi enzim dalam proses hidrolisis sehingga menurunkan kinerja enzim. Dengan demikian, perlu dilakukan proses praperlakuan yang dikenal dengan delignifikasi (penghilangan lignin). Proses ini akan meningkatkan area selulosa dengan menghilangkan lignin, melarutkan hemiselulosa dan merusak kristalinitas serta meningkatkan pori volume (Demain et al. 2005).
Praperlakuan dapat dilakukan dengan cara mekanik, kimiawi, dan fisik-kimia, namun cara ini memiliki kekurangan, diantaranya membutuhkan energi, tekanan dan biaya yang tinggi, penggunaan bahan kimia yang menghasilkan limbah toksik sehingga perlu pengolahan limbah lebih lanjut. Selain itu, penggunaan asam untuk delignifikasi akan bersifat korosif terhadap reaktor dan dapat menghasilkan inhibitor (Alvira et al. 2010). Untuk mengatasi permasalahan tersebut dilakukan praperlakuan secara biologis dengan menggunakan enzim yang dihasilkan oleh mikroorganisme seperti fungi, aktinomiset dan bakteri lainnya.
Enzim ligninolitik yang terlibat dalam degradasi lignin, di antaranya lignin peroksidase, manganase peroksidase dan lakase (Wong 2009). Beberapa mikroorganisme yang dilaporkan menghasilkan enzim tersebut ialah bakteri dari genus Alcaligenes, Arthrobacter, Norcadia, Pseudomonas, Streptomyces (Jing Li
Pleurotus ostreatus, Phanerochaete sordida 37, dan Pycnoporus cinnabarinus 115 (Sun & Cheng 2002).
Sistem degradasi lignin pada bakteri terjadi pada proses metabolisme primer. Enzim bakteri lebih menarik untuk aplikasi bioteknologi karena sistem pendegradasi lignin pada bakteri lebih spesifik. Beberapa bakteri menunjukkan kemampuan yang beragam dalam memetabolisme sejumlah senyawa aromatik (Zimmermann 1990). Bakteri yang mendapatkan perhatian lebih sebagai prokariot biodegradatif adalah aktinomiset. Bakteri ini tersebar luas pada substrat alam seperti tanah dan kompos sehingga memiliki peranan penting dalam perombakan bahan organik. Sumber utama karbon aktinomiset yang ada ditanah biasanya tidak larut dan bersifat polimerik sehingga aktinomiset mensekresikan enzim ekstraseluler. Aktinomiset berbeda dengan bakteri lain, bakteri ini memiliki hifa seperti atribut yang dimiliki fungi. Hifa ini akan menembus dan mengkolonisasi substrat untuk mendegradasi lignoselulosa pada dinding sel tumbuhan (McCarthy & Williams 1992). Beberapa penelitian melaporkan beberapa spesies Aktinomiset
yang menghasilkan enzim peroksidase, di antaranya Streptomyces viridosporus (Yee & Wood 1997), Streptomyces thermoviolaceus (Iqbal et al. 1994),
Thermomonospora mesophila dan Streptomyces badius (Godden et al. 1992). Biomassa lignoselulosa berasal dari limbah tumbuh-tumbuhan dengan komposisi kimia yang berbeda. Penelitian ini menggunakan empat biomassa lignoselulosa yaitu bagas tebu, tongkol jagung, tandan kosong kelapa sawit (TKKS), dan serbuk gergaji. Keempat substrat ini digunakan karena memiliki jumlah komponen selulosa yang lebih tinggi dibandingkan dengan komponen lain sehingga memiliki potensi yang besar untuk menghasilkan gula sederhana (Tabel 1). Perbedaan komposisi kimia masing-masing biomassa akan mempengaruhi kemampuan aktinomiset dalam degradasi. Antai & Crawford (1990) meneliti bahwa aktinomiset memiliki kemampuan yang lebih besar dalam mendegradasi jerami dibandingkan kayu lunak dan kayu keras. Dengan demikian perlu dilakukan pengkajian terhadap isolat-isolat aktinomiset koleksi Bagian Mikrobiologi, Departemen Biologi, IPB yang dapat menghasilkan enzim lignin peroksidase dalam mendegradasi biomassa lignoselulosa.
Tujuan
2 TINJAUAN PUSTAKA
Biomassa Lignoselulosa
Biomassa lignoselulosa dapat berasal dari berbagai jenis limbah, di antaranya limbah pertanian berupa jerami, tongkol jagung, sisa pangkasan jagung dan lainnya. Limbah perkebunan seperti tandan kosong kelapa sawit (TKKS), bagas tebu, kulit buah kopi dan lainnya. Limbah kayu dan kehutanan seperti sisa gergajian, dan limbah sludge pabrik kertas, serta sampah organik yang berasal dari rumah tangga dan pasar. Biomassa lignoselulosa dapat dijadikan biomaterial baru untuk menghasilkan bioproduk yang memiliki nilai yang lebih tinggi. Hal ini terkait dengan kandungan organik yang menyusun lignoselulosa berupa selulosa, hemiselulosa dan lignin (Howard et al. 2003).
Selulosa merupakan komponen utama lignoselulosa dengan monomer glukosa. Selulosa terdiri atas struktur amorf dan kristalin. Struktur amorf merupakan selulosa nonkristalin yang tidak memiliki pola difraksi. Struktur kristalin terdiri atas selulosa I, II, III dan IV. Selulosa I paling banyak terdapat di alam, dibedakan menjadi 2 yaitu (1) Iα dengan struktur triklinik, metastabil dan dominan pada tumbuhan tingkat rendah (2) Iβ dengan struktur monoklinik, stabil dan dominan pada tumbuhan tingkat tinggi. Selulosa II berasal dari perlakuan asam (mercerization), dan solubilization. Selulosa III berasal dari selulosa I dengan perlakuan cairan amonia. Selulosa IV berasal dari pemanasan selulosa III (Park et al. 2010, Brown 1999, Vassilev et al. 2012). Hidrolisis secara enzimatis mengubah selulosa menjadi glukosa pada struktur kristalin dengan menggunakan enzim eksoglukanase dan pada struktur amorf menggunakan enzim endoglukanase (Thygesen et al. 2005).
Hemiselulosa yang terkandung pada biomassa lignoselulosa berkisar 20-35%. Gula hemiselulosa dapat dikonversi menjadi etanol atau produk
fermentasi bernilai lainnya. Hemiselulosa tersusun atas polimer heterogen dari pentosa (xilosa dan arabinosa), heksosa (manosa, glukosa, galaktosa) dan sugar acid. Hemiselulosa pada kayu keras banyak mengandung xilan sedangkan kayu lunak banyak mengandung glukomanan. Xilan pada beberapa tumbuhan merupakan heteropolisakarida dengan rantai utama homopolimer dari unit-unit β -D-xylopyranose dengan ikatan glikosidik β-(1Æ4). Komposisi xilan bervariasi pada setiap tumbuhan. Xilan pada birchwood mengandung 89.3% xilosa, 1% arabinosa, 1.4% glukosa, dan 89.3% asam anhidrouronik. Xilan pada sekam padi mengandung 46% xilosa, 44.9% arabinosa, 6.1% galaktosa, 1.9% glukosa, dan 1.1% asam anhidrouronik. Enzim pendegradasi xilan berperan dalam menguraikan struktur kompleks pada xilan (Saha 2003).
Lignin berasal dari kata Latin “lignum” yang berarti kayu. Lignin disintesis dari p-koumaril, koniferil, dan sinapsil alkohol yang diinisiasi oleh enzim polimerisasi dehidrogenatif (Gambar 1). Lignin terdiri atas 3 struktur yaitu (1) 4-hidroksifenil (H) merupakan turunan p-koumaril alkohol yang tidak memiliki gugus OCH3, (2) guaisil (G) merupakan turunan koniferil alkohol yang memiliki
satu gugus aril-OCH3, (3) syringyl (S) merupakan turunan sinapsil alkohol
dengan 2 gugus aril-OCH3 (Gambar 2) (Wong 2009). Jenis ikatan yang paling
lebih dari separuh dari semua ikatan antar unit jenis ikatan lain yang penting yaitu 5,5, β-5, α-O-4 (Fengel & Weneger 1994).
Kandungan komponen penyusun lignoselulosa pada setiap tumbuhan bervariasi. Biomassa yang memiliki kandungan selulosa lebih tinggi dibandingkan dengan hemiselulosa dan lignin memiliki potensi yang cukup baik untuk diubah menjadi beragam produk yang memiliki nilai tambah (Tabel 1).
Tabel 1 Persentase komponen organik pada masing-masing substrat
Substrat Selulosa
Biokonversi lignoselulosa menjadi bioproduk bernilai melalui beberapa tahap yaitu praperlakuan (mekanik, kimia, dan biologi), hidrolisis polimer menjadi molekul yang dapat dimetabolisme, contohnya, gula heksosa dan pentosa, pemanfaatan molekul yang dihasilkan untuk pertumbuhan mikrob atau memproduksi produk kimia, pemisahan dan pemurnian. Proses praperlakuan menjadi bagian penting dalam menghasilkan yield produk yang tinggi (Howard et al. 2003).
Delignifikasi
Delignifikasi atau penghilangan lignin merupakan praperlakuan yang dilakukan untuk melepaskan selulosa dan hemiselulosa dari lignin (Gambar 2). Proses ini bertujuan untuk meningkatkan perolehan gula sederhana atau pembentukan gula melalui hidrolisis, menghindari degradasi atau hilangnya karbohidrat, menghindarkan terbentuknya produk samping yang dapat menghambat proses hidrolisis dan fermentasi, dan biaya lebih efektif (Kumar et al. 2009). Mosier et al. (2005) menambahkan bahwa praperlakuan sangat
p‐koumaril alkohol Koniferil alkohol Sinapsil alkohol
mendapatkan bahwa aktinomiset dari genus Streptomyces memproduksi beberapa enzim ektraselular peroksidase untuk katalisis oksidatif pemutusan model senyawa lignin ikatan β-aril eter.
Enzim Lignin Peroksidase
Lignin peroksidase merupakan protein heme mengkatalisis H2O2 yang
berkaitan dengan depolimerisasi oksidatif lignin. Enzim ini secara relatif tidak spesifik substrat karena diketahui dapat mengoksidasi substrat aromatik fenol dan beberapa model senyawa lignin nonfenolik. Enzim ligninolitik dihubungkan dengan pemecahan lignin karena enzim ini mampu mengoksidasi lignin yang berkaitan dengan senyawa aromatik. Substrat aromatik fenolik seperti guaiakol, asam vanilik, asam syringie dan senyawa nonfenolik seperti veratril alkohol, dimethyphenylenediamine sering kali digunakan untuk mengkarakteristik siklus katalitik, senyawa pembentuk dan reaksi oksidasi enzim intermediet, dan menyelidiki pemutusan ikatan spesifik. Komponen ini disintesis menirukan substruktur lignin seperti diarylpropane dan β-aril eter. Model komponen lignin
β-O-4 merupakan tipe utama dalam penjelasan degradasi lignin karena ikatan ini banyak terdapat pada biomassa lignoselulosa dengan kisaran 50 % pada gimnosperma dan 60% pada angiosperma (Wong 2009).
Jalur Degradasi Lignin
Skema degradasi lignin oleh aktinomiset ditunjukkan pada Gambar 3. Komponen I adalah 3,4-dimethoxyphenyl-ω-(2-methoxyphenoxy) acetophenon, komponen II merupakan 1-(34-dimethoxyphenyl)-2-(2-methoxyphenoxy) etanol dan komponen III adalah 4-hydroxy-3-methoxyphenyl- ω-(2-methoxyphenoxy) acetophenon. Streptomyces sp. EC1, Streptomyces sp. EC22, S.cyaneus dan
Komponen II
Pemanfaatan melalui jalur
β‐ketoadipat
Gambar 3 Skema degradasi lignin oleh Aktinomiset (Godden et al. 1992)
1 Reaksi tidak ditetapkan 2 Reaksi/produk diamati pada
Streptomyces sp.EC1
3 Reaksi/produk diamati pada
Thermomonospora mesophila
S. badius dapat menggunakan komponen II untuk menghasilkan komponen I dan III. Pemutusan model komponen β-aril eter melibatkan 3 elemen yaitu, demetilasi struktur cincin aromatik, oksidasi Cα untuk pengenalan gugus karbonil, dan pemutusan α-β menjadi produk monomer. Oksidasi Cα terlibat dalam degradasi lignin in situ, di luar perannya sebagai syarat untuk pemutusan α-β (Godden et al. 1992).
Rhodococcus jostii RHA1 diidentifikasi memiliki DypB peroksidase yaitu lignin peroksidase yang memutuskan β-aril eter. DypB peroksidase pada galur ini memiliki kemiripan dengan sebagian besar bakteri terutama aktinobakteria. DypB peroksidase mendegradasi lignin dengan pemutusan β-aril eter menghasilkan produk akhir berupa vanilin dengan skema sebagai berikut :
3 METODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan dari bulan Oktober 2012- April 2013. Bertempat di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB-LPPM, Institut Pertanian Bogor, Darmaga, Bogor.
Bahan dan Alat
Sebanyak 19 isolat yang digunakan berasal dari koleksi Yulin Lestari dan 4 isolat berasal dari koleksi Bagian Mikrobiologi, Departemen Biologi, FMIPA IPB, biomassa lignoselulosa berupa media yang digunakan untuk pertumbuhan yaitu bagas tebu, Tandan Kosong Kelapa Sawit (TKKS), tongkol jagung, dan serbuk gergaji, media Yeast Malt (YM), media Deokjin Maximal Medium (DJMM) dan lainnya. Alat yang diperlukan adalah inkubator goyang, autoklaf, pH meter, mikroskop cahaya terpolarisasi, hammer mill, spektrofotometer, neraca analitik, oven, sentrifus.
Metode Kerja
Peremajaan Isolat Aktinomiset
Biakan murni dari masing-masing isolat diremajakan pada media Yeast Malt (YM) dengan komposisi (g/l) : ekstrak khamir 3; ekstrak malt 3; glukosa 10; agar 20. Isolat diinkubasi pada suhu ruang selama 7 hari.
Seleksi Kemampuan Lignolitik Isolat Aktinomiset
Seleksi Aktinomiset dengan Merah Kongo dan Fuchsin
Isolat yang telah diremajakan kemudian digoreskan pada media YM padat yang mengandung 200 mg/l merah kongo atau 50 mg/l pewarna fuchsin. Pembentukan zona bening menunjukkan adanya enzim yang mampu mendegradasi komponen recalcitrant (Kang et al. 1999). Pengukuran zona bening yang terbentuk di sekitar koloni digunakan untuk menghitung indeks potensial (lignolitik), didapatkan dengan rumus sebagai berikut :
Karakteristik Enzim Isolat 42
Aktivitas Lignin Peroksidase
Isolat terpilih ditumbuhkan pada media Deokjin Maximal Medium (DJMM) selama 7 hari. Komposisi media terdiri atas: 0.3 % ekstrak khamir, 2% kasein; 0.7% CaCO3, 0.1% NH4Cl, 4% pati jagung, 0.1% R2YE trace metals (Lampiran
1) dan 0.6 % xilan (Yee et al. 1996). Isolat yang ditumbuhkan pada media Deokjin Maximal Medium (DJMM) padat sebanyak 2 corckborer disubkultur dalam 10 ml media Deokjin Maximal Medium (DJMM) cair dan dikocok dengan kecepatan 100 rpm pada suhu ruang. Enzim peroksidase diukur pada hari ke-6 selama 3 hari berselang. Aktivitas peroksidase diukur dengan mensentrifugasi kultur selama 15 menit dengan kecepatan 8500 g (Sorvall RC-5B plus). Enzim ekstrak kasar dipekatkan dengan cara dimasukkan ke dalam kantong selofan yang memiliki nominal molecular weight cuttoff 2000 Dalton dan didialisis menggunakan PEG 6000 pada suhu 5oC (Boyer 1986).
Aktivitas lignin peroksidase diukur dengan menggunakan colorimetric assay. Pengujian dilakukan berdasarkan konversi substrat pereduksi yang dikombinasikan dengan hidrogen peroksida dan kromogen pada kondisi pH, suhu dan konsentrasi reaktan tetap (Nicell & Wright 1997). Substrat pereduksi yang digunakan dalam pengujian ini adalah fenol dan hidrogen peroksida (H2O2),
sedangkan 4-aminoantipyrin (Am-NH2) sebagai color-generating substrates.
Bagian reaksi assay melibatkan oksidasi satu-elektron fenol yang dikatalisis oleh peroksidase dengan mekanisme Chance-George sebagai berikut:
k1
E + H2O2 Æ E1 + H2O ... 1
k2
E1 + PhOH Æ E2 + PhO. ... 2
k3
E2 + PhOH Æ E + PhO. + H2O ... 3
(Job & Dunford 1976)
PhO. + Am-NH2↔ PhOH + Am-NH. ... 4
PhO. + Am-NH.Æ Am-NH-Oph ... 5 Am-NH-OPh + H2O2Æ Dye + H2O2 ... 6
(Metelitzea et al.1991)
2PhO. + Am-NH2 + H2O2Æ Dye + PhOH + 2H2O
PhOH + Am-NH2 + 2H2O2Æ Dye + 4H2O
(Nicell & Wright 1997)
didefinisikan sebagai pemanfaatan µmol hidrogen peroksida dalam 1 menit pada kondisi di atas (Nicell & Wright 1997).
Unit/mg = ΔA/menit (6.58 x mg enzim/ml campuran reaksi) Keterangan :
6.58 = mM extinction coefficient dari quinoneimine dye (L.mmol-1.cm-1)
Pertumbuhan sel dihitung berdasarkan biomassa bobot kering dengan menggunakan kertas filter dan dikeringkan dalam oven semalaman pada suhu 80oC (Yee et al. 1996).
Aktivitas xilanase
Isolat terpilih diremajakan pada cawan berisi media xilan padat dengan komposisi 1% ekstrak khamir, 10.3 % sukrosa, 0.5% birchwood xilan dan 2% agar-agar selama 7 hari. Sebanyak 2 corckborer (diameter 1cm) kultur padat isolat tersebut, diinokulasikan ke dalam 10 ml media xilan cair, diinkubasi pada suhu kamar dengan pengocokkan 100 rpm. Kultur cair disentrifugasi pada kecepatan 5000 rpm selama 15 menit pada suhu 4oC. Filtrat yang diperoleh dipisahkan dari endapan dan digunakan sebagai ekstrak kasar xilanase. Penggujian aktivitas xilanase dilakukan dengan mengukur gula pereduksi sebagai produk hidrolisis xilan oleh xilanase menggunakan metode DNS (Miller 1959).
Pengujian sampel dilakukan dengan cara menambahkan 500 µl enzim ekstrak kasar ke dalam 500 µl substrat (0.5% birchwood xilan dalam 100 mM bufer fosfat pH 7.0), diinkubasi pada suhu ruang selama 60 menit. Reaksi enzimatis diakhiri dengan penambahan 1 ml reagen DNS (asam dinitrosisilat) dan dipanaskan dalam air mendidih (100oC) selama 15 menit. Campuran reaksi didinginkan dan diukur absorbansinya pada panjang gelombang 540 nm. Kontrol dibuat dengan cara menambahkan 500 µl enzim ekstrak kasar ke dalam campuran yang telah mengandung 500 µl substrat dan 1 ml DNS lalu dimasukkan ke dalam air mendidih selama 15 menit. Campuran didinginkan dan diukur absorbansinya pada panjang gelombang 540 nm dengan spektrofotometer. Blanko dibuat dengan cara yang sama seperti kontrol tetapi enzim ekstrak kasar diganti dengan akuades steril.
Aktivitas xilanase (unit/ml) = S K F
W BM ,
Keterangan :
S : konsentrasi gula pereduksi sampel K : konsentrasi gula pereduksi kontrol Fp: faktor pengenceran
Aktivitas xilanase dinyatakan dalam unit dimana satu unit aktivitas xilanase didefinisikan sebagai jumlah yang menyebabkan perubahan substrat xilan birchwood menjadi 1 µmol gula xilosa per menit.
Delignifikasi Substrat Lignoselulosa oleh Aktinomiset Isolat 42
Karakterisasi Substrat
Substrat lignoselulosa yang digunakan adalah TKKS, bagas tebu, serbuk gergaji, dan tongkol jagung. Substrat dikeringkan dan ukuran substrat diperkecil hingga 40 mesh. Substrat dikarakterisasi dengan metode Van Soest et al. (1991) (Lampiran 5). Pengamatan mikroskopik dilakukan dengan mikroskop cahaya terpolarisasi dan Scanning Electron microscopy (SEM).
Persiapan Substrat
Masing-masing substrat sebanyak 10 g ditambahkan ke dalam media yang mengandung 0.3 % ekstrak khamir, 0.7% CaCO3, 0.1% NH4Cl, 0.1% R2YE trace
metals (Lampiran 1). Kemampuan penyerapan air untuk masing-masing biomassa berdasarkan kemampuan serat untuk menyerap air yang sesuai untuk kultivasi media padat. Oleh karena itu, penambahan media cair sebanyak 50 ml untuk substrat jagung dan serbuk gergaji, 70 ml untuk TKKS dan 80 ml untuk bagas tebu. Campuran substrat dan media disterilisasi pada suhu 121oC selama 15 menit.
Proses Kultivasi
Isolat 42 ditumbuhkan pada media Deokjin Maximal Medium (DJMM) selama 7 hari. Sebanyak 2 corckborer disubkultur dalam 10 ml media Deokjin Maximal Medium (DJMM) cair, dikocok dengan kecepatan 100 rpm dan diinkubasi selama 5 hari pada suhu ruang.
Sebanyak 0.02 (g berat kering /g substrat) inokulum diinokulasikan pada masing-masing substrat dan diinkubasi pada suhu ruang selama 6 minggu (Pametto & Crawford 1986).
Penentuan Kemampuan Delignifikasi Substrat
hemiselulosa dan lignin menggunakan metode Van Soest et al. (1991). Pengamatan mikroskopik dilakukan dengan mikroskop cahaya terpolarisasi dan Scanning Electron Microscopy (SEM). Persentase kehilangan bobot substrat dihitung dengan persamaan berikut:
• Susut bobot (%) = – x 100% Keterangan:
BKO = Bobot Kering Oven (g)
Penurunan kadar komponen serat (sebagai lignin, selulosa, hemiselulosa) dihitung berdasarkan rumus:
• % Penurunan Komponen Serat (%) = x- [y ( ] Keterangan:
4 HASIL DAN PEMBAHASAN
Hasil
Seleksi Kemampuan Lignolitik Isolat Aktinomiset
Seleksi awal untuk mengidentifikasi kemampuan lignolitik isolat-isolat aktinomiset pada penelitian ini dilakukan dengan menambahkan komponen xenobiotik recalcitrant seperti azo-dyes dan tryphenylmethane dyes pada media Yeast Malt (YM). Senyawa azo-dyes yang digunakan pada penelitian ini ialah merah kongo dengan konsentrasi 200 mg/l. Dari 23 isolat aktinomiset, didapatkan 11 isolat aktinomiset yang dapat membentuk zona bening di sekitar koloni setelah diinkubasi selama 7 hari (Tabel 2, Gambar 5). Zona bening yang terbentuk berkisar antara 0.6-3.3 cm, sehingga diperoleh indeks lignolitik yang berkisar antara 0.2–0.5.
Tabel 2 Seleksi aktinomiset dengan merah kongo
Isolat
Respon terhadap Merah kongo
Nilai Indeks Lignolitik
1 - 0
5 - 0
6 - 0
8 + 0.2
9 - 0
10 + 0.25
11 - 0
12 - 0
15 - 0
16 + 0.3
24 - 0
25 + 0.5
32 - 0
34 + 0.28
35 + 0.22
37 - 0
39 + 0.34
42 + 0.28
43 + 0.23
B1 + 0.2
K10 - 0
T8 - 0
T13 + 0.3
Keterangan :
Seleksi lanjut dengan senyawa tryphenylmethane dyes yaitu fuchsin (50 mg/l). Fuchsin dikenal dengan nama lain rosaniline hydrochloride atau magenta. Isolat yang memiliki kemampuan mendegradasi merah kongo ditumbuhkan pada media padat yang mengandung fuchsin, didapatkan satu isolat setelah diinkubasi selama 7 hari, yaitu isolat 42 (Tabel 3). Hasil positif diperlihatkan dengan pemudaran warna (Gambar 6). Reaksi perubahan warna fuchsin terjadi cukup lambat yaitu setelah 30 hari gores. Pemudaran warna terjadi sangat jelas setelah 8 bulan inkubasi (Gambar 6d).
Tabel 3 Seleksi Aktinomiset dengan fuchsin
Isolat
Respon terhadap Fuchsin
8 TT 10 TT 16 TT 25 TT 34 TT 35 TT 39 TT 42 Positif 43 TT B1 TT T13 TT
Keterangan:
Positif : Tumbuh dan terjadi pemudaran warna TT : Tidak Tumbuh
Gambar 5 Respon isolat aktinomiset terhadap pewarna merah kongo a) tidak membentuk zona bening di sekitar koloni b) membentuk zona
Penapisan lignolitik dengan cara ini bersifat kualitatif. Nilai indeks lignolitik dan pemudaran warna pada media, dengan penambahan merah kongo dan fuchsin tidak menunjukkan jumlah aktivitas ALiP, sehingga diperlukan uji aktivitas ALiP secara kuantitatif.
Karakteristik Enzim Isolat 42
Aktivitas Enzim Lignin Peroksidase
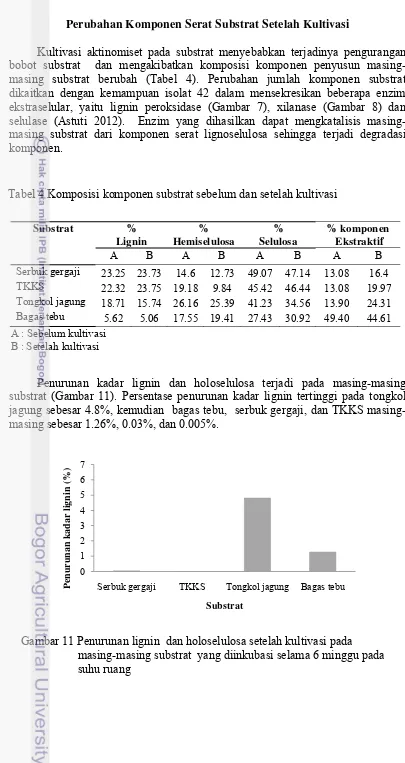
Isolat 42 di subkultur pada media DJMM (Deoxjin Maximal Medium) padat selama 7 hari, kemudian dipindahkan pada media DJMM cair untuk pengukuran aktivitas. Aktivitas enzim lignin peroksidase diukur pada hari ke 6, 8, dan 10 masing-masing sebesar 13.39 U/mg, 24.46 U/mg, dan 13.28 U/mg (Gambar 7).
Aktivitas Lignin Peroksidase Biomassa (mg/mL)
Aktivitas Enzim Xilanase
Isolat 42 di subkultur pada media xilan padat selama 7 hari dan dipindahkan pada media xilan cair untuk pengukuran aktivitas xilanase. Aktivitas xilanase diukur pada hari ke 5, 10, dan 15 dengan aktivitas masing-masing sebesar 0.038 U/ml, 0.055 U/ml, dan 0.034 U/ml.
Aktivitas Enzim Selulase
Isolat 42 memiliki aktivitas selulase. Pengukuran diawali dengan menginokulasi isolat 42 pada media CMC padat selama 7 hari kemudian dipindahkan pada media CMC cair. Pengukuran aktivitas selulase dilakukan oleh Astuti (2012) yang memperoleh aktivitas tertinggi pada hari ke-15 sebesar 0.048 U/ml. Selain itu, isolat 42 memiliki aktivitas selulase pada substrat spesifik CMCase, avisel, dan Fpase masing-masing sebesar 0.028 U/ml, 0.023 U/ml, dan 0.037 U/ml.
Delignifikasi Substrat Lignoselulosa oleh Aktinomiset Isolat 42
Tahap ini menggunakan empat biomassa lignoselulosa yaitu serbuk gergaji, Tandan Kosong Kelapa Sawit (TKKS), tongkol jagung, dan bagas tebu. Isolat 42 tumbuh pada permukaan substrat dengan warna koloni abu-abu (Gambar 9). Kolonisasi isolat 42 tampak jelas pada substrat tongkol jagung dan bagas tebu (Gambar 9 g-h). Kolonisasi memperlihatkan bahwa isolat 42 dapat memanfaatkan substrat dengan mendegradasi komponen pada substrat ini.
0
Pemanfaatan substrat dengan mendegradasi komponen pada masing-masing biomassa lignoselulosa oleh isolat 42 didukung dengan terjadinya susut bobot setelah kultivasi (Gambar 10). Persentase susut bobot dihitung berdasarkan perbandingan bobot substrat setelah dan sebelum delignifikasi. Susut bobot (%) mengindikasikan perubahan komposisi komponen substrat akibat interaksi aktinomiset dengan substrat. Persentase susut bobot (%) pada bagas tebu, tongkol jagung, TKKS dan serbuk gergaji masing-masing sebesar 13.8%, 11.64%, 6.04%, dan 2.14%.
a b c d
e f g h
Gambar 9 Kultivasi biomassa oleh isolat 42 sebelum diinkubasi pada suhu ruang (a-d) dan setelah inkubasi 6 minggu (e-f). a & e: serbuk gergaji, b & f: TKKS, c & g: tongkol jagung, d & h: bagas tebu.
Gambar 10 Persentase susut bobot substrat setelah kultivasi 0
2 4 6 8 10 12 14 16 18
serbuk gergaji TKKS tongkol jagung bagas tebu
Susut bobot
(%
)
Perubahan Komponen Serat Substrat Setelah Kultivasi
Kultivasi aktinomiset pada substrat menyebabkan terjadinya pengurangan bobot substrat dan mengakibatkan komposisi komponen penyusun masing-masing substrat berubah (Tabel 4). Perubahan jumlah komponen substrat dikaitkan dengan kemampuan isolat 42 dalam mensekresikan beberapa enzim ekstraselular, yaitu lignin peroksidase (Gambar 7), xilanase (Gambar 8) dan selulase (Astuti 2012). Enzim yang dihasilkan dapat mengkatalisis masing-masing substrat dari komponen serat lignoselulosa sehingga terjadi degradasi komponen.
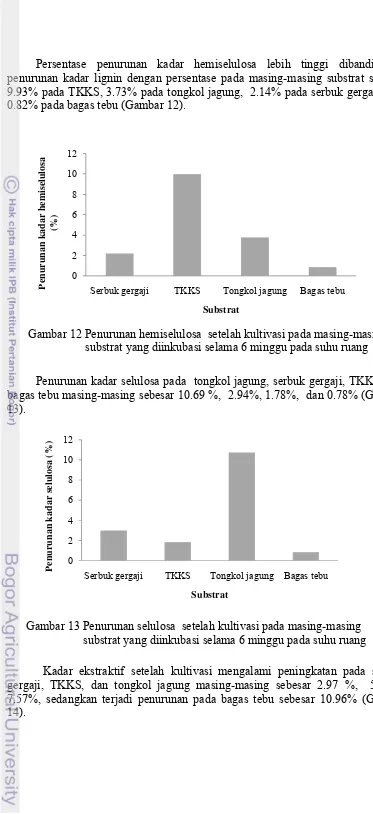
Penurunan kadar lignin dan holoselulosa terjadi pada masing-masing substrat (Gambar 11). Persentase penurunan kadar lignin tertinggi pada tongkol jagung sebesar 4.8%, kemudian bagas tebu, serbuk gergaji, dan TKKS masing-masing sebesar 1.26%, 0.03%, dan 0.005%.
0
Serbuk gergaji TKKS Tongkol jagung Bagas tebu
Penurunan kadar
lignin
(%
)
Substrat
Gambar 11 Penurunan lignin dan holoselulosa setelah kultivasi pada masing-masing substrat yang diinkubasi selama 6 minggu pada suhu ruang
Tabel 4 Komposisi komponen substrat sebelum dan setelah kultivasi
Substrat % A : Sebelum kultivasi
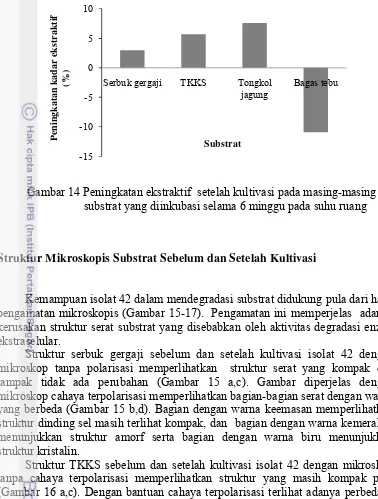
Persentase penurunan kadar hemiselulosa lebih tinggi dibandingkan penurunan kadar lignin dengan persentase pada masing-masing substrat sebesar 9.93% pada TKKS, 3.73% pada tongkol jagung, 2.14% pada serbuk gergaji, dan 0.82% pada bagas tebu (Gambar 12).
Penurunan kadar selulosa pada tongkol jagung, serbuk gergaji, TKKS, dan bagas tebu masing-masing sebesar 10.69 %, 2.94%, 1.78%, dan 0.78% (Gambar 13).
Kadar ekstraktif setelah kultivasi mengalami peningkatan pada serbuk gergaji, TKKS, dan tongkol jagung masing-masing sebesar 2.97 %, 5.68%, 7.57%, sedangkan terjadi penurunan pada bagas tebu sebesar 10.96% (Gambar 14).
0 2 4 6 8 10 12
Serbuk gergaji TKKS Tongkol jagung Bagas tebu
Penurunan
kadar selulosa (%
)
Substrat
0 2 4 6 8 10 12
Serbuk gergaji TKKS Tongkol jagung Bagas tebu
Penurunan kadar
hemiselulosa
(%
)
Substrat
Gambar 13 Penurunan selulosa setelah kultivasi pada masing-masing substrat yang diinkubasi selama 6 minggu pada suhu ruang
Struktur Mikroskopis Substrat Sebelum dan Setelah Kultivasi
Kemampuan isolat 42 dalam mendegradasi substrat didukung pula dari hasil pengamatan mikroskopis (Gambar 15-17). Pengamatan ini memperjelas adanya kerusakan struktur serat substrat yang disebabkan oleh aktivitas degradasi enzim ekstraselular.
Struktur serbuk gergaji sebelum dan setelah kultivasi isolat 42 dengan mikroskop tanpa polarisasi memperlihatkan struktur serat yang kompak dan tampak tidak ada perubahan (Gambar 15 a,c). Gambar diperjelas dengan mikroskop cahaya terpolarisasi memperlihatkan bagian-bagian serat dengan warna yang berbeda (Gambar 15 b,d). Bagian dengan warna keemasan memperlihatkan struktur dinding sel masih terlihat kompak, dan bagian dengan warna kemerahan menunjukkan struktur amorf serta bagian dengan warna biru menunjukkan struktur kristalin.
Struktur TKKS sebelum dan setelah kultivasi isolat 42 dengan mikroskop tanpa cahaya terpolarisasi memperlihatkan struktur yang masih kompak pula (Gambar 16 a,c). Dengan bantuan cahaya terpolarisasi terlihat adanya perbedaan (Gambar 16 b,d). Warna kebiruan pada serat sebelum kultivasi isolat 42 berada terselubung di dalam substrat sehingga tidak tampak begitu jelas, namun setelah kultivasi, warna kebiruan tersebut berserakan di sekitar substrat dan lebih terlihat jelas pada permukaan substrat, warna kebiruan menunjukkan struktur kristalin selulosa yang terlepas.
Struktur serat tongkol jagung sebelum dan setelah kultivasi isolat 42 dengan mikroskop tanpa polarisasi memperlihatkan adanya perbedaan (Gambar 17 a, c). Sebelum kultivasi, struktur fibril teratur dan sangat kompak. Namun, terjadi perubahan setelah kultivasi, struktur fibril terlihat acak dan berongga yang menunjukkan adanya indikasi degradasi oleh aktinomiset.
-15 -10 -5 0 5 10
Serbuk gergaji TKKS Tongkol jagung
Bagas tebu
Peningkatan
kadar ekstraktif (%
)
Substrat
(a) (b)
(c) (d)
Gambar 15 Struktur mikroskopis serbuk gergaji perbesaran 200x: sebelum kultivasi (a-b) dan setelah kultivasi (c-d); menggunakan mikroskop cahaya (a-c) dan cahaya terpolarisasi (b-d)
(a) (b)
(c) (d)
Struktur serat bagas tebu sebelum dan setelah kultivasi Isolat 42 tidak memperlihatkan banyak perubahan seperti pada tongkol jagung. Struktur serat pada bagas tebu lebih sederhana dibandingkan pada tongkol jagung. Namun degradasi serat bagas tebu oleh isolat 42 hanya ditunjukkan dengan adanya celah yang terbentuk pada serat setelah kultivasi (Gambar 18 a, c). Pengamatan dengan mikroskop cahaya terpolarisasi memperlihatkan adanya warna kebiruan yang menunjukkan selulosa kristalin pada serat sebelum dan setelah kultivasi Isolat 42 (Gambar 18 b, d).
Dari keempat substrat yang digunakan, substrat tongkol jagung terdegradasi lebih baik dibandingkan dengan substrat lain. Hasil diperjelas dengan pengamatan Scanning Electron Microscopy (SEM) (Gambar 19). Substrat yang belum terdegradasi masih utuh dan tidak ada lubang yang terbentuk (Gambar 19a). Substrat yang telah terdegradasi diperlihatkan adanya lubang pada substrat tongkol jagung setelah kultivasi (Gambar 19 b). Kerusakan substrat dengan membentuk jaring-jaring diperjelas pada Gambar 19(c), (d), isolat 42 dapat mengkolonisasi permukaan substrat yang ditandai dengan adanya sel yang menempel pada permukaan substrat (tanda anak panah).
(a) (b)
(c) (d)
(a) (b)
(c) (d)
Gambar 18 Struktur mikroskopis bagas tebu perbesaran 200x: sebelum kultivasi (a-b) dan setelah kultivasi (c-d); menggunakan mikroskop cahaya (a-c) dan cahaya terpolarisasi (b-d)
Gambar 19 Struktur mikroskopik tongkol jagung dengan SEM a) sebelum delignifikasi perbesaran 5000x; setelah delignifikasi b)1650x c) 5700x d) 6200x
Pembahasan
Seleksi awal untuk mengidentifikasi kemampuan lignolitik isolat-isolat aktinomiset pada penelitian ini dilakukan dengan menambahkan komponen xenobiotik recalcitrant seperti azo-dyes dan tryphenylmethane dyes pada media Yeast Malt (YM) berupa merah kongo dan fuchsin. Aktinomiset berperan sebagai agen biodegradatif lingkungan yang dapat mensekresikan enzim ekstraselular untuk mendegradasi senyawa recalcitrant tersebut (Kang et al. 1999).
Seleksi pertama dilakukan dengan menumbuhkan 23 isolat aktinomiset pada media YM dengan penambahan merah kongo, dan didapatkan 11 isolat yang memiliki aktivitas peroksidase (Tabel 2) yang ditandai dengan terbentuknya zona bening di sekitar koloni (Gambar 5). Merah kongo merupakan azo-dyes yang termasuk ke dalamgolongan sulfonated azo dye, dengan nama IUPAC disodium 4-amino-3-[4-[4-(1-amino-4-sulfonato naphthalen-2-yl) diazenylphenyl] phenyl] diazenyl- naphthalene-1-sulfonate, dengan adanya gugus SO3H dan struktur dasar
(-N=N-). Menurut Kang et al. (1999), Streptomyces mampu mendegradasi pewarna (dyes) dengan mensekresi enzim ekstraselular peroksidase. Aktivitas enzim ini akan menyebabkan pemudaran warna di sekitar koloni dengan terbentuknya zona bening.
Enzim ekstraselular peroksidase akan memutuskan struktur dasar merah kongo dengan penyerangan atom nitrogen (-N=N-), kemudian mengubah azo dye menjadi kation radikal yang rentan terhadap penyerangan nukleofilik oleh air atau hidrogen peroksida dan akan menghasilkan produk reaktif (intermediat) melalui reaksi redoks hingga memproduksi intermediet stabil (Goszczynski et al.1994, Gomare et al. 2008).
Seleksi lanjut dengan senyawa tryphenylmethane dyes yaitu fuchsin dengan konsentrasi 50 mg/l. Fuchsin dikenal dengan nama lain rosaniline hydrochloride, magenta, 4,4’-[(4-imino-2,5-cyclohexadien-I-ylidene)methylene]bis[benzeamine]. Isolat yang memiliki kemampuan mendegradasi merah kongo ditumbuhkan pada media padat mengandung fuchsin. Menurut Kang et al. (1999) isolat aktinomiset yang dapat tumbuh pada media dengan penambahan fuchsin menunjukkan bahwa isolat memiliki kemampuan dalam mengoksidasi senyawa fenol klorin (2,4 Dichlorophenol/DCP). Menurut Yee & Wood (1997) Streptomyces viridosporus T7 yang dapat mendegradasi DCP mensekresikan ALiP-P3 yang juga dapat mendegradasi lignin pada ikatan 1,2-diarylpropane (β-1) dan arylglyserol- β-aryl ether (β-O-4). Dari 11 isolat terpilih dari tahap sebelumnya hanya satu isolat yang dapat tumbuh setelah diinkubasi selama 7 hari, yaitu isolat 42 (Tabel 3). Hasil positif diperlihatkan dengan pemudaran warna yang ditunjukkan pada Gambar 6.
senyawa tryphenylmethane dyes lain yaitu kristal violet, metil violet, etil violet, dan victoria blue B.
Kemampuan isolat 42 mendegradasi senyawa azo dyes dan triphenylmethane dyes menjadikan isolat ini lebih potensial dibandingkan dengan isolat lain. Kemampuan ini mengindikasikan bahwa isolat 42 memiliki memiliki aktivitas enzim mirip peroksidase dan aktivitas oksidasi fenol-klorin. Menurut Kang et al. (1999) aktinomiset yang memiliki kedua kemampuan ini mempunyai kemiripan dengan enzim isoform Actinomycetes Lignin-Peroksidase- P3 (ALiP-P3) yang dikarakterisasi dari S. viridosporus. ALiP yang disekresikan oleh Streptomyces memiliki kemiripan dengan LiP yang dihasilkan oleh Phanerochaete chysosporium.
Lignin peroksidase (LiP) dapat mendegradasi dan memodifikasi senyawa aromatik recalcitrant yang bervariasi dan mengoksidasi sejumlah aromatik polisiklik dan senyawa fenolik (Mliki & Zimmermann 1992, Godden et al. 1992). Kang et al.(1999) menetapkan ALiP sebagai pendegradasi beberapa variasi struktur xenobiotik recalcitrant termasuk azo-dyes dan fenol klorin (chlorinated phenol).
Penapisan lignolitik isolat aktinomiset dengan cara ini bersifat kualitatif. Nilai indeks potensial (Tabel 2) dan pemudaran warna pada media dengan penambahan fuchsin tidak menunjukkan jumlah aktifitas ALiP, sehingga diperlukan uji aktivitas ALiP secara kuantitatif.
Astuti (2012) telah mengindentifikasi isolat 42 dan dinyatakan homolog dengan Streptomyces exfoliatus. Aktinomiset dari genus Streptomyces ini memiliki hifa vegetatif dan bersporulasi pada umur 7-14 hari. Menurut Ramachandra et al. (1987) beberapa aktinomiset dari golongan Streptomyces diketahui mampu mendegradasi lignoselulosa dengan cara mendegradasi lignin dan memotong karbohidrat. Aktinomiset yang menghasilkan enzim lignin peroksidase telah banyak diketahui, di antaranya Streptomyces cyaneus (Mliki & Zimmermann 1992), Streptomyces galur EC 22 dan Streptomyces thermoviolaceus (Mercer et al. 1996).
Selain enzim lignin peroksidase, beberapa aktinomiset memiliki kemampuan mendegradasi lignoselulosa akan memiliki enzim xilanase dan selulase karena lignoselulosa tersusun atas komponen organik hemiselulosa dan selulosa. Aktinomiset yang memiliki aktivitas selulase adalah Streptomyces ruber (El-Sersy et al. 2010). Karakterisasi enzim xilanase dan selulase perlu dilakukan untuk mengetahui kemampuan isolat dalam mendegradasi substrat.
Kemampuan mendegradasi komponen bergantung pada aktivitas enzim yang dimiliki. Semakin besar aktivitas enzim maka akan semakin besar pula kemampuannya dalam mendegradasi komponen lignoselulosa. Menurut Adsul et al. (2004). Rasio enzim terhadap substrat merupakan salah satu faktor yang mempengaruhi efektivitas hidrolisis substrat.
yang berkaitan dengan stabilitas molekul enzim dan menghasilkan enzim yang lebih tinggi dengan mengurangi ukuran biomassa.
Optimasi lignin peroksidase juga dapat dilakukan dengan penambahan sumber karbon sebagai induser seperti lignoselulosa, selulosa dan xilan (Macedo et al. 1999). Penggunaan yeast ekstrak juga mampu meningkatkan pertumbuhan sel dan aktivitas peroksidase (Lodha et al. 1991). Namun, penggunaan yeast ekstrak (0.5 g/l) dengan penambahan suplemen CMC (3 g/l) sebagai sumber karbon menyebabkan aktivitas lignin peroksidase menurun 83% dibandingkan tanpa CMC. Oleh karena itu, media DJMM diformulasikan dengan penambahan xilan. Hal ini didukung dari penelitian Tuncer et al. (2004) yang mengamati bahwa penambahan xilan pada media mampu menginduksi enzim ekstraselular endoxilanase dan lignin peroksidase pada Streptomyces sp. F2621 menjadi lebih tinggi dari medium dasar salt-yeast extract dan ballmilled wheat straw (BMWS).
Aktivitas enzim lignin peroksidase diukur berdasarkan laju pembentukan produk berwarna dari reaksi pengujian yang sebanding dengan konsentrasi enzim aktif. Enzim (E) akan dioksidasi oleh H2O2 menjadi intermediat enzimatik aktif
yang disebut komponen I (Persamaan 1). Komponen I ini akan menerima fenol (PhOH) pada sisi aktif sehingga terjadi oksidasi menghasilkan komponen II (E2) dan fenol radikal (PhO.) yang dilepaskan ke larutan (Persamaan 2). Komponen II akan dioksidasi oleh molekul fenol kedua dan melepaskan fenol radikal lainnya dan kembali ke enzim awal (E), dengan demikian siklus sempurna (Persamaan 3). Perubahan warna dihasilkan dari reaksi fenol radikal yang bereaksi dengan aminoantipyrine (Am-NH2) dan hidrogen peroksida menghasilkan produk
antipyrilquinoneimne berwarna merah muda (Persamaan 4, 5, dan 6) (Nicell & Wright 1997).
Enzim lignin peroksidase yang dihasilkan oleh bakteri merupakan produk dari proses metabolisme primer (Gambar 7) (Godden et al. 1992). Hal ini didukung dengan hasil penelitian Tuncer et al. (2004) yang menyatakan bahwa Streptomyces sp. F262 memproduksi enzim lignin peroksidase pada fase pertumbuhan. Pada penelitian ini, aktivitas tertinggi dihasilkan pada hari ke-8. Berdasarkan Ramachandra et al.(1987) aktivitas enzim lignin peroksidase akan mencapai puncak pada awal fase stasioner dan secara dramatis akan menurun ketika memasuki fase akhir stasioner. Aktivitas enzim lignin peroksidase optimal akan berbeda karena pengaruh nutrisi terutama sumber karbon. Tuncer et al. (1999) melakukan pengamatan pada aktinomiset termofilik, Thermoomonospora fusca BD25 yang ditumbuhkan pada media dengan penambahan 0.6% (w/v) xilan diketahui bahwa aktivitas peroksidase dihasilkan pada fase pertumbuhan (48-96 jam), dan menurun perlahan setelah 7 hari inkubasi dengan aktivitas sebesar 12.08 U/ml.
Tuncer et al. (2004) menyatakan juga bahwa Streptomyces memiliki aktivitas lignoselulolitik berupa peroksidase, xilanase dan endoglukanase. Pada penelitian ini, Isolat 42 ditumbuhkan pada media xilan dan memiliki aktivitas yang diukur pada hari ke 5, 10 dan 15 (Gambar 8).
Meryandini et al. (2006) dengan menggunakan isolat Streptomyces spp. SKK 1-8 dengan aktivitas yang lebih tinggi sebesar 0.65 U/ml.
Isolat 42 memiliki aktivitas enzim selulolitik, sebagaimana dilakukan oleh Astuti (2012) dengan aktivitas tertinggi pada hari ke-15. Isolat 42 memiliki aktivitas selulase pada substrat spesifik CMCase, avisel dan Fpase.Adanya ketiga aktivitas enzim spesifik menunjukkan kemampuan isolat dalam mendegradasi selulosa. Menurut Datshban et al. 2010 hidrolisis selulosa membutuhkan gabungan enzim endogukanase, eksoglukanase dan β-glukosidase yang bekerja secara sinergis.
Ogawa et al. (2007) dan Wang et al.(2008) menjelaskan bahwa isolat yang memiliki aktifitas spesifik pada CMCase menunjukkan bahwa isolat tersebut memiliki enzim endoglukanase. Substrat CMC akan didegradasi oleh enzim endoglukanase yang memutuskan ikatan selulosa dibagian internal area amorf. Aktivitas spesifik pada substrat avicel menunjukkan adanya enzim eksoglukanase yang memutuskan unit selobiosil dari ujung rantai selulosa, area yang diserang merupakan kristalin. FPase merupakan metode untuk menganalisis total aktivitas selulase (Dasthban et al. 2010).
Aktivitas selulase pada substrat CMCase yang dihasilkan isolat 42 lebih tinggi dibandingkan dengan avicel. Menurut Wang et al. (2008) enzim selulase yang dihasilkan merupakan endoglukanase yang menunjukkan aktivitas aviselase (eksoglukonase).
Hasil memperlihatkan kemampuan isolat 42 menghasilkan lignin peroksidase, xilanase dan selulase. Hal ini membuktikan bahwa isolat 42 merupakan Streptomyces yang memiliki potensi sebagai sumber enzim untuk degradasi biomassa lignoselulolitik.
Biomassa lignoselulosa mengandung komponen heterogen kompleks dari komponen organik yaitu selulosa, hemiselulosa, lignin dan ekstraktif. Setiap tumbuhan memiliki persentase komponen yang bervariasi (Tabel 1). Biomassa lignoselulosa yang digunakan pada tahap delignifikasi merupakan Agro-industrial residues berupa serbuk gergaji, TKKS, tongkol jagung dan bagas tebu. Biomassa ini memiliki kandungan selulosa yang lebih tinggi dibandingkan dengan hemiselulosa dan lignin sehingga memiliki potensi yang cukup baik untuk diubah menjadi beragam produk yang memiliki nilai tambah (Vassilev et al. 2012, Howard et al .2003).
Pemanfaatan biomassa lignoselulosa mengalami permasalahan dalam proses pemisahan antar komponennya, terutama lignin. Ikatan lignin yang kuat menghalangi penetrasi enzim dalam proses hidrolisis sehingga menurunkan kinerja enzim (Mosier et al. 2005). Dengan demikian, perlu dilakukan proses praperlakuan yang dikenal dengan delignifikasi (penghilangan lignin). Penelitian ini mengkaji kemampuan isolat 42 dalam mendelignifikasi lignin pada substrat serbuk gergaji, TKKS, tongkol jagung dan bagas tebu.
Isolat 42 memiliki hifa yang menyerupai atribut pada fungi dan tumbuh pada permukaan substrat (Gambar 9). Menurut Ward (1989); Couto & Sanroman (2006); Pandey (2003) SSF sesuai untuk mikroorganisme berfilamen seperti yeast dan fungi yang tumbuh pada permukaan substrat sehingga disebut “Solid substrates bed” dengan substrat yang basah dan tidak ada jumlah air bebas (free water) atau terbatas dengan Water actvity (aw) berkisar 0.7. Water actvity (aw)
substrat merupakan penghubung sebagai parameter dasar untuk transfer massa air dan solut (solutes)menuju sel mikrob.
Ukuran substrat yang digunakan pada penelitian ini diperkecil hingga 40 mesh. Menurut Ward (1989) ukuran partikel substrat merupakan faktor penting dalam penggunaan metode SSF untuk mengoptimasikan rongga antar partikel agar transfer gas dan panas lebih mudah. Panas dihasilkan dari aktivitas mikrob selama fermentasi dan dapat mendenaturasi enzim yang dihasilkan dari proses ini (Singhania et al. 2009).
Kemampuan isolat 42 dalam mengkolonisasi masing-masing substrat diperlihatkan dengan pertumbuhan koloni Streptomyces pada permukaan substrat dengan warna koloni abu-abu (Gambar 9). Kolonisasi memperlihatkan bahwa isolat 42 dapat memanfaatkan substrat dengan mendegradasi komponen pada substrat tersebut. Hal ini sesuai dengan pernyataan Godden et al.(1992) yang menyatakan bahwa aktinomiset yang ada ditanah merupakan saprofit biodegradatif aerobik dengan substrat utama adalah biomassa tumbuhan. Menurut Tuomela et al. (2000) kemampuan mikrob dalam mengasimilasi bahan organik tergantung dengan kemampuanya dalam memproduksi enzim yang dibutuhkan untuk mendegradasi komponen substrat, semakin kompleks substrat yang digunakan maka semakin komplek enzim yang dibutuhkan. Isolat 42 memiliki kemampuan lignoselulolitik dengan menghasilkan enzim lignin peroksidase, xilanase dan selulase (Gambar 7; 8; Astuti 2012). Keberadaan enzim ini membantu isolat dalam mendegradasi komponen organik yang kompleks dari masing-masing substrat lignoselulosa menjadi molekul sederhana berupa karbon yang dapat dimanfaatkan sel mikrob.
Pertumbuhan koloni pada permukaan substrat tongkol jagung dan bagas tebu tampak lebih padat dan jelas dibandingkan dengan dua substrat lainnya (Gambar 9). Hal ini menunjukkan bahwa kemampuan degradasi isolat 42 terhadap masing-masing substrat berbeda yang dikaitkan dengan perbedaan jumlah komposisi dan komponen masing-masing penyusun substrat (Tabel 1).
Kemampuan isolat 42 dalam mendegradasi substrat diperlihatkan dari penurunan jumlah bobot substrat setelah delignifikasi yang ditunjukkan pada (Gambar 10). Persentase susut bobot dihitung berdasarkan perbandingan bobot substrat setelah dan sebelum delignifikasi. Bobot yang hilang (%) mengindikasikan adanya penggunaan komponen substrat akibat interaksi aktinomiset dengan substrat (Gambar 10). Menurut Tuomela et al. (2000) bahan organik dari lignoselulosa dimanfaatkan mikrob sebagai sumber karbon untuk proses metabolisme yang menghasilkan energi dan melepaskan CO2, termoenergi
berupa panas dan produk akhir yang lebih sederhana sesuai dengan enzim ekstraseluler yang dihasilkan.
dengan pertumbuhan koloni yang lebih padat dibandingkan pada substrat serbuk gergaji dan TKKS (Gambar 9). Hal ini menunjukkan bahwa komponen penyusun masing-masing substrat berpengaruh terhadap pertumbuhan dan kemampuan isolat dalam mendegradasi substrat.
Komponen penyusun substrat akan berbeda untuk setiap substrat, yang terlihat dari morfologinya. Bagas tebu merupakan limbah batang tebu yang gulanya sudah diekstraksi dan memiliki empat fraksi yaitu serat yang tersusun atas fraksi padatan organik, non-soluble solid berupa susbtansi inorganik yang tidak dapat larut dalam air, soluble solid berupa sukrosa dan sejumlah kecil komponen kimia seperti lilin yang dapat larut dalam air dan air (Canilha et al.2013).
Tongkol jagung terbagi menjadi 3 bagian yaitu sekam (chaff) yang juga disebut beeswing terletak di bagian paling luar, empelur (pith) berupa bagian lembut berspons berada di bagian tengah, dan cincin kayu (woody ring) yang merupakan bagian paling keras terletak di antara sekam dan empelur. Dengan komposisi kimia selulosa, hemiselulosa, lignin, protein, lemak,dan ash (Garotte et al. 2007).
TKKS merupakan struktur buah yang memiliki serat keras dan kasar seperti sabut. Pada bagian tengah terdapat lakuna dengan struktur berbentuk tabung berpori. Pada bagian dalam pembuluh ditemukan granul pati dan terdapat silika pada seratnya. Silika menyebar pada seluruh permukaan serat yang menyebabkan serat menjadi keras dan mengandung gugus hidroksil yang menjadikan serat hidrofilik. Namun, mengandung selulosa yang tinggi sehingga dapat bermanfaat untuk berbagai aplikasi (Shinoj et al. 2011).
Serbuk gergaji terdiri atas Tectona grandis dan Falcataria moluccana yang tergolong kayu keras (hardwood). Kayu keras tersusun atas kimia kompleks yaitu selulosa, hemiselulosa, lignin, beberapa komponen terlarut seperti stilbenes, flavonoid, tanin, terpenoid, dan komponen tidak larut seperti pektin dan protein dinding sel (Plomion et al. 2001). Taylor et al. (2002) menambahkan bahwa terdapat komponen ektraktif pada kayu yang memberikan karakter terhadap tumbuhan tersebut, ektraktif Tectona grandis dapat bersifat toksik dan menjadi pertahanan alami terhadap mikrob pengrusak kayu, berupa zat kuionon (Krishna & Nair 2010).
Kultivasi aktinomiset pada substrat menyebabkan terjadinya perubahan persentase komponen serat sebelum dan setelah kultivasi (Tabel 4). Persentase perubahan komponen setelah kultivasi menunjukkan kenaikan dan penurunan jumlah komponen, salah satunya pada serbuk gergaji. Persentase lignin dan ekstraktif pada serbuk gergaji setelah kultivasi mengalami kenaikan sedangkan persentase komposisi hemiselulosa dan selulosa mengalami penurunan (Tabel 4). Kenaikan persentase sebenarnya menggambarkan penurunan komponen lainnya dalam suatu substrat. Nilai persentase komponen serat setelah degradasi merupakan selisih antara persentase setelah dan sebelum kultivasi terhadap nilai mutlak bobot (Gambar 11-13 dengan perhitungan pada Lampiran 6).
lignoselulosa sehingga terjadi degradasi komponen. Ball et al. (1990) menyatakan bahwa aktinomiset memiliki kemampuan melarutkan lignokarbohidrat.
Penurunan kadar lignin pada masing-masing substrat terjadi karena aktivitas enzim lignin peroksidase yang dieksresikan oleh aktinomiset isolat 42 (Gambar 7; 11). Enzim peroksidase ini seringkali dikaitkan dengan degradasi lignin karena kerja enzim relatif tidak spesifik. Substrat yang mampu didegradasi adalah senyawa seperti fenol, aromatik amines dan beberapa komponen seperti alkil peroksida (Wong 2009, Jing Li et al. 2009).
Kadar lignin substrat setelah dikultivasi isolat 42 mengalami tingkat penurunan yang berbeda untuk setiap substrat (Gambar 11), hal ini berkaitan dengan heterogenitas lignin untuk setiap jenis tumbuhan. Menurut Fengel & Wegener (1995), perbedaan dalam komposisi komponen lignin terjadi dalam seksi, kelas, ordo, dan genera maupun pada jaringan-jaringan, sel-sel kayu dan bahkan pada lapisan dinding sel satu spesies. Achyuthan et al. (2010) juga menambahkan bahwa potensi penghambatan degradasi lignin tergantung pada kandungan ligninnya, tipe lignin (G atau GS), crosslinked, struktur fenolik dan polimerik.
Isolat 42 dapat tumbuh pada semua substrat biomas yang digunakan. Penurunan lignin tertinggi terjadi pada tongkol jagung dan kemudian bagas tebu (Gambar 11). Hal ini menunjukkan bahwa isolat dapat memanfaatkan lignin sebagai sumber karbon. Menurut Le Roes-Hill et al. (2011), saat kondisi nutrisi terbatas, enzim lignin peroksidase disekresikan dan bereaksi dengan H2O2
menghasilkan radikal bebas yang akan menyerang lignin dengan cara berikatan dengan matrik lignin sehingga ikatan Cα-Cβ dan β-O-4 terdegradasi.
Penurunan lignin yang rendah terjadi pada serbuk gergaji dan TKKS (Gambar 11). Serbuk gergaji yang digunakan adalah kayu Tectona grandis dan kayu Falcataria moluccana (Miq) yang tergolong kayu keras. Menurut Nascimento et al. (2013) beberapa kayu keras mengandung senyawa kimia seperti tannin, flavonoid, kuinon, dan stilbenes yang terakumulasi di dalam komponen ekstraktif kayu keras (hardwood). Keberadaan senyawa ini dapat melindungi kayu terhadap degradasi organisme perusak seperti rayap, jamur, dan bakteri yang dapat menyebabkan aktivitas isolat 42 dalam mendegradasi komponen lignin terhambat. Hasil penelitian Krishna & Nair (2010) melaporkan bahwa ekstrak kulit kayu dan kayu Tectona grandis memiliki aktivitas antibakteri. Lacret et al. (2011) mendapatkan dua kuinon baru dari ekstrak Tectona grandis, dan Neamatallah et al. (2005) melaporkan bahwa ekstrak Tectona grandis mengandung 5-hydroxy-1,4-naphthalenedione yang bersifat antibakteri.
Pada TKKS, enzim lignin peroksidase yang dihasilkan isolat 42 tidak memutuskan ikatan pada lignin melainkan bereaksi dengan senyawa antioksidan dan tannin yang menyebabkan penurunan lignin sangat rendah (Gambar 11). Han dan May (2012) melaporkan bahwa terdapat senyawa antioksidan berupa asam galia, rutin, asam ferulik, dan cathechin yang diekstraksi dari TKKS kering, serta tannin (Ibrahim et al. 2005). Menurut Blokhina et al. (2003) senyawa antioksidan dan tannin dapat berperan sebagai senyawa penangkap Reactive Oxygen Species (ROS) berupa radikal hidroksil (•OH), hidrogen peroksida (H2O2), superoxide (O2•- ), nitric oxide (NO•), atau peroxinitric (OONO-), enzim
Kadar hemiselulosa pada keempat substrat mengalami penurunan (Gambar 12). Perbedaan penurunan kadar hemiselulosa dapat terjadi dikarenakan komposisi spesifik dari polisakarida untuk masing-masing substrat berbeda. Hal ini disebabkan oleh hemiselulosa merupakan polisakarida heterogen yang tersusun atas xilosaa, glukosa, manosa, galaktosa, L-arabinosa, asam D-glukoronik dan 4-O-metil- asam D-D-glukoronik. Dengan klasifikasi gula utama pada polimer backbone yaitu xilan atau manan (Walford 2008). Berdasarkan Fengel & Wegener (1995) kayu keras memiliki kandungan xilosa yang tinggi dan lebih banyak mengandung gugus asetil daripada kayu lunak. Pada kayu lunak kandungan manosa lebih tinggi dan lebih banyak unit galaktosa daripada kayu keras. Hemiselulosa bagas tebu disusun atas backbone xilosa dengan unit cabang glukosa dan arabinosa (Walford 2008), tongkol jagung memiliki unit l-arabino-(4-O-methyl-d-glucurono)-d-xylan (Ebringerova et al. 1992), birchwood yang mewakili kayu keras memiliki unit glucopyranosyl uronic acid. Komposisi spesifik ini akan berpengaruh terhadap pemutusan ikatan oleh enzim xilanase. Menurut Ebringerova et al. (1992) pemutusan optimal pada rantai subsitusi yang berbeda dibutuhkan kombinasi enzim.
Penurunan hemiselulosa tertinggi terjadi pada TKKS (Gambar 12), yang menunjukkan bahwa isolat 42 dapat memanfaatkan hemiselulosa sebagai sumber karbonnya karena menghasilkan enzim xilanase (Gambar 8). Meskipun pengurangan kadar lignin rendah, hemiselulosa dapat dimanfaatkan karena pengaruh pengecilan ukuran substrat hingga 40 mesh yang memberikan akses masuk bagi mikrob untuk memanfaatkan xilan melalui bagian terpotong. Menurut Fengel & Wegener (1995) perlakuan fisik akan berpengaruh terhadap penghilangan lignin.
Penurunan kadar selulosa (Gambar 13) terjadi akibat aktivitas selulase isolat 42 pada substrat spesifik avisel, FPase dan CMCase (Astuti 2012). Menurut Adsul et al. (2004) dan Wang et al. (2008) aktivitas selulase merupakan atribut mikrob untuk memanfaatkan selulosa yang melibatkan gabungan enzim hidrolisis, terdiri atas endoglukanase, eksoglukanase (cellobiohydrolase), and β-glucosidase yang bekerja secara sinergis. Henrissat (1994) menambahkan bahwa selulase mendegradasi selulosa dengan menghidrolisis ikatan glikosidik yang menghubungkan residu β–D-glukosil selulosa.
Penurunan kadar selulosa dari keempat substrat berbeda yang diperlihatkan pada Gambar 13. Jumlah komposisi struktur kristalin dan amorf selulosa untuk setiap tumbuhan berbeda menyebabkan perbedaan penurunan kadar selulosa. Menurut Henrissat (1994) dan Absul et al. (2004) aspek sinergis enzim selulase terhadap substrat dipengaruhi oleh struktur dan ultrastruktur substrat selulosa serta ratio masing-masing enzim.
Kandungan struktur kristalin yang tinggi seperti pada serbuk gergaji dan TKKS mengakibatkan penurunan selulosa rendah. Hu et al. (2009) menambahkan bahwa selulosa dengan kristalin yang tinggi akan membutuhkan waktu yang lebih lama untuk dihidrolisis daripada selulosa yang mengandung sedikit kristalin.
Tuomela et al. (2000) menambahkan bahwa enzim komplek akan mendegradasi komponen organik menjadi molekul sederhana.
Peningkatan kadar ekstraktif untuk serbuk gergaji, TKKS, dan tongkol jagung tidak sebanding dengan penurunan kadar lignin dan holoselulosa (Gambar 11-14). Hal ini mengindikasikan bahwa mikrob memanfaatkan gula sederhana yang, didukung dari kisaran waktu produksi enzim tertinggi terhadap waktu delignifikasi. Waktu produksi tertinggi enzim lignin peroksidase, xilanase dan selulase didapatkan masing-masing pada hari ke 8, 10, dan 15 (Gambar 7-8, Astuti 2012), sedangkan waktu inkubasi isolat 42 pada substrat selama 6 minggu sehingga memungkinkan isolat menggunakan gula sederhana untuk menghasilkan energi, panas dan CO2. Tuomela et al. (2000) menambahkan bahwa mikrob yang
menghasilkan enzim kompleks akan mengubah komponen organik menjadi senyawa yang lebih sederhana, seperti karbon yang digunakan sebagai sumber energi dalam metabolisme dan nitrogen untuk pertumbuhan sel dan menjalankan fungsi sel.
Kadar ekstraktif pada bagas tebu mengalami penurunan drastis (Gambar 11-14), sedangkan kadar lignin dan holoselulosa mengalami penurunan yang paling rendah. Kondisi ini mengindikasikan bahwa mikrob memanfaatkan gula sederhana yang tersedia pada bagas tebu sebelum mendegradasi komponen lain. Menurut du Toit et al. (1984) bagas tebu yang belum diekstraksi memiliki kandungan monosakarida, berupa 0.74%-2.5% arabinosa, 0.07%-.99% galaktosa, 8.13- 10.08% xilosa dan 1.44-3.57% glukosa.
Kerusakan masing-masing substrat akibat aktivitas degradasi enzim ekstraselular dapat dilihat dari hasil pengamatan mikroskopis (Gambar 15-17). Aktivitas enzim ekstraselular yang dihasilkan isolat 42 memiliki respon yang berbeda terhadap masing-masing substrat. Dengan demikian, struktur mikroskopis masing-masing substrat akan memperlihatkan respon yang berbeda pula.
Struktur serbuk gergaji setelah kultivasi tidak memperlihatkan perubahan (Gambar 15). Pengamatan ini didukung dari hasil persentase susut bobot, kadar hemiselulosa, selulosa, dan lignin yang mengalami sedikit penurunan (Gambar 10-13). Hal ini mengindikasikan bahwa serbuk gergaji belum terdegradasi dengan baik oleh aktinomiset dikarenakan serbuk gergaji terdiri atas kayu keras dengan kadar lignin yang tinggi (Tabel 1), dan memiliki komponen yang heterogen. Salah satu komponen yang memiliki aktivitas penghambatan pertumbuhan yaitu kuinon. Lacret et al. (2011) membuktikan bahwa kuinon berpotensi menghambat pertumbuhan mikrob.
Struktur TKKS setelah delignifikasi memperlihatkan perubahan yaitu banyaknya selulosa dengan struktur kristalin yang terlepas, ditunjukkan dengan gambar kebiruan berhamburan disekitar substrat (Gambar 16). Hal ini didukung dengan hasil penurunan kadar hemiselulosa yang cukup tinggi (Gambar 12). Fengel & Wegener (1995) menyatakan bahwa selulosa terikat kuat pada hemiselulosa dan lignin, sehingga penurunan hemiselulosa mengakibatkan adanya rongga antar komponen struktur kristalin terlepas.