LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI
di
PT. Mutiara Mukti Farma (MUTIFA) Medan
Disusun Oleh:
Boy Indrawan, S.Farm 083202106
PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI FARMASI di
PT. Mutiara Mukti Farma (MUTIFA) Medan
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara
Disusun Oleh:
Boy Indrawan, S. Farm 083202106
Disetujui Oleh: Pembimbing,
Donald Situmeang, S.Si., Apt.
Disahkan Oleh: Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa atas limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan dan penyusunan laporan ini.
Pada kesempatan ini, penulis menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara.
2. Bapak Drs. Wiryanto, M.S., Apt., selaku Koordinator Program Studi Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara. 3. Bapak Jacob selaku Direktur Utama PT. MUTIFA Medan yang telah berkenan
memberikan fasilitas kepada penulis untuk melaksanakan Praktek Kerja Profesi (PKP).
4. Ibu Betty, S.Si., Apt., selaku Manager Quality Assurance (QA) yang telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP).
5. Bapak Donald Situmeang, S.Si., Apt., selaku Manager Produksi Solid Non Beta Laktam dan sebagai pembimbing dan memberikan fasilitas serta mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP) di PT. MUTIFA.
telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP).
7. Ibu Dra. Nuranti Sirait selaku Manager Quality Control (QC) yang telah membimbing dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP).
8. Bapak Amiruddin, S.H., selaku Manager Personalia yang telah membantu kami melaksanakan praktek kerja profesi.
9. Bapak Edi Jones, Amd., selaku Kabag PPIC dan Ibu Melya Utami, S.Farm., Apt., selaku Supervisor QC, Ibu Herawati, S.H., selaku Kabag GBK (Gudang Bahan Kemasan) yang telah membantu dan mengarahkan penulis selama melaksanakan Praktek Kerja Profesi (PKP).
10. Seluruh staf dan karyawan PT. MUTIFA Medan atas perhatian dan bantuan yang diberikan kepada penulis selama melaksanakan Praktek Kerja Profesi (PKP).
Penulis menyadari atas kekurangan dalam penulisan laporan ini, untuk itu penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan laporan ini.
Medan, Februari 2010 Penulis
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN... ii
KATA PENGANTAR... iii
DAFTAR ISI... v
DAFTAR GAMBAR... viii
DAFTAR TABEL... ix
DAFTAR LAMPIRAN... x
RINGKASAN... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 1
1.3 Manfaat ... 2
1.4 Tempat dan Waktu ... 2
BAB II TINJAUAN UMUM ... 3
2.1 Industri Farmasi ... 3
2.2 CPOB….……… 4
2.2.1 Manajemen Mutu……… 4
2.2.2 Personalia………. 7
2.2.3 Bangunan dan Fasilitas ………... 8
2.2.4 Peralatan ………... 11
2.2.5 Sanitasi dan Higiene ... 12
2.2.7 Pengawasan Mutu ……… 17
2.2.8 Inspeksi Diri dan Audit Mutu ………... 18
2.2.9 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian ... 19
. 2.2.10 Dokumentasi ………... 21
2.2.11 Pembuatan dan Analisis berdasarkan kontrak …... 22
2.2.12 Kualifikasi dan Validasi ... 23
BAB III TINJAUAN KHUSUS PT. MUTIFA MEDAN ... 28
3.1 Sejarah ... 28
3.2 Lokasi dan Sarana Produksi ... 30
3.2.1 Lokasi ... 30
3.2.2 Sarana Produksi ... 30
3.3 Struktur Organisasi ... 32
3.3.1 Departemen Produksi ... 32
3.3.2 Departemen Pemastian Mutu/Quality Assurance ... 34
3.3.3 Departemen Pengawasan Mutu/Quality Control... 36
3.3.4 Departemen Research and Development (R&D)... 37
3.3.5 Departemen Personalia ... 38
3.3.6 Departemen Keuangan ... 38
3.3.7 Departemen Teknik ... 38
3.3.8 Departemen Production Planning and Inventory Control 39 3.4 Limbah ... 40
BAB IV PEMBAHASAN ... 46
4.1 Manajemen Mutu ... 46
4.3 Bangunan dan Fasilitas... 48
4.4 Peralatan... 50
4.5 Sanitasi dan Higiene... 50
4.6 Produksi... 51
4.7 Pengawasan Mutu... 52
4.8 Inspeksi Diri dan Audit Mutu... 53
4.9 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian... 54
4.10 Dokumentasi... 55
4.11 Kualifikasi dan Validasi... 55
BAB V KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
5.2 Saran ... 58
DAFTAR PUSTAKA ... 59
DAFTAR GAMBAR
Halaman
Gambar 1. Bagan Aspek yang Saling Berkaitan Membangun
Manajemen Mutu ... 7 Gambar 2. Denah Lokasi PT. MUTIFA ………... 30
Gambar 3. Diagram Sistem Pengolahan Limbah Cair di PT.MUTIFA... 41
DAFTAR TABEL
Halaman
Tabel 1. Tolak Ukur Pemantauan Limbah Cair di PT. MUTIFA…… 42
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Struktur Organisasi PT. MUTIFA ... 60
Lampiran 2. Bagan Proses Pembuatan Tablet/Kaplet... 61
Lampiran 3. Bagan Proses Pembuatan Liquida ... 62
Lampiran 4. Bagan Proses Pembuatan Kapsul ... 63
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan yang merupakan salah satu program dalam pendidikan profesi apoteker, yang bertujuan agar mahasiswa/mahasisiwi mengetahui dan memahami tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa juga diharuskan dapat memperoleh wawasan dan pengetahuan yang lebih luas, memahami penerapan CPOB di PT. MUTIFA Medan, serta mengetahui gambaran tentang situasi dan kondisi kerja di PT. MUTIFA Medan.
RINGKASAN
Telah dilakukan Praktek Kerja Profesi (PKP) di Industri Farmasi PT. Mutiara Mukti Farma (MUTIFA) Medan yang merupakan salah satu program dalam pendidikan profesi apoteker, yang bertujuan agar mahasiswa/mahasisiwi mengetahui dan memahami tugas dan fungsi apoteker dalam industri farmasi, yang diharapkan dapat sebagai bekal untuk menghadapi dunia kerja yang sesungguhnya. Mahasiswa juga diharuskan dapat memperoleh wawasan dan pengetahuan yang lebih luas, memahami penerapan CPOB di PT. MUTIFA Medan, serta mengetahui gambaran tentang situasi dan kondisi kerja di PT. MUTIFA Medan.
BAB I PENDAHULUAN
1.1Latar Belakang
Industri farmasi merupakan salah satu tempat bagi profesi apoteker untuk melakukan pekerjaan kefarmasian terutama menyangkut pengadaan, pengendalian mutu sediaan farmasi, penyimpanan, pendistribusian dan pengembangan obat. Kemampuan seorang apoteker dalam mengelola industri farmasi merupakan faktor yang sangat penting untuk keberhasilan industri.
Kedudukan apoteker diatur oleh peraturan pemerintah yang dituangkan dalam Pedoman Cara Pembuatan Obat yang Baik (CPOB), yaitu apoteker berperan sebagai penanggung jawab produksi dan pengendalian mutu. Untuk menghasilkan sediaan obat jadi yang memenuhi persyaratan yang telah ditetapkan sesuai dengan tujuan penggunaannya, maka setiap industri farmasi wajib menerapkan Cara Pembuatan Obat yang Baik (CPOB) dalam seluruh aspek dan rangkaian kegiatan produksi. Dalam hal ini sangat diperlukan Apoteker profesional, yaitu Apoteker yang mempunyai Ilmu pengetahuan dan keahlian tinggi serta mempunyai wawasan luas.
Dalam pelaksanaan Praktek Kerja Profesi di industri farmasi, Fakultas Farmasi USU menjalin kerjasama dengan PT. Mutiara Mukti Farma (MUTIFA).
1.2 Tujuan
1. Mengetahui dan memahami tugas, fungsi dan tanggung jawab apoteker di Industri Farmasi.
2. Membekali calon apoteker agar memiliki wawasan, pengetahuan, keterampilan dan pengalaman praktis untuk melakukan pekerjaan kefarmasian, serta memahami penerapan CPOB di Industri Farmasi.
3. Mengetahui gambaran tentang situasi dan kondisi kerja di Industri Farmasi 4. Memberi kesempatan kepada calon apoteker untuk melihat dan mempelajari
strategi dan pengembangan industri farmasi
5. Mempersiapkan calon apoteker dalam memasuki dunia kerja
1.3 Manfaat
Adapun manfaat Praktek Kerja Profesi Apoteker di Industri Farmasi adalah:
1. Mengetahui, memahami tugas dan tanggung jawab apoteker dalam menjalankan pekerjaan kefarmasian di industri farmasi.
2. Mendapatkan pengalaman praktis mengenai pekerjaan kefarmasian di industri farmasi.
3. Meningkatkan rasa percaya diri untuk menjadi apoteker yang profesional di industri.
1.4 Tempat dan Waktu
BAB II
TINJAUAN UMUM
2.1 Industri Farmasi
Industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri farmasi sebagai industri penghasil obat, dituntut untuk dapat menghasilkan obat yang memenuhi persyaratan khasiat, keamanan dan mutu dalam dosis yang digunakan untuk tujuan pengobatan. Karena menyangkut soal nyawa manusia, industri farmasi dan produknya diatur secara ketat. Industri farmasi di Indonesia diberlakukan persyaratan yang diatur dalam CPOB (Manajemen Industri Farmasi, 2007).
Perusahaan industri farmasi wajib memperoleh izin usaha industri farmasi. Menurut Keputusan Menteri Kesehatan No.245/Menkes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin Usaha Industri Farmasi, untuk memperoleh izin usaha farmasi diperlukan tahap persetujuan prinsip. Persetujuan prinsip diberikan kepada pemohon untuk dapat langsung melakukan persiapan-persiapan, usaha pembangunan, pengadaan pemasangan instalasi, dan produksi percobaan. Izin usaha industri farmasi diberikan kepada pemohon yang telah siap berproduksi sesuai persyaratan CPOB.
sebagai penangung jawab mutu. Industri farmasi yang telah memenuhi persyaratan CPOB diberikan sertifikat CPOB.
2.2 CPOB
Cara Pembuatan Obat yang Baik (CPOB) bertujuan untuk menjamin obat yang dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. Pada pembuatan obat, pengendalian menyeluruh sangat esensial untuk menjamin konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembarangan tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa, memulihkan kesehatan atau memelihara kesehatan.
Tidaklah cukup bila produk jadi hanya sekedar lulus dari serangkaian pengujian tetapi yang lebih penting, mutu harus dibentuk ke dalam produk tersebut. Mutu obat bergantung pada bahan awal, bahan pengemas, proses produksi dan pengendalian mutu, bangunan, peralatan yang dipakai, dan personil yang terlibat (CPOB, 2006).
Ada dua belas aspek dalam CPOB 2006 yaitu: 2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar tercapai tujuan CPOB dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Untuk mencapai tujuan tersebut maka diperlukan manajemen mutu. Unsur dasar manajemen mutu adalah:
• Infrastruktur atau sistem mutu yang tepat, mencakup struktur organisasi,
• Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan
tingkat kepercayaan tinggi, sehingga produk yang dihasilkan akan selalu memenuhi persyaratan yang ditetapkan (CPOB, 2006).
Dari unsur diatas, sistem manajemen mutu di industri farmasi mencakup antara lain:
• Struktur organisasi mutu, termasuk kewenangan pemastian mutu dan
pengawasan mutu
• Pengendalian perubahan
• Sistem pelulusan batch
• Penanganan penyimpangan
• Pengolahan ulang
• Inspeksi diri dan audit eksternal
• Pelaksanaan program kualifikasi dan validasi
• Personalia
• Sistem dokumentasi
(Manajemen Farmasi Industri, 2007)
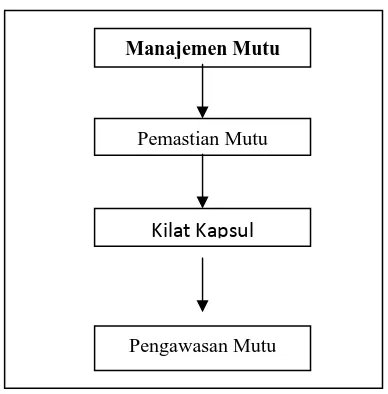
Aspek yang saling berkaitan membangun manajemen mutu terdiri dari pemastian mutu, CPOB, pengawasan mutu, dan pengkajian mutu produk. Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan tujuan untuk memastikan bahwa obat yang dihasilkan memenuhi persyaratan mutu dan tujuan pemakaiannya.
dengan tujuan penggunaan dan dipersyaratkan dalam izin edar serta spesifikasi produk. CPOB mencakup produksi dan pengawasan mutu.
Pengawasan mutu adalah bagian dari CPOB yang berhubungan dengan:
• Pengambilan sampel
• Spesifikasi dan pengujian
• Organisasi, dokumentasi dan prosedur pelulusan yang memastikan bahwa
pengujian yang diperlukan dan relevan telah dilakukan sehingga bahan yang belum diluluskan tidak digunakan serta produk yang belum diluluskan tidak dijual sebelum mutunya dinilai memenuhi syarat.
Setiap industri farmasi hendaklah mempunyai fungsi pengawasan mutu. Fungsi ini hendaklah independen dari bagian lain. Personil pengawasan mutu hendaklah memiliki akses ke area produksi untuk melakukan pengambilan sampel dan investigasi bila diperlukan.
Pengkajian mutu produk secara berkala hendaklah dilakukan terhadap semua obat terdaftar dengan tujuan untuk membuktikan konsistensi proses, kesesuaian dari spesifikasi bahan awal, bahan pengemas dan obat jadi. Pengkajian mutu produk secara berkala biasanya dilakukan tiap tahun, dengan mempertimbangkan hasil kajian ulang sebelumnya.
Pengawasan Mutu
Gambar 1. Bagan Aspek yang Saling Berkaitan Membangun Manajemen Mutu
Kilat Kapsul Manajemen Mutu
Pemastian Mutu
2.2.2 Personalia
Industri farmasi hendaklah memiliki personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai. Tiap personil tidak dibebani tanggung jawab yang berlebihan untuk menghindari resiko terhadap mutu obat. Industri farmasi harus memiliki struktur organisasi. Tugas spesifik dan kewenangan dari personil pada posisi penanggungjawab hendaklah dicantumkan dalam uraian tugas tertulis.
Personil kunci mencakup kepala bagian produksi, kepala bagian pengawasan dan kepala bagian pemastian mutu. Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, pengawasan mutu, dan pemastian mutu dipimpin oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain.
sehingga memungkinkan untuk melaksanakan tugas secara profesional. Sedangkan kepala bagian pengawasan mutu hendaklah seorang terkualifikasi dan lebih diutamakan seorang apoteker.
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang bertugas di area produksi, gudang penyimpanan dan laboratorium (termasuk personil teknik, perawatan dan petugas kebersihan). Di samping pelatihan dasar dalam teori dan praktek CPOB, personil baru hendaklah mendapatkan pelatihan sesuai dengan tugas yang diberikan. Pelatihan berkesinambungan hendaklah diberikan dan efektifitas penerapannya, dinilai secara berkala. Hendaklah tersedia program pelatihan yang disetujui kepala bagian masing-masing. Catatan pelatihan hendaklah disimpan (CPOB, 2006).
2.2.3 Bangunan dan Fasilitas
Desain dan tata letak ruang hendaklah memastikan:
• Kompatibilitas dengan kegiatan produksi lain yang mungkin dilakukan di
dalam sarana yang sama atau sarana yang berdampingan.
• Pencegahan area produksi, area penyimpanan dan area pengawasan mutu
dimanfaatkan sebagai jalur lalu lintas umum bagi personil yang tidak berkepentingan.
Area yang menjadi perhatian utama dalam aspek bangunan dan fasilitas adalah:
• Area penimbangan
• Area produksi
Untuk memperkecil resiko bahaya medis yang serius akibat terjadinya pencemaran silang, produk antibiotik tertentu (penisilin), produk hormon seks, produk sitostatik, produk biologi hendaklah diproduksi di bangunan terpisah.
Tata ruang produksi sebaiknya dirancang sedemikian rupa sehingga kegiatan produksi dilakukan di area yang saling berhubungan antara satu ruangan dengan ruangan yang lain mengikuti urutan tahap produksi dan menurut kelas kebersihan yang dipersyaratkan, mencegah kesesakan dan ketidakteraturan, dan memungkinkan terlaksananya komunikasi dan pengawasan yang efektif.
Permukaan dinding, lantai dan langit-langit bagian dalam ruangan di mana terdapat bahan baku dan bahan pengemasan primer, produk antara atau produk ruahan, hendaklah halus, bebas retak, tidak melepaskan partikulat serta mudah dibersihkan. Konstruksi lantai di area pengolahan hendaklah dibuat dari bahan kedap air, permukaannya rata dan memungkinkan pembersihan yang cepat dan efisien apabila terjadi tumpahan bahan. Sudut antara dinding dan lantai di area pengolahan hendaklah berbentuk lengkungan.
• Area penyimpanan
Area penyimpanan hendaklah memiliki kapasitas yang memadai untuk menyimpan dengan rapi dan teratur berbagai macam bahan dan produk seperti bahan awal dan bahan pengemas, produk antara, produk ruahan dan produk jadi, produk dalam status karantina, produk yang telah diluluskan, produk yang ditolak, produk yang dikembalikan atau produk yang ditarik dari peredaran.
Area penyimpanan hendaklah didesain untuk menjamin penyimpanan yang baik, terutama area tersebut hendaklah bersih, kering dan mendapat penerangan yang cukup serta dipelihara dalam batas suhu yang ditetapkan. Obat narkotik dan berbahaya lain hendaklah disimpan di tempat terkunci.
• Area pengawasan mutu
Laboratorium pengawasan mutu hendaklah terpisah dari area produksi. Luas ruang hendaklah memadai untuk mencegah campur baur. Hendaklah disediakan tempat penyimpanan yang luas dan memadai untuk sampel, baku pembanding, pelarut, pereaksi dan catatan. Suatu ruangan terpisah mungkin diperlukan untuk memberi perlindungan terhadap instrumen.
• Sarana pendukung
letaknya terpisah. Sedapat mungkin letak bengkel perbaikan dan perawatan peralatan terpisah dari area produksi (CPOB, 2006).
2.2.4 Peralatan
Desain dan kontruksi peralatan hendaklah memenuhi persyaratan sebagai berikut:
• Peralatan hendaklah didesain dan dikontruksikan sesuai dengan tujuannya.
• Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara,
produk jadi tidak boleh menimbulkan reaksi yang dapat menimbulkan identitas, mutu atau kemurnian di luar batas yang ditentukan.
• Bahan yang diperlukan untuk pengoperasian alat khusus, misalnya
pelumas atau pendingin tidak boleh bersentuhan dengan bahan yang sedang diolah sehingga tidak mempengaruhi identitas, mutu atau kemurnian bahan awal, produk antara ataupun produk jadi.
• Peralatan hendaklah didesain sedemikian rupa agar mudah dibersihkan.
Peralatan tersebut hendaklah dibersihkan sesuai prosedur tertulis yang rinci serta disimpan dalam keadaan bersih dan kering.
2.2.5 Sanitasi dan Higiene
Prosedur higiene perorangan termasuk persyaratan untuk mengenakan pakaian pelindung hendaklah diberlakukan bagi semua personil yang memasuki area produksi. Untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan personil, hendaklah personil mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya termasuk penutup rambut. Personil diinstruksikan supaya menggunakan sarana mencuci tangan dan mencuci tangannya sebelum memasuki area produksi. Untuk tujuan itu perlu dipasang poster yang sesuai.
Bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik. Hendaklah tersedia dalam jumlah yang cukup sarana toilet dengan ventilasi yang baik dan tempat cuci bagi personil yang letaknya mudah diakses dari area pembuatan. Hendaknya disediakan sarana yang memadai untuk penyimpanan pakaian personil dan milik pribadinya di tempat yang tepat.
Setelah digunakan, peralatan hendaklah dibersihkan baik bagian luar maupun bagian dalam sesuai dengan prosedur yang telah ditetapkan, serta dijaga dan disimpan dalam kondisi yang bersih. Tiap kali sebelum dipakai, kebersihannya diperiksa untuk memastikan bahwa semua produk atau bahan dari batch sebelumnya telah dihilangkan (CPOB, 2006).
2.2.6 Produksi
pengemasan dan distribusi hendaklah dilakukan sesuai dengan prosedur atau instruksi tertulis dan bila perlu dicatat.
Seluruh bahan yang diterima hendaklah diperiksa untuk memastikan kesesuiannya dengan pemesanan. Bahan awal yang diterima, produk antara, produk ruahan, produk jadi hendaklah dikarantina segera setelah diterima atau diolah, sampai dinyatakan lulus untuk pemakaian dan distribusi.
Pengolahan produk yang berbeda hendaklah tidak dilakukan secara bersamaan pada ruang kerja yang sama. Selama pengolahan, semua bahan, wadah, produk ruahan, peralatan atau mesin produksi, ruang kerja yang dipakai hendaklah diberi label atau penandaan dari produk atau bahan yang sedang diolah, kekuatan dan nomor batch.
Hal-hal yang perlu diperhatikan dalam produksi adalah:
• Pengadaan bahan awal
Semua penerimaan, pengeluaran dan jumlah bahan tersisa hendaklah dicatat. Catatan hendaklah berisi keterangan mengenai pasokan, nomor batch/lot, tanggal penerimaan, tanggal pelulusan, dan tanggal daluarsa.
• Pencegahan pencemaran silang
Tiap tahap proses, produk dan bahan hendaklah dilindungi terhadap pencemaran mikroba dan pencemaran lain. Resiko pencemaran silang ini dapat timbul akibat tidak terkendalinya debu, uap, percikan atau organisme dari bahan atau produk yang sedang diproses, dari sisa yang tertinggal pada alat dan pakaian kerja operator.
Pencemaran silang hendaklah dihindari dengan tindakan teknis atau pengaturan yang tepat, antara lain:
a. Produksi di dalam gedung yang terpisah diperlukan untuk produk seperti penisilin, hormon seks, sitostatik, dan produk biologi.
b. Tersedia ruang penyangga udara dan penghisap udara.
c. Memakai pakaian pelindung yang sesuai di area di mana produk yang beresiko tinggi terhadap pencemaran silang diproses.
d. Melaksanakan prosedur pembersihan dan dekontaminasi yang terbukti efektif.
• Penimbangan dan penyerahan
Kapasitas, ketelitian dan ketepatan alat timbang yang dipakai hendaklah sesuai dengan jumlah bahan yang ditimbang. Untuk tiap penimbangan hendaklah dilakukan pembuktian kebenaran identitas, jumlah bahan yang ditimbang oleh dua personil yang independen dan pembuktian tersebut dicatat.
Bahan awal, produk antara dan produk ruahan yang diserahkan hendaklah diperiksa ulang kebenarannya dan ditandatangani oleh supervisor produksi sebelum dikirim ke bagian produksi.
• Pengembalian
Semua bahan awal dan bahan pengemas yang dikembalikan ke gudang penyimpanan hendaklah didokumentasikan dengan benar.
• Pengolahan
Semua bahan yang dipakai di dalam pengolahan hendaklah diperiksa sebelum dipakai. Semua peralatan yang dipakai dalam pengolahan hendaklah diperiksa sebelum digunakan. Peralatan hendaklah dinyatakan bersih secara tertulis sebelum digunakan. Semua kegiatan pengolahan hendaklah dilaksanakan mengikusi prosedur yang tertulis. Tiap penyimpangan hendaklah dilaporkan. Semua produk antara hendaklah diberi label yang benar dan dikarantina sampai diluluskan oleh bagian pengawasan mutu.
dalam dokumen produksi induk, dan dipantau selama proses berlangsung serta dicatat dalam catatan batch. Tablet yang diambil dalam ruang pencetak tablet untuk keperluan pengujian tidak boleh dikembalikan lagi ke dalam batch yang bersangkutan.
• Kegiatan pengemasan
Kegiatan pengemasan berfungsi mengemas produk ruahan menjadi produk jadi. Pengemasan hendaklah dilaksanakan di bawah pengendalian yang ketat untuk menjaga identitas, keutuhan dan mutu produk akhir yang dikemas. Semua kegiatan pengemasan hendaklah dilaksanakan sesuai dengan instruksi yang diberikan dan menggunakan bahan pengemas yang tercantum dalam prosedur pengemasan induk. Rincian pelaksanaan pengemasan hendaklah dicatat dalam catatan pengemasan batch.
• Pengawasan selama proses
Pengawasan selama proses hendaklah mencakup :
a. Semua parameter produk, volume atau jumlah isi produk diperiksa pada saat awal dan selama proses pengolahan atau pengemasan
b. Kemasan akhir diperiksa selama proses pengemasan dengan selang waktu yang teratur untuk memastikan kesesuaiannya dengan spesifikasi dan memastikan semua komponen sesuai dengan yang ditetapkan dalam prosedur pengemasan induk.
• Karantina produk jadi
diluluskan untuk diserahkan ke gudang, pengawasan yang ketat hendaklah dilaksanakan untuk memastikan produk dan catatan pengolahan batch memenuhi semua spesifikasi yang ditentukan.
Selama menunggu pelulusan dari bagian pemastian mutu, seluruh batch/lot yang sudah dikemas hendaklah ditahan dalam status karantina.
Pelulusan akhir produk hendaklah didahului penyelesaian yang memuaskan dari:
a. Produk memenuhi persyaratan mutu dalam semua spesifikasi pengolahan dan pengemasan.
b. Sampel pertinggal dari kemasan yang dipasarkan dalam jumlah yang mencukupi untuk pengujian di masa yang akan datang. c. Pengemasan dan penandaan memenuhi semua persyaratan
sesuai hasil pemeriksaan oleh bagian pengawasan mutu.
d. Produk jadi yang diterima di area karantina sesuai dengan jumlah yang tertera pada dokumen penyerahan barang (CPOB, 2006).
2.2.7 Pengawasan Mutu
Pengawasan mutu hendaklah mencakup semua kegiatan analitis di laboratorium, antara lain:
• Pengambilan sampel.
• Pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan, dan
produk jadi.
• Pengujian yang dilakukan dalam rangka validasi.
• Penanganan sampel pertinggal.
• Menyusun dan memperbaharui spesifikasi bahan dan produk serta metode
pengujiannya.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan. Personil pengawasan mutu hendaklah memiliki akses ke area produksi untuk pengambilan sampel (CPOB, 2006).
2.2.8 Inspeksi Diri dan Audit Mutu
Inspeksi diri adalah cara meninjau kembali seluruh tata kerja diri sendiri dari setiap segi yang mungkin berpengaruh terhadap produk. Tujuan inspeksi diri adalah untuk mengevalusai apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan.
auditor dari luar yang independen. Inspeksi diri hendaklah dilakukan secara rutin minimal satu kali setahun, dan di samping itu pada situasi khusus, misalnya terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan. Prosedur dan catatan inspeksi diri hendaknya didokumentasikan dan dibuat program tindak lanjut yang efektif.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pelaksanaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
Kepala bagian pemastian mutu hendaklah bertanggung jawab bersama dengan bagian terkait untuk memberi persetujuan pemasok yang dapat diandalkan memasok bahan awal dan bahan pengemas dan memenuhi spesifikasi yang telah ditentukan. Hendaklah dilakukan evaluasi sebelum pemasok disetujui dan dimasukkan ke dalam daftar pemasok atau spesifikasi. Evaluasi hendaklah mempertimbangkan riwayat pemasok dan sifat bahan yang dipasok (CPOB, 2006).
2.2.9 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
sistem, bila perlu mencakup penarikan kembali produk yang diketahui cacat dari peredaran secara cepat dan efektif.
Laporan dan keluhan mengenai produk dapat disebabkan oleh:
• Keluhan mengenai mutu dan berupa kerusakan fisik, kimiawi atau biologis
dari produk atau kemasannya.
• Keluhan atau laporan karena reaksi yang merugikan seperti alergi,
toksisitas, reaksi fatal atau reaksi hampir fatal dan reaksi medis lain.
• Keluhan atau laporan mengenai efek terapetik produk seperti produk tidak
berkhasiat atau respon klinis yang rendah.
Hendaklah tersedia prosedur tertulis yang merinci penyelidikan, evaluasi, tindak lanjut yang sesuai, termasuk pertimbangan untuk penarikan kembali produk, dalam menanggapi keluhan terhadap obat yang diduga cacat. Tiap laporan dan keluhan hendaklah diselidiki dan dievaluasi secara menyeluruh dan mendalam mencakup:
• Pengkajian seluruh informasi mengenai laporan atau keluhan.
• Inspeksi atau pengujian sampel obat yang dikeluhkan dan diterima serta,
bila perlu pengujian sampel dari batch yang sama.
• Pengkajian semua data dan dokumentasi termasuk catatan batch, catatan
distribusi dan laporan pengujian dari produk yang akan dikeluhkan atau dilaporkan.
kesehatan. Penarikan kembali produk dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut.
Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke industri farmasi karena keluhan mengenai kerusakan, daluarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang dapat menimbulkan keraguan akan identitas, mutu, jumlah dan keamanan obat yang bersangkutan.
Industri farmasi hendaklah menyiapkan prosedur untuk penahanan, penyelidikan dan pengujian produk kembalian serta pengambilan keputusan apakah produk kembalian dapat diproses ulang atau harus dimusnakan setelah dilakukan evaluasi. Produk kembalian dapat dikategorikan sebagai berikut:
• Produk kembalian yang masih memenuhi spesifikasi dan karena itu dapat
dikembalikan ke dalam persediaan.
• Produk kembalian yang dapat diproses ulang.
• Produk kembalian yang tidak memenuhi spesifikasi dan tidak dapat
diproses ulang.
Produk kembalian yang tidak dapat diolah ulang hendaklah dimusnahkan. Bila produk harus dimusnakan, dokumentasi hendaklah mencakup berita acara pemusnahan yang diberi tanggal dan ditandatangani oleh personil yang melaksanakan dan personil yang menyaksikan pemusnahan (CPOB, 2006).
2.2.10 Dokumentasi
memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul karena mengandalakan komunikasi lisan.
Dokumen yang diperlukan dalam industri farmasi, antara lain: a. Spesifikasi
Hendaklah tersedia spesifikasi bahan awal, bahan pengemas, produk antara dan ruahan, serta produk jadi.
b. Dokumen produksi
Dokumen yang esensial dalam produksi adalah:
• Dokumen produksi induk yang berisi formula produksi dari suatu produk
dalam bentuk sediaan dan kekuatan tertentu.
• Prosedur produksi induk, terdiri dari prosedur pengolahan induk dan
prosedur pengemasan induk.
• Catatan produksi batch, terdiri dari catatan pengolahan batch dan catatan
pengemasan batch, yang merupakan reproduksi dari masing-masing prosedur pengolahan induk dan prosedur pengemasan induk, dan berisi semua data dan informasi yang berkaitan dengan pelaksanaan produksi dari suatu batch produk (CPOB, 2006).
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
menyatakan secara jelas prosedur pelulusan tiap batch produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian pemastian mutu.
Pemberi kontrak bertanggung jawab untuk menilai kompetensi penerima kontrak dalam melaksanakan pekerjaan atau pengujian yang diperlukan dan memastikan bahwa prinsip dan pedoman CPOB diikuti. Pemberi kontrak hendaklah menyediakan semua informasi yang diperlukan kepada penerima kontrak untuk melaksanakan pekerjaan kontrak secara benar sesuai izin edar dan persyaratan legal lain. Pemberi kontrak hendaklah memastikan bahwa penerima kontrak memahami sepenuhnya masalah yang berkaitan dengan produk atau pekerjaan atau pengujian yang dapat membahayakan gedung, peralatan, personil, bahan atau produk lain.
Penerima kontrak harus mempunyai gedung dan peralatan yang cukup, pengetahuan dan pengalaman, dan personil yang kompeten untuk melakukan pekerjaan yang diberikan oleh pemberi kontrak dengan memuaskan. Pembuatan obat berdasarkan kontrak hanya dapat dilakukan oleh industri farmasi yang memiliki sertifikat CPOB yang diterbitkan oleh Otoritas Pengawasan Obat (OPO) (CPOB, 2006).
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi.
digunakan dalam produksi maupun pengawasan mutu akan senantiasa mencapai hasil yang diinginkan (CPOB, 2006). Langkah-langkah pelaksanaan validasi adalah sebagai berikut:
• Membentuk komite validasi yang bertanggung jawab terhadap
pelaksanaan validasi di industri farmasi yang bersangkutan.
• Menyusun Rencana Induk Validasi (RIV), yaitu dokumen yang
menguraikan secara garis besar pedoman pelaksanaan validasi.
• Membuat dokumen validasi, yaitu prosedur tetap (protap), protokol serta
laporan validasi
• Pelaksanaan validasi
• Melaksanakan peninjauan periodik, change control dan revalidasi
(Manajemen Industri Farmasi, 2007).
Validasi untuk mesin, peralatan produksi dan sarana penunjang disebut kualifikasi. Kualifikasi tersebut adalah langkah pertama dalam melaksanakan validasi di industri farmasi (Manajemen Industri Farmasi, 2007). Kualifikasi terdiri dari empat tingkatan, yaitu:
a. Kualifikasi Desain/ Design Qualification (DQ)
Kualifikasi desain adalah unsur pertama dalam melakukan validasi terhadap fasilitas, sistem atau peralatan baru.
b. Kualifikasi Instalasi/ Instalation Qualification (IQ)
Kualifikasi hendaklah dilakukan terhadap fasilitas, sistem dan peralatan baru atau yang dimodifikasi, mencakup:
• Instalasi peralatan, pipa dan sarana penunjang hendaklah sesuai dengan
• Pengumpulan dan penyusunan dokumen pengoperasian dan perawatan
peralatan dari pemasok.
• Ketentuan dan persyaratan kalibrasi.
• Verifikasi bahan konstruksi
c. Kualifikasi Operasional/ Operational Qualification (OQ)
Kualifikasi operasional hendaklah dilakukan setelah kualifikasi instalasi selesai dilaksanakan, dikaji dan disetujui. Kualifikasi operasional hendaklah mencakup:
• Kalibrasi
• Prosedur pengoperasian dan pembersihan
• Pelatihan operator dan ketentuan perawatan preventif.
d. Kualifikasi Kinerja/ Performance Qualification (PQ)
Kualifikasi kinerja hendaklah dilakukan setelah kualifikasi operasional selesai dilaksanakan, dikaji dan disetujui. Kualifikasi kinerja hendaklah mencakup:
• Pengujian dengan menggunakan bahan baku, bahan pengganti yang
memenuhi spesifikasi atau produk simulasi.
• Uji meliputi satu atau beberapa kondisi yang mencakup batas operasional
atas dan bawah (CPOB, 2006).
Jenis-jenis validasi adalah sebagai berikut:
a. Kualifikasi mesin, peralatan produksi dan sarana penunjang b. Validasi metode analisa
pengawasan mutu, senantiasa mencapai hasil yang diinginkan secara konsisten.
c. Validasi proses produksi
Tujuan validasi produksi adalah :
• Memberikan dokumentasi secara tertulis bahwa prosedur produksi yang
berlaku dan digunakan dalam proses produksi rutin, senantiasa mencapai hasil yang diinginkan secara terus-menerus.
• Mengidentifikasi dan mengurangi problem yang terjadi selama proses
produksi dan memperkecil kemungkinan terjadinya proses ulang.
• Meningkatkan efektifitas dan efisiensi proses produksi.
d. Validasi proses pengemasan
Tujuan validasi proses pengemasan adalah:
• Memberikan dokumentasi secara tertulis bahwa prosedur pengemasan
yang berlaku dan digunakan dalam proses pengemasan rutin, senantiasa mencapai persyaratan yang ditentukan.
• Operator/pelaksana yang melakukan proses pengemasan kompeten serta
mengikuti prosedur pengemasan yang telah ditentukan.
• Proses pengemasan yang dilakukan tidak terjadi peristiwa campur baur
antar produk maupun batch. e. Validasi pembersihan
Tujuan validasi pembersihan adalah:
• Memberikan dokumentasi secara tertulis bahwa prosedur
• Peralatan/mesin yang dibersihkan tidak terdapat pengaruh yang
negatif karena efek pembersihan.
• Operator/pelaksana yang melakukan pembersihan kompeten,
mengikuti prosedur pembersihan dan peralatan pembersihan yang telah ditentukan.
• Cara pembersihan menghasilkan tingkat kebersihan yang sudah
BAB III
TINJAUAN KHUSUS
PT. MUTIFA (MUTIARA MUKTI FARMA) MEDAN
3.1 Sejarah
Pada tahun 1975 didirikan Industri Farmasi di kota Medan dengan nama “Sejati Pharmaceutical Industries”, yang memproduksi obat merek “SIAGOGO”. Setelah beberapa tahun berproduksi, perusahaan ini kemudian dialihkan pemiliknya kepada Bapak Drs. W. H. Siahaan dan memindahnamakan perusahaan tersebut dalam suatu akte notaris tertanggal 31 Januari 1980 dengan nama PT. Mutiara Mukti Farma (MUTIFA) yang berlokasi di Jl. Brigjen Katamso No. 220 Medan.
Berdasarkan Surat Keputusan Menteri Kesehatan RI tahun 1981 No. 0098/SK/PAB/81 memutuskan memberikan izin untuk mendirikan pabrik farmasi kepada PT. Mutiara Mukti Farma (MUTIFA) dengan nama “MUTIFA INDUSTRI FARMASI” untuk memproduksi obat-obatan. Dengan dikeluarkannya surat izin produksi oleh Departemen Kesehatan RI c/q Badan Pengawasan Obat dan Makanan No. 213/AA/III/81, mulailah PT Mutiara Mukti Farma memproduksi obat-obatan.
Pada tanggal 29 November 1988, dengan akte notaris No. 35 diadakanlah perubahan akte atas pemegang saham serta manajemen perusahaan, yang ditetapkan melalui keputusan Menteri Kehakiman RI No. C2-1134.HT.01.04 th 89 tanggal 31 Januari 1989. Dalam akte tersebut, berdasarkan keputusan rapat Dewan Komisaris serta pemegang saham, ditetapkan bahwa yang menjadi penanggung jawab dengan jabatan Direktur Utama adalah Bapak Jacob.
Sesuai dengan Keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988 tentang Pedoman Cara Pembuatan Obat yang Baik (CPOB), bahwa setiap industri farmasi harus mengacu pada pedoman tersebut, maka untuk memenuhi ketentuan tersebut PT. MUTIFA telah membangun pabrik yang baru di Jl. Karya Jaya No. 68 Km 8,5 Namorambe. Pada bulan Mei 1994 produksi telah dilaksanakan di pabrik yang baru dan pada saat ini kegiatan administrasi juga telah dilakukan di lokasi tersebut. Pada tanggal 27 Juli 1994 PT. MUTIFA diberikan sertifikat sebagai industri farmasi yang telah memenuhi CPOB.
3.2 Lokasi dan Sarana Produksi 3.2.1 Lokasi
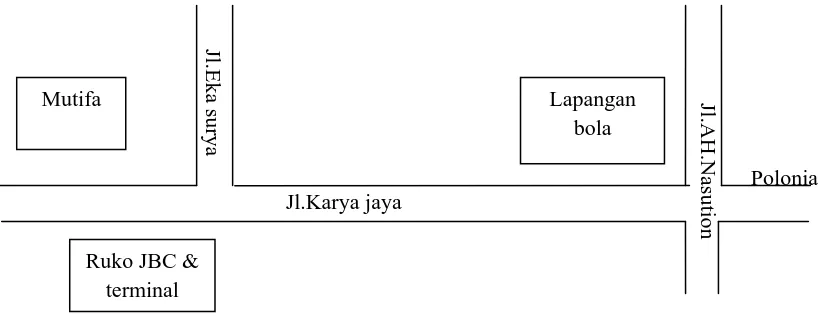
PT. MUTIFA Medan berada di Jl. Karya Jaya No. 68 Km 8,5 Namorambe Medan. Denah lokasi PT. MUTIFA ditunjukkan pada Gambar 2 berikut ini :
Mutifa
Ruko JBC & terminal
Jl.Eka surya
Jl.Karya jaya
Jl.AH.Na
sution
Lapangan bola
[image:42.595.123.532.204.364.2]Polonia
Gambar 2. Denah Lokasi PT. MUTIFA
Luas areal PT. MUTIFA Medan mempunyai luas areal 9600 m2 dan luas bangunan 6259 m2. Sumber arus listrik berasal dari Perusahaan Listrik Negara (PLN), dan apabila arus listrik dari PLN terputus digunakan generator. Sumber air berasal dari sumur pompa dan air PAM. Untuk keperluan produksi digunakan air sumur yang telah mengalami proses pengolahan. Air PAM digunakan untuk pencucian alat, mandi, dan bila aliran PAM mengalami masalah, untuk menggantikan air PAM digunakan air sumur yang telah mengalami tiga kali penyaringan. Bangunan penunjang lainnya terdiri dari Musholla, kamar mandi, dan pos jaga.
3.2.2 Sarana Produksi
mengangkut bahan baku ke ruang produksi, bahan kemasan ke ruang pengemasan, obat jadi dari ruang karantina ke gudang obat jadi relatif singkat.
Produk beta laktam diproduksi dalam bangunan tersendiri dan terpisah dengan produk non beta laktam. Ruang produksi dirancang sedemikian rupa sehingga diharapkan dapat mencegah terjadinya kontaminasi silang terhadap proses produksi obat serta terlewatnya salah satu langkah dalam proses produksi. Keadaan ruang produksi adalah sebagai berikut :
a. Lantai
Lantai ruang produksi beta laktam dan non beta laktam terbuat dari beton yang dilapisi granit di antaranya diisi dengan semen putih. Sudut ruangan berbentuk lengkung dengan lantai. Lantai mempunyai permukaan yang rata, mudah dibersihkan, tidak menahan partikel, tahan terhadap gesekan, deterjen, desinfektan, dan bahan kimia.
b. Dinding
Dinding ruang terbuat dari beton, yang dilapisi dengan sebagian epoksi dan sebagian acrylic, sehingga permukaan dinding menjadi licin, rata, kedap air, mudah dibersihkan, tahan terhadap bahan kimia, deterjen, desinfektan, tidak menahan partikel, serta tidak menjadi tempat bersarangnya binatang kecil.
c. Langit-langit
d. Pengaturan Udara
Aliran udara yang digunakan dalam ruangan produksi beta laktam dan non beta laktam adalah Air Handling System (AHS). Supply udara yang akan disalurkan ke dalam ruang produksi berasal dari 2 sumber, yaitu berasal dari udara yang disirkulasi kembali (sebanyak 80%) dan berasal dari udara bebas (sebanyak 20%). Supply udara tersebut kemudian melewati filter yang terdapat di dalam filter house yang terdiri dari prefilter yang memiliki efisiensi penyaringan sebesar 35% dan medium filter yang memiliki efisiensi penyaringan sebesar 95%. Selanjutnya, supply udara ini melewati cooling coil (evaporator) yang akan menurunkan suhu (T) dan kelembaban relatif (RH) udara. Kemudian udara dipompa dengan menggunakan static pressure fan (blower) ke dalam ruang produksi melalui ducting (saluran udara). Jumlah udara yang masuk ke dalam ruang produksi diatur dengan menggunakan volume dumper. Selanjutnya udara disirkulasi kembali ke AHS. Kecepatan
pertukaran udara dalam ruangan produksi beta laktam maupun non beta laktam 20 kali per jam dan untuk koridor 25 kali per jam.
3.3 Struktur Organisasi
Struktur organisasi PT. MUTIFA merupakan struktur organisasi vertikal. Kekuasaan tertinggi dipegang oleh direktur utama. Direktur utama membawahi delapan departemen. Masing-masing departemen dipimpin oleh seorang manager yang langsung bertanggung jawab penuh kepada direktur utama.
3.3.1 Departemen Produksi
b. Departemen produksi solid non beta laktam c. Departemen produksi cair non beta laktam
Ada pun tugas dan tanggung jawab departemen produksi , yaitu :
• Melaksanakan pembuatan obat mulai dari pengolahan, pengemasan primer
dan sekunder, sampai karantina produk jadi.
• Melaksanakan secara teknis dan administrasi semua tugas selama
pengelolahan dan pengemasan dengan berpedoman pada prosedur tetap (protap) yang ditetapkan.
• Jika ada kegagalan dalam produksi, mendiskusikannya dengan manager
QC dan mencari penyebab serta jalan keluar.
• Bertanggung jawab agar alat atau mesin untuk keperluan produksi
dikualifikasi atau divalidasi serta dipakai dengan benar.
• Turut membantu pelaksanaan inspeksi CPOB dan menjaga pelaksanaan
serta pematuhan terhadap peraturan CPOB.
• Memelihara kebersihan daerah produksi.
Bagian-bagian produksi PT. MUTIFA terdiri atas: a. Unit tablet
b. Unit kapsul
Mesin-mesin yang digunakan pada produksi kapsul adalah mesin mixer, FBD, mesin pengisi kapsul, mesin kilap kapsul, mesin strip dan mesin blister. Pada produksi kapsul perlu diperhatikan kondisi ruangan yaitu temperatur dan kelembaban. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, kadar zat berkhasiat, waktu hancur, disolusi, dan LOD.
c. Unit liquida
Unit liquida memproduksi sediaan bentuk cair seperti suspensi, emulsi dan sirup. Unit ini dilengkapi dengan mesin mixer dan mesin pengisi obat ke dalam wadah (automatic), dan mesin alucap manual. Hal-hal yang diperiksa selama produksi adalah pH larutan, berat jenis (BJ) larutan, keseragaman volume, viskositas larutan, kadar zat berkhasiat, dan kebocoran wadah.
d. Unit salep
Mesin-mesin yang digunakan pada produksi salep antara lain mesin mixer dan mesin pengisi salep ke dalam wadah. Hal-hal yang diperiksa selama produksi adalah keseragaman bobot, kadar zat berkhasiat dan homogenitas.
3.3.2 Departemen Pemastian Mutu/Quality Assurance (QA)
Departemen QA bertanggung jawab dalam menjamin mutu suatu produk mulai dari pemesanan bahan baku dan kemasan obat sampai obat siap dikonsumsi konsumen, termasuk di dalamnya pemilihan pemasok. Sistem mutu ditetapkan berdasarkan CPOB.
Tugas-tugas bagian pemastian mutu mencakup:
b. Semua langkah produksi dan pengendalian diuraikan secara jelas dan CPOB diterapkan.
c. Tanggung jawab manajerial diuraikan dengan jelas dalam uraian jabatan. d. Pengaturan disiapkan untuk pembuatan pasokan dan penggunaan bahan
awal dan pengemas yang benar. e. Validasi yang perlu dilakukan.
f. Pengkajian terhadap semua dokumen yang terkait dengan proses pengemasan dan pengujian batch, dilakukan sebelum memberikan pengesahan pelulusan untuk distribusi. Penilaian hendaklah meliputi semua faktor yang relevan termasuk kondisi pembuatan, hasil pengujian atau pengawasan selama proses, pengkajian dokumen produksi termasuk pengemasan, pengkajian penyimpangan dari prosedur yang telah ditetapkan, pemenuhan persyaratan dari spesifikasi produk jadi dan pemeriksaan produk dalam kemasan akhir.
g. Obat tidak dijual atau dipasok sebelum manager pemastian mutu menyatakan bahwa tiap batch produksi dibuat dan dikendalikan sesuai dengan persyaratan yang tercantum dalam izin edar serta peraturan lain yang berkaitan dengan aspek produksi, pengawasan mutu dan pelulusan produk.
h. Tersedia pengaturan yang memadai untuk memastikan bahwa sedapat mungkin produk disimpan, didistribusikan dan selanjutnya ditangani sedemikian rupa agar mutu tetap dijaga selama masa edar /simpan obat. i. Tersedia prosedur inspeksi diri atau audit mutu yang secara berkala
j. Pemasok bahan awal dan pengemas dievaluasi dan disetujui untuk memenuhi spesifikasi mutu yang telah ditentukan oleh perusahaan.
k. Penyimpangan dilaporkan, diselidiki dan dicatat.
l. Tersedia sistem persetujuan terhadap perubahan yang berdampak pada mutu produksi.
m. Prosedur pengolahan ulang dievaluasi dan disetujui.
n. Evaluasi mutu produk berkala dilakukan untuk verifikasi konsistensi proses dan memastikan perbaikan proses yang berkesinambungan.
3.3.3 Departemen Pengawasan Mutu/Quality Control (QC)
Departemen QC di PT. MUTIFA terdiri dari tiga bagian, yaitu: a. Unit QC
b. Bagian Registrasi c. Bagian Standarisasi
Unit QC di PT. MUTIFA bertanggung jawab untuk memastikan bahwa:
• Bahan awal untuk produksi obat memenuhi spesifikasi identitas,
kemurnian, kualitas dan keamanan yang telah ditetapkan.
• Semua pengawasan selama proses (in process controls) dan pemeriksaan
laboratorium terhadap suatu batch obat telah dilaksanakan dan batch tersebut memenuhi spesifikasi.
• Suatu batch obat memenuhi persyaratan mutunya selama waktu peredaran
yang telah ditetapkan.
baku sampai produk jadi. Tujuannnya adalah untuk menentukan kualitas produk yang dihasilkan.
Bagian registrasi juga bekerja sama dengan departemen R&D. Dalam waktu bersamaan dengan trial formulasi skala produksi yang dilakukan oleh departemen R&D, bagian registrasi ini melakukan pendaftaran produk ke Balai POM. Bagian registrasi ini dibantu oleh seorang administrasi desain yang bertugas membuat desain kemasan suatu produk.
3.3.4 Departemen Research and Development (R&D) Adapun tugas dan kegiatan departemen R&D adalah :
• Mengembangkan dan merencanakan formula baru.
• Mengevaluasi dan memperbaiki formula yang sudah beredar kemudian
diinformasikan ke departemen QC dan produksi.
• Bekerja sama dengan unit QC dalam menentukan standarisasi bahan baku,
kemasan dan obat jadi.
• Mengelola perpustakaan.
3.3.5 Departemen Personalia
Departemen personalia di PT. MUTIFA menangani keperluan yang berkaitan dengan ketenagakerjaan dan karyawan, mulai dari perekrutan karyawan, pelatihan sampai pada pelayanan kesejahteraan karyawan.
3.3.6 Departemen Keuangan (Finance)
Departemen keuangan di PT. MUTIFA merencanakan anggaran dan kontrol biaya setelah ramalan penjualan (forecasting) dibuat oleh bagian pemasaran, membayar biaya operasional industri dan mengurus penggajian karyawan.
3.3.7 Departemen Teknik
Adapun tanggung jawab departemen teknik di PT. MUTIFA, yaitu:
• Pemeliharaan alat-alat dan mesin produksi.
• Pemeliharaan fasilitas penunjang di pabrik farmasi, yaitu listrik, AHU dan
water system.
• Pemeliharaan instrumen laboratorium.
• Pemeliharaan instalasi pengelolahan limbah.
3.3.8 Departemen Production Planning and Inventory Control (PPIC)
Departemen PPIC merupakan jembatan komunikasi antara pemasaran, produksi, pengadaan, penyimpanan dan pengembangan produk. Perencanaan produksi harus dilakukan sebaik mungkin dengan mempertimbangkan variabel-variabel yang mempengaruhi sehingga tidak terjadi penimbunan dan kekurangan stok barang. PPIC menyusun rencana dengan menyesuaikan permintaan marketing dengan mempertimbangkan anggaran, persediaan bahan baku, jadwal, kapasitas produksi dan peralatan yang tersedia. Departemen PPIC di PT. MUTIFA dipimpin oleh manager PPIC.
a. Production Planning
Setelah ramalan penjualan (forecasting) dibuat oleh bagian pemasaran (marketing), selanjutnya disusun perencanaan produksi (production planning) dan Rencana Anggaran Belanja Perusahaan (RABP) sebagai acuan untuk memenuhi permintaan bagian pemasaran tersebut. Perencanaan produksi terdiri dari rencana produksi tahunan, yang kemudian dipilah menjadi rencana produksi periodik (semester dan triwulan). Selanjutnya rencana produksi periodik dipilah lagi menjadi rencana produksi bulanan, mingguan dan harian.
Sasaran pokok dari perencanaan produksi antara lain:
• Ketepatan waktu penyelesaian pesanan (permintaan) pelanggan
• Berkurangnya biaya produksi
• New product launching dan menjaga produk-produk lama berjalan teratur
b. Inventory Control
Alasan perlunya persediaan bagi industri, yaitu:
• Antisipasi adanya unsur ketidakpastian permintaan
• Adanya unsur ketidakpastian pasokan dari supplier
• Adanya unsur ketidakpastian tenggang waktu (lead time) waktu
pemesanan
Inventory (persediaan) di industri farmasi, terdiri dari raw material (bahan baku), packaging material (bahan pengemas), finished product (obat jadi), dan work in process (barang setengah jadi). Tujuan diadakannya persediaan antara
lain:
• Untuk memberikan layanan terbaik bagi pelanggan.
• Untuk memperlancar proses produksi.
• Untuk mengantisipasi kemungkinan terjadinya kekurangan persediaan
(stockout).
• Untuk menghadapi fluktuasi harga.
3.4 Limbah
a. Limbah Non Beta Laktam
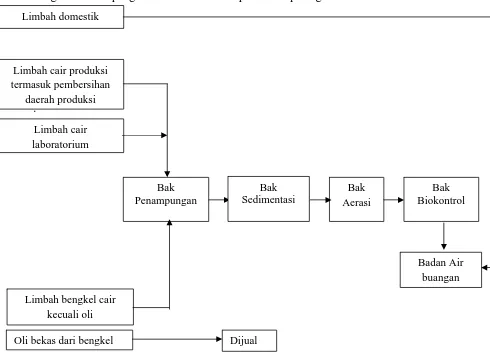
Jenis limbah non beta laktam di PT. MUTIFA ada 3 jenis yaitu: 1. Limbah cair .
Limbah cair ini berasal dari limbah produksi, limbah laboratorium, limbah domestik, dan limbah bengkel
Diagram sistem pengolahan limbah cair dapat dilihat pada gambar 3 berikut ini:
.
Limbah domestik
Limbah cair produksi termasuk pembersihan
daerah produksi
Limbah cair laboratorium
Badan Air buangan Bak
Aerasi
Bak Biokontrol
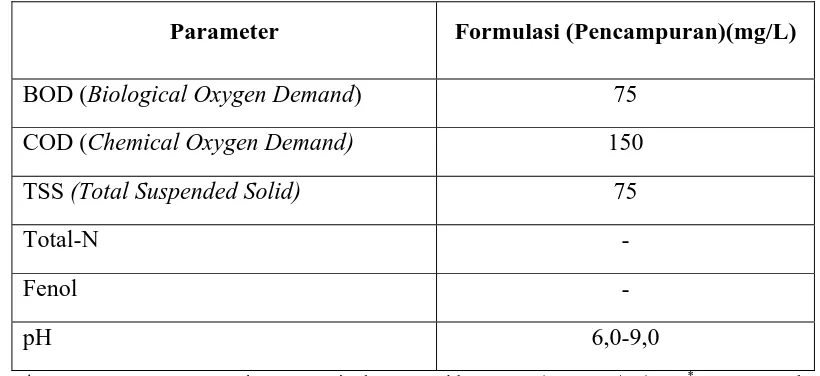
[image:53.595.80.570.245.600.2]Tolak ukur yang dipakai untuk pemantauan limbah cair adalah berdasarkan baku mutu air limbah yang diisyaratkan dalam Surat Keputusan Menteri Negara Lingkungan Hidup No.51/MENLH/10/1995* tentang Baku Mutu Limbah Cair Industri seperti yang terdapat dalam tabel 1.
Gambar 3. Diagram Sistem Pengolahan Limbah Cair di PT.MUTIFA
Oli bekas dari bengkel Dijual
Bak Sedimentasi Bak
Penampungan
Tabel 1. Tolak Ukur Pemantauan Limbah Cair di PT. MUTIFA
Parameter Formulasi (Pencampuran)(mg/L)
BOD (Biological Oxygen Demand) 75
COD (Chemical Oxygen Demand) 150
TSS (Total Suspended Solid) 75
Total-N -
Fenol -
pH 6,0-9,0
* Surat Keputusan Menteri Negara Lingkungan Hidup No.51/MENLH/10/1995* tentang Baku
Mutu Limbah Cair Industri
2. Limbah Padat.
Limbah padat ini berasal dari:
a. Bekas kemasan bahan awal (bahan baku/bahan kemasan) seperti kertas, kotak karton, wadah kayu/plastik/kaca, drum, kaleng.
b. Buangan proses produksi seperti tepung sisa proses, produk antara/ruahan yang rusak atau kotor, kemasan (aluminium foil, botol, dus)
c. Buangan bahan hasil pengujian laboratorium seperti tablet bekas pengujian kekerasan, waktu hancur, dan lain-lain.
d. Bahan awal dan produk jadi yang rusak
e. Wadah bekas bahan produksi (plastik, tong rusak, dan lain-lain). f. Limbah padat domestik.
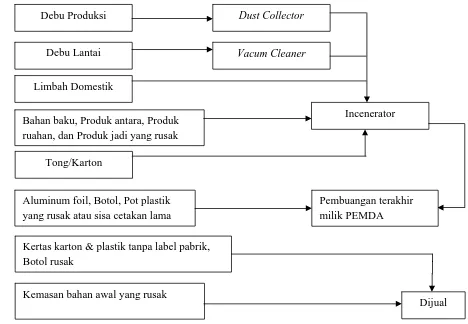
limbah padat yang berserakan di pabrik. Diagram sistem pengolahan limbah padat di PT. MUTIFA adalah sebagai berikut:
Kemasan bahan awal yang rusak Debu Produksi
Debu Lantai
Limbah Domestik
Tong/Karton
Bahan baku, Produk antara, Produk ruahan, dan Produk jadi yang rusak
Aluminum foil, Botol, Pot plastik yang rusak atau sisa cetakan lama
Dust Collector
Vacum Cleaner
Incenerator
Kertas karton & plastik tanpa label pabrik, Botol rusak
Pembuangan terakhir milik PEMDA
[image:55.595.104.572.135.459.2]Dijual
Gambar 4. Diagram Sistem Pengolahan Limbah Padat di PT. MUTIFA 3. Limbah Udara .
Limbah udara ini berasal dari: a. Gas, uap dan asap
- Bahan kimia / reagensia.
- Bahan baku seperti ammonia liquida, alkohol, dan lain-lain. - Proses produksi seperti metilen klorida dari proses coating. - Pembakaran zat padat.
Tolak ukur yang dipakai untuk pamantauan limbah udara adalah kualitas udara di dalam dan di luar lingkungan pabrik, meliputi kadar H2S, NH2, SO2, CO, NO2, TSP. Sistem penanggulangan limbah udara antara lain tertera pada tabel 2.
Tabel 2. Sistem Penanggulangan Limbah Udara di PT. MUTIFA
Jenis Cara Pengendalian
1.Bahan kimia/reagensia laboratorium 2. Asap pembakaran sampah
3. Uap solven 4. Debu Produksi
1. Lemari Asam
2. Incenerator cerobong tinggi 3. Exhaust fan
4. Pemasangan dust collector
4. Limbah Suara.
Limbah suara ini berasal dari mesin produksi, genset, mesin sistem penunjang (AHU, mesin boiler). Cara pengendalian limbah suara ini dapat diatasi dengan menggunakan ear insert oleh pekerja.
Tolak ukur yang digunakan untuk pemantauan limbah suara adalah angka kebisingan dan getaran di dalam dan di luar area pabrik yang diukur sesuai dengan angka kebisingan maksimum 65 dB dan getaran maksimum 7,5 Hz.
b. Limbah Beta Laktam
produksi antibiotika beta laktam. Limbah suara berasal dari mesin produksi, genset, mesin sistem penunjang (AHU)
Pengelolaan Limbah Beta Laktam adalah sebagai berikut:
1. Limbah Cair.
Limbah cair yang berasal dari gedung beta laktam dialirkan ke bak/kolam perusakan cincin beta laktam dengan menggunakan larutan NaOH, setelah itu dialirkan/digabung dengan limbah cair non beta laktam di bak penampungan, dan seterusnya diolah bersama.
2. Limbah Padat.
Limbah padat yang berupa wadah yang mengandung bahan antibiotik beta laktam dicuci dan dibilas bersih dengan air bersih di ruang pencucian di dalam gedung beta laktam. Air pencucian tersebut merupakan limbah cair dari gedung beta laktam yang dialirkan ke bak perusak cincin beta laktam, sedangkan wadah yang telah dicuci dan dibilas bersih tersebut dikeluarkan dari gedung beta laktam dan ditangani limbahnya seperti pada pengelolaan limbah padat non beta laktam.
3. Limbah Udara.
Limbah udara berupa debu produksi disedot dan dikumpulkan oleh dust collector.
4. Limbah Suara.
BAB IV PEMBAHASAN
Industri farmasi sebagai produsen obat-obatan harus dapat menjamin bahwa produk yang dihasilkan memenuhi persyaratan mutu dan terus menjaga konsistensi mutunya dalam setiap pembuatan. Salah satu pedoman yang digunakan industri farmasi untuk menghasilkan produk yang bermutu adalah Cara Pembuatan Obat yang Baik (CPOB).
PT. MUTIFA Medan sebagai salah satu PMDN yang memproduksi obat telah menerapkan CPOB sejak bulan April tahun 1994. Penerapan CPOB dan seluruh aspek rangkaian produksi merupakan suatu langkah untuk menjamin mutu obat jadi, sehingga memenuhi persyaratan yang ditentukan sesuai dengan tujuan penggunaannya. Dalam prosesnya, mutu dalam produk harus dibentuk di dalam produk tersebut, tidak cukup hanya lulus dari pemeriksaan mutu. Aspek-aspek yang mempengaruhi proses pembentukan mutu terhadap produk tertuang dalam aspek-aspek yang harus diperhatikan dalam CPOB. Selama Praktek Kerja Profesi (PKP), penulis melakukan pengamatan terhadap proses pembentukan mutu melalui penerapan CPOB.
4.1 Manajemen Mutu
Untuk menjamin khasiat, keamanan dan mutu produknya, PT. MUTIFA memiliki manajemen mutu sesuai dengan CPOB 2006. Hal ini dapat dilihat dari adanya pemisahan kewenangan dan tanggung jawab departemen QA dan QC.
konsumen, termasuk di dalamnya pemilihan pemasok. Sistem mutu ditetapkan berdasarkan CPOB. Beberapa hal yang ditangani departemen QA antara lain:
• Penyelenggaran pelatihan CPOB kepada karyawan yang bekerja di area
produksi dan pengawasan mutu.
• Penanganan dan pengendalian sistem dokumentasi.
• Menyusun dan mengendalikan protap.
• Melaksanankan validasi.
• Mengadakan audit terhadap pemasok.
• Melaksanakan inspeksi diri.
• Penolakan dan pelulusan obat jadi.
• Penyelidikan terhadap kegagalan.
• Penanganan hasil uji di luar spesifikasi.
• Penanganan keluhan, penarikan kembali obat jadi dan penanganan obat
kembalian.
dari rencana design industri (R&D), pembelian bahan, proses produksi hingga distribusi obat jadi.
4.2 Personalia
PT. MUTIFA memiliki struktur organisasi di mana departemen produksi, QA dan QC dipimpin oleh manager yang berbeda serta tidak saling bertanggung jawab satu dengan yang lain. Manager produksi dan QA merupakan seorang apoteker yang terdaftar dan memiliki pengalaman praktis yang memadai pada bidang masing-masing sehingga memiliki keterampilan manajerial untuk melaksanakan tugas secara profesional. Sedangkan manager QC adalah seorang sarjana kimia yang berpengalaman dalam bidangnya.
Untuk mendukung kegiatan operasionalnya, PT. MUTIFA memerlukan personil yang terampil dan terlatih. Dalam rangka memenuhi persyaratan CPOB, langkah-langkah yang diambil PT. MUTIFA Medan di bidang personalia adalah dengan cara mengirim pimpinan atau staf untuk mengikuti pelatihan mengenai CPOB. Selanjutnya diharapkan pimpinan atau staf tersebut dapat memberikan bimbingan dan pelatihan tentang CPOB kepada karyawan sehingga kegiatan perusahaan akan memenuhi ketentuan CPOB.
4.3 Bangunan dan Fasilitas
Ruang produksi dirancang mengikuti alur proses produksi sehingga memperkecil resiko terjadinya kekeliruan antara produk obat atau komponen obat yang berbeda, mencegah pencemaran silang dan memperkecil resiko terlewatnya atau salah melaksanakan tahapan proses produksi. Di dalam area produksi terdapat ruang pengawasan selama proses (in process control).
Area produksi diventilasi menggunakan AHU termasuk filter udara dengan tingkat efisiensi yang dapat mencegah pencemaran dan pencemaran silang serta mengendalikan suhu dan kelembaban. Area di mana dilakukan kegiatan yang menimbulkan debu seperti penimbangan bahan, pencampuran dan pencetakan tablet memiliki dust collector. Tetapi dust collector belum berfungsi dengan baik. Hal ini dapat dilihat pada saat kegiatan tersebut berlangsung, ruangan terdapat debu di lantai dan di sela-sela peralatan. Debu tersebut hanya dibersihkan pada saat selesai kegiatan produksi dengan vacum cleaner.
agar tidak berkontak langsung dengan lantai, tidak tercemar debu, kotoran dan terhindar dari rembesan air.
Area pengawasan mutu memiliki ruangan terpisah untuk memberi perlindungan terhadap instrumen seperti spektrofotometri UV-Visibel. Ruang istirahat, kantin, toilet dan bengkel tidak berhubungan langsung dengan area produksi, laboratorium pengawasan mutu dan area penyimpanan.
4.4 Peralatan
Alat timbang dan alat ukur untuk proses produksi dan pengawasan dikalibrasi secara berkala. Dalam tiap ruang produksi hanya terdapat satu peralatan yaitu :
• Ruang pencampuran hanya terdapat satu alat drum mixer.
• Ruang granulasi hanya terdapat satu alat granulator.
• Ruang pengeringan hanya terdapat satu alat fluid bed dryer.
• Ruang lubrikasi hanya terdapat satu alat lubrikator.
Hal ini bertujuan untuk menghindari resiko kekeliruan dan pencemaran silang. 4.5 Sanitasi dan Higine
Setiap personil yang masuk ke dalam area produksi (grey area) harus mengenakan pakaian pelindung, masker, sarung tangan dan penutup kepala. Hal ini dilakukan untuk menjamin perlindungan produk dari pencemaran dan untuk keamanan personil. Personil mencuci tangan sebelum memasuki area produksi. Sarana toilet dan tempat cuci tangan mudah diakses dari area produksi.
4.6 Produksi
Produksi adalah semua kegiatan dari penerimaan bahan awal, pengolahan sampai pengemasan untuk menghasilkan obat jadi. Proses produksi dilaksanakan berdasarkan rencana produksi mingguan. Manager produksi akan menurunkan Surat Perintah Produksi (SPP) kemudian melampirkan catatan pengolahan dan pengemasan batch. Bersama dengan dikeluarnya SPP, manager produksi juga mengeluarkan Surat Perintah Pengeluaran Barang (SPPB) kepada kepala gudang.
Seluruh bahan awal dan bahan pengemas yang diterima diperiksa kesesuiannya dengan pemesanan kemudian dikarantina. Apabila memenuhi persyaratan spesifikasi maka diluluskan dan bahan awal serta bahan pengemas tersebut dapat dipakai. Apabila bahan awal dan bahan pengemas tersebut berlebih maka dikembalikan ke gudang penyimpanan.
Bahan awal tersebut kemudian diserahkan ke ruang penimbangan. Untuk tiap penimbangan dilakukan pembuktian kebenaran identitas, jumlah bahan yang ditimbang oleh dua petugas penimbangan dan pembuktian tersebut dicatat. Sebelum dilakukan pengolahan, peralatan diperiksa kebersihannya dan dinyatakan bersih secara tertulis sebelum digunakan. Semua kegiatan pengolahan dilaksanakan mengikusi prosedur pengolahan induk. Pengawasan selama proses produksi dilakukan pada produk antara dan produk ruahan.
mutu meluluskannya. Produk jadi kemudian diserahkan ke gudang obat jadi dan siap didistribusikan.
4.7 Pengawasan Mutu
Departemen pengawasan mutu di PT. MUTIFA bertanggung jawab atas:
• Pelaksanaan pengambilan contoh.
• Pemeriksaan contoh bahan baku, produk ruahan dan produk jadi.
• Menyusun dan merevisi prosedur tetap (protap).
• Menjaga kebersihan ruangan dan peralatan yang digunakan .
Mula-mula bahan baku yang baru datang akan masuk ke gudang dengan status karantina. Gudang akan mengirimkan slip penerimaan barang ke departemen QC. Berdasarkan slip yang diterima, QC melakukan pengambilan contoh untuk semua bahan aktif dan bahan penolong. Setiap bahan baku yang masuk harus dilengkapi dengan sertifikat analisa yang akan digunakan sebagai acuan pemeriksaan bahan. Setelah diperiksa, bahan baku yang diluluskan ditempelkan label released (warna hijau) kemudian bahan baku disimpan di gudang. Apabila bahan baku ditolak ditempelkan label rejected (warna merah) dan ditempatkan pada area ditolak yang ada di gudang. Kemudian dikembalikan kepada pemasok.
Produk ruahan adalah produk yang telah selesai diolah dan siap untuk dikemas. Pengambilan contoh dilakukan pada saat pembuatan berlangsung yaitu pada awal, tengah dan akhir proses. Produk ruahan harus segera diperiksa sesuai dengan spesifikasinya.
dilakukan pada proses pengemasan yaitu pada awal, tengah dan akhir pengemasan. Setelah diperiksa sesuai dengan spesifikasinya, penerbitan label released/rejected harus diparaf oleh manager QA.
4.8 Inspeksi Diri dan Audit Mutu
Inspeksi diri PT. MUTIFA diadakan satu tahun sekali. Inspeksi diri dilakukan oleh tim inspeksi diri yang diketuai oleh manager QA. Inspeksi diri dilakukan terhadap departemen produksi, R&D, QC, QA, dan teknik. Laporan dibuat setelah inspeksi diri selesai dilaksanakan. Inspeksi yang dilakukan pada tiap-tiap departemen mencakup antara lain:
• Personalia
• Bangunan
• Perawatan bangunan dan peralatan
• Penyimpanan bahan awal, bahan pengemas dan obat jadi
• Peralatan
• Pengolahan dan pengawasan selama proses
• Pengawasan mutu
• Dokumentasi
• Sanitasi dan higiene
• Program validasi dan revalidasi
• Kalibrasi alat
• Prosedur penarikan kembali obat jadi
• Penanganan keluhan
• Pengawasan label
Laporan tersebut mencakup hasil inspeksi diri, evaluasi serta kesimpulan, saran tindakan perbaikan. Audit mutu dilakukan oleh badan POM. Audit ini mencakup aspek CPOB. Badan POM didampingi manager QA melaksanakan audit langsung di lapangan.
4.9 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
Keluhan dapat berupa keluhan menyangkut efek samping obat dan menyangkut teknis kualitas obat. Keluhan tersebut dilaporkan ke departemen QA. Keluhan yang menyangkut teknis kualitas obat dapat dibagi atas:
• Kategori A
Misalnya kesalahan pada cetakan bahan pengemas yang mengandung resiko bagi pasien, laporan negatif dari media massa yang berkaitan dengan keamanan obat dan pemalsuan.
• Kategori B
Misalnya kesalahan dalam bahan pengemas tercetak yang tidak mengandung resiko terhadap pasien (nomor kode tidak ada) dan cacat estetik.
Tindak lanjutnya dapat berupa penggantian produk atau penarikan produk (recall). Penarikan obat jadi dapat dilakukan karena keinginan produsen (misalnya mau mengganti kemasan) atau keinginan badan POM. Produk kembalian yang ditarik akan disimpan di gudang. Penanganan selanjutnya bisa dihancurkan, dijadikan stok kembali atau diolah kembali.
4.10 Dokumentasi
Sistem dokumentasi PT. MUTIFA meliputi:
• Prosedur tetap (protap)
• Spesifikasi (bahan baku, pengemas, produk jadi)
• Catatan pengolahan batch dan catatan pengemasan batch
• Penandaan (status ruangan, mesin, label karantina, released, rejected)
• Protokol dan laporan validasi
• Dokumen registrasi
• Catatan kalibrasi
Sistem dokumentasi merupakan hal yang penting dalam industri farmasi untuk memastikan bahwa setiap karyawan mendapat instruksi yang jelas dan rinci mengenai bidang tugas yang harus dilaksanakannya sehingga memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul apabila hanya mengandalkan instruksi lisan. Sistem dokumentasi produk (catatan pengolahan dan pengemasan batch) harus menggambarkan riwayat lengkap dari setiap batch suatu produk sehingga memungkinkan penyelidikan serta penelusuran kembali terhadap batch yang bersangkutan apabila terdapat kesalahan selama produk tersebut dipasarkan.
4.11 Kualifikasi dan Validasi
Kualifikasi di PT. MUTIFA merupakan tanggung jawab departemen teknik. Kualifikasi adalah pembuktian secara tertulis berdasarkan data yang menunjukan bahwa suatau peralatan, fasilitas, sistem penunjang dan proses pengemasan secara otomatis bekerja sesuai dengan spesifikasi yang ditetapkan.
Kualifikasi mencakup:
• Design Qualification (DQ)
Dokumen awal yang harus disiapkan mencakup desain alat dan spesifikasi konstruksi. DQ hanya dilakukan untuk alat/sistem baru dan harus disiapkan sebelum instalation qualification.
• Instal