SKRIPSI
PENETAPAN KADAR RESIDU TETRASIKLIN
DALAM DAGING AYAM PEDAGING SECARA ADISI
STANDAR DENGAN SPEKTROFOTOMETRI
ULTRAVIOLET
OLEH:
CHRISTINA
NIM 071501028
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENETAPAN KADAR RESIDU TETRASIKLIN
DALAM DAGING AYAM PEDAGING SECARA ADISI
STANDAR DENGAN SPEKTROFOTOMETRI
ULTRAVIOLET
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
CHRISTINA
NIM 071501028
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR RESIDU TETRASIKLIN DALAM
DAGING AYAM PEDAGING SECARA ADISI STANDAR
DENGAN SPEKTROFOTOMETRI ULTRAVIOLET
OLEH:CHRISTINA NIM 071501028
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Desember 2011
Pembimbing I, Panitia Penguji,
Prof. Dr. Jansen Silalahi, M. AppSc.,Apt. Prof. Siti Morin Sinaga, M.Sc., Apt. NIP 195006071979031001 NIP 195008281976032002
Pembimbing II,
Prof. Dr. Jansen Silalahi, M. AppSc.,Apt. NIP 195006071979031001
Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Dra. Salbiah, M.Si., Apt. NIP 194810031987012001
Drs. Immanuel S. Meliala, M.Si., Apt. NIP 195001261983031002
Medan, Desember 2011 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji syukur ke hadirat Tuhan Yang Maha Kuasa yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Penetapan Kadar Residu Tetrasiklin dalam Daging Ayam Pedaging secara Adisi Standar dengan Spektrofotometri Ultraviolet”. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Tujuan dari penelitian ini adalah untuk mengetahui apakah penetapan kadar residu pada daging ayam pedaging dapat dilakukan dengan spektrofotometri ultraviolet secara adisi standar dan apakah kadar residu tetrasiklin dalam daging ayam pedaging yang diuji melebihi BMR menurut SNI 01-6366-2000. Hendaknya hasil penelitian ini dapat memberikan informasi bagi instansi yang bersangkutan dalam penyampaian informasi maupun bimbingan teknis kepada peternak ayam pedaging sehingga residu obat-obatan dalam produk ternak dapat dikurangi.
Penulis menyampaikan rasa hormat dan terima kasih yang sebesarbesarnya kepada Bapak Prof. Dr. Jansen Silalahi, M.AppSc., Apt dan Bapak Drs. Fathur Rahman Harun, M.Si., Apt. yang telah banyak memberikan bimbingan dan bantuan yang tak ternilai harganya selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih juga penulis haturkan kepada bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan fasilitas dan banyak masukan selama masa pendidikan dan penelitian.
setulusnya kepada Kak Mustika Furi, Kak Tina dan Bang Abdi selaku operator di laboratorium penelitian serta Sylvia Halim yang sangat membantu selama penelitian ini dan seluruh teman-teman farmasi stambuk 2007 yang tidak dapat disebutkan namanya satu per satu, atas segala dorongan motivasi dan bantuannya kepada penulis hingga selesainya penulisan skripsi ini.
Medan, Desember 2011 Penulis,
PENETAPAN KADAR RESIDU TETRASIKLIN DALAM DAGING AYAM PEDAGING SECARA SPEKTROFOTOMETRI ULTRAVIOLET
DENGAN METODE ADISI STANDAR Abstrak
Tetrasiklin termasuk dalam antibiotik yang umum digunakan sebagai obat-obatan veteriner oleh peternak ayam untuk pencegahan dan pengobat-obatan penyakit. Penggunaan yang berlebihan dapat meninggalkan residu dalam produk peternakan tersebut termasuk daging ayam. Implikasi klinis akibat mengonsumsi produk ternak yang mengandung residu antibiotik antara lain alergi, keracunan, dan resistensi terhadap antibiotik tertentu. Tujuan penelitian ini adalah untuk menetapkan kadar residu tetrasiklin dalam daging ayam pedaging yang beredar di pusat perbelanjaan Kota Medan.
Sampel diambil dari 2 pusat perbelanjaan yakni Hypermart (Sun Plaza) dan Carrefour (Jl. Gatot Subroto). Penetapan kadar residu tetrasiklin dalam ayam pedaging dilakukan secara spektrofotometri ultraviolet dengan metode adisi standar. Sampel terlebih dahulu diekstraksi dengan larutan buffer McIlvaine-EDTA kemudian dilewatkan dalam Cartridge SPE C18.
Hasil penelitian menunjukkan bahwa kedua sampel yang diperiksa ternyata mengandung residu tetrasiklin dengan kadar 4,9141 µg/g dalam sampel Hypermart dan 8,5556 µg/g dalam sampel Carefour. Validasi metode menunjukkan bahwa prosedur penelitian yang dilakukan memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali 103,8225% (RSD = 0,6143%).
DETERMINATION OF TETRACYCLINE RESIDUE IN BROILER CHICKEN MEAT BY ULTRAVIOLET SPECTROPHOTOMETRY
BY STANDARD ADDITION METHOD Abstract
Tetracyline included in antibiotic that has been widely used by poultryman to prevent or treat diseases in broiler chicken. Overuse of this antibiotic may lead to the presence of its residue in animal products including chicken meat. Clinic implication which are caused by the consumption of animal products contain antibiotic residues are allergy, intoxication, and spesific of antibiotic resistance. The objective of this research was to determine level of tetracycline residue in broiler chicken meat that acquired at supermarket in Medan City.
Samples were obtained from 2 supermarkets that is Hypermart (Sun Plaza) and Carrefour (Gatot Subroto. Determination of the level of tetracycline residue in broiler chicken meat was done by ultraviolet spectrophotometry by standard addition method. The sample was extracted with McIlvaine-EDTA buffer solution firstly and then pass through SPE C18 cartridge.
The results show that both of studied samples contain tetracycline residue by level 4.9141 µg/g in Hypermart sample and 8.5556 µg/g in Carefour sample. Method validation has performed that research procedure have good accuracy and precision with percent recovery 103.8225% (RSD = 0.6143%).
DAFTAR ISI
2.1.1 Sifat Fisikokimia Tetrasiklin HCl ... 5
2.1.2 Pemakaian Tetrasiklin pada Ternak ... 6
2.1.3 Residu Tetrasiklin pada Ternak ... 7
2.2 Analisis Residu Tetrasiklin ... 8
2.2.1 Proses Ekstraksi ... 9
2.2.2 Ekstraksi Fase Padat... 9
2.3 Spektrofotometri Ultraviolet ... 11
2.3.1 Teori Spektrofotometri Ultraviolet ... 11
2.3.2 Analisis Kuantitatif secara Spektrofotometri Ultraviolet 13 2.3.3 Metode Adisi Standar ... 13
3.3.2 Pembuatan Larutan Induk Baku Tetrasiklin Hidroklorida BPFI ... 19
3.3.3 Penentuan Panjang Gelombang Serapan Maksimum 20
3.3.4 Ekstraksi Sampel... 20
3.3.5 Penentuan Kadar Residu Tetrasiklin dalam Daging Ayam Pedaging ... 21
3.3.7.1 Uji Akurasi dengan Persen Perolehan
Kembali... .. 23
3.3.7.2 Presisi... 23
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Pemilihan Panjang Gelombang ... 24
4.2 Penyiapan Larutan Sampel ... 25
4.3 Analisis Kuantitatif ... 27
4.4 Validasi Metode ... 30
BAB V KESIMPULAN DAN SARAN ... 31
5.1 Kesimpulan ... 31
5.2 Saran ... 31
DAFTAR PUSTAKA ... 32
DAFTAR TABEL
Halaman Tabel 1 Hasil Penetapan kadar Residu Tetrasiklin pada Sampel Daging
DAFTAR GAMBAR
Halaman Gambar 1 Rumus Struktur Tetrasiklin HCl ... 6 Gambar 2 Empat langkah dalam Penggunaan ekstraksi Fase Padat ... 11 Gambar 3 Grafik Penentuan Kadar dalam Metode Adisi Standar ... 14 Gambar 4 Kurva Serapan Tetrasiklin Hidroklorida Baku Pembanding
Farmakope Indonesia (konsentrasi 10µg/ml) dalam Pelarut HCl 0,1 N ... 25 Gambar 2 Grafik Penentuan Konsentrasi Residu Tetrasiklin dalam
DAFTAR LAMPIRAN
Halaman Lampiran 1 Perhitungan Konsentrasi Pengukuran pada Pemilihan
Panjang Gelombang ... 34 Lampiran 2 Data Absorbansi dan Grafik Penentuan Konsentrasi
Residu Tetrasiklin dalam Larutan Sampel Daging Hypermart dengan Metode Adisi Standar ... 35 Lampiran 3 Perhitungan Persamaan Regresi dan Penetapan Kadar
Residu Tetrasiklin dalam Sampel Daging Hypermart ... 41 Lampiran 4 Analisis Data secara Statistik dari Hasil Penetapan Kadar
Residu Tetrasiklin dalam Sampel Daging Hypermart ... 53 Lampiran 5 Data Absorbansi dan Grafik Penentuan Konsentrasi
Residu Tetrasiklin dalam Larutan Sampel Daging Carefour dengan Metode Adisi Standar ... 56 Lampiran 6 Perhitungan Persamaan Regresi dan Penetapan Kadar
Residu Tetrasiklin dalam Sampel Daging Carefour ... 62 Lampiran 7 Analisis Data secara Statistik dari Hasil Penetapan Kadar
Residu Tetrasiklin dalam Sampel Daging Carefour ... 74 Lampiran 8 Data Absorbansi dan Grafik Penentuan Konsentrasi
Residu Tetrasiklin pada Uji Perolehan Kembali Tetrasiklin Baku yang Ditambahkan pada Sampel Daging Hypermart dengan Metode Adisi Standar ... 78 Lampiran 9 Perhitungan Persamaan Regresi Hasil Perolehan Kembali
Tetrasiklin Baku yang Ditambahkan pada Sampel Daging Hypermart ... 81 Lampiran 10 Contoh Perhitungan Persen Perolehan Kembali ... 87 Lampiran 11 Analisis Data secara Statistik dari Hasil Perolehan
Kembali Tetrasiklin Baku yang Ditambahkan pada Sampel Daging Hypermart ... 88 Lampiran 12 Gambar Instrumen Spektrofotometer dan Cartridge SPE
PENETAPAN KADAR RESIDU TETRASIKLIN DALAM DAGING AYAM PEDAGING SECARA SPEKTROFOTOMETRI ULTRAVIOLET
DENGAN METODE ADISI STANDAR Abstrak
Tetrasiklin termasuk dalam antibiotik yang umum digunakan sebagai obat-obatan veteriner oleh peternak ayam untuk pencegahan dan pengobat-obatan penyakit. Penggunaan yang berlebihan dapat meninggalkan residu dalam produk peternakan tersebut termasuk daging ayam. Implikasi klinis akibat mengonsumsi produk ternak yang mengandung residu antibiotik antara lain alergi, keracunan, dan resistensi terhadap antibiotik tertentu. Tujuan penelitian ini adalah untuk menetapkan kadar residu tetrasiklin dalam daging ayam pedaging yang beredar di pusat perbelanjaan Kota Medan.
Sampel diambil dari 2 pusat perbelanjaan yakni Hypermart (Sun Plaza) dan Carrefour (Jl. Gatot Subroto). Penetapan kadar residu tetrasiklin dalam ayam pedaging dilakukan secara spektrofotometri ultraviolet dengan metode adisi standar. Sampel terlebih dahulu diekstraksi dengan larutan buffer McIlvaine-EDTA kemudian dilewatkan dalam Cartridge SPE C18.
Hasil penelitian menunjukkan bahwa kedua sampel yang diperiksa ternyata mengandung residu tetrasiklin dengan kadar 4,9141 µg/g dalam sampel Hypermart dan 8,5556 µg/g dalam sampel Carefour. Validasi metode menunjukkan bahwa prosedur penelitian yang dilakukan memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali 103,8225% (RSD = 0,6143%).
DETERMINATION OF TETRACYCLINE RESIDUE IN BROILER CHICKEN MEAT BY ULTRAVIOLET SPECTROPHOTOMETRY
BY STANDARD ADDITION METHOD Abstract
Tetracyline included in antibiotic that has been widely used by poultryman to prevent or treat diseases in broiler chicken. Overuse of this antibiotic may lead to the presence of its residue in animal products including chicken meat. Clinic implication which are caused by the consumption of animal products contain antibiotic residues are allergy, intoxication, and spesific of antibiotic resistance. The objective of this research was to determine level of tetracycline residue in broiler chicken meat that acquired at supermarket in Medan City.
Samples were obtained from 2 supermarkets that is Hypermart (Sun Plaza) and Carrefour (Gatot Subroto. Determination of the level of tetracycline residue in broiler chicken meat was done by ultraviolet spectrophotometry by standard addition method. The sample was extracted with McIlvaine-EDTA buffer solution firstly and then pass through SPE C18 cartridge.
The results show that both of studied samples contain tetracycline residue by level 4.9141 µg/g in Hypermart sample and 8.5556 µg/g in Carefour sample. Method validation has performed that research procedure have good accuracy and precision with percent recovery 103.8225% (RSD = 0.6143%).
BAB I PENDAHULUAN 1.1 Latar Belakang
Pangan hewani sangat dibutuhkan manusia sebagai sumber protein yang sangat penting karena mengandung asam-asam amino yang mendekati susunan asam amino yang dibutuhkan manusia sehingga lebih mudah dicerna dan lebih efisien pemanfaatannya. Namun demikian, pangan hewani yang tidak aman (tercemar oleh mikroba maupun bahan kimia) akan menjadi tidak berguna dan membahayakan kesehatan manusia (Bahri, dkk., 2005).
Antibiotika seperti tetrasiklin secara luas digunakan dalam dunia peternakan baik untuk pengobatan, pencegahan penyakit maupun sebagai tambahan dalam pakan yang mendorong pertumbuhan pada ternak (Botsoglou dan Fletouris, 2001). Hampir semua pabrik pakan menambahkan senyawa obat berupa antibiotik ke dalam ransum jadi (Bahri, 2008). Pengaruh pemberian antibiotik yang menguntungkan disebabkan oleh adanya faktor pengendali infeksi subklinis. Antibiotik juga mampu meningkatkan digesti pati dengan jalan menekan aktivitas mikroba yang bertanggung jawab terhadap produksi gas di lambung (Soeparno, 1998). Hal ini diperkuat oleh hasil penelitian yang menyatakan bahwa sebagian besar sampel pakan ayam dari Cianjur, Sukabumi, Bogor, Tangerang dan Bekasi positif mengandung antibiotik golongan tetrasiklin dan obat golongan sulfonamida (Bahri, 2008).
selanjutnya disebut sebagai residu yang kemudian terakumulasi dalam jaringan/organ tubuh dengan konsentrasi yang bervariasi. Kandungan residu obat yang melewati batas maksimum residu (BMR) yang ditetapkan dapat menimbulkan reaksi alergis, keracunan, resistensi mikroba tertentu atau gangguan fisiologis pada manusia. Adapun waktu henti pemakaian antibiotik golongan tetrasiklin adalah 5 hari menjelang ternak dipotong (Lastari, dkk., 1987). Menurut SNI 01-6366-2000, BMR antibiotik golongan tetrasiklin dalam daging dan susu tidak boleh melebihi 100 ppb. Hasil penelitian pada produk ternak asal beberapa daerah di Jawa menunjukkan bahwa pada daging, telur, dan susu ditemukan residu antibiotik golongan tetrasiklin dan sulfonamida (Bahri, 2008).
Muriuki, et.al. (2001) dan Suryani (2009) telah melakukan penetapan kadar residu antibiotik golongan tetrasiklin secara Kromatografi Cair Kinerja Tinggi (KCKT). Perbedaannya terletak pada detektor yang digunakan, Muruiki menggunakan detektor penangkap elektron dengan fase gerak metanol-asetonitril-asam oksalat 0,01 M (1 : 1,5 : 2,5) pada laju alir 2 ml/menit, sementara Suryani memanfaatkan detektor fotodioda dengan fase gerak asam oksalat 0,0025 M-asetonitril (4:1) pada laju alir 1 ml/menit. Laboratory Quality Assurance Division (2007) telah mengembangkan suatu metode analisis residu tetrasiklin pada daging secara KCKT dengan pengekstraksi buffer McIlvaine-EDTA serta memanfaatkan ekstraksi fase padat (Solid Phase Extraction/SPE) C-18 dengan pengkondisi metanol dan air, pembilasan dengan air serta pengelusi metanol asam oksalat 0,01 M.
gugus amina), maka senyawa ini dapat menyerap radiasi pada panjang gelombang di daerah ultraviolet. Menurut Budavari (2001), tetrasiklin memiliki serapan maksimum dalam larutan asam pada panjang gelombang 220 nm, 268 nm, dan 355 nm. Sedangkan menurut Moffat (2004) tetrasiklin memiliki serapan maksimum dalam larutan asampada panjang gelombang 270 nm ( A11 = 417 a)
dan 356 nm.
Berdasarkan hal tersebut di atas, peneliti memilih metode spektrofotometri ultraviolet sebagai metode yang digunakan pada penetapan kadar residu tetrasiklin dalam daging ayam pedaging. Karena metode ini mempunyai banyak keuntungan antara lain dapat digunakan untuk analisa suatu zat dalam jumlah kecil, pengerjaannya mudah, sederhana, cukup sensitif dan selektif, biayanya relatif murah dan mempunyai kepekaan analisis cukup tinggi (Munson, 1991).
Tujuan penelitian ini adalah untuk mengetahui apakah penetapan kadar residu pada daging ayam pedaging dapat dilakukan dengan spektrofotometri ultraviolet secara adisi standar yang memanfaatkan prosedur preparasi sampel menurut Laboratory Quality Assurance Division (2007) dan apakah kadar residu tetrasiklin dalam daging ayam pedaging yang diuji melebihi BMR menurut SNI 01-6366-2000. Untuk menguji keabsahan dari metode yang dikerjakan maka pada akhir penelitian ini dilakukan validasi. Parameter validasi yang dilakukan meliputi akurasi dan presisi.
1.2. Perumusan Masalah
Assurance Division dapat digunakan pada penetapan kadar residu tetrasiklin dalam daging ayam pedaging dan memenuhi uji validasi?
b. Apakah kadar residu tetrasiklin dalam daging ayam pedaging yang diuji melebihi BMR yang ditetapkan oleh SNI?
1.3. Hipotesis
a. Spektrofotometri ultraviolet secara adisi standar yang memanfaatkan prosedur preparasi sampel menurut Laboratory Quality Assurance Division dapat digunakan pada penetapan kadar residu tetrasiklin dalam daging ayam pedaging dan memenuhi uji validasi.
b. Kadar residu tetrasiklin dalam daging ayam pedaging yang diuji tidak melebihi BMR yang ditetapkan oleh SNI.
1.4 Tujuan Penelitian
a. Menggunakan spektrofotometri ultraviolet secara adisi standar yang memanfaatkan prosedur preparasi sampel menurut Laboratory Quality Assurance Division dalam penetapan kadar residu tetrasiklin dalam daging ayam pedaging dan menguji keabsahan metode yang digunakan.
BAB II
TINJAUAN PUSTAKA 2.1 Tetrasiklin
Antibiotika adalah golongan sintetis, yang memiliki khasiat mematikan atau menghambat pertumbuhan bakteri. Kegiatan antibiotik untuk pertama kalinya ditemukan secara kebetulan oleh dr. Alexander Fleming. Tetapi penemuan ini baru dikembangkan dan digunakan pada permulaan perang dunia II di tahun 1941, ketika obat-obat antibakteri sangat diperlukan untuk menanggulangi infeksi dari luka-luka akibat pertempuran (Tan dan Rahardja, 2008).
Tetrasiklin merupakan kelompok antibiotika yang dihasilkan oleh jamur Streptomyces aureofaciens atau S. rimosus. Tetrasiklin merupakan derivat dari senyawa hidronaftalen, dan berwarna kuning (Subronto, 2001). Tetrasiklin merupakan antibiotika berspektrum luas yang aktif terhadap bakteri gram-positif maupun gram-negatif yang bekerja merintangi sintesa protein (Tan dan Rahardja, 2008).
2.1.1 Sifat Fisikokimia Tetrasiklin HCl
Tetrasiklin HCl memiliki rumus molekul C22H24N2O8.HCl dengan berat
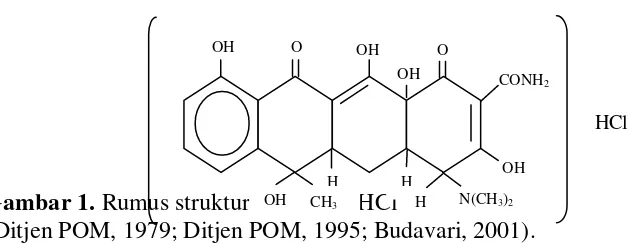
cahaya matahari yang kuat dalam udara lembab menjadi gelap. Dalam larutan dengan pH lebih kecil 2, potensi berkurang dan cepat rusak dalam larutan alkali hidroksida serta memiliki suhu lebur 2140. Rumus struktur dari Tetrasiklin HCL dapat dilihat pada Gambar 1.
Gambar 1. Rumus struktur tetrasiklin HCl
(Ditjen POM, 1979; Ditjen POM, 1995; Budavari, 2001). 2.1.2 Pemakaian Tetrasiklin pada Ternak
Pada unggas (ayam, kalkun), untuk pencegahan CRD tetrasiklin diberikan dengan dosis 100-200 mg/gallon air minum, sedangkan untuk pengobatan CRD dan air sacculitis, hexamitiasis dan bleucomb, sinusitis, dan sinivovitis, tetrasiklin diberikan dengan dosis 200-400 mg/gallon air minum (Subronto, 2001).
Di bidang peternakan, selain untuk tujuan terapetik, antibiotik juga dipakai sebagai imbuhan pakan untuk merangsang pertumbuhan pada ternak (Bahri, 2008). Beberapa antibiotika yang banyak dipakai sebagai perangsang pertumbuhan antara lain dari golongan tetrasiklin, penisilin, macrolida, dan lincomisin. Pengaruh pemberian antibiotik yang menguntungkan disebabkan oleh adanya faktor pengendali infeksi subklinis. Antibiotik juga mampu meningkatkan digesti pati dengan jalan menekan aktivitas mikroba yang bertanggung jawab terhadap produksi gas di lambung (Soeparno, 1998).
Namun akhir-akhir ini penggunaan senyawa antibiotik dalam pakan ternak telah menjadi perdebatan sengit oleh para ilmuwan akibat efek buruk yang ditimbulkan melalui residu yang ditinggalkan baik pada daging, susu maupun
telur. Larangan penggunaan antibiotik dalam pakan ternak bukan merupakan hal yang baru bagi sebagian negara Eropa. Beberapa negara tertentu telah membatasi penggunaan zat aditif tersebut dalam pakan ternak seperti di Swedia tahun 1986, Denmark tahun 1995, Jerman tahun 1996 dan Swiss tahun 1999. Akan tetapi pelarangan tersebut tidak menyeluruh dan hanya terbatas pada jenis antibiotik tertentu misalnya avoparcin (Denmark), vancomisin (Jerman), spiramisin, tilosin, dan virginiamicin (Uni Eropa). Hingga kini hanya tersisa empat antibiotik yang masih diizinkan penggunaannya dalam pakan ternak pada masyarakat Eropa yaitu flavophospholipol, avilamycin, monensin-Na dan salinomycin-Na. Sementara di Indonesia larangan penggunaan beberapa antibiotik dalam imbuhan pakan tercantum dalam revisi UU no 6 tahun 1967 (masih dalam tahap penyelesaian). Hanya saja ada sedikit kerancuan karena tidak mencantumkan jenis antibiotik apa saja yang dilarang penggunaannya dalam pakan ternak (Sjofjan, 2011).
2.1.3 Residu Tetrasiklin pada Ternak
adalah kurun waktu dari saat pemberian obat terakhir hingga ternak boleh dipotong atau produknya dapat dikonsumsi (Bahri, 2008). Waktu henti pemakaian antibiotik golongan tetrasiklin adalah 5 hari menjelang ternak dipotong (Lastari, dkk., 1987).
2.1.4 Efek Residu Antibiotik dalam Produk Ternak terhadap Kesehatan
Pemakaian yang luas dari obat-obatan pada ternak menimbulkan kemungkinan yang besar terjadinya residu obat maupun metabolitnya dalam produk ternak. Kehadiran residu obat-obatan di dalam makanan tentu akan mempengaruhi kesehatan manusia. Salah satunya misalnya terjadinya reaksi
alergi dari antibiotik golongan β-laktam pada konsumen yang sensitif. Efek lain
yang mungkin timbul yaitu terjadinya keracunan, resistensi mikroba dan gangguan fisiologis pada manusia (Botsoglou dan Fletouris, 2001).
2.2 Analisis Residu Tetrasiklin
Analisis residu antibiotik golongan tetrasiklin secara Kromatografi Cair Kinerja Tinggi (KCKT) telah dikembangkan oleh Muriuki, et.al. (2001) dan Suryani (2009). Muriuki menganalisis residu tetrasiklin dalam daging sapi dengan menggunakan detektor penangkap elektron dengan fase gerak metanol-asetonitril-asam oksalat 0,01 M (1 : 1,5 : 2,5) pada laju alir 2 ml/menit. Kadar residu yang diperoleh berkisar 524 µg/kg – 1046 µg/kg. Sementara Suryani menganalisis residu tetrasiklin dalam daging ayam pedaging dengan memanfaatkan detektor berkas fotodioda dengan fase gerak asam oksalat 0,0025 M-asetonitril (4:1) pada laju alir 1 ml/menit. Kadar residu tetrasiklin yang diperoleh berkisar 5 µg/kg – 68 µg/kg.
Ekstraksi merupakan suatu metode yang digunakan dalam proses pemisahan suatu komponen dari campurannya dengan menggunakan bantuan pelarut sebagai tenaga pemisah. Tetrasiklin mampu berikatan dengan protein (membentuk konjugat) dan ion logam (membentuk khelat) sehingga sulit diekstraksi dari matriks biologi. Untuk melepaskan ikatan tersebut dapat dilakukan dengan mendenaturasi protein menggunakan pereaksi pengendap protein dengan penambahan etilendiamin tetra-asetat (EDTA), asam sitrat, suksinat, atau oksalat untuk meningkatkan efisiensi ekstraksi (Botsoglou dan Fletouris, 2001).
Muriuki et.al. (2001) menggunakan buffer McIlvaine pH 4 dan metanol pada proses ekstraksi awal dengan perbandingan 3:7, sementara Suryani (2009) menggunakan asam trikloroasetat dan buffer McIlvaine-EDTA sebagai pengekstraksi awal. Selanjutnya keduanya menggunakan ekstraksi fase padat C18 sebagai proses ekstraksi lanjutan.
2.2.2 Ektraksi Fase Padat
Pelarut Sampel = Pelarut Pelarut
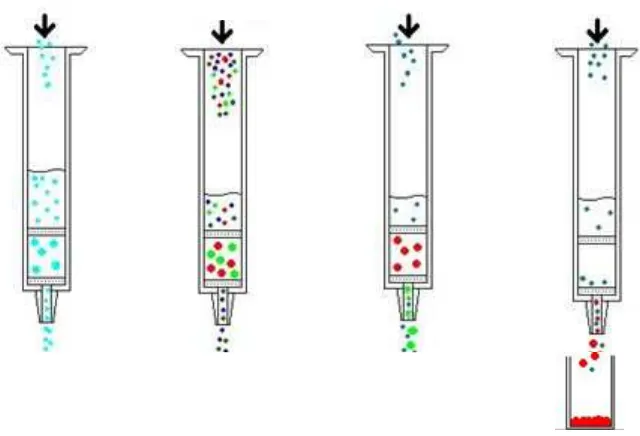
Ekstraksi fase padat dapat dibagi menjadi 4 berdasarkan jenis fase diam atau penjerap yang dikemas dalam cartridge, yakni fase normal (normal phase), fase terbalik (reversed phase), adsorpsi (adsorption) dan pertukaran ion (ion exchange) (Anonim a, 1998). Pemilihan penjerap didasarkan pada kemampuannya berikatan dengan analit, dimana ikatan antara analit dengan penjerap harus lebih kuat dibandingkan ikatan antara analit dengan matriks sampel. Sehingga analit akan tertahan pada penjerap. Selanjutnya dipilih pelarut yang mampu melepaskan ikatan antara analit dengan penjerap pada tahap elusi (Botsoglou dan Fletouris, 2001).
Gambar 2. Empat langkah dalam penggunaan ekstraksi fase padat (Anonim c, 2005).
2.3 Spektrofotometri Ultraviolet
2.3.1 Teori Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet adalah suatu teknik pengukuran serapan radiasi elektromagnetik yang diserap oleh zat pada daerah ultraviolet (panjang gelombang 190 nm - 380 nm) (Ditjen POM, 1979). Radiasi ultraviolet diabsorpsi oleh molekul organik aromatik, molekul yang mengandung elektron-π terkonjugasi dan/ atau atom yang mengadung elektron-n, menyebabkan transisi elektron di orbit terluarnya dari tingkat energi elektron dasar ke tingkat energi elektron tereksitasi lebih tinggi (Satiadarma, 2004).
Gugus atau atom dalam molekul organik yang mampu menyerap sinar ultraviolet dan sinar tampak disebut kromofor (misalnya C=C, C=O, dan NO2).
Sedangkan auksokrom (misalnya –OH, –NH2 dan –OCH3) merupakan gugus
pergeseran pita absorpsi menuju ke panjang gelombang yang lebih besar (pergeseran merah atau pergeseran batokromik) disertai dengan peningkatan intensitas (efek hiperkromik) (Gandjar dan Rohman, 2007).
Untuk mengukur banyaknya radiasi yang diserap oleh suatu molekul dapat dibuat suatu grafik (spektrum absorpsi) yang menghubungkan banyaknya sinar yang diserap dengan frekuensi (atau panjang gelombang) sinar. Transisi yang dibolehkan untuk suatu molekul dengan struktur kimia yang berbeda adalah tidak sama sehingga spektrum absorpsinya juga berbeda. Dengan demikian, spektrum absorpsi dapat digunakan sebagai bahan informasi yang bermanfaat untuk analisis kualitatif. Banyaknya sinar yang diabsorpsi pada panjang gelombang tertentu sebanding dengan banyaknya molekul yang menyerap radiasi. Dengan demikian spektrum absorpsi juga dapat digunakan untuk analisis kuantitatif (Gandjar dan Rohman, 2007).
Pada penentuan analit yang terdapat dalam suatu matriks diperlukan pengukuran dari blanko matriks untuk meralat kesalahan yang disebabkan oleh matriks. Bila komponen matriks untuk blanko tidak dapat diperoleh, maka dapat digunakan metode adisi standar, yaitu dengan menambahkan standar ke dalam larutan sampel yang diukur dengan konsentrasi yang meningkat secara teratur (Satiadarma, 2004).
2.3.2 Analisis kuantitatif secara Spektrofotometri Ultraviolet
yang nilainya sebanding dengan banyaknya molekul yang mengabsorpsi radiasi dan merupakan dasar analisis kuantitatif. Senyawa yang tidak mengabsorpsi radiasi ultraviolet-sinar tampak dapat juga ditentukan dengan spektroskopi ultraviolet-sinar tampak, apabila ada reaksi kimia yang dapat mengubahnya menjadi kromofor atau dapat disambungkan dengan suatu pereaksi kromofor (Satiadarma, 2004).
2.3.3 Metode Adisi Standar
Metode adisi standar dipakai secara luas karena mampu meminimalkan kesalahan yang disebabkan oleh perbedaan kondisi lingkungan (matriks) sampel dan standar (Anonim b, 2010). Idealnya kalibrasi standar seharusnya mendekati komposisi dari sampel yang dianalisis, tidak hanya pada konsentrasi analit tetapi juga dalam hal konsentrasi dari elemen lain yang ada dalam matriks sampel, sehingga dapat meminimalkan pengaruh dari berbagai komponen dalam sampel terhadap absorbansi yang terukur (Skoog dan West, 1996). Pemanfaatan teknik adisi standar sangat membantu terutama untuk analisa senyawa yang kadarnya kecil (Ramette, 1981).
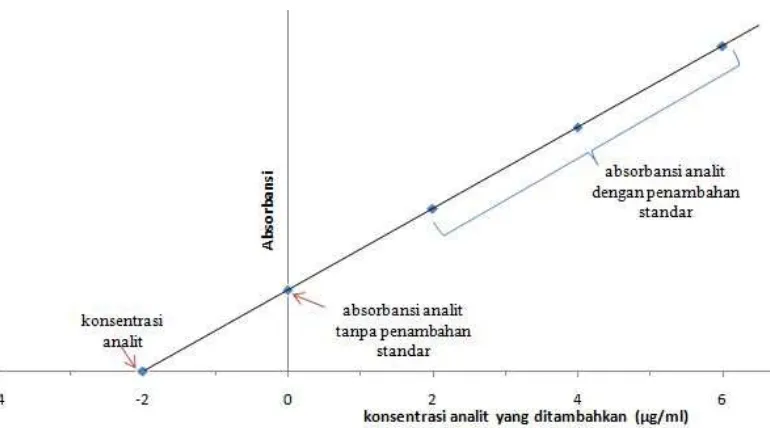
Gambar 3. Grafik Penentuan Kadar dalam Metode Adisi Standar (Harris, 1987) Seperti terlihat pada Gambar 3, sumbu X merupakan konsentrasi standar yang ditambahkan sementara sumbu Y menunjukkan nilai absorbansinya. Ekstrapolasi garis pada sumbu X (titik potong pada sumbu X, mensubstitusikan nilai Y = 0 pada persamaan regresi) inilah yang setara dengan konsentrasi analit (concentration of unknown) yang terkandung dalam larutan sampel yang diukur (Harris, 1987).
Berdasarkan hukum Beer akan berlaku hal – hal berikut: Ax = k. Ck
At = k ( Cs + Ck )
Dimana : Cx = kadar zat sampel
Cs = kadar zat yang ditambahkan ke dalam larutan sampel Ax = absorbansi zat sampel (tanpa penambahan zat standar) At = absorbansi zat sampel + zat standar
-Konsentrasi analit dalam sampel dapat dihitung dengan membuat grafik At lawan Cs seperti pada Gambar 3. Dengan mengekstrapolasi At = 0 pada grafik atau mensubstitusikan nilai Y = 0 (absorbansi = 0) akan diperoleh kadar analit dalam sampel, sehingga diperoleh :
Cx = Cs ×
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaanya (Harmita, 2004).
Menurut USP (United States Pharmacopeia), ada 8 langkah dalam validasi metode analisis yakni akurasi, presisi, batas deteksi, batas kuantifikasi, spesifisitas, linieritas dan rentang, kekasaran (Ruggedness) dan ketahanan (Robutness) (Gandjar dan Rohman, 2007).
Presisi dari suatu metode analisis adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis ditetapkan berulang kali pada sejumlah cuplikan yang diambil dari satu sampel homogen. Presisi dinyatakan sebagai simpangan baku atau simpangan baku relatif (Relative Standard Deviation).
Batas deteksi adalah nilai parameter uji batas, yaitu konsentrasi analit terendah yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi pada kondisi percobaan yang dilakukan. Limit deteksi dinyatakan dalam konsentrasi analit dalam sampel.
Batas kuantifikasi didefenisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan. Batas kuantifikasi juga dinyatakan dalam konsentrasi analit dalam sampel.
Spesifisitas adalah kemampuan untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen-komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradasi, dan komponen matriks.
Linieritas merupakan kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran yang diberikan. Rentang didefenisikan sebagai konsentrasi terendah dan tertinggi yang mana suatu metode analisis menunjukkan akurasi, presisi, dan linieritas yang mencukupi.
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah penelitian deskriptif yang mengarah pada pengembangan metode, dengan tujuan mengembangkan spektrofotometri ultraviolet secara adisi standar dalam penetapan residu tetrasiklin dalam daging ayam pedaging.
3.1 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas, spektrofotometer UV-Vis (Shimadzu UV-Vis 1800), sentrifugator (Hitachi), vortex (Boeco), blender (National), cartridge SPE C18 (Isolute C18), vacum manifold (Agilent) dan neraca analitik (Boeco).
Bahan yang digunakan jika tidak dinyatakan lain merupakan kualitas p.a. (pro analysis) keluaran E.Merck antara lain asam klorida, asam sitrat monohidrat, asam oksalat dihidrat, dinatrium hidrogen pospat anhidrat, Dinatrium edetat dihidrat, tetrasiklin hidroklorida baku (BPFI), dan air suling (Brataco).
3.2 Sampel
3.3. Prosedur Penelitian 3.3.1 Pembuatan Pereaksi 3.3.1.1 Larutan HCl 0,1 N
Sebanyak 8,4 ml HCl pekat diencerkan dengan air suling dalam labu ukur 1000 ml hingga garis tanda.
3.3.1.2 Buffer McIlvaine pH 4
Buffer McIlvaine dibuat dengan mencampurkan larutan natrium pospat dengan larutan asam sitrat. Larutan natrium pospat dibuat dengan melarutkan 7,1025 g dinatrium hidrogen pospat anhidrat dengan air suling hingga garis tanda dalam labu ukur 250 ml. Larutan asam sitrat dibuat dengan melarutkan 5,2525 g asam sitrat monohidrat dengan air suling hingga garis tanda dalam labu ukur 250 ml. Buffer McIlvaine dibuat dengan mencampurkan 200 ml larutan asam sitrat dengan 125 ml larutan natrium fosfat. Kemudian di cek pH nya (Laboratory Quality Assurance Division, 2007).
3.3.1.3 Buffer McIlvaine-EDTA
Sebanyak 12,98 g dinatrium EDTA dihidrat dilarutkan ke dalam 325 ml buffer McIlvaine (Laboratory Quality Assurance Division, 2007).
3.3.1.4 Larutan metanol asam oksalat 0,01 M
Sebanyak 0,126 g asam oksalat dihidrat dilarutkan dengan metanol dalam labu ukur 100 ml, cukupkan hingga garis tanda (Laboratory Quality Assurance Division, 2007).
3.3.2 Pembuatan Larutan Induk Baku Tetrasiklin HCl BPFI
N lalu dicukupkan sampai garis tanda dengan HCl 0,1 N dan dikocok homogen, sehingga diperoleh larutan dengan konsentrasi 500 µg/ml, larutan ini disebut larutan induk baku (LIB I). Dari larutan ini dipipet 5,00 ml, dimasukkan ke dalam labu ukur 50 ml, lalu diencerkan dengan HCl 0,1 N sampai garis tanda sehingga diperoleh konsentrasi 50 µg/ml (LIB II).
3.3.3 Penentuan Panjang Gelombang Serapan Maksimum
Sejumlah 5,00 ml larutan induk baku (LIB) II (50 µg/ml) dipipet, dimasukkan ke dalam labu ukur 25 ml, kemudian diencerkan dengan HCl 0,1 N sampai garis tanda (10 µg/ml). Lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 10 µg/ml. kemudian diukur serapan pada panjang gelombang 200-400 nm. Perhitungan konsentrasi pengukuran pada pemilihan panjang gelombang dapat dilihat pada Lampiran 1 halaman 32.
3.3.4 Ekstraksi Sampel
Dipasang Cartridge SPE C18 pada Vacum manifold. Cartridge dikondisikan dengan 10,0 ml metanol dan 20,0 ml air suling dalam kondisi vakum pada laju 1,5 – 2,5 ml/menit (conditioning step). Supernatan yang diperoleh pada tahap akhir sentrifugasi dimasukkan ke dalam cartridge lalu dijalankan dalam kondisi vakum pada laju yang sama (loading step). Selanjutnya cartridge dibilas dengan 20,0 ml air suling lalu didiamkan selama 5 menit. Tetrasiklin yang terikat pada fase diam dielusi dari cartridge dengan 6 ml metanol asam oksalat 0,01 M (elutioning step) (Laboratory Quality Assurance Division, 2007). Hasilnya dimasukkan ke dalam labu ukur 25 ml dan dicukupkan dengan HCl 0,1 N hingga garis tanda (larutan sampel).
3.3.5 Penentuan Kadar Residu Tetrasiklin dalam Daging Ayam Pedaging Sebanyak masing-masing 4,00 ml larutan sampel dipipet ke dalam 5 labu ukur 25 ml, tambahkan berturut-turut 0,00; 2,50; 3,75; 5,00; dan 6,25 ml LIB II, cukupkan dengan HCl 0,1 N hingga garis tanda sehingga diperoleh masing-masing larutan tetrasiklin baku dengan konsentrasi 0,0; 5,0; 7,5; 10,0; dan 12,5 µg/ml. Absorbansi dari masing-masing larutan diukur pada panjang gelombang 270 nm kemudian dibuatgrafik absorbansi versus konsentrasi standar.
Rumus perhitungan kadar residu tetrasiklin dalam sampel ditulis sebagai berikut. Kadar residu tetrasiklin dalam sampel (µg/g sampel)
=
3.3.6. Analisis Data Penetapan kadar Secara Statistik
Data perhitungan kadar residu tetrasiklin pada bagian 3.3.5 dianalisis secara statistik menggunakan uji t.
Rumus yang digunakan untuk menghitung simpangan baku adalah :
SD =
-Sedangkan untuk mendapatkan thitung digunakan rumus:
thitung =
-Data diterima jika –ttabel < thitung < ttabel pada interval kepercayaan 95% dengan nilai α = 0,05.
Untuk menghitung kadar residu tetrasiklin dalam sampel secara statistik digunakan rumus:
Kadar residu tetrasiklin = ± (t × SD/ )
Keterangan :
SD = standard deviation/simpangan baku Xi = kadar residu tetrasiklin
= kadar rerata residu tetrasiklin
n = jumlah pengulangan
CF - CA
C*A
3.3.7 Uji Validasi dengan Parameter Akurasi dan Presisi 3.3.7.1 Uji Akurasi dengan Persen Perolehan Kembali
Akurasi ditentukan dengan menggunakan metode penambahan baku (the method of standard additives), yakni ke dalam sampel daging ayam ditambahkan tetrasiklin HCl baku sebanyak 100% dari kadar tetrasiklin yang diketahui terdapat dalam sampel, kemudian dianalisis dengan prosedur yang sama seperti pada sampel. Hasil dinyatakan dalam persen perolehan kembali (% recovery). Persen perolehan kembali dapat dihitung dengan menggunakan rumus sebagai berikut.
% Perolehan Kembali = _________ x 100% Keterangan:
CF = kadar analit yang diperoleh setelah penambahan tetrasiklin baku
CA = kadar analit sebelum penambahan tetrasiklin baku
C*A = kadar tetrasiklin baku yang ditambahkan
3.3.7.2 Presisi
Presisi metode penelitian dinyatakan oleh simpangan baku relatif (Relative Standard Deviation/RSD) dari serangkaian data uji perolehan kembali. RSD dapat dirumuskan sebagai berikut.
RSD = × 100%
Keterangan : SD = standard deviation/simpangan baku
= kadar rerata tetrasiklin dalam sampel yang diuji
BAB IV
HASIL DAN PEMBAHASAN 4.1 Pemilihan Panjang Gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimum. Untuk memilih panjang gelombang maksimum, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu (Gandjar dan Rohman, 2007).
Penentuan panjang gelombang ini dilakukan pada konsentrasi yang memberikan serapan dengan kesalahan fotometrik terkecil (absorbansi ± 0,4343). Untuk mendapatkan konsentrasi tersebut dapat dihitung menggunakan nilai koefisien ekstingsi, A11, dari literatur. Dimana menurut Moffat (2004) nilai A11
dalam larutan asam pada panjang gelombang 270 nm adalah 417a.
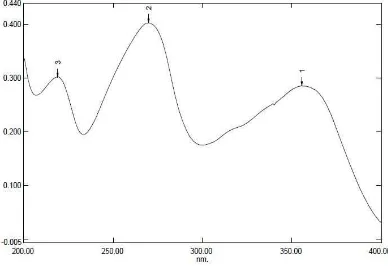
Dari perhitungan pada Lampiran 1 diperoleh konsentrasi pengukuran adalah 10 µg/ml dan hasil pengukuran menunjukkan panjang gelombang maksimum tetrasiklin dalam larutan HCl 0,1 N adalah 270 nm dengan serapan 0,403 seperti terlihat pada Gambar 4 halaman 23.
Gambar 4. Kurva Serapan Tetrasiklin Hidroklorida Baku Pembanding Farmakope Indonesia (konsentrasi 10 µg/ml) dalam Pelarut HCl 0,1 N.
Keterangan : puncak 1 muncul pada panjang gelombang 355,8 nm dengan absorbansi 0,286; puncak 2 muncul pada panjang gelombang 270 nm dengan absorbansi 0,403; puncak 3 muncul pada panjang gelombang 219 nm dengan absorbansi 0,302.
Dari Gambar 4, dapat dilihat bahwa serapan maksimum tetrasiklin dalam suasana asam adalah pada panjang gelombang 270 nm. Hal ini sesuai dengan Moffat (2004) yang menyatakan bahwa tetrasiklin mempunyai serapan maksimum pada panjang gelombang 270 nm dalam suasana asam. Selanjutnya untuk penetapan kadar residu tetrasiklin dalam daging ayam pedaging dilakukan pada panjang gelombang tetrasiklin hidroklorida BPFI yang memberikan serapan maksimum yaitu pada 270 nm.
4.2 Penyiapan Larutan Sampel
ayam menggunakan buffer McIlvaine-EDTA. Tertasiklin mampu berikatan dengan protein membentuk konjugat sehingga sukar diekstraksi dari matriks sampel. Selain itu kendala lain dalam ekstraksi tetrasiklin dari sampel daging yaitu pembentukan kelat antara tetrasiklin dengan ion logam yang terkandung dalam matriks. Sehingga untuk ekstraksi sampel dan deproteinasinya biasanya dipakai pelarut yang sedikit asam untuk membebaskan tetrasiklin yang terikat nonkovalen dengan makromolekul tersebut. Untuk itu dipakai buffer McIlvaine-EDTA pH 4, dimana penambahan McIlvaine-EDTA dalam larutan buffer dimaksudkan untuk meningkatkan effisiensi ekstraksi, karena EDTA mampu bersaing dengan tetrasiklin dalam membentuk kelat dengan logam (Botsoglou dan Fletouris, 2001).
step) dengan menggunakan pelarut yang tidak mampu mengelusi analit tetapi mampu memindahkan komponen matriks yang tidak diinginkan. Pelarut yang dipakai pada tahap ini adalah air (Botsoglou dan Fletouris, 2001). Selanjutnya cartridge didiamkan hingga kering (± 5 menit) dan kemudian analit dielusi dengan metanol asam oksalat 0,01 M (acidic methanol). Metanol dalam suasana asam ini dimaksudkan untuk menetralkan gugus silanol yang tersisa pada penjerap, dan memutuskan ikatan hidrogen antara analit dengan gugus hidroksil pada permukaan penjerap (Anonim a, 1998).
4.3 Analisis kuantitatif
Untuk analisis kuantitatif ditentukan dengan spektrofotometri ultraviolet secara adisi standar. Metode adisi standar dipilih karena mampu meminimalkan kesalahan yang disebabkan oleh perbedaan kondisi lingkungan (matriks) sampel dan standar (Anonim b, 2010). Idealnya kalibrasi standar seharusnya mendekati komposisi dari sampel yang dianalisis, tidak hanya pada konsentrasi analit tetapi juga dalam hal konsentrasi dari elemen lain yang ada dalam matriks sampel, sehingga dapat meminimalkan pengaruh dari berbagai komponen dalam sampel terhadap absorbansi yang terukur (Skoog dan West, 1996). Pemanfaatan teknik adisi standar sangat membantu terutama untuk analisa senyawa yang kadarnya kecil (Ramette, 1981).
7,5; 10,0; dan 12,5 µg/ml. Kemudian diukur absorbansinya dan hasilnya diplot pada grafik (seperti terlihat pada Gambar 5).
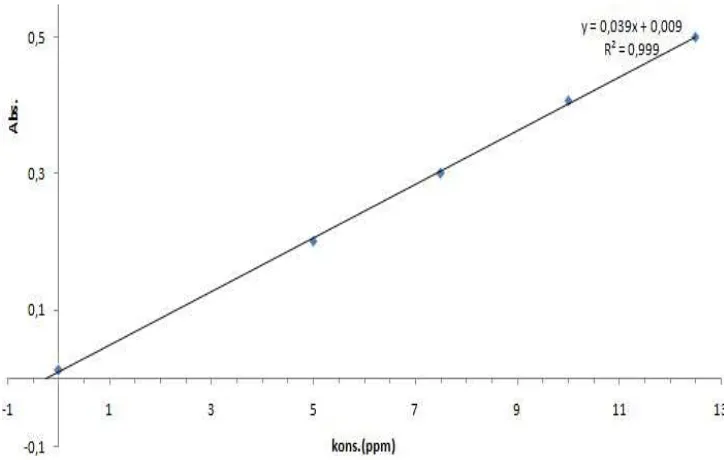
Gambar 5. Grafik Penentuan Konsentrasi Residu Tetrasiklin dalam Larutan Sampel Hypermart dengan Metode Adisi Standar (perulangan I) Pada Gambar 5 di atas, sumbu X merupakan konsentrasi standar yang ditambahkan sementara sumbu Y menunjukkan nilai absorbansinya. Dengan mengekstrapolasikan garis pada sumbu X (titik potong pada sumbu X) atau mensubstitusikan nilai Y = 0 pada persamaan regresi, maka akan diperoleh konsentrasi analit (concentration of unknown) yang terkandung dalam larutan sampel yang diukur (Harris, 1987).
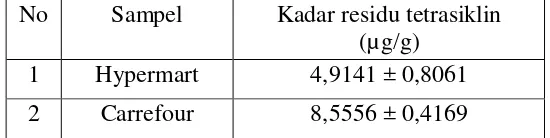
7 halaman 72 sehingga diperoleh kadar residu tetrasiklin pada kedua sampel yang diperlihatkan pada Tabel 1.
Tabel 1. Hasil Penetepan Kadar Residu Tetrasiklin pada Sampel Daging Ayam Pedaging
No Sampel Kadar residu tetrasiklin (µg/g)
1 Hypermart 4,9141 ± 0,8061 2 Carrefour 8,5556 ± 0,4169
Menurut SNI 01-6366-2000, kadar residu antibiotik golongan tetrasiklin dalam daging dan susu tidak boleh melebihi 100 ppb (0,1 µg/g) , sedangkan dari hasil penelitian diperoleh kadar residu tetrasiklin hingga 40 sampai 80 kali lipat dari batas maksimum residu yang diperbolehkan.
Kandungan residu obat yang melewati batas maksimum residu (BMR) yang ditetapkan akan meyebabkan bahan makanan menjadi tidak aman untuk dikonsumsi karena dapat menimbulkan reaksi alergis, keracunan, resistensi mikroba tertentu atau mengakibatkan gangguan fisiologis pada manusia. Kasus gangguan resistensi terhadap bakteri Campylobacter yang berkaitan dengan masalah residu antibiotik bahkan telah dilaporkan di Amerika Serikat (Bahri, dkk., 2005).
4.4 Validasi Metode
Validasi metode juga dilakukan terhadap prosedur yang dikerjakan pada penelitian ini. Tujuan validasi ini adalah untuk menunjukkan bahwa metode yang digunakan telah sesuai dengan maksud yang dikehendaki, serta sebagai suatu persyaratan dasar yang diperlukan untuk menjamin kualitas dan reabilitas hasil dari semua aplikasi analitik (Ermer, 2005). Parameter validasi yang diuji adalah akurasi dan presisi.
Akurasi prosedur ditentukan dengan menggunakan metode penambahan baku (the method of standard additives). Metode ini dilakukan pada sampel Hypermart dan hasilnya dinyatakan dalam persen perolehan kembali (% recovery). Data absorbansi dan grafik hasil perolehan kembali dapat dilihat pada Lampiran 8 halaman 76, sedangkan contoh perhitungan persen perolehan kembali dapat dilihat pada Lampiran 10 halaman 85. Data hasil pengujian akurasi (dengan 3 kali perulangan) dapat dilihat pada Tabel 2.
Tabel 2. Data Uji Validasi dengan Metode Penambahan Baku Rerata kadar
Keterangan : data merupakan hasil dari 3 kali perulangan.
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
Metode spektrofotometri ultraviolet secara adisi standar dapat digunakan pada penetapan kadar residu tetrasiklin dalam daging ayam pedaging karena memenuhi uji validasi, dimana metode ini menunjukkan kecermatan dan keseksamaan yang baik dengan persen perolehan kembali 103,8225% dan RSD 0,6143%.
Dari hasil penelitian diperoleh kadar residu tetrasiklin dalam sampel Hypermart dan Carrefour berturut – turut adalah 4,9141 µg/g dan 8,5556 µg/g. Kadar residu tetrasiklin dalam kedua sampel yang diuji melebihi BMR menurut SNI 01-6366-2000 y aitu 100 ppb (0,1 µg/g).
5.2. Saran
DAFTAR PUSTAKA
Anonim a. (1988). Guide to Solid Phase Extraction. [diakses 19 Januari 2011]; [12 screen].
http://www.sigmaaldrich.com/Graphics/Supelco/objects/4600/4538.pdf Anonim b. (2010). Makalah AAS. [diakses 24 Mei 2011]; [21 screen].
http://www.scribd.com/doc/39329390/Makalah-AAS
Anonim c. (2005). Solid-Phase Extraction. [diakses 31 Oktober 2011]; [45 screen].
http://www.odn.slupsk.pl/SPE_introduction_by_HG_in_English.ppt
Bahri, S., Masbulan, E., dan Kusumaningsih, A. (2005). Proses Praproduksi sebagai Faktor Penting dalam Menghasilkan Produk Ternak yang Aman untuk Manusia. Jurnal Litbang Pertanian 24(I): 27-33.
Bahri, S. (2008). Beberapa Aspek Keamanan Pangan Asal Ternak di Indonesia. Pengembangan Inovasi Pertanian 1(III): 225-242.
Botsoglou, N.A. dan Fletouris, D.J. (2001). Drug Residues in Foods pharmacology, Food Safety, and Analysis. New York: Marcel Dekker, Inc.: 985-987, 582-586.
Budavari, S. (2001). The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals. 13th ed. Whitehouse: Merck & Co., Inc.: 1641.
Ditjen POM. (1979). Farmakope Indonesia Edisi ke III. Jakarta: Departemen Kesehatan RI: 595-596.
Ditjen POM. (1995). Farmakope Indonesia Edisi ke IV. Jakarta: Departemen Kesehatan RI: 781-782, 1061.
Ermer, J. (2004). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA: 3-6.
Gandjar, I. G. dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan ke IV. Yogyakarta: Pustaka Pelajar: 229-231, 252-254.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian 1(III): 117-135.
Harris, D. C. (1987). Quantitative Chemical Analysis. 2nd ed. New York : W. H. Freeman and Company: 585-586.
Laboratory Quality Assurance Division. (2007). Qualitative Identification of Tetracyclines. USA: United States Department of Agriculture Food Safety and Inspection Service, Office of Public Health Science: 1-9.
Lastari, P., Kristyanto, E.H., Pracoyo, N.I. (1987). Analisa Residu Tetrasiklin dalam Ayam Broiler. Cermin Dunia Kedokteran 46: 28-30.
Moffat, A. C. (2004). Clarke’s Isolation and Identification of Drugs. 3rd ed. London: The Pharmaceutics Press.
Munson, J. W. (1991). Analisis Farmasi Metode Modern. Penerjemah: Parwa Harjana B. Surabaya: Airlangga University Press: 334.
Muriuki, F.K., Ogara, W.O., Njeruh, F.M. dan Mitema, E.S. (2001). Tetracycline Residue Levels in Cattle Meat from Nairobi Salughter House in Kenya. Journal of veterinary Science 2 (II): 97-101.
Ramette, R.W. (1981). Chemical Equilibrium and Analysis. London: Addison-Wesley Publishing Company: 74.
Satiadarma, K., dkk. (2004). Asas Pengembangan Prosedur Analisis. Edisi ke I. Cetakan Pertama. Surabaya: Airlangga University Press: 87, 90-91, 378-388.
Sjofjan, O. (2011). Aspek Keamanan Pakan untuk Menghasilkan Kualitas Produk Peternakan yang Aman. [diakses 26 November 2011].
http://www.disnak-jatim.go.id
Skoog, D.A., West, D.M. dan Holler, F.J. (1996). Fundamental of Analytical Chemistry. 7th ed. New York: Saunders College Publishing: 572-574. Soeparno. (1998). Ilmu dan Teknologi Daging. Cetakan ke III. Yogyakarta:
gadjah mada university press: 113-114.
Subronto. (2001). Ilmu Penyakit Ternak II. Cetakan pertama. Yogyakarta : Gadjah Mada University Press. 257- 259, 315- 321.
Lampiran 1. Perhitungan Konsentrasi Pengukuran pada Pemilihan Panjang gelombang
Diketahui nilai A11 = 417a (Moffat, 2004)
A = A11.b.c (g/100ml)
0,4343 = 417.1.c
C = g/100ml
= 1,0141 × 10-3 g/100ml = 1,0141 × 10-3 × 104 µg/ml = 10,141 µg/ml
Lampiran 2. Data Absorbansi dan Grafik Penentuan Konsentrasi Residu Tetrasiklin dalam Larutan Sampel Daging Hypermart dengan Metode Adisi Standar
Lampiran 2. (lanjutan) Pengulangan VI
Lampiran 3. Perhitungan Persamaan Regresi dan Penetapan Kadar Residu Tetrasiklin dalam Sampel Daging Hypermart
Pengulangan I
= 0,0393
b =
= 0,2848 – (0,0393)×7 = 0,0099
Sehingga diperoleh persamaan garis regresi
Y = 0,0393X + 0,0099
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 3. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0393X + 0,0099 Ketika Y = 0
Maka X (Cs) = (0 – 0,0099) ∕ 0,0393 = − 0,2519 µg/ml Cx = − (− 0,2519 µg/ml)
= 0,2519 µg/ml
Kadar analit dalam sampel adalah (X1)
=
=
= 3,9267 µg/g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 3. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0395X + 0,0114
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 3. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0395X + 0,0114 Ketika Y = 0
Maka X (Cs) = (0 – 0,0114) ∕ 0,0395 = − 0,2886 µg/ml Cx = − (−0,2886 µg/ml)
= 0,2886 µg/ml
Kadar analit dalam sampel adalah (X2)
=
=
= 4,4985 µg/g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 3. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0387X + 0,0154
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 3. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0387X + 0,0154 Ketika Y = 0
Maka X (Cs) = (0 – 0,0154) ∕ 0,0387 = − 0,3979 µg/ml Cx = − (−0,3979 µg/ml)
= 0,3979 µg/ml
Kadar analit dalam sampel adalah (X3)
=
=
= 6,1748 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 3. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0393X + 0,0119
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 3. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0393X + 0,0119 Ketika Y = 0
Maka X (Cs) = (0 – 0,0119) ∕ 0,0393 = − 0,3028 µg/ml Cx = − (−0,3028 µg/ml)
= 0,3028 µg/ml
Kadar analit dalam sampel adalah (X4)
=
=
= 4,7084 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 3. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0393X + 0,0143
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
--
Lampiran 3. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0393X + 0,0143 Ketika Y = 0
Maka X (Cs) = (0 – 0,0143) ∕ 0,0393 = − 0,3639 µg/ml Cx = − (−0,3639 µg/ml)
= 0,3639 µg/ml
Kadar analit dalam sampel adalah (X5)
=
=
= 5,6508 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 3. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0395X + 0,0122
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
--
Lampiran 3. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0395X + 0,0122 Ketika Y = 0
Maka X (Cs) = (0 – 0,0122) ∕ 0,0395 = − 0,3089 µg/ml Cx = − (−0,3089 µg/ml)
= 0,3089 µg/ml
Kadar analit dalam sampel adalah (X6)
=
=
= 4,7988 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 4. Analisis Data secara Statistik dari Hasil Penetapan Kadar Residu Tetrasiklin dalam Sampel Daging Hypermart
No. Xi (µg/g) Xi − (Xi − )2
Lampiran 4. (lanjutan)
thitung data 6 = −0,1609 × = −0,4835
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data 1 dan 3.
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 – 1 diperoleh nilai
Lampiran 4. (lanjutan)
thitung data 4 = −0,1153 × = −0,4550
(semua data diterima)
Kadar residu tetrasiklin = ± (ttabel × SD ∕ )
Lampiran 5. Data Absorbansi dan Grafik Penentuan Konsentrasi Residu Tetrasiklin dalam Larutan Sampel Daging Carefour dengan Metode Adisi Standar
Lampiran 5. (lanjutan) Pengulangan VI
Lampiran 6. Perhitungan Persamaan Regresi dan Penetapan Kadar Residu Tetrasiklin dalam Sampel Daging Carefour
Pengulangan I
= 0,0366
b =
= 0,2764 – (0,0366)×7 =0,0204
Sehingga diperoleh persamaan garis regresi
Y = 0,0366X + 0,0204
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 6. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0366X + 0,0204 Ketika Y = 0
Maka X (Cs) = (0 – 0,0204) ∕ 0,0366 = − 0,5564 µg/ml Cx = − (−0,5564 µg/ml)
= 0,5564 µg/ml
Kadar analit dalam sampel adalah (X1)
=
=
= 8,6448 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 6. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0365X + 0,0192
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 6. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0365X + 0,0192 Ketika Y = 0
Maka X (Cs) = (0 – 0,0192) ∕ 0,0365 = − 0,5259 µg/ml Cx = − (−0,5259 µg/ml)
= 0,5259 µg/ml
Kadar analit dalam sampel adalah (X2)
=
=
= 8,1842 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 6. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0379X + 0,0161
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 6. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0379X + 0,0161 Ketika Y = 0
Maka X (Cs) = (0 – 0,0161) ∕ 0,0379 = − 0,4243 µg/ml Cx = − (−0,4243 µg/ml)
= 0,4243 µg/ml
Kadar analit dalam sampel adalah (X3)
=
=
= 6,6144 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 6. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0368X + 0,0095
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
-Lampiran 6. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0368X + 0,0095 Ketika Y = 0
Maka X (Cs) = (0 – 0,0095) ∕ 0,0368 = − 0,2577 µg/ml Cx = − (−0,2577 µg/ml)
= 0,2577 µg/ml
Kadar analit dalam sampel adalah (X4)
=
=
= 4,0218 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 6. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0364X + 0,0206
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
-Lampiran 6. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0364X + 0,0206 Ketika Y = 0
Maka X (Cs) = (0 – 0,0206) ∕ 0,0364 = − 0,5669 µg/ml Cx = − (−0,5669 µg/ml)
= 0,5669 µg/ml
Kadar analit dalam sampel adalah (X5)
=
=
= 8,7979 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 6. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0364X + 0,0201
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
-Lampiran 6. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0364X + 0,0201 Ketika Y = 0
Maka X (Cs) = (0 – 0,0201) ∕ 0,0364 = − 0,5526 µg/ml Cx = − (−0,5526 µg/ml)
= 0,5526 µg/ml
Kadar analit dalam sampel adalah (X6)
=
=
= 8,5954 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 7. Analisis Data secara Statistik dari Hasil Penetapan Kadar Residu Tetrasiklin dalam Sampel Daging Carefour
No. Xi (µg/g) Xi − (Xi − )2
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 6 – 1 diperoleh nilai
Lampiran 7. (lanjutan)
thitung data 6 = 1,119 × = 1,4634
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data 4.
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 5 – 1 diperoleh nilai
Lampiran 7. (lanjutan)
thitung data 4 = 0,6306 × = 1,5713
thitung data 5 = 0,4281 × = 1,0667
Untuk itu dihitung kembali dengan cara yang sama tanpa mengikutsertakan data 3.
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 4 – 1 diperoleh nilai
ttabel = 3,18. Data diterima bila − ttabel < thitung < ttabel.
thitung =
-thitung data 1 = 0,0892 × = 0,6805
Lampiran 7. (lanjutan)
thitung data 3 = 0,2423 × = 1,8485
thitung data 4 = 0,0398 × = 0,3036
(semua data diterima)
Kadar residu tetrasiklin = ± (ttabel × SD ∕ )
Lampiran 8. Data Absorbansi dan Grafik Penentuan Konsentrasi Residu Tetrasiklin pada Uji Perolehan Kembali Tetrasiklin Baku yang Ditambahkan pada Sampel Daging Hypermart dengan Metode Adisi Standar
Lampiran 8. (Lanjutan) Pengulangan III
Lampiran 9. Perhitungan Persamaan Regresi Hasil Perolehan Kembali Tetrasiklin Baku yang Ditambahkan pada Sampel Daging Hypermart
Sehingga diperoleh persamaan garis regresi
Y = 0,0399X + 0,0257
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
-Lampiran 9. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0399X + 0,0257 Ketika Y = 0
Maka X (Cs) = (0 – 0,0257) ∕ 0,0399 = − 0,6445 µg/ml Cx = − (−0,6445 µg/ml)
= 0,6445 µg/ml
Kadar analit dalam sampel yang telah ditambahkan tetrasiklin baku adalah (X1)
=
=
= 10,0685 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 9. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0397X + 0,0258
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
-Lampiran 9. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0397X + 0,0258 Ketika Y = 0
Maka X (Cs) = (0 – 0,0258) ∕ 0,0397 = − 0,6498 µg/ml Cx = − (−0,6498 µg/ml)
= 0,6498 µg/ml
Kadar analit dalam sampel yang telah ditambahkan tetrasiklin baku adalah (X2)
=
=
= 10,1320 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 9. (lanjutan)
Sehingga diperoleh persamaan garis regresi
Y = 0,0400X + 0,0259
Untuk mencari hubungan linier antara konsentrasi (X) dengan absorbansi (Y) maka dihitung koefisien korelasi (r) sebagai berikut
r =
--
-=
-Lampiran 9. (lanjutan)
Menurut metode adisi standar Cx = −Cs, ketika Absorbansi (Y) = 0 Berdasarkan persamaan regresi yang diperoleh
Y = 0,0400X + 0,0259 Ketika Y = 0
Maka X (Cs) = (0 – 0,0259) ∕ 0,0400 = − 0,6472 µg/ml Cx = − (−0,6472 µg/ml)
= 0,6472 µg/ml
Kadar analit dalam sampel yang telah ditambahkan tetrasiklin baku adalah (X3)
=
=
= 10,1052 µg∕g Keterangan :
Cx = konsentrasi analit dalam larutan yang diukur Cs = konsentrasi larutan standar
Lampiran 10. Contoh Perhitungan Persen Perolehan Kembali
Rumus : % Perolehan Kembali = - × 100%
Keterangan:
CF = kadar analit yang diperoleh setelah penambahan tetrasiklin baku
CA = kadar analit sebelum penambahan tetrasiklin baku
C*A = kadar tetrasiklin baku yang ditambahkan
Rerata kadar tetrasiklin dalam sampel A = 4,9141 μg/g.
Kadar analit yang diperoleh setelah penambahan tetrasiklin baku misalkan pada data 1 adalah CF = 10,0685 μg/g.
Kadar analit yang ditambahkan adalah C*A = 5 μg/g.
Maka persen perolehan kembali adalah
% Perolehan Kembali = - × 100%
= - × 100%
Lampiran 11. Analisis Data secara Statistik dari Hasil Perolehan Kembali Tetrasiklin Baku yang Ditambahkan pada Sampel Daging Hypermart
Pada interval kepercayaan 95% dengan nilai α = 0,05, dk = 3 – 1 diperoleh nilai
Lampiran 12. Gambar Instrumen Spektrofotometer dan Cartridge SPE C18
Seperangkat instrumen spektrofotometer (Shimadzu UV- Vis 1800) dan komputer sebagai perangkat pendukung.
Lampiran 13. Gambar Alat Pendukung Lainnya
Neraca analitik (Boeco)
Lampiran 13. (lanjutan)
Vortex (Boeco)