TERHADAP LAYU FUSARIUM
RULLY DYAH PURWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ii
Saya menyatakan dengan sebenar-benarnya bahwa disertasi saya berjudul “Variasi Somaklonal dan Seleksi In Vitro Abaka (Musa textilis Nee) untuk Ketahanan terhadap Layu Fusarium” adalah benar-benar asli karya saya dengan arahan komisi pembimbing, dan bukan hasil jiplakan atau tiruan dari tulisan siapapun serta belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun.
Bogor, Januari 2007
Rully Dyah Purwati
iii
(Musa textilis Nee.) untuk Ketahanan terhadap Layu Fusarium. Dibimbing oleh EDI GUHARDJA, SAID HARRAN, SUDARSONO dan SUDJINDRO.
Kendala utama yang dihadapi dalam pengembangan abaka di daerah tropis adalah adanya serangan penyakit layu yang disebabkan oleh jamur Fusarium oxysporum Schlecht.f.sp. cubense (E.F. Smith) Snyd & Hans dan dilaporkan telah menimbulkan kerusakan antara 5-65% dari pertanaman abaka di lapangan. Sejauh ini, penggunaan kultivar abaka yang resisten merupakan metode alternatif pengendalian F. oxysporum f.sp. cubense (Foc) yang efektif. Perakitan kultivar abaka resisten terhadap penyakit tersebut melalui hibridisasi atau seleksi sulit dilakukan karena sempit nya keragaman genetika. Pendekatan induksi keragaman genetika dengan menggunakan kombinasi perlakuan mutagenesis dan perbanyakan tanaman secara in vitro yang dilanjutkan dengan seleksi in vitro
merupakan metode yang efisien untuk memperoleh kultivar abaka resisten terhadap penyakit layu Fusarium.
Penggunaan mutagen EMS yang dikombinasikan dengan kultur in vitro
meningkatkan tipe varian somaklonal diantara bibit abaka yang diregenerasikan dari kalus embriogen. Keberadaan sejumlah fenotipe varian diantara bibit abaka hasil perlakuan EMS pada kalus embriogen mengindikasikan meningkatnya keragaman genetika bibit abaka. Dengan demikian, terbuka peluang penggunaan metode tersebut untuk mendapatkan karakter unggul tertentu seperti produktivitas dan kualitas serat tinggi, atau resistensi terhadap layu Fusarium, meskipun kebanyakan varian yang didapat bersifat negatif. Untuk itu perlu didukung dengan teknik seleksi in vitro menggunakan agens penyeleksi filtrat kultur (FK) Foc atau asam fusarat (AF).
Dari hasil pengembangan teknik seleksi in vitro terhadap kalus embriogen abaka, dapat dibuktikan bahwa FK dari tiga isolat Foc dan toksin asam fusarat (AF) mampu menghambat proliferasi kalus embriogen dan tunas abaka. Seleksi in
vitro dengan mengkulturkan kalus embriogen abaka yang sebelumnya diberi
perlakuan 0.6% EMS dalam media selektif dengan penambahan 40% FK Foc
isolat Banyuwangi atau 50 mg/l AF, diperoleh klon-klon varian abaka yang insensitif FK Foc sebanyak 326 tunas dari klon Tangongon dan 176 tunas dari klon Sangihe-1. Dari kalus embriogen abaka hasil seleksi in vitro dengan AF diperoleh tunas yang insensitif terhadap AF sebanyak 85 tunas varian abaka klon Tangongon dan 28 tunas varian klon Sangihe-1. Setelah tahapan aklimatisasi, pembibitan, dan evaluasi respon terhadap inokulasi Foc berhasil diperoleh 8 bibit untuk abaka klon Tangongon dan 8 bibit untuk abaka klon Sangihe-1 yang meningkat resistensinya terhadap infeksi Foc isolat Banyuwangi.
Kata kunci: Keragaman somaklonal, seleksi in vitro, abaka, Fusarium oxysporum
iv
Abaca (Musa textilis Nee) to Resistance against Fusarium Wilt. Supervised by EDI GUHARDJA, SAID HARRAN, SUDARSONO, and SUDJINDRO.
Cultivation of abaca (Musa textilis Nee) in Indonesia is hampered by
Fusarium wilt (Panama disease) due to infection of Fusarium oxysporum Schlecht f.sp. cubense (E.F. Smith) Snyd & Hans (Foc) and caused reduction of abaca fibre yield by as much as 5-65% in comercial abaca cultivation. The use of resistance Fusarium wilt abaca clones is the most efective method for overcoming the problem. However, development of F. oxysporum f.sp cubense (Foc) resistance abaca genotypes requires the availability of a wide abaca genetic variability. Induction of genetic variability through mutagenesis in combination with in vitro
selection may be the most efficient method for developing the Foc resistant abaca clones.
The use of EMS mutagen combined with in vitro culture improves type of somaclonal variants in abaca plantlets regenerated from embryogenic calli. The existence of somaclonal variants among regenerated abaca plantlet indicate the increased genetic variability of abaca; therefore, open the possibility of using embryogenic calli treated with EMS to obtain desirable mutant such as fiber productivity and quality, or Fusarium wilt resistance, even though most of variants have negative characters. For this reason, the use of in vitro selection using culture filtrates (CF) of Foc or fusaric acid is required.
Culture filtrates of three Foc isolates and toxin fusaric acid (FA) inhibited proliferation of embriogenic calli and shoots of abaca. Following treatment by 0.6% EMS of abaca embriogenic calli, and cultured in selection medium containing 40% CF Foc isolate Banyuwangi or 50 mg/l FA, resulted in 326 shoots of abaca variants insensitive to Foc CF from clone Tangongon and 176 shoots from clone Sangihe-1. Meanwhile 85 shoots insensitive to FA of abaca variants clone Tangongon and 28 shoots of clone Sangihe-1 were resulted from in vitro
selection using FA as selective agents. Following acclimatization and evaluation of responses to Foc inoculation resulted in 8 plantlets from clone Tangongon and 8 plantlets from clone Sangihe-1 with increase in resistance to Foc infection isolate Banyuwangi.
Keywords: somaclonal variation, in vitro selection, abaca, Fusarium oxysporum
v
© Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
vi
TERHADAP LAYU FUSARIUM
Rully Dyah Purwati
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
vii
NRP : G426010071
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Edi Guhardja, MSc Dr. Ir. Said Harran, MSc
Ketua Anggota
Prof. Dr. Ir. Sudarsono, MSc Dr. Ir. Sudjindro, MS
Anggota Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S, DEA Prof. Dr. Ir. Khairil A. Notodiputro, MS
viii
sehingga disertasi ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Mei 2003 hingga Agustus 2006 berjudul: Variasi somaklonal dan seleksi in
vitro abaka (Musa textilis Nee) untuk ketahanan terhadap layu Fusarium.
Pemilihan judul tersebut bertujuan untuk memperoleh klon unggul baru abaka yang memiliki produktivitas dan kualitas serat tinggi, serta tahan terhadap penyakit layu fusarium. Penulisan disertasi ini bertujuan untuk memperoleh gelar doktor pada Program Studi Biologi.
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Ir. Edi Guhardja, M.Sc selaku ketua komisi pembimbing, Bapak Dr. Ir. Said Harran, M.Sc, Bapak Prof. Dr. Ir. Sudarsono, M. Sc dan Bapak Dr. Ir. Sudjindro, MS selaku anggota komisi pembimbing, yang telah banyak memberikan saran dan bimbingan. Penulis juga menyampaikan terima kasih kepada Kepala Badan Penelitian dan Pengembangan Pertanian (Jakarta), Kepala Puslit Pengembangan Tanaman Perkebunan (Bogor), dan Kepala Balai Penelitian Tanaman Tembakau dan Serat (Malang) yang telah memberikan kesempatan dan izin studi untuk mengikuti program doktor (S3) pada sekolah Pascasarjana IPB. Berikutnya penulis menyampaikan terima kasih kepada Pemimpin Proyek Pengkajian Teknologi Pertanian Partisipatif (PAATP) yang telah memberikan dana studi S3. Terima kasih juga penulis sampaikan kepada Ibu Dr. Ika Mariska (APU) dari Balai Besar Bioteknologi dan Sumber Daya Genetik (Bogor) atas pemberian saran-saran dan kultur abaka klon Tangongon sebagai bahan penelitian. Tak lupa kepada seluruh rekan-rekan di Balittas, Malang yang telah membantu baik moril maup un materiil, penulis menyampaikan terima kasih. Kepada rekan-rekan di program studi Biologi dan Agronomi yang telah berteman, bersahabat dan berdiskusi selama studi di IPB, penulis menyampaikan terima kasih. Terima kasih yang tak terhingga penulis sampaikan kepada sdri. Aris Farida yang telah setia membantu dalam pelaksanaan penelitian. Ungkapan terima kasih juga disampaikan kepada suami dan anak-anak, serta seluruh keluarga yang telah memberikan do’a, semangat dan kasih sayangnya. Kepada semua pihak yang telah memberikan bantuan selama penelitian dan penyusunan disertasi, penulis menyampaikan terima kasih.
Semoga disertasi ini bermanfaat bagi yang membutuhkan.
Bogor, Januari 2007
ix
empat dari pasangan R.M. Soerjopoetro dan R.Ngt. Soekapti. Pendidikan sarjana ditempuh di Departemen Agronomi, jurusan Pemuliaan Tanaman, Fakultas Pertanian Universitas Gadjah Mada, Jogjakarta, lulus pada tahun 1983. Pendidikan S2 jurusan Bioteknologi Pertanian ditempuh pada tahun 1994-1996 di Murdoch University, Perth, Australia dengan gelar Master of Philosophy yang diperoleh tahun 1998. Beasiswa untuk pendidikan S2 berasal dari pemerintah Australia (Ausaid).Tahun 2001 penulis mendapat kesempatan untuk melanjutkan ke program doktor pada program studi Biologi, sekolah Pascasarjana IPB, dengan beasiswa yang diperoleh dari Proyek PAATP Badan LITBANG Pertanian.
Sejak bulan Maret 1984 penulis bekerja sebagai tenaga honorer, terhitung mulai April 1985 diangkat menjadi Pegawai Negeri Sipil di Balai Penelitian Tanaman Tembakau dan Serat (Balittas). Sejumlah tugas yang pernah diembannya antara lain: Ketua Kelompok Peneliti Pemuliaan Balittas (1989-1992); Focal Point Scientist of IJO (International Jute Organisation) Germplasm Project (1989-1993); National Project Coordinator of IJO Project on Application of Biotechnology in the Improvement of Jute, Kenaf and Allied Fibres Phase II (1998-2000).
x
DAFTAR TABEL.……….. xiv
DAFTAR GAMBAR ………... xvii
DAFTAR LAMPIRAN... xxi
BAB I PENDAHULUAN ………... 1
LATAR BELAKANG ………. 1
PENDEKATAN MASALAH ……….. 4
TUJUAN PENELITIAN ……….. 6
MANFAAT PENELITIAN………... 7
GARIS BESAR DISERTASI ……….. 7
BAB II TINJAUAN PUSTAKA………... 14
TANAMAN ABAKA ………... 14
1 Biologi dan manfaatnya ………... 14
2 Asal dan penyebarannya ……….... 14
3 Plasma nutfah dan pemuliaannya………... 15
PENYAKIT LAYU FUSARIUM………. 16
1 Gejala yang ditimbulkan ……….. .... 17
2 Respon tanaman terhadap penyakit layu Fusarium ... 18
3 Metabolit yang terdapat dalam ekstrak F. oxysporum.... 18
4 Asam Fusarat dan gejala yang ditimbulkannya ……... 19
KULTUR JARINGAN ABAKA ………. 20
MUTASI DAN KERAGAMAN SOMAKLONAL……….. 21
SELEKSI IN VITRO………. 23
BAB III METODE INOKULASI DAN KERAPATAN KONIDIUM Fusarium oxysporum f.sp. cubense UNTUK MENGINFEKSI ABAKA…………... 25
ABSTRAK ………... 25
ABSTRACT ………... 26
PENDAHULUAN ………... 26
BAHAN DAN METODE ……….... 27
Isolat F. oxysporum f.sp cubense dan Bahan Tanaman... 27
Efektivitas Metode Inokulasi……….... 28 Pengaruh Kerapatan Konidia Foc terhadap Intensitas
Penyakit…...
xi
HASIL ………... 31
Efektivitas Metode Inokulasi……….. ………... 31
Pengaruh Kerapatan Konidia Foc………... 31
Respon 10 klon abaka terhadap infeksi Foc………... 33
PEMBAHASAN ………... 33
SIMPULAN ………... 37
DAFTAR PUSTAKA... 39
BAB IV INDUKSI MUTAN SOMAKLONAL DENGAN PER-LAKUAN EMS PADA KULTUR KALUS EMBRIOGEN ABAKA (Musa textilis Nee)…... 41
ABSTRAK ………... 41
ABSTRACT ………... 42
PENDAHULUAN ………... 42
BAHAN DAN METODE ……….... 43
Induksi dan proliferasi kalus embriogen abaka……..…….. 43
Daya hambat EMS terhadap proliferasi kalus embriogen.... 44
Keragaman fenotipik bibit abaka akibat perlakuan EMS... 44
HASIL ……….. 45
Induksi dan proliferasi kalus embriogen abaka…...……... 45
Daya hambat EMS terhadap proliferasi kalus embriogen.... 45
Keragaman fenotipik bibit abaka akibat perlakuan EMS... 46
PEMBAHASAN ……….. 49
SIMPULAN ………... 51
DAFTAR PUSTAKA... 55
BAB V KERAGAAN DI LAPANGAN DARI KLON VARIAN ABAKA YANG DIINDUKSI DENGAN ETHYL METHANESULPHONATE (EMS) ……….... 57
ABSTRAK ………... 57
ABSTRACT ………... 58
PENDAHULUAN ………... 58
BAHAN DAN METODE ……….... 59
Induksi varian dengan EMS dan regenerasi tanaman …... 59
Penanaman bibit abaka varian di lapangan ………... 60
Karakter kualitatif tanaman di lapangan….………... 60
Karakter kuantitatif tanaman di lapangan….………... 61
HASIL ……….. 61
xii
DAFTAR PUSTAKA... 71
BAB VI SELEKSI IN VITRO UNTUK RESISTENSI ABAKA TERHADAP F. oxysporum f.sp. cubense MENG-GUNAKAN FILTRAT KULTUR SEBAGAI AGENS PENYELEKSI……... 73
ABSTRAK ………... 73
ABSTRACT ………... 74
PENDAHULUAN ………... 74
BAHAN DAN METODE ……….... 75
Penyiapan FK Foc ……….... 75
Daya hambat FK tiga isolat Foc……..………... 76
Seleksi in vitro dengan FK Foc………..…….. 76
Regenerasi dan Evaluasi Tunas Varian Hasil Seleksi in vitro... 77 HASIL ……….. 78
Daya hambat FK tiga isolat Foc……… ……….. 78
Seleksi in vitro dengan FK Foc……….... 79
Evaluasi Tunas Varian Hasil Seleksi in vitro………... 80
PEMBAHASAN ……….. 81
SIMPULAN ………... 83
DAFTAR PUSTAKA... 85
BAB VII SELEKSI IN VITRO UNTUK RESISTENSI ABAKA TERHADAP F. oxysporum f.sp. cubense MENG-GUNAKAN ASAM FUSARAT SEBAGAI AGENS PENYELEKSI………... 88
ABSTRAK ………... 88
ABSTRACT ………... 89
PENDAHULUAN ………... 89
BAHAN DAN METODE ……….... 91
Daya hambat AF ……….. 91
Peningkatan keragaman abaka dengan EMS ………... 92
Seleksi in vitro dengan AF ………... 92
Evaluasi Tunas Varian Hasil Seleksi in vitro………... 93
HASIL ……….. 93
Daya hambat AF ……….. 93
Seleksi in vitro dengan AF ………... 95
xiii
BAB VIII RESISTENSI KLON ABAKA VARIAN SOMAKLONAL
TERHADAP INFEKSI F. oxysporum f.sp cubense ... 104
ABSTRAK ………... 104
ABSTRACT ………... 105
PENDAHULUAN ………... 105
BAHAN DAN METODE ……….... 107
Populasi bibit abaka ………... 107
Inokulasi bibit abaka dengan Foc Bw………... 107
HASIL ……….. 108
Populasi bibit abaka……….. 108
Respon individu bibit terhadap Foc BW……….. 110
Pengaruh panjang akar dan tinggi bibit awal terhadap resistensi... 112 Perbedaan respon klon yang berasal dari satu eksplan ….... 112
PEMBAHASAN ……….. 113
SIMPULAN ………... 115
DAFTAR PUSTAKA... 118
BAB IX PEMBAHASAN UMUM ……….... 120
BAB X SIMPULAN DAN SARAN ………... 127
SIMPULAN... 127
SARAN... 129
DAFTAR PUSTAKA………... 131
xiv
1 Pengaruh metode inokulasi F. oxysporum f.sp. cubense
isolat Banyuwangi (Bw), Bojonegoro (Bn) atau Malang (Ml) terhadap persentase tanaman bergejala, rataan skor gejala kelayuan dan intensitas penyakit pada bibit abaka klon Tangongon, pada 30 hari sesudah inokulasi.
32
2 Pengaruh kerapatan konidia F. oxysporum f.sp. cubense
isolat Banyuwangi yang digunakan untuk menginokulasi bibit abaka klon Tangongon (Tg), Sangihe-1 (Sh), atau UB-3 (Ub) terhadap persentase bibit bergejala, rataan skor gejala kelayuan (SGK), dan intensitas penyakit (IP).
32
3 Pengaruh kerapatan konidia F. oxysporum f.sp. cubense
isolat Banyuwangi yang digunakan untuk menginokulasi bibit abaka klon Tangongon (Tg), Sangihe-1 (Sh), atau UB-3 (Ub) abaka klon Tangongon (Tg), Sangihe-1 (Sh), atau UB-3 (Ub) terhadap persentase bibit bergejala, rataan skor gejala nekrosis(SGN) pada bonggol bibit, dan intensitas penyakit (IP), pada 60 hari sesudah inokulasi.
33
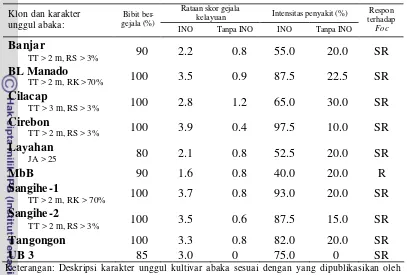
4 Respons 10 klon abaka terhadap infeksi Fusarium oxysporum f.sp. Cubense isolat Banyuwangi. Pengamatan dilakukan pada 60 hari sesudah inokulasi.
34
5 Pengaruh perlakuan berbagai konsentrasi larutan mutagen EMS pada eksplan kalus embriogen abaka klon Tangongon dan Sangihe-1 terhadap persentase eksplan bertunas, jumlah tunas per eksplan, dan penurunan jumlah total tunas. Pengamatan dilakukan 5 bulan setelah perlakuan EMS.
46
6 Tipe dan persentase keragaman karakter kualitatif diantara populasi bibit abaka klon Tangongon dan Sangihe-1 varian yang diregenerasikan dari kalus embriogen setelah diberi perlakuan berbagai konsentrasi EMS pada 3 bulan setelah aklimatisasi.
47
7 Rataan berbagai karakter kuantitatif pada populasi bibit abaka klon Tangongon dan Sangihe-1 varian yang diregenerasikan dari kalus embriogen setelah diberi perlakuan berbagai konsentrasi EMS pada 3 bulan setelah aklimatisasi.
xv
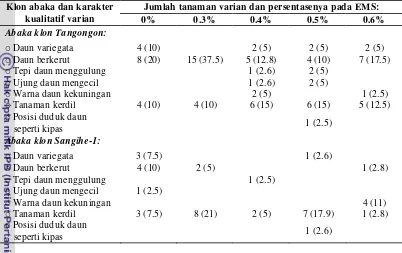
8 Tipe karakter kualitatif varian dan frekuensinya diantara populasi abaka klon Tangongon dan Sangihe-1 yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS. Pengamatan dilakukan di lapangan hingga 16 bulan.
62
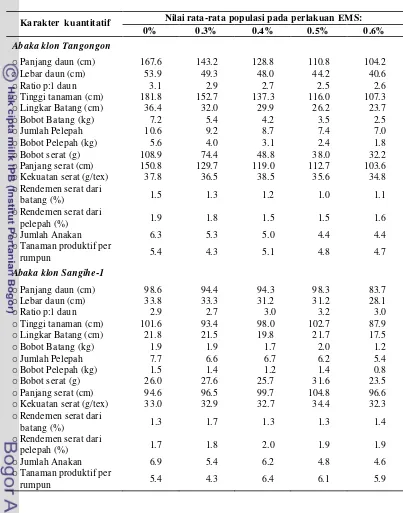
9 Rataan karakter kuantitatif tanaman pada populasi abaka klon Tangongon dan Sangihe-1 yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS. Pengamatan dilakukan di lapangan hingga 16 bulan.
63
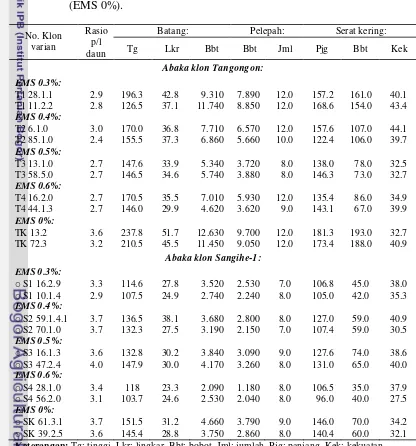
10 Karakter kuantitatif tanaman abaka klon Tangongon dan Sangihe-1 varian dengan hasil serat per tanaman tertinggi untuk masing- masing perlakuan EMS 0.3%, 0.4%, 0.5% dan 0.6% dan perlakuan standar (EMS 0%).
65
11 Daya hambat filtrat kultur Fusarium oxysporum f.sp.
cubense (Foc isolat Banyuwangi [Bw], Malang [Ml],
Bojonegoro [Bn]) terhadap pertumbuhan tunas abaka klon Tangongon dan Sangihe-1. Pengamatan dilakukan 3 bulan setelah penanaman tunas abaka dalam media selektif.
79
12 Hasil seleksi in vitro kalus embriogen abaka yang telah diberi perlakuan EMS dalam filtrat kultur (FK) Fusarium
oxysporum f.sp. cubense isolat Banyuwangi dengan
konsentrasi 40% v/v (sub- letal), pada 6 bulan setelah tanam.
80
13 Persentase daun bergejala (DB), rataan skor gejala kerusakan (SGK), intensitas penyakit (IP), dan ketahanan klon varian abaka klon Tangongon (Tg) dan Sangihe-1 (Sh) hasil seleksi in vitro dalam media dengan penambahan filtrat kultur Fusarium oxysporum f. sp. cubense (Foc) isolat Banyuwangi, yang ditentukan berdasarkan hasil uji inokulasi daun dengan Foc isolat Banyuwangi dengan teknik detached leaf dual cultures.
81
14 Persentase kalus bertunas, jumlah tunas per eksplan, total tunas dan persentase penurunan tunas abaka klon Tangongon (Tg) dan Sangihe-1 (Sh) yang dipanen setelah ditanam dalam media selektif dengan penambahan berbagai konsentrasi asam fusarat. Pengamatan dilakukan 5 bulan setelah tanam.
xvi
15 Persentase kematian tunas dan rataan skor kerusakan tunas abaka klon Tangongon yang ditanam dalam media selektif dengan penambahan berbagai konsentrasi asam fusarat (AF), pada 30, 60, dan 90 hari sesudah tanam.
95
16 Penghambatan pertumbuhan kalus embriogen dua klon abaka yang ditanam dalam media proliferasi tunas dengan atau tanpa penambahan asam fusarat (AF). Pengamatan dilakukan 6 bulan setelah tanam.
95
17 Persentase daun bergejala (PDB), rataan skor gejala kerusakan (SGK), intensitas penyakit (IP), dan ketahanan abaka klon Tango ngon (Tg) dari lapang dan klon hasil seleksi in vitro dalam media dengan penambahan asam fusarat. Respons ketahanan ditentukan berdasarkan hasil uji inokulasi daun dengan F. oxysporum f. sp. cubense
isolat Banyuwangi.
97
18 Respons bibit abaka yang diregenerasikan dari kalus embriogen (Populasi KJ), dari kalus embriogen dengan perlakuan EMS (Populasi EMS), dari EMS diikuti seleksi in vitro dalam filtrat kultur F. oxysporum f.sp. cubense
(Populasi EMS+FK) atau dalam asam fusarat (Populasi EMS+AF) terhadap infeksi F. oxysporum f.sp. cubense
isolat Banyuwangi. Pengamatan dilakukan 60 hari sesudah inokulasi.
108
19 Hubungan antara panjang akar dan tinggi bibit abaka awal dengan skor kerusakan bibit dan hari bibit mati setelah perlakuan inokulasi bibit abaka klon Tangongon dengan F. oxysporum f.sp. cubense isolat Banyuwangi di rumah kaca.
109
20 Hubungan antara panjang akar dan tinggi bibit abaka awal dengan skor kerusakan bibit (SKB) yang diamati 60 hari sesudah inokulasi dan hari bibit mati setelah perlakuan inokulasi bibit abaka klon Sangihe-1 dengan F. oxysporum
f.sp. cubense isolat Banyuwangi di rumah kaca.
111
21 Keragaman respons terhadap infeksi F. oxysporum f.sp.
cubense diantara bibit abaka klon Tangongon dan Sangihe-1 yang diregenerasikan dari satu kalus embriogen. Pengamatan skor kerusakan bibit (SKB) dilakukan 60 hari sesudah inokulasi Foc Bw pada bibit yang diuji.
xvii
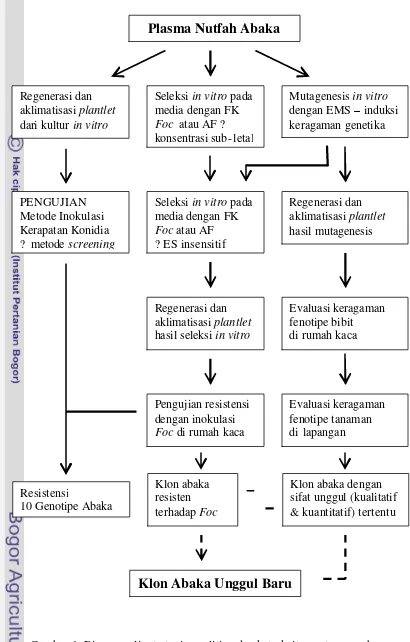
1 Diagram alir strategi penelitian dan keterkaitan antar percobaan.
13
2 (a) Biakan Fusarium oxysporum f.sp. cubense (Foc) dalam media PDB; (b) Bibit abaka umur 2 bulan yang digunakan dalam penelitian dan siap diinokulasi dengan Foc; (c) Fenotipe bibit dengan gejala layu skor 0, (d) skor 1, (e) skor 2, (f) skor 3, dan (g) skor 4, sesuai dengan kriteria yang dikembangkan oleh Epp (1986); (h) Fotomikrograf penampang melintang akar abaka pada 30 hari sesudah inokulasi dengan Foc (perbesaran 200x) menunjukan adanya kerusakan jaringan penyusun akar yang ditunjukkan oleh warna coklat kehitaman pada jaringan epidermis dan korteks; (i) penampang melintang akar abaka sehat, yang tidak diinokulasi dengan Foc.
38
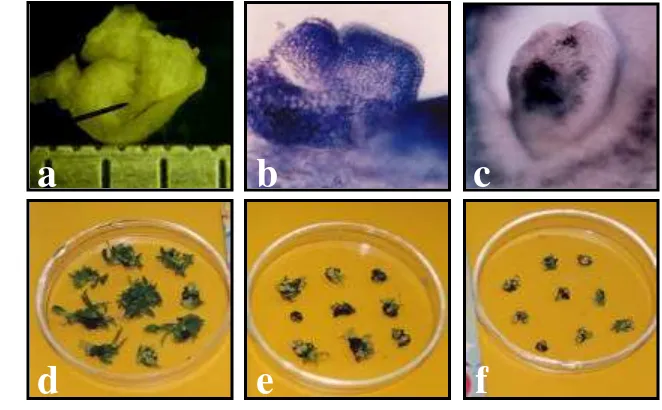
3 Eksplan kalus embriogen dan perkembangan embrio somatik abaka dengan atau tanpa perlakuan EMS. (a) Close up eksplan kalus embriogen dengan ukuran 3x3x3 mm3, (b) Embrio somatik abaka klon Tangongon (pembesaran 20x) berbentuk jantung (heart shape), (c) Embrio somatik abaka klon Sangihe-1 berbentuk globular (globular shape) pada fase polarisasi (pembesaran 10x), (d) proliferasi kalus embriogen tanpa perlakuan EMS menjadi tunas, (e) penghambatan proliferasi kalus embriogen yang diberi perlakuan EMS 0.3% dan (f) yang diberi perlakuan EMS 0.5% - setelah 3 bulan dalam media proliferasi tunas.
52
4 Populasi bibit abaka varian, diregenerasikan dari kalus embriogen yang telah diberi perlakuan larutan mutagen EMS. (a) Representatif bibit abaka yang dievaluasi keragaman somaklonalnya, (b) Bibit varian dengan fenotipe kate (kerdil) dibandingkan dengan bibit normal hasil kultur jaringan (tanpa perlakuan EMS), (c) Bibit varian dengan fenotipe daun variegata (dv), (d) Bibit varian dengan fenotipe batang semu yang ramping (br), dan (e) bibit varian dengan pelepah berwarna ungu-kehitaman (ph). Pengamatan dilakukan pada saat bibit berumur 2 bulan sesudah aklimatisasi.
xviii
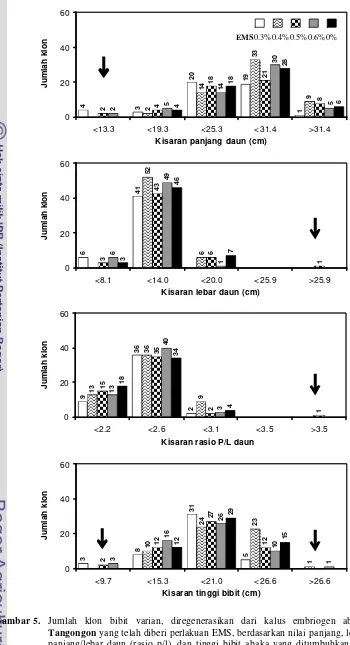
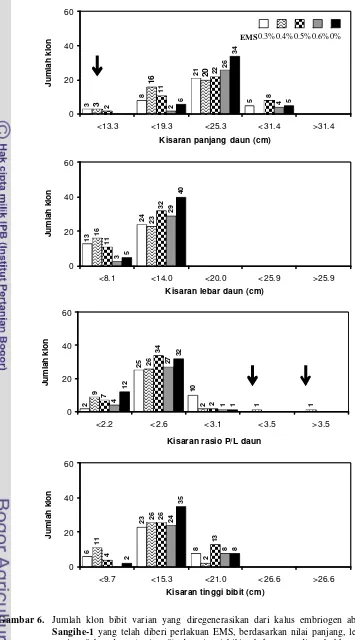
5 Jumlah klon bibit varian, diregenerasikan dari kalus embriogen abaka klon Tangongon yang telah diberi perlakuan EMS, berdasarkan nilai panjang, lebar, rasio panjang/lebar daun (rasio P/L), dan tinggi bibit abaka yang ditumbuhkan di rumah kaca. Tanda panah menunjukkan bibit varian untuk masing- masing fenotipe.
53
6 Jumlah klon bibit varian, diregenerasikan dari kalus embriogen abaka klon Sangihe-1 yang telah diberi perlakuan EMS, berdasarkan nilai panjang, lebar, rasio panjang/lebar daun (rasio P/L), dan tinggi bibit abaka yang ditumbuhkan di rumah kaca.
54
7 (a) Populasi tanaman abaka yang ditumbuhkan di lapangan, (b) daun variegata pada tanaman induk dan anakannya, (c) Tanaman abaka varian dengan fenotipe kate (kerdil), (d) daun berkerut dan tepi daun menggulung, (e) daun berkerut, (f) duduk daun berhadapan, seperti kipas, (g) Perbedaan warna serat antara klon Sangihe-1 dan Tangongon, (h) sel getah (gt) yang diamati diantara sel-sel dari jaringan kalus embriogen abaka klon Sangihe-1
68
8 Sebaran nilai dan jumlah klon berdasarkan peubah panjang serat, bobot serat dan bobot pelepah per tanaman serta tinggi batang semu tanaman di lapangan diantara populasi tanaman abaka klon Tangongon varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%).
69
9 Sebaran nilai dan jumlah klon berdasarkan peubah bobot dan kekuatan serat, jumlah pelepah per tanaman serta tinggi batang semu tanaman di lapangan diantara populasi tanaman abaka klon Sangihe-1 varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%).
xix
10 Representasi tunas abaka dengan skoring gejala kerusakan tunas 0 hingga 4 (berdasarkan kriteria yang dikembangkan oleh Epp 1987) setelah ditanam dalam media selektif dengan penambahan filtrat kultur kultur
Fusarium oxysporum f.sp. cubense isolat Banyuwangi. (FK 0%) atau dalam media selektif dengan FK Foc 10%, 20%, 30%,40%, 50%, atau 60%.
84
11 Daya hambat filtrat kultur (FK) Fusarium oxysporum
f.sp. cubense (Foc) isolat Banyuwangi terhadap pertumbuhan dan proliferasi tunas abaka klon Tangongon. Perkembangan tunas dalam media tanpa FK
84
12 Seleksi in vitro kalus embriogen abaka dalam media yang mengandung FK Foc isolat Banyuwangi. Kalus embriogen abaka klon Tangongon (a) mengalami proliferasi tunas dalam media tanpa FK, (b) sebagian besar membusuk dan dorman, atau membusuk dan memproliferasikan (c) tunas, (d) tunas roset, serta (e) kalus embriogen yang insensitif FK dalam media selektif dengan penambahan 40% FK Foc isolat Bw.
85
13 Representasi tunas abaka dengan skoring gejala kerusakan tunas 0 hingga 4 (berdasarkan kriteria yang dikembangkan oleh Epp 1987) setelah ditanam dalam media selektif dengan penambahan AF.
99
14 Daya hambat berbagai konsentrasi asam fusarat (AF) terhadap pertumbuhan dan proliferasi kalus embriogen abaka klon Tangongon (atas) dan Sangihe-1 (bawah). Foto diambil saat 5 bulan setelah penanaman ke dalam media selektif dengan penambahan AF
100
15 Daya hambat berbagai konsentrasi asam fusarat (AF) terhadap pertumbuhan dan proliferasi tunas klon Tangongon, pada saat 3 bulan setelah penanaman ke dalam media selektif dengan penambahan AF.
100
16 Perkembangan eksplan kalus embriogen abaka setelah periode seleksi in vitro dalam media yang mengandung asam fusarat (AF). Kalus embriogen abaka (a) mengalami proliferasi tunas dalam media tanpa AF, (b) membusuk, (c) membusuk dan memproliferasikan kalus embriogen yang insensitif AF, dan (d) memproliferasi-kan tunas ruset yang insensitif AF, dalam media selektif dengan penambahan AF 50 mg/l.
xx
(b) skor 1, (c) skor 2, (d) skor 3, dan (e) skor 4, sesuai dengan kriteria yang dikembangkan oleh Epp (1987). (f) Representatif populasi bibit abaka yang dievaluasi responsnya terhadap infeksi F. oxysporum f.sp. cubense
isolat Banyuwangi di rumah kaca. (g) bibit abaka yang mati dan yang tetap bertahan hidup setelah diinokulasi dengan Foc. (h) variasi respons bibit abaka yang diregenerasikan dari satu kalus embriogen hasil seleksi in vitro terhadap infeksi Foc: fenotipe tidak mengalami kerusakan, sebagian mengering, hingga bibit mati.
18 Sebaran respons berdasarkan skor kerusakan bibit pada pengamatan 60 hari setelah diinokulasi dengan F. oxysporum f.sp. cubense isolat Banyuwangi. Bibit abaka Populasi KJ (kultur jaringan) diregenerasikan dari kalus embriogen, Populasi EMS – kalus embriogen dengan perlakuan EMS, Populasi EMS+FK – kalus embriogen dengan perlakuan EMS dan diikuti dengan seleksi in vitro dalam filtrat kultur Foc dan Populasi EMS+AF – kalus embriogen dengan perlakuan EMS dan diikuti dengan seleksi in vitro dalam asam fusarat.
117
19 Pengaruh tinggi bibit awal (TBA) dan panjang akar awal (PAA) terhadap skor kerusakan bibit (SKB) pada pengamatan 30 dan 60 hari sesudah inokulasi (hsi) bibit abaka dengan F. oxysporum f.sp. cubense isolat Banyuwangi. Total bibit yang dievaluasi sebanyak 99 bibit yang terdiri atas gabungan populasi kultur jaringan, EMS, EMS+FK, dan EMS+AF dari abaka klon Tangongon dan Sangihe-1.
xxi
Nomor J u d u l Halaman
1 Sebaran nilai dan jumlah klon berdasarkan peubah panjang daun, lebar daun dan rasio panjang/lebar daun tanaman di lapangan diantara populasi abaka klon Tangongon varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%), pada 16 bulan setelah tanam.
140
2 Sebaran nilai dan jumlah klon berdasarkan peubah diameter batang, bobot batang dan jumlah anakan tanaman di lapangan diantara populasi abaka klon Tangongon varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%), pada 16 bulan setela h tanam.
141
3 Sebaran nilai dan jumlah klon berdasarkan peubah jumlah pelepah, kekuatan serat, rendemen serat dari batang, dan dari pelepah tanaman di lapangan diantara populasi abaka klon Tangongon varian yang diregenerasikan dari kalus embrio gen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%), pada 16 bulan setelah tanam.
142
4 Sebaran nilai dan jumlah klon berdasarkan peubah panjang daun, lebar daun, dan rasio panjang/lebar daun tanaman di lapangan diantara populasi abaka klon Sangihe -1 varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%), pada 16 bulan setelah tanam
143
5 Sebaran nilai dan jumlah klon berdasarkan peubah diameter dan bobot batang, serta jumlah anakan tanaman di lapangan diantara populasi abaka klon Sangihe -1 varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%), pada 16 bulan setelah tanam
144
6 Sebaran nilai dan jumlah klon berdasarkan peubah bobot pelepah, panjang serat, rendemen serat dari batang dan dari pelepah tanaman di lapangan diantara populasi abaka klon Sangihe -1 varian yang diregenerasikan dari kalus embriogen dengan perlakuan berbagai konsentrasi EMS (0%, 0.3%, 0.4%, 0.5%, dan 0.6%), pada 16 bulan setelah tanam.
PENDAHULUAN
LATAR BELAKANG
Abaka (Musa textilis Nee) merupakan tanaman sejenis pisang penghasil
serat. Abaka memiliki daun dan batang yang lebih ramping, dan ujung daunnya
lebih runcing dibandingkan pisang. Pangkal daun membulat dan salah satu sisi
lamina lebih pendek dibandingkan sisi lainnya (Berger 1969; Tabora dan Carlos
1978).Tepi lamina daun berwarna hitam sehingga mudah dibedakan dengan daun
pisang. Tinggi tanaman berkisar antara 3-7.5 meter, buahnya berisi biji
kecil-kecil, buah berwarna hijau saat masak tetapi kemudian berubah menjadi kuning
pucat dan akhirnya hitam (Dempsey 1963; Tabora dan Carlos 1978).
Serat abaka dihasilkan dari pelepah daun yang membentuk batang semu,
serat tersebut memiliki nilai ekonomis, karena dapat digunakan sebagai bahan
pembuatan tali-temali dan bahan baku kertas berkualitas tinggi (Hilman dan
Toruan-Mathius 2001). Pulp abaka sangat baik digunakan untuk bahan baku
kertas tipis seperti kertas saring, kertas dasar stensil, kertas sigaret, kantong teh
celup, kertas pembungkus, kertas dinding, kertas dokumen dan kertas uang. Selain
itu serat abaka juga digunakan sebagai bahan tekstil, kain jok, pembungkus kabel,
popok bayi (pampers) dan bahan peredam suara pada pesawat terbang (Triyanto et
al. 1982; Wardiyati 1999).
Kebutuhan serat abaka di pasar dunia untuk berbagai industri cukup tinggi,
terutama untuk memenuhi permintaan negara-negara maju seperti: Jepang,
Amerika Serikat, Inggris, Jerman, dan Italia. Potensi pasar internasional tercatat
sebesar 600 000 ton serat abaka per tahun. Philippina sebagai negara terbesar
penghasil serat, baru dapat menghasilkan sekitar 80 000 ton atau 13% dan diikuti
oleh Equador sekitar 10 000 ton atau 2% dari kebutuhan serat dunia (BI 2003;
Aragon 2000). Keadaan ini memberikan peluang untuk mengembangkan abaka di
Indonesia, dan secara agronomis penanaman abaka di Indonesia sangat sesuai
karena abaka adalah tanaman yang berasal dari daerah tropis. Namun menurut
guna, dan teknik pasca panen yang efisien diperlukan untuk mendukung
pengembangan industri abaka.
Kendala utama yang dihadapi dalam pengembangan abaka di daerah tropis
adalah adanya serangan penyakit layu yang disebabkan oleh jamur Fusarium
oxysporum f.sp. cubense. Penyakit layu Fusarium, yang juga dikenal sebagai
Panama disease, merupakan salah satu penyakit yang sangat merugikan pada
tanaman pisang, termasuk abaka yang ditanam di daerah tropika. Penyakit yang
disebabkan oleh cendawan Fusarium oxysporum Schlecht.f.sp. cubense (E.F.
Smith) Snyd & Hans ini telah menginfeksi pertanaman pisang di Asia, Afrika,
Australia, dan daerah tropika di Amerika sejak 50 tahun yang lalu (Hwang & Ko
2004). Di Leyte-Filipina F. oxysporum f.sp. cubense (Foc) dilaporkan telah
menimbulkan kerusakan antara 5-65% dari pertanaman abaka di lapangan
(Bastasa & Baliad 2005). Di Indonesia, Foc diketahui telah menyerang tanaman
pisang hingga seluas 3 300 ha di 3 provinsi di Sumatera (Nasir & Jumjunidang
2003). Hal tersebut menjadi kendala pengembangan abaka, tanaman serat untuk
pembuatan kertas berkualitas tinggi, bahan industri, dan kerajinan tangan (Hilario
2006) di Indonesia, mengingat genotipe abaka yang resisten terhadap cendawan
Foc belum tersedia.
Pengendalian Foc di lapangan diketahui sulit dilakukan karena cendawan ini
mampu bertahan dalam waktu yang lama diantara sisa-sisa tanaman yang
terinfeksi dalam bentuk miselia atau di tanah dalam bentuk klamidospora (Agrios
1997). Dengan demikian, pengendalian penyakit layu Fusarium sebaiknya
dilakukan secara terpadu dengan penggunaan bibit sehat dari genotipe abaka yang
resisten, penggunaan mikroba antagonis, penanaman gulma berguna dan
penggunaan pestisida nabati (Djatnika et al. 2003; Di Pietro et al. 2003).
Meskipun telah diuji, efektivitas mikroba antagonis untuk pengendalian Foc
masih terbatas, efektivitasnya di lapang masih belum diketahui, dan belum ada
mikroba antagonis yang dapat diandalkan untuk secara tuntas mengendalikan Foc
(Bastasa & Baliad 2005). Sejauh ini, penggunaan kultivar abaka yang resisten
merupakan metode alternatif pengendalian Foc yang efektif (Ploetz 2000).
Berbagai teknik dapat digunakan untuk memperoleh kultivar yang resisten
antara lain dengan hibridisasi, seleksi, mutasi dan lain- lain. Penggunaan teknik
seleksi in vitro merupakan salah satu cara yang efisien untuk memperoleh kultivar
abaka resisten terhadap penyakit layu Fusarium tersebut. Namun sebelum
dilakukan seleksi in vitro, keragaman genetika abaka perlu ditingkatkan lebih dulu
karena abaka termasuk dalam genus Musa spp. yang diperbanyak secara vegetatif
sehingga mempunyai keragaman genetika rendah sebagai akibat tidak terjadinya
hibridisasi seksual (Roux 2004). Tanaman dengan karakteristik seperti Musa spp.
dapat ditingkatkan keragaman genetikanya melalui induksi variasi somaklonal,
sebagaimana yang telah dilakukan pada tanaman apel, nanas, kentang, ubi jalar,
ubi kayu, bunga mawar, tulip, krisan, dan anyelir (Ahloowalia & Maluszynski
2001). Induksi varian somaklonal dapat menghasilkan karakter varian defisiensi
klorofil, peningkatan atau penurunan kuantitas dan kualitas hasil, serta ketahanan
penyakit sebagai akibat perubahan gen tunggal atau perubahan (penggandaan dan
rearrangement) di tingkat kromosom (Ahloowalia 1986).
Pendekatan induksi mutan/varian dengan menggunakan kombinasi
perlakuan mutagenesis dan perbanyakan tanaman secara in vitro merupakan
metode yang dapat diterapkan untuk tanaman yang keragaman genetiknya rendah
dan diperbanyakan secara vegetatif (klonal) seperti abaka. Perlakuan mutagenesis
secara fisik (dengan menggunakan sinar UV, sinar X dan sinar γ) atau secara
kimiawi (menggunakan senyawa mutagen colchicine, dietil sulfat [DES],
etilenimin [EI], nitroso etil- [NEU] atau nitroso metil urea [NMU|, serta etil
metansulfonat [EMS]) telah digunakan untuk meningkatkan frekuensi terjadinya
mutasi. Senyawa EMS paling banyak digunakan sebagai mutagen kimia karena
mudah dibeli dan tidak bersifat mutagenik setelah dihidrolisis, serta terbukti
merupakan mutagen yang efektif untuk berbagai jenis tanaman (van Harten 1998).
Senyawa EMS telah berhasil digunakan untuk menginduksi mutan pada tanaman
tembakau (Gichner et al. 2001), kubis-kubisan (Sakamoto et al. 2002,
Spasibionek 2006), pisang (Roux 2004), dan kenaf (Arumingtyas & Indriyani
2005).
Untuk mengidentifikasi mutan/varian yang resisten terhadap infeksi Foc,
kultur in vitro yang telah diberi perlakuan mutagenesis diseleksi secara in vitro
Foc. Salah satu syarat penggunaan seleksi in vitro untuk menapis varian
somaklonal dengan sifat unggul tertentu adalah tersedianya metode kultur jaringan
yang dapat menghasilkan banyak plantlet dan mampu menginduksi variasi
somaklonal diantara populasi plantlet yang diregenerasikan. Metode baku
regenerasi plantlet klonal abaka dalam jumlah besar secara in vitro telah tersedia
(Mariska & Suk madjaja 2003) tetapi kemampuannya untuk menginduksi variasi
somaklonal secara kuantitatif belum dievaluasi.
Dengan tersedianya metode untuk regenerasi plantlet, agens penyeleksi
yang sesuai dan metode yang efektif, kegiatan seleksi in vitro dapat dilakukan
untuk menghasilkan kultivar yang memiliki keunggulan sifat kuantitatif atau
kualitatif tertentu dan resisten terhadap penyakit layu Fusarium.
PENDEKATAN MASALAH
Perbaikan klon abaka yang resisten terhadap penyakit layu yang
disebabkan oleh Foc dan berdaya hasil tinggi dapat dilakukan dengan melakukan
induksi keragaman genetik yang dilanjutkan dengan seleksi in vitro dengan
menggunakan agens penyeleksi tertentu. Evaluasi dan identifikasi terhadap hasil
seleksi in vitro tersebut berupa karakter resisten terhadap penyakit layu Fusarium
perlu dilakukan untuk pengambilan keputusan selanjutnya.
Hal penting dalam pemuliaan abaka adalah tersedianya keragaman
genetika yang luas, sehingga kegiatan penapisan untuk memperoleh genotipe yang
diinginkan seperti resisten terhadap Foc dapat dilakukan dengan mudah. Namun
abaka termasuk dalam genus Musa spp. yang diperbanyak secara vegetatif
sehingga mempunyai keragaman genetika rendah sebagai akibat tidak terjadinya
hibridisasi seksual (Roux 2004). Oleh karena itu, sebelum dilakukan penapisan
maupun perakitan klon abaka untuk memperoleh klon unggul yang tahan terhadap
infeksi Foc, perlu dilakukan kegiatan peningkatan keragaman genetika.
Peningkatan keragaman genetika yang dilakukan dalam penelitian ini adalah
induksi keragaman somaklonal karena tanaman dengan karakteristik seperti Musa
spp. dapat ditingkatkan keragaman genetikanya melalui induksi variasi
somaklonal, sebagaimana yang telah dilakukan pada tanaman apel, nanas,
& Maluszynski 2001). Untuk memperoleh hasil yang maksimal, induksi
keragaman somaklonal pada kalus embriogen abaka klon Tangongon dan
Sangihe-1 diberi perlakuan mutagen kimia EMS sebelum dikulturkan secara in
vitro. Pendekatan induksi mutan/varian dengan menggunakan kombinasi
perlakuan mutagenesis dan perbanyakan tanaman secara in vitro merupakan
metode yang dapat diterapkan untuk tanaman yang keragaman genetikanya rendah
dan diperbanyak secara vegetatif (klonal) seperti abaka. Induksi varian
somaklonal dengan EMS mampu menghasilkan berbagai karakter varian sebagai
akibat perubahan gen tunggal atau perubahan (penggandaan dan rearrangement)
di tingkat kromosom (Ahloowalia 1986). Untuk mengidentifikasi mutan/varian
yang resisten terhadap infeksi Foc, kultur in vitro yang telah diberi perlakuan
mutagenesis diseleksi secara in vitro dalam media selektif dengan penambahan
filtrat kultur Foc atau asam fusarat (AF).
Penggunaan filtrat kultur Foc dan asam fusarat untuk seleksi in vitro
berdasarkan laporan bahwa Fusarium oxysporum f.sp. cubense merupakan
patoge n yang menyerang abaka dan dalam proses infeksi mensekresikan
non-host-specific toxin yang dapat membantu proses infeksi. Dalam penelitian ini
digunakan dua macam agens penyeleksi tersebut untuk membandingkan mana
yang lebih efisien dan efektif. Kalus embriogen abaka klon Tangongon dan
Sangihe-1 dengan perlakuan EMS 0.6% dikulturkan dalam media seleksi dengan
penambahan FK Foc atau AF. Tunas abaka yang diproliferasikan dari kalus
embriogen yang dikulturkan dalam media selektif tersebut merupakan
tunas/varia n yang insensitif FK Foc atau AF. Bibit abaka yang diregenerasikan
dari tunas insensitif FK Foc atau AF hasil seleksi in vitro diidentifikasi
resistensinya terhadap infeksi Foc. Hal ini untuk mengetahui apakah tunas yang
insensitif FK Foc atau AF tersebut merupakan tunas varian atau tunas kimera.
Tunas kimera yang tersusun dari jaringan varian (resisten) dan jaringan normal
(rentan) dapat bertahan dalam media selektif yang mengandung FK Foc atau AF
sehingga terjadi salah identifikasi hasil seleksi in vitro. Sel/jaringan kimera yang
escaped dari seleksi tidak 100% terdiri atas sel/jaringan varian yang insensitif
terhadap FK Foc atau AF tetapi juga terdapat sel/jaringan normal. Pada tahapan
yang rentan terhadap infeksi Foc. Pada tahapan proliferasi dalam media tanpa
penambahan FK Foc, tunas baru dapat berkembang dari sel/jaringan normal
sehingga menghasilkan bibit dengan fenotipe rentan terhadap infeksi Foc (bibit
escaped).
Untuk memperoleh metode yang akurat pada identifikasi atau penapisan
varian yang resisten terhadap infeksi Foc, juga dilakukan serangkaian percobaan
pengembangan metode inokulasi dan kerapatan konidia Foc yang sesuai untuk
mengevaluasi resistensi klon-klon abaka terhadap infeksi Foc. Dalam percobaan
ini dievaluasi metode inokulasi 1 (INO-1): penanaman bibit abaka dalam media
tanam yang diinokulasi dengan Foc. Metode INO-2: penanaman bibit abaka yang
akarnya telah dipotong ± 1 cm di bagian ujung dan direndam selama dua jam
dalam suspensi konidia Foc (106 konidia/ml) pada media tanah steril. Metode
INO-3: penanaman bibit abaka dalam media tana h steril dan penyiraman dengan
50 ml suspensi konidia Foc (106 konidia/ml). Bibit abaka yang tidak diinokulasi
Foc digunakan sebagai kontrol. Kerapatan konidia Foc isolat Banyuwangi yang
dievaluasi terdiri atas: 105 konidia/ml (KON-1) dan 106 konidia/ml (KON-2).
Bibit abaka yang tidak diinokulasi (KON-0) digunakan sebagai kontrol. Sebelum
digunakan untuk identifikasi varian abaka hasil seleksi in vitro, metode inokulasi
dan kerapatan konidia yang dapat menimbulkan gejala penyakit paling parah
digunakan untuk pengujian respon sepuluh genotipe abaka yaitu klon Banjar, BL
Manado, Cilacap, Cirebon, Layahan, MbB, Sangihe -1, Sangihe -2,
Tangongon, dan UB 3. Varian hasil seleksi in vitro yang resisten terhadap infeksi
Foc berdasarkan evaluasi dengan menggunakan metode ini dikonservasi sebagai
materi genetik yang tahan terhadap penyakit layu Fusarium, dan dapat digunakan
untuk pengembangan abaka di Indonesia terutama pada daerah-daerah endemis
Fusarium.
TUJUAN PENELITIAN
Penelitian yang dilakukan bertujuan untuk (1) mengevaluasi efektivitas
metoda inokulasi Foc dan kerapatan konidia Foc untuk menginduksi timbulnya
infeksi Foc pada bibit abaka, serta mengevaluasi respons sepuluh genotipe abaka
abaka yang diseleksi dengan perlakuan EMS (3) mengevaluasi efektivitas
senyawa EMS untuk meningkatkan keragaman somaklonal plantlet abaka yang
diregenerasikan dari kalus embriogen yang diberi perlakuan EMS, (4)
mengevaluasi tipe dan frekuensi keragaman karakter kualitatif dan kuantitatif
yang timbul diantara populasi tanaman mutan abaka yang didapat dari perlakuan
EMS, (5) mengevaluasi daya hambat filtrat kultur (FK) Foc isolat Banyuwangi
dan asam fusarat (AF) terhadap proliferasi dan pertumbuhan tunas abaka, (6)
menentukan konsentrasi sub- letal FK Foc isolat Banyuwangi dan AF, yaitu
konsentrasi yang mempunyai daya hambat paling tinggi terhadap pertumbuhan
dan proliferasi tunas abaka, (7) meregenerasikan sel/jaringan varian yang toleran
terhadap FK Foc isolat Banyuwangi dan AF menjadi plantlet abaka, dan (8)
mengevaluasi respons plantlet yang didapat dari hasil seleksi in vitro terhadap
infeksi Foc.
Target yang dicapai dalam penelitian ini adalah diperolehnya klon unggul
abaka baru yang mempunyai sifat kualitatif/kuantitatif tertentu yang diinginkan
dan resisten terhadap infeksi Fusarium oxysporum f.sp. cubense (Foc).
MANFAAT PENELITIAN
Peluang ekspor serat abaka sangat besar, mengingat penghasil serat abaka di
dunia hanya negara Philippina dan Equador. Namun pengembangan abaka di
Indonesia masih mengalami beberapa kendala antara lain belum tersedianya klon
unggul, terutama yang tahan terhadap penyakit layu Fusarium. Dengan
diperolehnya klon unggul abaka yang memiliki produktivitas dan kualitas serat
tinggi serta tahan terhadap penyakit layu Fusarium, diharapkan dapat
meningkatkan luas areal pengembangan abaka di Indonesia sehingga berdampak
positif terhadap peningkatan produktivitas serat abaka baik di tingkat
petani/pengusaha maupun nasional.
GARIS BESAR DISERTASI
Disertasi ini disusun berdasarkan pemikiran bahwa keberhasilan
pengembangan tanaman abaka resisten terhadap penyakit layu Fusarium yang
seleksi in vitro akan lebih tinggi apabila: (1) tersedia metode seleksi resistensi
terhadap infeksi Foc yang efektif dan akurat untuk tanaman abaka, (2) tersedia
metode induksi variasi somaklonal untuk menghasilkan keragaman genetik yang
luas pada varian abaka dengan karakter kuantitatif dan kualitatif yang berbeda
dengan bibit/tanaman standar, (3) tersedia metode seleksi in vitro yang efektif dan
akurat untuk menghasilkan tunas yang insensitif terhadap agens penyeleksi dan
resisten terhadap penyakit layu Fusarium.
Pengembangan klon abaka tahan penyakit dan unggul dalam sifat kualitatif
atau kuantitatif tertentu sulit dilakukan karena keragaman genetika plasma nutfah
abaka di Indonesia masih sempit (Hadipoentyanti et al. 2001) dan belum tersedia
teknik hibridisasi yang tepat. Oleh karena itu, perlu dilakukan serangkaian
percobaan induksi mutan somaklonal yang dilanjutkan dengan seleksi in vitro
dengan menggunakan FK Foc dan AF sebagai agens penyeleksi. Namun untuk
mengevaluasi bibit/tanaman abaka hasil seleksi in vitro tersebut diperlukan
metode penapisan (screening) yang efektif. Percobaan awal dilakukan untuk
memperoleh metode inokulasi dan kerapatan konidia Foc yang efektif untuk
pengujian resistensi bibit abaka hasil kultur in vitro terhadap infeksi Foc.
Percobaan respon abaka terhadap infeksi Foc dilakukan terhadap sepuluh genotipe
abaka yang belum diketahui sifat resistensinya. Hal ini untuk membuktikan
keefektifan metode inokulasi dan kerapatan konidia yang diperoleh dari percobaan
sebelumnya.
Induksi mutan somaklonal dilakukan dengan menggunakan mutagen kimia
etil metansulfonat (EMS) terhadap kalus embriogen abaka klon Tangongon dan
Sangihe-1. Evalua si keragaman kuantitatif dan kualitatif dilakukan: (1) pada fase
pertumbuhan vegetatif yaitu saat bibit abaka umur 3 bulan setelah aklimatisasi
(sebelum ditanam di lapangan); (2) pada fase pertumbuhan generatif yaitu saat
tanaman abaka berumur 16 bulan setelah ditanam di lapangan. Hasil evaluasi
terhadap keragaman kuantitatif dan kualitatif abaka hasil perlakuan EMS
digunakan untuk mengembangkan metode induksi varian yang dikombinasikan
dengan seleksi in vitro.
Seleksi in vitro dengan menggunakan agens penyeleksi FK Foc dan AF
in vitro dikembangkan setelah diketahui konsentrasi sub-letal FK Foc dan AF dari
percobaan sebelumnya. Pada bagian akhir penelitian ini, tunas insensitif terhadap
FK Foc dan AF yang dihasilkan dari seleksi in vitro dievaluasi resistensinya
terhadap infeksi Foc. Hasil yang diperoleh selanjutnya dibahas pada BAB III
sampai dengan BAB VIII. BAB III membahas “Keefektifan Metode Inokulasi
dan Kerapatan Konidia Fusarium oxysporum f.sp. cubense untuk
Menginfeksi Abaka” dan tulisan ini telah disubmit ke jurnal ilmiah nasional
terakreditasi dan sedang dalam proses review untuk diterbitkan di jurnal HAYATI
Institut Pertanian Bogor. Percobaan-percobaan yang dilakukan pada pembahasan
tersebut ditujukan untuk menentukan keefektifan metode inokulasi serta kerapatan
konidia Foc untuk menginfeksi bibit abaka hasil kultur in vitro. Hasil percobaan
ini digunakan untuk pengujian respon sepuluh genotipe abaka terhadap infeksi
Foc dan selanjutnya akan digunakan sebagai metode penapisan klon-klon yang
diperoleh dari mutagenesis dan seleksi in vitro pada percobaan berikutnya. Peubah
yang diukur dalam percobaan ini adalah persentase tanaman bergejala, rataan skor
gejala kelayuan, intensitas penyakit pada bibit abaka, dan resistensi terhadap
infeksi Foc.
Salah satu upaya untuk meningkatkan keragaman genetika tanaman adalah
melakukan mutasi. Mutasi yang dilakukan secara in vitro dengan menggunakan
mutagen kimia EMS menghasilkan tunas-tunas mutan somaklonal yang memiliki
keragaman sifat kuantitatif dan kualitatif. Dari hasil penelitian diketahui bahwa
konsentrasi EMS berkorelasi dengan sifat kuantitatif dan kualitatif bibit abaka
varian yang diregenerasikan dari kalus embriogen hasil perlakuan dengan
berbagai konsentrasi EMS. Peubah yang diamati pada percobaan ini meliputi
persentase eksplan bertunas, jumlah tunas per eksplan, dan penurunan jumlah total
tunas pada 5 bulan setelah perlakuan EMS; tipe dan persentase keragaman
karakter kualitatif, serta berbagai karakter kualitatif diantara populasi bibit abaka
klon Tangongon dan Sangihe-1 varian yang diregenerasikan dari kalus embriogen
setelah diberi perlakuan berbagai konsentrasi EMS pada umur 3 bulan setelah
aklimatisasi. Hasil percobaan tentang hubungan antara perlakuan EMS dengan
proliferasi kalus embriogen, sifat kuantitatif dan kualitatif pada fase pertumbuhan
perlakuan dengan EMS ditulis pada BAB IV, dengan judul “Induksi Mutan
Somaklonal dengan Perlakuan EMS pada Kultur Kalus Embriogen Abaka
(Musa textilis Nee)”. Bagian dari disertasi ini telah disubmit ke jurnal ilmiah
nasional terakreditasi dan sedang dalam proses review untuk diterbitkan di jurnal
HAYATI, Institut Pertanian Bogor.
Meskipun pada fase pertumbuhan vegetatif telah dilaporkan ada sejumlah
varian pada karakter kualitatif dan kuantitatif yang dapat digunakan sebagai
indikator terjadinya mutasi somaklonal, namun evaluasi dilanjutkan hingga fase
pertumbuhan generatif untuk mengetahui konsentrasi EMS yang dapat
menghasilkan keragaman somaklonal pada tanaman abaka, dan mengevaluasi
keragaman karakter kualitatif dan kuantitatif yang muncul pada tanaman yang
diregenerasikan dari kalus embriogen yang diberi perlakuan dengan EMS pada
fase generatif, terutama karakter produktivitas dan kualitas serat. Pengujian
dilakukan dengan mengamati tipe dan persentase keragaman kualitatif, karakter
kuantitatif yang diamati antara lain: panjang daun, lebar daun, ratio p:l, tinggi
tanaman, lingkar batang, berat batang, jumlah pelepah, berat pelepah, berat
serat kering, panjang serat kering, kekuatan serat, rendemen serat dari batang,
rendemen serat dari pelepah, jumlah anakan, jumlah tanaman produktif. Hasil
percobaan tersebut ditulis pada BAB V dengan judul “Keragaan di Lapangan
dari Klon Varian Abaka yang Diinduksi dengan Ethyl Methanesulphonate (EMS)” Bagian dari disertasi ini telah disubmit ke jurnal ilmiah nasional
terakreditasi HAYATI, Institut Pertanian Bogor.
Berdasarkan evaluasi terhadap percobaan induksi mutan somaklonal kalus
embriogen abaka dengan perlakuan EMS terhadap varian karakter kualitatif dan
kuantitatif telah diperoleh individu- individu yang unggul, namun belum diperoleh
klon yang resisten terhadap penyakit layu Fusarium. Sedangkan penyakit layu
Fusarium merupakan salah satu kendala dalam pengembangan abaka yang sulit
dikendalikan. Untuk mengatasi hal tersebut dilakukan penelitian seleksi in vitro
dengan menggunakan filtrat kultur (FK) Foc isolat Banyuwangi sebagai agens
penyeleksi. Penggunaan FK Foc sebagai agens penyeleksi diharapkan mampu
menghasilkan varian abaka dari klon Tangongon dan Sangihe-1 yang insensitif
daun dengan Foc isolat Banyuwangi menggunakan teknik detached leaf dual
cultures. Pengamatan pada seleksi in vitro dilakukan terhadap berbagai peubah
yaitu daya hambat filtrat kultur terhadap pertumbuhan tunas abaka, eksplan yang
bertunas dan dorman, rataan jumlah tunas/eksplan, jumlah tunas, penurunan
jumlah tunas akibat FK. Pengamatan pada pengujian resistensi varian abaka klon
Tangongon dan Sangihe-1 hasil seleksi in vitro dalam media dengan penambahan
filtrat kultur Foc isolat Banyuwangi meliputi: persentase daun bergejala, rataan
skor gejala kerusakan, intensitas penyakit, dan ketahanan klon-klon tersebut. Hasil
percobaan penggunaan FK Foc untuk seleksi in vitro abaka ditulis pada BAB VI
dengan judul “Seleksi In Vitro untuk Resistensi Abaka terhadap F. oxysporum
f.sp. cubense Menggunakan Filtrat Kultur sebagai Agens Penyeleksi”. Bagian
dari disertasi ini telah disubmit ke jurnal ilmiah nasional terakreditasi dan sedang
dalam proses review untuk diterbitkan di jurnal HAYATI, Institut Pertanian
Bogor.
Dari percobaan sebelumnya diketahui bahwa penggunaan FK Foc sebagai
agens penyeleksi dalam seleksi in vitro untuk memperoleh klon varian abaka
tahan terhadap Foc cukup efektif. Dari hasil uji inokulasi daun dengan Foc isolat
Banyuwangi menggunakan teknik detached leaf dual cultures diperoleh empat
bibit varian yang diduga imun, empat – resisten, dan tiga – agak resisten. Namun
demikian, untuk membandingkan metode seleksi in vitro mana yang lebih efektif
dilakukan percobaan seleksi in vitro dengan menggunakan asam fusarat sebagai
agens penyeleksi. Asam fusarat (AF) merupakan toksin murni yang diproduksi
oleh cendawan Fusarium spp. yang mempunyai peranan besar dalam infeksi
patogen pada tanaman. Seperti halnya pada penggunaan FK Foc, penggunaan AF
sebagai agens penye leksi diharapkan mampu menghasilkan varian abaka dari klon
Tangongon dan Sangihe-1 yang insensitif terhadap AF dan resisten terhadap
infeksi Foc berdasarkan hasil uji inokulasi daun dengan Foc isolat Banyuwangi
menggunakan teknik detached leaf dual cultures. Peubah-peubah yang diamati
juga sama dengan pada percobaan sebelumnya yaitu: daya hambat AF terhadap
pertumbuhan tunas abaka, eksplan yang bertunas dan dorman, rataan jumlah
tunas/eksplan, jumlah tunas, penurunan jumlah tunas akibat AF. Pengamatan pada
vitro dalam media dengan penambahan AF meliputi: persentase daun bergejala,
rataan skor gejala kerusakan, intensitas penyakit, dan ketahanan klon-klon
tersebut. Hasil percobaan ini ditulis pada BAB VII dengan judul “Seleksi In Vitro
untuk Resistensi Abaka terhadap F. oxysporum f.sp. cubense Menggunakan Asam Fusarat sebagai Agens Penyeleksi”. Bagian dari disertasi ini akan
disubmit ke jurnal ilmiah nasional terakreditasi AGROTROPIKA, Universitas
Lampung.
Pada bagian akhir dari penelitian ini dilakukan serangkaian percobaan
untuk mengetahui resistensi bibit varian abaka hasil kultur in vitro, mutagenesis
dengan EMS, dan mutagenesis dengan EMS yang dilanjutkan dengan seleksi in
vitro dengan menggunakan FK Foc dan AF, terhadap infeksi Foc. Metode
inokulasi yang digunakan untuk pengujian resistensi ini merupakan hasil
percobaan pada BAB III. Pengamatan terhadap beberapa peubah yaitu: panjang
akar bibit sebelum inokulasi, tinggi bib it sebelum dan sesudah inokulasi, skor
gejala kelayuan, dan pada hari ke berapa bibit mati. Dari hasil analisis tersebut
diperoleh 21 dan 2 klon masing- masing hasil seleksi in vitro dengan agens
penyeleksi FK Foc dan AF, 20 klon hasil induksi mutasi dengan EMS, dan 2 klon
hasil kultur jaringan (in vitro) yang resisten terhadap infeksi Foc. Dengan
demikian strategi pemuliaan untuk resistensi terhadap penyakit layu yang
disebabkan oleh F. oxysporum f.sp cubense dapat dilakukan secara in vitro. Hasil
percobaan dan pengujian resistensi untuk klon-klon tersebut ditulis pada BAB
VIII dengan judul “Resistensi Klon Abaka Varian Somaklonal terhadap
Infeksi Fusarium oxysporum f.sp cubense”. Bagian dari disertasi ini akan disubmit ke jurnal ilmiah nasional terakreditasi HAYATI, Institut Pertanian
Bogor.
Diagram alir strategi penelitian untuk menghasilkan klon abaka unggul baru
yang mempunyai sifat kualitatif atau kuantitatif diinginkan dan resisten terhadap
Gambar 1. Diagram alir strategi penelitian dan keterkaitan antar percobaan
Klon Abaka Unggul Baru
Klon abaka resisten terhadap Foc
Klon abaka dengan sifat unggul (kualitatif & kuantitatif) tertentu Resistensi
10 Genotipe Abaka
Pengujian resistensi dengan inokulasi
Foc di rumah kaca
Evaluasi keragaman fenotipe tanaman di lapangan PENGUJIAN:
Metode Inokulasi Kerapatan Konidia ? metode screening
Seleksi in vitro pada media dengan FK
Foc atau AF ? ES insensitif
Regenerasi dan aklimatisasi plantlet
hasil mutagenesis
Regenerasi dan aklimatisasi plantlet
hasil seleksi in vitro
Evaluasi keragaman fenotipe bibit di rumah kaca Regenerasi dan
aklimatisasi plantlet
dari kultur in vitro
Seleksi in vitro pada media dengan FK
Foc atau AF ? konsentrasi sub- letal
Plasma Nutfah Abaka
Mutagenesis in vitro
BAB II
TINJAUAN PUSTAKA
TANAMAN ABAKA
1. Biologi dan manfaatnya
Abaka (Musa textilis Nee) merupakan tanaman sejenis pisang penghasil
serat termasuk dalam genus: Musa, famili: Musaceae, ordo: Zingiberales. Abaka
memiliki daun dan batang yang lebih ramping, dan ujung daunnya lebih runcing
dibandingkan pisang. Pangkal daun membulat dan salah satu sisi lamina lebih
pendek dibandingkan sisi lainnya (Berger 1969; Tabora dan Carlos 1978).Tepi
lamina daun berwarna hitam sehingga mudah dibedakan dengan daun pisang.
Tinggi tanaman berkisar antara 3-7.5 meter, buahnya berisi biji kecil-kecil, buah
berwarna hijau saat masak tetapi kemudian berubah menjadi kuning pucat dan
akhirnya hitam (Dempsey 1963; Tabora dan Carlos 1978).
Awalnya serat abaka yang dihasilkan dari pelepah daun yang membentuk
batang semu, banyak digunakan sebagai tali-temali, terutama kapal dan bahan
untuk industri pancing karena tahan terhadap kelembaban, air laut dan air tawar
(Purseglove 1983). Selain itu serat abaka dapat ditenun dan digunakan sebagai
bahan pakaian yang sejuk dipakai, untuk kain jok, popok bayi (pampers),
pembungkus kabel listrik dan peredam suara kapal terbang (Heyne 1987;
Duryatmo dan Dasoeki 1999). Pulp abaka sangat baik digunakan untuk bahan
baku kertas tipis seperti kertas dokumen, surat berharga, kertas uang, kertas
kemasan (Triyanto et al. 1982), kertas saring, kertas dasar stensil, kertas sigaret,
kertas teh celup, kertas pembungkus daging/sosis, dan kertas lensa (Aragon 2000).
Penggunaan serat abaka untuk kertas uang peso di Filipina dimulai tahun 2000,
sedangkan di Jepang sudah sejak lama dilakukan (Hilario 2006).
2. Asal dan penyebarannya
Abaka berasal dari Filipina (Nur 1957, Villordon 2003), daerah penanaman
terbesar adalah semenanjung Bicol yang terletak di bagian selatan pulau Luzon;
Mindanao. Karena abaka merupakan tanaman asli Filipina, maka disebut juga
sebagai ’Manila Hemp’ dan pada tahun 1690 disebut sebagai Musa mindanensis
(Montgomery 1954). Usaha penyebaran abaka sudah dimulai sejak 1811 tetapi
selalu mengalami kegagalan karena introduksi menggunakan biji, kondisi
pertumb uhan tidak sesuai, dan kurangnya pengetahuan tentang budidaya
(Purseglove 1983). Tahun 1924-1925 bibit abaka berhasil diintroduksi ke
Panama, Costa Rica, Guatemala, dan Honduras, kemudian menyebar dan dapat
tumbuh baik di India, Ceylon, Kepulauan Andaman, Bengal, Hawai, Kepulauan
Salomon, Jamaica, Tinidad, Sabah, Sumatra, Malaya dan New Guinea (Hilman
dan Toruan-Mathius 2001). Pengembangan abaka di Indonesia dimulai pada tahun
1853 di Minahasa, tetapi pada saat itu keuntungan yang diperoleh dari budidaya
abaka sangat rendah. Tahun 1905 mulai dikembangkan di Jawa dan Sumatera
Selatan dan tumbuhnya tidak mengecewakan. Pada tahun 1912 dilaporkan bahwa
terdapat tiga perkebunan besar di Besuki, Jawa Timur dan pada tahun tersebut
dapat mengekspor 200 ton serat, kemudian produktivitas menurun dan
keuntungannya terlampau kecil, sehingga perkebunan tersebut tidak berkembang
(Heyne 1987; Hilman dan Toruan-Mathius 2001). Salah satu perkebunan abaka di
Indonesia yang masih tersisa antara lain di Bayulor, Banyuwangi seluas ± 400 ha.
3. Plasma nutfah dan pemuliaannya
Plasma nutfah abaka di Philippina mencapai sekitar 192 aksesi (Villareal
1988), tetapi hanya 20 diantaranya yang memiliki nilai komersial tinggi. Tiga
varietas utama yang banyak ditanam adalah: Tangongon, Bungulanon, dan
Maguindanao (Dempsey 1963; Purseglove 1983; Hilman dan Toruan-Mathius
2001). Di Indonesia, koleksi plasma nutfah yang terdapat di Balittas, hanya 37
aksesi, sepuluh diantaranya telah dianalisis keragaman genetiknya oleh
Hadipoentyanti et al. (2001), hasil analisis menunjukkan bahwa 10 aksesi tersebut
memiliki hubungan kekerabatan dekat.
Pemuliaan abaka terutama ditujukan untuk memperoleh varietas tahan
terhadap penyakit atau hama. Penyakit yang banyak ditemukan pada pertanaman
abaka adalah penyakit yang disebabkan oleh virus bunchy top, mosaik, jamur
Pseudomonas solanacearum, serta nematoda Radopholus simulus dan
Pratylenchus coffeae. Hama utama yang banyak dijumpai adalah: aphids, ulat
Cosmopolites sordidus (Germ), hama pemakan daun Thosea sinensis (Purseglove,
1983; Hilman dan Toruan-Mathius 2001). Persilangan antara abaka (M. textilis,
2n=20, kualitas serat baik) dengan pacol (M. balbisiana, 2n=22, tahan bunchy top
dan mosaik), telah menghasilkan hibrid yang memiliki sifat tahan terhadap
penyakit tersebut dan kualitas pulp paling tinggi. Hibrid tersebut telah
dikembangkan secara besar-besaran di Filipina sebagai agro- industri (Villareal
1988). Varietas unggul abaka diharapkan mempunyai ciri-ciri: batang tinggi besar
(minimal tinggi 6 m dan diameter batang bawah 20 cm), perakaran dalam dengan
jumlah akar >150 pada setiap tanaman dewasa, memiliki >20 pelepah daun per
batang, kandungan serat minimum 2.5 persen, dapat beradaptasi pada kondisi
tanah dan lingkungan yang berbeda, resisten terhadap kekeringan dan banjir, masa
produktif lama, resisten terhadap hama dan penyakit, memiliki kualitas serat baik
(Purseglove 1983).
PENYAKIT LAYU FUSARIUM
Penyakit layu Fusarium, yang juga dikenal sebagai Panama disease,
merupakan salah satu penyakit yang sangat merugikan pada tanaman pisang,
termasuk abaka (Musa textilis Nee) yang ditanam di daerah tropika. Penyakit yang
disebabkan oleh cendawan Fusarium oxysporum Schlecht.f.sp. cubense (E.F.
Smith) Snyd & Hans ini telah menginfeksi pertanaman pisang di Asia, Afrika,
Australia, dan daerah tropika di Amerika sejak 50 tahun yang lalu (Hwang & Ko
2004). Cendawan tersebut dapat bertahan lama di dalam tanah dalam sruktur
klamidospora pada sisa-sisa tanaman dan merupakan sumber inokulum yang dapat
menyerang abaka dan tanaman lainnya. Penyakit ini dapat menular karena
perakaran tanaman sehat berhubungan dengan spora yang dilepaskan oleh
tanaman sakit yang ada di sekitarnya, dapat juga melalui bibit dan tanah yang
terinfeksi (Agrios 1997). Cendawan ini menyebar cepat pada daerah yang
kelengasan tanahnya tinggi, drainasenya buruk, tanah remah dan masam.
Penyebaran patogen terutama melalui bibit, tanah yang terinfeksi, sisa tanaman
2002). Sampai saat ini telah dikenal 4 ras F. oxysporum f.sp. cubense, tiga
diantaranya merupakan patogen utama pada pisang (Wibowo et al. 2001).
1. Gejala yang ditimbulkan
Fusarium menghasilkan sejumlah senyawa toksik yang dapat berpengaruh
terhadap kesehatan manusia dan produktivitas hewan (Ahmed et al. 1991).
Tanaman yang terinfeksi menunjukkan gejala awal berupa bercak kekuningan
atau garis-garis pada bagian bawah daun pertama atau kedua. Warna kekuningan
akan berkembang di sepanjang tepi daun dan menyebar ke arah tulang daun
kemudian coklat dan mengering. Apabila terjadi serangan berat tangkai daun
disekeliling batang semu patah, kadang-kadang lapisan luar batang semu juga
membelah dimulai dari permukaan tanah (Ploetz et al. 1994; Damayanti 2002).
Gejala yang paling khas dari penyakit ini adalah gejala dalam yaitu apabila
pangkal batang dibelah membujur akan terlihat garis-garis coklat atau hitam
menuju ke semua arah, dari bonggol ke pangkal dan tangkai daun melalui jaringan
pembuluh. Gejala infeksi lanjut akan terlihat pada bonggol, dimana bonggol
menjadi berwarna merah gelap atau merah kecoklatan. Tunas yang tumbuh pada
bagian bonggol yang terserang akan berwarna kuning atau merah (Hutagalung
2002).
Patogen yang ada di tanah akan masuk ke akar melalui lenti sel akar,
kemudian berkembang sangat cepat disepanjang akar dan menghasilkan miselium.
Miselium kemudian masuk ke dalam pembuluh xilem melalui noktah dan
menghasilkan mikrokonidium. Spora ini terbawa oleh aliran zat cair ke atas,
terhenti dan tersangkut pada dinding sel jaringan pembuluh xilem dan
berkecambah membentuk miselium sehingga menyumbat aliran zat cair.
Polisakarida dan enzim yang dihasilkan patogen ini dapat menyebabkan
kerusakan pada sel-sel jaringan xilem membentuk gel dan gum (massa koloidal)
dan menyebabkan penyumbatan pembuluh. Adanya sekresi berupa massa koloidal
serta mengkerutnya sel-sel pembuluh menyebabkan aliran zat cair menjadi
terhambat sehingga terjadi proses penurunan laju aliran air dalam pembuluh dan
2. Respon tanaman terhadap penyakit layu Fusarium
Respon tanaman terhadap penyakit pada tahap infeksi awal adalah dengan
membentuk jaringan yang memblokir dan membatasi invasi seperti: lignin,
suberin dan endodermis, serta mensintesis senyawa anti mikroba yang disebut
‘phytoalexin’ (Scala et al., 1985). Adanya auksin menginduksi pembentukan gel,
mempercepat pertumbuhan dan meningkatkan respirasi sehingga terbentuk tilosis
pada xilem dan memblokir patogen untuk tidak menyebar lebih jauh. Selain itu,
pada varietas yang resisten terhadap Fusarium terdapat konjugasi antara asam
fusarat dengan glycine hingga 25%. Konjugasi ini menyebabkan toksin asam
fusarat menjadi tidak aktif sehingga efisien untuk menghindari layu (Harborne,
1988).
Hasil penelitian pada tanaman pisang menunjukkan bahwa aktivitas
peroksidase meningkat secara cepat saat diinfeksi dengan Fusarium, hal ini
merupakan bukti bahwa enzim peroksidase berperan dalam respon pertahanan.
Peran enzim peroksidase dalam pertahanan tanaman adalah mengoksidasi
senyawa fenolik dan meningkatkan laju proliferasi senyawa mirip lignin yang
berfungsi sebagai barier. Kecepatan dan besarnya aktivitas mekanisme pertahanan
mengekspresikan adanya resistensi. Pada tanaman yang r