PEMBUATAN DAN KARAKTERISASI DEKSTRIN
DARI PATI UMBI TALAS (Xanthosoma sagittifolium (L.) Schott)
DENGAN METODE KATALIS ASAM DAN ENZIMATIS
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SELVIA WILIANTARI
NIM 111501152
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PEMBUATAN DAN KARAKTERISASI DEKSTRIN
DARI PATI UMBI TALAS (Xanthosoma sagittifolium (L.) Schott)
DENGAN METODE KATALIS ASAM DAN ENZIMATIS
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SELVIA WILIANTARI
NIM 111501152
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PEMBUATAN DAN KARAKTERISASI DEKSTRIN
DARI PATI UMBI TALAS (Xanthosoma sagittifolium (L.) Schott)
DENGAN METODE KATALIS ASAM DAN ENZIMATIS
OLEH:
SELVIA WILIANTARI
NIM 111501152
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 30 Mei 2015
Pembimbing I, Panitia Penguji,
Prof. Dr. Karsono, Apt. Prof. Dr. Hakim Bangun, Apt.
NIP 195409091982011001 NIP 195201171980031002
Pembimbing II, Prof. Dr. Karsono, Apt.
NIP 195409091982011001
Dr. Sumaiyah, M.Si., Apt. Dr. Kasmirul Ramlan Sinaga, M.S., Apt. NIP 197712262008122002 NIP 195504241983031003
Dra. Azizah Nasution, M.Sc, Ph.D., Apt. NIP 195503121983032001
Medan, Juni 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
iv
KATA PENGANTAR
Puji Syukur kehadirat Allah SWT yang telah memberikan karunia yang
berlimpah sehingga penulis dapat meyelesaikan penyusunan skripsi yang berjudul
“Pembuatan dan Karakterisasi Dekstrin dari Pati Umbi Talas (Xanthosoma
sagittifolium (L.) Schott) dengan Metode Katalis Asam dan Enzimatis”. Skripsi
ini diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana
Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih kepada Bapak Prof. Dr. Karsono, Apt., dan Ibu Dr. Sumaiyah, M.Si.,
Apt., selaku pembimbing yang telah memberikan waktu, bimbingan, dan nasehat
selama penelitian hingga selesainya penyusunan skripsi ini. Ucapan terima kasih
kepada Bapak Prof. Dr. Sumadio Hadisaputra, Apt., selaku Dekan Fakultas
Farmasi dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt., selaku Wakil Dekan I
Fakultas Farmasi USU yang telah memberikan bantuan dan fasilitas sehingga
penulis dapat menyelesaikan pendidikan, serta kepada Ibu Sri Yuliasmi, S.Farm,
M.Si., Apt., selaku penasehat akademik yang telah membimbing penulis selama
masa pendidikan di Fakultas Farmasi Universitas Sumatera Utara. Ucapan terima
kasih juga penulis sampaikan kepada Bapak Prof. Dr. Hakim Bangun, Apt., Bapak
Dr. Kasmirul Ramlan Sinaga, M.S., Apt., dan Ibu Dra. Azizah Nasution, M.Sc,
Ph.D., Apt., selaku dosen penguji yang telah memberikan saran dan arahan
kepada penulis dalam menyelesaikan skripsi ini. Terima kasih juga kepada Ibu
Lia Laila, S.Farm., M.Sc., Apt., dan Bapak Bayu Eko Prasetyo, S. Farm., M.Sc.,
Apt., selaku dosen yang telah memberi arahan dan bantuan kepada penulis
v
Penulis juga mengucapkan terimakasih dan penghargaan yang tiada
terhingga kepada Ayahanda Kapten Inf Busril dan Ibunda Dra. Ernawilis, yang
telah memberikan cinta dan kasih sayang, pengorbanan baik materi maupun
motivasi beserta doa yang tulus yang tidak pernah berhenti kepada penulis.
Adikku tercinta Detia Wilian Refindani dan Satria Wilian Nofriadi serta seluruh
keluarga yang selalu mendoakan dan memberikan semangat. Teman-teman
terbaikku Wetcy, Hesti, Husna, Nanda, Fhatma, Tiwi, Eka, Silvia, Arie,
teman-teman STF 2011 dan FKK 2011 serta semua pihak yang tidak dapat disebutkan
satu persatu yang telah banyak membantu hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis
berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, Mei 2015 Penulis,
vi
PEMBUATAN DAN KARAKTERISASI DEKSTRIN DARI
PATI UMBI TALAS (Xanthosoma sagittifolium (L.) Schott)
DENGAN METODE KATALIS ASAM DAN ENZIMATIS
ABSTRAK
Latar belakang: Talas merupakan penghasil karbohidrat sehingga berpotensi sebagai subsitusi terigu dan beras atau sebagai diversifikasi bahan pangan dan bahan baku industri farmasi.
Tujuan: Tujuan penelitian ini adalah untuk melakukan pembuatan dan karakterisasi dekstrin dari pati umbi talas sebagai bahan baku pembuatan dekstrin, yang dibuat dengan metode katalis asam dan metode enzimatis.
Metode: Umbi talas dihaluskan dan didekantasi dengan akuades. Pembuatan dekstrin dilakukan dengan dua metode yaitu metode katalis asam dengan HCl 1 N dan metode enzimatis dengan enzim α-amilase. Kemudian dekstrin dikarakterisasi dan diuji persyaratan mutunya sesuai dengan Standar Nasional Indonesia (SNI) 01-2593-1992. Karakterisasi meliputi rendemen, pemeriksaan warna, pengujian kualitatif dengan larutan lugol, kehalusan 80 mesh, kadar air, kadar abu, kelarutan dalam air dingin, dekstrosa ekuivalen, titik lebur, dan derajat asam.
Hasil: Hasil Penelitian menunjukkan bahwa rendemen dekstrin yang diperoleh dengan metode katalis asam adalah 41,73 % sedangkan metode enzimatis adalah 67,10 %. Pemeriksaan warna dengan metode katalis asam diperoleh dekstrin berwarna kekuning-kuningan sedangkan dengan metode enzimatis diperoleh dekstrin berwarna putih. Pengujian kualitatif dengan larutan lugol dekstrin pada metode asam dan metode enzimatis menunjukkan hasil yang sama yaitu ungu kecoklat-coklatan. Kehalusan 80 mesh dekstrin dengan metode katalis asam dan metode enzimatis berturut-turut adalah 94,7 % ± 0,06 dan 93,96 % ± 0,02. Kadar air dekstrin dengan metode katalis asam adalah 8,79 % ± 0,15 sedangkan metode enzimatis adalah 7,62 % ± 0,23. Kadar abu dekstrin dengan metode katalis asam adalah 0,45 % ± 0,02 sedangkan metode enzimatis adalah 0,42 % ± 0,04. Kelarutan dalam air dingin dekstrin dengan metode katalis asam adalah 57,47 % ± 0,25 sedangkan metode enzimatis adalah 63,09 % ± 0,1. Dekstrosa ekuivalen dekstrin dengan metode katalis asam adalah 13,65 ± 0,36 sedangkan metode enzimatis adalah 15,31 ± 0,41. Titik lebur dekstrin dengan metode katalis asam adalah 185 oC ± 0,57 sedangkan metode enzimatis adalah 182 oC ± 0,57. Derajat asam dekstrin dengan metode katalis asam adalah 2,86 ± 0,23 sedangkan metode enzimatis adalah 4,39 ± 0,4.
Kesimpulan: Hasil penelitian memperlihatkan bahwa karakterisasi dekstrin dengan metode asam dan metode enzimatis memenuhi persyaratan mutu Standar Nasional Indonesia (SNI) 01-2593-1992.
vii
DEXTRIN OF TARO TUBER STARCH
(Xanthosoma sagittifolium (L.) Schott) PREPARATION
AND CHARACTERIZATION WITH ACID CATALYST
AND ENZYMATIC METHODS
ABSTRACT
Background: Taro produces carbohydrate, thus it has potentially as a substitute material of wheat and rice or as a diversification of food and pharmaceutical industrial raw materials.
Objective: The aim of this study was to preparation and characterization dextrin of taro tuber starch as raw material to produce dextrin, which was made by acid catalyst and enzymatic methods.
Methods: The taro tuber was mashed and decantated with distilled water. The dextrin was made by two methods, there were acid catalyst method with HCl 1 N and enzymatic method with α-amylase enzyme. Then dextrin was characterized and it’s quality requirements was tested according to the Indonesian National Standard (SNI) 01-2593-1992. The characterization included yield value, color test, qualitative test of Lugol solution, 80 mesh fineness, water content, ash content, solubility in cold water, dextrose equivalent, melting point, and acid degree.
Results: The results showed that the yield value of dextrin by acid catalyst method was 41.73 % while by the enzymatic method was 67.10 %. The color test showed that the dextrin was yellowish by acid catalyst method while the enzymatic method was white. The qualitative test of lugol solution showed similar results by acid catalyst method and enzymatic method, there was brownish purple of the dextrin. The 80 mesh fineness of the dextrin by acid catalyst and enzymatic methods showed there were 94.7 % ± 0.06 and 93.96 % ± 0.02. The water content of the dextrin by acid catalyst method was 8.79 % ± 0.15 while by enzymatic method was 7.62 % ± 0.23. The ash content of the dextrin by acid catalyst method was 0.45 % ± 0.02 meanwhile by enzymatic method was 0.42 % ± 0.04. The solubility of the dextrin in the cold water by acid catalyst method was 57.47 % ± 0.25 while by enzymatic methods was 63.09 % ± 0.1. Dextrose equivalent of the dextrin by acid catalyst method was 13.65 ± 0.36 while by enzymatic method was 15.31 ± 0.46. The melting point of the dextrin by acid catalyst method was 185 oC ± 0.57 and by enzymatic method was 182 cC ± 0.57. The acid degree of the dextrin by acid catalyst method was 2.86 ± 0.23 while by enzymatic method was 4.39 ± 0.4.
Conclusion: This research suggests that the characterization of dextrin by acid and enzymatic methods meet the quality requirements of Indonesian National Standard (SNI) 01-2593-1992.
viii
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... . vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 5
1.3 Hipotesis ... 6
1.4 Tujuan Penelitian ... 6
1.5 Manfaat Penelitian ... 7
BAB II TINJAUAN PUSTAKA ... 8
2.1 Uraian Tumbuhan ... 8
2.1.1 Sistematika tumbuhan ... 9
2.1.2 Nama lain ... 9
2.1.3 Pengolahan talas ... 9
2.1.4 Kandungan gizi ... 10
ix
2.2.1 Pembuatan pati ... 13
2.3 Dekstrin ... 14
2.3.1 Hidrolisis asam ... 15
2.3.2 Enzim α-amilase ... 17
2.3.3 Penggunaan dekstrin ... 19
BAB III METODE PENELITIAN ... 21
3.1 Lokasi Penelitian ... 21
3.2 Jenis Penelitian ... 21
3.3 Alat ... 21
3.4 Bahan ... 21
3.5 Pembuatan Pereaksi ... 22
3.5.1 Larutan HCl 1 N ... 22
3.5.2 Larutan Na2CO3 1 N ... 22
3.5.4 larutan lugol ... 22
3.5.5 Larutan NaOH 0,1 N ... 22
3.5.5 Larutan fenolftalein LP ... 22
3.6 Penyiapan Sampel ... 22
3.6.1 Pengambilan sampel ... 23
3.6.2 Identifikasi sampel ... 23
3.6.3 Pengolahan sampel ... 23
3.7 Metode Pembuatan Dekstrin ... 24
3.7.1 Metode katalis asam ... 24
3.7.2 Metode enzimatis ... 24
3.8 Pemeriksaan Rendemen ... 25
x
3.9.1 Pemeriksaan warna ... 25
3.9.2 Pengujian kualitatif dengan larutan lugol ... 25
3.9.2.1 Metode katalis asam ... 25
3.9.2.2 Metode enzimatis ... 25
3.9.3 Penetapan kehalusan 80 mesh ... 26
3.9.4 Penetapan kadar air ... 26
3.9.5 Penetapan kadar abu ... 26
3.9.6 Penetapan kelarutan dalam air dingin ... 27
3.9.7 Penetapan kadar dekstrosa ekuivalen (DE) ... 27
3.9.8 Pengujian titik lebur ... 28
3.9.9 Penetapan derajat asam ... 28
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1 Identifikasi Sampel ... 29
4.2 Rendemen ... 29
4.3 Karakteristik Dekstrin ... 32
4.3.1 Warna dekstrin ... 33
4.3.2 Pengujian kualitatif dengan larutan lugol …. ... 34
4.3.3 Kehalusan 80 mesh ... 34
4.3.4 Kadar air ... 35
4.3.5 Kadar abu ... 35
4.3.6 Kelarutan dalam air dingin ... 36
4.3.7 Kadar dekstrosa ekuivelen (DE) ... 38
4.3.8 Titik lebur ... 40
4.3.9 Derajat asam ... 40
xi
5.1 Kesimpulan ... 42
5.2 Saran ... 43
DAFTAR PUSTAKA ... 44
xii
DAFTAR TABEL
Halaman
Tabel 2.1 Komposisi gizi umbi talas mentah (per 100 g) ... 11
Tabel 4.1 Orientasi metode katalis asam (HCl 1 N) ... 29
Tabel 4.2 Orientasi metode enzimatis (enzim α-amilase) ... 30
xiii
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur pati ... 13
Gambar 2.2 Struktur dekstrin ... 15
xiv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Umbi talas (Xanthosoma sagittifolium (L.) Schott) ... 47
Lampiran 2. Pati umbi talas (Xanthosoma sagittifolium (L.) Schott). .. 47
Lampiran 3. Oven ... 48
Lampiran 4. Autoklaf ... 48
Lampiran 5. Tanur ... 49
Lampiran 6. Orbital shaker ... 49
Lampiran 7. Melting point ... 50
Lampiran 8. pH meter ... 50
Lampiran 9. Hasil identifikasi tumbuhan LIPI ... 51
Lampiran 10. Sertifikat analisis enzim α-amilase ... 52
Lampiran 11. Skema pembuatan pati umbi talas ... 53
Lampiran 12. Skema pembuatan dekstrin metode katalis asam ... 54
Lampiran 13. Skema pembuatan dekstrin metode enzimatis ... 55
Lampiran 14. Pengujian kualitatif dengan larutan lugol pati umbi talas ... 56
Lampiran 15. Perhitungan rendemen ... 57
Lampiran 16. Warna dekstrin ... 58
Lampiran 17. Pengujian kualitatif dengan larutan lugol ... 59
Lampiran 18. Perhitungan kehalusan 80 mesh ... 60
Lampiran 19. Perhitungan kadar air ... 62
Lampiran 20. Perhitungan kadar abu ... 64
Lampiran 21. Perhitungan kelarutan dalam air dingin ... 66
xv
Lampiran 23. Hasil pengujian titik lebur ... 72
vi
PEMBUATAN DAN KARAKTERISASI DEKSTRIN DARI
PATI UMBI TALAS (Xanthosoma sagittifolium (L.) Schott)
DENGAN METODE KATALIS ASAM DAN ENZIMATIS
ABSTRAK
Latar belakang: Talas merupakan penghasil karbohidrat sehingga berpotensi sebagai subsitusi terigu dan beras atau sebagai diversifikasi bahan pangan dan bahan baku industri farmasi.
Tujuan: Tujuan penelitian ini adalah untuk melakukan pembuatan dan karakterisasi dekstrin dari pati umbi talas sebagai bahan baku pembuatan dekstrin, yang dibuat dengan metode katalis asam dan metode enzimatis.
Metode: Umbi talas dihaluskan dan didekantasi dengan akuades. Pembuatan dekstrin dilakukan dengan dua metode yaitu metode katalis asam dengan HCl 1 N dan metode enzimatis dengan enzim α-amilase. Kemudian dekstrin dikarakterisasi dan diuji persyaratan mutunya sesuai dengan Standar Nasional Indonesia (SNI) 01-2593-1992. Karakterisasi meliputi rendemen, pemeriksaan warna, pengujian kualitatif dengan larutan lugol, kehalusan 80 mesh, kadar air, kadar abu, kelarutan dalam air dingin, dekstrosa ekuivalen, titik lebur, dan derajat asam.
Hasil: Hasil Penelitian menunjukkan bahwa rendemen dekstrin yang diperoleh dengan metode katalis asam adalah 41,73 % sedangkan metode enzimatis adalah 67,10 %. Pemeriksaan warna dengan metode katalis asam diperoleh dekstrin berwarna kekuning-kuningan sedangkan dengan metode enzimatis diperoleh dekstrin berwarna putih. Pengujian kualitatif dengan larutan lugol dekstrin pada metode asam dan metode enzimatis menunjukkan hasil yang sama yaitu ungu kecoklat-coklatan. Kehalusan 80 mesh dekstrin dengan metode katalis asam dan metode enzimatis berturut-turut adalah 94,7 % ± 0,06 dan 93,96 % ± 0,02. Kadar air dekstrin dengan metode katalis asam adalah 8,79 % ± 0,15 sedangkan metode enzimatis adalah 7,62 % ± 0,23. Kadar abu dekstrin dengan metode katalis asam adalah 0,45 % ± 0,02 sedangkan metode enzimatis adalah 0,42 % ± 0,04. Kelarutan dalam air dingin dekstrin dengan metode katalis asam adalah 57,47 % ± 0,25 sedangkan metode enzimatis adalah 63,09 % ± 0,1. Dekstrosa ekuivalen dekstrin dengan metode katalis asam adalah 13,65 ± 0,36 sedangkan metode enzimatis adalah 15,31 ± 0,41. Titik lebur dekstrin dengan metode katalis asam adalah 185 oC ± 0,57 sedangkan metode enzimatis adalah 182 oC ± 0,57. Derajat asam dekstrin dengan metode katalis asam adalah 2,86 ± 0,23 sedangkan metode enzimatis adalah 4,39 ± 0,4.
Kesimpulan: Hasil penelitian memperlihatkan bahwa karakterisasi dekstrin dengan metode asam dan metode enzimatis memenuhi persyaratan mutu Standar Nasional Indonesia (SNI) 01-2593-1992.
vii
DEXTRIN OF TARO TUBER STARCH
(Xanthosoma sagittifolium (L.) Schott) PREPARATION
AND CHARACTERIZATION WITH ACID CATALYST
AND ENZYMATIC METHODS
ABSTRACT
Background: Taro produces carbohydrate, thus it has potentially as a substitute material of wheat and rice or as a diversification of food and pharmaceutical industrial raw materials.
Objective: The aim of this study was to preparation and characterization dextrin of taro tuber starch as raw material to produce dextrin, which was made by acid catalyst and enzymatic methods.
Methods: The taro tuber was mashed and decantated with distilled water. The dextrin was made by two methods, there were acid catalyst method with HCl 1 N and enzymatic method with α-amylase enzyme. Then dextrin was characterized and it’s quality requirements was tested according to the Indonesian National Standard (SNI) 01-2593-1992. The characterization included yield value, color test, qualitative test of Lugol solution, 80 mesh fineness, water content, ash content, solubility in cold water, dextrose equivalent, melting point, and acid degree.
Results: The results showed that the yield value of dextrin by acid catalyst method was 41.73 % while by the enzymatic method was 67.10 %. The color test showed that the dextrin was yellowish by acid catalyst method while the enzymatic method was white. The qualitative test of lugol solution showed similar results by acid catalyst method and enzymatic method, there was brownish purple of the dextrin. The 80 mesh fineness of the dextrin by acid catalyst and enzymatic methods showed there were 94.7 % ± 0.06 and 93.96 % ± 0.02. The water content of the dextrin by acid catalyst method was 8.79 % ± 0.15 while by enzymatic method was 7.62 % ± 0.23. The ash content of the dextrin by acid catalyst method was 0.45 % ± 0.02 meanwhile by enzymatic method was 0.42 % ± 0.04. The solubility of the dextrin in the cold water by acid catalyst method was 57.47 % ± 0.25 while by enzymatic methods was 63.09 % ± 0.1. Dextrose equivalent of the dextrin by acid catalyst method was 13.65 ± 0.36 while by enzymatic method was 15.31 ± 0.46. The melting point of the dextrin by acid catalyst method was 185 oC ± 0.57 and by enzymatic method was 182 cC ± 0.57. The acid degree of the dextrin by acid catalyst method was 2.86 ± 0.23 while by enzymatic method was 4.39 ± 0.4.
Conclusion: This research suggests that the characterization of dextrin by acid and enzymatic methods meet the quality requirements of Indonesian National Standard (SNI) 01-2593-1992.
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan salah satu negara yang beriklim tropis. Negara
Indonesia ini mempunyai kekayaan alam yang melimpah terutama pada jenis
tanaman pangan lokal umbi-umbian, namun sampai saat ini pemanfaatan umbi
belum optimal. Agar kecukupan pangan saat ini dapat terpenuhi, maka upaya
yang dilakukan adalah meningkatkan produktivitas budidaya pangan dengan
pemanfaatan teknologi. Salah satunya adalah bahan lokal talas (Nurcahya, 2014).
Pemanfaatan sumber pangan dari komoditas pertanian berupa umbi-umbian
di Indonesia memiliki prospek yang baik untuk menambah devisa negara.
Tanaman umbi-umbian seperti ubi kayu dan ubi jalar sudah sering digunakan
sebagai sumber pangan dan bahan baku industri. Padahal umbi-umbian lain
seperti talas mempunyai potensi yang cukup baik untuk dikembangkan
(Ridal, 2003).
Penelitian-penelitian yang telah dilakukan tentang pemanfaatan umbi kayu
(tapioka) dalam pembuatan dekstrin diantaranya adalah Jati (2006) yang
melakukan penelitian tentang pengaruh waktu hidrolisis dan konsentrasi HCl
terhadap nilai Dextrose Equivalen (DE) dan karakterisasi mutu pati termodifikasi
dari pati tapioka dengan metode hidrolisis asam untuk mengetahui pengaruh
faktor lama pemanasan, konsentrasi HCl dan interaksi antara keduanya dalam
pembuatan pati termodifikasi secara metode basah (gelatinisasi) dan metode
kering (penyangraian). Peneliti lainnya Ningsih (2010) melakukan penelitian
tentang pembuatan dekstrin dari pati ubi kayu (Manihot esculenta) menggunakan
2
lebih luas dan dikarakterisasi sesuai dengan syarat mutu dekstrin untuk industri
pangan SNI 1992. Kemudian Pudiastuti dan Pratiwi (2013) juga telah melakukan
penelitian tentang pembuatan dekstrin dari tepung tapioka (merk “Gunung
Agung”) secara enzimatik (α-amilase dari Bacillus licheneformis) dengan
pemanasan microwave sebagai pengganti pemanas konvensional dan mengkaji
pengaruh konsentrasi pati dan waktu likuifaksi terhadap DE dan viskositas. Selain
itu Santosa (2010) juga telah melakukan penelitian tentang hidrolisa enzimatik
pati tapioka (merk “Gunung Agung”) dengan kombinasi pemanasan
microwave-water bath pada pembuatan dekstrin sebagai salah satu usaha untuk mengkonversi
pati tapioka menjadi dekstrin dengan ketersediaan bahan baku pati tapioka yang
terpenuhi, sehingga dapat mengurangi volume impor dekstrin. Peneliti lain
Triyono (2007) telah melakukan pemanfaatan jenis umbi lain yaitu ubi jalar
(Ipomea batatas (L.)) untuk meningkatkan fungsional pati dari ubi jalar dengan
menggunakan enzim α-amilase dari Bacillus subtilis sebagai bahan subsitusi
pengolahan pangan dengan memperhatikan pengaruh pH dan konsentrasi pati
yang dikarakterisasi sesuai persyaratan mutu Standar Nasioanal Indonesia (SNI).
Sun, et., al (2010) juga telah melakukan penelitian tentang pembuatan dekstrin
menggunakan pati jagung dan memperhatikan pengaruh suhu, waktu reaksi dan
penambahan α-amilase netral dan α-amilase termostabil pada nilai dextrose
equivalen (DE), yang kemudian dikarakterisasi dari morfologi, kristalografi,
distribusi ukuran partikel, scanning electron microscope, X-ray difraktometer,
3
Penelitian tentang pemanfaatan umbi talas dalam pembuatan dekstrin
masih terbatas, beberapa yang telah diteliti diantaranya Perwitasari (2009) yang
melakukan pembuatan dekstrin sebagai bahan perekat dari pati umbi talas
(Colocasia esculenta (L.)) dengan menggunakan variasi jumlah katalisator HCl
dan suhu pemanasan. Kemudian Ridal (2003) telah melakukan penelitian tentang
sifat fisiko-kimia tepung dan pati talas (Colocasia esculenta) dan kimpul
(Xanthosoma sp) yang dikarakterisasi dan diuji penerimaan α-amilase (Bacillus
licheneformis) terhadap pati talas dan kimpul. Peneliti lain Triyono (2006)
melakukan upaya pemanfaatan umbi talas (Colocasia esculenta) sebagai bahan
pati pada pengembangan teknologi pembuatan dekstrin menggunakan enzim α
-amilase jenis fungamil (fungi) dengan variasi konsentrasi pati dan enzim yang
digunakan. Penelitian-penelitian diatas umumnya menggunakan umbi talas jenis
Colocasia esculenta (L.) sebagai bahan baku pembuatan dekstrin, sementara talas
jenis Xanthosoma sagittifolium (L.) pemanfaatannya masih terbatas dan memiliki
potensi yang baik untuk dikembangkan sebagai bahan baku pembuatan dekstrin.
Talas adalah umbi dari tanaman tropis yang banyak dimanfaatkan di
beberapa negara karena sebagian besar bagian tanaman dapat dimanfaatkan untuk
dikonsumsi oleh manusia. Talas merupakan penghasil karbohidrat sehingga
berpotensi sebagai subsitusi terigu dan beras atau sebagai diversifikasi bahan
pangan, bahan baku industri dan lain sebagainya. Talas (Xanthosoma sp)
mengandung kadar pati yang tinggi yaitu 85,68 %. Umbi talas kaya akan gum
(musilages) yang dimanfaatkan sebagai bahan pengikat, emulsifier, dan karena
mempunyai granula pati yang kecil dapat dimanfaatkan sebagai bahan
4 biologis (Ridal, 2003).
Dalam industri farmasi terdapat dua jenis pati yang sering digunakan yaitu
pati alami dan pati modifikasi. Pati dalam bentuk alami (native starch) adalah pati
yang dihasilkan dari sumber umbi-umbian dan belum mengalami perubahan sifat
fisik dan kimia. Pati yang belum dimodifikasi mempunyai beberapa kekurangan
yaitu membutuhkan waktu pemasakan yang lama (sehingga membutuhkan energi
tinggi), pasta yang terbentuk keras dan tidak bening, sifatnya terlalu lengket, tidak
tahan dengan perlakuan asam dan kelarutan rendah. Kendala-kedala tersebut
menyebabkan pati alami penggunaannya terbatas dalam industri pangan, oleh
karena itu dikembangkan teknologi untuk memodifikasi pati sehingga diperoleh
pati dengan kecerahan lebih tinggi (pati lebih jernih), kekentalan yang stabil baik
pada suhu tinggi maupun suhu rendah, gel yang terbentuk lebih jernih, tekstur gel
yang terbentuk lebih lunak, granula pati lebih mudah pecah, waktu dan suhu
dalam gelatinisasi yang lebih rendah, kelarutan tinggi, serta waktu dan suhu
granula pati untuk pecah lebih rendah (Koswara, 2009).
Salah satu produk modifikasi pati adalah dekstrin. Pembuatan dekstrin dapat
dilakukan dengan dua cara yaitu dengan metode kering (penyangraian) dan
metode basah. Metode kering (penyangraian) menghasilkan perubahan warna
pada pati selama proses pembuatan sehingga dekstrin yang diperoleh berwarna
lebih gelap. Oleh karena itu dipilih pembuatan dekstrin dengan menggunakan
metode basah yang dilakukan dengan penambahan asam atau enzim. Pembuatan
dekstrin dengan menggunakan katalis asam memiliki keunggulan karena
prosesnya mudah, bahan baku mudah didapatkan dan murah (Jati, 2006).
5
proses yang tidak ekstrim (suhu sedang dan pH mendekati normal), tingkat
konversi yang lebih tinggi dan diperoleh reaksi yang lebih spesifik (Ridal, 2003).
Dekstrin adalah polimer dekstrosa dalam bidang farmasi digunakan sebagai
diluent tablet dan kapsul, pengikat, bahan selaput gula yang berfungsi sebagai
plasticizer, perekat dan agen pengetal (thickening agent) untuk suspensi (Rowe,
et al., 2009).
Dunia industri farmasi di Indonesia menggunakan dekstrin yang selama ini
diimport dari luar. Kebutuhan dekstrin dalam industri farmasi dari tahun ke tahun
semakin meningkat (Triyono, 2007). Volume import dekstrin Indonesia pada
tahun 2007 mencapai 39.309.703 kg senilai US$ 26.209.257. Itu meningkat dari
tahun sebelumnya yang hanya 36.747.033 kg senilai US$ 21.791.938
(Pudiastuti dan Pratiwi, 2013).
Berdasarkan uraian di atas maka dilakukan penelitian pembuatan dekstrin
dari pati umbi talas sehingga meningkatkan pemanfaatan pati umbi talas.
Kemudian dilakukan karakterisasi dekstin yang didapatkan menurut Standar
Nasional Indonesia (SNI 01-2593-1992).
1.2 Perumusan Masalah
a. Apakah dekstrin dari pati umbi talas (Xanthosoma sagittifolium (L.)
Schott) dengan metode katalis asam memenuhi persyaratan SNI
01-2593-1992 ?
b. Apakah dekstrin dari pati umbi talas (Xanthosoma sagittifolium (L.)
Schott) dengan metode enzimatis memenuhi persyaratan SNI
6
c. Apakah terdapat perbedaan karakterisasi dekstrin yang diperoleh dari pati
umbi talas (Xanthosoma sagittifolium (L.) Schott) dengan metode katalis
asam dan metode enzimatis ?
1.3Hipotesis
a. Dekstrin dari pati umbi talas (Xanthosoma sagittifolium (L.) Schott)
dengan metode katalis asam memenuhi persyaratan SNI 01-2593-1992.
b. Dekstrin dari pati umbi talas (Xanthosoma sagittifolium (L.) Schott)
dengan metode enzimatis memenuhi persyaratan SNI 01-2593-1992.
c. Terdapat perbedaan karakterisasi dekstrin yang diperoleh dari pati umbi
talas (Xanthosoma sagittifolium (L.) Schott) dengan metode katalis asam
dan metode enzimatis.
1.4Tujuan Penelitian
a. Mengetahui dekstrin dari pati umbi talas (Xanthosoma sagittifolium (L.)
Schott) dengan metode katalis asam apakah memenuhi persyaratan SNI
01-2593-1992.
b. Mengetahui dekstrin dari pati umbi talas (Xanthosoma sagittifolium (L.)
Schott) dengan metode enzimatis apakah memenuhi persyaratan SNI
01-2593-1992.
c. Mengetahui apakah terdapat perbedaan karakterisasi dekstrin yang
diperoleh dari pati umbi talas (Xanthosoma sagittifolium (L.) Schott)
7
1.5Manfaat Penelitian
Adapun manfaat penelitian ini adalah untuk meningkatkan teknologi
8
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Talas kimpul (Xanthosoma sagittifolium (L.) Schott) merupakan keluarga
talas yang berasal dari Amerika Tengah dan menyebar ke daerah-daerah tropika.
Tanaman kimpul dapat tumbuh di hampir seluruh kepulauan di Indonesia hingga
ketinggian 1300 meter di atas permukaan laut. Talas kimpul merupakan tanaman
tegak dengan pelepah berwarna hijau muda. Pelepah menyatu dengan batang dan
akan terasa halus ketika diraba. Daun berwarna hijau terang dengan permukaan
yang berlapis lilin dan memiliki bentuk seperti jantung (Setyawan, 2015).
Tanaman kimpul tumbuh baik di daerah tropika basah dengan curah hujan
merata sepanjang tahun. Umumnya tanaman kimpul akan memberikan hasil
optimum pada lahan darat yang gembur. Tanaman kimpul dapat tumbuh baik di
tanah yang terlindung sinar matahari. Kemampuan tanaman kimpul untuk tumbuh
di tempat ideal untuk mengisi lahan kosong di pedesaan. Tanaman kimpul cocok
untuk tanaman tumpang sari pada kebun-kebun kopi karena tahan terhadap
lingkungan (Ridal, 2003).
Talas merupakan tanaman sekulen yaitu tanaman yang umbinya banyak
mengandung air. Umbi tersebut terdiri dari umbi primer dan umbi sekunder.
Kedua umbi tersebut berada dibawah permukaan tanah. Hal yang membedakan
adalah umbi primer merupakan umbi induk yang memiliki bentuk silinder dengan
panjang 30 cm dan diameter 15 cm, sedangkan umbi sekunder merupakan umbi
yang tumbuh disekeliling umbi primer dengan ukuran yang lebih kecil. Umbi
9
vegetatif. Umur panen umbi berkisar antara 6-18 bulan dan ditandai dengan daun
yang tampak mulai menguning atau mengering (Nurcahya, 2014).
2.1.1 Sistematika tumbuhan
Kingdom : Plantae
Subkingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Liliopsida
Sub Kelas : Arecidae
Ordo : Arales
Famili : Araceae
Spesies : Xanthosoma sagittifolium (L.) Schott (Nurcahya,2014).
2.1.2 Nama lain
Talas mempunyai beberapa nama umum yaitu Talas Belitung (Kimpul),
Taro, Old cocoyam, ‘Dash(e)en’ dan ‘Eddo (e)’. Di beberapa negara juga dikenal
dengan nama lain, seperti : Abalong (Philipina), Taioba (Brazil), Arvi (India),
Keladi (Malaya), Satoimo (Japan), Tayoba (Spanyol) dan Yu-tao (China)
(Nurcahya, 2014).
2.1.3 Pengolahan talas
Salah satu hambatan pada produksi dan konsumsi talas adalah kandungan
kristal-kristal kalsium oksalat pada umbi dan daun segar yang dapat menyebabkan
rasa gatal pada kulit mulut dan tenggorokan (Rahmawati, dkk., 2012). Timbulnya
rasa gatal terutama disebabkan oleh kalsium oksalat bentuk rapida yang keluar
10
lidah, bibir dan langit-langit mulut ketika dikunyah (Ridal, 2003). Hal pertama
yang perlu diperhatikan adalah mengurangi kadar kalsium oksalat pada talas.
Kalsium oksalat dari persenyawaan garam antara ion kalsium dan ion oksalat. Ion
ini sangat bermanfaat untuk proses metabolisme dan untuk pertahanan internal
bagian talas (Nurcahya, 2014).
Cara tradisional dilakukan untuk menghilangkan rasa gatal dengan
perebusan secukupnya. Selain itu dapat dilakukan dengan perendaman semalaman
dalam air (Rahmawati, dkk., 2012). Langkah lain yang dapat dilakukan untuk
mengurangi kadar kalsium oksalat pada talas dapat dilakukan sebagai berikut :
a) Talas dicuci sampai bersih selama 5 menit menggunakan perbandingan
talas dan air (1:4) (Nurcahya, 2014).
b) Talas direndam selama 20 menit menggunakan NaCl berkadar 1 % dan
talas dicuci kembali dengan air (1:4) (Nurcahya, 2014).
c) Perlakuan kimiawi dengan penambahan asam kuat (HCl) yang
mendekomposisi kalsium oksalat menjadi asam oksalat. Reaksi antara HCl
dengan kalsium oksalat akan menghasilkan endapan CaCl2 dan asam
oksalat yang dapat dinyatakan dengan persamaan reaksi :
2HCl (l) + CaC2O4 (S) CaCl2(s) + H2C2O4 (l) (Ridal, 2003).
2.1.4 Kandungan gizi
Talas merupakan sumber pangan yang penting karena selain merupakan
sumber karbohidrat, protein dan lemak, talas juga mengandung beberapa unsur-
unsur mineral dan vitamin. Sebagai pengganti nasi, talas mengandung banyak
karbohidrat dan protein yang terkandung dalam umbinya, sedangkan daunnya
11
Umbi talas mengandung komponen makronutrien dan mikronutrien meliputi
protein, karbohidrat, lemak, serat kasar, fosfor, kalsium, besi, tiamin, riboflavin,
[image:28.595.114.398.199.460.2]niasin, dan vitamin C (Nurcahya, 2014).
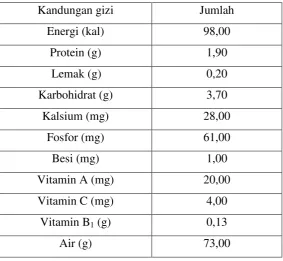
Tabel 2.1 Komposisi gizi umbi talas mentah (per 100 g)
Kandungan gizi Jumlah
Energi (kal) 98,00
Protein (g) 1,90
Lemak (g) 0,20
Karbohidrat (g) 3,70
Kalsium (mg) 28,00
Fosfor (mg) 61,00
Besi (mg) 1,00
Vitamin A (mg) 20,00
Vitamin C (mg) 4,00
Vitamin B1 (g) 0,13
Air (g) 73,00
(Turang dan Matindas, 2011).
Komposisi kimia tersebut tergantung pada beberapa faktor, seperti jenis
varietas, usia dan tingkat kematangan dari umbi. Faktor iklim dan kesuburan
tanah juga turut berperan terhadap perbedaan komposisi kimia dari umbi talas.
Nilai lebih dari umbi talas adalah kemudahan patinya untuk dicerna. Hal ini
disebabkan oleh ukuran granula patinya yang cukup kecil dan patinya
mengandung amilosa dalam jumlah yang cukup banyak (20-25%). Selain itu talas
juga bebas dari gluten, maka pangan olahan dari talas dapat digunakan untuk diet
12
2.2 Pati
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Berbagai
pati tidak sama sifatnya, tergantung dari panjang rantai C-nya, serta apakah lurus
atau bercabang rantai molekulnya. Pati terdiri dari dua fraksi yang dapat
dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut
disebut amilopektin (Winarno, 2004).
Secara umum pati terdiri dari 20 % bagian yang larut air panas (amilosa) dan
80 % bagian yang tidak larut air panas (amilopektin). Amilosa merupakan
molekul yang lurus, terdiri dari 250-300 satuan D-glukopiranosa dan dihubungkan
secara seragam oleh ikatan α-1,4 glukosida. Amilopektin terdiri dari 1000 atau
lebih satuan glukosa yang kebanyakan juga dihubungkan dengan hubungan α-1,4
glukosida. Namun, terdapat juga sejumlah hubungan α-1,6 glukosida yang
terdapat pada titik-titik percabangan. Jumlah hubungan semacam ini terdapat
kurang lebih 4 % dari seluruh jumlah hubungan atau satu untuk setiap 25 satuan
glukosa (Gunawan dan Mulyani, 2010). Struktur kimia pati (Rowe, et al., 2009)
13
Gambar 2.1 Struktur pati
Amilosa dan amilopektin merupakan komponen penting pembentuk struktur
dasar pati, dan sangat mempengaruhi karakteristik fisiko kimia pati yang
dihasilkan. Amilosa memiliki karakteristik rantai relatif lurus, struktur gel kuat,
serta apabila diberi pewarna iodine akan menghasilkan warna biru. Sementara itu,
amilopektin memiliki karakteristik rantai bercabang, struktur gel lembek, dan
apabila diberi pewarna iodine akan menghasilkan warna coklat kemerahan
(Herawati, 2012).
2.2.1 Pembuatan pati
Pembuatan pati melalui tahapan proses pengupasan, pencucian,
pemotongan, penghalusan, peremasan, penyaringan, pengendapan, pencucian,
pengeringan, penghalusan dan pengayakan. Proses pengupasan dan pencucian
bertujuan untuk membersihkan umbi dari akar, kulit dan kotoran yang melekat
pada umbi tersebut. Pemotongan dimaksudkan untuk mempermudah proses
penghalusan umbi, penghalusan dilakukan bertujuan untuk merusak jaringan umbi
14
Peremasan dimaksudkan untuk menyempurnakan kerusakan jaringan umbi
agar pati dapat keluar dari jaringannya dengan menambahkan akuades pada proses
penghalusan. Penyaringan bertujuan untuk memisahkan kotoran yang sukar
dihilangkan dengan pencucian dan memisahkan ampas dengan pati yang
diperoleh. Pati dibiarkan mengendap selama satu malam, kemudian dilakukan
pencucian dengan dengan akuades untuk mendapatkan pati yang bersih dan
berwarna putih (Ridal, 2003)
Pengeringan pati basah dilakukan dengan meletakkan pati basah pada suhu
ruangan hingga pati kering. Kemudian dilakukan penghalusan pati dan
pengayakan untuk mendapatkan pati yang halus.
2.3 Dekstrin
Dekstrin adalah pati atau hidrolisis pati secara parsial dimodifikasi oleh
pemanasan dalam keadaan kering dengan atau tanpa asam, alkali atau agen
kontrol pH (USP, 2007).
Dekstrin merupakan produk degradasi pati yang dapat dihasilkan dengan
beberapa cara, yaitu memberikan perlakuan suspensi pati dalam air dengan asam
atau enzim pada kondisi tertentu, atau degradasi pati dalam bentuk kering dengan
menggunakan perlakuan panas atau kombinasi antara panas dan asam atau katalis
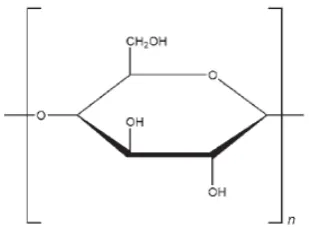
lain. Dekstrin mempunyai rumus kimia (C6H10O5)n dan memiliki struktur serta
karakteristik intermediate antara pati dan dekstrosa (Herawati, 2010).
Dekstrin praktis tidak larut dalam kloroform, etanol (95%), eter, dan
propan-2-ol, sedikit larut dalam air dingin dan sangat larut dalam air panas membentuk
larutan mucilaginous. Berat molekul dekstrin secara khas adalah 4.500-85.000 dan
15
[image:32.595.214.369.121.240.2]525. Struktur kimia dekstrin (Rowe, et al., 2009) ditunjukkan pada gambar 2.2.
Gambar 2.2 Struktur dekstrin
2.3.1 Hidrolisis asam
Hampir semua reaksi hidrolisis memerlukan katalisator untuk mempercepat
jalannya reaksi. Katalisator yang dipakai dapat berupa enzim atau asam. Asam
yang dipakai beraneka ragam mulai dari asam klorida, asam sulfat, sampai asam
nitrat. Yang berpengaruh pada kecepatan reaksi adalah konsentrasi ion H+, bukan
jenis asamnya. Meskipun demikian, di dalam industri umumnya dipakai asam
klorida. Pati termodifikasi dengan hidrolisis asam klorida menghasilkan pati yang
strukturnya lebih renggang, sehingga air lebih mudah menguap pada waktu
pengeringan (Agra, dkk., 1973).
Faktor-faktor yang mempengaruhi hidrolisis :
1. Suhu
Suhu mempengaruhi jalannya reaksi hidrolisis, terutama pada kecepatan
reaksinya. Untuk kisaran suhu 90-100 oC, kecepatan reaksi meningkat dua
kali lebih cepat setiap kenaikan suhu 5 oC. Sedangkan secara keseluruhan,
pada umumnya kecepatan reaksi hidrolisis akan meningkat dua kali lebih
cepat setiap kenaikan suhu 10 oC. Dengan penggunaan suhu yang lebih
16
Penggunaan suhu tinggi juga dapat meminimalkan penggunaan katalisator
sehingga biaya operasional lebih ekonomis.
2. Katalisator
Penggunaan katalisator pada reaksi hidrolisis dilakukan pertama kali oleh
Braconnot pada 1819. Beliau menghidrolisis linen (selulosa) menjadi gula
fermentasi dengan menggunakan asam sulfat pekat. Setelah itu ditemukan
bahwa asam dapat digunakan sebagai katalisator untuk mempercepat
reaksi hidrolisis (Groggins, 1997). Katalisator yang biasa di gunakan
berupa asam, yaitu asam klorida, asam sulfat, asam sulfit, asam nitrat, atau
yang lainnya. Makin banyak asam yang di pakai sebagai katalisator, makin
cepat jalannya reaksi hidrolisa. Penggunaan katalisator dengan konsentrasi
kecil (larutan encer) lebih disukai karena akan memudahkan pencampuran
sehingga reaksi dapat berjalan merata dan efektif. Penggunaan konsentrasi
katalisator yang kecil dapat mengurangi kecepatan reaksi. Namun hal ini
dapat diatasi dengan menaikkan suhu reaksi.
3. Waktu
Waktu reaksi mempengaruhi konversi yang dihasilkan. Semakin lama
waktu reaksi, maka semakin tinggi pula konversi yang di hasilkan. Hal ini
disebabkan oleh kesempatan zat reaktan untuk saling bertumbukan dan
bereaksi semakin besar, sehingga konversi yang di hasilkan semakin tinggi
(Perwitasari dan Cahyo, 2009).
4. Netralisasi
Proses hidrolisis yang dilakukan dalam penelitian ini merupakan proses
17
pemecahan senyawa lebih lanjut. Proses hidrolisis diakhiri dengan
menghentikan pemanasan yang dilakukan dalam autoklaf, dan
menetralisasi suasana asam. Kondisi asam oleh asam klorida dinetralisasi
dengan larutan natrium karbonat (Perwitasari dan Cahyo, 2009).
Reaksi :
2 HCl + Na
2CO3 2 NaCl + H2O + CO2
2.3.2 Enzim α-amilase
α-amilase (α-1,4-glukan-4-glukanohidrolase) adalah enzim yang terdapat
dalam getah pankreas dan ludah yang dapat menghidrolisis amilum dengan
pemecahan secara acak terhadap ikatan glukosidik α-1,4. Amilosa memberikan
campuran dari glukosa, maltosa sedangkan amilopektin memberikan campuran
dari oligosakarida bercabang yang mengandung ikatan α-1,6 (Gunawan dan
Mulyani, 2010). α-amilase merupakan endo-enzim yang memecah ikatan α-1,4
secara random atau pada ikatan yang berada ditengah rantai polimer (Ridal, 2003).
α-amilase adalah jenis enzim amilase terbesar yang terkandung dalam tubuh
manusia dan mamalia yang lain. Pada tubuh manusia α-amilase terdapat pada
saliva dan pankreas. Selain itu, α-amilase juga dapat ditemukan pada gandum
(barley), jamur (ascomycetes), dan bakteri (bacillus). Enzim α-amilase umumnya
diisolasi dari Bacillus amyloquefaciens, Bacillus subtilis, Bacillus coagulans,
Pseudomonas saccharophila, Aspergillus orizae, dan Aspergillus candidus
(Robyt, 1984).
Hidrolisis enzimatis memberikan beberapa keuntungan, yaitu prosesnya
18
dihasilkan lebih sedikit abu dan kerusakan warna dapat diminimalkan (Setyawan,
2015) serta dihasilkan tingkat konversi yang lebih tinggi (Ridal, 2003).
[image:35.595.165.444.151.346.2]
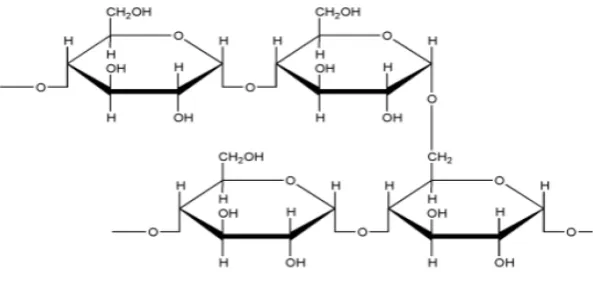
Gambar 2.3Formasi aktivitas α-amilase pada amilopektin (Meyer, 1973).
Beberapa faktor yang dapat mempengaruhi kerja enzim yaitu:
a. Suhu, semua reaksi kimia dipengaruhi oleh suhu. Kecepatan reaksi katalis
enzim dapat meningkat dengan meningkatnya suhu, tetapi karena enzim
merupakan protein yang akan terdenaturasi pada suhu tinggi maka enzim
memiliki suhu optimum dalam melakukan kerjanya. Setiap enzim
memiliki temperatur optimum yang berbeda-beda sehingga diperoleh
efisiensi yang maksimum (Mckee dan Mckee, 2004).
b. Nilai pH, konsentrasi ion hidrogen dapat mempengaruhi kerja enzim.
Perubahan pH yang tajam dapat menyebabkan enzim terdenaturasi.
Beberapa enzim aktif hanya pada nilai pH yang sempit. Nilai pH optimum
pada setiap enzim sangat bervariasi (Mckee dan Mckee, 2004).
c. Konsentrasi substrat, untuk dapat terjadi kompleks enzim substrat perlu
adanya kontak antara enzim dengan subtrat pada bagian aktif enzim.
19
karboksilat dan kation imidazolium. Pada konsentrasi substrat rendah,
bagian aktif enzim hanya menampung sedikit substrat. Bila konsentrasi
substrat diperbesar, makin banyak substrat yang dapat berhubungan
dengan enzim pada bagian aktif tersebut. Dengan demikian konsentrasi
kompleks enzim substrat makin besar dan hal ini menyebabkan makin
besarnya kecepatan reaksi. Pada suatu batas konsentrasi substrat tertentu,
semua bagian aktif telah dipenuhi oleh substrat atau telah jenuh dengan
substrat. Dalam keadaan ini, bertambah besarnya konsentrasi substrat tidak
menyebabkan bertambah besarnya konsentrasi kompleks enzim substrat,
sehingga jumlah hasil reaksinya pun tidak bertambah besar (Poedjiadi dan
Supriyanti, 2009).
d. Konsentrasi enzim, kecepatan suatu reaksi yang menggunakan enzim
tergantung pada konsentrasi enzim tersebut. Pada suatu konsentrasi
substrat tertentu, kecepatan reaksi bertambah dengan bertambahnya
konsentrasi enzim. Dalam hal ini substrat yang digunakan dalam jumlah
yang berlebih (Poedjiadi dan Supriyanti, 2009).
2.3.3 Penggunaan dekstrin
Dekstrin dapat digunakan dalam bidang farmasi dan pangan. Dalam bidang
farmasi dekstrin digunakan sebagai diluent tablet dan kapsul, pengikat, bahan
selaput gula yang berfungsi sebagai plasticizer, perekat dan agen pengetal
20
Beberapa sediaan farmasi yang menggunakan dekstrin sebagai bahan
tambahan :
1. OptiNateTM merupakan kapsul multivitamin/mineral yang diberikan
sebelum/sesudah melahirkan dan tablet kombinasi dengan asam lemak
esensial (Niazi, 2009a).
2. Krim hidrokortison 0,5 % dan krim hidrokortison 1 % (Niazi, 2009b).
Pada bidang pangan dekstrin dapat dimanfaatkan sebagai komponen utama
maupun bahan tambahan makanan dalam koridor food ingredient yang merupakan
komponen bahan makanan untuk memproduksi makanan siap saji. Dekstrin dapat
berfungsi sebagai bahan pengikat dan enkapsulasi yang diaplikasikan dalam
pengembang kue, perisa, rempah dan minyak (Herawati, 2012). Selain itu
dekstrin dapat digunakan juga sebagai sumber karbohidrat bagi orang yang
menjalani program diet karena dekstrin memiliki kandungan elektrolit yang
21
BAB III
METODOLOGI PENELITIAN
3.1 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Penelitian dan Teknologi Sediaan
Farmasi III Fakultas Farmasi Universitas Sumatera Utara.
3.2 Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian deskriptif yang bertujuan
menggambarkan sifat dari suatu keadaan secara sistematis, yaitu untuk
mengetahui karakteritik dekstrin dari pati umbi talas (Xanthosoma sagittifolium
(L.) Schott) dengan metode katalis asam dan metode enzimatis.
3.3 Alat-alat
Alat-alat yang digunakan adalah alat-alat gelas, autoklaf (Wisd Laboratory
Analytical), ayakan 80 mesh, batang pengaduk, blender (Miyako), buret (Oberol),
cawan porselen, freezer (LG), hot plate stirer (Thermo Scientific Cimarec), kertas
saring, klem, krus porselen, melting point (Stuart), orbital shaker (Major Science),
oven (Dynamica), penangas air, penjepit tabung, pH meter (Eco Tester), saringan
kain halus, statif, spatula, spot plate, tanur (Stuart), termometer, dan timbangan
digital (Boeco Germany).
3.4 Bahan
Bahan-bahan yang digunakan adalah umbi talas (Xanthosoma sagittifolium
(L.) Schott), akuades, enzim α-amilase (Sigma All-rich), etanol absolut p.a
(Merck), larutan fehling A (Fluka Analytical Sigma-Aldrich), larutan fehling B
22 Na2CO3 1 N dan NaOH 0,1 N.
3.5 Pembuatan Pereaksi
3.5.1 Larutan HCl 1 N
Sebanyak 8,5 ml larutan asam klorida P diencerkan dengan akuades hingga
100 ml (Ditjen POM, 1995).
3.5.2 Larutan Na2CO3 1 N
Sebanyak 5,3 gram natrium karbonat dilarutkan dalam akuades hingga 100
ml (Ditjen POM, 1979).
3.5.3 Larutan lugol
Sebanyak 5 g iod (I2) dan 10 g KI dilarutkan dalam 10 ml akuades, setelah
larut kemudian diencerkan menjadi 100 ml (SNI, 1992).
3.5.4 Larutan NaOH 0,1 N
Sebanyak 0,4 gram natrium hidroksida dilarutkan dalam akuades bebas
karbondioksida hingga 100 ml (Ditjen POM,1979).
3.5.5 Larutan fenolftalein LP
Sebanyak 1 gram fenolftalein P dilarutkan dalam 100 ml etanol P (Ditjen
POM, 1995).
3.6 Penyiapan Sampel
Penyiapan sampel meliputi pengambilan sampel, identifikasi sampel dan
23
3.6.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purporsif, artinya tanpa
membandingkan sampel yang diambil dengan sampel yang sama dari daerah lain.
Sampel yang digunakan adalah umbi talas (Xanthosoma sagittifolium (L.) Schott),
yang diperoleh di Pasar Sore Jamin Ginting yang berasal dari Tanah Karo
(Berastagi), Kecamatan Medan Baru, Sumatera Utara.
3.6.2 Identifikasi sampel
Identifikasi sampel (umbi talas) dilakukan di Pusat Penelitian dan
Pengembangan Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.6.3 Pengolahan sampel
Sebanyak 8 kg umbi talas dikupas dan dicuci menggunakan air bersih.
Kemudian umbi talas dipotong melintang dengan ukuran ± 1 cm, lalu dimasukkan
ke dalam blender dan ditambah akuades dengan perbandingan 5L/kg. Blender
hingga halus dan disaring dengan saringan kain halus sambil diperas, dipisahkan
ampas umbi talas dan suspensi pati. Kemudian ditambahkan akuades ke ampas
sambil diperas, lalu disaring dan uji perlakuan ini diulangi hingga didapat air
sarian bening. Suspensi pati didiamkan dalam wadah hingga pati mengendap
selama ± 24 jam. Setelah 24 jam bagian atas larutan yang keruh dibuang dan
tambahkan sebanyak 2L/kg akuades dibiarkan selama ± 24 jam lagi. Kemudian
dibuang cairan bening bagian atas dan endapan pati dikeringkan pada suhu
ruangan. Pati kering yang diperoleh kemudian dihaluskan dengan blender dan
diayak dengan ayakan 80 mesh. Kemudian dilakukan pengujian kualitatif pati
24 dapat dilihat pada Lampiran 14, halaman 56.
3.7 Metode Pembuatan Dekstrin
3.7.1 Metode katalis asam
Sebanyak 300 g pati ditambahkan dengan akuades hingga 1,5 L dibuat
suspensi pati 20 %. Kemudian ditambahkan dengan katalis asam (HCl 1 N) 150
ml dan diaduk hingga homogen. Suspensi pati dipanaskan dalam autoklaf selama
10 menit pada suhu 110 oC. Reaksi hidrolisis dihentikan dengan menambahkan
Na2CO3 1 N (217 ml) hingga didapat pH 7 dan didinginkan pada suhu ruangan.
Kemudian ditambahkan etanol absolut p.a sebanyak 300 ml (1:1) dan diaduk.
Dekstrin didinginkan dalam freezer selama ± 12 jam hingga terbentuk dua
lapisan. Selanjutnya disaring dan endapan yang diperoleh dikeringkan dalam oven
pada suhu 80 oC selama 3 jam, didapatkan dekstrin kasar, kemudian dekstrin
dihaluskan mengunakan blender dan diayak menggunakan ayakan 80 mesh serta
dilakukan pengujian kualitatif dengan larutan lugol. Hasil yang diperoleh adalah
serbuk dekstrin (Perwitasari, 2009).
3.7.2 Metode enzimatis
Sebanyak 50 g pati ditambahkan dengan akuades hingga 250 ml di buat
suspensi 20 %. Kemudian dilakukan pengecekan pH (pH=6,8). Kemudian
suspensi pati dipanaskan diatas hot plate stirer pada suhu 95 oC dan diaduk
hingga didapat gel bening (gelatinisasi). Selanjutnya suhu diturunkan hingga
40 oC dan kemudian tambahkan enzim α-amilase 0,025 g/50 g pati (likuifaksi).
Dilakukan hidrolisis selama 24 jam sambil terus diaduk dan dilakukan pengujian
25
dekstrin hingga mendidih dan dikeringkan dalam oven pada suhu 80 oC selama 7
jam. Kemudian dekstrin dihaluskan dengan blender dan diayak dengan
ayakan 80 mesh. Hasil yang diperoleh adalah serbuk dekstrin (Ningsih, 2010).
3.8 Pemeriksaan Rendemen
Rendemen dekstrin yang diperoleh dapat dihitung dengan cara
membandingkan antara berat pati yang digunakan dan berat dekstrin yang
diperoleh (Ningsih, 2010).
Rendemen = �
� x 100 %
Dimana; a = berat pati yang digunakan (g)
b = berat dekstrin yang diperoleh (g)
3.9 Pemeriksaan Karakteristik Dekstrin
3.9.1 Pemeriksaan warna
Pemeriksaan warna dilakukan dengan mengamati warna dekstrin putih
sampai kekuning-kuningan (SNI, 1992).
3.9.2 Pengujian kualitatif dengan larutan lugol
3.9.2.1 Metode katalis asam
Sebanyak 0,5 g serbuk dekstrin dimasukkan ke dalam tabung reaksi.
Kemudian ditambah 25 ml air suling dan ditetesi dengan larutan lugol, warna
yang terjadi diamati (SNI, 1992).
3.9.2.2 Metode enzimatis
26
konsentrasi pati 20 % pada suhu 95 oC, dilanjutkan pada suhu 40 oC selama 24
jam dan dilakukan pengujian kualitatif dengan larutan lugol setiap 3 jam
(Ningsih, 2010).
3.9.3 Penetapan kehalusan 80 mesh
Sebanyak 10 g serbuk dekstrin diayak dengan ayakan berukuran 80 mesh.
Bagian yang tertinggal dalam ayakan ditimbang (SNI, 1992).
Kehalusan 80 mesh = (100 – a) %
Dimana: a= persentase dari bagian yang tidak melewati ayakan 80 mesh
3.9.4 Penetapan kadar air
Sebanyak 2 g serbuk dekstrin dimasukkan dalam sebuah krus porselen yang
telah diketahui bobotnya. Dibiarkan selama 2 jam dalam lemari pengering pada
suhu 100 oC. Setelah itu didinginkan dalam desikator, lalu ditimbang. Pekerjaan
ini dilakukan berulang kali selang 1 jam sampai bobot tetap (SNI, 1992).
Kadar air
=
Penyusutan bobot serbuk dekstrin (g)Bobot serbuk dekstrin (g) X100 %
3.9.5 Penetapan kadar abu
Krus porselen kosong dipijar dan didinginkan, kemudian ditimbang sampai
bobot tetap, kedalam krus ini ditimbang 2 g serbuk dekstrin diarangkan
perlahan-lahan dalam tanur pada suhu 600 °C, dipijarkan sampai menjadi abu. Setelah itu
krus didinginkan dalam desikator dan ditimbang sampai bobot tetap (SNI, 1992).
Kadar abu = Bobot abu (g)
27
3.9.6 Penetapan kelarutan dalam air dingin
Sebanyak 0,5 g serbuk dekstrin ditimbang dalam cawan porselen yang telah
diketahui bobotnya. Kemudian dilarutkan dengan air dalam labu ukur 50 ml
sampai tanda tera. Kemudian disaring dan dipipet 10 ml, diuapkan dipenangas air.
Setelah itu dipanaskan dalam lemari pengering pada suhu 100 oC selama 3 jam
hingga bobot tetap (SNI, 1992).
Kelarutan dalam air dingin = a (g)
Bobot serbuk dekstrin (g)X fp x 100 %
Dimana : a = bobot kering dari 10 ml larutan
fp= faktor pengenceran
3.9.7 Penetapan kadar dekstrosa ekuivalen (DE)
Nilai dekstrosa ekuivalen diawali dengan mancari nilai Fehling Factor
dengan cara 2,5 gram glukosa dilarutkan dengan akuades sampai 1000 ml lalu
diambil 15 ml dan ditambahkan larutan fehling A dan B masing-masing 5 ml.
campuran dididihkan kemudian dititrasi dalam keadaan mendidih dengan larutan
glukosa sampai warna coklat kemerahan. Kebutuhan titran dicatat lalu Fehling
Factor dihitung dengan cara:
Faktor Fehling (FF) = Kebutuhan titran (ml )x berat glukosa (g)
1000
Nilai dekstrosa ekuivalen ditentukan dengan cara : larutan dekstrin dibuat
dengan konsentrasi 2,5 g/50 ml, lalu dimasukkan buret. Sebanyak 50 ml akuades
ditambahkan masing-masing 5 ml larutan fehling A dan B dan 15 ml larutan
glukosa. Larutan dididihkan dan dititrasi dengan larutan dekstrin sampai berwarna
coklat kemerahan. Titran yang dibutuhkan dicatat dan nilai dekstrosa ekuivalen
28
DE = FF x 100
konsentrasi larutan dekstrin (g/ml ) x kebutuhan titran (ml )
3.9.8 Pengujian titik lebur
Sebanyak 50 mg serbuk dekstrin dimasukkan ke dalam pipa kapiler.
Kemudian diletakkan dalam alat melting point, atur suhu hingga mencapai 200 oC,
amati serbuk dekstrin dalam pipa kapiler yang melebur melalui kaca pembesar.
Catat suhu serbuk dekstrin mulai melebur.
3.9.9 Penetapan derajat asam
Sebanyak 5 g serbuk dekstrin dimasukkan ke dalam erlenmeyer 250 ml dan
dituangi 100 ml etanol absolut p.a yang terlebih dahulu dinetralkan dengan
fenolftalein. Biarkan tertutup selama 24 jam, sambil kadang-kadang digoyangkan
(Orbital Shaker). Setelah disaring dengan kertas saring, 50 ml saringan dititar
dengan NaOH 0,1 N, dicatat volume NaOH 0,1 N yang diperlukan untuk menitar
100 g serbuk dekstrin (SNI, 1992).
Derajat asam = fp x ml titrasi x N NaOH x 100 g
bobot serbuk dekstrin (g)
29
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sampel
Identifikasi sampel telah dilakukan di Pusat Penelitian dan Pengembangan
Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor adalah umbi talas
(Xanthosoma sagittifolium (L.) Schott) dari famili Araceae. Hasil identifikasi
dapat dilihat pada Lampiran 9, halaman 51.
4.2 Rendemen
Sebelum pembuatan dekstrin dilakukan orientasi beberapa formula
pembuatan dekstrin, dengan formula sebagai berikut :
Tabel 4.1 Orientasi metode katalis asam (HCl 1 N)
Variabel F1 F2 F3 F4
Konsentrasi pati 20 % 20 % 20 % 20 %
HCl 1 N 15 ml 15 ml 10 ml 10 ml
Suhu 110 oC 110 oC 110 oC 110 oC
Waktu 10 menit 10 menit 10 menit 10 menit
Na2CO3 1 N 28,7 ml 25,5 ml 14,5 ml 18,3 ml
Etanol absolut p.a - 100 ml 100 ml 100 ml
Pengeringan Oven Hot plate Oven Hot plate
Hasil Dekstrin
lengket Dekstrin basah Serbuk dekstrin kekuningan Serbuk dekstrin coklat
Dari Tabel 4.1 diatas dapat dilihat bahwa hasil orientasi dengan metode
katalis asam (HCl 1 N) pada formula 1 (F1) diperoleh dekstrin yang lengket. Hal
ini disebabkan masih terdapatnya air dalam jumlah yang cukup banyak sehingga
30
Sedangkan pada formula 2 (F2) diperoleh dekstrin yang basah. Hal ini dapat
disebabkan karena jumlah HCl yang digunakan, semakin banyak jumlah katalis
asam maka semakin cepat proses hidrolisis, walaupun telah dilakukan pemisahan
dengan etanol absolut p.a. Pada formula 4 (F4) diperoleh serbuk dekstrin
berwarna coklat dengan menggunakan HCl 1 N 10 ml dan pemisahan dengan
etanol absolut p.a. Hal ini dapat disebabkan karena pengeringan dekstrin
menggunakan hot plate menghasilkan panas yang tidak merata dan menghasilkan
dekstrin berwarna coklat. Oleh karena itu digunakan formula 3 (F3) sebagai
[image:47.595.113.514.367.543.2]formula terbaik dengan diperoleh serbuk dekstrin berwarna kekuningan.
Tabel 4.2 Orientasi metode enzimatis (enzim α-amilase)
Variabel F1 F2 F3
Konsentrasi Pati 30 % 20 % 15 %
Suhu 95 oC 95 oC 95 oC Enzim α-amilase 0,03 g 0,01 g 0,0075 g
Hasil Gel mengendap
dekstrin tidak terbentuk Gel keruh serbuk dekstrin putih terbentuk Gel bening Serbuk dekstrin putih terbentuk
Dekstrin - 13,4208 g 5,2450 g
Dari Tabel 4.2 diatas dapat dilihat bahwa hasil orientasi metode enzimatis
(enzim α-amilase) pada formula 1 (F1) dekstrin tidak terbentuk karena diperoleh
gel yang mengendap pada bagian dasar beaker pada saat gelatinisasi pada
suhu 95 oC, sehingga penambahan enzim tidak memberikan pengaruh.
Konsentrasi pati yang tinggi yaitu 30 % (30 g ad 100 ml akuades) menyebabkan
gelatinisasi sempurna tidak terjadi. Endapan putih lebih banyak terbentuk pada
31
diberikan tiap satuan waktu tidak cukup untuk memecah semua granula pati
membentuk gelatin. Sebagian granula pati lebih dulu mengendap sebelum suhu
gelatinisasi tercapai (Santosa, 2010).
Pada formula 2 (F2) merupakan formula terbaik dengan konsentrasi pati
20 % (20 g ad 100 ml akuades) karena dekstrin dapat terbentuk dan dekstrin yang
diperoleh cukup banyak yaitu 13,4208 g. Sedangkan pada formula 3 (F3) dekstrin
dapat terbentuk dengan konsentrasi pati 15 % (15 g ad 100 ml akuades), namun
dekstrin yang dihasilkan sedikit yaitu 5,2540 g. Hal ini dikarenakan semakin
sedikit konsentrasi pati yang digunakan maka semakin sedikit dekstrin yang
terbentuk. Konsentrasi enzim yang digunakan sesuai dengan penelitian yang telah
dilakukan Santosa (2010) yaitu konsentrasi enzim α-amilase yang digunakan
adalah 0,025 g/50 g pati.
Berdasarkan hasil penelitian diperoleh rendemen yang berbeda pada
pembuatan dekstrin dengan metode katalis asam sesuai formula 3 (F3) dan
metode enzimatis sesuai formula 2 (F2). Dekstrin dengan metode katalis asam
didapatkan rendemen yaitu 41,73 % dan dengan metode enzimatis yaitu 67,10 %.
Perhitungan dapat dilihat pada Lampiran 15, halaman 57. Rendemen yang
diperoleh bergantung pada konsentrasi pati yang digunakan. Hal ini sesuai dengan
penelitian yang dilakukan Triyono (2006) produk dekstrin diperoleh pada kondisi
32
4.3 Karakteristik Dekstrin
Berdasarkan hasil penelitian yang telah dilakukan diperoleh dekstrin dengan
menggunakan dua metode yaitu metode katalis asam (HCl 1 N) dan metode
enzimatis (enzim α-amilase). Kemudian dilakukan karakterisasi sesuai dengan
[image:49.595.115.516.257.715.2]persyaratan mutu SNI 01-2593-1992, hasil dapat dilihat pada Tabel 4.3 berikut :
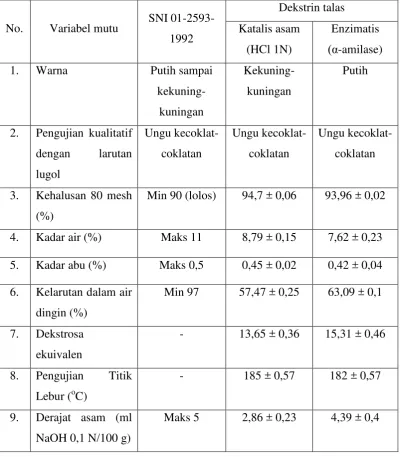
Tabel 4.3 Karakteristik dekstrin
No. Variabel mutu SNI 01-2593-1992 Dekstrin talas Katalis asam (HCl 1N) Enzimatis (α-amilase) 1. Warna Putih sampai
kekuning-kuningan
Kekuning-kuningan
Putih
2. Pengujian kualitatif
dengan larutan lugol Ungu kecoklat-coklatan Ungu kecoklat-coklatan Ungu kecoklat-coklatan
3. Kehalusan 80 mesh
(%)
Min 90 (lolos) 94,7 ± 0,06 93,96 ± 0,02
4. Kadar air (%) Maks 11 8,79 ± 0,15 7,62 ± 0,23
5. Kadar abu (%) Maks 0,5 0,45 ± 0,02 0,42 ± 0,04
6. Kelarutan dalam air
dingin (%)
Min 97 57,47 ± 0,25 63,09 ± 0,1
7. Dekstrosa
ekuivalen
- 13,65 ± 0,36 15,31 ± 0,46
8. Pengujian Titik
Lebur (oC)
- 185 ± 0,57 182 ± 0,57
9. Derajat asam (ml
NaOH 0,1 N/100 g)
33
4.3.1 Warna dekstrin
Dekstrin industri pangan adalah salah satu produk hidrolisis zat pati,
berwarna putih sampai kekuning-kuningan (SNI,1992). Hasil penelitian
didapatkan, dekstrin talas berwarna kekuning-kuningan yang dibuat dengan
metode katalis asam (HCl 1 N) dan yang dibuat dengan metode enzimatis (enzim
α-amilase) berwarna putih. Hasil dapat dilihat pada Lampiran 16, halaman 58. Hal
ini telah sesuai dengan persyaratan mutu yang tetapkan dalam SNI 01-2593-1992.
Perbedaan warna ini dapat disebabkan karena proses pembuatan dekstrin yang
berbeda. Pada pembuatan dekstrin dengan metode enzimatis dilakukan pada suhu
yang tidak ekstrim yaitu 40 oC, sehingga tidak terjadi penguraian pati lebih lanjut
menjadi glukosa dan dapat diperoleh dekstrin berwarna putih (Ningsih, 2010).
Sedangkan pada pembuatan dekstrin dengan metode katalis asam dilakukan
pada suhu yang tinggi yaitu 110 oC yang bisa menyebabkan pati lebih banyak
terhidrolisis. Hal ini dapat dicegah dengan netralisasi menggunakan Na2CO3 1 N
dan pemisahan dengan etanol absolut p.a. Netralisasi dan pemisahan dapat
mengurangi jumlah HCl dan air yang terdapat dalam dekstrin, sehingga mencegah
hidrolisis pati lebih lanjut selama proses pengeringan. Hal ini sesuai dengan
penelitian sebelumnya yang dilakukan oleh Perwitasari dan Cahyo (2009)
konversi pati menjadi dekstrin meningkat dengan bertambahnya suhu, waktu dan
konsentrasi HCl yang digunakan. Namun konversi pati akan mengalami titik balik
dimana konversi pati akan menurun karena semakin cepat reaksi hidrolisa pati
menjadi glukosa, sehingga untuk menghasilkan dekstrin sebagai produk parsial
34
4.3.2 Pengujian kualitatif dengan larutan lugol
Pengujian kualitatif dengan larutan lugol menunjukkan hasil yang sama dari
pembuatan dekstrin menggunakan metode katalis asam (HCl 1 N) dan metode
enzimatis (enzim α-amilase). Warna yang diperoleh adalah ungu
kecoklat-coklatan hasil dapat dilihat pada Lampiran 17, halaman 59. Hal ini telah sesuai
dengan persyaratan mutu yang tetapkan dalam SNI 01-2593-1992.
Warna ungu kecoklatan menandakan terdapatnya gula pereduksi dari hasil
hidrolisis pati dengan metode katalis asam dan metode enzimatis. Hidrolisis ini
memecah polisakarida menjadi monomer-monomer yang lebih kecil dan
mempunyai sifat mereduksi. Hal ini sama dengan penelitian yang dilakukan Jati
(2006), warna ungu kecoklatan yang dihasilkan menunjukkan telah terjadi
pemutusan rantai polisakarida pati menjadi monomer yang lebih sederhana seperti
oligosakarida dan monosakarida. Sehingga jumlah gula pereduksi meningkat dan
menimbulkan warna ungu kecoklatan saat diberi larutan lugol.
4.3.3 Kehalusan 80 mesh
Kehalusan 80 mesh menunjukkan hasil yang hampir sama pada dekstrin
yang dibuat dengan metode katalis asam (HCl 1 N) dan metode enzimatis (enzim
α-amilase). Hasil penelitian yang diperoleh dengan metode katalis asam adalah
94,7 % ± 0,06 dan dengan metode enzimatis adalah 93,96 % ± 0,02 . Hasil ini
telah sesuai dengan persyaratan mutu yang ditetapkan SNI 01-2593-1992 min
90 %. Perhitungan dapat dilihat pada Lampiran 18, halaman 60.
Ukuran partikel yang halus dan kecil diperlukan untuk mempermudah
penggunaan dekstrin. Ukuran yang seragam ini dibuat dengan cara memblender
35
partikel dekstrin yang kecil akan meningkatkan luas permukaan dekstrin sehingga
meningkatkan kelarutan dekstrin. Menurut Jati (2006), semakin halus dekstrin
maka semakin bagus pula mutunya karena dekstrin yang memiliki kehalusan yang
tinggi akan mudah dalam penangan produksi selanjutnya.
4.3.4 Kadar air
Hasil pengujian kadar air menggunakan metode katalis asam (HCl 1 N)
menunjukkan kadar air yang diperoleh lebih besar yaitu 8,79 % ± 0,15 dan
dekstrin yang dibuat dengan metode enzimatis (enzim α-amilase)memiliki kadar
air yang lebih rendah yaitu 7,62 % ± 0,23. Hasil ini telah sesuai dengan
persyaratan mutu SNI 01-2593-1992 maks 11 %. Perhitungan dapat dilihat pada
Lampiran 19, halaman 62.
Kadar air yang berbeda ini disebabkan karena lama proses pengeringan yang
berbeda. Pada pembuatan dekstrin dengan metode katalis asam dekstrin yang
diperoleh dikeringkan dalam oven selama 3 jam sedangkan dekstrin yang
diperoleh dengan metode enzimatis waktu pengeringannya lebih lama 7 jam,
sehingga kadar air yang diperoleh dengan metode enzimatis lebih rendah.
Dekstrin yang bermutu baik akan memiliki kadar air yang rendah. Kadar air
yang tinggi dapat menyebabkan tumbuhnya mikroorganisme dan menurunkan
kualitas dekstrin. Dekstrin dengan kadar air yang rendah akan lebih mudah dalam
penyimpanan dan aplikasinya (Jati, 2006).
4.3.5 Kadar abu
Kadar abu berhubungan dengan kandungan mineral yang terkandung di
dalam bahan baku yaitu talas. Abu adalah zat anorganik sisa hasil pembakaran
36
Hasil pengujian kadar abu pada dekstrin yang diperoleh dengan metode
katalis asam (HCl 1 N) adalah 0,45 % ± 0,02 dan dekstrin yang diperoleh dengan
metode enzimatis (enzim α-amilase) adalah 0,42 % ± 0,04. Hal ini telah sesuai
dengan persyaratan mutu SNI 01-2593-1992 yaitu maks 0,5 %. Perhitungan dapat
dilihat pada Lampiran 20, halaman 64.
4.3.6 Kelarutan dalam air dingin
Sebelum penelitian dilakukan percobaan kelarutan air dingin pati umbi talas,
diperoleh hasil kelarutan dalam air dingin adalah 3,62 % ± 0,2. Lalu dilakukan
pengujian kelarutan dalam air dingin dekstrin yang dibuat dengan metode katalis
asam (HCl 1 N) dan metode enzimatis (enzim α-amilase). Hasil yang diperoleh
dengan metode katalis asam adalah 57,47 % ± 0,25 dan metode enzimatis
adalah 63,09 % ± 0,1. Perhitungan dapat dilihat pada Lampiran 21, halaman 66.
Hal ini menunjukkan telah terjadi peningkatan kelarutan dekstrin dengan metode
katalis asam dan metode enzimatis. Berdasarkan kelarutannya, dekstrin secara
perlahan larut dalam air dingin dan sangat larut dalam air panas (Rowe, et al.,
2009).
Modifikasi pati dengan katalis asam terjadi melalui reaksi pemutusan ikatan
α-(1,4) glikosidik pati oleh katalisator HCl 1 N dengan adanya air. Sedangkan
modifikasi pati dengan metode enzimatis terjadi melalui pemutusan ikatan α-(1,4)
glikosidik secara random atau pada tengah rantai polimer (Ridal, 2003). Enzim α
-amilase m