DAN PENGEMBANGAN METODE DETEKSI
I GEDE RAI MAYA TEMAJA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa disertasi berjudul Chrysanthemum B Carlavirus (CVB) yang Menginfeksi Krisan di Indonesia: Karakterisasi dan Pengembangan Metode Deteksi adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, September 2008
ABSTRAK
I GEDE RAI MAYA TEMAJA. Chrysanthemum B Carlavirus (CVB) yang Menginfeksi Krisan di Indonesia: Karakterisasi dan Pengembangan Metode Deteksi. Dibimbing oleh GEDE SUASTIKA, SRI HENDRASTUTI HIDAYAT, dan UTOMO KARTOSUWONDO.
Chrysanthemum B Carlavirus (CVB) dilaporkan telah menginfeksi krisan di berbagai negara. Gejala belang (mottle) ringan, pemucatan tulang daun (vein-clearing) dan mosaik (mosaic) ringan pada daun; dan pecah warna (color breaking) pada bunga berhasil ditemukan pada tanaman krisan di Cianjur, Jawa Barat, Indonesia. Berdasarkan deteksi serologi (DAS-ELISA) menggunakan antiserum spesifik CVB diketahui bahwa gejala tersebut berasosiasi dengan CVB. Penelitian ini bertujuan untuk mengungkap sifat-sifat biologi dan molekuler CVB isolat Indonesia (CVB-Ina) serta mengembangkan teknik serologi untuk deteksi cepat dan akurat.
Analisis mikroskop elektron dan reaksi serologi membuktikan CVB-Ina memiliki karakter yang mirip dengan CVB isolat lainnya. Namun demikian, hasil bioesei menunjukkan bahwa CVB-Ina mengakibatkan munculnya gejala penebalan tulang daun, pemucatan tulang daun, mosaik ringan dan belang ringan pada daun krisan; mampu menginfeksi tanaman Nicotiana benthamiana; dan memiliki efesiensi yang relatif lebih tinggi dalam penularan melalui kutudaun Macrosiphoniella sanborni. Hal tersebut berbeda dengan CVB isolat lainnya yang umumnya tidak mampu menimbulkan gejala pada tanaman krisan, tidak menginfeksi N. benthamiana, dan ditularkan dengan efisensi rendah melalui kutudaun M. sanborni. Karakter molekuler protein selubung CVB-Ina menunjukkan beberapa perbedaan pada runutan asam aminonya. Hal ini kemungkinan yang menyebabkan karakter biologi CVB-Ina agak berbeda.
Antiserum yang diproduksi memiliki sensitifitas yang tinggi untuk mendeteksi CVB menggunakan teknik I-ELISA dan TBIA. TBIA mempunyai kelebihan yaitu biayanya lebih murah, lebih mudah dan cepat, blotting sampel dapat dilakukan di lapangan, kemudian membran disimpan untuk proses selanjutnya di laboratorium, oleh karena itu TBIA dapat disarankan sebagai metode deteksi untuk survei CVB skala besar.
ABSTRACT
I GEDE RAI MAYA TEMAJA. Chrysanthemum B Carlavirus (CVB) that Infected Chrysanthemum in Indonesia: Characterization and Development of Detection Methode. Under direction of GEDE SUASTIKA, SRI HENDRASTUTI HIDAYAT, and UTOMO KARTOSUWONDO.
Infection of chrysanthemum B Carlavirus (CVB) in chrysanthemum has been reported from many countries where the plants were cultivated. In a survey of chrysanthemum growing fields (and greenhouses) in Cianjur regency, West Java, Indonesia, some chrysanthemum cultivars exhibited a variety of symptoms ranging from mild mottle, vein-clearing and mild mosaic of leaves; and color breaking of flowers. Through DAS-ELISA, the sap extracted from diseased plant samples were found to be positively reacted with serum anti-CVB. The virus isolate was then designed as CVB Indonesian isolate. The objectives of this research are to study biological and molecular characters of CVB Indonesian isolate and to develop serological technique for raphid and accurate virus detection.
An isolate of CVB obtained from chrysanthemum (Dendranthema grandiflora) plantation in Indonesia was characterized and found to be unique. The virus isolate, shared similar characters with other CVB isolates based on electron microscopy analysis and serological reaction. However, the result of bioassay showed that Indonesian isolate was very distinct from most CVB isolates reported earlier. The virus isolate induced vein banding, vein clearing, mild mosaic and mild mottle on the leaves of chrysanthemum plants, could infect Nicotiana benthamiana, and was transmitted by chrysanthemum-colonized aphid, Macrosiphoniella sanborni. In contrast, most CVB isolates were not able to induce any symptoms on chrysanthemum leaves, were not able to infect N. benthamiana, and were transmitted in low efficiency by aphid. Furthermore, molecular characterization of coat protein gene exhibited some differences in amino acid sequences. This might explained distinct biological characters of CVB Indonesian isolate.
The antiserum produced had high sensitivity for detection of CVB when examined by I-ELISA and TBIA. Besides its low cost, TBIA allows the samples to be blotted on the nitrocellulose membranes in the field and storage of the membranes for later processing in the laboratory. This feature makes it the metode of choice for large-scale CVB surveying.
RINGKASAN
I GEDE RAI MAYA TEMAJA. Chrysanthemum B Carlavirus (CVB) yang Menginfeksi Krisan di Indonesia: Karakterisasi dan Pengembangan Metode Deteksi. Dibimbing oleh GEDE SUASTIKA, SRI HENDRASTUTI HIDAYAT, dan UTOMO KARTOSUWONDO
Krisan (Dendranthema grandiflora Kitam.) adalah salah satu jenis bunga yang banyak diminati oleh masyarakat dunia karena daya tarik warna, bentuk, dan ukurannya yang beranekaragam. Chrysanthemum B Carlavirus (CVB) adalah virus utama yang menginfeksi krisan dan dilaporkan telah tersebar pada pertanaman krisan di berbagai negara. Infeksi CVB pada tanaman krisan menyebabkan gejala belang atau pemucatan tulang daun yang sangat ringan pada daun, serta penurunan kualitas bunga. Namun demikian lebih sering kultivar yang terinfeksi virus ini tidak menunjukkan gejala (symptomless).
Perdagangan krisan di pasar dunia mensyaratkan bahan tanaman bebas virus. Sertifikasi bahan tanaman krisan bebas virus membutuhkan metode deteksi yang cepat dan akurat. Tantangan ini mendorong penelitian yang mengarah pada penyediaan metode deteksi CVB yang diperlukan dan dapat diterapkan untuk pemenuhan kebutuhan sertifikasi.
Di Indonesia, belum ada informasi lengkap mengenai penyakit pada tanaman krisan yang disebabkan oleh CVB dan keragamannya. Oleh karena itu penelitian mengenai status penyakit di lapangan, karakter biologi dan molekuler CVB isolat Indonesia serta teknik identifikasi cepat dan akurat sangat penting dilakukan dalam usaha menemukan pengendalian CVB pada tanaman krisan. Penelitian ini bertujuan untuk mengungkap sifat-sifat biologi dan molekuler CVB-Ina serta mengembangkan teknik serologi untuk deteksi cepat dan akurat.
Pengamatan gejala infeksi dilakukan pada areal pertanaman krisan di Brastagi kabupaten Karo (Sumatera Utara); Cibadak dan Cipanas kabupaten Cianjur (Jawa Barat); Kota Batu dan Pujon kabupaten Malang (Jawa Timur); dan Baturiti kabupaten Tabanan dan Pancasari kabupaten Buleleng (Bali). Kejadian penyakit ditentukan berdasarkan reaksi sampel terhadap antiserum CVB pada metode ELISA. Uji kisaran inang dilakukan menggunakan 26 spesies tanaman dari famili Solanaceae, Leguminosae, Cucurbitaceae, Chenopodiaceae, Cruciferae dan Amaranthaceae. Kajian penularan melalui kutudaun diawali dengan identifikasi kutudaun dan dilanjutkan dengan uji efisiensi penularan menggunakan masing-masing 1, 7, 14, 21 kutudaun setiap tanaman.
Identifikasi karakter molekuler CVB meliputi kegiatan pemurnian virus, pengamatan morfologi virus dengan mikroskop elektron, analisis protein selubung dengan SDS-PAGE dan Western blot, perunutan DNA virus melalui tahapan ekstraksi RNA, amplifikasi DNA, perunutan DNA dan analisis filogenetika.
Pengembangan teknik serologi untuk deteksi cepat dan akurat dimulai dengan pembuatan antiserum, selanjutnya dilakukan pengamatan spesifisitas reaksi antiserum dengan protein selubung CVB melalui analisis Western blot dan ISEM, dan pengembangan metode serologi TBIA dan ELISA untuk deteksi CVB.
ringan, mosaik ringan, pemucatan tulang daun dan penebalan tulang daun pada daun, dan terjadi malformasi daun yaitu ukuran daun lebih kecil, tebal dan menggulung ke atas. Pada bunga menunjukkan gejala pecah warna.
Hasil pengkajian kisaran inang menggunakan 26 spesies tanaman membuktikan bahwa CVB memiliki kisaran inang yang terbatas, yaitu hanya menginfeksi Nicotiana benthamiana, N. clevelandii, N. tabacum var. White Burley, N. tabacum var. Havana, Petunia hybrida, Chenopodium amaranticolor dan C. quinoa. Pada penelitian ini ditemukan bahwa CVB isolat Indonesia menginfeksi tanaman N. benthamiana dan menimbulkan gejala pemucatan tulang daun dan belang ringan. Belum ada laporan CVB isolat lainnya menginfeksi tanaman N. benthamiana. CVB-Ina terbukti dapat ditularkan oleh kutudaun Macrosiphoniella sanborni. Efisiensi penularannya lebih tinggi dibandingkan dengan CVB isolat Jepang (CVB-S). Empat belas individu kutudaun setiap tanaman sudah mampu menularkan CVB-Ina, sedangkan CVB-S baru bisa ditularkan menggunakan 21 individu kutudaun setiap tanaman.
Sifat-sifat virus seperti morfologi dan ukuran partikel, ukuran protein selubung, karakter biologi dan urutan asam nukleatnya menunjukkan kesesuaian dengan karakter CVB yang berasal dari lokasi geografi lain. CVB-Ina memiliki partikel berbentuk batang agak lurus dan lentur dengan ukuran panjang 685 nm dan lebar 12 nm, dengan berat molekul protein selubung 34 kDa. Karakter molekuler CVB dikaji berdasarkan susunan nukleotida fragmen DNA yang diperoleh dari perunutan hasil amplifikasi fragmen DNA. Amplifikasi fragmen DNA CVB dengan teknik RT-PCR berhasil mendapatkan fragmen berukuran 739 bp dari sampel daun asal Medan, Cianjur, Malang dan Bali, sesuai dengan ukuran fragmen yang diharapkan berdasarkan analisis runutan primer di Plant Virus GenBank, Soul Women’s University. Analisis filogenetik menggunakan data hasil perunutan fragmen DNA tersebut menunjukkan bahwa isolat-isolat Indonesia berada dalam satu kelompok dan termasuk dalam kelompok yang sama dengan CVB-S dan memiliki jarak genetik terdekat yaitu 0,23–0,25. Isolat CVB Indonesia memiliki tingkat kesamaan runutan nukleotida yang sangat tinggi dengan jarak genetik antara 0,01–0,05, namun demikian isolat-isolat Indonesia tersebut terbagi lagi menjadi dua sub kelompok. Isolat CVB Cianjur dan Medan termasuk satu sub kelompok, dan isolat CVB Bali dan Malang pada sub kelompok lainnya. Analisis runutan asam amino protein selubung empat isolat CVB Indonesia dan isolat CVB-S menunjukkan bahwa isolat-isolat tersebut memiliki tingkat kesamaan runutan asam amino yang cukup tinggi (86-90%). Walaupun demikian ada beberapa bagian pada runutan asam amino yang menunjukkan perbedaan. Perbedaan pada runutan asam amino ini yang kemungkinan menyebabkan karakter biologi CVB Indonesia agak berbeda dari isolat CVB lainnya.
Antiserum yang tidak diserap maupun yang diserap mempunyai titer 1/50.000, sedangkan antiserum murni mempunyai titer 1/100.000. Kajian spesifisitas reaksi antiserum dengan protein selubung CVB, dilakukan melalui analisis Western blot dan ISEM. Analisis Western blot terhadap protein selubung virus menggunakan antiserum yang sudah dimurnikan menunjukkan bahwa pita protein berukuran 34 kDa yang diduga sebagai protein selubung CVB pada uji SDS-PAGE, bereaksi positif dengan antiserum. Protein 34 kDa yang terdeteksi pada analisis Western blot sesuai dengan berat molekul protein selubung CVB yang digunakan untuk imunisasi pada hewan percobaan. Pengamatan partikel CVB pada mikroskop elektron dengan metode ISEM menggunakan antiserum yang diproduksi pada penelitian ini memberikan hasil partikel berbentuk panjang agak lentur nampak lebih jelas pada grid yang sebelumnya dicelupkan pada suspensi antiserum, dibandingkan pada siapan virus murni tanpa antiserum. Hal ini menunjukkan bahwa antiserum yang dihasilkan memberikan reaksi yang spesifik terhadap protein selubung virus.
Antiserum CVB yang berhasil diperoleh digunakan dalam penelitian selanjutnya yaitu pengembangan metode deteksi. Dalam kegiatan penelitian tersebut dilakukan kajian terhadap metode TBIA dan ELISA. Sensitifitas I-ELISA dalam mendeteksi CVB cukup tinggi dan virus masih terdeteksi pada pengenceran cairan perasan tanaman terinfeksi 1/256. Pengenceran sampel cairan perasan tanaman terinfeksi 1/16 masih menunjukkan reaksi positif sampai pada pengenceran antiserum 1/100.000. Pada penelitian ini TBIA terbukti cukup sensitif untuk mendeteksi keberadaan CVB pada tanaman krisan. Reaksi positif masih nampak pada pengenceran antiserum 1/10.000.
Menangani sampel jumlah besar, uji serologi secara TBIA lebih menguntungkan dibandingkan dengan teknik ELISA. Metode TBIA lebih mudah dan cepat, biayanya lebih murah karena hanya diperlukan bahan pereaksi yang lebih sedikit dan dapat menguji sampel lebih banyak. Di samping itu, bloting sampel pada membran dilakukan beberapa menit dan dapat dikerjakan di lapangan, untuk kemudian membran disimpan untuk proses selanjutnya di laboratorium.
Berdasarkan hasil penelitian terhadap kajian sifat-sifat biologi dan molekuler CVB-Ina dapat disimpulkan bahwa CVB sudah menginfeksi tanaman krisan di Indonesia. CVB-Ina memiliki karakter biologi yang khusus, yakni mengakibatkan muncul variasi gejala pada tanaman krisan, mampu menginfeksi tanaman N. benthamiana, dan memiliki efesiensi yang lebih tinggi dalam penularan melalui kutudaun M. sanborni. Kemungkinan perbedaan karakter biologi tersebut disebabkan beberapa perbedaan pada runutan asam amino protein selubungnya. TBIA merupakan metode deteksi CVB yang memenuhi persyaratan sensitifitas, massal dan ekonomis.
©Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
CHRYSANTHEMUM B CARLAVIRUS (CVB) YANG
MENGINFEKSI KRISAN DI INDONESIA: KARAKTERISASI
DAN PENGEMBANGAN METODE DETEKSI
I GEDE RAI MAYA TEMAJA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Ir. Nurhayati H.S. Arifin, M.Sc.
Judul Disertasi : Chrysanthemum B Carlavirus (CVB) yang Menginfeksi Krisan di Indonesia: Karakterisasi dan Pengembangan Metode Deteksi
Nama : I Gede Rai Maya Temaja
NIM : A461050011
Disetujui
Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc. Ketua
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Anggota
Prof. Dr. Ir. Utomo Kartosuwondo, MS. Anggota
Diketahui
Ketua Program Studi Entomologi/Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc.
Dekan Sekolah Pascasarjana IPB
Prof. Dr. Ir. Khairil A. Notodiputro, MS.
RIWAYAT HIDUP
Penulis dilahirkan di Badung, 9 Oktober 1962. Penulis merupakan anak ke
delapan di antara sepuluh bersaudara dari pasangan I Ketut Rideg dan Ni Nengah
Kelepon. Penulis menikah dengan Ir. Ni Luh Komang Kusumawati dan dikaruniai
dua putera yaitu I Gede Andy Andika Parahita (15 tahun) dan I Made Bayu
Puradipa (13 tahun).
Pendidikan sarjana ditempuh di Jurusan Hama dan Penyakit Tumbuhan,
Fakultas Pertanian, Universitas Udayana, lulus pada tahun 1986. Pendidikan
sarjana strata 2 ditempuh di Program Studi Fitopatologi, Program Pascasarjana,
Universitas Gadjah Mada, lulus pada tahun 1994. Sejak tahun 2005 penulis
terdaftar sebagai mahasiswa program doktor (strata 3) pada Program Studi
Entomologi dan Fitopatologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Sejak tahun 1987 penulis diangkat sebagai staf pengajar tetap pada Jurusan
Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Udayana
Denpasar.
Satu artikel bagian dari disertasi ini yaitu dengan judul “Deteksi
Chrysanthemum B Carlavirus (CVB) pada Tanaman Krisan di Indonesia” telah
dipublikasikan pada Jurnal Agritrop 26 (1): 6-12, 2007, diterbitkan oleh Fakultas
Pertanian, Universitas Udayana. Dua artikel sedang diusulkan untuk diterbitkan
yaitu pada jurnal internasional Acta Horticulturae dengan judul “Characterization
of a Severe Strain of Chrysanthemum B Carlavirus (CVB) Isolated from
Chrysanthemum in Indonesia” dan pada Jurnal Hama dan Penyakit Tanaman
Tropika, Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas
Lampung dengan judul “Karakter Molekuler Chrysanthemum B Carlavirus
(CVB) Isolat Krisan (Dendranthema grandiflora Kitam.) di Indonesia” (in press).
Bagian dari penelitian ini telah disampaikan pada tiga pertemuan ilmiah
internasional yaitu pada: (1) The Third Asian Conference on Plant Pathology di
Yogyakarta dengan judul “First Report on Occurrence of Chrysanthemum B
Carlavirus (CVB) on Chrysanthemum in Indonesia”, (2) Plant Science Meeting
for Graduate Students in Utsunomiya di Utsunomiya Jepang dengan judul “Study
International Symposium on Virus Diseases of Ornamental Plants di Harleem
Belanda dengan judul “Characterization of a Severe Strain of Chrysanthemum B
PRAKATA
Penulis mengucapkan syukur kehadirat Hyang Widhi - Tuhan Yang
Mahaesa karena atas perkenan-Nya disertasi yang berjudul “Chrysanthemum B
Carlavirus (CVB) yang Menginfeksi Krisan di Indonesia: Karakterisasi dan
Pengembangan Metode Deteksi” dapat diselesaikan.
Penulis menyampaikan rasa terima kasih yang tak terhingga kepada Dr. Ir.
Gede Suastika, M.Sc., Dr. Ir. Sri Hendrastuti Hidayat, M.Sc., dan Prof. Dr. Ir.
Utomo Kartosuwondo, MS. atas segala kesabaran dan bimbingan, kritik, saran,
serta dukungan moral yang sangat besar peranannya dalam terselesaikannya
disertasi ini.
Terima kasih saya sampaikan kepada Dr. Ir. Nurhayati H.S.Arifin, M.Sc.
dan Prof. Dr. Ir. Made Sudana, MS. yang bersedia menjadi penguji luar komisi
pada sidang tertutup dan terbuka. Terima kasih atas saran yang diberikan untuk
perbaikan disertasi ini.
Ucapan terima kasih juga disampaikan kepada Rektor Universitas
Udayana, Denpasar, Dekan Fakultas Pertanian dan Ketua Jurusan Hama dan
Penyakit Tumbuhan, Fakultas Pertanian, Universitas Udayana, atas ijin yang
diberikan kepada penulis untuk mengikuti program doktor (S3) di program studi
Entomologi dan Fitopatologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Ucapan yang sama disampaikan kepada Rektor Institut Pertanian Bogor, Dekan
Sekolah Pascasarjana, IPB, Ketua dan seluruh staf pengajar program studi
Entomologi dan Fitopatologi, Ketua dan seluruh staf pengajar dan administrasi
Departemen Proteksi Tanaman, Fakultas Pertanian IPB. Ucapan terima kasih
disampaikan juga pada tim manajemen Beasiswa Program Pascasarjana (BPPS)
Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional yang
telah memberikan dana untuk mengikuti program doktor.
Terima kasih kepada ketua dan staf Laboratorium Imunologi FKH IPB
atas bantuannya dalam percobaan produksi antiserum. Penulis juga
menyampaikan rasa terima kasih dan penghargaan kepada teman-teman
Laboratorium Virologi, Tuti Susanti Legiastuti, Dr.Ir. Noor Aidawati, Dr.Ir. Eliza
S. Rusli, Latifah, Mas Khamdan, Pak Irwan, Ibu Ifa Manzila, Ibu Sukendah,
Edi, serta Pak Mpud. Hal yang sama juga disampaikan pada seluruh rekan-rekan
mahasiswa program studi Entomologi dan Fitopatologi dan, teman-teman di
Punhawacana Bali, dan adik-adik di Brahmacarya (Asrama Bali Cikuray).
Terima kasih kepada keluarga tercinta Ir. Ni Luh Komang Kusumawati,
I Gede Andy Andika Parahita dan I Made Bayu Puradipa atas doa tulus,
pengorbanan, pengertian, ketabahan, dan dorongan semangat yang tiada pernah
putus. Mohon maaf selama tiga tahun terakhir tidak dapat memberikan kasih
sayang yang utuh kepada kalian. Semoga apa yang bapak lakukan ini dapat
menjadi teladan bagi kalian.
Akhirnya penulis berharap bahwa apa yang telah dihasilkan ini dapat
bermanfaat bagi pengembangan ilmu pengetahuan di masa yang akan datang.
Bogor, September 2008
DAFTAR ISI
Halaman
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
Hipotesis ... 4
Alur penelitian ... 4
TINJAUAN PUSTAKA ... 7
Krisan (Dendranthema grandiflora Kitam.) ... 7
Chrysanthemum B Carlavirus (CVB) ... 10
BAHAN DAN METODE ... 19
Karakter Biologi Chrysanthemum B Carlavirus (CVB) ... 19
Karakter Molekuler Chrysanthemum B Carlavirus (CVB) ... 24
Uji Serologi Chrysanthemum B Carlavirus (CVB) ... 31
HASIL ... 34
Karakter Chrysanthemum B Carlavirus (CVB) ... 34
Deteksi Serologi Chrysanthemum B Carlavirus (CVB) ... 55
PEMBAHASAN ... 65
SIMPULAN DAN SARAN .... 75
Simpulan ... 75
Saran ... 75
DAFTAR PUSTAKA ... 76
DAFTAR TABEL
Halaman
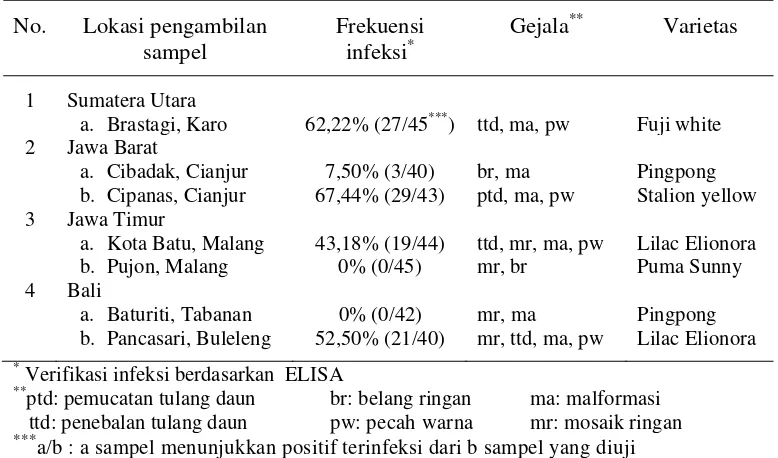
1. Frekuensi infeksi CVB pada sampel tanaman krisan dari sentra produksi krisan di Indonesia ... 35
2. Frekuensi infeksi virus pada sampel tanaman krisan bergejala dari berbagai lokasi berdasarkan ELISA ... 37
3. Respon berbagai tanaman indikator terhadap infeksi CVB-Ina ... 39
4. Hasil Penularan CVB melalui kutudaun M. sanborni ... 43
5. Tingkat kesamaan isolat CVB yang berasal dari geografi berbeda berdasarkan runutan gen protein selubung ... 52
6. Tingkat kesamaan empat isolat CVB Indonesia dan isolat CVB-S berdasarkan runutan asam amino protein selubung ... 54
7. Reaksi antiserum terhadap cairan perasan tanaman terinfeksi CVB pada uji serologi dengan metode I-ELISA ... 62
DAFTAR GAMBAR
Halaman
1. Alur Penelitian karakterisasi dan pengembangan metode deteksi CVB Indonesia ...
6
2. Skema organisasi genom CVB ... 13
3. Kondisi pertanaman krisan saat pengambilan sampel di beberapa lokasi ... 19
4. Perbanyakan kutudaun pada tanaman krisan dalam kurungan kedap serangga ... 23
5. Perbanyakan virus pada tanaman N. benthamiana ... 25
6. Gejala infeksi CVB pada tanaman krisan ... 34
7. Variasi gejala CVB pada beberapa tanaman ... 40
8. Imago kutudaun M. sanborni ... 41
9. Gambar mikroskopi kutudaun yang dapat menyerang krisan ... 42
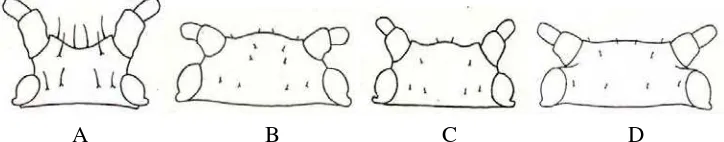
10. Bentuk kepala M. sanborni berkembang sempurna, dan bentuk kepala B. helichrysi, A. gossypii dan C. rufomaculata yang tidak berkem-bang ... 42
11. Kauda M. sanborni berbentuk lidah, kauda B. helichrysi berbentuk helm, kauda A. gossypii agak mengecil pada bagian tengah, dan kauda C. rufomaculata berbentuk kerucut ... 42
12. Sifunkuli M. sanborni meruncing ke arah ujung, sifunkuli B. helichry-si meruncing dengan bibir pada ujungnya, helichry-sifunkuli A. gossypii meruncing dari pangkal sampai bagian tengah dan hampir lurus dari bagian tengah sampai ke ujung, dan sifunkuli C. rufomaculata membengkak didekat ujung dengan bibir pada bagian ujungnya ... 43
13. Hasil pemurnian virus dengan pemisahan virus melalui ultrasenrifu-gasi dengan gradien kepekatan sesium sulfat ... 44
14. Profil spektrofotometri siapan virus murni ... 45
15. Jumlah tanaman N. benthamiana, N. clevelandii, N. tabacum var. White Burley, N. tabacum var. Havana, P. hybrida, C. amaranticolor dan C. quinoa yang menunjukkan titer virus tinggi ... 47
17. Hasil analisis SDS-PAGE dan Western blot ... 49
18. Hasil amplifikasi DNA CVB isolat Indonesia dengan metode RT-PCR menggunakan sepasang primer CVB 5 dan CVB 3... 49
19. Perbandingan hasil perunutan DNA yang berasal dari 4 isolat CVB-Indonesia ... 51
20. Filogenetika kekerabatan 4 isolat CVB Indonesia terhadap isolat CVB dari lokasi geografi lain yang ada di GeneBank ... 53
21. Perbandingan hasil perunutan asam amino empat isolat CVB Indonesia (Ina) dan isolat CBB S Jepang (Jpn) ... 54
22. Nilai absorbansi antiserum pada panjang gelombang 280 ... 56
23. Titer antiserum tidak diserap, antserum diserap dan antiserum murni berdasarkan ELISA ... 58
24. Nilai absorbansi antiserum tidak diserap, diserap dan antiserum murni pada uji ELISA terhadap isolat CVB dari berbagai lokasi (Cianjur, Medan, Malang dan Bali) ... 59
25. Hasil analisis western blot protein selubung CVB menggunakan antiserum yang diproduksi ... 60
26. Partikel CVB pada pengamatan dengan mikroskop elektron ... 61
27. Reaktivitas antiserum pada pengenceran 1/100, 1/500, 1/1000, 1/5000 dan 1/10.000 terhadap isolat CVB dari berbagai lokasi dibandingkan dengan kontrol negatif pada uji serologi dengan TBIA ... 63
DAFTAR LAMPIRAN
Halaman
1. Nilai absorbansi (405 nm) sampel pada reaksi ELISA dengan menggunakan beberapa antiserum ... 84
Latar Belakang
Krisan (Dendranthema grandiflora Kitam.) adalah salah satu jenis
tanaman bunga yang banyak diminati oleh masyarakat mancanegara karena daya
tarik warna, bentuk, dan ukurannya yang beranekaragam. Di Indonesia, krisan
banyak dibudidayakan dalam skala kecil oleh petani maupun dalam skala besar
oleh perusahaan agribisnis terutama di daerah sejuk di provinsi Jawa Barat, Jawa
Timur, Jawa Tengah, Sumatera Utara, Sulawesi Utara dan Bali. Disamping untuk
memenuhi kebutuhan dalam negeri, krisan diproduksi terutama untuk memenuhi
kebutuhan luar negeri seperti negara-negara Eropa, Jepang, dan negara Asia
lainnya. Ekspor krisan Indonesia dalam bentuk bunga potong dan stek batang.
Permintaan bunga potong dan tanaman krisan pot di pasar dalam negeri
(domestik) maupun pasar internasional makin meningkat dari tahun ke tahun.
Situasi ini memberi peluang bagi petani produsen dan pengusaha bunga krisan
untuk meningkatkan kuantitas, kualitas dan kontinuitas produksi bunga krisan
yang sesuai dengan permintaan pasar (Marwoto, 2000). Pada tahun 2004 luas
panen krisan di Indonesia mencapai 154,3 Ha dengan produksi 27.683.449
tangkai, yang sebagian besar ditanam di provinsi Jawa Barat yaitu dengan luas
panen 105,6 Ha dengan produksi 23.386.679 tangkai (Direktorat Jenderal Bina
Produksi Hortikultura, 2005).
Di samping bunga potong, krisan juga diperdagangkan dalam bentuk bibit
yaitu stek pucuk. Produksi bibit krisan dalam negeri meningkat dari 1,7 juta bibit
pada tahun 2005 menjadi 5,9 juta bibit di tahun 2006 dan 6,5 juta bibit di tahun
2007. Walaupun terjadi peningkatan produksi bibit krisan, impor bibit tersebut
juga mengalami peningkatan dari tahun 2005 ke tahun 2006 dan tahun 2007. Hal
ini disebabkan karena kebutuhan bibit krisan meningkat lebih cepat dibanding
kemampuan produksi bibit di dalam negeri (Direktorat Jenderal Hortikultura,
2008).
Salah satu kendala dalam budidaya tanaman krisan adalah serangan
patogen. Penyakit-penyakit utama tanaman krisan adalah penyakit karat hitam
chrysanthemi Allesch dan S. leucanthemi Sacc. et Speg.), tepung oidium (Oidium
chrysanthemi Rab.), kapang kelabu (Botrytis cenerea Pers.), layu cendawan
(Fusarium oxysporum Schlecht. ex Fr. dan Verticillium alboatrum Reinke et
Bert.), dan penyakit-penyakit yang disebabkan oleh chrysanthemun stunt viroid
(CSVd), chrysanthemun mild mosaic virus (CMMV) atau chrysanthemum B
carlavirus (CVB) (Pirone, 1978; Semangun, 1991).
Infeksi virus yang bersifat sistemik akan terbawa pada turunan tanaman
krisan yang diperbanyak secara vegetatif. Pengaruh infeksi virus pada tanaman
hias, khususnya krisan dapat menyebabkan penurunan kualitas maupun kuantitas.
Horst et al. (1977) melaporkan bahwa pengaruh infeksi CVB dapat
mengakibatkan kerusakan tanaman rata-rata mencapai 80%. Survei yang
dilakukan Verma et al. (2003) di Himachal Pradesh (India) menemukan bahwa
CVB menginfeksi tanaman krisan dengan kejadian penyakit mencapai 94,66%.
CVB yang merupakan salah satu penyebab penyakit utama pada tanaman
krisan menginduksi berbagai macam gejala. Belang atau pemucatan tulang daun
yang sangat ringan adalah gejala yang paling umum (Hollings, 1957; Hollings &
Stones, 1972). Beberapa varietas krisan terinfeksi menunjukkan penurunan
kualitas bunga dibandingkan dengan tanaman yang bebas virus. Penurunan
kualitas bunga terutama karena pada tanaman terinfeksi warna mahkota bunga
terputus-putus (pecah warna), mengalami distorsi dan berukuran lebih kecil dari
normal. Kadang-kadang pada krisan terinfeksi CVB berkembang gejala garis
nekrotik pada bunga, dan sering kali tanaman terinfeksi tidak menunjukkan gejala
(symptomless).
CVB dapat ditularkan melalui inokulasi mekanik dan penyambungan,
walaupun secara alami virus ini ditularkan secara non persisten oleh kutudaun
Myzus persicae, Macrosiphum euphorbiae, Aulacorthum solani, Coloradoa
rufomaculata dan Macrosiphoniella sanborni (Hollings & Stones, 1972).
Penyebaran jarak jauh CVB terjadi terutama melalui bahan perbanyakan vegetatif
tanaman. Hal inilah yang menyebabkan negara-negara pengimpor krisan
menerapkan aturan ketat terhadap semua bahan tanaman krisan yaitu harus bebas
Indonesia sebagai salah satu komunitas dunia, bila ingin produk krisannya
diterima di pasar dunia, harus mengikuti aturan perdagangan internasional
terutama perlakuan karantina tumbuhan. Sertifikasi bahan tanaman krisan bebas
virus membutuhkan metode deteksi yang cepat dan akurat. Tantangan ini
mendorong penelitian yang akan dilakukan mengarah pada penyediaan metode
deteksi CVB yang diperlukan dan dapat diterapkan untuk pemenuhan kebutuhan
sertifikasi. Sertifikasi yang didukung metode deteksi yang handal diharapkan
dapat menyelamatkan ekspor krisan Indonesia.
Pada tahun 2005, pengamatan penulis di daerah pertanaman krisan di
Cipanas, Cianjur, Jawa Barat menemukan gejala penyakit belang ringan dan
pemucatan tulang daun, mirip gejala yang disebabkan oleh infeksi CVB. Penyakit
ini diduga disebabkan oleh virus. Berdasarkan gejalanya yang mirip dengan
serangan CVB, maka perlu dilakukan karakterisasi melalui pengujian sifat-sifat
suatu virus meliputi deskripsi gejala virus pada tanaman krisan, reaksi sampel
terhadap serum anti-CVB, mengamati bentuk dan ukuran partikel virus, ukuran
protein selubung virus, respon tanaman indikator terhadap infeksi virus, kajian
penularan CVB melalui kutudaun, amplifikasi dan perunutan fragmen gen
protein selubung virus.
Kajian serologi CVB dengan menggunakan antiserum CVB pada metode
ELISA untuk mendeteksi dan mengidentifikasi virus telah dilakukan di India
terhadap kultivar krisan berbeda (Verma et al. 2003; Ram et al. 2005) dan di
Jepang untuk mendeteksi CVB pada tanaman Gymnaster savatieri (Suastika et al.
1997).
Sekarang ini, metode deteksi yang didasarkan pada analisis asam nukleat
virus telah banyak digunakan untuk mendeteksi dan mengidentifikasi CVB atau
genus carlavirus. Sebagai contoh teknik reverse transcriptase-polymerase chain
reaction (RT-PCR) dengan menggunakan primer spesifik telah terbukti dapat
digunakan untuk mendeteksi dan mengidentifikasi CVB dari tanaman yang
berbeda dan tempat yang berbeda (Verma et al. 2003; Ram et al. 2005).
Deteksi carlavirus dengan menggunakan teknik RT-PCR yang dilanjutkan
antara virus yang termasuk genus carlavirus (Lee et al. 2003; Chen et al. 2002;
Zang et al. 1998; Choi & Ryu, 2003).
Di Indonesia, belum ada informasi lengkap mengenai penyakit pada
tanaman krisan yang disebabkan oleh CVB dan keragamannya. Oleh karena itu
penelitian mengenai status penyakit di lapangan, identifikasi virus penyebab
penyakit melalui pengujian sifat-sifat biologi, deteksi dan identifikasi virus
melalui kajian serologi, dan kajian karakter molekuler virus dengan RT-PCR dan
perunutan nukleotida sangat penting dilakukan dalam usaha menemukan
pengendalian CVB pada tanaman krisan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengungkap sifat-sifat biologi dan
molekuler CVB isolat Indonesia serta mengembangkan teknik serologi untuk
deteksi CVB cepat dan akurat pada tanaman krisan.
Hipotesis
1. CVB isolat Indonesia mempunyai karakter biologi dan molekuler khusus,
yang berbeda dari isolat-isolat CVB lain.
2. Metode deteksi cepat dan akurat dapat dikembangkan untuk CVB isolat
Indonesia.
Alur Penelitian
Penelitian dilakukan melalui survei di lapangan, percobaan di rumah kaca
dan laboratorium, yang terdiri atas:
1. Determinasi karakter biologi CVB pada tanaman krisan, meliputi: a) pengamatan keragaman gejala virus pada tanaman krisan; b) reaksi
sampel terhadap antiserum virus yang menginfeksi krisan; c) respon tanaman indikator terhadap infeksi CVB; dan d) kajian penularan CVB dengan serangga vektor kutudaun.
2. Determinasi karakter molekuler CVB, meliputi: a) pemurnian virus; b) karakterisasi virus murni dengan spektrofotometri; c) pengamatan bentuk
sodiom dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) dan Western blot; dan e) penentuan keragaman molekuler CVB isolat Indonesia, meliputi ; ekstraksi RNA, amplifikasi DNA (RT-PCR), perunutan fragmen gen protein selubung CVB, dan analisis filogenetika.
3. Kajian serologi, meliputi: a) produksi antiserum; b) uji ELISA dan TBIA); dan c) pengujian metode serologi untuk deteksi sampel.
Gambar 1. Alur penelitian karakterisasi dan pengembangan metode deteksi CVB Indonesia Identiikasi CVB
dengan RT‐PCR
Perunutan isolat‐isolat CVB
Analisis keragaman isolat‐isolat CVB
Kisaran inang CVB: • Keragaman
gejala • Kisaran inang
Kajian penularan CVB melalui
kutudaun
Pemurnian CVB
• Karakter morfologi dengan mikroskop elektron
•Analisis protein selubung
Produksi antiserum CVB
Pengembangan metode deteksi CVB:
TINJAUAN PUSTAKA
Krisan (Dendranthema grandiflora Kitam.)
Sejarah Tanaman Krisan
Krisan yang merupakan tanaman hias bunga berupa perdu dengan sebutan
lain seruni atau bunga emas (golden flower) berasal dari Cina. Tanaman ini sudah
ditanam 500 tahun sebelum Masehi, yang semula hanya digemari oleh masyarakat
Cina. Sekitar abad ke-8 Masehi krisan dibawa dan dibudidayakan di Jepang.
Kebanggaan terhadap bunga krisan menyebabkan bunga ini dijadikan sebagai
simbol kekaisaran Jepang dengan sebutan Queen of The East. Tanaman krisan
diintroduksi ke kawasan Eropa pada abad ke-17. Tanaman krisan pun menyebar di
kawasan Eropa, kemudian ke Asia. Pada tahun 1753 Karl Linnaeus, ahli botani
Swedia, mengkombinasikan kata Latin chrysos yang berarti emas dengan kata
anthemon yang berarti bunga, untuk menamakan tanaman krisan. Jenis atau
varietas krisan modern diduga mulai ditemukan pada abad ke-17
(http//www.mums.org).
Krisan mulai dikoleksi di Indonesia pada tahun 1800an dan
dikembangkan secara komersial sejak tahun 1940an. Krisan merupakan salah satu
jenis tanaman hias bunga yang sangat diminati dan memiliki nilai ekonomi yang
relatif tinggi di Indonesia serta mempunyai prospek pemasaran cerah, terutama
dijual berupa bunga potong dan tanaman hias bunga pot. Sentra produksi krisan di
Indonesia antara lain: Bandung, Cianjur, Sukabumi, Lembang, Bogor dan Garut
(Jawa Barat), Semarang, Magelang, Karanganyar dan Sukoharjo (Jawa Tengah),
Malang dan Pasuruan (Jawa Timur), dan Brastagi (Sumatera Utara). Jenis atau
varietas krisan yang dikembangkan di Indonesia umumnya krisan hibrida yang
berasal dari Belanda, Amerika Serikat dan Jepang (Rukmana & Mulyana, 1997).
Budidaya Tanaman Krisan
Krisan tumbuh baik di dataran tinggi antara 600 -1000 m dpl, dapat
tumbuh hampir di semua jenis tanah dengan aerasi dan drainase baik, memiliki
tingkat kesuburan yang tinggi dengan kandungan unsur hara dalam jumlah
15,5°C dan suhu siang 32°C (Kofranek, 1992). pH optimum tanah untuk
pertumbuhan krisan adalah 5,5-6,7 (Carter, 1992; Konfranek, 1992).
Tanaman ini sangat responsif terhadap lama waktu penyinaran cahaya atau
fotoperiode. Agar tanaman dapat berbunga dengan baik, kebanyakan varietas
memerlukan hari pendek selama fase pembungaan (Janick, 1972; Kofranek,
1992). Tanaman yang ditanam untuk tujuan produksi bunga diberi penyinaran
sekitar 14,5 jam per hari dengan tujuan merangsang pertumbuhan vegetatif
dan mencapai panjang batang tertentu sebelum terjadi pembungaan. Untuk
daerah tropis, tambahan penyinaran 2,5 jam per hari cukup untuk
mempertahankan fase vegetatif dan penghentian penyinaran akan mendorong
pembentukan bunga.
Perbanyakan tanaman krisan dapat dilakukan dengan stek pucuk dari
tanaman induk dan anakan (Genders, 1961; Crater, 1992). Panjang stek pucuk
yang ideal adalah 5 cm dan biasanya sudah memiliki 3 helai daun yang
membuka penuh. Anakan bisa diperoleh langsung dari tanaman produksi
dengan cara mencabut bersama akarnya. Pembibitan diperlukan jika digunakan
stek pucuk dalam perbanyakan tanaman (Kofranek, 1992).
Jarak tanam yang biasa digunakan pada penanaman krisan potong
yaitu 10 cm x 10 cm atau 20 cm x 20 cm (Rukmana & Mulyana, 1997). Cara
yang paling praktis untuk memulai penanaman yaitu dengan memasang jaring
penegak lebih dahulu di atas bedengan. Dengan demikian jarak tanam dapat
mengikuti pola kotak-kotak pada jaring yang ukurannya sudah tertentu.
Menurut Laurie & Ries (1950) pemupukan dan drainase sangat
berpengaruh pada awal pertumbuhan. Krisan tidak memerlukan pemupukan
lebih lanjut bila telah membentuk kuncup bunga berdiameter lebih dari 1,0-1,5
cm. Tahap ini dicapai saat tanaman berumur 10-12 minggu setelah tanam
(Kofranek, 1992).
Merangsang pertumbuhan cabang-cabang lateral dengan tujuan mendapat
tanaman krisan dengan tipe banyak bunga per tangkai (tipe spray), dilakukan
dengan pembuangan titik tumbuh (soft pinch) (Crater, 1992). Pembuangan titik
tumbuh umumnya dilakukan pada saat tanaman berumur 10-14 hari setelah
besar pertangkai (tipe standard), dilakukan pembuangan kuncup lateral
(Kofranek, 1992; Greensill, 1970).
Di daerah beriklim tropis krisan membutuhkan waktu sekitar 3-4
bulan sejak bibit ditanam sampai menghasilkan bunga. Saat panen yang tepat
adalah ketika bunga setengah mekar atau 3-4 hari sebelum mekar penuh.
Biasanya pada saat ini bunga telah mencapai ukuran penuh, intensitas warna
hampir mencapai puncaknya, dan bunga masih kuncup (Rukmana & Mulyana,
1997).
Hama dan Penyakit pada Tanaman Krisan
Kendala utama pada budidaya tanaman krisan adalah gangguan hama dan
penyakit. Hama-hama penting yang menyerang tanaman krisan adalah Ostrinia
nubilalis (Lepidoptera: Pyralidae); Thrips sp. (Thysanoptera: Thripidae);
Liriomyza trifolii (Diptera: Agromyzidae); Aphis gossypii (Homoptera:
Aphididae) (Elzingga, 1978; Pirone, 1978; Blackman & Eastop, 1984). Pirone
(1978) melaporkan bahwa selain A. gossypii¸ tanaman krisan juga dapat diserang
oleh kutudaun yang lain seperti Macrosiphoniella sanborni dan Myzus persicae.
Penyakit-penyakit utama tanaman krisan adalah penyakit bercak daun
septoria (Septoria chrysanthemi dan S. leucanthemi), karat hitam (Puccinia
chrysanthemi), karat putih (P. horiana), tepung oidium (Oidium chrysanthemi),
kapang kelabu (Botrytis cenerea), dan layu cendawan (Fusarium oxysporum dan
Verticillium alboatrum (Pirone, 1978; Semangun, 1991).
Beberapa virus dilaporkan menginfeksi tanaman krisan, yang terpenting
antara lain Tomato aspermy cucumovirus (TAV) dan Cucumber mosaic
cucumovirus (CMV); Chrysanthemum B carlavirus (CVB); dan Tomato spotted
wilt tospovirus (TSWV) (Bouween & Zaayen, 1995). Beberapa virus lainnya yang
dapat menginfeksi krisan adalah Turnip mosaic potyvirus (TuMV) (Chen et al.
2000), Tobacco mosaic tobamovirus (TMV), Potato Y potyvirus (PVY), dan
Potato X potexvirus (PVX) (Navalinskiene & Samuitiene, 1996).
Selain dari jenis cendawan dan virus, krisan juga terinfeksi oleh viroid.
Ada dua jenis viroid yang menginfeksi tanaman krisan yaitu Chrysanthemum
stunt viroid (CSVd) dan Chrysanthemum chlorotic mottle viroid (CChMVd)
Chrysanthemum B Carlavirus (CVB)
Kisaran Inangdan Gejala Infeksi
CVB atau nama lainnya adalah Chrysanthemum mild mosaic virus,
Chrysanthemum virus B, Chrysanthemum Q virus, Chrysanthemum dwarf mottle,
Chrysanthemum necrotic mottle, Gynura latent virus, dan Chrysanthemum vein
mottle virus adalah virus dari genus carlavirus (Hollings & Stone, 1972; Hakkart
& Maat, 1974).
CVB mempunyai kisaran inang yang sempit, menginfeksi tanaman krisan
dan sekitar 10 spesies pada 5 famili dikotiledon (Hollings, 1957). Pada penelitian
Verma et al. (2003), dari 22 spesies tanaman yang diinokulasi untuk uji kisaran
inang, hanya 5 spesies yang terinfeksi, yaitu N. clevelandii, N. glutinosa, N.
rustika, Petunia hybrida dan Vicia faba. Sedangkan penelitian Suastika et al.
(1997) menemukan bahwa CVB mampu menginfeksi tanaman Gymnaster
savateri, N. clevelandii, N. occidentalis, P. hybrida, Helichrysum bracteatum,
Zinnia elegans, C. amaranticolor, C. quinoa, Sesamum indicum dan Tetragonia
expansa. Sedangkan 13 spesies tanaman lainnya dari 7 famili yang diuji, tidak
terinfeksi.
Hollings (1957) melaporkan bahwa beberapa spesies tanaman yang sesuai
untuk penyebaran CVB antara lain Aster amellus, Chrysanthemum carinatum,
C. morifolium, N. clevelandii, N. glutinosa, N. rustika, N. affinis. Sedangkan yang
bukan inang CVB antara lain Datura stramonium, C. amaranticolor, C. quinoa,
Gomphrena globosa, Capsicum annuum, Cucumis sativus, Licopersicon
esculentum.
Walaupun memiliki inang yang terbatas, tetapi CVB dilaporkan tersebar
pada pertanaman krisan di seluruh dunia. Infeksi virus ini pada tanaman krisan
menyebabkan perubahan fisiologi tanaman, yang berakibat gejala belang daun
atau pemucatan tulang daun yang sangat ringan pada beberapa kultivar. Namun
demikian sering kultivar yang terinfeksi virus ini tidak menunjukkan gejala
(symptomless) (Hollings & Stone, 1972). Beberapa varietas terinfeksi
bebas virus. Penurunan kualitas bunga terutama karena pada tanaman terinfeksi
warna mahkota bunga terputus-putus (pecah warna), mengalami distorsi dan
berukuran lebih kecil dari normal. Kadang-kadang pada krisan terinfeksi CVB
berkembang gejala garis nekrotik pada bunga (Hollings & Stones, 1972).
Survey Verma et al. (2003) di Himachal Pradesh (India) menemukan
bahwa tanaman krisan terserang CVB dengan gejala penebalan tulang daun,
mosaik, belang, dan pemucatan tulang daun yang ringan. Pada tanaman dengan
daun menunjukkan gejala mosaik yang keras, bunganya juga mengalami
malformasi. Pengamatan Suastika et al. (1997) pada tanaman G. savateri
menemukan bahwa CVB menyebabkan gejala belang ringan pada daun dan pecah
warna pada bunga. Menurut deskripsi Noordam (1972) kisaran inang dan gejala
yang ditimbulkan oleh virus CVB antara lain :
1. P. hybrida menunjukkan gejala bercak kuning lokal setelah 2-5
minggu, beberapa isolat virus dari krisan menyebabkan gejala
nekrotik atau bercak hijau atau cincin kuning.
2. N. glutinosa menunjukkan gejala bercak klorotik lokal setelah 2-3,5
minggu, dan gejala infeksinya non sistemik.
3. N. clevelandii menunjukkan gejala belang ringan dan pemucatan
tulang daun setelah 3 minggu.
4. T. expansa menunjukkan gejala bercak klorotik lokal memanjang
dengan diameter ± 3 mm setelah 2-5 minggu dan infeksinya tidak
sistemik.
Penularan CVB
Semua anggota genus Carlavirus diketahui dapat ditularkan secara
mekanis, dan sebagian besar juga ditularkan secara non persisten melalui
kutudaun (Foster, 1992), walaupun ada yang ditularkan oleh kutu kebul (Bemisia
tabaci) yaitu Cowpea mild mottle virus (CPMMV) (Badge et al.1996; Hull, 2002).
CPMMV juga dapat ditularkan melalui benih, seperti halnya Pea strike virus
(PeSV) dan Red clover vein mosaic virus (RCVMV) (Hull, 2002).
CVB bisa ditularkan secara non persisten oleh kutudaun, melalui
tidak dapat ditularkan melalui kontak antar tanaman dan melalui benih. Di lapang
virus ini dapat ditularkan oleh kutudaun Myzus persicae, Macrosiphum
euphorbiae, Aulacorthum solani, Coloradoa rufomaculata, Macrosiphoniella
sanborni dan Aphis gossypii (Hollings & Stone, 1972; Hollings, 1957; Ohkawa et
al. 2007). Hollings & Stone (1972) melaporkan bahwa periode makan akuisisi
kutudaun 30-45 menit dan periode puasanya hingga 1 jam. Frekuensi penularan
virus meningkat setelah serangga dilaparkan 3 jam sebelum periode makan
akuisisi.
Morfologi dan Taksonomi CVB
CVB adalah virus yang mempunyai partikel berbentuk batang agak lurus
dan lentur, dengan ukuran 680-685 nm x 12-13 nm. Partikel lebih lurus dan
kelihatan kurang lentur dibandingkan Carnation latent virus (CLV), dan
cenderung terputus-putus bila dilakukan pengecatan dengan phosphotungstate
(Hollings & Stone, 1972; Suastika et al. 1997; Foster, 1992; Verma et al. 2003).
Menurut Hull (2002), CVB termasuk ke dalam genus mengambang
(floating genera), karena genus-genus pada kelompok ini tidak bisa dimasukkan
dalam famili. Sampai saat ini ada 20 genus virus tanaman yang dimasukkan dalam
floating genera ini dengan karakterisasi mempunyai asam nukleat ribonukleat
dalam bentuk utas tunggal (single strand (ss) RNA) positive-sense dan tidak
memenuhi syarat untuk dikelompokkan pada familia tertentu.
Carlavirus yang anggotanya dicirikan dengan tipe CLV, mempunyai
partikel bentuk batang agak lentur dengan ukuran panjang 610-700 nm dan
diameter 12-15 nm. Virion mengandung molekul RNA tunggal linier dalam
bentuk positive-sense utas tunggal (positive-sense ssRNA), panjangnya 7,4-8,5
nm, dan memiliki polyadenyl (poly A) pada ujung 3’. Asam nukleatnya
diselubungi oleh sub unit-sub unit protein selubung sejenis dengan berat
masing-masing 31-36 kDa (Hull, 2002; Lee et al. 2003; Zavriev et al. 1991; Foster, 1992;
Lawrence et al. 1995).
Lebih dari 35 spesies virus tergolong dalam genus carlavirus, beberapa
diantaranya sudah dilaporkan runutan lengkap nukleotidanya yaitu Actonitum
latent virus (AcoLV), Blueberry scorch virus (BlScV), Garlic latent virus
(PVM) dan CVB (Cohen et al. 2000; Chen et al. 2002; Fuji et al. 2002; Hataya et
al. 2000; Zavriev et al. 1991; Ohkawa et al. 2007). Beberapa spesies dari
carlavirus sudah dirunut pada daerah terminal 3’nya, termasuk diantaranya PVS,
HeLVS, CLV, LSV, CVB, CPMMV dan Daphne Virus S (DVS) (Badge et al.
1996; Foster & Mills, 1992; Lee et al. 2003). Semuanya menunjukkan organisasi
genom yang mirip, dengan kemiripan ukuran open reading frame (ORF), dan
tingkat homologi yang tinggi pada runutan asam amino diantara protein
padanannya.
RNA dengan poly A pada ujung 3’, memiliki 6 ORF yaitu ORF1
menyandi polipeptida (223 kDa) yang merupakan replikase virus; ORF2 (25
kDa), ORF3 (12 kDa) dan ORF4 (7 kDa) membentuk triple gene block (TGB)
yang berperan dalam pergerakan virus dari sel ke sel; ORF5 menyandi protein
selubung (34 kDa) dan ORF6 (11-16 kDa) menyandi protein cystein-rich yang
belum diketahui fungsinya (Gambar 2).
Gambar 2. Skema organisasi genom CVB (Sumber : Ohkawa et al. 2007). RNA memiliki 6 ORF dengan poly A pada ujung 3’
Identifikasi dan Deteksi CVB
Bioassay. Identifikasi virus secara biologis (bioesei) dapat dilakukan
melalui uji kisaran inang dan atau melalui uji hubungan virus dan serangga
vektornya. Cara tersebut telah dilakukan untuk mendeteksi dan mengidentifikasi
CVB (Hollings & Stones, 1972; Ram et al. 2005; Verma et al. 2003; Suastika et
al. 1997).
Uji serologi. Teknik serologi merupakan salah satu cara deteksi dan
identifikasi suatu patogen dalam suatu inang, yang memanfaatkan reaksi spesifik
antara antigen dan antiserum (Crowther, 1995). Metode ini, telah mengalami
perkembangan yang sangat pesat dan aplikasinya di bidang penyakit tumbuhan
sudah sangat umum digunakan, yaitu untuk mendeteksi suatu patogen khususnya
menentukan konsentrasi virus dalam jaringan tumbuhan, mendeteksi virus
tumbuhan dalam tubuh serangga vektor dan untuk mengetahui hubungan
kekerabatan antar virus (Agrios, 1997). Deteksi dan identifikasi secara serologi
sudah umum diaplikasikan untuk berbagai virus. Ada beberapa cara yang
digunakan untuk deteksi serologi antara lain immunosorbent electron microscopy
(ISEM) (Dykstra, 1992; Flager et al. 1993), immunoflourescent staining
(Hampton et al. 1990), gel double-diffusion test, dot-blot immunobinding assay
(DIBA), tissue-blot immunoassay (TBIA), western blot (Harlow & Lane 1999;
Lin et al. 1990), agarose gel presipitation test (AGPT) (Mahmood et al. 1997)
dan enzyme linked immunosorbent assay (ELISA) (Harlow & Lane 1999; Kumari
et al. 2006).
Metode serologi yang telah berhasil dikembangkan untuk mendeteksi virus
tumbuhan diantaranya yaitu ELISA dan western blot untuk mendeteksi beberapa
protein selubung dari genus Begomovirus (Abouzid et al. 2002), DIBA
digunakan untuk mendeteksi Zuccini yellow mosaic virus (ZYMV) (Somowiyarjo
et al. 1989), metode ISEM telah berhasil digunakan untuk deteksi dan identifikasi
bentuk partikel Tomato yellow leaf curl virus (TYLCV) oleh Attathom et al.
(1990). Deteksi partikel virus menggunakan antiserum dengan metode immune
electron microscopy (IEM) dilakukan oleh Sharma et al. (2005) terhadap virus
CMV, Lily mottle virus (LMoV) dan LSV pada tanaman lily. Deteksi dengan
metode immunoflourescent staining juga telah berhasil dilakukan oleh Sudarshana
et al. (1997) untuk mengetahui dinamika pergerakan Bean dwarf mosaic
geminivirus (BDMV) dari sel ke sel pada Phaseolus vulgaris. Pengujian
presipitasi dengan memanfaatkan reaksi difusi antara antigen dan antibodi telah
berhasil dilakukan oleh Mahmood et al. (1997) untuk mendeteksi Wheat streak
mosaic tritimovirus (WSMV).
TBIA digunakan untuk mengamati keberadaan Chickpea chlorotic dwarf
virus (CpCDV) pada jaringan tanaman (Kumari et al. 2006), dan juga cukup
sensitif untuk mendeteksi Florida hibiscus virus (Kamenova & Adkins, 2004).
TBIA pertama kali dikerjakan oleh Lin et al. (1990) untuk mendeteksi beberapa
virus dan mycoplasmalike organism. Teknik TBIA memiliki beberapa kelebihan
distribusi virus pada bagian terinfeksi; 2) pengerjaan deteksi lebih cepat dan lebih
sedikit membutuhkan tenaga kerja, sebab membran dapat diblot dalam beberapa
menit, sehingga dapat diterapkan dalam skala besar; 3) blotting dapat dilakukan di
lapangan dan kemudian dikirim ke laboratorium untuk pengerjaan selanjutnya;
dan 4) membran dapat disimpan dalam suhu ruang selama 10 hari tanpa
kehilangan sensitivitasnya.
Deteksi CVB secara serologi dilaporkan telah dipakai untuk mendeteksi
CVB pada tanaman krisan dengan metode double antibody sandwich-ELISA
(DAS-ELISA) (Ram et al. 2005; Verma et al. 2003). Verma et al. (2003) juga
menggunakan antiserum CVB untuk melihat partikel virus pada kajian IEM. Pada
tanaman G. savatieri antiserum CVB digunakan untuk deteksi virus secara
serologi dengan metode indirect-ELISA (I-ELISA) dan untuk ISEM (Suastika
et al. 1997).
Keberhasilan dan ketelitian teknik serologi untuk mendeteksi dan
mengidentifikasi virus sangat tergantung pada ketersediaan pereaksi diagnostik
seperti antiserum dengan kualitas yang baik (Kumari et al. 2006). Antiserum
adalah serum yang mengandung antibodi (Noordam, 1973). Antibodi adalah
molekul imunoglobulin yang dihasilkan oleh sistem imun dari hewan sebagai
tanggapan terhadap suatu rangsangan molekul asing (antigen) (Crowther, 1995).
Antibodi banyak dimanfaatkan dalam kajian imunologi untuk mengidentifikasi
suatu patogen. Ikatan antigen dengan antibodi sangat spesifik, suatu molekul
antigen mempunyai kemampuan untuk bereaksi atau berikatan dengan suatu
molekul imunoglobulin (Sambrook et al., 1989). Antigen pada umumnya terdiri
atas makromolekul yaitu berupa protein, nukleoprotein ataupun polisakarida
yang mempunyai berat molekul lebih dari 10.000 dan akan bereaksi spesifik
apabila diinjeksikan ke dalam tubuh hewan percobaan. Molekul dengan berat
molekul lebih rendah dari 5000 biasanya tidak efektif sebagai imunogen
(Crowther, 1995). Virus mempunyai berbagai macam gen yang masing-masing
akan menyandikan pembentukan suatu protein. Untuk membuat antibodi dari
suatu virus tumbuhan pada umumnya digunakan protein selubung partikel virus.
Sambrook et al. (1989) membagi antibodi berdasarkan reaksinya terhadap
suatu antigen, yang disebut dengan antibodi poliklonal. (2) Antibodi yang
bereaksi terhadap epitop spesifik disebut dengan antibodi monoklonal. (3)
Antibodi yang bereaksi terhadap protein dalam bentuk terdenaturasi. Antibodi ini
dapat bersifat monoklonal maupun poliklonal. Antibodi poliklonal dibentuk oleh
sejumlah klon limfosit B yang dirangsang oleh banyak epitop dari suatu antigen
sehingga variabilitas antibodi tinggi. Antibodi monoklonal, sangat spesifik karena
hanya dibentuk oleh satu macam epitop. Produksi antibodi poliklonal lebih mudah
dan murah dibandingkan antibodi monoklonal.
Beberapa jenis hewan berdarah panas yang sering digunakan untuk
memproduksi antibodi antara lain kelinci, marmut, ayam, mencit, domba dan
kuda. Marmut sering menjadi hewan pilihan karena hanya memerlukan sedikit
antigen untuk imunisasi, volume serumnya relatif banyak, mudah
pemeliharaannya, dan menghasilkan antiserum yang baik kualitasnya. Menurut
Rollin & Kesel (1995), marmut adalah sumber komplemen serum yang sangat
baik.
Potensi antigen untuk menimbulkan respon kekebalan sangat dipengaruhi
oleh berat molekul, struktur dan kompleksitasnya, sedangkan kualitas antibodi
dipengaruhi oleh konsentrasi antigen dan cara imunisasi. Respon kekebalan
dapat ditingkatkan melalui modifikasi antigen dengan mencampur menggunakan
bahan tambahan seperti adjuvant (Duncan, 1980). Antigen dapat memicu respon
kekebalan paling kuat apabila diinjeksikan langsung pada kelenjar getah bening
poplitea (Sambrook et al., 1989), tetapi memerlukan keterampilan khusus untuk
melakukan injeksi. Terdapat berbagai cara imunisasi hewan percobaan yang
umum dilakukan yaitu dengan cara menginjeksikan antigen melalui otot paha
(intramuscular), pembuluh darah vena (intravenous), di bawah kulit (sub
cutaneous), dan rongga perut (intraperitoneal) (Svendsen & Hau, 1994;
Sambrook et al., 1989). Imunisasi secara berulang dengan selang waktu tertentu
dapat meningkatkan respon kekebalan suatu individu.
RT-PCR. Karakterisasi virus tanaman dapat dilakukan juga melalui sifat
asam nukleat virus tersebut. Saat ini metode deteksi dan identifikasi virus yang
akurat banyak dilakukan berbasis pada pengetahuan biologi molekuler yang telah
mengamplifikasi DNA secara invitro, sangat berguna dalam mengidentifikasi
virus yang menginfeksi tanaman, hewan dan manusia. Identifikasi virus dengan
teknik PCR didasarkan pada sifat primer yang spesifik (Sambrook et al. 1989).
Oleh karena itu penentuan primer sangat menentukan spesifisitas hasil deteksi.
Identifikasi, studi keragaman dan analisis filogenetika kelompok carlavirus
seringkali menggunakan primer yang disusun berdasarkan informasi gen protein
selubung dan ujung 3’ untranslated region (UTR) (Badge et al. 1996; Foster &
Mills, 1992; Lee et al. 2003).
Modifikasi teknik PCR yaitu teknik RT-PCR dengan menggunakan primer
spesifik terbukti dapat digunakan untuk mendeteksi dan mengidentifikasi CMV,
LMoV, LSV dan Strawberry latent ringspot virus (SLRSV) pada tanaman lily
(Sharma et al. 2005; Choi & Ryu, 2003). Identifikasi molekuler dengan teknik
RT-PCR juga telah digunakan untuk mengkarakterisasi Daphne virus S (DVS)
pada tanaman Daphne spp. (Lee et al. 2003); Garlic latent virus (GarLV), Onion
yellow dwarf virus (OYDV) dan Leek yellow stripe virus (LYSV) pada tanaman
bawang putih; Shallot yellow stripe virus (SYSV) pada tanaman Allium fistulosum
var. caespitosum; dan LMoV pada tanaman lily (Chen et al. 2002).
Analisis asam nukleat CVB dengan teknik RT-PCR dilakukan oleh Levay
& Zavriev pada tahun 1991. Ram et al. (2005) pada penelitiannya memproduksi
tanaman krisan bebas CVB menggunakan teknik RT-PCR untuk mendeteksi dan
mengkarakterisasi CVB dari tanaman yang berbeda dan tempat yang berbeda.
Keunggulan masing-masing metode deteksi sangat ditentukan oleh
berbagai faktor. Identifikasi virus dengan kajian biologis memerlukan waktu yang
cukup lama karena harus mempersiapkan tanaman indikator, tetapi biaya yang
dikeluarkan tidak banyak. Metode serologi dan RT-PCR adalah metode yang lebih
dapat dipercaya dan lebih sensitif sebagai metode pendeteksi virus atau indexing,
dibandingkan dengan kajian biologi. Sering terjadi bahwa virus tidak terdeteksi
pada kajian biologi, tetapi menunjukkan hasil posistif dengan metode serologi dan
RT-PCR yang dapat mendeteksi virus pada konsentrasi rendah (Ram et al. 2005).
Namun demikian ELISA dan RT-PCR harus ditunjang dengan laboratorium yang
Pemurnian Virus
Kajian suatu virus penyebab penyakit tumbuhan, khususnya untuk
mengetahui morfologi, pengamatan bentuk dan ukuran partikel serta pembuatan
antiserum membutuhkan tersedianya virus murni. Sehingga untuk tujuan itu,
pemurnian virus merupakan salah satu langkah penting. Berbagai metode dan
modifikasi pemurnian suatu virus telah diketahui yang disesuaikan dengan sifat
dan jenis virusnya (Matthews 1992). Secara umum pemurnian virus dilakukan
melalui beberapa tahapan yaitu: 1) perbanyakan virus pada inang yang sedikit
mengandung atau tidak mengandung zat inhibitor, 2) mengurangi aktivitas enzim
inhibitor melalui pemilihan media homogenisasi yang tepat dengan cara
menggunakan penyangga pada molaritas dan pH larutan yang tepat, serta
penambahan bahan aditif seperti antioksidan atau bahan pengkelat , 3) penjernihan
ekstrak tanaman yang terinfeksi virus dengan tujuan untuk menghilangkan
molekul makro seperti mitokondria, ribosom, polisom, polisakarida dengan cara
menambahkan bahan pelarut organik misalnya eter, kloroform, atau butanol yang
dapat mendenaturisasi lemak dan protein tanpa merusak struktur virusnya, dan 4)
pemisahan virus dari komponen tanaman dengan presipitasi partikel
menggunakan polyethyleneglycole (PEG), dengan cara ultrasentrifugasi dengan
gradien kepekatan sukrosa atau sesium sulfat yang dapat memisahkan partikel
virus berdasarkan bentuk, ukuran dan berat jenisnya.
Beberapa penelitian sudah berhasil memurnikan carlavirus antara lain
adalah CVB, Elderberry carlavirus, DVS dan Nerine latent virus (NLV)
menggunakan gradien sukrose (Suastika et al. 1997; Van Lent et al. 1980; Lee et
al. 2003; Maat et al. 1978); dan CVB dan LSV menggunakan gradien sesium
sulfat (Verma et al. 2003; Sharma et al. 2005). Sedangkan Hollings et al. (1970)
memurnikan CVB menggunakan metode pemisahan virus dengan satu atau
beberapa siklus sentrifugasi diferensial (10.000 g selama 15 menit; 80.000 selama
TINJAUAN PUSTAKA
Krisan (Dendranthema grandiflora Kitam.)
Sejarah Tanaman Krisan
Krisan yang merupakan tanaman hias bunga berupa perdu dengan sebutan
lain seruni atau bunga emas (golden flower) berasal dari Cina. Tanaman ini sudah
ditanam 500 tahun sebelum Masehi, yang semula hanya digemari oleh masyarakat
Cina. Sekitar abad ke-8 Masehi krisan dibawa dan dibudidayakan di Jepang.
Kebanggaan terhadap bunga krisan menyebabkan bunga ini dijadikan sebagai
simbol kekaisaran Jepang dengan sebutan Queen of The East. Tanaman krisan
diintroduksi ke kawasan Eropa pada abad ke-17. Tanaman krisan pun menyebar di
kawasan Eropa, kemudian ke Asia. Pada tahun 1753 Karl Linnaeus, ahli botani
Swedia, mengkombinasikan kata Latin chrysos yang berarti emas dengan kata
anthemon yang berarti bunga, untuk menamakan tanaman krisan. Jenis atau
varietas krisan modern diduga mulai ditemukan pada abad ke-17
(http//www.mums.org).
Krisan mulai dikoleksi di Indonesia pada tahun 1800an dan
dikembangkan secara komersial sejak tahun 1940an. Krisan merupakan salah satu
jenis tanaman hias bunga yang sangat diminati dan memiliki nilai ekonomi yang
relatif tinggi di Indonesia serta mempunyai prospek pemasaran cerah, terutama
dijual berupa bunga potong dan tanaman hias bunga pot. Sentra produksi krisan di
Indonesia antara lain: Bandung, Cianjur, Sukabumi, Lembang, Bogor dan Garut
(Jawa Barat), Semarang, Magelang, Karanganyar dan Sukoharjo (Jawa Tengah),
Malang dan Pasuruan (Jawa Timur), dan Brastagi (Sumatera Utara). Jenis atau
varietas krisan yang dikembangkan di Indonesia umumnya krisan hibrida yang
berasal dari Belanda, Amerika Serikat dan Jepang (Rukmana & Mulyana, 1997).
Budidaya Tanaman Krisan
Krisan tumbuh baik di dataran tinggi antara 600 -1000 m dpl, dapat
tumbuh hampir di semua jenis tanah dengan aerasi dan drainase baik, memiliki
tingkat kesuburan yang tinggi dengan kandungan unsur hara dalam jumlah
15,5°C dan suhu siang 32°C (Kofranek, 1992). pH optimum tanah untuk
pertumbuhan krisan adalah 5,5-6,7 (Carter, 1992; Konfranek, 1992).
Tanaman ini sangat responsif terhadap lama waktu penyinaran cahaya atau
fotoperiode. Agar tanaman dapat berbunga dengan baik, kebanyakan varietas
memerlukan hari pendek selama fase pembungaan (Janick, 1972; Kofranek,
1992). Tanaman yang ditanam untuk tujuan produksi bunga diberi penyinaran
sekitar 14,5 jam per hari dengan tujuan merangsang pertumbuhan vegetatif
dan mencapai panjang batang tertentu sebelum terjadi pembungaan. Untuk
daerah tropis, tambahan penyinaran 2,5 jam per hari cukup untuk
mempertahankan fase vegetatif dan penghentian penyinaran akan mendorong
pembentukan bunga.
Perbanyakan tanaman krisan dapat dilakukan dengan stek pucuk dari
tanaman induk dan anakan (Genders, 1961; Crater, 1992). Panjang stek pucuk
yang ideal adalah 5 cm dan biasanya sudah memiliki 3 helai daun yang
membuka penuh. Anakan bisa diperoleh langsung dari tanaman produksi
dengan cara mencabut bersama akarnya. Pembibitan diperlukan jika digunakan
stek pucuk dalam perbanyakan tanaman (Kofranek, 1992).
Jarak tanam yang biasa digunakan pada penanaman krisan potong
yaitu 10 cm x 10 cm atau 20 cm x 20 cm (Rukmana & Mulyana, 1997). Cara
yang paling praktis untuk memulai penanaman yaitu dengan memasang jaring
penegak lebih dahulu di atas bedengan. Dengan demikian jarak tanam dapat
mengikuti pola kotak-kotak pada jaring yang ukurannya sudah tertentu.
Menurut Laurie & Ries (1950) pemupukan dan drainase sangat
berpengaruh pada awal pertumbuhan. Krisan tidak memerlukan pemupukan
lebih lanjut bila telah membentuk kuncup bunga berdiameter lebih dari 1,0-1,5
cm. Tahap ini dicapai saat tanaman berumur 10-12 minggu setelah tanam
(Kofranek, 1992).
Merangsang pertumbuhan cabang-cabang lateral dengan tujuan mendapat
tanaman krisan dengan tipe banyak bunga per tangkai (tipe spray), dilakukan
dengan pembuangan titik tumbuh (soft pinch) (Crater, 1992). Pembuangan titik
tumbuh umumnya dilakukan pada saat tanaman berumur 10-14 hari setelah
besar pertangkai (tipe standard), dilakukan pembuangan kuncup lateral
(Kofranek, 1992; Greensill, 1970).
Di daerah beriklim tropis krisan membutuhkan waktu sekitar 3-4
bulan sejak bibit ditanam sampai menghasilkan bunga. Saat panen yang tepat
adalah ketika bunga setengah mekar atau 3-4 hari sebelum mekar penuh.
Biasanya pada saat ini bunga telah mencapai ukuran penuh, intensitas warna
hampir mencapai puncaknya, dan bunga masih kuncup (Rukmana & Mulyana,
1997).
Hama dan Penyakit pada Tanaman Krisan
Kendala utama pada budidaya tanaman krisan adalah gangguan hama dan
penyakit. Hama-hama penting yang menyerang tanaman krisan adalah Ostrinia
nubilalis (Lepidoptera: Pyralidae); Thrips sp. (Thysanoptera: Thripidae);
Liriomyza trifolii (Diptera: Agromyzidae); Aphis gossypii (Homoptera:
Aphididae) (Elzingga, 1978; Pirone, 1978; Blackman & Eastop, 1984). Pirone
(1978) melaporkan bahwa selain A. gossypii¸ tanaman krisan juga dapat diserang
oleh kutudaun yang lain seperti Macrosiphoniella sanborni dan Myzus persicae.
Penyakit-penyakit utama tanaman krisan adalah penyakit bercak daun
septoria (Septoria chrysanthemi dan S. leucanthemi), karat hitam (Puccinia
chrysanthemi), karat putih (P. horiana), tepung oidium (Oidium chrysanthemi),
kapang kelabu (Botrytis cenerea), dan layu cendawan (Fusarium oxysporum dan
Verticillium alboatrum (Pirone, 1978; Semangun, 1991).
Beberapa virus dilaporkan menginfeksi tanaman krisan, yang terpenting
antara lain Tomato aspermy cucumovirus (TAV) dan Cucumber mosaic
cucumovirus (CMV); Chrysanthemum B carlavirus (CVB); dan Tomato spotted
wilt tospovirus (TSWV) (Bouween & Zaayen, 1995). Beberapa virus lainnya yang
dapat menginfeksi krisan adalah Turnip mosaic potyvirus (TuMV) (Chen et al.
2000), Tobacco mosaic tobamovirus (TMV), Potato Y potyvirus (PVY), dan
Potato X potexvirus (PVX) (Navalinskiene & Samuitiene, 1996).
Selain dari jenis cendawan dan virus, krisan juga terinfeksi oleh viroid.
Ada dua jenis viroid yang menginfeksi tanaman krisan yaitu Chrysanthemum
stunt viroid (CSVd) dan Chrysanthemum chlorotic mottle viroid (CChMVd)
Chrysanthemum B Carlavirus (CVB)
Kisaran Inangdan Gejala Infeksi
CVB atau nama lainnya adalah Chrysanthemum mild mosaic virus,
Chrysanthemum virus B, Chrysanthemum Q virus, Chrysanthemum dwarf mottle,
Chrysanthemum necrotic mottle, Gynura latent virus, dan Chrysanthemum vein
mottle virus adalah virus dari genus carlavirus (Hollings & Stone, 1972; Hakkart
& Maat, 1974).
CVB mempunyai kisaran inang yang sempit, menginfeksi tanaman krisan
dan sekitar 10 spesies pada 5 famili dikotiledon (Hollings, 1957). Pada penelitian
Verma et al. (2003), dari 22 spesies tanaman yang diinokulasi untuk uji kisaran
inang, hanya 5 spesies yang terinfeksi, yaitu N. clevelandii, N. glutinosa, N.
rustika, Petunia hybrida dan Vicia faba. Sedangkan penelitian Suastika et al.
(1997) menemukan bahwa CVB mampu menginfeksi tanaman Gymnaster
savateri, N. clevelandii, N. occidentalis, P. hybrida, Helichrysum bracteatum,
Zinnia elegans, C. amaranticolor, C. quinoa, Sesamum indicum dan Tetragonia
expansa. Sedangkan 13 spesies tanaman lainnya dari 7 famili yang diuji, tidak
terinfeksi.
Hollings (1957) melaporkan bahwa beberapa spesies tanaman yang sesuai
untuk penyebaran CVB antara lain Aster amellus, Chrysanthemum carinatum,
C. morifolium, N. clevelandii, N. glutinosa, N. rustika, N. affinis. Sedangkan yang
bukan inang CVB antara lain Datura stramonium, C. amaranticolor, C. quinoa,
Gomphrena globosa, Capsicum annuum, Cucumis sativus, Licopersicon
esculentum.
Walaupun memiliki inang yang terbatas, tetapi CVB dilaporkan tersebar
pada pertanaman krisan di seluruh dunia. Infeksi virus ini pada tanaman krisan
menyebabkan perubahan fisiologi tanaman, yang berakibat gejala belang daun
atau pemucatan tulang daun yang sangat ringan pada beberapa kultivar. Namun
demikian sering kultivar yang terinfeksi virus ini tidak menunjukkan gejala
(symptomless) (Hollings & Stone, 1972). Beberapa varietas terinfeksi