EVALUASI TIGA METODE PREPARASI RNA TOTAL
UNTUK DETEKSI
Turnip mosaic virus
PADA BENIH
Brassica
sp. DENGAN
REVERSE TRANSCRIPTION POLYMERASE CHAIN
REACTION
JATI ADIPUTRA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
2
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Evaluasi Tiga Metode Preparasi RNA Total untuk Deteksi TuMV pada Benih Brassica sp. dengan Reverse
Transcription Polymerase Chain Reaction adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
3
ABSTRACT
JATI ADIPUTRA. Evaluation of Three Total RNA Preparation Methods for Detection of Turnip mosaic virus from Brassica Seeds using Reverse Transcription Polymerase Chain Reaction Supervised by SRI HENDRASTUTI HIDAYAT and TRI ASMIRA DAMAYANTI.
Turnip mosaic virus (TuMV) is an important seedborne virus that infects
vegetable crops, especially brassica group. Plant Quarantine agency of Indonesia considers TuMV as an A1 Quarantine regulated pest, because its occurrence was not reported until 2006. Due to increasing number of brassica seeds imported to Indonesia, it is important for Plant Quarantine Agency to have an accurate and reliable detection method to prevent the virus entering the country. The objective of the study is to evaluate three total RNA extraction methods from Brassica seeds for TuMV detection using RT-PCR. The sample used are caisin (Brassica rappa L cv. group caisin) seeds and seeds germinated for 3, 5 and 7 days. Total RNA extraction methods evaluated in this study were: Willey, Randles, and RNeasy plant mini kit for comparation. Analysis on total RNA produced by the three methods showed that Randles method resulted in high RNA concentration, but the RNA purity was low. On the other hand, RNeasy method resulted in high RNA purity but the concentration of RNA was low. Specific TuMV fragment of 800 bp was succesfully amplified from seeds without germination using Willey and Randles methods. All three methods were able to detect TuMV seeds germinated for 3 days. Randles method was the only method which able to detect TuMV from seeds germinated for 5 days; whereas none of the methods were able to detect TuMV from seeds germinated for 7 days. Duplex RT-PCR with primer nad5F and nad5R used as an internal control was able to amplify both TuMV and internal control DNA. It was concluded that Willey methods have the best succes rate compare to the other two methods for detecting TuMV from Brassica seeds.
4
RINGKASAN
JATI ADIPUTRA. Evaluasi Tiga Metode Preparasi RNA Total untuk Deteksi TuMV pada Benih Brassica sp. dengan Reverse Transcription Polymerase Chain
Reaction Dibimbing oleh SRI HENDRASTUTI HIDAYAT dan TRI ASMIRA
DAMAYANTI.
Turnip mosaic virus (TuMV; Potyvirus) merupakan jenis virus terpenting
kedua yang menyerang pertanaman sayur-sayuran, terutama dari marga Brassica. Virus ini terbawa benih, sehingga berpotensi untuk masuk ke wilayah Indonesia melalui benih impor. Berdasarkan Kepmentan no.38 tahun 2006 TuMV masih tergolong OPTK A1 dan harus dicegah pemasukkannya ke dalam wilayah Indonesia. Oleh karena itu perlu dilakukan upaya deteksi TuMV pada benih menggunakan metode dengan tingkat keberhasilan yang baik. RT-PCR telah dikenal memiliki sensitivitas yang lebih baik dibanding ELISA, namun keberhasilan RT-PCR untuk mendeteksi virus tanaman ditentukan oleh metode ekstraksi RNA yang tepat. Oleh karena itu perlu dilakukan evaluasi untuk menentukan metode ekstraksi yang tepat untuk mendeteksi TuMV pada benih
Brassica sp.
Sampel yang digunakan adalah benih caisin (Brassica rappa L cv. group caisin) yang terinfeksi TuMV di lapang. Ekstraksi RNA dilakukan pada benih, serta kecambah umur 3, 5 dan 7 hari dengan tiga metode ekstraksi RNA yang berbeda, yaitu: Willey, Randles, dan RNeasy plant mini kit. RNA hasil ekstraksi diukur konsentrasi dan kemurniannya menggunakan spektrofotometer pada panjang gelimbang 260 dan 280 nm. RNA kemudian diubah menjadi cDNA menggunakan enzim M-MuLV reverse transcriptase, lalu cDNA yang dihasilkan diamplifikasi menggunakan duplex PCR dengan primer spesifik TuMV, yaitu TuMV8573F dan TuMV 9385R dengan produk berukuran 800 bp dan primer nad5F dan nad5R sebagai kontol internal. Hasil amplifikasi divisualisasi menggunakan gel agarosa konsentrasi 1,5%.
Hasil kuantifikasi RNA menunjukkan bahwa metode Randles memiliki nilai konsentrasi RNA total tertinggi, namun dengan kemurnian terendah. Sebaliknya metode RNeasy memiliki konsentrasi terendah namun dengan kemurnian yang cukup baik. Deteksi TuMV pada benih menunjukkan hasil positif untuk RNA total yang dideteksi menggunakan metode Willey dengan tingkat keberhasilan yang lebih baik dari Randles, sedangkan metode RNeasy tidak dapat mendeteksi TuMV pada benih. Pada kecambah 3 hari TuMV berhasil terdeteksi menggunakan ketiga metode ekstraksi. Pada kecambah 5 hari hanya RNA yang diekstrak menggunakan metode Randles yang mampu mendeteksi TuMV. Sedangkan pada kecambah berumur 7 hari TuMV tidak berhasil terdeteksi dengan tiga metode ekstraksi RNA tersebut. Kesimpulan dari penelitian ini adalah metode ekstraksi RNA total yang dikembangkan oleh Willey merupakan metode dengan tingkat keberhasilan terbaik untuk mendeteksi TuMV dari benih dan kecambah. Duplex PCR menggunakan primer TuMV dan primer nad5 dapat digunakan untuk mendeteksi keberadaan TuMV dan RNA total jaringan tanaman.
5
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
6
EVALUASI TIGA METODE PREPARASI RNA TOTAL UNTUK
DETEKSI
Turnip mosaic virus
PADA BENIH
Brassica
sp.
DENGAN REVERSE TRANSCRIPTION POLYMERASE
CHAIN REACTION
JATI ADIPUTRA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi/Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
7
9
PRAKATA
Bismillahi rohmaani rohiim. Alhamdulillahi robbil’alamin.
Segala puji dan syukur kepada Allah SWT atas limpahan rahmat dan hidayah-Nya kepada penulis sehingga dapat menyelesaikan penulisan tesis yang berjudul “Evaluasi tiga metode preparasi RNA total untuk deteksi TuMV pada benih Brassica sp. dengan reverse transcription polymerase chain reaction”. Salawat dan salam tercurah kepada Rasullulah SAW, keluarga, para sahabat, dan para pengikutnya.
Penulis menyampaikan rasa terima kasih yang tidak terhingga kepada Dr. Ir. Sri Hendrastuti Hidayat, MSc. dan Dr. Ir. Tri Asmira Damayanti M.Agr. atas bimbingan, kesabaran, pengkayaan wawasan, saran, kritik dan dukungan moril yang sangat besar peranannya dalam penyelesaian penulisan tesis ini. Ucapan terima kasih juga disampaikan kepada Ir. Syukur Iwantoro, MS, MBA. atas kesempatan yang diberikan kepada penulis untuk mengikuti program magister di IPB, serta Dr. Ir. Catur Putra Budiman MSc. atas dukungannya terhadap penulis selama mengikuti Sekolah Pasca Sarjana ini. Ucapan terima kasih juga disampaikan kepada Dr. Ir. Eliza S. Rusli, M.Si yang bersedia menjadi Penguji Luar Komisi pada Ujian Tesis.
Rasa hormat yang setinggi-tingginya penulis sampaikan kepada kedua orang tua tercinta, ayahanda Parali Setiadi, ibunda Sri Lestari dan kakak-kakakku tercinta mas Dodit (Alm.), mas Bimo, mas Danar, mas Kikit, dan mas Neri yang telah mencurahkan kasih sayang, doa dan bimbingan. Ucapan terima kasih yang tidak terhingga juga penulis ucapkan kepada istri terkasih Primadani Kuliahsari atas kesabaran, kasih sayang dan dukungannya. Ucapan terima kasih disampaikan pula pada Mertua Bapak Heri Purnomo dan Ibu Puji Ken Rahayu, dan adik-adik ipar tersayang, adik Krisna dan adik Heni atas doa, dorongan semangat dan bantuan moril selama ini.
Penulis juga menyampaikan terima kasih kepada rekan-rekan di Balai Besar Uji Standar Karantina Pertanian R. Yudiarto, Rumenda Ginting, Nurjanah, Dwi Sugipriatini, Titi Sumarti, Yani Dawi, Derhani LG, Rahmawati, Ummu Salamah R, Andi Prasetiawan, Dwi Subekti, dan Isti Wulandari atas persahabatan dan kerjasamanya. Penulis juga mengucapkan terima kasih kepada mbak Tuti dari laboratorium Virologi IPB atas bantuannya selama penelitian.
Akhir kata penulis haturkan terima kasih kepada semua pihak dan semoga hasil penelitian ini bermanfaat untuk kepentingan umat manusia dan ilmu pengetahuan.
Bogor, 14 Februari 2009
10
RIWAYAT HIDUP
Jati Adiputra, SSi. Dilahirkan di Purworejo tanggal 5 Agustus 1976, sebagai anak keenam dari enam bersaudara, pasangan Bapak Parali Setiadi dan Ibu Sri Lestari. Penulis menikah dengan Primadani Kuliahsari pada tahun 2007.
Penulis menempuh pendidikan di SMU Charitas, Jakarta, lulus pada tahun 1994. Penulis melanjutkan ke pendidikan tinggi di Universitas Nasional Jakarta, Fakultas Biologi pada tahun 1994 -2001.
Pada Tahun 2005 penulis diterima sebagai Tenaga Pengendali Organisme Pengganggu Tumbuhan di Badan Karantina Pertanian. Sejak tahun tersebut penulis bekerja sebagai Tenaga Pengendali Organisme Pengganggu Tumbuhan di Balai Besar Uji Standar Karantina Pertanian, Jakarta.
EVALUASI TIGA METODE PREPARASI RNA TOTAL
UNTUK DETEKSI
Turnip mosaic virus
PADA BENIH
Brassica
sp. DENGAN
REVERSE TRANSCRIPTION POLYMERASE CHAIN
REACTION
JATI ADIPUTRA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
2
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Evaluasi Tiga Metode Preparasi RNA Total untuk Deteksi TuMV pada Benih Brassica sp. dengan Reverse
Transcription Polymerase Chain Reaction adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
3
ABSTRACT
JATI ADIPUTRA. Evaluation of Three Total RNA Preparation Methods for Detection of Turnip mosaic virus from Brassica Seeds using Reverse Transcription Polymerase Chain Reaction Supervised by SRI HENDRASTUTI HIDAYAT and TRI ASMIRA DAMAYANTI.
Turnip mosaic virus (TuMV) is an important seedborne virus that infects
vegetable crops, especially brassica group. Plant Quarantine agency of Indonesia considers TuMV as an A1 Quarantine regulated pest, because its occurrence was not reported until 2006. Due to increasing number of brassica seeds imported to Indonesia, it is important for Plant Quarantine Agency to have an accurate and reliable detection method to prevent the virus entering the country. The objective of the study is to evaluate three total RNA extraction methods from Brassica seeds for TuMV detection using RT-PCR. The sample used are caisin (Brassica rappa L cv. group caisin) seeds and seeds germinated for 3, 5 and 7 days. Total RNA extraction methods evaluated in this study were: Willey, Randles, and RNeasy plant mini kit for comparation. Analysis on total RNA produced by the three methods showed that Randles method resulted in high RNA concentration, but the RNA purity was low. On the other hand, RNeasy method resulted in high RNA purity but the concentration of RNA was low. Specific TuMV fragment of 800 bp was succesfully amplified from seeds without germination using Willey and Randles methods. All three methods were able to detect TuMV seeds germinated for 3 days. Randles method was the only method which able to detect TuMV from seeds germinated for 5 days; whereas none of the methods were able to detect TuMV from seeds germinated for 7 days. Duplex RT-PCR with primer nad5F and nad5R used as an internal control was able to amplify both TuMV and internal control DNA. It was concluded that Willey methods have the best succes rate compare to the other two methods for detecting TuMV from Brassica seeds.
4
RINGKASAN
JATI ADIPUTRA. Evaluasi Tiga Metode Preparasi RNA Total untuk Deteksi TuMV pada Benih Brassica sp. dengan Reverse Transcription Polymerase Chain
Reaction Dibimbing oleh SRI HENDRASTUTI HIDAYAT dan TRI ASMIRA
DAMAYANTI.
Turnip mosaic virus (TuMV; Potyvirus) merupakan jenis virus terpenting
kedua yang menyerang pertanaman sayur-sayuran, terutama dari marga Brassica. Virus ini terbawa benih, sehingga berpotensi untuk masuk ke wilayah Indonesia melalui benih impor. Berdasarkan Kepmentan no.38 tahun 2006 TuMV masih tergolong OPTK A1 dan harus dicegah pemasukkannya ke dalam wilayah Indonesia. Oleh karena itu perlu dilakukan upaya deteksi TuMV pada benih menggunakan metode dengan tingkat keberhasilan yang baik. RT-PCR telah dikenal memiliki sensitivitas yang lebih baik dibanding ELISA, namun keberhasilan RT-PCR untuk mendeteksi virus tanaman ditentukan oleh metode ekstraksi RNA yang tepat. Oleh karena itu perlu dilakukan evaluasi untuk menentukan metode ekstraksi yang tepat untuk mendeteksi TuMV pada benih
Brassica sp.
Sampel yang digunakan adalah benih caisin (Brassica rappa L cv. group caisin) yang terinfeksi TuMV di lapang. Ekstraksi RNA dilakukan pada benih, serta kecambah umur 3, 5 dan 7 hari dengan tiga metode ekstraksi RNA yang berbeda, yaitu: Willey, Randles, dan RNeasy plant mini kit. RNA hasil ekstraksi diukur konsentrasi dan kemurniannya menggunakan spektrofotometer pada panjang gelimbang 260 dan 280 nm. RNA kemudian diubah menjadi cDNA menggunakan enzim M-MuLV reverse transcriptase, lalu cDNA yang dihasilkan diamplifikasi menggunakan duplex PCR dengan primer spesifik TuMV, yaitu TuMV8573F dan TuMV 9385R dengan produk berukuran 800 bp dan primer nad5F dan nad5R sebagai kontol internal. Hasil amplifikasi divisualisasi menggunakan gel agarosa konsentrasi 1,5%.
Hasil kuantifikasi RNA menunjukkan bahwa metode Randles memiliki nilai konsentrasi RNA total tertinggi, namun dengan kemurnian terendah. Sebaliknya metode RNeasy memiliki konsentrasi terendah namun dengan kemurnian yang cukup baik. Deteksi TuMV pada benih menunjukkan hasil positif untuk RNA total yang dideteksi menggunakan metode Willey dengan tingkat keberhasilan yang lebih baik dari Randles, sedangkan metode RNeasy tidak dapat mendeteksi TuMV pada benih. Pada kecambah 3 hari TuMV berhasil terdeteksi menggunakan ketiga metode ekstraksi. Pada kecambah 5 hari hanya RNA yang diekstrak menggunakan metode Randles yang mampu mendeteksi TuMV. Sedangkan pada kecambah berumur 7 hari TuMV tidak berhasil terdeteksi dengan tiga metode ekstraksi RNA tersebut. Kesimpulan dari penelitian ini adalah metode ekstraksi RNA total yang dikembangkan oleh Willey merupakan metode dengan tingkat keberhasilan terbaik untuk mendeteksi TuMV dari benih dan kecambah. Duplex PCR menggunakan primer TuMV dan primer nad5 dapat digunakan untuk mendeteksi keberadaan TuMV dan RNA total jaringan tanaman.
5
© Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
6
EVALUASI TIGA METODE PREPARASI RNA TOTAL UNTUK
DETEKSI
Turnip mosaic virus
PADA BENIH
Brassica
sp.
DENGAN REVERSE TRANSCRIPTION POLYMERASE
CHAIN REACTION
JATI ADIPUTRA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi/Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
7
9
PRAKATA
Bismillahi rohmaani rohiim. Alhamdulillahi robbil’alamin.
Segala puji dan syukur kepada Allah SWT atas limpahan rahmat dan hidayah-Nya kepada penulis sehingga dapat menyelesaikan penulisan tesis yang berjudul “Evaluasi tiga metode preparasi RNA total untuk deteksi TuMV pada benih Brassica sp. dengan reverse transcription polymerase chain reaction”. Salawat dan salam tercurah kepada Rasullulah SAW, keluarga, para sahabat, dan para pengikutnya.
Penulis menyampaikan rasa terima kasih yang tidak terhingga kepada Dr. Ir. Sri Hendrastuti Hidayat, MSc. dan Dr. Ir. Tri Asmira Damayanti M.Agr. atas bimbingan, kesabaran, pengkayaan wawasan, saran, kritik dan dukungan moril yang sangat besar peranannya dalam penyelesaian penulisan tesis ini. Ucapan terima kasih juga disampaikan kepada Ir. Syukur Iwantoro, MS, MBA. atas kesempatan yang diberikan kepada penulis untuk mengikuti program magister di IPB, serta Dr. Ir. Catur Putra Budiman MSc. atas dukungannya terhadap penulis selama mengikuti Sekolah Pasca Sarjana ini. Ucapan terima kasih juga disampaikan kepada Dr. Ir. Eliza S. Rusli, M.Si yang bersedia menjadi Penguji Luar Komisi pada Ujian Tesis.
Rasa hormat yang setinggi-tingginya penulis sampaikan kepada kedua orang tua tercinta, ayahanda Parali Setiadi, ibunda Sri Lestari dan kakak-kakakku tercinta mas Dodit (Alm.), mas Bimo, mas Danar, mas Kikit, dan mas Neri yang telah mencurahkan kasih sayang, doa dan bimbingan. Ucapan terima kasih yang tidak terhingga juga penulis ucapkan kepada istri terkasih Primadani Kuliahsari atas kesabaran, kasih sayang dan dukungannya. Ucapan terima kasih disampaikan pula pada Mertua Bapak Heri Purnomo dan Ibu Puji Ken Rahayu, dan adik-adik ipar tersayang, adik Krisna dan adik Heni atas doa, dorongan semangat dan bantuan moril selama ini.
Penulis juga menyampaikan terima kasih kepada rekan-rekan di Balai Besar Uji Standar Karantina Pertanian R. Yudiarto, Rumenda Ginting, Nurjanah, Dwi Sugipriatini, Titi Sumarti, Yani Dawi, Derhani LG, Rahmawati, Ummu Salamah R, Andi Prasetiawan, Dwi Subekti, dan Isti Wulandari atas persahabatan dan kerjasamanya. Penulis juga mengucapkan terima kasih kepada mbak Tuti dari laboratorium Virologi IPB atas bantuannya selama penelitian.
Akhir kata penulis haturkan terima kasih kepada semua pihak dan semoga hasil penelitian ini bermanfaat untuk kepentingan umat manusia dan ilmu pengetahuan.
Bogor, 14 Februari 2009
10
RIWAYAT HIDUP
Jati Adiputra, SSi. Dilahirkan di Purworejo tanggal 5 Agustus 1976, sebagai anak keenam dari enam bersaudara, pasangan Bapak Parali Setiadi dan Ibu Sri Lestari. Penulis menikah dengan Primadani Kuliahsari pada tahun 2007.
Penulis menempuh pendidikan di SMU Charitas, Jakarta, lulus pada tahun 1994. Penulis melanjutkan ke pendidikan tinggi di Universitas Nasional Jakarta, Fakultas Biologi pada tahun 1994 -2001.
Pada Tahun 2005 penulis diterima sebagai Tenaga Pengendali Organisme Pengganggu Tumbuhan di Badan Karantina Pertanian. Sejak tahun tersebut penulis bekerja sebagai Tenaga Pengendali Organisme Pengganggu Tumbuhan di Balai Besar Uji Standar Karantina Pertanian, Jakarta.
11
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA ... 4
Karakteristik Turnip mosaic virus ... 4
Morfologi dan biologi ... 4
Kisaran inang, gejala dan daerah sebar ... 6
Karakteristik caisin (Brassica rappa L cv. group caisin) ... 7
Deteksi Virus Tanaman menggunakan RT-PCR ... 8
BAHAN DAN METODE ... 11
Waktu dan Tempat Penelitian ... 11
Bahan Penelitian ... 11
Metode Penelitian ... 11
Penyiapan Bahan ... 11
Benih ... 11
Kecambah ... 11
Ekstraksi RNA Total ... 12
Metode Willey ... 12
Metode Randles ... 12
RNeasy plant mini kit (Qiagen, Germany) ... 12
Kuantifikasi Hasil Ekstraksi RNA... 13
Sintesis cDNA... 13
Polymerase chain reaction... 14
Visualisasi Hasil Amplifikasi ... 15
HASIL DAN PEMBAHASAN... 16
Hasil... 16
Kondisi Perkecambahan Benih ... 16
Kuantitas dan Kemurnian RNA Hasil Ekstraksi ... 16
Duplex RT-PCR Menggunakan Kontrol Internal ... 18
Deteksi TuMV pada Benih Caisin secara RT-PCR... 20
Pembahasan... 21
SIMPULAN DAN SARAN... 26
Simpulan... 26
Saran... 26
12
DAFTAR TABEL
Halaman
1
2
3
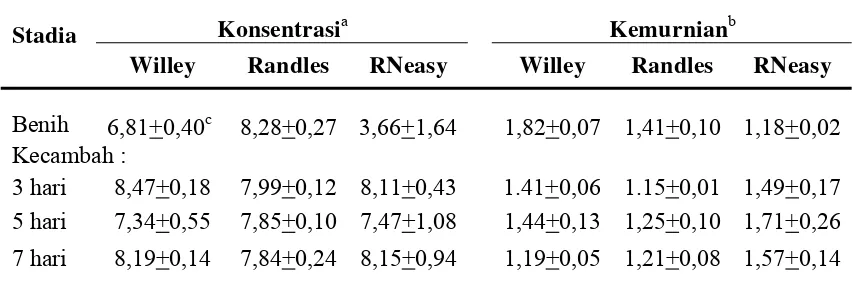
Konsentrasi (µg/ml) dan kemurnian RNA total caisin diukur menggunakan spektrofotometer... Konsentrasi (µg/ml) dan kemurnian RNA total benih millet
diukur menggunakan spektrofotometer ... Rekapitulasi hasil deteksi TuMV pada benih caisin menggunakan tiga metode ekstraksi yang berbeda...
17
18
13
DAFTAR GAMBAR
Halaman
1 2
3
4 5
6
Diagram genom TuMV... Posisi primer TuMV 8573F dan TuMV 9385R pada bagian gen NIb dan gen selubung protein (CP) ... Skema lokasi primer kontrol internal dalam gen nad5 pada mitokondria ... Pertumbuhan kecambah caisin ... Visualisasi hasil deteksi TuMV pada benih caisin menggunakan tiga metode ekstraksi RNA yang berbeda ... Hasil amplifikasi kontrol internal menggunakan primer nad5F dan nad5R pada kecambah millet berumur 3 hari dengan tiga metode ekstraksi RNA ...
4
14
15 16
19
14
DAFTAR LAMPIRAN
Halaman
1
2
Data kemurnian dan konsentrasi (µg/ml) masing-masing metode ektraksi RNA pada stadia perkembangan benih caisin yang berbeda ... Data kemurnian dan konsentrasi (µg/ml) masing-masing metode ektraksi RNA pada stadia perkembangan benih millet
yang berbeda ...
31
15
PENDAHULUAN
Latar Belakang
Turnip mosaic virus (TuMV; Potyvirus) merupakan virus terpenting kedua
yang menginfeksi pertanaman sayur-sayuran (CABI 2007). Virus ini umumnya menyerang tanaman dari famili Brassicaceae, namun dapat pula menginfeksi jenis-jenis tanaman dari famili yang lain (Noad 2004). Selain menyebabkan penurunan hasil, TuMV juga mempengaruhi kualitas produk yang dihasilkan dari tanaman yang terinfeksi (CABI 2007).
Jenis virus ini tersebar secara luas di beberapa negara (Stavolone et al. 1998), termasuk Indonesia. Rusli et al. (2007) melaporkan bahwa tanaman-tanaman sawi hijau dan lobak di Jawa Barat, Jawa Tengah, Jawa Timur, dan Bali telah terinfeksi oleh TuMV. Meskipun demikian berdasarkan Keputusan Menteri Pertanian nomor 38 tahun 2006, TuMV masih dikategorikan sebagai organisme pengganggu tumbuhan karantina (OPTK) A1 yang perlu dicegah pemasukkannya ke wilayah Indonesia melalui beberapa jenis media pembawa termasuk diantaranya adalah benih. Berdasarkan hal tersebut tersedianya metode deteksi yang dapat dipercaya mutlak diperlukan, mengingat Indonesia hingga saat ini masih melakukan impor beberapa jenis benih tanaman sayuran seperti kubis, sawi, caisin, dan brokoli dari negara-negara yang dilaporkan merupakan daerah endemik TuMV.
Metode deteksi TuMV yang dilakukan oleh lembaga Karantina Pertanian Indonesia, terutama Balai Besar Uji Standar (BBUSKP), saat ini didasarkan pada metode deteksi benih yang telah dikecambahkan menggunakan teknik Enzyme
linked immunosorbent assay (ELISA) dan reverse transcription polymerase chain
reaction (RT-PCR). Deteksi secara ELISA didasarkan pada penggunaan antibodi
16
BBUSKP tahun 2008, dari sekitar 60 sampel komoditi sayur-sayuran yang diuji menggunakan metode ELISA dan RT-PCR, terdapat 8 sampel benih sayur-sayuran yang terdeteksi TuMV menggunakan RT-PCR. Sedangkan menggunakan metode ELISA, TuMV hanya dapat terdeteksi pada 1 sampel benih caisin (data tidak dipublikasikan).
Di balik keunggulannya metode RT-PCR juga memiliki beberapa kekurangan diantaranya adalah keberadaan senyawa inhibitor pada ekstrak RNA total tanaman yang dapat mempengaruhi proses amplifikasi DNA target (Narayanasamy 2008). Oleh karena itu pemilihan metode ekstraksi RNA yang tepat sangat berpengaruh terhadap keberhasilan deteksi RNA virus pada jaringan tanaman.
Metode ekstraksi RNA yang sering digunakan oleh BBUSKP adalah mengikuti prosedur kit-kit ekstraksi RNA komersial yang digunakan untuk melakukan ekstraksi RNA total pada benih yang telah dikecambahkan. Penggunaan kit-kit ekstraksi komersial ini sangat praktis tetapi umumnya metode ini lebih banyak disarankan untuk ekstraksi RNA asal jaringan daun atau kecambah. Untuk mempersingkat waktu dan meningkatkan tingkat keberhasilan deteksi, maka perlu dilakukan upaya deteksi pada benih tanaman tanpa dikecambahkan terlebih dahulu. Reeves (1998) menyatakan bahwa material benih mengandung senyawa (inhibitor) yang dapat menghambat kerja enzim Taq Polymerase, pada level yang dapat menurunkan sensitivitas deteksi.
Beberapa bahan kimia dapat digunakan untuk mengeliminasi inhibitor, serta memulihkan RNA dalam proses PCR, salah satunya adalah fenol (Merante et al. 1996). Wyllie et al (1993) dalam Alberchtsen (2006) melakukan ekstraksi RNA untuk mendeteksi cucumber mosaic virus (CMV) pada benih lupin (Lupinus
angustifolius) menggunakan Fenol/kloroform untuk memisahkan RNA dari
inhibitor-inhibitor PCR. Hasilnya metode ini ternyata dapat digunakan untuk mendeteksi satu benih lupin yang terinfeksi CMV dari 2.000 benih lupin sehat. Bahan yang sama, digunakan oleh Hodgson et al.(1998) untuk melakukan ekstraksi
RNA Coconut tinangaja viroid (CTiVd) dari jaringan tanaman kelapa, dengan
17
Hingga saat ini Badan Karantina Pertanian belum pernah melakukan evaluasi metode preparasi RNA total dari benih Brassica untuk keperluan deteksi TuMV. Berdasarkan hal tersebut, maka perlu dilakukan evaluasi metode ekstraksi RNA dan deteksi untuk mengetahui tingkat keberhasilan yang terbaik dalam mendeteksi virus terbawa benih.
Tujuan Penelitian
18
TINJAUAN PUSTAKA
Karakteristik Turnip mosaic virus
Morfologi dan Biologi
Turnip mosaic virus termasuk ke dalam famili Potyviridae (CABI
2007).Virus ini mempunyai partikel berbentuk filamen dengan panjang 720 nm dan berdiameter 12 sampai 15 nm. Genom virus ini terdiri dari RNA utas tunggal berorientasi positif dengan panjang nukleotida 9834 nukleotida (APS 1997; Tomlinson & Walkey 1967, diacu dalam CABI 2007). Genom TuMV terdiri atas
open reading frame (ORF) tunggal sepanjang 9489 basa, sedangkan daerah yang
tidak mengkode asam amino (non coding region-NCR) sepanjang 129 nukleotida Genom TuMV mengkode polyprotein besar sebanyak 3863 asam amino yang kemudian diproses secara proteolitik menjadi delapan macam protein oleh tiga proteinase, yaitu: protein N-terminal (P1), helper component-proteinase (HC-Pro),
nuclear inclusion a protein(NIa-pro) Protein virus lain diantaranya adalah:
cytoplasmic inclusion protein (CI), genome-linked protein (VPg), protein nuclear
inclusion b (NIb), coat protein (CP) (Mahajan et al. 1996, diacu dalam Firdaus
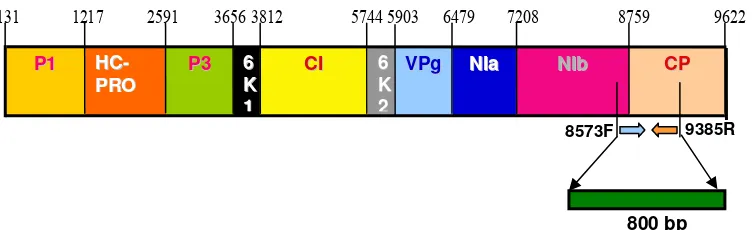
2005; Nicolas & Laliberte 1992). Revers et al. (1999) melaporkan bahwa beberapa protein seperti: P1, HC-Pro, CI, NIa, Nib, dan CP berperan dalam replikasi RNA virus. Sedangkan protein P3 virus TuMV berperan penting dalam siklus infeksi dan penentuan kisaran inang (Gambar1) (Suehiro et al. 2004).
Gambar 1. Diagram genom TuMV, menunjukkan potongan-potongan fragmen yang disintesis. 5’UTR = 5’-untranslated region; P1 = protein 1; HC-Pro = helper component proteinase; P3 = protein 3; 6K1 = peptida 1; CI = cylindrical inclusion protein; 6K2 = peptida 2; VPg = viral
genome-linked protein; NIa = nuclear inclusion a (proteinase); NIb =
nuclear inclusion b (viral replicase); CP = coat protein; 3’UTR =
3’-untranslated region.
Poly (A)…
C CPP N
NIIbb N
NIIaa V
VPPgg 6 6 K K 2 2 C CII 6 6 K K 1 1 P P33 H
HCC- -P P P11
PRROO
5’UTR
131 1217 2591 3656 3812 5744 5903 6479 7208 8759 9622
19
Virus TuMV dapat ditularkan oleh lebih dari 40 jenis kutudaun secara non-persisten, virus dapat bertahan pada kutudaun selama 4 jam setelah akuisisi, seringkali kurang dari waktu tersebut (Noad 2004, APS 1997). Wang dan Pirone (1999) melaporkan bahwa protein HC-Pro berperan sangat besar dalam penularan
Potyvirus melalui kutudaun, selain itu protein ini juga menentukan dalam spesifitas
kutudaun yang menjadi vektor untuk masing-masing jenis Potyvirus. Selain ditularkan dengan kutudaun virus ini juga dapat ditularkan melalui perbanyakan vegetatif pada tanaman-tanaman jenis Brassica yang mengandung TuMV (CABI 2007).
Hingga saat ini belum banyak laporan yang menerangkan mengenai penularan TuMV melalui benih. Namun Kartiningtyas dan Hidayat (2006) melaporkan terdeteksinya TuMV pada benih-benih caisin lokal dari daerah Jawa Barat dan Jawa Tengah dengan teknik ELISA. Berdasarkan hasil deteksi tersebut diketahui tingkat infeksi TuMV pada benih berkisar antara 2 sampai 15%. Hasil ini menunjukkan bahwa TuMV adalah virus yang terbawa benih. Jenis-jenis virus yang sebelumnya dikenal tidak ditularkan melalui benih, mungkin terbawa benih pada persentase yang rendah di dalam inangnya (Agarwal & Sinclair 1996).
Virus pada umumnya terbawa benih pada bagian embrio. Infeksi dari bagian lain pada saat perkembangan benih mungkin terjadi, karena sebagian besar virus bergerak dari sel satu ke sel lainnya melalui sitoplasma (Agarwal & Sinclair 1996; Khan & Djikstra 2002). Virus-virus yang ditransmisikan melalui embrio dapat mengalami keadaan inaktif pada bagian di luar embrio, seperti pada testa dan
endosperma. Infeksi pada kedua lokasi dalam benih tersebut dapat terjadi baik
melalui infeksi embrio maupun tidak melalui embrio. Sebagai contoh, benih kacang
polong yang terinfeksi Pea seed-borne mosaic potyvirus (PSbMV) dengan tingkat
infeksi hingga 50%, mengandung virus-virus yang inaktif pada kulit benih, tetapi
dapat terdeteksi menggunakan metode deteksi ELISA ataupun metode deteksi asam
nukleat. Sedangkan kandungan virus yang dapat ditransimisikan melalui benih
20
Kisaran Inang, Gejala dan Daerah Sebar
Turnip mosaic virus mempunyai kisaran inang yang cukup luas. Sebanyak
318 jenis tanaman dalam 156 marga dari 43 famili merupakan inang dari jenis virus ini (Edwardson & Christie 1991, diacu dalam CABI 2007). Selain itu TuMV juga menyerang beberapa jenis gulma (Keinath 2005). Berdasarkan hasil penelitian Rusli et al. (2007) diketahui kisaran inang TuMV meliputi famili Brasicaceae (sawi putih, sawi hijau, kubis, lobak, caisin, brokoli dan pak coy), famili Solanaceae
(Nicotiana tabacum, N. benthamiana, dan N. glutinosa) serta famili
Chenopodiaceae (Chenopodium amaranticolor). Virus ini dapat ditularkan secara mekanik ke banyak jenis tanaman dan menghasilkan gejala mosaik sistemik yang bervariasi (Lin & Lian 1983). Berdasarkan CABI (2007) TuMV menginfeksi semua bagian tanaman kecuali akar. Tahap perkembangan tanaman yang diserang juga bervariasi mulai dari tahap pembungaan, pembuahan, perkecambahan dan perkembangan vegetatif.
Tanaman yang terinfeksi TuMV memperlihatkan gejala yang bervariasi tergantung pada jenis dan kultivar tanaman yang diserang (Lin & Lian 1993). Gejala awal pada bibit Brassica yang diinokulasi dengan TuMV adalah bercak klorotik, dan mottling pada daun diikuti dengan gejala vein clearing sistemik, mosaik dan/atau nekrosis, distorsi daun, serta seringkali kerdil (CABI 2007). Pada bibit selada virus ini dapat menyebabkan kerdil yang parah, hingga menyebabkan kematian (APS 1997). Pada Hibiscus esculentus gejala yang tampak adalah klorosis, pemucatan tulang daun diikuti dengan nekrosis, dan lambatnya pertumbuhan (Gera et al. 2001). Pada Nicotiana glutinosa dan N. rustica gejala yang terlihat adalah cincin klorotik dan mottle pada daun (Lin & Lian 1993).
Virus ini memiliki daerah sebar yang cukup luas di beberapa negara di dunia. Di Eropa, Asia dan Australia virus ini memiliki sebaran yang hampir merata di seluruh wilayah. Di Afrika virus in hanya terbatas di Kenya, Maroko, dan Afrika Selatan. Di Amerika bagian utara virus ini tersebar luas di Amerika Serikat dan Kanada, sedangkan di bagian benua Amerika lainnya TuMV hanya endemis di Argentina serta di Trinidad dan Tobago (CABI 2007).
21
Bali, dengan intensitas serangan yang bervariasi pada ketinggian lokasi yang berbeda (Rusli et al. 2007).
Sifat Umum Caisin (Brassica rappa L cv. group caisin)
Caisin merupakan jenis tanaman sayur-sayuran yang termasuk dalam famili Brasicaceae dan merupakan grup kultivar dari jenis Brassica rapa. Dalam beberapa literatur, B. rapa seringkali disebut dengan B. campestris, namun baru-baru ini
telah dibuktikan dan ditetapkan bahwa B. rapa adalah nama yang seharusnya
digunakan (Dixon 2007; Siemonsma & Piluek 1994). Tanaman ini merupakan jenis tanaman yang umum dibudidayakan di negara-negara di Asia. Dimulai dari daerah Cina bagian tengah kemudian kultivasi caisin menyebar ke wilayah Cina lainnya hingga ke Asia Tenggara seperti Thailand, Malaysia, Vietnam, Indonesia dan negara-negara Indo-China lainnya, bahkan India Barat (Dixon 2007).
Caisin adalah tanaman herba annual dengan akar utama yang kuat dan
berbentuk tabung, serta tangkai yang bercabang dan berdiri tegak dengan
ketinggian 20 sampai 60 cm. Daun umumnya berwana hijau terang dan menjepit
tangkai, dengan bulu-bulu halus, daun bagian bawah berlekuk, biasanya dengan
cuping dan petiola pada bagian apikal. Bunga berukuran kecil dengan panjang
maksimal 1 cm, sepal menyebar. Buah memiliki panjang 4 sampai 10 cm. biji
berdiameter 1 sampai 1,5 mm, berwarna coklat tua dengan retikulum yang jelas
(CABI 2007; Siemonsma & Piluek 1994).
Menurut Siemonsma dan Piluek (1994) benih caisin (Brassica rapa L. cv.
Group caisin) dan sawi putih (Brassica rapa L. cv. Group chinese cabbage)
berkecambah setelah 3 sampai 5 hari pada temperatur 20 sampai 25oC. Secara umum B. rapa adalah tanaman dengan pertumbuhan yang cepat, dapat dipanen 6
sampai 15 minggu setelah penebaran benih, tergantung pada varietas tanaman dan
musim. Di daerah tropis tanaman ini hanya cocok untuk kultivasi pada ketinggian
di atas 800 m.dpl. (CABI 2007).
Beberapa jenis penyakit penting yang menyerang marga Brassica
diantaranya adalah busuk lunak (Erwinia carotovora), embun tepung (Peronospora
parasitica), TuMV, akar gada (Plasmodiophora brassicae), bercak alternaria
22
individu tanaman Brassica mempunyai nilai ekonomi yang tinggi. Kerusakan
akibat penyakit meskipun dengan persentase yang rendah akan mempengaruhi hasil
dan pendapatan secara ekonomi. Sedikit saja mengalami cacat pada hasil maka
akan menyebabkan produk tersebut tidak dapat diterima pasar dan menjadi tidak
lagi memiliki nilai. Oleh karena itu teknik pengendalian yang tepat perlu diterapkan
dalam melakukan pengendalian penyakit Brassica dan penggunaan benih yang
sehat sangat mutlak diperlukan (Dixon 2007; Siemonsma & Piluek 1994).
Deteksi Virus Tanaman Menggunakan RT-PCR
Deteksi virus menggunakan teknik PCR sangat populer digunakan karena prosedurnya sangat sensitif, relatif tidak mahal dan tidak memerlukan kemampuan teknis yang tinggi. PCR dapat digunakan untuk memperbanyak potongan DNA target hanya dalam waktu beberapa jam, bahkan dengan cetakan DNA dalam jumlah yang sangat kecil (Albrechtsen 2006). Untuk memperbanyak DNA target yang diinginkan, dibutuhkan sepasang primer (oligonukleotida) baik spesifik untuk
jenis maupun strain tertentu maupun umum untuk beberapa jenis patogen.
Potongan DNA target, kemudian diperbanyak pada tiga skala temperatur yang
berbeda untuk (i) mendenaturasi DNA target menjadi untai tunggal, (ii) melekatkan
primer sesuai dengan pasangannya pada cetakan DNA target, dan (iii) melakukan
ekstensi primer dengan bantuan enzim polimerase DNA (Narayanasamy 2008). Karena enzim polimerase hanya dapat bekerja pada DNA, maka untuk deteksi virus dengan materi genetik RNA digunakan teknik modifikasi PCR yang disebut reverse transcription polymerase chain reaction (RT-PCR). Pada metode ini, sebelum amplifikasi DNA, terlebih dahulu harus dilakukan sintesis cDNA melalui proses transkripsi balik (Reverse transcription) menggunakan enzim
reverse trancriptase (Webster et al 2004).
Teknik RT-PCR mempunyai sensitivitas yang lebh tinggi dalam mendeteksi virus tanaman dibandingkan dengan teknik serologi. Hasil deteksi terhadap empat jenis virus tanaman apel menunjukkan bahwa RT-PCR mendeteksi 8,6% lebih banyak sampel yang positif dibandingkan menggunakan ELISA (Calayani et al.
23
virus pada jaringan daun dengan hasil yang cukup baik pada pengenceran hingga
1/2560. Meskipun demikian proses penangkapan antigen virus oleh antibodi seperti yang dilakukan pada ELISA dapat digunakan untuk proses penyiapan cetakan RNA virus pada deteksi menggunakan RT-PCR. Modifikasi ini disebut dengan
Immunocapture RT-PCR (IC-RT-PCR). Pada metode ini partikel ditangkap oleh
antibodi yang sesuai dengan virus target pada dinding tabung PCR. Setelah itu dilakukan proses pelepasan RNA virus dari selubung protein virus, lalu dilakukan diamplifikasi menggunakan RT-PCR. (Webster et al. 2004).
Disamping kelebihan-kelebihan di atas teknik RT-PCR masih memiliki kelemahan, seperti keberadaaan inhibitor pada RNA yang telah diekstraksi dari jaringan tanaman. Menurut Arnal et al. (1999) dua parameter harus diperhatikan ketika memilih metode ekstraksi yaitu tertangkapnya materi virus dan eliminasi atau inaktivasi senyawa inhibitor. Secara lebih spesifik senyawa inhibitor PCR diantaranya adalah bahan-bahan fenolik, protein maupun polisakarida. Tipe, lokasi dan konsentrasi dari inhibitor-inhibitor ini dapat bervariasi tergantung pada umur tanaman dan kultivar. Sebagai contoh polisakarida dapat meningkat pada daun muda dari beberapa kultivar kacang-kacangan (Dietzgen 2002).
Beberapa senyawa organik dapat digunakan untuk memisahkan RNA dari protein, dan dengan mengeksploitasi perbedaan dalam hidrofobisitas antara RNA dan protein, keduanya dapat dipisahkan dengan membuat dua fase yang berbeda. Reagen yang umum digunakan untuk tujuan ini adalah fenol. Setelah pemisahan menjadi dua fase, RNA akan tetap berada di fase atas, sementara lapisan protein akan berada dalam fase fenol atau pada bagian interfase (Macfarlane & Dahle 1998). Fenol merupakan senyawa yang telah lama dikenal sebagai pemisah protein dan perusak integritas sel secara cepat. Fenol yang digunakan bersama dengan kloroform akan dapat secara simultan menghilangkan protein dan lipid dari larutan yang mengandung asam nukleat (Merante et al. 1996). Fenol memang merupakan bahan yang banyak digunakan dalam proses ekstraksi RNA, tetapi reagen ini sangat berbahaya dan dapat memberikan luka serius pada kulit . Oleh karena itu penggunaannya dilakukan sangat hati-hati ((Macfarlane & Dahle 1998).
24
berbeda. Selain itu penambahan EDTA juga dilakukan untuk menghambat pembentukkan kumpulan protein serta mengikat Mg2+ sehingga dapat menghambat kerja enzim nuklease yang membutuhkan Mg (Merante et al. 1996).
Sejalan dengan perkembangan teknologi, saat ini juga telah banyak bermunculan kit-kit ekstraksi komersial yang menggunakan teknologi yang lebih maju seperti membran silika, dan glass bead. Metode-metode tersebut menawarkan kemudahan dan hasil dengan kemurnian yang lebih baik, namun kegunaannya pada umumnya terbatas hanya pada jaringan-jaringan tertentu saja (Albrechtsen 2006). Li et al. (2008) melaporkan bahwa ekstraksi RNA menggunakan RNeasy plant mini kit dengan teknik membran silika ternyata tidak dapat digunakan untuk melakuan ekstraksi RNA dari jaringan tanaman tertentu.
Hasil positif pada suatu deteksi dan keberadaan total RNA melalui visualisasi pada gel agarosa umumnya digunakan sebagai indikator untuk melihat keberhasilan suatu proses ekstraksi RNA. Meskipun demikian terdapat cara lain yang dapat digunakan unuk mendeteksi keberhasilan suatu ekstraksi RNA dari jaringan tanaman, yaitu dengan menggunakan kontrol internal. Menurut Gambino dan Gribaudo (2006) kontrol internal RNA sangat penting untuk mendeteksi adanya kesalahan hasil negatif karena degradasi RNA selama proses ekstraksi atau keberadaan inhibitor pada proses transkripsi balik dan PCR. Pada penelitiannya untuk mendeteksi dua jenis virus pada tanaman anggrek, Lee dan Chang (2006) menggunakan multiplex RT-PCR dengan primer nad5f dan nad5r dari mRNA tanaman sebagai kontrol internal. Hasilnya menunjukkan bahwa kontrol internal tersebut dapat digunakan untuk menghindari terjadinya kesalahan negatif akibat kegagalan ekstraksi RNA total dari jaringan tanaman.
25
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Oktober 2008 sampai Januari 2009 di Laboratorium Biomolekuler, Balai Besar Uji Standar Karantina Pertanian.
Bahan Penelitian
Bahan yang digunakan untuk penelitian ini adalah benih caisin (Brassica
rappa L cv. group caisin) yang diambil dari tanaman terinfeksi TuMV di lapang.
Selain itu untuk melihat keberhasilan ketiga metode ekstraksi untuk mengekstraksi RNA total dari benih dengan jenis tanaman yang berbeda. maka digunakan benih
millet (Panicum miliaceum), dengan prosedur ekstraksi RNA total yang sama
dengan ekstraksi pada benih caisin.
Metode Penelitian
Pada penelitian ini dilakukan ekstraksi RNA total dari benih caisin. Sampel benih uji dibedakan berdasarkan tahap perkembangannya yaitu benih dan kecambah dengan tiga macam umur perkecambahan yang berbeda, yaitu: 3, 5, dan 7 hari. Hal ini dilakukan karena virus yang berada di dalam benih umumnya memiliki kadar yang lebih rendah dibandingkan dengan setelah dikecambahkan (Albrechtsen 2006). Oleh karena itu perlakuan ini digunakan untuk melihat tingkat keberhasilan deteksi pada tahap perkembangan benih yang berbeda, dengan jumlah sampel yang sama.
Penyiapan Bahan
Benih. Sampel yang berupa benih sebanyak 1200 butir langsung digerus menggunakan nitrogen cair di dalam satu mortar. Selanjutnya sampel dipisahkan menjadi tiga bagian masing-masing terdiri atas enam ulangan. Sampel yang digunakan adalah 0,1 g untuk setiap ulangan.
26
dilakukan ekstraksi sebanyak enam kali ulangan. menggunakan tiga macam metode ekstraksi yang berbeda.
Ekstraksi RNA total
Metode Wyllie. Metode ekstraksi dilakukan seperti diuraikan dalam
Albrechtsen (2006). Sampel jaringan tanaman sebanyak 0,1 g digerus dan ditambahkan 500 µl bufer ekstrak (TRIS-HCl 50 mM, pH 8.5, EDTA 10 mM, NaCl 200 mM) dan 500 µl fenol/kloroform/isoamilalkohol(PCI). Setelah dicampur
hingga homogen larutan disentrifugasi selama 1 menit dengan kecepatan 13.000
xg. Supernatan dipisahkan, kemudian ditambahkan kloroform/isoamilalkohol
(50:1) sebanyak 1 volume supernatan, dan dilanjutkan dengan sentrifugasi 13.000
xg selama 1 menit. Supernatan yang diperoleh ditambahkan 1 volume isoproponal,
lalu diinkubasi pada suhu -20oC selama satu malam. Keesokan harinya dilakukan sentrifugasi 13.000 xg selama 3 menit, hingga terbentuk pelet. Pelet diresuspensi
dengan penambahan 100 µl bufer TE (Tris-HCl 10 mM, pH 7.4, EDTA 1 mM), 4
µl 5M NaCl, dan 250 µl etanol 96% kemudian diinkubasi di es selama 20 menit.
Setelah sentrifugasi selama 3 menit pada kecepatan 13.000 xg pelet
dikeringanginkan, kemudian dilarutkan dalam 50 µl air bebas RNase.
Metode Randles. Metode ekstraksi dilakukan seperti diuraikan dalam Hodgson et al. (1998). Sebanyak 0,1 g sampel jaringan tanaman digerus dan ditambahkan 800 µl bufer NETM (2 M NaCl, 100 mM sodium acetate, 10 mM EDTA, 50 mM Tris-HCl [pH7.5], 0.25% [vol/vol] 2 mercaptoethanol), 40 μl 20%
(w/v) sodium dodecyl sulfate (SDS), selanjutnya diinkubasi pada 25oC selama 30
menit. Setelah itu ditambahkan 750 μl PCI (25:24:1), dan disentrifugasi 10,000 ×g selama 15 menit. Supernatan ditambah dengan 1 volume isopropanol. Setelah disentrifugasi 11.000 xg selama 15 menit, pelet dicuci dengan etanol 70%, lalu dikeringanginkan. Setelah itu pelet dilarutkan dalam 50µl air bebas RNase.
27
rpm selama 2 menit. Setelah sentrifugasi, cairan akan melewati kolom dan terkumpul pada tabung koleksi dibawahnya. Cairan dipindahkan ke tabung 1,5 ml baru dan ke dalamnya ditambahkan etanol 96% sebanyak 0,5 volume cairan, lalu dicampur hingga merata dan dipindahkan ke dalam RNeasy spin column, untuk dilakukan sentrifugasi 10.000 rpm selama 15 detik. Setelah selesai cairan yang melalui kolom dibuang dan 700µl Buffer RW1 dimasukkan lagi ke dalam RNeasy
spin column, dan disentrifugasi lagi pada 10.000 rpm selama 15 detik, cairan yang
melalui kolom lalu dibuang kembali.
Pada RNeasy spin column yang sama, ditambahkan 500 µl Bufer RPE dan disentrifugasi 10.000 rpm selama 15 detik, kemudian cairan yang melewati kolom dibuang. Untuk mengeringkan membran maka ditambahkan lagi 500µl bufer RPE dan disentrifugasi 10.000 rpm selama 2 menit, setelah itu tabung penampung cairan dibuang beserta isinya dan digantikan dengan tabung 1,5 ml yang baru dan ditambahkan 50µl air bebas RNase melalui RNeasy spin column yang sama untuk melarutkan RNA. Cairan yang terkumpul pada tabung 1,5 ml yang baru adalah RNA total yang akan digunakan untuk proses selanjutnya.
Kuantifikasi Hasil Ekstraksi RNA
Setelah proses ekstraksi, RNA diukur kemurnian dan konsentrasinya menggunakan spektrofotometer (Perkin Elmer, USA) pada panjang gelombang 260 nm dan 280 nm. Pengukuran konsentrasi RNA dilakukan pada panjang gelombang 260 nm dengan perhitungan 1 nilai absorbansi sama dengan 40 µg/ml. Kemurnian RNA diukur pada rasio A260/A280, karena protein diserap pada panjang gelombang 280 nm (Rapley & Heptinstall 1998)
Sintesis cDNA
28
kemudian diinkubasi dalam Thermal cycler (Thermo Hybaid, Germany) dengan program 25oC selama 5 menit, 37o C selama 90 menit, dan 70oC selama 15 menit.
Polymerase Chain Reaction
Setelah sintesis cDNA kemudian dilakukan amplifikasi DNA menggunakan
Go Taq green master mix (Promega, USA) dalam total volume 25 µl. Primer yang
[image:38.595.119.496.290.405.2]digunakan adalah TuMV 8573F (5’-AGC TCC CTA GCA CAA GAA GG-3’) dan TuMV 9385R (5’-TCG AGC TAA GCA CAT GTC GG-3’) yang mengamplifikasi potongan gen NIb dan selubung protein dengan ukuran 800 bp (Gambar 2) (Nicolas & Laliberta 1992).
Gambar 2. Posisi primer TuMV 8573F dan TuMV 9385R pada bagian gen NIb dan gen selubung protein (CP) yang menghasilkan fragmen DNA sebesar 800 bp.
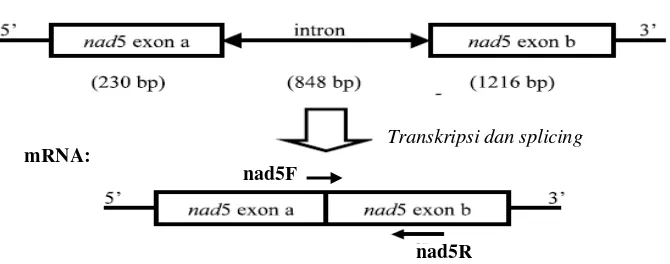
Sebagai kontrol internal digunakan primer nad5F (5’- GAT GCT TCT TGG GGC TTC TTG TT -3’) dan nad5R (5’- CTC CAG TCA CCA ACA TTG G -3’) yang mendeteksi mRNA dari bagian mitokondria tanaman dan menghasilkan produk PCR berukuran 181 bp (Gambar 3) (Menzel et al. 2002). Amplifikasi cDNA kemudian dilakukan dalam thermal cycler (Thermo Hybaid, Germany) dengan siklus 1 kali 95oC selama 5 menit, dilanjutkan dengan 30 siklus 95oC selama 30 detik, 50oC selama 90 detik, 72oC selama 60 detik, dan terakhir adalah ekstensi 72oC selama 10 menit.
Poly (A)…
C CPP N
NIIbb N
NIIaa V
VPPgg 6 6 K K 2 2 C CII 6 6 K K 1 1 P P33 H
HCC- -P P P11
PRROO
8573F
800 bpbp 9385R
29
nad5R nad5F
mRNA: Transkripsi dan splicing
[image:39.595.131.466.98.230.2]DNA mitokondria :
Gambar 3. Skema lokasi primer kontrol internal (tanda panah) dalam gen nad5 pada mitokondria (Menzel et al. 2002).
Visualisasi Hasil Amplifikasi
30
HASIL DAN PEMBAHASAN
Hasil Kondisi Perkecambahan Benih
Pengamatan terhadap kondisi perkecambahan benih menunjukkan bahwa benih berkecambah dengan cepat dan bervariasi pada setiap umur kecambah.
Menurut Siemonsma dan Piluek (1994) benih caisin (Brassica rapa L. cv. Group
caisin) dan sawi putih (B. rapa L. cv. Group chinese cabbage) berkecambah
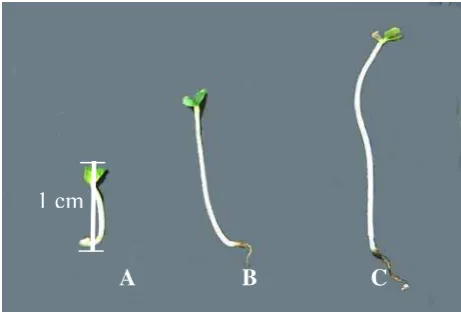
setelah 3 sampai 5 hari pada temperatur 20 sampai 25oC. Namun pada hasil pengamatan kecambah telah mulai terlihat memasuki hari kedua. Kecambah umur 3 hari rata-rata memiliki panjang 1 cm; kecambah umur 5 hari rata-rata memiliki panjang 1 sampai 2 cm; kecambah umur 7 hari rata-rata memiliki panjang 2 sampai 3 cm (Gambar 4).
1 cm
[image:40.595.199.430.367.523.2]A B C
Gambar 4. Pertumbuhan kecambah caisin pada umur A) 3 hari, B) 5 hari, C) 7 hari
Kuantitas dan Kemurnian RNA Hasil Ekstraksi
31
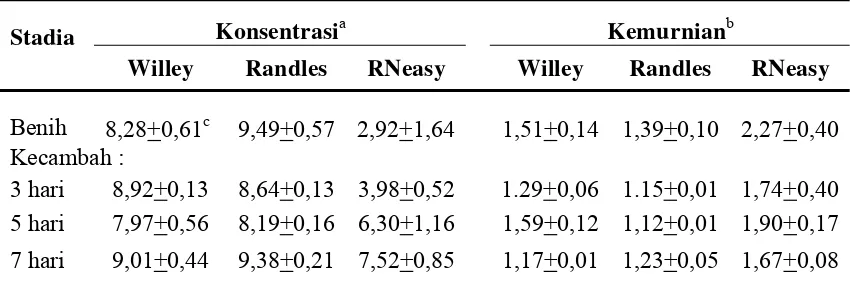
9,01 µg/ml; sedangkan ekstraksi RNA menggunakan kit RNeasy menghasilkan konsentrasi RNA yang terendah yaitu 2,92 µg/ml pada benih.
[image:41.595.114.539.423.564.2]Hasil pengukuran kemurnian RNA hasil ekstraksi, juga memberikan nilai yang sangat bervariasi (Tabel 1). Menurut Rapley dan Heptinstall (1998) pengukuran kemurnian RNA pada rasio A260/A280 seharusnya memberikan nilai 2.0 untuk menunjukkan bahwa sampel yang diekstrak telah murni dari keberadaan protein. Metode ekstraksi RNeasy untuk kecambah berumur 5 hari memberikan nilai kemurnian yang paling mendekati 2.0. Hal ini menunjukkan protein yang tercampur dengan RNA berada dalam jumlah yang sangat kecil. Nilai yang paling rendah terlihat pada hasil ekstraksi metode Randles dengan kisaran antara 1,12 sampai 1,39. Hasil ekstraksi menggunakan metode Willey memiliki kisaran nilai masih dibawah 1,90, nsmun lebih tinggi dibandingkan dengan nilai kemurnian metode Randles. Hal tersebut menunjukkan metode Willey masih memiliki kemurnian yang lebih baik dibandingkan dengan metode Randles.
Tabel 1. Konsentrasi (µg/ml) dan kemurnian RNA total caisin diukur menggunakan spektrofotometer
Konsentrasia Kemurnianb Stadia
Willey Randles RNeasy Willey Randles RNeasy
Benih 8,28+0,61c 9,49+0,57 2,92+1,64 1,51+0,14 1,39+0,10 2,27+0,40 Kecambah :
3 hari 8,92+0,13 8,64+0,13 3,98+0,52 1.29+0,06 1.15+0,01 1,74+0,40 5 hari 7,97+0,56 8,19+0,16 6,30+1,16 1,59+0,12 1,12+0,01 1,90+0,17 7 hari 9,01+0,44 9,38+0,21 7,52+0,85 1,17+0,01 1,23+0,05 1,67+0,08 a
Konsentrasi diukur pada panjang gelombang 260nm, kemudian nilai absorbansi dikali dengan 40 µg/ml.
b
Kemurnian diukur dengan menghitung rasio absorbansi pada panjang gelombang 260nm dan 280 nm.
c
Standar deviasi
32
Untuk melihat keberhasilan ekstraksi RNA total dengan ketiga metode ekstraksi pada benih dari jenis tanaman yang berbeda, maka dilakukan ekstraksi RNA menggunakan benih millet, kemudian dilakukan pengukuran konsentrasi dan kemurnian RNA menggunakan spektrofotometer. Hasil pengukuran konsentrasi dan kemurnian memperlihatkan bahwa ekstraksi RNA pada benih dan kecambah
millet dengan tiga metode ekstraksi yang sama pada ekstraksi RNA menggunakan
[image:42.595.113.540.372.517.2]benih caisin, memberikan hasil dengan kecenderungan konsentrasi dan nilai kemurnian RNA yang tidak jauh berbeda dengan ekstraksi RNA pada benih caisin. Secara umum hasil ini menunjukkan bahwa nilai kemurnian Randles masih tetap rendah seperti pada hasil ekstraksi RNA yang dilakukan pada benih caisin, bila dibandingkan kedua metode lainnya, sedangkan RNeasy tetap memberikan nilai kemurnian RNA yang cukup baik pada kecambah (Tabel 2).
Tabel 2. Konsentrasi (µg/ml) dan kemurnian RNA total benih millet diukur menggunakan spektrofotometer
Konsentrasia Kemurnianb Stadia
Willey Randles RNeasy Willey Randles RNeasy
Benih 6,81+0,40c 8,28+0,27 3,66+1,64 1,82+0,07 1,41+0,10 1,18+0,02 Kecambah :
3 hari 8,47+0,18 7,99+0,12 8,11+0,43 1.41+0,06 1.15+0,01 1,49+0,17 5 hari 7,34+0,55 7,85+0,10 7,47+1,08 1,44+0,13 1,25+0,10 1,71+0,26 7 hari 8,19+0,14 7,84+0,24 8,15+0,94 1,19+0,05 1,21+0,08 1,57+0,14 a
Konsentrasi diukur pada gelombang 260nm, kemudian absorbansi dikali dengan 40 µg/ml.
b
Kemurnian diukur dengan menghitung rasio absorbansi pada panjang gelombang 260nm dan 280 nm.
c
Standar deviasi
Duplex RT-PCR menggunakan kontrol internal
33
proses RT-PCR yang sama. Apabila hal ini terjadi, maka diasumsikan metode ekstraksi yang dievaluasi berjalan dengan baik
M
M 1 2 3 4 5 6 M H 1 2 3 4 5 6
185 bp
a
B
800 bp
800 bp
M 1 2 3 4 5 6
A
b
1 2 3 4 5 6 M
200 bp
c
M 1 2 3 4 5 6 1 2 3 4 5 6 M
800 bp
b
a c
M 1 2 3 4 5 6 M 1 2 3 4 5 6 M 1 2 3 4 5 6
C
800 bp
185 bp
185 bp
[image:43.595.97.541.130.481.2]a b c
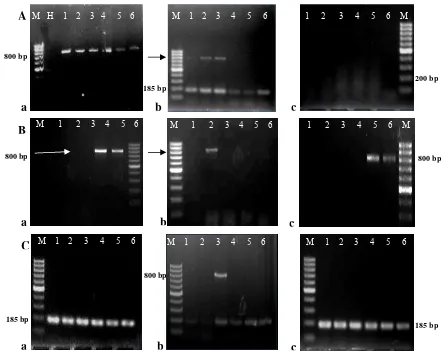
Gambar 5. Visualisasi hasil deteksi TuMV pada benih caisin menggunakan tiga metode ekstraksi RNA yang berbeda, yaitu: a) Metode Willey, b) Metode Randles, c) Metode RNeasy. Deteksi dilakukan pada A) Benih, B) Kecambah 3 hari, C) Kecambah 5 hari. M = Marker 100 bp, H= kontrol negatif (Amplifikasi PCR dilakukan secara duplex RT-PCR menggunakan primer nad5f dan nad5r sebagai kontrol internal pada gambar A.b, A.c, C.a, C.b, dan C.c)
Hasil amplifikasi menggunakan kontrol internal dapat digunakan sebagai indikasi keberhasilan ekstraksi RNA menggunakan masing-masing metode ekstraksi pada tahap perkembangan benih yang berbeda. Hal tersebut menunjukkan bahwa metode ekstraksi yang digunakan untuk kecambah telah berhasil mengekstrak RNA total dari jaringan tanaman (Gambar 5.A dan 5.C).
34
menggunakan metode Willey dan Randles. Sebaliknya target DNA untuk kontrol internal tidak berhasil teramplifikasi untuk sampel benih yang diekstraksi menggunakan kit RNeasy (Gambar 5.A).
Amplifikasi DNA kontrol internal juga dilakukan pada benih dan kecambah
millet. Hasil amplifikasi menunjukkan bahwa ketiga metode ekstraksi RNA dapat
berjalan dengan baik pada kecambah millet (Gambar 6). Ekstraksi RNA total pada benih millet ternyata tdak berhasil mengekstraksi RNA total menggunakan kit Rneasy. Hal yang serupa juga didapatkan pada ekstraksi RNA total yang dilakukan pada benih caisin. Dua metode lainnya (Willey dan Randles) dapat digunakan untuk melakukan ekstraksi RNA total pada benih millet.
1 2 3 4 5 M B C
[image:44.595.117.528.292.396.2]A M 1 2 3 4 5 1 2 3 4 5 M
Gambar 6. Hasil amplifikasi kontrol internal menggunakan primer nad5F dan nad5R pada kecambah millet berumur 3 hari dengan tiga metode ekstraksi RNA, yaitu: A) metode Willey, B) metode Randles, dan C) metode Rneasy, M= Marker 100 bp.
Deteksi TuMV pada Benih Caisin Menggunakan RT-PCR
35
Tabel 3. Rekapitulasi hasil deteksi TuMV pada benih caisin menggunakan tiga metode ekstraksi yang berbeda
Stadia perkecambahan benih Metode ekstraksi
Benih 3 hari 5 hari 7 hari
Willey +
(6/6)a + (2/6) - (0/6) - (0/6)
Randles +
(3/6) + (1/6) + (1/6) - (0/6)
RNeasy -
* b
+ (2/6) - (0/6) - (0/6) a
jumlah ulangan yang positif dari jumlah seluruh ulangan
b
RNA total tidak berhasil diekstrak dari jaringan tanaman
Pembahasan
Meningkatnya frekuensi benih impor yang masuk ke wilayah Indonesia, turut memperbesar ancaman masuknya virus-virus terbawa benih ke dalam wilayah Indonesia. Secara umum diketahui rata-rata tingkat penularan virus melalui benih hanya dibawah 1%, tetapi penularan sekunder secara alami melalui serangga vektor dapat menyebabkan kerusakan besar pada pertanaman (Lee et al. 2004). Oleh karena itu masuknya virus terbawa benih melalui benih impor ke dalam wilayah Indonesia dapat menyebabkan kerugian yang besar secara ekonomi dan pasar pertanian yang tidak stabil. Di sisi lain terhambatnya kelancaran masuknya benih impor ke dalam wilayah Indonesia, dapat menghambat laju aktivitas ekonomi di dalam negeri, sehingga memberikan tantangan besar bagi karantina pertanian untuk melakukan deteksi OPTK secara cepat namun harus disertai dengan akurasi, tingkat keberhasilan dan sensitivitas yang tinggi
36
seperti pengujian untuk benih impor maupun pengujian kesehatan benih (Lee et al. 2004; Khan & Djikstra 2002). Meskipun demikian hasil amplifikasi DNA menggunakan PCR ditentukan oleh penyediaan materi asam nukleat dengan kualitas yang baik. Hal tersebut terjadi karena beberapa material benih mengandung bahan kimia yang dapat menghambat kerja enzim Taq Polymerase, pada level yang dapat menurunkan sensitivitas deteksi Reeves (1998).
Deteksi TuMV pada benih memperlihatkan bahwa deteksi menggunakan metode Willey sebagai metode ekstraksi RNA total memberikan tingkat keberhasilan 100%, sementara ekstraksi RNA menggunakan materi yang sama, metode Randles hanya memberikan keberhasilan 50%, sedangkan kit RNeasy tidak berhasil mendeteksi TuMV. Keunggulan metode Willey ditentukan oleh kualitas RNA yang dihasilkan. Selain dapat menghasilkan RNA dengan konsentrasi yang cukup tinggi, RNA yang dihasilkan oleh metode Willey juga memiliki kemurnian yang cukup baik. Sebaliknya pada kedua metode yang lain konsentrasi dan kemurnian yang dihasilkan tidak seimbang sehingga menyebabkan kegagalan atau menurunkan tingkat keberhasilan deteksi TuMV pada benih caisin. Menurut Li et al. (2008) konsentrasi RNA hasil ekstraksi yang tinggi dan jumlah inhibitor PCR yang rendah menentukan keberhasilan deteksi suatu jenis patogen tanaman.
37
menggunakan PCI tanpa dilakukan langkah penambahan CI, sehingga hasil ekstraksi memberikan nilai kemurnian yang sangat rendah (Tabel 1).
Kualitas RNA yang dihasilkan dari suatu proses ekstraksi juga ditentukan oleh jenis tanaman maupun bagian tanaman yang diekstraksi (Kiefer et al. 2007). Jenis tanaman yang berbeda, memiliki kandungan senyawa yang berbeda, sehingga RNA yang diekstrak dari jenis tanaman yang berbeda akan memberikan hasil yang berbeda (Li et al. 2008). Demikian pula dengan ekstraksi RNA pada bagian-bagian tanaman tertentu, seperti benih. Benih caisin memiliki kandungan minyak yang cukup tinggi, yaitu berkisar antara 35 sampai 40 %, sehingga pemilihan metode ekstraksi RNA menentukan keberhasilan maupun kualtias RNA yang dihasilkan.
Deteksi TuMV dari benih caisin menggunakan metode ekstraksi RNeasy, memperlihatkan hasil negatif, sebaliknya dua metode ektraksi lainnya memeperlihatkan hasil positif. Hal tersebut diduga disebabkan oleh konsentrasi RNA yang dihasilkan oleh RNeasy terlalu rendah sehingga proses amplifikasi DNA tidak berjalan dengan baik. Hal tersebut dapat terlihat dari hasil duplex PCR menggunakan kontrol internal (Gambar 5. A.c) yang tidak berhasil mendeteksi mRNA tanaman pada RNA total yang diekstrak menggunakan RNeasy. Rendahnya konsentrasi RNA total disebabkan oleh rendahnya kemampuan pencampuran antara bufer ekstrak RNeasy (bufer RLC mengandung guanidine isothiocyanate) dan sampel benih yang telah dihaluskan, sehingga proses ekstraksi sel tanaman tidak berjalan tidak berjalan dengan baik.
RNeasy plant mini kit adalah kit komersial yang menggunakan membran
silika untuk mengikat RNA total dalam jaringan tanaman, dan kemudian mencuci inhibitor-inhibitor melalui membran tersebut, sehingga nilai kemurnian yang diberikan oleh RNeasy pada umumnya cukup tinggi hingga mendekati 2.0 (standar kemurnian RNA). Meskipun demikian hasil penelitian Li et al. (2008) yang melakukan deteksi berbagai jenis patogen pada beberapa jenis jaringan tanaman yang berbeda menunjukkan bahwa, metode RNeasy tidak dapat digunakan untuk mendeteksi beberapa jenis patogen pada jaringan tanaman tertentu, diantaranya adalah: Blackcurrant reversion virus pada Ribbes nigrum, dan Ralstonia
38
Hasil deteksi TuMV pada benih yang telah berkecambah memperlihatkan ketidakseragaman hasil untuk setiap umur perkecambahan dengan metode ekstraksi yang berbeda. Hal ini diduga disebabkan oleh beberapa faktor, diantaranya adalah penggunaan kelompok sampel yang berbeda pada setiap umur perkecambahan, sehingga terjadinya hasil negatif pada umur perkecambahan tertentu dapat disebabkan karena RNA total diekstrak dari individu yang tidak mengandung TuMV. Pada suatu pengujian untuk mendeteksi patogen terbawa benih heterogenitas dari benih dalam suatu lot menjadi suatu masalah tersendiri. Heterogenitas benih terutama berhubungan dengan ketidakseragaman infeksi pada benih. Heterogenitas benih dapat saja terlihat secara fisik dari diskolorasi warna benih, ukuran benih yang berubah. Meskipun demikian beberapa patogen terbawa benih tidak memperlihatkan gejala atau perubahan fisik pada benih (Morisson 1999).
Selain itu, pada umur perkecambahan yang semakin tinggi peluang terambilnya individu yang mengandung TUMV juga semakin kecil, karena bertambahnya volume dan ukuran setiap individu sampel. Pada benih yang dikecambahkan, sebanyak 200 batang kecambah untuk setiap ulangan dipotong dan diletakan dalam satu wadah kemudian dicampur agar sampel yang diekstrak menjadi homogen. Kecambah-kecambah yang tercampur tersebut kemudian ditimbang 0,1 g untuk setiap metode ekstraksi. Kelemahan dari cara ini adalah proses pencampuran tidak dapat dilakukan secara merata, karena masih berupa potongan-potongan besar (4 sampai 6 mm), sehingga pada saat dilakukan penimbangan masih terjadi kemungkinan tidak terbawanya potongan jaringan tanaman yang mengandung TuMV.
Faktor lain yang menyebabkan perbedaan hasil pada masing-masing umur perkecambahan adalah perbedaan jumlah senyawa-senyawa inhibitor yang ada di dalam setiap kecambah pada umur yang berbeda. Dietzgen (2002) melaporkan bahwa tipe, lokasi dan konsentrasi inhibitor di dalam tanaman dapat bervariasi tergantung pada umur tanaman dan kultivar, sebagai contoh polisakarida dapat meningkat pada daun muda dari beberapa kultivar kacang-kacangan
39
relatif lebih tinggi dibandingkan kedua metode lainnya Tingkat keberhasilan yang lebih tinggi dapat dipengaruhi oleh keberadaan senyawa inhibitor yang lebih rendah pada metode Willey bila dibandingkan dengan metode ekstraksi Randles. Sensitivitas metode Willey telah diujikan sebelumnya dan dapat digunakan untuk mendeteksi 1 benih yang terinfeksi CMV dari 2000 butir benih lupin sehat (Albrechtsen 2006).
Hasil ekstraksi RNA menggunakan benih millet memperlihatkan bahwa metode Willey juga memiliki potensi yang cukup baik untuk digunakan pada benih dari jenis tanaman yang berbeda. Hal tersebut dapat terlihat pada rata-rata konsentrasi RNA yang cukup tinggi dan nilai kemurnian yang mendekati 2.0, terutama pada hasil ekstraksi RNA pada benih. Faktor-faktor tersebut dapat mendukung keberhasilan deteksi virus tanaman menggunakan RT-PCR. Dengan kualitas RNA yang tidak terlalu jauh berbeda, RNA yang dihasilkan oleh metode Willey dapat digunakan untuk mendeteksi TuMV pada benih caisin dengan tingkat keberhasilan yang cukup baik. Benih-benih rumput dan millet (Famili Poaceae) umumnya diimpor ke dalam wilayah Indonesia dalam jumlah besar sebagai tanaman penutup. Importasi benih dari jenis tanaman ini juga mengandung resiko masuknya sejumlah jenis virus dan patogen lainnya yang dapat menyerang jenis-jenis tanaman dari famili yang sama dengan nilai ekonomi yang lebih tinggi seperti jagung dan padi.
40
Kekurangan dari metode ini adalah waktu pengerjaan yang cukup panjang, karena harus melewati beberapa tahapan inkubasi, tetapi untuk mengatasi hal ini dapat dilakukan penyesuaian dengan mengujicobakan waktu presipitasi pada -20oC yang lebih singkat, seperti 15 maupun 30 menit. Berdasarkan pengujian menggunakan metode Randles, tahap akhir yang memerlukan penambahan etanol 96%, bufer TE, dan NaCl dapat dimodifikasi menggunakan etanol 70% tanpa dilakukan inkubasi di dalam es selama 20 menit.
Deteksi pada benih memberikan hasil yang lebih menjanjikan dibandingkan deteksi yang dilakukan pada kecambah, karena pada ekstraksi menggunakan benih yang belum dikecambahkan dapat dilakukan pencampuran dengan jumlah individu sampel yang lebih banyak. Selain itu waktu yang dibutuhkan untuk perkecambahan akan memperpanjang waktu deteksi.
41
SIMPULAN DAN SARAN
Simpulan
1. Metode Willey mempunyai tingkat keberhasilan yang lebih baik untuk mendeteksi TuMV pada benih caisin dibandingkan dengan metode Randles dan RNeasy plant minikit .
2. Deteksi TuMV terbawa benih dengan preparasi total RNA menggunakan metode Willey dari benih yang tidak dikecambahkan dapat meningkatkan peluang keberhasilan deteksi dibandingkan dengan preparasi total RNA dari benih yang telah dikecambahkan.
3. Deteksi TuMV dengan primer TuMV 8573F dan TuMV 9385R dapat dilakukan secara duplex RT-PCR bersama Primer nad5F/nad5R untuk mendeteksi kegagalan ekstraksi RNA total.
Saran
1. Metode ekstraksi RNA mengikuti metode Willey dan duplex RT-PCR
menggunakan primer nad5F dan nad5R sebagai kontrol internal dapat
diterapkan sebagai prosedur RT-PCR untuk deteksi TuMV pada benih-benih
Brassica lainnya untuk pengujian rutin karantina tumbuhan.
2. Optimasi metode Willey, perlu dilakukan untuk mempersingkat waktu ekstraksi RNA total. Selain itu untuk mendapatkan hasil amplifikasi DNA yang terbaik juga perlu dilakukan optimasi komposisi komponen PCR dalam duplex RT-PCR antara primer spesifik TuMV dan primer kontrol internal untuk mendapatkan intensitas DNA target lebih tinggi dibandingkan dengan intensitas DNA kontrol internal
3. Perlu dilakukan evaluasi metode ekstraksi RNA Willey untuk deteksi jenis-jenis patogen yang lain pada benih tanaman untuk meningkatkan efisiensi dan kemampuan deteksi karantina menggunakan metode PCR.
42
DAFTAR PUSTAKA
Agarwal VK, Sinclair JB. 1996. Principle of Seed Pathology. Florida: CRC Press Inc.
Albrechtsen SE. 2006. Testing Methods for Seed-transmitted Viruses: Principles andPprotocols. Wallingford: CABI Publishing
APS. 1997. Compendium of Lettuce Diseases. Minnesota: APS Press
Arnal C, Ferre-Aubineau V, Besse B, Mignote B, Schwartzbrod L, Biliaudel S. 1999. Comparison of seven RNA extraction methods on stool and shelfish samples prior to Hepatitis A virus amplification. J. virol. Meth. 77: 17-26 CABI. 2007. Crop Protection Compendium. Wallingford: CAB International. Calayani K, Sercei CU, Gazel M, Jelkman W. 2006 Detection of Four Apple
Viruses by ELISA and RT-PCR Assays in Turkey. Turk J Agric For 30: 241-246
Dietzgen RG. 2002. Application of PCR in plant virology. Di dalam: Khan JA, Djikstra J, editor. Plant Viruses as Molecular Pathogens. Oxford: Food products press. hlm. 471-500
Dixon GR. 2007. Vegetable Brassicas and Related crucifers. Reading: CAB International
Firdaus. 2005. Deteksi dan karakterisasi Turnip mosaic virus penyebab penyakit mosaik pada tanaman caisin (Brassica campestris L. Subsp. chinensis
(Rupr.) Olsson). [tesis] Bogor: Sekolah Pasca Sarjana. Fakultas Peranian. Institut Pertanian Bogor
Gambino G, Gribaudo I. 2006. Simultaneous detection of nine grapevine viruses by multiplex reverse transcription-polymerase chain reaction with coamplification of a plant RNA as internal control. Phytopathology
96:1223-1229.
Gera A, Lampel M, Cohen J, Rosner A. 2001. Okra (Hibiscus esculentus)—A new host of Turnip mosaic virus in Israel. Plant Dis. 85(3): 336
Henson M J, French R. 1993. The polymerase chain reaction and plant disease
diagnosis. Annu. Rev. Phytopathol. 31: 81-109.
www.annualreviews.org/aronline [26 januari 2008]
Hodgson RAJ, Wall GC, Randles JW. 1998. Specific identification of Coconut
tinangaja viroid for differential field diagnosis of viroids in coconut palm.
43
Keinath P A. 2005. Reservoir Weed Hosts for Turnip mosaic virus in Iran. Plant Dis 89(3): 33Noad B. 2004. Virus diseases in canola and mustard. New South Wales: NSW Department of primary industries.
www.agric.nsw.gov.au
Khan AJ, Djikstra J. 2002. Seed transmission of viruses: Biological and molecular insights. Di dalam: Khan JA, Djikstra J, editor. Plant Viruses as
Molecular Pathogens. Oxford: Food products press. hlm. 105 - 126
Kiefer E, Heller W, Ernst D. 2000. A simple and eficient protocol for isolation of functional RNA from plant tisuues rich in secondary metabolites. Plant
Mol. Bio. Rep. 18: 33–39
Lee SC, Chang YC. 2006. Multiplex RT-PCR detection of two orchid viruses with an internal control of plant nad5 mRNA. Plant Pathology Bulletin 15: 187-196.
Lee YB, Lim HR, Choi JY, Ryu KH. 2004. Development of molecular detection of three species of seed-transmissible viruses useful for plant quarantine.
Plant Pathol. J. 20(4) : 302-307
Li R, Mock R, huang Q, Abad J, Hartung J, Kinard G. 2008. A reliable and inexpensive method of nucleic acid extraction for the PCR based detection of diverse plant pathogen. J. Virol. Meth. 1