I. PENDAHULUAN
A. LATAR BELAKANG
Indonesia adalah salah satu negara yang menggunakan berbagai macam produk pekatan kedelai sebagai bahan baku pengemulsi daging tiruan, nugget, sosis, kornet, dan bahan pangan lainnya. Namun, umumnya bahan baku pekatan kedelai yang digunakan tersebut masih diimpor karena belum ada industri dalam negeri yang memproduksi pekatan kedelai tersebut dalam skala yang cukup besar. Hal ini disebabkan oleh kontinuitas bahan baku kedelai dari dalam negeri yang tidak memadai. Kebutuhan kedelai pada tahun 2004 saja sudah mencapai 2,02 juta ton, sedangkan produksi dalam negeri baru 0,71 juta ton dan kekurangannya terpaksa diimpor. Hanya sekitar 35% dari total kebutuhan yang dapat dipenuhi dari produksi dalam negeri (Departemen Pertanian, 2005)a.
Harga kedelai yang melambung di Indonesia belakangan ini pun menimbulkan kekhawatiran berbagai pihak. Salah satu penyebab meningkatnya harga berbagai produk kedelai ini adalah produktivitas kedelai yang rendah di Indonesia dan tidak sebanding dengan konsumsinya. Hingga saat ini Indonesia masih mengandalkan impor kedelai dari negara lain untuk memenuhi konsumsi kedelai dalam negeri. Berdasarkan data dari Departemen Pertanian (2005)b, rata-rata impor kedelai tahun 2002-2004 saja sudah mencapai satu juta ton.
Indonesia dikenal sebagai negara yang kaya akan potensi alamnya. Sebagai negara tropis dengan curah hujan yang merata hampir sepanjang tahun, terdapat keanekaragaman hayati Indonesia yang memiliki potensi. Salah satunya adalah tanaman kecipir (Psophocarpus tetragonolobus (L.) DC) yang merupakan tanaman asli dari Papua New Guinea dan hanya tumbuh di daerah ekuator yang bercurah hujan tinggi (Anonim, 2008)a.
kedelai karena kemudahannya tumbuh di berbagai jenis lahan. Produksi biji kecipir dapat mencapai 2380 kg/hektar, sedangkan produksi kacang tanah dan kedelai masing-masing hanya 1000 kg/hektar dan 900 kg/hektar (Rismunandar, 1986).
Hampir semua bagian dari tanaman kecipir dapat dimanfaatkan dan dikonsumsi. Daun dan buah mudanya dapat dijadikan sayuran, sedangkan akarnya menggelembung membentuk umbi yang dapat dimakan. Bijinya yang sudah tua dapat diolah menjadi tempe. Biji dari kecipir merupakan salah satu sumber protein kacang-kacangan yang sedang ramai diteliti saat ini karena kandungan proteinnya yang tinggi yaitu sekitar 29.8%-39.0%, hampir sama dengan kandungan protein kedelai sekitar 30-40% (National Academy of Science, 1981 dan Winarno, 1974). Menurut Ekpenyong (1978), biji kecipir memiliki komposisi asam amino yang hampir sama dengan kedelai, dengan metionin dan sistein sebagai asam amino pembatasnya. Salah satu kelebihan lain yang dimiliki oleh biji kecipir adalah aktivitas lipoksigenasenya yang lebih rendah daripada kedelai yang berarti bahwa akan menghasilkan bau langu yang lebih sedikit daripada kedelai selama penanganan, penyimpanan dan pemrosesan (Van Den et al.,1981; de Lumen et al., 1981).
Sebagai negara berkembang yang diikuti oleh perkembangan industri pangannya, Indonesia perlu mengembangkan sumber protein alternatif sebagai pengganti sumber protein hewani dan sumber protein nabati dari kedelai. Selama ini, kedelai adalah salah satu pengganti sumber protein hewani yang unggul dan banyak digunakan di Indonesia. Namun, seperti telah dikatakan sebelumnya, produktivitas kedelai di Indonesia sangat rendah sehingga tak dapat memenuhi kebutuhan dalam negeri.
merupakan salah satu produk pekatan protein yang banyak dimanfaatkan pada produk bakery, olahan daging dan dairy product (FAO, 2009). Selain itu, konsentrat protein memiliki sifat fungsional spesifik yang tidak dapat diperoleh dari tepung kedelai serta memiliki harga yang lebih terjangkau dibandingkan dengan protein isolat (FAO, 2009). Oleh karena itu, perlu dilakukan penelitian mengenai berbagai sifat fisikokimia dan sifat fungsional dari konsentrat protein biji kecipir.
B. PERUMUSAN MASALAH
Penelitian mengenai sifat fisikokimia dan sifat fungsional dari konsentrat biji kecipir (Psophocarpus tetragonolobus (L.) DC) ini dilakukan agar diketahui pengolahan yang tepat dalam pemanfaatan konsentrat biji kecipir. Konsentrat protein biji kecipir berpotensi digunakan sebagai sumber protein alternatif, dengan adanya penelitian ini dapat juga diketahui aplikasi konsentrat protein biji kecipir pada berbagai jenis produk pangan.
C. TUJUAN PENELITIAN
1. Mengetahui sifat fisikokimia konsentrat protein biji kecipir (Psophocarpus tetragonolobus (L.) DC).
II. TINJAUAN PUSTAKA
A. KECIPIR (Psophocarpus tetragonolobus (L.) DC)
Tanaman kecipir sudah lama dikenal di Indonesia dengan berbagai nama yang berbeda. Nama lain dari kecipir adalah jaat (bahasa Sunda), kelongkang (bahasa Bali), serta biraro (Ternate) (Anonim, 2008)b. Kecipir (Psophocarpus tetragonolobus (L.) DC) termasuk dalam genus Psophocarpus, famili Fabaceae, ordo Leguminosa dan subklas Dicotyledonae (Kay, 1979).
Tanaman kecipir adalah tanaman setahun, berbentuk perdu, berakar tunggang yang dapat membentuk umbi akar. Kecipir biasanya tumbuh membelit, berdaun majemuk, berdaun banyak. Setiap tangkai daun memiliki tiga anak daun yang berbentuk bulat, ujung daunnya runcing dan permukaannya licin. Buah kecipir berbentuk empat sayap membujur, di antara biji-bijinya bersekat, tiap polong mengandung 5-10 biji dan panjang polongnya sekitar 6-36 cm (National Academy of Science, 1981). Berikut ini gambar biji kecipir dalam polongnya.
Gambar 1. Biji Kecipir dalam Polong (Lyra, 2008)
berpasir, tanah lempung, tanah berat, tanah gambut, bahkan tanah yang tidak subur (Soedarsono, 1979). Produktivitas tanaman kecipir ini cukup tinggi, dari satu hektar tanah dapat dihasilkan dua hingga lima ton biji kecipir yang sudah matang (Khan, 1976), dan 35 ton polong muda (Jiminez, 1976).
Hampir semua bagian tanaman kecipir dapat dimakan baik daun, bunga, polong muda, umbi dan bijinya. Biji kecipir mengandung zat-zat gizi seperti protein, lemak, karbohidrat, vitamin dan mineral yang lebih tinggi bila dibandingkan dengan polong muda, umbi dan daunnya. Komposisi kimia dari beberapa bagian tanaman kecipir dapat dilihat pada Tabel 1.
Tabel 1. Komposisi Kimia Polong, Biji, Umbi, Daun dan Bunga Kecipir Komponen Polong Biji Matang Umbi Daun
Air (%) 76.0-93.0 8.7-24.6 54.9-65.2 64.2-85.0 Protein (%) 1.9-4.3 29.8-39.0 3.0-15.0 5.0-7.6 Lemak (%) 0.1-3.4 15.0-20.4 0.4-1.1 0.5-2.5 Karbohidrat (%) 1.1-7.9 23.9-42.0 27.2-30.5 3.0-8.5 Serat (%) 0.9-3.1 3.7-16.1 1.6-17.0 3.0-4.2 Abu (%) 0.4-1.9 3.3-4.9 0.9-1.7 1.0-2.9 Sumber : (National Academy of Science, 1981)
Biji kecipir memiliki kadar protein yang tinggi sekitar 29.8-39.0 % sehingga dapat dijadikan alternatif sumber protein nabati selain kedelai (National Academy of Science, 1981). Berikut ini tabel perbandingan nilai gizi biji kecipir dengan kacang-kacangan lain (Tabel 2).
Tabel 2. Perbandingan Nilai Gizi Biji Kecipir, Kedelai, dan Kacang Tanah per 100 gram
Zat Gizi Biji Kecipir
Biji Kedelai
Kacang Tanah Protein (g) 36.60 35.10 23.40 Karbohidrat (g) 35.60 32.00 21.60
Lemak (g) 15.30 17.70 45.30
Serat (g) 3.70 4.20 2.10
Abu (g) 3.80 5.00 2.40
Air (g) 8.70 10.20 7.30
B. KONSENTRAT PROTEIN
Konsentrat protein adalah produk pekatan protein yang memiliki kandungan protein minimal 70%, sedangkan isolat protein memiliki kadar protein minimal 90% (Waggle dan Kolar, 1979). Pemekatan kadar protein bahan pangan dapat dilakukan dengan cara mengolahnya menjadi tepung, tepung rendah lemak, konsentrat, dan isolat protein (Waggle dan Kolar, 1979). Konsentrat protein umumnya memiliki kandungan protein sekitar 65-75%, 15-25% polisakarida tak larut, 4-6% mineral, dan 0.3-1.2% minyak (Cheftel et al., 1985).
Kandungan gula pada konsentrat protein telah dikurangi, sehingga produk yang menggunakan konsentrat protein lebih mudah dicerna dan lebih sedikit menyebabkan flatulensi. Konsentrat protein dapat dengan mudah dibentuk teksturnya, namun membutuhkan jumlah air dan energi mekanik yang lebih besar daripada produk tepung rendah lemak (Riaz, 2004).
Pembuatan konsentrat protein dilakukan dengan ekstraksi mineral dan karbohidrat yang larut air. Mineral dan karbohidrat larut air dapat diekstrak dengan larutan asam, campuran air-etanol, atau air panas. FAO (2009) mengklasifikasikan tiga cara yang umumnya digunakan dalam proses produksi konsentrat protein, yaitu proses pencucian dengan alkohol, proses pencucian dengan asam, proses denaturasi protein dengan panas. Proses pembuatan konsentrat protein dengan pencucian alkohol didasarkan pada kemampuan alkohol rantai pendek (metanol, etanol, atau isopropil alkohol) untuk mengekstrak fraksi gula larut air tanpa melarutkan protein. Umumnya konsentrasi alkohol optimum yang digunakan adalah 60%. Setelah proses ekstraksi gula, alkohol dievaporasi dari protein dengan menggunakan prinsip destilasi dan protein dikeringkan (FAO, 2009).
Proses yang ketiga adalah denaturasi protein menggunakan uap panas, yang dilanjutkan dengan ekstraksi komponen gula menggunakan air panas. Protein yang telah terdenaturasi dipisahkan dan dikeringkan (FAO, 2009). Denaturasi protein adalah modifikasi konformasi atau struktur sekunder, tersier, atau kuarterner protein yang tidak disertai dengan pemutusan ikatan peptida yang terdapat pada struktur primernya. Denaturasi protein ini dapat mengurangi kelarutan protein karena bagian hidrofobiknya tidak terlindungi dan juga dapat mengubah kapasitas pengikatan air (Cheftel et al., 1985). Denaturasi protein dapat disebabkan oleh proses panas (Pablo et al.,1981).
Denaturasi protein juga dapat disebabkan oleh ekstraksi menggunakan pelarut. Denaturasi protein karena pelarut organik dipengaruhi oleh derajat hidrofobisitas dan derajat pengencerannya dengan air. Pelarut organik yang bersifat hidrofobik yang tidak bercampur dengan air, seperti n-heksana, memiliki kemungkinan yang kecil untuk dapat mendenaturasi protein meskipun pada suhu yang tinggi (Fukushima, 1969).
C. SIFAT FISIKOKIMIA DAN SIFAT FUNGSIONAL KONSENTRAT PROTEIN
1. Warna dan Derajat Putih
Warna merupakan salah satu aspek penting dalam penerimaan produk pangan. Jika warna produk tidak terlihat menarik, maka konsumen akan menolak produk tersebut dan tidak akan memperhatikan faktor lainnya (Francis, 2003).
output dapat berupa CIE-XYZ, Judd-Hunter L a b CIELAB, dan CIELCH (Francis, 2003; Francis, 1996).
Sistem warna Hunter Lab memiliki tiga atribut yaitu L, a, dan b. Nilai L menunjukkan tingkat kecerahan sampel dan memiliki skala dari 0 sampai 100, dimana 0 menyatakan sampel sangat gelap dan 100 menyatakan sampel sangat cerah. Nilai a menunjukkan derajat merah atau hijau sampel, dimana a positif menunjukkan warna merah dan a negatif menunjukkan warna hijau. Nilai a memiliki skala dari -80 sampai 100. Nilai b positif menunjukkan warna kuning dan b negatif menunjukkan warna biru. Nilai b memiliki skala dari -70 sampai 70 (Francis, 1996). Sistem atribut nilai Hunter Lab dapat dilihat pada Gambar 2.
Gambar 2. Sistem Warna Hunter Lab (MacEvoy, 2005)
Pengukuran warna dapat dilakukan dengan alat kromameter Minolta CR-200. Prinsip dari kromameter Minolta adalah pengukuran perbedaan warna melalui pantulan cahaya oleh permukaan sampel (Hutching, 1999). Kromameter adalah suatu alat untuk analisis warna secara terstimulus untuk mengukur warna yang dipantulkan oleh suatu permukaan. Data pengukuran berupa nilai L, a, dan b diperoleh dapat berupa nilai absolut maupun nilai selisih dengan warna standar (Anonim,1997)c. Dari pengukuran warna menggunakan kromameter Minolta tersebut dapat dihitung nilai derajat putih. Derajat putih dapat dihitung dengan menggunakan rumus berikut
2. Particle Size Index (PSI)
Particle Size Index (PSI) adalah suatu ukuran yang diperlukan untuk mengetahui ukuran partikel suatu bahan. Ukuran ini umumnya digunakan untuk bahan tepung-tepungan.
PSI dibutuhkan untuk menentukan kualitas penggilingan dan juga merupakan parameter kerusakan pati, penyerapan air, dan produksi gas. Indeks ini menunjukkan kekerasan relatif suatu bahan dengan cara penggilingan dan separasi (Anonim, 2008)d.
3. Densitas Kamba (ρA)
Densitas merupakan salah satu sifat fisik bahan pangan. Densitas produk berbentuk bubuk (food powder) dipengaruhi oleh komposisinya (Wirakartakusumah et al., 1992). Densitas kamba adalah massa partikel yang menempati suatu unit volum tertentu. Densitas kamba ditentukan oleh berat wadah yang diketahui volumnya dan merupakan hasil pembagian dari berat bubuk dengan volum wadah.
Nilai densitas kamba menunjukkan porositas suatu bahan. Bahan yang lebih ringkas memiliki porositas yang lebih rendah. Jumlah rongga antar partikel menentukan banyaknya ruang kosong yang terbentuk dan juga menentukan nilai densitas kamba suatu bahan (Khalil, 1999). Nilai densitas dari berbagai makanan berbentuk bubuk umumnya antara 0.3-0.8 g/cm3. Hal ini menunjukkan bahwa makanan berbentuk bubuk memiliki porositas yang tinggi, yaitu sekitar 40-80% (Wirakartakusumah et al., 1992).
Densitas kamba dari jenis pangan ini dipengaruhi oleh beberapa faktor yang saling berhubungan, yaitu intensitas gaya tarik-menarik antar partikel, ukuran partikel, dan jumlah dari titik yang berhubungan. Perubahan densitas kamba dapat menyebabkan perubahan sifat-sifat bubuk (Wirakartakusumah et al., 1992).
4. Asam Amino
gugus amino dan satu rantai samping (-R). Bentuk molekul asam amino dapat dilihat pada Gambar 3.
Gambar 3. Bentuk Molekul Asam Amino (Winarno, 1997).
Terdapat 20 jenis asam amino yang berbeda ukuran, bentuk, muatan, dan reaktivitasnya. Berbagai jenis asam amino dapat dilihat pada Tabel 3.
Tabel 3. Jenis Asam Amino
Asam Amino Singkatan Tiga
Huruf
Lambang Satu Huruf
Alanin (Alanine) Ala A
Arginin (Arginine) Arg R
Asparagin (Asparagine) Asn N
Asam Aspartat (Aspartic
Acid) Asp D
Sistein (Cysteine) Cys C
Glutamin (Glutamine) Gln Q
Asam Glutamat (Glutamic
Acid) Glu E
Glisin (Glysine) Gly G
Histidin (Histidine) His H
Isoleusin (Isoleucine) Ile I
Leusine (Leucine) Leu L
Lisin (Lysine) Lys K
Metionin (Methionine) Met M
Fenilalanin (Phenilalanine) Phe F
Prolin (Proline) Pro P
Serin (Serine) Ser S
Treonin (Threonine) Thr T
Triptofan (Tryptophane) Trp W
Tirosin (Tyrosine) Tyr Y
Valin (Valine) Val V
Keduapuluh asam amino dapat dibagi menjadi empat kelas berdasarkan polaritas rantai sampingnya (Damodaran, 1996):
(1)Asam amino dengan rantai samping nonpolar (hidrofobik)
Kelompok ini terdiri dari asam amino alanin, isoleusin, leusin, metionin, fenilalanin, prolin, triptofan, serta valin yang bersifat tidak larut dalam air. Sifat hidrofobik akan meningkat dengan bertambah panjangnya rantai samping alifatik.
(2)Asam amino dengan rantai samping polar (hidrofilik)
Asam amino yang termasuk dalam kelompok ini adalah asam amino yang mempunyai gugus fungsional netral, polar, serta dapat membentuk ikatan dengan molekul air. Serin, treonin, tirosin, asparagin, glutamin dan sistein termasuk golongan hidrofilik karena memiliki gugus reaktif seperti gugus hidroksil, gugus amida dan gugus tiol.
(3)Asam amino dengan rantai samping yang bermuatan positif
Lisin dengan gugus epsilon NH2, arginin dengan gugus guanidin dan
histidin dengan gugus imidasol digolongkan ke dalam kelompok ini. (4)Asam amino dengan rantai samping yang bermuatan negatif
Hanya terdapat dua asam amino yang memiliki rantai samping yang bermuatan negatif, yaitu asam glutamat dan asam aspartat.
5. Protein Solubility
Protein solubility merupakan sifat fungsional pertama yang biasanya diuji pada pengembangan protein sebagai ingredien yang baru. Kelarutan protein ini berhubungan dengan sifat fungsional protein yang lainnya, terutama pada sifat buih, gel dan emulsi. Protein dengan kelarutan protein yang tinggi memiliki dispersabilitas molekul protein yang baik dan dapat membentuk sistem dispersi koloid yang baik pula.
Tingkat kelarutan protein dalam suatu medium cair merupakan hasil interaksi elektrostatik dan hidrofobik antara molekul protein tersebut. Kelarutan dapat meningkat jika gaya elektrostatik lebih tinggi daripada interaksi hidrofobik. Umumnya kurva kelarutan protein terhadap pH membentuk huruf U, di mana titik terendah berada pada pH isoelektrik. Pada pH isoelektrik (pI) ini, muatan dari protein sama dengan nol. Hal ini menyebabkan interaksi antar protein menjadi maksimum dan menyebabkan ketidaklarutan protein (Zayas, 1997).
Faktor lainnya seperti kondisi pemrosesan, tipe pelarut dan suhu berkaitan dengan struktur protein yang terbentuk. Jika semua faktor tersebut menyebabkan terjadinya denaturasi protein, maka kelarutan dari protein akan menurun.
6. Daya Serap Air (WHC)
Daya serap air (water holding capacity) adalah jumlah air yang terperangkap dalam matriks protein pada kondisi tertentu. Daya serap air berhubungan dengan jumlah gugus asam amino polar yang terdapat dalam molekul protein. Gugus asam amino polar, seperti hidroksil, amino, karboksil, dan sulfihidril memberikan sifat hidrofilik bagi molekul protein sehingga dapat menyerap atau mengikat air (Suwarno,2003).
Kemampuan protein menyerap air berperan dalam pembentukan tekstur produk pangan. Semakin banyak air yang diserap, maka semakin baik tekstur dan mouthfeel bahan pangan tersebut. Pengikatan air bergantung pada komposisi dan konformasi antara molekul-molekul protein. Interaksi antara air dan gugus hidrofilik dari rantai samping protein dapat terjadi melalui ikatan hidrogen. Jumlah air yang dapat ditahan oleh protein bergantung pada komposisi asam amino, hidrofobisitas permukaan, dan proses pengolahan. Jumlah air yang diikat akan meningkat jika kepolaran protein meningkat (Suwarno, 2003).
Campbell, 1981). Daya serap air oleh protein juga dipengaruhi oleh konsentrasi protein dan adanya komponen lain, seperti polisakarida hidrofilik, lemak, garam, lamanya pemanasan dan kondisi penyimpanan. Semakin tinggi konsentrasi protein dalam suatu bahan pangan, maka daya serap airnya pun semakin baik (Zayas, 1997).
Garam dapat berkompetisi dengan protein dalam mengikat air. Konsentrasi garam tinggi dapat menyebabkan dehidrasi protein karena adanya kompetisi antara garam dan protein sehingga terjadi penekanan lapisan elektrik di sekeliling molekul protein dan terjadi perubahan konformasi protein, penurunan hidrasi protein, dan pengendapan (Suwarno, 2003).
Suhu tinggi dapat mengurangi daya serap air oleh protein. Adanya pemanasan, pemekatan, pengeringan, atau pembentukan tekstur ini dapat mengakibatkan denaturasi protein dan transisi konformasi sehingga terjadi pembukaan rantai polipeptida dan jumlah asam amino polar pada protein berkurang (Zayas, 1997). Namun, pemanasan, agregasi, dan denaturasi tersebut dapat juga menyebabkan perubahan konformasi tertentu sehingga daya serap air meningkat (Hutton dan Campbell, 1981).
7. Daya Serap Minyak
Daya serap minyak adalah kemampuan protein untuk menyerap dan menahan lemak. Daya serap minyak suatu protein dipengaruhi oleh sumber protein, ukuran partikel protein, kondisi proses pengolahan, zat aditif lain, suhu, dan derajat denaturasi protein. Ukuran dan tekstur protein yang lebih halus, lebih seragam, dan lebih porous memudahkan penyerapan dan pengikatan minyak. Denaturasi protein dapat meningkatkan daya serap minyak karena terbukanya struktur protein sehingga asam amino non polarnya terpapar. Namun, denaturasi yang berlebihan dapat menurunkan kemampuan protein mengikat lemak karena rusaknya rantai hidrofobik protein (Suwarno, 2003).
hidrofobik penting untuk stabilitas kompleks lipid-protein. Interaksi antara protein dengan anion asam lemak dapat mengubah struktur protein dengan cara menurunkan ikatan hidrofobik intramolekul.
Daya serap minyak suatu protein tergantung pada strukturnya. Struktur yang bersifat lipolitik dengan kandungan cabang protein nonpolar yang lebih dominan, berkontribusi terhadap peningkatan daya serap minyak (Lin et al., 1974). Daya serap minyak bermanfaat dalam aplikasi protein pada produk daging sintetis dan berperan penting dalam memperbaiki karakteristik citarasa (Suwarno, 2003).
8. Aktivitas dan Stabilitas Emulsi
Emulsi adalah dispersi atau suspensi suatu cairan dalam cairan lain, di mana molekul kedua cairan ini tidak saling berbaur, tetapi saling antagonis. Tiga bagian utama dalam suatu sistem emulsi adalah bagian pendispersi juga dikenal sebagai continuous phase yang biasanya berupa air, bagian terdispersi yang biasanya terdiri dari butiran-butiran lemak, serta bagian emulsifier yang berfungsi menjaga agar butir-butir lemak tetap tersuspensi dalam air (Winarno, 1997).
Daya kerja emulsifier dipengaruhi oleh bentuk molekul yang dapat terikat, baik pada air (polar) dan pada minyak (non polar). Emulsi minyak dalam air (O/W) terjadi bila emulsifier lebih terikat pada air (polar), sedangkan
emulsi air dalam minyak (W/O) terjadi bila emulsifier lebih terikat pada minyak
(non polar) (Winarno, 1997).
Sifat emulsifikasi protein dipengaruhi oleh laju adsorbsi antarmuka minyak-air, jumlah protein teradsorbsi, serta kemampuan untuk membentuk sebuah film yang kental, kohesif, dan kontinyu melalui interaksi kovalen dan non kovalen (Widowati et al., 1998). Selain itu, sifat emulsi suatu protein juga dipengaruhi oleh desain peralatan yang digunakan, suhu minyak, dan suhu larutan protein (Zayas, 1997).
terdistribusi merata dan mampu membentuk film yang kohesif dan kuat (Zayas, 1997).
Daya dan stabilitas emulsi suatu protein disebabkan oleh aktivitasnya yang menyerupai surfaktan, yaitu kemampuan untuk mengurangi tegangan permukaan antara komponen hidrofobik dan hidrofilik (Macritche, 1978). Selain itu, protein juga memiliki kemampuan untuk membentuk lapisan permukaan penyerap yang menyelubungi droplet minyak sehingga dapat menahan minyak dan membentuk emulsi minyak dalam air yang stabil.
Perbandingan jumlah asam amino hidrofilik-lipofilik yang seimbang sangat menentukan kemampuan protein dalam membentuk emulsi karena dapat menurunkan tegangan interfasial. Protein hidrofilik-lipolitik dapat teradsobsi pada interfasial minyak-air dengan mekanisme lipofilik dengan berikatan pada sisi minyak atau dengan mekanisme hidrofilik yaitu dengan berikatan dengan fase air (Zayas, 1997).
Protein teradsorbsi dapat menurunkan tegangan permukaaan atau interfasial sehingga dapat memfasilitasi pembentukan emulsi. Protein globular dengan hidrofobisitas permukaan tinggi, seperti lisozim, ovalbumin, dan protein whey, akan mengalami peningkatan daya emulsi dengan pemanasan sedang dan strukturnya sedikit terbuka (Zayas, 1997). Beberapa faktor yang mempengaruhi stabilitas emulsi antara lain: (1) tegangan permukaan antara dua fase, (2) karakteristik lapisan penyerap antara dua fase, (3) muatan pada globular, (4) perbandingan antara ukuran dan permukaan globular dengan volumenya, (5) perbandingan antara berat dengan volume fase terdispersi dan pendispersi, dan (6) viskositas fase pendispersi (Morr, 1981).
Indikator kapasitas emulsi adalah kelarutan dan hidrofobisitas. Kapasitas emulsi berhubungan dengan kelarutan protein (Volkert dan Klein , 1979). Semakin tinggi kelarutan suatu protein, maka kemampuannya untuk membentuk lapisan yang menyelubungi droplet minyak juga semakin tinggi sehingga aktivitas emulsinya meningkat.
9. Gelasi
tolak-menolak seimbang sehingga terbentuk matriks yang dapat menarik air dalam jumlah besar (Schmidt, 1981). Daya gelling adalah kemampuan protein dalam membentuk suatu jaringan kohesif yang kaku dan dapat mengikat air. Daya gelling dipengaruhi oleh interaksi antara protein-protein dan juga interaksi antara protein dan air (Cheftel et al., 1985).
Gelasi adalah salah satu sifat protein yang berkaitan dengan penarikan air dari lingkungan oleh molekul-molekul protein. Sifat ini berperan dalam pembentukan dan pengendapan matriks protein. Gel protein merupakan hasil dari interaksi intermolekuler yang menghasilkan jaringan tiga dimensi serat-serat protein. Gel dibentuk saat protein membuka sebagian, mengembangkan segmen polipeptida terurai yang berinteraksi pada titik-titik spesifik untuk membentuk jaringan ikatan silang tiga dimensi. Cairan dapat mencegah pembentukan jaringan tiga dimensi dengan collapsing (melipat). Sifat-sifat tekstural gel ditentukan oleh interaksi protein-protein, protein-pelarut, dan fleksibilitas rantai-rantai polipeptida. Interaksi protein-protein yang sangat kuat akan mengakibatkan jaringan tiga dimensi melipat dan air akan keluar dari struktur (Suwarno, 2003).
Mekanisme pembentukan gel karena pemanasan terjadi dalam dua tahap, yaitu tahap asosiasi dan agregasi yang mengakibatkan terbentuknya formasi gel pada kondisi yang sesuai. Suhu gelasi bergantung pada karakter dan konsentrasi protein. Waktu dan suhu pemanasan umumnya berkurang dengan meningkatnya konsentrasi protein. Peningkatan suhu ini juga dapat menyebabkan kekeruhan gel (Schmidt, 1981).
protein, namun dengan rendahnya konsentarsi protein gel terbentuk dalam waktu pemanasan yang lebih lama (Schmidt, 1981).
Penurunan pH dari pH tinggi ke pH netral juga dapat menyebabkan terjadinya perubahan aktivitas molekul protein sehingga kemampuan membentuk gel dan kemampuan aktivasi ikatan sulfihidril yang penting dalam agregasi pun berubah. Ukuran agregat yang terbentuk akan semakin kecil dengan naiknya pH dari 5 menjadi 10 karena adanya gaya tolak-menolak antara molekul protein meningkat (Suwarno, 2003).
10.Kapasitas dan Stabilitas Buih
Buih adalah struktur terdispersi di mana cairan koloid seperti larutan protein bertindak sebagai medium pendispersi dan gas sebagai fase terdispersi. Mekanisme pembentukan buih diawali dengan terbukanya ikatan intramolekuler protein sehingga rantai protein memanjang, kemudian udara masuk di antara molekul protein yang terbuka dan bertahan sehingga protein mengembang (Cherry dan Watters, 1981). Buih adalah campuran kompleks yang terdiri dari gas, cairan, padatan, dan surfaktan. Kapasitas busa suatu protein sangat kritis dalam aplikasi pangan, protein dari sumber yang berbeda memiliki kemampuan yang berbeda pula dalam menstabilkan busa karena perbedaan komposisi, konformasi, fleksibilitas molekuler, dan sifat-sifat fisikokimianya (Elizade et al., 1991).
Daya buih protein menunjukkan kemampuan produksi suatu area permukaan dari buih per unit berat protein dan kemampuan protein untuk menstabilkan lapisan permukaan tersebut. Foaming agent harus memiliki sifat-sifat menstabilkan buih secara cepat dan efektif pada konsentrasi rendah, efektif pada berbagai kisaran pH pangan, dan efektif dalam media dengan foam inhibitor, seperti alkohol, lemak, dan bahan-bahan flavor. Foam inhibitor adalah bahan tidak larut air yang dapat mengganggu lapisan protein pada gelembung-gelembung udara (Suwarno, 2003). Lemak dapat melemahkan interaksi antara protein-protein dengan mengganggu permukaan hidrofobik (Zayas, 1997).
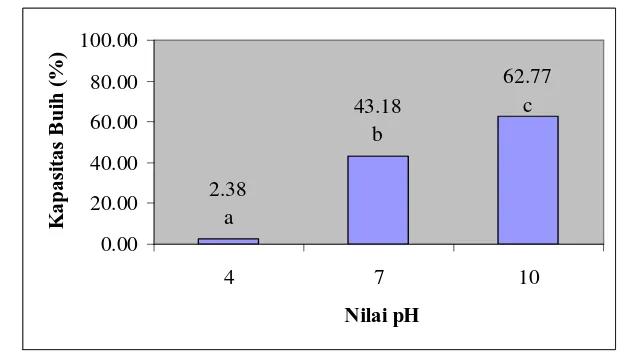
Daya buih dipengaruhi oleh sumber protein alami, metode dan proses, termasuk di dalamnya adalah proses pembuatan konsentrat protein, pH, konsentrasi protein, suhu dan waktu pembuihan, serta metode pembuihan. Daya buih meningkat seiring dengan meningkatnya konsentrasi protein karena terjadi peningkatan ketebalan lapisan pada interfasial, stabilitas buih maksimal diperoleh saat elastisitas permukaan juga maksimal (Suwarno,2003).
Kapasitas dan stabilitas buih suatu protein dipengaruhi oleh kelarutan protein, laju difusinya ke arah permukaan, dan penyerapannya. Faktor-faktor tersebut bergantung pada sifat-sifat hidrofobik, orientasi, asosiasi polipeptida, viskoelastisitas, kesetimbangan agregasi-konjugasi, muatan permukaan, dan hidrasi. Selain itu, kapasitas dan stabilitas buih juga dipengaruhi oleh pH, suhu, garam, gula, lemak, dan sumber protein. Kapasitas dan stabilitas buih bertambah dengan meningkatnya konsentrasi protein. Buih yang terbentuk pada konsentrasi tinggi bersifat padat dan stabil karena lapisan yang terbentuk tebal (Kinsella dan Damodaran, 1981).
III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT
Bahan utama yang digunakan dalam penelitian ini adalah biji kecipir yang diperoleh dari Balai Penelitian Tanaman Sayuran Bandung. Bahan kimia yang diperlukan untuk ekstraksi protein dan analisis ialah heksana, HCl 1 N, NaOH 1 N, air destilata, minyak kedelai, K2SO4, HgO, H2SO4 pekat, NaOH-Na2S2O3
pekat, H3BO3, HCl 0.02 N, batu didih, indikator metil merah serta metil biru, HCl
6 N, kertas saring, kapas, HCl 0.01 N, NaOH 0.01 N, larutan pengering (metanol, picolotiocianat, trietilamin), larutan derivatisasi (metanol, natrium asetat, trietilamin), asetonitril 60%, buffer natrium asetat 1M, natrium karbonat, NaOH 0.1N, Na K tartarat 1%, dan CuSO4.
Alat yang digunakan dalam pembuatan sampel konsentrat protein biji kecipir adalah antara lain abrasive peeler, oven pengering, pin disc mill, mini spray dryer BUCHI B190, sentrifus, loyang, panci, wadah perendam, dan saringan 60 mesh. Alat yang dibutuhkan untuk analisis adalah Chromameter CR-200 Minolta, tanur, alat ekstraksi Soxhlet, alat destilasi, labu Kjeldahl 100 ml, neraca analitik, HPLC dengan kolom pico tag 3.9 x 150 mm, water bath, refrigerator, waring blender, spektrofotometer Spectronic 20D+, pHmeter Orion model 210A, cawan aluminium, desikator, cawan porselen, sudip, pipet tetes, pipet Mohr, alat destilasi, labu lemak, gelas piala, gelas arloji, gelas ukur 10 ml, tabung reaksi, labu Erlenmeyer 250 dan 500 ml, batang gelas, magnetic stirer, tabung sentrifus, vorteks, tabung reaksi bertutup, dan hot plate.
B. METODE PENELITIAN
1. Pembuatan Tepung Biji Kecipir Rendah Lemak
Pembuatan tepung biji kecipir dilakukan dengan merendam biji kecipir selama 24 jam, kemudian direbus selama 30 menit lalu dilakukan pengupasan. Setelah itu dikeringkan dalam oven 50oC selama 9-11 jam. Biji kemudian ditepungkan dengan pin disc mill dan diayak pada saringan 60 mesh. Untuk menghilangkan sebagian lemak pada tepung, dilakukan ekstraksi lemak dengan menggunakan metode maserasi heksana. Proses maserasi dengan heksana dilakukan pada suhu ruang selama 2 jam dengan perbandingan 1:5 sesuai dengan percobaan yang dilakukan oleh Handoko (2000). Tahapan lengkap pembuatan tepung kecipir rendah lemak dapat dilihat pada Gambar 4 berikut.
Gambar 4. Pembuatan Tepung Biji Kecipir Rendah Lemak
2. Penentuan Titik Kelarutan Maksimum dari Protein Biji Kecipir
Titik kelarutan maksimum dari protein biji kecipir perlu ditentukan untuk efisiensi proses ekstraksi protein. Berdasarkan penelitian yang dilakukan oleh Erlina et al. (1982), kelarutan maksimum dari protein biji kecipir adalah pH 6.37, sedangkan berdasarkan penelitian Okezie dan Bello (1989), kelarutan
Biji kecipir
Dikeringkan dalam oven 50oC selama 9-11 jam
Ditepungkan dengan pin disc mill
Diayak 60 mesh
Direndam dalam air selama 24 jam
Direbus 70-80oC selama 30 menit
Diekstraksi lemaknya dengan maserasi heksana (1:5) selama 2 jam pada suhu ruang
Tepung kecipir rendah lemak
protein maksimum berkisar antara pH 10 dan 12. Oleh karena itu akan diuji kelarutan protein kecipir pada ketiga pH tersebut dan diukur rendemennya. Percobaan ini diujicobakan dengan melarutkan tepung kecipir rendah
lemak pada ketiga pH tersebut, lalu protein terlarut dipisahkan dan diendapkan pada pH isoelektriknya. Protein yang mengendap dipisahkan dan dikeringkan dengan menggunakan spray dryer, lalu rendemen protein dari tepung dihitung dan dibandingkan. Rendemen protein yang tertinggi menggambarkan titik kelarutan maksimum dari protein biji kecipir.
3.Penentuan Metode Pengeringan Konsentrat Protein Biji Kecipir
Sebelum konsentrat protein diproduksi, dilakukan penelitian untuk menentukan metode pengeringan konsentrat. Parameter warna adalah parameter yang cukup penting dalam penerimaan suatu produk. Oleh karena itu, diperlukan pemilihan metode pengeringan yang tepat agar diperoleh warna konsentrat protein yang dapat diaplikasikan pada berbagai jenis produk. Penelitian pendahuluan ini mengujicobakan 4 jenis pengeringan, yaitu pengeringan dengan oven vakum, oven biasa, rumah kaca dan spray dryer. Metode pengeringan akan dipilih berdasarkan warna konsentrat protein yang telah dikeringkan. Protein yang telah diendapkan pada pH isoelektriknya dikeringkan dengan empat jenis pengering dan dibandingkan warnanya secara objektif dengan menggunakan kromameter MINOLTA CR-200. Metode pengeringan yang dibandingkan adalah pengeringan dengan oven pada suhu 50oC, pengeringan dengan oven vakum pada suhu 70oC dan tekanan 60 psi, spray dryer dengan suhu outlet 80oC, serta rumah kaca yang bersuhu antara 50-70oC.
4. Pembuatan Konsentrat Protein Biji Kecipir
Prinsip pembuatan konsentrat protein biji kecipir adalah melarutkan tepung biji kecipir pada pH kelarutan protein maksimum, kemudian protein diendapkan pada pH isoelektriknya dan dikeringkan. Menurut Erlina (1982), titik isoelektrik kecipir terdapat pada rentang pH 3.87-4.87, sedangkan pada penelitian Okezie dan Bello (1988) titik isoelektrik yang digunakan ialah pH 4. Proses pelarutan protein dilakukan pada pH yang menghasilkan rendemen protein terbesar yang telah dilakukan sebelumnya, yaitu pada pH 10.
Proses recovery dilakukan untuk mengekstrak protein yang masih terkandung dalam residu awal. Residu awal dilarutkan kembali proteinnya dan digabungkan dengan filtrat yang telah diendapkan. Campuran filtrat larutan tersebut diendapkan proteinnya, dipisahkan dari filtratnya dan dikeringkan. Pengeringan dengan spray dryer dilakukan berdasarkan percobaan sebelumnya yang menunjukkan bahwa pengeringan dengan spray dryer menghasilkan konsentrat dengan derajat putih yang paling tinggi. Secara lengkap, proses pembuatan konsentrat protein ini dapat dilihat pada Gambar 5.
@
Gambar 5. Pembuatan Konsentrat Protein Biji Kecipir
@
Dilarutkan lagi dengan air destilata dengan jumlah sama seperti sebelumnya Filtrat diendapkan di
refrigerator semalaman
Filtrat diambil
Dicampur dan diendapkan pada pH
Protein dilarutkan lagi pada pH 10 dengan NaOH 1N
Dipanaskan suhu 50oC selama 1 jam Residu
Filtrat
Tepung kecipir rendah lemak
Dipanaskan suhu 50oC selama 1 jam dengan pengadukan Dilarutkan dalam air destilata dengan perbandingan 1:10
Gambar 5. Pembuatan Konsentrat Protein Biji Kecipir
5. Analisis Proksimat
Penelitian utama yang dilakukan adalah analisis proksimat, sifat fisikokimia dan sifat fungsional dari konsentrat protein kecipir yang sudah diproduksi sebelumnya.
a. Analisis Kadar Air Metode Oven (SNI 01-2891-1992)
Cawan alumunium dikeringkan dalam oven pada suhu 105oC selama 15 menit, lalu didinginkan dalam desikator selama 10 menit. Cawan ditimbang menggunakan neraca analitik. Sampel sebanyak 1-2 gram dimasukkan ke dalam cawan, kemudian cawan serta sampel ditimbang dengan neraca analitik. Cawan berisi sampel dikeringkan dalam oven pada suhu 105oC selama 3 jam. Selanjutnya cawan berisi sampel didinginkan dalam desikator, kemudian ditimbang. Penimbangan diulangi hingga diperoleh bobot konstan (selisih
bobot ≤ 0.0005 gram). Perhitungan :
Kadar air (g/100 g bahan basah) = W – (W1-W2) x 100 W
Keterangan : W= bobot contoh sebelum dikeringkan (g) W1= bobot contoh + cawan kering kosong (g) W2= bobot cawan kosong (g)
b. Analisis Kadar Protein Metode Kjeldahl Mikro (AOAC 960.52 yang dimodifikasi)
Sejumlah kecil sampel (100-250mg) ditimbang dan dipindahkan ke dalam labu Kjedahl. Setelah itu, ditambahkan 1.0 ± 0.1 gram K2SO4, 40 ± 10
mg HgO, dan 2.0 ± 0.1 ml H2SO4. Dua sampai tiga butir batu didih dimasukkan
ke labu Kjedahl dan dididihkan selama 1-1.5 jam sampai cairan menjadi jernih. Setelah cairan jernih, labu Kjedahl yang berisi sampel didinginkan dan ditambahkan sejumlah kecil air secara perlahan-lahan ke dalamnya, kemudian didinginkan kembali. Isi labu dipindahkan ke dalam alat destilasi kemudian dicuci dan bilas 5-6 kali dengan 1-2 ml air destilata.
Erlenmeyer 125 ml yang berisi 5 ml larutan H3BO3 dan 2-4 tetes
indikator (campuran dua bagian metil merah 0.2% dalam alkohol dan satu bagian metilen biru 0.2% dalam alkohol) diletakkan di bawah kondensor. Ujung tabung kondensor harus terendam di bawah larutan H3BO3 kemudian di
tambahkan 8-10 ml larutan NaOH-Na2S2O3 dan dilakukan destilasi sampai
tertampung kira-kira 15 ml destilat dalam erlenmeyer. Setelah itu, tabung kondensor dibilas dengan air dan bilasannya ditampung dalam erlenmeyer yang sama. Selanjutnya isi erlenmeyer diencerkan sampai kira-kira 50 ml dan kemudian ditritasi dengan HCl 0.02 N sampai terjadi perubahan warna menjadi abu-abu. Penentuan protein pun dilakukan untuk blanko. Cara perhitungan kadar protein :
Kadar N (%) = (ml HCl contoh- ml HCl blanko)x N HCl x 14.007 x 100%
mg contoh
Kadar protein (%) = %N x faktor konversi
c. Analisis Kadar Lemak Metode Soxhlet (SNI 01-2891-1992)
ditimbang. Selongsong kertas saring yang berisi contoh dengan kapas dikeringkan pada suhu 80oC selama ± 1 jam. Selongsong kertas tersebut dimasukkan ke dalam alat Soxhlet yang telah dihubungkan ke labu lemak. Ekstraksi lemak dengan heksana dilakukan selama ± 6 jam. Selanjutnya, labu lemak yang berisi lemak hasil ekstraksi dipanaskan di dalam oven pada suhu 105°C. Setelah itu didinginkan di dalam desikator, kemudian ditimbang hingga bobotnya tetap. Cara perhitungan kadar lemak:
Kadar lemak (g/100 g bahan basah) = (W1-W2) x 100 W
Kadar lemak (g/100 g bahan kering) = kadar lemak (%BB) x 100 (100-kadar air (%BB)) Keterangan : W = Bobot sampel (g)
W1= Bobot labu lemak + lemak hasil ekstraksi (g) W2= Bobot labu lemak kosong (g)
d. Analisis Kadar Abu (SNI 01-2891-1992)
Cawan pengabuan dikeringkan dalam oven 105oC selama 15 menit, kemudian didinginkan dalam desikator, dan ditimbang. Sampel sebanyak 2-3 gram ditimbang dalam cawan tersebut, kemudian cawan yang berisi sampel padat diarangkan dahulu sebelum dimasukkan ke dalam tanur. Pengabuan dilakukan dalam tanur pada suhu maksimum 5500C hingga pengabuan sempurna. Cawan yang berisi sampel didinginkan dalam desikator, kemudian ditimbang dengan neraca analitik hingga bobotnya tetap.
Perhitungan :
Kadar abu (g/100 g bahan basah) = (W1-W2) x 100 W
Kadar abu (g/100 g bahan kering) = kadar abu (%BB) x 100 (100-kadar air (%BB))
Keterangan : W = Bobot sampel sebelum diabukan (gram)
W1= Bobot cawan + sampel setelah diabukan (gram) W2= Bobot cawan kosong (gram)
e. Analisis Kadar Karbohidrat by difference
6. Analisis Sifat Fisikokimia
a. Analisis Warna dan Derajat Putih dengan Chromameter Minolta CR-200 (modifikasi Hutching, 1999)
Pengukuran dilakukan dengan meletakkan sampel di dalam wadah sampel yang sudah tersedia dan selanjutnya dilakukan pengukuran pada skala nilai L, a, b. Selanjutnya dihitung nilai derajat putih dengan persamaan:
Derajat putih = 100 - √{(100-L)2 + (a2+ b2)}
b. Particle Size Index (PSI) (modifikasi Bejarano et al., 2007)
Sampel sebanyak 5 gram diayak menggunakan ayakan dalam berbagai ukuran (mesh) yaitu 40 mesh (420 m), 60 mesh (318 m), 80 mesh (180 m), dan 100 mesh (150 m). Sampel diayak menggunakan alat selama 10 menit. Material yang tersisa dalam ayakan dinyatakan dalam percent over.
PSI = Σ aibi Keterangan : ai = percent over pada ayakan
bi= koefisien relatif ayakan (40, 60, 80, 100 mesh dinyatakan dalam 0.4, 0.6, 0.8, dan 1.0)
c. Densitas Kamba (ρA) (Okezie dan Bello, 1988)
Sampel dimasukkan ke dalam sebuah gelas ukur 10 ml yang telah diketahui beratnya. Gelas ukur yang telah dimasukkan sampel diketuk-ketukkan ke meja > 30 kali hingga tak ada lagi rongga ketika sampel ditepatkan menjadi 10 ml. Gelas ukur yang berisi sampel tersebut kemudian ditimbang. Densitas kamba dapat dihitung dari hasil pembagian berat sampel dengan volumenya (10 ml). Pengukuran densitas kamba dilakukan dua kali ulangan.
Densitas kamba (g/ml) = (a-b) x 100% 10
Keterangan : a = berat gelas ukur berisi 10 ml sampel (g) b = berat gelas ukur kosong (g)
d.Komposisi Asam Amino (AOAC 982.30)
HCl 6 N (khusus untuk asam amino triptofan, HCl diganti dengan NaOH). Lalu sampel tersebut dipanaskan selama 24 jam pada suhu 100oC, kemudian disaring. Sampel diambil sebanyak 30 ml dan ditambahkan larutan pengering (metanol, picolotiocianat, dan trietilamin). Sampel dikeringkan dengan pompa vakum dan ditambahkan lagi dengan 30 ml larutan derivatisasi (metanol, natrium asetat, dan trietilamin).
Sampel didiamkan 20 menit, kemudian ditambahkan 200 ml natrium asetat sebelum diinjek ke alat HPLC. Kolom HPLC yang digunakan adalah kolom pico tag 3.9x150 mm dengan fase gerak asetonitril 60% dan buffer natrium asetat 1M. Detektor yang digunakan adalah detektor UV dengan panjang gelombang 254 nm. Kadar asam amino dihitung dengan rumus berikut: Kadar asam amino = Luas area contoh x konsentrasi standar x BM x FK x 100
Luas area standar bobot sampel Keterangan: BM= Berat molekul asam amino
FK = Faktor konversi
7. Analisis Sifat Fungsional
a. Protein solubility (Sathe et al., 1982)
Tahap ini dilakukan untuk mengetahui profil kelarutan protein biji kecipir pada berbagai pH. Profil mengenai kelarutan protein ini penting untuk diketahui karena berpengaruh terhadap sifat fungsional protein lainnya (Zayas, 1997). Kelarutan protein ini dapat diamati dengan melarutkan 10 mg sampel ke dalam 10 ml air, lalu pH larutan ditepatkan. Larutan disentrifus dan supernatan diambil untuk dianalisis konsentrasi protein terlarutnya dengan metode Lowry. Pengujian dilakukan dua ulangan.
0.5 ml supernatan diambil dan ditambahkan 3.5 ml akuades
Ditambahkan 5.5 ml pereaksi Lowry*
10 mg konsentrat protein biji kecipir dilarutkan dalam 10 ml air
Larutan tersebut ditepatkan pH 2-12 dengan menggunakan HCl dan NaOH 1N
Gambar 6. Penentuan Kurva Protein Solubility
*Pereaksi Lowry adalah campuran 50 ml NaOH 0.1 N yang mengandung 2% Natrium karbonat dan 1 ml Na-K-tartarat yang mengandung CuSO4 5%.
b.Daya Serap Air (WHC) (Sathe et al., 1982)
Sebanyak 1 g sampel dan 10 ml air destilata dimasukkan ke dalam tabung sentrifus kemudian dikocok dengan vorteks selama dua menit. Campuran kemudian didiamkan selama satu jam pada suhu ruang, kemudian disentrifuse dengan kecepatan 3000 rpm selama 25 menit. Filtrat dipisahkan secara hati-hati dan diukur dengan gelas ukur 10 ml untuk diketahui volum air bebas yang tidak terikat. Pengukuran daya serap air dilakukan dua kali ulangan, di mana densitas air diasumsikan 1 g/ml. Daya serap air dapat dihitung dengan persamaan berikut.
Daya Serap Air (g/g) = (10 ml – volum air tidak terikat (ml)) x densitas air berat sampel kering
c.Daya Serap Minyak (Chakraborty, 1986 dalam Zheng et al, 2007)
Sebanyak 1 gram sampel dimasukkan ke dalam tabung sentrifus dan ditambahkan 10 ml minyak kedelai. Campuran tersebut dikocok dengan vorteks selama 30 detik dan didiamkan selama 30 menit pada suhu ruang. Setelah itu,
Divorteks dan disimpan 15 menit pada suhu ruang
Ditambahkan 0.5 ml Folin Ciocalteu
Divorteks dan disimpan 30 menit pada ruang gelap hingga warna biru terbentuk
Absorbansi protein terlarut diukur pada panjang gelombang 650 nm
disentrifus pada kecepatan 3600 rpm selama 20 menit. Supernatan dituang ke gelas ukur 10 ml dan diamati volum minyak bebas. Pengukuran dilakukan dua kali ulangan, di mana densitas minyak kedelai diasumsikan sebesar 0.88 g/ml (Sathe et al, 1982). Daya serap minyak dihitung dengan persamaan berikut.
Daya Serap Minyak = (10 ml – volum minyak bebas (ml)) x densitas minyak
(g/g) berat sampel
d.Aktivitas dan Stabilitas Emulsi (modifikasi Franzen & Kinsella, 1976) Pengukuran aktivitas emulsi dilakukan dengan mencampur sebanyak 0.25g sampel dan 25 ml air. Sebanyak 25 ml larutan sampel ditambah 25 ml minyak kedelai. Campuran didispersikan dengan blender selama 1 menit, lalu diambil sebanyak 5 ml untuk ditepatkan pHnya sambil diaduk dengan magnetic stirer. Kemudian disentrifus dengan kecepatan 3000 rpm selama 10 menit sehingga volume emulsi dapat diukur. Aktivitas emulsi dapat dihitung dengan persamaan berikut
Aktivitas Emulsi (%) = volum campuran teremulsi x 100% volum total dalam tabung
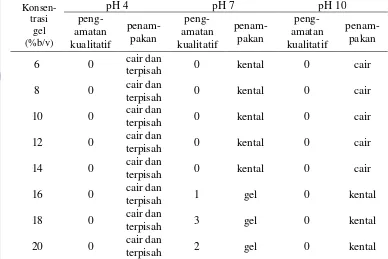
Pengamatan juga dilakukan pada aktivitas emulsi setelah dilakukan pemanasan terhadap sampel. Larutan sampel dan minyak yang sudah didispersikan, dipanaskan 80oC selama 30 menit (Neto et al., 2001 dalam Lawal et al., 2007), disentrifus dengan kecepatan 3000 rpm selama 10 menit dan diamati lagi volume emulsinya. Untuk mengamati stabilitas emulsi selama waktu tertentu, emulsi yang sudah terbentuk disimpan selama beberapa lama pada suhu ruang. Volume emulsi diamati pada jam ke-0.5, 1, 2, 4, 6 kemudian dicatat dan dibuat kurva kestabilan emulsinya (Okezie dan Bello, 1988). Percobaan kapasitas dan stabilitas emulsi ini dilakukan pada pH 2, 4, 6, 8, dan 10 sebanyak dua kali ulangan.
e.Daya Gelasi (Coffman dan Garcia, 1977)
penelitian Okezie dan Bello (1988), gel dapat terbentuk dengan pemanasan minimal 80oC 30 menit yang diikuti oleh pendinginan 4oC selama 1 jam. Kekuatan gel yang terbentuk diukur secara kualitatif dan dicatat penampakannya. Pengukuran sifat gelasi ini dilakukan dua ulangan. Skala yang digunakan untuk pengukuran gel adalah:
0 = gel tidak terbentuk
1 = gel sangat lemah, gel jatuh bila dimiringkan 2 = gel tidak jatuh bila tabung dibalik vertikal
3 = gel tidak jatuh bila tabung dibalik vertikal dan dihentak sekali 4 = gel tidak jatuh bila tabung dibalik dan dihentak > 5 kali
f. Kapasitas dan Stabilitas Buih (Coffman dan Garcia, 1977)
Sebanyak 2 g sampel dilarutkan dalam 20 ml akuades dan dihomogenkan dengan magnetic stirer selama ± 1 menit. Larutan tersebut kemudian diatur pHnya dan dikocok dengan waring blender selama 2 menit. Volume busa sebelum dan sesudah dikocok dicatat, kemudian kapasitas buih dihitung dengan persamaan berikut:
Kapasitas Buih (%) = volum busa sesudah dikocok x 100% volum awal larutan protein
IV.HASIL DAN PEMBAHASAN
1. Pembuatan Tepung Biji Kecipir Rendah Lemak
Tahap pembuatan tepung ini adalah tahap yang umumnya dilakukan sebelum tahap pembuatan konsentrat. Tahap penepungan ini sangat penting untuk mempermudah proses ekstraksi protein karena luas permukaan yang semakin besar. Terdapat beberapa tahap dalam pembuatan tepung ini, di antaranya adalah tahap pengupasan kulit biji kecipir dan tahap ekstraksi lemak. Dengan adanya pengupasan kulit sebagian besar serat dapat dibuang, sedangkan pada tahap ekstraksi lemak, lemak dapat dikurangi. Penggunaan tepung bebas lemak sangat penting pada tahap pembuatan konsentrat karena lemak dapat membentuk kompleks dengan protein dan menghambat proses ekstraksi protein pada tahap berikutnya (Leimena, 2000).
Tahap pengupasan dilakukan dengan metode pengupasan basah, meliputi perendaman dalam air selama 24 jam dan perebusan selama 30 menit. Menurut penelitian Sambudi dan Buckle (1991), dengan perendaman dan perebusan tersebut, kulit kecipir dapat dikupas dengan cukup mudah, enzim lipoksigenase dapat dihilangkan dengan adanya pemanasan, dan sifat fungsional dari protein tersebut dapat ditingkatkan, terutama daya serap airnya.
Dalam tahap ekstraksi lemak ini ukuran bahan perlu diperhatikan. Ukuran bahan yang tepat akan menjadikan proses ekstraksi lemak efisien dan tidak memakan waktu yang lama. Apabila ukuran bahan terlalu halus, bahan akan menggumpal sehingga akan sulit ditembus pelarut, sebaliknya jika ukuran bahan terlalu besar, proses ekstraksi akan berlangsung lama (Moestafa, 1981). Oleh karena itu, dipilih ukuran 60 mesh karena jika ukuran bahan di atas 50 mesh sebenarnya tidak akan memberikan dampak yang nyata pada perbedaan kadar lemak yang terekstraksi (Handoko, 2000). Berdasarkan penelitian Handoko (2000), ekstraksi lemak selama 2 jam adalah waktu yang optimum, karena setelah waktu 2 jam, pelarut heksana akan menjadi jenuh dan tidak mampu lagi melarutkan lemak. Berikut ini dapat dilihat hasil analisis proksimat dari tepung kecipir rendah lemak (Tabel 4).
Tabel 4. Komposisi Tepung Biji Kecipir Rendah Lemak Analisis Berat basah Berat kering
Kadar air (%) 7.19 7.75
Kadar abu (%) 4.22 4.54
Kadar protein (%) 40.72 43.87
Kadar lemak (%) 5.26 5.67
Kadar karbohidrat (%) 42.61 45.91
FAO menggolongkan tepung kedelai ke dalam beberapa kelas berdasarkan kadar lemak yang terkandung (FAO, 2009). Tepung kedelai dapat digolongkan sebagai tepung kedelai rendah lemak jika kandungan lemaknya berkisar antara 4.5%-9%. Jika dilihat dari kadar lemak yang terkandung dalam tepung kecipir (5.67%), tepung kecipir yang dihasilkan dapat digolongkan sebagai tepung rendah lemak.
2. Penentuan Titik Kelarutan Maksimum dari Protein Biji Kecipir
Nilai pH sangat berpengaruh terhadap proses ekstraksi protein. Protein memiliki sifat kelarutan yang berbeda pada berbagai tingkatan pH yang berbeda. Prinsip dari proses pembuatan konsentrat protein adalah dengan mengurangi dan menghilangkan komponen lain seperti karbohidrat, lemak dan serat sehingga kadar proteinnya meningkat (Lusas dan Rhee, 1995). Secara garis besar, konsentrat protein dibuat dengan melarutkan protein pada pH kelarutan protein tertinggi, lalu protein terlarut tersebut dipisahkan dan diendapkan pada pH isoelektriknya. pH isoelektrik ditentukan berdasarkan studi literatur, di mana Sathe et al (1982), Okezie dan Bello (1988) menyebutkan bahwa titik isoelektrik protein kecipir adalah pH 4.
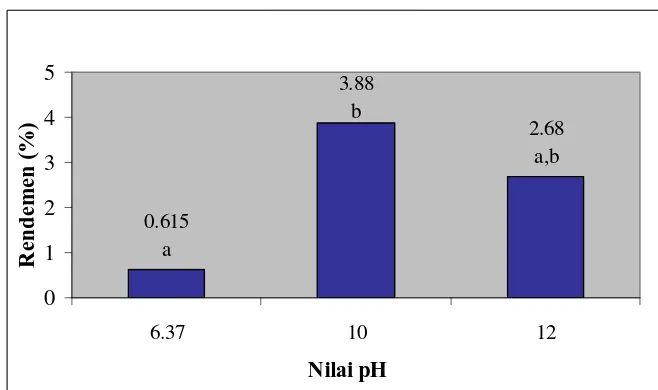
Nilai pH kelarutan protein biji kecipir perlu ditentukan karena beberapa sumber menyatakan perbedaan titik kelarutan maksimum dari protein kecipir. Berdasarkan penelitian yang dilakukan oleh Erlina et al. (1982), kelarutan maksimum dari protein biji kecipir adalah pH 6.37, sedangkan berdasarkan penelitian Okezie dan Bello (1989), kelarutan protein maksimum berkisar antara pH 10 dan 12. Kelarutan protein yang tinggi akan menghasilkan rendemen protein yang tinggi pula. Berikut ini dapat dilihat perbandingan rendemen protein terekstrak pada pH yang berbeda.
0.615
Gambar 8 menunjukkan bahwa pada selang kepercayaan 95%, rendemen pada pH 6.37 dan 10 berbeda nyata, sedangkan rendemen pH 12 tidak berbeda nyata dengan rendemen pH 6.37 dan pH 10. Rendemen protein tertinggi diperoleh pada pH 10, karena itu untuk proses produksi konsentrat protein biji kecipir digunakan pH 10 untuk ekstraksi protein.
Okezie dan Bello (1989) melakukan percobaan dengan melarutkan protein kecipir pada pH 10, meskipun pada percobaan tersebut rendemen pH 12 lebih tinggi. Pelarutan protein pada pH 10 lebih dipilih daripada pH 12 karena mempertimbangkan beberapa hal. Proses pelarutan protein sebaiknya tidak dilakukan di atas pH 10 karena terdapat kemungkinan terbentuknya komponen antinutrisi seperti lisinoalanin (Kinsella, 1979). Selain itu, dipertimbangkan juga banyaknya HCl yang dibutuhkan untuk mengendapkan protein pada pH isoelektrik (pH 4).
3. Penentuan Metode Pengeringan Konsentrat Protein Biji Kecipir
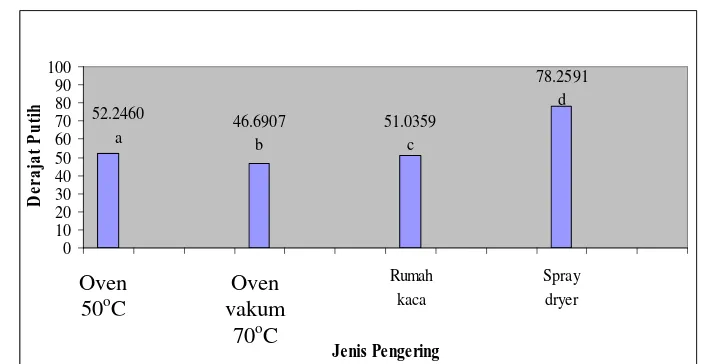
Metode pengeringan konsentrat protein dapat mempengaruhi warna dan sifat fungsional dari protein itu sendiri, karena sifat fungsional protein sangat tergantung dari kondisi proses pembuatan konsentrat tersebut (Fernandez-Quintella et al, 1997). Jenis pengeringan dipilih berdasarkan parameter warna. Berdasarkan hasil pengeringan dengan empat jenis pengering diperoleh perbandingan warna konsentrat seperti berikut.
78.2591
Gambar 9. Perbandingan Derajat Putih Pada Berbagai Pengeringan Oven
50oC
Oven vakum
Gambar 9 menunjukkan bahwa nilai derajat putih dengan berbagai jenis pengering berbeda nyata satu sama lain pada selang kepercayaan 95%, di mana pengeringan dengan spray dryer memberikan warna konsentrat yang paling cerah karena memiliki derajat putih paling tinggi. Data lengkap mengenai nilai L, a dan b dari konsentrat dengan berbagai jenis pengeringan dapat dilihat pada Lampiran 2.
Penelitian selanjutnya menggunakan metode pengeringan spray dryer. Selain karena warna, pemilihan spray dryer dilakukan karena mempertimbangkan efisiensi waktu. Pengeringan dengan spray dryer lebih cepat daripada pengeringan dengan oven yang bersistem batch.
4. Pembuatan Konsentrat Protein Biji Kecipir
Konsentrat protein adalah pekatan protein dengan kadar protein 60-70% berat kering (Hanson, 1974). Tahap pembuatan konsentrat dimulai dengan melarutkan tepung kecipir rendah lemak pada air dengan perbandingan 1:10 untuk memperoleh rendemen protein yang baik (Smith, 1958 dan Circle, 1951). Peningkatan pH menjadi 10 adalah tahap ekstraksi protein, di mana pada pH 10, protein berada dalam posisi kelarutan tertinggi. Cheftel et al. (1985) menyebutkan bahwa sebagian besar asam amino akan bermuatan negatif pada pH di atas titik isoelektriknya, pada kondisi ini muatan sejenis cenderung untuk tolak menolak sehingga interaksi antara residu asam amino minimum dan kelarutannya meningkat. Untuk meningkatkan rendemen ekstraksi protein, proses ekstraksi pada pH 10 dilakukan dengan pemanasan 50oC, pemanasan merupakan kondisi optimum untuk mengekstrak protein (Circle, 1951).
Pengeringan slurry protein sesudah disentrifus dilakukan dengan menggunakan spray dryer pada suhu inlet 170oC dan suhu outlet 80oC seperti percobaan Zheng et al (2007). Dengan menggunakan spray dryer, warna konsentrat yang dihasilkan menjadi lebih cerah karena protein dikeringkan dengan waktu yang singkat dan reaksi Maillard dapat dihindari. Menurut Fernandez-Quintela et al. (1997), tidak terdapat perbedaan yang nyata pada sifat fungsional konsentrat protein yang dikeringkan dengan spray dryer dengan freeze dryer. Hal ini menunjukkan bahwa metode pengeringan dengan spray dryer dapat diterapkan pada proses pembuatan konsentrat protein biji kecipir.
5. Analisis Proksimat
Terdapat beberapa jenis produk pekatan protein, salah satunya adalah konsentrat protein. Sampai saat ini belum ada standar baku yang ditetapkan untuk mendefinisikan konsentrat protein. CODEX hanya menetapkan standar baku untuk mendefinisikan produk pekatan protein kedelai dan menetapkan komposisi baku dari produk pekatan protein kedelai tersebut.
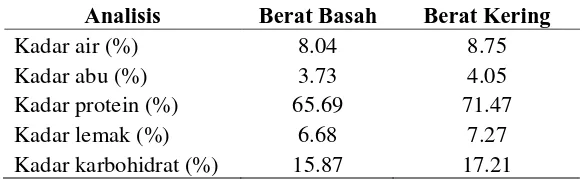
Analisis proksimat yang dilakukan meliputi kadar air, kadar protein, kadar abu, kadar lemak dan kadar karbohidrat by difference. Berdasarkan hasil percobaan, kadar protein konsentrat protein kecipir adalah 65.69% berat basah dan 71.47% berat kering seperti dapat dilihat pada Tabel 5 berikut.
Tabel 5. Komposisi Konsentrat Protein Biji Kecipir
Analisis Berat Basah Berat Kering
Kadar air (%) 8.04 8.75
Kadar abu (%) 3.73 4.05
Kadar protein (%) 65.69 71.47
Kadar lemak (%) 6.68 7.27
Kadar karbohidrat (%) 15.87 17.21
dihasilkan telah memenuhi standar CODEX (1989) yang biasanya hanya diterapkan pada pekatan protein kedelai.
Komposisi konsentrat protein biji kecipir yang dihasilkan menunjukkan kadar protein yang sama, kandungan lemak dan abu yang lebih kecil dan kadar air yang lebih besar dari percobaan yang dilakukan oleh Sathe et al. (1982). Perbedaan komposisi konsentrat protein kecipir yang dihasilkan dapat disebabkan oleh adanya perbedaan proses produksi konsentrat. Pada percobaan ini, kandungan lemak yang lebih rendah disebabkan oleh adanya tahapan ekstraksi lemak pada tepung kecipir, sedangkan kadar air yang lebih tinggi dapat disebabkan oleh perbedaan proses penyimpanan.
6. Analisis Sifat Fisikokimia
a. Analisis Warna dan Derajat Putih dengan Kromameter Minolta CR-200 Warna merupakan salah satu parameter fisik yang penting untuk diamati. Warna konsentrat protein yang tidak terlalu gelap dapat memperluas aplikasi konsentrat pada berbagai jenis produk makanan. Proses pengolahan sangat berpengaruh terhadap warna konsentrat yang dihasilkan. Honestin (2007) menyatakan bahwa suhu pengeringan dan perlakuan pramasak berpengaruh terhadap kecerahan warna tepung-tepungan yang dihasilkan.
Gambar 10. Konsentrat Protein Biji Kecipir
putihnya sebesar 72.40 %. Notasi warna konsentrat protein biji kecipir pada Tabel. 6 menunjukkan bahwa pigmen biji kecipir yang berpotensi menghasilkan warna coklat pada konsentrat, dapat dihilangkan selama proses produksi. Selain itu, komponen gula yang dapat menyebabkan terjadinya reaksi Maillard pada konsentrat juga dapat dikurangi. Parameter warna ini tidak menunjukkan pengaruh proses pengolahan terhadap sifat fisikokimia dan fungsional lain dari konsentrat protein biji kecipir.
Tabel 6 . Parameter Warna Konsentrat Protein Biji Kecipir Parameter warna Nilai
L (lightness) 75.42 a (warna merah) 0.85 b (warna kuning) 12.52 Derajat putih (%) 72.40
b. Particle Size Index (PSI)
Ukuran partikel mempengaruhi parameter penyerapan air, cooking loss dan tekstur dari produk yang dihasilkan. Semakin halus ukuran partikel, semakin besar tingkat penyerapan air dan cooking loss ketika proses produksi (Hatcher et al., 2002). Distribusi ukuran partikel pangan berbentuk bubuk memiliki pengaruh yang nyata pada densitas kamba dan porositas bahan. Semakin kecil ukuran partikel, semakin kecil densitas kamba dan semakin tinggi porositasnya.
c. Densitas kamba
Densitas kamba merupakan perbandingan antara berat bahan dengan volum bahan yang dinyatakan dalam satuan g/ml. Peleg dan Bagley (1983) menyatakan bahwa densitas kamba tergantung dari beberapa faktor, yaitu gaya tarik antara partikel, ukuran partikel dan luas permukaan sentuh partikel.
Konsentrat protein biji kecipir mempunyai densitas kamba sebesar 0.5831 g/ml. Nilai densitas kamba dari konsentrat protein biji kecipir ini sebanding dengan nilai densitas kamba tepung biji kecipir (0.5300 g/ ml) yang diteliti oleh Okezie dan Bello (1988). Bahan pangan dengan bentuk bubuk umumnya memiliki densitas kamba antara 0.3-0.8 g/ml (Wirakartakusumah et al., 1992). Hal ini menunjukkan bahwa makanan berbentuk bubuk memiliki porositas yang tinggi, yaitu sekitar 40-80%.
Densitas kamba ini berhubungan dengan formulasi produk dan pengemasan bahan pangan. Semakin tinggi nilai densitas kamba, menunjukkan bahwa produk semakin padat dan memiliki porositas yang rendah. Pada formulasi produk, nilai densitas kamba berpengaruh terhadap jumlah konsentrat protein yang dapat ditambahkan ke dalam satu sajian produk pangan. Konsentrat protein diharapkan memiliki nilai densitas kamba yang cukup tinggi karena dapat menghasilkan kekentalan pasta protein yang rendah, hal ini merupakan faktor yang penting untuk aplikasi makanan yang berbentuk bubur untuk anak-anak dan orang sakit (Padmashree et al., 1987).
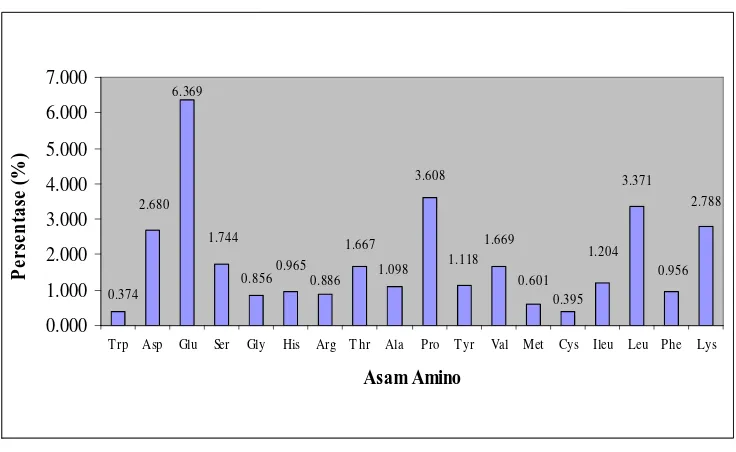
d. Komposisi Asam Amino
2.788
Gambar 11. Komposisi Asam Amino Konsentrat Protein Biji Kecipir
Gambar 11 di atas menunjukkan bahwa konsentrat protein biji kecipir dominan mengandung asam glutamat, diikuti oleh prolin, leusin, lisin dan asam aspartat. Dari komposisi tersebut dapat dilihat bahwa protein konsentrat biji kecipir ini cenderung bersifat hidrofilik. Asam aspartat, asam glutamat dan lisin dapat mengikat sekitar 4-7 molekul air/ molekul asam amino, sedangkan asam amino polar hanya 1-2 molekul air/ molekul asam amino, bahkan asam amino non polar hanya 1 molekul air/molekul asam amino atau tidak sama sekali (Zayas, 1997). Jika dilihat dari komposisi asam aminonya saja, konsentrat protein biji kecipir ini memiliki daya ikat air yang baik, sedangkan daya ikat minyaknya tidak terlalu baik.
Konsentrat protein biji kecipir mengandung semua asam amino esensial, yaitu lisin, leusin, isoleusin, arginin, fenilalanin, valin, treonin, metionin, dan triptofan. Berdasarkan penelitian ini, sistein dan metionin menjadi asam amino pembatas bagi konsentrat protein biji kecipir ini. Asam amino pembatas ditentukan dengan menghitung skor kimia untuk asam amino esensial yang terkandung pada konsentrat protein biji kecipir.
amino dari konsentrat protein biji kecipir dengan isolat protein kedelai komersial (Promine D). Kedua pekatan protein tersebut memiliki asam amino pembatas yang sama, yaitu metionin dan sistein. Skor kimia untuk konsentrat protein kecipir adalah 58%, sedangkan isolat kedelai memiliki skor kimia sebesar 65.7%. Penelitian yang dilakukan Okezie dan Bello (1988) ini menunjukkan bahwa komposisi asam amino dari protein kecipir sebanding dengan isolat protein kedelai, terutama pada distribusi dan kandungan asam amino esensialnya.
7. Analisis Sifat Fungsional a. Protein Solubility
Kelarutan protein adalah jumlah protein sampel yang terlarut dalam larutan. Kelarutan protein dipengaruhi oleh faktor internal dan eksternal. Faktor internal yang mempengaruhi adalah komposisi asam amino, berat molekul protein, dan konformasi protein. Adapun beberapa faktor eksternal yang mempengaruhi kelarutan protein yaitu kekuatan ionik, tipe pelarut, pH, suhu dan kondisi pemrosesan tertentu (Zayas, 1997). Profil kelarutan protein ini sangat berhubungan dengan sifat fungsional protein lainnya, terutama sifat buih, emulsi dan gelasi (Zayas, 1997).
0.000
Gambar 12 menunjukkan profil kelarutan dari konsentrat protein biji kecipir membentuk kurva berbentuk huruf U antara pH 2-11. Kelarutan protein mencapai titik terendah pada pH 4 dan naik perlahan-lahan hingga mencapai kelarutan maksimum pada pH 11 dan turun kembali pada pH 12. Banyaknya protein terlarut pada medium cair adalah hasil gaya elektrostatik dan interaksi hidrofobik antara molekul protein. Kelarutan meningkat jika gaya elektrostatik protein dan medium lebih besar daripada interaksi hidrofobik (Zayas, 1997). Pada pH asam atau basa, protein bermuatan positif atau negatif dan meningkatkan interaksi protein-air sehingga kelarutan protein meningkat. Pada pH isolektrik, muatan protein nol dan meningkatkan interaksi antara protein itu sendiri sehingga kelarutannya menurun. Fenomena inilah yang menjelaskan kurva kelarutan protein terhadap pH membentuk huruf U dengan kelarutan terendah pada titik isoelektrik (Zayas, 1997).
Percobaan Sathe et al. (1982) menggambarkan bahwa kelarutan terendah konsentrat protein kecipir dicapai pada pH 4, dan seiring dengan meningkatnya pH, kelarutan pun meningkat dengan kelarutan maksimum pada pH 12. Namun pada penelitian ini, kelarutan protein kecipir hanya meningkat hingga pH 11 dan menurun pada pH 12. Hal ini dapat terjadi karena pada pH 12, protein biji kecipir telah mengalami denaturasi sehingga kelarutannya menurun. Winarno (1997) menjelaskan bahwa protein yang terdenaturasi berkurang kelarutannya, karena protein bagian dalam yang bersifat hidrofobik berbalik keluar, sedangkan bagian luar yang bersifat hidrofilik terlipat ke dalam.
basa dapat menyebabkan denaturasi protein yang bersifat permanen (Damodaran, 1996).
b. Daya Serap Air (WHC)
Daya serap air atau water holding capacity merupakan kemampuan protein untuk mengikat air selama diaplikasikannya gaya-gaya, tekanan, sentrifugasi dan pemanasan (Zayas, 1997). Daya serap air berhubungan dengan juiciness dan tekstur dari berbagai produk pangan, seperti daging, bakery dan produk yang memiliki karakter gel (Damodaran, 1996).
Daya serap air dari konsentrat protein biji kecipir sebesar 1.6070 g air/ g solid konsentrat. Daya serap air dari konsentrat protein biji kecipir ini sebanding dengan daya serap air dari tepung kedelai (1.3 g air/ g solid), namun masih lebih rendah jika dibandingkan dengan konsentrat protein kedelai (2.2 g air/ g solid) seperti dilaporkan oleh Kinsella (1979). Nilai daya serap air dari konsentrat protein biji kecipir ini masih termasuk dalam kisaran nilai daya serap air untuk konsentrat dan isolat protein komersial (1.5-2.5 g H2O/ g solid)
seperti dilaporkan oleh Lin dan Zayas (1987).
Daya serap air tergantung pada komposisi protein dan konformasi molekul protein itu sendiri (Zayas, 1997). Karena itu, daya serap air konsentrat protein biji kecipir ini pun sangat dipengaruhi oleh faktor-faktor tersebut. Jika ditinjau dari komposisi asam aminonya, konsentrat protein biji kecipir seharusnya memiliki daya serap air yang baik, mengingat banyaknya asam amino ionik (asam aspartat, asam glutamat dan lisin) yang terkandung. Interaksi air dengan gugus hidrofilik asam amino terjadi karena adanya ikatan hidrogen.
c. Daya Serap Minyak
Karakteristik produk pangan banyak melibatkan interaksi antara protein dan lemak, seperti pembentukan emulsi, emulsifikasi lemak pada daging, absorpsi flavor dan tekstur adonan. Kinsella (1979) menjelaskan mekanisme absorpsi minyak sebagai fenomena terperangkapnya minyak secara fisik. Selanjutnya Kinsella (1979) dan Sathe et al. (1982) menyatakan bahwa absorbsi lemak ditentukan oleh pengikatan lemak oleh gugus nonpolar pada protein.
Dalam produk pangan yang berbentuk bubuk, pengikatan lemak dipengaruhi oleh ukuran partikel. Protein dalam bentuk bubuk dengan densitas rendah dan ukuran partikel kecil mengabsorbsi dan memerangkap minyak lebih banyak daripada protein dengan densitas yang tinggi (Zayas, 1997).
Kemampuan protein mengikat lemak sangat penting untuk aplikasi protein sebagai meat replacer dan extender sehubungan dengan mouthfeel dan retensi flavor yang melibatkan daya ikat lemak pada produk. Daya serap minyak dari konsentrat protein biji kecipir ini adalah 1.0194 g minyak/ g solid konsentrat. Nilai daya serap minyak dari konsentrat protein biji kecipir ini sebanding dengan daya serap minyak dari konsentrat protein kedelai komersial (ISOPRO) sebesar 1.1704 g minyak/ g solid seperti dilaporkan oleh Lin et al. (1974). Namun lebih kecil dari daya serap minyak protein kecipir yang diujicobakan oleh Sathe et al. (1982).
Jika dilihat berdasarkan struktur partikel konsentrat protein biji kecipir yang halus dan nilai densitas yang menunjukkan sifat porous, seharusnya konsentrat protein biji kecipir memiliki daya serap minyak yang cukup tinggi. Namun daya serap minyak yang tidak terlalu tinggi pada konsentrat biji kecipir ini dapat disebabkan oleh komposisi asam amino konsentrat protein biji kecipir yang cenderung polar dan sedikit mengandung asam amino nonpolar yang dibutuhkan untuk mengikat lemak atau minyak.
d. Aktivitas dan Stabilitas Emulsi