UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS SPERMISIDAL DAN EVALUASI
PENGARUH EKSTRAK ETANOL 70% BIJI JARAK
PAGAR (
Jatropha curcas
L.) TERHADAP
KONSENTRASI HORMON TESTOSTERON PADA
TIKUS JANTAN GALUR
Sprague-Dawley
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
SUCHINDA FER HARTI
1110102000023
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Nama : Suchinda Fer Harti
Program Studi : Farmasi
Judul : Uji Aktivitas Spermisidal Dan Evaluasi Pengaruh Ekstrak
Etanol 70% Biji Jarak Pagar (Jatropha curcas L.) Terhadap
Konsentrasi Hormon Testosteron Pada Tikus Jantan Galur
Sprague-Dawley
Penelitian ini dilakukan untuk menguji aktivitas spermisidal dan evaluasi
pengaruh ekstrak etanol 70% biji jarak pagar (Jatropha curcas L.) terhadap
konsentrasi testosteron pada tikus jantan. Ekstrak diberikan secara oral sekali
sehari selama 48 hari. Sampel terdiri dari 25 ekor tikus jantan galur
Sprague-Dawley yang terbagi menjadi 5 kelompok yaitu kelompok kontrol (Na CMC 1%),
kelompok perlakuan I (5mg/kgBB), II (25mg/kgBB), III (50mg/kgBB) dan IV
(tidak diberi perlakuan). Kemudian hasil dianalisis dengan menggunakan analisis
One Way ANOVA dan dilanjutkan dengan uji Multiple Comparisons. Konsentrasi
testosteron diukur dengan menggunakan metode ELISA. Hasil menunjukkan
bahwa pemberian ekstrak biji jarak pagar pada kelompok perlakuan dosis
25mg/kgBB dan dosis 50mg/kgBB mengalami peningkatan konsentrasi
testosteron tapi tidak berbeda bermakna secara statistik. Aktivitas spermisidal
secara in vitro dievaluasi menggunakan berbagai seri konsentrasi ekstrak biji jarak
pagar. Hasil penelitian menunjukkan bahwa MEC dari ekstrak biji jarak pagar
dapat melumpuhkan 100% sperma yang berada pada konsentrasi 3.5mg/mL.
Kata Kunci : Antifertilitas, Biji jarak pagar (Jatropha curcas L.), konsentrasi
Name : Suchinda Fer Harti
Program Study : Pharmacy
Title : Spermicidal Activity and Evaluation of Effect of 70%
Ethanolic Extract of Jatropha curcas Seeds of Testosterone
Concentration in Male Sprague-Dawley Rats
The present study is conducted to find out the spermicidal activity and evaluation
of effect of 70% ethanolic extract of Jatropha curcas seeds of testosterone
concentration in Male Sprague-Dawley Rats. The extract was given orally once a
day for 48 days. The sample consisted of 25 Sprague-Dawley male rats that were
divided five groups; control group (NaCMC 1%), treatment I (5mg/kgBW), II
(25mg/kgBW), III (50mg/kgBW) and IV (no trreatment). The result of experiment
was analyzed by using One Way ANOVA and by Multiple Comparisons test.
Testosterone concentration was measured with ELISA method. The results
showed that 70% ethanolic extract of Jatropha curcas seeds in dosage
25mg/kgBW dan dosis 50mg/kgBW resulted increased to testosterone
concentration but no significant differences. Spermicidal efficacy was evaluated in
vitro test using different concentrations extract of Jatropha curcas seeds. The
minimum effective concentration (MEC) of Jatropha curcas seed extract for 100
% immobilization of sperm in 20 secs was around 3.50 mg/mL.
Key Words: Anitfertility, Jatropha curcas seeds, testosterone concentration,
Alhamdulillahirabbil’alamin, segala puji syukur yang tidak terhingga kehadirat Allah SWT atas segala rahmat dan karunia-Nya yang telah dilimpahkan
kepada penulis sehingga pada akhirnya penulis dapat menyelesaikan skripsi ini.
Skripsi yang berjudul “UJI AKTIVITAS SPERMISIDAL DAN EVALUASI PENGARUH EKSTRAK ETANOL 70% BIJI JARAK PAGAR (Jatropha
curcas L.) TERHADAP KONSENTRASI HORMON TESTOSTERON
PADA TIKUS JANTAN GALUR Sprague-Dawley”yang disusun dalam rangka memenuhi persyaratan untuk memperoleh gelar Sarjana Farmasi pada Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Syarif Hidayatullah Jakarta.
Selama penyusunan dan penyelesaian skripsi ini, penulis telah
memperoleh bantuan dari berbagai pihak yang senantiasa meluangkan waktu
dalam memberikan bimbingan, petunjuk, saran serta dorongan kepada penulis
dalam penyusunan skripsi ini. Selesainya penyusunan skripsi ini tidak lepas dari
bantuan berbagai pihak, maka pada kesempatan ini perkenanlah penulis
menyampaikan ucapan terimakasih dan penghargaan yang tulus dan
sebesar-besarnya kepada :
1. Prof. DR. (hc). Dr. M.K. Tadjudin, Sp. And., selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
2. Drs. Umar Mansur M.Sc, Apt., selaku Ketua Program Studi Farmasi
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Dr. Azrifitria M.Si, Apt., selaku pembimbing yang dengan sabar telah
memberikan ilmu, pengarahan, bimbingan dan bantuannya dalam
penyusunan skripsi ini.
4. Puteri Amelia M.Farm, Apt., selaku pembimbing yang telah memberikan
arahan, bimbingan dan bantuannya dalam membimbing penulis selama ini.
5. Bapak dan Ibu dosen Program Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta yang
telah membimbing dan memberikan ilmunya kepada penulis selama
dukungan baik moril maupun materi serta doa yang tak terhingga di setiap
langkah penulis. Tidak ada apapun di dunia ini yang dapat membalas
semua kebaikan, kasih sayang yang telah kalian berikan kepada anakmu,
semoga Allah senantiasa memberikan kesehatan, perlindungan,
keberkahan kepada kedua orangtua hamba tercinta.
7. Kakakku tersayang Adnes Sandi Ahmad dan Adikku tersayang Shindy
Nurjannah yang dengan sabar dan ikhlas telah meluangkan waktu dan
tenaganya untuk membantu penulis.
8. Teman temanku tersayang, Yeyet Durotul Yatimah, Mayta Ravika, Annisa
Nur Fitriani, Auva Marwah Murod, Salsabiela Dwi dan Myra Kharisma
atas kebersamaan, semangat dan dukungannya yang telah banyak
membantu dan memotivasi penulis.
9. Teman seperjuangan sepenelitian Jaga Paramudita dan Julia Anggraini,
terimakasih atas bantuan, motivasi dan kebersamaannya selama penelitian.
10.Teman-teman seperjuangan Farmasi Angkatan 2010, Andalusia yang telah
saling mendukung, mengisi keceriaan dan memberi semangat selama
proses perkuliahan sampai menyelesaikan skripsi ini.
11.Semua pihak yang telah membantu selama penelitian dan penyelesaian
skripsi baik secara langsung maupun tidak langsung yang namanya tidak
dapat penulis sebutkan satu persatu.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas semua
bantuan, dan dukungan yang diberikan. Dengan segala kerendahan hati, penulis
menyadari bahwa masih banyak kekurangan dan keterbatasan dalam penyusunan
skripsi ini. Oleh karena itu penulis sangat mengharapkan kritik yang sangat
membangun dari pembaca guna memperbaiki kemampuan penulis.
Ciputat, 2 Juli 2014
HALAMAN JUDUL... 2.1.5 Kandungan Kimia Biji Jarak... 2.1.6 Kegunaan... 2.5. Sistem Reproduksi Hewan Jantan...
2.5.1. Spermatozoa... 2.5.2. Spermatogenesis ... 2.5.3. Perah Hormon pada Spermatogenesis... 2.6. ELISA (Enzym Linked Immunosorbent Assay)...
3.2.4.Alat... 3.4.4.Pengujian Parameter Spesifik dan Non Spesifik... 3.4.4.1. Parameter Spesifik...
BAB 4 HASIL PENELITIAN DAN PEMBAHASAN...
4.1.Hasil Penelitian... 4.1.6. Pengukuran Konsentrasi Hormon Testosteron... 4.1.7.Pengujian Aktivitas Spermisidal... 4.2.Pembahasan...
BAB 5 KESIMPULAN DAN SARAN...
2.1. Komposisi kimia inti biji dan cangkang biji jarak pagar... 9
2.2. Data Biologis tikus... 15
3.1. Perlakuan terhadap kelompok tikus... 29
3.2. Pengenceran yang dilakukan dan kotak yang dihitung... 34
3.3. Cara Pengenceran... 34
3.4. Rumus Konsentrasi Spermatozoa... 34
4.1. Hasil Penapisan Fitokimia Ekstrak Etanol Biji Jarak Pagar... 37
4.2. Parameter Standar ekstrak etanol biji jarak pagar... 38
4.3. Rerata Konsentrasi Spermatozoa tikus... 39
4.4. Konsentrasi Testosteron... 40
4.5. Aktivitas Spermisidal Ekstrak Etanol Biji Jarak Pagar... 41
1. Tanaman, daun, bunga, buah dan biji Jatropha curcas... 7
2. Sistem reproduksi hewan jantan, ventral view... 16
3. Spermatozoa tikus... 18
4. Tahapan pembentukan spermatogenesis... 19
5. Tahapan siklus sel dalam spermatogenesis tikus... 21
6. Mekanisme pengaturan hormon pada spermtogenesis... 23
7. Prinsip ELISA secara langsung... 25
8. Prinsip ELISA secara tidak langsung... 26
9. Grafik hasil rerata konsentrasi spermatozoa... 39
10.Diagram Konsentrasi Testosteron... 40
11.Grafik Aktivitas Spermisidal Ekstrak Biji Jarak Pagar... 42
12.Vacuum Rotary Evaporator (Eyela)... 65
13.Tanur (Thermo Scientific)... 65
14.Botol Maserasi... 65
15.Serbuk Biji Jarak Pagar... 65
16.Freezer (Sanyo) ... 65
17.Oven (Memmert) ... 65
18.Botol Timbang (Pyrex)... 65
19.Kandang tikus, tempat makan dan botol minum... 65
20.Plat Tetes... 65
21.Kurs Silikat... 65
22.Tabung Reaksi (Pyrex)... 65
23.Mikropipet (Wiggen Houser)... 65
24.Tempat Pembiusan... 66
25.Sentrifuge (Eppendrof)... 66
26.Vortex (Wiggenhouser)... 66
27.Mikroskop (Motic)... 66
28.Hemasitometer (Nesco)... 66
29.Kit Elisa (Drg.)... 66
30.Elisa Reader (Biotek)... 66
31.Alat Bedah Minor... 66
32.Papan Bedah...66
33.Tube... 66
34.NaCl Fisiologis ... 66
35.Mikropipet (Eppendrof)...,... 66
36.Larutan George ... 67
37.Larutan Beker’s Buffer... 67
38.Biji Jarak Pagar... 68
39.Serbuk biji jarak pagar... 68
40.Proses maserasi... 68
41.Proses penyaringan maserat... 68
42.Filtrat yang dihasilkan... 68
43.Pemekatan ekstrak dengan vacuum rotary evaporator... 68
44.Ekstrak kental biji jarak pagar... 68
48.Pemberian makan dan minum hewan coba secara ad libitum... 69
49.Pemberian ekstrak secara oral dengan alat sonde oral... 69
50.Pengambilan darah melalui ekor tikus (lateral vein)... 69
51.Darah tikus untuk pengujian konsentrasi testosteron... 69
52.Darah didiamkan selama 24jam agar terbentuk serum... 69
53.Tikus dikorbankan dengan bius eter... 69
54.Pembedahan Tikus ... 69
55.Kauda epididimis tikus... 69
56.Perhitungan konsentrasi spermatozoa di hemasitometer... 69
57.Pengamatan dibawah mikroskop dengan perbesaran 400x... 69
58.Cairan Spermatozoa ditambahkan dengan 1 ml NaCl untuk pengujian aktivitas spermisidal... 69
59.Larutan ekstrak dengan berbagai seri konsentrasi ... 70
60.Pengujian aktifitas spermisidal di hemasitometer... 70
61.Penambahan Larutan Baker’s Buffer pada spermatozoa &ekstrak.. 70
62.Inkubasi spermatozoa... 70
63.Kit ELISA (Drg) Testosteron, plat, standar dan reagennya... 70
64.Sampel serum... 70
65.Standar dimasukkan ke dalam sumuran /well.... 70
66.Sampel dimasukkan ke sumuran... 70
67.Penambahan Substrat Solution ke dalam masing-masing sumuran... 70
68.Inkubasi plat dalam suhu ruang selama 60 menit... 70
69.Setelah diinkubasi, dengan cepat buang seluruh isi sumuran…..…. 70
70.Penambahan Wash Solution (Dilakukan 3kali pengulangan)... 70
71.Penambahan Substrat Solution...... 71
72.Inkubasi plat dalam suhu ruang & ruang tertutup selama 15 menit. 71 73.Penambahan Stop Solution..... 71
74.Plat didiamkan selama 10 menit... 71
1. Hasil Determinasi Tanaman... 62
2. Hasil Penapisan Fitokimia Ekstrak Etanol 70% Biji Jarak Pagar... 63
3. Gambar Bahan dan Alat Penelitian ... 65
4. Kegiatan Penelitian... 68
5. Pemerikasaan Parameter Standar Ekstrak... 72
6. Alur Penelitian... 73
7. Perhitungan Dosis Ekstrak Biji Jarak Pagar... 75
8. Berat Badan Tikus Jantan... 77
9. Hasil Perhitungan Konsentrasi Spermatozoa... 79
10.Hasil Pengujian Konsentrasi Testosteron Serum... 80
11.Hasil Pengujian Aktivitas Spermisidal... 83
12.Analisis Data Konsentrasi Spermatozoa... 85
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Kepadatan penduduk di Indonesia merupakan salah satu
permasalahan yang dihadapi oleh pemerintah yang sampai saat ini belum
dapat diatasi, hal ini disebabkan terus meningkatnya jumlah penduduk
setiap tahunnya. Peningkatan jumlah penduduk semakin lama semakin
mengkhawatirkan karena tidak diimbangi dengan peningkatan
kesejahteraan. Bertambahnya jumlah penduduk tidak saja akan
mempersulit usaha peningkatan dan pemerataan kesejahteraan rakyat
dibidang pangan, tetapi juga lapangan pekerjaan, pendidikan, kesehatan
dan perumahan (Ari Nur Kristanti, 2010). Oleh karena itu pemerintah
menjadikan program Keluarga Berencana (KB) sebagai bagian dari
pembangunan nasional.
Kebijakan pembangunan keluarga berencana masih didominasi oleh
perempuan, karena terbukti baru sekitar 1,1 persen peserta KB pria di
Indonesia. Bahkan dapat dikatakan bahwa meskipun program KB telah
berhasil menurunkan pertumbuhan penduduk, namun belum mampu
meningkatkan derajat kesehatan dan kesejahteraan perempuan.
Berdasarkan Survey Demografi dan Kesehatan Indonesia (SDKI) tahun
2012 Angka Kematian Ibu (AKI) di Indonesia mengalami kenaikan dari
228 kasus kematian per seratus ribu kelahiran hidup pada 2007, menjadi
359 per seratus ribu kelahiran hidup pada 2012. Sesuai dengan target MDG’s (Millenium Development Goals), hasil tersebut masih jauh dari target AKI tahun 2015, yaitu 102 kelahiran per seratus ribu kelahiran
hidup.
Keberhasilan KB sangat terkait dengan penggunaan kontrasepsi.
Kurangnya keterlibatan pria dalam kontrasepsi dapat menyebabkan KB
menjadi kurang efektif. Hal ini terjadi karena masih banyak keraguan
mengenai potensi kontrasepsi pria dan saat ini belum ada produk
reversible, murah dan dapat diterima. Berbagai upaya penelitian telah
dilakukan para peneliti untuk mendapatkan pilihan kontrasepsi pria yang
memenuhi persyaratan (Nuraini, Tuti., Dadang Kusmana dan Efy Afifah,
2012). Menurut Soehadi, K. dan K.M. Arsyad (1983) metode kontrasepsi
pria yang digunakan saat ini, adalah kondom, vasektomi, dan senggama
terputus. Akan tetapi, hasilnya masih belum sepenuhnya diterima
masyarakat, karena memberikan efek samping dan belum 100% dapat
mencegah kehamilan
Usaha untuk memperoleh bahan kontrasepsi pria yang berasal dari
tanaman telah banyak diteliti, tetapi hasilnya belum memuaskan, sehingga
penerapannya ke manusia masih diragukan. Oleh sebab itu pemanfaatan
bahan tanaman masih merupakan prioritas untuk diteliti mengingat bahan
obat-obatan yang berasal dari tanaman mempunyai keuntungan antara lain
toksisitasnya rendah, mudah diperoleh, murah harganya dan kurang
menimbulkan efek samping (Arsyad, K.M. 1986). Berbagai jenis tanaman
sudah diteliti memiliki pengaruh terhadap sistem reproduksi hewan jantan,
sehingga dapat digunakan sebagai bahan kontrasepsi pria.
Tanaman jarak (Jatropha curcas) merupakan tanaman yang
termasuk famili Euphorbiaceae. Tanaman ini memiliki nilai ekonomis
tinggi karena biji yang dihasilkan dapat bermanfaat untuk bahan baku obat
dan penghasil minyak. Menurut Sharma, Shivani., Hitesh K.D. dan Bharat
P. (2012) tanaman jarak pagar (Jatropha curcas) memiliki berbagai
aktivitas farmakologi diantaranya biji tanaman jarak digunakan untuk
pengobatan arthritis, asam urat dan sebagai kontrasepsi. Hasil eksplorasi
etnomedikal juga telah mendokumentasikan bahwa biji jarak pagar
memiliki efek sebagai antifertilitas (Kamal, Sachdeva., Singhal Manmohan
dan Srivastava Birendra. 2011; Abdulhamid, A et al. 2013)
Secara empiris dilaporkan bahwa beberapa negara seperti Kamboja,
Vietnam dan India telah menggunakan biji jarak sebagai bahan yang dapat
menyebabkan aborsi, sedangkan di Sudan biji jarak digunakan sebagai
bahan kontrasepsi. Senyawa yang terdapat pada biji jarak yang berpotensi
Brewis, 1999 yang dikutip dari Sinthia, P dan Sunarno. 2007). Penelitian
dari Sinthia, P dan Sunarno (2007) menyatakan bahwa pemberian serbuk
biji jarak secara peroral dengan dosis 0,2 g/ekor/hari pada mencit dengan
lama perlakuan 14 hari menunjukkan bahwa efek antifertilitas pada biji
jarak belum memberikan pengaruh yang signifikan terhadap perubahan
profil uterus, baik berat uterus maupun tebal endometrium. Buah dari
tanaman jarak pagar juga mampu menurunkan motilitas dan jumlah
sperma serta memiliki aktivitas sebagai abortivum (Shweta, Gediya.,
Ribadiya Chetna, Soni Jinkal, Shah Nancy dan Jain Hitesh. 2012).
Kandungan kimia yang terkandung dalam biji jarak pagar adalah
asam lemak, sterol, campesterol, stigmasterol, beta-sitosterol,
delta5-avenasterol. Beta-sitosterol merupakan komponen terbesar yang
terkandung dalam biji jarak pagar (Debnath, Mousumi dan P.S.
Bisen,2008). Senyawa beta-sitosterol termasuk dalam golongan senyawa
sterol pada tumbuhan/fitosterol. Senyawa sterol merupakan turunan dari
senyawa steroid.
Penelitian tentang tanaman jarak yang berpotensi sebagai
antifertilitas ini dilakukan sebagai lanjutan dari penelitian yang telah
dilakukan oleh Widya Dwi Arini (2012) untuk melihat efek antifertilitas
dari ekstrak etanol 70% biji jarak pagar (Jatropha curcas) secara in vivo.
Pemberian ekstrak etanol biji jarak pagar dengan dosis 5mg/kg BB,
25mg/kg BB, dan 50mg/kgBB selama 48 hari pada tikus jantan dapat
menurunkan spermatozoa, bobot testis dan diameter tubulus seminiferus
secara bermakna secara statistik jika dibandingkan dengan hewan kontrol.
Selain itu juga pemberian ekstrak dengan dosis 5mg/kg BB, 25mg/kg BB,
dan 50mg/kgBB selama 48 hari pada tikus jantan dapat mempengaruhi
proses spermatogenesis yang diindikasikan dengan penurunan jumlah
spermatosit dan jumlah sel sertoli.
Uraian diatas kemudian melatarbelakangi penulis untuk melanjutkan
pengujian antifertilitas yang belum dilakukan oleh peneliti sebelumnya.
Pengujian dilakukan untuk melihat pengaruh ekstrak etanol 70% biji jarak
pada tikus jantan galur Sprague-Dawley secara in vivo dan pengujian
aktivitas spermisidal pada tikus jantan galur Sprague-Dawley secara in
vitro. Dilakukan juga pengujian konsentrasi spermatozoa untuk
memastikan bahwa penelitian yang dilakukan dengan menggunakan
tanaman dan dosis yang sama akan sama hasilnya dengan penelitian yang
dilakukan oleh Widya Dwi Arini (2012).
1.2. Rumusan Masalah
Berdasarkan latar belakang yang telah dipaparkan diatas maka dapat
diambil rumusan masalah sebagai berikut :
Apakah ada pengaruh pemberian ekstrak etanol 70% dari biji jarak pagar (Jatropha curcas) terhadap konsentrasi testosteron pada tikus
jantan galur Sprague-Dawley secara in vivo ?
Apakah ada pengaruh pemberian ekstrak etanol 70% dari biji jarak
pagar (Jatropha curcas) terhadap aktivitas spermisidal pada tikus
jantan galur Sprague-Dawley secara in vitro ?
1.3. Tujuan Penelitian
Penelitian uji antifertilitas ekstrak etanol 70% biji jarak pagar
(Jatropha curcas) pada tikus jantan galur Sprague-Dawley, bertujuan
untuk :
Menguji aktivitas ekstrak etanol 70% dari biji jarak pagar (Jatropha
curcas) terhadap konsentrasi testosteron pada tikus jantan galur
Sprague-Dawley secara in vivo.
Menguji aktivitas ekstrak etanol 70% dari biji jarak pagar (Jatropha
curcas) terhadap aktivitas spermisidal pada tikus jantan galur
Sprague-Dawley secara in vitro.
1.4. Hipotesis
Hipotesis dari penelitian uji antifertilitas ekstrak etanol 70 % biji
jarak pagar (Jatropha curcas) pada tikus jantan galur Sprague-Dawley
Pemberian ekstrak etanol 70% dari biji jarak pagar (Jatropha curcas)
dapat menurunkan kadar testosteron pada tikus jantan galur
Sprague-Dawley secara in vivo.
Pemberian ekstrak etanol 70% dari biji jarak pagar (Jatropha curcas) dapat mempengaruhi aktivitas spermisidal pada tikus jantan galur
Sprague-Dawley secara in vitro.
1.4.1. Manfaat Penelitian
Memberikan informasi kepada masyarakat, tentang manfaat biji
jarak pagar (Jatropha curcas) sebagai agen antifertilitas yang telah
dibuktikan dengan pemberian pada tikus jantan galur Sprague-Dawley,
yang diharapkan dapat menjadi landasan ilmiah untuk dikembangkan
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Jarak Pagar
2.1.1 Klasifikasi
Menurut National Plant Data Centre, Natural Research
Concervation Service, United State Department of Agriculture klasifikasi
tanaman jarak pagar berdasarkan ilmu taksonomi adalah,
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivision : Spermatophyta
Division : Magnoliophyta
Class : Magnoliopsida
Subclass : Rosidae
Order : Euphorbiales
Family : Euphorbiaceae
Genus : Jatropha L.
Species : Jatropha curcas L.
2.1.2 Nama Lokal
Nama daerah: nawaih nawas (Nangroe Aceh Darussalam), jirak
(Sumatra Barat), jarak kosta, jarak kusta, jarak budeg, dan kalake pagar
(Sunda), jarak gundul dan jarak pager (Jawa), kalekhe paghar (Madura),
jarak pageh (Bali), paku luba dan jarak pageh (Nusa Tenggara), paku kase
(Timor), jarak kosta, jarak wolanda, dan bindalo (Sulawesi), bintalo
(Gorontalo), balacai (Manado), tangang kali atau
tangang-tangang kanjoli (Makassar), muun mav, ai hua kamaalo, jai huakamalo,
balacai, dan kadoto (Maluku), malate dan makamale (Seram), balacai
(Halmahera)(Prihandana dan Hendroko, 2006).
2.1.3 Morfologi
Tanaman jarak pagar merupakan tanaman dengan tinggi 1-7 m,
bercabang tidak teratur. Batangnya berkayu, silindris, dan bila terluka
Bagian-bagian jarak pagar (Hambali et al. 2007) antara lain :
a) Daun. Daun tanaman jarak pagar adalah daun tunggal berlekuk dan
bersudut 3 atau 5. Daun tersebar di sepanjang batang. Permukaan atas
dan bawah daun berwarna hijau dengan bagian bawah lebih pucat
dibanding permukaan atas. Daunnya lebar dan berbentuk jantung atau
bulat telur melebar dengan panjang 5- 15 cm.
b) Bunga. Bunga tanaman jarak pagar adalah bunga majemuk, berwarna
kuning kehijauan. Bunganya mempunyai 5 kelopak berbentuk bulat
telur dengan panjang kurang lebih 4 mm. Setiap tandan terdapat lebih
dari 15 bunga.
c) Buah. Buah tanaman jarak pagar berbentuk bulat telur dengan diameter
2 – 4 cm. Panjang buah 2 cm dengan ketebalan sekitar 1 cm. Buah berwarna hijau ketika muda serta abu – abu kecoklatan atau kehitaman ketika masak. Buah jarak terbagi menjadi 3 ruang, masing – masing ruang berisi 1 biji sehingga dalam setiap buah terdapat 3 biji.
Gambar 1. Tanaman, daun, bunga, buah dan biji Jatropha curcas L
2.1.4 Ekologi dan Penyebaran
Tanaman jarak pagar merupakan tanaman dikotil yang berasal dari
Amerika Tengah dan saat ini telah tersebar di berbagai tempat di Afrika
dan Asia. Tanaman ini dapat tumbuh di berbagai daerah dengan cuaca
yang beragam, dari daerah tropis yang sangat kering sampai subtropis
lembab maupun daerah hutan basah (Nurcholis, M. dan Sumarsih. S.
2007).
Genus Jatropha dari famili Euphorbiaceae ini memiliki kira-kira
175 spesies di dunia. Tanaman dari famili Euphorbiaceae ini banyak
ditemukan di Afrika Tengah dan Selatan, Asia Tenggara dan India.
Awalnya tanaman ini penyebarannya kemungkinan dilakukan oleh pelaut
Portugis dari Karibia melalui pulau Cape Verde dan Guinea Bissau ke
negara lain di Afrika dan Asia (Syah, A.N.A. 2006)
Tanaman jarak pagar mudah beradaptasi terhadap lingkungan
tempat tumbuhnya, lingkungan tumbuh yang optimal bagi pertumbuhan
tanaman jarak pagar, yaitu pada ketinggian 0 – 2000 m di atas permukaan laut, suhu berkisar antara 18o–30oC. Jarak pagar dapat tumbuh pada tanah yang kurang subur, tetapi memiliki sistem pengairan yang baik, tidak
tergenang, dan pH tanah 5.0 – 6.5 (Hambali et al. 2007).
2.1.5 Kandungan Kimia Biji Jarak
Biji jarak pagar rata-rata berukuran 18 x 11 x 9 mm, berat 0,62
gram, dan terdiri atas 58,1 % biji inti berupa daging (kernel) dan 41,9 %
kulit. Kadar minyak trigliseriddalam inti biji sama dengan 55% atau 33%
dari berat total biji. Asam lemak penyusun minyak jarak pagar terdiri atas
22,7% asam jenuh dan 77,3% asam tak jenuh. Kadar asam lemak minyak
terdiri dari 17,0% asam palmiat, 5,6 % asam stearat, 37,1 % asam oleat,
dan 40,2 % asam linoleat (Brodjonegoro, Rekksowardjojo, Soerawidjaja,
2006 yang dikutip dalam Nugroho, Adi. 2008).
Kandungan kimia yang terkandung dalam biji jarak pagar adalah
asam lemak, sterol, campesterol, stigmasterol, beta-sitosterol,
delta5-avenasterol. Beta-sitosterol merupakan komponen terbesar yang
Bisen,2008). Senyawa beta-sitosterol termasuk dalam golongan senyawa
sterol pada tumbuhan/fitosterol. Senyawa sterol merupakan turunan dari
senyawa steroid.
Biji jarak pagar dapat dipisahkan bagian daging dan cangkang.
Bagian daging mencapai 60-62,7% dari bagian biji. Komposisi kimia inti
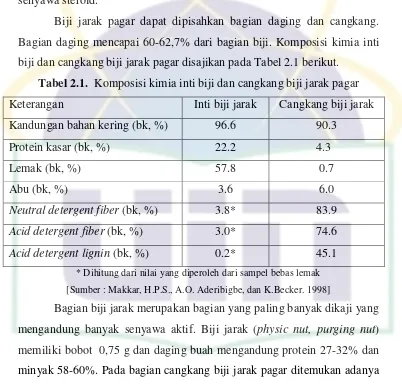
biji dan cangkang biji jarak pagar disajikan pada Tabel 2.1 berikut.
Tabel 2.1. Komposisi kimia inti biji dan cangkang biji jarak pagar
Keterangan Inti biji jarak Cangkang biji jarak
Kandungan bahan kering (bk, %) 96.6 90.3
Protein kasar (bk, %) 22.2 4.3
Lemak (bk, %) 57.8 0.7
Abu (bk, %) 3.6 6.0
Neutral detergent fiber (bk, %) 3.8* 83.9
Acid detergent fiber (bk, %) 3.0* 74.6
Acid detergent lignin (bk, %) 0.2* 45.1
* Dihitung dari nilai yang diperoleh dari sampel bebas lemak [Sumber : Makkar, H.P.S., A.O. Aderibigbe, dan K.Becker. 1998]
Bagian biji jarak merupakan bagian yang paling banyak dikaji yang
mengandung banyak senyawa aktif. Biji jarak (physic nut, purging nut)
memiliki bobot 0,75 g dan daging buah mengandung protein 27-32% dan
minyak 58-60%. Pada bagian cangkang biji jarak pagar ditemukan adanya
aktivitas penghambat tripsin, lektin, saponin, sedangkan ester forbol
ditemukan pada bagian daging biji jarak. Senyawa curcin dan ester forbol
yang merupakan senyawa racun dan antinutrisi paling banyak ditemukan
pada bagian biji.
2.1.6. Kegunaan
Olahan dari semua bagian tanaman jarak pagar (Jatropha curcas)
termasuk biji, daun dan kulit kayu segar atau sebagai rebusan digunakan
dalam pengobatan tradisional. Minyak dari biji memiliki aktivitas sebagai
pencahar yang kuat dan juga banyak digunakan untuk penyakit kulit serta
untuk meredakan rasa sakit seperti yang disebabkan oleh rematik. Getah
luka. Rebusan dari daun digunakan untuk pengobatan batuk dan sebagai
antiseptik setelah kelahiran (Heller,J. 1996).
Tanaman ini memiliki nilai ekonomis tinggi karena biji yang
dihasilkan dapat bermanfaat untuk bahan baku obat dan penghasil minyak.
Menurut Sharma, Shivani., Hitesh K.D., Bharat P. (2012) tanaman jarak
pagar (Jatropha curcas) memiliki berbagai aktivitas farmakologi
diantaranya biji tanaman jarak digunakan untuk pengobatan arthritis, asam
urat dan sebagai kontrasepsi. Sedangkan bagian akar dari tanaman jarak
yang mengandung japodargin dan japodagrone menunjukkan aktivitas
antibakteri dengan menghambat secara aktif bakteri Bacillus subtilis dan
Shapylococcus aureus. Selain itu secara ilmiah dilaporkan bahwa ekstrak
etanol 50% dari daun tanaman jarak mempunyai aktivitas antidiabetes
pada tikus diabetes yang diinduksi aloksan. Ekstrak metanol dari jarak
pagar juga menunjukkan aktivitas antiinflamasi yang diinduksi oleh
karaginan pada tikus dan aktivitas anti diare pada mencit albino. Secara
empiris dilaporkan bahwa beberapa negara seperti, Kamboja, Vietnam dan
India telah menggunakan biji jarak sebagai bahan yang dapat
menyebabkan aborsi, sedangkan di Sudan telah menggunakan biji jarak
sebagai bahan kontrasepsi. Senyawa yang terdapat pada biji jarak yang
berpotensi sebagai agensia antifertilitas dikenal dengan nama jatrophone
(Cambie and Brewis, 1999 yang dikutip dari Sinthia, P dan Sunarno.
2007).
2.2 Simplisia dan Ekstrak
2.2.1 Simplisia
Simplisia tumbuhan obat merupakan bahan baku pada proses
pembuatan ekstrak, baik sebagai bahan obat ataupun produk. Dalam buku
Materia Medika Indonesia (MMI) ditetapkan definisi bahwa simplisia
adalah bahan alamiah yang dipergunakan sebagai obat yang belum
mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa
bahan yang telah dikeringkan. Simplisia dibedakan menjadi simplisia
adalah simplisia yang berupa tumbuhan utuh, bagian tumbuhan atau
eksudat tumbuhan. Eksudat tumbuhan ialah isi sel yang secara spontan
keluar dari tumbuhan atau isi sel yang dengan cara tertentu dikeluarkan
dari selnya atau senyawa nabati lainnya yang dengan cara tertentu
dipisahkan dari tumbuhannya dan belum berupa senyawa kimia murni
(Depkes RI,2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan
mengekstraksi senyawa aktif dari simplisia nabati ataupun hewani dengan
menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan
sedemikian hingga memenuhi baku yang telah ditetapkan (Depkes RI,
2000).
2.3 Ekstraksi
Ekstraksi merupakan penarikan kandugan kimia yang terdapat
dalam simplisia. Karena di dalam simplisia mengandung senyawa aktif
berbeda-beda dan mempunyai struktur kimia yang berbeda-beda, sehingga
metode di dalam penarikan senyawa aktif dalam simplisia harus
memperhatikan faktor seperti: udara, suhu, cahaya, logam berat. Pada
proses ekstraksi dapat melalui tahap-tahap yaitu: pembuatan serbuk,
pembasahan, penyarian, dan pemekatan (Depkes RI 2000).
2.3.1 Cara Dingin
a) Maserasi
Maserasi merupakan proses ekstraksi simplisia dengan menggunakan
pelarut dengan menggunakan beberapa kali pengocokan atau
pengadukan pada temperatur ruangan. Secara teknologi termasuk
ekstraksi dengan prinsip metode pencapaian konsentrasi pada
keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang
kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan
penambahan pelarut setelah dilakukan penyaringan maserat pertama,
b) Perkolasi
Perkolasi merupakan proses ekstraksi simplisia dengan menggunakan
pelarut yang selalu baru sampai sempurna yang umumnya dilakukan
pada temperatur ruangan. Proses terdiri dari tahapan pengembangan
bahan, tahap maserasi antara, tahap perkolasi sebenanya (penetesan
atau penampungan ekstrak), terus menerus sampai diperoleh ekstrak
(perkolat) yang jumlahnya 1-5 kali bahan (Depkes RI, 2000).
2.3.2. Cara Panas
a) Refluks
Refluks merupakan ekstraksi simplisia menggunakan pelarut
berdasarkan titik didihnya, selama waktu tertentu yang jumlah pelarut
terbatas yang relatif konstan dengan adanya pendingin balik.
Umumnya dilakukan pengulangan proses pada residu pertama sampai
3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Depkes
RI, 2000).
b) Sokletasi
Sokletasi merupakan ekstraksi simplisia menggunakan pelarut yang
selalu baru yang umumnya dilakukan menggunakan alat khusus
sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif
konstan dengan adanya pendinginan balik (Depkes RI, 2000).
c) Digesti
Digesti merupakan maserasi kinetik pada temperatur yang lebih tinggi
dari temperatur ruangan (kamar), biasanya dilakukan pada temperatur
40-50⁰C. (Depkes RI, 2000). d) Infus
Infus merupakan ekstraksi simplisia menggunakan pelarut air pada
temperatur penangas air (bejana infus tercelup dalam penangas air
mendidih, temperatur terukur (96-98⁰C) selama waktu tertentu (15-20 menit) (Depkes RI, 2000).
e) Dekok
2.3.3. Destilasi Uap
Destilasi uap merupakan ekstraksi senyawa kandungan menguap
atau minyak atsiri dari bahan (segar atau simplisia) dengan uap air
berdasarkan peristiwa tekanan parsial senyawa kandungan menguap
dengan fase uap air dari ketel secara kontinyu sampai sempurna yang di
akhiri dengan kondensasi fasa uap campuran (senyawa kandungan
menguap ikut terdestilasi) menjadi destilat air bersama senyawa
kandungan yang memisah sempurna atau memisah sebagian.
Destilasi uap, bahan (simplisia) benar-benar tidak tercelup ke
dalam air yang mendidih, namun dilewati uap air sehingga senyawa
kandungan menguap ikut terdestilasi. Destilasi uap dan air, bahan
(simplisia) bercampur sempurna atau sebagian dengan air mendidih,
senyawa kandungan menguap tetap kontinyu ikut terdestilasi (Depkes RI,
2000).
2.3.4. Cara Ekstraksi Lainnya
a) Ekstraksi berkesinambungan
Ekstraksi berkesinambungan merupakan proses ekstraksi yang
dilakukan berulang kali dengan pelarut yang berbeda atau resirkulasi
cairan pelarut dan prosesnya tersusun berurutan beberapa kali. Proses
ini dilakukan untuk meningkatkan efisiensi (jumlah pelarut) dan
dirancang dalam jumlah besar dan terbagi dalam beberapa bejana
ekstraksi (Depkes RI, 2000).
b) Super kritikal karbondioksia
Penggunaan super kritik untuk ekstraksi serbuk simplisia, dan
umumnya digunakan gas karbondioksida dengan variabel tekanan dan
temperatur akan diperoleh spesifikasi kondisi polaritas tertentu yang
sesuai untuk melarutkan golongan senyawa kandungan tertentu.
Penghilangan cairan pelarut dengan mudah dilakukan karena
karbondioksida menguap dengan mudah, sehingga hampir langsung
c) Ekstraksi ultrasonik
Getaran ultrasonik (> 20000 Hz) memberikan efek pada proses
ekstraksi dengan prinsip meningkatkan permeabilitas dinding sel,
menimbulkan gelembung spontan (cavitation) sebagai stres dinamik
serta menimbulkan ekstrak interfase. Hasil ekstraksi tergantung pada
frekuensi getaran, kapastas alat dan lama proses ultrasonikasi (Depkes
RI, 2000).
d) Ekstraksi energi listrik
Energi listrik digunakan dalam bentuk medan listrik, medan magnet serta “elektik-dischagres” yang dapat mempercepat proses dan meningkatkan hasil dengan prinsip menimbulkan gelembung spontan
dan menyebarkan gelombang ultrasonik (Depkes RI, 2000).
2.4 Karakteristik Tikus
2.4.1 Klasifikasi Tikus Putih (Rattus norvegicus)
Menurut Krinke, G.J. (2000), klasifikasi tikus putih (Rattus
norvegicus) adalah sebagai berikut :
Kingdom : Animalia
Phylum : Chordata
Subphylum : Veterbrata
Class : Mammalia
Ordo : Rodentia
Family : Muridae
Subfamily : Murinae
Genus : Rattus
Species : Rattus norvegicus
2.4.2 Biologis Tikus Putih (Rattus norvegicus)
Tikus digolongkan ke dalam ordo rodentia (hewan pengerat),
famili Muridae dari kelompok mamalia. Ordo rodentia merupakan ordo
dari kelas mamalia yang terbesar yaitu 40% dari 5000 spesies mamalia.
lingkungannya, baik saat cuaca dingin maupun panas. Tiga galur atau
varietas tikus yang biasa digunakan sebagai hewan percobaan yaitu galur
Sprague-Dawley yang memiliki kepala kecil, berwarna albino putih dan
ekornya lebih panjang dari badannya. Galur Wistar memiliki telinga yang
panjang, kepala yang lebar, dan ekor yang tidak sama panjang seperti
tubuhnya. Galur Long Evans yang lebih kecil dari tikus putih dan memiliki
warna hitam pada kepala dan tubuh bagian depan (Smith,
Mangkoewidjojo, S. 1987).
Tikus putih (Rattus norvegicus) sering digunakan pada berbagai
macam penelitian karena tikus ini memiliki kemampuan reproduksi yang
tinggi, murah serta mudah untuk mendapatkannya. Ada dua sifat yang
membedakan tikus dari hewan percobaan lain, yaitu tikus tidak dapat
muntah karena struktur anatomi yang tidak lazim pada tempat esofagus
bermuara ke dalam lambung dan tikus tidak mempunyai kantung empedu.
Kelompok tikus putih pertama-tama dikembangkan di Amerika Serikat
antara tahun 1887-1897. Keunggulan tikus putih dibandingkan dengan
tikus liar antara lain lebih cepat berkembang biak. Kelebihan lainnya
sebagai hewan laboratorium adalah sangat mudah ditangani, dapat
ditinggal sendirian dalam kandang asal dapat mendengar suara tikus lain
dan berukuran cukup besar sehingga memudahkan pengamatan (Smith,
Mangkoewidjojo, S. 1987). Adapun data biologis tikus sebagai berikut :
2.5. Sistem Reproduksi Hewan Jantan
Sistem reproduksi hewan jantan terdiri atas testis, epididimis,
duktus deferens, kelenjar aksesori (kelenjar vesikulosa, prostat dan
bulbouretralis), uretra dan penis. Testis dari tikus jantan terdapat pada dua
kantung skrotum yang dipisahkan oleh membran tipis yang terletak antara
anus dan preputium. Testis terdiri dari tubulus seminiferus yang panjang
dan berkelok-kelok, yang pada epitelnya merupakan tempat
berlangsungnya spermatogenesis. Ujung dari tubulus seminiferus ini
kemudian bermuara menuju epididimis. Epididimis terdiri dari tiga bagian
yaitu kapus epididimis yang membesar di ujung proksimal pada testis,
yang hampir seluruhnya terbenam ke dalam lemak; korpus epididimis
yang terdapat di sekitar dorsomedial testis serta kauda epididimis pada
ujung distal testis, merupakan tempat pematangan spermatozoa yang
kemudian bermuara ke vas deferens (Suckow, 2006).
Gambar 2. Sistem reproduksi hewan jantan, ventral view
Pada hewan yang melakukan fertilisasi secara interna organ
reproduksinya dilengkapi dengan adanya organ kopulatori, yaitu suatu
organ yang berfungsi menyalurkan spermatozoa dari organisme jantan ke
betina. Peranan hewan jantan dalam hal reproduksi terutama adalah
memproduksi spermatozoa dan sejumlah kecil cairan untuk
memungkinkan sel spermatozoa masuk menuju rahim. (William, O. R.
2005).
Tikus memiliki lima pasang kelenjar seks aksesori yang terletak
didalam panggul dan yang mengelilingi kandung kemih (Gambar 2) yaitu
kelenjar dari duktus deferens; dua pasang kelenjar prostat, yang berada
pada bagian dorsal dan ventral dari duktus deferens; sepasang kelenjar
vesikular yang berbentuk sabit besar dan berbentuk convulted, serta satu
pasang kelenjar koagulasi yang terdapat dalam kelenjar vesikular.
Sepasang kelenjar bolbourethralis yang berada pada otot bolboglandular
(Suckow, 2006).
Testis memiliki dua fungsi, yaitu sebagai tempat spermatogenesis
dan produksi androgen. Oleh sebab itu, testis dapat juga dikatakan sebagai
kelenjar ganda karena secara fungsional bersifat endokrin dan juga
eksokrin. Fungsi endokrin terletak pada sel Leydig yang menghasilkan
androgen, terutama testosteron. Fungsi eksokrin terletak pada epitelium
seminiferus yang menghasilkan spermatozoa (Fawcett, D.W. 2002).
Spermatogenesis terjadi dalam suatu struktur yang disebut tubulus
seminiferus. Tubulus ini berlekuk-lekuk dalam lobus yang semuanya
duktusnya kemudian meninggalkan testis dan masuk ke dalam epididimis.
Produksi androgen terjadi dalam kantung dari sel khusus yang terdapat di
daerah interstitial antara tubulus. Tubulus seminiferus dilapisi oleh
epitelium yang dilapisi oleh epitelium bertingkat yang sangat kompleks
yang mengadung sel spermatogenik dan sel-sel yang menunjang. Sel-sel
penunjang berjenis tunggal disebut sel sertoli (Heffner, L.J. dan Schust,
D.J. 2005).
Tubulus seminiferus dikelilingi oleh membran basal. Didekat
Epitel yang mengandung spermatozoa yang sedang berkembang
disepanjang tubulus disebut epitel seminiferus atau epitel germinal. Pada
potongan melintang testis, spermatosit dalam tubulus berada dalam
berbagai tahap pematangan. Diantara spermatosit terdapat sel sertoli. Sel
ini secara metabolik dan struktural berguna untuk menjaga spermatozoa
yang sedang berkembang. Sel sertoli memiliki jari-jari sitoplasma yang
besar dan kompleks yang dapat mengelilingi banyak spermatozoa dalam
suatu waktu. Sel ini juga berfungsi pada proses merubah prekusor
androgen menjadi estrogen, suatu produk yang menghasilkan pengaturan
umpan balik lokal pada sel leydig yang memproduksi androgen. Selain itu,
sel sertoli juga menghasilkan protein pengikat androgen (Heffner, L.J. dan
Schust, D.J. 2005).
2.5.1 Spermatozoa
Proses produksi spermatozoa di dalam testis disebut
spermatogenesis. Spermatozoa pada hewan pengerat lebih panjang dari
spesies mamalia lain, termasuk mamalia dan hewan domestik pada
umumnya (Krinke,G.J. 2000). Kepala sperma pada tikus berbentuk seperti
kait (Gambar 3).
Keterangan : a) Kepala (berbentuk kait), b) bagian tengah, c) ekor Gambar 3. Spermatozoa tikus
(Sumber: RR Alvira Wijaya, 2012). 2.5.2 Spermatogenesis
Dasar pengetahuan yang cukup telah dibangun tentang
spermatogenesis pada tikus. Sel primodial germinal yang telah berhenti
bermigrasi diliputi oleh sel Sertoli dan membran basal yang menonjol
jantan tetap tidak aktif sampai sebelum masa pubertas, yaitu sekitar 50 hari
setelah kelahiran. Pada tahap itu mereka mulai membelah dan menjadi
spermatogonium, dan kemudian terus membelah sampai hewan kehilangan
kemampuan untuk memproduksi spermatozoa (Krinke,G.J. 2000).
Spermatogenesis merupakan proses pembentukan spermatozoa.
Proses ini dimulai dengan sel benih primitif, yaitu spermatogonium. Pada
saat terjadinya perkembangan sel kelamin, sel ini mulai mengalami
mitosis, dan menghasilkan generasi sel-sel yang baru. Sel-sel ini dapat
terus membelah sebagai sel induk, yang disebut spermatogonium tipe A,
atau dapat berdeferensiasi selama siklus mitosis yang progresif menjadi
spermatogonium B. Spermatogonium B merupakan sel progenitor yang
akan berdeferensiasi menjadi spermatosit primer. Segera setelah
terbentuk, sel-sel ini memasuki tahap profase dari pembelahan meiosis
pertama. Spermatosit primer merupakan sel terbesar dalam garis
keturunan spermatogenik ini dan ditandai dengan adanya kromosom
dalam berbagai tahap proses penggelungan di dalam intinya (Fawcett,
Gambar 4. Tahapan pembentukan spermatogenesis (Sumber: Junqueira, L. C., Jose Carneiro dan Robert O. K, 2007).
Dari pembelahan meiosis pertama ini timbul sel berukuran lebih
kecil yang disebut spermatosit sekunder. Spermatosit sekunder sulit
diamati dalam sediaan testis karena merupakan sel berumur pendek dan
berada dalam tahap interfase yang sangat singkat dan dengan cepat
memasuki pembelahan meiosis kedua. Pembelahan spermatosit
sekunder menghasilkan spermatid. Karena tidak ada fase-S (sintesis DNA)
yang terjadi antara pembelahan meiosis pertama dan kedua pada
spermatosit, jumlah DNA per sel berkurang setengah selama pembelahan
kedua ini, yang menghasilkan sel haploid (n). Oleh karena itu, proses
meiosis menghasilkan sel dengan jumlah kromosom haploid. Dengan
adanya pembuahan, sel memperoleh kembali jumlah diploid yang normal
(Junqueira, L. C., Jose Carneiro dan Robert O. K. 2007).
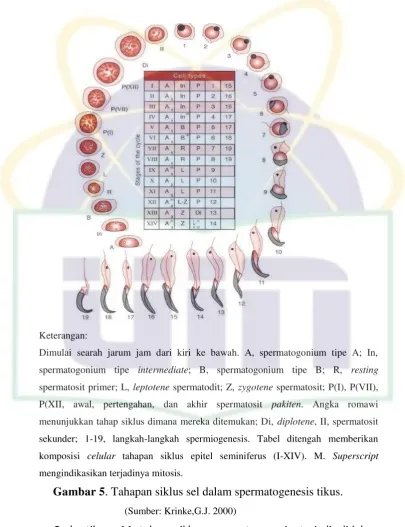
Spermatogonium secara kasar diklasifikasikan menjadi tiga jenis:
Jenis A, intermediate dan B (Gambar 5). Pada tikus, spermatogonium
kemudian mengalami enam kali mitosis, dan kemudian menjadi
sermatosit preleptotene. Spermatosit kemudian berada dalam fase
meiosis menjadi spermatosit sekunder leptotene, zygotene dan pakiten.
Setiap spermatosit akan membelah menjadi empat spermatid haploid,
yang mengalami spermiogenesis menjadi: spermatid fase golgi (1-3),
terdapatnya granul kromosom; fase cap (4-7), adanya head cap pada
granul akrosom yang membesar dan menutupi 1/3 bagian nukleus; fase
akrosom (8-14), nukleus dan head cap memanjang; fase maturasi (15-18)
nukleusnya menjadi lebih pendek dan sitoplasma terkondensasi di
sepanjang ekor yang telah mulai memanjang; hingga dihasilkan
spermatozoa (19) yang dilepaskan ke lumen dengan ekor menghadap ke
Keterangan:
Dimulai searah jarum jam dari kiri ke bawah. A, spermatogonium tipe A; In, spermatogonium tipe intermediate; B, spermatogonium tipe B; R, resting spermatosit primer; L, leptotene spermatodit; Z, zygotene spermatosit; P(I), P(VII), P(XII, awal, pertengahan, dan akhir spermatosit pakiten. Angka romawi menunjukkan tahap siklus dimana mereka ditemukan; Di, diplotene, II, spermatosit sekunder; 1-19, langkah-langkah spermiogenesis. Tabel ditengah memberikan komposisi celular tahapan siklus epitel seminiferus (I-XIV). M. Superscript mengindikasikan terjadinya mitosis.
Gambar 5. Tahapan siklus sel dalam spermatogenesis tikus.
(Sumber: Krinke,G.J. 2000)
Pada tikus, 14 tahap siklus spermatogenesis terjadi didalam
tubulus seminifeus. Tubulus memiliki pengaturan bertahap dan setiap
bagian dari tubulus menunjukkan tahapan yang melibatkan empat atau
lima generasi dari sel germinal yang selaras (Gambar 5). Pada tikus,
dibutuhkan waktu selama 12 hari untuk menyelesaikan satu siklus yang
terdiri dari 14 tahapan. Sebuah spermatogonium tikus membutuhkan
diperlukan waktu 48 hari untuk menyelesaikan langkah spermatogenesis
secara keseluruhan (Krinke,G.J. 2000).
2.5.3 Peran Hormon pada Spermatogenesis
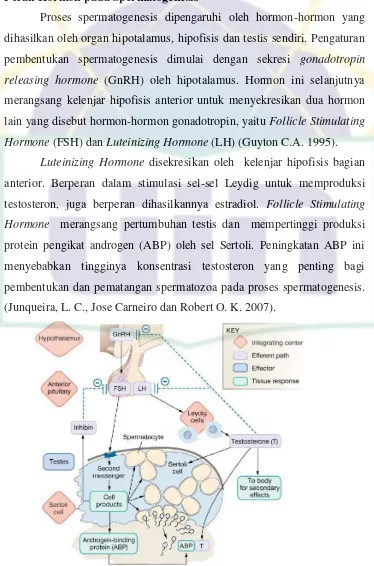
Proses spermatogenesis dipengaruhi oleh hormon-hormon yang
dihasilkan oleh organ hipotalamus, hipofisis dan testis sendiri. Pengaturan
pembentukan spermatogenesis dimulai dengan sekresi gonadotropin
releasing hormone (GnRH) oleh hipotalamus. Hormon ini selanjutnya
merangsang kelenjar hipofisis anterior untuk menyekresikan dua hormon
lain yang disebut hormon-hormon gonadotropin, yaitu Follicle Stimulating
Hormone (FSH) dan Luteinizing Hormone (LH) (Guyton C.A. 1995).
Luteinizing Hormone disekresikan oleh kelenjar hipofisis bagian
anterior. Berperan dalam stimulasi sel-sel Leydig untuk memproduksi
testosteron, juga berperan dihasilkannya estradiol. Follicle Stimulating
Hormone merangsang pertumbuhan testis dan mempertinggi produksi
protein pengikat androgen (ABP) oleh sel Sertoli. Peningkatan ABP ini
menyebabkan tingginya konsentrasi testosteron yang penting bagi
pembentukan dan pematangan spermatozoa pada proses spermatogenesis.
(Junqueira, L. C., Jose Carneiro dan Robert O. K. 2007).
Gambar 6. Mekanisme pengaturan hormon pada spermtogenesis
Sistem pengaturan umpan balik negatif beroperasi terus menerus
untuk mengatur dengan tepat kecepatan sekresi testosteron. Hipotalamus
mensekresi GnRH yang merangsang kelenjar hipofisis anterior untuk
mensekresi LH. Sebaliknya LH merangsang hyperplasia sel-sel leydig
testis dan memproduksi testosteron. Testosteron memberikan umpan balik
negatif ke hipotalamus, untuk menghambat produksi GnRH sehingga
membatasi kecepatan pembentukan testosteron (Grohol J.M. 2006).
Testosteron dihasilkan oleh sel interstitial leydig bila testis
dirangsang oleh LH dari kelenjar hipofisis, dan jumlah testosteron yang
disekresi kira-kira sebanding dengan jumlah LH yang tersedia, sedangkan
FSH berfungsi untuk merangsang pertumbuhan testis dan mempertinggi
produksi protein pengikat androgen oleh sel sertoli, yang merupakan
komponen tubulus testis yang berguna menyokong pematangan sel
spermatozoa dalam proses spermatogenesis (Sherwood L. 2001). LH dan
FSH disekresi oleh kelenjar hipofisis anterior terutama akibat aktivitas
saraf pada hipotalamus.
Testosteron merupakan hormon yang mengontrol perkembangan
organ reproduksi pria dan tanda seks sekunder pada pria berupa
pembesaran laring, perubahan suara, pertumbuhan rambut ketiak, pubis,
dada, kumis dan jenggot serta untuk pertumbuhan otot dan tulang.
Testosteron merupakan hormon kelamin pria yang disekresikan oleh testis
bersama beberapa hormon seks lain yang dinamakan androgen.
Testosteron merupakan hormon yang paling banyak dan paling kuat
daripada hormon androgen lain, sehingga dianggap yang paling
bertanggungjawab akan efek hormonal pria. Testosteron dibentuk oleh sel
interstitial leydig yang terletak pada interstitial antara tubulus seminiferus
dan membentuk sekitar 20% massa testis dewasa. Semua androgen
merupakan senyawa steroid. (Guyton C.A. 1995).
2.6. ELISA (Enzym Linked Immunosorbent Assay)
ELISA (Enzym Linked Immunosorbent Assay) adalah suatu teknik
deteksi dengan metode serologis yang berdasarkan atas reaksi spesifik
tinggi dengan menggunakan enzim sebagai indikator. ELISA adalah suatu
teknik biokimia yang terutama digunakan dalam bidang imunologi untuk
mendeteksi kehadiran antibodi atau antigen dalam suatu sampel. ELISA
telah digunakan sebagai alat diagnostik dalam bidang medis, patologi
tumbuhan, dan juga berbagai bidang industri.
Prinsip dasar ELISA adalah analisis interaksi antara antigen dan
antibodi yang teradsorpsi secara pasif pada permukaan fase padat dengan
menggunakan konjugat antibodi atau antigen yang dilabel enzim. Enzim
ini akan bereaksi dengan substrat dan menghasilkan warna. Warna yang
timbul dapat ditentukan secara kualitatif dengan pandangan mata atau
kuantitatif dengan pembacaan nilai absorbansi pada ELISA plate reader.
Dilakukan pembuatan kurva kalibrasi, plot antara nilai absorbansi dan
konsentrasi standar dan kemudian digunakan untuk menghitung kadar
pada sampel.
Teknik pengujian dengan metoda ELISA dapat dilakukan dengan
beberapa metode, pemilihan tergantung dari besar molekul yang akan
dideteksi, serta tingkat sensitifitas dan spesifitas yang dikehendaki.
Beberapa metode tersebut diantaranya (Walker, John.M and Ralph Rapley.
2008):
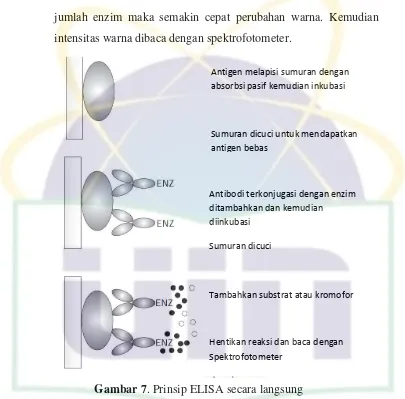
1. Direct ELISA
ELISA secara langsung adalah bentuk paling sederhana dari
ELISA. Teknik ini seringkali digunakan untuk mendeteksi dan
mengukur konsentrasi antigen pada sampel. ELISA ini
menggunakan suatu antibodi spesifik (monoklonal) untuk
mendeteksi keberadaan antigen yang diinginkan pada sampel yang
diuji. Dimana antigen pasif melekat pada fase padat pada periode
inkubasi. Fase padat yang paling umum digunakan adalah sumuran
plat mikrotiter. Setelah dilakukan pencucian, antigen terdeteksi
oleh penambahan antibodi yang berikatan kovalen dengan enzim.
Kemudian diinkubasi dan ditambahkan kromogen/substrat dimana
jumlah enzim maka semakin cepat perubahan warna. Kemudian
intensitas warna dibaca dengan spektrofotometer.
Gambar 7. Prinsip ELISA secara langsung
(Sumber: Walker, John.M and Ralph Rapley. 2008)
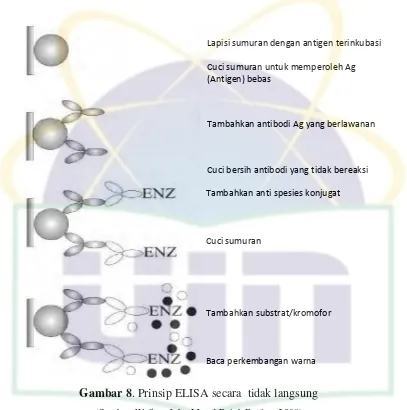
2. Indirect ELISA
Pada metoda ini menunjukan bahwa warna yang ditimbulkan tidak
langsung disebabkan oleh antigen dan antibodi yang bereaksi.
Dibutuhkan suatu antibodi antispesies yang dilabel dengan enzim.
Antigen secara pasif melekat pada sumuran kemudian di inkubasi.
Setelah melakukan pencucian, antibodi spesifik diinkubasi dengan
antigen. Kemudian sumuran dicuci dan setiap antibodi yang terikat
akan terdeteksi dengan penambahan antibodi antispesies yang
berikatan secara kovalen dengan enzim. Antibodi tersebut adalah
antibodi yang spesifik untuk spesies tertentu.
Antigen melapisi sumuran dengan
absorbsi pasif kemudian inkubasi
Sumuran dicuci untuk mendapatkan antigen bebas
Antibodi terkonjugasi dengan enzim ditambahkan dan kemudian diinkubasi
Sumuran dicuci
Tambahkan substrat atau kromofor
Hentikan reaksi dan baca dengan
Gambar 8. Prinsip ELISA secara tidak langsung
(Sumber: Walker, John.M and Ralph Rapley. 2008)
3. Sandwich ELISA
Teknik ELISA jenis ini menggunakan antibodi primer spesifik
untuk menangkap antigen yang diinginkan dan antibodi sekunder
tertaut enzim signal untuk mendeteksi keberadaan antigen yang
diinginkan. Pada dasarnya, prinsip kerja dari ELISA sandwich
mirip dengan ELISA direct. Namun, karena antigen yang
diinginkan tersebut harus dapat berinteraksi dengan antibodi
primer spesifik dan antibodi sekunder spesifik tertaut enzim signal,
maka teknik ELISA ini cenderung dikhususkan pada antigen
memiliki minimal 2 sisi antigenik (sisi interaksi dengan antibodi)
atau antigen yang bersifat multivalent seperti polisakarida atau
protein.
Lapisi sumuran dengan antigen terinkubasi
Cuci sumuran untuk memperoleh Ag (Antigen) bebas
Tambahkan antibodi Ag yang berlawanan
Cuci bersih antibodi yang tidak bereaksi
Tambahkan anti spesies konjugat
Cuci sumuran
Tambahkan substrat/kromofor
BAB 3
METODE PENELITIAN
3.1. Tempat dan Waktu Penelitian
Penelitian ini berlangsung dalam waktu 5 bulan, terhitung dari
bulan Januari 2014 sampai Juni 2014. Penelitian dilakukan di
Laboratoritum Kimia Obat, Laboratorium Penelitian II, Laboratorium
Research, Laboratorium Multiguna, Laboraturium Hewan (Animal House)
Fakultas Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah
Jakarta.
3.2. Alat dan Bahan
3.2.1. Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah tikus albino
jantan galur Sprague Dawley yang sehat, fertil, berumur 10 minggu
dengan berat 200 sampai 250 gram yang diperoleh dari Animal Facility
and Modeling Provider IPB (Institut Pertanian Bogor) sebanyak 25 tikus.
3.2.2. Bahan Uji
Bahan uji yang digunakan dalam penelitian ini adalah biji tanaman
jarak pagar (Jatropha curcas L) yang diperoleh dari BALITTAS (Badan
Penelitian Tanaman Manis dan Serat) Malang, Jawa Timur. Tanaman yang
digunakan sebelumnya dideterminasi terlebih dahulu di Herbarium
Bogoriense Bidang Botani Pusat Penelitian Biologi LIPI (Lembaga Ilmu
Pengetahuan Indonesia) Bogor.
3.2.3. Bahan Kimia
Bahan kimia yang digunakan dalam penelitian ini adalah etanol
70%, Na CMC, pereaksi untuk penapisan fitokimia (ammoniak 25% dan
10%, etil asetat, HCl pekat 10% dan 1%, pereaksi Dragendorff; pereaksi
Mayer; Aquadest; lempeng magnesium, butanol eter, pereaksi Liebermann
– Buchard, FeCl3 1%, NaOH 1 N, petroleum eter, kloroform). Penyiapan
sperma (normal saline water), larutan George, NaCl, larutan Eosin-Y 1%,
buffer Baker’s (asam pikrat, formaldehid 4%, asam asetat) dan NaCl
3.2.4. Alat
Alat-alat yang digunakan dalam penelitian ini adalah timbangan
analitik (AND GH-202), vacuum rotary evaporator (EYELA), labu
erlenmeyer, gelas ukur, batang pengaduk, spatula, kertas saring, kapas,
corong gelas, tabung reaksi, pipet tetes, oven (Memmert), tanur (Thermo
Scientific), alumunium foil, timbangan hewan (Ohauss), kandang tikus
beserta tempat makanan dan minum, sonde oral, wadah pembiusan, alat
bedah minor, kaca objek dan cover glass, cawan penguap, mikropipet
(Eppendorf Reasearch plus), tube, centrifuge (Eppendorf), vortex (Wiggen
houser), mikroskop cahaya (Motic BA 310 dan Epson), Hemasitometer
Improved Neubauer (NESCO), Kit ELISA (Biozatix) dan ELISA reader
(Biotek).
3.3. Rancangan Penelitian
3.3.1. Hewan Uji
Penelitian ini bersifat eksperimental yang terdiri atas 5 kelompok
perlakuan dengan masing-masing terdiri dari 5 ekor tikus jantan (Rattus
novergicus L.) galur Sprague Dawley. Jumlah tikus yang digunakan pada
setiap kelompok penelitian disesuaikan dengan Research Guidelines for
Evaluating The Safety and Efficacy of Herbal Medicines (WHO, 2000)
yaitu untuk pengujian pada hewan pengerat masing-masing kelompok
terdiri dari setidaknya lima ekor.
3.3.2. Dosis Perlakuan
Acuan dosis yang digunakan berdasarkan penelitian yang
dilakukan oleh Widia Dwi Arini (2012) dengan dosis 5mg/kgBB, 25
mg/kgBB dan 50 mg/kgBB. Untuk perhitungan dosis dapat dilihat pada
lampiran 7. Pemberian ekstrak etanol biji jarak pagar dilakukan selama 48
hari sesuai dengan siklus spermatogenesis tikus. Perlakuan yang dilakukan
Tabel 3.1 Perlakuan terhadap kelompok tikus
Keterangan: [ ] T adalah konsentrasi testosteron serum [ ] Spermatozoa adalah konsentrasi spermatozoa
3.4. Kegiatan Penelitian
3.4.1. Penyiapan Simplisia
Biji jarak yang telah dikeringkan dengan kadar air 8,15% diperoleh
dari BALITTAS (Badan Penelitian Tanaman Manis dan Serat) Malang,
Jawa Timur. Sebanyak 2 kg biji jarak pagar yang telah kering kemudian
dihaluskan menggunakan seed grinder di Balai Penelitian Obat dan
Tanaman (Balitro) Bogor hingga menjadi serbuk. Serbuk simplisia yang
dihasilkan sebanyak 1,78 kg. Serbuk simplisia kemudian disimpan dalam
wadah yang kering, tertutup rapat dan terlindung dari cahaya.
3.4.2. Pembuatan Ekstrak
Pembuatan ekstrak biji jarak pagar menggunakan metode ekstraksi
cara dingin yaitu dengan remaserasi . Serbuk simplisia di maserasi dengan
pelarut etanol 70% dalam wadah gelap hingga terendam. Pergantian
pelarut dilakukan setiap 2 sampai 3 hari sekali. Proses maserasi ini diulang
hingga menghasilkan maserat yang berwarna pucat (mendekati tak
berwarna). Maserat yang telah didapat kemudian difiltrasi menggunakan
Kelompok Pelakuan
Diberi suspensi ekstrak biji jarak pagar (Jatropha curcas) dengan dosis sedang yaitu 25mg/kgBB
Diberi suspensi ekstrak biji jarak pagar (Jatropha
Kelompok pegujian aktivitas spermisidal tidak diberi perlakuan
- Kauda epididimis
kapas dan kertas saring hingga didapatkan filtrat. Selanjutnya filtrat
dipekatkan menggunakan vacuumrotary evaporator dan freeze dry sampai
diperoleh ekstrak kental. Ekstrak kental yang dihasilkan selanjutnya
disimpan di dalam lemari es.
3.4.3. Penapisan Fitokimia
Pada penapisan fitokimia dilakukan pemeriksaan terhadap
kandungan golongan senyawa kimia dari ekstrak etanol 70% biji jarak
pagar, meliputi pemeriksaan alkaloid, flavonoid, saponin, tanin, steroid,
dan terpenoid.
1. Identifikasi Golongan Alkaloid
Sejumlah 0,5 gram ekstrak dimasukan ke dalam tabung reaksi
kemudian tambahkan 2mL etanol 70% lalu aduk sampai rata.
Tambahkan 5 mL asam klorida 2 N, dipanaskan di penangas air selama
2 menit, dan didinginkan. Kemudian disaring dan ditampung filtratnya.
Filtrat ditambahkan beberapa tetes reagen Mayer. Sampel kemudian
diamati hingga keruh atau ada terbentuk endapan (Mojab, Kamalinejad,
Ghaderi & Vahidipour, 2003).
2. Identifikasi Golongan Flavonoid
Sejumlah 0,5 gram ekstrak dimasukan ke dalam tabung reaksi
kemudian tambahkan 2mL etanol 70% lalu aduk sampai rata.
Tambahkan serbuk magnesium 0,5 gram dan 3 tetes HCl pekat.
Terbentuknya warna jingga sampai merah menunjukkan adanya flavon,
merah sampai merah padam menunjukkan flavanon, merah padam
sampai merah keunguan menunjukkan flavanon (Mojab, Kamalinejad,
Ghaderi & Vahidipour, 2003).
3. Identifikasi Golongan Saponin
Sejumlah 0,5 gram ekstrak dimasukan ke dalam tabung reaksi
kemudian tambahkan 2mL etanol 70% lalu aduk sampai rata.
Tambahkan 20mL aquabides dan dikocok kemudian didiamkan selama
15-20menit. Jika tidak ada busa = negatif; busa lebih dari 1cm = positif
dari 2cm = positif kuat (Mojab, Kamalinejad, Ghaderi & Vahidipour,
2003).
4. Identifikasi Golongan Tanin
Sejumlah 0,5 gram ekstrak dimasukan ke dalam tabung reaksi
kemudian tambahkan 2mL etanol 70% lalu aduk sampai rata.
Kemudian masukkan ke dalam plat tetes lalu tambahkan FeCl3
sebanyak 3 tetes, jika menghasilkan biru karakteristik, biru-hitam, hijau
atau biru-hijau dan endapan (Mojab, Kamalinejad, Ghaderi &
Vahidipour, 2003; Sarma & Babu, 2011).
5. Identifikasi Golongan Steroid
Sejumlah 0,5 gram ekstrak dimasukan ke dalam tabung reaksi
kemudian tambahkan 2mL etanol 70% lalu aduk sampai rata.
Tambahkan 2mL kloroform, kemudian ditambahkan 2 mL asam sulfat
pekat dengan cara diteteskan perlahan dari sisi dinding tabung reaksi.
Pembentukan cincin warna merah menunjukkan adanya steroid (Mojab,
Kamalinejad, Ghaderi & Vahidipour, 2003).
6. Identifikasi Golongan Terpenoid
Sejumlah 0,5 gram ekstrak dimasukan ke dalam tabung reaksi
kemudian tambahkan 2mL etanol 70% lalu aduk sampai rata.
Tambahkan 2mL kloroform dan 1mL asetat anhidrida lalu dinginkan.
Setelah dingin tambahkan asam sulfat pekat. Jika terjadi warna
kemerahan menunjukkan adanya terpenoid (Mojab, Kamalinejad,
Ghaderi & Vahidipour, 2003).
3.4.4. Pengujian Parameter Spesifik dan Non Spesifik
3.4.4.1.Parameter Spesifik
Parameter spesifik yang diamati meliputi :
1. Identitas Ekstrak. Deskripsi tata nama meliputi :
- Nama ekstrak (generik, dagang, paten)
- Nama latin tumbuhan (sistematika botani)
- Bagian tumbuhan yang digunakan
2. Organoleptik. Penggunaan panca indera mendeskripsikan bentuk,
warna, bau, rasa sebagai berikut :
- Bentuk : padat, serbuk-kering, kental, cair
- Warna : kuning, coklat, dll
- Bau : aromatik, tidak berbau, dll
- Rasa : pahit, manis, kelat, dll (Depkes RI, 2000).
3.4.4.2.Parameter Non Spesifik
1. Susut Pengeringan
Ekstrak ditimbang secara seksama sabanyak 1 g sampai 2 g dan
dimasukkan ke dalam botol timbang dangkal bertutup yang sebelumnya
telah dipanaskan pada suhu 1050C selama 30 menit dan telah ditara. Sebelum ditimbang, ekstrak ditarakan dalam botol timbang dengan
menggoyangkan botol hingga merupakan lapisan setebal lebih kurang
5mm sampai 10mm. Jika ekstrak diuji berupa ektrak kental, ratakan
dengan batang pengaduk, kemudian dimasukkan ke dalam ruang
pengering, buka tutupnya, keringkan pada suhu 1050C hingga bobot tetap. Sebelum setiap pengeringan, biarkan botol dalam keadaan tertutup
mendingin dalam desikator hingga suhu kamar. Jika ekstrak sulit kering
dan mencair pada pemanasan, ditambahkan 1g silika pengering yang telah
ditimbang secara seksama setelah dikeringkan dan disimpan dalam
desikator pada suhu kamar. Silika tersebut dicampur secara merata dengan
ekstrak pada saat panas, kemudian keringkan kembali pada suhu
penetapan hingga bobot tetap (Depkes RI, 2000).
2. Kadar Abu
Lebih kurang 2g sampai 3g ekstrak yang telah digerus dan ditimbang
secara seksama dimasukkan ke dalam krus silikat yang telah dipijarkan
dan ditara, ratakan. Perlahan dipijarkan hingga arang habis, dinginkan,
timbang. Jika cara ini arang tidak dapat dihilangkan, tambahkan air panas,
saring melalui kertas saring bebas abu. Sisa kertas dan kertas saring dalam