PENGARUH KITOSAN TERHADAP PENYAKIT KERDIL
HAMPA PADA TANAMAN PADI
VERONICA TIURIDA APRILIANA SIMANJUNTAK
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
VERONICA TIURIDA APRILIANA SIMANJUNTAK. Pengaruh Kitosan terhadap Penyakit Kerdil Hampa pada Tanaman Padi. Dibimbing oleh SURYO WIYONO dan GEDE SUASTIKA.
Kitosan merupakan senyawa biopolimer yang dapat memacu respon biokimia pertahanan tanaman terhadap infeksi patogen. Penelitian ini bertujuan menguji keefektifan kitosan dalam menekan Rice ragged stunt virus (RRSV). Perlakuan yang digunakan adalah penyemprotan kitosan dengan konsentrasi 0.1% dan 1% masing-masing sebelum dan setelah inokulasi. Sebagai pembanding digunakan tanaman yang tidak diinokulasi dan tanaman diinokulasi tanpa kitosan. Inokulasi dilakukan dengan menggunakan vektor Nilaparvata lugens pada 21 hari setelah tanam (HST). Setiap perlakuan terdiri dari tiga ulangan dengan tiga rumpun tanaman padi, disusun dalam Rancangan Acak Kelompok (RAK). Parameter pengamatan meliputi pertumbuhan tanaman berupa tinggi dan jumlah anakan tanaman serta kejadian dan keparahan penyakit. Data yang diperoleh dianalisis ANOVA pada taraf 5% dan uji lanjut Duncan. Semua perlakuan kitosan secara umum meningkatkan pertumbuhan tanaman dibandingkan kontrol positif. Tanaman yang diberi perlakuan kitosan mempunyai gejala ringan yang meliputi beberapa daun menggulung dan agak mengeriting, sedangkan tanaman kontrol positif menunjukkan gejala lebih parah berupa kerusakan sedang sampai berat yang meliputi sebagian besar helaian daun kasar atau menggulung, pembengkakan tulang daun, jumlah anakan sedikit, dan kerdil. Kejadian penyakit terendah ditunjukkan pada perlakuan kitosan 1% yang disemprotkan sebelum inokulasi (44.44%) sedangkan kejadian penyakit perlakuan lainnya 100%. Perlakuan kitosan 1% sebelum inokulasi secara nyata menekan keparahan penyakit kerdil hampa sebesar 40.74%, sedangkan perlakuan lain tidak berpengaruh nyata.
PENGARUH KITOSAN TERHADAP PENYAKIT KERDIL
HAMPA PADA TANAMAN PADI
VERONICA TIURIDA APRILIANA SIMANJUNTAK
A34070040
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul : Pengaruh Kitosan terhadap Penyakit Kerdil Hampa pada Tanaman Padi
Nama : Veronica Tiurida Apriliana Simanjuntak NRP : A34070040
Disetujui,
Dosen Pembimbing 1 Dosen Pembimbing 2
Dr. Ir. Suryo Wiyono, M.Sc. Agr. Dr. Ir. Gede Suastika, M.Sc.
NIP. 19690212 199203 1003 NIP. 19620607 198703 1003
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Abdjad Asih Nawangsih, M.Si. NIP. 19650621 198910 2001
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 13 April 1989 sebagai anak pertama dari pasangan Lorentz Simanjuntak dan Magdalena Silitonga. Penulis lulus dari SMA Negeri 1 Bandar Lampung pada tahun 2007 dan diterima di IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis diterima di Departemen Proteksi Tanaman pada tahun 2008.
PRAKATA
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa yang telah memberikan nikmat dan karunia-Nya sehingga skripsi dengan judul “Pengaruh Kitosan terhadap Penyakit Kerdil Hampa pada Tanaman Padi” dapat diselesaikan. Skripsi ini merupakan persyaratan untuk memperoleh gelar sarjana pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilakukan pada November 2011 sampai April 2012.
Pada kesempatan ini penulis menyampaikan terima kasih kepada orang-orang yang telah membantu penulis, mulai dari kegiatan penelitian sampai dengan selesainya tugas akhir ini. Khususnya kepada:
1. Ayah dan ibu serta adik-adik tercinta yang telah memberikan dukungan moral maupun materi, kasih sayang, dan doa restu kepada penulis.
2. Dr. Ir. Suryo Wiyono, M.Sc. Agr. dan Dr. Ir. Gede Suastika, M.Sc. yang telah memberikan bimbingan, bantuan, arahan, masukan, serta nasehat kepada penulis sejak awal penelitian sampai akhir penyusunan skripsi ini.
3. Dr. Ifa Manzila, M.Si. yang banyak membantu kinerja deteksi virus di Laboratorium Mikrobiologi, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian (BB Biogen) dan pencarian tanaman bergejala RRSV di daerah Subang.
4. Semua laboran Departemen Proteksi Tanaman khususnya bapak Dadang yang membantu di Laboratorium Mikologi Tumbuhan, mbak Tuti yang membantu di Laboratorium Virologi Tumbuhan, dan bapak Saefuddin serta bapak Mamat yang membantu penelitian di Rumah Kaca University Farm, Institut Pertanian Bogor.
5. Teman-teman laboratorium Virologi Tumbuhan: mbak Pipit, Rita Kurnia Apindiati serta teman-teman Laboratorium Mikrobiologi, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian (BB Biogen) yang membantu selama proses penelitian sampai penyusunan tugas akhir.
Bogor, Juni 2012
DAFTAR ISI
Morfologi Dan Biologi Wereng Batang Coklat ... 11
Biotipe Wereng Batang Coklat ... 12
Kitosan dan Penggunaannya untuk Pengendalian Penyakit Tanaman ... 13
Reverse Transcription-Polymerase Chain Reaction (RT-PCR) ... 15
BAHAN DAN METODE ... 17
Waktu dan Tempat Penelitian ... 17
Bahan dan Alat ... 17
Metode Penelitian ... 17
Penyediaan Tanaman Sumber Inokulum ... 17
Deteksi Virus Kerdil Hampa pada Tanaman Sumber Inokulum dengan Metode RT-PCR ... 18
Penanaman Tanaman Uji ... 19
Perbanyakan Wereng Batang Coklat ... 19
Periode Makan Akuisisi ... 20
Inokulasi ... 20
Pembuatan Larutan Kitosan ... 20
Perlakuan ... 20
Parameter Pengamatan ... 21
Pertumbuhan Tanaman ... 22
viii
HASIL DAN PEMBAHASAN ... 23
Hasil ... 23
Gejala ... 23
Pengaruh Perlakuan Kitosan terhadap Kejadian Penyakit dan Keparahan Penyakit ... 23
Pengaruh Perlakuan Kitosan terhadap Pertumbuhan Tanaman ... 24
Deteksi RRSV dengan RT-PCR... 28
Pembahasan Umum ... 28
KESIMPULAN DAN SARAN ... 32
Kesimpulan ... 32
Saran ... 32
DAFTAR TABEL
Halaman 1. Pengaruh perlakuan kitosan terhadap kejadian dan keparahan
DAFTAR GAMBAR
Halaman 1. Gejala serangan RRSV pada sumber inokulum ……… 23 2. Tinggi tanaman akibat perlakuan kitosan pada 0-7 HSI, 7-14 HSI, 14-21
HSI, 21-28 HSI, dan 28-35 HSI ……… 25 3. Pengaruh kitosan terhadap tinggi tanaman………...………… 26 4. Perbandingan tinggi tanaman antara perlakuan ch sb 1 dan kontrol
negatif………...………
26 5. Jumlah anakan pada 7 HSI, 14 HSI, 21 HSI, 28 HSI, dan 35 HSI.…..… 27 6. Pengaruh kitosan terhadap jumlah anakan...……… 27 7. Hasil amplifikasi DNA genom virus dengan metode RT-PCR
menggunakan pasangan primer spesifik untuk RRSV...……..…………
DAFTAR LAMPIRAN
Halaman
1. Pengaruh kitosan terhadap tinggi tanaman ……… 37
2 Pengaruh kitosan terhadap jumlah anakan tanaman ……….. 38
3. Pengaruh kitosan terhadap persentase kejadian penyakit (KP) ……. 39
4. Pengaruh kitosan terhadap persentase keparahan penyakit (P) ……. 40
5. Hasil analisis ragam pertumbuhan tinggi tanaman pada 0 HSI ……. 41
6. Hasil analisis ragam pertumbuhan tinggi tanaman pada 7 HSI ……. 41
7. Hasil analisis ragam pertumbuhan tinggi tanaman pada 14 HSI …... 42
8. Hasil analisis ragam pertumbuhan tinggi tanaman pada 21 HSI …... 42
9. Hasil analisis ragam pertumbuhan tinggi tanaman pada 28 HSI …... 43
10. Hasil analisis ragam pertumbuhan tinggi tanaman pada 35 HSI …... 43
11. Hasil analisis ragam jumlah anakan pada 0 HSI ……… 44
12. Hasil analisis ragam jumlah anakan pada 7 HSI ……… 44
13. Hasil analisis ragam jumlah anakan pada 14 HSI ……….. 45
14. Hasil analisis ragam jumlah anakan pada 21 HSI ……….. 45
15. Hasil analisis ragam jumlah anakan pada 28 HSI ……… 46
16. Hasil analisis ragam jumlah anakan pada 35 HSI ……….. 46
17. Data hasil pengamatan ………... 47
18. Hasil analisis ragam kejadian penyakit pada 0 HSI ………... 47
19. Hasil analisis ragam kejadian penyakit pada 7 HSI ………... 47
20. Hasil analisis ragam kejadian penyakit pada 14 HSI ………. 48
21. Hasl analisis ragam kejadian penyakit pada 21 HSI ……….. 48
22. Hasil analisis ragam kejadian penyakit pada 28 HSI ………. 49
23. Hasil analisis ragam kejadian penyakit pada 35 HSI ………. 50
24. Hasil analisis ragam keparahan penyakit pada 0 HSI ……….... 50
25. Hasil analisis ragam keparahan penyakit pada 7 HSI ……… 50
26. Hasil analisis ragam keparahan penyakit pada 14 HSI ……….. 51
27. Hasil analisis ragam keparahan penyakit pada 21 HSI ……….. 51
28. Hasil analisis ragam keparahan penyakit pada 28 HSI ……….. 52
PENDAHULUAN
Latar Belakang
Rice ragged stunt virus (RRSV) dapat menyebabkan pertumbuhan
terhambat, tepi daun tidak rata, berlekuk-lekuk atau sobek-sobek dan terjadi pembengkakan tulang daun atau pembentukan puru yang berwarna kuning pucat sampai coklat serta terjadi pembelitan daun, malai tidak dapat keluar dengan sempurna, dan gabah hampa. RRSV pertama kali dilaporkan terdapat di Indonesia pada tahun 1976 yaitu di daerah Pandeglang, Jawa Barat (Hibino et al. 1977). Setahun kemudian virus ini dilaporkan terdapat di Cotabato Utara, Mindanau, Filipina. Saat ini, penyakit kerdil hampa dilaporkan telah menyebar di negara-negara Asia termasuk China, India, Jepang, Malaysia, Filipina, Sri Langka, Taiwan, dan Thailand (Ling et al. 1978).
Sampai saat ini belum ada laporan tentang varietas padi yang tahan terhadap RRSV. Varietas yang tahan terhadap wereng coklat belum tentu tahan terhadap serangan RRSV yang ditularkan oleh hama ini. Menurut Hibino et al. (1977), pada tingkat serangan yang tinggi, penyakit kerdil hampa dapat menyebabkan penurunan produksi sampai 50%. Di India kerugian hasil mencapai 80-100%. Hasil survei di Indonesia menunjukkan apabila tanaman terinfeksi 34-76% maka berkurangnya hasil panen mencapai 53-82%.
Beberapa upaya pengendalian dapat dilakukan seperti misalnya melalui pengendalian vektor virus dan penggunaan bahan-bahan antiviral. Pengendalian vektor virus dapat dilakukan dengan kultur teknis yaitu membersihkan gulma serta penggunaan insektisida. Upaya pengendalian virus tanaman yang umum dilakukan adalah dengan menggunakan varietas yang tahan yang contohnya adalah varietas Ciherang. Varietas ini banyak ditanam petani di daerah sentra pertanaman padi Bogor, Karawang dan Subang. Varietas ini sebenarnya merupakan varietas tahan terhadap wereng batang coklat (WBC) biotipe 2 dan 3 tetapi baru-baru ini dilaporkan sudah mulai terkena serangan WBC biotipe 3 yang cukup berat (Ratna et al. 2008).
bahan tertentu. Ketahanan sistemik dari suatu tanaman dapat diaktifkan dengan menginduksi gen-gen ketahanan yang terdapat di dalam tanaman. Salah satu agen yang dapat menginduksi ketahanan tanaman adalah ekstrak tumbuhan (Hersanti 2003) dan kitosan (Vasyukova et al. 2001).
Kitosan merupakan produk turunan dari kitin yang banyak terdapat pada serangga, krustasea, dan fungi, yang merupakan biopolimer alami kedua terbanyak di alam setelah selulosa (Sanford & Hutchings 1987). Diperkirakan lebih dari 109-1010 ton kitosan diproduksi di alam tiap tahun. Indonesia sebagai negara maritim sangat berpotensi menghasilkan kitin dan kitosan. Data statistik menunjukkan bahwa negara yang memiliki industri pengolahan kerang menghasilkan sekitar 56 200 ton limbah/tahun. Limbah tersebut dapat diproses dan diubah menjadi kitosan. Oligomer kitosan adalah produk yang termahal, yaitu senilai $ 60 000/ton (Sanford 1989).
Kitosan memiliki banyak kegunaan di antaranya sebagai bahan pengawet alami dan bahan kosmetik. Selain itu kitosan juga digunakan untuk menekan perkembangan penyakit tanaman yang disebabkan oleh cendawan, bakteri, dan virus. Wang et al. (2007) melaporkan bahwa pelapisan kitosan dengan konsentrasi 2% pada buah mangga mampu menghambat perkembangan penyakit antraknosa. Selain itu kitosan dilaporkan juga mampu untuk menekan infeksi Alfalfa mosaic virus (AMV) (Pospieszny et al. 1991) dan infeksi Potato spindle tuber viroid
(PSTVd) (Pospieszny 1993). Hingga saat ini belum ada penelitian tentang efektifitas kitosan terhadap RRSV pada tanaman padi.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efektifitas kitosan untuk mengendalikan penyakit kerdil hampa pada tanaman padi.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tanaman Padi
Taksonomi Tanaman Padi
Padi (Oryza sativa L.) termasuk dalam famili Gramineae, sub famili Oryzoideae, suku Oryzeae dan genus Oryza. Padi termasuk golongan tanaman semusim yaitu tanaman yang biasanya berumur pendek, kurang dari satu tahun dan hanya satu kali berproduksi, setelah berproduksi akan mati atau dimatikan. Tanaman padi dikelompokkan ke dalam dua kelompok yaitu kelompok Indica (padi bulu) yang umumnya terdapat di negara-negara tropik seperti Indonesia dan Japonica (padi cere) yang umumnya terdapat di negara-negara bukan tropik atau sub tropik seperti Jepang (Nasoetion 2001).
Padi merupakan tanaman pangan berumpun. Tanaman pertanian kuno ini berasal dari dua benua, yaitu Asia dan Afrika Barat tropis dan subtropis. Bukti sejarah menunjukkan bahwa penanaman padi di Zhejiang (Cina) sudah dimulai pada 3.000 tahun SM. Fosil butir padi dan gabah ditemukan di Hastinapur Uttar Pradesh India sekitar 100-800 SM. Tanaman padi di Indonesia berasal dari perantau-perantau Malaysia yang membawa tanaman padi sekitar tahun 1.500 SM (Siregar 1980).
Morfologi Tanaman Padi
Tanaman padi mempunyai batang yang beruas-ruas. Panjang batang tergantung jenisnya. Pada ruas batang bawah pendek, semakin ke atas mempunyai ruas batang yang makin panjang. Ruas pertama dari atas merupakan ruas terpanjang. Ruas batang padi berongga dan bulat. Di antara ruas batang padi terdapat buku, tiap-tiap buku duduk sehelai daun. Batang baru muncul pada ketiak daun. Batang baru dapat disebut batang sekunder apabila batang tersebut terletak pada buku terbawah (Aak 2001).
Tanaman padi membentuk rumpun dengan anakannya, biasanya anakan akan tumbuh pada dasar batang. Pembentukan anakan terjadi secara bersusun yaitu anakan pertama, kedua, ketiga dan seterusnya. Setiap tanaman padi mempunyai jumlah anakan yang berbeda-beda sehingga berpengaruh terhadap umur penanaman selanjutnya. Anakan tumbuh pada umur 10 hari setelah penanaman di sawah (Aak 2001).
Ciri khas daun padi adalah sisik dan telinga daun. Hal ini menyebabkan daun padi dapat dibedakan dari jenis rumput yang lain. Bagian-bagian dari daun padi yaitu helaian daun yang bentuknya memanjang terletak pada batang padi, pelepah daun merupakan bagian daun yang menyelubungi batang, lidah daun yang terletak pada perbatasan antara helaian daun dan upih (Aak 2001).
Sekumpulan bunga padi (spikelet) yang keluar dari buku paling atas dinamakan malai. Sumbu utama malai adalah ruas buku yang terakhir pada batang. Panjang malai tergantung pada varietas padi yang ditanam dan cara bercocok tanam. Jumlah cabang pada setiap malai berkisar antara 15-20 buah, setiap malai bisa mencapai 100-120 bunga (Aak 2001).
Bunga padi merupakan bunga telanjang yang mempunyai satu bakal buah, enam buah benang sari, serta dua tangkai putik. Bakal buah mengandung air (cairan) untuk kebutuhan lodikula, warnanya keunguan/ungu tua. Benang sari terdari dari tangkai sari, kepala sari, dan kandung serbuk. Tangkai sari padi tipis dan pendek, sedangkan pada kepala sari terletak kandung serbuk yang berisi tepung sari (pollen). Lodikula merupakan daun mahkota yang telah berubah bentuk yang berfungsi mengatur pembukaan bunga (Aak 2001).
5 mahkota yang letaknya di atas lemma pada bunga tanaman padi). Buah ini merupakan hasil penyerbukan dan pembuahan yang mempunyai bagian-bagian antara embrio yang terletak pada bagian lemma, endosperm yang merupakan bagian dari buah atau biji padi yang besar dan bekatul merupakan bagian buah padi yang berwarna coklat (Aak 2001).
Pertumbuhan tanaman padi terdiri dari fase vegetatif, fase reproduktif, dan masa pemasakan. Lama fase vegetatif adalah 60-70 hari, terdiri dari fase bibit berkecambah (kurang dari 21 hari) dan fase pertunasan sampai tercapai jumlah maksimum.
Lama fase reproduksi adalah 36 hari, terdiri dari fase primordia (60-70 hari setelah tabur benih, fase pemanjangan ruas dan bunting (kurang lebih 75 hari sesudah tabur benih), fase heading diikuti keluarnya malai dari pelepah daun benderadan fase berbunga kira-kira 100 hari sesudah telur.
Fase pemasakan berlangsung 25-35 hari meliputi fase masak susu, fase masak tepung, fase masak gabah, dan fase lewat masak yaitu setelah gabah masak ditandai dengan mengeringnya daun dari bawah secara berangsur-angsur yang akhirnya kering dan mati.
Pemupukan dilakukan untuk memenuhi nutrisi yang diperlukan tanaman padi. Pupuk yang digunakan sebaiknya kombinasi antara pupuk organik dan pupuk buatan. Pupuk organik yang diberikan berupa pupuk kandang atau pupuk hijau dengan dosis 2-5 ton/ha. Pupuk organik diberikan saat pembajakan/cangkul pertama. Selain pupuk organik diberikan juga pupuk kimia dengan dosis 200 kg urea/ha, 75-100kg SP-36/ha, dan 75-100 kg KCl/ha. Urea diberikan 2-3 kali yaitu 14 HST, 30 HST, dan menjelang primordia bunga. Pupuk SP-36 dan KCl diberikan saat tanam atau 14 HST. Jika digunakan pupuk majemuk dengan perbandingan 15-15-15, dosisnya 300 kg/ha. Pupuk majemuk diberikan setengah dosis saat tanaman berumur 14 HST, sisanya menjelang primordial bunga (50 HST).
Hama Dan Penyakit Tanaman Padi
coklat (Nilaparvata lugens Stal), wereng hijau (Nephottetix virescens), kepinding tanah (kepinding tanah Malaya Scotinophara coarctata dan kepinding tanah Jepang Scotinophara lurida), walang sangit (Leptocorisa oratorius Fabricius), tikus (Rattus argentiventer) , ganjur (Orseolia oryzae Wood-Mason), hama putih palsu (Cnaphalocrocis medinalis), hama putih (Nymphula depunctalis), ulat grayak (Spodoptera mauritia acronyctoides), ulat tanduk hijau (Melanitis leda
ismene Cramer), ulat jengkal palsu hijau (Naranga aenescens), orong-orong
(Gryllotalpa orientalis Burmeister), lalat bibit (Hydrellia philippina Ferino),
keong mas (Pomacea canaliculata Lamarck), burung (Lonchura spp., Ploceus
sp.).
Beberapa patogen yang menginfeksi tanaman padi antara lain: hawar daun bakteri (Xanthomonas campestris pv. oryzae), bakteri daun bergaris
(Xanthomonas campestris pv. oryzicola), blast (Pyricularia grisea), hawar
pelepah daun (Rhizoctonia solani Kuhn), busuk batang (Magnaporthe salvinii,
Helminthosporium sigmoideum var. irregulare), busuk pelepah (Sarocladium
oryzae (Sawada) Gums dan Hawksworth), bercak coklat (Helmintosporium
oryzae), bercak Cercospora (Cercospora oryzae), hawar daun jingga, tungro
(virus tungro), kerdil rumput, dan kerdil hampa yang ditularkan oleh wereng batang coklat.
Virus Kerdil Hampa
Taksonomi Virus Kerdil Hampa
Virus kerdil hampa adalah virus yang relatif baru ditemukan, termasuk kelompok Reovirus (Shikata et al 1978 dalam Ling 1978) dan dimasukkan dalam sub kelompok Acanthovirus (Ling et al. 1978). Nama lain virus ini adalah Infectious gall virus. Virus kerdil hampa (Rice Ragged Stunt Virus) disebabkan
7 Penyakit kerdil hampa merupakan penyakit yang sudah lama dikenal pada tanaman padi sawah dan pertama kali ditemukan di Pandeglang, Jawa Barat tahun 1976. Kemudian pada tahun 1977 ditemukan di beberapa daerah Jawa Tengah, Jawa Timur, Bali Sumatera Selatan, Sumatera Utara, Sulawesi, dan Lombok (Hibino et al. 1977).
Virus ini sebelumnya mungkin telah terdapat di Indonesia tetapi gejalanya tertutup gejala kerdil rumput. Kenyataannya, di daerah-daerah yang banyak ditanam kultivar padi yang resisten terhadap kerdil rumput maka kerdil hampa akan banyak terlihat. Hasil survei di Indonesia menunjukkan bila tanarnan terinfeksi 34-76%, maka berkurangnya hasil panen mencapai 53-82%.
Partikel Virus Kerdil Hampa
Virus kerdil hampa mempunyai partikel yang berbentuk polihedral dengan ukuran antara diameter 50-70 nm. Partikel ini banyak terdapat pada sel-sel floem dan sel-sel puru (Shikata et al. 1978). Hibino et al. (1977) melaporkan bahwa penyakit kerdil hampa disebabkan oleh virus yang berbentuk bulat dengan ukuran 60 nm. Sifat fisik virus kerdil hampa adalah sebagai berikut: ketahanan suhu 4◦C adalah 7 hari, batas pengenceran 10-5 (daun) dan 10-6 (serangga), panas inaktivasi 60◦C dan stabil pada pH 6-9.
Gejala Virus Kerdil Hampa
Gejala penyakit yang ditimbulkan virus kerdil hampa berbeda pada setiap tahap perkembangan tanaman. Gejala muncul atau terlihat lebih kurang 3-4 minggu setelah inokulasi virus pada tanaman. Gejala pada tanaman muncul 10-36 hari setelah inokulasi. Sedangkan Hibino et al. (1977) melaporkan bahwa kira-kira 2 minggu setelah inokulasi gejala pertama muncul. Tanaman terlihat kerdil dan daun berwarna hijau tua. Satu bulan setelah inokulasi, terlihat daun memilin dan robek-robek pada tepinya. Kira-kira dua bulan setelah inokulasi, gejala tidak jelas pada daun-daun yang baru. Tanaman menjadi lebih kerdil dan daun-daun lebih pendek.
klorotik kemudian keputih-putihan dan bagian daun yang putih menjadi kuning atau kuning kecoklatan. Daun-daun yang robek lebih banyak terdapat pada helai daun apabila dibandingkan dengan pada pelepah daun. Pada helai daun, bagian yang robek lebih banyak terdapat pada satu sisi (Ling et al. 1978).
Daun yang memilin terjadi pada ujung helai daun. Pertama-tama terlihat satu putaran, kemudian putarannya menjadi bayak sampai berbentuk seperti spiral. Keadaan ini disebabkan oleh pertumbuhan daun yang tidak seimbang pada kedua sisi daun yang terinfeksi (Ling et al. 1978).
Gejala lain yang tampak dari penyakit kerdil hampa adalah pembengkakan tulang daun. Pembengkakan ini disebabkan oleh perkembangan sel-sel floem dalam berkas jaringan. Bagian yang membengkak (puru) ini lebih banyak terdapat pada pelepah daun apabila dibandingkan dengan pada helai daun. Ukuran panjang puru adalah 0.1 mm sampai 1 mm. Warna puru bervariasi, kira-kira 82% kuning muda atau putih, 2% coklat muda, 6% coklat tua dan 10% kombinasi. Warna puru tidak mengalami perubahan seperti daun mati. Pada helai daun bagian atas dan pelepah daun bagian bawah banyak ditemukan puru (Ling et al. 1978).
Pada tahap lanjut dari pertumbuhan tanaman, daun bendera tanaman sakit menjadi lebih pendek, seringkali terlihat terpilin dan robek-robek pada tepi daunnya. Malai juga menjadi lebih pendek dan keluarnya malai tidak sempurna (Hibino et al., 1977; Ling et al. 1978). Selain itu pembungaan juga terlambat (Ghosh & John 1980).
Pada tanaman sakit seringkali dihasilkan percabangan dari buku-buku batang bagian bawah. Percabangan semakin bertambah dengan bertambahnya umur tanaman. Akibat percabangan, malai yang dihasilkan seringkali lebih kecil dan lebih banyak jumlahnya jika dibandingkan dengan tanaman yang tidak bercabang. Pada tanaman sakit hanya sedikit ditemukan bulir yang berisi atau bulir pada umumnya kosong (Ling et al. 1978). Tanaman sakit dapat bertahan hidup lama sesudah pembungaan, yaitu lebih dari 6 bulan di rumah kaca IRRI (Ling 1977).
Penularan Virus Kerdil Hampa
9 coklat. Wereng batang coklat (Nilparvata lugens Stal) merupakan salah satu serangga hama penting pada tanaman padi karena selain dapat merusak secara langsung, juga dapat sebagai penular penyakit virus kerdil rumput dan kerdil hampa (Hibino et al. 1977). Serangga tersebut dapat menularkan penyakit virus kerdil hampa sampai akhir masa hidupnya, tetapi tidak dapat menularkan kepada keturunannya lewat telur (Ling et al. 1978).
Ketiga biotipe wereng batang coklat dapat menularkan virus ini dengan efektivitas yang sama. Hubungan virus dengan vektornya adalah secara persisten. Nimfa dan imago dapat menularkan virus (Ling et al. 1978). Menurut Ghosh dan John (1980), nimfa lebih efisien daripada imago dalam menularkan virus kerdil hampa. Persentase penularan nimfa instar pertama 19.3%, instar kedua 25.8%, instar ketiga 29%, instar keempat 27.6% dan instar kelima 21.4%.
Periode makan akuisisi terpendek lebih kurang delapan jam dan periode latennya rata-rata lebih kurang sembilan hari (2-33 hari). Periode makan inokulasi minimum lebih kurang satu jam dan bila periode makan inokulasinya diperpanjang sampai satu hari maka tanaman yang terinfeksi akan bertambah banyak. Periode retensinya berkisar antara 3-35 hari (rata-rata 15 hari) atau 13-35% dari lama hidupnya. Penularan virus adalah transtadial tetapi tidak transovarial. Periode inkubasinya dalam tanaman 2-3 minggu, sedangkan inkubasi virus dalam tubuh serangga berkisar 5-18 hari. Hibino et al. (1977) melaporkan bahwa tanaman yang terserang kerdil hampa menunjukkan suatu penyembuhan sementara, karena gejala dapat hilang tetapi akan timbul kembali.
Persentase tertinggi serangga yang infektif dapat menularkan virus adalah pada hari kesembilan setelah makan akuisisi. Jumlah hari untuk menularkan virus berkisar dari 3-100% atau rata-rata 41% dari sejak serangga mulai efektif sampai kematiannya. Makin tua serangga tersebut makin menurun kemampuan menularkan virus (Ling et al. 1978). Kemampuan menularkan virus kerdil hampa oleh wereng batang coklat biotipe 1, 2, dan 3 tidak berbeda nyata (Ling & Aguiero 1977).
antara bentuk-bentuk bersayap pendek dan panjang (42% dan 48%). Di Indonesia menurut Hibino et al. (1977) rata-rata 11% populasi wereng batang coklat aktif menularkan virus kerdil hampa, sedangkan di Jepang menurut Shikata et al. (1978) rata-rata 28%. Lamanya makan akuisisi mempengaruhi banyaknya serangga yang aktif sebagai penular yaitu dengan makan akuisisi yang lamanya berkisar dari 5-26.7%.
Jumlah bibit yang terinfeksi dipengaruhi oleh lamanya makan inokulasi serangga dan banyaknya serangga tersebut. Terdapat kecendrungan bahwa makin lama makan inokulasi dan makin banyak jumlah serangga vektor wereng batang coklat makin tinggi persentase bibit padi yang terinfeksi (Hibino et al. 1977).
Mekanisme pertahanan inang terhadap patogen terdiri dari pertahanan struktural melalui hambatan fisik yang menekan patogen saat masuk ke dalam tanaman dan pertahanan biokimia sel serta jaringan tanaman dengan memproduksi substansi yang bersifat toksin terhadap patogen (Agrios 2005). Matthews (1991) juga melaporkan bahwa mekanisme reaksi ketahanan tanaman terhadap infeksi virus dibedakan menjadi tiga kelompok yaitu tanaman resisten, tanaman toleran, dan tanaman rentan. Tanaman resisten menunjukkan reaksi hipersensitif dengan mematikan sel-sel terlokalisasi pada tempat yang diinfeksi tanpa penyebaran virus lanjut sehingga pertumbuhan patogen dapat dibatasi. Pada tanaman toleran, virus dapat bereplikasi dan menyebar ke dalam tanaman tetapi pengaruhnya terhadap hasil hanya sedikit. Pada tanaman rentan, virus bereplikasi dan menyebar ke dalam tanaman yang mengakibatkan pengaruh terhadap hasil yang signifikan bahkan kematian pada tanaman.
Wereng Batang Coklat
Taksonomi Wereng Batang Coklat
Wereng batang coklat termasuk dalam ordo Hemiptera, subordo Auchenorrhyncha, infraordo Fulgoromorpha, family Delphacidae, genus Nilaparvata, dan spesies Nilaparvata lugens. Anggota genus Nilaparvata
11 menusukkan stiletnya ke dalam ikatan pembuluh vaskular tanaman inang dan menghisap cairan tanaman dalam jaringan floem. Wereng batang coklat tersebar di wilayah Palaeartik (Cina, Jepang, dan Korea), wilayah Oriental (Bangladesh, Kamboja, India, Malaysia, Serawak, Taiwan, Muangthai, Vietnam, Indonesia, dan Filipina), serta wilayah Australian (Australia, Kepulauan Fiji, Kaledonia, Mikronesia, Kepulauan Solomon, dan Papua Nugini) (Baehaki 1993).
Morfologi Dan Biologi Wereng Batang Coklat
Morfologi suatu serangga dapat dilihat dari bentuk tubuh, ukuran, dan warna dari masing-masing fase perkembangan. N. lugens membutuhkan waktu sekitar 50 hari untuk menyelesaikan siklus hidupnya yang diawali dengan peletakan telur oleh imago betina (Rismunandar 1993). N. lugens menghasilkan telur berbentuk lonjong dan diletakkan berkelompok seperti sisiran pisang di dalam jaringan pelepah daun yang menempel pada batang. Warna telur transparan keputihan dengan panjang 1.3 mm. Kemudian telur akan menetas 7–10 hari setelah diletakkan dan berkembang menjadi nimfa (Harahap & Tjahjono 1997).
Nimfa terdiri dari 5 fase perkembangan (instar) yang berlangsung selama 12-15 hari. Setiap instar dapat dibedakan dari ukuran tubuh dan bakal sayap yang semakin membesar. Nimfa instar pertama berwarna putih keabu-abuan dengan panjang 0,6 mm, sedangkan instar kelima berwarna coklat dengan panjang 2.0 mm. Perubahan warna tubuh dari putih keabu-abuan lalu menjadi coklat terjadi secara bertahap sesuai dengan perkembangan instar. Waktu yang diperlukan untuk menyelesaikan periode nimfa yaitu 12.82 hari (Harahap & Tjahjono 1997).
Mochida et al. (1977) mengungkapkan bahwa siklus hidup wereng batang coklat relatif pendek, tergantung pada temperatur dan ketersediaan makanan. Pada suhu 25°C siklus hidupnya adalah 28-32 hari dan pada suhu 28°C siklus hidupnya 23-25 hari. Lama siklus hidup wereng batang coklat dari telur sampai menjadi dewasa diperlukan waktu antara 21-24 hari, dengan rata-rata 22.5 hari.
1977). Pada fase imago N. lugens siap berkopulasi dan meletakkan telur. Seekor imago betina dalam masa hidupnya selama 10-24 hari mampu meletakkan telur sebanyak 300-350 butir (Harahap & Tjahjono 1997).
N. lugens dewasa mempunyai 2 bentuk sayap yaitu makroptera (bentuk
yang bersayap panjang) dan brakhiptera (bentuk yag bersayap pendek). Makroptera yaitu wereng batang coklat yang mempunyai sayap depan dan sayap belakang secara normal, sedangkan brakhiptera yaitu wereng batang coklat yang mempunyai sayap depan dan sayap belakang yang tumbuh tidak normal (Mochida 1977). Faktor-faktor yang menyebabkan timbulnya kedua bentuk sayap ini diantaranya adalah kepadatan populasi, ketersediaan inang, dan umur tanaman (Baehaki 1993).
Biotipe Wereng Batang Coklat
Ketahanan varietas padi terhadap wereng batang coklat dianggap sama karena adanya penolakan rasa oleh serangga. Pada varietas tahan, wereng coklat dapat menghisap cairan sel tanaman dari pembuluh tapis dengan stiletnya tetapi tidak terus menerus. Hal ini diduga karena adanya bahan kimia yang menghalangi penghisapan itu. Hambatan ini mengakibatkan angka kematian nimfa tinggi dan kesuburan wereng coklat menurun.
Populasi wereng coklat sebelum varietas tahan digunakan disebut biotipe satu. Varietas tahan seperti IR 26, yang tahan terhadap wereng coklat biotipe satu, ternyata di Sumatera Utara dalam waktu lima musim sudah tidak tahan lagi, karena populasi wereng coklat sudah menjadi biotipe dua. Pada waktu ini di Indonesia pada umumnya populasi wereng coklat terdiri dari biotipe dua, dan di Sumatera Utara serta di tempat lain ada yang sudah menjadi biotipe tiga. Secara morfologi, wereng coklat biotipe baru ini sama dengan wereng coklat biotipe sebelumnya. Perbedaannya hanya secara fisiologi dan biokimia, karena wereng coklat biotipe baru ini dapat makan dan berkembang pada varietas yang dulunya tahan.
13
Kitosan dan Penggunaannya untuk Pengendalian Penyakit Tanaman
Kitosan adalah poli –(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin. Kitosan juga dijumpai secara alamiah di beberapa organisme.
Proses deasetilasi kitosan dapat dilakukan dengan cara kimiawi maupun enzimatik. Proses kimiawi menggunakan basa, misalnya NaOH dan dapat menghasilkan kitosan dengan derajat deasetilasi yang tinggi, yaitu mencapai 85-93% (Tsigos et al. 2000). Namun, proses kimiawi menghasilkan kitosan dengan bobot molekul yang beragam dan deasetilasinya juga sangat acak (Martinou et al. 1995; Tsigos et al. 2000), sehingga sifat fisik dan kimia kitosan tidak seragam. Selain itu, proses kimiawi juga dapat menimbulkan pencemaran lingkungan, sulit dikendalikan, dan melibatkan banyak reaksi samping yang dapat menurunkan rendemen (Chang et al. 1997; Tokuyasu et al. 1997). Proses enzimatik dapat menutupi kekurangan proses kimiawi. Pada dasarnya deasetilasi secara enzimatik bersifat selektif dan tidak merusak struktur rantai kitosan sehingga menghasilkan kitosan dengan karakteristik yang lebih seragam agar dapat memperluas bidang aplikasinya (Tokuyasu et al. 1997).
Kitosan merupakan padatan amorf yang berwarna putih kekuningan dengan rotasi spesifik [α]D11 -3 hingga -10° (pada konsentrasi asam asetat 2%). Kitosan larut pada kebanyakan larutan asam organik pada pH sekitar 4.0, tetapi tidak larut pada pH lebih besar dari 6.5, juga tidak larut dalam pelarut air, alkohol, dan aseton. Dalam asam mineral pekat seperti HCl dan HNO3, kitosan larut pada konsentrasi 0.15-1.1%, tetapi tidak larut pada konsentrasi 10%. Kitosan tidak larut dalam H2SO4 pada berbagai konsentrasi, sedangkan di dalam H3PO4 tidak larut pada konsentrasi 1% sementara pada konsentrasi 0.1% sedikit larut. Perlu diketahui bahwa kelarutan kitosan dipengaruhi oleh bobot molekul, derajat deasetilasi, dan rotasi spesifiknya yang beragam bergantung pada sumber dan metode isolasi serta transformasinya.
1.036 x 105 dalton tergatung proses pembuatannya. Kitosan mudah mengalami degradasi secara biologi dan tidak beracun (Kurt et al. 1991).
Kitosan merupakan polimer yang diperoleh dari kulit terluar dari krustacea seperti kepiting dan udang (Sanford & Hutchings 1987; Sanford, 1989). Kitosan mempunyai muatan positif dengan banyak polimer yang secara fisiologis dan biologis unik dan digunakan dalam berbagai bidang industri seperti tat alias (lotion dan krim wajah), makanan (pengawet, antioksidan, antimikroba), bioteknologi, farmakologi, dan obat-obatan serta pertanian (fungisida, elisitor) (Ren et al. 2001).
Penelitian menggunakan kitosan dalam pengendalian berbagai jenis patogen seperti cendawan, bakteri, dan virus saat ini telah banyak dilakukan. Kitosan bukan hanya efektif dalam menghentikan pertumbuhan patogen, tetapi juga merubah morfologi, struktur, dan disorganisasi molekul dari sel jamur (Benhamou 1992).
Pertumbuhan miselium dapat dihentikan atau menjadi lambat ketika media pertumbuhan jamur menggunakan kitosan. Peningkatan konsentrasi kitosan mengakibatkan pertumbuhan Alternaria alternate, Botrytis cinerea, Colletrotichum gloeosporioides, dan Rhizopus stolonifer, menurun (El Ghaouth et
al. 1992). Hal yang sama dilaporkan pada Sclerotinia sclerotiorum saat
konsentrasi kitosan ditingkatkan dari 1% sampai 4% (Cheah et al. 1997). Penelitian lain menunjukkan penurunan pertumbuhan linier dari Rhizoctonia fragariae dengan konsentrasi kitosan yang meningkat secara bertahap 0.5-6.0
mg/ml (Wade & Lamondia 1994). Pertumbuhan miselium Fusarium solani f.sp. phaseoli dan F. solani f.sp pisi dapat dihambat dengan kitosan pada konsentrasi
15 Kitosan juga dapat memberikan pengaruh hambatan pada penyakit tanaman yang disebabkan oleh virus dan viroid dengan meningkatkan respon hipersensitif inang terhadap infeksi virus (Pospieszny et al. 1991). Sebagai contoh, pada daun kacang, infeksi lokal yang disebabkan oleh Alfalfa mosaic virus (AMV) dapat ditekan dengan penyemprotan kitosan 0.1% atau ditambahkan pada inokulum (Pospieszny et al. 1991). Hal tersebut juga dilaporkan pada daun tomat yang terinfeksi Potato spindle tuber viroid (PSTVd) dan diberi perlakuan dengan kitosan pada konsentrasi yang sama (Pospieszny 1997).
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006). Teknik RT-PCR merupakan teknik yang digunakan untuk mendeteksi virus yang memiliki genom RNA seperti sebagian besar virus tumbuhan sehingga diperlukan modifikasi teknik PCR karena molekul sasarannya adalah RNA. RT-PCR merupakan teknik PCR yang dapat menggandakan RNA menjadi DNA. Teknik RT-PCR terdiri atas dua reaksi yaitu reaksi transkripsi balik (reverse transcription) yang menggunakan genom RNA virus sebagai cetakan dan menghasilkan cDNA primer (untai tunggal) serta reaksi penggandaan PCR. Primer yang digunakan sesuai dengan virus yang akan dideteksi (Akin 2006). PCR merupakan teknik yang relatif sederhana dan merupakan teknik penggandaan (amplifikasi) dengan menggunakan DNA primer yang memiliki runutan nukleotida khas untuk molekul asam nukleat yang akan dideteksi. Primer merupakan molekul oligonukleotida yang disintesis in vitro dan runutan nukleotidanya disesuaikan dengan genom virus yang akan dideteksi. PCR hanya akan menggandakan asam nukleat yang sesuai dengan primer.
menggunakan enzim reverse transcriptase dan primer. Tahap ini sangat penting dalam kaitannya dengan proses PCR untuk amplifikasi DNA dengan bantuan DNA polymerase sebab DNA polymerase hanya dapat bekerja pada template yang berupa DNA. Tahapan RT dapat dilakukan dalam tabung yang sama dengan PCR (one-step PCR) atau pada tabung yang terpisah (two-step PCR) menggunakan suhu berkisar 40°C sampai 50°C, tergantung pada karakteristik reverse transcriptase yang digunakan. Tahap berikutnya adalah denaturasi dsDNA pada 95°C, pada tahap ini dua untai DNA akan terpisah dan primer dapat
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai November 2011 hingga April 2012, bertempat di Laboratorium Mikologi Tumbuhan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, Rumah Kaca University Farm, Institut Pertanian Bogor, serta Laboratorium Mikrobiologi, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian (BB Biogen), Bogor.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini berupa inokulum bergejala RRSV asal Situ Gede, Bogor, tanaman padi sehat varietas Ciherang, wereng batang coklat (WBC) Nilaparvata lugens biotipe 2, kitosan Di-Maak konsentrasi 2% (produksi PT. Saha Bhojana Paripurna, Jakarta, Under License of chitosan Thailand), air, tanah, pupuk NPK, satu set Qiagen RNeasy Plant Mini Kits, komponen RT PCR, komponen PCR, dan primer RRSV.
Alat yang digunakan adalah baki plastik berukuran 33 cm x 25 cm, ember plastik besar diameter 25 cm dan tinggi 17.5 cm, aspirator plastik, kurungan plastik untuk ember besar berdiameter 20 cm dan tinggi 70 cm yang pada bagian permukaan atasnya ditutup kain kasa, gelas ukur, label nama, tabung reaksi, phmeter, hand sprayer, pipet mikro, pistil, mortar, mesin PCR, dan kamera digital.
Metode Penelitian
Penyediaan Tanaman Sumber Inokulum
Deteksi Virus Kerdil Hampa pada Tanaman Sumber Inokulum dengan Metode RT-PCR
Jaringan daun padi sumber inokulum sebanyak 0.1 g didinginkan dengan nitrogen cair, kemudian dilumatkan dengan mortar sampai menjadi tepung halus dan RNA total diekstraksi menggunakan RNeasy Plant Mini Kits (Qiagen). RNA hasil ekstraksi disintesis menjadi cDNA dengan menggunakan teknik RT. Reaksi RT dibuat dengan total volume 10 µl yang mengandung 2 µl RNA total, 2 µl buffer RT 10X, 0.35 µl 50 mM DTT (dithiothreitol), 0.5 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0.35 µl M-MuLV Rev, 0.35 µl RNase inhibitor, 0.75 µl oligo (dT), dan 3.7 µl H2O. Reaksi RT dilakukan dalam sebuah Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem,
USA) yang diprogram untuk satu siklus pada suhu 25ºC selama 5 menit, 42ºC selama 60 menit, dan 70ºC selama 15 menit.
Siapan cDNA hasil RT digunakan sebagai template dalam reaksi PCR. PE Applied Biosystem, USA). Proses ini didahului dengan denaturasi awal pada 94ºC selama 5 menit, dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada 94ºC selama 30 detik, penempelan primer (annealing) pada 55ºC selama 1 menit, dan pemanjangan (extension) pada 72ºC selama 1 menit, dan diikuti pemanjangan akhir pada 72ºC selama 7 menit. Amplikon hasil PCR dielektroforesis dengan 1% agarose gel yang mengandung ethidium bromida (EtBr) dan TAE bufer dengan voltase 90 V selama 30 menit. Hasil elektroforesis divisualisasikan dengan Transluminator UV dan didokumentasikan dengan kamera digital.
19 tanaman-tanaman padi dari daerah lain yang diduga terinfeksi RRSV sebagai pembanding dengan hasil perlakuan.
Penanaman Tanaman Uji
Varietas padi yang digunakan adalah varietas Ciherang yang disemai di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB dengan cara benih direndam terlebih dahulu selama semalam serta tanah dilumpurkan di dalam baki selama satu hari. Setelah itu, benih yang telah direndam tersebut langsung disebar atau disemai pada baki plastik berukuran 33 cm x 25 cm yang diisi dengan tanah yang telah dilumpurkan sebelumnya. Setelah berumur dua minggu bibit padi dipindahkan ke dalam ember berisi tanah dan diisi air secukupnya. Penanaman dilakukan di Rumah Kaca University Farm, IPB. Setiap ember ditanami satu bibit tanaman padi. Pada penelitian ini dilakukan sebanyak enam perlakuan dengan ulangan sebanyak tiga kali, tiap ulangan ada tiga unit tanaman sehingga digunakan 54 ember tanaman perlakuan.
Perbanyakan Wereng Batang Coklat
Wereng batang coklat (WBC) biotipe 2 (imago) diambil dari rumah kaca BALITPA, Sub BB Padi, Kebun Percobaan Muara, Bogor. WBC tersebut dibiakkan pada tanaman padi varietas Ciherang. Benih disemai di dalam baki plastik berukuran 33 cm x 25 cm yang sebelumnya telah diberi tanah basah secukupnya, kemudian dipelihara setiap hari. Setelah benih tumbuh, menjadi bibit, dan berumur tiga minggu, 12 bibit tanaman padi dipindahkan ke enam ember yang berisi tanah. Masing-masing ember diisi dua bibit tanaman padi. Tanaman padi tersebut dipelihara dan digunakan untuk inang perbanyakan WBC.
Periode Makan Akuisisi
Nimfa instar tiga WBC dipelihara pada tanaman padi asal Situ Gede, Bogor, yang bergejala RRSV (sumber inokulum). Tanaman kemudian ditutup dengan sungkup plastik yang berukuran tinggi 70 cm dan diameter 20 cm. Setelah sembilan hari, serangga dipindahkan ke tanaman padi varietas Ciherang yang sehat.
Inokulasi
Proses inokulasi dilakukan setelah sembilan hari masa akuisisi. WBC dipindahkan dengan aspirator plastik ke sejumlah tanaman padi sehat kemudian diberi kurungan kasa. Inokulasi dilakukan pada tanaman padi umur 21 HST. WBC dibunuh setelah 24 jam dengan harapan tidak ada lagi WBC yang hidup atau berkembangbiak pada tanaman-tanaman inokulasi yang dapat menyebabkan tanaman terkena serangan WBC kemudian mati duluan sebelum muncul gejala RRSV yang diharapkan.
Pembuatan Larutan Kitosan
Konsentrasi kitosan yang digunakan pada penelitian ini sebesar 0.1% dan 1% (w/v). Kitosan yang digunakan adalah kitosan dengan nama dagang Di-Maak dengan konsentrasi 2%. Konsentrasi diturunkan hingga 0.1% dan 1% dengan cara diencerkan menggunakan akuades sampai setiap konsentrasi untuk satu perlakuan didapatkan sebanyak 180 ml. Kitosan yang sudah diencerkan dengan konsentrasi tersebut disemprotkan pada tanaman padi satu hari sebelum dan sesudah diinokulasi RRSV. pH diatur menjadi 6.0 dengan penambahan NaOH.
Perlakuan
Adapun perlakuan yang digunakan adalah sebagai berikut: 1. Perlakuan kitosan 0.1% sebelum inokulasi (ch sb 0.1)
21
Parameter Pengamatan
Adapun parameter pengamatan yang diamati adalah sebagai berikut: Perkembangan Penyakit
Parameter yang digunakan untuk mengetahui perkembangan penyakit yaitu kejadian penyakit dan keparahan penyakit.
a. Kejadian penyakit
Persentase kejadian penyakit dihitung dengan rumus Sinaga (2006):
Keterangan : KP = kejadian penyakit (% tanaman bergejala) n = tanaman bergejala
N = jumlah tanaman yang diamati b. Keparahan penyakit
Perhitungan keparahan penyakit ditentukan dengan menggunakan skala yang telah ditentukan sebelum dilakukan pengamatan. Pengamatan dilakukan pada saat tanaman berumur 0 MSI sampai 5 MSI. Adapun skala yang digunakan seperti yang telah dibuat oleh Komisi Nasional Plasma Nutfah, Balai Penelitian dan Pengembangan Pertanian, Departemen Pertanian (2003) sebagai berikut:
0-Tidak ada gejala
3-Terjadi reduksi tinggi tanaman 0-10%, tidak ada daun kasar/menggulung, pembengkakan tulang daun kecil dan sangat sedikit, biasanya pada leher daun 5-Terjadi reduksi tinggi tanaman 0-10%, 1-2 helai daun menunjukkan gejala kasar/menggulung, sedikit pembengkakan tulang daun pada bagian leher daun
7-Terjadi reduksi tinggi tanaman 11-30%, 3-4 helai daun menunjukkan gejala kasar/menggulung, lebih banyak terjadi pembengkakan tulang daun pada bagian leher daun dan beberapa pada helaian dan pelepah daun
KP = x 100% n
9-Terjadi reduksi tinggi tanaman hingga >30%, sebagian besar helaian daun menunjukkan gejala kasar/menggulung, terjadi pembengkakan tulang daun umumnya pada bagian helaian dan pelepah daun
Persentase keparahan penyakit dihitung dengan rumus Sinaga (2006): P =
Keterangan: P = keparahan penyakit
n = jumlah tanaman yang diamati pada kategori serangan
v = nilai kategori serangan
Z = nilai skala kategori serangan tertinggi N = jumlah seluruh tanaman yang diamati
Pertumbuhan Tanaman
Pertumbuhan tanaman yang diamati adalah tinggi tanaman dan jumlah anakan. Penghitungan tinggi dan jumlah anakan tanaman dilakukan pada 0 sampai 5 minggu setelah inokulasi (MSI) (0, 1, 2, 3, 4, 5 MSI = 0, 7, 14, 21, 28, 35 HSI).
Analisis Data
Percobaan disusun dalam Rancangan Acak Kelompok Lengkap (RAKL). Data penelitian ditabulasi dengan program Microsoft Office Excel 2007 dan Statistical Analysis System (SAS) for windows versi 9.1.3, lalu dilanjutkan dengan
HASIL DAN PEMBAHASAN
Hasil Gejala
Gejala merupakan ekspresi dari tanaman akibat adanya gangguan fungsi fisiologis baik disebabkan oleh patogen maupun kekurangan unsur hara. Tanaman yang diberi perlakuan kitosan memiliki gejala kerusakan ringan yang meliputi beberapa daun menggulung, agak mengeriting, dan dapat juga dikatakan bahwa gejala dari tanaman yang diberi perlakuan kitosan adalah gejala yang tidak jelas atau tidak khas karena pengaruh dari kitosan itu sendiri. Sedangkan gejala tanaman kontrol positif menunjukkan gejala yang lebih parah berupa kerusakan sedang sampai berat yang meliputi sebagian besar helaian daun menunjukkan gejala kasar atau menggulung, pembengkakan tulang daun, jumlah anakan sedikit, dan kerdil.
Gambar 1 Gejala serangan RRSV pada sumber inokulum meliputi (a) kerdil, (b) daun bendera membentuk spiral, dan pada hasil perlakuan meliputi (c) daun menggulung, (d) daun mengeriting, (e) daun kasar, (f) seperti gerigitan
Pengaruh Perlakuan Kitosan terhadap Kejadian Penyakit dan Keparahan Penyakit
Kejadian penyakit. Pada tanaman perlakuan yang menunjukkan kejadian penyakit terendah adalah pada konsentrasi 1% sebelum inokulasi (ch sb 1), sedangkan perlakuan lain menunjukkan kejadian penyakit yang tidak berbeda nyata dengan kontrol positif tanpa perlakuan kitosan yaitu 100% (Tabel 1).
Keparahan penyakit. Secara umum perlakuan kitosan menurunkan keparahan penyakit. Perlakuan penyemprotan kitosan 1% sebelum inokulasi mempunyai keparahan penyakit yang lebih rendah dan berbeda nyata tetapi perlakuan lain tidak berbeda nyata dengan kontrol positif (Tabel 2). Dengan demikian perlakuan penyemprotan kitosan 1% sebelum inokulasi mampu menghambat keparahan penyakit kerdil hampa sebesar 40.74%.
Pengaruh Perlakuan Kitosan terhadap Pertumbuhan Tanaman
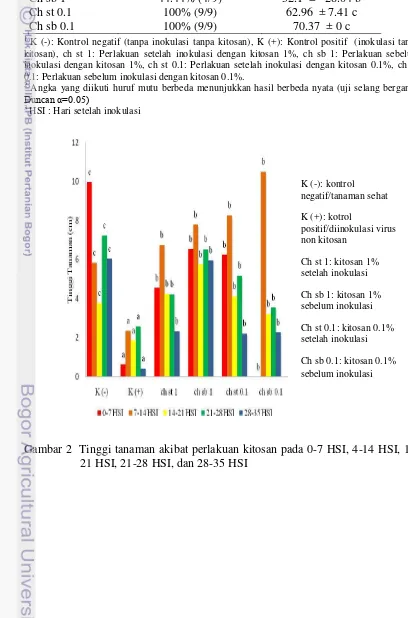
Tinggi tanaman. Tinggi tanaman merupakan salah satu aspek dalam perkembangan vegetatif. Tinggi merupakan pertumbuhan dari tanaman secara vertikal dan setiap harinya mengalami perubahan. Secara umum, perlakuan kitosan berpengaruh nyata terhadap tinggi tanaman dibandingkan dengan kontrol positif tanpa perlakuan. Perlakuan kitosan menunjukkan pengaruh terhadap tinggi tanaman mulai terlihat pada 7 HSI. Walaupun tanaman terinfeksi RRSV, namun pertumbuhannya hampir sama baiknya dengan tanaman sehat (Gambar 2 dan 3, Lampiran 1) dan pertumbuhan yang paling mendekati tanaman sehat yaitu tanaman perlakuan ch sb 1 dengan konsentrsi kitosan 1% yang disemprotkan sebelum inokulasi (Gambar 4, Lampiran 1).
25
Tabel 1 Pengaruh perlakuan kitosan terhadap kejadian dan keparahan penyakit kerdil hampa pada 35 HSI
Perlakuan Kejadian Penyakit Keparahan Penyakit
K (-) 0% (0/9) 0.00 ± 0.00 a 0.1: Perlakuan sebelum inokulasi dengan kitosan 0.1%.
2
Angka yang diikuti huruf mutu berbeda menunjukkan hasil berbeda nyata (uji selang berganda
Duncan α=0.05)
3
HSI : Hari setelah inokulasi
Gambar 3 Pengaruh kitosan terhadap tinggi tanaman. Dari kiri: K (-) atau tanaman sehat, K (+) atau tanaman diinokulasi virus non kitosan, ch st 1 atau kitosan 1% setelah inokulasi, ch sb 1 atau kitosan 1% sebelum inokulasi, ch st 0.1 atau kitosan 0.1% setelah inokulasi, dan ch sb 0.1 atau kitosan 0.1% sebelum inokulasi
27
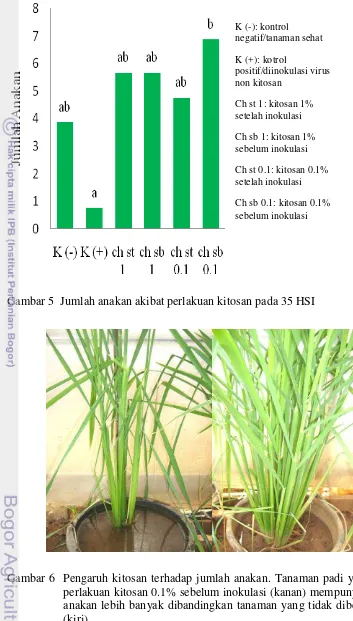
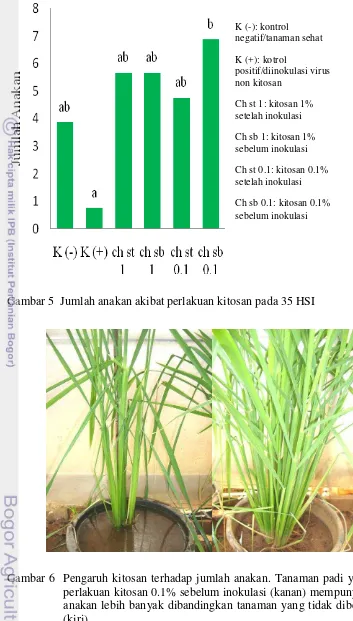
Gambar 5 Jumlah anakan akibat perlakuan kitosan pada 35 HSI
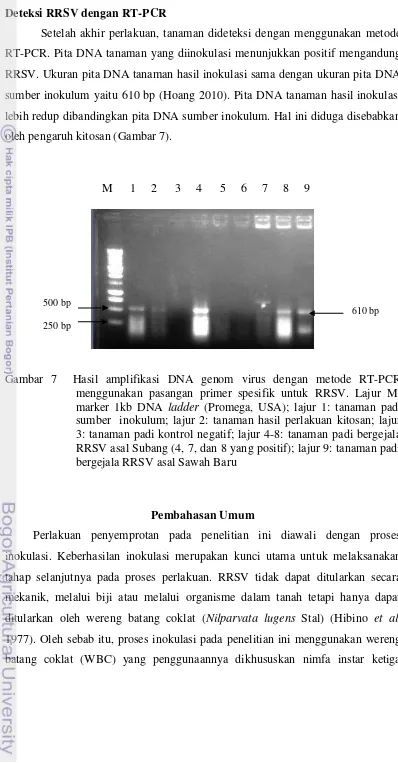
Gambar 6 Pengaruh kitosan terhadap jumlah anakan. Tanaman padi yang diberi perlakuan kitosan 0.1% sebelum inokulasi (kanan) mempunyai jumlah anakan lebih banyak dibandingkan tanaman yang tidak diberi kitosan (kiri)
K (-): kontrol
negatif/tanaman sehat
K (+): kotrol
positif/diinokulasi virus non kitosan
Ch st 1: kitosan 1% setelah inokulasi
Ch sb 1: kitosan 1% sebelum inokulasi
Ch st 0.1: kitosan 0.1% setelah inokulasi
Deteksi RRSV dengan RT-PCR
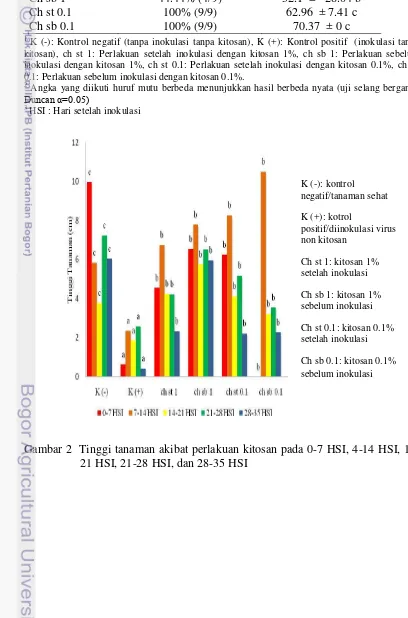
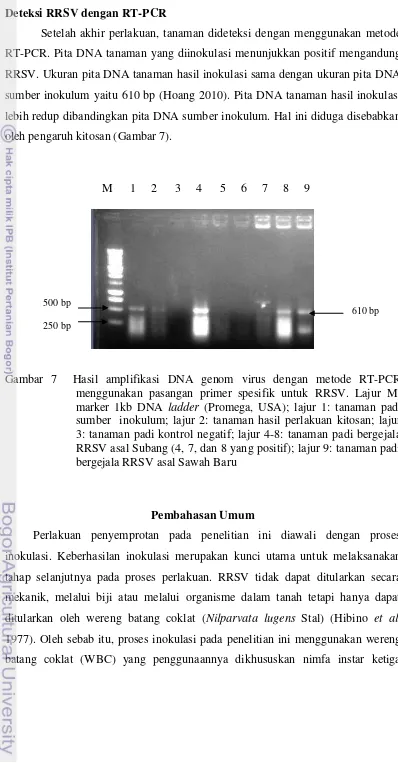
Setelah akhir perlakuan, tanaman dideteksi dengan menggunakan metode RT-PCR. Pita DNA tanaman yang diinokulasi menunjukkan positif mengandung RRSV. Ukuran pita DNA tanaman hasil inokulasi sama dengan ukuran pita DNA sumber inokulum yaitu 610 bp (Hoang 2010). Pita DNA tanaman hasil inokulasi lebih redup dibandingkan pita DNA sumber inokulum. Hal ini diduga disebabkan oleh pengaruh kitosan (Gambar 7).
Gambar 7 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan pasangan primer spesifik untuk RRSV. Lajur M: marker 1kb DNA ladder (Promega, USA); lajur 1: tanaman padi sumber inokulum; lajur 2: tanaman hasil perlakuan kitosan; lajur 3: tanaman padi kontrol negatif; lajur 4-8: tanaman padi bergejala RRSV asal Subang (4, 7, dan 8 yang positif); lajur 9: tanaman padi bergejala RRSV asal Sawah Baru
Pembahasan Umum
Perlakuan penyemprotan pada penelitian ini diawali dengan proses inokulasi. Keberhasilan inokulasi merupakan kunci utama untuk melaksanakan tahap selanjutnya pada proses perlakuan. RRSV tidak dapat ditularkan secara mekanik, melalui biji atau melalui organisme dalam tanah tetapi hanya dapat ditularkan oleh wereng batang coklat (Nilparvata lugens Stal) (Hibino et al. 1977). Oleh sebab itu, proses inokulasi pada penelitian ini menggunakan wereng batang coklat (WBC) yang penggunaannya dikhususkan nimfa instar ketiga
M 1 2 3 4 5 6 7 8 9
500 bp
250 bp
29 karena menurut Ghosh dan John (1980), nimfa lebih efisien daripada imago dalam menularkan RRSV. Persentase penularan nimfa instar pertama 19.3%, instar kedua 25.8%, instar ketiga 29%, instar keempat 27.6% dan instar kelima 21.4%. Selain ketepatan dari vektor, inokulasi juga didukung dari sumber inokulum. Maka sebelum penularan, sumber inokulum dideteksi terlebih dahulu dengan metode RT-PCR. Setelah hasil deteksi menunjukkan positif RRSV maka tahap penularan dapat dilaksanakan. Gejala hasil inokulasi dapat terlihat jelas setelah pengamatan selama 35 HSI.
Keberhasilan inokulasi juga dapat dilihat dari hasil deteksi RT-PCR sumber inokulum dan tanaman perlakuan (Gambar 7). Terbukti bahwa ukuran pita DNA tanaman perlakuan penyemprotan kitosan sama dengan ukuran pita DNA sumber inokulum yaitu 610 bp (Hoang 2010). Namun di antara keduanya yang membedakan adalah terangnya pita DNA. Hal ini dapat dilihat bahwa pita DNA hasil perlakuan penyemprotan kitosan lebih redup dibandingkan dengan terang pita DNA sumber inokulum.
Perlakuan kitosan 1% sebelum inokulasi (ch sb 1) mempunyai nilai kejadian penyakit paling rendah (44.44%). Sedangkan perlakuan lainnya mempunyai kejadian penyakit 100% seperti kontrol positif sehingga kejadian penyakit pada perlakuan kitosan 1% sebelum inokulasi berbeda nyata dengan kejadian penyakit perlakuan lainnya. Hal sama terjadi pada keparahan penyakit dimana perlakuan kitosan 1% sebelum inokulasi memiliki keparahan penyakit terendah (32.09%) yang berbeda nyata, baik dengan perlakuan kitosan lain maupun dengan kontrol positif (Tabel 1, Lampiran 17). Gejala tanaman yang diberi perlakuan kitosan adalah kerusakan ringan yang meliputi beberapa daun menggulung, agak mengeriting, dan dapat juga dikatakan bahwa gejala dari tanaman yang diberi perlakuan kitosan adalah gejala yang tidak jelas atau tidak khas karena pengaruh dari kitosan itu sendiri. Hal ini menunjukkan bahwa perlakuan kitosan 1% sebelum inokulasi paling efektif terhadap kejadian dan keparahan penyakit kerdil hampa pada tanaman padi.
berbeda nyata dengan kontrol positif (45.99 cm) (Gambar 3, Lampiran 1). Perlakuan ini juga memiliki rata tinggi tanaman yang paling mendekati rata-rata tinggi tanaman sehat (Gambar 4). Sedangkan untuk jumlah anakan, kitosan 0.1% sebelum inokulasi mempunyai rata-rata jumlah anakan yang paling banyak dan berbeda nyata dengan kontrol positif (Gambar 5, Lampiran 2). Kemampuan kitosan dalam merangsang pertumbuhan disebabkan oleh sifat kitosan yang mampu meningkatkan respon terhadap hormon giberelin dan auksin (Uthairatanakij et al. 2007).
Pada umumnya kitosan berpengaruh dalam menekan penyakit tanaman yang disebabkan oleh virus. Kitosan dilaporkan mampu menekan infeksi Tobacco necrosis virus, Tobacco mosaic virus, Peanut stunt virus, Cucumber mosaic virus,
dan Potato virus X (Pospieszny et al. 1991; Chirkov 2002; Pospieszny 1997; Struszczyk 2002). Khusus konsentrasi kitosan 1%, Haryanto (2010) dan Ramadhan (2012) mengemukakan bahwa kitosan konsentrasi 1% memberikan hasil terbaik dalam penekanannya terhadap infeksi Bean common mosaic virus pada tanaman kacang panjang.
KESIMPULAN DAN SARAN
Kesimpulan
Pada konsentrasi dan waktu aplikasi kitosan yang diuji, perlakuan penyemprotan kitosan 1% sebelum inokulasi paling efektif dalam menekan kejadian dan keparahan penyakit kerdil hampa, serta meningkatkan tinggi tanaman. Hal ini ditunjukkan dengan persentase kejadian dan keparahan penyakit yang paling kecil dan berbeda nyata dibandingkan dengan perlakuan lain serta untuk tinggi tanaman, perlakuan ini paling mendekati tinggi tanaman sehat.
Saran
DAFTAR PUSTAKA
Aak. 2001. Budidaya Tanaman Padi. Yogyakarta: Kanisius.
Addy HS. 2009. Biotechnology molecular.
http://tophotnews.wordpress.com/2009/11/25/reverse-transcription-pcr-rt-pcr/ [21 Januari 2012].
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York: Academic Press. Akin HM. 2006. Virologi Tumbuhan. Yogyakarta: Kanisius.
Ardjasa WS, Sudaryanto B. 2002. Komponen unggulan teknologi untuk meningkatkan produktivitas dan pendapatan budidaya padi pada lahan sawah irigasi di Lampung. Makalah seminar IPTEK Padi pada Pekan Padi Nasional I di Balitpa, Sukamandi, 5 Maret 2002. 19 p.
Babang Suprihatno et al. 2010. Deskripsi Varietas Padi. Subang: Balai Besar Penelitian Tanaman Padi.
Baehaki SE. 1993. Berbagai Hama Serangga Padi. Bandung: Angkasa.
[BBPTP] Balai Besar Penelitian Tanaman Padi. 2006. Deskripsi Varietas Padi. Sukamandi: Balai Besar Penelitian Tanaman Padi.
Benhamou N, Theriault G. 1992. Treatment with chitosan enhances resistence of tomato plants to the crown and root pathogen Fusarium oxysporum f. sp. radicis-lycopersici. Physiol. Mol. Plant Pathol. 41: 34-52.
Chang KL, Tsai G, Lee J, Fu WR. 1997. Heterogeneous N-deacetylation of chitin in alkaline solution. Carbohydrate Res. 303: 327-332.
Cheah LH, Page BBC, Sheperd R. 1997. Chitosan coating for inhibition of Sclerotina carrots. N. Z. J. Crop Hort Sci. 25: 89-90.
Chirkov SN. 2002. The antiviral activity of chitosan (review). App Biochem Microbiol 38:1–8.
El Ghaouth A, Arul J, Asselin A, Benhamou N. 1992. Antifungal activity of chitosan on post-harvest pathogens: induction of morphological and cytological alterations in Rhizopus stolonifer. Mycol. 96: 769-779.
Ghosh, A. V. T. John. 1980. Rice ragged stunt virus disease in India. Plant Dis 64: 1032-1033.
Hadwiger LA, Beckman JM. 1980. Chitosan asa component of pea-Fusarium solani interactions. Plant Physiol. 66: 205-211.
Harahap IS, Tjahjono B. 1997. Pengendalian Hama Penyakit Padi. Jakarta: Swadaya.
Haryanto. 2010. Pemanfaatan kitosan untuk menekan infeksi virus mosaik pada tanaman kacang panjang (Vigna unguiculata subsp. sesquipedalis) [Skripsi]. Fakultas Pertanian, Institut Pertanian Bogor.
Hibino H, Roechan M, Sudarisman S, Tantera DM. 1977. A virus disease of rice (kerdil hampa) transmitted by brown planthopper, Nilaparvata lugens Stal, in Indonesia. Contr Centr Res Inst Agric Bogor 35: 15 p.
Hoang HTT, Lam ND, Nguyan CN, Chu HH. 2010. Genetic variation of Rice ragged stunt virus isolated in Vietnam [Unpublished]. http://www.ncbi.nlm.nih.gov/nuccore/FR696611.1 [ 29 Maret 2012].
Kendra DF, Hadwiger LA. 1984. Characterization of the smallest chitosan oligomer that is maximally antifungal to Fusarium solani and elicits pisatin formation by Pisum sativum. Mycol. 8: 276-281.
Kurt ID, Varum KM, Smidsord O. 1991. Chitosan crosslinked with Mo (VI) polyxyanions effect of chemical properties. Di dalam : Brine CJ, Sandford PA, Zikakis JP, Editor. Advances in Chitin and Chitosan. New York. Elsevier Applied Science.
Ling KC, Tiongco ER, Aguiero VM. 1977. Transmission of rice ragged stunt disease. Int. Rice Res. Newsl. 2 (6) : 11-12.
Ling KC, Tiongco ER, Aguiero VM. 1978. Rice ragged stunt disease in the Philippines. IRRI Res. Paper Series. 16: 25 p.
Matthews REF. 1991. Plant Virology. Ed ke-3. London: Academic Press.
Mochida O, Suryana T, Hendarsih, Wahyu A. 1977. Identification, biology, occurrence and appearance of the brown planthopper. Papper Presented at the Pasific. Science Association Symp. Denpasar. Indonesia.
Nasoetion AH. 2001. Pengantar ke Ilmu-Ilmu Pertanian. Jakarta: PT. Pustaka Litera AntarNusa.
Naylor M, Murphy AM, Berry JO, and Carr JP. 1998. Salicylic acid can induce resistance to plant virus movement. Molecular Plant Microbe Interac 11: 860-866.
Pospieszny H, Chirkov S, Atabekov J. 1991. Induction of antiviral resistance in plants by chitosan. Plant Sci 79: 63-68.
Pospieszny H. 1993. Effect of chitosan on infection of potato spindle tuber viroid (PSTV). 6th International Congress of Plant Pathology Montreal. Canada. Pospieszny H. 1997. Antiviroid activity of chitosan. Crop Protec 16: 105-106. Ramadhan Rizki. 2012. Evaluasi beberapa konsentrasi kitosan terhadap
penekanan infeksi Bean common mosaic potyvirus pada tanaman kacang panjang (Vigna sinensis) [Skripsi]. Fakultas Pertanian, Institut Pertanian Bogor.
35 Ren H, Endo H, Hayashi T. 2001. Antioxidative and antimutagenic activities and polyphenol content of pesticide-free and organically cultivated green vegetable using water-soluble chitosan as a soil modifier and leaf surface spray. J. Food Agric Sci. 81: 1426-1432.
Sandford PA. 1989. Chitin and Chitosan. Skjak-braek, Athonsen G, Sandford TP, editor. Elsevier Applied Science, London and New York.
Sandford PA, Hutchings GP. 1987. Industrial polysaccharides. Di dalam: Yalpani M, Editor. Chitosan a natural cationic biopolymer: Industrial applications. Amsterdam: Elsevier. Hlm 363-376.
Sinaga MS. 2006. Dasar-dasar Ilmu Penyakit Tumbuhan. Depok: Penebar Swadaya.
Shikata ER, Senboku TE, Tiongco, Ling KC. 1978. Transmission of rice ragged stunt disease by Nilaparvata lugens in Japan. Int. Rice Res. Newsl. 3 (2) : 8. Siregar H. 1980. Budidaya Tanaman Padi di Indonesia. Jakarta: Sastra Hudaya. Struszczyk MH. 2002. Chitin and chitosan - Part II Applications of Chitosan.
Polimery 47: 396–403.
Tokuyasu K, Ono H, Kameyama MO, Hayashi K, Moil Y. 1997. Deacetylation of Chitin Oligosaccharides of dp 2-4 by Chitin Deacetylase from Colletotrichum Lindemuthianum. Carbohydrate Res. 303:353-358.
Tsigos I, Martinou A, Kafetzopoulos D, Bouriotis V. 2000. Chitin Deacetylases: New, Versatile Tools in Biotechnology. TIBTECH. 18:305-312.
Uthairatanakij A, Silva JAT, Obsuwan K. 2007. Chitosan for improving orchid production and quality. J. Orchid Sci and Biotech 1: 1-5.
Vasyukova NI, Zinov‟eva SV, ll‟inskaya LI, Perekhod EA Chalenko GI, Gerasimova NG, ll‟ina AV, Varmalov VP, Ozeretskovskaya OL. 2001. Modulation of plant resistance to desease by water-soluble chitosan. App Biochem Microbiol 37 (1): 103-109.
Wade HE, Lamondia JA. 1994. Chitosan inhibits Rhizoctonia fragariae but not Strawberry black root rot. Adv. Strawberry Res. 13: 26-31.
Wang J, Wang B, Jiang B, dan Zhao Y. 2007. Quality and shelf life of mango (Mangifera indica l. cv. „Tainong‟) coated by using chitosan and polyphenols. SAGE Publications. Food Sci Tech Int 13 (4): 317-322. Yuwono T. 2006. Teori dan Aplikasi Polymerase Chain Reaction. Yogyakarta:
37
Lampiran 1 Pengaruh kitosan terhadap tinggi tanaman
1
K (-): Kontrol negatif (tanpa inokulasi tanpa kitosan), K (+): Kontrol positif (inokulasi tanpa kitosan), ch st 1: Perlakuan setelah inokulasi dengan kitosan 1%, ch sb 1: Perlakuan sebelum inokulasi dengan kitosan 1%, ch st 0.1: Perlakuan setelah inokulasi dengan kitosan 0.1%, ch sb 0.1: Perlakuan sebelum inokulasi dengan kitosan 0.1%.
2Angka yang diikuti huruf mutu berbeda menunjukkan hasil berbeda nyata (uji selang berganda Duncan α=0.05) 3
HSI : Hari setelah inokulasi
Perlakuan Tinggi tanaman (cm)
0 HSI 7 HSI 14 HSI 21 HSI 28 HSI 35 HSI
K (-) 81.68 ± 5.02 c 91.66 ± 11.17c 97.50 ± 14.08 c 101.28 ± 15.68 c 108.53 ± 15.22 c 114.59 ± 16.04 c K (+) 38.12 ± 6.18 a 38.75 ± 6.02 a 41.11 ± 8.21 a 42.97 ± 9.72 a 45.56 ± 14.39 a 45.99 ± 15.70 a Ch st 1 54.20 ± 11.4 b 58.76 ± 14.34 b 65.52 ± 20.97 b 69.78 ± 25.57 b 74.01 ± 27.90 b 76.35 ± 30.32 b Ch sb 1 53.53 ± 12.18 b 60.08 ± 13.56 b 67.88 ± 16.95 b 73.64 ± 16.39 b 80.17 ± 16.87 b 86.14 ± 17.28 b Ch st 0.1 50.58 ± 12.67 b 56.83 ± 13.45 b 65.10 ± 15.56 b 69.23 ± 17.72 b 74.41 ± 22.22 b 76.63 ± 26.49 b Ch sb 0.1 55.45 ± 14.8 b 55.45 ± 14.81 b 65.96 ± 22.31 b 69.19± 25.26 b 72.74 ± 22.16 b 75.02 ± 31.88 b
Lampiran 2 Pengaruh kitosan terhadap jumlah anakan tanaman
Perlakuan Jumlah Anakan
0 HSI 7 HSI 14 HSI 21 HSI 28 HSI 35 HSI
K (-) 2.22± 1.39 b 2.77± 1.48 d 3.44± 1.51 b 2.55± 1.24 a 2.99± 1.41 a 3.88 ± 1.83 ab K (+) 0.33± 0.71a 0.44± 0.88 b 0.55± 1.13 a 0.55± 1.33 a 0.77± 1.64 a 0.77± 1.64 a Ch st 1 0.77± 1.20 a 0.77± 1.20 c 1 ± 1.5 a 4.106± 4.17 a 4.44± 4.56 a 5.66 ± 4.39 ab Ch sb 1 0.88 ± 0.78 a 1.1± 0.93 a 1.66± 1.32 a 4.33± 3.04 a 5.00± 3.54 a 5.66± 3.28 ab Ch st 0.1 0.66± 1.12 a 0.77± 1.30 a 1.11± 1.76 a 3.55± 3.13 a 4.11± 3.30 a 4.77± 3.31 ab Ch sb 0.1 0.99± 1.41 a 0.99± 1.41 a 1.44 ± 2.13 a 5.22± 8.41 a 6.11± 8.57 a 6.88± 8.31 b
Catatan kaki seperti pada Lampiran 1.
39 Lampiran 3 Pengaruh kitosan terhadap kejadian penyakit (KP)
Perlakuan KP
0 HSI 7 HSI 14 HSI 21 HSI 28 HSI 35 HSI
K (-) 0.00 ± 0.00 0.00 ± 0.00 a 0.00 ± 0.00 a 0± 0 a 0.00 ± 0.00 a 0.00± 0 a K (+) 0.00 ± 0.00 55.55 ± 19.24 b 55.55 ± 19.24 b 55.55± 19.24 c 100.00 ± 0.00 c 100.00 ± 0.00 c Ch st 1 0.00 ± 0.00 11.11 ± 19.24 a 33.33 ± 33.33 ab 33.33 ± 33.33 abc 100.00 ± 0.00 c 100.00 ± 0.00 c Ch sb 1 0.00 ± 0.00 11.11 ± 19.24 a 11.11 ± 19.24 a 11.11 ± 19.24 ab 44.44± 38.49 b 44.44± 38.48 b Ch st 0.1 0.00 ± 0.00 11.11 ± 19.24 a 11.11 ± 19.24 a 44.44 ± 19.24 bc 100.00 ± 0.00 c 100.00 ± 0.00 c Ch sb 0.1 0.00 ± 0.00 0.00 ± 0.00 a 33.33 ± 33.33 ab 33.33 ± 33.33 abc 77.77± 19.24 c 100.00 ± 0.00 c
Catatan kaki seperti pada Lampiran 1.
Lampiran 4 Pengaruh kitosan terhadap keparahan penyakit (P)
Perlakuan P
0 HSI 7 HSI 14 HSI 21 HSI 28 HSI 35 HSI
K (-) 0.00 ± 0.00 0.00 ± 0.00 a 0.00 ± 0 .00a 0.00± 0.00a 0.00 ± 0.00 a 0.00 ± 0.00 a K (+) 0.00 ± 0.00 18.51 ± 6.41 b 30.85 ± 10.69 b 30.85 ± 10.69 b 58.02± 8.55 c 72.83± 8.55 c Ch st 1 0.00 ± 0.00 3.70 ± 6.41 a 13.57 ± 11.90 a 18.51 ± 18.51 b 55.55± 0 c 67.9± 4.28 c Ch sb 1 0.00 ± 0.00 3.70 ± 6.41 a 6.17 ± 10.69 a 6.17 ± 10.68 a 27.20± 23.81 b 32.1± 28.04 b Ch st 0.1 0.00 ± 0.00 3.70 ± 6.41 a 6.17 ± 10.69 a 14.81 ± 6.41 b 55.55± 0 c 62.96± 7.41 c Ch sb 0.1 0.00 ± 0.00 0.00 ± 0.00 a 13.57 ± 11.90 a 18.51 ± 18.51 b 50.61± 13.01 c 70.37± 0 c
Catatan kaki seperti pada Lampiran 1.
4
41 Lampiran 5 Hasil analisis ragam pertumbuhan tinggi tanaman pada 0 HSI
Sumber
Hasil uji lanjut perbandingan berganda Duncan
Perlakuan Subset
a Uses Harmonic Mean Sample Size = 3.000. b Alpha = .05.
Lampiran 6 Hasil analisis ragam pertumbuhan tinggi tanaman pada 7 HSI Sumber
Hasil uji lanjut perbandingan berganda Duncan
Perlakuan Subset