(Andrographis paniculata)
GUSMAINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul “Pemanfataan Bakteri
Endofit untuk Meningkatkan Produksi dan Kadar Andrografolid pada Tanaman Sambiloto (Andrographis paniculata) adalah benar karya saya dengan arahan dari
komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Maret 2014
Gusmaini
Kadar Andrografolid pada Tanaman Sambiloto (Andrographis paniculata).
Dibimbing oleh SANDRA ARIFIN AZIZ, DIDY SOPANDIE, ABDUL MUNIF dan NURLIANI BERMAWIE.
Sambiloto (Andrographis paniculata) merupakan salah satu tanaman yang
banyak digunakan dalam industri obat. Hal tersebut disebabkan karena sambiloto mempunyai banyak khasiat antara lain sebagai antimalaria, antidiabetes, antimikroba, antivirus, antiinflamasi, dan antikanker. Permasalahan yang dihadapi dalam mengembangkan budidaya tanaman sambiloto yaitu produksi dan kadar andrografolid rendah. Teknik budidaya belum terstandar dan penelitian yang minim adalah salah satu penyebabnya. Upaya yang dapat dilakukan untuk mengatasi permasalahan tersebut adalah dengan pemberian bakteri endofit dan fosfat. Bakteri endofit mempunyai peran sebagai pemacu pertumbuhan tanaman dan penghasil senyawa metabolit sekunder. Peranan tersebut didukung dengan dihasilkannya senyawa pemacu pertumbuhan tanaman antara lain auksin, giberelin, dan sitokinin, serta dapat menyuplai hara melalui fiksasai N dan melarutkan P. Fosfat berperan sebagai penyusun makro molekul, pembentuk senyawa penyimpanan dan transfer energi, serta regulator reaksi biokimia. Penelitian ini diharapkan dapat meningkatkan hasil baik secara kuantitas maupun kualitas.
Penelitian ini secara umum bertujuan untuk mendapatkan konsorsium bakteri endofit serta dosis fosfat yang mampu meningkatkan produksi dan kadar andrografolid pada tanaman sambiloto. Penelitian ini secara khusus bertujuan: 1) mendapatkan konsorsium bakteri endofit dari tanaman sambiloto pada beberapa kondisi agroklimat yang mampu memicu pertumbuhan tanaman sambiloto, 2) mendapatkan konsorsium bakteri endofit yang berpotensi dalam memicu pertumbuhan, produksi dan kadar andrografolid pada tanaman sambiloto, 3) memperoleh informasi hubungan konsorsium bakteri endofit dan fosfat terhadap pertumbuhan, produksi dan kadar andrografolid pada tanaman sambiloto di lapangan, 4) memperoleh informasi hubungan antara konsorsium bakteri endofit dan fosfat pada media larutan hara dalam meningkatkan produksi dan kadar andrografolid. Disertasi ini disusun berdasarkan percobaan series dari percobaan ke-satu hingga ke-empat.
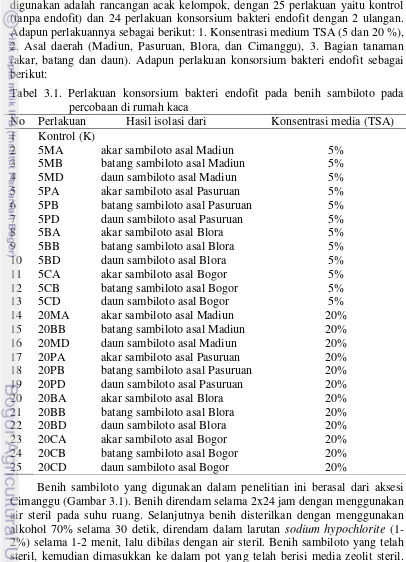
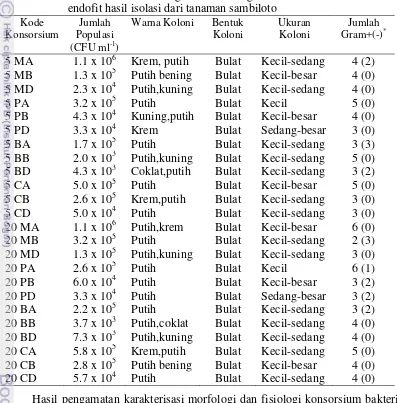
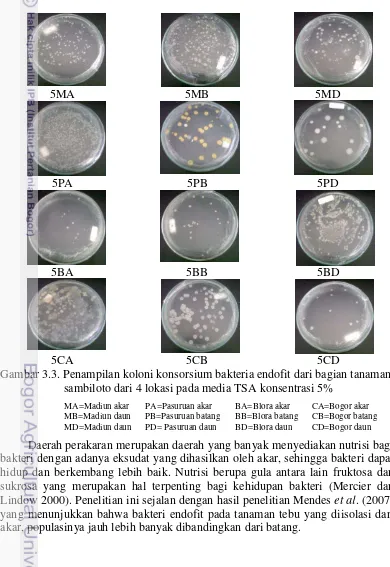
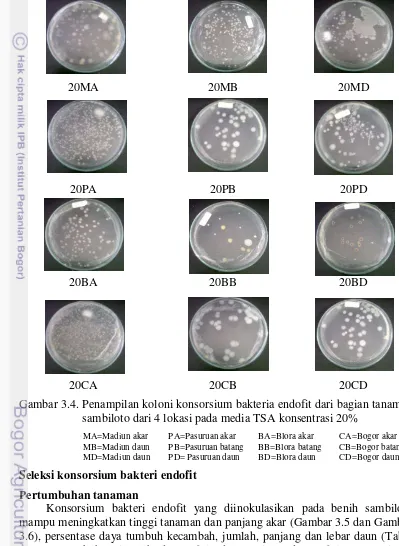
Percobaan ke-satu berjudul “Eksplorasi, isolasi dan seleksi konsorsium bakteri endofit dari tanaman sambiloto sebagai pemacu pertumbuhan tanaman”. Penelitian ini mengisolasi bakteri endofit yang berasal dari 4 lokasi yaitu Jawa Barat (Bogor), Jawa Tengah (Blora), dan Jawa Timur (Madiun dan Pasuruan) dengan kondisi agroklimat yang berbeda. Hasil penelitian menunjukkan bahwa diperoleh 24 konsorsium bakteri endofit yang beragam dari bagian tanaman akar, batang, dan daun pada 2 macam konsentrasi media Trytone Soya Agar 5 dan 20%.
pemacu pertumbuhan dan produksi andrografolid pada tanaman sambiloto”. Percobaan di rumah kaca ini menyeleksi 4 konsorsium bakteri endofit ditambah satu isolat yang berasal dari daun tanaman Graminae di rumah kaca. Pengujian
menggunakan rancangan acak kelompok, 6 perlakuan dan 4 ulangan. Perlakuan terdiri atas: kontrol, konsorsium 5MD, 20BB, 20BD, 20 CD, dan 90AA (isolat dari Graminae). Hasil penelitian menunjukkan bahwa konsorsium bakteri endofit
berpotensi memacu pertumbuhan tinggi tanaman dan jumlah cabang primer, produksi bahan kering tanaman dan kadar andrografolid pada tanaman berumur 14 MST. Bobot kering tajuk meningkat berkisar 25-82.81%, sejalan dengan meningkatnya serapan hara N, P, dan K. Peningkatan bobot kering tajuk dan produksi andrografolid tertinggi ditunjukkan oleh konsorsium bakteri endofit 20CD. Konsorsium bakteri endofit 20CD, 20BB dan 20BD nyata meningkatkan kadar andrografolid dibandingkan dengan kontrol.
Percobaan ke-tiga berjudul “Penggunaan bakteri endofit dan pupuk P pada tanaman sambiloto”. Percobaan ini merupakan percobaan lapangan menguji konsorsium bakteri endofit dan pupuk P. Penelitian menggunakan RAK, 9 perlakuan, faktorial, dan 3 ulangan. Faktor pertama adalah konsorsium bakteri endofit yaitu 1) tanpa konsorsium bakteri endofit, 2) konsorsium 20CD, dan 3) konsorsium 20BB. Faktor ke-dua adalah dosis pupuk P terdiri atas: 1) tanpa P, 2) 27 kg ha-1 P, dan 3) 54 kg ha-1 P. Hasil penelitian menunjukkan bahwa kedua konsorsium bakteri endofit mampu meningkatkan pertumbuhan, produksi dan kadar andrografolid dibandingkan tanpa konsorsium bakteri endofit pada tanaman berumur 14 MST. Konsorsium bakteri endofit 20CD dan 20BB pengaruhnya sama dalam meningkatkan produksi bahan kering, kadar dan produksi andrografolid. Kadar andrografolid yang dihasilkan 2.42% (20BB) dan 2.69% (20CD). Pemberian pupuk P nyata meningkatkan pertumbuhan, produksi bahan kering tanaman dibandingkan dengan tanpa P. Peningkatan produksi bahan kering tanaman sejalan dengan peningkatan karakter fisiologi tanaman yaitu luas daun, laju tumbuh relatif dan laju asimilasi bersih. Dosis 27 dam 54 kg ha-1 P sama dalam menghasilkan produksi bahan kering tanaman dan produksi andrografolid. Pemberian pupuk P tidak meningkatkan kadar andrografolid. Konsorsium bakteri endofit atau pupuk P meningkatkan serapan hara N, P, dan K. Konsorsium bakteri endofit dan pupuk P tidak berinteraksi di lapang.
yang dihasilkan lebih tinggi (2.7%). Pemberian konsorsium bakteri endofit pada kondisi dosis P kurang dan dosis P cukup tidak berpengaruh terhadap parameter yang diamati didalam media larutan hara.
Hasil dari kempat percobaan tersebut menunjukkan bahwa 24 konsorsium bakteri endofit yang diperoleh dari tanaman sambiloto yang tumbuh pada beberapa agroklimat beragam dan berpotensi sebagai pemacu pertumbuhan tanaman. Pada kondisi P cukup produksi bahan kering tanaman yang dihasilkan meningkat, tetapi pada kondisi kekurangan P kadar andrografolid yang meningkat, dan konsorsium bakteri endofit tidak berperan didalam media larutan hara. Dua konsorsium bakteri endofit terbaik yaitu 20CD dan 20BB mampu memacu pertumbuhan, produksi dan kadar andrografolid serta serapan hara N, P, dan K pada tanaman sambiloto berumur 14 MST di lapangan. Pemberian pupuk P berperan dalam meningkatkan pertumbuhan dan produksi bahan kering serta produksi andrografolid. Pemberian pupuk P tidak meningkatkan kadar andrografolid. Hasil penelitian ini merekomendasi konsorsium bakteri endofit yang diisolasi dari daun tanaman sambiloto dari daerah Bogor pada media TSA 20% (20CD) dan yang diisolasi dari batang tanaman sambiloto dari daerah Blora pada media TSA 20% (20BB) atau pemupukan P dengan dosis 27 kg ha-1 untuk budidaya tanaman sambiloto pada tanah Latosol atau tanah-tanah yang mempunyai sifat kimia yang sama dengan percobaan ini.
Andrographolide Content on King of Bitter (Andrographis paniculata).
Supervised by SANDRA ARIFIN AZIZ, DIDY SOPANDIE, ABDUL MUNIF and NURLIANI BERMAWIE.
King of bitter (Andrographis paniculata) is widely used in the
pharmaceutical industry as antimalarial, antidiabetic, antimicrobial, antiviral, anti-inflammatory, and anticancer. The problems in its cultivation were low yield and andrographolide content since appropriate cultivation techniques have not been standardized and minimal research. One of the solutions was the application of endophytic bacteria and phosphate. Endophytic bacteria have roles as growth promoter and producer of secondary metabolites. They generate plant hormone such as auxin, gibberellins, and cytokinins, and also can supply nutrients such as Nitrogen fixation and Phophate solubilization. Phosphate acts as a constituent of macro molecules and compound storage; transferring energy; and regulating biochemical reactions. This research aimed to increase yield of king bitter plant both in quantity and quality.
This study had general objective to find endophytic bacteria consortia and appropriate phosphate dosage to increase yield and andrographolide content of king of bitter. Specifically it aimed to: 1) obtain endophytic bacteria consortia at king of bitter indigenous from several agro-climatic conditions which can promote plant growth, 2) obtain potential endophytic bacteria consortia which can stimulate plant growth and increase yield and andrographolide content, 3) obtain the information of the association of endophytic bacteria consortia and phosphate on growth, yield and andrographolide content of king of bitter in the field, 4) obtain the information of association of endophytic bacteria consortia and phosphate in increasing the yield and content of andrographolide of king of bitter in nutrient solution media. This dissertation consisted of four experiments.
The title of first experiment was “The exploration, isolation and selection of endophytic bacteria consortia from king bitter plant as plant growth promoter”. The activity in this study was to isolate endophytic bacteria from four locations which has different agro-climatic conditions viz. West Java (Bogor), Central Java (Blora), and East Java (Madiun and Pasuruan). The results showed there were 24 endophytic bacteria consortia from roots, stems, and leaves. Media used for isolation were 5% and 20% Trytone Soya Agar (TSA). The consortia isolated from root tissue (105-106 CFU ml-l) had higher population than from leaves and stems (103-105 CFU ml-l). All the 24 consortia were potential as plant growth promoter. However, only four consortia (5MD, 20BB, 20BD, and 20CD) had better effect on plant growth than others, so chosen and tested for further research.
The title of the second experiment was “The potency of endophytic bacteria consortia to promote growth and andrographolide content on king bitter plant”. Four selected endophytic bacteria and one bacteria isolated from Graminae
indicated by 20CD. Andrographolide content of 20CD, 20BB and 20BD treatments were significantly higher than control.
The title of the third experiment was “The application of endophytic bacteria and P fertilizer on king of bitter in the field”. This research was designed in RBD factorial, 9 treatments, and 3 replications. The first factor was endophytic bacteria consortia treatments 1) no endophytic bacteria consortia, 2) 20CD, and 3) 20BB. The second factor was the rate of P fertilizer consisted of: 1) without P, 2) 27 kg ha-1 P, and 3) 54 kg ha-1 P. The results showed that both endophytic bacterial consortia were capable of enhancing growth, and increasing yield and andrographolide content at 14 WAP. The 20CD and 20BB treatments had similar effect in increasing dry matter production, content and yield of andrographolide. Andrographolide content of 20CD and 20BB treatments were 2.42 and 2.69% respectively. The application of P fertilizer significantly increased growth, dry matter yield than without P. The increased of dry matter yield were indicated by physiological characters of plant such as increase in leaf area, relative growth rate and net assimilation rate. The application of 27 and 54 kg ha-1 P gave similar result at dry matter yield and andrographolide yield. The application of 27 kg ha-1 P did not increase andropholide content. Endophytic bacteria consortia or P fertilizer application increased N, P, and K uptake. There were no interaction between endophytic bacteria consortia and P fertilizer treatments.
The title of the fourth experiment was “The agronomic response of king of bitter to the endophytic bacteria consortia and phosphate in nutrient solution media”. This experiment consisted of two stages: a) the response of king of bitter to several P concentrations in nutrient solution media. The trial was designed in randomized block design, 6 treatments and 4 replications. P concentrations tested were 0, 0.01, 0.05, 0.1, 1.0, dan 2.0 mM KH2PO4, b) the response of king bitter plant to endophytic bacteria consortia and P concentration in nutrient solution media. The trial was arranged in RBD (randomized block design), 4 treatments and 6 replications. The treatments consisted of: 0.1 mM KH2PO4, 0.1 mM KH2PO4 + 20 CD, 1.0 mM KH2PO4, and 1.0 mM KH2PO4 + 20CD. The first stage experiment resulted standard concentrations of P were P deficient (0.1 mM KH2PO4) and P sufficient (1.0 mM KH2PO4). The results of the second stage revealed that the application of P sufficient produced the highest dry matter production and nutrient uptake, but produced low andrographolide content (2.33%). Phosphate deficient produced lower dry matter production, but produced highest andrographolide content (2.7%). The application of endophytic bacteria consortia at condition of P deficient or P sufficient on nutrient solution media had no significant effect on parameters observed.
27 kg ha P fertilizer were recommended for king of bitter cultivation at Latosols or soils that have the similar soil chemistry properties with experiment land.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Agronomi dan Hortikultura
PEMANFAATAN BAKTERI ENDOFIT UNTUK
MENINGKATKAN PRODUKSI DAN KADAR
ANDROGRAFOLID PADA TANAMAN SAMBILOTO
(Andrographis paniculata)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
1. Ujian Tertutup Tanggal 4 Februari 2014 Penguji Luar Komisi Pembimbing: a. Dr Ir Maya Melati, MS MSc.
Staf Pengajar pada Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor
b. Dr Dra Rahayu Widyastuti, MSc
Staf Pengajar pada Departemen Ilmu Tanah Fakultas Pertanian, Institut Pertanian Bogor
2. Ujian Terbuka Tanggal 26 Maret 2014 Penguji Luar Komisi Pembimbing: a. Dr Ir Yul Bahar
Sekretaris Direktorat Jendral Hortikultura Kementerian Pertanian
b. Dr Ir Sudradjat
Judul Disertasi : Pemanfaatan Bakteri Endofit untuk Meningkatkan Produksi dan Kadar Andrografolid pada Tanaman Sambiloto (Andrographis paniculata)
Nama : Gusmaini
NRP : A262090091
Disetujui oleh: Komisi Pembimbing
Prof Dr Ir Sandra Arifin Aziz, MS Ketua
Prof Dr Ir Didy Sopandie, MAgr Anggota
Dr Ir Abdul Munif, MScAgr Anggota
Dr Ir Nurliani Bermawie Anggota
Diketahui oleh:
Ketua Program Studi Agronomi dan Hortikultura
Dekan Sekolah Pascasarjana
Dr Ir Maya Melati, MS MSc
Tanggal Ujian: 26 Maret 2014
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Alhamdulillahi rabbil alamin, puji dan syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga karya ilmiah ini dapat diselesaikan dengan baik.
Disertasi berjudul ”Pemanfataan Bakteri Endofit untuk Meningkatkan Produksi
dan Kadar Andrografolid pada Tanaman Sambiloto (Andrographis paniculata)” disusun berdasarkan 4 tahap penelitian yang dilaksanakan secara terpadu. Keempat tahap penelitian tersebut merupakan penelitian dalam satu kesatuan baik laboratorium, rumah kaca dan di lapngan. Disertasi ini diharapkan dapat memberikan pengetahuan dan informasi mengenai peluang pemanfaatan konsorsium bakteri endofit sebagai agensia hayati dan pemupukan yang dapat bermanfaat dan berguna dalam peningkatan produktivitas dan kandungan andrografolid pada budidaya tanaman sambiloto.
Ucapan terima kasih dan penghargaan setinggi-tingginya penulis sampaikan kepada Prof Dr Ir Sandra Arifin Aziz, MS, Prof Dr Ir Didy Sopandie, MAgr, Dr Ir Abdul Munif MScAgr, dan Dr Ir Nurliani Bermawie, selaku komisi pembimbing atas segala bimbingan dan arahannya sehingga disertasi ini dapat terselesaikan dengan baik. Ucapan terima kasih juga disampaikan kepada yang terhormat Dr Ir Ahmad Junaedi, MSi dan Dr Ir Suryo Wiyono sebagai penguji luar komisi yang telah memberikan masukan pada ujian prelim lisan. Dr Ir Maya Melati, MS MSc dan Dr Dra Rahayu Widyastuti, MSc selaku penguji luar komisi pada ujian tertutup, kami ucapkan terima kasih.
Ucapan terima kasih juga penulis sampaikan kepada Kepala Badan Penelitian dan Pengembangan Pertanian, Ketua Komisi Pembinaan Tenaga Badan Penelitian dan Pengembangan Pertanian, Kepala Balai Penelitian Tanaman Rempah dan Obat, yang telah memberikan kesempatan untuk mengikuti pendidikan program Doktor di IPB dan mendanai penelitian melalui program KKP3T.
Ungkapan terima kasih juga disampaikan kepada teman-teman Teknisi Litkayasa Ekofisologi, Laboratorium Uji Balittro yang telah banyak membantu dalam pelaksanaan penelitian. Ucapan terima kasih juga disampaikan kepada teman-teman seperjuangan Angkatan 2009 Program Studi AGH (Tyas Pratiwi, Amisnaipa, Maisura, Marjani Aliyah, Alce Ilona Noya, M. Cholid, Amrullah, dan La Ode afa) yang selama perkuliahan dan penelitian banyak berinteraksi dan berdiskusi, serta memberikan semangat. Teman-teman di Balittro, Forum petugas belajar Badan Litbang Pertanian di IPB, Yayasan Mahkota Insan Cita, alumni HMI, alumni Faperta Unila 86 serta semua rekan-rekan lain yang tidak dapat disebutkan satu persatu atas segala perhatian, dukungan, bantuan dan doanya dalam penyelesaian studi.
Terima kasih dan penghargaan yang mendalam dan terkasih penulis tujukan kepada suami tercinta Widya Hartono, anak-anakku Dini Aulia Ramadhanty dan M. Dannis Aulia, atas segala kesabaran, ketabahan, pengertian, pengorbanan, dan doanya.
Disertasi ini terkhusus penulis persembahkan kepada kedua orang tua tercinta, ayahanda (Zainal Abidinsyah alm) dan terutama ibunda (Sinjarmas almh) yang hingga akhir hayatnya tidak henti-hentinya mendoakan, memberikan dorongan dan semangat agar cepat selesai. Ucapan terima kasih juga penulis sampaikan kepada mertua, kakak-kakak (Sadrawati, Zunafiah, Leaderwan, Yulianti, dan Agustami), adik (Hidayatullah), dan ipar yang telah memberikan dorongan semangat, motivasi, dan doanya. Kepada semua pihak yang telah berperan dalam penelitian dan penulisan disertasi ini yang tidak dapat ditulis satu persatu, penulis ucapkan terima kasih. Akhir kata, penulis berharap hasil penelitian ini dapat bermanfaat bagi pihak-pihak yang memerlukannya.
Bogor, Maret 2014
DAFTAR ISI
Halaman
DAFTAR TABEL xvi
DAFTAR GAMBAR xviii
DAFTAR LAMPIRAN xx
1. PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
Kerangka dan Ruang Lingkup Penelitian 3
2. TINJAUAN PUSTAKA 5
3. EKSPLORASI, ISOLASI DAN SELEKSI KONSORSIUM BAKTERI ENDOFIT DARI TANAMAN SAMBILOTO SEBAGAI PEMACU
PERTUMBUHAN TANAMAN 18
Abstrak 18
Pendahuluan 19
Bahan dan Metode 20
Hasil dan Pembahasan 22
Simpulan 31
4 POTENSI KONSORSIUM BAKTERI ENDOFIT SEBAGAI PEMACU PERTUMBUHAN DAN PRODUKSI ANDROGRAFOLID PADA
TANAMAN SAMBILOTO 32
Abstrak 32
Pendahuluan 33
Bahan dan Metode 34
Hasil dan Pembahasan 37
Simpulan 44
5 PENGGUNAAN KONSORSIUM BAKTER ENDOFIT DAN PUPUK
FOSFAT PADA TANAMAN SAMBILOTO 45
Abstrak 45
Pendahuluan 46
Bahan dan Metode 47
Hasil dan Pembahasan 49
Simpulan 60
6 TANGGAP AGRONOMI TANAMAN SAMBILOTO TERHADAP KONSORSIUM BAKTERI ENDOFIT DAN FOSFAT PADA MEDIA
LARUTAN HARA 62
Abstrak 62
Bahan dan Meode 64
Hasil dan Pembahasan 66
Simpulan 75
7. PEMBAHASAN UMUM 77
8. SIMPULAN DAN SARAN 81
DAFTAR PUSTAKA 83
LAMPIRAN 99
DAFTAR TABEL
Halaman
2.1. Respon tanaman terhadap keadaan kahat P 18
3.1. Perlakuan konsorsium bakteri endofit 21
3.2. Kondisi agroklimat daerah asal eksplorasi tanaman sambiloto yang
digunakan pada percobaan ini 22
3.3. Sifat kimia tanah ke-empat lokasi eksplorasi tanaman sambiloto 23 3.4. Kadar andrografolid pada tanaman sambiloto dari daerah eksplorasi 24 3.5. Karakterisasi daun tanaman sambiloto hasil eksplorasi 24 3.6. Karakterisasi morfologi koloni bakteri endofit hasil isolasi dari tanaman
sambiloto 25
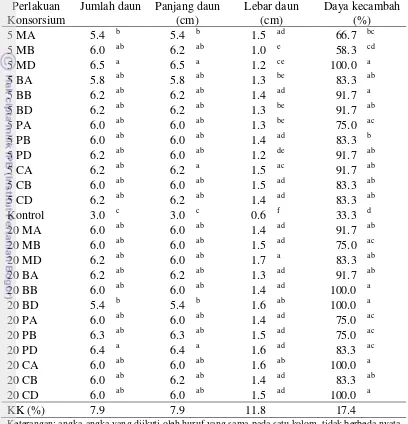
3.7. Pertumbuhan tanaman sambiloto setelah diinokulasi bakteri endofit pada
umur 1.5 bulan 29
3.8. Bobot kering tanaman sambiloto setelah diinokulasi bakteri endofit pada
umur 1.5 bulan 31
4.1. Sifat kimia pada tanah dan pupuk kandang 35
4.2. Pengujian HR bakteri endofit pada tanaman tembakau 36 4.3. Pengaruh konsorsium bakteri endofit terhadap pertumbuhan tanaman
sambiloto umur 14 MST 38
4.4. Produksi hormon pada bakteri endofit 39
4.5. Pengaruh konsorsium bakteri endofit terhadap terhadap
produksi bahan segar tanaman sambiloto umur 14 MST 39 4.6. Pengaruh konsorsiium bakteri endofit terhadap produksi
bahan kering tanaman sambiloto 41
4.7. Pengaruh konsorsium bakteri endofit terhadap kadar dan
serapan hara pada tanaman sambiloto 42
4.8. Pengaruh konsorsium bakteri endofit terhadap kadar dan produksi
andrografolid pada tanaman sambiloto 43
5.1. Kondisi lingkungan pada saat percobaan 49
5.2. Pengaruh bakteri endofit dan P terhadap pertumbuhan tinggi tanaman dan jumlah cabang primer tanaman sambiloto pada umur 8 dan 14 MST 51 5.3. Pengaruh bakteri endofit dan P terhadap karakter fisiologis tanaman
sambiloto umur 14 MST 52
5.4. Pengaruh konsorsium bakteri endofit dan pupuk P terhadap
produksi bahan kering tanaman sambiloto pada 8 dan 14 MST 54 5.5. Pengaruh bakteri konsorsium endofit dan pupuk P terhadap
5.6. Pengaruh konsorsium bakteri endofit dan P terhadap kadar dan
produksi andrografolid umur 8 dan 14 MST 59
6.1. Bahan kering tanaman dan kadar andrografolid pada media
larutan hara umur 4 MST 68
6.2. Pengaruh P dan bakteri endofit pada media larutan hara
terhadap produksi bahan kering tanaman sambiloto 4 MST 72 6.3. Pengaruh P dan bakteri endofit pada media larutan hara terhadap serapan
DAFTAR GAMBAR
Halaman 1.1. Diagram alir penelitian pemanfaatn konsorsium bakteri endofit untuk
meningkatkan produksi dan kadar andrografolid pada tanaman sambiloto 4 2.1. Biosintesis lintasan mevalonat dan non mevalonat 8
3.1. Benih sambiloto asal aksesi cimanggu 22
3.2. Penampilan lingkungan tumbuh sambiloto di tempat ekplorasi 23 3.3. Penampilan koloni konsorsium bakteri endofit dari bagian tanaman
sambiloto dari 4 lokasi pada konsentrasi TSA 5% 26 3.4. Penampilan koloni konsorsium bakteri endofit dari bagian tanaman
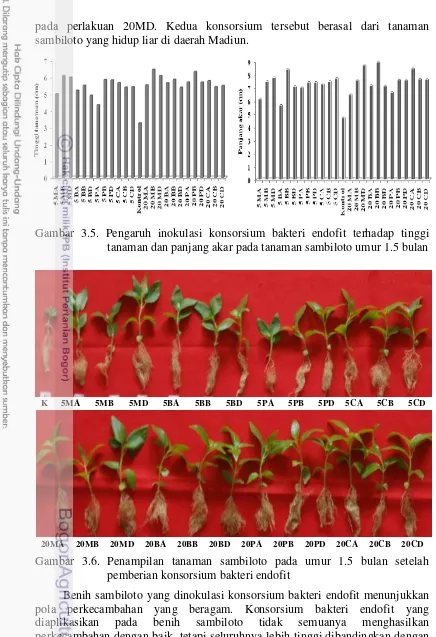
sambiloto dari 4 lokasi pada konsentrasi TSA 20% 27 3.5. Pengaruh inokulasi bakteri endofit terhadap tinggi tanaman
dan panjang akar pada umur 1.5 bulan. 28
3.9. Penampilan tanaman sambiloto pada umur 1.5 bulan setelah
pemberian konsorsium bakteri endofit 28
4.1. Pengujian HR bakteri endofit pada tanaman tembakau 36 4.2. Keragaan koloni konsorsium bakteri endofit 36 4.3. Keragaan tanaman sambiloto setelah aplikasi konsorsium
bakteri endofit pada umur 14 MST 38
4.4. Keragaan bobot segar tajuk sambiloto setelah pemberian
konsorsium bakteri endofit 40
5.1. Keragaan tanaman sambiloto di lapang pada umur 8 dan 14 MST 50 5.2. Pengaruh pemberi bakteri endofit dan P terhadap perakaran tanaman
sambiloto 50
5.3. Keragaan tanaman sesuai perlakuan pada 14 MST 54 5.4. Hubungan umur tanaman dengan LTR pada pemberian
konsorsium bakteri endofit (A) dan pupuk fosfat (B) 56 5.5. Hubungan umur tanaman dengan LAB pada pemberian
konsorsium bakteri endofit (A) dan pupuk fosfat (B) 57 6.1. Keragaan alat percobaan pada media larutan hara 65 6.2. Pengaruh pemberian P terhadap (A) tinggi tanaman dan (B)
panjang akar tanaman sambiloto di dalam media larutan hara 66 6.3. Pengaruh dosis P terhadap pertumbuhan sambiloto pada
media larutan hara umur 4 MST 67
6.4. Penampilan tanaman sambiloto pada keenam konsentasi P didalam
6.5. Pengaruh pemberian P terhadap luas daun (LA) dan nisbah luas daun
(NLD) tanaman sambiloto pada media larutan hara umur 4 MST 69 6.6. Keragaan tanaman setelah aplikasi konsorsium bakteri endofit dan P
di dalam media larutan hara umur 4 MST 70
6.7. Pengaruh konsorsium bakteri endofit dan P terhadap pertumbuhan
di dalam media larutan hara umur 4 MST 71
6.8. Keragaan tajuk tanaman sambiloto setelah pemberian P dan konsorsium bakteri endofit di dalam media larutan hara umur 4 MST 71 6.9. Pengaruh pemberian P dan konsorsium bakteri endofit terhadap
kadar andrografolid (A) dan produksi androgarolid (B) tanaman
DAFTAR LAMPIRAN
Halaman
1 Cara isolasi konsorsium bakteri endofit 100
2 Lay out percobaan 101
3 Komposisi larutan hara 103
1. PENDAHULUAN
Latar Belakang
Tanaman sambiloto (Andrographis paniculata) merupakan salah satu
tanaman obat yang hidup di daerah tropis dan banyak tumbuh tersebar secara liar di Asia termasuk Indonesia. Tanaman sambiloto merupakan sejenis tanaman herba termasuk famili Acanthaceae yang banyak digunakan dan diyakini
masyarakat Indonesia mempunyai banyak khasiat dan manfaat, namun belum dibudidayakan dengan baik dan benar. Tanaman sambiloto yang dipergunakan untuk industri obat tradisional diambil dari tanaman yang tumbuh liar dengan kondisi lingkungan yang sangat beragam sehingga mutu simplisia yang dihasilkan belum memenuhi standar (Yusron dan Januwati2004).
Tanaman sambiloto mengandung beberapa senyawa kimia antara lain terpenoid, flavonoid, alkane, keton, aldehid, mineral (kalium, kalsium, natrium), asam kersik, dan dammar (Rao et al. 2004). Senyawa-senyawa tersebut banyak
terkandung didalam daun tanaman sambiloto dengan senyawa utama andrografolid yang merupakan senyawa lakton dari golongan terpenoid khususnya diterpenoid (Srivastava dan Akhila 2010). Andrografolid menunjukkan aktivitas sitotoksik dan sitostatik terhadap sel kanker dan anti-tumor (Chen et al. 2007; Akowuah et al. 2006), antihepatoprotektif (Kapil et al.
1993; Batkhuu et al. 2002), antiinflamasi (Wang et al. 2004; Levita et al. 2010),
antioksidan (Lin et al. 2009), antidiabetes (Zhang et al. 2009), dan antimikrob
(Xu et al. 2006).
Beragam hasil penelitian telah dilakukan untuk meningkatkan produksi biomas dan andrografolid pada tanaman sambiloto antara lain pemberian pupuk (Yusron et al. 2007; Ramesh et al. 2011), penggunaan mikoriza (Arpana dan
Bagyaraj 2007), dan pemberian fitohormon secara eksogen (Anuradha et al.
2010). Hasil penelitian di Indonesia menunjukkan produksi herba kering berkisar 0.64–1.3 ton ha-1, kadar andrografolid kurang dari 2%, dan potensi produksi andrografolid 15.05–16.25 kg ha-1 (Yusron et al. 2007; Mariani 2009). Hasil
penelitian di India mencapai produksi herba kering sambiloto berkisar 1.4–3.3 ton ha-1, kadar andrografolid 2-2.5%, dan potensi produksi andrografolid berkisar 38-41 kg ha-1 (Ramesh et al. 2011; Singh et al. 2011).
Penyebab rendahnya produksi tersebut diperkirakan karena belum diperolehnya teknologi budidaya yang tepat untuk pengembangan budidaya tanaman sambiloto akibat minimnya penelitian yang dilakukan. Teknologi budidaya tersebut meliputi faktor genetik yaitu dihasilkannya aksesi/varietas yang mempunyai daya hasil tinggi dan lingkungan tumbuh yang sesuai. Penelitian yang banyak dilakukan hanya terfokus pada peningkatan hasil biomas, dan belum banyak yang mengarah pada kandungan bahan aktif (kadar andrografolid). Salah satu upaya dalam mengatasi permasalahan tersebut adalah dengan penggunaan bakteri endofit dan pemberian fosfat.
Peranan bakteri endofit yang cukup signifikan dalam meningkatkan produksi tanaman pangan antara lain pada tanaman tebu (Dong et al. 1995), padi
(Fitri dan Gofar 2009), dan kacang tanah (Lee et al. 2005). Pada umumnya
seperti antimikroba dan antibiotik (Radji 2005; Ebrahimi et al. 2010), antiviral,
antikanker, anti‐inflammasi, dan antioksidan (Strobel dan Daisy 2003; Guo et al.
2008). Demikian pula dengan tanaman sambiloto, penelitian bakteri endofit masih terbatas sebagai antimikroba dan antibiotik (Rahardjo dan Syarmalina 2006; Anurachalam dan Gayathri 2010; Kannan et al. 2012), antimalaria (Levita et al. 2010), dan diversifikasi genetik bakteri endofit (Yogiara et al. 2012),
sedangkan peran bakteri endofit dalam budidaya tanaman obat terutama sambiloto masih belum diketahui.
Bakteri endofit diketahui dapat mengikat hara nitrogen dari udara dan melarutkan fosfat sehingga mengurangi pengggunaan pupuk buatan (Pedraza et al. 2004), serta memproduksi fitohormon (Puente et al. 2009). Selain itu, bakteri
endofit dapat pula memproduksi senyawa bioaktif alami (Strobel 2003; Firakova
et al. 2007; Guo et al. 2008). Fitohormon selain dapat memacu perumbuhan
tanaman, juga dapat meningkatkan produksi bahan aktif tanaman. Senyawa andrografolid merupakan senyawa biosintesis yang termasuk didalam golongan terpenoid khususnya diterpenoid (Srivastava dan Akhila 2010) yang diproduksi melalui lintasan asam mevalonat pada sitosol atau non mevalonat pada plastid, yang disintesis dari Isopentenyl Pyrophosphate (IPP) (Croteu et al. 2000;
Brielmann et al. 2006). Hasil penelitian menunjukkan bahwa pemberian GA3 dan
IAA eksogen mampu meningkatkan kadar andrografolid pada tanaman sambiloto (Anurada et al. 2010). Adanya peran-peran bakteri endofit tersebut di atas
diharapkan dapat berdampak positif terhadap pengembangan budidaya tanaman sambiloto.
Selain bakteri endofit, fosfat juga penting dalam peningkatan produksi dan kadar andrografolid tanaman sambiloto. Fosfat mempunyai 3 fungsi yang sangat penting didalam tanaman yaitu sebagai 1) penyusun makro molekul, 2) pembentuk senyawa penyimpanan dan transfer energi, 3) regulator reaksi biokimia melalui fosforilasi yang dapat mengaktivasi atau protein inaktif yang dianggap sebagai faktor kunci dalam sinyal transduksi (Maschner 1995). Fosfat memegang peranan penting pada banyak reaksi enzim, hal ini karena fosfat bagian dari inti sel yang sangat penting dalam pembelahan sel dan perkembangan jaringan meristem, merangsang pertumbuhan akar dan mempercepat pembungaan dan pemasakan buah, maka apabila terjadi kekurangan fosfat, hal ini mengindikasikan pada pengurangan secara umum sebagian besar proses metabolisme seperti pembelahan dan pembesaran sel, respirasi dan fotosintesis (Terry dan Ulrich 1993).
Pada proses metabolisme sekunder terutama biosintesis andrografolid yang tergolong senyawa aktif golongan terpenoid khususnya diterpenoid. Fosfat diperlukan dalam setiap proses mulai dari pembentukan asam mevalonat melalui proses fosforilasi yang memerlukan energi yaitu adenosin trifosfat (ATP). Proses selanjutnya yaitu pembentukan Isopentenyl Pyrophosphate juga memerlukan
suplai fosfat hingga terbentuknya andrografolid (Vickery dan Vickery 1981; Brielmann 2006; Srivastava dan Akhila 2010).
Tujuan Penelitian
andrografolid pada tanaman sambiloto sebagai bahan baku obat alami. Penelitian ini secara khusus bertujuan untuk:
1. Mendapatkan konsorsium bakteri endofit dari tanaman sambiloto pada beberapa kondisi agroklimat yang mampu memicu pertumbuhan tanaman sambiloto.
2. Mendapatkan konsorsium bakteri endofit yang berpotensi dalam memicu pertumbuhan, produksi dan kadar andrografolid pada tanaman sambiloto. 3. Memperoleh informasi hubungan konsorsium bakteri endofit dan fosfat
terhadap pertumbuhan, produksi dan kadar andrografolid pada tanaman sambiloto di lapangan.
4. Memperoleh informasi hubungan antara konsorsium bakteri endofit dan fosfat pada media larutan hara dalam meningkatkan produksi dan kadar andrografolid.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat: 1) menyediakan inovasi teknologi untuk menghasilkan bahan baku sambiloto dan mutu yang baik dengan memanfaatkan bakteri endofit, dan 2) menyediakan informasi tentang peranan konsorsium bakteri endofit dan fosfat terhadap produksi dan kadar andrografolid pada tanaman sambiloto.
Hipotesis
1. Konsorsium bakteri endofit dari beberapa kondisi agroklimat yang mampu memacu pertumbuhan tanaman sambiloto.
2. Konsorsium bakteri endofit yang berpotensi mampu meningkatkan pertumbuhan, produksi dan kadar andrografolid pada tanaman sambiloto. 3. Informasi hubungan konsorsium bakteri endofit dan fosfat terhadap
pertumbuhan, produksi dan kadar andrografolid pada tanaman sambiloto di lapangan.
4. Korelasi positif antara pemberian fosfat dan konsorsium bakteri endofit pada media larutan hara dalam meningkatkan produksi dan kadar andrografolid.
Kerangka dan Ruang Lingkup Penelitian
antara konsorsium bakteri endofit dengan hara P. Seluruh penelitian dilakukan di laboratorium mikrobiologi, rumah kaca dan kebun percobaan Balittro Bogor. Analisis kimia tanah dan jaringan tanaman dilakukan di Laboratorium Uji Balittro. Analisis andrografolid dilakukan di Laboratorium Pusat Studi Biofarmaka IPB dan Balittro. Analisis hormon dilakukan di Laboratorium Balai Besar Pasca Panen Litbang Pertanian, dan identifikasi bakteri dilakukan di Laboratorium International Centre Biodiversity Bogor (ICBB). Ruang lingkup penelitian disajikan pada Gambar 1.1 berikut:
Rekomendasi konsorsium bakteri endofit dan fosfat untuk meningkatkan produksi dan kadar andrografolid
2. TINJAUAN PUSTAKA
Tanaman Sambiloto (Andrographis paniculata) Botani dan taksonomi
Sifat morfologi tanaman sambiloto yang tumbuh pada lingkungan tumbuh berbeda pada umumnya sama, kecuali pada sifat morfologi kuantitatif seperti tinggi tanaman, panjang dan lebar daun. Tanaman sambiloto termasuk dalam klasifikasi sebagai berikut:
Spesies : Andrographis paniculata Nees
Produksi dan mutu simplisia tanaman obat pada umumnya dipengaruhi oleh faktor genetik (varietas) dan lingkungan, termasuk di dalamnya teknologi budidaya, kondisi lahan dan penanganan pasca panen. Faktor-faktor lingkungan yang berpengaruh terhadap pertumbuhan dan produksi tanaman antara lain iklim meliputi cahaya, curah hujan, suhu udara, kelembaban dan lingkungan perakaran baik fisik maupun kimia (Pujiasmanto et al. 2007).
Lingkungan tumbuh
Kondisi lingkungan yang optimal akan mendukung tanaman untuk tumbuh dengan baik. Tanaman sambiloto menginginkan lingkungan tumbuh dengan tipe iklim A, B dan C menurut klasifikasi Schmidt dan Ferguson dengan curah hujan 2000-3000 mm tahun-1. Ketinggian tempat yang optimum bagi pertumbuhan dan produksi sambiloto yaitu mulai 1-700 m dpl. Tinggi tempat ini erat hubungannya dengan suhu yang juga sangat berpengaruh terhadap berbagai proses fisiologi tanaman dan akan mempengaruhi produksi sambiloto (Yusron dan Januwati 2004).
Tanaman sambiloto menghendaki banyak sinar matahari, namun demikian tanaman ini masih tumbuh dan berproduksi dengan baik pada kondisi ternaungi sampai 30%, tetapi jika budidaya dilakukan dengan kondisi naungan diatas 30%, mutu simplisia sambiloto cenderung menurun. Hasil penelitian Saravanan et al.
(2008) menunjukkan bahwa total herbal tanaman sambiloto dan hasil andrografolid merupakan yang tertinggi di bawah kondisi cahaya terbuka. Hal tersebut menunjukkan bahwa A. paniculata sesuai untuk budidaya terbuka.
Sambiloto mampu tumbuh hampir pada semua jenis tanah. Pada habitat alamnya, sambiloto ditemui di hutan-hutan pada kondisi solum tanah yang dangkal. Sambiloto dapat tumbuh di ketinggian 180-861 m di atas permukaan laut dengan kondisi lingkungan suhu 20-27oC, kelembaban udara relatif 78-87%, dan curah hujan 2000-3000 mm tahun-1. Sambiloto dapat tumbuh pada tanah dengan kandungan unsur hara N sedang, P rendah, K sedang, Mg rendah, Ca sangat rendah sampai rendah, C organik rendah sampai sedang, dan pH masam sampai sangat masam (Pujiasmanto et al. 2007).
sambiloto yang tumbuh di dataran menengah (2.27 %), sedangkan di dataran rendah (1.37 %) dan dataran tinggi (0.89 %) (Pujiasmanto et al. 2009). Tanaman
sambiloto untuk menghasilkan produksi yang maksimal, memerlukan kondisi tanah yang subur. Kadar andrografolid terbentuk melalui proses metabolisme sekunder dalam tumbuhan sebagai upaya untuk mempertahankan diri dari ekosistem tumbuhnya, oleh karena itu tinggi rendahnya kadar metabolit sekunder dalam setiap tumbuhan dipengaruhi oleh lingkungan seperti ketinggian tempat, curah hujan, kesuburan tanah dan suhu (Vanhaelen et al. 1991).
Senyawa kimia yang terkandung dalam tanaman sambiloto
Daun dan percabangan tanaman sambiloto mengandung laktone yang terdiri dari deoksi andrografolid, andrografolid, flavonoid, alkane, keton, aldehid, mineral (kalium, kalsium, dan natrium), asam kersik, dan dammar (Rao et al.
2004). Andrografolid termasuk golongan biosintesis diterpenoid yang utama di dalam A. paniculata dan turunannya telah diidentifikasi sebagai kandungan kimia
utama yang bertanggung jawab atas terapeutik tanaman (Chao dan Lin 2010; Wang et al. 2004; Xia 2004; Chen et al. 2007; Wang et al. 2009; Akowuah et al.
2006; Muntha et al. 2003; Nanduri et al. 2004; Rao et al. 2004; Srivastava et al.
2004).
Efek farmakologis tanaman sambiloto
Tanaman sambiloto mempunyai banyak khasiat dan manfaat. Hasil penelitian menunjukkan bahwa secara farmakologi, tanaman sambiloto banyak sekali efeknya antara lain sebagai antikanker dan antitumor (Jada et al. 2007;
Akowuah et al. 2006), hepatoprotektif (Kapil et al. 1993; Batkhuu et al. 2002;
Liu et al. 2007; Rao et al. 2004), antiinflamasi (Wang et al. 2004; Levita et al.
2010), antioksidan (Lin et al. 2009), antidiabetes (Zhang et al. 2009), antibakteri
(Xu et al. 2006), agen antivirus (Calabrese et al. 2000; Singh et al. 2001),
antihipertensi (Huang 1987), antihyperglycaemic (Zhang dan Tan 1999), dan
antiHIV (Calabrese et al. 2000), obat demam, sakit tenggorokan, dan malaria
(Pandy dan Mandal 2010). Andrografolid mempunyai beberapa turunan yang berpotensi sebagai antikanker antara lain 14 acetylandrografolid sebagai
antikanker leukemia, ginjal, dan rahim (Jada et al. 2007). Neoandrografolid
sebagai antihepatotoxicity (Kapil et al. 1993; Batkhuu et al. 2002; Liu et al.
2007).
Beberapa hasil penelitian menunjukkan bahwa pertumbuhan sel kanker dapat dihambat dengan menggunakan ekstrak andrografolid yang terkandung dalam tanaman sambiloto. Derivat andrografolid yaitu 3.19-isopropylidene andrographolide adalah selektif terhadap leukemia dan sel-sel kanker usus besar
sedangkan 14-acetylandrographolide adalah selektif terhadap leukemia, sel-sel
kanker ovarium dan ginjal (Jada et al. 2007). Jiang et al. (2007) menyatakan
andrografolid dapat menghambat adhesi sel kanker lambung ke sel endotel dengan memblokir ekspresi eselectin (Jiang et al. 2007), dan menghambat sel
kanker manusia (Shi et al. 2008).
Metabolit Sekunder
Metabolit sekunder dijumpai dalam jumlah terbatas pada tumbuhan dan metabolit sekunder tertentu mungkin dihasilkan pada satu spesies atau beberapa spesies tertentu, sedangkan metabolit primer ditemukan hampir pada semua spesies tumbuhan (Taiz dan Zeiger 2002).
Metabolit sekunder merupakan senyawa yang disintesis tanaman dan digolongkan menjadi lima yaitu glikosida, terpenoid, fenol, flavonoid, dan alkaloid. Senyawa-senyawa tersebut bermanfaat bagi tanaman itu sendiri maupun bagi serangga, hewan dan manusia. Metabolit sekunder sangat diperlukan bagi tumbuhan karena mempunyai fungsi yang cukup penting antara lain: 1) sistem pertahanan terhadap virus, bakteri dan jamur, 2) sistem pertahanan terhadap serangga, 3) sistem pertahanan terhadap tanaman lain melalui allelopati, 4) atraktan serangga untuk membantu penyerbukan, 5) sistem pertahanan terhadap lingkungan yang kurang menguntungkan, dan 6) sebagai obat, food additive,
flavor, pewarna dan pestisida nabati (Vickery dan Vickery 1981).
Pengertian senyawa terpenoid
Tanaman sambiloto mengandung metabolit sekunder yang tergolong dalam senyawa terpenoid khususnya diterpenoid (Srivastava dan Akhila 2010). Terpenoid adalah senyawa metabolit sekunder yang berasal dari senyawa hidrokarbon isometrik dan merupakan kelompok bahan kimia yang paling luas dan beragam dari produk alami. Senyawa ini dihasilkan terutama oleh berbagai macam tanaman, meskipun beragam tetapi memiliki struktur yang sederhana dan mudah diklasifikasikan. Terpenoid adalah kelompok yang unik dari hidrokarbon alam berbasis produk alam, strukturnya diturunkan dari isopren, dan menimbulkan struktur yang dibagi ke dalam unit-unit isopentane (2-methylbutane) (Brielmann et al. 2006).
Istilah terpenoid atau isoprenoid terdiri atas 5 karbon isopren yang semuanya adalah turunan dari terpenoid (Vickery dan Vickery 1981). Terpenoid berasal dari berbagai jenis
zat produk alami yang disintesis tumbuhan dengan berbagai fungsi yang penting secara fisiologi maupun terhadap manusia. Lebih dari 40000 jenis terpenoid telah diisolasi dari tanaman, binatang dan berbagai spesies bakteri (Rohdich et al.
2005).
Struktur dan biosintesis terpenoid
Struktrur terpenoid berasal dari isoprene memiliki rumus molekul C5H8.
Rumus molekul dasar senyawa terpen merupakan kelipatan (C5H8)n dengan n adalah jumlah unit isoprene terkait. Struktur-struktur yang terkait dalam pembentukan terpenoid adalah: isoprene, dimethylalllil pyrophospat (DMAPP), dan Isopentenyl Pyrophosphate (IPP) (Vickery dan Vickery 1981; Brielmann et al. 2006). Senyawa Terpenoid dapat
terbentuk melalui 2 lintasan yaitu: 1) lintasan mevalonat yang terbentuk di sitosol dan 2) lintasan non mevalonat yang terbentuk di plastid (Rohmer 1999, Dubay et al. 2003).
Biosintesis terpenoid melalui lintasan mevalonat
Pembentukan senyawa terpenoid melalui lintasan mevalonat yang diturunkan dari senyawa acetyl CoA melalui pembentukan intermediate acetoacetyl CoA dan 3-hydroxy-3-methyl-glutaryl CoA (HMG CoA), reaksi ini
dikatalisasi oleh masing-masing enzim acetyl CoA acetyltransferase dan HMG CoA synthase. Reduksi dari HMG CoA dikatalis oleh HMG CoA reduktase
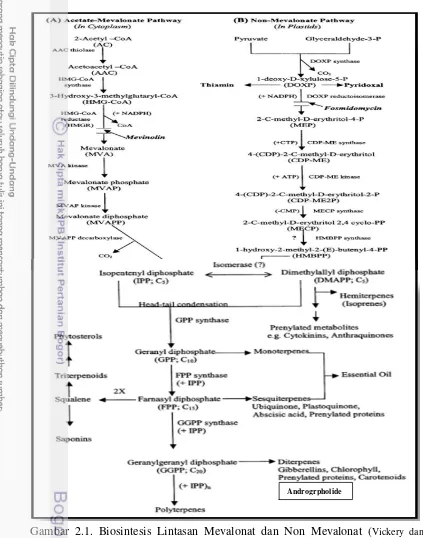
Gambar 2.1. Biosintesis Lintasan Mevalonat dan Non Mevalonat (Vickery dan Vickery 1981; Dubay et al. 2003)
Setelah asam mevalonat terbentuk lalu difosforilasi oleh ATP dan enzim asam mevalonate kinase kemudian terbentuk asam mevalonat 5-pyrophosphate.
Asam mevalonat 5-pyrophosphate melalui proses dekarboksilasi-dehidrasi
menjadi isopentenyl phyrophosphate, reaksi ini dikatalis oleh enzim pyrophospho mevalonat decarboxylase. Asam mevalonat adalah prekusor utama untuk semua
terpenoid melalui lintasan mevalonat yang dibiosintesis oleh tanaman. Secara umum lintasan biosintesis terpenoid dari proses asam mevalonat sehingga menghasilkan kelompok-kelompok terpenoid. Akhir proses yaitu dengan
mengisomer isopentenyl phyropphosphate menjadi dimethylallyl phyropphosphate oleh enzim isopentenyl phyropphosphate isomerase (Dubay et al. 2003; Brielmann 2006; Srivastava dan Akhila 2010) (Gambar 2.1)
Biosintesis terpenoid melalui lintasan non mevalonat
Sebagian besar peneliti mengungkapkan bahwa pembentukan senyawa terpenoid umumnya melalui lintasan mevalonat, namun ada yang mengatakan dapat melalui lintasan non mevalonat yang berasal dari asam piruvat. Jalur non mevalonat berbeda dengan jalur mevalonat biosintesis isoprenoid. Tanaman dan protozoa apicomplexan seperti parasit malaria memiliki kemampuan untuk memproduksi isoprenoids (terpenoid) menggunakan jalur alternatif yaitu jalur non-mevalonat yang terjadi dalam plastid mengarah pada pembentukan IPP dan DMAPP (Rohmer 1999) (Gambar 2.1), setelah terbentuknya IPP dan DMAPP proses selanjutnya yaitu pembentukan kelompok terpenoid (Gambar 2.1). Sebagian besar bakteri termasuk patogen seperti bakteri Mycobacterium tuberculosis mensintesis IPP dan DMAPP melalui jalur non-mevalonat (Lichtenthaler 1999).
Klasifikasi Terpenoid
Terpenoid dapat diklasifikasikan menurut jumlah unit isoprene dan dapat dibagi berdasarkan jumlah atom C. Menurut Vickery dan Vickery (1981); Brielmann et al.
(2006), terpenid dapat dikelompokkan yaitu: Hemiterpenoids 1 unit isoprene (C-5), Monoterpenoid 2 unit isoprene (C-10), Seskuiterpenoid 3 unit isoprene (C-15), Diterpenoids 4 unit isopren (C-20), Sesterterpenoids 5 unit isopren (C-25) (jarang ditemukan), Triterpenoid unit 6 isopren (C-30), Tetraterpenoids 8 unit isopren (C-40), Polyterpenoids dengan jumlah yang lebih besar dari unit isopren.
Biosintesis andrografolid pada tanaman sambiloto
Senyawa andrografolid termasuk ke dalam biosintesis terpenoid khususnya kelompok diterpenoid. Diterpenoid terdiri atas empat unit isopren dan memiliki rumus molekul C20H32 (Srivastava dan Akhila 2010). Selain andrografolid, giberelin termasuk golongan
diterpenoid, berperan penting sebagai hormon pertumbuhan pada tumbuhan tingkat tinggi.
Bakteri Endofit
Bakteri endofit didefinisikan sebagai bakteri yang hidup atau mengkoloni pada jaringan tanaman sehat baik pada akar, batang maupun daun tanpa memperlihatkan tanda yang jelas atau mengganggu tanaman inangnya dan hidup didalam jaringan vaskuler tanaman yang sehat (Kloepper et al. 1999, Lindow dan
Jenis bakteri endofit
Tiap tanaman mengandung satu atau lebih bakteri endofit (Strobel 2003; Strobel dan Daisy 2003). Hampir semua tanaman vaskular yang hidup di iklim tropis memiliki bakteri endofit (Firakova et al. 2007; Zhang et al. 2006). Bakteri
endofit tersebut berada pada seluruh bagian tanaman baik daun, akar, batang, maupun kulit pada tanaman angiospermae (Banarjee 2011).
Hasil penelitian Thompson et al. (1993), menunjukkan lebih dari 78 spesies
bakteri dari 37 genus yang berhasil diidentifikasi dan 12 genus yang tidak dapat diidentifikasi dari permukaan daun antara lain berasal dari genus Pseudomonas, Enterobacteriacae, bakteri gram negatif dan bakteri gram positif. Jenis Pseudomonas yang banyak ditemukan antara lain P. aureofasciens dan P. syringae. Jenis Enterobacteriacae,Erwina herbicola merupakan jenis isolat yang
paling dominan. Bakteri gram positif antara lain Arthrobacter oxydans, Micrococcus roseus dan Mycobacterium lacticum.
Bakteri tersebut terdapat pada trikhom, stomata, sepanjang tulang daun, dinding sel epidermis (Mariano dan Carter 1993) dan spora serta jaringan intraseluler vaskular (Hallmann 2001). Menurut Werner (1992), jenis bakteri yang paling sering ditemui di daun adalah Pseudomonas, Xanthomon&as, Flavobacterium, Archromobacter, Bacillus, Mycobacterium, Beijerinckia, Azotobacter, dan Mycoplana. Methylobacterium adalah salah satu jenis bakteri
yang hidup berasosiasi dengan tanaman.
Faktor-faktor yang mempengaruhi keberadaan bakteri endofit
Beberapa faktor yang dapat mempengaruhi keberadaan bakteri pada daun baik terhadap jumlah maupun keragamannya antara lain: kondisi daun, ketersediaan nutrisi, kelembaban, temperatur, pencucian, serta mikroorganisme di udara (Sundin dan Jacobs 1999). Nutrisi merupakan hal yang terpenting bagi kehidupan bakteri yaitu berupa gula antara lain fruktosa dan sukrosa (Mercier dan Lindow 2000). Nutrisi ini tidak menyebar secara merata pada permukaan daun, hanya dijumpai pada sel epidermis dekat tulang daun dan stomata (Leveau 2001). Umumnya bakteri ditemukan dalam jumlah lebih besar pada permukaan bawah daun dibandingkan bagian atas karena pada bagian bawah daun banyak terdapat stomata (Beattie dan Lindow 1999).
Hasil penelitian Freiberg (1998), menunjukkan bahwa faktor lingkungan yang sangat berpengaruh terhadap penambatan N2 pada daun adalah curah hujan. Kecepatan maksimum penambatan N2 oleh sianobakteri daun per luas daun per jam sebesar 26 ng cm-2 N pada periode ada hujan, dan menurun hingga nol selama dua sampai tiga hari pada periode tanpa hujan, sedangkan intensitas cahaya matahari kurang berpengaruh terhadap bakteri endofit (Freiberg 1998). Radiasi matahari berpengaruh kuat terhadap ekologi bakteri endofit, yang ditunjukkan oleh persentase hunian bakteri dari genus Curtobacterium pada
permukaan atas lebih banyak dibandingkan bagian permukaan bawah daun (Jacob dan Sundin 2001).
Beberapa bakteri mampu mempertahankan diri dari kondisi kurang menguntungkan dengan mengeluarkan senyawa tertentu antara lain P. syringae
pv syringae menghasilkan senyawa alginat, yaitu polisakarida yang dihasilkan
kurang menguntungkan akibat pemanasan oleh sinar infra merah, sehingga bakteri dapat bertahan pada permukaan daun (Penazola et al. 1997).
Kelembaban udara dapat mempengaruhi populasi bakteri. Kelembaban sangat diperlukan untuk kolonisasi bakteri pada permukaan daun khususnya pada tumbuhan yang hidup pada iklim basah dan curah hujan tinggi. Hasil penelitian Timmer et al. (1987) menunjukkan bahwa populasi Xanthomonas campestris pv. vesicatoria meningkat pada kelembaban yang tinggi (≥ 90%), berfluktuasi pada
kelembaban sedang (50–65%), dan menurun bahkan tidak teramati pada kelembaban rendah (10–25%).
Peranan Bakteri Endofit Pemicu pertumbuhan tanaman
Beberapa pengaruh yang menguntungkan dari interaksi bakteri endofit dengan tanaman inang antara lain 1) sebagai penghasil hormon yang berperan dalam memacu pertumbuhan tanaman (Morris 2001), 2) penambat N2 (Dong et al. 1995; Asis et al. 2004), hal tersebut cukup penting karena dapat mengurangi
setengah dari kebutuhan N melalui aktivitas fiksasi Nnya pada tanaman tebu di Brazil (Boddey et al. 1995), 3) dapat melawan patogen tanaman melalui induksi
ketahanan sistemik dan dihasilkannya senyawa antagonis (Kloepper et al. 1999,
Sturz dan Nowak 2000), dan 4) meningkatkan resistensi tanaman terhadap kondisi tertekan seperti cekaman air (Azevado et al. 2000), meningkatkan hasil,
mengurangi infeksi patogen, serta mengurangi stres biotik atau abiotik tanaman, tanpa patogenisitas (Welbaum et al. 2004; van Loon dan Bakker 2005;
Lugtenberg dan Kamilova 2009).
Umumnya tumbuhan memenuhi kebutuhan terhadap hormon melalui kemampuannya mensintesis fitohormon (Taiz dan Zeiger 2002; Salisbury dan Ross 1992). Fitohormon yang dihasilkan tanaman merupakan senyawa kimia yang memediasi komunikasi antar sel yang mempengaruhi bentuk dan fungsi tanaman (Salisbury dan Ross 1992). Fitohormon juga dapat disekresikan oleh bakteri yang hidup di sekitar tanaman.
Peranan bakteri endofit yang cukup penting adalah sebagai pemicu pertumbuhan tanaman yaitu dengan dihasilkannya fitohormon antara lain Indole Acetic Acid (IAA) (Ergun et al. 2002; Pedraza et al. 2004), sitokinin (Taller dan
Wang 1989: Ergun et al. 2002), dan giberelin (GA3) (Ergun et al. 2002; Kharwar et al. 2008). Beberapa bakteri yang dapat memproduksi berbagai jenis hormon
secara in vitro antara lain bioaktivitas sitokinin telah dideteksi dari filtrat kultur Azotobacter chrococcum, A. beijerinckia, dan A. vinelandii (Taller dan Wong
1989), dan juga diproduksi oleh bakteri Paenibacillus polymyxa pada fase
pertumbuhan logaritmik akhir (Timmusk et al. 1999). Satu strain Azotobacter
mengekskresikan 3–50 µg IAA ml-1 (Vancura 1988), dan bakteri penambat N2 (Herbaspirillum seropodicae dan Bukholderia brasiliensis) yang hidup pada
tanaman padi juga secara nyata mensekresikan fitohormon auksin (Padua et al.
2001).
Bakteri endofit, selain menghasilkan fitohormon IAA dan sitokinin, bakteri endofit juga menghasilkan hormon giberrelin (GA3). Bastian et al. (1998)
melaporkan terdapat kandungan IAA dan GA3 pada Acetobacter diazotrhopicus
dan Herbaspirillum seropedicea. GA3 juga terdapat pada Aspergillus fumigates
sp. GAH7 yang mensintesis giberrelin (Hamayun 2010). Fitohormon yang dihasilkan tanaman diperlukan oleh bakteri agar dapat tumbuh dengan baik, sedangkan hormon yang dihasilkan bakteri membantu agar tanaman dapat tumbuh secara normal, seperti mencegah pertumbuhan sel secara cepat, kerusakan tanaman akibat pembekuan sel dan kerusakan tanaman akibat cuaca dingin (Leveau 2001).
Bakteri penambat N2 pada daun ada yang hidup bebas dan ada yang bersimbiosis membentuk nodul pada daun. Tanaman tropika tertentu diketahui bersimbiosis dengan Chromobacterium dan Klebsiella dan membentuk nodul
daun. Bakteri penambat N2 tertentu dijumpai didalam nodul daun Marlberry
(famili Rubiaceae) (Oevelan et al. 2003). Bakteri penambat N2 dipengaruhi oleh
cahaya yang menunjukkan ketergantungannya terhadap fotosintesis (Pereg et al.
1994). Boddey et al. (1995), mendapatkan bakteri penambat N2 (BNF) pada
tanaman tebu kultivar tertentu di Brazil yang dapat mengurangi setengah dari kebutuhan unsur nitrogen melalui aktivitas menambat N2 yaitu lebih dari 150 kg N ha-1 tahun-1, dan bakteri penambat N2 ditemukan pada jaringan akar, tajuk, dan daun tebu (Kennedy et al. 1997). Bakteri penambat N2 tidak semua
menguntungkan bagi tanaman dari hasil penelitian menunjukkan bahwa beberapa strain bakteri penambat N2 ada yang dapat menstimulasi pertumbuhan tanaman padi, ada yang sedikit berpengaruh, dan ada pula yang dapat menghambat pertumbuhan dan perkembangan tanaman padi (Rolfed dan Weinman 2001), dan tanaman kentang (Sturz 1995).
Penghasil senyawa bioaktif
Bakteri endofit selain memacu pertumbuhan tanaman, dapat juga menghasilkan senyawa metabolit sekunder, yaitu senyawa bioaktif yang dapat berfungsi sebagai obat. Sejumlah besar tanaman, bakteri, dan hewan laut telah diperiksa metabolit sekunder atau bioaktifnya (Firakova et al. 2007). Bakteri
endofit sebagai sumber produk bioaktif (Strobel 2003). Penelitian Melliawati (2006), telah mengisolasi senyawa aktif dari bakteri endofit sebagai antibakteri untuk proteksi tanaman. Beberapa jenis mikroorganisme menunjukkan kekhususan inang dan aktivitas antagonis spesifik lain; kekhususan ini melibatkan interaksi biokimia yang kompleks antara tanaman dan mikroorganisme (Gomez 2010). Informasi yang tersedia dapat memberikan arahan dalam pemilihan jenis organisme yang terkait dengan tanaman obat ketika mencari produk alami yang baru (Strobel 2003).
Kemampuan bakteri endofit memproduksi senyawa metabolit sekunder sesuai dengan tanaman inangnya merupakan peluang yang sangat besar dan dapat diandalkan untuk memproduksi metabolit sekunder (Strobel et al. 2003; Radji
2005). Beberapa bakteri endofit telah diisolasi senyawa aktifnya yang berfungsi sebagai antibakteri (Strobel et al. 2003), antivirus (Guo et al. 2000); antibiotik
(Arunachalam dan Gayathri, 2010) dan antioksidan (Anurada et al. 2010).
Fitohormon
yang disintesiskan pada bagian tertentu dari tanaman dan pada umumnya diangkut ke bagian lain tanaman kemudian zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis. Zat pengatur tumbuh dalam konsentrasi rendah dapat mempengaruhi proses fisiologis tumbuhan. Hal ini disebabkan karena adanya asam yang langsung mempengaruhi sintesis protein dan mengatur aktivitas enzim (Gardner et al. 1991). Fitohormon tersebut antara
lain auksin (IAA) dan GA3.
Peranan fitohormon terhadap pertumbuhan tanaman
Istilah auksin digunakan pada sekelompok senyawa kimia yang memiliki fungsi utama mendorong pemanjangan kuncup yang sedang berkembang. Beberapa auksin dihasilkan secara alami oleh tumbuhan, misalnya IAA (Indole Acetic Acid). Auksin merupakan salah satu hormon yang sangat penting didalam
pertumbuhan tanaman dan berperan untuk memacu pertumbuhan sepanjang sumbu longitudinal. Hal spesifik yang terlihat berupa peningkatan pembesaran sel yang berlangsung ke segala arah secara isodiametrik. Auksin juga berperan dalam pembelahan dan pembentangan sel (Wattimena 1991).
Pengaruh IAA nyata meningkatkan pertumbuhan tanaman kunyit pada 200 ppm. Pada konsentrasi yang lebih tinggi dapat meningkatkan sel sekretori, tetapi menurunkan diameter sel sekretori rimpang kunyit (Wijayati et al. 2005).
Pemberian IAA dalam konsentrasi tinggi tidak lagi memacu pembentangan sel tetapi menghambat karena melampaui batas optimum (Hopkins 1995). Peristiwa ini berhubungan dengan terhambatnya pemasukan air kedalam sel karena konsentrasi IAA yang terlalu tinggi menyebabkan pH dinding sel berubah, sehingga air tidak dapat terserap secara maksimal. Sel menjadi tidak dapat mengembang dan membesar akibat terhambatnya pemasukan air. Hal ini kurang sesuai dengan fungsi dari IAA itu sendiri yaitu meningkatkan tekanan osmotik sel yang diatur oleh gradien potensial pada plasma membran (Davies 1995).
Zat pengatur tumbuh lain yang dapat mengendalikan pertumbuhan dan perkembangan tanaman yaitu asam giberelat. Giberelin adalah turunan dari asam giberelat merupakan hormon tumbuhan alami yang merangsang pembungaan, pemanjangan batang dan membuka benih yang masih dorman. Ada sekitar 100 jenis giberelin, namun Gibberellic Acid (GA3) yang paling umum digunakan.
Senyawa ini merupakan hormon pada tanaman yang mempunyai pengaruh memacu pertumbuhan, serta dapat meningkatkan ukuran daun, bunga, dan buah. Respon tanaman terhadap GA meliputi peningkatan pembelahan sel dan pembesaran sel. Asam giberelat diketahui dapat mendukung proses pembentukan RNA baru serta sintesis protein (Taiz dan Zeiger 2002).
Asam giberelat merupakan hormon tanaman yang mempunyai efek fisiologis dapat mempengaruhi diferensiasi kambium dalam proses pembentukan berkas pengangkut. Pemberian GA dapat meningkatkan jumlah floem yang terbentuk (Davies 1995). Selulosa dan lignin sebagai penyusun dinding sel akan meningkat jumlahnya seiring peningkatan jumlah floemnya. Selulosa dan lignin merupakan penentu kualitas serat. Hormon ini juga dapat memacu pertumbuhan dan perkembangan tanaman serta memperpendek siklus hidup tanaman.
Pengaruh GA3 terhadap diferensiasi sel telah dilaporkan oleh Maryani (1992), bahwa perlakuan GA3 pada konsentrasi 30 ppm memacu pembentukan sklerenkim batang Hibiscus cannabius. Perlakuan giberelin juga berpengaruh
panen, diameter bunga, dan panjang tangkai bunga krisan (Zuhriyah 2004). Pemberian GA3 pada konsentrasi 50 ppm optimum untuk meningkatkan luas daun dan pada konsentrasi 75 ppm optimum untuk meningkatkan bobot kering dan kadar saponin pada tanaman daun sendok (Plantago major) (Khristyana et al.
2005). Perlakuan GA3 memberikan pengaruh yang signifikan terhadap perubahan diameter batang tunas, tinggi batang tunas tanaman rami dan kandungan lignin (Mudyantini 2008).
Salisbury dan Ross (1995) menyatakan bahwa peningkatan GA3 endogen dapat meningkatkan hidrolisis pati, fruktan, dan sukrosa menjadi molekul glukosa dan fruktosa. Selulosa merupakan penggabungan unit-unit glukosa menjadi senyawa makromolekul yang tidak larut dalam semua pelarut yang biasa digunakan (Fengel dan Gerd 1995). Pemberian GA3 dapat meningkatkan kandungan glukosa dalam tanaman maka kandungan selulosa juga akan meningkat (Mudyantini 2008).
Peranan fitohormon terhadap bahan aktif tanaman
Hormon pertumbuhan selain dihasilkan tanaman, juga dapat disekresikan oleh bakteri yang hidup di sekitar dan di dalam jaringan tanaman. Hormon tumbuh ternyata tidak hanya mampu memacu pertumbuhan dan produksi tetapi juga dapat meningkatkan mutu dan kadar bahan aktif. Pemberian zat pengatur tumbuh GA3 sebesar 50 mg l-1 mampu meningkatkan produksi artemisinin dari 0.77 menjadi 1.10 mg g-1. Kinetin 10 dan 20 mg l-1 meningkatkan produksi artemisia. Hormon tumbuh disintesis dari bakteri endofit dan dimanfaatkan untuk meningkatkan produksi dan kadar artemisinin (Farooqi et al. 1996). Pemberian
GA3 dan IAA eksogen mampu meningkatkan kadar andrografolid pada tanaman sambiloto (Anurada et al. 2010).
Bakteri endofit dapat mensintesis giberelin dan memacu pertumbuhan tanaman padi (Khan et al. 2009), dan timun (Hamayun et al. 2010). Bakteri
endofit mampu meningkatkan produksi segar herba dan minyak tanaman Ocimum sanctum (Tiwari et al. 2009), meningkatkan produksi dan kandungan N pada
tanaman padi sawah tadah hujan (Pedraza et al. 2009), padi lahan gambut (Fitri
dan Gofar, 2009), dan kacang tanah (Lee at al. 2005).
Fosfat
Peranan unsur fosfat terhadap tanaman
Unsur fosfat merupakan salah satu unsur esensial yang diperlukan untuk pertumbuhan dan reproduksi tanaman selain nitrogen dan kalium (Salisbury dan Ross 1992; Taiz dan Zeiger 2002). Jika tanpa salah satu unsur esensial maka siklus hidup tanaman tidak akan lengkap siklus hidupnya, tidak dapat digantikan oleh unsur lain dan terlibat langsung dalam metabolisme tanaman (Fageria 2009). Bila pasokan P pada tanaman tidak tercukupi maka tidak dapat memberikan potensi hasil yang maksimal (Fageria dan Gheyi 1999) karena pertumbuhan dan perkembangannya tidak normal (Glass 1989). Fosfat berperan penting didalam penyimpanan dan transfer energi dalam tanaman (Marschner 1995; Fageria dan Gheyi 1999).
mengaktivasi atau protein inaktif yang dianggap sebagai faktor kunci dalam transduksi sinyal. Fosfat memegang peranan penting pada banyak reaksi enzim, hal ini karena P bagian dari inti sel yang sangat penting dalam pembelahan sel dan perkembangan jaringan meristem, merangsang pertumbuhan akar dan mempercepat pembungaan dan pemasakan buah. Fosfat berfungsi dalam pertumbuhan dan metabolisme tanaman, maka kekurangan fosfor mengindikasikan pada pengurangan secara umum sebagian besar proses metabolisme seperti pembelahan dan pembesaran sel, respirasi dan fotosintesis (Terry dan Ulrich 1993).
Beberapa hasil penelitian menunjukkan pentingnya pemberian P yang akan mempengaruhi pertumbuhan dan hasil tanaman. Pemberian P akan menghasilkan tanaman serealia, kacang-kacangan yang jauh lebih baik dibandingkan dengan tanpa pemberian P, meskipun pemupukan N dan K diberikan (Fageria 2009). Selain berperan dalam proses metabolisme primer, unsur P berperan pula di dalam proses metabolit sekunder terutama kelompok terpenoid, baik melalui lintasan asam mevalonat maupun non mevalonat (Vickery dan Vickery 1986; Srivastava dan Akhila 2010).
Tanaman biasanya mengabsorbsi P dalam bentuk ion orthofosfat primer (H2PO4-), orthofosfat sekunder (HPO42-) (Leiwakabessy et al. 2003), PO43-,
H2PO3-, dan HPO32- (Avila et al. 2013). Gardner et al. (1991) menyatakan fosfor
berasal dari pecahan organik dan inorganik tanah sebagai berikut: 1) larutan tanah sedikit mengandung P yang dapat larut seperti orthofosfat (H2PO-4 dan HPO42-), 2) mineral yang berisi P seperti apatit, Ca, Mg, Fe, dan Al-P, 3) genangan labil mengandung P yang diabsorbsi oleh koloid tanah, Fe dan Al-P dalam keseimbangan dengan P larutan tanah. Konsentrasi ion P dipengaruhi oleh kemasaman tanah. Bentuk H2PO4- banyak dijumpai pada tanah masam, dan HPO42- dijumpai pada tanah alkali. Selain itu dipengaruhi pula oleh waktu, temperatur, dan ketersediaan bahan organik didalam tanah. Disamping ion-ion tersebut, tanaman dapat menyerap P dalam bentuk asam nukleat, fitin dan fosfohumat (Havlin et al. 1999).
Fosfat yang diserap tanaman tidak direduksi, melainkan berada didalam senyawa-senyawa organik dan anorganik dalam bentuk teroksidasi. Fosfat anorganik banyak terdapat didalam cairan sel sebagai komponen sistem penyangga tanaman. Fosfat dalam bentuk organik terdapat sebagai: (1) fosfolipid, yang merupakan komponen membran sitoplasma dan kloroplas; (2) fitin, yang merupakan simpanan fosfat dalam biji; (3) gula fosfat, yang merupakan senyawa antara dalam berbagai proses metabolisme tanaman; (4) nukleoprotein, komponen utama DNA dan RNA inti sel; (5) ATP, ADP, AMP, dan senyawa sejenis, sebagai senyawa berenergi tinggi untuk metabolisme; (6) NAD dan NADP, merupakan koenzim penting dalam proses reduksi dan oksidasi; dan (7) FAD dan berbagai senyawa lain, yang berfungsi sebagai pelengkap enzim tanaman (Salisbury dan Ross 1995).
sedangkan RNA sebagai penterjemah informasi dan keterlibatan lain dalam sintesis protein. Fosfat juga merupakan penyusun fitin, yaitu bentuk utama P yang tersimpan dalam biji. Substansi ini merupakan garam kalsium dan magnesium inositol asam heksafosfat, sedangkan fosfolipid merupakan bahan yang berperanan penting dalam mengatur permeabilitas membran sel dan pengangkutan ion (Salisbury dan Ross 1995).
Pergerakan fosfat didalam tanah
Pergerakan hara P didalam tanah diserap oleh akar melalui proses difusi yang didasarkan pada perbedaan konsentrasi unsur hara yang berada pada suatu tempat dengan tempat yang lain di dalam bentuk larutan tanah. Pergerakan ion fosfat menuju akar tanaman terdiri dari dua cara yakni aliran massa dan difusi (Tisdale et al. 1985). Kadar P larutan tanah di luar sel akar umumnya hanya 1
μM, sedangkan kadar dalam sitoplasma adalah 103-104 lebih tinggi. Fosfat yang diserap tanaman tidak mengalami reduksi akan tetapi tetap dalam bentuk oksidatif tertinggi (Marschner 1995)
Respon tanaman terhadap defisiensi fosfat
Mekanisme adaptasi tanaman terhadap kahat P dapat dikelompokkan menjadi dua yaitu: 1) mekanisme internal yang berkaitan dengan penggunaan P oleh jaringan tanaman, dan 2) mekanisme eksternal yang memungkinkan efisiensi serapan P yang lebih tinggi oleh akar (Peng dan Ismail 2004 dalam Sopandie 2006). Mekanisme internal dicapai melalui kemampuan tanaman untuk: a) memanfaatkan P dengan efisien, dan b) memobilisasi P dari jaringan yang tidak lagi aktif bermetabolisme. Mekanisme eksternal meliputi: 1) kemampuan tanaman untuk membentuk perakaran yang lebih panjang, 2) kemampuan meningkatkan luas serapan dengan pertumbuhan rambut akar, 3) kemampuan melarutkan P tidak tersedia melalui perubahan pH atau sekresi senyawa pengkelat, 4) kemampuan menggunakan P organik melalui sekresi fosfatase, dan 5) kemampuan dalam bersimbiosis dengan mikoriza (Peng dan Ismail 2004 dalam Sopandie 2006).
Faktor utama penyebab ketersediaan hara P rendah di tanah adalah akibat fiksasi (Syarif 2007). P tersedia bagi tanaman kurang dari 1% P total tanah (Masrchner 1995). Pada umumnya ketersediaan P terdapat pada kisaran pH 5.5 sampai 7.0. Ketersediaan P menurun di bawah pH 5.5 karena terfiksasi oleh Al, Fe, hidroksida, dan liat, sedangkan di atas pH 7.0, fosfat difiksasi oleh Ca dan Mg (Tisdale et al. 1985). Ketersediaan P tanah yang rendah tersebut menyebabkan
mekanisme eksternal menjadi lebih penting, tanaman mengembangkan berbagai mekanisme untuk membuat P menjadi tersedia dan juga untuk meningkatkan kemampuan menyerap P. Salah satu mekanisme eksternal yang penting dalam meningkatkan ketersediaan P adalah dengan peningkatan kinetika serapan P (Kochian et al. 2004 dalam Sopandie 2006).