Korelasi Antara Ekspresi TNF-α dan Microvessel Density
Pada Penderita Karsinoma Nasofaring di RSUP H. Adam Malik Medan
TESIS
Oleh :
Sujahn Anto Pardede NIM 097109007
PROGRAM PENDIDIKAN DOKTER SPESIALIS ILMU KESEHATAN TELINGA HIDUNG TENGGOROK
BEDAH KEPALA LEHER
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA MEDAN
Korelasi Antara Ekspresi TNF-α dan Microvessel Density
Pada Penderita Karsinoma Nasofaring di RSUP H. Adam Malik Medan
TESIS
Diajukan untuk Melengkapi Tugas dan Memenuhi Salah Satu Syarat untuk Mencapai Gelar Dokter Spesialis dalam Bidang Telinga
Hidung Tenggorok dan Bedah Kepala Leher
Oleh :
Sujahn Anto Pardede
PROGRAM PENDIDIKAN DOKTER SPESIALIS ILMU KESEHATAN TELINGA HIDUNG TENGGOROK
BEDAH KEPALA LEHER
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA MEDAN
Medan, 26 Mei 2014
Tesis dengan judul
Korelasi Antara Ekspresi TNF-α dan Microvessel Density Pada Penderita Karsinoma Nasofaring di RSUP H. Adam Malik Medan
Telah disetujui dan diterima baik oleh Komisi Pembimbing
Ketua
NIP: 19700316 200212 1 002
dr. Farhat, Mked (ORL-HNS), SpTHT-KL (K)
Anggota I
NIP: 19540126 198403 1 001 Prof. DR. Dr. Delfitri Munir, SpTHT-KL (K)
Anggota II
19780523 200212 1 002
dr. Ashri Yudhistira, M.Ked (ORL-HNS), Sp. THT-KL
Diketahui oleh
Ketua Departemen Ketua Program Studi
Prof.Dr.dr.Abd.Rachman S,Sp.THT-KL(K)
KATA PENGANTAR
Salam sejahtera, saya sampaikan puji syukur kepada Tuhan Yang Maha Kuasa atas kasih setia, penyertaan dan karuniaNya tesis ini dapat saya selesaikansebagai salah satu syarat dalam menyelesaikan pendidikan untuk memperoleh gelar Spesialis dalam bidang Ilmu Kesehatan Telinga Hidung Tenggorok dan Bedah Kepala Leher di Fakultas Kedokteran Universitas Sumatera Utara Medan. Saya menyadari penulisan tesis ini masih jauh dari sempurna, baik isi maupun bahasanya. Walaupun demikian, mudah-mudahan tulisan ini dapat menambah perbendaharaan penelitian tentang Korelasi Antara Ekspresi TNF-α dan
Microvessel DensityPada Penderita Karsinoma Nasofaring di RSUP H. Adam Malik Medan
Dengan telah selesainya tulisan ini, pada kesempatan ini dengan tulus hati saya mengucapkan terima kasih yang tak terhingga dan penghargaan setinggi-tingginya kepada yang terhormat :
dr. Farhat, M. Ked (ORL-HNS), Sp. THT-KL(K) atas kesediaannya sebagai ketua pembimbing penelitian ini, Prof. Dr. dr. Delfitri Munir, Sp. THT-KL(K) dan dr. Ashri Yudhistira, M.Ked(ORL-HNS), Sp.THT-KL sebagai anggota pembimbing serta dr. Putri Ch. Eyanoer, MSEpid, Ph.D sebagai pembimbing ahli. Di tengah kesibukan beliau, dengan penuh perhatian dan kesabaran, telah banyak memberi bantuan, bimbingan, saran dan pengarahan yang sangat bermanfaat kepada saya dalam menyelesaikan tulisan ini.
Dengan telah berakhirnya masa pendidikan saya, pada kesempatan yang berbahagia ini perkenankanlah saya menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada :
Yang terhormat Dekan Fakultas Kedokteran Universitas Sumatera Utara Prof. dr. Gontar Alamsyah Siregar, Sp.PD(KGEH), atas kesempatan
yang diberikan kepada saya untuk mengikuti Program Pendidikan Dokter Spesialis Ilmu Kesehatan THT-KL di Fakultas Kedokteran Universitas Sumatera Utara.
Yang terhormat Bapak Direktur RSUP H. Adam Malik Medan, yang telah mengizinkan peneliti untuk melakukan penelitian di rumah sakit yang beliau pimpin dan telah memberikan kesempatan pada saya untuk menjalani masa pendidikan di rumah sakit yang beliau pimpin.
Yang terhormat Ketua Departemen Ilmu Kesehatan Telinga Hidung Tenggorok dan Bedah Kepala Leher Fakultas Kedokteran USU Prof. Dr. dr. Abdul Rachman Saragih, Sp.THT-KL(K) dan Ketua Program Studi Ilmu Kesehatan THT-KL Fakultas Kedokteran USU, Dr. dr. T. Siti Hajar Haryuna Sp.THT-KL, yang telah memberikan izin, kesempatan dan ilmu kepada saya dalam mengikuti Program Pendidikan Dokter Spesialis Ilmu Kesehatan THT-KLsampai selesai.
Yang terhormat supervisor di jajaran Departemen THT-KL Fakultas Kedokteran USU/RSUP H. Adam Malik Medan, Prof. dr. Ramsi Lutan, Sp.THT-KL(K), dr. Yuritna Haryono, Sp.THT-KL(K), Prof. dr. Askaroellah Aboet, KL(K), Prof. Dr. dr. Abdul Rachman Saragih, Sp.THT-KL(K), dr. Muzakkir Zamzam, SpTHT-Sp.THT-KL(K), dr. Mangain Hasibuan, SpTHT-KL, dr. T.Sofia Hanum, Sp.THT-KL(K), Prof. Dr. dr. Delfitri Munir, SpTHT-KL(K), dr. Linda I. Adenin, Sp.THT-KL, almh dr. Hafni,Sp.THT-KL(K), dr. Ida Sjailandrawati Harahap, SpTHT-KL, dr.Adlin Adnan,
Sofyan, M.Kes, Sp.THT-KL. Terima kasih atas segala ilmu, keterampilan dan bimbingannya selama ini.
Yang tercinta teman-teman sejawat PPDS Ilmu Kesehatan THT-KL Fakultas Kedokteran USU,atas bantuan, nasehat, saran maupun kerjasamanya selama masa pendidikan.
Yang mulia dan tercinta Ayahanda Drs. P. Pardede, MBA dan Ibunda A. Hutasoit, ananda sampaikan rasa hormat dan terima kasih yang tak terhingga serta penghargaan yang setinggi-tingginya atas kasih sayang yang telah diberikan dan dilimpahkan kepada ananda sejak dalam kandungan, dilahirkan, dibesarkan dan diberi pendidikan yang baik serta diberikan suri tauladan yang baik hingga menjadi landasan yang kokoh dalam menghadapi kehidupan ini, dengan memanjatkan doa kepada Tuhan agar dengan umur panjang, kesehatan dan kesejahteraan Engkau memberkati kedua orang tua kami.
Yang tercinta Ayah mertua P. Sihaloho dan Ibu mertua D. Naibaho. Ayah dan Ibu mertua yang selama ini telah memberikan dorongan dan restu untuk selalu menuntut ilmu setinggi-tingginya.
Kepada istriku tercinta Astrid Dina Tiur Sihaloho, SS serta kedua buah hati kami yang amat kusayang Jordan Tomando Jahnapul Pardededan Jordie Jahnsen Pardede, tiada kata yang lebih indah yang dapat ayahanda ucapkan selain ucapan terima kasih yang setulus-tulusnya atas pengorbanan tiada tara, cinta dan kasih sayang, kesabaran, ketabahan, pengertian dan dorongan semangat yang tiada henti-hentinya dan doa kepada ayahanda sehingga dengan penyertaan Tuhan akhirnya
kita sampai pada saat yang berbahagia ini.
Kepada seluruh kerabat dan handai taulan yang tidak dapat kami sebutkan satu persatu, yang telah memberikan bantuan kami ucapkan
terima kasih yang sebesar-besarnya.
Akhirnya izinkanlah saya mohon maaf yang setulus-tulusnya atas segala kesalahan dan kekurangan saya selama mengikuti pendidikan ini, semoga segala bantuan, dorongan, petunjuk yang diberikan kepada saya selama mengikuti pendidikan kiranya mendapat balasan yang berlipat ganda dari Tuhan, Yang Maha Pemurah, Maha Pengasih dan Maha Penyayang. Amin.
Medan, Mei 2014 Penulis
ABSTRAK
Pendahuluan : Angiogenesis adalah hal yang sangat dibutuhkan dalam nutrisi dan oksigenasi sel tumor. Hal ini penting untuk proliferasi dan penyebaran metastasis neoplasma padat. Angiogenesis dapat dinilai secara imunohistokima dengan Microvessel density (MVD). TNF-α telah dilaporkan dapat menjadi mediator pada angiogenesis yang dipicu oleh makrofag. TNF-α dapat menginduksi ekspresi molekul proangiogenik seperti VEGF dan reseptornya VEGFRs.
Tujuan : Mengetahui korelasi ekspresi TNF-α dengan MVD pada penderita karsinoma nasofaring di RSUP H. Adam Malik Medan
Metode : Penelitian ini penelitian analitik dengan studi potong lintang. Tiga puluh tiga sampel diperiksa secara imunohistokima untuk ekspresi TNF-α dan MVD. Kemudian hasil dianalisa dengan uji Spearman.
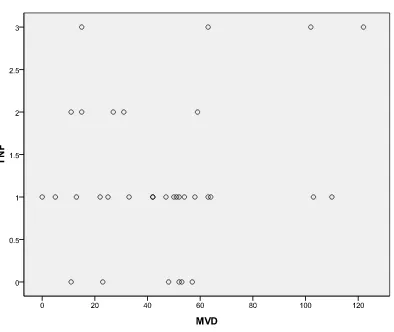
Hasil Penelitian : Sebanyak 33 sampel KNF diperiksa ekspresi TNF-α dan MVD secara immunohistokimia. Penderita KNF paling banyak ditemukan pada laki-laki (69,70%), kelompok umur 41-60 tahun (57,58%) dan tipe non keratinizing squamous cell carcinoma (54,55%). Ekspresi TNF-α positif paling banyak ditemukan pada ukuran tumor T3-T4 (59,30%), ukuran kelenjar getah bening N2-3 (70,40%) dan stadium III-IV sebanyak (92,60%) dengan menggunakan Fisher’s exact test tidak ditemukan hubungan yang bermakna antara ekspresi TNF-α dengan ukuran tumor primer (p=0,242), ukuran kelenjar getah bening (p=0,605) dan stadium klinis (p=0,142). MVD tinggi paling banyak ditemukan pada ukuran tumor primer T3-T4 (61,10%), ukuran kelenjar getah bening N2-N3 (72,20%) dan stadium III-IV (88,90%), begitu juga MVD tidak ditemukan hubungan bermakna dengan ukuran tumor primer (p=0,316), ukuran kelenjar getah bening (p=0,512) dan stadium klinis (p=0,626) setelah dilakukan Fisher’s exact test. Tidak ditemukan adanya korelasi positif antara ekspresi TNF-α dengan MVD (r=1,000; p=0,630)
Kesimpulan : Tidak ditemukan adanya korelasi antara ekspresi TNF-α dan MVD pada karsinoma nasofaring
ABSTRACT
Introduction : Angiogenesis is a required process in the nutritional supply and oxygenation of tumor cells that possesses crucial role in the proliferation and metastatic spread of solid neoplasms. Angiogenesis can be assessed by Microvessel Density (MVD) via immunohistochemistry method. TNF-α has been reported acted as mediator in angiogenesis triggered by macrophages. TNF-α is able to induce the expression of proangiogenic molecules such as VEGF and its receptors, VEGFRs.
Objective : To determine the correlation between the expressions of TNF-α and MVD in patients with nasopharyngeal carcinoma in H. Adam Malik General Hospital Medan.
Methods : A cross-sectional study. 33 samples from patients with nasopharyngeal carcinoma were examined for the expressions of TNF-α and MVD via immunohistochemistry method. Results were analyzed by Spearman's test.
Results : NPC most commonly occurs in males (69.70%), 41-60 years age group (57.58%) and non-keratinizing type of squamous cell carcinoma (54.55%). TNF-α positive expression mostly found in T3-T4 tumor size (59,30%), N2-N3 lymph node size around (70,40%) and clinical stage of III-IV (92,60%). Fisher's exact test showed no significant correlation either between the expression of TNF-α and primary tumor size (p=0.242), lymph node size (p=0.605) and clinical stage (p=0.142). Highly count MVD mostly found in T3-T4 tumor size (61,10%), N2-N3 lymph node size (72,20%) and clinical stage of III-IV (88,90%). There were no significant correlation between the expression of MVD and primary tumor size (p=0.316), lymph node size (p=0.512) and clinical stage (p=0.626). There is also no correlation between the expression of TNF-α and MVD (r=1,000; p=0,630).
Conclusion : There is no correlation between the expression of TNF-α and MVD in nasopharyngeal carcinoma
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
KATA PENGANTAR ... ii
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR DIAGRAM ... xiv
DAFTAR SINGKATAN ... xv
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 2
1.3 Tujuan Penelitian ... 3
1.3.1 Tujuan umum ... 3
1.3.2 Tujuan khusus ... 3
1.4 Manfaat Penelitian ... 3
BAB 2 TINJAUAN PUSTAKA... 4
2.1 Karsinoma Nasofaring ... 4
2.2 Tumor Necrosis Factor (TNF-α)... 11
2.3 Peran TNF-α dalam Perkembangan Kanker ... 15
2.4 Penilaian TNF-α ... 16
2.6 TNF-α dan Angiogenesis... 19
2.7 Microvessel Density (MVD) ... 20
2.8 Kerangka Konsep ... 21
2.9 Hipotesis ... 22
BAB 3 METODE PENELITIAN ... 22
3.1 Jenis Penelitian ... 23
3.2 Waktu dan Tempat Penelitian ... 23
3.3 Populasi, Sampel, dan Teknik Pengambilan Sampel ... 23
3.3.1 Populasi ... 23
3.3.2 Sampel ... 23
3.3.3 Teknik pengambilan sampel ... 24
3.4 Variabel Penelitian ... 24
3.5 Definisi Operasional ... 25
3.6 Bahan Penelitian ... 27
3.7 Instrumen Penelitian ... 28
3.8 Prosedur Kerja Pemeriksaan Immunohistokimia ... 29
3.9 Kerangka Kerja ... 30
3.10 Cara Pengumpulan Data ... 30
3.11 Cara Analisis Data ... 30
BAB 4 HASIL PENELITIAN ... 31
BAB 5 PEMBAHASAN ... 36
BAB 6 KESIMPULAN DAN SARAN ... 47
6.1 Kesimpulan ... 47
6.2 Saran ... 47
LAMPIRAN 1 ... 60
LAMPIRAN 2 ... 63
LAMPIRAN 3 ... 66
LAMPIRAN 4 ... 67
LAMPIRAN 5 ... 68
LAMPIRAN 6 ... 69
LAMPIRAN 7 ... 76
DAFTAR TABEL
Halaman
Tabel 4.1 Distribusi Frekuensi Karakteristik Subjek Penelitian ... 31
Tabel 4.2 Distribusi Frekuensi Ukuran Tumor Primer (T) Berdasarkan Ekspresi TNF-α ... 32 Tabel 4.3 Distribusi Frekuensi Pembesaran Kelenjar Getah Bening
Leher (N) Berdasarkan Ekspresi TNF-α ... 33 Tabel 4.4 Distribusi Frekuensi Stadium Klinis Berdasarkan Ekspresi
TNF-α ... 33
Tabel 4.5 Distribusi Frekuensi Ukuran Tumor Primer (T) Berdasarkan MVD ... 34
Tabel 4.6 Distribusi Frekuensi Pembesaran Kelenjar Getah Bening
Leher (N) Berdasarkan MVD ... 34
DAFTAR GAMBAR
Halaman
Gambar 1. Anatomi Nasofaring...4
Gambar 2. Terapi Karsinoma Nasofaring Berdasarkan NCCN (2010)...10
Gambar 3. Interaksi Antara Sel Tumor dan Sel Imun...12
Gambar 4. Signaling Pathway TNF-α Melalui Reseptornya...14
Gambar 5. Kerangka Konsep...22
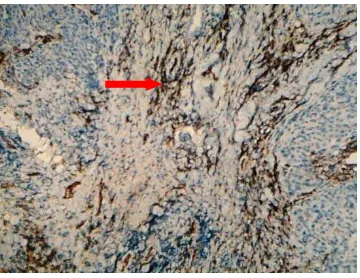
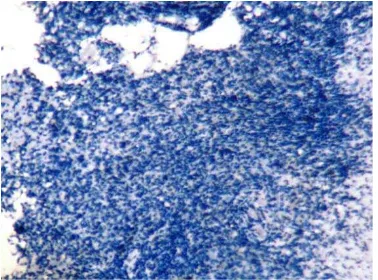
Gambar 1 Lampiran 9. Pewarnaan dengan CD 31 pada Jaringan KNF dengan Microvessel Density Tinggi (Pembesaran x40) ... 78
Gambar 2 Lampiran 9. Pewarnaan dengan CD 31 pada Jaringan KNF dengan Microvessel Density Tinggi (Pembesaran x200) ... 78
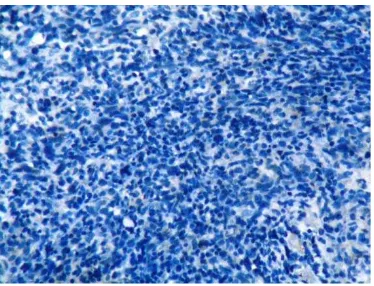
Gambar 3 Lampiran 9. Pewarnaan dengan CD 31 pada Jaringan KNF dengan Microvessel Density Rendah(Pembesaran x40) ... 79
Gambar 4 Lampiran 9. Pewarnaan dengan CD 31 pada Jaringan KNF dengan Microvessel Density Rendah(Pembesaran x200) ... 79
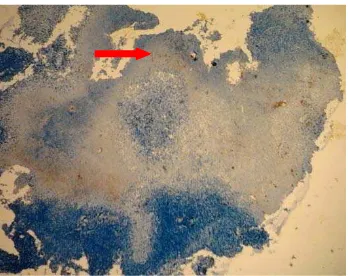
Gambar 5 Lampiran 9. Pewarnaan Immunohistokimia TNF-α Skor +3 (Pewarnaan Positif >50%) pada Jaringan KNF dengan Pembesaran x100 ... 79
Gambar 6 Lampiran 9. Pewarnaan Immunohistokimia TNF-α Skor +3 (Pewarnaan Positif >50%) pada Jaringan KNF dengan Pembesaran x400 ... 80
Gambar 8 Lampiran 9. Pewarnaan Immunohistokimia TNF-α Skor +2 (Pewarnaan Positif 10-50%) pada Jaringan KNF dengan
Pembesaran x400...80
Gambar 9 Lampiran 9. Pewarnaan Immunohistokimia TNF-α Skor +1 (Pewarnaan Positif <10%) pada Jaringan KNF dengan
Pembesaran x100...81
Gambar 10 Lampiran 9. Pewarnaan Immunohistokimia TNF-α Skor +1 (Pewarnaan Positif <10%) pada Jaringan KNF dengan
Pembesaran x400...81
Gambar 11 Lampiran 9. Pewarnaan Immunohistokimia TNF-α Skor 0 (Negatif) pada jaringan KNF dengan Pembesaran x100...81
DAFTAR DIAGRAM
DAFTAR SINGKATAN
5FU : 5 Fluorouracil
AJCC : American Joint Committee of Cancer
AML
AP-1 : Activator Protein – 1 AP : Anteroposterior
ASK1 : Apoptosis Signal-Regulating Kinase 1 bFGF : Basic Fibroblast Growth Factor
CCL2 : Chemokine (C-C motif) Ligand 2 CD120a : Cluster of Differentiation 120 a CD120b : Cluster of Differentiation 120 b CD31 : Cluster of Differentiation 31 CD34 : Cluster of Differentiation 34 CD95 : Cluster of Differentiation 95 CLL : Chronic Lymphocytic Leukemia
COX : Cyclooxygenase 2 CTL : Cytotoxic T Lymphocyte
CT-Scan : Computed Tomography Scan
CXCL 8 : (= IL8)
DAB : Diamino Benzidine
DC : Dendritic Cell
DNA : Deoxyribonucleic Acid EBV : Ebstein Barr Virus
EGFR : Epidermal Growth Factor Receptor
FADD : Fas-Associated Protein with Death Domain
FK USU : Fakultas Kedokteran Universitas Sumatera Utara HGF : Human Growth Factor
ICAM 1 : Intercellular Adhesion Molecule 1 IFNα : Interferon α
IKK : IkB Kinase IL1 : Interleukin 1
IL4 : Interleukin 4 IL6 : Interleukin 6 IL10 : Interleukin 10 IL13 : Interleukin 13 IL15 : Interleukin 15 IL17 : Interleukin 17 IL23 : Interleukin 23
JNK
JNKK : Jnk-Activated Kinase
KGB : Kelenjar Getah Bening KNF : Karsinoma Nasofaring LP : Lapangan Pandang MEKK : MAPK Kinase Kinase
MKK7 : MAP Kinase Kinase 7 MMP : Matrix Metalloproteinase
MMP2 : Matrix Metalloproteinase 2 MMP3 : Matrix Metalloproteinase 3 MMP9 : Matrix Metalloproteinase 9 MMP12 : Matrix Metalloproteinase 12 MRI : Magnetic Resonance Imaging
MVD : Microvessel Density
NFkB : Nuclear Factor Kappa-Light-Chain-Enhancer Of Activated B
Cells
NK Cells : Natural Killer Cells
NO : Nitric Oxic
PBS : Phosphat Buffered Saline
PDGF : Platelet-Derived Growth Factor PKCα- : Protein Kinase C Alpha
RSUP : Rumah Sakit Umum Pusat TAF : Tumor Angiogenesis Factor
TBS : Tris Buffered Saline
TGF-α
TGFβ :
THT-KL : Telinga Hidung Tenggorok- Bedah Kepala dan Leher
Tis : Tumor in situ
TNF-α : Tumor Necrosis Factor Alpha
TNFRI : Tumor Necrosis Factor Receptor 1 TNFRII : Tumor Necrosis Factor Receptor 2
TRADD : Tumor Necrosis Factor Receptor Type 1-Associated Death Domain
TRAF : Tumor Necrosis Factor Receptor Associated Factors
TRAIL : Tnf-Related Apoptosis-Inducing Ligand
VEGF : Vascular Endothelial Growth Factor
VEGFR : Vascular Endothelial Growth Factor Receptor
ABSTRAK
Pendahuluan : Angiogenesis adalah hal yang sangat dibutuhkan dalam nutrisi dan oksigenasi sel tumor. Hal ini penting untuk proliferasi dan penyebaran metastasis neoplasma padat. Angiogenesis dapat dinilai secara imunohistokima dengan Microvessel density (MVD). TNF-α telah dilaporkan dapat menjadi mediator pada angiogenesis yang dipicu oleh makrofag. TNF-α dapat menginduksi ekspresi molekul proangiogenik seperti VEGF dan reseptornya VEGFRs.
Tujuan : Mengetahui korelasi ekspresi TNF-α dengan MVD pada penderita karsinoma nasofaring di RSUP H. Adam Malik Medan
Metode : Penelitian ini penelitian analitik dengan studi potong lintang. Tiga puluh tiga sampel diperiksa secara imunohistokima untuk ekspresi TNF-α dan MVD. Kemudian hasil dianalisa dengan uji Spearman.
Hasil Penelitian : Sebanyak 33 sampel KNF diperiksa ekspresi TNF-α dan MVD secara immunohistokimia. Penderita KNF paling banyak ditemukan pada laki-laki (69,70%), kelompok umur 41-60 tahun (57,58%) dan tipe non keratinizing squamous cell carcinoma (54,55%). Ekspresi TNF-α positif paling banyak ditemukan pada ukuran tumor T3-T4 (59,30%), ukuran kelenjar getah bening N2-3 (70,40%) dan stadium III-IV sebanyak (92,60%) dengan menggunakan Fisher’s exact test tidak ditemukan hubungan yang bermakna antara ekspresi TNF-α dengan ukuran tumor primer (p=0,242), ukuran kelenjar getah bening (p=0,605) dan stadium klinis (p=0,142). MVD tinggi paling banyak ditemukan pada ukuran tumor primer T3-T4 (61,10%), ukuran kelenjar getah bening N2-N3 (72,20%) dan stadium III-IV (88,90%), begitu juga MVD tidak ditemukan hubungan bermakna dengan ukuran tumor primer (p=0,316), ukuran kelenjar getah bening (p=0,512) dan stadium klinis (p=0,626) setelah dilakukan Fisher’s exact test. Tidak ditemukan adanya korelasi positif antara ekspresi TNF-α dengan MVD (r=1,000; p=0,630)
Kesimpulan : Tidak ditemukan adanya korelasi antara ekspresi TNF-α dan MVD pada karsinoma nasofaring
ABSTRACT
Introduction : Angiogenesis is a required process in the nutritional supply and oxygenation of tumor cells that possesses crucial role in the proliferation and metastatic spread of solid neoplasms. Angiogenesis can be assessed by Microvessel Density (MVD) via immunohistochemistry method. TNF-α has been reported acted as mediator in angiogenesis triggered by macrophages. TNF-α is able to induce the expression of proangiogenic molecules such as VEGF and its receptors, VEGFRs.
Objective : To determine the correlation between the expressions of TNF-α and MVD in patients with nasopharyngeal carcinoma in H. Adam Malik General Hospital Medan.
Methods : A cross-sectional study. 33 samples from patients with nasopharyngeal carcinoma were examined for the expressions of TNF-α and MVD via immunohistochemistry method. Results were analyzed by Spearman's test.
Results : NPC most commonly occurs in males (69.70%), 41-60 years age group (57.58%) and non-keratinizing type of squamous cell carcinoma (54.55%). TNF-α positive expression mostly found in T3-T4 tumor size (59,30%), N2-N3 lymph node size around (70,40%) and clinical stage of III-IV (92,60%). Fisher's exact test showed no significant correlation either between the expression of TNF-α and primary tumor size (p=0.242), lymph node size (p=0.605) and clinical stage (p=0.142). Highly count MVD mostly found in T3-T4 tumor size (61,10%), N2-N3 lymph node size (72,20%) and clinical stage of III-IV (88,90%). There were no significant correlation between the expression of MVD and primary tumor size (p=0.316), lymph node size (p=0.512) and clinical stage (p=0.626). There is also no correlation between the expression of TNF-α and MVD (r=1,000; p=0,630).
Conclusion : There is no correlation between the expression of TNF-α and MVD in nasopharyngeal carcinoma
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Karsinoma nasofaring (KNF) adalah suatu karsinoma sel skuamosa yang berasal dari sel epitel nasofaring (Brennan 2006; Wei 2006). Lo et al. (2006) menyatakan bahwa KNF merupakan salah satu tipe kanker yang paling sering dijumpai di Cina bagian Selatan dan Asia Tenggara. Lebih dari 50.000 kasus KNF baru dilaporkan setiap tahun di daerah ini.
Dilaporkan angka kejadian KNF antara pria dan wanita di Hongkong adalah 20 sampai 30 per 100.000 dan di bagian selatan provinsi Guangdong adalah 15 sampai 20 per 100.000. Insiden KNF tetap tinggi di antara orang Cina yang berimigrasi ke negara Asia Tenggara atau Amerika Utara, tetapi rendah di antara orang Cina yang lahir di Amerika Utara. Hal ini menunjukkan bahwa faktor genetik, etnis dan lingkungan mungkin memainkan peranan dalam etiologi penyakit (Wei 2006)
KNF sering dihubungkan dengan infeksi Epstein barr virus (EBV) dan akhir-akhir ini produk gen dari EBV melalui siklus latent dan lytic
kemungkinan besar mempunyai peranan dalam memicu dan mempengaruhi produksi sitokin (Huang et al. 1999).
.
TNF-α telah sering ditemukan pada proses keganasan dan sering dihubungkan dengan prognosis yang buruk, kehilangan respon hormon dan cachexia. Adanya suatu hubungan antara TNF-α dan malignansi telah diidentifikasikan pada karsinoma ovarium. Gen untuk TNF-α telah ditemukan terekspresi pada 45 dari 65 biopsi terhadap sel epitel karsinoma ovarium (Aggarwal et al. 2006).
Stroma dari solid tumor sangat penting untuk kelangsungan hidup tumor itu sendiri dan komponen yang sangat mendukung serta diperlukan
adalah pembuluh darah. Ketika ukuran tumor lebih dari 2-4 mm3
TNF-α dapat meningkatkan tumor angiogenesis melalui beberapa faktor angiogenik seperti IL8 dan VEGF. Bila fungsi dari TNF-α di netralisir dengan menggunakan antibodi poliklonal maka akan menghentikan aktivitas angiogenesis dari TNF-α sepenuhnya (Wu & Zhou 2010).
akan memerlukan pembentukan pembuluh darah baru untuk mencukupi suplai oksigen dan nutrisi, serta pembuangan zat sisa. Pembentukan pembuluh darah baru ini disebut dengan “tumor angiogenesis” suatu istilah yang diperkenalkan oleh Judah Folkman pada tahun 1971. Angiogenesis dipicu oleh pelepasan berbagai sitokin pro-angiogenik oleh sel tumor (Burton & Libuti 2009)
Pendekatan patologis untuk memperkirakan suatu angiogenesis adalah dengan perkiraan mikroskopik densitas pembuluh darah atau
Microvessel density (MVD) dari jaringan tumor melalui pemeriksaan immunohistokimia (Choi et al. 2005).
Karena sampai saat ini di RSUP. H. Adam Malik Medan belum ada data mengenai korelasi antara ekspresi TNF-α dan gambaran MVD pada penderita karsinoma nasofaring, maka peneliti merasa tertarik untuk menelitinya.
1.2 Perumusan Masalah
Dengan memperhatikan latar belakang di atas, maka masalah
1.3 Tujuan Penelitian 1.3.1 Tujuan umum
Mengetahui korelasi antara ekspresi TNF-α dan gambaran MVD pada penderita karsinoma nasofaring di RSUP H. Adam Malik Medan.
1.3.2 Tujuan khusus
a. Mengetahui distribusi frekuensi karakteristik karsinoma nasofaring di RSUP H. Adam Malik Medan.
b. Mengetahui distribusi frekuensi ekspresi TNF-α pada karsinoma nasofaring berdasarkan ukuran tumor, pembesaran kelenjar getah bening dan stadium tumor di RSUP H. Adam Malik Medan c. Mengetahui distribusi frekuensi MVD pada karsinoma
nasofaring berdasarkan ukuran tumor, pembesaran kelenjar getah bening dan stadium tumor di RSUP H. Adam Malik Medan d. Mengetahui korelasi antara ekspresi TNF-α dan gambaran MVD pada penderita karsinoma nasofaring di RSUP H. Adam Malik Medan.
1.4 Manfaat Penelitian
Penelitian ini bermanfaat antara lain :
a. Memberikan informasi mengenai tingkat ekspresi TNF-α dan MVD pada karsinoma nasofaring di RSUP. H. Adam Malik Medan.
b. Sebagai rujukan penelitian berikutnya yang berkaitan dengan TNF-α dan MVD, seperti perannya dalam tatalaksana karsinoma nasofaring.
BAB 2
TINJAUAN PUSTAKA
2.1 Karsinoma Nasofaring
Nasofaring merupakan bagian faring yang terletak paling atas oleh karena itu disebut juga dengan epifaring. Nasofaring secara anatomis terletak di bagian belakang dari rongga hidung dan mempunyai batas mulai dari dasar tengkorak sampai ke palatum mole. Atap nasofaring dibentuk oleh basis sphenoid dan basis oksipital, dinding posterior di bentuk oleh vertebra, dasar nasofaring dibentuk oleh palatum mole, dinding depan dibentuk oleh koana, serta dinding lateral dimana ditemukan muara tuba eustachius seperti yang terlihat pada gambar 1 dibawah ini (Dhingra 2007).
Gambar 1. Anatomi nasofaring (Wei 2006).
yang jarang. Di Amerika Serikat kurang dari 1% dari seluruh kanker. Angka kejadian di Amerika dan Eropa bervariasi antara 0,22 sampai 0,5
per 100.000 populasi. Sebaliknya, KNF mempunyai prevalensi yang luas di Asia Tenggara, Timur Tengah, dan Afrika Utara dengan insidensi yang lebih tinggi dibandingkan bagian dunia yang lain (Dhingra 2007).
Usia insidensi KNF berbeda dengan kanker lainnya. Di Cina KNF mulai muncul pada usia 15-19 tahun. Pada pria, KNF sering ditemukan pada usia 15-34 tahun dan mencapai puncaknya usia 35-64 tahun kemudian menurun setelah usia tersebut (Chew 1997).
Dari data rekam medik di RSUP H. Adam Malik Medan, jumlah penderita KNF yang datang berobat dari Januari 2006-Desember 2009 ditemukan 335 orang dengan rentang usia 12-81 tahun (Puspitasari 2011).
Diyakini bahwa terdapat sejumlah faktor lingkungan bersama dengan faktor genetik/host yang mungkin bertanggung jawab terhadap penyebab kanker ini. Ho menyatakan sedikitnya ada 3 faktor etiologi yaitu infeksi Virus Epstein-Barr, kerentanan genetik dan faktor lingkungan yang berperan dalam tingginya insidensi KNF di Cina (Kumar 2003).
KNF merupakan proses keganasan pada manusia yang berasal dari sel epithelium yang berada pada rongga nasofaring. KNF merupakan salah satu contoh keganasan yang menyerang pada manusia dan secara konsisten selalu dihubungkan dengan infeksi virus. Genome dari Virus Epstein-Barr ditemukan di dalam semua sel KNF (Lutzky et al. 2008).
Walaupun gejala pasien dengan KNF tidak spesifik dan hampir semua
pasien dengan penyakit ini tidak dapat didiagnosis pada tingkat awal, gejala yang tidak spesifik ini dapat dikelompokkan menjadi empat kelompok:
1. Massa di nasofaring: epistaksis, obstruksi nasal (insidensi 73%). 2. Disfungsi tuba eustachius: perasaan penuh pada telinga,
3. Erosi dasar tengkorak dan lumpuhnya saraf kranial: nyeri kepala, diplopia, perasaan baal (35%).
4. Massa leher: leher atas (76%).
Berdasarkan penelitian, saraf kranial yang paling sering dipengaruhi adalah III, V, VI dan XII (Plant 2009).
Otitis media serosa dijumpai pada 41% pasien dari 237 pasien yang baru terdiagnosa KNF. Sehingga apabila seorang pasien dewasa, ras cina datang dengan gejala ini, seorang ahli THT harus mempertimbangkan kemungkinan KNF (Wei 2006).
Gejala hidung dapat berupa epistaksis, sekret hidung dan saliva bercampur darah pada saat membuang sumbatan hidung. Ozaena terjadi sebagai akibat nekrosis tumor dan khas pada KNF stadium lanjut. Karsinoma nasofaring memiliki kecenderungan untuk cepat menyebar ke kelenjar limfe. Metastase kelenjar limfe bilateral dan kontralateral sering dijumpai (Chew 1997).
Diagnosis dari KNF sulit karena lokasi anatomisnya. Sering, penyakit secara klinis tidak menimbulkan gejala sampai menyerang struktur yang berdekatan dan menghasilkan gejala (Titcomb Jr 2001).
Ketika pasien datang dengan gejala KNF, mereka harus dievaluasi secara klinis tanda-tanda fisik KNF (misalnya, keberadaan kelenjar getah bening di leher, cairan di telinga tengah, dan keterlibatan saraf kranial
Diagnosis dapat kita lakukan melalui langkah-langkah berikut ini (Brennan 2006):
) (Wei 2006).
1. Evaluasi gejala klinis dan ukuran serta lokasi dari kelenjar limfe servikal.
2. Nasofaringoskopi untuk mengetahui adanya tumor primer. 3. Pemeriksaan neurologis nervus kranialis.
4. CT-Scan/MRI dari kepala.
6. Scintigraphy tulang untuk melihat penyebaran ke tulang. 7. Pemeriksaan darah lengkap.
8. Ureum, elektrolit, kreatinin dan fungsi hati.
9. Biopsi dari kelenjar limfe dan tumor primer untuk pemeriksaan histopatologi.
Pemeriksaan radiologi yang lebih baik untuk KNF adalah CT-Scan dengan kontras dan MRI dengan enhancement. Umumnya buku onkologi lebih menganjurkan pemeriksaan MRI dari pada CT-Scan karena dapat memberikan detail yang lebih baik tentang perluasan dan keterlibatan intrakranial. Sebaliknya, CT-Scan dapat menunjukkan adanya erosi tulang. Faktor-faktor ini penting untuk menentukan stadium penyakit (Jeyakumar et al. 2006).
Pada tahun 1978, WHO mengajukan klasifikasi karsinoma nasofaring berdasarkan konsep Shanmugartnam dan Sobin. Menurut WHO karsinoma nasofaring dibagi dalam tiga subtipe:
(1). Keratinizing Squamous Cell Carcinoma (WHO tipe I), (2). Non keratinizing Squamous Cell Carcinoma (WHO tipe II), (3). Undifferentiated Carcinoma (WHO tipe III).
Pada tahun 1991, WHO kembali mengklasifikasikan karsinoma nasofaring atas :
a. Squamous Cell Carcinoma dengan subtipe Keratinizing Squamous Cell Carcinoma
b. Non Keratinizing Carcinoma yang dibagi atas Differentiated dan
Undifferentiated (Brennan 2006).
Klasifikasi TNM menurut AJCC 2010:
Tumor Primer (T)
TX Tumor primer tidak dapat dinilai T0 Tidak terbukti adanya tumor primer Tis Karsinoma in situ
T2 Tumor dengan perluasan ke daerah parafaring.
T3 Tumor melibatkan struktur tulang dasar tengkorak dan/atau
sinus paranasal
T4 Tumor dengan perluasan intrakranial dan/atau terlibatnya syaraf kranial, hipofaring, orbita atau dengan perluasan ke fossa infratemporal/ruang mastikator.
KGB Regional (N)
NX KGB regional tidak dapat dinilai
N0 Tidak ada metastase ke KGB regional
N1 Metastase kelenjar getah bening leher unilateral dengan diameter terbesar 6 cm atau kurang, di atas fossa supraklavikular, dan/atau unilateral atau bilateral kelenjar getah bening retrofaring dengan diameter terbesar 6 cm atau kurang.
N2 Metastase kelenjar getah bening bilateral dengan diameter terbesar 6 cm atau kurang, di atas fossa supraklavikular. N3 Metastase pada kelenjar getah bening diatas 6 cm dan/atau
pada fossa supraklavicular: N3a Diameter terbesar lebih dari 6 cm N3b Meluas ke fossa supraklavikular
Metastase Jauh (M)
M0 Tanpa metastase jauh
M1 Metastase jauh
Kelompok stadium :
0 Tis N0 M0
I T1 N0 M0
II T1 N1 M0
T2 N1 M0
III T1 N2 M0
T2 N2 M0
T3 N0 M0
T3 N1 M0
T3 N2 M0
IVA T4 N0 M0
T4 N1 M0
T4 N2 M0
IVB setiap T N3 M0
IVC setiap T setiap N M1
Berdasarkan lokasinya, nasofaring berdekatan dengan struktur penting dan sifat infiltrasi dari KNF menyebabkan pembedahan terhadap tumor primer sulit dilakukan. Akan tetapi KNF bersifat radiosensitif sehingga radioterapi telah menjadi modalitas terapi primer untuk KNF selama bertahun-tahun. KNF umumnya tidak dapat dioperasi, lebih responsif terhadap radioterapi dan kemoterapi dibandingkan tumor ganas kepala leher lainnya (Wei 2006; Guigay et al. 2006).
Terapi supervoltase yang juga diberikan kepada kelenjar limfe di sekitarnya dengan dosis 6000-7000 rad. Tumor yang persisten ataupun berulang dapat diatasi dengan radioterapi siklus ke dua (Dhingra 2007).
Pemberian radioterapi telah berhasil mengontrol tumor T1 dan T2 pada 75-90% kasus dan tumor T3 dan T4 pada 50-75% kasus. Kontrol kelenjar
leher mencapai 90% pada pasien dengan N0 dan N1, tapi tingkat kontrol regional berkurang menjadi 70% pada kasus N2 dan N3 (Wei 2006).
Kemoterapi sebagai komponen terapi kuratif utama pada KNF pertama kali dipergunakan pada tahun 1970-an. Bahkan pada pasien yang gagal
dengan radioterapi tunggal atau dengan metastasis sistemik menunjukkan
response rate yang tinggi terhadap penggunaan kemoterapi. Kombinasi 5FU dan cisplatin (cisdiamine-dichloroplatinum) telah terbukti mempunyai efek sitostatika secara sinergis pada sel kanker manusia. Dosis
cisdiamine-dichloroplatinum (CDDP) adalah 100 mg/m2 dengan bolus infus diberikan pada hari pertama dan dosis 5 FU 1000 mg/m2
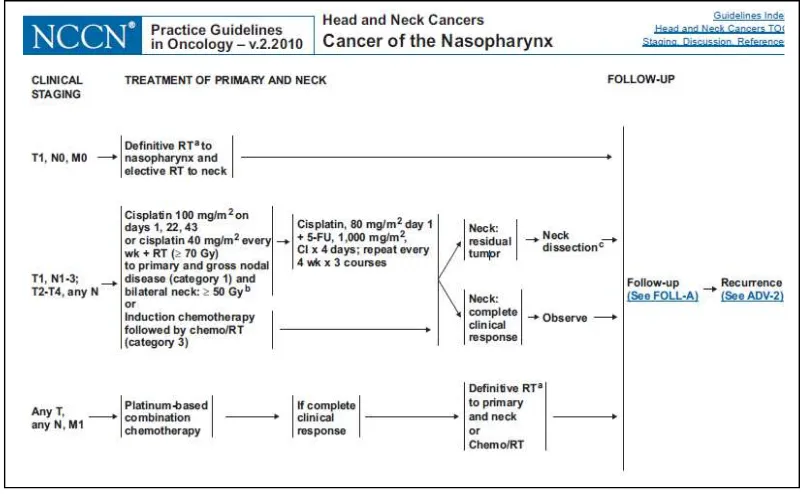
National Comprehensive Cancer Network (2010), mengajukan suatu skema penatalaksanaan karsinoma nasofaring (gambar 2) dengan kombinasi kemoterapi dan radioterapi.
[image:31.595.113.514.414.661.2]/hari diberikan dengan infus selama 24 jam pada hari 1-5. Siklus diulang setiap 4 minggu. Kemoterapi diberikan 2-4 siklus (Scanlon et al. 1986; Mould & Tai 2002; Yeh et al. 2006).
2.2 Tumor Necrosis Factor (TNF-α)
Pada beberapa keganasan, kondisi peradangan muncul sebelum
proses malignansi. Sebaliknya pada proses keganasan yang lain, bahan onkogen justru memicu perubahan pada inflammatory microenvironment
yang dapat membantu pertumbuhan dan perkembangan tumor (Mantovani et al. 2008).
Peradangan adalah bagian dari respon host terhadap rangsangan lingkungan baik internal maupun eksternal. Respon ini berfungsi untuk menetralkan hasil yang dikeluarkan oleh rangsangan tersebut terhadap
host. Respon ini bisa pirogenik, seperti demam. Ketika peradangan akut atau demam dimanifestasikan untuk jangka waktu yang singkat, ia memiliki konsekuensi terapeutik. Namun, ketika peradangan menjadi kronis atau berlangsung terlalu lama, dapat berbahaya dan dapat menyebabkan penyakit. Peradangan kronis telah dikaitkan untuk berbagai hal yang terlibat dalam tumorigenesis, termasuk transformasi seluler, promosi, kelangsungan hidup, proliferasi, invasi, angiogenesis dan metastasis (Aggarwal et al. 2006; Schetter, Heegaard & Harris 2010).
Sitokin merupakan suatu molekul mediator untuk respon imun dan peradangan. Molekul-molekul ini mempunyai fungsi seluler yang sangat luas dan terstimulasi ketika homeostasis jaringan berubah. Sitokin dapat di kelompokkan menjadi pro-inflammatory (IL1, IL6, IL15, IL17, IL23, dan TNF-α), atau anti-inflammatory (IL4, IL10, IL13, transforming growth factor (TGFβ) dan interferon (IFNα). Bergantung pada keseimbangannya, sitokin menghasilkan efek sebagai pro- atau anti-tumorigenik (gambar 3)
(Schetter, Heegaard & Harris 2010).
Pertama kali diidentifikasi sebagai sitokin anti-tumor pada sistem imunitas innate dan adaptif. TNF-α diperlukan juga untuk proliferasi dan fungsi yang normal dari NK cells, sel T, sel B, makrofag, dan sel dendrit, serta bertindak sebagai molekul yang penting dalam menghancurkan tumor tertentu. Akan tetapi bukti yang terbaru menunjukkan bahwa TNF-α merupakan suatu mediator utama pada cancer-related inflammation dan juga berperan sebagai tumour-promoting factor (Wu & Zhou 2010).
Gambar 3. Interaksi antara sel tumor dan sel imun (Lin & Karin 2007)
Pada akhir-akhir ini, kuat dugaan bahwa sitokin pro-inflammatory
berasal dari percobaan hewan menunjukkan sitokin-sitokin ini terlibat dalam pembentukkan kanker (Huang
Oberyszyn et al. (1993) menunjukkan bahwa produksi sitokin pro-inflammatory seperti IL-1α, TNF-α, dan granulocyte macrophage colony-stimulating factor memicu infiltrasi leukosit dan pembentukkan karsinoma pada tikus yang diberi perlakuan dengan 12-O-tetradecanoylphorbol-13-acetate (Huang
et al. 1999).
TNF-α manusia merupakan polipeptida 26 kDa yang aktif secara biologis sebagai protein transmembran dan terdapat pada berbagai macam permukaan sel hematopoetik dan non-hematopoetik. TNF-α
signals melalui 2 reseptor yang berbeda antara lain TNFRI/p55/CD120a dan TNFRII/p75/CD120b dimana reseptor ini ditemukan di kebanyakan
sel. Melalui cross-linking TNFRI berikatan dengan molekul TNFR-associated DD (TRADD) yang akan membantu perekrutan dan
pengaktifan pro-caspase 8 sehingga akan memicu cascade apoptosis. TNFRI juga dapat memicu anti-apoptosis dan jalur aktivasi yang dinamakan aktivasi faktor transkripsi NF-κB melalui kinases receptor-interacting protein dan NF-κB-inducing kinase serta transcription factor AP-1 melalui perekrutan TRAF2 (TNFR-associated factor-2) dan aktivasi MEKK1/JNKK/JNK pathway seperti yang terlihat pada gambar 4 dibawah ini. Peran dari 75 kDa TNFRII masih dalam perdebatan. Di duga TNFRII mengikat TNF-α dan mentransfernya ke TNFRI (Mitsiades et al. 2003; Morrison et al. 2004).
et al. 1999).
TNF-α mengaktifkan TNFRI, 55 kDa protein membran plasma dengan C-terminal death domain analog dengan CD95 (Fas/APO-1). CD95 dan TNFR1 memicu apoptosis melalui Fas-associated protein dengan death domain (FADD), yang mengaktifkan ICE-related protease (caspase)
Gambar 4. Signaling pathway TNF-α melalui reseptornya (Cai et al. 2008)
TNF-α mempunyai peran yang bimodal pada perkembangan tumor. Pemberian lokal dengan dosis yang tinggi dari TNF-α memiliki efek antiangiogenik dan mempunyai efek anti tumor yang sangat kuat, di lain pihak TNF-α yang dihasilkan secara kronik di dalam microenvironment
tumor dapat meningkatkan pertumbuhan dan sifat invasif tumor dengan memicu sitokin/kemokin lain yang terlibat di dalam progresi tumor (seperti IL-6 dan CCL2), faktor proangiogenik (seperti VEGF, basic fibroblast growth factors, CXCL8 dan thymidine phosphorilase) dan matrix metalloproteinases (MMPs). Suatu bukti peran TNF-α dalam malignansi terlihat dari percobaan pada tikus dengan TNF-α dan TNFR yang telah di
knockout akan resisten terhadap skin carcinogenesis (Madhusudan et al. 2005).
efek patofisiologis pada konsentrasi yang tinggi dan ditemukan pada berbagai macam jaringan (Von Wolff et al. 1999).
Walaupun pertama kali diduga sebagai produk dari makrofag, TNF-α pada akhir-akhir ini juga di hasilkan oleh berbagai jenis sel tumor, termasuk sel B limfoma, sel T limfoma, megakaryoblastik leukemia, akut myeloblastik leukemia (AML), kronik limfositik leukemia (CLL), kanker payudara, karsinoma kolon, karsinoma paru, skuamous sel karsinoma, karsinoma ovarium, cervical epithelial ovarian cancer, gliobalstoma, dan neuroblastoma (Aggarwal et al. 2006).
TNF-α mempunyai peranan yang penting pada hubungan peradangan dengan keganasan. TNF-α berperan dalam pertumbuhan dan perubahan struktur jaringan sehingga dapat meningkatkan pertumbuhan tumor dan metastasis. TNF-α juga dapat menginduksi produk sitokin lain, faktor angiogenik, dan MMPs, dimana semuanya dapat meningkatkan ukuran tumor dan kelangsungan hidup sel tumor (Wu & Zhou 2010).
2.3 Peran TNF-α dalam Perkembangan Kanker
TNF-α terlibat dalam semua jalur dalam tumorigenesis. Pertama, TNF-α memicu pembentukan dan perkembangan tumor, hal ini dapat terjadi oleh karena mediasi dari aktivitas nuclear factor-κB (NF-κB), PKCα -dan AP-1 dependent pathways. NF-κB mempunyai peranan penting dalam perkembangan tumor yang di picu oleh TNF-α. Pada percobaan dengan sel epidermal JB6 tikus, pemberian TNF-α dapat meningkatkan aktivitas NF-κB pada dose-dependent (Wu & Zhou 2010).
Kedua, TNF-α dapat meningkatkan proliferasi sel tumor, dimana TNF-α bertindak sebagai mutagen yang menyebabkan proliferasi dan kelangsungan hidup dari sel tumor tanpa memicu diferensiasi sel. Sebagai tambahan, TNF-α tidak hanya bertindak sebagai autokrin growth factor
Ketiga, TNF-α dapat meningkatkan tumor angiogenesis melalui beberapa faktor angiogenik seperti IL8 dan VEGF. Bila fungsi dari TNF-α di netralisir dengan menggunakan antibodi poliklonal maka akan menghentikan aktivitas angiogenesis dari TNF-α sepenuhnya (Wu & Zhou 2010).
2.4 Penilaian TNF-α
Salah satu cara untuk menilai TNF-α pada sel yaitu melalui pemeriksaan imunohistokimia dimana pemeriksaan ini menilai reaksi antigen-antibodi terhadap TNF-α. Apabila timbul reaksi positif maka akan menghasilkan reaksi imun berupa warna coklat pada sitoplasma. Reaksi ini kemudian dihitung secara semikuantitatif dengan skor 0: berarti negatif, 1: pewarnaan positif < 10% jumlah sel, 2: pewarnaan positif 10-50% jumlah sel dan 3: pewarnaan positif > 50% jumlah sel (Calabrese et al. 2004).
2.5 Angiogenesis
Angiogenesis penting pada proses remodelling vaskular dan penyembuhan luka namun juga dapat terjadi pada beberapa kondisi patologis seperti rheumatoid artritis, retinopati diabetik, psoriasis dan kanker (Amalinei et al. 2010).
Angiogenesis merupakan proses yang kompleks dimana terbentuknya pembuluh darah baru yang berasal dari pembuluh darah yang telah ada, yang melibatkan interaksi multipel antara sel endotelial, perisit sekitar dan
sel otot polos, matriks ekstraseluler dan sitokin angiogenik (Rundhaug 2003).
bahwa sel pada jaringan pre kanker membutuhkan kemampuan angiogenik untuk membuat sel tersebut berubah menjadi ganas
(Carmeliet & Jain 2000)
Angiogenesis adalah hal yang sangat dibutuhkan dalam nutrisi dan oksigenasi sel tumor. Hal ini penting untuk proliferasi dan penyebaran metastasis neoplasma padat (Taweevisit, et al. 2010).
Pang dan Poon (2006), menyatakan bahwa tumor padat bermula pada nodul avaskuler yang dorman yang hanya dapat tumbuh dan berkembang apabila mendapat vaskularisasi. Neovaskularisasi harus terjadi sebagai sumber oksigen dan nutrisi pada sel tumor. Lebih lanjut lagi, pembuluh darah baru imatur meningkatkan masuknya sel tumor ke dalam sirkulasi sehingga menimbulkan metastasis jauh. Pada saat ini juga diketahui bahwa ketergantungan neovaskularisasi tidak hanya pada tumor padat, tapi juga berperan dalam perkembangan malignansi hematologis. Pengetahuan tentang peranan fundamental angiogenesis pada pertumbuhan tumor telah menyebabkan ketertarikan yang besar dalam penelitian mekanisme regulasinya dan implikasi klinis pada penanganan pasien kanker pada tiga dekade terakhir ini.
Proses angiogenesis di stimulasi ketika tumor membutuhkan zat gizi dan oksigen. Angiogenesis diatur oleh molekul aktivator (faktor angiogenik) dan inhibitor (faktor anti-angiogenik), akan tetapi peningkatan aktivitas dari faktor angiogenik itu sendiri belum cukup memadai untuk memicu angiogenesis karena aktivitas molekul inhibitor juga perlu diturunkan (Nishida et al. 2006).
Angiogenesis bisa diawali oleh pelepasan faktor proangiogenik (seperti
VEGF, bFGF, dan TNF-α) dari sel inflamasi, sel mast, makrofag atau sel
tumor. Faktor ini akan berikatan dengan reseptor di permukaan sel endotel yang dapat merangsang proliferasi, meningkatkan ekspresi cell
adhesion molecules (misalnya integrin α1β1, α2β1 dan α5β1) (Rundhaug
Sedangkan protein yang dapat menginhibisi angiogenesis seperti angiostatin, endostatin, interferon, platelet factor 4 dan tissue inhibitor of
metalloproteinase-1, -2dan -3 (Nishida et al. 2006).
Pembentukan pembuluh darah baru dimulai dengan pelepasan faktor angiogenik yang berikatan dengan reseptor spesifik pada sel endotel dari pembuluh darah yang telah ada sehingga memicu proses angiogenesis. Proteinase seperti matrix metalloproteinases (MMPs) dan aktivator plasminogen diperlukan untuk menghancurkan matriks ekstraseluler di sekitar tunas pembuluh darah yang baru. Selama proses angiogenesis, molekul adesi sel endotel seperti integrin αvβ3
Angiogenesis terdiri dari dua fase. Fase pertama di tandai dengan adanya aktivasi dari sel endotel yang diam menjadi proliferatif dan
bermigrasi. Mediator yang menyebabkan transisi ini antara lain TNF-α, IL-8 dan molekul adhesi seperti E-selectin. Growth factor seperti bFGF dan VEGF juga merupakan stimulator yang potensial untuk proliferasi serta migrasi sel endotel. Fase berikutnya adalah fase dimana sel endotel masuk kembali ke dalam pembuluh darah serta berhenti berproliferasi dan migrasi, hal ini diduga akibat aktivitas dari nitric oxide (NO) yang menginhibisi kerja dari mediator angiogenik (Hewala et al. 2010)
dan vascular adhesion molecule-1 membantu menghubungkan pembuluh darah baru dengan pembuluh darah yang telah ada sehingga membentuk jaringan pembuluh darah intratumoral (Pang dan Poon 2006)
Angiogenesis merupakan suatu persyaratan untuk pertumbuhan dan
metastasis tumor. Neovaskularisasi memberikan bukan hanya jalur untuk suplai nutrisi, namun juga merupakan saluran sel tumor untuk masuk ke sirkulasi, oleh karena pembuluh darah yang baru berproliferasi memiliki membran basal yang lebih mudah dimasuki oleh sel tumor dibandingkan dengan pembuluh darah matur (Poon et al. 2002).
2.6 TNF-α dan Angiogenesis
Pembentukan atau inhibisi terhadap angiogenesis dengan cara mengatur produksi sitokin telah ditemukan pada invitro maupun uji coba
pada hewan. Salah satu contohnya adalah TNF-α, dimana TNF-α telah
dilaporkan dapat menjadi mediator pada angiogenesis yang dipicu oleh
makrofag. TNF-α dapat menginduksi ekspresi molekul proangiogenik
seperti VEGF dan reseptornya VEGFRs (Guadagni et al. 2007).
TNF-α merupakan sitokin inflamatori yang dapat memicu
angiogenesis. Namun studi terhadap sifat angiogenik dari TNF-α
memberikan hasil yang kontradiktif. TNF-α dapat memicu angiogenesis
pada invivo dan menstimulasi migrasi dari sel endotel, tetapi TNF-α
menginhibisi aktivitas dari mitogen seperti bFGF dan VEGF di dalam sel endotel pada invitro. Oleh karena itu diduga bahwa sifat angiogenik dari
TNF-α di mediasi oleh berbagai faktor angiogenik sekunder seperti
platelet-derived growth factor, VEGF, IL-8 dan bFGF (Chen et al. 2004).
Yoshida et al. (1997) menemukan bahwa TNF-α dapat meningkatkan produksi IL-8, VEGF dan bFGF dimana semuanya merupakan faktor
angiogenik yang poten. Peningkatan ekspresi IL-8, VEGF dan bFGF beserta reseptornya terjadi di sel endotel pembuluh darah, sel stroma dan
sel kanker.
Berbagai macam faktor menjadi mediator terhadap efek proangiogenik
dari TNF-α seperti VEGF dan reseptornya (VEGFR2), bFGF, IL-8,
platelet-activating factor, Ephrin A (ligand untuk Eph family dari reseptor tyrosin kinase), NO, E-selectin, intercelluler adhesion molecule 1 (ICAM-1) dan thymidine fosforilase (Szlosarek, Charles & Balkwill 2006)
Menurut Tomita et al. (2004) TNF-α dapat mempertahankan neovaskularisasi dari tumor dengan menginduksi hepatocyte growth factor
Berdasarkan penelitian yang dilakukan oleh Kuwano (2004) didapatkan bahwa IL-1α dan TNF-α secara signifikan meningkatkan produksi VEGF, IL-8, bFGF dan COX2 di dalam sel endotel dan sel kanker.
2.7 Microvessel Density (MVD)
Microvessel density (MVD) merupakan marker terhadap proses neoangiogenesis yang bertanggung jawab untuk pertumbuhan dan metastase tumor (Bono et al. 2002).
Pengaruh angiogenesis terhadap prognosa dari keganasan telah banyak diteliti dengan cara melakukan pengukuran terhadap MVD. Pemeriksaan immunohistokimia untuk MVD menggunakan antibodi seperti CD 31, faktor VIII (Von Willebrand factor VIII) dan CD 34 (Bochner et al. 1995; Bono et al.2002).
Neovaskularisasi tumor dinilai secara kuantitatif dengan pemeriksaan immunohistokimia menggunakan marker endotelial untuk mewarnai
microvessels yang tidak dapat terlihat pada pemeriksaan histologi konvensional. Setelah pewarnaan, seluruh bagian tumor dilihat di bawah mikroskop dengan pembesaran rendah (x40) untuk melihat “hot spot” yang merupakan area tumor dengan neovaskularisasi terbanyak.
Microvessels kemudian dihitung dengan pembesaran tinggi (x200) dan jumlah pembuluh darah dalam lima area hot spot dinilai sebagai MVD (Pang dan Poon 2006).
Pendekatan patologis untuk memperkirakan angiogenesis dan
limfangiogenesis antara lain dengan perkiraan mikroskopik terhadap densitas pembuluh darah atau microvessel density dari jaringan dengan pemeriksaan immunohistokimia (Choi et al. 2005).
Penelitian tentang MVD pada karsinoma nasofaring pada umumnya mengenai penentuan nilai prognostik dari MVD. Penelitian-penelitian ini
dilakukan baik secara manual maupun dibantu komputer dengan menggunakan berbagai antibodi penanda sel endotel dengan nilai batas yang berbeda-beda pula (Taweevisit et al. 2010). Beberapa penelitian juga telah menilai hubungan MVD dengan prognosis secara klinis pada tumor kepala leher dengan hasil yang bertentangan (Rao et al. 2011).
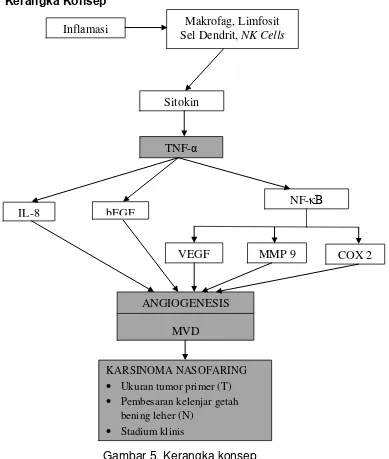
[image:42.595.132.521.285.744.2]2.8 Kerangka Konsep
Gambar 5. Kerangka konsep
Makrofag, Limfosit Sel Dendrit, NK Cells
TNF-α
NF-κB
VEGF MMP 9 COX 2
bFGF IL-8
ANGIOGENESIS
MVD Sitokin Inflamasi
KARSINOMA NASOFARING
• Ukuran tumor primer (T)
• Pembesaran kelenjar getah bening leher (N)
= Variabel Penelitian
Pada saat terjadi inflamasi sel imun seperti makrofag, limfosit, sel dendrit dan natural killer cells akan memicu produksi sitokin dimana salah satunya adalah TNF-α. Kemudian TNF-α akan memicu produksi IL-8 dan bFGF yang akan mempengaruhi terjadinya angiogenesis. TNF-α juga akan mempengaruhi faktor transkripsi NF-κB dimana akan memicu aktivitas dari VEGF, MMP-9 dan COX-2 yang akhirnya akan mempengaruhi angiogenesis. Angiogenesis merupakan proses yang dibutuhkan oleh tumor dalam perkembangannya.
2.9 Hipotesis
BAB 3
METODE PENELITIAN
3.1 Jenis Penelitian
Penelitian ini merupakan penelitian analitik dengan studi potong lintang (cross sectional).
3.2 Waktu dan Tempat Penelitian
Penelitian dilakukan di Departemen THT-KL RSUP. H. Adam Malik Medan dan Departemen Patologi Anatomi Fakultas Kedokteran USU selama bulan Mei 2013-November 2013.
3.3 Populasi, Sampel dan Teknik Pengambilan Sampel 3.3.1Populasi
Populasi adalah penderita yang didiagnosis KNF berdasarkan anamnesis, pemeriksaan fisik dan hasil biopsi histopatologi yang berobat ke Sub divisi Onkologi-Bedah Kepala Leher Departemen THT-KL FK USU/RSUP H. Adam Malik Medan.
3.3.2 Sampel
Besar sampel yang diperlukan untuk mengetahui korelasi kadar TNF-αdan microvessel density dihitung dengan menggunakan rumus untuk penelitian analitik korelatif.
� =� Zα+ Zβ 0,5 ln [1 + r1−r]
� 2
+ 3
Keterangan :
N : Jumlah sampel yang akan diperiksa α : Kesalahan tipe I (0,05)
β Kesalahan tipe II (0,1) Z β : 1,282
r : Perkiraan koefisien korelasi (0,53)(Feng et al. 2011)
� =� 3,242 0,5 ln 3,26�
2 + 3
�= � 3,242 0,5 x 1,18�
2 + 3
� =� 3,242 0,5 ln 4,19�
2 + 3
� = 33 Kriteria inklusi :
1. Penderita yang didiagnosis KNF berdasarkan hasil pemeriksaan histopatologi baik laki-laki maupun perempuan.
2. Bersedia diikutsertakan pada penelitian dan menandatangani informed consent.
Kriteria eksklusi :
1. Penderita yang sudah pernah didiagnosis menderita keganasan lainnya.
2. Penderita sudah pernah mendapat pengobatan dengan radioterapi, kemoterapi atau kombinasi keduanya.
3.3.3 Teknik pengambilan sampel
Pengambilan sampel penelitian adalah dengan secara non probability consecutive sampling
3.4 Variabel Penelitian
Variabel dependenpada penelitian ini adalah :
o Ekspresi TNF-α
o Microvessel density
Variabel independenpada penelitian ini adalah :
o Ukuran tumor primer (T)
o Pembesaran kelenjar getah bening leher (N) o Stadium klinis
3.5 Defenisi Operasional
1. Karsinoma nasofaring adalah tumor ganas yang berasal dari sel epitel yang melapisi permukaan nasofaring (Brennan 2006).
2. Jenis kelamin sesuai dengan yang tercatat pada rekam medis yaitu: a. Laki-laki
b. Perempuan
3. Umur adalah usia yang dihitung dalam tahun dan perhitungannya berdasarkan kalender masehi. Umur penderita karsinoma nasofaring sesuai dengan yang tercatat pada rekam medis, dikelompokkan atas:
≤20 tahun 21-40 tahun 41-60 tahun >60 tahun
4. Tipe histopatologi adalah tipe gambaran histopatologi sediaan tumor menurut kriteria WHO (Brennan 2006).
Hasil ukur: kriteria WHO
Tipe 1: Keratinizing squamous cell carcinoma
Tipe 2: Non keratinizingsquamous cell carcinoma
Tipe 3: Undifferentiated carcinoma
5. Ukuran tumor primer (T) karsinoma nasofaring adalahbesar dan perluasan tumor primer sesuai kriteria AJCC tahun 2010 yang diukur oleh ahli Radiologi dengan memakai CT-Scan.
Hasil ukur: 0, 1, 2, 3, 4
T1: Tumor terbatas di nasofaring atau tumor meluas ke orofaring dan/kavum nasi tanpa perluasan ke parafaring.
T2: Tumor dengan perluasan ke daerah parafaring.
T3: Tumor melibatkan struktur tulang dasar tengkorak dan/atau sinus paranasal
T4: Tumor dengan perluasan intrakranial dan/atau terlibatnya syaraf kranial, hipofaring, orbita atau dengan perluasan ke fossa infratemporal/ruang mastikator.
6. Ukuran kelenjar getah bening leher (N) adalahukuran kelenjar getah bening leher sesuaikriteria AJCC tahun 2010 yang diukur oleh ahli Radiologi dengan memakai CT-Scan.
Hasil ukur: 0,1,2,3
N0: Tidak ada metastase ke KGB regional
N1: Metastase kelenjar getah bening leher unilateral dengan diameter terbesar 6 cm atau kurang, di atas fossa supraklavikular, dan/atau unilateral atau bilateral kelenjar getah bening retrofaring dengan diameter terbesar 6 cm atau kurang.
N2: Metastase kelenjar getah bening bilateral dengan diameter terbesar 6 cm atau kurang, di atas fossa supraklavikular.
N3: Metastase pada kelenjar getah bening diatas 6 cm dan/atau pada fossa supraklavicular.
7. Stadium karsinoma nasofaring adalah penentuan stadium penyakit
berdasarkan klasifikasi AJCC tahun 2010 yang dikelompokkan: I, II, III, IV
8. Ekspresi TNF-α
Hasil ukur:0 – 3
Ekspresi TNF-α negatif : 0 Ekspresi TNF-α positif : 1-3 9. Microvessel Density
Jumlah pembuluh darah mikro per lapangan pandang yang diperiksa dengan pemeriksaan immunohistokimia (Sari 2004).
Hasil Ukur: Jumlah pembuluh darah mikro (Microvessel/MV)/Lapangan Pandang (LP)
• Rendah: < 45 MV/LP
• Tinggi: > 45 MV/LP
3.6 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah jaringan nasofaring penderita KNF. Bahan jaringan diperiksa secara immunohistokimia
dengan menilai imunoreaktivitas antibodi TNF-α. Skor imunoreaktivitas dinilai:
0: berarti negatif
(Calabrese et al. 2004)
1: pewarnaan positif < 10% jumlah sel 2: pewarnaan positif 10-50% jumlah sel 3: pewarnaan positif > 50% jumlah sel Hasil ukur:0 - 3
Ekspresi TNF-α negatif : 0 Ekspresi TNF-α positif : 1-3
jumlah pembuluh darah mikro (Microvessel/MV) per lapangan pandang (LP). (Sari 2004)
Evaluasi dilakukan oleh 3 orang ahli patologi tanpa mengetahui data klinis pasien.
3.7 InstrumenPenelitian
Penelitian ini membutuhkan beberapa bahan, reagen dan peralatan sebagai berikut:
a. Catatan medis penderita dan status penelitian penderita b. Formulir persetujuan ikut penelitian
c. Bahan untuk pemeriksaan histopatologi
Formalin 10%, blok parafin, aqua destillata, hematoxyllin-eosin. d. Bahan untuk pemeriksaan immunohistokimia
Xylol, alkohol absolut, alkohol 95%, alkohol 80%, alkohol 70%, H202
e. Alat untuk biopsi
0,5% dalam methanol, Phosphat Buffer Saline (PBS), antibodi TNF-α, antibodi sekunder, Envision, Choromogen Diamino Benzidine (DAB). Lathium Carbonat jenuh, Tris EBTA, Hematoxylin, aqua destillata.
Blakesley nasal foscep lurus/bengkok, endoskopi kaku, 4 mm, 00
f. Alat untuk pemeriksaan immunohistokimia .
3.8 Prosedur Kerja Pewarnaan Immunohistokimia TNF-α
1. Deparafinisasi slide (Xylol 1, Xylol 2, Xylol 3) @ 5 menit
2. Rehidrasi (Alkohol absolute, Alk 96%, Alk 80%, Alk 70%) @ 4 menit
3. Cuci dengan air mengalir 5 menit
4. Masukkan slide ke dalam PT Link Dako Epitope Retrieval : set up Preheat 65°C, Running time 98°C selama 15 menit.
± 1 jam
5. Pap Pen. Segera masukkan dalam Tris Buffered Saline (TBS) pH 7,4
5 menit
6. Blocking dengan peroxidase block 5-10 menit 7. Cuci dalam Tris Buffered Saline (TBS) pH 7,4 5 menit 8. Blocking dengan Normal horse Serum (NHS) 3 % 15 menit 9. Cuci dalam Tris Buffered Saline (TBS) pH 7,4 5 menit 10. Inkubasi dengan antibodi TNF-α dengan pengenceran
1:40 untuk pemeriksaan ekspresi TNF-α dan dengan antibodi CD-31 dengan pengenceran 1:200 untuk pemeriksaan MVD
1 jam
11. Cuci dalam Tris Buffered Saline (TBS) pH 7,4 /Tween 20 5 menit
12. Dako Real Envision Rabbit/Mouse 30 menit
13. Cuci dalam Tris Buffered Saline (TBS) pH 7,4 /Tween 20 5-10 menit 14. DAB+Substrat Chromogen solution dengan
pengenceran 20 µL DAB : 1000 µL substrat (tahan 5 hari di suhu 2-8°C setelah di-mix)
5 menit
15. Cuci dengan air mengalir 10 menit
16. Counterstain dengan Hematoxylin 3 menit
17. Cuci dengan air mengalir 5 menit
18. Lithium carbonat (5% dlm aqua) 2 menit
19. Cuci dengan air mengalir 5 menit
3.9 Kerangka Kerja
3.10 Cara Pengumpulan Data
Data diambil dari hasil pemeriksaan di Departemen THT-KL FK USU/RSUP H. Adam Malik Medan dan pemeriksaan immunohistokimia di Departemen Patologi Anatomi FK USU.
3.11 Cara Analisis Data
Data yang telah terkumpul akan diolah menggunakan program komputer SPSS. Untuk menilai korelasi antara kadar TNF-α dan MVD akan diuji dengan uji korelasi Pearson. Namun oleh karena data tidak terdistribusi normal maka digunakan uji non parametrik Spearman.Data dipresentasikan dalam bentuk tabel dan diagram.
Jaringan Karsinoma Nasofaring
Korelasi kedua parameter
BAB 4
HASIL PENELITIAN
[image:52.595.112.512.314.726.2]Penelitian ini merupakan penelitian cross sectional. Sampel diambil secara non probabilty consecutive sampling dari populasi penelitian hingga memenuhi jumlah sampel minimal berdasarkan rumus perhitungan besar sampel untuk korelasi yaitu 33 sampel. Diperoleh hasil sebagai berikut:
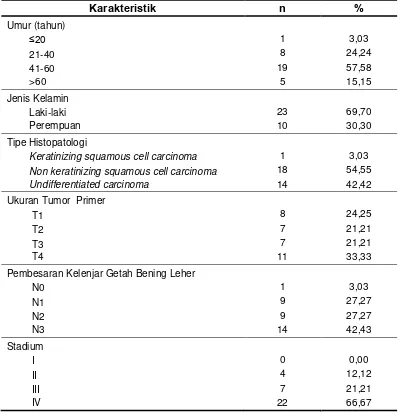
Tabel 4.1 Distribusi frekuensi karakteristik subjek penelitian
Karakteristik n %
Umur (tahun)
≤20 1 3,03
21-40 8 24,24
41-60 19 57,58
>60 5 15,15
Jenis Kelamin
Laki-laki 23 69,70
Perempuan 10 30,30
Tipe Histopatologi
Keratinizing squamous cell carcinoma 1 3,03 Non keratinizing squamous cell carcinoma 18 54,55
Undifferentiated carcinoma 14 42,42
Ukuran Tumor Primer
T1 8 24,25
T2 7 21,21
T3 7 21,21
T4 11 33,33
Pembesaran Kelenjar Getah Bening Leher
N0 1 3,03
N1 9 27,27
N2 9 27,27
N3 14 42,43
Stadium
I 0 0,00
II 4 12,12
III 7 21,21
IV 22 66,67
Usia termuda pada subjek penelitian ini adalah 16 tahun, usia tertua 71 tahun dengan rerata 47,58. Laki-laki sebanyak 23 subjek dan perempuan
10 subjek.
Berdasarkan tipe histopatologi, terbanyak dijumpai tipe non keratinizing squamous cell carcinoma sebanyak 18 subjek (54,55%) dan paling sedikit dengan tipe keratinizing squamous cell carcinoma yaitu sebanyak 1 subjek (3,03%). Ukuran tumor primer terbanyak dijumpai pada penelitian ini adalah T4 yaitu 11 subjek (33,33%), paling sedikit T2 dan T3 masing-masing 7 subjek (21,21%). Pembesaran kelenjar getah bening terbanyak adalah N3 yaitu 14 subjek (42,43%), paling sedikit N0 yaitu 1 subjek (3,03%). Stadium terbanyak dijumpai adalah stadium 4 yaitu sebanyak 22 subjek (66,67%) dan tidak dijumpai pasien dengan stadium 1.
Tabel 4.2 Distribusi frekuensi ukuran tumor primer (T) berdasarkan ekspresi TNF-α.
Ekspresi TNF-α
Positif % Negatif %
Ukuran Tumor Primer
T1-T2 11 40,70 4 66,70
T3-T4 16 59,30 2 33,30
Total 27 100,00 6 100,00
Berdasarkan tabel 4.2 diatas, TNF-α positif ditemukan lebih banyak pada pada ukuran tumor T3 dan T4 yaitu sebanyak 16 subjek, pada T1
dan T2 sebanyak 11 subjek. Sedangkan TNF-α negatif terbanyak pada ukuran tumor T1 dan T2 yaitu 4 subjek, pada T3 dan T4 ditemukan 2 subjek. Uji Fisher’s exact menunjukkan tidak ada hubungan yang bermakna antara ukuran tumor primer dengan TNF-α (p=0,242).
Tabel 4.3 Distribusi frekuensi pembesaran kelenjar getah bening leher (N) berdasarkan ekspresi TNF-α.
Ekspresi TNF-α
Positif % Negatif %
Pembesaran KGB Leher
N0-N1 8 29,60 2 33,30
N2-N3 19 70,40 4 66,70
Total 27 100,00 6 100,00
Berdasarkan tabel diatas, TNF-α positif paling banyak ditemukan pada ukuran pembesaran kelenjar getah bening N2-N3 yaitu sebanyak 19 subjek, TNF-α positif paling sedikit pada N0-N1 yaitu 8 subjek. Sedangkan TNF-α negatif terbanyak ditemukan pada N2-N3 yaitu 4 subjek serta paling sedikit pada N0-N1 yaitu 2 subjek. Setelah dilakukan uji Fisher’s exact, tidak ditemukan adanya hubungan yang bermakna antara pembesaran kelenjar getah bening leher dengan ekspresi TNF-α (p=0,605).
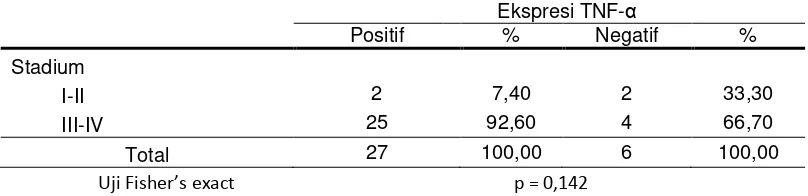
Tabel 4.4 Distribusi frekuensi stadium klinis berdasarkan ekspresi TNF-α.
Ekspresi TNF-α
Positif % Negatif %
Stadium
I-II 2 7,40 2 33,30
III-IV 25 92,60 4 66,70
Total 27 100,00 6 100,00
Berdasarkan tabel 4.4, ekspresi TNF-α positif ditemukan terutama pada stadium III dan IV yaitu sebanyak 25 subjek dan TNF-α positif pada stadium I dan II hanya 2 subjek. TNF-α negatif terbanyak ditemukan pada stadium III dan IV yaitu 4 subjek, sedangkan pada stadium I dan II hanya 2 subjek. Uji Fisher’s exact menyatakan tidak ada hubungan yang bermakna antara stadium klinis dengan ekspresi TNF-α (p=0,142).
Uji Fisher’s exact p = 0,605
[image:54.595.113.517.490.588.2]Tabel 4.5 Distribusi frekuensi ukuran tumor primer (T) berdasarkan MVD.
MVD
Tinggi % Rendah %
Ukuran Tumor Primer
T1-T2 7 38,9 8 53,3
T3-T4 11 61,1 7 46,7
Total 18 100,0 15 100,0
Berdasarkan tabel diatas, MVD yang tinggi paling banyak ditemukan pada ukuran tumor primer T3 dan T4 yaitu 11 subjek, sedangkan pada T1 dan T2 ditemukan pada 7 subjek. MVD rendah pada ukuran tumor primer T3 dan T4 ditemukan pada 7 subjek, sedangkan pada ukuran T1 dan T2 ditemukan pada 8 subjek. Uji Fisher’s exact pada tabel diatas
menunjukkan bahwa tidak ditemukan adanya hubungan yang bermakna antara ukuran tumor primer dengan MVD (p=0,316).
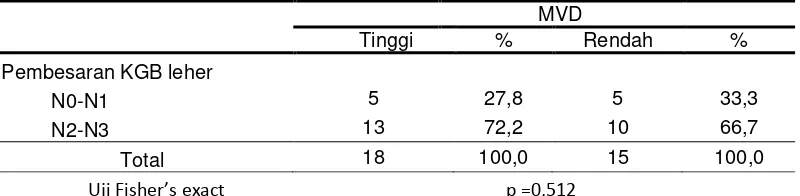
Tabel 4.6 Distribusi frekuensi ukuran pembesaran kelenjar getah bening (N) berdasarkan MVD.
MVD
Tinggi % Rendah %
Pembesaran KGB leher
N0-N1 5 27,8 5 33,3
N2-N3 13 72,2 10 66,7
Total 18 100,0 15 100,0
MVD yang tinggi paling banyak ditemukan pada pembesaran kelenjar getah bening N2-N3 yaitu sebanyak 13 subjek, sedangkan N0-N1 hanya ditemukan pada 5 subjek. MVD rendah pada pembesaran kelenjar getah bening N2-N3 ditemukan pada 10 subjek. MVD rendah pada N0-N1 ditemukan pada 5 subjek. Setelah dilakukan uji Fisher’s exact, tidak ditemukan adanya hubungan yang bermakna antara pembesaran kelenjar getah bening leher dengan MVD (p=0,512).
Uji Fisher’s exact p = 0,316
[image:55.595.118.518.469.567.2]Tabel 4.7 Distribusi frekuensi stadium klinis berdasarkan MVD
MVD
Tinggi % Rendah %
Stadium
I-II 2 11,1 2 13,3
III-IV 16 88,9 13 86,7
Total 18 100,0 15 100,0
Uji Fisher’s exact p = 0,626
MVD yang tinggi paling banyak ditemukan pada stadium III dan IV yaitu sebanyak 16 subjek, sedangkan pada stadium I dan II ditemukan pada 2 subjek. MVD rendah pada stadium III dan IV ditemukan pada 13 subjek dan pada stadium I dan II hanyak 2 subjek. Uji fisher’s exact menunjukkan tidak ada hubungan antara stadium klinis dengan MVD (p=0,626).
Diagram 4.1 Korelasi Ekspresi TNF-α dengan MVD
BAB 5 PEMBAHASAN
Subjek pada penelitian ini berkisar antara usia 16-71 tahun dengan rerata 47,58 tahun. Kelompok usia terbanyak adalah kelompok usia 41-60 yaitu sebanyak 19 subjek (57,58 %) yang terlihat pada tabel 4.1 Meskipun tidak sama persis namun sejalan dengan peneliti-peneliti lainnya yang mendapatkan kelompok umur 41-60 tahun merupakan proporsi tertinggi pada populasi dengan kisaran 25-50% (Pua et al. 2008; Liu et al. 2010; Puspitasari 2011).
Hal ini disebabkan karena sistem mekanisme perbaikan DNA yang mengalami mutasi (DNA repair) sudah kurang berfungsi dengan baik dan penurunan daya tahan tubuh pada usia lebih dari 40 tahun. Mekanisme perbaikan DNA dibutuhkan guna memperbaiki rangkaian asam amino pada kode genetik DNA yang mengalami mutasi. Jika mekanisme perbaikan DNA ini mengalami kegagalan dalam menjalankan fungsinya maka mutasi gen DNA yang sudah terjadi akan menyebabkan pertumbuhan sel tidak terkendali (Soehartono et al. 2007).
Pada penelitian ini perbandingan subjek dengan jenis kelamin laki-laki dan perempuan adalah 2,3:1 (Tabel 4.1). Beberapa penelitian sebelumnya yang pernah dilakukan baik di Medan maupun negara lain juga menunjukkan penderita KNF laki-laki lebih banyak daripada perempuan dengan rata-rata perbandingan 2-3:1 (Chang & Adami 2006; Harahap 2009; Puspitasari 2011; Turkoz et al. 2011).
kematian akibat KNF pada pekerja tambang, pandai besi, pembuat roti, para petani dan penebang kayu (Turkoz et al. 2011).
Tipe histopatologi terbanyak yang ditemukan pada penelitian ini adalah tipe non keratinizing squamous cell carcinoma, yaitu sebanyak 18 subjek (54,55%) (tabel 4.1).
Wei et al. (2011) mengutip laporan Cao et al. (2006) yang menyatakan bahwa 97,6% dari 1.142 kasus KNF di Guangdong merupakan tipe non keratinizing squamous cell carcinoma, 1,7% tipe undifferentiated carcinoma dan 0,5% merupakan tipe keratinizing squamous cell carcinoma.
Hasil yang berbeda didapatkan oleh Alabi et al. (2010) di Nigeria yang menemukan tipe terbanyak adalah undifferentiated carcinoma sebesar 70%, tipe keratinizing squamous cell carcinoma sebesar 20% dan tipe
non-keratinizing squamous cell carcinoma sebesar 10 %.
Karsinoma nasofaring tipe non keratinizing squamous cell carcinoma
dan undifferentiated carcinoma paling banyak dijumpai di daerah endemik KNF, seperti di Cina Selatan, Asia Tenggara dan Afrika Utara. Sementara KNF tipe 1 lebih sering dijumpai di Eropa dengan prognosis yang lebih buruk (Licitra et al. 2003; Guigay et al. 2006).
Pada penelitian ini, ukuran tumor primer terbanyak yang ditemukan adalah ukuran T4. Pembesaran kelenjar getah bening terbanyak dijumpai adalah N3 dan stadium terbanyak dijumpai adalah stadium 4.
Pada stadium dini KNF memiliki gejala yang tidak khas dan mirip dengan infeksi saluran nafas atas bahkan sering secara klinis tidak
pengetahuan yang kurang dan kondisi sosial ekonomi yang rendah dari penderita seringkali menjadi kendala dalam menegakkan diagnosis
penyakit ini. Oleh karena itu gejala dini dari KNF sering terlewatkan dan pasien terdiagno