MUHAMMAD REZA CORDOVA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul “Bioakumulasi Logam Berat dan Malformasi Kerang Hijau (Perna viridis) di Perairan Teluk Jakarta” adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Juli 2011
Malformation of Green Mussels (Perna viridis) in Jakarta Bay. Under the direction of NEVIATY P. ZAMANI and FREDINAN YULIANDA
Jakarta is Indonesia’s economy and government center and the most populated city. Besides that, Jakarta is also a home for many industries. All of these activities produce large number of waste and waste water that are usually discharged without any further treatment into the river streams, and cause heavy pollution. Polluted water at Jakarta Bay, especially from heavy metal, affects the organism that live in this area, especially green mussel (Perna viridis). The objectives of the research were to examine the bioaccumulation of heavy metal (Hg, Cd, Pb) and to develop a model of pollution load to Jakarta Bay and heavy metal accumulation in green mussel. This research used field survey methodology with green mussel in Muara Angke, Jakarta as a sample. The observed parameters were water pollution indicator, heavy metal accumulation and percentage of green mussel malformation. The result of water pollution parameter such as Biological oxygen demand (BOD), chemical oxygen demand (COD), Nitrate (NO3), Orthophosphate (PO4), Mercury (Hg), Cadmium (Cd), Plumbum (Pb) were higher than the allowed limit. The results showed that total pollution load (in tons/month) were 1,56 for NO3; PO4 1,32; Hg 2,03; Cd 0,26 and 248 for Pb. The bioaccumulation of heavy metals that was occurred on green mussel will be accumulated along with the age increasing. The highest value was mercury that accumulates in hepatopancreas. Due to the bioaccumulation of heavy metals in organs of mussels, morphology change (deformation/malformation) i.e. thick size larger than the width of the green mussel occurred. From the result, it could be predicted that the pollution load coming to Jakarta Bay and heavy metals accumulation in sediment and mussel depends on amount of input pollutant. This situation could be avoided by the development and implementation of the Waste Water Treatment Plant to treat the waste water before being discharged to the river stream.
Kerang Hijau (Perna viridis) di Perairan Teluk Jakarta. Dibimbing oleh NEVIATY P. ZAMANI dan FREDINAN YULIANDA
Teluk Jakarta merupakan tempat bermuaranya 13 sungai yang melewati Provinsi Jawa Barat, Provinsi DKI Jakarta dan Provinsi Banten. Sungai-sungai yang bermuara ke Teluk Jakarta tersebut membawa limbah, baik berupa sampah padat maupun limbah cair yang dihasilkan dari berbagai kegiatan. Kondisi tersebut mengakibatkan kualitas lingkungan perairan akan cenderung menurun dari waktu ke waktu. Limbah cair yang masuk ke Teluk Jakarta seringkali membawa zat yang berbahaya dan beracun seperti logam berat. Logam berat merupakan unsur yang tidak dapat di uraikan dan mudah terakumulasi dalam lingkungan perairan dan dalam organisme laut. Logam berat yang masuk ke dalam lingkungan perairan selanjutnya akan terakumulasi dalam biota, terutama biota laut yang bersifatsessile.
Kondisi tersebut di atas, memperlihatkan bahwa logam berat yang masuk ke dalam Perairan Teluk Jakarta semakin tinggi, dan telah melebihi batas pulih dirinya sehingga menyebabkan logam berat terakumulasi dalam tubuh kerang hijau. Oleh karena itu kondisi eksisting pencemaran yang masuk ke Teluk Jakarta, akumulasi logam berat pada kerang hijau, model akumulasi logam berat pada kerang hijau serta malformasi kerang hijau saat ini perlu dilihat kembali, sehingga akan dapat menjadi bahan pertimbangan (dasar) pengelolaan perairan Teluk Jakarta di masa yang akan datang.
Tujuan dari penelitian adalah (1) mengkaji nilai beban pencemaran yang masuk ke Teluk Jakarta, (2) mengkaji informasi kontaminasi bahan pencemar logam berat pada tubuh kerang hijau (Perna viridis), (3) mengkaji gambaran morfologi kerang hijau di Teluk Jakarta (melihat prosentase kejadian malformasi pada kerang hijau), (4) mengkaji model akumulasi logam berat pada kerang hijau di Teluk Jakarta yang menerima berbagai macam limbah dan kondisi kualitas airnya yang saat ini umumnya masuk pada kategori tercemar berat.
Penelitian ini dilaksanakan dengan cara pengambilan sample di lapangan. Pengukuran parameter fisik dan kimia dilakukan dengan dua cara, yakni cara langsung (insitu) dan analisa laboratorium. Data dianalisis dengan metode deskriptif kuantitatif terhadap parameter-parameter fisika-kimia perairan, beban pencemaran dan analisis kandungan logam berat pada kerang hijau serta membangun model dinamik untuk melihat model akumulasi pencemaran logam berat di Teluk Jakarta. Model ini terdiri atas dua sub model, yakni (1) sub model beban pencemaran dan (2) sub model akumulasi logam berat.
ortofosfat 1.32 ton/bulan; merkuri 2.03 ton/bulan; kadmium 0.26 ton/bulan dan 2.48 ton/bulan. Dengan beban yang masuk tersebut dari sungai ke perairan Teluk Jakarta, terjadi akumulasi pencemar, terutama logam berat, pada sedimen dan pada kerang hijau. Penelitian ini memperlihatkan bahwa konsentrasi logam berat merkuri, kadmium dan timbal pada sedimen Kali Angke dan daerah bagan tancap kerang hijau sudah melewati baku mutu (level limit) yang ditetapkan oleh IADC/CEDA (1997).
Konsentrasi logam berat Hg, Cd dan Pb baik yang terdapat di dalam air maupun pada sedimen berada melebihi ambang batas yang ditentukan. Namun demikian kondisi ini tidak mengakibatkan kematian masal kerang hijau. Hal ini mengandung arti bahwa konsentrasi logam berat yang terdapat pada lingkungannya belum masuk pada konsentrasi akut, namun demikian sudah masuk pada konsentrasi kronis. Dalam kondisi ini, akumulasi logam berat akan melakukan transformasi, sehingga cepat atau lambat akan menyebabkan mutasi genetik pada sel, dan pada akhirnya mengakibatkan terjadinya malformasi kerang hijau. Dari seluruh kerang hijau yang dianalisis, terdapat 12,83% yang tebalnya lebih besar dibandingkan lebarnya. Ditinjau secara umur, ada kecenderungan semakin lama umur dari kerang hijau maka malformasi yang terjadi juga lebih tinggi. Hal ini sesuai dengan akumulasi logam berat yang semakin besar seiring dengan bertambahnya umur kerang hijau.
Hasil pemodelan dinamik menunjukkan bahwa model akumulasi logam berat yang dibangun memiliki kinerja yang baik dan mampu menggambarkan prilaku sistem nyata, dengan nilai validitas absolute mean error (AME) dan absolute variation error
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
MUHAMMAD REZA CORDOVA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sainspada
Program studi Ilmu Kelautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Muhammad Reza Cordova
NRP : C551090141
Program Studi : Ilmu Kelautan
Disetujui, Komisi Pembimbing
Dr. Ir. Neviaty P. Zamani, M.Sc Dr. Ir. Fredinan Yulianda, M.Sc
Ketua Anggota
Mengetahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Kelautan
Dr. Ir. Neviaty P. Zamani, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr.
Teluk Jakarta memiliki kontribusi menunjang kehidupan baik terhadap biota yang ada di dalamnya maupun terhadap masyarakat yang ada di sekitarnya bahkan pada masyarakat yang jauh lebih luas lagi. Namun demikian di sisi lain memiliki banyak permasalahan lingkungan, salah satunya adalah sangat menurunnya kualitas lingkungan perairan. Ekosistem memiliki daya pulih (kapasistas asimilasi/self purification) terhadap bahan pencemar yang masuk ke dalam ekosistem, tetapi kemampuan tersebut relatif terbatas. Banyaknya buangan hasil kegiatan dan aktivitas di sekitar Teluk Jakarta menyebabkan perairan menerima beban pencemaran dalam jumlah besar. Telah banyak penelitian yang mengindikasikan perairan Teluk Jakarta mengalami pencemaran yang setiap tahunnya cenderung mengalami peningkatan. Bahan pencemar akan terakumulasi pada sedimen dan pada biota laut terutama yang bersifat sesile seperti kerang hijau (Perna viridis) sehingga mengancam kesehatannya dan mengakibatkan terjadinya kecacatan (malformasi).
Fokus utama dari penulisan tesis ini adalah mengkaji seberapa besar pencemar yang dihasilkan kegiatan antropogenik di Teluk Jakarta terutama pencemar logam berat, (model dinamis) akumulasinya pada sedimen dan kerang hijau serta pengaruh logam berat terhadap kesehatan kerang hijau ditinjau dari kecacatan yang terjadi
Dari penulisan tesis ini diharapkan pembaca dapat lebih memahami berapa besar beban pencemaran yang masuk ke Teluk Jakarta dan pengaruhnya terhadap biota, terutama kerang hijau yang dibudidayakan di wilayah ini. Akhir kata penulis menyadari masih jauh dari sempurna dan mungkin tidak dapat memuaskan semua pihak. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun.
Bogor, Juli 2011
sehingga tesis ini berhasil diselesaikan. Pada kesempatan ini penulis juga menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dr. Ir. Neviaty P. Zamani, M.Sc dan Dr. Ir. Fredinan Yulianda, M.Sc sebagai dosen pembimbing yang dengan sabar berkenan membimbing, memberikan masukan dan memberikan dorongan moril pada penulis.
2. Bapak Dr. Ir. Tri Prartono sebagai penguji luar komisi yang telah memberikan kritis dan saran perbaikan serta masukan yang sangat berarti dalam penulisan ini. 3. Staf Lab Hidrobiologi Laut ITK, Bapak Prof. Dedi Soedharma, Bapak Prof. Dietriech G. Bengen, Ibu Dr. Ir. Mujizat Kawaroe, M.S., Bang Beginer Subhan S.Pi., M.Si., Mbak Meutia S.Si., M.Si., Mbak Adriani S.Pi., M.Si., yang telah memberikan masukan berharga, semangat, dan dukungan moril saat penulisan. 4. BPLHD DKI Jakarta yang telah memberikan kesempatan pada penulis untuk
mengikuti penelitian ini.
5. Dinas Perikanan dan Kelautan, Jakarta yang telah memberikan izin untuk menganalisis sample
6. Bapak Dr. Ir. Suwari dan Bapak Subhan, M.Si yang dengan sabar mengajarkan pola berpikir sistem dan pemodelan sistem dinamik
7. Keluarga (Ibunda Etty Riani, Ayahanda Harsono Hadisoemardjo, Adik Rama, Adik Dzikri dan Adik Farah serta Adinda Yayu Alitalia) yang telah memberikan kasih sayang, semangat dan motivasi pada penulis.
Penulis dilahirkan di Bogor pada tanggal 3 November 1986. Penulis merupakan putera pertama dari empat bersaudara dari Bapak Harsono Hadisoemardjo dan Ibu Etty Riani. Riwayat pendidikan penulis dimulai dengan memasuki TK Permata Bogor tahun 1990 hingga 1992, pada tahun 1998 penulis lulus dari SD Negeri Bangka III Bogor, pada tahun 2001 lulus dari SLTP Negeri IV Bogor, pada tahun 2004 lulus dari SMU Negeri 3 Bogor. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih program studi Pengelolaan Sumberdaya dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pada tahun 2009 penulis berkesempatan melanjutkan pendidikan jenjang Magister di Sekolah Pascasarjana IPB. Penulis memilih mayor Ilmu Kelautan. Selama mengikuti perkuliahan Magister, penulis ikut serta dalam kegiatan yang diselenggarakan di lingkungan Institut Pertanian Bogor, turut aktif dalam organisasi kemahasiswaan Wahana Interaksi Mahasiswa Pascasarjana Ilmu dan Teknologi Kelautan (WATERMASS IKL) dan anggota Unit Kegiatan MahasiswaOnigiridibawah naungan
DAFTAR TABEL... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN... iv
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Kerangka Pemikiran... 3
1.3. Perumusan Masalah ... 5
1.4. Tujuan Penelitian ... 6
1.5. Manfaat Penelitian ... 7
2. TINJAUAN PUSTAKA... 9
2.1. Pencemaran ... 9
2.1.1. Pencemaran Air dan Laut... 10
2.1.2. Pencemaran di Teluk Jakarta ... 13
2.2. Logam Berat... 14
2.3. Pencemaran dan Toksisitas Logam Berat ... 18
2.4. Karakteristik Logam Berat... 19
2.4.1. Merkuri (Hg) ... 19
2.4.2. Kadmium (Cd) ... 25
2.4.3. Timbal (Pb) ... 29
2.5. Logam Berat pada Sedimen Laut ... 33
2.6. Beban Pencemaran ... 36
2.7. Kerang Hijau ... 37
2.7.1. Malformasi Kerang Hijau ... 40
2.8. Pemodelan Sistem ... 43
2.9. Sistem Dinamik... 44
3. METODA PENELITIAN ... 45
3.1. Lokasi dan Waktu Penelitian ... 45
3.2. Alat dan Bahan... 45
3.3. Metoda Pengumpulan Data ... 46
3.4. Analisis Data ... 47
3.4.1. Beban Pencemaran... 48
3.4.2. Analisis Malformasi Kerang Hijau ... 49
3.4.3. Model Akumulasi Logam Berat... 49
4. HASIL DAN PEMBAHASAN... 53
4.1. Gambaran Umum Lokasi Penelitian ... 53
4.2. Kondisi Perairan Muara Angke... 53
4.2.1.4. Logam Berat di Air ... 60
4.2.1.4.1. Merkuri (Hg)... 60
4.2.1.4.2. Kadmium (Cd) ... 62
4.2.1.4.3. Timbal (Pb) ... 63
4.2.1.5. Beban Pencemaran... 64
4.2.2. Kualitas Sedimen ... 67
4.2.2.1. Logam Berat di Sedimen ... 69
4.2.2.1.1. Merkuri (Hg)... 69
4.2.2.1.2. Kadmium (Cd)... 70
4.2.2.1.3. Timbal (Pb)... 70
4.2.3. Kerang Hijau... 71
4.2.3.1. Morfologi ... 71
4.2.3.2. Logam Berat di Kerang Hijau... 73
4.2.3.3. Malformasi ... 77
4.2.4. Pemodelan Akumulasi Logam Berat ... 80
4.2.4.1. Sub Model Beban Pencemaran ... 81
4.2.4.2. Simulasi Sub Model Beban Pencemaran ... 83
4.2.4.3. Sub Model Akumulasi Logam Berat pada Sedimen dan Kerang Hijau ... 85
4.2.4.4. Simulasi Sub Model Akumulasi pada Sedimen dan Kerang Hijau... 86
4.2.5. Validasi Model... 88
4.2.6. Penyusunan Skenario Beban Pencemaran Perairan Teluk Jakarta dan Akumulasi Logam Berat ... 89
5. KESIMPULAN DAN SARAN... 97
DAFTAR PUSTAKA ... 99
DAFTAR TABEL
Halaman 1. Beberapa jenis pencemar dan sumbernya……….. 10 2. Konsentrasi merkuri (ng/l) di beberapa tempat……… 23 3. Konsentrasi merkuri (mg/l) pada jaringan beberapa organisme laut dari
Teluk Terra Nova, Antartica……….. 24 4. Efisiensi merkuri inorganik dan methymerkuri dari makanan dan sedimen
oleh organisme laut……… 24
5. Konsentrasi kadmium terlarut (μg/l) di beberapa perairan……….. 27 6. Konsentrasi kadmium (μg/g) pada jaringan otot beberapa organisme………. 28 7. Konsentrasi timah terlarut (μg/l) dibeberapa perairan………. 31 8. Konsentrasi timah pada jaringan (μg/g) beberapa organisme……… 32 9. Hasil analisis kisaran kadar logam berat (ppm) dalam air laut dan sedimen di
perairan muara Sungai Cisadane Bulan Juli dan Nopember 2005………… 34 10. Kadar alamiah logam berat dalam sedimen………... 35 11. Baku mutu logam berat dalam sedimen………. 35 12. Parameter kualitas air yang diteliti serta metode analisa dan pengukurannya.. 48 13. Beberapa parameter kualitas air di Kali Angke dan lokasi budidaya kerang
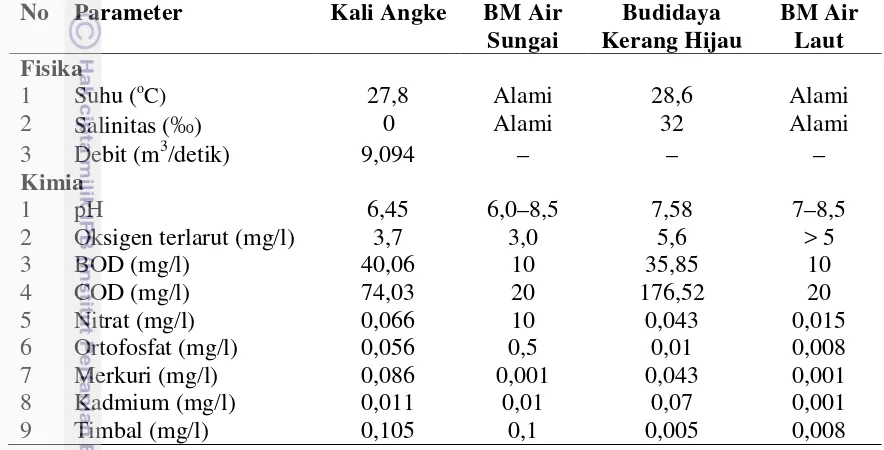
hijau………... 54
14. Beban pencemaran dari Kali Angke yang masuk ke perairan Teluk Jakarta… 65 15. Kualitas sedimen Kali Angke dan lokasi budidaya kerang hijau……….. 68 16. Ukuran cangkang (panjang, lebar dan tebal) kerang hijau di bagan tancap
kerang hijau, Muara Angke………... 71 17. Ukuran berat (total, daging dan cangkang) dan volume daging kerang hijau
di bagan tancap kerang hijau, Muara Angke………. 71 18. Kandungan logam berat pada kerang hijau di bagan tancap kerang hijau,
Muara Angke………….……… 74
19. Kandungan logam berat pada organ kerang hijau (daging, hepatopankreas dan insang) di bagan tancap kerang hijau, Muara Angke……….. 74 20. Presentasi malformasi ditinjau dari morfologi (tebal>lebar) kerang hijau…… 77 21. Analisa kandungan logam berat per individu……… 77 22. Data validasi model pencemaran perairan Teluk Jakarta ditinjau dari
DAFTAR GAMBAR
Halaman 1. Kerangka pemikiran penelitian ………. 5 2. Skema pengelompokan bahan yang terkandung dalam air limbah
(Sugiharto, 1987) ………... 12
3. Tabel periodik (http://www.ptable.com/) ………. 16 4. Hubungan antara pH, kadar Cl- dan pembentukan spesiasi Hg (Moore dan
Ramamoorthy, 1984) ………. 22
5. Kerang hijau (Perna viridisL.) ………. 37 6. Perbedaan insang kerang hijau normal (kiri) dan kerang hijau dengan
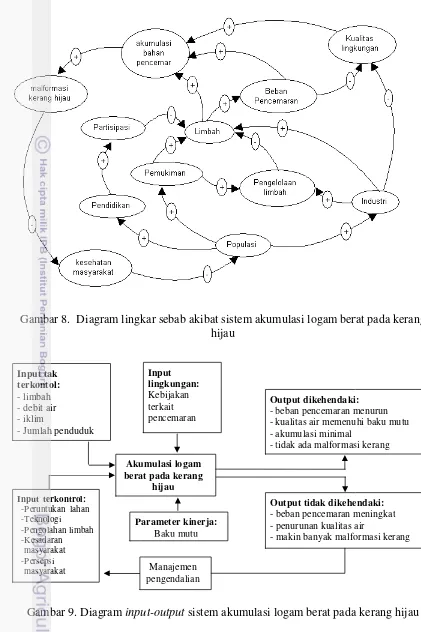
insang yang mengalami malformasi (kanan) (Jose dan Deepthi 2005)…….. 42 7. Lokasi penelitian………... 45 8. Diagram lingkar sebab akibat sistem akumulasi logam berat pada kerang
hijau ………... 51 9. Diagram input-output sistem akumulasi logam berat pada kerang
hijau………... 51
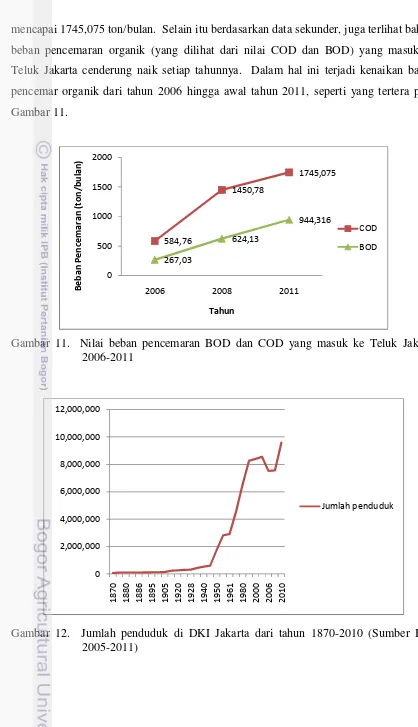
10. Tingkat kesuburan perairan Teluk Jakarta (DPPK DKI Jakarta 2006)…….. 59 11. Nilai beban pencemaran BOD dan COD yang masuk ke Teluk Jakarta
2006-2011 ……….. 66
12. Jumlah penduduk di DKI Jakarta dari tahun 1870-2010 (Sumber BPS
2005-2011) ……… 66
13. Jumlah industri di DKI Jakarta dari tahun 2006-2010 (Sumber BPS
2005-2011) ……….. 67
14. Malformasi pada kerang hijau……… 80 15. Diagram sebab akibat (causal loop) submodel beban pencemaran ………... 81 16. Diagramstock flowsubmodel beban pencemaran ……… 82 17. Beban masukan ke Teluk Jakarta ditinjau dari BOD, COD, NO3 dan PO4.. 83 18. Beban masukan ke Teluk Jakarta ditinjau dari logam berat (Hg, Cd, Pb)…. 84 19. Diagram sebab akibat submodel akumulasi logam berat pada sedimen dan
kerang hijau ………... 85
20. Diagram stock flow submodel akumulasi logam berat pada sedimen dan
kerang hijau……… 86
21. Akumulasi logam berat pada sedimen ……….. 87 22. Akumulasi logam berat pada kerang hijau ……… 87 23. Prediksi beban pencemaran COD perairan Teluk Jakarta sampai tahun
2020 ………... 91
24. Prediksi beban pencemaran BOD perairan Teluk Jakarta sampai tahun
2020 ………... 91
25. Prediksi beban pencemaran NO3 perairan Teluk Jakarta sampai tahun
2020 ………... 92
DAFTAR LAMPIRAN
Halaman
1. Stasiun pengambilan sample air………. 111
2. Hasil analisa data mentah dan fluktuasi debit air……….. 113
3. Prinsip pengukuran kandungan logam berat………114
4. Pengukuran kandungan logam berat……….. 116
5. Sample kerang hijau……… 118
6. Ukuran fisik kerang hijau………119
1.1. Latar Belakang
Teluk Jakarta merupakan salah satu wilayah pesisir di Indonesia yang di dalamnya banyak terdapat kegiatan, seperti pemukiman, perkotaan, transportasi, wisata, dan industri. Tingginya kegiatan di sekitar kawasan ini mengakibatkan tekanan terhadap lingkungan semakin tinggi. Disisi lain, Teluk Jakarta juga merupakan tempat bermuaranya 13 sungai yang melewati Provinsi Jawa Barat, Provinsi DKI Jakarta dan Provinsi Banten. Sungai-sungai yang bermuara ke Teluk Jakarta tersebut membawa limbah, baik berupa sampah padat maupun limbah cair yang dihasilkan dari berbagai kegiatan. Kondisi tersebut mengakibatkan kualitas lingkungan perairan akan cenderung menurun dari waktu ke waktu.
Limbah cair yang masuk ke dalam ekosistem perairan akan mempengaruhi kualitas air ekosistem penerimanya, dalam jumlah yang tidak bisa ditolelir, limbah dapat mengakibatkan terjadinya perubahan komposisi kandungan zat yang ada di dalamnya, serta mengakibatkan terjadinya perubahan aspek fisik perairan, atau dengan kata lain akan menyebabkan terjadinya pencemaran pada ekosistem perairan penerimanya. Pencemaran juga dapat mengakibatkan fungsi air tidak sesuai dengan peruntukannya, sehingga air tidak dapat menjadi habitat biota akuatik yang aman dan tidak memenuhi syarat kesehatan bagi biota yang hidup di dalamnya.
Limbah cair yang masuk ke Teluk Jakarta seringkali membawa zat yang berbahaya dan beracun seperti logam berat. Logam berat merupakan unsur yang tidak dapat diuraikan dan mudah terakumulasi dalam lingkungan perairan dan dalam organisme laut. Selain itu, dalam jumlah di atas ambang batas logam berat dapat menyebabkan terjadinya kematian langsung, menimbulkan efek karsinogenik, teratogenik dan mutagenik, serta memiliki pengaruh baik langsung maupun tidak langsung terhadap kesehatan manusia (Amduret al. 1991). Logam berat yang masuk ke dalam lingkungan perairan selanjutnya akan terakumulasi dalam biota, terutama biota laut yang bersifatsessile.
Jakarta. Dilain pihak kerang hijau juga dapat mengakumulasi bahan pencemar dalam jumlah yang tinggi (Riani 2009). Adapun salah satu jenis bahan pencemar yang diakumulasi dalam jumlah tinggi oleh kerang hijau adalah logam berat, bahkan Riani (2009) memberikan gelar kerang hijau sebagai vaccum cleaner pada perairan yang tercemar logam berat. Lebih lanjut Phillips (1980) menyatakan bahwa kerang (bivalvia) merupakan bioindikator yang paling tepat dan efisien.
Penelitian pencemaran logam berat di perairan Teluk Jakarta sebenarnya sudah banyak di lakukan pada beberapa tahun yang lalu, yakni penelitian yang dilakukan oleh LON-LIPI (1979) yang mendapatkan adanya Hg (4,0-135 ppb) dan Cd (0,5 ppb) di Perairan Muara Angke. Penelitian Wahyono (1994) di Perairan Kamal mendapatkan Hg 1,10-4,70 ppb, Cd 48,3-95,4 ppb dan Pb 5,10-7,90 ppb. Penelitian Diniah (1995) di Perairan Kamal mendapatkan Hg <1,00-2,16 ppb, Cd 84-110 ppb dan Pb 1,32-1,75 ppb. Penelitian Vitneret al. (2001) di Perairan Kamal mendapatkan Hg 0,02-420 ppb, Cd 3-20 ppb, dan Pb 40-150 ppb. Riani dan Sutjahjo (3-2004) di Perairan Kamal Muara mendapatkan Hg 0,075-0,210 ppb, Cd 0,004-0,108 ppm, Pb 0,005-0,105 ppm, Cd 0,004-0,108 ppm, dan Sn ttd – 0,001 ppm. Fitriati (2004) mendapatkan Hg 0,75-1,23 ppb, Cd 26,89-78,49 ppb dan Pb 3,0-9,31 ppb di Kamal Muara Barat dan Timur serta di Cilincing Hg 1,03-0,74 ppb, Cd 18,88-80,28 ppb dan Pb 5,92-12,24 ppb. Data tersebut memperlihatkan bahwa logam berat yang masuk ke dalam perairan relatif tidak pernah berkurang, bahkan dengan bertambahnya jumlah industri, logam berat yang masuk ke dalam Teluk Jakarta cenderung meningkat setiap tahunnya.
Hasil penelitian kapasitas asimilasi, yakni kemampuan air menerima bahan pencemar tanpa menurunkan kualitasnya (Quano, 1993) memperlihatkan bahwa pada tahun 1998 hanya logam berat Zn yang telah melebihi kapasitas asimilasinya, sedangkan Cd, Pb, Cr dan Cu belum mencapai kapasitas asimilasinya (Anna, 1999). Namun pada tahun 2005 logam berat Pb, Hg, Cd, Cr dan Sn yang masuk ke perairan Teluk Jakarta telah melebihi kapasitas asimilasinya (Riani, 2005).
Kondisi tersebut di atas memperlihatkan bahwa logam berat yang masuk ke dalam Perairan Teluk Jakarta semakin tinggi, dan telah melebihi batas pulih dirinya sehingga menyebabkan logam berat terakumulasi dalam tubuh kerang hijau. Oleh karena itu akumulasi logam berat ke dalam tubuh kerang hijau saat ini perlu dilihat kembali, begitu pula dengan model akumulasi logam berat tersebut pada kerang hijau. Selain itu mengingat logam berat bersifat teratogenik, maka penelitian yang juga perlu dilakukan adalah penelitian mengenai pengaruh logam berat tersebut terhadap kesehatan kerang hijau di Teluk Jakarta, yang ditinjau dari malformasinya. Kajian ini diharapkan dapat memperlihatkan kondisi eksisting akumulasi logam berat pada kerang hijau, model akumulasi logam berat pada kerang hijau serta malformasi kerang hijau saat ini, sehingga akan dapat menjadi bahan pertimbangan (dasar) pengelolaan perairan Teluk Jakarta di masa yang akan datang.
1.2. Kerangka Pemikiran
Pada dasarnya sudah banyak penelitian yang mengindikasikan perairan Teluk Jakarta mengalami pencemaran yang setiap tahunnya cenderung mengalami peningkatan. Mulyono (2000) yang menyatakan pencemaran perairan di Teluk Jakarta menyebabkan akumulasi logam berat yang melebihi ambang batas pada ikan tongkol, kakap, bawal dan baronang. Riani dan Sutjahjo (2004) dan Mulyawan (2005); menemukan bahwa akumulasi logam berat pada kerang hijau juga jauh melebihi ambang batas yang telah di tentukan. Riani (2005) mengatakan bahwa kapasitas asimilasi beberapa parameter kualitas air, termasuk logam berat Hg, Pb, Cd, Cr dan Sn telah jauh melebihi kapasitas asimilasinya. Raharjo (2005) mendapatkan hasil bahwa pencemaran yang berasal dari limbah aktivitas masyarakat meningkat hingga beberapa kali lipat dan mencapai radius 60 km, hingga mencapai kawasan Kelurahan Pulau Seribu Utara, hingga Pulau Panggang. Akibat pencemaran tersebut diindikasikan penurunan produksi ikan tangkap di Teluk Jakarta dalam jangka waktu 1999-2002 dari sebelumnya 28,526 ton menjadi 17,829 ton. Tingginya bahan pencemar di perairan Teluk Jakarta membuat akumulasi logam berat pada sedimen, seperti timah yang mencapai 26,6 mg/kg – 70 mg/kg (Suharsono 2005). Salah satu kawasan di Teluk Jakarta yang jelas mengalami timbunan bahan pencemar adalah Pelabuhan Tanjung Priok (Asuhadi 2006) dan kawasan Pantai Marina (Mezuan 2007). Korelasi tingginya bahan pencemar yang masuk ke perairan Teluk Jakarta hingga terakumulasi pada sedimen dan biota (plankton, ikan dan kerang) sehingga melebihi ambang batas yang ditentukan juga dilakukan oleh Johari (2009) dan Dahlia (2009). BPLHD DKI Jakarta (2006) menyebutkan perairan Teluk Jakarta yang tercemar berat mencapai 43% dan tercemar sedang 57%.
akumulasi logam berat pada kerang hijau (Perna viridis) pada perairan yang tercemar logam berat, perlu untuk segera dilakukan. Untuk lebih jelasnya kerangka pemikiran penelitian ini dapat dilihat pada Gambar 1.
Gambar 1. Kerangka pemikiran penelitian
1.3. Perumusan Masalah
Gangguan lingkungan di perairan Teluk Jakarta semakin meningkat, namun pengendaliannya belum dilaksanakan dengan baik. Gangguan lingkungan tersebut terjadi karena adanya buangan dari berbagai kegiatan antropogenik, baik berupa limbah organik maupun anorganik yang berakibat pada menurunnya kualitas badan air penerimanya. Hal ini sesuai dengan hasil penelitian Sitepu (2008) bahwa kegiatan rumah tangga yang membuang limbah langsung ke badan air tanpa pengolahan terlebih
Pencemaran kualitas air
Pencemaran pada kerang hijau
Beban pencemaran
Teluk Jakarta KBP > BM
Keterangan:
KBP : Konsentrasi beban pencemar per liter air BM : Baku mutu
Bahan pertimbangan komprehensif Model pencemaran
perairan dan akumulasi pada
kerang hijau
Akumulasi logam berat pada kerang
hijau
Malformasi pada kerang
dahulu akan meningkatkan limbah organik dan limbah anorganik dalam badan air. Ketidaktahuan masyarakat tentang bahaya limbah domestik yang langsung dibuang ke ekosistem perairan tanpa mengalami pengolahan terlebih dahulu dapat memperberat pencemaran pada ekosistem perairan yang menerima. Selain itu, banyaknya industri yang lokasinya berdekatan membuang langsung limbahnya ke dalam badan air akan menurunkan kemampuan air untuk mempurifikasi diri. Di lain pihak pada limbah industri di dalamnya mengandung berbagai bahan yang sulit untuk diuraikan seperti bahan sintetik dan limbah B3 termasuk di dalamnya limbah logam berat. Menurut Napitupilu (2009) dari industri yang ada di DKI Jakarta, hanya kurang lebih 5% yang mempunyai IPAL, sehingga 95% industri tersebut akan membuang limbahnya ke dalam badan air dengan tanpa pengolahan terlebih dahulu.
Banyaknya limbah tersebut selain akan menurunkan kualitas air juga dapat mengancam kehidupan biota air yang hidup di dalamnya, salah satunya adalah kerang hijau (Perna viridis) yang bersifat sessil. Namun, besaran data kontaminasi limbah terutama logam berat yang bersifat akumulatif pada biota air seperti kerang hijau, saat ini belum diketahui. Begitu pula halnya dengan kondisi kerang hijau saat ini serta bagaimana model akumilasinya pada kerang hijau, belum ada informasinya. Berdasarkan pertimbangan tersebut maka permasalahan yang perlu diteliti adalah sebagai berikut.
1. Berapa besar bahan pencemar (beban pencemaran) yang masuk ke Teluk Jakarta saat ini
2. Berapa besar kontaminasi logam berat pada organ tubuh kerang hijau saat ini
3. Bagaimana kondisi morfologi kerang hijau di Teluk Jakarta (apakah terjadi malformasi pada kerang hijau)
4. Bagaimana model akumulasi logam berat pada kerang hijau di Teluk Jakarta yang menerima berbagai macam limbah dan saat ini kondisi kualitas airnya umumnya masuk pada kategori tercemar berat
1.4. Tujuan Penelitian
Penelitian ini bertujuan untuk
2. Mengkaji informasi kontaminasi bahan pencemar logam berat pada tubuh kerang hijau (Perna viridis)
3. Mengkaji gambaran morfologi kerang hijau di Teluk Jakarta (melihat prosentase kejadian malformasi pada kerang hijau)
4. Mengkaji model akumulasi logam berat pada kerang hijau di Teluk Jakarta yang menerima berbagai macam limbah dan kondisi kualitas airnya yang saat ini umumnya masuk pada kategori tercemar berat
1.5.Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat
1. Sebagai sumber informasi ilmiah mengenai kondisi dan kualitas perairan, beban dan tingkat pencemaran di Teluk Jakarta serta akumulasinya pada kerang hijau.
2. Sebagai sumber informasi ilmiah mengenai kontaminasi bahan pencemar dan pengaruhnya terhadap malformasi biota laut, khususnya kerang hijau (Perna viridis) yang ada di Teluk Jakarta
3. Sebagai sumber informasi dan alat bantu pengambilan keputusan, kebijakan dan strategi dalam upaya pengendalian pencemaran perairan Teluk Jakarta
2.1. Pencemaran
Pencemaran adalah masuknya bahan dan senyawa dari kegiatan manusia ke lingkungan sehingga menyebabkan berkurangnya nilai guna, baik ditinjau secara fisik, kimia, biologi dan estetika. Pencemaran memerlukan penilaian yang subjektif. Sebagai contoh pencemaran bahan organik yang menyebabkan terjadinya peningkatan konsentrasi unsur hara yang sangat dibutuhkan oleh tanaman di dalam air. Satu sisi adalah sisi positif, yaitu berupa terjadinya peningkatan kesuburan perairan yang berarti pula peningkatan potensi guna perairan. Di sisi lain, dampak buruk dari peningkatan unsur hara akan menganggu keseimbangan ekosistem perairan dan memerlukan penanganan yang serius (Connel dan Miller 1995; Damar 2004).
Sumber pencemaran dapat dibagi menjadi dua, bersumber pada lokasi tertentu (point source) dan yang sumbernya tersebar (non point/diffuse source). Point source
memiliki dampak yang ditimbulkan dapat ditentukan berdasarkan karakteristik spasial kualitas air. Volume pencemar dari point source biasanya relatif tetap. Sumber non-point sourcedapat berupapoint source dalam jumlah yang banyak. Misalnya: limpasan dari daerah pertanian yang mengandung pestisida dan pupuk, limpasan dari daerah pemukiman (domestik), dan limpasan dari daerah perkotaan (Effendi 2003). Davis dan Cornwell (1991) mengemukakan beberapa jenis pencemar dan sumbernya seperti yang tertera pada Tabel 1.
Tabel 1. Beberapa jenis pencemar dan sumbernya 1. Limbah yang dapat
menurunkan kadar oksigen 2. Nutrien
3. Patogen 4. Sedimen 5. Garam-garam 6. Logam yang toksik
7. Bahan organik yang toksik 8. Pencemaran panas Sumber : Davis dan Cornwell (1991)
2.1.1. Pencemaran Laut
Bagi sebagian besar organisme, air merupakan bahan terpenting kedua setelah oksigen. Ketersediaan air dengan kualitas yang sesuai peruntukanya harus cukup dan mudah didapatkan. Masuknya bahan, senyawa atau zat lain secara langsung maupun tidak langsung ke air akan mengakibatkan fungsi air sehingga tidak berjalan sebagaimana mestinya. Perubahan kualitas air dapat disebabkan oleh zat pencemar perairan maupun senyawa yang masuk ke aliran air atau tersimpan didasar, berakumulasi (khususnya pada endapan) dan suatu saat dapat terjadi pencucian atau pengenceran. Senyawa tersebut, terutama yang beracun, berakumulasi dan menjadi suatu konsenterasi tertentu yang berbahaya bagi mata rantai kehidupan. Haslam (1992) membagi zat pencemar menjadi:
1. Organisme patogen seperti bakteri, virus, dan protozoa
2. Zat hara tanaman (garam-garam nitrat dan fosfat yang larut dalam air), yang berasal dari penguraian limbah organik jika berlebihan dapat mengakibatkan eutrofikasi.
4. Bahan inorganik yang larut dalam air (asam, garam, logam berat, dan senyawa-senyawanya, anion, seperti sulfida, sulfit dan sianida).
5. Bahan-bahan kimia yang larut dan tidak larut (minyak, plastik, pestisida, pelarut, PCB, fenol, formaldehida, dan lain-lain). Zat-zat tersebut merupakan penyebab yang sangat beracun bahkan pada konsentrasi yang rendah (<1 ppm).
6. Zat-zat/bahan-bahan radioaktif.
7. Pencemaran thermal ; biasanya dalam bentuk limbah air panas yang berasal dari kegiatan suatu pembangkit tenaga. Pencemaran ini dapat mengakibatkan naiknya temperatur air, meningkatkan rasio dekomposisi dari limbah organik yang biodegradabledan mengurangi kapasitas air untuk menahan oksigen. 8. Sedimen (suspended solid); merupakan partikel yang tidak larut atau terlalu
besar untuk dapat segera larut. Kecenderungan sedimen untuk tinggal di dasar air tergantung pada ukurannya. Rasio aliran (flow rate) dan besarnya turbulensi yang ada pada suatu badan air. Partikel yang berukuran antara 1µm hingga 1nm, tetap dapat “melayang” dalam air, yang disebutcolloidal solid. Air yang banyak mengandung colloidal solid terlihat seperti air susu. Jumlah sedimen mempengaruhi turbiditas air, dan kualitasnya mempengaruhi warna.
Air dengan kotoran dari masyarakat dan rumah tangga dan juga berasal dari industri, air tanah, air permukaan serta dari buangan lainnya disebut air limbah (Sugiharto 1987). Metcalf dan Eddy (2002) menambahkan air buangan tersebut berasal dari air yang digunakan pada berbagai kegiatan manusia, sehingga terdapat perubahan karakteristik air. Rump (1999) menerangkan lebih lanjut bahwa perubahan karakteristik tersebut berupa perubahan komposisi air setelah digunakan oleh manusia. Kualitas air merupakan indikator kondisi perairan apakah masih dalam keadaan baik atau tercemar (Kupchella dan Hyland 1993).
air limbah terdiri dari 99,9% air dan 0,1% bahan lain seperti bahan padat, koloid dan terlarut. Bahan lain tersebut terbagi atas bahan organik dan anorganik. Bahan organik dalam air limbah terbagi atas 65% protein, 25% karbohidrat dan 10% lemak, sedangkan bahan anorganiknya terbagi menjadi butiran, garam dan metal (Sugiharto 1987). Skema pengelompokan bahan yang terkandung dalam air limbah dapat dilihat pada Gambar 2.
Gambar 2. Skema pengelompokan bahan yang terkandung dalam air limbah (Sugiharto 1987)
Dahuri (2003) menyatakan pengaruh yang membahayakan bagi kehidupan biota, sumberdaya, kenyamanan ekosistem laut, baik disebabkan secara langsung maupun tidak langsung oleh pembuangan bahan-bahan atau limbah ke dalam laut yang berasal dari kegiatan manusia, merupakan definisi pencemaran laut. GESAMP (Group of Expert on Scientific Aspect on Marine Pollution), dalam Sanusi (2006) mendefenisikan pencemaran laut sebagai masuknya zat-zat (substansi) atau energi ke dalam lingkungan laut dan estuari baik langsung maupun tidak langsung, akibat adanya kegiatan manusia yang menimbulkan kerusakan pada lingkungan laut, kehidupan di laut, kesehatan manusia, mengganggu aktivitas di laut (usaha penangkapan, budidaya, alur pelayaran) serta secara visual mereduksi keindahan (estetika). Berdasarkan Peraturan Pemerintah Nomor 19 Tahun 1999, pencemaran laut diartikan dengan masuknya atau dimasukkannya makhluk hidup, zat, energi, dan/atau komponen lain ke dalam lingkungan laut oleh kegiatan manusia sehingga kualitasnya turun sampai ke tingkat tertentu yang menyebabkan lingkungan laut tidak sesuai lagi dengan baku mutu dan/atau fungsinya.
Sanusi (2006) menjabarkan sifat toksik dan persistensi dari polutan yang masuk ke laut selain tergantung pada karakter fisik dan kimianya juga dari faktor lingkungan lautnya, yakni
Air limbah
Air (99%) Bahan padat (0.1%)
1. Kemantapan ekosistem (constancy); terkait dengan besar kecilnya pengaruh perubahan;
2. Persistensi ekosistem (persistent); terkait dengan lamanya waktu untuk kelangsungan proses-proses normal ekosistem;
3. Kelembaman ekosistem (inertia); terkait dengan kemampuan bertahan terhadap gangguan eksternal;
4. Elastisitas ekosistem (elasticity); terkait dengan kekenyalan/kemampuan ekosistem untuk kembali ke keadaan semula setelah mengalami gangguan; 5. Amplitudo ekosistem (amplitude); terkait dengan besarnya skala gangguan
namun daya pulih (recovery) masih memungkinkan.
2.1.2. Pencemaran di Teluk Jakarta
Sutamihardja et al. (1982) menjelaskan bahwa faktor yang menyebabkan pencemaran di Teluk Jakarta merupakan faktor yang sama yang menyebabkan pencemaran di laut, yakni:
1. Penggundulan hutan pada wilayah hulu dan penambangan pasir di daerah aliran sungai akan mengakibatkan erosi dan sedimentasi
2. Penggunaan pupuk kimia dan berbagai macam pestisida untuk intensifikasi pertanian mengakibatkan residu bahan kimia dan pestisida masuk ke aliran sungai dan laut.
3. Pemanfaatan sungai sebagai tempat sampah yang menyebabkan berbagai limbah mengalir ke sungai dan akhirnya ke laut. Sampah padat sudah menimbulkan masalah di kota-kota besar. Limbah padat ini dapat ditemukan di mana-mana, ditimbun di tanah lapang tak terpakai, membusuk, terlarut dan masuk ke selokan-selokan menuju ke sungai dan ke laut. Fungsi lain sungai yang kurang tepat, digunakan untuk MCK, misalnya di Sungai Ciliwung.
5. Pengoperasian PLTU memerlukan air pendingin yang diambil air laut. Setelah digunakan air pendingin akan dibuang sebagai limbah panas. Di Teluk Jakarta terdapat dua lokasi PLTU, yakni di Muara Karang dan di Tanjung Priok.
6. Pencemaran dari kegiatan industri yang diakibatkan oleh faktor: a. Perencanaan kompleks industri yang tak teratur.
b. Perluasan kota yang masuk ke kawasan industri menyebabkan berbaurnya pemukiman dengan kompleks industri.
c. Tak tersedianya atau adanya pengolahan limbah yang tak sempurna. d. Karena kondisi yang miskin, air digunakan untuk industri dan untuk
keperluan rumah tangga.
e. Kesadaran akan bahaya limbah industri yang kurang atau tak ada.
f. Kemampuan pulih-diri sungai-sungai yang menerima limbah yang berbeda.
g. Musim kering yang mengakibatkan debit air sangat rendah.
Pada wilayah DKI Jakarta, yang sebagian besar daerah pemukiman maupun industrinya membuang limbah ke sungai tanpa diolah terlebih dahulu, akan sangat mempengaruhi kualitas Teluk Jakarta. Japan Internasional Cooperation Agency
(JICA), menyatakan tahun 2010 jumlah limbah cair industri dari DKI Jakarta akan mencapai 256,631 m3/hari dengan beban polusi organik 118,600 kg BOD/hari. Kondisi pencemaran tersebut menjadi antara enam (6) sampai dengan sembilan kali (19) lipat dibandingkan pada awal dekade 1990.
Masalah lain yang berkaitan dengan kualitas air di Teluk Jakarta pada saat ini adalah terjadinya eutrofikasi, bahkan pada kawasan pesisir telah terjadi kondisi hyper-eutrofikasi(Damar 2004). Mulyono (2000) menyatakan eutrofikasi pada perairan Teluk Jakarta disebabkan dua hal yakni: (a) beban (load) bahan pencemar yang dibawa melalui sungai dan saluran-saluran pembuangan (out full) yang bermuara ke perairan Teluk Jakarta dan (b) proses fisik, kimia dan biologi yang terjadi di perairan Teluk Jakarta.
2.2. Logam Berat
Groot, Salomons, Allersma (1976) mengemukakan bahwa yang juga termasuk pada logam berat adalah Cr, Mn, Fr, Co, Ni Cu dan Zn yang berada di baris pertama di logam transisi pada tabel periodik (Gambar 3). Selanjutnya Palar (2004) menambahkan logam berat merupakan istilah untuk mengelompokan ion-ion logam berat dalam tiga kelompok secara biokimia, yakni
(1) Logam yang dengan mudah mengalami reaksi dengan unsur oksigen (oxygen seeking metals)
(2) Logam yang dengan mudah megalami reaksi kimia bila bertemu dengan unsur nitrogen atau belerang atau sulfur (nitrogen sulfur-seeking metals)
(3) Logam antara atau transisi yang memiliki sifat spesifik sebagai logam pengganti (ion pengganti)
Gambar 3. Tabel periodik ( http://www.ptable.com/)
Moore dan Ramamoorthy (1984) menjelaskan lebih lanjut sifat logam berat, yakni:
1) Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan keberadaannya secara alami sulit terurai (dihilangkan);
2) Dapat terakumulasi dalam organisme termasuk kerang dan ikan; 3) Memiliki EC10dan LC50- 96 jam yang rendah;
4) Memiliki waktu paruh yang tinggi dalam tubuh biota laut;
5) Memiliki nilai faktor konsentrasi (concentration factor atau enrichment factor) yang besar dalam tubuh biota laut. Faktor konsentrasi atau disebut pula koefisien bioakumulasi adalah rasio antara kadar polutan dalam tubuh biota akuatik dan kadar polutan yang bersangkutan dalam kolom air.
yang merupakan elemen esensial untuk bakteria dan hewan, unsur Cr untuk hewan, unsur Cu untuk tumbuhan dan hewan, unsur Mn untuk tumbuhan dan hewan, unsur Mo untuk tumbuhan, unsur Ni untuk tumbuhan, unsur Se untuk hewan dan unsur Zn untuk tumbuhan dan hewan.
Contoh logam berat non esensial antara lain adalah unsur Ag, As, Ba, Cd, Hg, TI, Pb, Sb. Hingga saat ini manfaat unsur-unsur tersebut belum diketahui, sehingga peran unsur-unsur tersebut masih belum jelas apakah sama seperti logam berat esensial atau tidak. Namun demikian logam berat non esensial tersebut di atas sudah terbukti memiliki dampak racun jika terdapat dalam jumlah yang melebihi ambang batas yang sudah ditentukan. Selanjutnya Alloway (1995) menambahkan bahwa logam berat yang berpotensi bahaya (menjadi racun) adalah As, Cd, Cu, Cr, Hg, Pb dan Zn.
Pada dasarnya jika suatu jenis logam berat terdapat dalam tanah, maka akan terjadi beberapa kemungkinan, dan salah satu kemungkinan yang akan terjadi adalah terjadinya reaksi kimia dari logam berat tersebut. Adapun reaksi yang mungkin terjadi terhadap logam berat dalam tanah jika dalam tanah tersebut terdapat senyawa organik atau senyawa inorganik antara lain adalah:
- membentuk senyawa larut, komleks dari berbagai macam molekul
- presipitasi atau kopresipitasi
- terinkorporasi ke dalam struktur mineral
- terakumulasi atau terfiksasi ke dalam bahan biologi
- dikompleks dengan agen pengkhelat
- diabsorb dalam mineral liat atau koloid organik
pH lingkungan berada pada nilai 9, maka bentuk Cd akan berubah menjadi Cd(OH)2. Berdasarkan hal tersebut, maka secara umum penurunan pH akan meningkatkan ketersediaan logam berat kecuali Mo dan Sn. Hal ini disebabkan pada pH yang rendah, logam berat akan lepas atau larut dalam air, sehingga konsentrasinya dalam air mengalami peningkatan.
2.3. Pencemaran dan Toksisitas Logam Berat
Logam berat merupakan bahan buangan hasil kegiatan yang menimbulkan pencemaran terutama perairan laut di negara berkembang. Sumber limbah yang banyak mengandung logam berat biasanya berasal dari aktivitas industri, pertambangan, pertanian dan pemukiman. Bryan dalam Rochayatunet al.(2005) menyatakan 18 jenis logam berat yang dipertimbangkan sebagai bahan pencemar, terutama dalam jumlah berlebih sangat beracun bagi kehidupan organisme. Pada batas dan kadar tertentu, semua logam berat dapat menimbulkan pengaruh yang negatif terhadap organisme perairan.
Bryan (1984) dalam Darmono (2001) menambahkan dampak negatif tersebut dipengaruhi juga oleh jenis logam, interaksi antar logam dan jenis racun lainnya, spesies hewan, daya permeabilitas organisme, dan mekanisme detoksikasi serta pengaruh lingkungan seperti suhu, pH, dan oksigen. Faktor lain yang mempengaruhi toksisitas logam berat adalah suhu dan pH, salinitas dan kesadahan (Hutagalung, 1984). Toksisitas logam berat semakin tinggi saat terjadi penurunan pH dan/atau penurunan salinitas perairan dan/atau meningkatnya suhu. Toksisitas logam berat akan menurun seiring meningkatnya kesadahan. Sanusi (2006) menyatakan saat peningkatan kesadahan, logam berat akan membentuk senyawa komplek dan mengendap pada substrat sehingga toksisitasnya menurun.
Darmono (1995) menyatakan pencemaran logam berat yang terjadi di wilayah estuaria, erat hubungannya dengan penggunaan logam tersebut oleh manusia. Pada air laut dilautan lepas kontaminasi logam berat biasanya terjadi secara langsung dari atmosfer atau karena tumpahan minyak dari kapal-kapal tanker yang melaluinya, sedangkan di daerah sekitar pantai kontaminasi logam kebanyakan berasal dari mulut sungai yang terkontaminasi oleh limbah buangan industri atau pertambangan. Pada daerah-daerah perindustrian, sungai dan laut sekitarnya umumnya berangsur-angsur menerima tekanan terus menerus. Muara sungai umumnya merupakan alur perjalanan bahan cemaran yang dibawa melalui sungai dari aktivitas didarat ke laut (Rochyatunet al. 2005).
2.4. Karakteristik Logam Berat 2.4.1. Merkuri (Hg)
Merkuri (hydrargyrum atau Hg) memiliki nomor atom 80 dengan berat atom 200,59 g/mol (Cotton dan Wilkinson 1989). Sumber alami merkuri berasal dari pelapukan batuan dan erosi tanah yang mengandung HgS (cinnabar) (Effendi 2003). Lu (2006) menambahkan kegiatan antropogenik seperti penambangan, peleburan bahan logam, pembakaran bahan bakar fosil, dan proses produksi baja, semen dan fosfat merupakan sumber merkuri yang dapat menambah keberadaannya di alam.
1. Berbentuk cair pada suhu kamar (25oC) dan memiliki titik beku yang paling rendah dibanding logam lainnya (-39oC). Dalam bentuk cair, merkuri memiliki kisaran suhu yang lebar (396oC)
2. Volatilitas yang tinggi dibanding logam lainnya
3. Konduktor yang baik dengan ketahanan listrik yang rendah
4. Mudah dicampur dengan logam lain menjadi logam campuran yang disebut logam campuran (amalgam/alloy);
5. Toksik terhadap semua makhluk hidup
Toksisitas mekuri yang sangat tinggi, mengakibatkan hanya bakteri anaerobik saja yang dapat melakukan mobilisasi terhadap logam ini. Manahan (2001) menyatakan merkuri ditemukan sebagitrace komponen pada banyak mineral, dengan kandungan di bebatuan kurang lebih 80 ppb atau kurang. Cinnabar atau merkuri sulfida merah merupakan salah satu jenis merkuri yang sangat mahal. Fosil batu bara dan lignite mengandung merkuri kurang lebih 100 ppm atau lebih dari itu. Logam merkuri dihasilkan secara alamiah dari pengolahan bijihnya, cinnabar, dengan menggunakan oksigen melalui reaksi (1) dibawah ini:
HgS + O2 Hg + SO2……….(1)
Logam merkuri yang dihasilkan ini, digunakan dalam sintesa senyawa- senyawa anorganik dan organik yang mengandung merkuri. Dalam kehidupan sehari-hari, merkuri berada dalam tiga bentuk dasar, yaitu merkuri metalik, merkuri anorganik dan merkuri organik. Di lingkungan perairan, merkuri organik dan anorganik paling mendominasi (Fardiaz 2005; Lu 2006; Sanusi 2006), seperti dinyatakan sebagai berikut: a. Merkuri anorganik, ion logam merkuri (Hg2+) dan garam-garamnya seperti
merkuri klorida (HgCl2) dan merkuri oksida (HgO2); b. Komponen merkuri organik:
Aril merkuri, mengandung hidrokarbon aromatik seperti fenil merkuri
asetat
Alkil merkuri, mengandung hidrokarbon alifatik dan merupakan merkuri yang paling beracun, misalnya metil merkuri dan etil merkuri
Pada lingkungan perairan, merkuri dapat ditemui dalam 3 bentuk yaitu Hg0, Hg+dan Hg2+, bentuk-bentuk ini sangat ditentukan oleh rekasi oksidasi dan reduksi yang ada. Di perairan yang konsentrasi oksigennya rendah atau dalam kondisi tereduksi, maka kebanyakan dari merkuri ini akan terbentuk dalam Hg0 dan Hg+, sedangkan merkuri akan berbentuk Hg2+ dalam kondisi yang kaya akan oksigen atau kondisi oksidasi. Merkuri akan menjadi HgS jika terdapat sulfit dalam perairan (Sanusi dan Putranto, 2009). Di perairan yang tidak tercemar, kadar Hg2+ terlarut sebanyak 0,02–0,1 mg/l (air tawar) dan <0,01–0,03 mg/l (air laut) (Sanusi 2006).
Sifat Hg yang sangat reaktif membuat Hg sangat mudah membetuk ikatan- ikatan komplek dengan ligan organik dan inorganik. Ikatan dengan ligan organik seperti grup
alkyl dan aryl yang ada dalam perairan seperti CH3-Hg+, (CH3)2-Hg+, CH3(CH2)-Hg+, dsb. Ikatan merkuri dengan ligan inorganik akan menghasilkan sifat amphypilic
seperti CH3-HgCl dan hydrophobic seperti CH3-Hg+dan (CH3)2-Hg. Senyawa organik Hg yang bersifat toksik adalah CH3-Hg+ yang terbentuk akibat proses metilasi dalam perairan. Proses metilasi ini sangat dipengaruhi oleh temperatur, kondisi redoks, kadar, ukuran partikel sedimen, aktivitas metabolisme bakteri dan jumlah ligan organik yang ada. Terdapat beberapa senyawa organik-Hg, namun senyawa yang bersifat toksik adalah CH3-Hg+yang terbentuk oleh proses metilasi dalam perairan, seperti ditampilkan dalam reaksi (2) (Baird 1995):
……….(2)
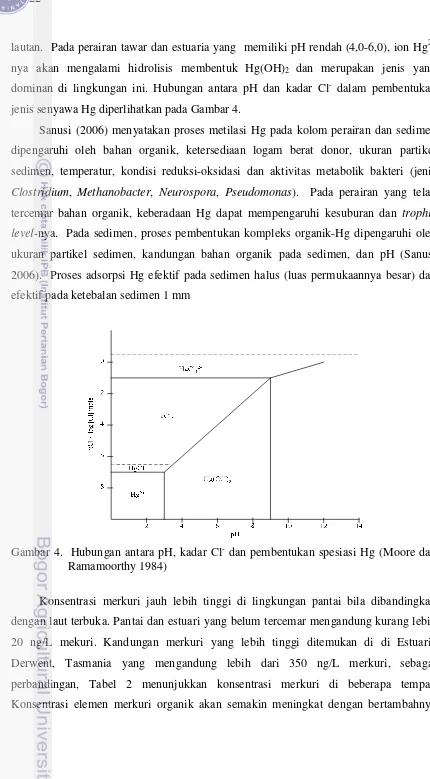
lautan. Pada perairan tawar dan estuaria yang memiliki pH rendah (4,0-6,0), ion Hg2+ nya akan mengalami hidrolisis membentuk Hg(OH)2 dan merupakan jenis yang dominan di lingkungan ini. Hubungan antara pH dan kadar Cl- dalam pembentukan jenis senyawa Hg diperlihatkan pada Gambar 4.
Sanusi (2006) menyatakan proses metilasi Hg pada kolom perairan dan sedimen dipengaruhi oleh bahan organik, ketersediaan logam berat donor, ukuran partikel sedimen, temperatur, kondisi reduksi-oksidasi dan aktivitas metabolik bakteri (jenis
Clostridium, Methanobacter, Neurospora, Pseudomonas). Pada perairan yang telah tercemar bahan organik, keberadaan Hg dapat mempengaruhi kesuburan dan trophic level-nya. Pada sedimen, proses pembentukan kompleks organik-Hg dipengaruhi oleh ukuran partikel sedimen, kandungan bahan organik pada sedimen, dan pH (Sanusi 2006). Proses adsorpsi Hg efektif pada sedimen halus (luas permukaannya besar) dan efektif pada ketebalan sedimen 1 mm
Gambar 4. Hubungan antara pH, kadar Cl- dan pembentukan spesiasi Hg (Moore dan Ramamoorthy 1984)
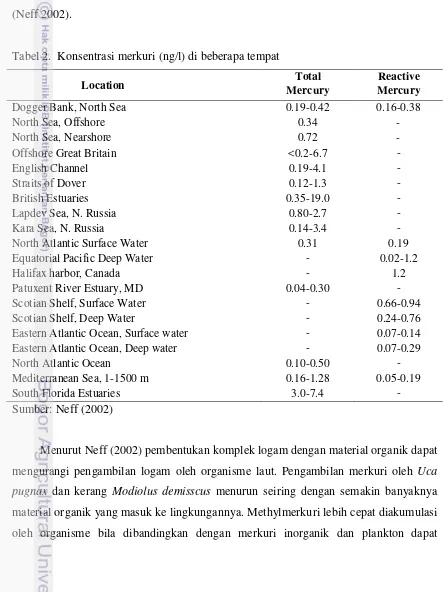
kedalaman. Konsentrasi merkuri yang berasosiasi dengansuspended material di sungai dan estuari kurang lebih 12 μg/L. Kurang lebih 0,4-2,7 μg/L merkuti ditemukan di Sungai Seine, Prancis. Sedimen lautan dan estuaria yang belum tercemar mengandung kurang lebih 0,2 μg/g merkuri atau bahkan kurang, sedangkan di Teluk Fransisco, Teluk Belingham dan Teluk Chesapeake yang sudah tercemar mengandung merkuri sebanyak 0,4-10,7 μg/g. Sedimen dari basin Lautan Arctic mengandung 0,034-0,116 μg/g merkuri (Neff 2002).
Tabel 2. Konsentrasi merkuri (ng/l) di beberapa tempat
Location MercuryTotal MercuryReactive
Dogger Bank, North Sea 0.19-0.42 0.16-0.38
North Sea, Offshore 0.34
-North Sea, Nearshore 0.72
-Offshore Great Britain <0.2-6.7
-English Channel 0.19-4.1
-Straits of Dover 0.12-1.3
-British Estuaries 0.35-19.0
-Lapdev Sea, N. Russia 0.80-2.7
-Kara Sea, N. Russia 0.14-3.4
-North Atlantic Surface Water 0.31 0.19
Equatorial Pacific Deep Water - 0.02-1.2
Halifax harbor, Canada - 1.2
Patuxent River Estuary, MD 0.04-0.30
-Scotian Shelf, Surface Water - 0.66-0.94
Scotian Shelf, Deep Water - 0.24-0.76
Eastern Atlantic Ocean, Surface water - 0.07-0.14
Eastern Atlantic Ocean, Deep water - 0.07-0.29
North Atlantic Ocean 0.10-0.50
-Mediterranean Sea, 1-1500 m 0.16-1.28 0.05-0.19
South Florida Estuaries 3.0-7.4
-Sumber: Neff (2002)
menyerap kedua jenis merkuri ini. Kebanyakan dari merkuri yang masuk ke dalam tubuh organisme ini akan di akumulasi dalam jaringan tubuh organisme. Cacing polychaeta Capitala capitata, kebanyakan mendapat merkuri dari alga atau detritus yang dimakannya. Pada lobster Nephrops norvegica akumulasi merkuri terjadi di bagian insang dan hepatopankreasnya. Setiap organisme memiliki pebedaan konsentrasi merkuri pada tiap jaringannya (Tabel 3). Organisme sendiri dapat mengasimilasi merkuri yang masung ke dalam tubuhnya (Tabel 4).
Tabel 3. Konsentrasi merkuri (mg/l) pada jaringan beberapa organisme laut dari Telyk Terra Nova, Antartica
Spesies Otot Hati Organ Lain
Scallop (Adamussium colbecki) 0,2 0,35 0,86 (insang) Fish (Trenuttomus bernacchii) 0,83 0,46 0,94 (ginjal) Adelie Penguin (Pygoscells adeliae) 0,6 1,6 1,20 (ginjal) Weddell Seal (Leptonychotes weddellii) 1,85 44 24,0 (limfa) Sumber: Neff (2002)
Tabel 4. Efisiensi merkuri inorganik danmethyl merkuridari makanan dan sedimen oleh organisme laut
Animal Food Efisiensi Asimilasi (%)
Hg(II) CH3Hg
PolychaetesNereis succinia Oxic sediment 7-22 66-75
MusselMytilus edulis Oxic sediment 1-9 30-87
CopepodAcartia tonsa Diatoms 15 62
FishCyprinodon variegatus Copepods 37 76
PlaicePleuronectes platessa Polychaetes 5 80
Sumber: Neff (2002)
merkuri yang lebih tinggi yaitu 0,015 mg/liter, namun spesies ini tidak menunjukkan efek yang berarti setelah terpapar dengan merkuri selama 28 hari pada konsetrasi 0,006 mg/liter. Pada larva bivalvia spesies Crassostrea gigas dan Mytilus edulis setelah terpapar dengan Hg dengan median efek konsentrasi (EC50) masing-masing sebanyak 0,0067 dan 0,0058 mg/liter akan menunjukkan perkembangan larva yang tidak normal.
2.4.2. Kadmium (Cd)
Kadmium disingkat dengan Cd (cadmium) memiliki nomor atom 49, dengan berat atom 112,41 g/mol, memiliki titik didih dan titik leleh masing-masing 765oC dan 320,9 o
C (Cotton dan Wilkinson 1989). Kadmium hampir selalu ditemukan dalam jumlah yang kecil dalam bijih-bijih seng, seperti sphalerite (ZnS). Greenokcite (CdS) merupakan mineral satu-satunya yang mengandung kadmium. Hampir semua kadmium diambil sebagai hasil produksi dalam persiapan bijih-bijih seng, tembaga dan timbal. Sumber utama polutan kadmium berasal dari aktivitas industri dan sisa-sisa penambangan. Produksi kadmium setiap tahunnya adalah 15.000–20.000 ton, dan kadmium tersebut diproduksi dari hasil penambangan (Paasivirta 2000). Sebagian besar makanan mengandung sejumlah kecil kadmium. Padi-padian dan produk biji-bijian biasanya merupakan sumber utama kadmium. Asap rokok juga menyebabkan meningkatnya kadmium di lingkungan (Baird 1995; Lu 2006). Kadmium mempunyai sifat tahan panas, sehingga baik untuk campuran-campuran bahan-bahan keramik dan plastik, kadmium juga sangat tahan terhadap korosi sehingga cocok untuk melapisi plat besi dan baja (Darmono 1995). Kadmium juga digunakan sebagai pigmen pada keramik, pada penyepuhan listrik, serta dalam pembuatan aloy dan baterai alkali (Baird, 1995; Lu 2006). Baird (1995) mengemukakan bahwa kadmium juga sering di pakai sebagai elektroda pada beterai kalkulator yang dikenal sebagaiNi-Cd(nikel kadmium).
Cd2++ H2O Cd(OH)++ H+……….(3)
Ikatan kompleks tersebut memiliki tingkat kelarutan yang berbeda, yakni: Cd2+>CdSO4>CdCl+>CdCO3>Cd(OH)+ (Sanusi 2006). Afinitas Cd terhadap anion klorida dibandingkan dengan logam berat lainnya sesuai urutan adalah Hg > Cd > Pb > Zn, dalam hal ini Cd menempati urutan kedua setelah Hg (Hahne dan Kroontje 1973 dalam Moore dan Ramamoorthy 1984). Bahan organik terlarut dalam perairan (gugus asam amino, sistein, polisakarida dan asam karbosiklik) memiliki kapasitas membentuk ikatan kompleks dengan Cd dan logam berat lainnya. Demikian pula keberadaan asam humus (humic substances) dalam perairan seperti asam fulvik dan asam humik akan membentuk ikatan kompleks (kelasi) dengan Cd. Pada umumnya stabilitas ikatan kompleks logam berat-asam humus mengikuti deret Irving–Williams (Irving–Williams Order) sebagai berikut:
Mg<Ca<Cd~Mn<Co<Zn~Ni<Cu<Hg ……….(4)
Di perairan tawar kemampuan pembentukan kompleks Cd oleh asam humus kurang lebih 2,7% daripada total Cd terlarut, sementara di perairan estuari lebih rendah dari 1% daripada total Cd terlarut. Berdasarkan hal tersebut maka, selain ditentukan oleh kadar asam humus dan Cd terlarut, parameter pH dan salinitas berperan dalam membentuk ikatan kompleks logam berat-asam humus. Logam berat Cd terlarut dalam air akan mengalami proses adsorpsi oleh partikel tersuspensi dan mengendap di sedimen. Proses adsorpsi akan diikuti oleh proses desorpsi yang mengembalikan Cd dalam bentuk terlarut dalam badan air (Sanusi 2006). Kadmium dalam air laut berbentuk senyawa klorida (CdCl2), sedangkan pada perairan tawar kadmium berbentuk karbonat (CdCO3). Pada perairan payau kedua senyawa tersebut berimbang (Darmono 1995).
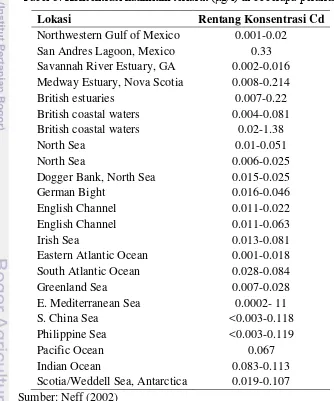
akan tinggi di permukaan dan menjadi semakin berkurang dengan bertambahnya kedalaman. Sebanyak 0,1-0,6 μg/g kadmium terkandung pada sedimen perairan yang belum mengalami pencemaran. Di daerah Perairan Atlantik dan Teluk Florida mengandung 0,01-0,3 μg/g kadmium dan konsentrasi kadmium ini berkorelasi positif dengan kandungan aluminium. Di daerah Pelabuhan New Bedfor yang sudah tercemar, konsentrasi kadmium dalam sedimen sekitar 52 μg/g dan 460 μg/g di Teluk Spencer Australia Selatan. Kadmium juga ditemukan pada air interstitial dengan konsentrasi 0,002-108 μg/L. Konsentrasi kadmium di Teluk Villefrance, Prancis menurun seiring dengan meningkatnya kedalaman dan meningkat lagi pada kedalaman lebih dari 27 cm (Neff, 2002).
Tabel 5. Konsentrasi kadmium terlarut (μg/l) di beberapa perairan
Lokasi Rentang Konsentrasi Cd
Northwestern Gulf of Mexico 0.001-0.02 San Andres Lagoon, Mexico 0.33 Savannah River Estuary, GA 0.002-0.016 Medway Estuary, Nova Scotia 0.008-0.214
British estuaries 0.007-0.22
British coastal waters 0.004-0.081 British coastal waters 0.02-1.38
North Sea 0.01-0.051
North Sea 0.006-0.025
Dogger Bank, North Sea 0.015-0.025
German Bight 0.016-0.046
English Channel 0.011-0.022
English Channel 0.011-0.063
Irish Sea 0.013-0.081
Eastern Atlantic Ocean 0.001-0.018 South Atlantic Ocean 0.028-0.084
Greenland Sea 0.007-0.028
E. Mediterranean Sea 0.0002- 11
S. China Sea <0.003-0.118
Philippine Sea <0.003-0.119
Pacific Ocean 0.067
Indian Ocean 0.083-0.113
Tabel 6. Konsentrasi kadmium (μg/g) pada jaringan otot beberapa organisme
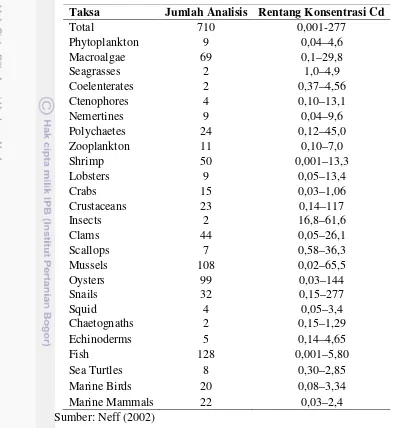
Taksa Jumlah Analisis Rentang Konsentrasi Cd
Total 710 0,001-277
Sea Turtles 8 0,30–2,85
Marine Birds 20 0,08–3,34
Marine Mammals 22 0,03–2,4
Sumber: Neff (2002)
diakumulasi pada bagian ginjal. Pada lobster, kadmium dengan jumlah yang paling banyak ditemukan pada organ hepatopankreas (Paasivirta, 2000). Tabel 6 menunjukkan konsentrasi kadmium pada jaringan otot beberapa organisme.
Keracunan kadmium dapat bersifat akut dan kronis. Efek keracunan yang dapat ditimbulkannya berupa penyakit paru-paru, hati, tekanan darah tinggi, gangguan pada sistem ginjal dan kelenjer pencernaan serta mengakibatkan kerapuhan pada tulang (Effendi 2003; Lu 2006). Manahan (2001) menambahkan keracunan akut Cd ke manusia akan menimbulkan efek yang sangat fatal, diantaranya meningkatkan tekanan darah, kerusakan ginjal, perusakan jaringan testis dan merusak sel darah merah. Efek ini hampir mirip apabila manusia mengalami keracunan Cd. Secara spesifik, Cd akan menggantikan Zn yang ada dalam enzim. Toksisitas Cd lebih rendah bila dibandingkan dengan toksisitas Hg dan Cu. Namun demikian, Cd dapat mereduksi klorofil, ATP, dan mengurangi konsumsi O2 fitoplankton dengan konsentarsi 0,01-0,1 mg/l ketika membentuk ikatan komplek CdCl2. Efeknya akan menjadi lebih toksik lagi ketika konsentrasinya menjadi meningkat, misalnya dapat menyebabkan toksistas akut pada ikan estuari pada konsentrasi Cd terlarut sebesar 8–85 mg/l (Mance 1990).
2.4.3. Timbal (Pb)
Timbal bernama latin plumbum (Pb), nomor atomnya 82 dan berat atomnya 207,20 g/mol (Cotton dan Wilkinson 1989). Timbal secara alami berasal dari pelapukan batuan dan erosi tanah yang mengandung timbal sulfida (PbS) (Effendi 2003). Lu (2006) menambahkan kegiatan antropogenik seperti penambangan, peleburan bahan logam, pembakaran bahan bakar fosil, dan proses produksi baja, semen dan fosfat merupakan sumber timbal yang dapat menambah keberadaannya di alam. Dalam pertambangan, timbal berbentuk timbal sulfida (PbS) yang disebut galena.
dipergunakan dalam industri kimia yang berbentuk tetra-etil-Pb, yang biasanya dicampur dengan bahan bakar minyak (BBM) dengan tujuan meningkatkan daya tahan mesin. Sifat Pb yang tahan korosif dan sifat yang mudah menyatu dengan bahan lain, mengakibatkan Pb banyak digunakan sebagai campuran cat misalnya Pb putih (Pb(OH)22PbCO3), Pb merah, Pb merah cerah (Pb3O4) dan PbCrO4untuk warna kuning. Penggunaan lainnya adalah untuk produk-produk logam seperti amunisi, pelapis kabel, pipa, solder, bahan kimia dan pewarna (Fardiaz 2005; Lu 2006; Darmono 1995).
Penggunaan timah hitam/timbal tersebut karena timbal memiliki sifat unggul (Darmono 1995; Fardiaz 2005) yakni:
1. Mempunyai titik lebur yang rendah sehingga mudah digunakan dan murah biaya operasinya.
2. Mudah dibentuk karena sifat logamnya yang lunak
3. Mempunyai sifat kimia aktif sehingga dapat dipergunakan untuk melapisi logam untuk mencegah terjadinya perkaratan
4. Kepadatan melebihi logam lain
5. Timbal dapat membentuk alloy dengan logam lainnya, dan alloy yang terbentuk mempunyai sifat yang berbeda dengan timbal murni
6. Memiliki densitas yang tinggi dibanding logam lain; kecuali emas dan merkuri, yaitu 11,34 g/cm3
7. Sifat kimia timbal menyebabkan logam ini dapat berfungsi sebagai pelindung jika kontak dengan udara lembab
timbal (lead gasoline) memberikan kontribusi yang berarti bagi keberadaan timbal di perairan. Kadar dan toksisitas timbal di perairan dipengaruhi oleh kesadahan, pH, alkalinitas, dan kadar oksigen (Effendi 2003; Neff 2002; Sanusi 2009).
Konsetrasi timah hitam (timbal) pada perairan laut terbuka yang belum tercemar kurang lebih 0,002-0,3 μg/L, namun konsetrasinya akan menjadi lebih dari 1 μg/L pada perairan pantai atau perairan teluk. Konsentrasi timbal di Samudra Atlantik Utara pada kondisi terlarut dan tersuspensi masing-masing 0,002-0,029 dan 0,0001-0,0004 μg/L. Tabel 7 di bawah menunjukkan konsentrasi timbal di beberapa perairan. Konsentrasi timbal di sedimen estuari dan pantai yang belum tercemar adalah 5-30 μg/g. Namun konsentrasi timbal ini akan menjadi meningkat pada daerah pantai yang berdekatan dengan pusat-pusat industri, seperti di sedimen Teluk San Francisco mengandung kurang lebih 2900 μg/g timah (Neff, 2002).
Tabel 7. Konsentrasi timah terlarut (μg/l) di beberapa perairan
Lokasi Pb Terlarut
N. Atlantic Surface Water 0,002–0,029 S. Atlantic Surface Water 0,003
Bermuda 0,016
S. North Sea Surface Water 0,008–0,20 S. North Sea Bottom Water 0,017–0,087 Offshore UK Surface Water 0,021–0,19
British Estuaries 0,023–1,1
Bristol Channel & Severn Estuary, UK 0,02–10,0
Greenland Sea 0,004–0,104
Ross Sea, Antarctica 0,005–0,027
East China Sea 0,041–0,517
Gulf of Mexico off LA 0,02–0,05
Galveston Bay, TX 0,009–0,02
S. California Bight Offshore 0,004–0,012 S. California Bight Nearshore 0,009–0,06
San Francisco Bay, CA 0,041
Sumber: Neff (2002)
dapat melalui rantai makanan sepertiCapitela capitatayang mengakumulasi timbal dari detritus dan alga yang dimakannya dan konsentrasinya dalam tubuh akan semakin meningkat seiring dengan semakin banyaknya alga yang dimakan. Kerang
Scrobicularia plana dan Polychaeta Nereis diversicolor memiliki kemampuan mengakumulasi timbal dari sedimen yang anoksik. Konsentrasi timbal pada jaringan beberapa organisme dapat dilihat pada Tabel 8.
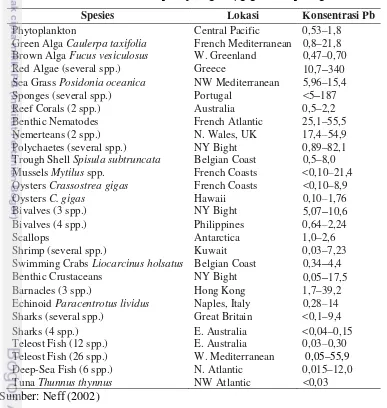
Tabel 8. Konsentrasi timah pada jaringan (μg/g) beberapa organisme
Spesies Lokasi Konsentrasi Pb
Phytoplankton Central Pacific 0,53–1,8
Green AlgaCaulerpa taxifolia French Mediterranean 0,8–21,8 Brown AlgaFucus vesiculosus W. Greenland 0,47–0,70
Red Algae (several spp.) Greece 10,7–340
Sea GrassPosidonia oceanica NW Mediterranean 5,96–15,4
Sponges (several spp.) Portugal <5–187
Reef Corals (2 spp.) Australia 0,5–2,2
Benthic Nematodes French Atlantic 25,1–55,5
Nemerteans (2 spp.) N. Wales, UK 17,4–54,9
Polychaetes (several spp.) NY Bight 0,89–82,1
Trough ShellSpisula subtruncata Belgian Coast 0,5–8,0 MusselsMytilusspp. French Coasts <0,10–21,4 OystersCrassostrea gigas French Coasts <0,10–8,9
OystersC. gigas Hawaii 0,10–1,76
Bivalves (3 spp.) NY Bight 5,07–10,6
Bivalves (4 spp.) Philippines 0,64–2,24
Scallops Antarctica 1,0–2,6
Shrimp (several spp.) Kuwait 0,03–7,23
Swimming CrabsLiocarcinus holsatus Belgian Coast 0,34–4,4
Benthic Crustaceans NY Bight 0,05–17,5
Barnacles (3 spp.) Hong Kong 1,7–39,2
EchinoidParacentrotus lividus Naples, Italy 0,28–14 Sharks (several spp.) Great Britain <0,1–9,4
Sharks (4 spp.) E. Australia <0,04–0,15
Teleost Fish (12 spp.) E. Australia 0,03–0,30 Teleost Fish (26 spp.) W. Mediterranean 0,05–55,9
Deep-Sea Fish (6 spp.) N. Atlantic 0,015–12,0
TunaThunnus thynnus NW Atlantic <0,03
Sumber: Neff (2002)
Menurut Neff (2002) pemaparan Pb dengan konsentrasi 476-758 μg/L pada
Mytilus edulis, Crasostrea gigasdanCancer magistermenyebabkan pertumbuhan larva menjadi abnormal, sedangkan konsentrasi akut dan kronik pada Mysidopsis bahia
Paasivirta (2000) memperlihatkan bahwa sebanyak 10-24% timbal (lead) yang ditemukan pada daging ikan dalam bentuktetrametyl lead(TML). Efek toksik timbal pada burung dan mamalia disebabkan logam ini memiliki kemampuan untuk berikatan dengan sel dan biomolekul seperti enzim dan hormon.
Soetrisno (2008) menyatakan timbal menjadi beracun dengan menggantikan kation-kation logam yang aktif biologis, seperti kalsium dan seng (zink), dari protein-proteinnya. Calmodulin misalnya, mengikat dan mengangkut empat kation kalsium. Jika kation-kation timbal menggantikan keempat kation kalsium tersebut, efisiensi enzim ini akan berkurang. Timbal menghambat total aktivitas enzim biosintetikheme, yakni asam delta-aminolevulinat dehidratase (delta-ALAD), ketika logam ini menggantikan kation seng tunggalnya, sehingga mengganggu pembentukan darah dan menghasilkan anemia parah. Darmono (1995) menambahkan timbal dapat menghambat aktifitas enzim yang terlibat dalam pembentukan hemoglobin yang dapat menyebabkan penyakit anemia. Gejala yang diakibatkan dari keracunan logam timbal adalah kurangnya nafsu makan, kejang, lesu dan lemah, muntah serta pusing-pusing. Timbal dapat juga menyerang susunan saraf, saluran pencernaan serta dapat mengakibatkan terjadinya depresi.
2.5. Logam berat pada sedimen laut
Berdasarkan penyebarannya sedimen laut dapat dibagi menjadi dua kelompok (Supangat dan Muawanah NA; Sanusi 2006). Kelompok pertama, sedimen yang tersebar sampai batas paparan benua (continental shelf margin) yang disebut sedimen laut dangkal (near shore sediment) dan sedimen laut dalam (deep sea sediment) yang tersebar di bawah paparan benua. Sedimen laut dangkal khususnya di perairan pesisir dan estuari diketahui merupakan ”storage system” berbagai unsur dan senyawa kimia (Supangat dan Muawanah; Sanusi 2006).
Logam berat yang masuk ke dalam lingkungan perairan akan mengalami pengendapan, pengenceran dan dispersi, kemudian diserap oleh organisme yang hidup di perairan tersebut. Pengendapan logam berat di suatu perairan terjadi karena adanya anion karbonat hidroksil dan klorida (Hutagalung 1984). Hutagalung (1991) menyatakan logam berat memiliki sifat mudah mengikat bahan organik dan setelah mengalami proses fisik-kimia akan mengendap di dasar perairan dan bersatu dengan sedimen, hal ini sejalan dengan penelitian Harahap (1991) dan Rochyatun, Kaisupy dan Rozak (2006) (Tabel 9) yang menyatakan kadar logam berat dalam sedimen lebih tinggi dibandingkan di air. Konsentrasi logam berat pada sedimen tergantung pada beberapa faktor yang berinteraksi. Faktor-faktor tersebut adalah :
1. Sumber dari mineral sedimen antara sumber alami atau hasil aktivitas manusia. Melalui partikel pada lapisan permukaan atau lapisan dasar sedimen.
2. Melalui partikel yang terbawa sampai ke lapisan dasar.
3. Melalui penyerapan dari logam berat terlarut dari air yang bersentuhan.
Tabel 9. Hasil analisis kisaran kadar logam berat (ppm) dalam air laut dan sedimen di perairan muara Sungai Cisadane Bulan Juli dan Nopember 2005
No Parameter Air Laut Sedimen
Juli Nopember Juli Nopember
I Pb <0,001-0,005 <0,001-0,003 9,42-34,40 10,32-37,50
2 Cd <0,001-0,001 <0,001-0,001 0,02-0,03 0,04-0,150
3 Cu <0,001-0,001 <0,001-0,004 8,15-34,59 5,08-34,30
4 Zn <0,001 <0,001-0,003 33,96-115,40 43,88-172,78
5 Ni <0,001-0,003 0,001-0,003 4,44-8,46 3,80-8,60
Sumber: Rochyatun, Kaisupy dan Rozak (2006)
Selanjutnya dikatakan bahwa deposisi padatan tersuspensi dalam perairan selain mengakibatkan mengendapnya material organik dalam sedimen juga akan menyebabkan akumulasi logam berat tersebut dalam sedimen. Semakin tinggi polutan organik dan anorganik dalam kolom air, makin tinggi pula akumulasi polutan tersebut dalam sedimen. Penjelasan tersebut, memperlihatkan bahwa kualitas fisik kimia sedimen suatu perairan dapat dijadikan indikator baik buruknya kualitas suatu perairan. Menurut Hutagalung (1984) pengendapan logam berat dalam suatu perairan terjadi karena adanya anion karbonat hidroksil dan klorida. Menurut Hutagalung (1991) besarnya konsentrasi logam berat pada sedimen tergantung pada beberapa faktor yang berinteraksi yakni:
1. Sumber dari mineral sedimen baik sumber alami maupun sumber yang berasal dari aktivitas manusia
2. Melalui partikel pada lapisan permukaan atau lapisan dasar sedimen 3. Melalui partikel yang terbawa sampai ke lapisan dasar
4. Melalui penyerapan dari logam berat terlarut dari air yang bersentuhan
Tabel 10. Kadar alamiah logam berat dalam sedimen
Parameter Kadar alamiah (ppm) RNO1 EPA2
Hg 0,002-0.35 0,2
Cd 0,1-2 1
Pb 10-70 5
Sumber:1RNO 1981 dalam Razak 1986;2Environmental Protection Agency, 1990 dalam Novotny dan Olem 1994.
Tabel 11. Baku mutu logam berat dalam sedimen
Parameter
Sumber: IADC (International Association of Drilling Contractors) / CEDA (Central Dredging Association) (1997)
Keterangan :
a. Level target. Jika konsentrasi kontaminan yang ada pada sedimen memiliki nilai yang lebih kecil dari nilai level target, maka substansi yang ada pada sedimen tidak terlalu berbahaya bagi lingkungan.