PENGARUH PENAMBAHAN SERUM DAN ATAU DNase
DALAM MEDIUM DISOSIASI TERHADAP JUMLAH DAN
VIABILITAS SPERMATOGONIA IKAN GURAME
(
Osphronemus gouramy
Lac
.
)
NURIDA DESSALMA SYAHRANIA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRAK
NURIDA DESSALMA SYAHRANIA. Pengaruh Penambahan Serum dan atau DNase dalam Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia Ikan gurame (Osphronemous gouramy Lac.) Dibimbing oleh ITA DJUWITA dan
IRMA ANDRIANI
Disosiasi adalah langkah awal yang diperlukan untuk mendapatkan jumlah spermatogonia yang cukup sebagai sel donor untuk transplantasi. Teknik disosiasi dilakukan dengan metode mekanik dan enzimatik untuk mempercepat pemisahan sel dan jaringan. Penelitian ini bertujuan untuk mengetahui pengaruh penambahan serum dan atau DNase pada medium disosiasi terhadap jumlah dan viabilitas spermatogonia. Testes diambil dari ikan gurame yang berukuran 500 sampai 800 gram/ekor dengan bobot gonad 20 mg. Disosiasi dilakukan menggunakan empat medium yang berbeda yaitu menggunakan PBS yang mengandung: (1) tripsin 0.5% (2) tripsin 0.5% + serum 5%, (3) tripsin 0.5% + DNase 10 IU/µL, dan (4) tripsin 0.5% + serum 5% + DNase 10 IU/µL, dengan volume total 500 µ l. Jumlah spermatogonia dihitung setiap jam selama lima jam disosiasi dengan menggunakan hemositometer, dan viabilitas sel diidentifikasi menggunakan pewarna Trypan Blue (TB). Data kuantitatif yang diperoleh dianalisis menggunakan metode analisis General Linier Model (GLM) dan uji lanjut Duncan’s jika terdapat perbedaan nyata. Penambahan serum dalam medium disosiasi tidak menunjukkan pengaruh yang nyata terhadap jumlah rata-rata spermatogonia, namun meningkatkan secara nyata persentase viabilitas spermatogonia. Penambahan DNase maupun kombinasi serum dan DNase mampu menghasilkan rata-rata jumlah spermatogonia dan persentase viabilitas spermatogonia paling tinggi selama disosiasi, dengan jumlah spermatogonia hidup yang meningkat secara nyata setelah disosiasi selama tiga jam untuk penambahan DNase dan dua jam untuk kombinasi serum dan DNase.
ABSTRACT
NURIDA DESSALMA SYAHRANIA. The Influence of Serum and or DNase in Dissociation Medium on the Number and Viability of Giant Gouramy (Osphronemus gouramy Lac.) Spermatogonia. Under direction of ITA
DJUWITA and IRMA ANDRIANI
ABSTRACT
Dissociation is the first step to obtain a sufficient number of spermatogonia as donor cells for transplantation. Dissociation techniques is perfomed by mechanical and enzymatic methods to accelerate the separation of cells and tissue. This study was aimed to determine the effect of serum and or DNase in the dissociation medium on the number and viability of spermatogonia. Testes were taken from giant gouramy (500-800 gram body of weight) with gonad weight 20 mg. Dissociation was performed using four different media that were PBS containing: (1) 0.5% trypsin, (2) 0.5% trypsin+5% serum, (3) 0.5% trypsin+10 IU/µL DNase, and (4) 0.5% trypsin+5% serum+10 IU/µL DNase, with total volume of 500 µL. The number of spermatogonia was calculated every hour during five hours dissociation using hemocytometer, and the percentage of viability were calculated based on Trypan Blue stainning method. Quantitive datas were analyzed using General Linier Model analysis (GLM) and continued by Duncan’s test if there was a significant difference. The addition of serum in the dissociation medium did not significantly affect on the number of spermatogonia, but significantly increased the viability percentage of spermatogonia. The addition of DNase or combination of serum and DNase could produce the highest number and percentage viability of spermatogonia, the number of viable spermatogonia significantly increased after three hours of DNase addition and two hours for the combination of serum and DNase.
RINGKASAN
NURIDA DESSALMA SYAHRANIA. Pengaruh Penambahan Serum dan atau DNase dalam Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia Ikan gurame (Osphronemous gouramy Lac.) Dibimbing oleh ITA DJUWITA dan
IRMA ANDRIANI.
Ikan gurame (Osphronemus gouramy Lac) merupakan salah satu jenis ikan air tawar yang banyak dipilih para petani untuk dipelihara dan dijual karena bernilai ekonomis tinggi. Ikan ini sangat peka terhadap suhu rendah dan memiliki organ pernapasan tambahan sehingga dapat mengambil oksigen dari luar air. Ikan gurame mempunyai kekurangan, pertumbuhannya tidak secepat ikan air tawar lainnya, seperti ikan mas dan ikan lele sehingga membutuhkan waktu dua sampai tiga tahun untuk matang gonad.
Diperlukan teknologi yang bisa mempercepat pematangan gonad pada ikan gurame. Salah satunya melalui pendekatan teknologi rekayasa gamet dengan teknologi transplantasi sel germinal. Teknologi transplantasi sel germinal jantan mampu memberikan peluang besar bagi peningkatan produksi gamet terutama bagi hewan-hewan yang mengalami masalah dalam reproduksinya.
Penggunaan sel germinal jantan (spermatogonia) didasari oleh beberapa faktor di antaranya, jumlah sel germinal spermatogonia lebih banyak dan ditemukan pada setiap fase perkembangan testes. Langkah awal dari pengembangan teknologi transplantasi dan penentu keberhasilan transplantasi sel germinal adalah ketersediaan spermatogonia tunggal. Teknik untuk mendapatkan jumlah spermatogonia tunggal dalam jumlah layak sebagai sel donor untuk transplantasi adalah disosiasi.
Teknik disosiasi dilakukan secara mekanik dan enzimatik untuk mempercepat pemisahan sel dari jaringan. Disosiasi mekanik dilakukan dengan mencacah jaringan sehalus mungkin, namun meminimalkan kerusakan. Teknik selanjutnya secara enzimatik dengan menggunakan enzim-enzim seperti tripsin, kolagenase, dan DNase.
Kombinasi selain menggunakan tripsin dan DNase, ke dalam medium disosiasi dapat ditambahkan serum guna memberikan zat nutrisi yang dibutuhkan oleh sel selama proses disosiasi berlangsung. Penelitian ini bertujuan untuk mengetahui pengaruh penambahan serum dan atau DNase dalam medium disosiasi terhadap jumlah dan viabilitas spermatogonia.
Medium disosiasi yang digunakan mencakup empat jenis medium yakni, Phosphate Buffered Saline (PBS) yang mengandung: (1) tripsin 0.5% (2) tripsin 0.5% + serum 5%, (3) tripsin 0.5% + DNase 10 IU/µL, dan (4) tripsin 0.5% + serum 5% + DNase 10 IU/µL, dengan total volume 500 µL.
Parameter yang diamati mencakup jumlah dan viabilitas spermatogonia. Viabilitas spermatogonia diidentifikasi menggunakan pewarna Trypan Blue (TB) 0.4%. Data kuantitatif yang diperoleh dianalisis dengan GLM dan uji lanjut Duncan jika terdapat perbedaan nyata (P<0.05).
meningkatkan persentase viabilitas spermatogonia, sedangkan penambahan DNase maupun kombinasi serum dan DNase mampu menghasilkan rata-rata jumlah spermatogonia dan persentase viabilitas spermatogonia yang lebih tinggi selama disosiasi, dengan jumlah spermatogonia hidup yang meningkat secara nyata seiiring lamanya disosiasi selama tiga jam untuk penambahan DNase dan dua jam untuk kombinasi serum dan DNase. Oleh karena itu, waktu optimum disosiasi untuk medium yang dikombinasikan dengan serum dan DNase selama dua jam, sedangkan pada medium yang hanya ditambahkan dengan DNase selama tiga jam.
Enzim proteolitik seperti tripsin mampu memisahkan ikatan-ikatan dan menghasilkan suspensi sel tunggal dan membantu pemisahan sel dari jaringan. Penambahan DNase mampu mencegah terjadinya penggumpalan kembali sel-sel dan mampu mengurangi viskositas suspensi sel. Adanya pengaruh interaksi jumlah dan viabilitas spermatogonia antara medium dan waktu inkubasi pada pengujian faktorial, menunjukkan bahwa kedua faktor tersebut saling mempengaruhi terhadap jumlah dan viabilitas spermatogonia.
PENGARUH PENAMBAHAN SERUM DAN atau DNase
DALAM MEDIUM DISOSIASI TERHADAP JUMLAH DAN
VIABILITAS SPERMATOGONIA IKAN GURAME
(
Osphronemus gouramy
Lac
.
)
NURIDA DESSALMA SYAHRANIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Saya menyatakan bahwa skripsi dengan judul Pengaruh Penambahan Serum dan atau DNase dalam Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia Ikan gurame (Osphronemous gouramy Lac.) adalah karya saya sendiri dengan arahan pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Judul Skripsi : Pengaruh Penambahan Serum dan atau DNase dalam Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia Ikan Gurame (Osphronemus gouramy Lac.)
Nama : Nurida Dessalma Syahrania
NIM : B04070029
Disetujui,
Dr. Drh. Hj. Ita Djuwita, M.Phil Irma Andriani, S.Pi, M.Si Dosen Pembimbing 1 Dosen Pembimbing 2
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi yang berjudul Pengaruh Penambahan Serum dan atau DNase dalam Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia Ikan Gurame (Osphronemus gouramy Lac.); disusun berdasarkan hasil penelitian pada bulan Januari 2010 sampai dengan Februari 2011, dan merupakan salah satu syarat untuk memperoleh gelar sarjana kedokteran hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Pada kesempatan ini tidak lupa penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Drh. Hj. Ita Djuwita, M. Phil dan dan Irma Andriani S.Pi, M.Si, masing-masing selaku dosen pembimbing pertama dan kedua yang telah memberikan banyak arahan, saran serta bimbingan selama menyelesaikan penelitian sampai penyusunan skripsi ini.
2. Drh. Isdoni M. Biomed. selaku dosen pembimbing akademik yang telah memberikan nasihat, motivasi, dan bimbingan moral selama penulis menempuh pendidikan sarjana di Fakultas Kedokteran Hewan Institut Pertanian Bogor.
3. Prof. Dr. Drh. Retno D. Soedjoedono, MS. Dan Dr. Drh. M. Agus Setiadi sebagai dosen penguji luar yang telah memberikan masukan dan saran. 4. Kelurga besar Laboratorium Embriologi, Mas Wahyu, Bu Eka,
rekan-rekan satu Laboratorium Embriologi Moy, Nyit-nyit, Ani, yayan, Mbak.yeni, Devi, Rani, Vivit, Rini, dan Adhil yang telah banyak membantu selama penelitian berlangsung.
6. Danang Dwi Cahyadi, a.k.a Nduet atas doa, kasih sayang, dukungan, dan motivasinya selama penyelesaian skripsi ini yang selalu meluangkan waktunya dan mengajarkan banyak hal kepada penulis.
7. Keluarga besar Kediri dan Pekalongan yang senantiasa memberikan dukungan moril kepada penulis.
8. Sahabat-sahabat terbaik Mimin, Anik, Ninuk, Ari, Nanda, Arni, Tami, Inez, Fahri, Agung, Bagus, atas semangat dan dukungannya.
9. PT. Lion Superindo, atas kerjasama dan bantuannya dalam penyediaan ikan gurame serta Mas Doni, Ilham, Agus, Alfian, atas bantuannya selama penelitian ini berlangsung.
10.Keluarga besar Ikatan Mahasiswa Kedokteran Hewan, VISI IPB dan Himpunan Minat Profesi Satwaliar.
11.Karya Salemba Empat, PPA, dan BBM yang telah memberikan beasiswa kepada penulis selama menyelesaikan pendidikan sarjana.
12.Rekan-Rekan Gianuzzi 44 atas kekompakan, kebersamaan, dukungan serta persahabatan dalam menggapai cita-cita di Fakultas Kedokteran Hewan IPB dan untuk semua pihak yang turut membantu kelancaran penelitian ini yang tidak bisa disebutkan satu-persatu.
Penulis menyadari skripsi ini masih jauh dari sempurna, dikarenakan keterbatasan pengetahuan penulis. Namun demikian, penulis mengharapkan bahwa hasil penelitian ini dapat bermanfaat untuk berbagai pihak.
Bogor, Oktober 2011
RIWAYAT HIDUP
Penulis dilahirkan di Pekalongan, Jawa Tengah pada tanggal 26 Desember 1988. Penulis merupakan putri kedua dari tiga bersaudara dari Bapak Syahroni MC. dan Ibu Dra. Islatifah MN.
Tahun 2001 penulis lulus dari SD Muhammadiyah 03 Pekajangan, kemudian pada tahun 2004 penulis menyelesaikan studi di SMPN 2 Pekalongan. Penulis lulus dari SMAN 1 Pekalongan pada tahun 2007 dan pada tahun yang sama penulis melanjutkan pendidikan sarjana di Institut Pertanian Bogor melalui jalur USMI dan diterima sebagai mahasiswa di Fakultas Kedokteran Hewan setelah satu tahun melalui Tingkat Persiapan Bersama (TPB).
Selama mengikuti perkuliahan penulis aktif dalam organisasi kemahasiswaan. Tahun 2007 penulis tergabung dalam organisasi mahasiswa daerah, Ikatan Mahasiswa Pekalongan (IMAPEKA). Tahun 2009-2010 penulis aktif sebagai anggota dan pengurus kaderisasi IMAKAHI dan pada tahun yang sama penulis ikut bergabung sebagai pengurus divisi pendidikan Himpunan Profesi Satwaliar dan dipercaya sebagai direktur Veterinary Integrity and Skill Improvement (VISI angkatan II) pada Tahun 2009-2010.
Penulis berkesempatan menjadi delegasi FKH IPB dalam ADIC (Aceh Development International Conference) di Bangi Malaysia pada tahun 2011. Selain itu, pada tahun 2008 PKMK yang diajukan penulis dengan judul Pemanfaatan Perca Kain Batik Sebagai Bahan Pembuatan Baju Anjing dan Kucing yang Bernilai Ekonomis, berhasil didanai oleh DIKTI.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
LAMPIRAN ... xvi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 3
TINJAUAN PUSTAKA ... 4
Ikan Gurame ... 4
Perkembangan Gonad Ikan Gurame ... 6
Proses Spermatogenesis ... 8
Medium Disosiasi ... 11
PBS (Phosphat Buffered Saline) ... 11
Serum ... 12
Tripsin ... 12
DNase ... 14
METODE PENELITIAN ... 15
Waktu dan Tempat ... 15
Alat dan Bahan ... 15
Prosedur Kerja ... 15
Disosiasi Gonad Ikan Gurame ... 15
Pengamatan Hasil Disosiasi ... 15
Rancangan Percobaan dan Analisis Data ... 16
HASIL DAN PEMBAHASAN ... 17
Morfologi Sel Testikular pada Medium Disosiasi ... 17
Pengaruh Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia ... 17
SIMPULAN ... 23
Simpulan ... 23
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1 Morfologi ikan gurame ... 4
2 Struktur testes pada ikan teleost …... 9
3 Struktur sel pembangun testes ... 10
4 Skema proses spermatogenesis ... 11
5 Komposisi sel spermatogenik ikan gurame ... 17
6 Pengaruh berbagai medium disosiasi terhadap jumlah spermatogonia .... 19
7 Pengaruh berbagai medium disosiasi terhadap viabilitas spermatogonia ... 20
8 Pengaruh berbagai medium disosiasi terhadap jumlah spermatogonia hidup ... 21
DAFTAR LAMPIRAN
Halaman
1 Tabulasi jumlah spermatogonia ... 29
2 Tabulasi viabilitas spermatogonia ... 30
3 Hasil analisis faktorial penghitungan jumlah spermatogonia …... 32
4 Hasil analisis faktorial penghitungan viabilitas spermatogonia ... 36
PENDAHULUAN
Latar Belakang
Ikan gurame (Osphronemus gouramy Lac.) merupakan salah satu jenis ikan air tawar yang banyak dipilih para petani untuk dipelihara dan dijual karena bernilai ekonomis tinggi. Di berbagai daerah, gurame bahkan menjadi salah satu komoditas unggulan pertanian (Khairuman & Amri 2003). Keunggulan gurame bagi petani antara lain, gurame dapat berbiak secara alami, mudah dipelihara karena bersifat pemakan apa saja, dapat hidup di air tergenang, dan memiliki organ pernapasan tambahan yaitu labirin (Jangkaru 2003).
Ikan gurame mempunyai kekurangan, yaitu pertumbuhannya tidak secepat ikan air tawar lainnya, seperti ikan mas dan ikan lele. Ikan gurame membutuhkan waktu dua sampai tiga tahun untuk matang gonad (Tim Agromedia Pustaka 2007). Oleh karena itu, diperlukan teknologi yang bisa mempercepat pematangan gonad pada ikan gurame, salah satunya melalui pendekatan teknologi transplantasi sel germinal (Takeuchi et al. 2004). Menurut Hiemstra et al. (2005) teknologi transplantasi sel germinal jantan mampu memberikan peluang besar bagi peningkatan produksi gamet terutama bagi hewan-hewan yang mengalami masalah dalam reproduksinya.
Penggunaan sel germinal jantan (spermatogonia) didasari oleh beberapa faktor di antaranya pada spermatogonia terdapat sekolompok sel yang memiliki karakteristik menyerupai PGC (Primordial Germ Cell) atau stem cell dengan tingkat development plasticity yang tinggi yakni spermatogonia dapat berkembang tidak hanya menjadi spermatozoa tetapi juga dapat berkembang menjadi oosit (Okutsu et al. 2006). Selain itu, jumlah spermatogonia lebih banyak, ditemukan pada setiap fase perkembangan testes, dan spermatogonia mampu membelah secara terus menerus (self renewal) sehingga dapat ditemukan sepanjang daur hidup hewan (Lacerda et al. 2010); karenanya dipandang lebih potensial untuk ditransplantasikan ke induk semang (Takeuchi et al. 2004).
Teknik untuk mendapatkan jumlah spermatogonia tunggal dalam jumlah layak sebagai sel donor untuk transplantasi adalah disosiasi (Andriani et al. 2010).
Pemisahan sel germinal dari jaringan padat penting untuk memperbesar viabilitas sel dan mengurangi penggumpalan kembali sel-sel (Freshney 2005). Faktor penting yang ikut berpengaruh dalam keberhasilan disosiasi yaitu, medium disosiasi, tipe/jenis enzim yang digunakan, konsentrasi enzim, suhu, dan waktu disosiasi (CHI Scientific 2007; Worthington 2011). Teknik disosiasi dilakukan dengan metode mekanik dan enzimatik untuk mempercepat pemisahan sel dari jaringan. Disosiasi mekanik dilakukan dengan mencacah jaringan sehalus mungkin, namun meminimalkan kerusakan. Teknik selanjutnya secara enzimatik dengan menggunakan enzim-enzim seperti tripsin, kolagenase, dan DNase (Freshney 2005; Lacerda et al. 2010).
Teknik disosiasi menurut Takeuchi et al. (2002) dapat menggunakan satu jenis enzim yaitu tripsin seperti halnya pada ikan rainbow trout, atau dua enzim yaitu tripsin dan DNase pada ikan nibe croaker dalam Phosphate Buffered Saline (PBS) yang mengandung CaCl2 (Okutsu et al. 2005; Takeuchi et al. 2009).
Tripsin dalam medium disosiasi merupakan protease yang mempunyai kemampuan sebagai enzim pencernaan paling kuat dan mampu menimbulkan efektifitas tinggi jika dikombinasikan dengan enzim lainnya (CHI Scientific 2007). DNase pada beberapa kasus ditambahkan pada beberapa medium disosiasi untuk mencegah terjadinya penggumpalan kembali sel-sel dan merupakan enzim pencernaan yang lemah (Worthingthon 2011). Kombinasi kedua enzim ini diharapkan dapat meningkatkan jumlah dan viabilitas spermatogonia selama disosiasi (Andriani et al. 2010). Menurut Lacerda et al. (2008) sebagai nutrisi dapat ditambahkan Fetal Bovine Serum (FBS).
Tujuan
Manfaat
TINJAUAN PUSTAKA
Ikan Gurame Osphronemus gouramy Lac.
Klasifikasi dan sistematika ikan gurame Osphronemus gouramy Lac. menurut Saanin (1984), adalah sebagai berikut:
Filum : Chordata Kelas : Pisces Ordo : Labirinthici Subordo : Anabantoidei Famili : Anabantidae Genus : Osphronemus
Spesies : Osphronemus gouramy Lac.
Secara morfologi ikan gurame mempunyai bentuk badan agak pipih, panjang, dan tertutup sisik yang berukuran besar, ikan ini terlihat kasar, serta kuat. Punggungnya tinggi dan mempunyai sirip perut dengan jari-jari yang sudah berubah menjadi alat peraba. Dengan bentuk badan tersebut memudahkan gurame untuk berbalik dan berbelok. Bagian kepala gurame muda berbentuk lancip dan akan tumbuh menjadi tumpul bila sudah besar. Pada kepala gurame jantan yang sudah tua terdapat tonjolan seperti cula. Mulutnya kecil dengan bibir bawah menonjol sedikit dibandingkan bibir atas (Jangkaru 2003).
Gambar 1 Ikan gurame Osphronemus gouramy (Anonim 2011c).
menjelang dewasa, yakni pada bagian punggung berwarna kecokelatan dan pada bagian perut berwarna keperakan atau kekuningan. Menurut Sitanggang & Sarwono (2002) badan gurame muda terdapat garis tegak berwarna hitam berjumlah 7 sampai 8 buah dan garis ini akan menghilang saat gurame dewasa. Jari-jari pertama sirip perut merupakan benang panjang yang berfungsi sebagai alat peraba. Ujung sirip punggung dan dubur dapat mencapai pangkal ekor.
Ikan gurame termasuk golongan ikan labyrinthici dan memiliki alat pernapasan tambahan berupa selaput yang menonjol pada tepi atas lapisan insang pertama yang disebut labirin. Pada selaput inilah terdapat pembuluh darah kapiler sehingga memungkinkan gurame dapat hidup di air tenang dan oksigen terlarut yang rendah (Keppler et al. 1989). Karena itulah gurame selalu muncul ke permukaan dan menyembulkan kepalanya ke atas permukaan air (Khairuman & Amri 2003).
Tempat asal gurame yang asli belum diketahui, akan tetapi penyebarannya sebagai ikan budi daya meliputi wilayah yang sangat luas. Di alam gurame mendiami perairan yang tenang dan tergenang seperti rawa-rawa, situ, dan danau. Di sungai yang berarus deras jarang ditemui gurame, ikan ini tersebar ke seluruh kepulauan Indonesia dan negara tetangga sebagai ikan budi daya yang berasal dari Jawa (Sitanggang & Sarwono 2002). Ikan gurame di daerah Jawa dikenal dengan nama gurameh, di Sunda sering disebut gurame, di Sumatera terkenal dengan nama kalu, kala, dan alui. Dalam bahasa inggris ikan gurame sering disebut giant gouramy (Tim Agromedia Pustaka 2007). Perbedaan morfologi gurame jantan dan betina dapat dilihat pada (Tabel 1).
Tabel 1 Perbedaan morfologi gurame jantan dan betina (Saparinto 2008)
Morfologi Jantan Betina
Dahi Menonjol Tidak menonjol
Dasar sirip dada Terang, keputih-putihan Agak kehitaman , gelap
Dagu Kuning Agak coklat
Ekor Apabila diletakkan dalam
tempat datar, ekor naik ke atas
Perkembangan Gonad Ikan Gurame Osphronemus gouramy Lac.
Bagian terpenting dalam alat reproduksi hewan adalah gonad, yaitu kelenjar kelamin yang menghasilkan sel gamet (spermatozoa dan oosit) (Dorland 1998). Menurut Evans & Claiborne (2006) gonad merupakan kumpulan dari sel-sel germinal yang berkembang menjadi telur atau spermatozoa dan sel somatik yang kemudian berubah menjadi penyusun kelenjar endokrin atau sel-sel lain yang berperan penting dalam proses gametogenesis. Gametogenesis merupakan serangkaian proses transformasi sel-sel germinal menjadi sel yang terspesialisasi yaitu sel telur pada betina (oogenesis) dan spermatozoa pada jantan (spermatogenesis) (Balinsky 1970).
Periode gametogenesis umumnya terbagi atas dua fase yaitu fase sebelum
diferensiasi dan setelah diferensiasi. Pada sebagian besar organisme, gonad yang
belum berdiferensiasi terdiri atas dua komponen sel somatik yaitu korteks dan
medulla. Korteks tersusun dan berasal dari dinding peritoneal dan medulla berasal
dari mesonephric blastema. Selama proses diferensiasi gonad menjadi ovari, korteks
akan mengalami perkembangan dan medulla mengalami degenerasi. Sedangkan pada
diferensiasi testikular korteks yang mengalami degenerasi dan medulla yang
berkembang.
Pada ikan tilapia dan umumnya hewan teleost, tidak terdapat dua struktur
komponen gonad pada saat sebelum diferensiasi seperti halnya sebagian besar
organisme vertebrata. Gonad teleost berkembang dari primordial tunggal pada korteks
(dinding peritoneal) (Harvey & Hoar 1979). Selanjutnya sel gonad primordial tersebut akan mengalami pembelahan mitosis (proliferasi) dan bermigrasi di
sepanjang dinding peritoneal.
Perubahan gonad secara sitologi, histologi, maupun morfologi akan terjadi selama proses perkembangan gonad berlangsung. Perubahan tersebut juga turut mempengaruhi bobot dan volume gonad yang dapat dijadikan indikator dalam menentukan sejauh mana perkembangan telah dialami oleh gonad dalam proses oogenesis pada ikan betina dan spermatogenesis pada ikan jantan (De Jong dalam Yusuf 2005).
berpengaruh di antaranya suhu, arus, adanya lawan jenis, dan lainnya. Sedangkan faktor internal antara lain, perbedaan spesies, umur, serta sifat-sifat fisiologi ikan (Lagler et al. 1977). Perkembangan gonad juga dipengaruhi oleh faktor lingkungan yaitu faktor makanan dan faktor suhu termasuk di dalamnya pencahayaan dan musim, periode penyinaran yang rendah serta suhu yang tinggi dapat mempercepat perkembangan gonad (Scott et al. 1984).
Ada dua tahap dalam perkembangan gonad yaitu tahap pertumbuhan gonad ikan hingga mencapai dewasa kelamin (sexually maturation) dan tahap pematangan gamet (gamet maturation). Tahap pertumbuhan gonad berlangsung sejak ikan menetas hingga mencapai dewasa kelamin, sedangkan tahap pematangan berlangsung setelah ikan dewasa. Tahap pematangan akan terus berlangsung dan berkesinambungan selama fungsi reproduksi ikan berjalan dengan normal (Lagler et al. 1977; Harvey & Hoar 1979). Pada hewan vertebrata termasuk ikan, terjadinya kematangan gonad merupakan periode dimana ikan yang muda memiliki kemampuan untuk melakukan reproduksi (Amer et al. 2001). Pertumbuhan ikan gurame akan mengalami perlambatan ketika mulai matang gonad, hal ini disebabkan karena gurame sedikit makan atau jarang makan, dimana aktivitas gurame lebih banyak digunakan untuk membuat sarang dan menjaga anaknya (Jangkaru 2003). Pertumbuhan ikan gurame jantan lebih lambat dibanding dengan ikan gurame betina. Namun, pada pertumbuhan selanjutnya ikan gurame jantan akan terlihat bentuk tubuhnya yang lebih memanjang dan melebar sehingga terlihat bentuk tubuhnya pipih, dan ikan gurame betina tumbuh menebal sehingga terlihat lebih gemuk (Saparinto 2008).
Menurut Jangkaru (2003) salah satu ciri induk gurame jantan yang matang gonad terlihat dari warna tubuhnya yang relatif lebih merah dan hitam terang dengan bagian perut yang membentuk sudut tumpul dan susunan sisik yang normal (tidak membuka) serta gerakan ikan yang terlihat lebih lincah. Badan induk jantan akan terlihat lebih ramping dan agak meruncing pada bagian analnya (Sendjaja 2002).
sebelum terjadinya pemijahan sebagian besar hasil metabolisme tertuju untuk perkembangan gonad. Gonad akan semakin bertambah berat diimbangi dengan bertambah besar ukurannya. Bobot gonad ikan akan mencapai maksimum saat ikan akan memijah, kemudian menurun dengan cepat selama pemijahan berlangsung sampai proses pemijahan selesai (Effendie 1997).
Proses Spermatogenesis
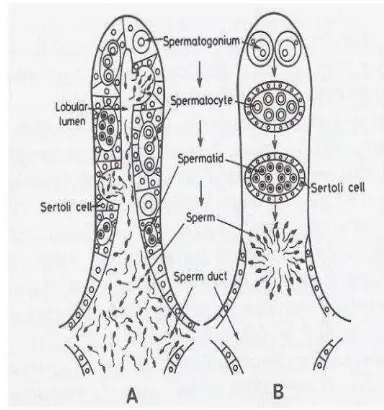
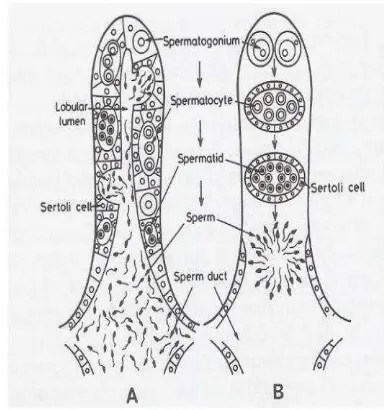
Testis merupakan organ yang memproduksi sperma dan menghasilkan hormon testosteron (Guyton 2007). Pada ikan golongan teleost, terdiri dari sepasang organ yang terletak pada bagian bawah dari gelembung renang di bagian atas dari usus dan ada di belakang ginjal. Testes ikan teleost diklasifikasikan ke dalam jenis-jenis spermatogonia yang terbatas dan tidak terbatas (berdasarkan lokasi tempat dari spermatogonia), atau jenis lobular dan tubular (tabung) berdasarkan ada tidaknya keberadaan lumen. Menurut Takashima dan Hibiya (1995) di dalam klasifikasi, jenis-jenis spermatogonia terbatas dan tidak terbatas disamakan dengan jenis-jenis lobular (ikan teleost, amfibi) dan tubular (reptil, burung, mamalia).
Pada lobuli terdapat tubulus seminiferus yang mengandung sel-sel germinal dan sel sertoli. Pada spesies dengan lobuli berlekuk, baik spermatogonia maupun tubulus seminiferus yang berada pada tahap perkembangan dapat dilihat di sepanjang lobuli dan spermatozoa yang matang akan dikeluarkan saat fase spermiasi ke dalam lumen lobular. Adapun testes dengan lobuli padat, tubulus seminiferus tersusun berdasarkan tahap-tahap perkembangan, berawal dari lobuli yang tertutup dan mengandung spermatogonia, dan berakhir di saluran efferent (Takashima dan Hibiya 1995). Struktur testes dapat dilihat pada Gambar 2.
Gambar 2 Struktur testes (A) tipe lobuli berlekuk dan (B) lobuli padat pada ikan teleost (Basuki 2011).
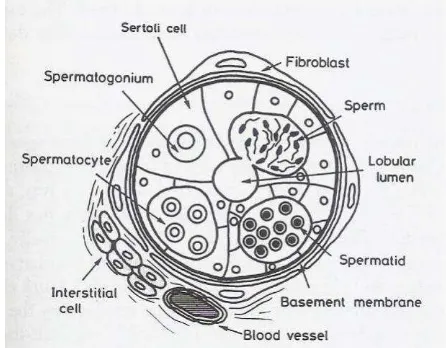
Proses spermatogenesis berlangsung di dalam tubulus seminiferus. Epitel tubulus dibangun oleh spermatogonia, spermatosit, spermatid dan spermatozoa, yang merupakan sel-sel spermatogenik. Spermatogonia berbentuk bulat dan terlihat paling besar di antara sel spermatogenik lainnya. Spermatosit letaknya lebih ke sentral dari spermatogonia dan bentuknya bulat, spermatid letaknya lebih ke sentral dari spermatosit, bentuknya bulat kecil dengan inti bulat di tengah. Adapun spermatozoa letaknya di sentral tubuli, bentuknya lebih jelas karena terdapat kepala dan ekor (Mauluddin 2009; Quintana et al. 2004).
Gambar 3 Struktur sel pembangun testes pada ikan (Basuki 2011).
Menurut Billard (1992) spermatogenesis terbagi dalam dua tahap yaitu spermatositogenesis dan spermiogenesis. Proses ini terjadi di sepanjang tubulus dengan berbagai macam tahap perkembangan. Spermatogenesis terjadi di lobular atau tubular dalam kista yang berisi sel primer spermatogonia. Kista tersebut dibentuk oleh sel somatik sertoli yang menempel pada sel primer spermatogonia. Ketika proses spermatogenesis berkembang, kista akan membesar dan akhirnya melepaskan sperma pada lobuler lumen dan bergerak ke kantung sperma.
Gambar 4 Skema proses spermatogenesis terlihat pada miosis 1 terjadi reduksi kromosom (Anonim 2009).
Medium Disosiasi
Disosiasi merupakan proses pemisahan sel menjadi soliter (Anonim 2010). Pemisahan sel dapat dilakukan dengan teknik mekanik maupun enzimatik. Disosiasi mekanik dilakukan dengan pemotongan atau tanpa pemotongan, mencacah jaringan sehalus mungkin, dengan melakukan penyaringan, penyemprotan juga pemipetan secara lembut namun, meminimalkan kerusakan (Freshney 2005). Teknik selanjutnya secara enzimatik dengan menggunakan enzim-enzim seperti tripsin, kolagen (Freshney 2005), dan DNase (Lacerda et al. 2010). Teknik disosiasi sel bersifat spesies spesifik karena masing-masing spesies mempunyai karakteristik anatomi gonad yang berbeda salah satunya karakteristik jaringan ikatnya (Kim et al. 2006; Marret & Durant 2000).
Phosphate Buffered Saline (PBS)
Phosphate Buffered Saline (PBS) merupakan larutan fisiologis yang umum digunakan sebagai pelarut dalam penelitian biologi. Penggunaan PBS merupakan solusi berbasis air garam yang mengandung natrium klorida, natrium fosfat, dan (dalam beberapa formulasi) klorida kalium dan fosfat kalium. Buffer inilah yang nantinya membantu sel dalam mempertahankan konsistensi pH (Medicago 2010).
glukosa dan garam-garam anorganik, serta kemampuan buffer dari fosfat (Malole 1990). Penggunaan buffer ini dikarenakan bersifat isotonik dan non toksik pada sel-sel serta mempunyai kemampuan dalam mempertahankan osmolaritas. Phosphate Buffered Saline yang mengandung CaCl2 mampu menjaga osmolalitas sel (Freshney 2005).Penggunaan PBS sebagai buffer juga sering digunakan dalam aplikasi kultur sel, prosedur immunohistokimia, prosedur mikrobiologi, dan untuk pengenceran (Medicago 2010).
Serum (Fetal Bovine Serum)
Serum merupakan bagian dari plasma yang tersisa setelah proses pembekuan darah, selama protein plasma yaitu fibrinogen diubah menjadi fibrin. Dalam komposisi serum terkandung zat-zat nutrisi seperti bermacam-macam protein, glukosa, asam lemak, hormon insulin, steroid, mineral, dan faktor pertumbuhan (Malole 1990, Jochem et al. 2011; Freshney 2005). Serum menurut Butler (2004) mampu menekan aktivitas tripsin dan sumber nutrisi yang kaya akan inhibitor tripsin (Anonim 2011a).
Adapun sebagian besar komponen dari serum terdiri atas protein (Freshney 2005). Jumlah serum yang ditambahkan pada medium kultur biasanya berkisar antara 2 sampai 20% (Shuler & Kargi 1992; Castilho 2008), dan menurut Okutsu et al. (2005) disosiasi pada ikan umumnya menggunakan serum dengan konsentrasi 5%.
Beberapa jenis serum yang umum digunakan di antaranya Fetal Calf Serum (FCS), Fetal Bovine Serum (FBS), serum kuda, dan manusia (Freshney 2005). Fetal Bovine Serum dan Fetal Calf Serum merupakan jenis serum yang sering digunakan, disamping mengandung fetuin yaitu suatu glikoprotein utama, FBS mampu mencegah proteolitik dan membantu perlekatan sel serta penyebaran sel pada substrat (Malole 1990). Selain itu, FBS juga memiliki persentase immunoglobulin yang rendah (Castilho 2008).
Tripsin
enzim terjadi di dalam sel dan sebagain besar diekstrasi dari sel tanpa merusak fungsinya. Semua sel menghasilkan sejumlah enzim yang berbeda-beda yang fungsinya ditentukan oleh enzim yang terdapat di dalamnya (Wibowo 2006).
Tripsin merupakan enzim yang dihasilkan oleh pankreas yang berperan dalam hidrolisa protein ke dalam unit peptida yang lebih kecil. (WordNet definition 2011). Sedangkan menurut Girindra (1982), tripsin merupakan bentuk aktif dari tripsinogen. Enzim ini termasuk dalam enzim proteolitik golongan endopeptidase yang berfungsi dalam proses hidrolisis (memutuskan ikatan kovalen sambil mengikat air) (Harrow 1958).
Enzim proteolitik seperti tripsin mampu memisahkan ikatan-ikatan dan menghasilkan suspensi sel tunggal (Anonim 2011b) dan membantu pemisahan jaringan (Worthingthon 2011). Enzim ini mampu menghidrolisis protein menjadi peptida-peptida kecil atau menjadi asam amino dan termasuk enzim protease yang memiliki kekuatan yang lebih besar jika dibandingkan enzim protease lainnya (De et al. 2011) serta mempunyai efektifitas tinggi apabila dikombinasikan dengan enzim lainnya (CHI Scientific 2007).
Salah satu enzim yang dapat menghidrolisis ikatan pada peptida dapat disebut juga sebagai enzim protease, peptidase, atau proteolitik. Tripsin dapat mengkatalis hidrolisis ikatan pada peptida di tengah rantai, bukan di ujung rantai, enzim ini dinamakan pula endopeptidase (Thenawijaya 1988).
Tripsin yang merupakan protein globular terdiri dari tiga rantai polipeptida yang dihubungkan melalui ikatan disulfida. Dengan adanya tripsin, protein akan terhidrolisis pada suhu 37 oC dan pH 8 dengan laju jauh lebih cepat dibandingkan dengan keadaannya tanpa tripsin. Penggunaan tripsin sebagai salah satu kombinasi media disosiasi telah banyak dilakukan dan diterapkan pada transplantasi sel, kultur jaringan, isolasi sel, yang memudahkan proses pemisahan sel atau jaringan.
DNase
Deoxyribonuclease (DNase) merupakan polipepetida glikolisis yang biasa digunakan untuk mendegradasi DNA utas tunggal dan double stranded DNA menjadi 5-phosphonucleotide dan oligonucleotide. Sifat dari DNase dapat dimodifikasi oleh ion divalen. Pemberian kalsium berperan penting dalam mempertahankan struktur dan aktivitas dari DNase.
DNase digunakan untuk melengkapi protease pada jaringan disosiasi (Sigma 2011), kemampuan DNase mencerna bahan yang dilepaskan dari sel-sel mati mampu menurunkan viskositas suspensi sel dan mengurangi terjadinya kerusakan sel (Andriani et al. 2010; Worthington 2011). Enzim ini mampu mencegah terjadinya penggumpalan kembali sel-sel dan merupakan enzim pencernaan yang lemah (Worthingthon 2011).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2010 sampai dengan Februari 2011, bertempat di Laboratorium Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat-alat yang digunakan antara lain gunting bedah, pinset, cawan petri, gelas objek, micropipette, tabung eppendorf, microtube, hemositometer, mikroskop, kamera, timbangan digital, gelas arloji, erlenmayer, gelas ukur, dan gelas piala.
Bahan yang digunakan antara lain gonad dari ikan gurame jantan, NaCl 0.7%, Phosphate Buffered Saline (PBS), tripsin 0.5%, Fetal Bovine Serum (FBS) 5%, DNase 10 IU/µL, CaCl2, dan Trypan Blue (TB) 0.4%.
Metode Penelitian
Disosiasi Gonad Ikan Gurame
Disosiasi dimulai dari pembedahan ikan gurame berjumlah 12 ekor dengan bobot berkisar 500 sampai 800 gram yang diperoleh dari pasar swalayan di Bogor untuk diambil gonadnya. Gonad dibersihkan dari lemak-lemak ikan yang menempel dengan larutan fisiologis kemudian ditimbang bobotnya.
Sampel gonad dengan bobot 20 mg diletakkan dalam cawan petri yang berisi medium disosiasi untuk dicacah kecil-kecil menggunakan gunting dan bantuan pinset selama 5 sampai 7 menit pada suhu ruang. Setelah itu, dilakukan pemipetan secara lembut setiap 30 menit untuk memperoleh hasil yang lebih baik.
Pengamatan terhadap Gonad Ikan Gurame Hasil Disosiasi
dengan diameter spermatogonia ≥ 10 µ m. Sel spermatogenik lainnya seperti spermatosit dan spermatid tidak dihitung. Viabilitas spermatogonia diidentifikasi menggunakan pewarna Trypan Blue (TB), spermatogonia yang mati akan terlihat berwarna biru di bawah mikroskop karena menyerap warna dari Trypan Blue (TB) dan yang hidup akan terlihat transparan.
Rancangan Percobaan dan Analisis Data
Rancangan percobaan dalam penelitian ini menggunakan rancangan acak lengkap (RAL) faktorial. Faktor pertama adalah medium, sedangkan faktor kedua adalah waktu disosiasi. Medium disosiasi yang digunakan terdiri atas empat perlakuan yaitu menggunakan PBS yang ditambahkan: (1) Tripsin 0.5% (2) Tripsin 0.5%+serum 5%, (3) Tripsin 0.5%+DNase 10 IU/µL, dan (4) Tripsin 0.5%+serum 5%+DNase 10 IU/µL, dengan total volume 500 µL. Masing-masing perlakuan dilakukan sebanyak tiga kali ulangan.
HASIL DAN PEMBAHASAN
Morfologi Sel Spermatogenik pada Medium Disosiasi
Hasil pengamatan sel spermatogenik dari berbagai medium disosiasi, terdapat beberapa jenis sel gamet jantan yaitu, spermatogonia, spermatosit, dan spermatid. Komposisi spermatogonia terlihat jelas di bawah mikroskop dengan diameter spermatogonia ≥ 10 µ m. Menurut Andriani et al. (2010) spermatogonia ikan gurame berdiameter ≥ 10 µm, dan berdasarkan penelitian Mauluddin (2009) sebaran diameter sel gamet jantan ikan gurame berkisar 5 sampai 15 µ m untuk spermatogonia, 3 sampai 5 µ m spermatosit, dan 1.5 sampai 2.5 µ m untuk spermatid (Gambar 5).
Gambar 5 Sel spermatogenik yang hidup terlihat berwarna transparan di bawah mikroskop (A), (1) menunjukkan spermatogonia yang hidup, (2) spermatosit, dan (3) spermatid. (B) spermatogonia yang mati terlihat berwarna biru dengan pewarnaan trypan blue (4), Bar: 10 µm.
Pengaruh Medium Disosiasi terhadap Jumlah dan Viabilitas Spermatogonia
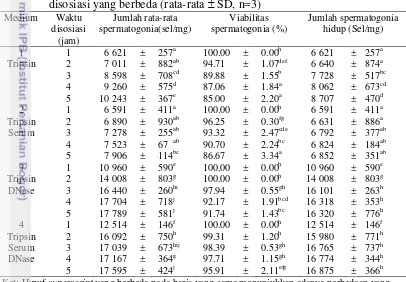
Berdasarkan Tabel 2 pada kelompok medium disosiasi yang ditambahkan tripsin, jumlah rata-rata spermatogonia dan spermatogonia hidup selama disosiasi mengalami peningkatan. Pada lima jam disosiasi jumlah rata-rata spermatogonia 10 243 ± 367 sel/mg dan persentase viabilitas spermatogonia 85.00 ± 2.20% yang berarti jumlah spermatogonia hidup pada lima jam disosiasi 8 707 ± 470 sel/mg. Persentase viabilitas spermatogonia menurun secara nyata (P<0.05) seiring lamanya waktu disosiasi. Hal ini dimungkinkan karena tripsin merupakan enzim pencernaan yang paling kuat (CHI Scientific 2007); dan dalam jangka waktu lama
A
B
4
2 3
mampu merusak membran sel, mendegradasi protein intraseluler sel dan dapat membunuh sel (Sigma 2011).
Penggunaan tripsin yang ditambahkan dalam Phosphate Buffered Saline merupakan medium umum untuk disosiasi sel dan isolasi sel. Tripsin cukup efektif digunakan dalam medium disosiasi karena kemampuannya yang selektif untuk protein ekstraselular. Kombinasi tripsin dan enzim lainnya seperti elastase dan kolagenase juga terbukti efektif untuk disosiasi (Worthington 2011); dengan konsentrasi yang digunakan berkisar antara 0.025% sampai 0.5% untuk disosiasi (Sigma 2011).
Tabel 2 Jumlah dan viabilitas spermatogonia dengan jenis medium dan waktu disosiasi yang berbeda (rata-rata SD, n=3)
Medium Waktu disosiasi (jam) Jumlah rata-rata spermatogonia(sel/mg) Viabilitas spermatogonia (%) Jumlah spermatogonia hidup (Sel/mg)
1 1 6 621 ± 257a 100.00 ± 0.00h 6 621 ± 257a Tripsin 2 7 011 ± 882ab 94.71 ± 1.07def 6 640 ± 874a 3 8 598 ± 708cd 89.88 ± 1.55b 7 728 ± 517bc 4 9 260 ± 575d 87.06 ± 1.84a 8 062 ± 673cd 5 10 243 ± 367e 85.00 ± 2.20a 8 707 ± 470d 2 1 6 591 ± 411a 100.00 ± 0.00h 6 591 ± 411a Tripsin 2 6 890 ± 930ab 96.25 ± 0.30fg 6 631 ± 886a Serum 3 7 278 ± 255ab 93.32 ± 2.47cde 6 792 ± 377ab
4 7 523 ± 67 ab 90.70 ± 2.24bc 6 824 ± 184ab 5 7 906 ± 114bc 86.67 ± 3.34a 6 852 ± 351ab 3 1 10 960 ± 590e 100.00 ± 0.00h 10 960 ± 590e Tripsin 2 14 008 ± 803g 100.00 ± 0.00h 14 008 ± 803g DNase 3 16 440 ± 260hi 97.94 ± 0.55gh 16 101 ± 263h 4 17 704 ± 718j 92.17 ± 1.91bcd 16 318 ± 353h 5 17 789 ± 581j 91.74 ± 1.43bc 16 320 ± 776h 4 1 12 514 ± 146f 100.00 ± 0.00h 12 514 ± 146f Tripsin 2 16 092 ± 750h 99.31 ± 1.20h 15 980 ± 771h Serum 3 17 039 ± 673hij 98.39 ± 0.53gh 16 765 ± 737h DNase 4 17 167 ± 364ij 97.71 ± 1.15gh 16 774 ± 344h 5 17 595 ± 424j 95.91 ± 2.11efg 16 875 ± 366h Ket: Huruf superscript yang berbeda pada baris yang sama menunjukkan adanya perbedaan yang nyata (P<0.05).
[image:34.595.110.516.309.591.2]dapat meningkatkan persentase viabilitas spermatogonia secara nyata (P<0.05) sampai lima jam disosiasi (Tabel 2), dengan jumlah spermatogonia hidup tertinggi pada lima jam disosiasi 6 852 ± 351 sel/mg (Gambar 6).
Gambar 6 Pengaruh berbagai medium disosiasi terhadap jumlah spermatogonia, tripsin, tripsin, serum, tripsin, DNase, tripsin, serum, DNAse.
Penambahan serum ke dalam medium disosiasi selain menyediakan nutrisi (Butler 2004), juga mampu melindungi spermatogonia dari efek toksisitas senyawa-senyawa tertentu pada medium disosiasi yang digunakan. Selain itu, serum mengandung vitamin (Valk et al. 2004), asam amino, glukosa, nukleosida, mineral, hormon, dan mengandung lipid dalam jumlah kecil (Freshney 2005; Jochem et al. 2011). Jumlah serum yang ditambahkan pada medium kultur biasanya berkisar antara 2 sampai 20% (Butler 2004; Castilho 2008). Sedangkan pada ikan biasanya menggunakan serum dengan konsentrasi 5% untuk disosiasi sel (Okutsu et al. 2005).
serum tetapi umumnya untuk menghentikan aktivitas tripsin digunakan soybean trypsin inhibitor (Worthington 2011).
Gambar 7 Pengaruh berbagai medium disosiasi terhadap viabilitas spermatogonia, tripsin, tripsin, serum,
tripsin, DNase, tripsin, serum, DNAse.
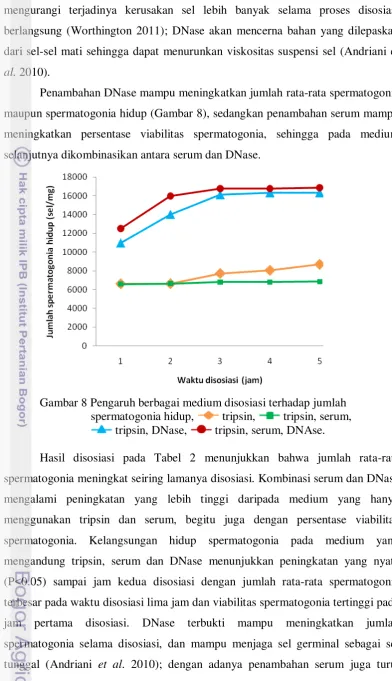
Baik jumlah rata-rata spermatogonia maupun spermatogonia hidup pada medium tripsin dan DNase meningkat secara nyata seiring lamanya waktu disosiasi (P<0.05) dengan jumlah rata-rata spermatogonia pada lima jam disosiasi 17 789 ± 581 sel/mg, namun persentase viabilitas spermatogonia menurun tidak nyata sampai jam ketiga disosiasi (P>0.05) dan sel hidup tertinggi pada lima jam disosiasi 16 320 ± 776 sel/mg (Tabel 2). Medium disosiasi yang ditambahkan DNase, mampu mencegah terjadinya kerusakan sel yang lebih besar (Worthington 2011) dan mencegah terjadinya penggumpalan kembali sel-sel yang telah didisosiasi (Sigma 2009; Roche 2011), sehingga jumlah spermatogonia hidup pada medium tripsin dan DNase lebih tinggi dibandingkan dengan medium tanpa penambahan DNase (Gambar 8).
mengurangi terjadinya kerusakan sel lebih banyak selama proses disosiasi berlangsung (Worthington 2011); DNase akan mencerna bahan yang dilepaskan dari sel-sel mati sehingga dapat menurunkan viskositas suspensi sel (Andriani et al. 2010).
[image:37.595.110.503.82.764.2]Penambahan DNase mampu meningkatkan jumlah rata-rata spermatogonia maupun spermatogonia hidup (Gambar 8), sedangkan penambahan serum mampu meningkatkan persentase viabilitas spermatogonia, sehingga pada medium selanjutnya dikombinasikan antara serum dan DNase.
Gambar 8 Pengaruh berbagai medium disosiasi terhadap jumlah spermatogonia hidup, tripsin, tripsin, serum, tripsin, DNase, tripsin, serum, DNAse.
mempertahankan sel dalam kondisi yang lebih baik. Komposisi medium tripsin, serum, dan DNase merupakan modifikasi dari berbagai medium disosiasi yang pernah digunakan pada ikan nila (Lacerda et al. 2008), nibe croaker (Takeuchi et al. 2009; Yazawa et al. 2010), dan ikan gurame (Andriani et al. 2010).
Kombinasi antara DNase dan serum dapat menghasilkan jumlah spermatogonia hidup dan persentase viabilitas spermatogonia yang lebih tinggi dibandingkan hanya dengan penambahan tripsin dan DNase, namun kelangsungan spermatogonia hidup pada medium tripsin, serum, dan DNase tidak menunjukkan peningkatan yang nyata sampai lima jam disosiasi (P>0.05).
Waktu optimum disosiasi pada medium tripsin, serum, dan DNase pada jam kedua disosiasi sedangkan pada medium yang hanya dikombinasikan tripsin dan DNase memberikan waktu disosiasi yang lebih lama yakni tiga jam, dengan jumlah rata-rata spermatogonia lebih tinggi pada lima jam disosiasi. Ikan teleost pada umumnya memperlihatkan waktu optimum disosiasi selama dua jam (Okutsu et al. 2008).
Teknik disosiasi yang dilakukan dengan metode enzimatik dan mekanik, turut berkontribusi dalam disosiasi spermatogonia. Secara enzimatik, komponen bahan disosiasi dengan penambahan tripsin dan DNase dapat menghasilkan jumlah spermatogonia yang lebih tinggi. Adapun proses mekanik juga menentukan keberhasilan proses disosiasi dalam menghasilkan jumlah dan viabilitas spermatogonia yang lebih tinggi. Oleh karena itu, pemipetan, pemotongan maupun pencacahan jaringan atau organ turut memainkan peranan penting dalam teknik disosiasi sel (Andriani et al. 2010).
SIMPULAN
Simpulan
DAFTAR PUSTAKA
Amer MA, Miura T, Miura C, Yamauchi K. 2001. Involvement of sex steroid hormones in the early stage of spermatogenesis in Japanese Huchen (Hucho perryi). Biol Reprod 65:1057-1066.
Andriani I, Djuwita I, Sumantadinata K, Zairin A, Arfah H, Alimuddin. 2010. Morphological characteristic of spermatogonia and testes dissociation: a preliminary study for the germ cell transplantation in giant gouramy (Oshpronemous gouramy). J Aquac Ind 5(2):163-172.
[Anonim]. 2009. Teori reproduksi sel. [terhubung berkala]. http://biologigonz. blogspot.com/2009/11/ teori-reproduksi-sel.html. [15 Maret 2011].
[Anonim]. 2010. Dissociation of cells from primary tissue. [terhubung berkala]. www.invitrogen.com. [28 Desember 2010].
[Anonim]. 2011a. Tripsinizing cells. [terhubung berkala]. Pingu.salk.edu. [27 Juli 2011]. [Anonim]. 2011b. Cell dissociation products. [terhubung berkala]. www.lifetechindia.
com. [28 Juli 2011].
[Anonim]. 2011c. Bibit gurame. [terhubung berkala]. http://w26.indonetwork. co.id/pdimage/95/2346995_1599372_gurameh.jpeg. [5 Agustus 2011].
Balinsky BI. 1970. An Introduction to Embryology. Philadelphia: W.B. Saunders. Basuki F. 2011. Pengenalan alat kelamin jantan dan betina pada ikan teleostei.
[terhubung berkala]. http://eprints.undip.ac.id/19061/1/KuliahTPI_ke_01.pdf. [13 Agustus 2011].
Billard R. 1992. Reproduction in rainbow trout: sex differentiation, dynamics of gametogenesis, biology and preservation of gametes. Aquaculture 100:35-42. Butler M. 2004. Animal Cell Culture and Technology. Cornwall UK: Bios Scientific
Publisher.
Castilho L. 2008. Animal Cell Technology: From Biopharmaceuticals to Gene Therapy. New York: Taylor & Francis.
CHI Scientific. 2007. Handbook Primary Cell Culture: A Practical Manual to the Labtoratory Standard. Maynard: CHI Scientific, Inc.
De D, Chakraborty PD, Bhattacharyya D. 2011. Regulation of trypsin activity by peptide fraction of an aqueous extract of human placenta used as wound healer. J Cell Physiol 226(8):2033-20140.
Dellman HD, Brown EM. 1992. Histologi Veteriner. Ed ke-3. Hartono R, penerjemah; Jakarta: UI Pr. Terjemahan dari: Text Book of Veterinary Histology.
Dorland. 1998. Kamus Saku Kedokteran. Jakarta: EGC.
Effendie MI. 1979. Metode Biologi Reproduksi. Bogor: Yayasan Dewi Sri. Effendie MI. 1997. Biologi Perikanan. Yogyakarta: Yayasan Pustaka Nusatama. Evans DH, Claiborne JB. 2006. The Physiology of Fishes. Ed ke-3. New York: Taylor
Freshney RI. 2005. Culture of Animal Cells: A manual of Basic Technique. Ed ke-5. New York: J Wiley.
Gaspersz V. 1991. Metode Perancangan Percobaan. Bandung: IKAPI. Girindra A. 1982. Biokimia I. Jakarta: Gramedia Pustaka Utama.
Gueroult M, Picot D, Ghanem J, Hartmann B, Baaden M. 2010. How cations can assist DNase I in DNA binding and hydrolysis. PLoS Comput Biol 6(11): e1001000. Guyton AC, Hall JE. 2007. Buku Ajar Fisiologi Kedokteran. Irawati, penerjemah;
Jakarta: EGC. Terjemahan dari: Textbook of Medical Physiology. Ed ke-11. Harrow B, Masuze A. 1958. Textbook of Biochemistry. Ed ke-7. Philadelpia: WB
Saunders.
Harvey, Hoar W . 1979. The Theory and Practice of induced Breeding Fish. Ottawa: ICDR.
Hiemstra SJ, Van der Lende T, Woelders H. 2005. The potential of cryopreservation and reproductive technologies for animal genetic resources conservation strategies. International Symphosiums: The Role of Biotechnologies, Italy.
Jangkaru Z. 2003. Memacu Pertumbuhan Gurame. Jakarta: Penebar Swadaya.
Jochems C, Valk J, Stafleu F, Baumans. 2011. The use of fetal bovine serum: ethical or scientific problem. ATLA 30:219-227.
Keppler R, Geisler, Patanakamjorn S, Narksook PE, Pooltanakit S, Tangam V, Bittner A. 1989. Approaches to the productive breeding of the south east Asian labyrinth fish (Osphronemous gouramy). Part 1: Mating, Nest Building, Productivity. Animal Research and Development. Institut for Scientific Co-orporation Hubingen 31:8-12.
Khairuman, Amri K. 2003. Pembenihan dan Pembesaran Gurami Secara Intensif. Jakarta: AgroMedia Pustaka.
Kim Y, Selvaraj V, Dobrinski I, Lee H, Mcente MC, Travis AJ. 2006. Recipient preparation and mixed germ cell isolation for spermatogonial stem cell transplantation in domestic cats. J Andrology 27:2.
Lacerda SMSN, Batlouni SR, Assis LH, Resende FM, Silva SM, Camposs-Silva R, Segatelli TM, Franc LR. 2008. Germ Cell transplantation in tilapia (Oreochromis niloticus). Cybium 32(2):115-118.
Lacerda SMSN, Batlouni SR, Costa GMJ, Segatelli TM, Quirino BR, Queiroz BM, Kalapothakis E, Franc LR. 2010. A new and fast technique to generate offspring after germ cells transplantation in adult fish: the nile tilapia (Oreochromis niloticus). Plos One 5:10740.
Lagler KF, Bardach JE, Miller RH, Passino DRM. 1977. Ichtyology. Toronto, Canada: J Wiley.
Marret C, Durrand P. 2000. Culture of porcine spermatogonia: effect of purification of the germ cells, extracellular matrix, and fetal calf serum on their survival and multiplication. Reprod Nutr Dev 40:305-319.
Mather JP, Roberts PE. 1998. Introduction to Cell Culture Theory and Technique. New York: Plenum Pr.
Mauluddin. 2009. Studi mengenai morfologi dan komposisi sel testikular ikan gurame Osphronemus gouramy Lac. [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Medicago. 2010. Phosphate bufered saline specification. [terhubung berkala]. http://www.medicago.se/sites/default/files/pdf/productsheets/PBS_Buffer_v._01.p df [5 Maret 2011].
Noel JS, Zucker RM, Wu NC, Demaray SY. 1977. The dissociation of transplantable tumors. J Histochem and Cytochem 25(7):544-553.
Ogawa T, Arechaga JM, Avarbock MR, Brinster RL. 1997. Transplantation of testis germinal cells into mouse seminiferus tubules. Int J Dev Biol 41:111-112.
Okutsu T, Suzuki K, Takeuchi Y, Takeuchi T, Yoshizaki G. 2005. Testicular germ cells can colonize sexually undifferentiated embryonic gonad and produce functional eggs in fish. Proc Natl Acad Sci 103(8):2725-2729.
Okutsu T, Takeuchi Y, Yoshizaki G. 2006. Manipulation of fish germ cell: visualization, cryopreservation and transplantation. J Reprod Dev 52(6):685-693. Okutsu T, Takeuchi Y, Yoshizaki G. 2008. Spermatogonial transplation in fish:
production or trout offspring from salmon parents. Fishier for Global Welfare and Environment. 5th Worls Fishier Congress 2008. hlm 209-219.
Quintana I, Silva A, Berois N, Macadar O. 2004. Temperature induces gonadal maturation and effect electrophysiological sexual maturity indicators in Brachyhypopamus pinnicaudatus from a temperature climate. J Exp Biol 207:1843-1853.
Roche. 2011. DNase. [terhubung berkala]. www.roche_applied_science.com. [26 Juli 2011].
Saanin H. 1984. Taksonomi dan Kunci Identifikasi Ikan Jilid I. Bandung: Binacipta Saparinto C. 2008. Panduan Lengkap Gurame. Jakarta: Penebar Swadaya.
Scott AP, Baynes SM, Skarphedinsson O, Bye VJ. 1984. Control of spawning time in rainbow trout Salmo gairdneri using constant long daylengths. Aquaculture 43:225-233.
Sendjaja JT, Riski MH. 2002. Usaha Pembenihan Gurame. Jakarta: Penebar Swadaya. Shuler ML, Kargi F. 1992. Bioprocess Engineering. USA: Prentice Hall.
Sigma. 2009. Biofiles for life science research, Issue 2. Sigma-Adlrich Corporation. Sigma. 2011. Cell dissociation. [terhubung berkala]. www.sigmaaldrich.com. [28 Juli
2011].
Stoss J. 1983. Fish gamet preservation and spermatozoa physiology. In: DJ. Randall, EM. Donaldson (Edts.) Fish Physiologi vol. IX B: Academic Pr. hlm 305-350. Takashima F, Hibiya T. 1995. An Atlas of Fish Histology: Normal and Pathological
Features. Ed ke-2. Tokyo: Kandhasa Ltd.
Takeuchi Y, Yoshizaki G, Kobayashi T, Takeuchi T. 2002. Mass isolation of primordial germ cells from transgenic rainbow trout carrying the green fluorescent protein gene driven by the vasa gene promoter. Biol Reprod 67:1087-1092.
Takeuchi Y, Yoshizaki G, Takeuchi, T. 2004. Surrogate broodstock produces salmonids: trout offspring can be created from trout-donor germ cells transplanted into salmon. Nature 430:629-630.
Takeuchi Y, Higuchi K, Yatabe T, Miwa M, Yoshizaki G. 2009. Spermatogonial cell transplantation in marine teleost. Biol Reprod 81(6):1055-1063.
Thenawijaya M. 1982. Dasar-Dasar Biokimia Jilid I. Jakarta: Erlangga. Thenawijaya M. 1988. Pengantar Biokimia. Jakarta: Erlangga.
Tim Agromedia Pustaka. 2007. Panduan Lengkap Budidaya Gurame. Jakarta: Agromedia.
Valk J van der, Mellor D, Brands R, Fischer R, Gruber F, Gstraunthaler G, Hellebrekers L, Hyllner J, Jonker FH, Prieto P, Thalen M, Baumans V. 2004. The humane collection of fetal bovine serum and possibilities for serum-free cell and tissue culture. Toxicol in vitro 18:1-12.
Wibowo U. 2006. Pengaruh pemberian formalin terhadap aktivitas enzim tripsin pada feses sapi melalui uji gelatin [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
WordNet definition. 2011. Trypsin. [terhubung berkala]. encyclopedia2. thefreedictionary.com/WorldNet. [23 Januari 2011].
Worthington. 2011. Tissue Dissociation Guide. Worthington Biochemical Corporation. Yazawa R, Takeuchi Y, Highuci K, Yatabe T, Kabeya N, Yoshizaki G. 2010. Chub
mackerel gonads support colonization, survival, and proliferation of intraperitoneally transplanted xenogenic germ cells. Biol Reprod 82:896-904. Yusuf NS. 2005. Efektifitas hormon LhRh analog dan estradiol-17β melalui emulsi
Lampiran 1 Tabulasi jumlah spermatogonia
PERLAKUAN WAKTU
INKUBASI
JUMLAH SPERMATOGONIA
Ulangan 1
Ulangan 2 Ulangan 3 Rata-rata
Simpangan baku
PBS,tripsin
jam ke-1 6699.35 6333.33 6829.27 6621 ± 257 jam ke-2 6062.09 7166.67 7804.88 7011 ± 882 jam ke-3 8823.53 9166.67 7804.88 8598 ± 708 jam ke-4 8957.52 8900.00 9923.58 9260 ± 575 jam ke-5 9823.53 10500.00 10406.50 10243 ± 367
PBS,Tripsin,Serum
jam ke-1 6856.26 6116.96 6801.17 6591 ± 412 jam ke-2 7951.07 6505.85 6214.19 6890 ± 930 jam ke-3 7122.02 7140.35 7571.93 7278 ± 255 jam ke-4 7510.39 7595.91 7463.16 7523 ± 67 jam ke-5 7774.31 797971.93 71.93 7906 ± 114
PBS,Tripsin,Dnase
jam ke-1 10333.33 11503.40 11054.42 10964 ± 590 jam ke-2 13833.33 14884.35 13306.12 14008 ± 803 jam ke-3 16666.67 16156.45 16496.60 16440 ± 260 jam ke-4 18333.33 16921.77 17857.14 17704 ± 718 jam ke-5 18333.33 17176.87 17857.14 17789 ± 581
PBS,Tripsin,serum,Dnase
Lampiran 2 Tabulasi viabilitas spermatogonia
PERLAKUAN WAKTU
INKUBASI JUMLAH SPERMATOGONIA Ulangan
1
Ulangan 2
Ulangan
3 Rata-rata
Simpangan baku
PBS,tripsin jam ke-1 100.00 100.00 100.00
100.00 ± -
jam ke-2 94.61 90.70 95.83
93.71 ± 2.68
jam ke-3 88.89 89.09 91.67
89.88 ± 1.55
jam ke-4 83.57 85.51 89.09
86.06 ± 2.80
jam ke-5 83.37 84.13 87.50
85.00 ± 2.20
PBS,Tripsin,Serum jam ke-1 100.00 100.00 100.00
100.00 ± -
jam ke-2 96.15 91.01 90.59
92.58 ± 3.10
jam ke-3 90.48 90.48 90.00
90.32 ± 0.27
jam ke-4 84.21 90.00 88.89
87.70 ± 3.07
jam ke-5 83.33 80.00 86.67
83.33 ± 3.33
PBS,Tripsin,Dnase jam ke-1 100.00 100.00 100.00
100.00 ± -
jam ke-2 100.00 100.00 100.00
100.00 ± -
jam ke-3 98.00 97.89 97.94
97.94 ± 0.05
jam ke-4 96.36 93.97 92.38
94.24 ± 2.00
jam ke-5 92.73 90.10 92.38
91.74 ± 1.43
PBS,Tripsin,serum,Dnase jam ke-1
100.00 100.00 100.00
100.00 ± -
jam ke-2 97.93 100.00 100.00
99.31 ± 1.20
jam ke-3 98.33 97.89 98.95
98.39 ± 0.53
jam ke-4 96.44 96.02 98.68
97.05 ± 1.43
jam ke-5 94.94 94.47 98.33
UNIANOVA jumlah BY inkubasi medium /METHOD=SSTYPE(3)
/INTERCEPT=INCLUDE
/POSTHOC=inkubasi medium(DUNCAN) /PRINT=DESCRIPTIVE
/CRITERIA=ALPHA(.05)
/DESIGN=inkubasi medium inkubasi*medium.
Between-Subjects Factors
Value Label N
inkubasi 1 Jam1 12
2 Jam2 12
3 Jam3 12
4 Jam4 12
5 Jam5 12
medium 1 PBS,Tripsin,D
Nase 15
2 PBS,Tripsin 15
3 PBS,Tripsin,S
erum 15
4 PBS,Tripsin,S
erum,DNase 15
Descriptive Statistics
Dependent Variable:jumlah
medium inkubasi Mean Std. Deviation N
PBS,Tripsin,DNase Jam1 1.0964E4 590.28423 3
Jam2 1.4008E4 803.47306 3
Jam3 1.6440E4 259.78830 3
Jam4 1.7704E4 718.12220 3
Jam5 1.7789E4 581.22475 3
Total 1.5381E4 2738.27518 15
PBS,Tripsin Jam1 6.6206E3 257.16342 3
Jam2 7.0112E3 881.73224 3
Jam3 8.5984E3 708.26841 3
Jam4 9.2604E3 575.07840 3
Post Hoc Tests
Tests of Between-Subjects Effects
Dependent Variable:jumlah
Source
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model 1.142E9a 19 6.009E7 194.082 .000
Intercept 8.300E9 1 8.300E9 2.681E4 .000
medium 9.583E8 3 3.194E8 1.032E3 .000
inkubasi 1.389E8 4 3.472E7 112.139 .000
medium * inkubasi 4.457E7 12 3714528.841 11.997 .000
Error 1.239E7 40 309625.220
Total 9.455E9 60
Corrected Total 1.154E9 59
a. R Squared = .989 (Adjusted R Squared = .984)
Total 8.3468E3 1497.50013 15
PBS,Tripsin,Serum Jam1 6.5915E3 411.85523 3
Jam2 6.8904E3 930.09805 3
Jam3 7.2781E3 254.62941 3
Jam4 7.5232E3 67.28768 3
Jam5 7.9061E3 114.09475 3
Total 7.2378E3 623.26370 15
PBS,Tripsin,Serum,DNase Jam1 1.2514E4 145.74218 3
Jam2 1.6092E4 750.14538 3
Jam3 1.7039E4 673.90282 3
Jam4 1.7167E4 364.09470 3
Jam5 1.7595E4 423.57761 3
Total 1.6082E4 1964.60685 15
Total Jam1 9.1725E3 2761.09761 12
Jam2 1.1000E4 4359.15172 12
Jam3 1.2339E4 4648.67070 12
Jam4 1.2914E4 4789.27897 12
Jam5 1.3383E4 4596.01817 12
Total 1.1762E4 4422.87227 60
UNIANOVA jumlah BY interaksi /METHOD=SSTYPE(3)
/INTERCEPT=INCLUDE
/POSTHOC=interaksi(DUNCAN) /PRINT=DESCRIPTIVE
/CRITERIA=ALPHA(.05)
/DESIGN=interaksi.
Tests of Between-Subjects Effects
Dependent Variable:jumlah
Source
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model 1.142E9a 19 6.009E7 194.082 .000
Intercept 8.300E9 1 8.300E9 2.681E4 .000 Duncan
medium N
Subset
1 2 3 4
PBS,Tripsin,Serum 15 7.2378E3
PBS,Tripsin 15 8.3468E3
PBS,Tripsin,DNase 15 1.5381E4
PBS,Tripsin,Serum,DNase 15 1.6082E4
Sig. 1.000 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 309625.220.
jumlah
Duncan
inkubasi N
Subset
1 2 3 4 5
Jam1 12 9.1725E3
Jam2 12 1.1000E4
Jam3 12 1.2339E4
Jam4 12 1.2914E4
Jam5 12 1.3383E4
Sig. 1.000 1.000 1.000 1.000 1.000 Means for groups in homogeneous subsets are displayed.
Based on observed means.
interaksi 1.142E9 19 6.009E7 194.082 .000
Error 1.239E7 40 309625.220
Total 9.455E9 60
Corrected Total 1.154E9 59
a. R Squared = .989 (Adjusted R Squared = .984)
Post Hoc Tests
jumlah
Duncan
interaksi N
Subset
1 2 3 4 5 6 7 8 9 10
31 3 6.5915E3
21 3 6.6206E3
32 3 6.8904E3 6.8904E3
22 3 7.0112E3 7.0112E3
33 3 7.2781E3 7.2781E3
34 3 7.5232E3 7.5232E3
35 3 7.9061E3 7.9061E3
23 3 8.5984E3 8.5984E3
24 3 9.2604E3
25 3 1.0243E4
11 3 1.0964E4
41 3 1.2514E4
12 3 1.4008E4
42 3 1.6092E4
13 3 1.6440E4 1.6440E4
43 3 1.7039E4 1.7039E4 1.7039E4
44 3 1.7167E4 1.7167E4
45 3 1.7595E4
14 3 1.7704E4
15 3 1.7789E4
UNIANOVA viabilitas BY medium inkubasi /METHOD=SSTYPE(3)
/INTERCEPT=INCLUDE
/POSTHOC=medium inkubasi(DUNCAN) /PRINT=DESCRIPTIVE
/CRITERIA=ALPHA(.05)
/DESIGN=medium inkubasi medium*inkubasi.
Descriptive Statistics
Dependent Variable:viabilitas
medium inkubasi Mean Std. Deviation N
PBS,Tripsin,DNase Jam1 1.0000E2 .00000 3
Jam2 1.0000E2 .00000 3
Jam3 97.9433 .05508 3
Jam4 92.1700 1.91366 3
Jam5 91.7367 1.42816 3
Total 96.3700 3.92083 15
PBS,Tripsin Jam1 1.0000E2 .00000 3
Jam2 94.7133 1.06875 3
Jam3 89.8833 1.55053 3
Jam4 87.0567 1.83895 3
Jam5 85.0000 2.19816 3
Total 91.3307 5.76093 15
PBS,Tripsin,Serum Jam1 1.0000E2 .00000 3
Jam2 96.2500 .30265 3
Jam3 93.3200 2.47322 3
Jam4 90.7000 2.24346 3
Jam5 86.6667 3.33500 3
Total 93.3873 5.05452 15
PBS,Tripsin,Serum,DNase Jam1 1.0000E2 .00000 3
Jam2 99.3100 1.19512 3 Means for groups in homogeneous subsets are displayed.
Based on observed means.
Jam3 98.3900 .53254 3
Jam4 97.7133 1.15106 3
Jam5 95.9133 2.10605 3
Total 98.2653 1.78890 15
Total Jam1 1.0000E2 .00000 12
Jam2 97.5683 2.37086 12
Jam3 94.8842 3.87214 12
Jam4 91.9100 4.29693 12
Jam5 89.8292 4.92482 12
Total 94.8383 5.05868 60
Lampiran 4 Hasil analisis faktorial penghitungan Viabilitas sel spermatogonia
Tests of Between-Subjects Effects
Dependent Variable:viabilitas
Source
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model 1415.225a 19 74.486 31.494 .000
Intercept 539658.568 1 539658.568 2.282E5 .000
medium 427.492 3 142.497 60.252 .000
inkubasi 813.176 4 203.294 85.958 .000
medium * inkubasi 174.557 12 14.546 6.151 .000
Error 94.602 40 2.365
Total 541168.395 60
Corrected Total 1509.826 59
a. R Squared = .937 (Adjusted R Squared = .908)
viabilitas
Duncan
medium N
Subset
1 2 3 4
PBS,Tripsin 15 91.3307
PBS,Tripsin,Serum 15 93.3873
PBS,Tripsin,DNase 15 96.3700
PBS,Tripsin,Serum,DNase 15 98.2653
Sig. 1.000 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 2.365.
viabilitas
Duncan
inkubasi N
Subset
1 2 3 4 5
Jam5 12 89.8292
Jam4 12 91.9100
Jam3 12 94.8842
Jam2 12 97.5683
Jam1 12 1.0000E2
Sig. 1.000 1.000 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 2.365.
UNIANOVA viabilitas BY interaksi /METHOD=SSTYPE(3)
/INTERCEPT=INCLUDE
/POSTHOC=interaksi(DUNCAN) /PRINT=DESCRIPTIVE
/CRITERIA=ALPHA(.05)
Tests of Between-Subjects Effects
Dependent Variable:viabilitas
Source
Type III Sum of
Squares df Mean Square F Sig.
Corrected Model 1415.225a 19 74.486 31.494 .000
Intercept 539658.568 1 539658.568 2.282E5 .000
interaksi 1415.225 19 74.486 31.494 .000
Error 94.602 40 2.365
Total 541168.395 60
Corrected Total 1509.826 59
a. R Squared = .937 (Adjusted R Squared = .908) Dependent Variable:viabilitas
interaks
i Mean Std. Deviation N