ANALISIS POTENSI BIJI DAN UMBI
TERATAI (
Nymphaea pubescens
Willd)
UNTUK PANGAN FUNGSIONAL
PREBIOTIK DAN ANTIBAKTERI
Escherichia coli
ENTEROPATOGENIK K1.1
YUSPIHANA FITRIAL
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Analisis Potensi Biji dan Umbi Teratai (Nymphaea pubescens Willd) untuk Pangan Fungsional Prebiotik dan Antibakteri Escherichia coli Enteropatogenik K1.1 adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2009
ABSTRACT
YUSPIHANA FITRIAL. The Potential Analysis of Seed and Root of Water Lily (Nymphaea pubescens Willd) as a Functional Food Prebiotic and Antibacterial Enteropathogenic Escherichia coli K1.1. Under supervision of MADE ASTAWAN, SOEWARNO T. SOEKARTO, KOMANG G. WIRYAWAN and TUTIK WRESDIYATI.
The purposes of this study were (1) to determine the antibacterial activities of water lily seed and root, both against pathogenic bacteria causing diarrhea and beneficial bacteria; (2) to identify phytochemical components in water lily seed and root, and to evaluate their activities as antibacterial against pathogenic bacteria causing diarrhea; (3) to measure and evaluate water lily seed’s and root’s prebiotic activities of carbohydrate fraction in vitro; (4) to evaluate biological activity of water lily seed’s and root’s flour and extract as antidiarrheal and prebiotic sources; (5) to evaluate the potential of water lily seed and its extract as immunomodulator.
Extraction of antibacterial components used multistage maceration extraction method based on solvent polarity level, i.e. hexane, ethyl acetate and ethanol. Each extract’s activities were tested using diarrhea-causing bacteria, Enteropathogenic E. coli K.1.1 (EPEC K1.1) and S. Typhimurium with agar well diffusion method. The MIC (minimum inhibitory concentration) and MBC (minimum bactericidal concentration) values were calculated with the highest antibacterial activities. Fractination was performed on extract with the largest antibacterial activity using thin-layer chromatography. The activities of each fraction were tested qualitatively by bio-autography method. Qualitative phytochemical tests were performed on all extracts
Carbohydrate fractions (glucose, fructose, sucrose, raffinose and stacchiose) in water lily seed and root were analyzed by HPLC. Carbohydrate fractions which were separated in previous stage were considered as sugar growth medium by modifying the growth medium of lactic acid bacteria and bifidobacterium in vitro.
In vivo test was carried out on Sprague Dawley male rats for 28 days. There were two groups of rats to be studied, i.e. normal (healthy) rats group and another rats group which were intervened by Enteropathogenic E.coli K1.1. The rats group that was intervened by EPEC K1.1, after 2 weeks feeding treatments, were orally infected with EPEC K1.1in a week. In this stage, a basal diet was made with casein as the feed protein source. Male rats were fed a basal diet (control group) or the same diet containing of water lily seed flour or the same diet containing of FOS (isocalory and
isonitrogen) or a basal diet with water lily seeds extract (given orally) for 4 weeks. Biological activities of water lily seed and extract were evaluated by observing total count of E.coli in cecal content and on cecum mucosa; total count of both aerobe and anaerobe lactic acid bacteria, small intestine histology and immunohistochemistry IgA of test rat’s small intestine.
Results of this study showed that the water lily’s seed and root had an antibacterial activity against EPEC K1.1 and Salmonella Typhimurium, especially in ethyl acetate extract. Ethanol extract had the same, yet lower activity. Ethyl acetate and ethanol extract of the seed did not show inhibition against the growth of lactic acid bacteria (Lactobacillus sp) and Bifidobacterium bifidum.
The MIC and MBC values of the ethyl acetate extract on EPEC K1.1were 0.89 (mg/mL) and 1.33 (mg/mL), respectively, while similar values of that on S.
hand, MIC and MBC values of the root’s ethyl acetate extract on EPEC K1.1 were 1.11(mg/mL), while similar values of that on S. Typhimurium were 1.11 and 1.55 (mg/mL), respectively.
Phytocompounds in water lily seed’s ethyl acetate extract were alkaloids, flavonoids, tannins, glycosides, saponins, and triterpenoids. Meanwhile, compounds within root’s ethyl acetate extract were alkaloids, tannins, saponins, glycosides and steroids. All fractions in the ethyl acetate extract had antibacterial activities against EPEC K1.1 and S. Typhimurium. These fractions were thought to be able to inhibit the growth of test-microbes by synergic action of the components.
Stachiose and raffinose were carbohydrate fractions of water lily’s seed and root that could possibly be considered as a prebiotic sources. They could be fermented by
Lactobacillus acidophilus and Bifidobacterium bifidum. The level of stachiose and raffinose was 0.60 mg/g of dry weight and 10.69 mg/g of dry weight in the seed and root, respectively.
Water lily seed and its ethyl acetate extract at the level of ≈ 1.87 g water lily seed or ≈ 13.23 mg/g rat weight or 17.80 mg/ml ethyl acetate extract significantly prevented and inhibited the growth of pathogenic bacteria like EPEC K1.1 causing diarrhea in rats. Water lily seed had higher ability of preventing and inhibiting the growth of these bacteria than its ethyl acetate extract. Water lily seed and its extract served as immunomodulator (meaning to stimulate the production of IgA) as a defense against pathogenic bacteria attack in the digestion tract. Both water lily seed and root had antibacterial and prebiotic activities, but water lily seed had more potency as antibacterial, while its root had more potency as a prebiotic source.
RINGKASAN
YUSPIHANA FITRIAL. Analisis Potensi Biji dan Umbi Teratai (Nymphaea pubescens Willd) untuk Pangan Fungsional Prebiotik dan Antibakteri Escherichiacoli Enteropatogenik K1.1. Dibimbing olehMADE ASTAWAN, SOEWARNO T. SOEKARTO, KOMANG G. WIRYAWAN dan TUTIK WRESDIYATI.
Teratai merupakan tanaman air yang banyak tumbuh secara alami di perairan rawa atau sungai yang tidak begitu dalam dan berair tenang. Kalimantan Selatan yang memiliki rawa seluas 800 000 Ha banyak ditumbuhi tanaman air salah satunya adalah teratai. Bagian tanaman teratai ini yang dapat dimanfaatkan sebagai bahan pangan adalah bunga, biji, batang dan umbinya. Akan tetapi yang paling banyak dimanfaatkan oleh penduduk, terutama di daerah Hulu Sungai Utara adalah bijinya. Biji buah teratai oleh penduduk setempat sering dijadikan sebagai sumber karbohidrat pengganti beras disaat paceklik ataupun dijadikan tepung untuk membuat kue. Di daerah lain, secara tradisional biji dan umbi teratai oleh masyarakat dimanfaatkan sebagai obat diare dan disentri.
Tujuan umum penelitian ini adalah meningkatkan potensi tanaman teratai sebagai sumber daya daerah yang tumbuh liar di rawa-rawa di Kalimantan Selatan, yaitu (1) sebagai sumber antibakteri dan prebiotik untuk mencegah diare, (2) sebagai sumber bahan pangan baru, (3) memanfaatkan atau memberi nilai tambah ekonomi.
Secara rinci tujuan khusus dari penelitian ini adalah (1) Mengukur aktivitas antibakteri umbi dan biji teratai, baik terhadap bakteri patogen penyebab diare maupun bakteri yang menguntungkan, (2) Mengidentifikasi komponen fitokimia yang terdapat pada umbi dan biji teratai, dan mengevaluasi aktivitasnya sebagai antibakteri terhadap bakteri patogen penyebab diare, (3) Mengukur dan mengevaluasi secara in vitro aktivitas prebiotik dari fraksi karbohidrat biji dan umbi teratai (4) Mengevaluasi aktivitas biologis dari tepung dan ekstrak umbi atau biji teratai dalam kaitannya sebagai pencegah diare dan sumber prebiotik, dan (5) Mengevaluasi potensi biji teratai dan ekstraknya sebagai imunomodulator dalam kaitannya dengan Imunoglobulin A di usus halus.
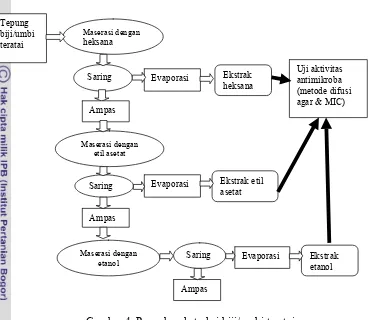
Ekstraksi komponen antibakteri secara maserasi menggunakan metode ekstraksi bertingkat berdasarkan tingkat kepolaran pelarut yaitu heksana (tidak polar), etil asetat (semi polar) dan etanol (polar).
Analisis aktivitas antibakteri ekstrak heksana, etil asetat dan etanol dilakukan dengan metode difusi agar atau sumur terhadap bakteri E. coli
Enteropatogenik K1.1 (EPEC K1.1), Salmonella Typhimurium, bakteri asam laktat (Lactobacillus acidophilus) dan bifidobacterium (Bifidobacterium bifidum). Pengamatan tidak hanya ditujukan untuk bakteri pathogen, tetapi juga terhadap bakteri yang menguntungkan dengan tujuan untuk mengetahui pengaruh ekstrak yang diduga mengandung senyawa antibakteri terhadap pertumbuhan bakteri menguntungkan.
concentration) dari ekstrak yang memiliki aktivitas penghambatan terhadap mikroba uji Tahap ini bertujuan untuk mengetahui jenis ekstrak yang memiliki aktivitas antibakteri paling besar berdasarkan tingkat kepolaran pelarut.
Analisis kualitatif fitokimia dari masing-masing ekstrak biji dan umbi teratai, meliputi tanin, alkaloid, saponin, glikosida, flavonoid, sterol dan/atau triterpen. Pada tahap ini masing-masing ekstrak (heksana, etil asetat dan etanol) komponen fitokimianya dianalisis secara kualitatif untuk mengetahui jenis komponen fitokimia yang terdapat pada masing-masing ekstrak.
Ekstrak yang memiliki aktivitas antibakteri tertinggi difraksinasi untuk diuji masing-masing fraksi yang terdapat pada biji dan umbi teratai terhadap bakteri EPEC K1.1 dan SalmonellaTyphimurium menggunakan metode bioautografi dan difusi agar atau sumur. Tahap ini bertujuan untuk mengetahui fraksi yang paling berperan sebagai antibakteri
Analisis komposisi fraksi karbohidrat yang terdapat pada biji dan umbi teratai dilakukan dengan HPLC. Pada tahap ini dianalisis komposisi fraksi karbohidrat yang terdapat pada tepung biji dan umbi teratai, meliputi monosakarida (glukosa dan fruktosa), disakarida (sukrosa), oligosakarida (rafinosa dan stakiosa).
Pengujian fraksi karbohidrat yang sudah dipisahkan pada tahap sebelumnya, dianggap sebagai gula pada media pertumbuhan dengan memodifikasi media pertumbuhannya secara in vitro. Tahap ini bertujuan untuk mengetahui apakah fraksi karbohidrat yang diduga berperan sebagai prebiotik dapat difermentasi oleh bakteri asam laktat dan bifidobacterium uji, yaitu dengan membandingkan antara glukosa yang terdapat pada media pertumbuhan bakteri asam laktat dan bifidobaterium sebagai sumber karbohidrat dengan gula lain yang terdapat pada biji dan atau umbi teratai.
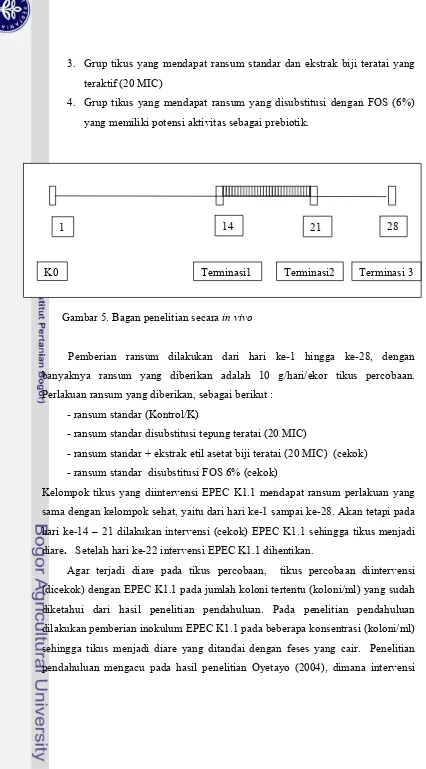
Pengujian secara in vivo dilakukan dengan tikus percobaan (jenis Sprague Dawley selama 28 hari) untuk mengevaluasi aktivitas biologis biji teratai baik yang berupa tepung maupun ekstrak biji dan kaitannya dengan pencegahan diare. Pada tahap ini, tepung biji disubstitusikan ke dalam pakan standar tikus percobaan (secara isokalori dan isonitrogen). Pembuatan ransum standar dengan kasein sebagai sumber protein ransum (10%). Ada dua kelompok tikus yang akan dipelajari yaitu kelompok tikus normal (sehat) dan kelompok tikus yang diintervensi E.coli. Masing-masing kelompok tikus dibagi menjadi 4 grup tikus (@ n=9 ekor), yaitu : (1) Grup tikus yang mendapat ransum standar, (2) Grup tikus yang mendapat ransum yang disubstitusi dengan tepung biji teratai (20 MIC), (3) Grup tikus yang mendapat ransum standar dan ekstrak biji teratai yang teraktif (20 MIC)(dicekok), (4) Grup tikus yang mendapat ransum yang disubstitusi dengan FOS (6%) yang memiliki potensi aktivitas sebagai prebiotik.(dicekok).
Kelompok tikus yang diintervensi EPEC K1.1 mendapat ransum perlakuan yang sama dengan kelompok sehat, yaitu dari hari ke-1 sampai ke-28. Akan tetapi pada hari ke-14 – 21 dilakukan intervensi (cekok) EPEC K1.1 sehingga tikus menjadi diare. Setelah hari ke-22 intervensi EPEC K1.1 dihentikan.
total E. coli isi sekum (pada hari ke-0, 14, 21 dan 28), histologi usus halus dan imunohistokimia IgA usus halus tikus percobaan (pada hari ke-0, 14, 21, 28).
Analisis data dilakukan dengan rancangan acak lengkap (RAL) menggunakan program SPSS dan uji beda lanjut dengan uji Duncan.
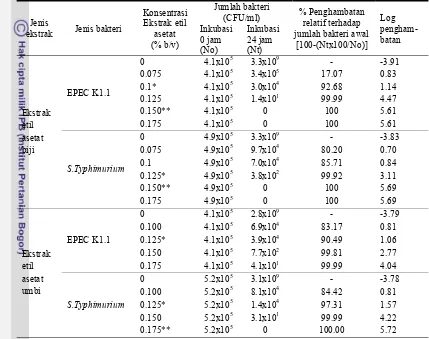
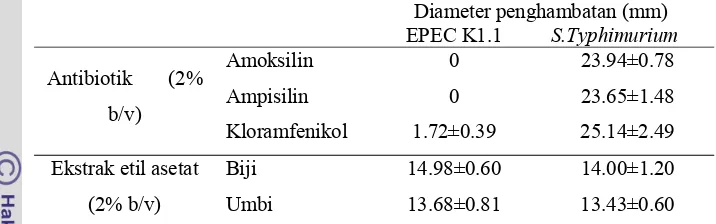
Berdasarkan hasil penelitian secara in vitro diketahui bahwa biji dan umbi teratai (Nymphaea pubescens Willd) memiliki aktivitas antibakteri terhadap EPEC K1.1 dan S.Typhimurium, terutama pada ekstrak etil asetat. Ekstrak etanol memiliki aktivitas yang lebih rendah daripada ekstrak etil asetat. Komponen aktif dari ekstrak biji dan umbi teratai tidak menghambat pertumbuhan bakteri asam laktat.
Nilai MIC dan MBC ekstrak etil asetat biji teratai terhadap EPEC K1.1 adalah 0.89 mg/ml dan 1.33 mg/ml. Nilai MIC dan MBC ekstrak etil asetat biji teratai terhadap S. Typhimurium adalah 1.11 mg/ml dan 1.33 mg/ml. Nilai MIC ekstrak etil asetat umbi terhadap EPEC K1.1 adalah 1.11 mg/ml sedangkan nilai MIC dan MBC ekstrak etil asetat umbi terhadap S. Typhimurium adalah 1.11 mg/ml dan 1.55 mg/ml.
Komponen fitokimia yang terdapat pada ekstrak etil asetat biji adalah alkaloid, tanin, saponin, glikosida, flavonoid dan triterpenoid, sedangkan yang terdapat pada umbi adalah alkaloid, tanin, saponin, glikosida dan steroid. Semua komponen tersebut memiliki aktivitas antibakteri.
Fraksi-fraksi dari ekstrak etil asetat biji dan umbi memiliki aktivitas antibakteri yang bekerja secara sinergis
Oligosakarida yang menjadi sumber prebiotik pada biji dan umbi teratai adalah stakiosa dan rafinosa Pada biji, kadar total stakiosa dan rafinosa adalah 0.60 mg/g (bk), sedangkan pada umbi kadarnya 10.69 mg/g (bk). Oligosakarida yang terdapat pada biji dan umbi teratai dapat difermentasi oleh Lactobacillus acidophilus dan Bifidobacterium bifidum.
Biji teratai dan ekstrak etil asetat biji teratai dengan kadar 20MIC ≈ 1.866 g tepung biji teratai atau ≈ 13.23 mg/g berat badan tikus percobaan atau ≈ 17.8 mg/ml ekstrak etil asetat secara nyata dapat mencegah dan menghambat pertumbuhan bakteri patogen penyebab diare (EPEC K.1.1) pada tikus percobaan. Biji teratai mempunyai kemampuan mencegah dan menghambat pertumbuhan bakteri patogen penyebab diare (EPEC K.1.1) yang lebih tinggi dibandingkan ekstrak etil asetat biji teratai.
Biji teratai dan ekstrak biji teratai dapat berperan sebagai imunomodulator (menstimulasi produksi IgA) sebagai pertahanan terhadap serangan patogen di saluran pencernaan.
Biji dan umbi teratai memiliki aktivitas antibakteri dan prebiotik, akan tetapi biji teratai lebih berpotensi sebagai antibakteri, sedangkan umbi teratai lebih berpotensi sebagai sumber prebiotik.
©Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengujian tersebut tidak merugikan kepentingan yang wajar IPB.
ANALISIS POTENSI BIJI DAN UMBI
TERATAI (
Nymphaea pubescens
Willd)
UNTUK PANGAN FUNGSIONAL
PREBIOTIK DAN ANTIBAKTERI
Escherichia coli
ENTEROPATOGENIK K1.1
YUSPIHANA FITRIAL
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Ir. Harsi D. Kusumaningrum
Penguji pada Ujian Terbuka : 1. Dr. dr. Sri Budiarti
Judul Disertasi : Analisis Potensi Biji dan Umbi Teratai (Nymphaea pubescens Willd) untuk Pangan Fungsional Prebiotik dan Antibakteri
Escherichiacoli Enteropatogenik K1.1 Nama : Yuspihana Fitrial
NRP : F261030021
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Made Astawan, M.S. Prof. Dr. Soewarno T. Soekarto, M.Sc.
Ketua Anggota
Dr. Ir. Komang G. Wiryawan Dr. drh. Tutik Wresdiyati
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr.Ir. Ratih Dewanti-Hariyadi, M.Sc Prof.Dr.Ir.Khairil Anwar Notodiputro, MS
PRAKATA
Segala puji bagi Allah SWT atas karunia dan rahmatNya-lah sehingga kami dapat menyelesaikan disertasi dengan judul ”Analisis Potensi Biji dan Umbi Teratai (Nymphaea pubescens Willd) untuk Pangan Fungsional Prebiotik dan Antibakteri Escherichia coli Enteropatogenik K1.1” ini. Disertasi ini dibuat sebagai salah satu syarat bagi mahasiswa pascasarjana program S3 untuk meraih gelar Doktor pada Program Studi Ilmu Pangan, Institut Pertanian Bogor.
Pada kesempatan ini kami menyampaikan penghargaan dan ucapan terima kasih kepada Prof. Dr. Ir. Made Astawan, MS selaku ketua komisi pembimbing atas segala waktu, pikiran dan saran yang diberikan selama proses pembimbingan. Kepada Prof. Dr. Soewarno T. Soekarto M.Sc, Dr. Ir. Komang G. Wiryawan dan drh. Tutik Wresdiyati, Ph.D., selaku anggota pembimbing, kami ucapkan terima kasih atas segala waktu, pikiran dan saran yang telah diberikan kepada kami, sehingga disertasi ini dapat diselesaikan. Kepada drh. Tutik Wresdiayati, Ph.D, kami ucapkan terima kasih atas segala bantuan bahan-bahan kimia yang diperlukan untuk analisis histologi dan imunohistokimia yang digunakan pada penelitian ini.
Ucapan terima kasih juga kami sampaikan kepada DIKTI yang bersedia mendanai penelitian ini lewat Hibah Bersaing ke-14 (2006-2007), sehingga penelitian dapat berjalan lancar. Kepada Gubernur Kalimantan Selatan diucapkan terima kasih atas bantuan dana penelitian yang diberikan melalui Rektor Universitas Lambung Mangkurat. Kepada PT. Damandiri diucapkan terima kasih atas bantuan dana yang diberikan. Kepada Ibu Dr. dr. Sri Budiarti dari Lab.Bioteknologi Hewan dan Biomedis, Pusat Penelitian Bioteknologi IPB, yang bersedia memberikan koleksinya berupa isolat E.coli Enteropatogenik K.1.1 (EPEC K1.1) sebagai bakteri uji pada penelitian ini, sekaligus juga sebagai penguji luar komisi pada saat ujian terbuka. Kepada Bapak Dr. Novik dari Lab. Mikrobiologi LIPI Bogor yang bersedia memberikan isolat koleksinya berupa
(Bpk. Gun Gun Ismail, Product Manager Inggredients Division) atas bantuan FOS (Fructooligoscharide), merupakan salah satu bahan yang digunakan pada penelitian ini.
Kepada Dr.Ir. Harsi D. Kusumaningrum ucapan terima kasih disampaikan atas kesediaannya menjadi penguji luar komisi pada ujian tertutup dan kepada Dr. dr. Purwantyastuti, M.Sc, SpPK ucapan terima kasih disampaikan atas kesediaannya menjadi penguji luar komisi pada ujian terbuka.
Kepada Ibu Sussi Astuti, Mu’ Nisa, Rifda Naufalin, Miksusanti, Nuraini, Asriani dan rekan-rekan mahasiswa pascasarjana IPB lainnya yang tidak bisa kami sebutkan satu persatu, diucapan terima kasih atas segala bantuan, dukungan, semangat dan waktu yang diluangkan untuk berdiskusi selama penulis melakukan penelitian dan penyusunan disertasi ini. Kepada para teknisi (mbak Ari, mbak Dewi & mas Taufik) yang membantu selama penelitian ini, kami ucapkan terima kasih.
Kepada ayahanda dan ibunda tercinta, terima kasih atas doa yang tulus dan nasihat yang diberikan kepada penulis. Kepada bapak dan ibu mertua disampaikan terimakasih atas segala pengertiannya dan doanya selama ini. Kepada saudara-saudara tercinta terimakasih atas segala pengertiannya dan dukungannya. Kepada Om & Tante Mirhan serta Yasmin sekeluarga terima kasih atas bantuan dan doanya. Kepada yang tercinta suami, Ir. Bambang Soekotjo dan ananda Nurkhaliza Galuh Putri, terimakasih atas segala pengertian, dukungan dan pengorbanannya yang diberikan selama penulis menyelesaikan studi ini.
Semoga Allah SWT memberi balasan yang berlipatganda dan semoga penelitian ini dapat memberi manfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Banjarmasin pada tanggal 15 Oktober 1969, sebagai anak ke-4 dari tujuh bersaudara, dari pasangan Drs.H.Yusuf Azidin dan Hj. St. Fatimah. Pendidikan sarjana ditempuh di Jurusan Pengolahan Hasil Perikanan, Fakultas Perikanan IPB, lulus pada tahun 1993. Penulis melanjutkan studi kejenjang S2 di Program Studi Ilmu Pangan IPB dan lulus pada tahun 2000. Pada tahun 2003, penulis melanjutkan studi S3 di Program Studi Ilmu Pangan.
DAFTAR ISI
Halaman
DAFTAR TABEL ……… iii
DAFTAR GAMBAR ………... v
DAFTAR LAMPIRAN ……… vii
I. PENDAHULUAN A. Latar Belakang ……… 1
B. Lingkup Penelitian ……….. 3
C. Tujuan Penelitian ……… 4
D. Hipotesis ………. 4
II. TINJAUAN PUSTAKA
A. Teratai
……….
5
B. Anti-Diare ……… 10
C. Prebiotik ……….. 17
D. Beberapa Bakteri Penyebab Diare ………. 23
E. Sistem Imun Saluran Pencernaan ……… 30
III. METODOLOGI A. Waktu dan Tempat Penelitian ………. 35
B. Bahan dan Alat ……… 35
C. Metode Penelitian ……… 36
D. Prosedur Analisis ………. 43
E. Analisis Data ……… 55
IV. HASIL DAN PEMBAHASAN A. Tanaman Teratai ………. 56
B. Komposisi Kimia Biji dan Umbi Teratai ……… 59
C. Antimikroba Biji dan Umbi Teratai ……… 60
D. Komponen Fitokimia Ekstrak Biji dan Umbi Teratai ... 68
E. Fraksinasi Ekstrak Etil asetat Biji dan Umbi Teratai dan Uji Aktivitas Fraksi ... 70
F. Identifikasi Senyawa Antimikroba Beberapa Fraksi Ekstrak Biji dan Umbi Teratai ………... 76
G. Analisis Fraksi Karbohidrat dari Biji dan Umbi Teratai ………. 79
H. Evaluasi Aktivitas Biologis Biji Teratai dan Ekstrak Biji Teratai 1. Penelitian Pendahuluan ………. 81
2. Penelitian Lanjutan ... 86
3. Histologi tebal mukosa usus halus tikus percobaan... 104
4. Pengaruh pemberian tepung biji teratai dan ekstrak etil asetat biji teratai terhadap kandungan imunoglobulin A(IgA) usus halus tikus percobaan ... 108
V. KESIMPULAN DAN SARAN………….……… . 113
DAFTAR TABEL
Halaman 1. Komposisi kimia tepung biji teratai ……… 7 2. Komposisi asam amino dan asam lemak esensial tepung biji teratai 8 3. Sifat fisik dari tepung biji teratai ……….. 9 4. Persamaan dan perbedaan serat pangan, inulin dan oligofruktosa … 18 5. Komposisi ransum tikus percobaan modifikasi AOAC 1990 ……… 40 6. Komposisi kimia biji dan umbi teratai ………... 59 7. Sifat fisik dan rendemen ekstrak biji dan umbi teratai ... 60 8. Diameter penghambatan (mm) ekstrak heksana, etil asetat dan etanol biji dan umbi teratai ... 64 9. Pertumbuhan bakteri EPEC K.1.1 dan Salmonella Typhimurium pada media NB yang mengandung ekstrak etil asetat biji dan umbi teratai 66 10. Diameter penghambatan (mm) ekstrak etil asetat biji dan umbi teratai dibandingkan dengan antibiotik terhadap EPEC K.1.1 dan
20. Tebal mukosa (µm) usus halus tikus percobaan kelompok sehat…. 105 21. Tebal mukosa (µm) usus halus tikus percobaan kelompok yang diintervensi EPEC K1.1 ……… 106 22. Kandungan Imunoglobulin A (Ig A) secara imunohistokimia pada usus halus tikus percobaan yang sehat dan yang diintervensi EPEC
DAFTAR GAMBAR
Halaman
1. Mekanisme peranan prebiotik ………. 23
2. Efek dari infeksi EPEC pada sel epitel usus inang ……….. 25
3. Mekanisme yang menginduksi respon IgA pada saluran pencernaan 33 4. Prosedur ekstraksi biji/umbi teratai ……….. 37
5. Bagan penelitian secara in vivo ……… 41
6 . Pengukuran tebal mukosa pada usus halus ... 53
7. Teratai (Nymphaea pubescens Willd) ………. 56
8. Buah teratai (a), buah yang pecah (b) dan biji teratai (c) ………… 57
9. Umbi teratai (Nymphaea pubescens Willd) ... 58
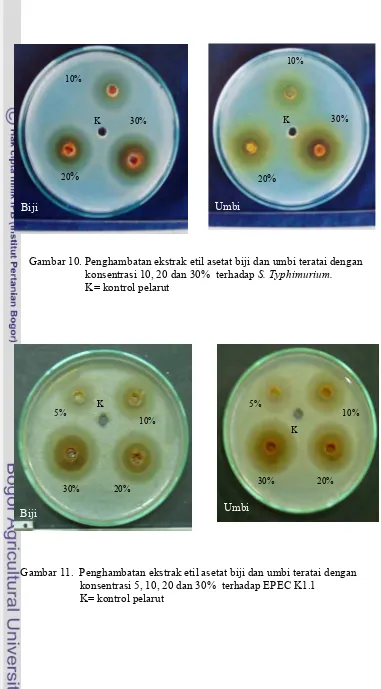
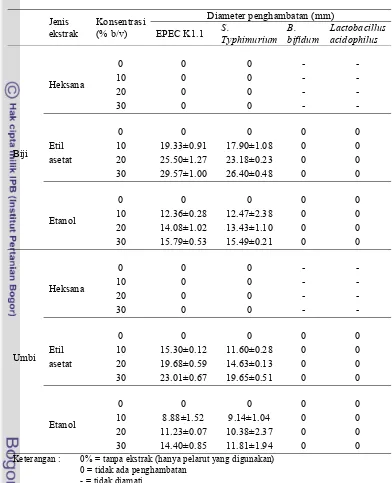
10. Penghambatan ekstrak etil asetat biji dan umbi teratai dengan konsentrasi 10, 20 dan 30% terhadap S. Typhimurium. ... 61
11. Penghambatan ekstrak etil asetat biji dan umbi teratai dengan konsentrasi 5,10, 20 dan 30% terhadap EPEC K.1.1 ……… 61
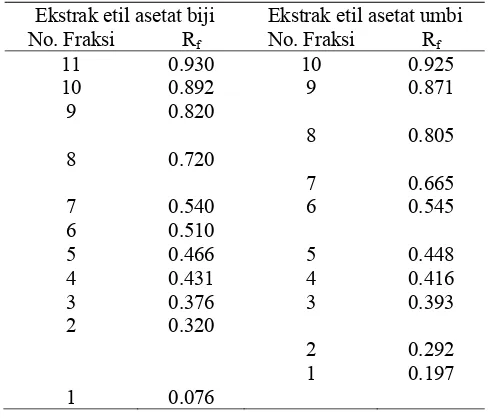
12. Bioautogram menunjukkan penghambatan ekstrak etil asetat biji terhadap EPEC K1.1 dan S.Typhimurium ... 72
13. Bioautogram yang menunjukkan penghambatan ekstrak etil asetat umbi terhadap S.Typhimurium dan EPEC K1.1 ………. 73
14. Koloni Bifidobacterium bifidum dan Lactobacillus acidophilus yang dapat memfermentasi gula (glukosa, oligosakarida) ... 80
15. E.coli dari isi sekum tikus percobaan dengan perlakuan pemberian tepung biji teratai dosis 10, 20 dan 30 MIC………. 83
16. E.coli dari mukosa sekum tikus percobaan dengan perlakuan pemberian tepung biji teratai dosis 10, 20 dan 30 MIC... 84
17. BAL aerob isi sekum tikus percobaan dengan perlakuan pemberian tepung biji teratai dosis 10, 20 dan 30 MIC... 85
18. BAL aerob mukosa sekum tikus percobaan dengan perlakuan Pemberian epung biji teratai dosis 10, 20 dan 30 MIC... 85
21. Fotomikrograf jejenum tikus percobaan dengan pewarnaan HE... 107 22. Foto mikrograf jejenum tikus perlcobaan yang diwarnai secara
I PENDAHULUAN
A. Latar Belakang
Teratai merupakan tanaman air yang banyak tumbuh secara alami di perairan rawa atau sungai yang tidak begitu dalam dan berair tenang. Kalimantan Selatan yang memiliki rawa seluas 800 000 ha (BPS Kalimantan Selatan 2000) banyak ditumbuhi tanaman air salah satunya adalah teratai. Bagian tanaman teratai ini yang dapat dimanfaatkan sebagai bahan makanan adalah bunga, biji, batang dan umbinya. Akan tetapi yang paling banyak dimanfaatkan oleh penduduk, terutama di daerah Hulu Sungai Utara adalah bijinya. Biji buah teratai oleh penduduk setempat sering dijadikan sebagai sumber karbohidrat pengganti beras disaat paceklik ataupun dijadikan tepung untuk membuat kue. Berdasarkan hasil penelitian Kairina dan Fitrial (2002) diperoleh hasil bahwa dari setiap rumpun teratai rata-rata terdapat 5.3 buah teratai tua yang menghasilkan 63.10 gram biji teratai kering. Biji teratai kering inilah yang kemudian dikupas kulitnya dan dijual dipasar.
Di daerah dengan sistem persawahan tadah hujan dimana sebagian besar areal persawahan di musim hujan terendam air memungkinkan tumbuhnya berbagai jenis tanaman air, terutama teratai. Meskipun demikian, hanya sedikit dari petani yang memanfaatkan tanaman teratai sebagai sumber penghasilan di musim hujan. Oleh karena itu, pemanfaatan tanaman teratai dianggap belum optimal. Sementara umbinya, selama ini tidak dimanfaatkan dan dibuang begitu saja ketika sawah dibersihkan untuk persiapan menanam padi.
Selain digunakan sebagai jamu-jamuan yang direbus untuk mengobati disentri atau diare yang disebabkan oleh sindrom iritasi pada usus besar, umbi teratai juga digunakan untuk pengobatan gonorrhoe, bisul dan tumor (Anonim 2004; Grieve 2004; Depkes 1997). Bagian umbi teratai banyak mengandung tanin, asam galat dan getah, pati, gum, resin, gula, amonia, asam tartarat dan fecula (Hughes 2004). Bagian bijinya memiliki khasiat meningkatkan fungsi hati dan limfa, memperbaiki stamina, membuat awet muda serta menyembuhkan diare dan disentri. Bagian biji mengandung alkaloid yaitu, nymphaeine (Raffauf 1970). Pada bagian biji juga mengandung pati, rafinosa, protein, lemak, kalsium, fosfor dan besi (CEMPAKA 2003).
Selain adanya tanin dan alkaloid yang berperan sebagai antibakteri, diduga ada komponen lain dari karbohidrat (78.13% dari umbi dan biji) yang berperan mencegah berlanjutnya diare, yaitu oligosakarida. Oligosakarida dengan rantai sisi manosa dapat menghalangi pelekatan mikroorganisme patogen (seperti E. coli, Helicobacter pylori dan Salmonella Typhimurium) pada dinding usus (Zopt & Roth 1996). Selain itu, pada perkembangan selanjutnya diketahui pula bahwa oligosakarida juga dapat berperan sebagai prebiotik yang dapat menstimulasi secara selektif pertumbuhan dan atau aktivitas flora di dalam usus besar, seperti
Lactobacillus dan atau Bifidobacterium. Lactobacillus dapat membantu ketahanan terhadap infeksi Salmonella, mencegah pelancong (orang yang bepergian) terkena diare dan membantu menghilangkan sindrom iritasi pada usus besar. Bifidobacterium dapat menstimulasi sistem imun, memproduksi vitamin B, menghambat pertumbuhan bakteri patogen, mereduksi kolesterol, dan mengurangi kembung akibat gas (Manning dan Gibson, 2004). Prebiotik dapat mencegah terjadinya inflammatory bowel disease yang timbul berkaitan dengan flora usus yang dapat menimbulkan diare dan muntah-muntah. Hasil penelitian Rushdi et al. (2004) menunjukkan bahwa pemberian diet yang diperkaya dengan serat pangan larut (guar gum) dapat menurunkan peristiwa diare pada pasien ICU yang menderita diare. Rushdi et al. (2004) menyimpulkan bahwa guar gum berperan sebagai prebiotik
sejumlah terbatas bakteri di dalam kolon, sehingga meningkatkan kesehatan inang. Substrat yang berasal dari makanan atau yang diproduksi oleh inang yang tersedia untuk difermentasi oleh mikroflora kolon, yaitu : resistant starch, polisakarida non pati (seperti pektin, selulosa, guar dan xylan), gula dan oligosakarida seperti laktosa, laktulosa, rafinosa, stakiosa dan frukto-oligosakarida (Manning & Gibson 2004). Komponen-komponen makanan tersebut berpotensi sebagai prebiotik
Berdasarkan temuan-temuan tersebut, dianggap perlu untuk melakukan kajian lebih lanjut tentang potensi biji dan umbi teratai sebagai pangan fungsional untuk antidiare dan prebiotik. Pada penelitian ini baik secara in vitro maupun in vivo dengan tikus percobaan, digunakan mikroba uji Escherichia coli
Enteropatogenik K1.1 (EPEC K1.1) penyebab diare yang diisolasi dari feses penderita diare. Bakteri strain ini menghasilkan protease ekstraseluler yang mampu mendegradasi mucin (Budiarti & Mubarik 2007) dan resisten terhadap antibiotik. Selain itu, digunakan juga Salmonella Typhimurium pada penelitian secara in vitro, dimana diketahui bakteri ini menyebabkan gastroenteritis (Karsinah et al. 1994; Goosney et al. 1999; Otshudi et al. 2000), atau disebut juga sindroma keracunan makanan. Menimbulkan gejala mual dan muntah, diikuti dengan nyeri abdomen, demam dan diare yang merupakan gejala yang paling menonjol (Karsinah et al. 1994).
B. Lingkup Penelitian
Lingkup penelitian meliputi tiga kajian, yaitu :
1. Ekstraksi biji dan umbi teratai dengan pelarut yang berbeda tingkat kepolarannya, diikuti dengan pengujian aktivitas antibakteri, analisis komponen fitokimia yang terdapat pada ekstrak, dan pemisahan masing-masing komponen untuk diuji aktivitas antibakterinya.
2. Ekstraksi fraksi karbohidrat yang terdapat pada biji dan umbi teratai yang berpotensi sebagai prebiotik, serta pengujian aktivitasnya secara in vitro
terhadap pertumbuhan bakteri asam laktat dan bifidobacterium.
konsumsi ransum, total bakteri asam laktat aerob dan anaerob pada sekum tikus percobaan, total E.coli, total mikroba pada isi sekum dan mukosa sekum, serta tinggi mukosa dan immunoglobulin A pada usus halus.
C. Tujuan Penelitian
Tujuan umum penelitian ini adalah meningkatkan potensi tanaman teratai sebagai sumber daya daerah yang tumbuh liar di rawa-rawa di Kalimantan Selatan, yaitu (1) sebagai sumber antimikroba dan prebiotik untuk mencegah diare, (2) sebagai sumber bahan pangan baru, (3) memanfaatkan atau memberi nilai tambah ekonomi. Secara rinci tujuan khusus dari penelitian ini adalah :
1. Mengukur aktivitas antibakteri ekstrak umbi dan biji teratai, baik terhadap bakteri patogen penyebab diare maupun bakteri yang menguntungkan. 2. Mengidentifikasi komponen fitokimia (alkaloid, tanin, saponin, flavonoid,
steroid) yang terdapat pada umbi dan biji teratai, dan mengevaluasi aktivitasnya sebagai antibakteri terhadap bakteri patogen penyebab diare. 3. Mengukur fraksi karbohidrat pada biji dan umbi teratai yang dapat
berfungsi sebagai prebiotik dan mengevaluasi secara in vitro aktivitas biologisnya.
4. Mengevaluasi secara in vivo (dengan tikus percobaan) aktivitas biologis dari tepung dan ekstrak biji atau umbi teratai dalam kaitannya sebagai pencegah diare dan sumber prebiotik.
5. Mengevaluasi potensi biji teratai dan ekstraknya sebagai imunomodulator dalam kaitannya dengan Imunoglobulin A di usus halus.
D. Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah :
1. Biji dan atau umbi teratai mengandung berbagai komponen antibakteri dan prebiotik
2. Tepung biji dan atau umbi teratai dapat mencegah diare.
II. TINJAUAN PUSTAKA
A.
Teratai
1. Tanaman Teratai
Secara taksonomi menurut Marianto (2001) teratai diklasifikasikan sebagai berikut :
Divisio : Spermathophyta (tumbuhan berbiji) Kelas : Monocotyl (tumbuhan berbiji tunggal) Ordo : Nymphales
Familia : Nymphaceae Genus : Nymphaea
Spesies : Nymphaea alba, N. odorata, N. tuberosa, N. pubescens, N. stellata, N. nouchali, dll.
Teratai termasuk tanaman keluarga Nymphaceae dan tergolong jenis tanaman yang berbunga sepanjng tahun. Famili Nymphaceae terdiri dari tujuh genus yaitu : Nymphaea (teratai), Nelumbo (lotus), Victoria (teratai raksasa),
Euryale, Nuphar, Barclaya dan Ondinea. Dari ketujuh genus tersebut, Nuphar, Barclaya dan Ondinae memiliki ciri dan sifat yang paling mencolok perbedaannya. Ketiga genus ini termasuk tanaman air penghasil oksigen. Seluruh bagian tanaman ini terendam di dalam air dan sering digunakan sebagai penghias akuarium serta biofilter air. Genus Nymphaea, Victoria dan Euryale memiliki kesamaan sifat yaitu daun dan bunganya tepat berada di atas permukaan air dan sering disebut sebagai tanaman air pinggir (marginalplant) karena memiliki akar dan batang yang terendam di dalam air (Don et al. 2000).
Sampai saat ini teratai yang tersebar di seluruh dunia diperkirakan ada 40 spesies dan 200 varietas. Teratai-teratai tersebut tersebar luas dan merata di seluruh dunia, mulai daerah gersang di Afrika hingga daerah dingin di Eropa. Habitat asli tanaman ini adalah rawa-rawa atau sungai yang tidak begitu dalam dan berair tenang. Teratai berkembang biak dengan bantuan alam, seperti angin, air ataupun serangga (Don et al. 2000).
memerlukan banyak sinar matahari dengan pH air netral sampai asam. Teratai memiliki akar yang kuat, panjang dan berumbi. Daunnya mengapung di atas air, bagian atas daun berwarna hijau tua, sedangkan bagian bawahnya berwarna ungu kemerahan. Bentuk daun bundar dengan diameter antara 9-12 cm. Bagian tepi daun melipat. Daunnya mempunyai tangkai yang disebut petiola.
Van Steenis, seorang ahli botani berkebangsaan Belanda menemukan tiga jenis spesies teratai asli Indonesia yaitu N. pubescens, N. stellata, N. nouchali
(Marianto 2001). Teratai tersebut banyak tersebar di daerah rawa-rawa dan sungai di Pulau Jawa dan Kalimantan.
2.
Biji
Teratai
Tidak semua jenis teratai bisa dimanfaatkan bijinya (Marianto 2001). Hanya teratai yang berbunga putih dengan tepi daun bergerigi yang dapat dimanfaatkan bijinya. Teratai ini hanya mekar di pagi dan sore hari, masyarakat sering menyebutnya dengan “Lumbu”. Bunga teratai akan menghasilkan buah yang bundar dengan diameter sekitar 4-12 cm. Biji buah berwarna coklat kehitaman dan tersimpan dalam daging buah. Biji ini memiliki kulit ari yang keras. Biji yang sudah tua dan kering dapat diolah menjadi tepung teratai atau dimasak seperti menanak nasi (Khairina dan Fitrial 2002).
Biji teratai putih yang biasanya dijadikan bahan makanan berasal dari spesies Nymphaea pubescens. Di daerah Hulu Sungai Utara, Kalimantan Selatan biji teratai biasanya dijadikan tepung sebagai bahan membuat kue (Khairina dan Fitrial 2001). Menurut Sastrapradja dan Bimantoro (1981) di Filiphina dan India biji teratai dijadikan tepung untuk pembuatan roti. Di daerah Tuban, Jawa Timur biji teratai dijadikan dodol atau jenang yang dicampur dengan beras ketan.
menghilangkan kulit luarnya yang berwarna hitam, biji tersebut harus ditumbuk. Di daerah Hulu Sungai Utara Kalimantan Selatan biasanya menggunakan gilingan padi untuk menghilangkan kulit luarnya.
Menurut Khairina dan Fitrial (2002), produksi biji teratai putih dapat dihitung berdasarkan jumlah biji kering yang diperoleh dari buah yang sudah tua. Dari setiap rumpun teratai diperoleh rata-rata 5.3 buah teratai tua yang menghasilkan 63.10 gram biji teratai kering. Meskipun produksi satu rumpun teratai hanya 63.10 g biji teratai, jika dilihat dari luasnya daerah rawa di Kalimantan Selatan (800 000 Ha) sangat memungkinkan biji teratai tersebut dijual di pasar tradisional sebagai bahan untuk membuat kue dengan harga yang tidak berbeda dengan beras.
3. Sifat Kimia dan Fisika Tepung Biji Teratai
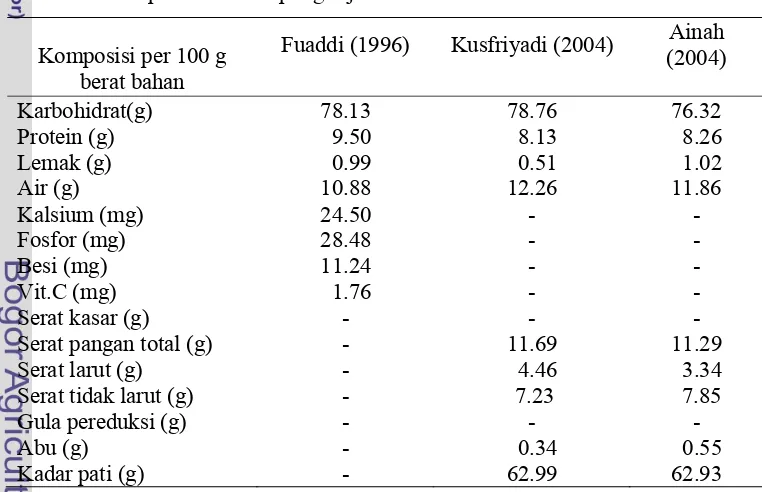
Komposisi kimia biji teratai bervariasi tergantung pada spesies, tempat tumbuh serta musim. Berdasarkan hasil penelitian terdahulu kandungan zat gizi tepung biji teratai dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia tepung biji teratai
Komposisi per 100 g berat bahan
Fuaddi (1996) Kusfriyadi (2004) Ainah (2004)
Karbohidrat(g) 78.13 78.76 76.32
Protein (g) 9.50 8.13 8.26
Lemak (g) 0.99 0.51 1.02
Air (g) 10.88 12.26 11.86
Kalsium (mg) 24.50 - -
Fosfor (mg) 28.48 - -
Besi (mg) 11.24 - -
Vit.C (mg) 1.76 - -
Serat kasar (g) - - -
Serat pangan total (g) - 11.69 11.29
Serat larut (g) - 4.46 3.34
Serat tidak larut (g) - 7.23 7.85
Gula pereduksi (g) - - -
Abu (g) - 0.34 0.55
Berdasarkan Tabel 1 terlihat biji teratai memiliki kandungan gizi yang baik, yaitu karbohidrat dan protein yang tinggi, tetapi lemaknya rendah. Hal ini sangat memungkinkan biji teratai sebagai sumber pangan baru yang bisa dikembangkan potensinya. Serat pangan yang tinggi dengan kandungan serat larut yang tinggi memungkinkan biji teratai sebagai sumber serat pangan. Demikian pula dengan kandungan gula pereduksi yang tinggi, memungkinkan biji teratai berpotensi sebagai prebiotik
Tepung biji teratai mengandung asam amino dan asam lemak dengan komposisi seperti terlihat pada Tabel 2.
Tabel 2. Komposisi asam amino dan asam lemak esensial tepung biji teratai Zat Gizi Jenis Kadar (% bb)
Asam amino non-esensial
Arginin 1.00 Aspartat 0.55 Glutamat 1.40 Serin 0.50 Glisin 0.26 Alanin 0.44
Asam amino
esensial
Histidin 0.16 Threonin 0.27 Tyrosin 0.21 Methionin 0.14 Valin 0.46 Fenilalanin 0.46 Isoleusin 0.37 Leusin 0.72 Lysin 0.17 Arginin 1.00
Asam lemak
Linoleat 18.34 Linolenat 0.81 Miristat 0.30 Palmitat 9.27 Stearat 14.36 Oleat 5.88 Sumber : Khairina dan Fitrial (2002)
Sifat-sifat fisik dari tepung biji teratai dapat dilihat pada Tabel 3. Berdasarkan ukuran granula pati (Tabel 3), granula pati biji teratai hampir sama ukurannya dengan granula pati beras yaitu 3-8 μm (Swinkels 1985).
Tabel 3. Sifat fisik dari tepung biji teratai
Sifat Fisik Nilai
a
Nilaib
Suhu gelatinisasi pati (°C) 74-80 74.5-80
Derajat putih (%) 33.18 47.7
Densitas Kamba (g/ml) 0.613 0.625
Sudut repos (derajat) 23.8 29.1
Ukuran granula pati (μm) - 1.5-12 (rata-rata 4)
Bentuk granula - Poligonal
Sumber: aAinah (2004)
b Kusfriyadi (2004)
4. Umbi Teratai
Menurut Marianto (2001), umbi teratai yang tampaknya tidak berguna ternyata memiliki beberapa khasiat obat. Ada dua macam umbi teratai yang bisa digunakan, yaitu umbi dari teratai merah dan putih. Umbi teratai putih lebih banyak mengandung zat tepung dibandingkan yang merah. Tepung yang rasanya agak manis tersebut jika dimasak terlebih dahulu akan membantu sistem pencernaan karena dapat memperkuat sistem kerja lambung, selain itu dapat memperlancar air seni dan menjaga elastisitas pembuluh darah. Tepung mentahnya digunakan untuk obat sariawan.
Umbi teratai banyak mengandung pati, protein, asparagin, vitamin C, katekol dan senyawa kimia lainnya (CEMPAKA 2003). Di Eropa, bagian umbi dari teratai jenis Nymphaea odorata digunakan sebagai astringent, obat disentri, diare, gonorrhoea dan leucorrhoea (Grieve 2004). Umbi dari spesies Nymphaea alba digunakan untuk mengobati disentri atau diare yang disebabkan oleh iritasi sindrom usus besar, dimana umbi tersebut mengandung alkaloid (nymphaeine dan nupharine), resin, glikosida dan tanin (Anonim 2004).
Menurut Depkes (1997) spesies Nymphaea alba (terate putih) yang bagian umbinya mengandung alkaloid dapat digunakan sebagai obat disentri dengan cara menumbuk halus umbi yang sudah bersih kemudian diseduh dengan segelas air matang panas, didinginkan dan disaring, hasil saringan diminum sekaligus.
Di Cina, umbi teratai jenis Lotus (Lianngau, Ou)(Nelumbo nucifera) telah dijadikan makanan lebih dari 3000 tahun yang lalu. Kapasitas produksi umbi
memproduksi umbi Lotus selain Cina adalah Jepang, Taiwan dan Korea Selatan. Taiwan dan Cina mengekspor umbi tersebut ke Jepang. Selain sebagai bahan obat-obatan (Cina), umbi Lotus ini memiliki keistimewaan karena kandungan kalsium dan kalium yang tinggi, yaitu 17.0-18.0 mg/100g umbi dan 350.0-470.0 mg/100 g umbi. Selain itu kandungan vitamin C yang tinggi yaitu 37.0-55.0 mg/100 g umbi.
B. Anti-Diare
Diare merupakan perubahan kebiasaan normal usus yang dicirikan dengan kehilangan cairan dalam jumlah besar dan feses yang berair (Brody 1999). Diare yang disertai pusing, muntah dan sakit perut serta buang air yang mengeluarkan nanah dan darah disebut disentri. Gejala penyakit tersebut biasanya muncul dalam 2-3 hari setelah terinfeksi dan berakhir sampai beberapa minggu. Akibatnya adalah terjadinya dehidrasi yang cepat, terutama pada anak-anak dan dapat menyebabkan kematian jika tidak diberi pengobatan. Diare dapat disebabkan oleh infeksi virus, keracunan makanan dan ‘diare pelancong’ akibat mengkonsumsi makanan dan minuman yang terkontaminasi organisme seperti bakteri dan parasit.
Berdasarkan mekanisme terjadi diare, Bowen (2001), membagi diare menjadi empat jenis, yaitu diare osmotik, diare sekretori, diare inflamatori dan infeksi dan diare yang dikaitkan dengan pengacauan motilitas.
Diare osmotik disebabkan oleh dua hal berikut : (1) konsumsi makanan yang tidak mudah diserap usus seperti karbohidrat (manitol, sorbitol), garam Epson (MgSO4) dan antacid (MgOH2), (2) malabsorpsi yaitu ketidakmampuan untuk menyerap sejumlah karbohidrat seperti lactose intolerance (suatu kondisi dimana epitel usus kekurangan enzim laktase), akibatnya laktosa (biasanya terdapat pada susu) tidak dapat dihidrolisis menjadi glukosa dan galaktosa untuk diserap. Laktosa tertahan di lumen usus, laktosa tersebut menahan air, akibatnya akan masuk ke usus besar. Di usus besar terjadi fermentasi oleh mikroba kolon menghasilkan gas yang berlebih. Diare osmotik ini berhenti jika penderita dipuasakan atau berhenti mengkonsumsi makanan yang sulit diserap.
tumor (seperti vasoactive intestinal peptide), obat-obatan (seperti obat asma, antidepresi dan obat jantung), sejumlah logam, toksin organik dan produk tanaman (seperti arsen, insektisida, toksin jamur dan kafein). Air dalam volume besar secara normal akan disekresi ke dalam lumen usus halus, air ini secara efisien diserap sebelum mencapai kolon. Diare terjadi jika sekresi air ke dalam lumen usus halus melebihi penyerapan. Sebagai contoh toksin cholera yang dihasilkan oleh V. cholera, dimana toksin ini mengaktifkan adenylyl cyclase, mengakibatkan meningkatnya konsentrasi intraseluler cAMP (cyclic adenosine
5’-monophosphate) di dalam sel crypt usus. Perubahan ini menyebabkan terbukanya saluran Cl- dalam waktu lama, dimana saluran ini merupakan instrumen untuk sekresi air dari crypt. Akibatnya, sekresi air menjadi tidak terkontrol. Selain itu toksin cholera juga mempengaruhi sistem syaraf yang merangsang sekresi secara independen.
Diare inflamatori dan infeksi disebabkan oleh rusaknya sel epitel usus yang disebabkan oleh mikroba atau virus patogen. Kerusakan ini tidak hanya menyebabkan keluarnya serum dan darah ke lumen tetapi juga kerusakan penyerapan oleh sel epitel. Penyerapan air menjadi sangat tidak efisien dan menghasilkan diare. Beberapa patogen yang sering dikaitkan dengan diare ini adalah bakteri (Salmonella, E.coli, Campylobacter), virus (rotavirus, coronavirus, norovirus) dan protozoa (Cryptosporium, Giardia). Respon imun terhadap kondisi inflamasi pada saluran pencernaan berperan terhadap perkembangan diare. Pengaktifan sel-sel darah putih mengakibatkan sel tersebut mensekresi mediator inflamasi dan cytokine yang dapat menstimulasi sekresi. Reactive oxygen species
dari sel darah putih dapat merusak atau membunuh sel-sel epitel usus. Sel-sel yang rusak tersebut digantikan oleh sel-sel immature yang kekurangan enzim dan pengangkut yang diperlukan saat penyerapan nutrisi dan air. Pada kondisi ini dapat pula terjadi diare osmotik.
1. Anti-diare dari bahan alam
Dewasa ini banyak hasil penelitian yang mengungkap secara ilmiah aktivitas dari bahan alam yang oleh masyarakat dijadikan sebagai obat diare. Aguwa dan Lawal (1988) meneliti ekstrak daun Calliandra portoricensis yang dikenal masyarakat sebagai antidiare dan anti-ulcer (luka/borok pada dinding usus). Hasil analisis fitokimia diketahui bahwa ekstrak daun tersebut mengandung tanin, flavonoid, saponin dan glikosida. Aguwa dan Lawal (1988) menduga aktivitas daun tersebut sebagai anti-ulcer karena kandungan tanin atau saponinnya yang tinggi. Selain itu, daun C. portoricensis juga memiliki aktivitas antimikroba, baik pada ekstrak air maupun ekstrak etanol yaitu dapat menghambat pertumbuhan E. coli, S.aureus dan S. faecalis, yang menunjukkan efektif sebagai agen untuk terapi pada gangguan pencernaan yang disebabkan oleh mikroorganisme.
Offiah dan Chikwendu (1999) melakukan analisis terhadap ekstrak air dari daun Ocium gratissimum yang diketahui memiliki aktivitas antidiare. Ekstrak tersebut dapat menghambat diare yang disebabkan oleh minyak jarak pada tikus percobaan yang ditunjukkan dengan berkurangnya feses berair pada tikus yang diberi ekstrak. Hasil uji fitokimia menunjukkan bahwa komponen utama ekstrak daun tersebut adalah tanin, steroid, triterpenoid dan karbohidrat.
Adzu et al. (2003) melakukan analisis terhadap kulit batang Zizyphus spinachristi (famili Rhamnaceae) yang dikenal masyarakat Nigeria utara sebagai antidiare. Ekstrak metanol dari kulit batang Zizyphus spinachristi menunjukkan aktivitas antidiare terhadap tikus percobaan yang diinduksi minyak jarak (menyebabkan tikus diare). Hasil uji fitokimia menunjukkan bahwa kulit batang
Zizyphus spinachristi mengandung glikosida, resin, saponin dan tanin.
Otshudi et al.(2000) melakukan seleksi terhadap enam spesies tanaman obat yang oleh masyarakt Desa Lomela, Republik Rakyat Kongo diketahui memiliki aktivitas antidiare dan disentri. Bagian tanaman yang memiliki aktivitas antidiare dan antidisentri adalah kulit akar dan daun Epinetrum villosum (Menispermaceae), kulit akar Roureopsis obliquifoliolata (Connaraceae), kulit batang dan kulit akar
Croton mubango (Euphorbiaceae), kulit batang dan kulit akar Cissus rubiginosa
(Vitaceae), daun dan kulit akar Vernonia amygdalina (Asteraceae) dan kulit akar
gula pereduksi. Hanya Epinetrum villosum yang mengandung alkaloid dan hanya
Epinetrum villosum dan Quassia africana yang tidak mengandung flavonoid. Sementara itu, dari ke enam tanaman tersebut tiga jenis (Epinetrum villosum, Roureopsisobliquifoliolata dan Cissus rubiginosa ) memiliki aktivitas antibakteri dan dua lainnya (Vernonia amygdalina dan Epinetrum villosum) sebagai anti-amuba yaitu Entamoeba histolytica.
Atta dan Mouneir (2004) melakukan analisis terhadap 6 jenis tanaman obat Egyptian yang dikenal masyarakat memiliki aktivitas antidiare. Hasil uji fitokimia menunjukkan bahwa komponen utamanya adalah tanin, flavonoid, sterol tidak jenuh/triterpen, karbohidrat, laktone dan protein/asam amino. Sedikit saponin terdapat pada Mentha microphylla, Conyza dioscoridis, Alhagi maurorum. Alkaloid dan anthraquinone tidak ditemukan pada semua ekstrak metanol tanaman yang dianalisis.
Aniagu et al. (2005) melakukan analisis terhadap akar Guiera senegalensis dimana di Nigeria Utara dikenal sebagai tanaman obat yang secara tradisional digunakan untuk mengobati diare dan disentri. Ekstrak air dari akar Guiera senegalensis memiliki aktivitas anti-ulcer pada tikus percobaan yang diinduksi dengan etanol sehingga terjadi luka pada pencernaan tikus percobaan. Aktivitas ekstrak maksimal adalah 100 mg/kg dan memiliki penghambatan 100% terhadap diare pada tikus percobaan yang diinduksi dengan minyak jarak. Komponen fitokimianya yang utama adalah tanin.
Biji atung (Parinarium glaberimum Hassk) oleh masyarakat dibeberapa daerah di Indonesia selain digunakan sebagai pengawet juga dijadikan sebagai obat diare (Heyne 1987). Biji atung ini memiliki aktivitas antimikroba dengan spektrum yang luas, baik terhadap bakteri Gram positif maupun Gram negatif. Komponen aktif utama pada biji atung adalah tanin dan flavonoid (Adawiyah
1998). 6. Komponen aktif anti-diare dari bahan alam
(a) Tanin
seperti : kulit batang, kayu, daun, buah dan akar. Tanin dibagi menjadi dua grup, yaitu tanin terkondensasi dan tanin terhidrolisis (Harborne 1987). Tanin terkondensasi atau flavolan secara biosintesis dapat dianggap terbentuk dengan cara kondensasi katekin tunggal yang membentuk senyawa dimer kemudian oligomer yang lebih tinggi. Tanin terhidrolisis terutama terdiri atas dua kelas yaitu depsida galoilglukosa. Pada senyawa ini, intinya berupa glukosa dikelilingi lima gugus ester galoil atau lebih. Pada kelas kedua, inti molekul berupa senyawa dimer asam galat, yaitu asam heksahidroksidifenat, yang juga berikatan dengan glukosa.
Tanin dan asam tanin mendenaturasi protein melalui pembentukan komplek (protein-tannate), kompleks tersebut membentuk lapisan pada mukosa usus dan membuatnya lebih tahan sedangkan sekresi gastrik berkurang secara simultan (Aniagu et al. 2005). Tanin, pada konsentrasi rendah dapat membuat lapisan pada permukaan lambung sehingga kurang permiabel dan lebih tahan terhadap kerusakan kimia atau mekanik atau iritasi (Aguwa & Lawal (1988); Otshudi et al. 2000). Tanin juga menyebabkan ‘vasocontriction’ lokal pembuluh darah mukosa usus dan akibatnya dapat mereduksi jumlah sekresi asam lambung oleh mukosa (Ramstad 1969 di dalam Aguwa dan Lawal 1988). Selain itu tanin juga memiliki aktivitas sitotoksik dan antineoplastik (Otshudi et al. 2000).
(b) Flavonoid
Flavonoid adalah senyawa fenolik hidroksilasi yang terbentuk dari unit C6-C3 yang terikat dengan cincin aromatik. Pada tumbuhan, flavonoid disintesis sebagai respon terhadap infeksi mikrobia. Aktivitas antimikroba flavonoid disebabkan kemampuannya untuk membentuk komplek dengan protein ekstraseluler dan protein terlarut, membentuk komplek dengan dinding sel bakteri. Flavonoid yang bersifat lebih lipofilik juga dapat merusak membran mikrobia (Cowan 1999).
dan radikal bebas (Aniagu et al. 2005). Ekstrak etanol Gentianopsis paludosa
yang mempunyai aktivitas antidiare, mengandung flavonoid yang berperan menghambat kontraksi pada ileum melalui campur tangan pada pergerakan Ca2+ dengan menghambat influx Ca2+ ekstraseluler dan membebaskan Ca2+ intraseluler (Wang et al. 2005).
Ekstrak tanaman yang mengandung flavonoid diketahui dapat memodifikasi produksi siklo-oksigenase 1 dan 2 (COX-1, COX-2) dan lipo-oksigenase (LOX) sehingga menghambat produksi prostaglandin (Agunu et al. 2005).
Aktivitas enzim COX-1 berhubungan dengan pembentukkan prostaglandin yang diperlukan untuk perlindungan saluran pencernaan dari kejadian ulcerative
sedangkan COX-2 bertanggungjawab dalam meningkatkan sintesis prostaglandin yang berhubungan dengan respon peradangan berupa demam dan rasa sakit. Prostaglandin E2 (PGE2) merupakan mediator peradangan spesifik yang terlibat dalam proses peradangan. Pada penelitian menggunakan castor oil untuk menstimulasi timbulnya diare non spesifik pada tikus percobaan mengakibatkan meningkatnya konsentrasi PGE2 vena portal. Castor oil membebaskan asam ricinolat yang menyebabkan perubahan cairan mukosa dan transport elektrolit pada mukosa sehingga menimbulkan sekresi yang berlebihan dan diare. Asam ricinolat ini menandakan meningkatnya kandungan PGE2 pada lumen dan menyebabkan peningkatan sekresi air dan elektrolit ke dalam usus halus. Penghambatan biosintesis prostaglandin berarti menunda diare akibat castor oil.
Pada ekstrak etanol Butea monosperma secara nyata mengurangi gejala diare melalui penghambatan PGE2 yang diketahui menyebabkan akumulasi cairan pada usus (enteropooling) dan motilitas saluran pencernaan (Gunakkunru et al.
2005). Agunu et al. 2005 menyimpulkan bahwa mekanisme anti diare suatu tanaman obat dapat melalui aktivitas antimikroba yang terkandung di dalam tanaman tersebut atau melalui penghambatan prostaglandin.
(c) Alkaloid
Alkaloid yang terdapat pada tanaman teratai dari genus Nymphaea adalah
Nymphaeine (C14H23NO2, BM = 237,35)(Raffauf 1970).
Alkaloid memiliki aktivitas mikrobiosidal (termasuk terhadap spesies
Giardia dan Entamoeba), terutama adalah efek anti diare, pengaruhnya diduga pada waktu transit di dalam usus halus (Cowan 1999). Mekanisme alkaloid seperti berberine dan harmane terhadap trypanosome dan plasmodia adalah karena kemampuannya mengkelat DNA.
(d) Triterpenoid dan steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu : skualena. Senyawa ini berstruktur siklik, kebanyakan berupa alkohol, aldehida atau asam karboksilat. Triterpenoid dapat dibagi menjadi empat golongan senyawa : triterpena sebenarnya, steroid, saponin dan glikosida jantung (Harborne 1987). Dua golongan yang terakhir sebenarnya triterpena atau steroid yang terdapat sebagai glikosida. Terpena umumnya memiliki struktur kimia C10H16 dan dapat terbentuk sebagai diterpena, triterpena dan tetraterpena (C20, C30 dan C40). Jika mengandung oksigen disebut terpenoid (Cowan 1999).
Terpena atau terpenoid memiliki aktivitas antibakteri. Mekanisme antibakteri dari terpena tidak sepenuhnya diketahui, akan tetapi diduga senyawa ini bekerja pada pengrusakan membran oleh senyawa lipofilik. Adanya penambahan senyawa metil pada diterpenoid menjadikan diterpenoid lebih hidrofililk yang dapat mengurangi aktivitas antimikrobanya (Cowan 1999).
Menurut Aguwa dan Lawal (1988), saponin terutama triterpen menunjukkan
anti-ulcer melalui pembentukan perlindungan terhadap mukus permukaan mukosa usus. Menurut Otshudi et al. (2000), saponin memiliki aktivitas ekspektoran dan antitusif.
Glikosida (berupa heksosa, hexosamin, fukosa dan asam sialik) yang terdapat pada akar tanaman Hemidesmus indicus dapat menghambat pelekatan
C. Prebiotik
Prebiotik adalah bahan pangan yang tidak dicerna yang memiliki efek menguntungkan terhadap inang melalui stimulasi secara selektif pertumbuhan dan/atau aktivitas satu atau dalam jumlah terbatas bakteri di dalam kolon, sehingga meningkatkan kesehatan inang (Gibson & Roberfroid 1995).
Menurut Manning dan Gibson (2004), substrat yang berasal dari makanan atau yang diproduksi oleh inang yang tersedia untuk difermentasi oleh mikroflora kolon, yaitu : yang melalui makanan, resistant starch, polisakarida non pati (seperti pektin, selulosa, guar dan xylan), gula dan oligosakarida seperti laktosa, laktulosa, rafinosa, stakhiosa dan frukto-oligosakarida. Senyawa yang diproduksi oleh inang seperti glikoprotein mucin yang diproduksi oleh sel goblet di dalam epitelium kolon yang merupakan senyawa endogenous yang difermentasi di dalam kolon. Protein dan peptida yang berasal dari makanan, hasil sekresi pankreatik atau diproduksi oleh bakteri juga tersedia meskipun jauh lebih kecil dibandingkan karbohidrat.
Menurut Ziemer dan Gibson (1998), beberapa sifat karbohidrat yang tidak dapat dicerna yang diklaim memiliki efek fungsional terhadap kesehatan antara lain: menunda pengosongan lambung, memodulasi waktu transit pada sistem pencernaan, meningkatkan toleransi terhadap glukosa, mereduksi penyerapan lemak dan kolesterol, meningkatkan volume dan kemampuan membawa air dari kandungan usus dan memodulasi fermentasi mikroba dengan meningkatkan produksi asam lemak ranta pendek, menurunkan pH dan produksi amonia. Kombinasi dari efek fungsional tersebut menghasilkan peningkatan kesehatan inang dengan menurunnya gangguan pada usus (konstipasi dan diare), penyakit kardiovaskuler dan kanker usus.
menstimulasi pertumbuhan dan atau aktivitas satu atau sejumlah terbatas bakteri yang menguntungkan di dalam kolon seperti Bifidobakteria.
Makanan yang kaya serat pangan adalah sayur-sayuran, buah-buahan, serealia dan polong-polongan (Gibson 2004). Pektin, hemiselulosa, guar gum dan inulin mudah larut dalam air sehingga membentuk gel di dalam saluran pencernaan. Hal ini membantu fermentasi oleh mikroflora usus karena meningkatnya luas permukaan yang tersedia untuk diserang oleh enzim. Sifat fermentasi dari serat yang berbeda tergantung pada sifat-sifat fisikokimianya. Ukuran partikel serat dan tingkat kelarutan memiliki efek terhadap kemampuan serat untuk difermentasi oleh bakteri
Schneeman (1999) membuat pembandingan antara serat pangan, inulin dan oligofruktosa berdasarkan fungsinya pada sistem pencernaan (Tabel 4).
Tabel 4. Persamaan dan perbedaan serat pangan, inulin dan oligofruktosa Karakteristik Serat pangan
Inulin dan Oligofruktosa
Dispersibilitas dalam air Beberapa polisakarida dapat terdispersi di
dalam air Larut dalam air
Bulk Tidak dicerna di dalam usus halus Tidak dicerna di dalam usus halus
Viskositas Beberapa polisakarida menjadi viscous di
dalam air Tidak bersifat viscous Menjerab/mengikat asam
empedu
Beberapa sumber serat akan mengikat atau menjerab asam empedu dan meningkatkan eksresinya
Tidak mengikat asam empedu
Dapat difermentasi Polisakarida yang memiliki kemampuan mengikat air yang tinggi dapat difermentasi
Sangat mudah difermentasi
1. Oligosakarida sebagai prebiotik
Menurut Bornet et al. (2002) oligosakarida memiliki tingkat polimerisasi di bawah 9. Jenis-jenis oligosakarida bahan alam yang berperan sebagai prebiotik (Gibson 2004), antara lain adalah :
(a) Inulin dan frukto-oligosakarida (FOS).
FOS rantai pendek adalah grup linier glukosil α(1→ 2)(fruktosil)n β (2→ 1) fruktosa dengan derajat polimerisasi pada kisaran 1 sampai 5 (Bornet et al. 2002). FOS rantai pendek secara alami terdapat pada bawang, jerusalem artichoke, asparagus, gandum, gandum hitam dan bawang putih. Bawang memiliki kandungan FOS tertinggi (25-40% berat kering) dimana 97 %-nya adalah fruktooligosakarida rantai pendek (n<5). FOS resisten terhadap α–amilase, sukrase dan maltase mamalia (Spiegel et al. 1994). FOS tersebut tidak dapat dicerna oleh manusia tetapi dapat dimanfaatkan secara selektif oleh bakteri gram positif seperti Bifidobakteria.
Studi fermentasi secara in vitro menggunakan inokulum fecal menunjukkan bahwa inulin dan oligofruktosa dimanfaatkan secara cepat dan menyeluruh oleh mikroflora usus dan tingkat polimerisasi substrat mempengaruhi kecepatan fermentasi. Inulin dan oligofruktosa merupakan substrat yang efisien untuk pertumbuhan strain Bifidobakteria dibandingkan dengan glukosa (Rao 1999). Studi dengan manusia juga menunjukkan bahwa konsumsi inulin dan oligofruktosa dapat meningkatkan Bifidobakteria (Hond et al. 2000).
Menurut Rao (2001) konsumsi oligosakarida (5 g/hari) selama 11 hari menghasilkan peningkatan jumlah Bifidobakteria dan tidak ada peningkatan setelah 10 hari berikutnya. Pada dua minggu setelah penghentian konsumsi oligofruktosa, jumlah Bifidobakteria menurun hampir sama dengan periode sebelum pemberian oligofruktosa. Hasil penelitian Campbell et al. (1996) menunjukkan bahwa pemberian 6% oligosakarida pada ransum selama 14 hari dapat meningkatkan Bifidobakteria cecal dan total bakteri anaerob pada tikus percobaan. Demikian pula dengan hasil penelitian Le Blay et al. (1999) dimana pemberian 9 g/100 g FOS pada pakan tikus percobaan, setelah 2 minggu dapat meningkatkan konsentrasi total bakteri penghasil asam laktat dan Lactobacillus
sp.
(b) Oligosakarida kedelai.
coli. Rafinosa yang diberikan pada sukarelawan sebesar 15 g per hari menghasilkan peningkatan Bifidobakteria secara nyata dan menurunkan
Bacteroides spp. dan Clostridium spp. (Benno et al. (1987) di dalam Gibson & Angus 2000). Campuran rafinosa dan stakhiosa secara nyata juga dapat meningkatkan Bifidobakteria (Hayakawa et al. (1990) di dalam Gibson & Angus 2000).
Jenis-jenis oligosakarida sintetik yang berperan sebagai prebiotik (Gibson 2004), antara lain : galakto-oligosakarida, laktosukrosa, isomalto-oligosakarida, gluko-oligosakarida, xilo-oligosakarida.
(a) Galakto-oligosakarida.
Galakto-oligosakarida adalah oligosakarida yang mengandung galaktosa dengan bentuk Glu α1-4[βGal 1-6]n , dimana n=2-5, dan diproduksi dari sirup laktosa menggunakan aktivitas trans-galaktosilase dari enzim β-galaktosidase (b) Laktosukrosa.
Laktosukrosa dihasilkan dari campuran laktosa dan sukrosa meng- gunakan enzim β-fruktofuranosidase dan ditemukan mampu menstimulasi
bifidogenik pada kultur murni. (c) Isomalto-oligosakarida (IMO).
Isomalto-oligosakarida tersusun dari monomer glukosa yang diikat oleh
α1-6 glukosidik. IMO berasal dari pati melalui dua tahapan proses enzimatik (Rastall 2000). Pertama, pati dihidrolisis menjadi malto-oligosakarida oleh kombinasi α-amilase dan pullulanase. Selanjutnya, dengan menggunakan α -glukosidase yang mengkatalisis reaksi transfer sehingga merubah ikatan α(1→4) malto-oligosakarida menjadi α(1→6) isomalto-oligosakarida. Glukosa dipisahkan dengan kromatografi sehingga dihasilkan produk dengan kandungan oligosakarida yang tinggi.
(d) Gluko-oligosakarida.
(e) Xilo-oligosakarida (XOS).
Xilo-oligosakarida adalah rantai dari molekul xilosa yang diikat oleh ikatan
β1-4 dan terutama terdiri dari xilobiosa, xilotriosa dan xilo-tertraosa.
2. Manfaat Prebiotik
Manfaat prebioktik menurut Gibson dan Roberfroid (1995), antara lain : (1) Efek terhadap patogen.
Prebiotik meningkatkan ketahanan terhadap patogen melalui peningkatan Bifidobakteria dan lactobacilli (Gibson & Roberfroid 1995). Asam laktat yang diekskresi oleh bakteri tersebut diketahui memiliki sifat penghambatan. Produk akhir metabolik seperti asam yang dieksresi oleh bakteri tersebut dapat menurunkan pH hingga tingkat yang rendah dimana patogen secara efektif berkompetisi. Beberapa spesies lactobacilli dan Bifidobakterial dapat mengeksresi antibiotik alami yang memiliki spektrum aktivitas yang luas. Bifidobakteria dapat mengeksresi senyawa antimikroba dengan spektrum aktivitas yang luas (Gibson & Wang 1994).
Bifidobakteria ini juga memiliki efek antagonis terhadap E. coli 0157 (Ziemer & Gibson 1998). Efek penghambatannya bervariasi pada spesies bifidobakteria, dimana Bifidobacterium infantis dan B. longum yang paling besar efeknya terhadap E. coli.
FOS mempengaruhi homeostatis sel-sel di dalam dinding usus (Tomasik dan Tomasik 2003). Aktivitas imunomodulasi dan bakteriostatik mungkin menghasilkan pemblokan reseptor untuk berinteraksi dengan bakteri patogen. Menurut Zopt dan Roth (1996), oligosakarida dengan rantai sisi manosa menghalangi pelekatan E. coli pada dinding usus. Hasil penelitian dengan memberikan frukto-oligosakarida dan inulin ke tikus percobaan dapat melindungi tikus terhadap patogen sistemik dan enterik dan penyebab tumor (Buddington et al. 2002).
kalsium di dalam usus. Akibatnya terjadi peningkatan penyerapan kalsium secara pasif berdasarkan gradien konsentrasi (Ouwehand et al. 2005) (ii) Fitat adalah komponen tanaman yang dapat mencapai kolon, yang juga dapat membentuk komplek dengan kation divalen yang tidak larut dan stabil seperti kalsium yang membuatnya tidak tersedia untuk ditransport. Fermentasi fitat oleh bakteri di kolon dapat membebaskan kalsium. (iii) Kalsium mengubah mekanisme di dalam kolon. Pada sistem ini, asam lemak rantai pendek masuk ke dalam kolon dalam bentuk proton dan kemudian berdisosiasi di dalam lingkungan intraseluler. Proton yang dibebaskan kemudian disekresi ke dalam lumen untuk menukar ion kalsium. Menurut Greger (1992) prebiotik dapat meningkatkan penyerapan kalsium dari kolon dan menurunkan kehilangan kalsium dari tulang.
(3) Melindungi terhadap kanker kolon.
Sedikitnya ada dua mekanisme perlindungan dari prebiotik terhadap perkembangan kanker kolon, yaitu : (i) produksi metabolit yang bersifat protektif. Butirat merupakan produk akhir dari fermentasi yang diketahui dapat menstimulasi apoptosis dalam cell line kanker kolon dan juga berperan sebagai bahan bakar untuk kesehatan sel-sel kolon. Mikroflora yang memproduksi butirat di dalam usus adalah Clostridia dan Eubacteria. Pada perkembangannya diketahui prebiotik dapat menstimulasi Eubacteria yang tidak berbahaya, bukan
Clostridia (toksik). (ii) prebiotik akan menyebabkan metabolisme bakterial di dalam kolon menghasilkan produk akhir yang tidak berbahaya.
(4) Efek imunologi.
Bakteri asam laktat diketahui menstimulasi mekanisme inang non-spesifik dan sejumlah tipe sel yang terlibat dalam respon imun spesifik. Seperti
Gambar 1. Mekanisme peranan prebiotik (Ouwehand et al. 2005). (Garis penuh menunjukkan peranan yang sudah pasti, garis putus-putus menunjukkan peranan yang masih spekulasi).
D. Beberapa Bakteri Penyebab Diare
1. Escherichia coli
Escherichia coli (E.coli) merupakan spesies dari genus Escherichia yang bersifat motil, berbentuk batang, gram negatif, termasuk dalam famili
Enterobacteriaceae dan suku Escherichia (Nataro & Kaper 1998). E.coli
merupakan flora normal usus besar dan bersifat anaerob fakultatif.
Menurut modifikasi bagan Kauffman, serotipe E.coli dibagi berdasarkan profil antigen permukaan O (somatic), H (flagellar) dan K (capsular)-nya (Nataro & Kaper 1998). Totalnya ada 170 antigen O yang berbeda dimana masing-masing didefinisikan sebagai satu serogrup. Analisis serotipe ini yang dijadikan faktor virulensi spesifik untuk identifikasi strain E.coli penyebab diare. Antigen O dan K merupakan polisakarida yang melindungi mikroba dari efek bakterisidal dari komplemen dan sel pagosit pada kondisi tidak adanya antibodi spesifik (Gross 1995). Nataro dan Kaper (1998) membagi E.coli penyebab diare menjadi 6 strain, yaitu enteropathogenic E.coli (EPEC), enterotoxigenic E.coli (ETEC),
Prebiotik
Mikrobiota
Menurunkan sintesis kolesterol
Penghambatan patogen
Meningkatkan penyerapan mineral Asam organik
Biomasa Modulasi
system imun Detoksifikasi
Nutrisi sel usus Menyembuhkan
konstipasi Apoptosis sel pre-kanker
enterohemorrhagic E.coli (EHEC), enteroaggregative E.coli (EAEC), enteroinvasive E.coli (EIEC) dan diffusely adherent E.coli (DAEC).
(a) Enterophatogenic Escherichia coli (EPEC)
EPEC adalah satu dari kelas patogen yang menyebabkan lesi attaching dan
effacing (A/E) pada sel usus. Ciri dari patogen A/E adalah terletak pada tumpuannya di permukaan sel epitel inang dan menyebabkan kerusakan pada mikrovili usus. EPEC melekat dan berkolonisasi pada epitel mukosa duodenum dan proximal jejunum. Menimbulkan kerusakan pada epitel jejunal melalui pembentukan mikrokoloni yang ditunjukkan dengan pelekatan yang terlokalisasi (Moat et al. 2002). Selain itu, bakteri ini juga melekat dan berkolonisasi pada kolon/usus besar bagian ascending dan transverse (Jay 2000). Infeksi EPEC pada sel epitel usus inang oleh Goosney et al. (1999) diterangkan seperti pada Gambar 2.
Interaksi antara EPEC dan sel inang menurut (Goosney et al. 1999) terbagi menjadi 3 tahap : pertama pelekatan ke sel epitel yang diperantarai oleh pembentukan fimbriae tipe IV yang dikenal sebagai bundle forming pili (BFP). Awal pelekatan ini membantu membawa bakteri kontak dengan sel inang. Semua gen yang diperlukan untuk pembentukan lesi A/E oleh EPEC tersimpan dalam 25 kbp (Gambar 2).
Tahap kedua, melibatkan sekresi protein bakteri, beberapa darinya masuk ke sel inang termasuk EspA, EspB dan EspD. Ekspresi dari protein ini maksimal pada suhu tubuh inang dan pada kondisi yang mirip dengan yang ditemukan di dalam saluran pencernaan, yang menunjukkan bahwa protein tersebut terlibat pada virulensi. Translokasi protein ini adalah esensial untuk mengaktifkan sejumlah signal tranduksi. EspA membuat kaki-kaki filamen di luar bakteri dan mungkin menjadi bagian mesin translokasi yang terlibat pada pengantaran protein virulensi lainnya. EspB dipindahkan ke dalam sitosol inang dan membran, yang mempengaruhi perubahan pathway signal sel inang. Semua protein efektor disekresi oleh sistem sekresi tipe III yang dikode oleh gen ese dan sep.
d r p l i i p s P t t k k m E
dari sel bak residu tiros pengikatan lebih dari 1 intimin dapa integrin tida permukaan