UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Senyawa Etil
p-
metoksisinamat (EPMS)
Melalui Proses Nitrasi Serta Uji Aktivitas Sebagai Antiinflamasi
SKRIPSI
NUR KHAYATI PUTRI INDRIYANI
NIM : 1111102000126
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
Modifikasi Struktur Senyawa Etil
p-
metoksisinamat
(EPMS) Melalui Proses Nitrasi Serta Uji Aktivitas
Sebagai Antiinflamasi
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
NUR KHAYATI PUTRI INDRIYANI
NIM : 1111102000126
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
ABSTRAK
Nama : Nur Khayati Putri Indriyani Program Studi : Farmasi
Judul Skripsi :
Telah dilakukan modifikasi struktur senyawa etil p-metoksisinamat (EPMS)
dalam rangka mengeksplorasi pengaruh penambahan gugus fungsi tertentu
terhadap aktivitas antiinflamasi EPMS. Modifikasi struktur dilakukan dengan
menambahkan gugus nitro pada area aromatis EPMS. Reaksi modifikasi
dilakukan dengan menghidrolisis bentuk ester EPMS menjadi asam
p-metoksisinamat (APMS), selanjutnya APMS direaksikan dengan asam nitrat
menggunakan irradiasi microwave. Hasil nitrasi selanjutnya diubah lagi menjadi
bentuk ester dengan mereaksikan dengan etanol dengan bantuan irradiasi
microwave untuk menghasilkan senyawa etil 4-metoksi 6-nitro sinamat (rendemen
11,36%). Aktivitas antiinflamasi senyawa etil p-metoksisinamat dan 4-metoksi
6-nitro sinamat diujikan dengan menggunakan metode inhibisi denaturasi Bovine
Serum Albumin (BSA). Hasil uji anti denaturasi BSA mengindikasikan bahwa
tidak terjadi perbedaan berarti aktivitas antiinflamasi kedua senyawa etil
p-metoksisinamat etil dan 4-metoksi 6-nitro sinamat. Hal ini menunjukkan bahwa
penambahan gugus NO pada senyawa etil p-metoksisinamat tidak mempengaruhi
aktivitas antiinflamasinya
Kata kunci : etil p-metoksisinamat, hidrolisis, nitrasi, esterifikasi, antiinflamasi Bovine Serum Albumin.
ABSTRACT
Name : Nur Khayati Putri Indriyani
Major : Pharmacy
Title :
Ethyl p-methoxycinnamate (EPMC) functional group has been modified to
explore effect of addition specific functional group on the anti-inflammatory
activity of EPMC. Structural modification was conducted by adding NO
functional group on the aromatic area of EPMC. Modification was carried out
through hidrolysis of the ester form of EPMC to become p-methoxycinnamic acid
(PMCA). After that, APMS was reacted with nitric acid using an irradiation
microwave. The nitration result was then modified again into the ester form by
reacting it with ethanol and using the irradiation microwave to produce ethyl
4-methoxy 6-nitro cinnamate (yield 11.36%). The anti-inflammatory activity of
ethyl p-methoxycicinnamate and 4-methoxy 6-nitro cinnamate was tested using
the inhibition denaturation of Bovine Serum Albumin (BSA) method. The result
indicated that there was no significant difference of the activity of of EPMC and
ethyl 4-methoxy 6-nitro cinnamate. This result showed that addition of NO group
on EPMC structure did not affect anti-inflammatory activity of EPMC
Keywords: ethyl p-methoxycinnamate, hydrolysis, nitration, esterification, ati-inflammatory, Bovine Serum Albumin,
KATA PENGANTAR
Segala puji dan syukur kehadirat Allah SWT yang senantiasa
mencurahkan segala rahmat-Nya kepada kita semua, khususnya penulis dalam menyelesaikan skripsi yang berjudul “Modifikasi Struktur Senyawa Etil p-metoksisinamat (EPMS) Melalui Proses Nitrasi Serta Uji Aktivitas Sebagai Antiinflamasi”. Shalawat dan salam senantiasa terlimpah kepada junjungan kita Nabi Muhammad SAW, teladan bagi umat manusia dalam menjalani kehidupan.
Skripsi ini disusun untuk memenuhi salah satu syarat memenuhi ujian akhir
guna mendapatkan gelar Sarjani Farmasi pada Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta. Dalam menyelesaikan penulisan skripsi ini tentu banyak berbagai
kesulitan dan berbagai halangan lainnya, sehingga penulis tidak terlepas dari doa,
bantuan dan bimbingan dari banyak pihak. Oleh karena itu, ucapan terima kasih
penulis sampaikan kepada :
1. Ibu Ismiarni Komala, M.Sc.,Ph.D.,Apt sebagai pembimbing I dan Ibu Ofa
Suzanti Betha, M.Si., Apt sebagai pembimbing II yang telah memberikan
ilmu, nasehat, waktu, tenaga, dan pikiran selama penelitian dan penulisan
skripsi.
2. Bapak Dr. H. Arif Sumantri, SKM.,M.Kes selaku Dekan Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Syarif Hidayatullah Jakarta.
3. Kementrian Agama Republik Indonesia yang telah memberikan bimbingan, arahan, dan “Beasiswa Santri Berprestasi” selama menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Islam Negeri Syarif Hidayatullah Jakarta.
4. Bapak Drs. Umar Mansur, M.Sc., Apt selaku ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
5. Ibu Puteri Amelia, M.Farm.,Apt selaku pembimbing akademik yang telah
6. Kedua orang tua tercinta, Abdul Khamid dan Sulastri yang selalu ikhlas
memberikan dukungan moral, material, nasehat-nasehat, serta lantunan doa
yang tiada pernah putus disetiap tasbih dan sujudnya setiap waktu.
7. Adik Linda Putri Apriliani yang selalu memberikan semangat ketika
melihatnya dan mendengar suara indahnya.
8. Ganjar basuki yang selalu memberikan semangat di saat suka dan duka
selama perkuliahan dan juga penyelesaian skripsi ini.
9. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan
bimbingan dan bantuan selama mnempuh pendidikan di Program Studi
Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri
Syarif Hidayatullah Jakarta.
10. Teman-teman farmasi 2011 khususnya farmasi “Beng-Beng” yang telah menjadi kepingan memori yang berharga di Ibu kota. Tanpa mereka, cerita
perjalanan mencari ilmu ini tidak lengkap.
11. Teman-teman seperjuangan CSS MORA yang selalu ada untuk memberikan
semnagat dan motivasi.
12. Teman-teman seperjuangan BSA : Reza, Ali, Nova, Indah, Ajiz, Sutar, dan
Mida serta teman-teman di lab PHA dengan semangat juang yang tinggi
terimaksih atas segala bantuannya.
13. Dan kepada semua pihak yang telah membantu penulis selama ini yang tidak
dapat disebutkan namanya satu persatu.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah
SWT. Penulis menyadari bahwa penulisan skripsi ini masih jauh dari
kesempurnaan, ibarat tak ada gading yang tak retak. Oleh karena itu, saran dan
kritik yang bersifat membangun sangat penulis nantikan. Dan semoga skripsi ini
dapat bermanfaat bagi pengembangan ilmu pengetahuan.
Jakarta, April 2015
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINILITAS ... iii
HALAMAN PESETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
2.6.2 Spektrofotometri ... 14
a. Spektrofotometri IR ... 14
b. Spektrofotometri UV Vis ... 15
c. Spektrofotometri Resonansi Magnetik ... 16
2.7 Inflamasi ... 17
2.7.1 Pengertian Inflamasi ... 17
2.7.2 Mekanisme Terjadinya Inflamasi ... 18
2.7.3 Obat Antiinflamasi ... 20
2.7.4 Uji Antiinflamasi ... 20
BAB III METODOLOGI PENELITIAN ... 23
3.1 Tempat dan Waktu Penelitian ... 23
3.1.1 Tempat Penelitian ... 23
3.1.2 Waktu Penelitian ... 23
3.2 Alat dan Bahan ... 23
3.2.1 Bahan ... 23
3.3 Prosedur Penelitian ... 24
3.3.1 Modifikasi Senyawa EPMS ... 24
3.3.2 Pemisahan dengan Kromatografi Kolom (Fraksinasi) ... 25
3.3.3 Identifikasi Senyawa ... 25
3.3.4 Preparasi ... 26
3.3.5 Uji In vitro Antiinflamasi ... 26
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Modifikasi Struktur Etil p-metoksisinamat ... 28
4.1.1 Reaksi Hidrolisis Etil p-metoksisinamat ... 29
4.1.2 Reaksi Nitrasi APMS ... 30
4.1.3 Reaksi Esterifikasi Senyawa Hasil Nitrasi ... 32
4.2 Identifikasi Senyawa Hasil Modifikasi ... 33
4.2.1 Senyawa Hasil Hidrolisis ... 34
4.2.2 Senyawa Nitrasi APMS ... 35
4.2.3 Esterifikasi Senyawa Hasil Nitrasi ... 37
4.3 Pengujian Aktivitas Antiinflamasi dan Hubungan struktur ... 41
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR GAMBAR
Gambar 2.1 Senyawa Turunan Sinamat ... 4
Gambar 2.2 Biosintesis Etil p-metoksisinamat ... 5
Gambar 2.3 Prinsip Reaksi Hidrolisis ... 5
Gambar 2.4 Mekanisme Reaksi Hidrolisis pada Ester ... 6
Gambar 2.5 Mekanisme Reaksi Hidrolisis Ester dengan Katalis Basa ... 7
Gambar 2.6 Prinsip Substitusi Elektrofilik pada Aromatis ... 7
Gambar 2.7 Mekanisme Nitrasi Aromatik ... 8
Gambar 2.8 Reaksi Umum Esterifikasi ... 9
Gambar 2.9 Skema Kromatografi Lapis Tipis ... 12
Gambar 2.10 Alur Mediator Berasal dari As. Arakidonat & Tempat Kerja obat .. 19
Gambar 4.1 KLT senyawa hasil hidrolisis ... 29
Gambar 4.2 mekanisme hidrolisis EPMS ... 30
Gambar 4.3 Reaksi Nitrasi APMS ... 31
Gambar 4.4 KLT senyawa hasil nitrasi ... 31
Gambar 4.5 Esterifikasi Senyawa Hasil Nitrasi ... 32
Gambar 4.6 Hasil KLT senyawa teresterifikasi ... 33
Gambar 4.7 KLT Senyawa dengan Heksan : Etil asetat perbandingan 4:1 ... 34
Gambar 4.8 KLT Senyawa Hidrolisis EPMS dengan heksan :etil asetat (9:1) ... 34
Gambar 4.9 Struktur senyawa Asam p-metoksisinamat ... 35
Gambar 4.10 Kromatogram senyawa hasil nitrasi ... 36
Gambar 4.11 Senyawa Etil p-metoksisinamat ... 39
DAFTAR LAMPIRAN
Lampiran 1 : Kerangka Penelitian... 49
Lampiran 2 : Skema Identifikasi Senyawa Hasil Modifikasi... 50
Lampiran 3 : Identifikasi Etil p-metoksisinamat ... 51
Lampiran 4 : Gambar senyawa ... 56
Lampiran 5 : Spektrum GCMS senyawa hasil nitrasi APMS ... 57
Lampiran 6 : Spektrum GCMS hasil hidrolisis ... 58
Lampiran 7 : Spektrum IR hasil esterifikasi ... 59
Lampiran 8 : Spektrum GCMS hasil esterifikasi ... 60
Lampiran 9 : Spektrum H1NMR dan 13C NMR hasil esterifikasi ... 61
Lampiran 10 : Hasil Perhitungan Uji Antiinflamasi ... 66
BAB I
PENDAHULUAN
1.1 Latar Belakang
Sejak zaman dahulu senyawa dari bahan alam telah memberikan
peranan yang penting dalam bidang kesehatan baik dengan tujuan untuk
menjaga kesesehatan ataupun untuk menyembuhkan penyakit. Senyawa dari
bahan alam dapat digunakan langsung sebagai obat atau dapat menjadi
senyawa model untuk dikembangkan menjadi senyawa obat yang lebih
potensial.
Etil p-metoksisinamat (EPMS) adalah merupakan senyawa utama
yang terdapat pada kencur (Kaempferia galanga Linn) dalam jumlah yang
relatif besar (80,05%). EPMS telah dilaporkan memiliki aktivitas analgesik
antiinflamasi dengan mekanisme kerja secara non selektif menghambat
COX-1/2, dengam masing-masing nilai IC50 1,12µM dan 0,83µM (Ridtidid
et al., 2008; Umar et al.,2012). EPMS mudah diisolasi dan merupakan
senyawa yang sangat potensial sebagai bahan dasar sintesa untuk turunan
sinamat karena mempunyai gugus fungsi reaktif seperti olefin dan ester
yang mudah di transformasikan menjadi gugus fungsi yang lain (Surbakti,
2008, Taufikurohmah, T., dkk,2008).
Dari berbagai penelitian, epidemiologi, dan studi klinis menunjukkan
bahwa obat antiinflamasi non steroid (AINS) khususnya yang selektif
terhadap COX-2 mempunyai prospek yang menjanjikan sebagai agen
antikanker (Thun, 2002). Oleh karena itu, desain dan sintesis obat
antiinflamasi khususnya golongan AINS banyak mengambil perhatian ahli
kimia medisinal, khususnya dekade terakhir ini. Obat AINS digunakan
sangat luas dalam pengobatan dan masuk dalam kategori obat OTC (Over
the counter). Maka dilakukan banyak sekali modifikasi pada AINS seperti
memberikan elaborasi konjugat gugus tertentu sesuai tujuan khusus seperti
meningkatkan kelarutan dalam air, pelepasan NO, pelepasan hidrogen
sulfat, aktivitas antioksidan, penghambatan antikolinergik dan
Dewasa ini telah banyak dikembangkan desain modifikasi senyawa
antiinflamasi dengan penambahan gugus NO. Alasan di balik
pengembangan kelas obat ini adalah bahwa gugus NO dapat
mempertahankan aliran darah mukosa lambung dan mencegah kepatuhan
leukosit pada endotel vaskular sirkulasi splanknikus (salah satu peristiwa
paling awal setelah pemberian AINS) sehingga dapat melawan efek
merugikan dari COX-1 dan cedera mukosa tidak terjadi (Halen et al, 2009).
Dalam rangka mengeksplorasi hubungan struktur aktivitas senyawa
etil-para metoksisinamat sebagai agen antiinflamasi, maka perlu untuk
dilakukan penelitian untuk menguji pengaruh penambahan gugus NO pada
EPMS terhadap aktivitas antiinflamasinya. Penambahan gugus NO pada
EPMS dilakukan dengan cara mengubah EPMS menjadi bentuk asamnya,
selanjutnya asam p-metoksi sinamat di nitrasi dengan menggunakan HNO3,
dan selankutnya bnetuk asam yang telah ternitrasi di esterifikasi kembali
dengan merekasikan dengan etanol. Uji antiinflmasi dilakukan secara in
vitro menggunakan metoda antidenaturasi Bovine Serum Albumin (BSA)
Pengujian ini dipilih karena mudah, sampel yang dibutuhkan untuk menguji
dalam jumlah yang sedikit, waktu analisa cepat, dan merupakan uji
1.2 Rumusan masalah
a. Apakah senyawa etil p-metoksisinamat dapat dimodifikasi menjadi
turunan senyawa yang mengandung gugus nitro melalui proses hidrolisis
etil p-metoksisinamat menjadi asam p-metoksisinamat, kemudian di
nitrasi menggunakan asam nitrat selanjutnya di re-esterifikasi?
b. Bagaimana hubungan struktur dan aktivitas terhadap anti inflamasi
setelah dimodifikasi pada senyawa etil para metoksisinamat?
1.3 Tujuan Penelitian
a.Melakukan modifikasi senyawa etil para metoksisinamat dengan
penambahan gugus nitro pada etil p-metoksisinamat.
b.Menguji aktivitas antiinflamasi senyawa etil para metoksisinamat yang
telah dimodifikasi melalui proses nitrasi.
1.4 Manfaat Penelitian
Mendapatkan senyawa turunan etil p-metoksisinamat yang
mengandung gugus nitro yang diharapkan dapat memberikan informasi baru
mengenai hubungan struktur aktivitas senyawa etil p-metoksisinamat
sebagai agen antiinflamasi.
1.5 Hipotesis
Penambahan gugus nitro pada senyawa Etil p-metoksisinamat akan
BAB II
TINJAUAN PUSTAKA
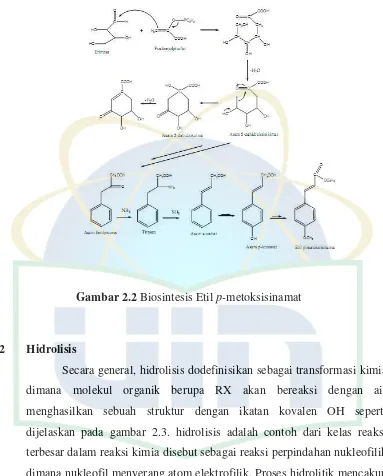
2.1 Senyawa etil p-metoksisinamat
Etil p-metoksisinamat termasuk turunan asam sinamat, dimana asam
sinamat adalah turunan senyawa phenil propanoad. Senyawa-senyawa yang
termasuk turunan sinamat adalah para hidroksi sinamat..
Gambar 2.1 (7), 3,4-dihidroksisinamat (8), dan 3,4,5 trimetoksisinamat (9)
Etil p-metoksisinamat termasuk kedalam senyawa ester yang
mengandung cincin benzena dan gugus metoksi yang bersifat nonpolar dan
juga gugus karbonil yang mengikat etil yang bersifat sedikit polar sehingga
dalam ekstraksinya dapat menggunakan pelarut-pelarut yang mempunyai
variasi kepolaran yaitu etanol, etil asetat, metanol, air, dan heksana
(Taufikhurohmah,2008).
Senyawa-senyawa turunan sinamat ditemukan secara luas di alam,
dalam tumbuhan tinggi, terutama sekali turunan p-hidroksisinamat.
Senyawa-senyawa ini biasanya terikat dalam bentuk ester atau glikosidanya,
dan beberapa diantaranya telah diketahui memiliki aktivitas biologis yang
Gambar 2.2 Biosintesis Etil p-metoksisinamat
2.2 Hidrolisis
Secara general, hidrolisis dodefinisikan sebagai transformasi kimia
dimana molekul organik berupa RX akan bereaksi dengan air
menghasilkan sebuah struktur dengan ikatan kovalen OH seperti
dijelaskan pada gambar 2.3. hidrolisis adalah contoh dari kelas reaksi
terbesar dalam reaksi kimia disebut sebagai reaksi perpindahan nukleofilik
dimana nukleofil menyerang atom elektrofilik. Proses hidrolitik mencakup
beberapa jenis mekanisme reaksi yang dapat didefinisikan oleh jenis pusat
reaksi dimana terjadi hidrolisis. Mekanisme reaksi yang paling sering
ditemui substitusi nukleofilik baik secara langsung maupun tidak langsung
Reaksi hidrolisis dapat terjadi dengan katalis basa atau asam.
Mekanisme reaksi hidrolisis sendiri dikelompokkan berdasarkan tipe
reaksi dasar seperti substitusi nukleofilik, gugus fungsi yang
ditransformasikan dengan reaksi substitusi nukleofilik, substitusi asil
nukleofilik, gugus fungsi yang ditransformasikan dengan reaksi substitusi
asil nukleofilik. Hidrolisis untuk turunan asam karboksilat masuk kedalam
kategori terakhir yakni gugus fungsi yang ditransformasikan dengan
reaksi substitusi asil nukleofilik. Mekanisme hidrolisis pada gambar 2.4
diinisiasi oleh protonasi pada karbonil oksigen. Protonasi menyebabkan
keadaan terpolarisasi pada gugus karbonil melepaskan elektron dari
karbon sehingga bersifat lebih elektrofilik dan akan menerima
penambahan nukleofilik dari air (Larson dan Weber, 1994).
Hidrolisis ester dengan katalis basa melalui mekanisme
penambahan nukleofilik OH (gambar 2.5) secara langsung kepada gugus
karbonil. Hidrolisis ester berkatalis basa terjadi karena ion OH merupakan
2.3 Nitrasi
Nitrasi adalah salah satu reaksi organik yang banyak dipelajari
baik secara aromatis maupun alifatik. Nitrasi dapat dilakukan dengan
berbagai metode seperti heterolitik (elektrofilik dan nukleofilik) dan nitrasi
radikal. Nitrasi aromatik biasanya merupakan elektrofilik dan untuk nitrasi
alifatik adalah radikal bebas. Senyawa nitroaromatik biasa digunakan
sebagai senyawa intermediet dalam sintesis plastik, insektisida, bahan
peledak, dan juga farmasetik. Sedangkan untuk nitroalifatik biasa
digunakan sebagai pelarut dan hasil sintesis dalam sintesis organik (Olah,
1982).
Gambar 2.6 Prinsip Substitusi Elektrofilik pada Aromatis
Reaksi nitrasi berlangsung dengan penggantian satu atau lebih gugus
nitro (-NO2) menjadi molekul yang reaktif. Gugus nitro akan menyerang
nitrogen membentuk nitramin dan bila menyerang oksigen membentuk
nitrat ester. Pada proses masuknnya gugus (-NO2) kedalam senyawa dapat
terjadi dengan menggantikan kedudukan beberapa atom atau gugus yang
ada dalam senyawa. Umumnya nitrasi yang banyak dijumpai adalah nitrasi
(-NO2) menggantikasi ataom H (Yulianto, 2010).
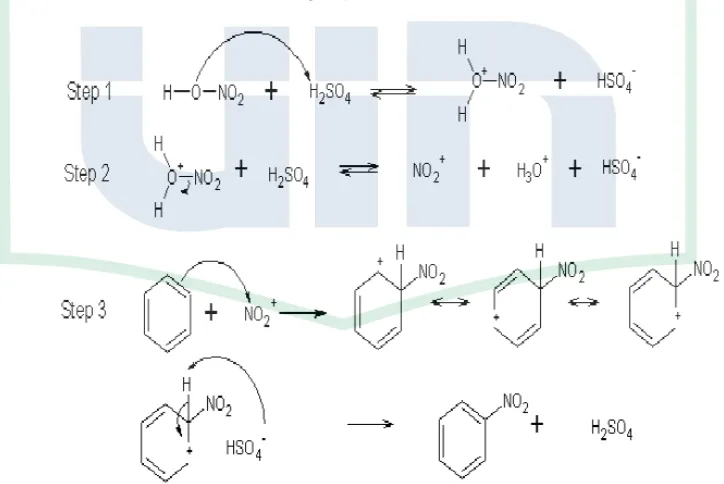
Nitrating agent adalah reaktan elektrofilik, dimana reaksi akan terjadi
pada atom karbon dari cincin aromatik yang mempunyai kepadatan elektron
terbesar. Gugus (-NO2) yang masuk dapat membentuk posisi ortho, meta,
dan para. Jumlah isomer pada produk tergantung pada substituen ini.
Substituen meta menyebabkan kepadatan elektron lebih besar dibandingkan
substituen ortho dan para, sehingga yield produk nitrasi akan didominasi
isomer meta (Yulianto, 2010).
Mekanisme nitrasi aromatik yang mengikuti prinsip substitusi
elektrofilik dengan berbagai step sehingga menghasilkan suatu senyawa
nitro aromatik dijelaskan pada gambar dibawah ini.
Gambar 2.7 Mekanisme Nitrasi Aromatik
2.4 Esterifikasi
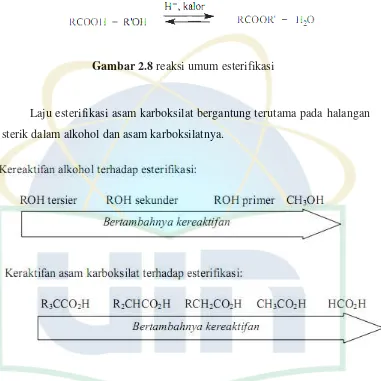
Ester asam karboksilat adalah suatu senyawa yang mengandung
Reaksi inilah yang disebut dengan reaksi esterifikasi. Esterifikasi
menggunakan katalis asam dan merupakan reaksi yang reversibel.
Gambar 2.8 reaksi umum esterifikasi
Laju esterifikasi asam karboksilat bergantung terutama pada halangan
sterik dalam alkohol dan asam karboksilatnya.
Reaksi esterifikasi bersifat reversible. Untuk memperoleh rendemen
yang tinggi dari reaksi esterifikasi, kesetimbangan harus digeser ke arah sisi
ester. Satu tehnik untuk mencapai ini adalah menggunakan salah satu zat
pereaksi secara berlebihan (Fessenden, 1986).
2.5 Perkembangan NO-AINS
Salah satu pengembangan yang sangat menjanjikan dalam
modifikasi struktur AINS dewasa ini adalah dengan penambahan gugus
donor NO yang memiliki tujuan untuk mempertahankan aliran darah
sirkulasi splanknikus (salah satu peristiwa paling awal setelah pemberian
AINS) sehingga dapat melawan efek merugikan dari COX-1 dan cedera
mukosa tidak terjadi (Halen et al., 2009).
Perbandingan antara aspirin dan 3-(nitroxymethyl) phenyl
2-acetoxybenzoate (NCX-4016) secara kuantitatif (basis mol) menunjukkan
bahwa NCX-4016 menunjukkan potensi antiinflamasi yang lebih besar
(Al-swayeh, 2000).
Dan efek pelepasan NO pada NCX-4016 tidak mengiritasi atau
menimbulkan tukak peptik (Takeuchi, 1998). Selain pada aspirin,
modifikasi struktur senyawa antiinflamasi dengan penambahan NO juga
dilakukan pada naproxen, ibuprofen, flurbiprofen, dan ketoprofen (Halen et
al., 2009).
2.6 Identifikasi
2.6.1 Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat
terlarut oleh suatu proses migrasi deferensial dinamis dalam sistem
yang terdiri dari dua fase atau lebih, salah satu di antaranya bergerak
secara berkesinambungan dalam arah tertentu dan di dalamnya zat-zat
itu menunjukkan perbedaan mobilitas disebabkan adanya perbedaan
dalam adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul
atau kerapatan muatan ion. Deangan demikian, masing-masing zat
dapat diidentifikasi atau ditetapkan dengan metode analitik
(Departemen Kesehatan, 1995).
Teknik kromatografi umum membutuhkan zat terlarut
terdistribusi diantara dua fase, satu diantaranya diam (fase diam),
yang lainnya bergerak (fase gerak). Fase gerak membawa zat
terlarut melalui media, hingga terpisah dari zat terlarut lainnya, yang
tereluasi lebih awal atau lebih akhir. Umumnya zat terlarut
dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk
cairan atau gas yang disebut eluen. Fase diam dapat bertindak
diaktifkan, silika gel, dan resin penukar ion, atau dapat bertindak
melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan
fase gerak. Dalam proses terakhir ini suatu lapisan cairan pada suatu
penyangga yang inert berfungsi sebagai fase diam (Departemen
Kesehatan,1995).
Jenis-jenis kromatografi yang bermanfaat dalam analisis
kualitatif dan kuantitatif yang digunakan dalam penetapan kadar
dan pengujian Farmakope Indonesia adalah Kromatografi Kolom,
Kromatografi Gas, Kromatografi Kertas, Kromatografi Lapis Tipis,
dan Kromatografi Cair Kinerja Tinggi. Kromatografi kertas dan
kromatografi lapis tipis umumnya lebih bermanfaat untuk tujuan
identifikasi, karena mudah dan sederhana. Kromatografi kolom
memberikan pilihan fase diam yang lebih luas dan berguna untuk
pemisahan masing-masing senyawa secara kuantitatif dari suatu
campuran (Departemen Kesehatan,1995).
a. Kromatografi Lapis Tipis
Kromatografi lapis tipis adalah metode pemisahan
fisikokimia. Lapisan yang memisahkan, yang terdiri atas bahan
berbutir-butir (fase diam), ditempatkan pada penyangga berupa pelat
gelas, atau lapisan yang cocok. Campuran yang akan dipisah berupa
larutan ditotolkan berupa bercak atau pita (awal). Setelah pelat atau
lapisan ditaruh di dalam bejana tertutup rapat yang berisi larutan
pengembang yang cocok (fase gerak), pemisahan terjadi selama
perambatan kapiler (pengembangan). Selanjutnya senyawa yang
tidak berwarna harus ditampakkan (dideteksi) (Stahl Egon dalam Khoirunni’mah, 2013).
Diantara berbagai jenis teknik kromatografi, kromatografi
lapis tipis adalah yang paling banyak digunakan untuk analisis obat
dilaboratorium farmasi. Metode ini hanya memerlukan investasi
kecil untuk perlengkapan dan menggunakan waktu yang singkat
cuplikan yang sangat sedikit (kira-kira 0,1 g). Selain itu, hasil palsu
yang disebabkan oleh komponen sekunder tidak mungkin terjadi,
kebutuhan ruangan minimum, dan penanganannya sederhana (Stahl
Egon dalam Khoirunni’mah, 2013).
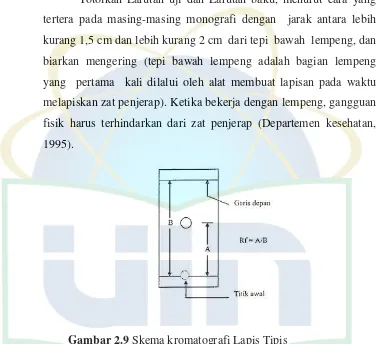
Totolkan Larutan uji dan Larutan baku, menurut cara yang
tertera pada masing-masing monografi dengan jarak antara lebih
kurang 1,5 cm dan lebih kurang 2 cm dari tepi bawah lempeng, dan
biarkan mengering (tepi bawah lempeng adalah bagian lempeng
yang pertama kali dilalui oleh alat membuat lapisan pada waktu
melapiskan zat penjerap). Ketika bekerja dengan lempeng, gangguan
fisik harus terhindarkan dari zat penjerap (Departemen kesehatan,
1995).
Gambar 2.9 Skema kromatografi Lapis Tipis
Beri tanda pada jarak 10 cm hingga 15 cm diatas titik
penotolan. Tempatkan lempeng pada rak penyangga, hingga tempat
penotolan terletak di sebelah bawah, dan masukkan rak ke dalam
bejana kromatografi. Pelarut dalam bejana harus mencapai tepi
bawah lapisan penjerap, tetapi titik penotolan jangan sampai
terendam. Letakkan tutup bejana pada tempatnya, dan biarkan sistem
hingga pelarut merambat 10 cm hingga 15 cm di atas titik penotolan,
umumnya diperlukan waktu lebih kurang 15 menit hingga 1 jam.
Keluarkan lempeng dari bejana ,buat tanda batas rambat pelarut,
cahaya ultraviolet gelombang pendek (254nm) dan kemudian dengan
cahaya ultraviolet gelombang panjang (366 nm). Ukur dan catat
jarak tiap bercak dari titik penotolan serta catat panjang gelombang
untuk tiap bercak yang diamati. Tentukan harga Rf untuk bercak
utama. Jika diperlukan, semprot bercak dengan pereaksi yang
ditentukan, amati dan bandingkan kromatogram zat uji dengan
kromatogram baku pembanding (Departemen kesehatan, 1995).
b. Kromatografi Kolom
Alat-alat yang diperlukan untuk kromatografi kolom sangat
sederhana, terdiri dari tabung kromatografi dan sebuah batang
pemampat yang diperlukan untuk memadatkan wol kaca atau kapas
pada dasar tabung jika diperlukan, serta untuk memadatkan zat
penjerap atau campuran zat penjerap dan air secara merata di dalam
tabung. Kadang-kadang digunakan cakram kaca berpori yang
melekat pada dasar tabung untuk menyangga isinya. Tabung
berbentuk silinder dan terbuat dari kaca, kecuali bila dalam
monografi, disebutkan terbuat dari bahan lain. Sebuah tabung
mengalir dengan diameter yang lebih kecil untuk mengeluarkan
cairan yang menyatu dengan tabung atau disambung melalui suatu
sambungan anti bocor pada ujung bawah tabung utama (Departemen
kesehatan, 1995).
Ukuran kolom bervariasi; kolom yang umum digunakan
dalam analisis farmasi mempunyai diameter dalam antara 150 mm
hingga 400 mm, tidak termasuk tabung pengalir. Tabung pengalir,
umumnya berdiameter dalam antara 3 mm hingga 6mm, dapat
dilengkapi dengan sebuah kran untuk mengatur laju aliran pelarut
yang melalui kolom dengan teliti. Batang pemampat merupakan
suatu batang silinder, melekat kuat pada sebuah tangkai yang terbuat
dari plastik, kaca, baja tahan karat, atau aluminium, kecuali bila
dinyatakan lain dalam monografi. Tangkai batang pemampat
panjang minimal 5 cm melebihi panjang efektif kolom, batang
mempunyai diameter lebih kurang 1 mm lebih kecil dari diameter
dalam kolom (Departemen kesehatan, 1995).
Zat penjerap atau fase diam (bisa berupa aluminium oksida
yang telah diaktifkan, silika gel, tanah diatome terkalsinasi, atau
tanah silika yang dimurnikan untuk kromatografi) dalam keadaan
kering atau dalam campuran dengan air, dimampatkan kedalam
tabung kromatografi kaca atau kuarsa. Zat uji yang dilarutkan
dalam sejumlah kecil pelarut, dituangkan kedalam kolom dan
dibiarkan mengalir kedalam zat penjerap. Zat berkhasiat diadsorpsi
dari larutan secara kuantitatif oleh bahan penjerap berupa pita sempit
pada permukaan atas kolom. Dengan penambahan pelarut lebih
lanjut melalui kolom, oleh gaya gravitasi atau denga
memberikantekanan, masing-masing zat bergerak turun dalam kolom
dengan kecepatan tertentu, sehingga terjadi pemisahan dan diperoleh
kromatogram (Departemen Kesehatan,1995).
2.6.2 Spektrofotometri
Spektrofotometri merupakan pengukuran suatu interaksi
antara radiasi elektromagnetik dan molekul atau atom dari suatu zat
kimia. Teknik yang sering digunakan dalam analisis farmasi
meliputi spektrofotometri serapan ultraviolet, cahaya tampak,
inframerah dan serapan atom (Departemen Kesehatan,1995).
a. Spektrofotometri IR
Spektrofotometri Infra Merah merupakan alat untuk merekam
spektrum didaerah inframerah yang terdiri dari suatu sistem optik
dengan kemampuan menghasilkan cahaya monokromatik di daerah
4000 cm-1 hingga 625 cm-1 (lebih kurang 2,5 πm hingga 16 πm) dan suatu metode untuk mengukur perbandingan intensitas
IR digunakan untuk mengidentifikasi gugus fungsi (Departemen
Kesehatan, 1995).
Hampir semua senyawa yang memiliki ikatan kovalen, baik
organik maupun anorganik, menyerap berbagai frekuensi radiasi
elektromagnetik diwilayah inframerah dari spektrum
elektromagnetik. Wilayah ini terletak pada panjang gelombang yang
berkisar dari sekitar 400 sampai 800 nm (Pavia et al.2008).
b. Spektrofotometri UV-Vis
Spektrofotometri serap merupakan pengukuran interaksi
antara radiasi elektromagnetik panjang gelombang tertentu yang
sempit dan mendekati monokromatik, dengan molekul atau atom
dari suatu zat kimia. Hal ini didasarkan pada kenyataan bahwa
molekul selalu mengabsorbsi cahaya elektromagnetik jika frekuensi
cahaya tersebut sama dengan frekuensi getaran dari molekul
tersebut. Elektron yang terikat dan elektron yang tidak terikat akan
tereksitasi pada suatu daerah frekuensi yang sesuai dengan cahaya
ultraviolet dan cahaya tampak (UV-Vis) (Roth et al., 1994).
Spektrum absorbsi daerah ini adalah sekitar 220 nm
sampai 880 nm dan dinyatakan sebagai spektrum elektron. Suatu
spektrum ultraviolet meliputi daerah bagian ultraviolet (190-380
nm), spektrum Vis (Visible) bagian sinar tampak (380-780 nm).
Pengukuran dengan alat spektrofotometer UV-Vis didasarkan pada
hubungan antara berkas radiasi elektromagnetik yang
ditransmisikan (diteruskan) atau yang diabsorbsi dengan tebalnya
cuplikan dengan konsentrasi dari komponen penyerap.
Hubungan tersebut dinyatakan dalam Hukum Lambert-Beer
(Sastroamidjojo, 1985) :
A = a . b . c
Keterangan :
(a) Daya Serap
(c) Konsentrasi larutan
(A) Serapan
Instrumentasi dari spektrofotometer UV-Vis ini dapat diuraikan
sebagai berikut :
1. Suatu sumber energi cahaya yang berkesinambungan yang
meliputi daerah spektrum yang mana alat tersebut dirancang
untuk beroperasi.
2. Suatu monokromator, yakni sebuah piranti untuk memencilkan
pita sempit panjang gelombang dari spektrum lebar yang
dipancarkan oleh sumber cahaya.
3. Suatu wadah untuk sampel (dalam hal ini digunakan kuvet).
4. Suatu detektor, yang berupa transduser yang merubah energi
cahaya menjadi suatu isyarat listrik.
5. Suatu amplifier (pengganda) dan rangkaian yang merubah energi
cahaya menjadi suatu isyarat listrk.
6. Suatu sistem baca dimana diperagakan besarnya isyarat listrik
yang ditangkap.
c. Spektrofotometri Resonansi Magnetik
Resonansi magnetik nuklir (NMR) adalah metode
spektroskopi yang bahkan lebih penting bagi ahli kimia organik dari
spektroskopi inframerah. Banyak inti dapat dipelajari dengan teknik
NMR, tapi hidrogen dan karbon yang paling umum tersedia. Jika
spektroskopi inframerah (IR) digunakan untuk mengidentifikasi
gugus fungsi, NMR memberikan informasi mengenai jumlah atom
magnetis yang berbeda dari jenis yang dipelajari.
NMR dapat menentukan jumlah masing-masing jenis yang
berbeda dari inti hidrogen serta memperoleh informasi mengenai
sifat dasar dari lingkungan terdekat dari masing-masing jenis.
Informasi yang sama dapat ditentukan untuk inti karbon. Kombinasi
IR dan data NMR seringkali cukup untuk menentukan secara benar
Instrumen NMR terdiri atas komponen-komponen sebagai
berikut (Willard et al., 1988) :
Magnet untuk memisahkan energi spin nuklir.
Paling tidak terdapat dua saluran frekuensi radio, satu untuk stabilisasi medan/frekuensi dan satu untuk memberikan frekuensi
radio untuk energi penyinaran. Yang ketiga dapat digunakan
untuk masing-masing inti yang akan dipisahkan.
Probe sampel yang mengandung kumparan untuk kopling
sampel dengan bidang frekuensi radio.
Detektor untuk memproses sinyal NMR.
Generator (Sweep Generator) untuk menyapu bersih baik medan
magnet maupun frekuensi radio melalui frekuensi resonansi
sampel.
Rekorder untuk menampillkan spektrum.
2.7 Inflamasi
2.7.1 Pengertian Inflamasi
Inflamasi adalah reaksi kompleks dalam jaringan ikat vascular
yang terjadi karena rangsangan eksogen dan endogen. Inflamasi
merupakan respon normal, pelindung terhadap cedera jaringan yang
disebabkan oleh trauma fisik, bahan kimia berbahaya atau agen
mikrobiologis, yang berupaya untuk menonaktifkan atau
menghancurkan organisme asing, menghilangkan iritasi yang
merupakan tahap pertama perbaikan jaringan. Proses inflamasi
biasanya mereda pada proses penyelesaian atau penyembuhan tapi
kadang-kadang berubah menjadi radang yang parah, yang mungkin
jauh lebih buruk dari penyakit ini dan dalam kasus ekstrim, juga
dapat berakibat fatal (Sen et al, 2010).
Kemerahan, suhu yang meningkat, pembengkakan, nyeri, dan
hilangnya fungsi adalah tanda klasik dari inflamasi. Inflamasi dapat
infeksi, bahan kimia, patogen, reaksi kekebalan tubuh dan luka
fisik (Sen et al, 2010).
2.7.2 Mekanisme Terjadinya Inflamasi
Terjadinya inflamasiadalah reaksi setempat dari jaaringan atau
sel terhadap suatu rangsang atau cedera, terjadinya rangsangan untuk
dilepaskannya zat kimia tertentu yang akan menstimulasi terjadinya
perubahan jaringan pada reaksi radang tersbut, diantaranya
histamin, serotonin, bradikinin, leukotrin, dan protaglandin.
Histamin bertanggung jawab pada perubahan yang paling awal yaitu
menyebabkan vasodilatasi pada arteriol yang didahului dengan
vasokontriksi awal dan peningkatan permeabilitas kapiler, hal ini
menyebabkan perubahan distribusi sel darah merah. Oleh karena
aliran darah yang lambat, seldarah merah akan mengguumpal,
akibatnya sel darah putih terdesak ke pinggir. Semakin lambat aliran
darah maka sel darah putih akan menempel pada dinding pembuluh
darah. Perubahan permeabilitas yang terjadi menyebabkan cairan
keluar dari pembuluh darah dan berkumpul dalam jaringan.
Bradikinin bereaksi lokal menimbulkan rasa sakit,
vasodilatasi,meningkatkan permeabilitas kapiler. Sebagai penyebab
radang. Prostaglandin berpotensi kuat setelah bergabung dengan
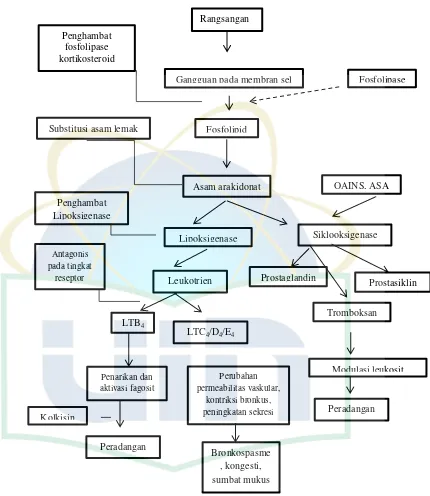
Gambar 2.10 Alur Mediator yang Berasal dari Asam Arakidonat dan Tempat Kerja Obat
Prosesinflamasi dimulai dari stimulus yang akan
mengakibatkan kerusakan sel, sebagai reaksi terhadap kerusakan sel
maka sel tersebut akan melepaskan beberapa fosfolipid yang
Rangsangan
Gangguan pada membran sel Fosfolipase
diantaranya adalah asam arakidonat. Setelah asam arakidonat
tersebut bebas akan diaktifkan oleh beberapa enzim, diantaranya
siklooksigenase dan lipooksigenase. Enzim tersebut merubah asam
arakidonat kedalam bentuk yang tidak stabil (hidroperoksid dan
endoperoksid) yang selanjutnya dimetabolisme menjadi leukotrin,
protaglandin, prostasiklin, dan tromboksan. Bagian prostaglandin
dan leukotrin bertanggung jawab terhadap gejala-gejala peradangan
(Katzung, 1998).
2.7.3 Obat Antiinflamasi
Obat-obat antiinflamasi adalah golongan obat yang memiliki
aktivitas menekan atau mengurangi peradangan. Aktivitas ini dapat
dicapai melalui berbagai cara yaitu menghambat pelepasan
prostaglandin dari sel-sel tempat pembentukannya. Berdasarkan
mekanime kerjanya, obat-obatan antiinflamasi terbagi dalam
golongan steroid yang terutama bekerja dengan cara menghambat
pelepasan prostaglandin dari sel-sel sumbernya dan golongan non
steroid yang bekerja melalui mekanisme lain seperti inhibisi
siklooksigenase yang berperan pada biosintesis protaglandin
(Setyarini, 2009).
Obat-obat antiinflamasi sangat efektif menghilangkan rasa
nyeri dan inflamasi dengan menekan produksi prostaglandin dan
metabolisme asam arakidonat dengan cara penghambatan
siklooksigenase dan lipooksigenase pada kaskade inflamasi.
Penekanan prostaglandin sebagai mediator inflamasi pada jaringan
menyebabkan kurangnya rasa nyeri dan pembengkakan sehingga
fungsi otot dan sendi membaik (Setyarini, 2009).
2.7.4 Uji Antiinflamasi
Inflamasi merupakan respon imun tubuh yang secara umum
terjadi karena adanya stimulus. Hal itu bisa dikarenakan oleh bakteri,
ketika sistem kekebalan tubuh berjuang melawan sesuatu dan
terkadang memunculkan efek berbahaya (IQWiQ,2010). Untuk itu
dikembangkanlah obat antiinflamasi untuk mengatasi efek
berbahaya dari proses inflamasi yang ada di dalam tubuh.
Dari berbagai penelitian, epidemiologi dan studi klinis
menunjukkan bahwa AINS khususnya yang selektif terhadap COX-2
mempunyai prospek yang menjanjikan sebagai agen antikanker
(Thun,2002). Oleh karena itu, desain dan sintesis obat antiinflamasi
khususnya golongan AINS banyak mengambil perhatian ahli kimia
medisinal, khususnya pada dekade terakhir ini. Obat AINS
digunakan sangat luas dalam pengobatan dan masuk dalam kategori
obat OTC (over the counter). Maka dilakukan banyak sekali
modifikasi pada AINS seperti memberikan elaborasi konjugat gugus
tertentu sesuai tujuan khusus seperti meningkatkan kelarutan dalam
air, pelepasan hidrogen sulfida, aktivitas antioksidan, penghambatan
antikolinergik dan antikolinesterase dan spesifikasi site target
(Qandil, 2012).
Beberapa metode in vitro dapat digunakan dalam mengetahui
potensi atau aktivitas antiinflamasi dari suatu obat, kandungan kimia
dan preparat herbal. Teknik-teknik yang bisa digunakan antara lain
adalah pelepasan fosforilasi oksidatif (ATP biogenesis terkait dengan
respirasi), penghambatan denaturasi protein, stabilisas membran
eritrosit, stabilisasi membran lisosomal, tes fibrinolitik dan agregasi
trombosit (Oyedapo et al., 2010).
Selain itu uji antiinflamasi secara in vitro juga bisa dilakukan
dengan melihat efek inhibisi pada siklooksigenase menggunakan kit
khusus uji skrining siklooksigenase (Umar et al., 2012).
Dalam pengembangan AINS, prinsip denaturasi dalam uji
antiinflamasi sering digunakan seperti pada uji antiinflamasi dengan
albumin telur (Chandra, 2012) dan uji dengan bovine serum albumin
(BSA) (Williams et al.,2008). Denaturasi protein pada jaringan
dari antigen-auto pada penyakit artritis dapat mengakibatkan
denaturasi protein secara in vivo. Oleh karena itu, penggunaan suatu
agen tertentu yang bisa mencegah denaturasi protein akan
bermanfaat pada pengembangan obat antiinflamasi (Chatterjee et
al.,2012).
Beberapa AINS seperti indometasin, ibufenak, asam
flufenamik dan asam salisilat memiliki kemampuan dalam mencegah
denaturasi BSA yang dipanaskan pada pH patologis yakni 6,2-6,5.
Selain itu beberapa ekstrak dan komponen murni tumbuhan seperti
ekstrak Boehmeria jamaicensis (Urb), fenil propanoid, eugenol,
polisulfid, dibenzil trisulfid dapat menghambat denaturasi BSA,
memiliki aktivitas sebagai antioksidan dan merupakan kandidat obat
antiinflamasi. Pada uji BSA, jika senyawa sampel menghambat
denaturasi dengan persen inhibisi >20% maka dianggap memiliki
aktivitas antiinflamasi dan layak untuk dikembangkan lebih lanjut
BAB III
METODOLOGI PENELITIAN
3.1 Tempat Dan Waktu Penelitian
3.1.1 Tempat
Penelitian mengenai modifikasi struktur kimia dari senyawa etil
p-metoksisinamat (EPMS) serta pengujian terhadap aktivitas sebagai
antiinflamasi dilaksanakan di Laboratorium Farmakognosi dan Fitokimia,
Laboratorium Penelitian I, Laboratorium Penelitian II, dan Laboratorium
Kimia Obat Program Studi Farmasi, Fakultas Kedokteran dan Ilmu
Kesehatan, UIN Syarif Hidayatullah Jakarta.
3.1.2 Waktu Penelitian
Penelitian ini dilaksanakan pada bulan November 2014 sampai dengan
April 2015.
3.2 Alat dan Bahan
3.2.1 Alat
Spektrofotometri H-NMR dan C-NMR (500 MHz, JEOL),
Spektrofotometer UV-Vis (HITACHI), Sprektrofotometri IR, Gas
spektrofotometri, evaporator (SB-1000 Eyela), digital water bath (SB-100
Eyela), lemari pendingin, inkubator (France etuves), plat aluminium TLC
silica gel 60 F254 (Merck), oven, timbangan analitik, penangas, statif,
mangkok atau baskom plastik, labu reaksi, corong, erlenmeyer, gelas piala,
rak, tabung reaksi, chamber KLT, termometer, blender, pipet eppendrof,
mikropipet, batang pengaduk, pinset, magnetik stirer, kertas saring, kapas,
aluminium foil, vial uji, botol, pH indikator, microwave.
3.2.2 Bahan
Senyawa etil p-metoksisinamat (EPMS), Na Diklofenak (Sigma
aldrich), asam sulfat pekat, asam nitrat 65%, HCl 15%, NaOH, silika gel
bahan pembantu lain : Aquadest, etil asetat, n-heksan, methanol,etanol p.a
dan TBS (Tris Buffer Saline).
3.3 Prosedur penelitian
3.3.1 Modifikasi Senyawa EPMS
a. Hidrolisis etil p-metoksisinamat
Sebanyak 1,5 gram NaOH (0,0375 mol) dilarutkan dengan etanol
pro analisis dalam gelas kimia dengan pengadukan menggunakan
magnetik stirer. Kemudian ditambahkan senyawa EPMS sebanyak 5 gram
(0,024 mol) ke dalamnya dan suhu dijaga pada 600C dan reaksi
berlangsung selama 3 jam. Pengecekan reaksi dilakukan menggunakan
KLT. Hasil reaksi di filtrasi, filtrat yang di dapat ditambahkan HCl 15%
hingga mencapai pH 4 dan menghasilkan serbuk berwarna putih. Residu
berupa senyawa hasil hidrolisis kemudian di keringkan (Mufidah,2014
yang dimodifikasi). Hasil reaksi di monitor dengan KLT
b. Nitrasi Hasil hidrolisis
Sebanyak 2,5 gram APMS (0,014) ditambahkan kedalam 10 mL
asam nitrat 65% (0,22 mol) dalam suhu -150C dengan cara
mereaksikannya didalam gelas kimia yang berisi es. Kemudian di iradiasi
menggunakan microwave pada 450 W selama 2 menit. Setelah iradiasi,
campuran reaksi di tuangkan kedalam akuades dingin kemudian di filtrasi,
maka akan di dapatkan padatan berwarna kuning (Bose et al, 2006).
c. Esterifikasi Senyawa Hasil Nitrasi
500 mg senyawa hasil nitrasi dilarutkan kedalam etanol sebanyak 50
mL di dalam erlenmeyer tertutup menggunakan magnetik stirer dan
dipanaskan sampai senyawa larut didalamnya. Tambahkan asam sulfat
pekat (0,2 mL, 4 mmol). Campuran reaksi kemudian diletakkan dalam
waterbath (yaitu gelas kimia yang berisi air) lalu diiradiasi dalam
microwave oven biasa dengan kekuatan 300 W selama 30 menit. Hasil
reaksi di filtrasi menggunakan etil asetat dan akuades. Didapatkan padatan
3.3.2 Pemisahan dengan Kromatografi Kolom (Fraksinasi)
Metode yang digunakan pada penelitian ini adalah menggunakan
kromatografi kolom yang mengacu pada metode yang digunakan oleh
Waters (1985). Silika gel 60 digunakan sebagai fase diam. Sedangkan fase
gerak yang digunakan menggunakan sistem fase gerak dengan polaritas
bertingkat. Masing-masing fraksi yang telah dipisahkan, dimonitor
profilnya melalui KLT menggunakan KLT Silica gel 60 F254 (E-merck)
metoksisinamat maupun hasil modifikasi, kemudian diidentifikasi
warna, bentuk, dan juga bau yang dihasilkan.
b. Pengukuran titik leleh
Senyawa yang didapat dari hasil modifikasi kemudian diidentifikasi titik lelehnya menggunakan alat melting point dengan merk “melting point SMP 10”.
c. Identifikasi senyawa menggunakan FTIR
Sedikit sampel padat (kira-kira 1-2 mg), kemudian ditambahkan
bubuk KBr murni (kira-kira 200 mg) dan diaduk hingga rata. Kemudian
sampel (pelet KBr yang terbentuk) diambil dan kemudian ditempatkan
dalam tempat sampel pada alat spektrofotometri inframerah untuk
dianalisis (hidayati,2012).
d. Identifikasi senyawa menggunakan GCMS
Kolom yang digunakan adalah HP-5MS (30 m x 0,25 mm ID x
0,25 µm); suhu awal 700C selama 2 menit, dinaikkan ke suhu 2850C
dengan kecepatan 200C/min selama 20 menit. Suhu MSD 2850C.
Kecepatan aliran 1,2 mL/min dengan split 1:100. Parameter scanning
dilakukan dari massa paling rendah yakni 35 sampai paling tinggi 550
e. Identifikasi Senyawa menggunakan H-NMR dan C-NMR
Sedikit sampel padat (kira-kira 10 mg), kemudian dilarutkan dalam
pelarut kloroform bebas proton (untuk NMR), setelah dilarutkan
kemudian dimasukkan kedalam tabung khusus NMR untuk dianalisis.
3.3.4 Preparasi
a) Pembuatan Reagen untuk Uji Antiinflamasi
1. Larutan TBS (Tris Buffer Saline) pH 6,3
Sebanyak 1,21 g Tris base dan 8,7 g NaCl dilarutkan dalam
1000 mL akuades. Kemudian pH di adjust sampai sampai 6,3
menggunakan asam asetat glasial (Mohan, 2003).
2. Penyiapan variant konsentrasi Na Diklofenak sebagai kontrol positif.
Pembuatan larutan induk sebesar 10.000 ppm Na diklofenak
dengan pelarut metanol. Kemudian dilakukan pengenceran menjadi
1000, 100, 10, dan 1 ppm.
3. Penyiapan variant konsentrasi senyawa hasil modifikasi (sampel)
Pembuatan larutan induk sebesar 10.000 ppm baik senyawa
hasil modifikasi dengan pelarut metanol. Kemudian dilakukan
pengenceran menjadi 1000, 100, 10, dan 1 ppm..
4. Pembuatan BSA 0,2% (w/v)
Sebanyak 0,2 gr BSA dilarutkan dalam TBS 100 ml (Williams et
al.,2008).
3.3.5 Uji In vitro Antiinflamasi (Williams, et al.,2008)
Pengujian aktivitas senyawa hasil modifikasi terhadap denaturasi BSA:
a. Pembuatan larutan uji
Larutan uji (5 mL) terdiri dari larutan 50 µL larutan sampel
yang kemudian di tambah dengan BSA hingga volume 5 mL sehingga
didapatkan variant konsentrasi menjadi 100; 10; 1; 0,1 dan 0,01 ppm.
b. Pembuatan Larutan Kontrol Negatif
Larutan kontrol negatif 1 (5 mL) terdiri dari 50 µL metanol yang
c. Pembuatan Larutan Kontrol Positif
Larutan kontrol positif (5 mL) terdiri dari 50 µL larutan natrium
diklofenak yang kemudian ditambah dengan BSA hingga volume
mencapai 5 mL sehingga didapatkan variant konsentrasi menjadi 100;
10; 1; 0,1 dan 0,01 ppm.
Setiap larutan diatas dipanaskan selama 5 menit pada suhu 720 – 730 C. Lalu didiamkan selama 25 menit pada suhu ruang dan diukur turbiditasnya dengan
spektrofotometri Uv-Vis (HITACHI) pada panjang gelombang 660 nm.
Persentase inhibisi dari denaturasi atau presipitasi BSA dikalkulasikan
dengan rumus berikut :
% inhibisi =
Beberapa AINS seperti indometasin, ibufenak, asam flufenamik dan asam
salisilat memiliki kemampuan dalam mencegah denaturasi BSA yang dipanaskan
pada pH patologis yakni 6,2-6,5. Pada uji BSA, jika senyawa sampel menghambat
denaturasi dengan persen inhibisi >20% maka dianggap memiliki aktivitas
BAB IV
HASIL DAN PEMBAHASAN
Pada penelitian ini dilakukan modifikasi senyawa etil para-metoksisinamat
yang diisolasi dari tanaman kencur melalui proses nitrasi gugus fungsi reaktif
yang dimiliki yaitu gugus aromatis, olefin dan ester. Tujuan modifikasi dilakukan
adalah untuk melihat pengaruh penambahan suatu gugus nitro pada senyawa etil
para metoksisinamat terhadap aktivitas antiinflamasinya. Uji antiinflamasi
dilakukan secara invitro dengan menggunakan Bovine Serum Albumin (BSA)
dengan prinsip inhibisi denaturasi protein.
4.1 Modifikasi Struktur etil p-metoksisinamat
Gugus fungsi NO dalam struktur senyawa antiinflamasi telah
diketahui berperan dalam mempertahankan aliran darah mukosa lambung
dan mencegah kepatuhan leukosit pada endotel vaskular sirkulasi
splanknikus (salah satu peristiwa paling awal setelah pemberian AINS)
sehingga dapat melawan efek merugikan dari COX-1 dan cedera mukosa
tidak terjadi (Halen et al, 2009). Menurut Umar et al (2012) etil
p-metoksisinamat (EPMS) memiliki aktivitas anagesik antiinflamasi dengan
mekanisme kerja secara non selektif menghambat COX-1/2. Berdasarkan
hal tersebut, dalam rangka meningkatkan aktivitas antiinflamasi dari EPMS,
maka dipandang perlu untuk ditambahkan gugus NO pada posisi aromatis
dari senyawa EPMS sebagai upaya untuk meningkatkan efikasi aktivitas
antiinflamasi EPMS
Pada percobaan pendahuluan, reaksi nitrasi langsung pada EPMS
dapat menghasilkan beberapa senyawa EPMS yang ternitrasi yang memiliki
kepolaran yang sama sehingga pada proses pemisahan senyawa tersebut
menjadi sulit untuk dilakukan. Untuk itu, perlu dilakukan alternatif metoda
yaitu merubah EPMS menjadi bentuk asam p-metoksisinamat (APMS),
yang selanjutnya APMS dinitrasi dengan mereaksikan dengan HNO3. Hasil
nitrasi selanjutnya diubah lagi menjadi bentuk esternya melalui proses
4.1.1 Reaksi hidrolisis etil p-metoksisinamat
Reaksi hidrolisis dilakukan dengan NaOH sebagai katalis basa dan
etanol p.a sebagai pelarut. Mekanisme reaksi hidrolisis diinisiasi oleh
protonasi pada karbonil oksigen. Protonasi menyebabkan keadaan
terpolarisasi pada gugus karbonil melepaskan proton dari karbon sehingga
bersifat lebih elektrofilik dan akan menerima penambahan nukleofilik OH
(Larson dan Weber, 1994).
Pada reaksi ini, NaOH 1,5 gram (0,0375 mol) sebagai katalis
dilarutkan kedalam etanol p.a kemudian ditambahkan dengan EPMS
sebanyak 5 gram (0,024 mol). Campuran selanjutnya dipanaskan pada suhu
600C selama 3 jam sampai terbentuknya serbuk berwarna putih. Hasil reaksi
dimonitor setiap selang waktu 15 menit sampai terbentuknya spot yang
mengindikadikan EPMS telah berubah menjadi APMS seperti yang terlihat
pada gambar 4.1. Setelah proses reaksi selesai, hasil reaksi dicuci dengan
menggunakan akuades. Filtrat yang diperoleh memiliki pH 13 kemudian di
tambahkan HCl 15% sampai dengan pH 4, hal ini bertujuan untuk mengikat
Na+ sehingga terbentuklah endapan putih berupa hasil hidrolisis (Mufidah,
2014).
Residu yang di dapat kembali dicuci dengan akuades untuk
menghilangkan garam yang terbentuk kemudian residu di keringkan. Residu
yang di dapatkan berwarna putih (lihat lampiran 5). Mekanisme reaksi
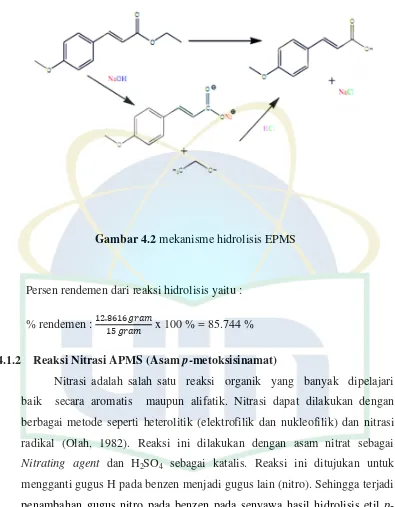
hidrolisis etil p-metoksisinamat dapat dilihat pada gambar 4.2
Gambar 4.1 KLT senyawa hasil hidrolisis
Etil p-metoksisinamat
Gambar 4.2 mekanisme hidrolisis EPMS
Persen rendemen dari reaksi hidrolisis yaitu :
% rendemen :
x 100 % = 85.744 %
4.1.2 Reaksi Nitrasi APMS (Asam p-metoksisinamat)
Nitrasi adalah salah satu reaksi organik yang banyak dipelajari
baik secara aromatis maupun alifatik. Nitrasi dapat dilakukan dengan
berbagai metode seperti heterolitik (elektrofilik dan nukleofilik) dan nitrasi
radikal (Olah, 1982). Reaksi ini dilakukan dengan asam nitrat sebagai
Nitrating agent dan H2SO4 sebagai katalis. Reaksi ini ditujukan untuk
mengganti gugus H pada benzen menjadi gugus lain (nitro). Sehingga terjadi
penambahan gugus nitro pada benzen pada senyawa hasil hidrolisis etil
p-metoksisinamat (Yulianto, 2010)
Metode yang digunakan untuk reaksi ini yaitu dengan Cold
Microwave. Keuntungan dari metode ini adalah memiliki waktu reaksi yang
cepat dalam hitungan menit. Hal penting yang harus diperhatikan adalah
preparasi pencampuran antara senyawa sampel dengan reagen yaitu asam
nitrat harus dilakukan pada suhu dingin (Bose, 2006). Suhu menjadi faktor
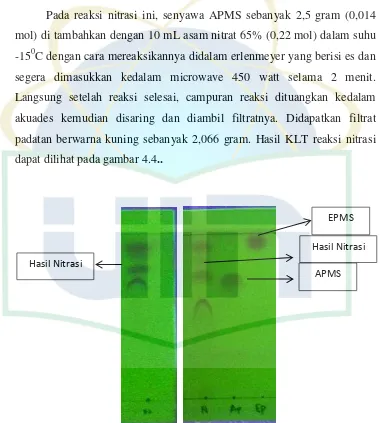
Gambar 4.3 Reaksi Nitrasi hasil hidrolisis
Pada reaksi nitrasi ini, senyawa APMS sebanyak 2,5 gram (0,014
mol) di tambahkan dengan 10 mL asam nitrat 65% (0,22 mol) dalam suhu
-150C dengan cara mereaksikannya didalam erlenmeyer yang berisi es dan
segera dimasukkan kedalam microwave 450 watt selama 2 menit.
Langsung setelah reaksi selesai, campuran reaksi dituangkan kedalam
akuades kemudian disaring dan diambil filtratnya. Didapatkan filtrat
padatan berwarna kuning sebanyak 2,066 gram. Hasil KLT reaksi nitrasi
dapat dilihat pada gambar 4.4..
Gambar 4.4 KLT Senyawa Hasil Nitrasi
Hasil Nitrasi
APMS Hasil Nitrasi
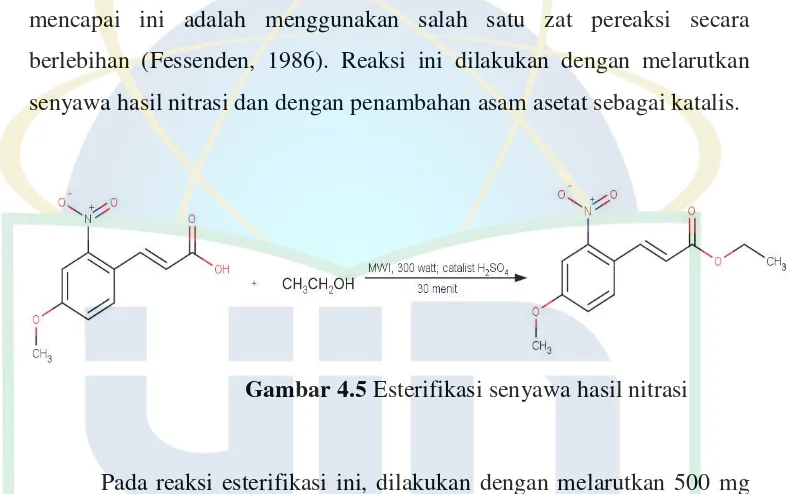
4.1.3 Reaksi Esterifikasi Senyawa Hasil Nitrasi
Ester asam karboksilat adalah suatu senyawa yang mengandung
gugus –COOR dengan R dapat berbentuk alkil maupun aril. Suatu ester dapat dibentuk dengan mereaksikan asam karboksilat dengan alkohol.
Reaksi inilah yang disebut dengan reaksi esterifikasi. Esterifikasi
menggunakan katalis asam dan merupakan reaksi yang reversibel.
Untuk memperoleh rendemen yang tinggi dari reaksi esterifikasi,
kesetimbangan harus digeser ke arah sisi ester. Satu tehnik untuk
mencapai ini adalah menggunakan salah satu zat pereaksi secara
berlebihan (Fessenden, 1986). Reaksi ini dilakukan dengan melarutkan
senyawa hasil nitrasi dan dengan penambahan asam asetat sebagai katalis.
Gambar 4.5 Esterifikasi senyawa hasil nitrasi
Pada reaksi esterifikasi ini, dilakukan dengan melarutkan 500 mg
senyawa hasil nitrasi dengan etanol sebanyak 50 mL dan dengan katalis
asam sulfat pekat (0,2 mL, 4 mmol) didalam waterbath (gelas kimia berisi
air) kemudian di iradiasi dengan microwave pada 300 watt selama 30
menit. Setelah reaksi selesai, dilakukan partisi menggunakan etil asetat dan
akuades untuk memisahkan senyawa hasil esterifikasi dengan asam yang
masih tersisa. Filtrat yang didapat dipisahkan menggunakan kromatografi
kolom dengan dimulai dari eluen heksan 100% dan heksan : etil asetat
(90:10). Sehingga didapatkan kristal berwarna kuning. Lalu dilakukan
pengecekan menggunakan KLT setiap hasil dari kromatografi kolom.
Gambar 4.6 hasil KLT senyawa teresterifikasi
Hasil senyawa teresterifikasi, didapatkan persen rendemen yaitu :
% rendemen =
4.2 Identifikasi Senyawa Hasil Modifikasi
Identifikasi senyawa hasil modifikasi dimulai dengan
membandingkan nilai Rf seluruh senyawa yang di KLT menggunakan eluen
heksan: etil asetat dengan perbandingan 4:1(Lihat gambar 4.7). Nilai Rf
yang di dapat adalah sebagai berikut :
Etil p-metoksisinamat = 0,558
Senyawa Hasil hidrolisis = 0,081
Senyawa Nitrasi = 0,205
Senyawa nitrasi yang teresterifikasi = 0,307
Berdasarkan nilai Rf dapat diketahui tingkat kepolaran dari senyawa
modifikasi. Nilai Rf etil p-metoksisinamat memiliki nilai tertinggi dimana
ini menunjukkan bahwa senyawa tersebut memiliki polaritas rendah. Pada
senyawa hasil hidrolisis, nilai Rf nya lebih kecil sehingga dengan
pengurangan atom C pada gugus ester dapat meningkatkan polaritas
senyawa. Selanjutnya untuk senyawa hasil nitrasi memiliki nilai Rf 0,205
lebih tinggi dari nilai Rf hasil hidrolisis, sehingga hal ini menunjukkan
hidrolisis. Pada senyawa esterifikasi hasil nitrasi menunjukkan polaritas
yang lebih rendah dibandingkan dengan polaritas hasil nitrasi.
Gambar 4.7 hasil KLT senyawa dengan eluen heksan : etil asetat (4:1)
Gambar 4.8 KLTsenyawa hidrolisis EPMS dengan Heksan : Etil asetat perbandingan 9:1
4.2.1 Senyawa Hasil Hidrolisis Etil p-metoksisinamat
Senyawa hasil hidrolisis etil p-metoksisinamat memiliki karakteristik
seperti berikut :
Warna : Putih
Bau : tidak ada bau
Bentuk : serbuk
Pengukuran titik leleh menggunakan alat melting point “smp 10” didapatkan rentang titik pada senyawa hasil hidrolisis yaitu 172-1740C.
Analisa senyawa hasil hidrolisis ini dilakukan dengan menggunakan
GCMS dan di cocokan dengan hasil dari Mufidah (2014) baik itu nilai Rf,
titik leleh dan hasil GCMS pada senyawa hasil hidrolisis. Dari interpretasi
GCMS menunjukkan bahwa senyawa hasil hidrolisis muncul pada waktu
retensi 9,649 yang memiliki berat molekul 178,0 dengan fragmentasi massa
pada 161; 133; 117; 89; dan 63 (Lihat Lampiran 6). adapun fragmentasi
yang terjadi pada senyawa hasil hidrolisis adalah sebagai berikut :
Dari data titik leleh, nilai Rf dan GCMS, ternyata hasil yang diperoleh
sama seperti yang dilakukan oleh Mufidah (2014). Sehingga senyawa hasil
hidrolisis etil p-metoksisinamat adalah Asam p-metoksisinamat.
Gambar 4.9 struktur senyawa asam p-metoksisinamat
4.2.2 Senyawa Nitrasi hasil hidrolisis
Elusidasi senyawa hasil nitrasi menggunakan analisa GCMS. Dari
data kromatogram GCMS dari nitrasi senyawa hasil hidrolisis, terlihat pada
gambar 4.10 menunjukan bahwa muncul beberapa data kromatogram dari
beberapa senyawa, dimana salah satunya adalah senyawa dengan waktu
224; 207; 177; 147; 102; dan 77. Adapun fragmentasi pada senyawa ini
adalah sebagai berikut :
Gambar 4.10 hasil kromatogram senyawa hasil nitrasi
Berdasarkan interpretasi GCMS dimana berat molekul apms (178)
bertambah 46 (-NO2) menunjukkan bahwa reaksi nitrasi ini telah berhasil
4.2.3 Esterifikasi Senyawa hasil Nitrasi
Senyawa hasil esterifikasi hasil nitrasi memiliki karakteristik sebagai
berikut :
Warna : kuning
Bau : tidak ada bau
Bentuk : kristal
Pengukuran titik leleh dilakukan dengan menggunakan melting point “smp 10”, sehingga didapatkan rentang titik leleh 101-1050C.
Penafsiran spektrum IR senyawa esterifikasi hasil nitrasi dari hasil
bilangan gelombang absorbansi gugus fungsi yang spesifik ditunjukkan
pada Tabel 4.1. (Lampiran 7). Ditemukan pita serapan pada bilangan
C-O pada pita serapan v 1334,80 – 1316,47 cm-1, serapan dari kedua gugus tadi menunjukkan terdapatnya ester. Dan diperkuat dengan munculnya pita
serapan pada bilangan gelombang v 2300-2000 cm-1. Lalu terdapatnya
gugus nitro pada posisi aromatik dapat ditunjukkan dengan adanya pita
Tabel 4.1 Daftar daerah spektrum IR senyawa esterifikasi hasil nitrasi
Ikatan Daerah Absorbansi (v, cm-1)
C=O 1690,68 – 1679,11
C-O 1334,80 -1316,47
C-H aril 3065,02 – 3031,26
C=C aril 1640,53 – 1604,84
C-H alifatik 2974,36 – 2882,74
C-O aril 1261,50 – 1220,03
Ester (COOR) 2300-2000
Aromatik posisi para 825,57
Nitro aromatik 1570 – 1300
Hal ini menunjukkan bahwa reaksi esterifikasi ini telah berhasil
dilakukan dimana ditunjukkan dengan munculnya gugus nitro aromatik
pada spektrum IR.
Analisa selanjutnya dilakukan dengan menggunakan GCMS.
Interpretasi GCMS menunjukkan bahwa senyawa ini muncul pada waktu
retensi 11,960 yang memiliki berat molekul 251 dengan fragmentasi massa
pada 251; 206; 178; 161; 134; 103; dan 77 (Lihat Lampiran 8). Adapun
Data analisa spektrum IR dan interpretasi GCMS dikonfirmasi
Gambar 4.11 senyawa Etil p-metoksisinamat
Tabel 4.2 Data Pergeseran kimia (δ) Spektrum 1
H NMR dan 13C NMR
senyawa EPMS dan senyawa hasil esterifikasi (CDCl3, 500 MHz)
Interpretasi NMR pada penelitian ini di bandingkan dengan hasil interpretasi
NMR pada senyawa etil p-metoksisinamat pada penelitian Mufidah (2014) dan
Hasali (2013). Spektrum H1NMR memberikan sinyal pada pergeseran kimia 1,32
ppm (3H) berbentuk triplet dan juga muncul pada 4,25 ppm (2H) berbentuk
quartet. Pada sinyal ini, terbentuk lebih downfield hal ini dikarenakan adanya
ikatan dengan oksigen. Spektrum H1NMR memberikan sinyal pada pergeseran
kimia 3,98 ppm (3H) dan muncul dengan bentuk singlet. Sinyal ini lebih ke arah
downfield karena berikatan dengan oksigen (-OCH3, metoksi). Pergeseran kimia
6,37 ppm (1H) berbentuk doublet memiliki hubungan dengan puncak pada
pergeseran kimia 7,59 ppm (1H) yang berbentuk doublet, dengan rentang nilai
konstanta kopling yang sama yaitu 15,6 Hz. Bentuk dari sinyal ini adalah olefin
dengan proton berkonfigurasi trans. Kemudian pada pergeseran kimia 7,11 ppm
(1H), 7,67 ppm (1H) dan 7,99 ppm (1H) merupakan proton-proton dari benzen
yang tersubstitusi. Pola sinyal pada pergeseran kimia 7,67 ppm menunjukkan
bahwa 1 proton terkopling secara ortho dengan 1 proton pada sinyal 7,11 ppm
dengan nilai konstanta kopling yaitu 9,1 Hz. Dan terkopling secara metha dengan
1 proton pada sinyal 7,99 ppm dengan nilai konstanta kopling yaitu 1,95 ppm.
Dari data interpretasi IR, GCMS, dan H1 NMR dan 13C NMR, senyawa hasil
esterfifikasi hasil nitrasi asam p-metoksisinamat adalah Etil 4-metoksi 6-Nitro
sinamat.
4.3 Pengujian Aktivitas Antiinflamasi dan Hubungan Struktur Aktivitas
Senyawa Hasil Modifikasi
Banyak sekali masalah yang terjadi berkaitan dengan penggunaan
hewan percobaan pada penelitian dalam bidang farmakologi, yaitu seperti
masalah kode etik dan kurang rasional pengguaan metode tersebut apabila
terdapat metode lain yang dapat digunakan (Chatterjee et al., 2012). Pada
penelitian ini, uji aktivitas antiinflamasi invitro dengan prinsip penghambatan
denaturasi protein (William et al., 2008) dipilih untuk melakukan skrining
awal antiinflamasi pada senyawa hasil modifikasi.
Penghambatan denaturasi protein, yang merupakan mekanisme utama
AINS sebagaimana yang dinyatakan oleh Mizushima (1964) sebelum
ditemukannya efek inhibisi pada siklooksigenase oleh Vane (1971),
mempunyai peran penting sebagai antirematik oleh AINS (Umapathy et al.,
2010).
Uji aktivitas antiinflamasi dilakukan pada 1 senyawa akhir yang
didapat melalui reaksi esterifikasi yaitu senyawa etil 4-metoksi 6-nitro
sinamat, senyawa etil p-metoksisinamat dan na diklofenak sebagai standard.
Pada uji inhibisi denaturasi BSA dengan rentang konsentrasi uji
50-0,035 ppm dapat memberikan % inhibisi >20% dianggap memiliki aktivitas
sebagai antiinflamasi (William et al., 2008). Natrium diklofenak aktif dalam
memberikan aktivitas sebagai antiinflamasi dimulai dari konsentrasi 10 ppm
dengan persen inhibisi 30,38 % dan pada konsentrasi 100 ppm dapat