SKRIPSI
PENGEMBANGAN PRODUK BUBUR GEL INSTAN BERBASIS PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERMODIFIKASI
Oleh: SHINTA F 24102117
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
SKRIPSI
PENGEMBANGAN PRODUK BUBUR GEL INSTAN BERBASIS PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERMODIFIKASI
Oleh: SHINTA F 24102117
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGEMBANGAN PRODUK BUBUR GEL INSTAN BERBASIS PATI UBI JALAR PUTIH (Ipomoea batatas L.) TERMODIFIKASI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh SHINTA F 24102117
Dilahirkan pada tanggal 20 Mei 1984 di Tangerang
Tanggal lulus : 13 Desember 2006
Disetujui, Bogor, 22 Januari 2007
Dr. Ir. Sugiyono, M.AppSc. Dr. Ir. Dede R. Adawiyah, MSi. Dosen pembimbing 1 Dosen pembimbing 2
Shinta. F24102117. Pengembangan Produk Bubur Gel Instan Berbasis Pati Ubi Jalar Putih (Ipomoea batatas L.) Termodifikasi. Di bawah bimbingan: Dr. Ir. Sugiyono, M.AppSc. dan Dr. Ir. Dede R. Adawiyah, MSi.
RINGKASAN
Pada penelitian ini, dilakukan pengembangan pati ubi jalar putih menjadi bubur gel instan melalui tahap modifikasi kimia dan fisik agar diperoleh tingkat gel yang baik dan stabil baik sebelum atau sesudah diberikan media pelengkap, seperti susu. Modifikasi kimia yang digunakan adalah hidrolisis asam dengan variasi pH 2, 3, 4 selama 2 dan 4 jam yang dilanjutkan dengan modifikasi ikatan silang menggunakan 5% STPP (sodium tripolifosfat) pada pH 9 dan modifikasi fisik (pre-gelatinisasi) menggunakan drum dryer. Tujuan penelitian ini adalah memperoleh pati instan yang memiliki tingkat gel yang baik dan dapat dikonsumsi sebagai bubur gel.
Pengaruh peningkatan pH dan waktu inkubasi pada pati termodifikasi asam terikat silang menyebabkan kadar amilosa cenderung semakin meningkat sehingga adanya modifikasi asam mempengaruhi kenaikan kadar amilosa pati. Peningkatan kekerasan gel hanya terjadi pada pati termodifikasi dengan perlakuan pH 2 (2 jam dan 4 jam). Kenaikan suhu awal gelatinisasi terjadi pada pati termodifikasi asam terikat silang dengan perlakuan pH 3 (2 jam dan 4 jam), sedangkan kenaikan suhu akhir gelatinisasi terjadi pada semua perlakuan terhadap pati termodifikasi asam terikat silang dan pati terikat silang. Derajat pembengkakan pati termodifikasi kimia memiliki grafik yang semakin meningkat dan cenderung stabil dibandingkan pati tanpa modifikasi pada suhu 100ºC. Semakin lama waktu inkubasi saat modifikasi asam, maka viskositas maksimum pada setiap perlakuan pH cenderung meningkat dengan viskositas maksimum tertinggi terjadi pada perlakuan pH 2 (2 jam dan 4 jam). Viskositas maksimum pati termodifikasi lebih tinggi dibandingkan pati tanpa modifikasi, yaitu hasil terbesar terdapat pada pati termodifikasi asam pada pH 2 selama 2 jam terikat silang (A2B2S), pati termodifikasi asam pada pH 2 selama 4 jam terikat silang (A2B4S), dan pati terikat silang (S) dengan nilai masing-masing 1510 BU, 1455 BU, dan 1420 BU. Namun, yang memiliki tingkat kekerasan gel yang terbesar adalah A2B2S dan A2B4S.
Pemilihan pati yang dimodifikasi fisik adalah pati termodifikasi kimia yang memiliki kekerasan gel terbesar (di atas 50gf) adalah A2B2S dan A2B4S, yaitu sebesar 56.0gf dan 68.3gf yang juga memiliki viskositas maksimum tertinggi. Kedua pati tersebut kemudian dimodifikasi fisik dan dilakukan uji organoleptik. Produk A2B2S, A2B4S, dan produk tanpa modifikasi (A0B0) sebagai pembanding diuji secara organoleptik untuk mendapatkan produk pilihan yang paling disukai panelis. Hasil uji organoleptik menunjukkan bahwa produk A2B4S merupakan produk yang paling disukai dengan skor hedonik citarasa sebesar 3.47 (cenderung disukai), skor tekstur sebesar 3.10 (netral), dan skor
Produk A2B4S memiliki kadar fosfor sebesar 0.151%. Kadar fosfor produk ini lebih tinggi jika dibandingkan kadar fosfor yang secara alami sudah ada sebesar 0.131% pada pati tanpa modifikasi. Meningkatnya kandungan fosfor tersebut menunjukkan telah terjadi ikatan silang antara fosfor dengan komponen di dalam granula pati. Adanya ikatan silang ditunjukkan dengan nilai derajat substitusi sebesar 0.008 yang menunjukkan bahwa pada produk A2B4S memiliki 8 ikatan silang di setiap 1000 unit anhidroglukosa atau satu ikatan silang di setiap 125 unit anhidroglukosa.
RIWAYAT PENULIS
Penulis bernama lengkap Shinta yang dilahirkan di Tangerang, 20 Mei 1984. Ia adalah putri ketujuh dari delapan bersaudara dari pasangan Teng Tjong Tek dan Lisa Sari Karwita. Riwayat pendidikan penulis dimulai di SDK Santa Patricia Jakarta (tahun1990-1996) kemudian dilanjutkan di SLTP Santa Patricia Jakarta (tahun 1996-1999) dan SMU 78 Jakarta (tahun 1999-2002). Penulis memulai jenjang pendidikan S1 di Institut Pertanian Bogor pada tahun 2002. Setamat SMU, penulis diterima di Institut Pertanian Bogor, Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, (yang kemudian berganti nama pada tahun 2005 menjadi Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian) melalui jalur SPMB (Seleksi Penyaringan Mahasiswa Baru).
Penulis terlibat dalam beberapa kegiatan organisasi selama masa studi di Departemen Ilmu dan Teknologi Pangan, yaitu Himpunan Mahasiswa Teknologi Pangan (HIMITEPA) tahun 2002-2006, UKM Keluarga Mahasiswa Buddhis Aditthana (KMBA) tahun 2002-2006 dan pada tahun 2002-2003 sempat menjabat sebagai sekretaris KMBA, Food Chat Club pada tahun 2003-2006 dan sempat menjabat sebagai bendahara pada tahun 2003-2004 serta sebagai sekretaris pada tahun 2004-2005. Penulis juga aktif mengikuti berbagai kepanitian acara di dalam kampus. Selain itu, penulis juga memiliki pengalaman kerja, yaitu saat menjalani praktek lapangan pada tahun 2005 selama dua bulan di PT. Essence Indonesia afiliasi dari IFF (International Flavor and Fragrance).
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Esa atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini yang berjudul ”Pengembangan Produk Bubur Gel Instan Berbasis Pati Ubi Jalar Putih (Ipomoea batatas L.) Termodifikasi”. Pada kesempatan ini, penulis mengucapkan terima kasih kepada beberapa pihak yang telah memberikan bantuan yang sangat berharga kepada:
1. Dr. Ir. Sugiyono, M.AppSc. selaku dosen pembimbing pertama dan Dr. Ir. Dede R. Adawiyah, MSi. selaku dosen pembimbing kedua atas segala bimbingan, arahan, masukan, dan nasihat-nasihat selama penelitian dan penyusunan skripsi penulis.
2. Dr. Ir. Yadi Haryadi, MSc. selaku dosen penguji atas saran, masukan, dan kesediaannya meluangkan waktu untuk menguji penulis.
3. PT Indofood Sukses Makmur, Tbk.: Bogasari Flour Mill selaku pihak yang telah mendanai sepenuhnya penelitian dan penulisan skripsi ini melalui Bogasari Nugraha Award 2005.
4. Kedua orang tua dan saudara atas doa, kasih sayang dan dukungan moril yang tiada hentinya kepada penulis.
5. Ivan Armatias selaku pemberi inspirasi dan penyemangat hidup yang telah memberikan dukungan dan kasih sayang.
6. Sahabat-sahabat tercinta sekaligus sebagai tim ubi jalar Bogasari, yaitu Nanda, Ribka, dan Pretty atas segala kerjasama, bantuan, dan semangat serta dukungan yang diberikan dalam suka dan duka selama empat tahun di ITP. 7. Para laboran laboratorium di Departemen Ilmu dan Teknologi Pangan, Pilot
Plant, dan laboratorium Gizi Seafast Center.
Herold, Stut, Meilina, Tukep, Karen, Julia, Arvi, Yeye, Randy, Evrin, Nene, Inggrid, Ajeng, Ina, Inal, Yudan, Steisi, Hanna, Inda, Feni, Ijal, Woro, Nya2, Boyon, Risna, Manginar, Nisvi, Bahar, Inda, Ulik, Dadik, Kiki, Farah, Putra, Hana, Didin, Eva, Manto, Dhenok, Temin, Gumilar, Eko, Zulkifli, Rahmat, dan teman-teman angkatan 39 lainnya yang juga bersama-sama melakukan penelitian di laboratorium atau magang. Terima kasih atas segala bantuan dan hiburannya.
9. Teman-teman angkatan 40, 41, dan 42.
10. Pihak-pihak lain yang tidak dapat disebutkan satu per satu.
Pada akhirnya, penulis berharap semoga skripsi ini berguna bagi yang memerlukan sehingga dapat dilakukan pengembangan untuk memperoleh hasil yang lebih optimum lagi.
Penulis
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xii
I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN ... 4
II. TINJAUAN PUSTAKA A. UBI JALAR ... 5
B. PATI UBI JALAR ... 6
C. MODIFIKASI PATI ... 9
1. Modifikasi Kimia ... 9
a. Hidrolisis Asam ... 10
b. Ikatan Silang ... 11
2. Modifikasi Fisik ... 12
III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT ... 15
B. METODE PENELITIAN ... 15
1. Penelitian Pendahuluan ... 15
2. Penelitian Utama ... 16
a. Modifikasi Pati ... 16
(1) Modifikasi asam ... 18
(2) Modifikasi Ikatan Silang ... 19
(3) Modifikasi Fisik ... 20
C. METODE PENGAMATAN ... 21
1. Metode Pengamatan Pati Tanpa Modifikasi ... 21
a. Rendemen Pati ... 21
b. Efisiensi Ekstraksi Pati ... 22
c. Derajat Putih ... 22
c. Analisis Kadar Pati ... 22
2. Metode Pengamatan Pati Tanpa Modifikasi ... 24
a. Penentuan Suhu Gelatinisasi dan Viskositas ... 24
b. Derajat Pembengkakan ... 24
c. Analisis Kadar Amilosa ... 25
d. Bentuk Granula Pati ... 27
e. Kekerasan Gel ... 27
3. Metode Pengamatan Produk ... 27
a. Kadar Air Metode Oven ... 27
b. Kadar abu ... 28
c. Kadar Protein ... 28
d. Kadar Lemak ... 29
e. Kadar Karbohidrat ... 29
f. Bentuk Granula Pati ... 30
g. Penentuan Kadar Fosfor ... 30
h. Derajat Substitusi ... 31
i. Uji Organoleptik ... 31
j. Penentuan Umur Simpan ... 32
IV. HASIL DAN PEMBAHASAN A. EKSTRAKSI PATI UBI JALAR ... 34
B. KARAKTERISTIK PATI UBI JALAR ... 35
B. MODIFIKASI KIMIA ... 36
1). Kadar Amilosa ... 38
2). Kekerasan Gel ... 40
3). Suhu Gelatinisasi dan Viskositas ... 43
C. MODIFIKASI FISIK ... 47
D. KARAKTERISTIK DUA PRODUK UNGGULAN ... 48
1). Karakteristik Organoleptik ... 49
2). Bentuk Granula Produk Prototipe ... 54
3). Derajat Substitusi Produk Prototipe ... 55
4). Uji Proksimat Produk Prototipe ... 56
5) Penentuan Umur Simpan Produk Prototipe ... 59
V. KESIMPULAN DAN SARAN A. KESIMPULAN ... 63
B. SARAN ... 64
DAFTAR PUSTAKA ... 65
DAFTAR TABEL
Halaman Tabel 1. Produksi, luas panen dan hasil per hektar ubi jalar di Indonesia ... .1 Tabel 2. Kode sampel berdasarkan variasi perlakuan ... 21 Tabel 3. Penentuan Glukosa, Fruktosa, dan Gula Invert dalam suatu
bahan dengan metode Luff-Schoorl ... 23 Tabel 4. Cara pembuatan standar amilosa ... 26 Tabel 5. Nilai RH dan Aw dari larutan garam jenuh yang digunakan
(suhu 30ºC) ... 32 Tabel 6. Hasil rendemen pati ubi jalar putih ... 34
Tabel 7. Hasil proksimat produk A2B4S tanpa penambahan gula halus
DAFTAR GAMBAR
Halaman Gambar 1. (a) Sruktur kimia amilosa; (b) Struktur kimia amilopektin;
(c) Penampakan amilosa dan amilopektin di dalam granula pati ..8
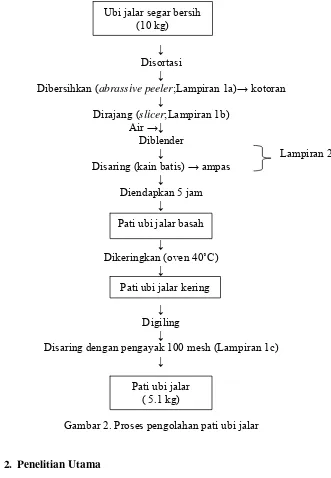
Gambar 2. Proses pengolahan pati ubi jalar ... 16
Gambar 3. Diagram alir pembuatan pati termodifikasi secara keseluruhan . 17 Gambar 4. Diagram alir pembuatan pati termodifikasi asam ... 18
Gambar 5. Diagram alir modifikasi pati dengan metode ikatan silang menggunakan STPP ... 19
Gambar 6. Diagram alir modifikasi fisik pembuatan tepung bubur gel instan dari pati ubi jalar ... 20
Gambar 7. Brabender Amylograph ... 24
Gambar 8. Texture Analyzer TA-XT2i ... 27
Gambar 9. (a) Ubi jalar putih varietas Sukuh sebelum dicuci dan dikupas; (b) Ubi jalar putih varietas Sukuh setelah dicuci dan dikupas ... 34
Gambar 10. Pati ubi jalar hasil pengendapan yang siap dikeringkan ... 35
Gambar 11. Pati ubi jalar kering yang siap dihaluskan ... 35
Gambar 12. Hasil grafik Brabender Amylograph pati tanpa modifikasi ... 36
Gambar 13. Grafik Brabender Amylograph pati termodifikasi dan tanpa termodifikasi yang menunjukkan kisaran suhu gelatinisasi dan viskositas maksimum ... 37
Gambar 14. Kadar amilosa pati termodifikasi dan pati tanpa modifikasi ... 40
Gambar 15. Kekerasan gel pati termodifikasi dan tanpa modifikasi ... 42
Gambar 16. (a) Penampakan gel dengan kekerasan gel dibawah 50gf (b) Penampakan gel dengan kekerasan gel diatas 50gf ... 42
Gambar 17. Suhu awal gelatinisasi dari pati ubi jalar putih yang telah dimodifikasi asam dan ikatan silang ... 43
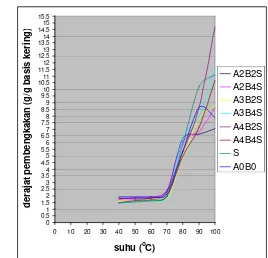
Gambar 19. Grafik derajat pembengkakan ( g/g basis kering) pati modifikasi
dan tanpa modifikasi diberbagai suhu ... 47
Gambar 20. Pati pre-gelatinisasi yang belum dihaluskan ... 48
Gambar 21. Penampakan produk sebelum penambahan susu; (a) 24 S, (b) 22 S, (c) NS ... 50
Gambar 22. Skor hedonik tekstur ... 52
Gambar 23. Skor hedonik overall ... 52
Gambar 24. Hasil uji ranking bubur gel ... 53
DAFTAR LAMPIRAN
Halaman
Lampiran 1a. Alat abrassive peeler... 70
Lampiran 1b. Slicer ... 71
Lampiran 1c. Alat pengayak pati 100 mesh ... 72
Lampiran 2. Proses penghancuran ubi jalar putih dan pengekstrakan pati .. 72
Lampiran 3. Kadar pati murni pada pati ubi jalar tanpa modifikasi ... 73
Lampiran 4. Hasil ANOVA kadar amilosa ... 74
Lampiran 5. Hasil ANOVA kekerasan gel ... 75
Lampiran 6a. Hasil ANOVA suhu awal gelatinisasi ... 76
Lampiran 6b. Hasil ANOVA suhu akhir gelatinisasi ... 77
Lampiran 7. Hasil ANOVA viskositas maksimum ... 78
Lampiran 8. Data derajat pembengkakan ( g/g basis kering) diberbagai suhu ... 79
Lampiran 9. Double drum dryer (pengering drum ganda) ... 79
Lampiran 10 Form pengujian oeganoleptik ... 80
Lampiran 11. Data rekapitulasi terhadap citarasa produk ... 82
Lampiran 12. Hasil ANOVA citarasa ... 83
Lampiran 13. Data rekapitulasi terhadap tekstur produk... 84
Lampiran 14. Hasil ANOVA tekstur ... 85
Lampiran 15. Data rekapitulasi terhadap overall produk ... 86
Lampiran 16. Hasil ANOVA overall ... 87
Lampiran 17. Nilai ranksum uji ranking... 88
Lampiran 18. Hasil uji ranking dengan Friedman test ... 89
Lampiran 20. Hasil analisis kadar fosfor ... 91
Lampiran 21a. Data hasil pengujian kadar air ... 92
Lampiran 21b. Data hasil pengujian kadar abu produk A2B4 S ... 93
Lampiran 21c. Data hasil pengujian kadar protein produk A2B4 S ... 93
Lampiran 21d. Data hasil pengujian kadar lemak produk A2B4 S ... 93
I. PENDAHULUAN
A. LATAR BELAKANG
Indonesia kaya akan sumber daya alam, tetapi masyarakat Indonesia
terbatas dalam pemanfaatannya sehingga banyak sumber daya alam tersebut
kurang memiliki nilai tambah, khususnya dalam bidang pangan.
Pendayagunaan yang kurang optimal tersebut disebabkan masih sedikitnya
teknologi pengolahan pascapanen yang diterapkan dan nilai ekonomis ubi jalar
yang rendah. Oleh karena itu, perlunya optimalisasi sumber daya alam yang
ada di Indonesia sebagai upaya penganekaragaman pangan serta
meningkatkan nilai tambah dari sumber daya alam tersebut. Salah satu bahan
pangan yang berpotensi adalah ubi jalar karena selama ini pemanfaatannya di
Indonesia juga kurang optimal, sedangkan produksi ubi jalar di Indonesia dari
tahun ke tahun cukup tinggi (Tabel 1). Meskipun luas lahan produksi ubi jalar
di Indonesia rata-rata mengalami penurunan setiap tahunnya, tetapi
produktivitas rata-rata hasil panen per hektar meningkat.
Tabel 1. Produksi, luas panen dan hasil per hektar ubi jalar di Indonesia
Tahun Produksi (ton)a Luas panen (ha)b Hasil per hektar (ton/ha)c
1998 1.935.044 202.093 9,6 1999 1.665.547 172.243 9,7 2000 1.827.687 194.262 9,4 2001 1.749.070 181.926 9,6 2002 1.771.692 177.276 10,0 2003 1.991.478 198.187 10,1 2004 1.901.802 181.882 10,4
2005 1.857.169 178.331 10.4 Sumber: a) Departemen Pertanian, 2003a
Pada saat ini sebagian besar masyarakat Indonesia membutuhkan pangan
yang praktis, khususnya untuk memenuhi kebutuhan sarapan. Oleh karena itu,
perlu dibuat produk dalam bentuk instan sehingga produk dapat dikonsumsi
hanya dengan menggunakan air matang. Dengan demikian, produk ini disebut
sebagai convenient foods yang juga cocok untuk daerah korban bencana alam
karena pada daerah pengungsian mereka sulit untuk memasak.
Tanaman ubi jalar mempunyai beberapa kelebihan bila dibandingkan
dengan tanaman sumber pati lainnya, yaitu dapat bertahan hidup dalam
kondisi iklim yang kurang baik, petumbuhannya tidak tergantung dari jenis
atau tipe tanah khusus, tidak membutuhkan input produk yang intensif, umur
tanaman yang pendek (3.5-4 bulan) sehingga mudah diperbanyak.
Sebagian besar ubi jalar terdiri atas air dan karbohidrat, yaitu sebesar
72.8% dan 24.3%. Karbohidrat pada ubi jalar terdiri atas pati, gula, selulosa,
pektin, dan hemiselulosa. Sebagian besar karbohidrat pada ubi jalar terdapat
dalam bentuk pati. Kadar pati ubi jalar dipengaruhi oleh umur tanaman ubi
tersebut saat dipanen. Pati ubi jalar terdiri atas 60%-70% amilopektin dan
10%-25% amilosa (Banks dan Greenwood, 1975).
Pati merupakan polimer glukosa dengan ikatan α-glikosida yang berperan sebagai cadangan makanan yang terdapat dalam biji-bijian atau
umbi-umbian. Pati atau karbohidrat secara umum merupakan bahan organik
pertama yang diproduksi dari reaksi antara karbondioksida dari udara dan air
dari dalam tanah, pada suatu proses fotosintesis dengan menggunakan energi
kimia menjadi suatu substansi atau zat yang dapat dimakan oleh manusia
ataupun hewan pada umumnya. Dengan demikian, menurut Greenwood dan
Munro (1987), pati memegang peranan penting dalam bidang pangan,
terutama dalam hal menyediakan kebutuhan energi manusia di dunia dengan
porsi yang tinggi. Selain itu, pati lebih mudah diubah sifatnya dengan
menggunakan modifikasi pati secara kimia ataupun fisik sehingga sesuai
dengan karakteristik yang diinginkan. Oleh karena itu, basis pati dipilih
Dalam bentuk aslinya secara alami, pati merupakan butiran-butiran
kecil yang disebut granula. Menurut Hodge dan Osman (1987)n, bentuk dan
ukuran granula merupakan karakteristik setiap jenis pati, karena itu dapat
digunakan untuk identifikasi. Selain ukuran granula, karakteristik lain adalah
bentuk, keseragaman granula, lokasi hilum, serta permukaan granulanya. Pati
ubi jalar memiliki diameter granula yang berukuran antara 15 μm sampai 55 μm (Fennema, 1976).
Produk yang dikembangkan dari pati modifikasi tersebut adalah bubur
instan yang dapat dikonsumsi dalam basis gel dengan penyajian yang cepat
serta dapat dikonsumsi oleh semua golongan umur sebagai makanan sarapan.
Bentuk bubur gel ini dipilih karena umumnya masyarakat mengkonsumsi
bubur sebagai makanan sarapan, sedangkan basis gel dipilih karena pati
mudah sekali membentuk gel. Selain itu, banyak masyarakat Indonesia
menyukai produk berbasis gel.
Pati termodifikasi adalah pati yang diperlakukan secara fisik atau kimia
untuk mengubah salah satu atau lebih sifat fisik atau kimianya yang penting.
Definisi pati termodifikasi lainnya adalah pati yang diberi perlakuan tertentu
yang bertujuan untuk menghasilkan sifat yang lebih baik untuk memperbaiki
sifat sebelumnya atau untuk mengubah beberapa sifat lainnya menjadi sifat
yang diinginkan.
Beberapa keunggulan pati modifikasi dibandingkan pati alami, antara
lain pati modifikasi dapat memiliki sifat fungsional yang tidak terdapat pada
pati alami. Selain itu, pati modifikasi dapat lebih luas penggunaannya dalam
skala industri besar yang lebih baik daripada pati alami karena pati alami
memiliki viskositas yang tidak stabil, penampakan yang kurang baik serta
memiliki stabiitas gel yang rendah. Pati modifikasi juga memiliki sifat yang
lebih konsisten dibandingkan dengan pati alami sehingga memudahkan
pengontrolan dan pembuatan produk dengan kualitas yang dapat dipercaya.
Oleh karena itu, pada penelitian ini digunakan modifikasi fisik dan kimia
B. TUJUAN
Penelitian ini bertujuan untuk memperoleh pati instan yang memiliki
tingkat gel yang baik melalui modifikasi kimia dan fisik dan dapat
II. TINJAUAN PUSTAKA
A.UBI JALAR
Ubi jalar (Ipomoea batatas L.) merupakan tanaman yang termasuk
ke dalam famili Convolvulaceae. Ubi jalar termasuk tanaman tropis,
tumbuh baik di daerah yang memenuhi persyaratan tumbuhnya, yaitu hawa
panas dengan udara yang lembab, suhu optimumnya 27oC dan lama
penyinaran 11-12 jam per hari. Ubi jalar dapat tumbuh sepanjang tahun di
dataran rendah maupun di pegunungan sampai 1000 m. Tidak seperti
tanaman palawija lainnya, ubi jalar tidak memerlukan tanah yang subur
(Soemartono, 1984).
Tanaman ini menyimpan cadangan makanannya di dalam batang.
Bagian batang yang berada di dalam tanah dan mengandung cadangan
makanan ini disebut umbi batang. Pada umumnya umbi-umbian
merupakan sumber karbohidrat terutama pati atau sumber citarasa dan
aroma karena mengandung oleoresin. Pembentukan umbi secara cepat
dimulai satu bulan setelah tanam dan mengembang setelah dua bulan.
Umbi yang ideal adalah lonjong agak panjang dan beratnya mencapai
200-250 gram (Soemartono, 1984).
Tanaman ubi jalar mempunyai beberapa kelebihan bila dibandingkan
dengan tanaman sumber pati lainnya. Kelebihan-kelebihan tersebut adalah
dapat bertahan hidup dalam kondisi iklim yang kurang baik,
petumbuhannya tidak tergantung dari jenis atau tipe tanah khusus, tidak
membutuhkan input produk yang intensif, dan umur tanaman yang pendek
(3.5-4 bulan) sehingga mudah diperbanyak.
Ubi jalar bermacam-macam jenisnya. Berdasarkan warna daging
umbinya, terdapat ubi jalar putih, ubi jalar merah, dan ubi jalar ungu. Kulit
ubi jalar lebih tipis dibandingkan dengan kulit ubi kayu. Bentuk umbi ubi
jalar sering tidak seragam (bulat, lonjong, benjol-benjol). Warna dagingnya
putih, krem, kuning, merah muda, dan jingga bergantung pada jenis dan
Sebagian besar umbi ubi jalar terdiri atas air dan karbohidrat, yaitu
sebesar 72.8% dan 24.3%. Karbohidrat pada ubi jalar terdiri atas pati, gula,
selulosa, pektin, dan hemiselulosa. Sebagian besar karbohidrat pada ubi
jalar terdapat dalam bentuk pati. Pati ubi jalar terdiri dari 60-70%
amilopektin dan sisanya adalah amilosa. Sukrosa merupakan gula yang
banyak terdapat dalam ubi jalar. Selain karbohidrat, ubi jalar putih juga
mengandung lemak dan protein (Soemartono, 1984).
Ubi jalar varietas Sukuh memiliki rendemen yang tinggi dengan
kandungan pati yang tinggi dibandingkan dengan varietas yang lainnya.
Tanaman ubi jalar tersebut memiliki karakteristik semi kompak dengan
panjang 75-150 cm, tidak memiliki umbi yang kembar pada satu tanaman,
dan daunnya secara umum berbentuk hati. Ubi jenis ini dapat tumbuh
dengan stabil pada tiga daerah dengan iklim yang berbeda, yaitu Bogor,
Lembang, dan Malang. Bogor adalah daerah dengan iklim tropis lembab
dengan keadaan tanah yang kurang subur. Lembang memiliki iklim yang
lebih dingin dan berdataran tinggi, sedangkan Malang memiliki tanah yang
sangat subur. Masa panen yang ideal terjadi pada hari ke-120 setelah
penanaman (di dataran rendah) dan hari ke-150 (di dataran tinggi)
(Tjintokohadi et al., 2001).
B. PATI UBI JALAR
Menurut Greenwood dan Munro (1979) yang diacu dalam Muchtadi
et al. (1987), pati memegang peranan penting dalam bidang pangan,
terutama dalam hal penyediaan kebutuhan energi manusia di dunia dengan
porsi yang tinggi. Lebih dari 80% tanaman pangan terdiri atas biji-bijian
atau umbi-umbian dan tanaman sumber pati lainnya.
Pati merupakan polimer glukosa dengan ikatan α-glikosida yang berperan sebagai cadangan makanan yang terdapat dalam biji-bijian atau
umbi-umbian. Pati atau karbohidrat secara umum merupakan bahan
organik pertama yang diproduksi, yaitu reaksi antara karbondioksida dari
udara dan air dari dalam tanah, pada suatu proses fotosintesis dengan
dimakan oleh manusia ataupun hewan pada umumnya (Greenwood dan
Munro, 1979).
Kadar pati ubi jalar dipengaruhi oleh umur tanaman ubi tersebut saat
dipanen. Semakin tua umur ubi dipanen, maka kadar patinya semakin
kecil, sedangkan serat kasar dan kadar abunya tidak dipengaruhi oleh
tanaman ubi saat dipanen.
Dalam bentuk aslinya secara alami, pati merupakan butiran-butiran
kecil yang disebut granula. Bentuk dan ukuran granula merupakan
karakteristik setiap jenis pati, karena itu dapat digunakan untuk
identifikasi. Selain ukuran granula, karakteristik lain adalah bentuk,
keseragaman granula, lokasi hilum, serta permukaan granulanya (Hodge
dan Osman, 1976). Pati ubi jalar memiliki dianmeter granula yang
berukuran antara 15 μm sampai 55 μm (Fennema, 1976).
Karbohidrat yang terdapat pada ubi jalar umumnya sekitar 80-90%
dari bobot kering ubi jalar. Pati ubi jalar merupakan bagian terbesar
karbohidrat dalam ubi jalar dan amilopektin merupakan bagian terbesar
dari pati ubi jalar. Pati tersusun paling sedikit oleh tiga komponen utama,
yaitu amilosa, amilopektin, dan material antara seperti protein dan lemak.
Umumnya pati ubi jalar mengandung 60%-70% amilopektin, 10%-25%
amilosa, dan 5%-10% material antara (Banks dan Greenwood, 1975).
Amilosa merupakan polimer linier yang terdiri atas unit glukosa
yang dihubungkan melalui ikatan glikosida α-D-(1,4) membentuk rantai lurus dengan bobot molekul 106 (Gambar 1 (a)) (Fennema, 1976). Tiap
rantai pati dapat mengandung 200 sampai 2000 unit glukosa. Amilopektin
merupakan polimer bercabang dimana terdiri dari ± 4000 unit glukosa dan
tiap unit glukosa dihubungkan dengan ikatan glikosida α-D-(1,4) pada rantai lurusnya serta ikatan glikosida α-D-(1,6) pada titik percabangannya (Gambar 1 (b)). Tiap cabangnya mengandung 20-30 unit glukosa
(Fennema, 1976;Wurzburg, 1989). Percabangan ini menyusun sekitar
4-5% dari seluruh ikatan pada amilopektin. Bobot molekul amilopektin
Secara mikroskopik, dalam granula pati, campuran molekul
berstruktur linier dan bercabang membentuk lapisan-lapisan tipis yang
berbentuk cincin atau lamela, dimana lamela tersebut terpusat mengelilingi
titik awal yang disebut hilum atau hilus (Bouwkamp, 1985). Antara
molekul amilosa yang berdekatan atau bagian luar cabang amilopektin
dapat mengadakan hubungan paralel melalui ikatan hidrogen membentuk
daerah kristal atau misel. Diantara misel-misel terdapat daerah amorf
(daerah yang kurang padat) yang mempunyai sifat mudah menyerap air
(Hodge dan Osman, 1976). Misela menyebabkan granula pati memiliki
sifat birefringence, yaitu sifat yang dapat merefleksikan atau memantulkan
cahaya terpolarisasi sehingga granula akan tampak berwarna-warni di
bawah mikroskop (Gambar 17) (Whistler et al., 1984) Penampakan
amilosa dan amilopektin di dalam granula pati dapat dilihat pada Gambar
1.
(a) (b)
((((((
(c)
C. MODIFIKASI PATI
Pati termodifikasi adalah pati yang diperlakukan secara fisik atau
kimia untuk mengubah salah satu atau lebih sifat fisik atau kimianya yang
penting. Definisi pati termodifikasi lainnya adalah pati yang diberi
perlakuan tertentu yang bertujuan untuk menghasilkan sifat yang lebih baik
untuk memperbaiki sifat sebelumnya atau untuk mengubah beberapa sifat
lainnya menjadi sifat yang diinginkan.
Beberapa keunggulan pati modifikasi dibandingkan dengan pati
alami, antara lain: (1) pati modifikasi dapat memiliki sifat fungsional yang
tidak terdapat pada pati alami, (2) pati modifikasi dapat lebih luas
penggunaannya dalam skala industri besar dan lebih baik daripada pati
alami. Pati alami memiliki viskositas yang tidak stabil, penampakan yang
kurang baik serta memiliki stabilitas gel yang rendah. Pati modifikasi juga
memiliki sifat yang lebih konsisten dibandingkan pati alami sehingga
memudahkan pengontrolan dan pembuatan produk dengan kualitas yang
dapat dipercaya.
1. Modifikasi Kimia
Menurut Langan (1989), modifikasi kimia yang biasa digunakan
dalam industri pangan adalah ikatan silang, stabilisasi, pemutihan,
hidrolisis, oksidasi, substitusi lipofilik, dan teknik hidrofobik. Pati
ikatan silang dapat tahan terhadap suhu yang tinggi, pH yang rendah,
dan gesekan yang keras serta dapat meningkatkan viskositas
(Nabeshima dan Grossmann, 2001). Modifikasi dengan stabilisasi
terdiri atas reaksi esterifikasi dan eterifikasi. Modifikasi ini
menghasilkan pati dengan tingkat retrogradasi yang lebih rendah dan
stabilitas yang meningkat serta dapat mengurangi pembentukan gel.
Modifikasi pemutihan berguna untuk menghilangkan noda-noda yang
secara alami terdapat pada pigmen sehingga dapat meningkatkan
derajat keputihan. Selain itu, modifikasi pemutihan dapat menurunkan
populasi mikroba pada pati (Langan, 1989). Hidrolisis asam
menjadi mudah membentuk gel. Modifikasi oksidasi juga dapat
menurunkan viskositas serta dapat menghasilkan gel yang lembut.
Substitusi lipofilik digunakan untuk modifikasi yang berkaitan dengan
emulsi minyak dalam air dan pati, sedangkan modifikasi hidrofobik
digunakan untuk membuat produk pati yang tahan terhadap air
(Langan, 1989).
Berdasarkan kegunaan masing-masing modifikasi yang telah
dijelaskan sebelumnya, maka untuk membentuk bubur gel pati yang
memiliki tingkat gel dan stabilitas yang baik, pada penelitian ini
dilakukan dual modifikasi, yaitu modifikasi kimia metode hidrolisis
asam yang dilanjutkan metode ikatan silang dan modifikasi fisik
dengan pre-gelatinisasi.
a) Hidrolisis Asam
Hidrolisis asam adalah salah satu bentuk modifikasi asam
yang dapat merubah sifat fisik dan kimia pati tanpa merubah
struktur granulanya (Shi dan Seib, 1992). Jika hidrolisis asam
dilakukan dengan menggunakan asam kuat, maka berat molekul dari
komponen pati akan semakin rendah karena asam akan
menghidrolisis ikatan glikosida sehingga memperpendek rantai
ikatan kimia pada pati (Wurzburg, 1989). Menurut French (1984)
yang diacu dalam Whistler et al. (1984), potongan yang memiliki
berat molekul rendah akan memudahkan penggabungan dari rantai
molekul linier. Penggabungan tersebut akan menghasilkan
pembentukan gel pati melalui pembentukan jaringan tiga dimensi
dari molekul pati, terutama tarik-menarik antara rantai lurus dari
amilosa dan antara molekul dengan ikatan hidrogen pada molekul
air (Meyer, 1973).
Kerr (1950) diacu dalam Wurzburg (1989) menyatakan bahwa
daerah amorf yang mengandung cabang pada ikatan glikosida β -D-(1,6) lebih mudah mengalami hidrolisis oleh asam dibandingkan
mudah menjadi fraksi linier. Oleh karena itu, pada tahap awal
modifikasi ini, jumlah amilosa atau fraksi linier dari pati tersebut
lebih tinggi dibandingkan pati tanpa modifikasi. Hal ini
mengindikasikan bahwa amilopektin lebih mudah terhidrolisis
daripada amilosa.
b) Ikatan Silang
Menurut Wurzburg (1989), senyawa kimia yang biasa
digunakan untuk membuat pati terikat silang ini adalah asam adipat,
fosfor oksiklorit, sodium trimetafosfat (STMP), epiklorohidrin, dan
sodium tripolifosfat (STPP). Pereaksi asam adipat merupakan asam
dikarboksilat (C6H11O4), hasil oksidasi dari berbagai jenis lemak,
digunakan bersama-sama dengan senyawa anhidrid sehingga
menghasilkan pati adipat. Fosfor oksiklorit, STMP, dan STPP akan
menghasilkan pati fosfat, sedangkan epiklorohidrin akan
menghasilkan pati gliserol. Akan tetapi, dalam membuat pati
modifikasi untuk bidang pangan hanya dapat menggunakan pati
adipat dan pati fosfat (Wurzburg, 1989).
Reaksi yang terjadi dengan menggunakan fosfor oksiklorit
atau asam adipat yang dicampur dengan anhidrid akan berlangsung
sangat cepat. Bagian yang tidak bereaksi dengan pati akan dapat
dengan cepat terhidrolisis. Kecepatan reaksi dengan menggunakan
STMP dan STPP berjalan lebih lambat dibandingkan dengan reaksi
menggunakan pereaksi fosfor oksiklorit dan asam adipat.
(Wurzburg, 1989).
Pada pati adipat, ikat silang dikombinasikan dengan hidroksil
pada pati melalui ikatan organik ester. Pati tersebut tahan terhadap
kondisi asam. Pati fosfat terjadi melalui ikatan antara pati dengan
ikatan ester anorganik. Pati tersebut tahan terhadap kondisi asam.
Metode ikatan silang dapat menghasilkan ikatan sintetik yang
dapat menggantikan ikatan hidrogen yang secara alami terdapat
dalam pati dan berperan dalam menjaga bentuk pati (Langan, 1989).
Dengan adanya pemanasan, maka granula pati akan mengembang
seiring melemahnya ikatan hidrogennya yang kemudian terjadi
perpecahan ikatan hidrogen tersebut. Akan tetapi, bentuk granula
tetap dapat dipertahankan karena adanya ikatan kimia akibat reaksi
ikatan silang yang membentuk jembatan antar molekul di dalam pati
sehingga menghasilkan keutuhan yang cukup untuk menjaga bentuk
granula yang sedang mengalami pembengkakan. Dengan demikian,
reaksi ikatan silang ini dapat meminimalkan atau mencegah
kehilangan viskositas (Wurzburg, 1989). Jika dibandingkan dengan
pati yang tidak dimodifikasi, viskositas pati akan meningkat sampai
mencapai puncak tertentu karena masih adanya ikatan hidrogen,
meskipun dalam kondisi melemah akibat pemanasan. Akan tetapi,
ketika pemanasan terjadi secara kontinyu, maka ikatan hidrogen
yang menjaga bentuk granula akan bersama-sama pecah dan hancur
dengan bentuk granula tersebut sehingga viskositas menjadi
menurun (Wurzburg, 1989).
Penambahan sodium sulfat atau sodium klorida sebelum
pengkondisian pH basa pada modifikasi ikatan silang berfungsi
menghambat pati tergelatinisasi secara awal. Mudahnya pati
menjadi tergelatinisasi tersebut akibat kondisi pH yang terlalu basa
sehingga mempercepat amilosa dan amilopektin keluar dari granula.
Selain itu, bahan kimia tersebut berfungsi mempercepat reaksi
fosforilasi (Woo dan Seib, 2002).
2. Modifikasi Fisik
Modifikasi fisik merupakan perubahan karakteristik pati yang
disebabkan perlakuan fisik, biasanya dikenal dengan pre-gelatinisasi.
Alat yang umumnya digunakan dalam pre-gelatinisasi adalah spray
mudah larut dalam air dingin (Langan, 1989). Produk pre-gelatinisasi
ini biasanya digunakan untuk produk-produk yang menggunakan pati
gel yang dibuat dalam basis instan. Nama lain pati pregelatinisasi
adalah precooked starch, pregelled starch, instant starch, cold water
starch, dan cold water swellable starch.
Mekanisme dari pre-gelatinisasi sama prinsipnya dengan
gelatinisasi. Akan tetapi, pre-gelatinisasi tersebut menyebabkan pati
yang telah mengalami gelatinisasi terhidrasi. Sifat inilah yang
menyebabkan pati pre-gelatinisasi dapat larut dalam air dingin.
Pada proses gelatinisasi, granula pati akan mengembang dalam
air panas atau hangat. Pembengkakan granula pati tersebut bersifat
reversible jika tidak melewati suhu gelatinisasi dan akan menjadi
irreversible jika telah mencapai suhu gelatinisasi (Greenwood dan
Munro, 1979).
Mekanisme gelatinisasi pati, yaitu ketika suspensi pati
dipanaskan, molekul-molekul air akan berpenetrasi masuk ke dalam
granula dan terperangkap pada susunan molekul-molekul amilosa dan
amilopektin. Dengan naiknya suhu suspensi pati dalam air, maka
pembengkakan granula semakin besar. Hal ini disebabkan karena
ikatan-ikatan hidrogen yang menahan molekul amilosa dan
amilopektin semakin lemah (Hodge dan Osman, 1976). Pembengkakan
tersebut bersifat reversible, artinya granula pati yang telah mengalami
pembengkakan dapat kembali seperti kondisi semula. Jika pemanasan
diteruskan, maka setelah mencapai suhu tertentu, maka sifat
pembengkakan granula menjadi irreversible. Pada akhirnya, granula
pati akan pecah sehingga molekul-molekul pati akan keluar terlepas
dari granula masuk ke dalam sistem larutan. Proses itulah yang disebut
gelatinisasi, sedangkan suhu dimana proses gelatinisasi berlangsung
disebut suhu gelatinisasi (Winarno, 1984).
Menurut Hodge dan Osman (1976), suhu gelatinisasi merupakan
suatu kisaran karena granula dari tiap jenis pati memiliki bentuk dan
pembengkakan granula juga berbeda. Selain itu, proses gelatinisasi
juga menyebabkan terjadinya perubahan-perubahan seperti viskositas,
peningkatan kejernihan pasta, larutnya molekul amilosa, dan hilangnya
sifat birefringence pati. Menurut BeMiller dan Whistler (1996), ubi
jalar memiliki suhu gelatinisasi sekitar 82-83oC. Suhu gelatinisasi ini
berhubungan dengan sifat granula pati seperti diameter, densitas, dan
jumlah senyawa yang diserap.
Menurut Chiu et al. (1982), dalam membuat gel instan dari pati
atau pati yang dapat membentuk gel hanya dengan mencampurkan air
dingin, dapat menggunakan metode modifikasi gabungan antara
hidrolisis asam dan ikatan silang dengan tambahan modifikasi fisik
untuk membuat produk menjadi instan, yaitu dengan pre-gelatinisasi.
Kombinasi tersebutlah yang digunakan dalam penelitian ini.
Kombinasi antara modifikasi asam (metode hidrolisis asam) dan
ikatan silang tersebut digunakan karena adanya hidrolisis asam dapat
mengontrol jumlah amilosa yang keluar dari granula, sedangkan ikatan
silang dapat menjaga bentuk granula tetap utuh agar tidak mudah
kehilangan viskositas. Selain itu, ikatan silang dapat meningkatkan
daya tahan granula akibat gesekan akibat tahap pre-gelatinisasi.
Tepung bubur gel pati ubi jalar ini merupakan produk akhir yang
diinginkan. Penyajian yang digunakan pada tepung bubur ini adalah
dilakukan penambahan air panas dengan takaran tertentu selama
beberapa menit (tergantung hasil penelitian) hingga dihasilkan
penyerapan 100%. Penyajian berikutnya adalah penggunaan media
pelengkap untuk bubur tersebut yang berupa cairan, yaitu dapat
digunakan susu atau santan, dimana disesuaikan dengan selera.
Adanya media susu atau santan yang digunakan dalam penyajiannya,
maka tepung bubur instan ini diharapkan memiliki sifat yang minimum
terhadap penyerapan akibat penambahan media tersebut sehingga tidak
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan baku utama yang digunakan pada penelitian ini adalah ubi jalar
putih varietas Sukuh yang diperoleh dari pasar tradisional yang berlokasi di
Ciapus, Bogor. Bahan-bahan tambahan yang digunakan antara lain air, HCl
pekat, H2SO4 pekat, HNO3 pekat, NaOH 10%, natrium sulfat (Na2SO4),
sodium tripolifosfat (Na5P3O10), etanol 80%, larutan Pb asetat, pereaksi
vanadat molibdat, larutan P2O5, Na-oksalat anhidrat, larutan Luff-Schoorl,
larutan Na-thiosulfat 0.1 N, indikator pati, kertas saring, ether, heksana,
garam jenuh, air destilasi, dan air bebas ion. Alat-alat yang digunakan pada
penelitian ini adalah abrassive peeler, slicer, blender, kain batis, saringan
100 mesh, pompa vakum, oven, drum dryer, neraca analitik, hot plate,
sealer, vortek, inkubator goyang, waterbath, sentrifus, tabung sentrifus,
spektrofotometer, pH meter, texture analyzer TA-XT2i, strirer, serta
alat-alat untuk analisis kimia, analisis fisik, peralat-alatan uji organoleptik, desikator,
timbangan, alat-alat gelas, dan alat masak lainnya.
B. METODE PENELITIAN 1. Penelitian Pendahuluan
Pada tahap ini dilakukan ekstraksi pati ubi jalar melalui tahap
pencucian, pengupasan, pengecilan ukuran, penyaringan, pengendapan,
dan pengeringan. Tahapannya disajikan pada Gambar 2. Analisis yang
dilakukan pada tahap ini adalah rendemen pati, efisiensi ekstraksi pati,
derajat putih, kadar amilosa, suhu awal gelatinisasi, suhu puncak
gelatinisasi, viskositas maksimum, derajat pembengkakan, kekerasan
Disortasi
Dibersihkan (abrassive peeler;Lampiran 1a) kotoran
Dirajang (slicer;Lampiran 1b) Air
Diblender
Lampiran 2
Disaring (kain batis) ampas
Diendapkan 5 jam
Dikeringkan (oven 40˚C)
Digiling
[image:32.612.158.489.70.548.2]Disaring dengan pengayak 100 mesh (Lampiran 1c)
Gambar 2. Proses pengolahan pati ubi jalar
2. Penelitian Utama a. Modifikasi Pati
Modifikasi pati ubi jalar dilakukan dengan metode hidrolisis
asam dan ikatan silang. Metode hidrolisis asam menggunakan asam
klorida sebagai pereaksi, yaitu pada pH 2, pH 3, dan pH 4 dan dengan
lama waktu reaksi 2 jam dan 4 jam, sedangkan metode ikatan silang
menggunakan pereaksi sodium tripolifosfat (STPP) dengan
konsentrasi 5% pada pH 9. Diagram alir tahapan modifikasi secara
keseluruhan disajikan pada Gambar 3. Analisis yang dilakukan Ubi jalar segar bersih
(10 kg)
Pati ubi jalar ( 5.1 kg) Pati ubi jalar basah
terhadap pati termodifikasi kimia adalah kadar amilosa, suhu awal
gelatinisasi, suhu puncak gelatinisasi, viskositas maksimum, derajat
pembengkakan, dan kekerasan gel. Pati yang terpilih kemudian
dimodifikasi fisik sehingga dihasilkan produk. Analisis yang
dilakukan terhadap produk terpilih adalah kadar amilosa, suhu awal
gelatinisasi, suhu puncak gelatinisasi, viskositas maksimum, derajat
pembengkakan, kekerasan gel, dan uji organoleptik. Hasil terpilih dari
uji organoleptik kemudian dilakukan analisis kadar amilosa, suhu
awal gelatinisasi, suhu puncak gelatinisasi, viskositas maksimum,
derajat pembengkakan, kekerasan gel, proksimat, bentuk granula pati,
dan kadar fosfor
Pati ubi jalar
Produk
Gambar 3. Diagram alir pembuatan pati termodifikasi secara keseluruhan (Modifikasi Erungan, 1991)
Modifikasi asam
Modifikasi ikatan silang
Pemilihan pati berdasarkan kekerasan gel terbesar
Modifikasi fisik
(1) Modifikasi Asam
Diagram alir tahapan modifikasi asam disajikan pada Gambar 4, dimana
menggunakan asam pekat HCl 0.1 N. Variasi pH yang digunakan pada pati,
yaitu pada pH 2, 3, dan 4 dengan masing-masing waktu inkubasi selama 2
jam dan 4 jam.
Pati + air (1 : 3)
Ditambahkan HCl 0.1 N sampai mencapai pH tertentu (pH 2, 3, 4) kemudian dimasukkan ke dalam inkubator goyang pada suhu 35˚C selama 2 dan 4 jam
dengan kecepatan 200 rpm
Dinetralkan dengan NaOH 5 % dan etanol 80 % dengan
perbandingan 1 : 1
Disaring dengan pompa vakum
Dicuci dengan air destilata sebanyak 1 x
Dikeringkan dengan oven pada suhu 40˚C
Pati termodifikasi asam
(2) Modifikasi Ikatan Silang
Diagram alir tahapan modifikasi ikatan silang disajikan pada Gambar 5,
dimana menggunakan pereaksi sodium tripolifosfat (STPP) sebanyak 5% ke
dalam pati termodifikasi asam yang telah dikondisikan pada pH 9.
Penambahan sodium sulfat sebelum pengkondisian pH 9 berfungsi
menghambat pati tergelatinisasi secara awal.
Pati termodifikasi asam
Ditambahkan Na2SO4 5% basis kering pati yang telah dilarutkan ke dalam air bebas ion (70 ml tiap 50 gram basis kering)
Ditambahkan NaOH 10% sampai mencapai pH 9
Ditambahkan STPP (sodium tripolifosfat) 5% basis kering pati
Dimasukkan ke dalam inkubator goyang pada 25ºC selama 1 jam dengan kecepatan 200 rpm
Dimasukkan ke dalam inkubator goyang pada 40ºC selama 3 jam dengan kecepatan 200 rpm
Diatur pH menjadi 5.5 dengan HCl 0.1 N
Dipompa vakum menggunakan kertas saring Whatman No. 01 dengan pembilasan air bebas ion sebanyak 5x
[image:35.612.112.497.170.684.2]Dikeringkan dengan oven pada suhu 40ºC
Gambar 5. Diagram alir modifikasi pati dengan metode ikatan silang menggunakan STPP (Wattanachant et al., 2003)
Pati ubi jalar termodifikasi (3) Modifikasi Fisik
Pati yang terpilih dari hasil modifikasi kimia kemudian dilanjutkan
dengan tahapan modifikasi fisik. Diagram tahapan modifikasi fisik disajikan
pada Gambar 6, dimana menggunakan drum dryer (Lampiran 12).
air
Suspensi pati 10%
Pregelatinisasi (drum dryer; 4 bar, 5 rpm)
Digiling halus bersama gula halus dan garam (pati : gula halus : garam – 3 : 1 : 0.1)
termodifikasi
Gambar 6. Diagram alir modifikasi fisik pembuatan tepung bubur gel instan dari pati ubi jalar (Kalogianni et al, 2002)
b. Perlakuan
Pati termodifikasi asam diperoleh dari hasil modifikasi asam
dengan menggunakan asam pekat HCl 0.1 N pada berbagai pH
selama waktu inkubasi tertentu. Pati termodifikasi asam tersebut
kemudian masing-masing dimodifikasi ikatan silang dengan
menggunakan pereaksi sodium tripolifosfat (STPP) 5% sehingga
dihasilkan pati termodifikasi kimia sebagai berikut (Tabel 2) :
Tabel 2. Kode sampel berdasarkan variasi perlakuan Kode Sampel Perlakuan
A2B2S Pati termodifikasi asam pH 2 selama waktu inkubasi 2 jam dan terikat silang
A2B4S Pati termodifikasi asam pH 2 selama waktu inkubasi 4 jam dan terikat silang
A3B2S Pati termodifikasi asam pH 3 selama waktu inkubasi 2 jam dan terikat silang
A3B4S Pati termodifikasi asam pH 3 selama waktu inkubasi 4 jam dan terikat silang
A4B2S Pati termodifikasi asam pH 4 selama waktu inkubasi 2 jam dan terikat silang
A4B4S Pati termodifikasi asam pH 4 selama waktu inkubasi 4 jam dan terikat silang
S Pati terikat silang tanpa termodifikasi asam A0B0 Pati tanpa modifikasi
C. METODE PENGAMATAN
1. Metode Pengamatan Pati Tanpa Modifikasi b. Rendemen Pati
Rendemen pati ubi jalar dihitung berdasarkan perbandingan
bobot kering pati yang diperoleh terhadap bobot umbi segar tanpa kulit
(bobot bersih). Perhitungan rendemen dihitung dengan menggunakan
rumus :
Keterangan :
a = bobot kering pati ubi jalar
b = bobot umbi ubi jalar bersih
c. Efisiensi Ekstraksi Pati
Efisiensi ekstraksi pati dihitung berdasarkan perbandingan
rendemen pati yang diperoleh dari hasil penelitian terhadap kadar pati
di dalam umbi. Efisiensi ekstraksi pati dihitung dengan menggunakan
rumus :
Efisiensi ekstraksi pati (%) = a x 100% b
Keterangan :
a = rendemen pati hasil penelitian
b = kadar pati di dalam umbi
d. Derajat Putih metode Whiteness Meter
Derajat putih diukur dengan menggunakan alat Whitenessmeter.
Pada alat ini dibandingkan derajat putih contoh dengan derajat putih
standar (MgO) yang bernilai 100%. Skala terkecil dari
Whitenesssmeter adalah 0% (sama dengan warna hitam) dan skala
terbesar adalah 100% (sama dengan warna putih dari standar MgO).
Pembacaan derajat putih contoh dapat dilihat langsung pada skala yang
terdapat pada Whitenessmeter. Derajat putih dari contoh yang diukur
mempunyai nilai 0-100%.
e. Analisis Kadar Pati (Apriyantono et al., 1989)
Pati tanpa modifikasi sebanyak 2-5 gram dimasukkan ke dalam
gelas piala 250 ml kemudian ditambahkan 50 ml akuades lalu diaduk
dengan akuades sampai volume filtrat 250 ml. Filtrat ini mengandung
karbohidrat yang larut dan dibuang.
Pati yang terdapat sebagai residu pada kertas saring dicuci
dengan 10 ml eter untuk menghilangkan lemak pada pati. Eter
dibiarkan menguap dari residu kemudian dicuci dengan alkohol 10%
untuk membebaskan lebih lanjut karbohidrat yang terlarut.
Residu dipindahkan secara kuantitatif dari kertas saring ke dalam
erlenmeyer dengan pencucian 200 ml akuades dan tambahkan 20 ml
HCl ± 25 % (bobot jenis 1.125), erlenmeyer ditutup dengan pendingin
balik dan dipanaskan di atas penangas air mendidih selama 2.5 jam.
Setelah dingin, larutan dinetralkan dengan larutan NaOH 45%
dan diencerkan sampai volume 500 ml lalu disaring. Kadar gula
dinyatakan sebagai glukosa dari filtrat yang diperoleh berdasarkan tabel
Luff-Schroorl (Tabel 3). Kadar glukosa dikalikan 0.9 merupakan kadar
pati.
Tabel 3. Penentuan Glukosa, Fruktosa, dan Gula Invert dalam suatu bahan dengan metode Luff-Schoorl
ml 0.1 N Na-thiosulfat
Glukosa, fruktosa, gula invert mg
C6H12O6
ml 0.1 N Na-thiosulfat
Glukosa, fruktosa, gula invert mg
C6H12O6
2. Metode Pengamatan Pati Termodifikasi dan Tanpa Modifikasi a. Penentuan Suhu Gelatinisasi dan Viskositas (Metode Brabender)
Penentuan suhu gelatinisasi dan viskositas pati ditentukan dengan
metode Brabender Amylograph. Alat Brabender Amylograph dapat
dilihat pada Gambar 7. Air destilata sebanyak 450 ml dimasukkan ke
dalam 45 gram sampel di dalam gelas piala. Suspensi dimasukkan ke
dalam wadah amilograf. Lengan sensor dipasang dan dimasukkan ke
dalam wadah dengan cara menaikkan head amilograph. Suhu awal
termoregulator diatur pada suhu 20°C. Switch pengatur suhu harus pada
posisi nol. Switch pengatur diatur pada posisi bawah (97°C) sehingga
jika masih hidup, suhu akan meningkat 1,5°C tiap 1 menit. Mesin
amilograf dihidupkan sehingga wadah akan berputar. Setelah suspensi
mencapai suhu 30°C, pena pencatat diatur pada skala kertas. Setelah
pasta mencapai suhu 95°C, pena akan terus bergerak sampai mencapai
[image:40.612.284.385.393.525.2]suhu dan viskositas maksimum.
Gambar 7. Brabender Amylograph
b. Derajat Pembengkakan (Sasaki dan Matsuki., 1998)
Sampel sebanyak 0.2 gram basis kering ditimbang dalam tabung
sentrifus yang telah ditimbang kemudian ditambahkan 5 ml air
destilata. Tabung sentrifus divortek kemudian dimasukkan ke dalam
waterbath goyang pada suhu 40°C, 50°C, 60°C, 70°C, 80°C, dan 90°C
selama 30 menit serta 100°C selama 1 jam. Tabung kemudian
didinginkan secepatnya dan disentrifus dengan kecepatan 3000 rpm
Endapan yang terbentuk kemudian ditimbang. Derajat pembengkakan
dihitung dengan menggunakan rumus :
Derajat pembengkakan (g/g basis kering) = W2-W1 W
Keterangan :
W2 = bobot tabung sentrifus setelah supernatan sudah dibuang (gram)
W1 = bobot tabung sentrifus dalam keadaan kering (gram)
W = bobot pati yang dimasukkan ke dalam tabung sentrifus
(gram basis kering)
c. Analisis Kadar Amilosa (Aliawati, 2003) Standarisasi Amilosa
Amilosa murni 40 mg dimasukkan ke dalam labu takar 100 ml
kemudian ditambahkan 1 ml etanol dan 9 ml NaOH 1N. Larutan
dibiarkan selama 23 jam pada suhu kamar atau dipanaskan dalam
penangas air bersuhu 100°C selama 10 menit. Larutan kemudian dipipet
dalam labu takar 100 ml dengan perlakuan seperti tercantum pada Tabel
4.
Masing-masing larutan ditambahkan dengan 1 ml asam asetat 1N
dan 2 ml I2 2% lalu diencerkan sampai volume 10 ml. Absorban diukur
dengan menggunakan spektrofotometer pada gelombang 620 nm
dengan rumus :
Abs rata-rata per1 ppm : a/2 + b/4 + c/6 + d/8 + e/12 + f/16
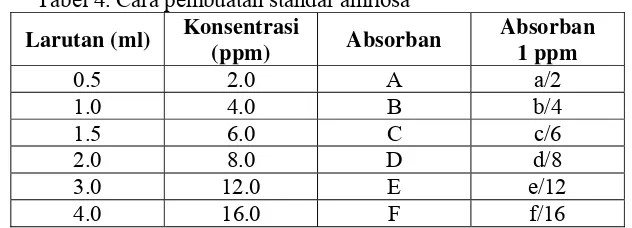
Tabel 4. Cara pembuatan standar amilosa
Larutan (ml) Konsentrasi
(ppm) Absorban
Absorban 1 ppm
0.5 2.0 A a/2 1.0 4.0 B b/4 1.5 6.0 C c/6 2.0 8.0 D d/8 3.0 12.0 E e/12 4.0 16.0 F f/16
Penentuan Kadar Amilosa Sampel
Sampel pati 100 mg dimasukkan ke dalam labu takar 100 ml
kemudian ditambahkan 1 ml etanol dan 9 ml NaOH 1N. Larutan
dibiarkan selama 23 jam pada suhu kamar atau dipanaskan dalam
penangas air bersuhu 100°C selama 10 menit dan didinginkan selama 1
jam. Larutan diencerkan dengan air suling menjadi 100 ml kemudian
sebanyak 5 ml dimasukkan ke dalam labu takar 100 ml yang berisi 60
ml air dan sebanyak 1 ml asam asetat 1 N dan 2 ml I2 2 % ditambahkan
dan diencerkan sampai volume 100 ml. Larutan dikocok dan didiamkan
selama 20 menit kemudian diukur absorbannya pada gelombang 620
nm. Kadar amilosa dihitung dengan rumus :
Kadar amilosa (%) = A 620 x f.k x 100 x 100% 100-k.a
Dimana f.k = 1
Abs 1 ppm x 50
Keterangan :
A 620 = absorban contoh
k.a = kadar air
d. Bentuk Granula Pati (metode mikroskopik)
Satu tetes suspensi pati ubi jalar diletakkan pada gelas objek.
Pengamatan dilakukan dengan menggunakan mikroskop yang
dilengkapi dengan kamera (Olympus C-35 A, Tokyo, Japan).
f. Kekerasan Gel (Anonim a, 2005)
Kekerasan gel pati ubi jalar menggunakan Texture Analyzer
(TA-XT2i) dengan jenis probe jenis cylinder delrin ukuran ½ inchi.
Perangkat alat Texture Analyzer (TA-XT2i) yang digunakan dapat
[image:43.612.243.413.304.434.2]dilihat pada Gambar 8.
Gambar 8. Texture Analyzer TA-XT2i
2. Metode Pengamatan Produk
a. Kadar Air Metode Oven (AOAC, 1995)
Sejumlah sampel (kurang lebih 5g) dimasukkan ke dalam cawan
yang telah diketahui bobotnya. Kemudian cawan dimasukkan ke dalam
oven bersuhu 100oC hingga diperoleh bobot yang konstan. Perhitungan
kadar air dilakukan dengan menggunakan rumus :
Kadar air (wet basis) (%) = ( )x100% c
b a
c− −
Kadar air (dry basis) (%) = ( )x100% b
a b a c
− − −
Keterangan : a = bobot cawan dan sampel akhir (g),
b = bobot cawan (g),
c = bobot sampel awal (g)
b. Kadar Abu (AOAC, 1995)
Cawan porselin dikeringkan dalam tanur bersuhu 400-600oC,
kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 3-5 g
sampel ditimbang dan dimasukkan ke dalam cawan porselin.
Selanjutnya sampel dipijarkan di atas nyala pembakar bunsen sampai
tidak berasap lagi, kemudian dilakukan pengabuan di dalam tanur listrik
pada suhu 400 – 600oC selama 4 – 6 jam atau sampai terbentuk abu
berwarna putih. Sampel kemudian didinginkan dalam desikator,
selanjutnya ditimbang. Kadar abu dhitung dengan menggunakan rumus:
Kadar abu(%) = 100%
) (
) (
x g sampel berat
g abu berat
c. Kadar Protein (AOAC, 1995)
Sampel sebanyak 0.1 gram dimasukkan ke dalam labu Kjeldahl
30 ml kemudian ditambahkan 1.9 gram K2SO4, 40 mg HgO, dan 2 ml
H2SO4. Sampel didinginkan dan ditambah sejumlah kecil air secara
perlahan-lahan kemudian didinginkan kembali. Isi tabung dipindahkan
ke alat destilasi dan labu dibilas 5-6 kali dengan 1-2 ml air. Air cucian
dipindahkan ke labu destilasi.
Erlenmeyer berisi 5 ml larutan H3BO3 dan 2 tetes indikator
(campuran 2 bagian merah metil 0.2% dalam alkohol dan 1 bagian biru
metilen 0.2% dalam alkohol) diletakkan di bawah kondensor. Ujung
tabung kondensor harus terendam di bawah larutan H3BO3. ditambah
larutan NaOH-Na2SO3 sebanyak 8-10 ml kemudian didestilasi dalan
erlenmeyer. Tabung kondensor dibilas dengan air dan bilasannya
ditampung dalam erlenmeyer yang sama. Isi erlenmeyer diencerkan
terjadi perubahan warna. Penetapan untuk blanko juga dilakukan
dengan cara yang sama. Perhitungan kadar protain dilakukan dengan
menggunakan rumus :
Kadar N(%) = (ml HCl – ml blanko) x N HCl x 14.007 x 100 mg sampel
Kadar protein (%) = % N x faktor konversi (6.25)
d. Kadar Lemak, Metode Soxhlet (AOAC, 1995)
Labu lemak dikeringkan dalam oven bersuhu 100-110ºC
kemudian didinginkan dalam desikator dan ditimbang. Sampel dalam
bentuk tepung ditimbang sebanyak 5 gram lalu dibungkus dengan
kertas saring dan dimasukkan ke dalam alat ekstraksi (soxhlet) yang
telah berisi pelarut heksana.
Refluks dilakukan minimum selama 5 jam dan pelarut yang ada
di dalam labu lemak kemudian didestilasi. Selanjutnya, labu lemak
yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu
100ºC hingga beratnya konstan kemudian didinginkan dalam desikator
dan ditimbang. Perhitungan kadar lemak dilakukan dengan
mengggunakan rumus :
Kadar lemak (%) = berat lemak (gram) x 100% berat sampel (gram)
e. Kadar Karbohidrat by difference (AOAC, 1995)
Kadar karbohidrat dengan metode by difference merupakan
penentuan kadar karbohidrat bahan makanan secara kasar dimana
bukan berdasarkan analisis, melainkan melalui perhitungan. Kadar
karbohidrat tersebut diperoleh berdasarkan rumus :
f. Bentuk Granula Pati (metode mikroskopik)
Satu tetes suspensi pati ubi jalar diletakkan pada gelas objek.
Pengamatan dilakukan dengan menggunakan mikroskop yang
dilengkapi dengan kamera (Olympus C-35 A, Tokyo, Japan).
g. Penentuan Kadar Fosfor (Apriyantono et al., 1989) Pembuatan kurva standar
Larutan fosfat standar masing-masing 0.00, 1.25, 2.50, 5.00, 7.50
ml dimasukkan ke dalam satu seri labu takar 100 ml. Masing-masing
aliquot diencerkan sampai volume 50-60 ml dengan akuades. Sebanyak
25 ml pereaksi vanadat-molibdat ditambahkan ke dalam masing-masing
labu takar dan diencerkan sampai volume 100 ml dengan akuades.
Larutan didiamkan selama 10 menit kemudian absorbansi
masing-masing larutan di dalam kuvet gelas diukur dengan spektrofotometer
pada panjang gelombang 400 nm. Masing-masing larutan tersebut
mengandung 0, 0.5, 1.0, 2.0, dan 3.0 mg P2O5/ 100 ml. Kurva
absorbansi vs mg P2O5 /100 ml kemudian dibuat.
Persiapan sampel
Sebanyak 10 ml HCl 5M ditambahkan pada sejumlah abu dari
pengabuan kering. Larutan disaring dengan kertas saring Whatman No.
1 dan filtrat dimasukkan ke dalam labu takar 250 ml. Cawan dibilas
dengan akuades kemudian air pembilas yang telah disaring
dicampurkan dengan filtrat di dalam labu takar. Endapan dicuci dengan
kertas saring sebanyak 2x dengan 20 ml akuades. Filtrat diencerkan
sampai tanda tera.
Penetapan sampel
Sebanyak 10 ml larutan yang diperoleh dari persiapan sampel
dimasukkan ke dalam labu takar 100 ml. Sebanyak 40 ml akuades dan
diencerkan dengan akuades sampai tanda tera. Larutan didiamkan
selama 10 menit kemudian absorbansinya diukur dengan
spektrofotometer pada panjang gelombang 400 nm. Konsentrasi fosfor
dari kurva standar berdasarkan absorbansi yang terbaca kemudian
dicatat. Kadar fosfor dihitung dengan menggunakan rumus :
Kadar fosfor (%) = mg fosfor sampel x total vol lar abu x 100% vol lar abu yang digunakan x berat sampel(mg)
h. Derajat Substitusi (Chang dan Lii, 1992)
Banyaknya ikatan silang yang terjadi dapat ditentukan dengan
mengetahui besarnya derajat substitusi (DS). Derajat substitusi dihitung
dengan rumus :
Derajat substitusi (DS) = 162 P 3100-124 P
dimana P adalah kadar fosfor
i. Uji Organoleptik
Analisis organoleptik dilakukan kepada 30 orang panelis tidak
terlatih terhadap produk bubur gel ubi jalar. Analisis organoleptik
meliputi uji hedonik dan uji ranking. Uji hedonik dilakukan untuk
mengetahui tingkat penerimaan panelis terhadap produk tersebut,
sedangkan uji ranking untuk mengetahui formulasi mana yang paling
disukai.
Parameter yang diujikan untuk uji hedonik adalah citarasa,
tekstur, dan overall dengan menggunakan lima skala (1 = sangat tidak
suka; 5 = sangat suka). Uji ranking dilakukan dengan pemberian
ranking pada produk. Ranking 1 menunjukkan produk yang paling
disukai. Data uji hedonik yang diperoleh kemudian dianalisa secara
statistik dengan program komputer statistik untuk uji keragaman atau
dilanjutkan dengan uji Duncan (SPSS 11.5). Data uji ranking yang
diperoleh dianalisa secara statistik dengan menggunakan Friedman test
yang dilanjutkan dengan uji lanjut LSD (SPSS 11.5).
j. Penentuan Umur Simpan
Penentuan umur simpan pada tepung bubur gel instan dari pati
ubi jalar dilakukan dengan penentuan kurva sorpsi isothermis,
penentuan kadar air kritis, dan pengukuran umur simpan. Penentuan
kurva sorpsi isothermis dilakukan dengan penyimpanan di dalam
desikator yang telah dijenuhkan dengan garam jenuh yang sesuai pada
8 level RH (Tabel 4) yang berbeda sampai mengalami kerusakan.
Penentuan Kurva Sorpsi Isothermis (Spies dan Wolf, 1987)
Sampel sebanyak 5 gram diletakkan pada cawan aluminium lalu
dimasukkan ke dalam desikator yang telah dijenuhkan dengan larutan
garam jenuh yang sesuai. Nilai RH dan Aw dari masing-masing larutan
[image:48.612.226.440.479.656.2]garam jenuh yang digunakan dapat dilihat pada Tabel 5.
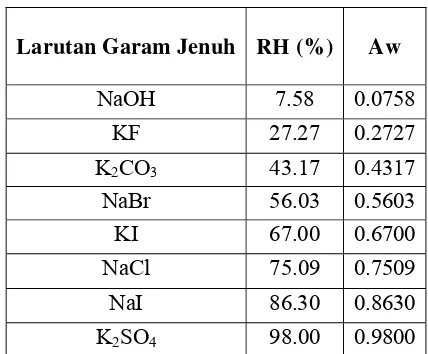
Tabel 5. Nilai RH dan Aw dari larutan garam jenuh yang digunakan (suhu 30oC)
Larutan Garam Jenuh RH (%) Aw
NaOH 7.58 0.0758
KF 27.27 0.2727
K2CO3 43.17 0.4317
NaBr 56.03 0.5603
KI 67.00 0.6700
NaCl 75.09 0.7509
NaI 86.30 0.8630
b Po Ws A x k mc me mi me gain ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − − = ln θ
Desikator kemudian disimpan pada suhu 30oC (konstan). Contoh
ditimbang secara periodik hingga beratnya konstan dengan selang
penimbangan satu hari. Contoh yang telah mencapai berat konstan lalu
diukur kadar air dan aktivitas air kesetimbangan maka dapat dibuat
kurva sorpsi isothermisnya.
Penentuan Kadar Air Kritis
Penentuan kadar air kritis dilakukan dengan meletakkan sampel
ke dalam desikator yang telah dijenuhkan garam jenuh KNO3 dengan
RH 93.00%. Parameter yang diamati yaitu pada saat sampel mulai
menggumpal kemudian diukur kadar air kritisnya.
Pengukuran Umur Simpan (Labuza, 1982)
Data-data yang dibutuhkan untuk menentukan umur simpan
produk pada suatu suhu dan RH tertentu adalah kadar air awal (mi),
kadar air kritis (mc), kadar air kesetimbangan (me), permeabilitas uap
air kemasan (k/x), berat kering produk (Ws), luas permukaan kemasan
(A), tekanan uap air jenuh (Po) dan kemiringan/slope kurva sorpsi
isotermis (b). Kemudian dari nilai-nilai di atas umur simpan dapat
ditentukan dengan persamaan sebagai berikut :
Keterangan :
θgain : waktu perkiraan umur simpan (hari) me : kadar air kesetimbangan (%bk) mi : kadar air awal (%bk)
mc : kadar air kritis (%bk) Ws : berat kering bahan (g)
A : luas permukaan kemasan (m2)
k/x : permeabilitas uap air kemasan (g/m2/hari/mmHg) Po : tekanan uap jenuh (mmHg)
IV. HASIL DAN PEMBAHASAN
A. EKSTRAKSI PATI UBI JALAR
Ubi jalar putih varietas Sukuh yang digunakan pada penelitian ini
memiliki umur panen berkisar empat bulan. Penampakan ubi jalar putih
varietas Sukuh segar dapat dilihat pada Gambar 9.
(a) (b)
Gambar 9. (a) Ubi jalar putih varietas Sukuh sebelum dicuci dan dikupas; (b) Ubi jalar putih varietas Sukuh setelah dicuci dan dikupas
Hasil rendemen yang diperoleh selama penelitian dapat dilihat pada
Tabel 6. Rendemen pati ubi jalar dihitung berdasarkan bobot pati (bobot
kering) per bobot ubi jalar segar bersih. Tabel 6 menunjukkan rata-rata
rendemen pati sebesar 12.64%. Efisiensi ekstraksi pati dihitung berdasarkan
rata-rata rendemen pati dari penelitian ini per rendemen pati berdasarkan SNI
01 - 4493 - 1998 tentang ubi jalar yaitu sebesar 25% sehingga dihasilkan
efisiensi ekstraksi pati sebesar 51%.
Tabel 6. Hasil rendemen pati ubi jalar putih Berat
bersih (kg)
Kadar air pati berat kering
(%)
Berat pati (kg)
Berat kering pati (kg)
Rendemen (%)
10.40 12.48 1.30 1.14 10.96 9.80 11.62 1.45 1.28 13.06 30.55 12.77 4.71 4.11 13.45 32.95 13.92 5.01 4.31 13.08
B. KARAKTERISTIK PATI UBI JALAR
Pati ubi jalar yang telah dihasilkan yang belum dikeringkan dapat dilihat
pada Gambar 10, sedangkan yang sudah dikeringkan dan siap dihaluskan
dapat dilihat pada Gambar 11 dengan derajat putih pati sebesar 85.7%. Standar
mutu pati ubi jalar di Indonesia terhadap derajat putih ini memang belum ada,
tetapi jika dibandingkan dengan standar mutu tapioka (pati ubi kayu)
berdasarkan SNI 01-3451-1994, yaitu sebesar 94.5% untuk mutu I dan 92%
untuk mutu II. Secara visual, pati ubi jalar yang dihasilkan memang memiliki
[image:51.612.241.414.270.402.2]warna putih kecoklatan.
Gambar 10. Pati ubi jalar basah hasil pengendapan yang siap dikeringkan
Gambar 11. Pati ubi jalar kering yang siap dihaluskan
Pati tersusun paling sedikit oleh tiga komponen utama, yaitu amilosa,
amilopektin, dan material antara seperti protein dan lemak (Banks dan
Greenwood, 1975). Dengan demikian, pati yang diperoleh melalui ekstraksi
pati belum merupakan pati murni sehingga masih mengandung material
[image:51.612.242.413.443.577.2]analisis tersebut, kadar pati murni dari pati ubi jalar putih yang dihasilkan
sebesar 81% dengan kadar amilosa sebesar 14.1%.
Gambar 12 menunjukkan grafik suhu gelatinisasi dan viskositas pati ubi
jalar putih tanpa modifikasi dengan menggunakan Brabender Amylograph.
Berdasarkan grafik tersebut, diperoleh suhu awal gelatinisasi sebesar 75˚C,
suhu puncak gelatinisasi sebesar 82˚C, dan viskositas maksimumnya sebesar
710 BU. Setelah mencapai suhu puncak gelatinisasi, viskositas pati menurun
sehingga grafiknya menurun.
Viskositas pati tersebut menurun setelah mencapai viskositas puncak
saat pengaturan suhu 95˚C pada Brabender Amylograph karena ikatan
hidrogen pada granula pati melemah sehingga granula yang telah
mengembang bersama-sama dengan ikatan hidrogen menjadi pecah dan
hancur menyebabkan air yang semula berada di dalam granula pati ikut keluar
mengakibatkan viskositas menjadi menurun (Wurzburg, 1989).
Gambar 12. Hasil grafik Brabender Amylograph pati tanpa modifikasi
C. MODIFIKASI KIMIA
Hidrolisis asam merupakan tahap modifikasi awal yang dilakukan
sebelum modifikasi ikatan silang. Hal ini dikarenakan pati yang telah terikat
silang memiliki granula yang tahan terhadap kondisi asam, sedangkan
granula agar menghasilkan tingkat gel yang lebih baik (Anonim, 2005).
Dengan adanya ikatan silang, dapat menjaga bentuk granula tetap utuh agar
tidak mudah kehilangan viskositas akibat pecahnya granula. Selain itu, ikatan
silang dapat meningkatkan daya tahan granula akibat gesekan pada tahap
pre-gelatinisasi. Hasilnya dapat dilihat pada uji viskositas melalui grafik
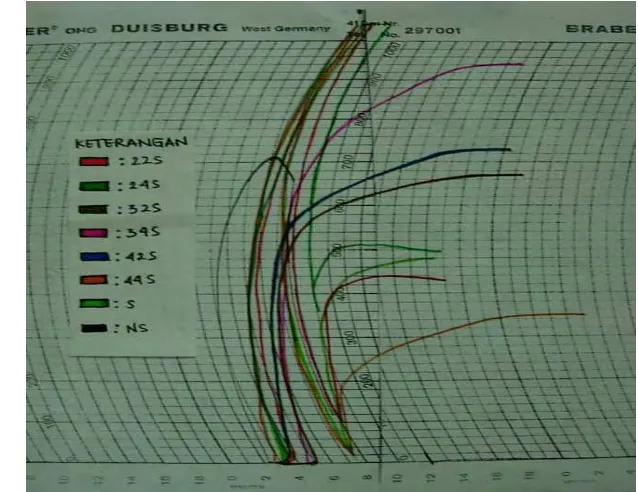
Brabender Amylograph, dapat dilihat pada Gambar 13 yang menunjukkan
bahwa grafik pati tanpa modifikasi memiliki puncak gelatinisasi yang tidak
stabil, sedangkan pati yang termodifikasi kimia memiliki puncak gelatinisasi
yang stabil. Pati tanpa modifikasi memiliki viskositas maksimum yang
menurun setelah mencapai puncak gelatinisasi, sedangkan pati yang
termodifikasi kimia memiliki viskositas maksimum yang stabil.
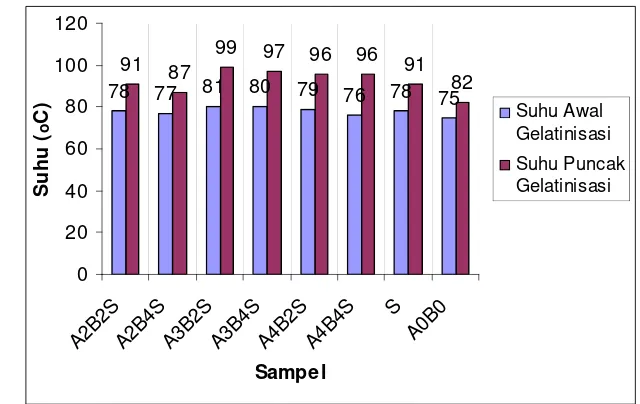
[image:53.612.162.481.304.550.2]Keterangan : 22 S = A2B2S, 24 S = A2B4S, 32 S = A3B2S, 34 S = A3B4S, 42 S = A4B2S, 44 S = A4B4S, S = S, NS = A0B0
Gambar 13. Grafik Brabender Amylograph pati termodifikasi dan tanpa modifikasi yang menunjukkan kisaran suhu gelatinisasi dan viskositas maksimum
Hidrolisis asam pada penelitian ini menggunakan asam kuat HCl
sebagai pereaksinya. Modifikasi asam ini dapat mengubah sifat fisik dan kimia
tersebut dipengaruhi