SIFAT ANTIJAMUR EKSTRAK METANOL KULIT BATANG Litsea tomentosa Blume.
NOVITRI HASTUTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Antifungal Properties of Methankol Extract from Bark of Litsea tomentosa Blume By:
Noviitri Hastuti, Wasrin Syafii, Philippe Geradin ABSTRACT
The bark is a waste that produced from harvesting activity and wood processing that have not been utilized efficiently. The bark volume is about 10-20% of whole stem volume depend on stem diameter. The bark utilization also has been grow to extract utilization for medical purpose, anti-fungi, anti-bacteria, and insecticides. The bark powder of L.tomentosa with size 40-60 mesh as much as 170 g was extracted using soxhlet with the methanol solvent. Rough methanol extract was tested to the brown rot fungi Poria placenta and Gloeophyllum trabeum. Meanwhile, Coriolus versicolor was used for white rot fungi. Anti-fungi index of methanol extract are 66.7% for Poria placenta, 54% for Coriolus versicolor and 100.0 % for Gloeophyllum trabeum, respectively. The concentrated methanol extract of L. tomentosa stem bark then separated using column chromatography. The results of LCMS and NMR analysis show that the extract contained alcaloid compound of brucine and 17 oxulapanine
Key word : bark, anti-fungi, alcaloid, brucine, 17-oxolupanine .
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Sifat Antijamur Ekstrak Metanol Kulit Batang Litsea tomentosa Blume. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NOVITRI HASTUTI. Sifat Antijamur Ekstrak Metanol Kulit Batang Litsea tomentosa Blume. Dibimbing oleh WASRIN SYAFII dan PHILIPPE GERARDIN
Kulit batang merupakan limbah dari kegiatan pemanenan maupun pengolahan kayu yang belum dimanfaatkan secara efisien. Volume kulit batang berkisar 10-20% dari volume batang tergantung pada diameter batang. Meskipun kecenderungan pemanfaatannya masih lebih rendah jika dibandingkan dengan pemanfaatan kayunya, namun perhatian pemanfaatan kulit batang mulai tumbuh ketika isu pemanfaatan biomassa hutan berkembang. Banyak studi tentang potensi penggunaan kulit batang telah dicapai. Hasil studi tersebut menunjukkan hasil positif dari penggunaan kulit batang sebagai bahan baku untuk menghasilkan panas maupun bahan baku perekat. Pemanfaatan kulit batang berkembang pada pemanfaatan ekstraknya untuk berbagai tujuan pengobatan, antijamur, antibakteri dan insektisida.
Litsea tomentosa Blume diketahui memiliki jenis alkaloid boldin, predisentrin, launobin dan laurolitsin pada ekstrak kayu batangnya. Keempat alkaloid ini diketahui memiliki sifat antitumor. Kulit batang L. tomentosa sendiri telah digunakan oleh masyarakat tradisional Kupang sebagai bahan untuk menyembuhkan penyakit malaria. Informasi mengenai senyawa yang terkandung pada kulit batang L.tomentosa sendiri masih belum diketahui. Untuk itu penelitian ini dilakukan guna mendapatkan informasi senyawa yang terdapat pada kulit batang L.tomentosa.
Serbuk kulit batang L.tomentosa ukuran 40-60 mesh sebanyak 170 g diekstraksi menggunakan Soxhlet dengan pelarut metanol. Ekstrak kasar metanol diujikan pada jamur pembusuk cokelat (brown rot fungi) Poria placenta dan Gloeophyllum trabeum. Untuk jamur pembusuk putih (white rot fungi) menggunakan Coriolus versicolor. Indeks antijamur ekstrak metanol untuk masing-masing jamur adalah 66.7 % untuk Poria placenta , 54. untuk %, Coriolus versicolor dan 100.0 % untuk Gloeophyllum trabeum.
Ekstrak metanol kulit batang L.tomentosa yang dipekatkan kemudian dipisahkan menggunakan kromatografi kolom. Analisis menggunakan LCMS dan NMR menunjukkan bahwa ekstrak mengandung senyawa alkaloid brusin dan 17-oxolupanin.
SUMMARY
NOVITRI HASTUTI. Antifungal Properties of Methnol Extract form Bark of Litsea tomentosa Blume; Supervised by WASRIN SYAFII and PHILIPPE GERARDIN
The bark is a waste that produced from harvesting activity and wood processing that have not been utilized efficiently. The bark volume is about 10-20% of whole stem volume depend on stem diameter. Even though the trend of the utilization is still lower than the wood utilization, the attention of utilization of stem bark has been grow since the issue of biomass utilization was developed. There are many study shown the potency of stem bark utilization obtained. Those study positively prove that the stem bark can be used as raw material to produce heat and as raw material of adhesive. The bark utilization also has been grow to extract utilization for medical purpose, anti-fungi, anti-bacteria, and insecticides.
Litsea tomentosa Blume was known have some alcaloids in the stem bark, they are : boldin, predisentrin, launobin, and laurolitsin. Those alcaloids known as anti-tumor agent. The bark of L. tomentosa have been utilized by traditional society in Kupang as medicine for malaria medication. The information about the compound contained in L. tomentosa stem bark is still unknown. For that reason, this research objective is to get the information about the compound contained in L. tomentosa stem bark.
The bark powder of L.tomentosa with size 40-60 mesh as much as 170 g was extracted using soxhlet with the methanol solvent. Rough methanol extract was tested to the brown rot fungi Poria placenta and Gloeophyllum trabeum. Meanwhile, Coriolus versicolor was used for white rot fungi. Anti-fungi index of methanol extract are 66.7% for Poria placenta, 54% for Coriolus versicolor and 100.0 % for Gloeophyllum trabeum, respectively.
The concentrated methanol extract of L. tomentosa stem bark then separated using column chromatography. The results of LCMS and NMR analysis show that the extract contained alcaloid compound of brucine and 17 oxulapanine.
Key word : bark, anti-fungi, alcaloid, brucine, 17-oxolupanine .
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu dan Teknologi Hasil Hutan
SIFAT ANTIJAMUR EKSTRAK METANOL KULIT
BATANG
Litsea tomentosa
Blume
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Sifat Antijamur Ekstrak Metanol Kulit Batang Litsea tomentosa Blume
Nama : Novitri Hastuti NIM : E251100071
Disetujui oleh Komisi Pembimbing
Prof. Dr. Ir. Wasrin Syafi’i, M. Agr Ketua
Dr. Philippe Gerardin Anggota
Diketahui oleh
Ketua Program Studi Teknologi Hasil Hutan
Prof. Dr. Ir. I Wayan Darmawan M. Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr
Tanggal Ujian: 29 Oktober 2012
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan karuniaNya sehingga penulis dapat menyelesaikan penulisan tesis. Objek penelitian yang dipilih penulis adalah sifat antijamur ekstrak metanol kulit batang Litsea tomentosa Blume. Hal ini didorong oleh informasi yang diperoleh di tempat pengambilan sampel tanaman yang menyebutkan tanaman banyak dimanfaatkan untuk menyembuhkan penyakit.
Terima kasih penulis sampaikan kepada dosen pembimbing di Indonesia yaitu Prof.Dr.Ir. Wasrin Syafii, MSc., atas kesediaanya memberikan pengarahan melalui lisan maupun tulisan. Di samping itu, penulis ingin menyampaikan terima kasih pula kepada Kadep Departemen Teknologi Hasil Hutan (DHH), Prof. Dr. Ir. Wayan Darmawan yang banyak membantu penulis untuk mendapatkan kesempatan program master gelar ganda di IPB. Penghargaan yang juga ingin penulis sampaikan kepada suami tercinta Imam Budiman, S.Hut, MA, ME atas dukungan penuhnya selama studi, kepada Ibu tercinta dan keluarga besar alm. Sutiyono atas doa dan kasihnya, serta sahabat penulis dan rekan-rekan mahasiswa S2 maupun S3 DHH yang banyak memberikan inspirasi dan masukan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Cilacap pada tanggal 30 November 1983 dari ayah bernama Sutiyono (alm) dan ibu bernama Endang Susilowati. Penulis merupakan putri bungsu dari 3 (tiga) bersaudara.
Pada tahun 2001 penulis diterima menjadi mahasiswi di Fakultas Kehutanan, Universitas Gadjah Mada, Jogjakarta. Pada tahun 2007 penulis menikah dengan kakak seniornya di fakultas yang bernama Imam Budiman. Tahun 2008 penulis dikaruniai seorang putri yang bernama Syahida Azka Auliya. Pada tahun yang sama pula penulis memulai karirnya sebagai pegawai negeri sipil di Pusat Litbang Keteknikan dan Pengolahan Hasil Hutan, Bogor.
i
Ruang Lingkup Penelitian ... 4
TINJAUAN PUSTAKA 5 Kulit Batang ... 5
Zat Ekstraktif ... 6
Alkaloid ... 8
Litsea tomentosa Blume ... 9
Pemanfaatan Kulit Batang ... 10
Jamur ... 11
METODOLOGI PENELITIAN 13 Waktu dan Tempat Penelitian... 13
Bahan dan Alat... 13
Bahan... 13
Alat... 14
Metode Penelitian ... 14
Ekstraksi Pendahuluan ... 14
Ekstraksi Menggunakan Metanol ... 15
Penetapan Kadar Air ... 15
Analisis Infra Merah (FTIR) ... 16
Analisis GCMS ... 16
Analisis LCMS... 17
Analisis NMR ... 18
Analisis sakarida ... 18
Kromatografi Kolom ... 18
Kromatografi Lapis Tipis ... 19
Uji Bioaktifitas Ekstrak ... 19
HASIL DAN PEMBAHASAN... 21
Ekstraksi Pendahuluan ... 21
Karakterisasi Infra Merah (FTIR)... 22
Karakterisasi GCMS ... 26
Karakterisasi LCMS ... 28
Optimisasi Proses ... 30
ii
Karakterisasi menggunakan NMR ... 32
Analisis Sakarida (Gula) ... 33
Uji Bioaktivitas Ekstrak Metanol ... 34
Kromatografi Kolom ... 38
Fraksi 1 ... 38
Fraksi 2 ... 39
Fraksi 3 ... 41
Fraksi 4 ... 41
SIMPULAN DAN SARAN... 43
Simpulan... 43
Saran... 43
iii
Halaman 1.
2. 3. 4. 5. 6.
Persentasi ekstrak pada ekstraksi pendahuluan ... ... Karakteristik senyawa hasil ekstraksi dari berbagai macam pelarut... Identifikasi ekstrak aseton dengan GCMS ... ... Karakterisasi NMR (1H) ekstrak metanol ... ... Jenis dan kadar sakarida pada ekstrak metanol ... ... Rataan pertumbuhan diameter mycelium jamur setelah 7 hari inkubasi...
iv
1. Struktur anatomi kulit batang pohon ... 2. Batang pohon (kiri) dan kulit batang Litsea tomentosa Blume (kanan) ... 3. Jenis alkaloid yang teridentifikasi pada kayu teras Litsea tomentosa Blume ... 4. Struktur molekul litsomentol ... 5. Peta lokasi pengambilan bahan (A) dan proses pengambilan kulit batang Litsea tomentosa Blume (B) ... 6. Skema ekstraksi suksesif ... 7. Skema metode kerja penelitian ... 8. Spektrum FTIR ekstrak diklorometan ... 9. Spektrum FTIR ekstrak aseton ... 10. Spektrum FTIR ekstrak toluen-etanol ... 11. Spektrum FTIR ekstrak air destilasi ... 12. Kromatogram ekstrak aseton ; (B) Kromatogram diperbesar pada waktu retensi 35.97 menit; (C) Spektrometri massa eksperimental pada 35.97 menit; (D) Spektrometri massa brusin pada database GCMS ... 13. Kromatogram ekstrak toluen-etanol (2:1) ... 14. (A) Kromatogram ion total ekstrak aseton; (B) Kromatogram pada
v
20. Struktur molekul brusin ... 21. Pengujian bioaktivitas ekstrak pada jamur Poria placenta : (1)
Kontrol (2) ditambahkan MeOH (3) ditambahkan ekstrak ... 22. Pengujian bioaktivitas ekstrak pada jamur Coriolus versicolor: (1)
Kontrol (2) ditambahkan MeOH (3) ditambahkan ekstrak ... 23. Pengujian bioaktivitas ekstrak pada jamur Gloeophyllum trabeum:
(1) Kontrol (2) ditambahkan MeOH; (3) ditambahkan ekstrak... 24. Diagram batang nilai indeks antijamur ekstrak metanol ... 25. (A) Kromatogram ion total fraksi 2; (B) Kromatogram pada m/z 395; (C) Kromatogram pada m/z 263... 26. Spektrometri massa fraksi 2 pada waktu retensi 10.76 menit mode
positif (atas) dan spektrometri massa pada mode negatif (bawah) ... 27. Spektrum NMR (1H) fraksi 2 ... 28. Struktur molekul 17-oxolupanine ... 29. Kromatogram pada m/z 395 (atas) dan spektrometri massa
eksperimental (bawah) ... 33
35
35
35 37
39
40 40 41
PENDAHULUAN
Latar Belakang
Kulit batang merupakan limbah dari kegiatan pemanenan maupun pengolahan kayu yang belum dimanfaatkan secara efisien. Volume kulit batang berkisar 10-20 % dari volume batang tergantung pada diameter batang. Meskipun kecenderungan pemanfaatannya masih lebih rendah jika dibandingkan dengan pemanfaatan kayunya, namun perhatian pemanfaatan kulit batang mulai tumbuh ketika isu pemanfaatan biomassa hutan berkembang. Saat ini kulit batang pohon banyak digunakan di industri perkayuan untuk menghasilkan panas dan memberikan manfaat seperti sumber daya listrik. Kulit batang diketahui mengandung ekstraktif maupun mineral yang relatif tinggi. Kulit batang yang sering dianggap sebagai limbah itu, kini mulai diperhatikan untuk diolah dan dimanfaatkan dengan adanya studi dan teknologi yang mendukung pengembangan metode untuk memanfaatkan kulit batang sehingga memiliki nilai ekonomi.
secara ekonomis, mengingat hasil studi yang menunjukkan potensi pemanfaatan ekstrak kulit batang.
Kulit batang Litsea tomentosa Blume diketahui digunakan oleh masyarakat lokal di Kupang, Nusa Tenggara Timur sebagai bahan obat penyembuh luka maupun antimalaria. Penelitian kandungan bahan aktif pada jenis ini telah dilakukan pada kayu batangnya. Ekstrak kayu batang L.tomentosa diketahui mengandung 4 jenis alkaloid yaitu : boldin, predisentrin, laurolitsin dan launobin. Keempat alkaloid ini diketahui memiliki sifat antitumor (Novianti et al., 2006).
Penelitian ini dilakukan untuk mendukung penelitian sebelumnya mengenai ekstrak kayu batang L. tomentosa. Eksplorasi senyawa yang terdapat pada ekstrak kulit batang L.tomentosa dilakukan untuk mengetahui jenis senyawa yang terdapat didalam ekstrak. Identifikasi jenis senyawa yang terdapat pada ekstrak kulit batang diperlukan untuk mengetahui macam senyawa yang terkandung didalamnya. Untuk menguji bioaktifitas ekstrak, perlu dilakukan uji antijamur terhadap ekstrak kulit batang.
Perumusan Masalah
Rumusan masalah dalam penelitian ini adalah sebagai berikut : 1. Apakah ekstrak kulit batang L. tomentosa memiliki sifat antijamur?
2. Senyawa apakah yang terdapat pada ekstrak kulit batang Litsea tomentosa Blume?
3. Bagaimanakah karakteristik senyawa yang terdapat dalam ekstrak tersebut?
Hipotesis
Tujuan Penelitian Tujuan penelitian ini antara lain :
1. Menguji aktivitas antijamur ekstrak kulit batang L. tomentosa.
2. Mengkarakterisasi senyawa yang terdapat pada ekstrak kulit batang L. tomentosa.
Manfaat Penelitian
Manfaat penelitian ini adalah untuk mendapatkan data dan informasi mengenai sifat bioaktivitas dari ekstrak kulit batang L. tomentosa sehingga diperoleh data ilmiah yang lebih lengkap mengenai senyawa yang terkandung di dalam ekstrak kulit batang L.tomentosa.
Ruang Lingkup Penelitian
TINJAUAN PUSTAKA
Kulit Batang
Secara umum kulit batang dapat diklasifikasikan menjadi kulit luar (outer bark) dan kulit dalam (inner bark). Kulit luar berfungsi sebagai pelindung pohon dari kondisi di luar. Kulit luar ini dapat mencegah kelembaban disaat hujan dan membantu pohon untuk tidak kehilangan kelembabannya di saat kekeringan. Bagian ini diperbaharui secara terus menerus dari dalam dan merupakan bagian yang tahan terhadap dingin dan panas serta melindungi pohon dari serangan serangga. Kulit dalam merupakan bagian kulit yang hidup namun kemudian mati untuk menjadi jaringan gabus yang akan membentuk kulit luar yang protektif.
Sumber : www.google.co.id
Gambar 1. Struktur anatomi kulit batang pohon
Zat Ekstraktif
Zat ekstraktif yang terdapat didalam kayu dapat digolongkan menjadi 3 (tiga) kelompok (Sjostrom, 1993):
1. Senyawa terpena dan terpenoid, didalamnya termasuk terpentin yang terdiri dari monoterpenoid dan seskuiterpenoid yang mudah menguap, resin dan campuran asam-asam resin. Terpentin telah digunakan secara tradisional sebagai pelarut pernis dan cat dan digunakan untuk berbagai tujuan seperti pembuatan perekat.
2. Senyawa lilin dan lemak. Kelompok ini terdiri atas senyawa ester alkohol alifatik campuran, dan asam lemak. Senyawa lilin dan steroid dapat digunakan sebagai pengikat atau pengganti lilin karbon. Suberin dan steroid juga digolongkan pada kelompok lilin dan steroid.
3. Senyawa fenol, didalamnya terdiri dari senyawa monomer, oligo maupun polimer fenol yang dapat ditemui pada kayu teras, kulit, daun, buah dan akar dalam jumlah yang cukup besar. Penyusun senyawa fenol yang penting adalah kelompok flavonoid. Senyawa fenol ada yang berasal dari asam shikimat atau jalur shikimat dan senyawa fenol yang berasal dari jalur asetat-malonat.
Faktor biofisik yang dimaksud seperti : iklim, kesuburan tanah, serta curah hujan. Zat ekstraktif dapat bervariasi jumlahnya didalam pohon itu sendiri maupun antar spesies. Kandungan zat ekstraktif antara kayu teras dan kayu gubal berbeda. Sebagai contoh kandungan zat ekstraktif pada kayu Pinus banksiana yang menunjukkan kandungan zat ekstraktif pada kayu teras lebih tinggi dibandingkan kayu gubal. Zat ekstraktif merupakan substansi organik yang terbentuk saat terjadinya perubahan kayu gubal menjadi kayu teras. Oleh karena itu pada umumnya kayu teras memiliki keawetan yang lebih tinggi jika dibandingkan dengan kayu gubal (Pandit dan Ramdan, 2000). Meskipun jmlah zat ekstraktif tergolong kecil pada struktur kayu dan merupakan komponen tambahan pada dinding sel kayu, namun keberadaan zat ekstraktif sering kali menjadi faktor penentu dalam hal keawetan kayu dan teknik pengolahan kayu. Kandungan zat ekstraktif dapat berubah selama pengeringan kayu terutama senyawa tak jenuh, lemak dan asam lemak terdegradasi. Ekstraktif juga sangat berpengaruh pada produksi pulp. Kandungan ekstraktif pada kayu segar dapat menyebabkan noda kuning/penguningan pulp. Ekstraktif juga mempengaruhi kekuatan pulp, perekatan dan pengerjaan akhir kayu.
Alkaloid
Alkaloid awalnya terbentuk dari kata alkali yang berarti basa dan oid yang berarti menyerupai. Alkaloid dapat diartikan sebagai senyawa yang menyerupai basa (Fessenden dan Fessenden, 1997). Alkaloid merupakan molekul organik yang sedikitnya memiliki 1 atom nitrogen dan memiliki struktur cincin heterosiklik. Adanya gugus tambahan pada struktur alkaloid seperti gugus metil radikal memberikan sifat yang unik pada alkaloid. Pada tumbuhan liar alkaloid umumnya bersifat toksik (racun). Alkaloid cenderung mudah untuk diekstrak menggunakan pelarut organik seperti metanol, kloroform, dietil-eter. Alkaloid yang terlarut dapat diidentifikasi menggunakan metode instrumental standar seperti kromatografi gas (GC), kombinasi kromatografi gas dengan spektrometri massa (GCMS) atau menggunakan LCMS dan HPLC. Alkaloid umumnya memiliki pengaruh biologis pada tubuh maupun pikiran manusia, karena dapat bertindak seperti narkotika, stimulan dan menyebabkan halusinasi. Oleh sebab itu alkaloid pada tumbuhan banyak dieksploitasi secara luas sebagai bahan obat maupun bahan psiko-aktif. Alkaloid termasuk salah satu senyawa yang relatif kecil pada kelompok senyawa organik. Berat atomnya berkisar antara 100 hingga 300. Alkaloid memiliki rasa yang pahit sebagai bentuk evolusi pada tumbuhan vaskular maupun jamur sebagai bentuk mekanisme pertahanan biologis.
Salah satu jenis alkaloid yang telah digunakan sejak dahulu dan berkembang hingga saat ini adalah alkaloid jenis kafein; Jenis alkaloid ini dapat dengan mudah ditemukan pada Caffea arabica dan Theobroma cacao ( Rafferty, 2007).
umum digunakan dalam resolusi asam optik aktif. Oleh karena itu, brusin dapat dimurnikan dan digunakan berulang.
Litsea tomentosa Blume.
L. tomentosa merupakan anggota famili Lauraceae. Jenis ini banyak tersebar di Peninsular Malaysia, Pulau Jawa, Kalimantan, Sulawesi, Filipina, Papua New Guini serta Myanmar. Di Indonesia jenis ini dikenal dengan nama huru meuhmal, huru dapung, huru leksa, wuru lutung (Lemmens et al.1995). Di Provinsi Nusa Tenggara Timur jenis ini dikenal dengan nama lokal kayu ular. Masyarakat NTT Litsea tomentosa Blume memiliki berat jenis 0.57. Jenis ini digolongkan pada kelas awet III dan kelas kuat III-II (Oey, 1990). Kayunya dapat digunakan sebagai medang atau rangka untuk konstruksi rumah.
Secara lengkap klasifikasi Litsea tomentosa Blume sebagai berikut : Klasifikasi
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Bangsa : Laurales
Famili : Lauraceae
Marga : Litsea
Sinonim : Litsea cuneata, Litsea membranacea Elmer, Litsea grandifolia Teschner
Deskripsi
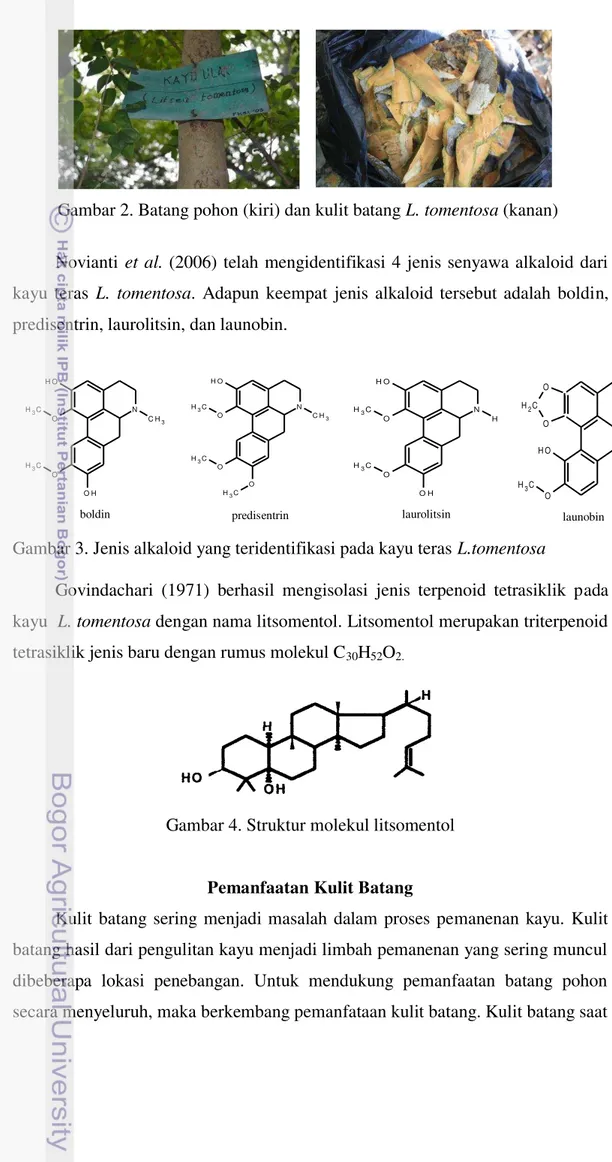
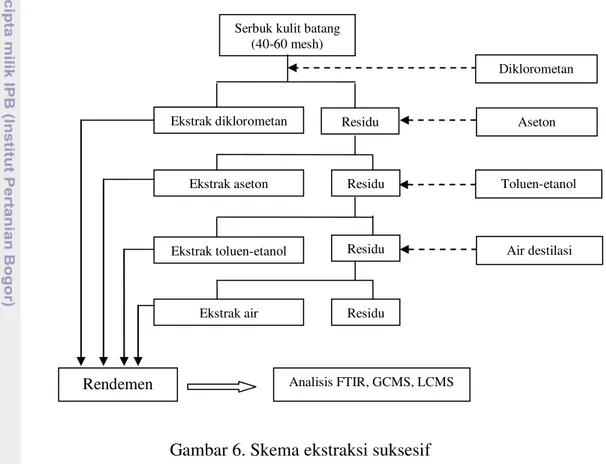
Gambar 2. Batang pohon (kiri) dan kulit batang L. tomentosa (kanan) Novianti et al. (2006) telah mengidentifikasi 4 jenis senyawa alkaloid dari kayu teras L. tomentosa. Adapun keempat jenis alkaloid tersebut adalah boldin, predisentrin, laurolitsin, dan launobin.
N
Gambar 3. Jenis alkaloid yang teridentifikasi pada kayu teras L.tomentosa
Govindachari (1971) berhasil mengisolasi jenis terpenoid tetrasiklik pada kayu L. tomentosa dengan nama litsomentol. Litsomentol merupakan triterpenoid tetrasiklik jenis baru dengan rumus molekul C30H52O2.
Gambar 4. Struktur molekul litsomentol
Pemanfaatan Kulit Batang
ini banyak digunakan sebagai sumber energi karena kalor yang dihasilkan. Selain itu pada sektor pertanian kulit batang banyak digunakan sebagai pupuk atau penambah unsur hara. Kandungan bahan kimia aktif pada kulit batang seperti jenis alkaloid dan terpenoid, memmungkinkan pengembangan pemanfaatan kulit batang bagi industri farmasi. Kandungan tanin yang tinggi pada kulit batang menyebabkan banyak ekstraksi tanin dilakukan untuk digunakan pada industri penyamakan kulit (Duret et al., 2009). Beberapa studi yang menunjukkan sifat anti rayap dan anti jamur dari ekstrak kulit batang memungkinkan pemanfaatan kulit batang sebagai bahan pengawet alami untuk kayu.
Jamur
Istilah "jamur" (mushroom) berasal dari bahasa Yunani yaitu mykes. Berawal dari kata mykes itulah berkembang istilah mycology yang berasal dari kata mykes yang artinya jamur dan logos yang berarti ilmu. Istilah lainnya yaitu fungus dalam bahasa Yunani juga merujuk kepada jamur. Fungus yang berarti tumbuh dengan subur, kemudian menjadi nama kingdom tumbuhan yaitu Fungi. Seorang botanis Italia bernama Pier Antonio Micheli, pada tahun 1729 memasukkan hasil penelitiannya mengenai jamur dan dipublikasikan pada Nova Plantarum Genera. Berbeda dengan tumbuhan lainnya yang bersifat autotrof, jamur merupakan organisme heterotrof. Secara tradisional, jamur merupakan organisme eukariotik yang mampu menghasilkan spora dan memiliki hifa (Alexopoulus et al., 1996). Diperkirakan diseluruh dunia terdapat 1.5 juta spesies yang termasuk di dalam kingdom Fungi, namun baru sekitar 69.000 spesies yang berhasil dideskripsikan (Hawksworth, 1991 dalam Alexopoulus,1996).
sebagai bahan makanan. Jamur ada yang digolongkan sebagai saprofit dan parasit. Saprofit mendapatkan makanan dari bahan organik yang telah mati. Parasit mampu hidup pada material organik yang hidup ataupun mati. Parasit dapat merugikan ataupun mematikan inang tempat jamur tersebut tumbuh. Disamping sebagai sumber makanan, jamur juga dapat menyerang berbagai produk yang digunakan oleh manusia. Bahkan jamur dapat menjadi sumber penyakit bagi manusia. Salah satu kerugian yang disebabkan oleh jamur adalah pembusukan/pelapukan kayu. Jamur pelapuk kayu dapat menyebabkan perubahan sifat fisik dan sifat kimia kayu. Jamur ini merombak polimer kayu menjadi senyawa sederhana yang dijadikan sebagai sumber makanan untuk bertahan hidup. Proses perombakan dilakukan secara biokimia dengan bantuan enzim (Arif et al., 2008).
Spesies jamur yang terkenal sebagai jamur pelapuk kayu antara lain : Chaetomium globosum, Coriolus versicolor, Dacryopinax spathularia, Lentinus lepideus, Phanerochaete chrysosporium, Phlebia brevispora, Polyporus sp., Poria placenta, Pycnoporus sanguineus, Schizophyllum commune, Trametes sp., Tyromyces palustris, Gloeophyllum trabeum. Terdapat dua macam tipe pelapukan kayu oleh jamur yaitu : white rot fungi (busuk putih) dan brown rot fungi (busuk cokelat). Jamur busuk putih umumnya mampu mendegradasi komponen dinding sel seperti lignin, hemiselulosa dan selulosa. Sebagai contoh Poria medulla-panis akan mendelignifikasi substrat pada kayu keras secara selektif, namun mampu mendegradasi seluruh komponen dinding sel pada jenis konifer. Terdapat 3 kelas enzim selulolitik yang teridentifikasi pada jamur busuk putih yaitu : (1) enzim hidrolitik seperti glukanase dan glikosidase; (2) enzim oksidatif; (3) enzim oksidoreduktif.
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilakukan selama 5 bulan terhitung sejak Februari hingga Juni 2012 di LERMAB (Laboratoire d'Etudes et de Recherche sur Le Matériau Bois) , Université de Lorraine, Nancy, Perancis.
Bahan dan Alat Bahan
Bahan yang digunakan dalam penelitian ini adalah kulit batang pohon Litsea tomentosa Blume di kawasan Taman Wisata Alam Camplong, 45 km sebelah barat laut Kota Kupang, Nusa Tenggara Timur. Kulit batang diambil dari pohon yang berusia antara 10-15 tahun.
(A) (B)
Gambar 5. (A) Peta lokasi pengambilan bahan dan (B) proses pengambilan kulit batang L.tomentosa
Bahan kimia yang digunakan untuk penelitian adalah diklorometan, aseton, toluen, etanol, metanol, etil asetat, air destilasi, DMSO, CDCL3. Untuk separasi menggunakan kromatografi kolom, bahan kimia yang digunakan antara lain silika gel sebagai fase diam. Fase gerak yang digunakan adalah campuran larutan diklorometan: etil asetat: metanol dengan perbandingan 36:12:5 (v/v).
Untuk uji bioaktifitas digunakan bahan agar, malt extract, air dan HCl 0,1 N. Jamur yang digunakan adalah jamur pembusuk kayu seperti : Poria placenta, Coriolus versicolor , Gloeophyllum trabeum yang telah dibiakkan sebelumnya di laboratorium biologi LERMAB.
Alat
Peralatan yang digunakan untuk preparasi sampel antara lain : grinder, saringan ukuran 40 dan 60 mesh, eksikator dan bejana plastik. Alat yang digunakan untuk ekstraksi adalah bejana reaksi pyrex, bejana soxhlet, kompor pemanas, gelas ukur, penjepit dan kertas saring. Alat yang digunakan untuk pemekatan ekstrak adalah tabung kaca, vacuum rotary evaporator,liophilizer. Untuk mengukur berat digunakan neraca analitik, untuk mengeringkan sampel digunakan oven suhu 50ºC dan untuk mengukur kadar air sampel digunakan oven suhu 103±2ºC. Perangkat separasi kromatografi kolom menggunakan tabung kaca tinggi ±150 cm sebagai kolom, silika gel, pasir hydrida, pipet, gelas ukur, tabung reaksi, lempeng silika untuk kromatografi lapis tipis (KLT). Untuk uji bioaktifitas digunakan alat aluminium foil, autoclave, dan peralatan gelas (erlenmeyer, gelas ukur), pipet, penjepit, perekat karet, cawan petri, pH meter, inkubator, lampu UV, pemantik api. Untuk analisis struktur kimia dan berat molekul menggunakan alat FTIR Spectrum 2000 Perkin Elmer, spectrum for windows version : 1.5 (07 Mar 1997) Perkin-Elmer 1995 PE 1150F0018, GCMS, LCMS, dan NMR Bruker DX dengan frekuensi 400Hz.
Metode Penelitian Ekstraksi Pendahuluan
menggunakan 4 macam pelarut dengan tingkat polaritas yang berbeda (suksesif) sebagai pendahuluan.
Pelarut dengan tingkat polaritas yang berbeda yaitu : diklorometan, aseton, toluen-etanol (2:1), air destilasi, masing-masing pada volume 150 mL. Ekstraksi akan berakhir jika pelarut penyari yang digunakan berwarna jernih. Ekstrak kemudian dipekatkan dengan menggunakan vacuum rotary evaporator pada suhu 40ºC dan tekanan 50 mmHg. Ekstrak pekat disimpan dalam wadah yang tertutup rapat untuk penggunaan selanjutnya.
Gambar 6. Skema ekstraksi suksesif
Ekstraksi Menggunakan Metanol
Ekstraksi menggunakan pelarut metanol (MeOH) dilakukan menggunakan soklet. Sebanyak ± 170 gram serbuk kulit batang dimasukkan ke dalam cartridge selulosa (kertas saring) dan diletakkan kedalam bejana soklet. Ekstraksi dilakukan pada suhu titik didih metanol yaitu ± 65ºC.
Alat soxhlet digunakan untuk ekstraksi senyawa dari fase padat dengan melewatkan dalam fase cair berupa pelarut. Serbuk kayu ditempatkan dalam cartridge selulosa, lalu dimasukkan ke dalam tubuh extractor yang melekat pada
Serbuk kulit batang (40-60 mesh)
Diklorometan
Ekstrak diklorometan Residu Aseton
Ekstrak aseton Residu Toluen-etanol
Residu
Ekstrak toluen-etanol Air destilasi
Residu Ekstrak air
sebuah reservoir pelarut (tabung) dan dilengkapi dengan kondensor. Pelarut diuapkan dan didinginkan dan jatuh menyentuh fase padat. Siklus ekstraksi ini kemudian diulang selama enam jam.
Untuk mengambil ekstrak yang masih bercampur dengan pelarut, maka pelarut diuapkan menggunakan vacuum rotary evaporator. Unit ini dapat dengan cepat menghapus pelarut yang mudah menguap dan menurunkan titik didih dengan mengurangi tekanan sekitar 50 mmHg. Tabung berisi ekstrak dan pelarut ditempatkan di bejana pengeringan selama beberapa menit. Untuk menghitung persentasi ekstrak digunakan rumus :
Persentasi Ekstrak = me / ms x 100 %
Dimana me adalah massa ekstrak kering dan ms (g) adalah massa sampel awal (serbuk) sebelum ekstraksi (g).
Penetapan Kadar Air
Penetapan kadar air serbuk dilakukan dengan mengeringkan serbuk pada oven bersuhu 102±3ºC. Pengukuran berat serbuk dilakukan hingga mendapatkan berat konstan. Adapun metode penetapan kadar air enggunakan rumus :
Kadar air (%) = BKU-BKT x 100% BKT
Dengan keterangan bahwa BKU adalah berat serbuk kering udara (g) dan BKT adalah berat serbuk kering oven (g).
Analisis Infra Merah (FTIR)
Analisis inframerah menggunakan perangkat FTIR Spectrum 2.000 Perkin Elmer. Sebanyak 5 mg ekstrak ditambahkan dengan kalium bromida (KBr) hingga homogen dan membentuk lempengan tipis. Lempengan yang terbentuk dianalisis dengan perangkat lunak FTIR Versi Windows 1.5 Perkin Elmer-1150F0018 PE 1995.
Analisis GCMS
500, yang dikemudikan oleh TurboMass v.5.4.2 dan perangkat lunak dengan database MS NIST Cari 2.0 (2005). Pemisahan kromatografi dilakukan dengan fase diam DB-5MS (panjang 30 m, diameter 250 mm, ketebalan film 0,25 µm) dengan oven terprogram selama 40 menit, suhu oven pertama sebesar 80ºC (10 menit), kemudian 190ºC (15 menit), 280ºC (10 menit), dan terakhir pada suhu tinggi sebesar 300ºC (5 menit). Fase gerak yang digunakan terdiri dari Helium dengan laju alir 1 mL/menit. Untuk melakukan ini, ekstrak dilarutkan dengan 200 µ L BSTFA (silylating agent). Persiapan ini ditempatkan selama 30 menit, ditutup dalam oven pada suhu 70ºC untuk memungkinkan BSTFA menguap. Setelah menguap, 1 mL etil asetat ditambahkan untuk melarutkan ekstraktif. Langkah terakhir yaitu 1μL larutan ekstrak disuntikkan ke GC.
Analisis LCMS
larut dalam metanol dilarutkan dalam 1-2 mL metanol dan dimasukkan ke dalam tabung kecil yang siap untuk dianalisis menggunakan LCMS.
Analisis NMR
Sebanyak 4 mg ekstrak ditambahkan 2 mL CDCl3. Setelah ekstrak larut lalu dianalisis alat analisis NMR Bruker DX dengan frekuensi 400Hz. Analisis NMR proton dilakukan dengan jumlah scan sebanyak 32 kali yang dilakukan pada suhu 298ºK dengan suntikan manual. Perangkat lunak yang digunakan untuk analisis adalah ACD/Chem Lab.
Analisis sakarida
Analisis sakarida dilakukan untuk mengetahui jenis dan kuantitas sakarida yang terkandung didalam ekstrak. Analisis ini dilakukan dengan melarutkan ekstrak sebanyak ±4 mg dengan ±4 mL metanol dan dianalisis menggunakan HPLC-PAD.
Kromatografi Kolom
penampungan sampel setinggi 3/4 tinggi tabung penampung yang ditandai dengan spidol. Elusi dilakukan hingga eluat yang tertampung dalam tabung penampung tidak berwarna lagi. Eluat yang ditampung juga dipisahkan atas perbedaan warna yang ada.
Kromatografi Lapis Tipis
Kromatografi lapis tipis dilakukan untuk penentuan eluen dan penggolongan fraksi dari kromatografi kolom. Prinsip KLT adalah menotolkan larutan ekstrak atau eluat pada lempeng silika gel (lempeng KLT). Penotolan menggunakan pipa kapiler dengan jumlah penotolan minimal 10 kali pada tempat yang sama. Lempeng KLT dilihat dibawah sinar lampu UV 254 nm untuk melihat spot terbaik dari masing-masing penotolan. Spot yang menunjukkan pemisahan terbaik pada KLT dapat digunakan sebagai dasar penentuan eluen. Penggolongan fraksi dari eluat hasil kromatografi kolom juga dilakukan melalui KLT. Pola spot yang terbentuk dan menunjukkan kemiripan digabungkan pada fraksi yang sama. Perbedaan warna eluat juga dapat membantu penggolongan fraksi dari kromatografi kolom.
Uji Bioaktifitas Ekstrak
larutan ekstrak. Pengujian bioaktivitas ekstrak terhadap ketiga jamur diatas dilakukan secara triplo. Pengukuran indeks anti jamur menggunakan metode Mun dan Prewitt, 2011 dengan rumus :
(AI) = [1-D1/D2] x100
dimana AI adalah nilai indeks antijamur, D1 nilai diameter pertumbuhan jamur pada pada cawan petri yang telah ditambahkan ekstrak, D2 nilai diameter pertumbuhan jamur pada cawan petri yang telah ditambahkan metanol.
Secara skematis metode penelitian dapat dijelaskan sebagai berikut:
Gambar 7. Skema metode kerja penelitian
Pada metode penelitian dilakukan ekstraksi pendahuluan lalu dilihat rendemen ekstrak masing-masing pelarut serta hasil analisis GCMS. Berdasarkan penilaian kedua aspek tersebut, rendemen ekstraksi pendahuluan cenderung rendah, hasil kromatogram GCMS mengindikasikan kuantitas senyawa target yang sedikit. Berdasarkan hasil studi mengenai ekstraksi L.tomentosa sebelumnya yang menggunakan pelarut metanol, maka pelarut yang dipilih adalah metanol.
HASIL DAN PEMBAHASAN
Ekstraksi Pendahuluan
Pelarut yang digunakan pada tahap ekstraksi pendahuluan ada 4 macam. Keempat pelarut memiliki polaritas yang meningkat yaitu : diklorometan, aseton, campuran toluen-etanol 2:1 , dan air destilasi. Persentasi ekstrak untuk masing-masing pelarut seperti pada Tabel 1 berikut :
Tabel 1. Persentasi ekstrak pada ekstraksi pendahuluan
Pelarut Persentasi Ekstrak (%)
Diklorometan 1.67
Aseton 2.93
Toluen-etanol (2:1) 5.88
Air destilasi 10.51
Berdasarkan Tabel 1 diatas, tampak bahwa persentasi ekstrak paling besar adalah ekstrak air dan persentasi terkecil adalah ekstrak diklorometan. Menurut Harkin & Rowe (1971) macam pelarut yang digunakan berpengaruh pada jenis komponen atau senyawa yang keluar (terekstrak). Umumnya senyawa non polar akan mudah diekstrak menggunakan pelarut non polar seperti eter, diklorometan dan kloroform. Demikian pula sebaliknya senyawa polar akan mudah diekstrak menggunakan pelarut polar seperti metanol atau air. Air merupakan pelarut paling polar. Adapun karakteristik senyawa yang dapat terekstrak oleh bermacam jenis pelarut yang digunakan seperti tersaji pada Tabel 2 berikut:
Tabel 2. Karakteristik senyawa hasil ekstraksi dari berbagai macam pelarut
Macam pelarut Jenis senyawa yang dapat diekstrak
Petrolium eter, eter, benzene, kloroform
Terpena dan turunannnya, lemak, lilin, asam lemak bebas, sterol,alkohol resin
Alkohol , aseton Polifenol sederhana, mono dan disakarida, tanin, senyawa glikosida
Air (dingin atau panas) Disakarida, pati, getah, tanin, pektin
Alkali (aqueuse) Phlobapene, asam fenolik, fragmen suberin, hemiselulosa, lignin
Asam (hidrolisis) Gula sederhana, asam uronik sebagai turunan dari holoselulosa, dan lignin residu
Karakterisasi Infra Merah (FTIR)
Adapun karakterisasi ekstrak dari masing-masing pelarut menggunakan FTIR adalah sebagai berikut :
1. Ekstrak diklorometan
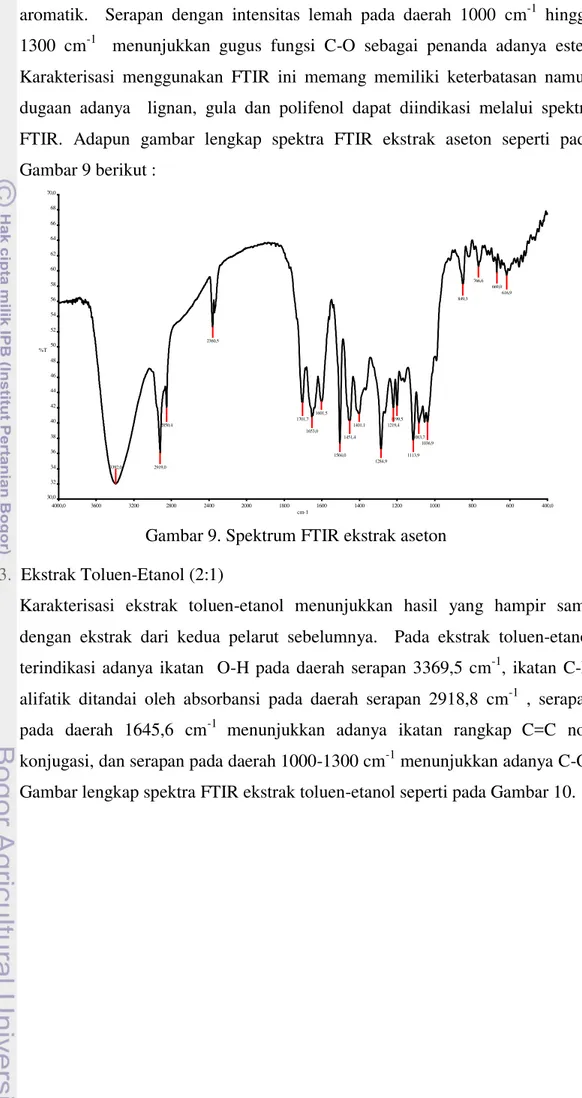
Berdasarkan spektra FTIR yang diperoleh seperti pada Gambar 8, senyawa kimia yang terdapat pada ekstrak terindikasi memiliki ikatan O-H pada
4000,0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 400,0 12,4
Gambar 8. Spektrum FTIR ekstrak diklorometan
2. Ekstrak Aseton
aromatik. Serapan dengan intensitas lemah pada daerah 1000 cm-1 hingga 1300 cm-1 menunjukkan gugus fungsi C-O sebagai penanda adanya ester. Karakterisasi menggunakan FTIR ini memang memiliki keterbatasan namun dugaan adanya lignan, gula dan polifenol dapat diindikasi melalui spektra FTIR. Adapun gambar lengkap spektra FTIR ekstrak aseton seperti pada Gambar 9 berikut :
4000,0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 400,0 30,0
Gambar 9. Spektrum FTIR ekstrak aseton 3. Ekstrak Toluen-Etanol (2:1)
4000,0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 400,0
Gambar 10. Spektrum FTIR ekstrak toluen-etanol
4. Ekstrak air destilasi
Karakterisasi FTIR ekstrak air destilasi menunjukkan adanya ikatan O-H dan C-H alifatik, ikatan C=O dan ikatan C=C dengan absorbansi yang lemah. Serapan pada ekstrak FTIR cenderung lebih lemah dibandingkan dengan ketiga ekstrak lainnya. Gambar lengkap spektra FTIR ekstrak air destilasi seperti pada Gambar 11.
4000,0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 400,0 16,1
Karakterisasi GCMS
Disamping karakterisasi menggunakan FTIR, ekstrak yang diperoleh dari 4 macam pelarut juga dikarakterisasi menggunakan GCMS. Berdasarkan analisis menggunakan GCMS, hanya ekstrak aseton dan toluen-etanol yang menunjukkan hasil positif. Keduanya menunjukkan identifikasi senyawa alkaloid berupa brusin. Untuk ekstrak diklorometan tidak menunjukkan hasil kromatogram yang signifikan. Hal ini juga terjadi pada ekstrak air destilasi. Identifikasi adanya brusin pada ekstrak aseton ditunjukkan pada Gambar 12 berikut :
4.84 6.84 8.84 10.84 12.84 14.84 16.84 18.84 20.84 22.84 24.84 26.84 28.84 30.84 32.84 34.84 36.84 Time 0
100
%
Litsea acetone 1m6 der 01 Scan EI+
TIC
32.83 33.33 33.83 34.33 34.83 35.33 35.83 36.33 36.83 37.33 37.83 Time 0
100
%
litsea acetone 1m6 der 01 Scan EI+
TIC
31.092643.919555.012679.0996 107.1361120.0420 162.3534 197.2205207.1488
280.5864
Gambar 12. (A) Kromatogram ekstrak aseton ; (B) Kromatogram diperbesar pada waktu retensi 35.97 menit; (C) Spektrometri massa eksperimental pada 35.97 menit; (D) Spektrometri massa brusin pada database GCMS
A
B
C
Berdasarkan Gambar 12 diatas, dapat diketahui bahwa pada 10 menit pertama belum ditemukan adanya puncak kromatogram yang mengidentifikasikan keberadaan senyawa tertentu. Pada waktu retensi antara 12 hingga 22 menit menunjukkan adanya puncak kromatogram yang mewakili adanya sylil dan glukosida. Keberadaan senyawa yang memiliki gugus furanik atau pyranik mungkin berada pada waktu retensi ini. Pada waktu retensi 35.97 menit terdapat puncak kromatogram yang kecil dan mengindikasikan adanya brusin berdasarkan spektrometri massa dan gambar struktur molekul senyawa yang muncul pada database GCMS. Brusin merupakan kelompok alkaloid. Adapun hasil analisis kromatografi gas pada ekstrak aseton secara lengkap seperti pada Tabel 3 berikut : Tabel 3. Identifikasi ekstrak aseton dengan GCMS
Waktu Retensi (menit) Nama senyawa
5.12 Asam propanoik
16.09 Myo-inositol
20.18 α -D Glucopiranosida
35.97 Brusin
Gambar 13. Kromatogram ekstrak toluen-etanol (2:1) Karakterisasi LCMS
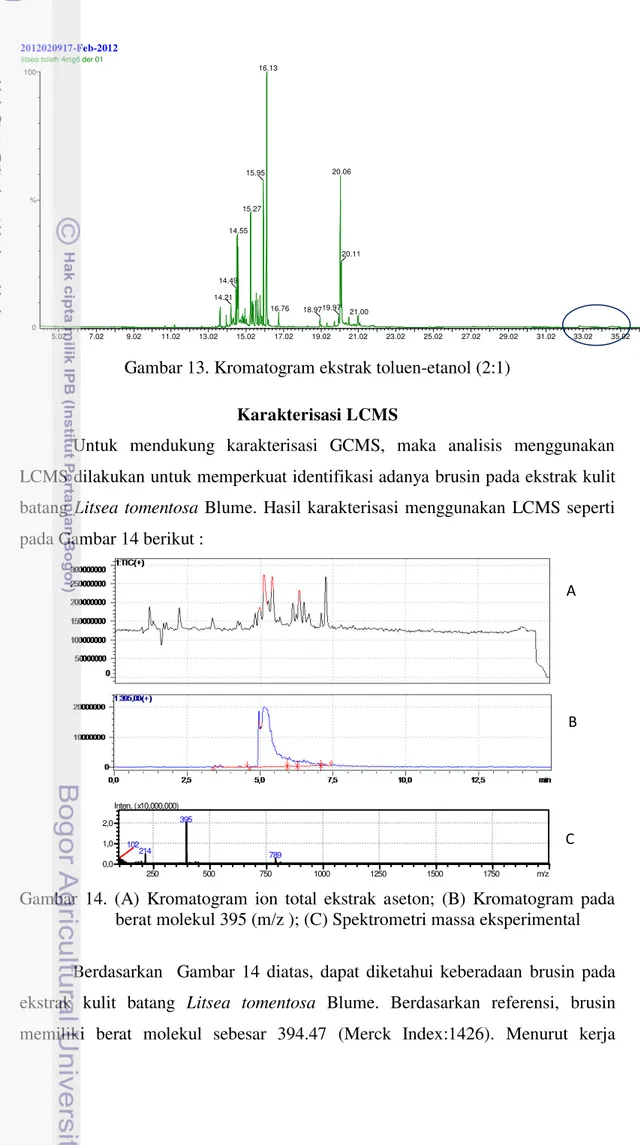
Untuk mendukung karakterisasi GCMS, maka analisis menggunakan LCMS dilakukan untuk memperkuat identifikasi adanya brusin pada ekstrak kulit batang Litsea tomentosa Blume. Hasil karakterisasi menggunakan LCMS seperti pada Gambar 14 berikut :
250 500 750 1000 1250 1500 1750 m/z
0,0 berat molekul 395 (m/z ); (C) Spektrometri massa eksperimental Berdasarkan Gambar 14 diatas, dapat diketahui keberadaan brusin pada ekstrak kulit batang Litsea tomentosa Blume. Berdasarkan referensi, brusin memiliki berat molekul sebesar 394.47 (Merck Index:1426). Menurut kerja 2012020917-Feb-2012
5.02 7.02 9.02 11.02 13.02 15.02 17.02 19.02 21.02 23.02 25.02 27.02 29.02 31.02 33.02 35.02 37.02 Time 0
100
%
litsea toleth 4mg6 der 01 Scan EI+
LCMS yang menggunakan detektor ESI, pembacaan dilakukan dengan skema [M+1] pada mode positif dan [M-1] pada mode negatif. Sifat gugus amina pada brusin yang lebih mudah terprotonisasi, menyebabkan pembacaan berat molekul yang teridentifikasi efektif pada mode positif. Oleh karena itu, teridentifikasinya nilai 395 pada waktu retensi 5, 21 menit mendukung hipotesa adanya brusin pada ekstrak. Senyawa lain yang teridentifikasi pada ekstrak aseton adalah senyawa enantiomer brusin yaitu striknin. Hal ini dapat diketahui berdasarkan Gambar 15 berikut :
250 500 750 1000 1250 1500 1750 m/z
0,0 1,0
2,0Inten. (x10,000,000)
335 102
214
Gambar 15. (A) Kromatogram pada 335 (m/z); (B) Spektrometri massa eksperimental
Berdasarkan referensi berat molekul striknin adalah 334.40 (Merck Index : 8724). Dengan demikian munculnya nilai 335 pada mode positif LCMS pada waktu retensi 4, 472 menit menunjukkan keberadaan striknin [M+1].
Brusin dan striknin juga teridentifikasi pada ekstrak toluen-etanol (2:1). Keduanya teridentifikasi pada waktu 5,21menit untuk brusin dan 4,48 menit untuk striknin. Karakterisasi LCMS mengenai teridentifikasinya brusin dan striknin pada ekstrak toluen-etanol seperti pada Gambar 16.
A
Gambar 16. (A) Kromatogram ion total ekstrak toluen-etanol; (B) Kromatogram pada m/z 395; (C) Kromatogram pada m/z 335
Optimasi Proses (Ekstraksi menggunakan metanol)
Setelah melakukan ekstraksi pendahuluan dan melakukan karakterisasi menggunakan infra merah, GCMS dan LCMS, maka dipilih teknik ekstraksi yang lebih optimal. Berdasarkan studi hasil penelitian sebelumnya dan hasil ekstraksi pendahuluan yang diperoleh, maka optimisasi proses dilakukan dengan pemilihan metanol sebagai pelarut dengan tetap menggunakan metode soklet. Persentasi ekstrak yang diperoleh menggunakan pelarut metanol sebesar 16.21 % dari jumlah total serbuk kulit batang yang diekstrak sebanyak ±170 gram. Adapun hasil optimisasi proses adalah sebagai berikut :
Karakterisasi menggunakan LCMS
Berdasarkan hasil analisa kromatografi cair (LCMS), brusin dan striknin dapat teridentifikasi pada ekstrak metanol kulit batang Litsea tomentosa Blume. Adapun gambar kromatogram lengkap yang menunjukkan adanya brusin dan striknin seperti pada Gambar 17.
A
B
Gambar 17. (A). Kromatogram ion total ekstrak metanol; (B) kromatogram pada m/z 395; (C) kromatogram pada m/z 335
Brusin teridentifikasi pada waktu retensi 5.21 menit. Selain brusin, pada ekstrak metanol ini dapat teridentifikasi adanya striknin pada waktu retensi 4.81 menit. Adanya kesamaan hasil identifikasi LCMS pada ekstraksi pendahuluan dan ekstraksi menggunakan metanol, semakin memperkuat keberadaan brusin pada ekstrak kulit batang Litsea tomentosa Blume. Striknin merupakan enantiomer dari brusin. Literatur menyebutkan bahwa striknin merupakan parents compounds dari brusin. Hal ini disebabkan perbedaan keduanya hanya terletak pada 2 gugus metoksi (-CH3O-) yang dimiliki oleh brusin. Brusin memiliki 6 atom karbon asimetris. Brusin kurang larut dalam air namun dapat larut dengan baik dalam alkohol. Struktur brusin dan striknin yang hampir mirip, sering dimanfaatkan untuk pemisahan asam rasemik. Oleh karena itu pemisahan antara striknin dan brusin bukanlah hal yang mudah.
A B
Gambar 18. (A) Struktur molekul brusin dan (B) Struktur molekul striknin A
B
Karakterisasi menggunakan NMR
Ekstrak metanol dianalisa menggunakan NMR untuk memperkuat hasil analisa sebelumnya. Hasil analisa NMR ekstrak dibandingkan dengan brusin standar dari Sigma Aldrich. Adapun hasil analisa NMR ekstrak metanol dengan brusin standar adalah sebagai berikut :
n o v i0 7 .0 0 1 .e s p
Gambar 19. Spektrum NMR (1H) ekstrak metanol dan brusin standar Berdasarkan Gambar 19 diatas, dapat diketahui bahwa adanya persamaan spektra NMR antara ekstrak metanol dengan brusin standar pada daerah 3.5 - 4.0 ppm. Pada daerah tersebut terdapat puncak dengan intensitas tinggi yang mengindikasikan keberadan 2 gugus metoksi siklik (-CH3O-). Keberadaan proton aromatik (1H dan 4H) diidentifikasi pada daerah 6.0- 8.5 ppm. Keberadaan proton pada karbon yang terikat gugus karboksil (-CH-C=O) ada pada daerah 2.0-3.0 ppm. Pada daerah sekitar 3.0 ppm menunjukkan proton methyne yang bertetangga dengan atom N (-CH-N-). Pada daerah 2.6 - 3.6 ppm mencirikan proton methylene yang bertetangga dengan atom N (-CH2-N-) . Hal ini memperkuat dugaan adanya brusin pada ekstrak metanol.
Ekstrak metanol
Adapun karakterisasi spektra NMR (1H) ekstrak metanol secara lengkap disajikan pada Tabel 4 dan Gambar 20 berikut :
Tabel 4. Karakterisasi NMR (1H) ekstrak metanol
Posisi ppm Posisi ppm
1H 6.70 16H 2.79
4H 7.73 17H a/b 1.33
8H 3.10 18H a
b
2.86 2.59 11H a
B
2.63 2.55
20H a b
3.28 2.43
12H 4.45 22H 6.30
13H 1.78 23H a/b 4.23
14H 1.67 MeO 2/3 3.85
15H a B
1.07 1.53
Gambar 20. Struktur molekul brusin
Analisis Sakarida (Gula)
Tabel 5. Jenis dan kadar sakarida pada ekstrak metanol Jenis sakarida Kadar dalam ekstrak (mg/g)
Glukosa 0.35
Xylosa 0.06
Mannosa 0.01
Asam glukoronik 0.20
Asam galakturonik 0.01
Seperti disebutkan sebelumnya, bahwa spektrometri massa LCMS dapat mendeteksi berat molekul senyawa tertentu. Untuk menghindari kerancuan atau kesalahan pembacaan berat molekul pada spektrometri massa LCMS, maka analisis sakarida ini penting dilakukan. Glukosa memiliki rumus molekul C6H12O6 memiliki berat molekul: 180.16 g/mol. Xylosa memiliki rumus molekul C5H10O5 memiliki berat molekul 150.13 g/mol . Mannosa memiliki rumus molekul dan berat molekul yang sama seperti glukosa. Asam glukoronik memiliki rumus molekul C7H12O6 dengan berat molekul 192.17 g/mol. Asam galakturonik memiliki rumus molekul C6H10O7 dengan berat molekul 194.14 g/mol.
Uji Bioaktivitas Ekstrak Metanol
Gambar 21. Pengujian bioaktivitas ekstrak pada jamur Poria placenta : (1) Kontrol (2) ditambahkan MeOH (3) ditambahkan ekstrak
Gambar 22. Pengujian bioaktivitas ekstrak pada jamur Coriolus versicolor : (1) Kontrol (2) ditambahkan MeOH (3) ditambahkan ekstrak
Gambar 23. Pengujian bioaktivitas ekstrak pada jamur Gloeophyllum trabeum: (1) Kontrol (2) ditambahkan MeOH; (3) ditambahkan ekstrak
Pengukuran indeks antijamur menggunakan metode Mun dan Prewitt, 2011 dengan rumus :
(AI) = [1-D1/D2] x100
dimana AI adalah nilai Indeks Antijamur, D1 nilai diameter pertumbuhan jamur yang telah ditambahkan ekstrak pada cawan petri, D2 nilai diameter pertumbuhan
1 2 3
1 2 3
jamur yang telah ditambahkan metanol pada cawan petri. Adapun rataan pertumbuhan diameter mycelium jamur seperti pada Tabel 6.
Tabel 6. Rataan pertumbuhan diameter mycelium jamur setelah 7 hari inkubasi
Species Tanpa MeOH
(cm)
Dengan MeOH (cm)
Dengan ekstrak (cm)
Poria placenta 7,67 3,00 1,00
Coriolus versicolor 6,17 2,90 1,33
Gloeophyllum trabeum 4,83 1,83 0,00
Berdasarkan Tabel 6 diatas tampak bahwa ekstrak kulit batang Litsea tomentosa Blume memiliki sifat inhibitor terhadap pertumbuhan ketiga jenis jamur. Adanya perbedaan nilai diameter pertumbuhan mycelium jamur yang ditambahkan metanol dengan yang ditambahkan ekstrak, menunjukkan bahwa bioaktifitas ekstrak memang berperan dalam menghambat pertumbuhan jamur. Meskipun pada penambahan metanol terlihat adanya hambatan pertumbuhan diameter mycelium jamur, hal ini dikarenakan metanol yang bersifat asam. Tingkat keasaman sangat berpengaruh bagi pertumbuhan jamur. Disamping tingkat kelembaban dan temperatur, pH berperan dalam menentukan pertumbuhan jamur. Umumnya jamur dapat bertahan hidup pada suasana yang tidak terlalu asam. Ketiga jenis jamur diatas dikenal sebagai jamur pembusuk kayu. Poria placenta dan Gloeophyllum trabeum dikenal sebagai brown rot fungi yang menyebabkan busuk cokelat pada kayu. Coriolus versicolor dikenal sebagai white rot fungi yang menyebabkan busuk putih pada kayu.
dipengaruhi oleh sifat inhibitor ekstrak metanol kulit batang Litsea tomentosa Blume.
Gambar 24. Diagram batang nilai indeks antijamur ekstrak metanol Jamur Poria placenta dan Gloeophyllum trabeum dikenal sebagai jamur pembusuk kayu dengan istilah brown rot fungi dan termasuk pada kelompok fungi Basidiomycetes. Brown rot fungi lebih banyak mendegradasi polisakarida pada interior kayu dan sedikit mendegradasi lignin sehingga kayu menjadi cokelat dan rapuh. Struktur anatomi hifa Poria placenta adalah hifa monomitic sedangkan Gloeophyllum trabeum memiliki hifa dengan tipe nodose septate. Poria placenta berdinding tipis hingga tebal, memiliki basidiospora dengan ukuran 12-14 x 5-6 µm. Gloeophyllum trabeum berdinding tipis dengan ukuran basidiospora 9.0-12.0 x 3.0-4.5 µm.
Jamur Coriolus versicolor dikenal dengan white rot fungi yang mampu mendegradasi lignin pada kayu. Secara umum jamur white rot fungi dibagi menjadi tiga kelompok yaitu : 1) jamur yang menguraikan selulosa dan hemiselulosa lebih dahulu kemudian lignin, 2) lebih banyak memetabolisme lignin lebih dahulu kemudian selulosa dan hemiselulosa dan 3) mampu mendegradasi semua polimer dinding sel secara simultan. Coriolus versicolor memiliki tipe hifa hialin-nodose septate. Jamur ini berdinding tipis hingga tebal dengan ukuran basidiospora 4.5-7.5 x 2.2-4.5 µm.
memungkinkan untuk ekstrak lebih mudah masuk ke dalam sel dibandingkan dengan jamur yang berdinding sel tebal. Faktor lain yang dapat mempengaruhi perbedaan indeks antijamur diatas adalah kandungan kimiawi yang terdapat pada jamur yang mampu mereduksi pengaruh ekstrak. Jamur Coriolus versicolor diketahui memiliki polisakarida-K yang sering digunakan sebagai immune system jamur itu sendiri dan diisolasi untuk tujuan penggunaan bahan obat seperti anti kanker (IMA, 2012).
Untuk mengetahui senyawa aktif yang terkandung pada ekstrak metanol kulit batang Litsea tomentosa Blume, maka dilakukan kromatografi kolom sebagai mekanisme separasi berbagai senyawa.
Kromatografi Kolom
Keberadaan brusin pada ekstrak metanol kulit batang Litsea tomentosa Blume. dapat diidentifikasi melalui analisa LCMS dan NMR. Untuk mendapatkan hasil yang lebih lanjut terkait kandungan senyawa aktif pada ekstrak kulit batang Litsea tomentosa Blume, maka pemisahan ekstrak dilakukan dengan kromatografi kolom. Tahapan pertama yang harus dilakukan adalah pemilihan eluen. Eluen terbaik yang dipilih adalah komposisi antara diklorometan:etil asetat:metanol dengan perbandingan 36:12:5. Melalui kromatografi kolom diperoleh 4 fraksi yang berbeda. Masing-masing fraksi kemudian dianalisis menggunakan LCMS dan NMR untuk mementukan struktur molekul senyawa didalamnya. Dari 4 fraksi yang diperoleh, hanya fraksi ke-2 dan ke-4 yang menunjukkan hasil positif, dimana berdasarkan hasil LCMS dan analisa NMR mengindikasikan adanya senyawa tertentu.
Fraksi 1
Fraksi 2
Jumlah fraksi 2 yang diperoleh adalah 29.1 mg. Pada fraksi ke-2 terindikasi adanya senyawa aktif yang menarik untuk dianalisis. Ini dapat diketahui berdasarkan hasil kromatografi cair dan spektra NMR. Adapun hasil analisis LCMS fraksi 2 seperti pada Gambar 25.
Gambar 25. (A) Kromatogram ion total fraksi 2; (B) Kromatogram pada m/z 395; (C) Kromatogram pada m/z 263
Berdasarkan Gambar 25 diatas, keberadaan brusin pada fraksi ke-2 menunjukkan hasil yang negatif. Namun pada waktu retensi sekitar 10.76 menit dapat dijumpai adanya nilai berat molekul yang menunjukkan adanya keberadaan senyawa tertentu. Dengan melihat Gambar 26 C, kita dapat menduga adanya senyawa yang memiliki berat molekul 262 pada fraksi ke-2 yang kemudian teridentifikasi pada m/z 263 [M+1]. Hal ini didukung oleh hasil spektrometri massa pada mode positif [M+1] dan mode negatif [M-1]. Hasil spektrometri massa fraksi 2 seperti pada Gambar 26.
A
B
250 500 750 1000 1250 1500 1750 m/z
250 500 750 1000 1250 1500 1750 m/z
0,0
Gambar 26. Spektrometri massa fraksi 2 pada waktu retensi 10.76 menit mode positif (atas) dan spektrometri massa pada mode negatif (bawah) Analisis NMR (1H) diperlukan untuk mendukung adanya keberadaan
mengingat tidak adanya pembanding dengan standar internal. Struktur molekul 17-oxolupanin seperti pada Gambar 28.
Gambar 28. Struktur molekul 17-oxolupanin
Struktur dasar alkaloid 17-oxolupanin adalah alkaloid lupanin. Alkaloid ini termasuk pada jenis alkaloid quinilozidine. Jung et.al (2006) meneliti potensi 17-oxolupanin sebagai agen antidiabetes. Alkaloid 13-α-OH lupanin dan 17-oxolupanin mampu mensekresi insulin pada konsentrasi glukosa sebesar 16.7 mM.
Fraksi 3
Berdasarkan hasil analisis LCMS dan NMR, tidak terdapat nilai kromatogram LCMS maupun yang mengindikasikan senyawa tertentu didalam ekstrak pada fraksi 3. Banyaknya fraksi 3 yang diperoleh sebanyak 3.7 mg. Identifikasi adanya brusin pada fraksi ini juga menunjukkan hasil yang negatif.
Fraksi 4
250 500 750 1000 1250 1500 1750 m/z
105 214
395 307
Gambar 29. Kromatogram pada m/z 395 (atas) dan spektrometri massa eksperimental (bawah)
Tidak teridentifikasinya striknin menunjukkan bahwa pemisahan striknin dan brusin tidak dapat dilakukan melalui kromatografi kolom. Hal ini dikarenakan brusin dan striknin merupakan enantiomer. Pemisahan senyawa enantiomer tidak dapat dilakukan melalui kromatografi kolom. Pemurnian brusin dapat dilakukan dengan penambahan ethyl alkohol pada brusin hidroklorida. Pengkristalan akan terjadi selama 24 jam. Kristal yang terbentuk disaring, dicuci dan dikeringkan untuk mendapatkan brusin dengan tingkat kemurnian yang lebih tinggi (Altamura et al., 2011).
SIMPULAN DAN SARAN
SimpulanSimpulan yang dapat ditarik dari hasil penelitian ini bahwa ekstrak metanol kulit batang Litsea tomentosa Blume memiliki sifat antijamur dengan kemampuannya menghambat pertumbuhan mycelium jamur Poria placenta , Coriolus versicolor dan Gloeophyllum trabeum. Hasil kromatografi kolom ekstrak metanol kulit batang Litsea tomentosa Blume mengindikasikan adanya senyawa brusin, striknin dan dugaan adanya senyawa yang memiliki berat molekul 262 yakni 17-oxolupanin. Pemisahan senyawa didalam ekstrak metanol kulit batang Litsea tomentosa Blume menggunakan metode kromatografi kolom menunjukkan hasil yang tidak optimal, dimana jumlah senyawa yang dikandung pada ekstrak menjadi sedikit (senyawa terdegradasi di dalam kolom).
Saran
DAFTAR PUSTAKA
Agrawal SS, Saraswati S, Mathur R, Pandey M. 2011. Cytotoxic and antitumor effects of brucine on Ehrlich ascites tumor and human cancer cell line.
Life Sciences 89:147–158.
Akoka S. Une introduction a la resonance magnetique nucleaire (Chapitre 4 : Notions d’interprétation d’un spectre RMN). Nantes:Universite de Nantes. hlm 2-6.
Alexopoulus CJ, Mims CW, Blackwell M. 1996. Introductory Mycology. New York: John Wiley & Sons, Inc.
Altamura M, Guidi A, Jierry L, Paoli P, Rossi P. 2011. Uncommon crystal motif of brusin in its diastereomeric salt with(11-oxo-11H-dibenzo[b,f][1,4]thiazepin-10-yl)-acetic acid: a case of possible crystallization-induced dynamic resolution. CrystEngComm 13: 2310-2317.
Ardiansyah. 2001. Teknik ekstraksi komponen buah andaliman (Zanthoxylum acanthopodium DC) dan antarasa (Litsea cubeba) [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Arif A, Muin M, Kuswinanti T, Rahmawati. 2008. Isolasi dan identifikasi jamur kayu dari hutan pendidikan Universitas Hasanuddin di Bengo-Bengo Kecamatan Cenrana Kabupaten Maros. Jurnal Perennial 5(1) : 15-22. Danarto YC, Prihananto SA, Pamungkas ZA. 2011. Pemanfaatan Tanin dari Kulit
Kayu Bakau sebagai Pengganti Gugus Fenol pada Resin Fenol Formaldehid. Prosiding Seminar Nasional Teknik Kimia “Kejuangan” Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia; Yogyakarta, 22 Feb 2011. Yogyakarta; Universitas Pembangunan Nasional Yogyakarta. hlm 1-5.
Duret X, Fredon E, Gerardin P, Masson E. 2009. Synthése sur les écorces. LERMAB, in press.
Enda WG .2009. Uji efek antidiare ekstrak etanol kulit batang salam Syzygium polyanthum (Wight) Walp. terhadap mencit jantan [skripsi]. Medan: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
Fessenden RJ, Fessenden JS. 1997. Dasar-dasar kimia organik. Sukmariah Maun, Kamianti Anas dan Tilda S.Sally : penerjemah. Jakarta: Binarupa Aksara. Terjemahan dari: Organic chemistry and fundamentals.
Govindachari T.R. 2002. Five decades in the study of natural products. Proceeding Indian Academy of Sciensces (Chem. Sci.), 114 (3); India, Juni 2002. India: Indian Academy of Sciences. hlm 175–195.
Harkin JM, Rowe JW. 1971. Bark and its possible uses. Research Note Forest Products Laboratory 091. Wisconsin: USDA. hlm 2-21.
[IMA] International Mycological Association. Fungal database nomenclature and species bank. [terhubung berkala]. http://.www.mycobank.org /BioloMICS.aspx?Table=Mycobank&Rec=89661&Fields=All [23 Okt 2012]
Jung M, Park M, Lee HC, Kang YH, Kang ES, Kim SK. 2006. Antidiabetic Agents from Medicinal Plants. Current Medicinal Chemistry 13:1203-1218.
Kuete V et al. 2007. Antimicrobial components of the methanolic extract from the stem bark of Garcinia smeathmannii Oliver (Clusiaceae). South African Journal of Botany 73 : 347–354.
Lemmens RHMJ, Soerianegara I, Wong WC. 1995. Plant Resources of South East-Asia 5(2). Bogor: Prosea Foundation.
Lestari A, Sunarya Y, Sardjono RE. 2011. Ekstraksi tanin dari kulit kayu akasia (Acacia mangium) dan pemanfaatannya sebagai inhibitor korosi logam pada feed water boiler. Jurnal Universitas Pendidikan Indonesia 2(2): 15-19.
Lusiana H. 2009. Isolasi dan uji anti Plasmodium secara in vitro senyawa alkaloid dari Albertisia papuana Becc [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Manohar V et al. 2011. Antifungal activities of origanum oil against Candida albicans. Molecular And Cellular Biochemistry 228: 111–117.
Mun SP, Prewitt L. 2011.Antifungal activity of organic extracts from Juniperus virginiana heartwood against wood decay fungi. Forest Products Journal 61(6): 126.
Novianti, MD et al. 2006. Empat senyawa alkaloid dari kayu batang Litsea tomentosa. Proc. ISSTOC D-6; Bandung, 2006. Bandung: Departemen Kimia Organik Institut Teknologi Bandung. hlm 1-5.
Oey DS. 1990. Berat Jenis dari Jenis-Jenis Kayu Indonesia dan Pengertian Beratnya Kayu untuk Keperluan Praktek Nr 13. Soewarsono PH, penerjemah. Bogor: Puslitbang Hasil Hutan. Terjemahan dari: Specific Gravity of Indonesian Woods and Its Significance for Practical Use. Pandit IKN, Ramdan H. 2002. Anatomi Kayu : Pengantar Sifat Kayu sebagai
Bahan Baku. Bogor: Yayasan Penerbit Fakultas Kehutanan Institut Pertanian Bogor.
Qiu P, Chen X, Chen X, Lin L, Ai C. 2008. Simultaneous determination of five toxic alkaloids in body fluids by high-performance liquid chromatography coupled with electrospray ionization tandem mass spectrometry. Journal of Chromatography B 875: 471–477.
Rafferty SM. 2007. The Archaeology of Alkaloids. In Theory and Practice of Archaeological Residue Analysis. Hans Barnard dan J. W. Eerkens, editor. British Archaeological Reports International Series 1650:179-188.
Risnasari, I. 2002. Tanin. Digital Library Universitas Sumatera Utara.[terhubung berkala]. http://library.usu.ac.id/download/fp/Hutan-Iwan6.pdf [2 Okt 2012]
Sjostrom E. 1993. Kimia kayu , dasar-dasar dan penggunaannya edisi kedua. Hardjono Sastrohamidjojo, penerjemah. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: Wood chemistry, basics and its uses. Suprapti S, Djarwanto, Hudiansyah. 2004. Ketahanan lima jenis kayu terhadap
tigabelas jamur perusak kayu (the resistance of five wood species against thirteen wood destroying fungi). Journal of Forests Products Ressources. [terhubungberkala].http://www.forda-mof.org/files/1040
sihati%20Naskah.pdf [2 Nov 2012].
Syahidah. 2008. Bioaktivitas zat ekstraktif kayu manggis (garcinia mangostana l.) Terhadap rayap tanah Coptotermes curvignathus Holmgren [tesis].Bogor: Program Pascasarjana, Institut Pertanian Bogor.
NANI NUR‟AENAH. Extraction and Characteristic of Collagen and Nanoparticle Collagen from the Skin of Stingray Fish (Pastinachus solocirostris) as Ingredient of Cosmetics. Under direction of TATI NURHAYATI and PIPIH SUPTIJAH.
Isolation of collagen from the skin of stingray fish (Pastinachus solocirostris) has been successfully conducted with three stages: first soaked in 0.05 M NaOH with a sample/solution ratio of 1:10 (w/v) for 6 hour, second soaked in 0.1 M acetic acid with a sample/solution ratio of 1:6 (w/v) for 2 hour, and third extraction with destilated water at temperature 40 C for 2 hour with a yield of 14.475 % (wet base). Nanoparticle collagen was made with desolvation method using etanol as a desolvating agent with a collagen solution/etanol ratio of 1:1. Yield of nanoparticle collagen was 9.64% (wet base) with particle size of 185.24 nm. Collagen and nanoparticle collagen is in the form of white powder with whiteness degree 72.48% and 60.03%, respectively. Protein is the major component in collagen and nanoparticle collagen (86.97% and 86.18%) with trace amount ofash (0.17% and 0.13%) and fat (0.19% and 0.25%), respectively. Based on sodium dodecyl sulfate-polyacrylamide gel electrophoresis patterns, amino acid composition, and fourier transform infrared (FTIR) spectra of both collagen and nanoparticle collagen were characterized as type I collagens. Nanostructural analysis of collagen and nanoparticle collagen by Scanning Electron Microscopy (SEM) shows that both were separate aggregates. Other characteristics of collagen and nanoparticle collagen were: Tmax of 165.88 C and 156.63 C; Viscosity 292.33 cP dan 110 cP; pH 5.00 dan 4.93; respectively. Collagen has highest solubility at pH 7 and the isoelectric point at pH 6, 9, and 10. Therefore, nanoparticle collagen has highest solubility at pH 3 dan and the isoelectric point at pH 6. Collagen and nanoparticle collagen from skin of stingray fish (Pastinachus solocirostris) has a characteristic for a potential use as a cosmetic ingredient.