Lampiran 2. Gambar daun gambir kering (Uncaria gambir Roxb.)
Gambar daun gambir kering yang di jual di pasar Sei Kambing C-II Medan
Lampiran 3. Gambar simplisia dan serbuk daun gambir (Uncaria gambir Roxb.)
Gambar simplisia daun gambir
Lampiran 4. Gambar mikroskopik serbuk simplisia daun gambir (Uncaria gambir Roxb.)
Keterangan gambar perbesaran 10 x 40 1. Sel batu
2. Kalsium oksalat bentuk jarum 3. Sel parenkim
4. Rambut penutup
1
3 2 2
Lampiran 5. Bagan Kerja Penelitian Daun gambir kering
Serbuk simplisia
Ampas Maserat II Maserat
Parameter uji antidiare EEDG meliputi: 1. Saat mulai terjadinya diare
Lampiran 6. Perhitungan hasil pemeriksaan karakteristik simplisia dan ekstrak A. Perhitungan serbuk simplisia daun gambir
1. Perhitungan penetapan kadar air
No Berat sampel (g) Volume air (ml) Kadar air (%)
2. Perhitungan penetapan kadar sari yang larut dalam air
No Berat sari (g) Berat sampel (g) Kadar sari (%)
Lampiran 6. (Lanjutan)
3. Perhitungan penetapan kadar sari yang larut dalam etanol
4. Perhitungan penetapan kadar abu total
5. Perhitungan penetapan kadar abu yang tidak larut dalam asam
B. Perhitungan karakterisasi ekstrak etanol daun gambir 1. Perhitungan penetapan kadar air
No Berat sampel (g) Volume air (ml) Kadar air (%)
2. Perhitungan penetapan kadar sari yang larut dalam air
No Berat sari (g) Berat sampel (g) Kadar sari (%)
% Kadar sari yang larut dalam air rata-rata =
3
87,33% 64,16%
85,79%
= 79.09%
3. Perhitungan penetapan kadar sari yang larut dalam etanol
No Berat sari (g) Berat sampel (g) Kadar sari (%)
Lampiran 6. (Lanjutan)
4. Perhitungan penetapan kadar abu total
Kadar sari yang larut dalam air = 100%
No Berat abu (g) Berat sampel (g) Kadar abu total (%)
5. Perhitungan penetapan kadar abu yang tidak larut dalam asam
No Berat abu (g) Berat sampel (g) Kadar abu (%)
% Kadar abu yang tidak larut asam rata-rata = 100% 3 hewan uji (Mulyono, 1984)
Jenis hewan uji Volume maksimum (ml) sesuai jalur pemberin
Lampiran 8. Konversi dosis antara jenis hewan dengan manusia (Laurance dan Bacharach, 1964)
Lampiran 9. Perhitungan konversi dosis
Dosis manusia (berat 70 kg) = 2-8 mg dan tidak melebihi 16 mg/hari Dosis tikus (berat 200 g) = 0,018 x (16 mg) = 0,2 mg
Maka dosis loperamid HCl untuk tikus = 1 mg/kg bb atau sama dengan 0,2 mg/200 g bb
2. Perhitungan konversi dosis EEDG dari tikus ke manusia : Dosis yang digunakan dalam penelitian adalah :
- 25 mg/kg bb atau sama dengan 5 mg/200 g bb - 50 mg/kg bb atau sama dengan 10 mg/200 g bb - 75 mg/kg bb atau sama dengan 15 mg/200 g bb - 100 mg/kg bb atau sama dengan 20 mg/200 g bb Dosis optimal EEDG pada tikus adalah 15 mg/200 g bb. Faktor konversi dosis tikus = 56,0
Dosis manusia = dosis pada tikus x faktor konversi = 15 mg x 56,0
= 840 mg/kg bb
3. Rendemen = 100% simplisia
berat
ekstrak berat
= 100% 26,42% g
700 g 185
Maka pemakaian ekstrak etanol daun gambir (EEDG) 75 mg/kg bb pada tikus setara dengan 283 mg simplisia daun gambir.
Dosis tikus (200 g) setelah dikonversikan = 1 mg/kg bb
Tablet imodium ditimbang sebanyak 20 tablet (berat setara = 2400 mg)
1 tablet Imodium mengandung 2 mg, jadi diambil 20 tablet imodium mengandung loperamid HCl sebanyak 40 mg
Loperamid HCl yang digunakan = 15 mg atau sama dengan dosis 75 mg/kg bb
Serbuk imodium yang diambil = 2400mg 900mg mg
40 mg
15
Lampiran 11. Perhitungan dosis pemberian ekstrak etanol daun gambir (EEDG) dan loperamid HCl (tablet imodium®)
EEDG yang diberikan untuk dosis 25 mg/kg bb EEDG yang diberikan untuk dosis 50 mg/kg bb
Berat badan tikus = 200 g EEDG yang diberikan untuk dosis 75 mg/kg bb
Berat badan tikus = 200 g
Lampiran 11. (lanjutan)
EEDG yang diberikan untuk dosis 100 mg/kg bb Berat badan tikus = 200 g
maka, dosis = 200g 20mg g
1000 mg
100
dosis pemberian = 1ml 0,667ml/200gbb tikus mg
30 mg
20
e. Konsentrasi loperamid HCl = 0,03% = 0,03 g/100 ml = 0,3 mg/ml Loperamid HCl yang diberikan untuk dosis 1 mg/kg bb
Berat badan tikus = 200 g
maka, dosis = 200g 0,2mg g
1000 mg
1
dosis pemberian = 1ml 0,667ml/200gbb tikus mg
0,3 mg
0,2
Gambar tikus feses berlendir Gambar tikus feses lembek
Konsistensi feses
Feses berlendir Feses lembek
Feses normal
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir
Grafik hasil orientasi dosis
Lampiran 14. Hasil pengamatan saat mulai terjadinya diare setelah pemberian oleum ricini
0 20 40 60 80 100 120
W
AK
T
U
KELOMPOK
Perlakuan Saat mulai terjadinya diare (menit)
OR + CMC 1% bb 60,83
OR + Loperamid HCl 1 mg/kg bb 107,83
OR + EEDG 10 mg/kg bb 66,33
OR + EEDG 20 mg/kg bb 68,33
OR + EEDG 25 mg/kg bb 68,66
OR + EEDG 50 mg/kg bb 77,83
OR + EEDG 75 mg/kg bb 99,50
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir
Lampiran 15. Hasil pengamatan konsistensi feses setelah pemberian oleum ricini Perlakuan
Hewan
Jumlah
Rata-rata (menit)
1 2 3 4 5 6
OR + CMC
1% bb 58 60 55 65 60 67 365 60,83
OR + Loperamid
HCl 1 mg/kg bb 112 90 120 108 105 112 647 107,83 OR + EEDG
25 mg/kg bb 60 65 88 73 60 66 412 68,66 OR + EEDG
50 mg/kg bb 80 87 66 84 61 89 467 77,83 OR + EEDG
75 mg/kg bb 88 90 115 101 113 90 597 99,50 OR + EEDG
1. Konsistensi feses berlendir
Kelompok Diameter serapan air
(cm)
2. Konsistensi feses lembek
Kelompok Diameter serapan air
(cm)
3. Konsistensi feses normal
Kelompok Diameter serapan air
(cm)
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir
1. Pengamatan frekuensi diare setelah pemberian oleum ricini
Perlakuan Hewan Jumlah Rata-rata
1 2 3 4 5 6
2. Pengamatan lama terjadinya diare setelah pemberian oleum ricini
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir
T1 : waktu mula-mula terjadi diare; T2 : waktu akhir terjadi diare Lampiran 17. Hasil deskriptif data
1. Saat mulai terjadinya diare
2. Konsistensi feses (diameter serapan air dan berat feses)
a. Diameter serapan air dan berat feses berlendir - Diameter serapan air berlendir
Kelompok
Lampiran 17. (Lanjutan)
Kelompok
b. Diameter serapan air dan berat feses lembek - Diameter serapan air lembek
Kelompok
Kelompok
c. Diameter serapan air dan berat feses normal - Diameter serapan air normal
Kelompok
- Berat feses normal
Lampiran 17. (Lanjutan)
5. Lama terjadinya diare
Lampiran 18. Hasil analisis statistik anava
1. Saat mulai terjadinya diare
2. Konsistensi feses (diameter serapan air)
3. Konsistensi feses (berat feses)
Lampiran 18. (Lanjutan)
4. Waktu defekasi
5. Frekuensi diare
6. Lama terjadinya diare
Sum of Squares df
Mean
Square F Sig.
Defekasi berlendir
Between Groups 15944.333 5 3188.867 26.966 .000
Within Groups 3547.667 30 118.256
Total 19492.000 35
Defekasi lembek
Between Groups 11798.139 5 2359.628 7.687 .000
Within Groups 9208.833 30 306.961
Total 21006.972 35
Defekasi normal
Between Groups 72197.556 5 14439.511 57.368 .000
Within Groups 7551.000 30 251.700
Total 79748.556 35
Sum of Squares df Mean Square F Sig.
Between Groups 81.139 5 16.228 35.193 .000
Within Groups 13.833 30 .461
Total 94.972 35
Sum of Squares df Mean Square F Sig.
Between Groups 157004.139 5 31400.828 162.900 .000
Within Groups
5782.833 30 192.761
Total
Lampiran 19. Hasil analisis statistik Duncan 1. Saat mulai terjadinya diare
kelompok N
2. Konsistensi feses (diameter serapan air) a. Diameter serapan air berlendir
kelompok N
b. Diameter serapan air lembek
Lampiran 19. (Lanjutan)
c. Diameter serapan air normal
Kelompok N
3. Konsistensi feses (berat feses) a. Berat feses berlendir
Kelompok N
b. Berat feses lembek
Lampiran 19. (Lanjutan) c. Berat feses normal
Lampiran 19. (Lanjutan) c. Defekasi normal
Kelompok N
Subset for alpha = 0.05
1 2 3 4
EEDG 100 mg/kg bb 6 2.2050
Loperamid HCl 1 mg/kg bb 6 2.3733 2.3733
EEDG 75 mg/kg bb 6 2.4033
EEDG 50 mg/kg bb 6 2.7867
EEDG 25 mg/kg bb 6 3.3050
CMC 1% bb 6 3.3300
Sig. .076 .746 1.000 .787
5. Frekuensi diare
kelompok N
Subset for alpha = 0.05
1 2 3
EEDG 100 mg/kg bb 6 2.8333
Loperamid HCl 1 mg/kg bb 6 3.0000
EEDG 75 mg/kg bb 6 3.5000
EEDG 25 mg/kg bb 6 5.3333
EEDG 50 mg/kg bb 6 5.6667
CMC 1% bb 6 6.8333
Sig. .118 .402 1.000
6. Lama terjadinya diare
kelompok N
Subset for alpha = 0.05
1 2 3 4
EEDG 100 mg/kg bb 6 1.1583
EEDG 75 mg/kg bb 6 1.3817
Loperamid HCl 1 mg/kg bb 6 1.3950
EEDG 50 mg/kg bb 6 2.1633
EEDG 25 mg/kg bb 6 2.6750
CMC 1% bb 6 2.8383
DAFTAR PUSTAKA
Adiyana, I. (2004). Efek Ekstrak Daun Jambu Biji Daging Buah Putih Dan Jambu Biji Daging Buah Merah Sebagai Antidiare. Acta Pharmaceutica Indonesia. 29(1): 18-20.
Anief, M. (1995). Ilmu Meracik Obat, Teori dan Praktik. Cetakan 5. Yogyakarta: Gadjah Mada University Press. Halaman 107.
Arif, A., dan Sjamsudin, U. (1995). Obat Lokal Dalam Farmakologi dan Terapi. Edisi IV. Jakarta: FK-UI. Halaman 511-512.
Ditjen POM. (1979). Farmakope Indonesia. edisi III. Jakarta: Departemen Kesehatan RI. Halaman 9-33.
Ditjen POM. (1989). Materia Medika Indonesia. Jilid V. Jakarta: Departemen Kesehatan RI. Halaman 137-139.
Ditjen POM. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 299-306, 321-322, 325, 333-337.
Ditjen POM. (1999). Cara Pengelolaan Simplisia Yang Baik. Jakarta: Departemen Kesehatan RI. Halaman 1-26.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan pertama Jakarta. Departemen Kesehatan RI. Halaman 10-17.
Dalimartha, S. (2007). Atlas Tumbuhan Obat Indonesia. Jakarta: Trubus Agriwidya. Halaman 36.
Endang, L., dan Puspadewi, V.A. (2012). Penyakit Maag dan Gangguan Pencernaan. Yogyakarta. Penerbit Kanisius. Halaman 43.
Ermiati. (2004). Budidaya, Pengolahan Hasil dan Kelayakan Usaha Tani Gambir
(Uncaria gambier Roxb.) di Kabupaten 50 Kota. Buletin TRO. 15(1): 50-63.
Haryanto, dan Sugeng. (2009). Ensiklopedi Tanaman Obat Indonesia. Pallmal, Yogyakarta. Halaman 183-184.
Harborne, J.B. (1973). Phytochemical Methods. London: 11 New Fatter Lane. Terjemahan: Kosasih Padmawinata dan Iwang Soediro. (1987). Metode Fitokimia. Bandung: Penerbit ITB. Halaman 113, 147-155.
Hayani, E. (2003). Analisis Kadar Katekin Dari Gambir Dengan Berbagai Metode. Buletin Teknik Pertanian 8(1): 31-32.
Heinrich, M., Barnes, J., Gibbons, s., dan Williamson, E.M. (2009).
Fundamentals of Pharmacognosy and Phytotherapy. United Kingdom. Elsevier Limited Oxford. Terjemahan: Winny R Syarief, Cucu Aisyah, Ella Elviana, dan Euis Rachmiyani Fidiasari. Farmakognosi dan Fitoterapi.
Jakarta. Buku Kedokteran EGC. Halaman 85, 105.
Jeejeebhoy, K. N. (1977). Symposium on Diarrhea Definition and Mechanisms of diarrhea. Scientific Section. CMA Journal. 116(7): 737-739.
Kresnawaty, I., dan Zainuddin, A. (2009). Aktivitas Antioksidan Dan Antibakteri Dari Derivat Metil Ekstrak Etanol Daun Gambir. Balai Penelitian Bioteknologi Perkebunan Indonesia. Bandung. Jurnal Littri. 15(4): 145-151.
Mardisiswojo, S., dan Radjakmangunsudarso, H. (1968). Cabe Puyang Warisan Nenek Moyang I. PMI. Jakarta. Halaman 102-103.
Markham, K.R. (1988). Cara Mengindentifikasi Flavonoida. Bandung. Institut Teknologi Bandung Press. Halaman 1-8.
Mills, S., dan Bone, K. (2000). Principles And Practce Of Phytotherapy Modern Herbal Medicine. London. Churchill Livingstone. Halaman 320.
Neal, M.J. (2006) At A Glance Farmakologi Medis. Edisi Kelima. Penerbit Erlangga. Surabaya. Halaman 32-33.
Robinson, T. (1991). Kandungan Organik Tumbuhan Tinggi. Terjemahan Padmawinata, K., dan Soediro, Penerbit Institute Teknologi Bandung. Bandung. Halaman 123-157, 191-209.
Sari, L.O.R.K. (2006). Pemanfaatan Obat Tradisional Dengan Pertimbangan Manfaat Dan Keamanan. Majalah Ilmu Kefarmasian. 7(1): 1-7.
Sa’aroni, Pudjiastuti, dan Adjirni. (1996). Efek Antidiare Infus Daun Kesembukan
(Paederia foetida L) pada Tikus Putih dan Toksisitas Akutnya Pada mencit. Cerminan Dunia Kedokteran. (109): 18-20.
Sardjono, Santoso, dan Dewoto. (1995). Analgesik Opioid dan Antagonis. Dalam Farmakologi dan Terapi. Edisi 4. Jakarta. Fakultas Kedokteran Universitas Indonesia. Halaman 200.
Sirait, M. (2007). Penuntun Fitokimia Dalam Farmasi. Bandung. Institut Teknologi Bandung. Halaman 158-159.
Sudarsono. (2002). Tumbuhan Obat II. Yogyakarta. Pusat Studi Obat Tradisional Universitas Gajah Mada. Halaman 34.
Tan, H.T., dan Rahardja, K. (2002). ) Obat-obat Penting: Khasiat, Penggunaan dan Efek-efek Sampingnya. Edisi Kelima. Cetakan 2. Jakarta: Penerbit PT. Elex Media Komputindo Gramedia. Halaman 270-287.
Wells, B.G. (2006). Pharmacotheraphy Handbook. Edisi 6. Singapore: The Mc Graw Hill Companies. Halaman 222-227.
BAB III
METODE PENELITIAN
Tahap penelitian meliputi penyiapan simplisia, karakterisasi simplisia dan ekstrak, skrining fitokimia simplisia dan ekstrak, pembuatan ekstrak etanol daun gambir, percobaan efek antidiare. Penelitian di lakukan di Laboratorium Fitokimia dan Laboratorium Farmakologi Fakultas Farmasi Universitas Sumatera Utara. Data hasil penelitian di analisis secara anava (analisis variansi) dan di lanjutkan dengan uji beda rata-rata Duncan menggunakan program SPSS versi 16.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat gelas, pisau, lemari pengering, seperangkat alat destilasi, oven listrik (Fischer scientific), neraca hewan (Presica Geniweigher GW-1500), neraca listrik (Vibra AJ), desikator (Fischer Scientific), krus porselin, mikroskop (Olympus), kaca objek (object glass), kaca penutup (deck glass), rotary evaporator, freeze dryer ,blender (National), cawan porselen, cawan porselen berdasar rata, alumunium foil, kertas saring, spatula, stopwatch, kandang hewan, oral sonde, pot plastik, wadah pengamatan.
3.1.2 Bahan
3.2 Pembuatan Larutan Pereaksi
3.2.1 Pereaksi Mayer
Sebanyak 5 g kalium iodida dalam 10 ml air suling kemudian di tambahkan larutan 1,36 g merkuri (II) klorida dalam 60 ml air suling. Larutan di kocok dan di tambahkan air suling hingga 100 ml (Ditjen POM, 1995).
3.2.2 Pereaksi Dragendroff
Sebanyak 0,8 g bismuth (III) nitrat di timbang, kemudian di larutkan dalam 20 ml asam nitrat pekat, pada wadah lain di timbang sebanyak 27,2 g kalium iodida lalu di larutkan dalam 50 ml air suling, kemudian kedua larutan di campurkan dan di diamkan sampai memisah sempurna. Larutan yang jernih di ambil dan di encerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM, 1995).
3.2.3 Pereaksi Bouchardat
Sebanyak 4 g Kalium Iodida di larutkan dalam 20 ml air suling kemudian di tambah 2 g Iodium sambil di aduk sampai larut, lalu cukupkan dengan air suling hingga 100 ml (Ditjen POM, 1995).
3.2.4 Pereaksi Molish
Sebanyak 3 g α-naftol di timbang, kemudian di larutkan dalam asam nitrat
0,5 N hingga di peroleh larutan 100 ml (Ditjen POM, 1995). 3.2.5 Larutan pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida di timbang, kemudian di larutkan dalam air secukupnya hingga di peroleh larutan 100 ml (Ditjen POM, 1995).
3.2.7 Larutan pereaksi Lieberman-Bourchard
Sebanyak 2 bagian asam asetat anhidrat di campurkan dengan 1 bagian asam sulfat pekat (Harborne, 1987).
3.2.8 Larutan pereaksi kloralhidrat
Dilarutkan 50 g kloralhidrat P dalam 20 ml air (Ditjen POM, 1995).
3.2.9 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat di encerkan dengan air suling hingga di peroleh 100 ml larutan (Ditjen POM, 1995).
3.2.10 Larutan pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat di encerkan dengan air suling hingga di peroleh 100 ml larutan (Ditjen POM, 1995).
3.3 Penyiapan Simplisia
3.3.1 Pengumpulan bahan penelitian
Pengumpulan bahan yang di gunakan dalam penelitian ini adalah daun gambir kering yang di beli dari Pasar Sei Kambing Kapten Muslim C-II Medan, yaitu tanpa membandingkan dengan tempat lain (secara purposif).
3.3.2 Identifikasi bahan tumbuhan
Determinasi sampel di lakukan di Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.3.3 Pengolahan simplisia daun gambir
Simplisia yang telah di peroleh, di bersihkan dari kotoran-kotoran lalu di cuci bersih dibawah air mengalir hingga bersih kemudian di tiriskan, di timbang, lalu daun gambir di masukkan dalam lemari pengering dengan temperatur 40°C
diblender menjadi serbuk di masukkan ke dalam wadah plastik dengan silika gel dan di simpan pada suhu kamar. Gambar serbuk simplisia daun gambir dapat di lihat pada Lampiran 3, halaman 52.
3.4 Karakteristik Simplisia dan Ekstrak 3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik di lakukan terhadap simplisia daun gambir meliputi bentuk, bau, warna dan rasa.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia di lakukan dengan cara meneteskan kloralhidrat di atas kaca objek, kemudian di letakkan sejumlah serbuk simplisia, lalu di tutup dengan kaca penutup dan di lihat di bawah mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air di lakukan dengan metode Azeotropi (destilasi toluen). Alat terdiri dari alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, dan tabung penerima 10 ml.
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling di masukkan ke dalam labu alas bulat, di pasang alat penampung dan pendingin, kemudian di destilasi selama 2 jam. Destilasi di hentikan dan di biarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima di baca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,1 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (Ditjen POM, 1995; WHO, 1992).
3.4.4 Penetapan kadar sari larut air
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml air kloroform (2,5 ml kloroform dalam air suling 1000 ml) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, dibiarkan selama 18 jam, di saring, lalu di uapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdatar rata yang telah di panaskan dan di tara. Sisa di panaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air di hitung terhadap bahan yang telah di keringkan di udara (Ditjen POM, 1995; WHO, 1992).
3.4.5 Penetapan kadar sari larut etanol
3.4.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah di gerus dan di timbang seksama di masukkan dalam krus platina atau krus silikat yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran di lakukan pada suhu 600oC selama 4 jam, kemudian di dinginkan dan di timbang sampai di peroleh bobot tetap. Kadar abu di hitung terhadap bahan yang telah di keringkan di udara (Ditjen POM, 1995; WHO, 1992).
3.4.7 Penetapan kadar abu tidak larut asam
Abu yang telah di peroleh dalam penetapan abu di dinginkan dengan 25 ml asam klorida encer lalu di didihkan selama 5 menit, di saring dengan kertas whatman atau kertas saring bebas abu, cuci dengan air panas, di pijarkan sampai bobot tetap, kemudian di dinginkan dan di timbang. Kadar abu yang tidak larut dalam asam di hitung terhadap bobot yang di keringkan di udara (Ditjen POM, 1995; WHO, 1992).
3.5 Skrining Fitokimia Simplisia dan Ekstrak 3.5.1 Pemeriksaan alkaloida
Sebanyak 0,5 g serbuk simplisia di timbang, di tambahkan 1 ml asam klorida 2 N dan 9 ml air suling, di panaskan di atas penangas air selama 2 menit, di dinginkan dan di saring, filtrat di pakai untuk uji alkaloid. Ambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat. Pada tabung I : tambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung III : tambahkan 2 tetes pereaksi bouchardat, akan terbentuk endapan berwarna coklat sampai kehitaman.
Alkaloida disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga dari percobaan di atas (Ditjen POM, 1995).
3.5.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia kemudian di tambahkan 100 ml air panas, didihkan selama 5 menit dan di saring dalam keadaan panas. Filtrat yang di peroleh kemudian di ambil 5 ml lalu di tambahkan 0,1 g serbuk Mg dan 1 ml HCl pekat da 2 ml amil alkohol, dikocok, di biarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Ditjen POM, 1995).
3.5.3 Pemeriksaan glikosida
Sebanyak 3 g gram serbuk simplisia di sari dengan 30 ml campuran etanol 96%-air suling (7:3) dan 10 ml asam sulfat 2 N, di refluks selama 10 menit,
3.5.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu di saring, filtratnya di encerkan sampai tidak berwarna. Larutan di ambil sebanyak 2 ml dan di tambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Harbone, 1987).
3.5.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia di masukkan ke dalam tabung reaksi di tambahkan 10 ml air panas, di dinginkan kemudian dikocok selama 10 detik. Jika terbentuk buih yang mantap setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan satu tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1995).
3.5.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g serbuk simplisia di maserasi dengan 20 ml eter selama 2 jam, di saring, filtrat di uapkan dalam cawan penguap dan pada sisanya di tambahkan 2 tetes pereaksi Lieberman-Bourchard. Apabila terbentuk warna ungu atau merahyang berubah menjadi biru atau biru hijau menunjukkan adanya steroida/triterpenoida (Ditjen POM, 1995).
3.6 Pembuatan Ekstrak Etanol Daun Gambir
dengan 2000 ml etanol 80%, di biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari, selanjutnya di saring. Filtrat etanol yang di peroleh di uapkan dengan menggunakan rotary evaporator pada suhu ± 40oC hingga di peroleh ekstrak kental selanjutnya freeze dryer pada suhu -40oC hingga di peroleh ekstrak kering.
3.7 Percobaan Efek Antidiare
Pengujian efek antidiare meliputi penyiapan hewan percobaan, bahan uji, kontrol negatif (CMC 1%), kontrol positif sebagai pembanding (loperamid HCl), induktor diare (oleum ricini), dan pengujian efek antidiare.
3.7.1 Penyiapan hewan percobaan.
Hewan percobaan yang di gunakan adalah tikus jantan putih galur Wistar dengan berat badan 150-200 g sebanyak 36 ekor, di bagi dalam 6 kelompok di mana setiap kelompok terdiri dari 6 ekor tikus.
3.7.2 Penyiapan bahan
Bahan yang digunakan meliputi suspensi CMC 1% sebagai kontrol negatif, suspensi loperamid HCl (tablet imodium®) sebagai pembanding kontrol positif, suspensi ekstrak etanol daun gambir sebagai bahan uji dan oleum ricini sebagai induktor diare.
3.7.2.1 Pembuatan suspensi CMC 1% (b/v)
3.7.2.2 Pembuatan suspensi loperamid HCl dosis 1 mg/kg bb
Tablet imodium® mengandung 2 mg loperamid HCl, di timbang sebanyak 20 tablet (berat = 2400 mg), di gerus dan di ambil serbuk sebanyak 900 mg di masukkan ke dalam lumpang, di tambah suspensi CMC 1% sedikit demi sedikit sambil di gerus homogen, di cukupkan dengan suspensi CMC 1% sampai 50 ml. Perhitungan dapat dilihat pada Lampiran 10, halaman 62.
3.7.2.3 Pembuatan suspensi EEDG konsentrasi 3%; 2,25%; 1,5%; 0,75% b/v Sejumlah suspensi CMC 1% di masukkan ke dalam lumpang di tambahkan sebanyak 1500 mg EEDG di gerus sampai homogen, lalu di cukupkan dengan CMC 1% sampai 50 ml (konsentrasi 3%). Pembuatan EEDG untuk konsentrasi 2,25%, 1,5%, dan 0,75% di buat dengan mengambil 7,5 ml, 5 ml dan 2,5 ml dari masing-masing, di masukkan ke dalam labu tentukur 10 ml dan di cukupkan dengan garis tanda dengan suspensi CMC 1%.
3.7.3 Pengujian efek antidiare
Urutan penelitian sebagai berikut :
a. tikus di adaptasikan dengan lingkungan penelitian selama 2 minggu.
b. tikus di puasakan 18 jam sebelum penelitian, selanjutnya di kelompokkan menjadi 6 kelompok masing-masing 6 ekor.
c. semua tikus di berikan oleum ricini sesuai berat badan tikus secara oral.
d. satu jam setelah pemberian oleum ricini, masing-masing kelompok di beri perlakuan yaitu kelompok I di berikan suspensi CMC dosis 1% sebagai kontrol negatif, kelompok II di berikan suspensi loperamid HCl dosis 1 mg/kg bb sebagai kontrol positif dan empat kelompok masing-masing di berikan suspensi EEDG dosis 25, 50, 75 dan 100 mg/kg bb. Semua perlakuan di berikan secara oral.
e. pengamatan di lakukan setiap 30 menit selama 6 jam meliputi saat mulai terjadinya diare, konsistensi feses (berlendir/berair, lembek dan normal), diameter serapan air, berat feses, frekuensi diare dan lama terjadinya diare.
Cara pengamatan parameter:
a. diare di tandai dengan buang air besar dimana frekuensinya meningkat dari keadaan normal dan konsistensi feses yang lembek atau cair.
b. saat mulai terjadinya diare, caranya dengan mencatat waktu mula-mula terjadinya diare (dalam menit) setelah pemberian oleum ricini.
c. konsistensi feses, caranya dengan melihat feses tikus apakah berlendir/berair, lembek dan normal.
e. berat feses, caranya dengan menimbang berat feses (dalam gram) setiap 30 menit setelah pemberian oleum ricini.
f. frekuensi diare, caranya dengan menghitung berapa kali terjadinya diare selama pengamatan.
g. lama terjadinya diare, caranya dengan mencatat selisih waktu terakhir terjadinya diare (saat konsistensi feses kembali normal) dengan waktu mula-mula terjadinya diare (saat konsistensi berlendir atau berair) dalam menit (Adiyana, 2004; Sa’roni, 1996)
3.8 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Sampel
Identifikasi sampel dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Hasilnya menunjukkan sampel yang digunakan adalah daun gambir (Uncaria gambir
Roxb.). Terlihat pada Lampiran 1, halaman 50.
4.2 Hasil Karakterisasi
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia daun gambir menunjukkan bentuk daun-daun kering dengan bagian-bagian yang remuk, ringan, mudah patah, warna permukaan luar coklat muda sampai coklat kekuningan, kadang terlihat getah-getah yang lengket pada daun, berwarna putih, bau khas aromatis dengan rasa kelat. Hasil dapat dilihat pada Lampiran 3, halaman 52.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaaan mikroskopik simplisia daun gambir menunjukkan adanya sel batu besar, dinding agak tipis, kadang kecil memanjang. Sel parenkim besar, dinding tipis, hablur kalsium oksalat bentuk jarum. Rambut penutup terdiri dari satu sel ujung runcing. Hasil dapat dilihat pada Lampiran 4, halaman 53. 4.2.3 Pemeriksaan karakteristik simplisia dan ekstrak
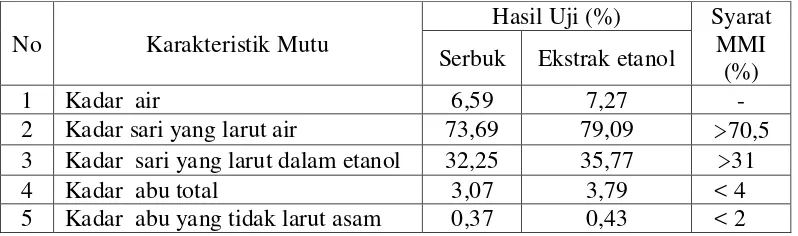
Tabel 4.1 Hasil karakteristik serbuk simplisia dan ekstrak etanol daun gambir
Pada tabel di atas dapat dilihat bahwa kadar air simplisia dan ekstrak memenuhi persyaratan umum yaitu di bawah 10%. Kadar air dilakukan untuk mengetahui besarnya kandungan air yang terdapat di dalam simplisia agar tahan lama dan tidak mudah ditumbuhi mikroba karena air merupakan media yang baik untuk tumbuhnya jamur bila kadar air yang diperoleh diatas 10%. Kadar sari yang larut dalam air dilakukan untuk mengetahui kadar metabolit primer seperti karbohidrat, lemak, dan protein yang terkandung dalam simplisia. Kadar sari yang larut dalam etanol dilakukan untuk mengetahui senyawa baik polar maupun non polar juga untukmengetahui kadar metabolit sekunder seperti alkaloid, flavonoid, glikosida, saponin, tanin, steroid/triterpenoid yang terkandung dalam simplisia. Kadar abu total dilakukan untuk mengetahui kadar senyawa anorganik dalam simplisia, misalnya logam K, Ca, Na, Pb dan Hg, sedangkan kadar abu tidak larut dalam asam dilakukan untuk mengetahui kadar senyawa abu yang tidak larut dalam asam, misalnya silika.
4.3 Hasil Skrining Fitokimia
Skrining fitokimia serbuk simplisia dan ekstrak etanol daun gambir yang diperoleh dapat dilihat pada Tabel 4.2. Hasil skrining fitokimia yang mengandung senyawa alkaloida, flavonoida, glikosida, tanin, saponin, steroida/triterpenoida.
No Karakteristik Mutu
Hasil Uji (%) Syarat MMI
(%) Serbuk Ekstrak etanol
1 Kadar air 6,59 7,27 -
2 Kadar sari yang larut air 73,69 79,09 >70,5 3 Kadar sari yang larut dalam etanol 32,25 35,77 >31
4 Kadar abu total 3,07 3,79 < 4
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol daun gambir
Keterangan: ( + ) = Positif, ( - ) = Negatif
Pada pemeriksaan skirining alkaloid dengan penambahan pereaksi Mayer terbentuk endapan putih, pereaksi Bourchardat terbentuk endapan berwarna coklat kemerahan dan pereaksi Dragendroff terbentuk endapan berwarna jingga. Penambahan pereaksi Molish dan asam sulfat pekat membentuk cincin berwarna ungu yang menunjukkan adanya senyawa glikosida. Terbentuknya busa yang stabil dengan pengocokkan dengan air panas dan tidak hilang dengan penambahan HCl 2 N, ini menunjukkan adanya senyawa saponin (Depkes, 1995). Penambahan serbuk Mg dan asam klorida pekat menghasilkan larutan berwarna merah menunjukkan adanya flavonoid. Penambahan FeCl3 memberikan warna biru kehitaman yang menunjukkan adanya senyawa tanin. Penambahan pereaksi Liebermann-Bourchard membentuk warna merah ungu yang menunjukkan adanya senyawa steroid/triterpenoid (Harborne, 1987).
4.4 Pengujian Efek Antidiare
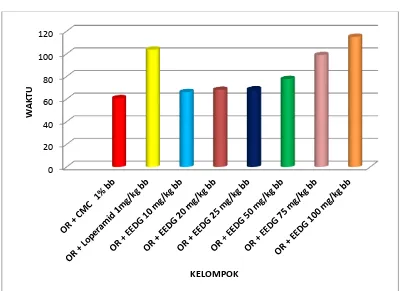
Pengujian efek antidiare dari suspensi ekstrak etanol daun gambir (EEDG) di awali dengan melakukan orientasi dosis yang digunakan yaitu dosis 10, 20, 25, 50, 75 dan 100 mg/kg bb. Dari keenam dosis yang diuji, maka dipilihlah dosis 25, 50, 75, 100 mg/kg bb untuk digunakan dalam penelitian karena dapat memberikan
No
. Golongan senyawa
efek terhadap penurunan diare. Sedangkan untuk dosis 10 mg dan 20 mg/kg bb tidak digunakan karena tidak memberikan efek yang signifikan terhadap penurunan diare.
Tikus yang telah dipuasakan 18 jam sebelum penelitian, di kelompokkan menjadi 6 yang kemudian di berikan oleum ricini sebanyak 2 ml setiap ekornya. Satu jam setelah pemberian oleum ricini masing-masing kelompok di beri perlakuan yaitu kelompok kontrol negatif di berikan suspensi CMC dosis 1% bb, kelompok kontrol positif di berikan suspensi loperamid HCl dosis 1 mg/kg bb dan kelompok bahan uji di berikan suspensi EEDG yang terdiri dari empat dosis yaitu 25, 50, 75 dan 100 mg/kg bb. Penentuan efek antidiare dari ekstrak etanol daun gambir di lakukan dengan cara mengamati saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan lama terjadinya diare.
4.4.1 Penentuan saat mulai terjadinya diare
Pada hasil data saat mulai terjadinya diare yang diperoleh dapat dilihat pada Tabel 4.3.
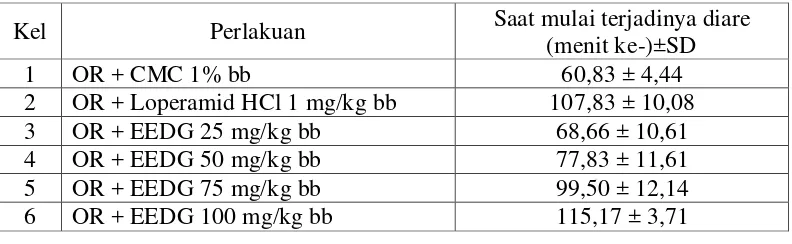
Tabel 4.3 Hasil data saat mulai terjadinya diare
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir
Pada Tabel 4.3 dapat dilihat adanya perubahan yang nyata (p<0,05) antara dosis dan rata-rata waktu mulai terjadinya diare setelah pemberian EEDG sebagai antidiare. Pemberian CMC diperoleh waktu saat mulai terjadinya diare pada menit
Kel Perlakuan Saat mulai terjadinya diare
(menit ke-)±SD
1 OR + CMC 1% bb 60,83 ± 4,44
2 OR + Loperamid HCl 1 mg/kg bb 107,83 ± 10,08
3 OR + EEDG 25 mg/kg bb 68,66 ± 10,61
4 OR + EEDG 50 mg/kg bb 77,83 ± 11,61
5 OR + EEDG 75 mg/kg bb 99,50 ± 12,14
60,83 ± 4,44 yang menggambarkan ada tidaknya pengaruh pembawa terhadap penginduksi, namun setelah pemberian EEDG dengan dosis yang bervariasi terlihat adanya perubahan waktu mulai terjadinya diare. Hal ini memperlihatkan EEDG dosis 100 mg/kg bb (115,17 ± 3,71) memiliki waktu mulai terjadinya diare paling lama di bandingkan dengan EEDG dosis 50 mg/kg bb (77,83 ± 11,61), dosis 25 mg/kg bb (68,66 ± 10,61) dan dosis 75 mg/kg bb (99,50 ± 12,14).
Gambar 4.1 Grafik saat mulai terjadinya diare
Pada Gambar 4.1 dapat di lihat perbedaan grafik dari masing-masing kelompok perlakuan. Pemberian loperamid HCl dosis 1 mg/kg bb menyebabkan perubahan waktu yang sangat berarti yaitu pada menit 107,83 ± 10,08, di mana waktu mulai terjadinya diare lebih lama di banding dengan EEDG dosis 25 dan 50 mg/kg bb. Berdasarkan uji statistik, EEDG dosis 75 mg/kg bb tidak berbeda
kontrol dan semakin cepat terjadinya diare maka efek antidiare akan semakin lemah. Hasil penentuan saat mulai terjadinya diare dapat di lihat pada analisis Duncan Lampiran 19, halaman 78.
Pengujian efek antidiare pada penelitian ini, menggunakan metode yang sama dengan penelitian yang telah dilakukan Winda (2010), yaitu metode defekasi dengan menggunakan oleum ricini sebagai penginduksi. Bedanya terletak pada banyaknya oleum ricini, yang mana waktu mulai terjadinya diare pada penelitian Winda yang di beri oleum ricini 0,5 ml/ekor adalah menit ke-129,2. Hasil tersebut berbeda dengan penelitian EEDG, yaitu pada menit ke-107,83 dengan pemberian oleum ricini 2 ml/ekor. Waktu mulai terjadinya diare tersebut di sebabkan oleh pengaruh jumlah oleum ricini yang diberikan pada hewan uji. Semakin banyak penginduksi yang diberikan, maka semakin cepat diare yang di timbulkan (Tjay dan Rahardja, 2002).
3.4.2 Penentuan konsistensi feses
A. Konsistensi feses (diameter serapan air)
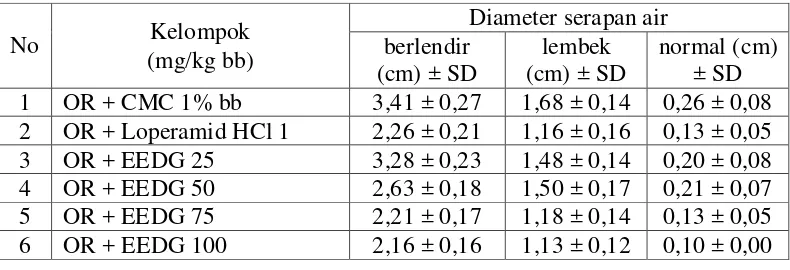
Pada hasil data konsistensi feses (diameter serapan air) yang di peroleh dapat dilihat pada Tabel 4.4.
Tabel 4.4 Hasil data konsistensi feses (diameter serapan air)
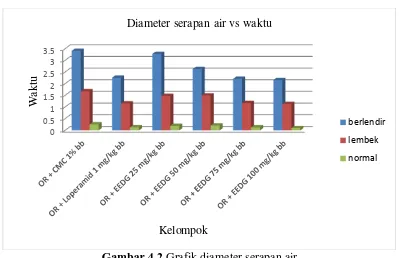
Gambar 4.2 Grafik diameter serapan air
Pada Tabel 4.4 dan Gambar 4.2 menunjukkan hubungan antara dosis dan konsistensi feses (diameter serapan air) setelah pemberian EEDG dapat dilihat pada Lampiran 15, halaman 68.
Pada hasil analisis statistik anava (p<0,05) dilanjutkan uji beda rata-rata duncan konsistensi feses (diameter serapan air), menunjukkan diameter serapan air berlendir yang di hasilkan kelompok dosis 50 mg/kg bb yang berbeda signifikan dengan masing-masing kelompok. Perbedaan yang tidak signifikan di hasilkan oleh kelompok pembanding, dosis 75 dan 100 mg/kg bb, juga pada kelompok dosis 25 mg/kg bb dengan kelompok kontrol tidak berbeda signifikan. Hasil diameter serapan air lembek, menunjukkan kelompok kontrol, berbeda secara signifikan terhadap masing-masing kelompok. Efek yang tidak berbeda secara signifikan di hasilkan oleh kelompok dosis 75, 100 mg/kg bb dan kelompok pembanding, juga kelompok dosis 25 mg/kg bb dengan dosis 50 mg/kg bb tidak berbeda signifikan.Terlihat pada Lampiran 19, halaman 78.
0 0.5 1 1.5 2 2.5 3 3.5
W
a
k
tu
Kelompok
Diameter serapan air vs waktu
berlendir
lembek
B. Konsistensi feses (berat feses)
Pada analisis data konsistensi feses (berat feses) yang di peroleh dapat di lihat pada Tabel 4.5.
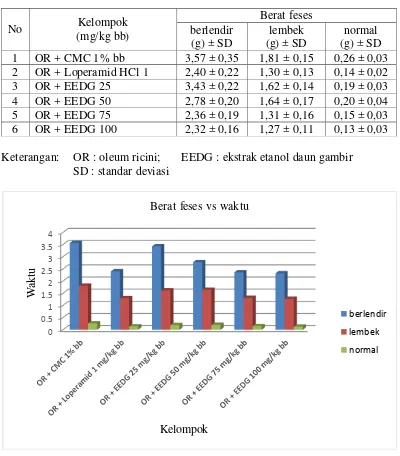
Tabel 4.5 Hasil analisis data berat feses
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir SD : standar deviasi
Gambar 4.3 Grafik berat feses
Penentuan konsistensi feses di lakukan dengan cara melihat bentuk feses yang terjadi, dapat di kategorikan ke dalam kelompok konsistensi feses berlendir (BL) dengan diameter serapan air lebih besar dari 2 cm, konsistensi feses lembek
(L) dengan diameter serapan air antara 1-2 cm, konsistensi feses normal (N) dengan diameter serapan air lebih kecil dari 1 cm.
Pada Tabel 4.5 dan Gambar 4.3 menunjukkan hubungan antara dosis dan konsistensi feses (berat feses) setelah pemberian EEDG dapat di lihat pada Lampiran 15, halaman 68.
Pada hasil analisis statistik anava (p<0,05) di lanjutkan uji beda rata-rata Duncankonsistensi feses (berat feses), menunjukkan berat feses berlendir yang di hasilkan kelompok dosis 50 mg/kg bb memiliki efek yang berbeda secara signifikan terhadap masing-masing kelompok. Perbedaan efek yang signifikan di hasilkan kelompok 75,100 mg/kg bb dan kelompok pembanding, juga kelompok dosis 25 mg/kg bb dan kelompok kontrol. Hasil berat feses lembek, menunjukkan kelompok kontrol, kelompok dosis 25 dan 50 mg/kg bb berbeda secara signifikan terhadap kelompok dosis 75, 100 mg/kg bb dan kelompok pembanding. Uji Duncan berat feses normal, menunjukkan hasil kelompok kontrol berbeda secara signifikan terhadap masing-masing kelompok. Efek yang tidak berbeda signifikan kelompok dosis 75, 100 mg/kg bb dan kelompok pembanding, juga kelompok dosis 25 dan 50 mg/kg bb tidak berbeda signifikan. Terlihat pada Lampiran 19, halaman 79.
Tabel 4.6 Waktu defekasi setiap 30 menit selama 6 jam pengamatan setelah diberi
Pada kelompok kontrol, defekasi berlendir terjadi pada menit 56-174, defekasi lembek terjadi pada menit 191-293 dan defekasi normal terjadi pada menit 315-358. Pada kelompok pembanding, defekasi berlendir terjadi pada menit
85-120, defekasi lembek terjadi pada menit 135-205 dan defekasi normal terjadi pada menit 224-250. Pada kelompok dosis 25 mg/kg bb, defekasi berlendir terjadi pada menit 58-133, defekasi lembek terjadi pada menit 144-293 dan defekasi normal terjadi pada menit 321-343. Pada kelompok dosis 50 mg/kg bb, defekasi berlendir terjadi pada menit 55-148, defekasi lembek terjadi pada menit 137-266 dan defekasi normal terjadi pada menit 252-320. Pada kelompok dosis 75 mg/kg bb, defekasi berlendir terjadi pada menit 88-136, defekasi lembek terjadi pada menit 141-233, dan defekasi normal terjadi pada menit 229-258. Pada kelompok dosis 100 mg/kg bb, defekasi berlendir terjadi pada menit 88-144, defekasi lembek pada menit 140-180 dan defekasi normal terjadi pada menit 193-240.
EEDG dosis 75 mg/kg bb dapat membentuk defekasi normal yang tidak berbeda signifikan (p<0,05) dengan kelompok pembanding. Pada hasil tersebut dapat di simpulkan bahwa semakin cepat terbentuk defekasi normal, maka semakin kuat efek anti diare yang dimilikinya.
4.4.3 Penentuan frekuensi diare
Pada Tabel 4.7 dan Gambar 4.4, terlihat hubungan antara dosis dengan frekuensi diare pada hewan uji setelah pemberian EEDG. Terlihat pada Lampiran 16, halaman 69.
Tabel 4.7 Hasil analisis data frekuensi diare
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir SD : standar deviasi
No Kelompok Frekuensi ± SD
1 OR + CMC 1% bb 6,83 ± 0,75
2 OR + Loperamid HCl 1 mg/kg bb 3,00 ± 0,63
3 OR + EEDG 25 mg/kg bb 5,33 ± 0,81
4 OR + EEDG 50 mg/kg bb 5,66 ± 0,51
5 OR + EEDG 75 mg/kg bb 3,50 ± 0,54
Hasil pengujian EEDG terlihat adanya perubahan yang nyata (p<0,05) terhadap frekuensi diare yang di hasilkan oleh kelompok kontrol (6,83 ± 0,75 kali). Kelompok dosis 75 mg/kg bb menyebabkan penurunan frekuensi diare (3,50 ± 0,54 kali) yang sebanding dengan kelompok pembanding (3,00 ± 0,63 kali) lebih kecil daripada kelompok dosis 25 mg/kg bb (5,33 ± 0,81 kali) dan 50 mg/kg bb (5,66 ± 0,51 kali), tetapi dengan pemberian dosis 100 mg/kg bb frekuensi diare yang ditimbulkan lebih sedikit daripada kelompok pembanding yaitu 2,83 ± 0,75. Terlihat pada Lampiran 17, halaman 75.
Gambar 3.4 Grafik frekuensi diare
Pada hasil analisis statistik anava (p<0,05) di lanjutkan uji beda rata-rata Duncan, frekuensi diare menunjukkan hasil kelompok kontrol berbeda signifikan terhadap masing-masing kelompok. Efek yang tidak berbeda signifikan di hasilkan kelompok pembanding, dosis 75 dan 100 mg/kg bb, juga kelompok dosis 25 dan 50 mg/kg bb yang tidak berbeda signifikan. Hasil yang di peroleh menunjukkan semakin tinggi frekuensi terjadinya diare maka efek antidiare akan
semakin lemah, begitu juga sebaliknya semakin rendah frekuensi terjadinya diare maka efek antidiare akan semakin kuat. Terlihat pada Lampiran 19, halaman 81. 4.4.4 Penentuan lama terjadinya diare
Pada Tabel 4.8 dan Gambar 4.5, terlihat hubungan antara dosis dengan lama terjadinya diare pada hewan uji setelah pemberian EEDG. Terlihat pada Lampiran 16, halaman 69.
Tabel 4.8 Hasil data lama terjadinya diare
Keterangan: OR : oleum ricini; EEDG : ekstrak etanol daun gambir SD : standar deviasi
Gambar 4.5 Grafik lama terjadinya diare
Pemberian oleum ricini pada kelompok kontrol menghasilkan waktu lama terjadinya diare 283 ± 13,30 menit, setelah pemberian EEDG dengan dosis yang
0 lama terjadinya diare vs waktu
bervariasi mengakibatkan waktu lama terjadinya diare menjadi berkurang. EEDG dosis 100 mg/kg bb (115 ± 6,88 menit) memiliki waktu lama terjadi diare tersingkat jika dibandingkan kelompok dosis 25 mg/kg bb (267 ± 12,53 menit), dosis 50 mg/kg bb (216 ± 17,42 menit), dosis 75 mg/kg bb (138 ± 13,51 menit) dan kelompok pembanding (139 ±17,00 menit). Terlihat pada Lampiran 17, halaman 75.
Pada hasil analisis statistik anava (p<0,05) dilanjutkan uji beda rata-rata Duncan,lama terjadinya diare menunjukkan kelompok dosis 50 mg/kg bb berbeda efek signifikan terhadap kelompok kontrol dan kelompok dosis 25 mg/kg bb. Sedangkan kelompok 100 mg/kg bb berbeda efek signifikan terhadap kelompok 75 mg/kg bb dan kelompok pembanding. Efek yang tidak berbeda signifikan dihasilkan oleh kelompok dosis 75 mg/kg bb dengan kelompok pembanding, juga kelompok 25 dan 50 mg/kg bb tidak berbeda signifikan. Terlihat pada Lampiran 19, halaman 81.
Parameter yang telah diamati efek antidiare dapat di kategorikan berdasarkan tingkat efektivitasnya dalam menekan diare sebagai berikut:
1. Lemah, bila efek antidiare diatas efek kelompok kontrol dan dibawah efek kelompok pembanding.
2. Sebanding, bila efek antidiare sama dengan efek kelompok pembanding. 3. Kuat, bila efek antidiare diatas efek kelompok pembanding.
dengan loperamid HCl dosis 1 mg/kg bb karena mampu menekan diare dan dosis 100 mg/kg bb mempunyai efektifitas yang lebih kuat dalam menekan diare di bandingkan dengan suspensi loperamid HCl dosis 1 mg/kg bb. Hal ini di sebabkan karena jumlah dosis yang di berikan berbeda-beda sehingga mempengaruhi kekuatan bahan uji dalam menekan diare, yang mana semakin tinggi dosis di berikan maka semakin besar efek antidiare yang akan di hasilkan oleh dosis tersebut.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang di lakukan dapat di simpulkan bahwa: 1. Hasil karakteristik simplisia dan ekstrak etanol daun gambir di peroleh
penetapan kadar air 6,59% dan 7,27%, kadar abu total 3,07% dan 3,79%, kadar abu tidak larut asam 0,37% dan 0,43%, kadar sari yang larut dalam etanol 32,35% dan 35,77% dan kadar sari yang larut dalam air 73,69% dan 79,09%. Hasil penetapan memenuhi persyaratan pada Materia Medika Indonesia.
2. Berdasarkan hasil skrining fitokimia diperoleh bahwa gambir mengandung senyawa alkaloida, flavonoida, saponin, tanin, glikosida dan steroida/ triterpenoida pada simplisia maupun ekstrak etanol daun gambir.
3. Efek antidiare ekstrak etanol daun gambir dari berbagai dosis bahan uji di peroleh dosis 25 mg/kg bb dan 50 mg/kg bb menunjukkan efek antidiare yang lemah, dosis 75 mg/kg bb menunjukkan efek antidiare hampir sama dan dosis 100 mg/kg bb menunjukkan efek antidiare yang kuat di bandingkan dengan obat loperamid HCl dosis 1 mg/kg bb.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Tumbuhan gambir (Uncaria gambir Roxb.) termasuk dalam suku kopi-kopian, berasal dari tumbuhan perdu yang membelit dan memiliki batang keras. Tinggi 1-3 cm, batang tegak, bulat, percabangan simpodial warna coklat pucat. Daun tunggal, berhadapan, bentuk elips, tepi bergerigi, pangkal bulat, ujung meruncung, panjang 8-13 cm, lebar 4-7 cm, warna hijau, bunga majemuk, bentuk lonceng, diketiak daun, panjang lebih kurang 5 cm, mahkota 5 helai berbentuk lonceng, tongkol bulat terdiri dari bunga kecil-kecil yang berwarna putih. Buah berbentuk bulat telur, panjang lebih kurang 1,5 cm berwarna hitam (Haryanto, 2009; Mardisiswojo, 1968).
2.1.1 Sistematika tumbuhan
Sistematika tumbuhan gambir (Uncaria gambir Roxb.) (Haryanto, 2009) sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledonae
Ordo : Rubiales
Famili : Rubiaceae
Genus : Uncaria
2.1.2 Manfaat tumbuhan
Gambir dapat merangsang keluarnya getah empedu sehingga membantu kelancaran proses diperut dan usus. Fungsi gambir sebagai campuran obat seperti luka bakar, obat diare, obat disentri, obat kumur-kumur, obat sariawan. Selain itu gambir di gunakan sebagai ramuan untuk makan sirih dan obat untuk sakit perut (Ermiati, 2004).
2.1.3 Kandungan kimia daun gambir
Senyawa kimia tumbuhan yang terdapat pada daun gambir adalah alkaloida, flavonoida, glikosida, tanin, saponin, steroida/triterpenoida.
1. Alkaloida
Alkaloida merupakan senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen, bersifat optis aktif. Kebanyakan alkaloida berbentuk Kristal dan hanya sedikit yang berupa cairan pada suhu kamar. Sebagian besar alkaloida berasa pahit. Alkaloida sering kali beracun bagi manusia dan banyak yang mempunyai kegiatan fisiologi yang menonjol, jadi banyak di gunakan secara luas dalam bidang pengobatan (Harborne, 1973).
Alkaloida juga terdapat di alam sebagai garam yang merupakan hasil reaksi antara basa (alkaloida) dan asam (misalnya asam sulfat untuk memberikan sulfat, atau asam klorida untuk memberikan hidroklorida) (Heinrich, 2009). 2. Flavonoida
fungsi sampai angiospermae. Beberapa fungsi flavonoida untuk tumbuhan yaitu pengaturan tumbuh, pengaturan fotosintesis, kerja antimikroba dan antivirus (Robinson, 1991).
Menurut perkiraan, kira-kira 2% dari seluruh karbon yang di fotosisntesis oleh tumbuhan di ubah menjadi flavonoida atau senyawa yang berkaitan erat dengannya. Sebagian besar tanin berasal dari flavonoida yang merupakan salah satu golongan fenol alam yang terbesar (Markham, 1988).
3. Glikosida
Glikosida adalah suatu senyawa bila di hidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon atau genin). Glikosida yang gulanya berupa glukosa adalah glukosida. Glikosida di bedakan menjadi α-glikosida dan β-glikosida. Pada tanaman, glikosida biasanya terdapat dalam bentuk beta. Pembagian glikosida paling banyak berdasarkan aglikonnya. Umumnya glikosida mudah terhidrolisis oleh asam mineral atau enzim. Hidrolisis oleh asam memerlukan panas dan hidrolisis oleh enzim tidak memerlukan panas (Sirait, 2007).
4. Tanin
Tanin adalah zat-zat penciut (adstringensia) yang berfungsi menciutkan selaput lendir usus dan mengecilkan pori sehingga akan menghambat sekresi cairan dan elektrolit yang di perkirakan dapat menghalangi penyerapan kuman dan toksin sekaligus mengurangi pengeluaran cairan berlebihan (Tan dan Rahardja, 2002).
dengan protein membentuk kopolimer mantap yang larut dalam air (Robinson, 1991).
Golongan tanin dalam makanan dan tanaman memberikan rasa kesat dan pahit. Golongan ini terdiri atas senyawa polifenol larut-air, yang dapat memiliki bobot molekul berat. Secara garis besar, tanin terbagi menjadi dua golongan yaitu tanin dapat-terhidrolisis, yang terbentuk dari esterifikasi gula dengan asam fenolat sederhana yang merupakan tanin turunan-sikamat (misalnya asam galat), dan tidak dapat-terhidrolisis, yang kadang di sebut tanin terkondensasi yang berasal dari polimerisasi (kondensasi) antar flavonoid. Tanin membentuk lapisan pelindung yang terbentuk dari protein yang terkoagulasi pada sepanjang dinding usus sebelah proksimal stimulus yang menambah aktivitas peristaltik. Akibatnya mukosa akan terikat lebih erat sehingga menjadi kurang permeable, suatu proses yang disebut adstrigensia. Tanin yang mendukung aktivitas adstrigensia, di mana tanin juga yang menghambat kelangsungan mikroorganisme yang menginfeksi, mengurangi hipersekresi cairan dan menetralisir protein inflamasi. Adanya afinitas terhadap protein bebas maka tanin akan berkonsentrasi pada area yang rusak. Tanin kondensasi mampu mengikat dan menonaktifkan aktifitas hipersekresi toksin (Sudarsono, 2002; Mills dan Bone, 2000).
5. Saponin
buih yang stabil. Pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau pada waktu memekatkan ekstrak tumbuhan merupakan terpercaya akan adanya saponin (Harborne, 1973).
6. Steroida/triterpenoida
Steroida adalah triterpenoida yang kerangka dasarnya cincin siklopentana perhidrofenantren. Uji yang biasa di gunakan adalah reaksi Liebermann-Burchard yang dengan kebanyakan steroida dan triterpenoida memberikan warna hijau-biru (Harborne, 1973).
Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis di turunkan dari hidrokarbon C30 asiklik. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa alkohol, aldehid atau asam karboksilat, berupa senyawa tahan warna, berbentuk kristal. Triterpenoida dapat dibagi menjadi empat golongan senyawa yaitu triterpenoida sebenarnya, steroida, saponin, dan glikosida jantung. Saponin dan glikosida jantung merupakan triterpenoida dan steroida yang terutama terdapat sebagai glikosida (Harborne, 1973).
2.2 Simplisia dan Ekstrak
2.2.1 Simplisia
tertentu di pisahkan dari tanamannya. Simplisia hewani adalah simplisia yang berupa hewan utuh atau zat-zat yang berguna yang di hasilkan oleh hewan dan belum berupa zat kimia murni. Simplisia mineral atau pelikan adalah simplisia yang berupa bahan pelikan atau mineral yang belum di olah dengan cara sederhana dan belum berupa zat kimia murni (Ditjen POM, 2000).
2.2.2 Ekstrak
Ekstrak adalah sediaan cair yang di peroleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut di uapkan dan massa atau serbuk yang tersisa di perlakukan sedemikian sehingga memenuhi baku yang telah di tetapkan (Ditjen POM, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang akan di ekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut dan mempunyai struktur yang berbeda-beda.
Metode ekstraksi dengan menggunakan pelarut dapat di bagi dua cara yaitu:
a. Cara dingin 1. Maserasi
(terus menerus). Remaserasi berarti di lakukan pengulangan penambahan pelarut setelah di lakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi
Ekstraksi dengan pelarut yang baru sampai sempurna yang umumnya di lakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara tahap perkolasi sebenarnya (penetesan/penampungan ekstrak), terus menerus sampai di peroleh ekstrak (perkolat) yang jumlahnya 1-5 kali bertahan.
b. Cara Panas 1. Refluks
Ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya di lakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2. Soxhlet
Ekstraksi menggunakan pelarut yang selalu baru yang umumnya di lakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Proses maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar) yaitu secara umum di lakukan pada temperatur 40-50ºC.
4. Infus
tercelup dalam penangas air mendidih, temperatur terukur 96-98ºC selama waktu tertentu (15-20 menit).
5. Dekok
Proses infus pada waktu yang lebih lama ≥ 30 menit dan temperatur
sampai titik didih air (Ditjen POM, 2000).
2.3 Uraian Diare
Diare adalah keadaan buang air besar dengan frekuensi tidak normal (meningkat) dengan konsistensi tinja yang lembek atau cair dan merupakan gejala dari penyakit tertentu atau gangguan lainnya (Tan dan Rahardja, 2002). Kandungan cairan merupakan penentuan utama volume dan konsistensi feses dan air umumnya 70% sampai 80% dari berat feses total.
Pada orang yang sehat, makanan dicerna hingga menjadi bubur (chymus), kemudian di teruskan ke usus halus untuk di uraikan lebih lanjut oleh enzim-enzim. Setelah terjadi proses resorpsi, sisa chymus yang terdiri atas 90% air dan sisa-sisa makanan yang sulit di cerna di dorong masuk ke usus besar. Dengan bantuan bakteri pengurai yang terdapat di usus besar sebagian besar sisa makanan masih dapat di serap dan air di resorpsi kembali, sehingga isi usus menjadi lebih padat (Endang dan Puspadewi, 2012).
2.3.1 Patofisiologi diare
Terdapat empat mekanisme patofisiologi diare yang mengganggu keseimbangan air dan elektrolit mengakibatkan terjadinya diare yaitu:
1. perubahan transport ion aktif yang di sebabkan oleh penurunan absorpsi natrium atau peningkatan sekresi klorida.
3. peningkatan osmolaritas luminal.
4. peningkatan tekanan hidrostatik jaringan.
Mekanisme tersebut sebagai dasar pengelompokkan diare secara klinik yaitu:
1. Secretory diarrhea, terjadi ketika adanya rangsangan dari substansi seperti vasoactive intestinal peptide (VIP), pencahar atau toksin bakteri, hal tersebut dapat meningkatkan sekresi atau menurunkan absorpsi air dan elektrolit dalam jumlah besar.
2. Osmotic diarrhea, di sebabkan oleh absorpsi zat-zat yang mempertahankan cairan intestinal.
3. Exudative diarrhea, di sebabkan oleh infeksi saluran pencernaan yang mengeluarkan darah ke dalam saluran pencernaan.
4. Motilitas usus, suatu kondisi peristaltik usus yang mengakibatkan berkurangnya kesempatan usus untuk menyerap makanan.
2.3.2 Klasifikasi diare
Berdasarkan klasifikasinya, diare dapat di bagi kedalam tiga kelompok yaitu:
1. Berdasarkan adanya infeksi, di bagi atas:
a. diare infeksi enteral atau diare karena infeksi di usus misalnya infeksi bakteri (Vibrio cholera, Eschericia coli, Salmonella dan Shigella), infeksi virus (Rotavirus dan Enterovirus) dan infeksi parasit (cacing, protozoa dan jamur).
2. Berdasarkan lamanya diare, di bagi atas:
a. diare akut yaitu diare yang terjadi secara mendadak yang biasanya berlangsung dalam waktu kurang dari 2 minggu.
b. diare kronik yaitu diare yang timbul perlahan-lahan 2 minggu atau lebih, baik menetap atau bertambah hebat.
3. Berdasarkan penyebab terjadinya diare, di bagi atas:
a. diare spesifik yaitu diare yang di sebabkan oleh adanya infeksi misalnya infeksi yang di sebabkan oleh virus, bakteri, parasit dan enterotoksin.
b. diare non spesifik yaitu diare yang tidak di sebabkan oleh adanya infeksi misalnya alergi makanan atau minuman, gangguan gizi, kekurangan enzim dan efek samping (Tan dan Rahadrja, 2002).
2.3.3 Penyebab diare
Diare di sebabkan oleh meningkatnya peristaltik usus, sehingga pelintasan chymus di percepat dan masih banyak mengandung air. Selain itu diare di sebabkan karena bertumpuknya cairan di usus akibat terganggunya resorpsi air atau terjadinya hipersekresi.
Faktor-faktor yang menyebabkan terjadinya diare: a. Virus
Virus melekat pada sel-sel mukosa usus yang menjadi rusak sehingga kapasitas absorpsi menurun dan sekresi air dan elekrolit memegang peranan. Diare yang terjadi bertahan terus sampai beberapa hari sesudah virus lenyap dengan sendirinya, biasanya dalam 3-6 hari.
b. Bakteri
meningkatnya hygiene masyarakat. Bakteri pada keadaan tertentu, misalnya bahan makanan yang terinfeksi oleh banyak kuman menjadi infasive dan menyerang ke dalam mukosa. Bakteri tersebut memperbanyak diri dan membentuk toksin-toksin yang dapat di reabsorpsi ke dalam darah dan menimbulkan gejala-gejala seperti demam tinggi, nyeri kepala dan kejang-kejang, di samping mencret berdarah dan berlendir. Penyebab utama dari jenis diare ini adalah bakteri Salmonella, Shigella, Campylobacter dan jenis Coli tertentu.
c. Parasit
Parasit yang sering menyebabkan diare seperti protozoa Entamoeba histolytica, Glardia lambia, Cyptosporidium dan Cyclospora, yang terutama terjadi di daerah tropis atau subtropis. Diare akibat parasit ini biasanya bercirikan mencret cairan yang intermiten dan bertahan lebih lama dari satu minggu. Gejala lain dapat berupa nyeri perut, demam, anorexia, nausea, muntah-muntah dan rasa letih (malaise).
d. Enterotoksin
Diare enterotoksin penyebabnya dalah kuman-kuman yang membentuk enterotoksin, yang terpenting adalah Eschericia coli dan Vobrio cholera dan sebagian kecil Shigella, Salmonella, Campylobacter dan Entamoeba histolytica.
Toksin melekat pada sel-sel mukosa dan dapat merusaknya. Diare jenis ini bersifat selflimiting artinya akan sembuh dengan sendirinya tanpa pengobatan dalam lebih kurang lima hari, setelah sel-sel mukosa yang rusak di ganti dengan sel-sel mukosa yang baru.
e. Makanan
osmotik usus meningkat sehingga menghalangi absorpsi air dan elektrolit dan menimbulkan diare. Alergi makanan dan minuman yang telah terkontaminasi dengan bakteri dan makanan yang tercemar logam berat juga dapat menyebabkan diare.
f. Penyakit
Sejumlah penyakit ada yang menyebabkan diare sebagai salah satu gejalanya, seperti kanker usus besar dan beberapa penyakit cacing lainnya misalnya penyakit cacing gelang dan cacing pita.
g. Pengaruh psikis
Keluhan dalam diare dapat timbul sebagai salah satu gejala penyakit atau sebagai akibat kelainan jiwa atau psikologis, misalnya ketegangan jiwa, emosi, stress dan lain-lain. Diare karena penyebab ini di kenal dengan istilah diare psikogenik (Tan dan Rahardja, 2002).
2.3.4 Obat-obat diare
Obat-obat yang di gunakan dalam pengobatan diare di kelompokkan menjadi beberapa kategori, yaitu:
1. kemoterapeutik, untuk terapi kausal yakni memberantas bakteri penyebab diare, seperti antibiotik, sulfonamida, kinolon dan furazolidon.
2. obstipansia, yang di bagi menjadi:
a. zat-zat penekan peristaltik, candu dan alkaloidanya, derivat petidin (difenoksilat dan loperamida), dan antikolinergik (atropine dan ekstrak belladonna).
c. adsorbensia, misalnya carbo adsorbens yang pada permukaannya dapat menyerap zat-zat beracun yang di hasilkan oleh bakteri. Termasuk dalam golongan ini antara lain adalah pektin, garam-garam bismuth dan aluminium.
3. spasmolitik, yakni zat-zat yang dapat melepaskan kejang-kejang otot yang sering kali menyebabkan nyeri perut pada diare (Tan dan Rahardja, 2002).
Obat antimotilitas (penekan peristaltik) secara luas di gunakan sebagai terapi simtomatis pada diare akut ringan sampai sedang. Opioid seperti morfin. difenoksilat dan kodein menstimulasi aktivitas reseptor pada neuron mienterikus dan menyebabkan hiperpolarisasi dengan meningkatkan konduktasi kaliumnya. Hal tersebut menghambat pelepasan asetilkolin dari pleksus mienterikus dan menurunkan motilitas usus. Loperamid hidrokloridum adalah opioid yang paling tepat untuk efek lokal pada usus karena tidak menembus ke dalam sawar otak sehingga loperamid hidrokloridum tidak dapat menyebabkan ketergantungan. Antibiotik berguna hanya pada infeksi spesifik tertentu, misalnya pada penyakit kolera dan disentri basiler yang dapat di terapi dengan tetrasiklin (Neal, 2006).
2.4 Loperamid Hidrokloridum
boleh di berikan pada anak-anak di bawah usia 2 tahun, karena fungsi hatinya belum berkembang dengan sempurna untuk menguraikan obat ini (Tan dan Rahardja, 2002).
2.5 Minyak Jarak
BAB I
PENDAHULUAN
1.1 Latar Belakang
Obat tradisional merupakan salah satu warisan budaya bangsa yang sampai saat ini masih di gunakan dan di akui manfaatnya. Bahan baku obat tradisional cukup banyak terdapat di Indonesia dan mudah di peroleh masyarakat, maka secara sosioekonomi kelihatannya menguntungkan bila obat ini dapat di kembangkan dan di gunakan di pusat pelayanan kesehatan (Hargono, 1992).
Pengobatan tradisional dengan menggunakan ramuan obat yang berasal dari tumbuhan bukanlah pengobatan yang terbaru tetapi telah di lakukan nenek moyang sejak zaman dahulu. Seiring dengan perkembangan zaman, masyarakat semakin banyak menggunakan tumbuhan obat dalam mengatasi masalah kesehatan dari pada menggunakan obat-obat modern. Hal ini menandai adanya kesadaran untuk kembali ke alamiah (back to nature), dengan memanfaatkan produk alami yang di yakini memiliki efek samping lebih relatif rendah di bandingkan obat moderen (Dalimartha, 2007).
Banyak tanaman obat yang di gunakan oleh masyarakat sebagai obat diare. Adapun tanaman obat yang dapat di gunakan untuk membantu mengatasi diare di antaranya mempunyai efek sebagai adstringen yaitu dapat mengerutkan selaput lendir usus sehingga mengurangi pengeluaran cairan diare dan disentri (Tan dan Rahardja, 2002).
tanaman berbunga termasuk famili Rubiaceae yang dapat di gunakan untuk mengatasi diare. Diare didefinisikan sebagai suatu keadaan peningkatan kecepatan pengosongan usus besar dan peningkatan kandungan air pada feses. Pada umumnya, apabila terjadi defekasi lebih dari 3 kali sehari, pengeluaran feses dengan konsistensi lunak/cair atau kombinasi keduanya mencerminkan suatu kondisi tidak normal pada proses defekasi (Jeejeebhoy, 1977).
Berdasarkan hal di atas maka di lakukan penelitian tentang uji efek antidiare ekstrak etanol daun gambir (Uncaria gambir Roxb.) pada tikus putih yang di buat diare dengan oleum ricini sebagai penginduksi, CMC 1% sebagai kontrol negatif dan obat loperamid HCl sebagai kontrol positif dari bahan uji antidiare ekstrak etanol daun gambir.
Pemanfaatan tumbuhan sebagai obat, kebenaran bahan baku penting untuk menjamin manfaat dan keamanan pengobatan. Oleh karena itu, sebelum di lakukan penelitian untuk melihat efek tumbuhan yang di gunakan di karakterisasi terlebih dahulu untuk menjamin mutu bahan baku yang akan di gunakan (Sari, 2006).
1.2 Perumusan Masalah
Berdasarkan latar belakang maka perumusan masalah pada penelitian adalah:
a. bagaimana karakterisasi simplisia dan ekstrak etanol daun gambir?
b. apakah simplisia dan ekstrak etanol daun gambir dapat di tentukan golongan senyawa kimianya?