Lampiran 1. Tumbuhan Kaliandra (C. calothyrsus) yang digunakan dalam penelitian
a. Tumbuhan Kaliandra di daerah Gundaling, Berastagi
Lampiran 3. Kromatogram Lapis TipisEkstrak Pekat Kloroform Daun Tumbuhan
Lampiran 4. Kromatogram Lapisan Tipis ekstrak daun tumbuhan Kaliandra (C. calothyrsus) setelah penggabungan fraksi.
II I
E E
Keterangan:
Fasa diam : Kieselgel 60 F254
E : Ekstrak daun tumbuhan Kaliandra (C. calothyrsus)
No Fraksi Jumlah Noda Harga Rf
I 36-55 2
Rf 1 = 0,485 Rf 2 = 0,311
Lampiran 5. Kromatogram Lapisan Tipis senyawa murni hasil isolasi
I II III
E E E
Keterangan :
Fase diam : Silika Gel 60 F254
Lampiran . 8 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ=4,0- 6,0 ppm
-OCH3
O
O
OCH3
OH H3CO
OH
1
2
3 4 5
6 7
8 1'
2' 3'
4'
5' 6'
A C
Lampiran 9. Ekspansi spektrum 1H-NMR Senyawa Hasil Isolasi pada δ= 6,0-8,5 ppm
H6 H8
H-5' H-3'
H-2' H-6'
O
O
OCH3
OH H3CO
OH
1
2
3 4 5
6 7
8 1'
2' 3'
4'
5' 6'
A C
Lampiran 10. Spektrum 1H-NMR senyawa pembanding flavonoida Pembanding untuk Metoksi (-OCH3)
DAFTAR PUSTAKA
Andersen,M.,Markham,K.R.2006. Flavonoids.Taylor & Francis Group.NewYork. Bhat, S., et al. 2005. Chemistry Of Natural Products. Narosa Publishing House.
India
Cseke, L., Kirakosyan, A., Kaufman, P., Warber, S., Duke, J., Brielmann, H. 2006. Natural Products From Plants. CRC Press.New York.
Dewick, P. M., 2002. Medicinal Natural Products. John Wiley & Sons Ltd. England
Djaja, W, Kuswaryan, S, dan Tanuwiria, U.H., 2007. Efek substitusi konsentrat oleh daun kering Kaliandra (Calliandra calothyrsus) terhadap kuantitas dan kualitas susu, bobot badan, dan pendapatan peternak. Universitas Padjajaran. Bandung
Gandjar, I.G., Rohman, A. 2007. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.
Gritter, R.J., Bobbit, J.M., Schwarting, A.E. 1991. Pengantar Kromatografi. Edisi Kedua. Penerbit ITB. Bandung.
Harborne, J.B. 1996. MetodaFitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terbitan ke-2. Terjemahan Kosasih Padmawinata dan Iwang Soediro. ITB. Bandung
Heinrich, M. 2010. Farmakognosi Dan Fitoterapi. Penerbit Buku Kedokteran EGC.Jakarta
Hostettmann, K., Hostettmann, M., Marston, A. 1995. Cara Kromatografi Preparatif, Penggunaan Pada Senyawa Bahan Alam. Penerbit ITB. Bandung.
Mabry, T.J., Markham, K.R., Thomas, M.B. 1970. The Sistematic Identification of Flavonoids. Springer Verlag.NewYork.
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasi Padmawinata. ITB. Bandung
Muldja, M.H. 1995. Analisis Instrumental. Cetakan Pertama. Universitas Airlangga Press. Surabaya.
Nakanishi, K., Goto, T., Ito, S., Natori, S., Nosoe, S. 1974. Natural Product Chemistry. Volume 1. Kodansha Ltd Academic Press. Tokyo.
Nessa,Zhari,Nornisah.2004. Free Radical-Scavenging Activity Of Organic Extracts And Of Pure Flavonoids Of Blumea Balsamifera DC Leaves.School Of Pharmaceutical Sciences Universiti Sains.Penang, Malaysia.
Nurahmadhan.2010.Leguminosa
Patterson, et all, 1996. Experience with Calliandra calothyrsus as a feed for livestock in africa.
Winrock Internasional and Taiwan Forestry Research Institute. USA
Pavia, D.L., Lampman, G.M., Kriz, G.S. 1979. Introduction to Spectroscopy: A Guide for Students of Organic Chemistry. Saunders College.Philadelphia. Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi.Edisi ke-4.
Terjemahan Kosasih Padmawinata. ITB Press. Bandung
Sastrohamidjojo, H. 1991. Sintesis Bahan Alam. Gadjah Mada University Press. Yogyakarta
Satiadarma, K., Mulja, M., Tjahjono, D.H., Kartasasmita, R.E. 1995. Asas Pengembangan Prosedur Analisis. Edisi Pertama.
Airlangga UniversityPress. Surabaya
Sirait, M. 2007. Penuntun Fitokimia Dalam Farmasi. Penerbit ITB. Bandung. Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Penerbit Widya
Padjajaran. Bandung.
Tangenjaya, B, 1992. Kaliandra dan Manfaatnya. Balai Penelitian Ternak dan TheAustralian Cebtre for International Agricultural Research (ACIAR) . Wiryowidagdo, S. 2007. Kimia dan Farmakologi Bahan Alam.Penerbit
BAB 3
METODE PENELITIAN
3.1 Alat-alat
1. Spektrofotometer 1H-NMR Jeol/Delta2NMR 500MHz
2. Spektrofotometer FT-IR Shimadzu
3. Spektrofotometer UV-Vis 4. Kolom Kromatografi
5. Rotarievapotaror Bűchi R-114
6. Labu rotarievaporator 1000 mL Schoot/ Duran
7. Lampu UV 254nm/356nm UVGL 58
8. Neraca Analitis Mettler AE 200
9. Chamber
10. Ekstraktor 5000 mL Schoot/Duran
11. Alat destilasi
12. Labu takar 250 mL Pyrex
13. Corong Pisah 1000 mL Pyrex
14. Gelas Beaker 500mL/1000mL Pyrex
15. Gelas Erlenmeyer 250 mL Pyrex
3.2 Bahan-bahan
1. Daun Tumbuhan Kaliandra
2. Metanol Destilasi
3. Etil asetat Teknis
4. Aquadest
5. N-heksana Teknis
6. Silika gel 40 (70-230 mesh) ASTM E.Merck. KgA 7. FeCl3 5%
8. NaOH 10% 9. Serbuk Mg 10. HCl(p)
11. H2SO4(p)
12. Pereaksi Benedict 13. HCl 6%
14. Kapas
15. Kloroform Teknis
16. Plat KLT silika gel 60 F254 E.Merck.Art 554
17. Plat KLT Preparatif 60 F254
18. Benzena p.a. E. Merck
19. Aseton p.a. E. Merck
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan Kaliandra
Serbuk daun Kaliandra diidentifikasi dengan menggunakan cara Skrining Fitokimia. Untuk membuktikan adanya senyawa flavonoida yang terdapat dalam daun tumbuhan Kaliandra maka dilakukan uji pendahuluan secara kualitatif dengan reaksi warna sebagai berikut:
Pertama-tama,dimasukkan 10 gram serabuk daun Kaliandra yang telah dikeringkan kedalam dua gelas erlenmeyer. Kemudian ditambahkan 100 ml metanol kedalam erlenmeyer I dan 100 ml etil asetat kedalam erlenmeyer II. Kemudian didiamkan 1 malam. Kemudian disaring. Selanjutnya ekstrak dari metanol dan etil asetat masing-masing dibagi kedalam 4 tabung reaksi. Kemudian masing-masing tabung reaksi ditambahkan dengan pereaksi :
- Untuk ekstrak metanol sampel
a. Tabung I : dengan FeCl3 5% menghasilkan larutan berwarna hitam
b. Tabung II : dengan serbuk Mg, dan HCl(p) menghasilkan larutan merah
jambu
c. Tabung III: dengan NaOH 10% menghasilkan larutan hijau kekuningan d. Tabung IV: dengan H2SO4(p) menghasilkan larutan hijau kehitaman
- Untuk ekstrak etil asetat sampel
a. Tabung I : dengan FeCl3 5% menghasilkan larutan berwarna hitam
b. Tabung II : dengan serbuk Mg, dan HCl(p) menghasilkan larutan merah
jambu
3.3.3 Ekstraksi Daun Tumbuhan Kaliandra
Serbuk daun Kaliandra ditimbang sebanyak 1000 g, kemudian dimaserasi dengan metanol sebanyak ± 16 L sampai semua sampel terendam dan dibiarkan selama 24 jam. Maserasi ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol. Kemudian diuapkan hingga semua pelarut metanol menguap. Lalu dilakukan pemisahan tanin dengan cara melarutkan fraksi pekat metanol dengan etil asetat, dan disaring. Filtrat kemudian di rotarievaporator lalu diuapkan hingga semua pelarut etil asetat menguap. Lalu fraksi pekat etil asetat dilarutkan dengan metanol dan di ekstraksi partisi berulang-ulang dengan n-heksana sampai lapisan n-heksana hampir bening. Lapisan metanol dipisahkan dari lapisan n-heksana, lalu dipekatkan kembali dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ektrak pekat lapisan metanol. Fraksi metanol di uji kandungan gula dengan pereaksi Benedict, lalu di hidrolisis dengan menggunakan HCl 6% sambil di panaskan diatas penangas air selama ± 60 menit. Kemudian disaring dan filtrat yang diperoleh di ektraksi partisi dengan kloroform sebanyak 3 kali hingga bening. Ekstrak kloroform dipekatkan dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ekstrak pekat kloroform sebanyak 1,4 g.
3.3.4 Analisis Kromatografi Lapis Tipis
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak kloroform dengan menggunakan fase diam silika gel 60F254 Merck. Analisis ini dimaksudkan untuk
mencari sistem dan perbandingan pelarut yang sesuai untuk kromatografi kolom. Fasa gerak yang digunakan adalah campuran pelarut n-heksana:etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40, 50:50(v/v).
tutup dan di elusi. Plat yang telah di elusi, di keluarkan dari bejana, lalu di keringkan.
Di amati noda yang terbentuk dibawah sinar UV, kemudian difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga
Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut n-heksana:etil asetat dengan perbandingan 80:20, 70:30, 60:40 (v/v).
3.3.5 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kromatografi kolom dilakukan terhadap ekstrak pekat kloroform yang telah diperoleh. Fasa diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM dan fasa gerak yaitu n-heksana 100%, campuran pelarut n-heksana:etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40, 50:50(v/v).
Dirangkai alat kromatografkolom. Terlebih dahulu dibuburkan silika gel 40 (70-230 mesh) ASTM dengan menggunakan n-heksana, diaduk-aduk hingga homogen lalu dimasukkan ke dalam kolom kromatografi. Kemudian dielusi dengan menggunakan n-heksana 100% hingga silika gel padat dan homogen. Dibuburkan 1,4 g ekstrak pekat kloroform dengan silika gel dengan pelarut kloroform, kemudian dimasukkan ke dalam kolom kromatografi yang telah berisi bubur silika gel, lalu ditambahkan fasa gerak n-heksana:etil asetat 90:10 (v/v) secara perlahan-lahan dan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n-heksana:etil asetat dengan perbandingan 80:20 (v/v), 70:30 (v/v), 60:40 (v/v), dan 50:50 (v/v). Hasil yang diperoleh ditampung dalam botol vial setiap ± 10 mL, lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian pasta dilakukan dengan kromatografi lapis tipis dengan menggunakan fasa diam silika gel 60 F254 dengan fasa gerak n-heksana:etil asetat
60:40 (v/v), dan kloroform:metanol 70:30 (v/v).
Dimasukkan 10 mL larutan fasa gerak ke dalam bejana kromatografi lapis tipis, lalu dijenuhkan. Ditotolkan pasta yang sebelumnya dilarutkan dengan kloroform pada plat KLT. Dimasukkan plat KLT tersebut ke dalam bejana kromatografi lapis tipis yang telah jenuh. Setelah pelarut fasa gerak merembes sampai batas tanda, plat KLT dikeluarkan dari bejana, dikeringkan, diamati di bawah sinar UV, dan difiksasi dengan menggunakan pereaksi FeCl3 5% dalam
metanol menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa flavonoida.
3.3.7 Identifikasi Senyawa Hasil Isolasi
3.3.7.1 Identifikasi dengan Spektrofotometer UV-Visible
Analisis dengan alat Spektrofotometer UV-Visible diperoleh dari Laboratorium Kimia Organik Bahan Alam ITB, Jalan Ganesha 10- Bandung, Jawa Barat dengan menggunakan pelarut metanol.
3.3.7.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
3.3.7.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton
(1H-NMR)
3.4 Bagan Skrining Fitokimia
Maserasi dengan pelarut Metanol
Serbuk daun tumbuhan kaliandra (Calliandra calothyrsus)
Diekstraksi maserasi dengan metanol Disaring
Dibagi kedalam 2 tabung reaksi
Ditambahkan pereaksi FeCl3 5%
Diamati perubahan warna
Larutan hitam (positif fenolik)
Ditambahkan pereaksi Mg-HCl
Diamati perubahan warna Larutan merah muda (positif fenolik)
Tabung I Larutan Hijau
Maserasi dengan pelarut Etil asetat
Serbuk daun tumbuhan kaliandra (Calliandra calothyrsus)
Diekstraksi maserasi dengan etil asetat Disaring
Dibagi kedalam 2 tabung reaksi
Ditambahkan pereaksi FeCl3 5%
Diamati perubahan warna
Larutan hitam (positif flavonoid)
Ditambahkan pereaksi Mg-HCl Diamati perubahan warna
Larutan merah muda (positif flavonoid)
Tabung I Larutan Hijau
3.5 Bagan Penelitian
1000 gram serbuk daun tumbuhan Kaliandra (Calliandra calothyrsus)
dimaserasi dengan metanol sebanyak 7 L didiamkan selama ± 48 jam
diulangi sebanyak 4 kali
Residu diuji dengan FeCl3
dipekatkan dengan rotarievaporator
diuapkan sampai semua pelarut metanol habis disaring
Ekstrak pekat metanol
dilarutkan dengan etil asetat secara berulang ulang sampai bening disaring
Ekstrak etil asetat
dipekatkan dengan rotarievaporator
Ekstrak pekat etil asetat Ekstrak metanol
dilarutkan dengan metanol
diuapkan sampai semua pelarut etil asetat menguap
Residu
diekstraksi partisi dengan n-heksan secara berulang-ulang sampai bening
Lapisan metanol Lapisan N-heksan
diuji dengan larutan Bennedict
dihidrolisa dengan HCl 6% sambil dipanaskan selama 1 jam didinginkan
disaring
Ekstrak metanol asam Residu
diekstraksi partisi dengan kloroform hingga lapisan kloroform bening
Lapisan kloroform Lapisan ekstrak
metanol asam dipekatkan
Ekstrak pekat kloroform
dipekatkan dengan rotarievaporator diuji dengan FeCl3
diuji dengan FeCl35%
diuji KLT dengan eluen n-Heksana : Etil Asetat (90:10 ; 80:20 ; 70:30 ; 60:40 ; 50:50)v/v dikolom kromatografi dengan fase diam silika gel dan fase gerak
(eluen) n-Heksana : Etil Asetat (90:10 ; 80:20 ; 70:30 ; 60:40 ; 50:50)v/v ditampung tiap fraksi sebanyak ± 5ml dalam botol vial
dianalisis KLT
digabung fraksi dengan harga Rf yang sama
Fraksi 1-15
Dianalisis KLT dengan sistem pelarut n-Heksan : Etil Asetat ; Benzena : Aseton ;
Kloroform : Metanol dengan perbandingan masing-masing 60:40 v/v
Dianalisis dengan spektrofotometer UV-Visible, FT-IR, dan spektrometer 1H-NMR
Hasil Analisis
Hasil Positif Hasil Positif Hasil Positif Hasil Negatif
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dari hasil skrining fitokimia terhadap ekstrak metanol dari daun tumbuhan Kaliandra (C. calothyrsus) menunjukkan bahwa sampel positif terhadap pereaksi- pereaksi flavonoida.
Hasil isolasi senyawa flavonoida dari daun tumbuhan Kaliandra diperoleh dengan menggunakan fase gerak n-heksana:etil asetat (60:40) v/v, dan senyawa
yang diperoleh berbentuk pasta berwarna coklat kemerahan, dengan massa = 60,9 mg, dengan Rf = 0,23 dan diuji kemurnian kromatografi lapis tipis dengan fase gerak benzena : aseton (60:40) v/v dan kloroform : metanol (60:40) v/v positif terhadap pereaksi flavonoida.
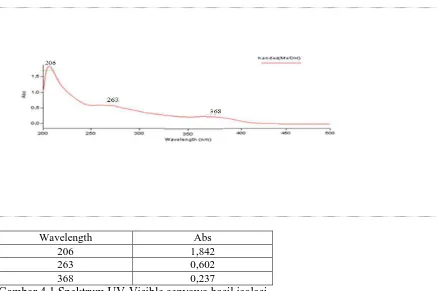
Spektrum UV-Visible senyawa hasil isolasi dengan menggunakan pelarut metanol ditunjukkan pada gambar 4.1 dibawah ini:
Wavelength Abs
206 1,842
263 0,602
368 0,237
Hasil analisis Spektrofotometer Ultraviolet-Visible (UV-Vis) dengan pelarut metanol memberikan panjang gelombang maksimum (λ maks) sebagai berikut:
1. Pita I memberikan panjang gelombang 368,00 nm 2. Pita II memberikan panjang gelombang 257,00 nm
Hasil ini menunjukkan bahwa golongan dari struktur flavonoida yang diperoleh adalah golongan flavonol.
Hasil Analisis spektrofotometer FT-IR dari pasta hasil isolasi menghasilkan pita-pita serapan pada daerah bilangan gelombang yang dapat dilihat pada gambar 4.2
Gambar 4.2 spektrum Infra Merah (FT-IR) senyawa hasil Isolasi
Keterangan , x : Bilangan gelombang (cm-1) , y : Transmitansi (%T)
Dari Hasil Spektrum Infra Merah Diperoleh:
1. Pada bilangan gelombang 3423,65 cm-1 puncak tajam menunjukkan adanya vibrasi ulur OH
2. Pada bilangan gelombang 2852,72-2924,09 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C-H alifatis
3. Pada bilangan gelombang 1734,01 cm-1 puncak tajam menunjukkan adanya vibrasi ikatan rangkap C=O
4. Pada bilangan gelombang 1550,84cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C aromatik
5. Pada bilangan gelombang 1382,86 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk –CH3
6. Pada bilangan gelombang 1251,80 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C-O dari gugus alkohol
7. Pada bilangan gelombang 1118,71 cm-1 puncak rendah menunjukkan adanya vibrasi C-O-C
8. Pada bilangan gelombang 728,6-749,90 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk =C-H
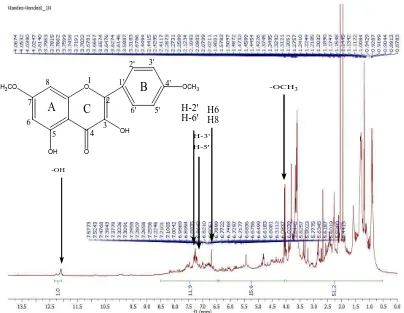
Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dapat dilihat pada gambar 4.3 dibawah ini :
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi
Dari hasil analisis Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut Aseton-d6 memberikan
pergeseran kimia (δ) pada daerah (ppm) sebagai berikut :
1. δ,1= 4,0674-4101 ppm puncak doublet menunjukkan proton (H) metoksi (–OCH3).
4.2 Pembahasan
Dari hasil kromatografi lapis tipis, diketahui bahwa perbandingan pelarut yang baik untuk mengisolasi senyawa flavonoida dari daun tumbuhan kaliandra adalah n-heksana:etil asetat 60:40 (v/v) yang menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan. Hal ini dibuktikan dengan analisis KLT yang menunjukkan adanya enam noda dengan jarak terpisah antar noda yang baik ( lampiran 3). Setelah pemisahan dengan kromatografi kolom kemudian dilakukan analisis KLT dan didapatkan 5 fraksi, dimana fraksi yang dilanjutkan adalah fraksi yang keempat sebanyak 60,9 mg. Senyawa yang diperoleh kemudian diuji kemurniannya dengan KLT dengan menggunakan pelarut Benzena:Aseton 60:40 (v/v) dan n-heksana:etil asetat 60:40 (v/v) menunjukkan satu noda pada senyawa yang dihasilkan.
Dari hasil interpretasi spektrum UV-Visible dengan pelarut metanol
(Gambar 4.1) memberikan panjang gelombang (λ maks) 263 nm dan 368 nm, hal
ini menunjukkan bahwa senyawa hasil isolasi sesuai dengan spektrum UV-Visible dari senyawa pembanding flavonoid yaitu Flavonol.
Dari hasil interpretasi Spektrum Inframerah (FT-IR) (Gambar 4.2) dan Spektrum 1H-NMR dengan menggunakan pelarut aseton dalam standar TMS (gambar 4.3) diperoleh :
Pergeseran kimia pada daerah δ= 4,0674-4101 ppm menunjukkan puncak
doublet menunjukkan proton dari -OCH3. Hal ini didukung oleh spektrum
inframerah pada bilangan gelombang 2852,72-2949,09 cm-1 puncak sedang menunjukkan adanya vibrasi ulur –CH alifatis dan bilangan gelombang 1386,82 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk –CH3 dan juga didukung
pada bilangan gelombang 1118,71 puncak sedang menunjukkan adanya vibrasi ulur dari C-O-C.
vibrasi ikatan rangkap C=C pada sistem aromatik pada bilangan gelombang 914,26 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur =CH
Pergeseran kimia pada daerah δ= 7,2101-7,2246 ppm terdapat puncak doublet menunjukkan adanya proton-proton pada posisi H-3’ dan H-5’ pada cincin B dan pada pergeseran kimia pada daerah δ= 7,2556-7,2658 ppm dengan puncak doublet menunjukkan proton-proton pada posisi H-2’ dan H-6’ pada cincin B. Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 914,26 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur =CH dan pada bilangan gelombang 1550,84 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C pada sistem aromatik.
Berdasarkan analisis data dan interpretasi yang dilakukan pada spektrum UV-Visible, Spektrum Inframerah (FT-IR), Spektrum 1H-NMR disimpulkan bahwa besar kemungkinan pasta yang diisolasi dari daun tumbuhan kaliandra (C. calothrysus) adalah senyawa flavonoida golongan flavonol.
Meskipun demikian, penulis mengakui bahwa data hasil 1H-NMR kurang murni karena adanya campuran dari senyawa hasil isolasi. Berikut ini merupakan struktur flavonoida yang diduga merupakan senyawa hasil isolasi.
BAB 5
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
1. Hasil uji skrining fitokimia dengan pereaksi flavonoida menunjukkan bahwa daun kaliandra (C. calothyrsus) mengandung senyawa flavonoida
2. Hasil isolasi yang diperoleh dari 1000 g daun tumbuhan kaliandra (C. calothyrsus) merupakan pasta berwarna coklat kemerahan, diperoleh sebanyak 60,9 mg, Rf=0,23 dengan eluen n-heksana : etil asetat 60:40 (v/v) 3. Hasil analisis dengan spektrofotometri UV-Visible, Spektrofotometri
Inframerah (FT-IR) dan Spektrometri Resonansi Magnetik Inti Proton (1 H-NMR) menunjukkan bahwa senyawa hasil isolasi dari daun tumbuhan Kaliandra (C. calothyrsus) adalah senyawa flavonoida golongan Flavonol.
5.2 SARAN
a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula-gula, dan hampir semua asam amino
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid
c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
d. Senyawa heterosiklik, seperti alkaloid, flavonoid, dan basa-basa nukleat.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Biasanya pengembangan bahan alam didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
Sebagai contoh, berbagai steroid dengan struktur yang berbeda, aktivitas kardiotoniknya (kardenolida dan bufadienolida) ditunjukkan secara spesifik oleh (a) ikatan cis cincin A/B, (b) adanya gugus gula pada C3, dan (c) gugus lakton
(dengan 5 atau 6 atom karbon) terkonjugasi pada C17.
O
3. Klasifikasi Berdasarkan Taksonomi
telah dapat diisolasi dari berbagai genus, spesies, suku, atau ordo. Bahkan di dalam satu spesies terdapat sejumlah komponen yang memiliki struktur dasar yang berkaitan. Sebagai contoh, opium dari Papaver somniferum mengandung lebih dari 20 alkaloid seperti morfin, kodein, tebain dan narkotin yang semuanya merupakan hasil biosintesis dari prekursor 11-benzilisokuinolin dengan kopling oksidatif.
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi dan karakterisasinya. Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan kalsifikasi tumbuhan.
N R
4. Klasifikasi Berdasarkan Biogenesis
Biogenesis dan biosintesis memiliki arti yang sama dan sering kali digunakan tanpa perbedaan. Namun, istilah biogenesis biasanya digunakan untuk reaksi pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis.
Berbagai teori tentang pembentukan senyawa metabolit primer dan metabolit sekunder telah dikemukakan di dalam berbagai publikasi. Diawali dengan teori aturan isoprena pada tahun 1930, yang menyatakan bahwa semua terpenoid dibentuk dari unit isoprena 5-C, dilanjutkan dengan teori poliketometilena untuk senyawa fenolik, yang merupakan saran pertama bagi biosintesis asetogenin (poliketida). Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor, yaitu:
Asetil ko-A
Malonil ko-A unit 2C(Me-C
O
) poliketida (asetogenin) a.
b. asam sikimat unit 6C-3C (6C-1C atau 6C-2C) senyawa fenolik
c. asam mevalonat unit prenil isoprenoid
CH2=C-CH2-CH2
Me
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan alkaloid
e. 5-5'-deoksiadenilmetionina unit 1C
2.3 Senyawa Flavonoida
Senyawa flavonoida diturunkan dari unit C6-C3 (fenil propana) yang bersumber
dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur
poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6-C3 (sebagai KoA tioester) untuk membentuk unit awal
-C3teroksidasi (tidak jenuh) untuk menghasilkan gugus flavon, atau dihidroksilasi
pada posisi C3 cincin piranon untuk menghasilkan gugus flavanol pada flavonoid.
Sistem penomoran untuk turunan senyawa flavonoid diberikan di bawah :
O
Flavanol ini selanjutnya dioksidasi untuk menghasilkan antosianin, yang memberikan warna biru terang pada bunga dan warna anggur merah gelap. Senyawa flavonoid juga berperan dalam memberikan banyak warna lain di alam, terutama daun mahkota kuning dan jingga, bahkan flavonoid yang tidak berwarna menyerap cahaya pada spektrum UV (karena banyak gugus kromofor) dan dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk membantu penyerbukan tanaman. Flavonoid tertentu juga mempengaruhi rasa makanan secara signifikan, misalnya beberapa tanaman memiliki rasa pahit dan kesat seperti glikosida flavanon naringin.
O
itu. Oleh karena itu, makanan kaya flavonoid dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung (yang dapat memburuk akibat oksidasi lipoprotein densitas-rendah) (Heinrich et al, 2009).
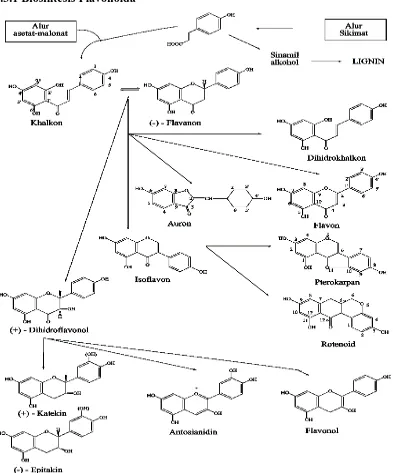
2.3.1 Biosintesis Flavonoida
Gambar 2.1Biosintesa hubungan antara jenis monomer flavonoida dari alur asetat-malonat dan alur sikimat (Markham, 1998).
Kerangka C15 yang dihasilkan, telah mempunyai substituen oksigen
sehubungan dengan pembentukan cincin A (jalur poliketida) dan dengan cincin B yang berasal dari sikimat (fenilalanina---asam sikimat). Setelah terjadi berbagai perubahan enzimatik dari ketiga atom karbon sentral dari kerangka 1,3-diaril propana dapat mempunyai berbagai gugus fungsional, misalnya hidroksil, ikatan rangkap, karbonil dan sebagainya.
2.3.2 Klasifikasi Senyawa Flavonoida
Dalam tumbuhan, flavonoid terdapat dalam berbagai bentuk struktur. Keragaman struktur flavonoid ini disebabkan karena perbedaan tahap modifikasi lanjutan dari struktur dasar flavonoid, antara lain:
1. Flavonoid O-glikosida.
Flavonoid biasanya terdapat sebagai flavonoid O-glikosida, pada senyawa tersebut satu gugus hidroksi flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi meyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan). Glukosa merupakan gula yang paling umum terlibat, walaupun galaktosa, ramnosa, xilosa, dan arabinosa sering juga terdapat. Gula lain yang ditemukan adalah alosa, manosa, fruktosa, apiosa dan asam glukuronat serta galakturonat.
2. Flavonoid C-glikosida.
3. Flavonoid Sulfat
Gabungan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih, yang terikat pada hidroksil fenol atau gula.
4. Biflavonoid
Biflavonod adalah flavonoid dimer, walau pun prosianidin dimer (satuan dasarnya katekin) biasanya tidak dimasukkan ke dalam golongan ini. Flavonoid yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ (atau kadang-kadang 5,7,3’,4’) dan ikatan antar-flavonoid berupa ikatan karbon-karbon atau kadang-kadang ikatan eter. Biflavonoid jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon flavonoid yang aktif-optik
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonid ini ialah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa biflavonoid. (Markham, 1988)
Menurut Robinson (1995), flavonoid dapat dikelompokkan berdasarkan tahanan oksidasi dan keragaman lain pada rantai C3 :
1. Flavon
O
O A C
B
2. Flavonol
Flavonol sangat tersebar luas di dalam tumbuhan, baik sebagai kopigmen antosianin dalam daun bunga maupun dalam daun tumbuhan tinggi. Dalam tumbuhan terdapat banyak sekali glikosida flavonol.Sampai saat ini yang paling umum adalah kuersetin 3-rutinosida yang dikenal sebagai rutin.
O
O
OH A C
B
3. Isoflavon
Isoflavon merupakan senyawa yang tidak begitu mencolok, tetapi senyawa ini penting sebagai fitoaleksin (senyawa pelindung) dalam tumbuhan untuk pertahanan terhadap penyakit.Isoflavon menunjukkan aktivitas sebagai estrogenik, insektisida, dan antifungi.Beberapa diantaranya berguna untuk racun tikus.
O
O
A C
B
4. Flavanon
dengan serbuk Mg dan HClpekat.Diantara flavonoida hanya flavon yang menghasilkan warna merah ceri kuat.
O
O A C
B
5. Flavanonol
Flavanonol (atau dihidroflavonol) barangkali merupakan flavonoid yang paling kurang dikenal, dan tidak dapat diketahui apakah senyawa ini terdapat sebagai glikosida. Senyawa ini stabil dalam asam klorida panas tetapi terurai oleh udara (Harborne, 1987).
O
Antosianin adalah pigmen daun bunga merah sampai biru yang biasa, banyaknya sampai 30% bobot kering dalam beberapa bunga. Antosianin terdapat juga dalam bagian lain tumbuhan tinggi kecuali fungus. Antosianin selalu terdapat dalam bentuk glikosida.
O
O
8. Leukoantosianidin
Merupakan monomer flavan 3,4-diol, leukoantosianidin jarang terdapat sebagai glikosida, namun beberapa bentuk glikosida yang dikenal adalah apiferol, dan peltoginol.
O
Khalkon adalah pigmen fenol kuning yang berwarna coklat tua dengan sinar UV bila dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air (Harborne, 1987).
A
O
B
10.Auron
O
O
CH
A
B
2.4Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel dan beberapa tetes HCl pekat, warna orange, pink, merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan 2,3-dihidro dan xanton. Penggunaan zinc sebagai pengganti magnesium dapat dilakukan, dimana hanya flavanonol yang memberikan perubahan warna merah pekat sampai magenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning
pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah.
3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa
fenol, tetapi tidak dapat digunakan untuk membedakan macam-macam golongan flavonoid. Pereaksi ini memberi warna kehijauan, warna biru, dan warna hitam-biru (Sarker, 2006).
2.5Teknik Pemisahan
Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan. (Muldja, 1995)
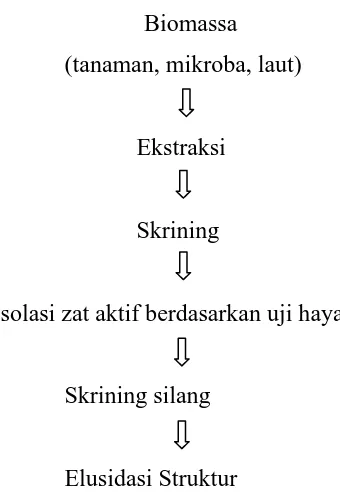
Biomassa (tanaman, mikroba, laut)
Ekstraksi
Skrining
Isolasi zat aktif berdasarkan uji hayati
Skrining silang
Elusidasi Struktur
Gambar 2.3 Skema Teknik Pemisahan Metabolit Sekunder
2.5.1 Ekstraksi
Jika telah dikeringkan, biomassa kemudian digiling menjadi partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini penting karena ektraksi efektif pada partikel kecil, dikarenakan memiliki luas permukaan yang lebih besar.
Pemilihan pelarut ekstraksi sangat penting. Jika tanaman diteliti dari sudut pandang etnobotani, ektraksi harus mengikuti pemakaiannya secara tradisional. Kegagalan mengekstraksi biomassa dapat menyebabkan kehilangan akses untuk mendapatkan zat aktif.
Terdapat sejumlah metode ekstraksi, yang paling sederhana adalah ekstraksi dingin (dalam labu besar berisi biomassa), dengan cara ini bahan kering hasil gilingan diekstraksi pada suhu kamar secara berturut-turut dengan pelarut yang kepolarannya makin tinggi. Keuntungan utama cara ini adalah merupakan metode ekstraksi yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan alam terurai. Penggunaan pelarut dengan peningkatan kepolaran secara berurutan memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan polaritasnya) dalam ektraksi. Hal ini sangat mempermudah proses isolasi. Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, meskipun beberapa senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar. (Heinrich et al, 2009)
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator. (Harborne, 1996)
2.5.2 Partisi
dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat. Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi fisik dengan medium lain (Heinrich et al, 2009).
2.5.3 Hidrolisis
Prosedur yang digunakan untuk hidrolisis asam dari flavonoid glikosida adalah, sebanyak 2 mg sampel flavonoid glikosida dicampur dengan asam klorida 6% sebanyak 5 ml dengan jumlah metanol yang sangat sedikit pada sampel untuk membuat proses hidrolisis menjadi sempurna. Larutan dipanaskan selama 45 menit lalu didinginkan, kemudian ekstrak sepenuhnya dilarutkan dengan eter. Penguapan dari larutan akan mengendapkan ramnosa dan glukosa. Lapisan eter, setelah dikeringkan dengan menggunakan natrium sulfat akan didapatkan aglikon flavonoid setelah diuapkan (Mabry et al, 1970).
2.5.4 Kromatografi
Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia Michael Tswett pada tahun 1903 untuk memisahkan pigmen berwarna dalam tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang berisi kalsium karbonat (CaCO3). Kromatografi merupakan suatu teknik pemisahan
Kromatografi dapat dibedakan atas berbagai macam tergantung pada pengelompokkannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi: kromatografi adsorbsi, kromatografi partisi, kromatografi pasangan ion, kromatografi penukar ion, kromatografi eksklusi ukuran. Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: kromatografi kertas, kromatografi lapis tipis (disebut juga kromatografi planar), kromatografi cair kinerja tinggi, dan kromatogtrafi gas. Bentuk kromatografi yang paling awal adalah kromatografi kolom yang digunakan untuk pemisahan sampel dalam jumlah yang besar.
Pemisahan pada kromatografi planar pada umumnya dihentikan sebelum semua fase gerak melewati seluruh permukaan fase diam. Solut pada kedua kromatografi ini dikarakterisasi dengan jarak migrasi solut terhadap jarak ujung fase geraknya. Nilai faktor retardasi solut (Rf) dapat dihitung dengan menggunakan perbandingan dalam persamaan:
Rf= Jarak yang ditempuh solut Jarak yang ditempuh fase gerak
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai perbandingan distribusi (D) dan faktor retensi sama dengan 0 yang berarti solut bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal di permukaan fase diam.
Proses Sorpsi
atau lebih mekanisme ini terlibat dalam satu jenis kromatografi. Keempat jenis tersebut adalah adsorpsi, partisi, pertukaran ion, dan eksklusi ukuran.
Adsorben
Silika gel merupakan jenis adsorben (fase diam) yang penggunaannya paling luas. Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus silanol (Si-OH). Gugus silanol bersifat sedikit asam dan polar karenanya gugus ini mampu membentuk ikatan hidrogen dengan solut-solut yang agak polar sampai sangat polar.
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu mendeaktifkan permukaan silika gel karena air akan menutup sisi aktif silika gel. Hal seperti ini dapat diatasi dengan memanaskan pada suhu 1050C, meskipun demikian reprodusibilitasnya sulit dicapai kecuali jika suhu dan kelembapan benar-benar dijaga secara hati-hati. Semakin polar solut maka akan semakin tertahan kuat ke dalam adsorben silika gel ini (Gandjar dkk, 2007).
Tabel 2.1 Daftar Adsorben pada Kromatografi
Jenis adsorben Kepolaran
Alumina
Karbon aktif (Charcoal) Silika gel
Magnesium silikat Selulosa
Resin-resin polimerik (stiren/difenil benzen)
(paling polar)
(paling non polar)
2.5.4.1Kromatografi Lapis Tipis
dengan menggunakan pipa mikrokapilaritas. Plat dikembangkan dengan meletakkannya didalam botol ataupun chamber pengembang yang berisi sejumlah kecil pelarut. Pelarut akan menaiki plat dengan adanya gaya kapilar, dan membawa senyawa dari sampel dengan itu. Senyawa yang berbeda dipisahkan dari dasarnya pada saat interaksi mereka dengan lapisan adsorben.
Plat KLT yang biasa digunakan adalah plat dengan ukuran pori silika 60 Å dan ketebalan lapisan 25 µm dalam penyangga poliester atau aluminium, beberapa dengan menggunakan atau tanpa menggunakan indikator fluorosensi yang sesuai untuk analisa cepat dari ekstrak kasar tanaman dan digunakan sebagai dasar dari langkah preparatif. Plat biasa dapat digunting dengan menggunakan gunting atau kertas cutter untuk mengambil ukuran yang diinginkan. Deteksi noda yang dihasilkan dapat menggunakan lampu ultraviolet ataupun dengan menyemprot dengan menggunakan reagen yang sesuai (Cseke et al, 2006).
2.5.4.2 Kromatografi Kolom
Kolom kromatografi atau tabung untuk pengaliran karena gaya tarik bumi (gravitasi) atau sistem bertekanan rendah biasanya terbuat dari kaca yang dilengkapi keran jenis tertentu pada bagian bawahnya untuk mengatur aliran pelarut. Ukuran keseluruhan kolom sungguh beragam, tetapi biasanya panjangnya sekurang-kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100 kalinya. Ukuran kolom dan banyaknya penjerap yang dipakai ditentukan oleh bobot campuran sampel yang akan dipisahkan.
Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan KLT) atau tampaknya berasal dari satu puncak (memakai pendeteksian sinambung) digabungkan, dan pelarutnya diuapkan, lebih baik dengan tekanan rendah. Jika pelarut dan penjerap murni. Maka fraksi-fraksi pun murni (Gritter dkk, 1991).
2.5.4.3 Kromatografi Lapis Tipis Preparatif
Sebagian besar pemakaian kromatografi lapis tipis preparatif hanya dalam jumlah miligram. Kromatografi lapis tipis preparatif bersama-sama dengan kromatografi kolom terbuka, dijumpai sebagian besar dalam isolasi bahan alam. Penjerap yang paling umum digunakan adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Ukuran partikel dan porinya kurang lebih sama dengan ukuran tingkat KLT.
Cuplikan sebanyak 10-100 mg dapat dipisahkan pada lapisan silika gel atau aluminium oksida 20 x 20 cm yang tebalnya 1 mm. Pengembangan plat KLTP biasanya dilakukan dalam bejana kaca yang dapat menampung beberapa plat. Bejana dijaga tetap jenuh dengan pelarut pengembang dengan bantuan sehelai kertas saring yang tercelup ke dalam pengembang.
2.6 Teknik Spektroskopi
Teknik analisis modern mencakup berbagai teknik analisis instrumen elektronika yang dikembangkan untuk mengukur parameter fisika dan kimia alami yang khas dan tetap dari atom atau molekul. Parameter khas yang bermakna untuk analisis adalah absorpsi dan emisi energi radiasi elektromagnet oleh atom atau molekul.
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai parameter analisis. Karena pada setiap teknik spektroskopi antaraksi radiasi elektromagnet dengan komponen atom/ molekul khas dan tidak semuanya sama, uraian teknik analisis didahului dengan mekanisme antaraksi tersebut, serta fenomena yang dipakai sebagai parameter analisisnya (Satiadarma dkk, 1995).
2.6.1 Spektroskopi Ultraviolet (UV-Vis)
Senyawa polifenol memiliki dua karakteristik pita penyerapan Ultraviolet dengan maksimal jarak 240 sampai 285 nm dan 300 sampai 550 nm. Berbagai macam golongan flavonoid dapat dikenali dari spektrum UV mereka masing-masing, karakteristik spektra UV dari masing-masing flavonoid yang mengandung jumlah dari golongan hidroksil aglikon, pola substituen glikosida, dan golongan asil aromatik bahan alam.
Saat ini penggunaan Spektroskopi UV-Visible paling sering digunakan dalam aplikasi untuk analisa kuantitatif, dan nilai dari metode ini dapat mengurangi perbandingan informasi yang banyak dari teknik spektroskopi yang lainnya seperti NMR dan MS (Andersen, 2006).
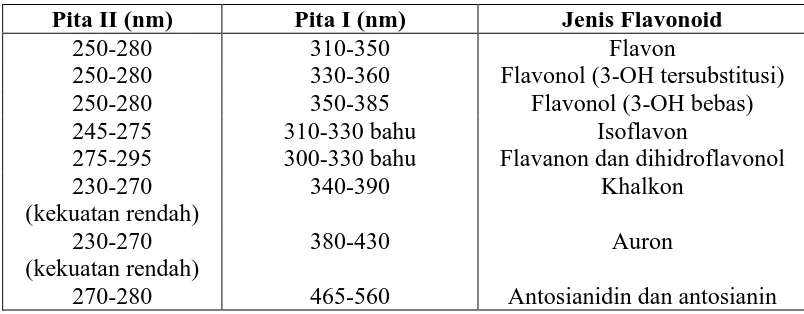
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara disajikan pada tabel dibawah :
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida Pita II (nm) Pita I (nm) Jenis Flavonoid
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi)
250-280 350-385 Flavonol (3-OH bebas)
245-275 310-330 bahu Isoflavon
275-295 300-330 bahu Flavanon dan dihidroflavonol 230-270
270-280 465-560 Antosianidin dan antosianin
Perubahan penyulihan pada cincin A cenderung tercerminkan pada serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung lebih jelas tercermin pada serapan pita I (Markham, 1988).
2.6.2 Spektroskopi Inframerah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation) dengan cara serupa dengan dua bola yang terikat oleh suatu pegas.
diserap. Ikatan nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur): vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk): vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Contohnya, ikatan O-H menyerap energi pada frekuensi 3330 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi regang ikatan O-H itu. Suatu ikatan O-H itu juga menyerap pada kira-kira 1250 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlain-lainan ini disebut cara vibrasi fundamental (Supratman, 2010).
2.6.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Setelah spektroskopi inframerah, spektroskopi resonansi magnetik inti (NMR) adalah yang metode yang paling penting digunakan dalam kimia organik. Dalam spektroskopi inframerah mengandung infromasi mengenai adanya gugus fungsi pada molekul, sedangkan spektroskopi NMR memberikan informasi mengenai jumlah dari masing-masing hidrogen.
Pergeseran kimia dalam unit δ ditunjukkan dalam jumlah resonansi proton yang
bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi
δ= pergeseran dalam Hz
frekuensi spektrometer dalam MHz
Unsur dasar dari spektrometer nmr adalah ilustrasi skematis. Sampel dilarutkan dalam pelarut yang tidak memiliki proton (biasanya CCl4) dan dalam
jumlah yang kecil dari TMS yang ditambahkan sebagai pusat referensi internal.
Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzena, siklopentana, atau aseton memiliki nilai
BAB I
PENDAHULUAN
1.1Latar Belakang
Flavonoid adalah kelompok terbesar dari senyawafenolik yang terdapat di alam, yang dimana dalam bagian tumbuhan baik dalam keadaan bebas dan sebagai glikosida. Istilah flavonoid diambil dari bahasa latin “flavus” yang artinya kuning, sebagian besar dari senyawa flavonoid berwarna kuning. Flavonoid juga dikenal sebagai pigmen atau co-pigmen dalam tumbuhan.Adanya pigmen-pigmen menyebabkan adanya warna yang berbeda-beda dan kombinasi warna yang terdapat di kulit, daun, bunga, buah dan biji dari tumbuhan.Warna-warna ini dapat menarik serangga(Bhat, 2005).
Flavonoida yang terdapat didalam tumbuhan dapat digunakan sebagai pelindung tubuh manusia dari radikal bebas dan dapat mengurangi resiko terjadinya penyakit kanker dan peradangan (Nessa, 2003).Senyawa flavonoid diduga sangat bermanfaat dalam makanan karena berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Oleh karena itu, makanan yang kaya flavonoid penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung (Heinrich, 2010).
Kaliandra bukan tanaman asli Indonesia. Tanaman ini berasal dari Amerika Tengah dan banyak ditemukan muiai dari Mexico Selatan sampai negara bagian barat taut. Jenis tanaman ini lebih dari 50 jenis dan yang terdapat di Indonesia hanya beberapa jenis, antara lain yang sering dijumpai adalah Calliandra Surinamensis dan Calliandra Colothyrsus. Calliandra Surinamensis ditanam di halaman atau pekarangan sebagai tanaman Was (Tangenjaya, B, 1992).
sampai saat ini pemanfaatannya belum optimum. Keberadaan daun Kaliandra mampu menjadi pakan andalan dalam jangka panjang. Kandungan nutrisi daun Kaliandra cukup potensial terutama protein yaitu 25,08 persen. Adapun faktor pembatas pemanfaatannya adalah Tanin (Patterson et al, 1996).
Dari studi literatur peneliti terdahulu terhadap tumbuhan Kaliandra; Tangenjaya (1992) menyatakan bahwa daun kaliandra sudah banyak dipakai sebagai pakan ternak walaupun penggunaannya masih perlu dicampur dengan hijauan lainnya . Pada umumnya domba, kambing dan sapi di Jawa sudah terbiasa mengkonsumsidaun kaliandara. Pemberian daun kaliandra sebagai pakan ternak dilakukan dalam tiga bentuk : segar, Iayu atau kering. Pemberian dalam bentuk segar merupakan yang paling efektif dibandingkan dengan bentuk layu ataupun kering karena prosentase pakan yang dapat dicerna lebih tinggi, disamping itu tanaman kaliandra bila tidak segera diberikan akan rontok . Kandungan protein kaliandra cukup tinggi, tetapi kaliandra mengandung tanin yang dapat menghambat daya cerna bila diberikan berlebihan, maka pemberian kaliandra sebagai pakan ternak dibatasi jumlahnya.
Nurahmadhan (2010) mengatakan bahwa daun Kaliandra mengandung protein sebesar 20%, tanin 8-11%, saponin, flavonoida, dan glikosida dalam jumlah kecil yang tidak membahayakan ternak. Ia juga mengatakan bahwa pemberian pada ternak sebaiknya dalam bentuk segar karena proses pengeringan akan menurunkan proses konsumsi dan kecernaanya. Selain itu, kandungan tanin dalam Kaliandra segar tidak berbahaya untuk ternak.
Sejauh ini penelitian terdahulu terhadap jenis golongan Flavonoida yang terdapat dalam daun Kaliandra (C. calothyrsus) belum pernah dipublikasikan , maka penulis tertarik untuk meneliti jenis golongan Flavonoida yang terkandung dalam daun Kaliandra (C. calothyrsus).
1.2 Permasalahan
cara mengisolasi senyawa flavonoida yang terdapat dalam daun tumbuhan kaliandra (C. calothyrsus).
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi senyawa flavonoida dan mengetahui golongan senyawa flavonoida yang terkandung dalam daun tumbuhan kaliandra (C. calothyrsus)
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya mengenai golongan senyawa flavonoida yang terkandung dalam daun tumbuhan kaliandra (C. calothyrsus) ..
1.5 Lokasi Penelitian
1. Tempat pengambilan sampel
Sampel yang digunakan diperoleh dari daerah Gundaling, Berastagi, Sumatera Utara.
2. Tempat melakukan penelitian
Penelitian dilakukan di Laboratorium Kimia Bahan Alam Hayati Universitas Sumatera Utara
3. Lokasi Identifikasi Senyawa Hasil Isolasi
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap daun tumbuhan kaliandra (C. calothyrsus) berupa serbuk halus yang kering sebanyak 1000 gram. Tahap awal yaitu dilakukan uji skrining fitokimia untuk senyawa flavonoida dari ektrak metanol dan etil asetat dengan menggunakan pereaksi serbuk Mg-HCl, FeCl3 5%, NaOH 10%, dan H2SO4(p).
Tahap isolasi yang dilakukan: 1. Ektraksi Maserasi
2. Pemisahan Tanin 3. Ektraksi Partisi
4. Hidrolisis (Pemutusan Gula) 5. Analisis Kromatografi Lapis Tipis 6. Analisis Kromatografi Kolom
7. Analisis Preparatif Kromatografi Lapis Tipis 8. Analisis Senyawa Hasil Isolasi
Tahapan analisis senyawa hasil isolasi yang dilakukan adalah: 1. Analisis Kromatografi Lapis Tipis
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KALIANDRA(Callindra calothyrsus)
ABSTRAK
Isolasi senyawa flavonoida yang terdapat pada daun Kaliandra (Calliandra calothyrsus) dilakukan secara maserasi dengan pelarut metanol.Ekstrak pekat metanol ditambahkan dengan etil asetat kemudian disaring. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 6% dan selanjutnya dipartisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan eluen n-heksana : etil asetat 90:10; 80:20; 70:30; 60:40 (v/v). Senyawa yang diperoleh berbentuk pasta berwarna coklat kemerahan sebanyak 60,9 mg dengan harga Rf=0,23. Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visible, Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR). Dari data analisis dan interpretasi spektroskopi, diduga bahwa senyawa hasil isolasi yang diperoleh adalah senyawa flavonoida yaitu golongan flavonol.
ISOLATION OF FLAVONOID COMPOUNDS FROM LEAVES OF KALIANDRA(Calliandra calothyrsus)
ABSTRACT
Isolation of flavonoid compounds from leaves of Kaliandra (Calliandra caothyrsus) has been done with maceration by methanol solvent. The concentrated extract of methanol added with ethyl acetate. The concentrated extract of ethyl acetate then dissolved with methanol and partition extracted with n-hexane. The concentrated extract of methanol acidified by HCl6%, then partition extracted with chloroform. The concentrated extract of chloroform separated with column chromatography with eluent n-hexane:ethyl acetate 90:10; 80:20; 70:30; 60:40 (v/v). The pure compoundwas Red brownies paste with weight 60,9 mg, Rf= 0,23. The compound further identified spectroscopy Ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR) and Proton Nuclear Magnetic Resonance Spectroscopy (1H-NMR). Spectroscopy analysis showed that the compound was Flavonol.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KALIANDRA
(Calliandra calothyrsus)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
HANDES SEBASTIAN HUTAHAEAN
110802050DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Isolasi Senyawa Flavonoida dari Daun Tumbuhan Kaliandra (Calliandra calothyrsus)
Kategori : Skripsi
Nama Mahasiswa : Handes Sebastian Hutahaean Nomor Induk Mahasiswa : 110802050
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, Februari 2016
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Prof.Dr. Tonel Barus Drs. Albert Pasaribu, M.Sc NIP. 194508011974121001 NIP. 1964 0810 1991 031002
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KALIANDRA (Calliandra calothyrsus)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Februari 2016
PENGHARGAAN
Puji syukur penulis panjatkan kehadiran Tuhan Yang Maha Esa atas berkat dan karunia yang begitu luar biasa karena melalui penyertaanNya skripsi ini dapat diselesaikan dalam waktu yang indah yang telah ditetapkanNya.
Ucapan terima kasih secara khusus penulis sampaikan dengan segala kerendahan hati kepada kedua orang tua penulis, Bapak terkasih Haposan Hutahaean, dan Mamak tersayang Aten Br. Situmorang atas doa, dukungan, perhatian, dan motivasi kepada penulis sehingga penulis dapat menyelesaikanskripsi ini. Tidak lupa juga kepada adek-adek Okviandus dan Yohana yang selalu memberikan semangat kepada penulis sehingga penulis selalu bersemangat menyelesaikan skripsi ini. Penulis juga menyadari bahwa skripsi ini tidak akan selesai tanpa adanya bantuan dari berbagai pihak, maka penulis mengucapkan terima kasih yang luar biasa kepada:
1. Bapak Drs. Albert Pasaribu, M.Sc dan Bapak Prof.Dr. Tonel Barus selaku dosen pembimbing yang telah banyak membimbing, mengajari dan memotivasi penulis selama melakukan penelitian dan penulisan skripsi. 2. Ibu Dr. Rumondang Bulan Nst, M.S selaku Ketua Departemen Kimia
FMIPA USU dan Bapak Drs. Albert Pasaribu, M.Sc selaku Sekretaris Departemen, serta kepada Ibu Dr. Cut Fatimah Zuhra , M.Si selaku dosen PA penulis dan kepada semua staf pengajar di Kimia FMIPA USU.
3. Kepala Laboratorium Bapak Lamek Marpaung, M.Phil, Ph.D atas bantuan, kepercayaan dan kerja sama selama saya menjadi asisten dan kepada seluruh asisten Laboratorium Kimia Bahan Alam Hayati (kak Agnes, kak Siska, kak Anita, bang Doni, bang Berkat, Andre, Deby, Rickson, dek Geo, Cinta, Jessy, Debby, Defrista, Haposan).
4. Kepada sahabat terbaik Ella Agita Br. Sembiring yang selalu memotivasi dan banyak memberikan masukan kepada penulis.
5. Kepada keluarga KCC, teman-teman stambuk 2011, dan adek-adek stambuk 2012,2013, & 2014.
6. Kepada Nadya Christina Saraswati Br. Tarigan yang selalu memberikan motivasi dan menemani penulis menyelesaikan skripsi ini.
Dan semua pihak yang tidak dapat disebutkan satu persatu, penulis ucapkan terima kasih. Kiranya Tuhan selalu memberikan perlindungan dan kasih sayang kepada kita.
Tuhan memberkati kita semua.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KALIANDRA(Callindra calothyrsus)
ABSTRAK
Isolasi senyawa flavonoida yang terdapat pada daun Kaliandra (Calliandra calothyrsus) dilakukan secara maserasi dengan pelarut metanol.Ekstrak pekat metanol ditambahkan dengan etil asetat kemudian disaring. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 6% dan selanjutnya dipartisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan eluen n-heksana : etil asetat 90:10; 80:20; 70:30; 60:40 (v/v). Senyawa yang diperoleh berbentuk pasta berwarna coklat kemerahan sebanyak 60,9 mg dengan harga Rf=0,23. Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visible, Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR). Dari data analisis dan interpretasi spektroskopi, diduga bahwa senyawa hasil isolasi yang diperoleh adalah senyawa flavonoida yaitu golongan flavonol.
ISOLATION OF FLAVONOID COMPOUNDS FROM LEAVES OF KALIANDRA(Calliandra calothyrsus)
ABSTRACT
Isolation of flavonoid compounds from leaves of Kaliandra (Calliandra caothyrsus) has been done with maceration by methanol solvent. The concentrated extract of methanol added with ethyl acetate. The concentrated extract of ethyl acetate then dissolved with methanol and partition extracted with n-hexane. The concentrated extract of methanol acidified by HCl6%, then partition extracted with chloroform. The concentrated extract of chloroform separated with column chromatography with eluent n-hexane:ethyl acetate 90:10; 80:20; 70:30; 60:40 (v/v). The pure compoundwas Red brownies paste with weight 60,9 mg, Rf= 0,23. The compound further identified spectroscopy Ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR) and Proton Nuclear Magnetic Resonance Spectroscopy (1H-NMR). Spectroscopy analysis showed that the compound was Flavonol.
DAFTAR ISI 1.1 Latar Belakang 1.2 Permasalahan 1.3 Tujuan Penelitian 1.4 Manfaat Penelitian 1.5 Lokasi Penelitian 1.6 Metode Penelitian
1 Bab 2 Tinjauan Pustaka
2.1 Tumbuhan Kaliandra
2.1.1 Sistematika Tumbuhan Kaliandra
2.1.2 Morfologi dan Manfaat Tumbuhan Kaliandra 2.2 Senyawa Organik Bahan Alam
2.3 Senyawa Flavonoida
2.3.1 Biosintesis Flavonoida
2.3.2 Klasifikasi Senyawa Flavonoida 2.4 Skrining Fitokimia
2.5 Teknik Pemisahan 2.5.1 Ekstraksi 2.5.2 Partisi 2.5.3 Hidrolisis 2.5.4 Kromatografi
2.5.4.1 Kromatografi Lapis Tipis 2.5.4.2 Kromatografi Kolom
2.5.4.3 Kromatografi Lapis Tipis Preparatif 2.6 Teknik Spektroskopi
2.6.1 Spektroskopi Ultraviolet (UV-Vis) 2.6.2 Spektroskopi Inframerah (FT-IR)
Bab 3 Metode Penelitian 3.1 Alat-alat 3.2 Bahan-bahan 3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan Pucuk Merah
3.3.3 Ekstraski Daun Tumbuhan Pucuk Merah 3.3.4 Analisis Kromatografi Lapis Tipis
3.3.5 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
3.3.7 Identifikasi Senyawa Hasil Isolasi
3.3.7.1 Identifikasi dengan Spektrofotometer UV- Visible
3.3.7.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
3.3.7.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR)
3.4 Bagan Skrining Fitokimia 3.5 Bagan Penelitian
29 Bab 4 Hasil dan Pembahasan
4.1 Hasil Penelitian 4.2 Pembahasan
40 44 Bab 5 Kesimpulan dan Saran
5.1 Kesimpulan 5.2 Saran
46 46
DAFTAR PUSTAKA 47
DAFTAR TABEL
Nomor Judul Halaman
Tabel
Tabel 2.1 Daftar Adsorben pada Kromatografi 22 Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan
Flavonoida
DAFTAR GAMBAR
Nomor Judul Halaman Gambar
DAFTAR LAMPIRAN
Nomor Judul Lampiran
Lampiran 1. Gambar daun tumbuhan Kaliandra (Calliandra calothyrsus)
Lampiran 2. Hasil Determinasi daun tumbuhan Kaliandra (Calliandra calothyrsus)
Lampiran 3. Kromatogram Lapisan Tipis Ekstrak Pekat Kloroform daun tumbuhan Kaliandra (Calliandra calothyrsus) sebelum Kromatografi Kolom
Lampiran 4. Kromatogram Lapisan Tipis Ekstrak Pekat Kloroform daun Tumbuhan Kaliandra (Calliandra calothyrsus) penggabungan fraksi
Lampiran 5. Kromatogram Lapisan Tipis senyawa murni hasil isolasi Lampiran 6. Spektrum Ultraviolet-Visible beberapa senyawa
Flavonoida
Lampiran7. Ekspansi Spektrum 1H-NMR senyawa hasil isolasi pada δ = 0 – 13,5 ppm
Lampiran 8. Ekspansi Spektrum 1H-NMR senyawa hasil isolasi pada δ = 4,0 – 6,0 ppm
Lampiran 9. Ekspansi Spektrum 1H-NMR senyawa hasil isolasi pada δ = 6,0 – 8,5 ppm
Lampiran 10. Spektrum 1H-NMR senyawa pembanding Flavonoida