(
Capsicum
spp.) DAN MEKANISME KETAHANANNYA
TERHADAP BEGOMOVIRUS PENYEBAB PENYAKIT
DAUN KERITING KUNING
ROKHANA FAIZAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Karakterisasi Beberapa Genotipe Cabai (Capsicum spp.) dan Mekanisme Ketahanannya terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning” adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Maret 2010
Rokhana Faizah
ROKHANA FAIZAH. Characterization of Several Pepper Genotypes and Their Resistance Mechanism to Begomovirus, the Causal Agent of Yellow Leaf Curl Disease. Supervised by SRIANI SUJIPRIHATI, MUHAMAD SYUKUR and SRI HENDRASTUTI HIDAYAT.
The plant breeding program to develop resistant plants of Begomovirus is needed to characterize of pepper germplasm. The activities followed by study on resistance mechanism based on information of structural and biochemical resistance against Begomovirus and their vector Bemisia tabaci. Pepper yellow leaf curl virus (PYLCV) belongs to the genus of Begomovirus, the family members of Geminiviridae. The virus has been reported as the causal agent of yellow leaf curl disease in pepper and transmitted by an insect vector, B. tabaci Genn. Evaluation of genotypes characters showed that the morphological characters of leaves, stems, flowers, and fruits can be distinguished among the genotypes of pepper. There are significant differences among pepper genotypes for the following variables: height of dicotomous, plant height, canopy width, stem diameter, leaves length and width, and flowering times. Dendrogram analysis based on qualitative characters involving 29 genotypes classifies the genotypes into 4 different groups. Most of the genotypes belong to group I, genotypes IPB C15 and IPB C63 are in group II, IPB C12 genotype in group III, whereas IPB C20 and IPB C21 are in group IV. All genotypes are included in C. annuum, except IPB C63 genotype which belongs to C. frutescens.
Capsicum species differs in the form of leaves, number of flowers at per node, the position of flowers, fruit color intermediate, and plants canopy. Resistance response of the genotypes was identified based on the measurement of disease intensity. IPB C12 genotype is resistant; IPB C10 and IPB C14 genotypes are moderately resistant; IPB C15, IPB C26, and 35C2 genotypes are susceptible. PYLCV detection using PCR technique has successfully amplified 780 bp-sized Begomovirus-specific DNA fragments. Dot blot hybridization is capable to detect PYLCV in resistant and moderately resistant genotypes to a dilution level of 1: 10, whereas susceptible genotypes can reach up to 1: 100 dilution level. Susceptible genotype tended to have a Begomovirus concentrations higher than genotypes resistant or moderate resistant. Genotypes resistance to Begomovirus is associated with structure of plants i.e. density of trichome and arrangement of palisade cells. An increased accumulation of salicylic acid and peroxidase enzyme activity are detected in Begomovirus-inoculated plants, 120 hours after inoculation. Based on the correlation among characters in pepper genotypes, it can be concluded that there is a correlation between the mechanisms of structural and biochemical resistance of plants following Begomovirus infection. Longer palisade cells will lead to thicker leaf and more accumulation of salicylic acid. Trichome density and palisade cells position are the structural barrier in the mechanism of pepper resistance to B. tabaci. Resistance mechanism to Begomovirus is the result of the width of palisade cells, increased accumulation of salicylic acid, and increased activity of peroxidase enzymes. There is a correlation between the structural and biochemical mechanisms to Begomovirus, with a positive correlation between the lengths of palisade cells and salicylic acid accumulation.
ROKHANA FAIZAH. Karakterisasi Beberapa Genotipe Cabai (Capsicum
spp.) dan Mekanisme Ketahanannya terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning. Di bawah bimbingan SRIANI SUJIPRIHATI, MUHAMAD SYUKUR, dan SRI HENDRASTUTI HIDAYAT.
Program pemuliaan tanaman untuk mendapatkan tanaman tahan terhadap Begomovirus penyebab penyakit daun keriting kuning adalah dengan melakukan karakterisasi genotipe cabai. Karakterisasi tersebut diharapkan diperoleh deskripsi pada masing-masing genotipe cabai. Selanjutnya, diperlukan kajian mekanisme ketahanan berdasarkan struktural dan biokimia terhadap infeksi Begomovirus dan vektor Bemisia tabaci. Pepper yellow leaf curl virus (PYLCV) termasuk dalam genus Begomovirus anggota famili Geminiviridae. Virus tersebut dilaporkan merupakan penyebab penyakit daun keriting kuning pada cabai dan ditularkan melalui serangga vektornya, yaitu kutukebul B. tabaci. Penelitian ini merupakan dua unit penelitian terpisah, yaitu Karakterisasi Beberapa Genotipe Cabai (Capsicum
spp.) dan Mekanisme Ketahanan Cabai terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning.
Penelitian pertama, Karakterisasi Beberapa Genotipe Cabai (Capsicum spp.) bertujuan untuk memperoleh informasi karakter kualitatif dan kuantitatif genotipe cabai, pengelompokan genotipe berdasarkan spesies Capsicum, dan mengelompokkan 29 genotipe cabai berdasarkan karakter kualitatif. Genotipe tersebut adalah IPB C1, IPB C2, IPB C3, IPB C4, IPB C5, IPB C6, IPB C7, IPB C9, IPB C10, IPB C11, IPB C12, IPB C14, IPB C15, IPB C16, IPB C17, IPB C19, IPB C20, IPB C21, IPB C28, IPB C37, IPB C50, IPB C51, IPB C63, IPB C64, IPB C68, IPB C105, IPB C107, IPB C110, dan IPB C111. Penelitian dilaksanakan pada bulan April hingga September 2008 di kebun penelitian Leuwikopo dan Laboratorium Genetika dan Pemuliaan Tanaman IPB. Perlakuan disusun dalam Rancangan Kelompok Lengkap Teracak (RKLT) faktor tunggal 3 ulangan, dimana masing-masing ulangan terdiri atas 10 tanaman. Hasil penelitian menunjukkan bahwa karakter morfologi daun, batang, bunga, dan buah dapat dibedakan antar genotipe cabai. Terdapat perbedaan sangat nyata antar genotipe cabai terhadap peubah tinggi dikotomus, tinggi tanaman, lebar tajuk, diameter batang, panjang dan lebar daun, serta waktu berbunga. Berdasarkan karakter kualitatif, 29 genotipe cabai yang diamati dibagi menjadi 4 kelompok yang sebagian besar masuk pada kelompok I, genotipe IPB C15 dan IPB C63 masuk kelompok II, genotipe IPB C12 masuk kelompok III, dan genotipe IPB C20 dan IPB C21 masuk kelompok IV. Seluruh genotipe termasuk ke dalam C. annuum kecuali genotipe IPB C63 yang termasuk C. frutescens. Perbedaan spesies Capsicum
terdapat pada bentuk daun, jumlah bunga pada tiap percabangan, posisi bunga, warna buah intermediate, dan habitus tanaman.
penyakit daun keriting kuning. Deteksi PYLCV dilakukan dengan teknik PCR dan hibridisasi asam nukleat. Pengamatan dan pengukuran mekanisme ketahanan struktural terdiri atas kerapatan trikoma, panjang dan lebar sel palisade, dan ketebalan daun. Analisis mekanisme ketahanan biokimia antara lain akumulasi asam salisilat dan aktivitas enzim peroksidase. Pengukuran dan pengamatan sifat-sifat struktural dilakukan pada fase kotiledon hingga fase generatif, dan analisis biokimia dilakukan pada 120 jam setelah inokulasi (jsi). Hasil penelitian menunjukkan berdasarkan pengukuran intensitas penyakit terhadap Begomovirus, respon ketahanan genotipe dapat dikelompokkan menjadi tahan untuk genotipe IPB C12, agak tahan untuk genotipe IPB C10 dan IPB C14, dan rentan untuk genotipe IPB C15, IPB C26, dan 35C2. Deteksi PYLCV dengan teknik PCR berhasil mengamplifikasi fragmen DNA spesifik Begomovirus berukuran 780bp. Hibridisasi Dot Blot mampu mendeteksi PYLCV pada genotipe tahan dan agak tahan hingga taraf pengenceran 1 : 10, sedangkan genotipe rentan dapat mencapai taraf pengenceran 1 : 100. Genotipe rentan (35C2) memiliki kerapatan trikoma yang rendah, susunan dan posisi sel palisade yang kurang rapi, tidak seragam, dan rongga antar sel cukup luas. Ketahanan genotipe cabai terhadap Begomovirus berhubungan dengan sifat struktural tanaman, yaitu kerapatan trikoma dan susunan sel palisade. Peningkatan akumulasi asam salisilat dan aktivitas enzim peroksidase terjadi pada tanaman yang diinokulasi Begomovirus yaitu pada waktu 120 jam setelah inokulasi. Berdasarkan korelasi antar karakter pada genotipe cabai, terdapat korelasi antara mekanisme ketahanan struktural dan biokimia tanaman cabai terhadap infeksi Begomovirus. Semakin panjang ukuran sel palisade, daun semakin tebal dan akumulasi asam salisilat semakin meningkat. Kerapatan trikoma, susunan dan posisi sel palisade merupakan penghalang struktural pada mekanisme ketahanan cabai terhadap vektor B. tabaci.
Ukuran luas sel palisade, peningkatan akumulasi asam salisilat dan aktivitas enzim peroksidase merupakan mekanisme ketahanan cabai terhadap Begomovirus.
Karakterisasi genotipe dapat digunakan untuk membuat deskripsi genotipe cabai. Berdasarkan karakter kualitatif, pengelompokan genotipe dibagi menjadi 4 kelompok besar dan terdapat 2 spesies Capsicum, yaitu C. annuum dan C. frutescens.
Berdasarkan respon ketahanan, genotipe IPB C12 termasuk genotipe tahan, IPB C10 dan IPB C14 agak tahan, serta IPB C15, IPB C26, dan 35C2 termasuk genotipe rentan. Konsentrasi Begomovirus cenderung lebih tinggi pada genotipe rentan dibanding genotipe tahan atau agak tahan. Mekanisme ketahanan cabai terhadap B. tabaci terdiri ataskerapatan trikoma dan susunan sel palisade. Mekanisme ketahanan cabai terhadap Begomovirus adalah ukuran luas sel palisade, peningkatan akumulasi asam salisilat, dan peningkatan aktivitas enzim peroksidase. Terdapat hubungan antara mekanisme ketahanan struktural dengan biokimia dengan adanya korelasi positif nyata antara panjang sel palisade dengan akumulasi asam salisilat.
© Hak cipta milik IPB, tahun 2010
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
(
Capsicum
spp.) DAN MEKANISME KETAHANANNYA
TERHADAP BEGOMOVIRUS PENYEBAB PENYAKIT
DAUN KERITING KUNING
ROKHANA FAIZAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Mekanisme Ketahanannya terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning
Nama : Rokhana Faizah NIM : A253070081
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Sriani Sujiprihati, M.S Ketua
Dr. Muhamad Syukur, SP. M.Si Dr. Ir. Sri Hendrastuti Hidayat, M.Sc
Anggota Anggota
Diketahui
Ketua Mayor Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Syukur Alhamdulillah tiada terkira penulis panjatkan ke Hadhirat Allah SWT. Rabb yang memberi segala kemudahan sehingga akhirnya penulis dapat menyelesaikan penelitian dan karya ilmiah ini. Tesis yang berjudul Karakterisasi Beberapa Genotipe Cabai (Capsicum spp.) dan Mekanisme Ketahanannya terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning merupakan tugas akhir untuk memperoleh gelar Magister Sains pada Sekolah Pascasarjana IPB.
Penelitian dan penulisan tesis ini dibimbing oleh Prof. Dr. Ir. Sriani Sujiprihati, M.S., Dr. Muhamad Syukur, SP., M.Si., dan Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Terima kasih dan penghargaan yang sedalam-dalamnya penulis sampaikan atas segala kesabaran, arahan dan bimbingan yang diberikan. Ucapan terima kasih penulis sampaikan kepada Dr. Ir. Yudiwanti Wahyu EK., M.S. sebagai penguji luar komisi pembimbing dan Dr. Ir. Darda Effendi, M.Sc. sebagai perwakilan Mayor Pemuliaan dan Bioteknologi Tanaman Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB. Ucapan terima kasih juga disampaikan kepada Hibah Tim Program Pascasarjana (HTPP) tahun 2009 dengan Nomor Kontrak 38/I3.24.4/SPK/BG-PD/2009 yang telah mendanai penelitian ini.
Terimakasih disampaikan kepada Rektor dan Dekan Sekolah Pascasarjana IPB, Ketua Departemen Agronomi dan Hortikultura, serta Ketua Mayor Pemuliaan dan Bioteknologi Tanaman (PBT) atas kesempatan yang diberikan kepada penulis untuk menimba ilmu di IPB. Ucapan terima kasih kepada Dr. Ir. Trikoesoemaningtyas, M.Sc dengan segala kepeduliaan dan kesabarannya mengarahkan penulis dan teman-teman PBT 2007 untuk menyelesaikan studi ini. Dosen-dosen di Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor yang telah memberikan dukungan dan kepercayaan selama ini.
Terima kasih juga disampaikan kepada Kepala, Laboran, dan Asisten pada Laboratorium (Lab.) Virologi Tumbuhan Departemen Proteksi Tanaman, Lab. Genetika dan Pemuliaan Tanaman, Lab. Ekofisiologi Tumbuhan Departemen Agronomi dan Hortikultura, Lab. Bioproses dan Rekayasa PAU, serta Lab. Pengujian Balai Besar Penelitian dan Pengembangan Pasca Panen Pertanian atas kesediaan bantuan, pengetahuan, serta tempat pelaksanaan penelitian ini. Teknisi KP. Leuwikopo dan KP. Cikabayan (Pak Mamat dan Pak Syaefudin) atas kesediaannya membantu proses penelitian ini.
Riyono, Imanto, Abdul Mungid, Anwar Parvez, Mokhamad Ali Rouf, Muhammad Alwi Mustaha, Gatot Pringgo Hartono atas pengenalan, persahabatan, pengertian, pengorbanan dan kasih sayangnya.
Terima kasih penulis sampaikan kepada teman-teman Pemuliaan dan Bioteknologi Tanaman IPB (Nurwanita Ekasari Putri, SP. M.Si., Hairinsyah, SP. M.Si., Amin Nur, SP. M.Si., Heni Safitri, SP. M.Si., Isnaini, SP. M.Si., Siti Noorrohmah, SP. M.Si., Yusie Arisanti, SP. M.Si., Alfin Widiastuti, SP. M.Si., dan Fifin Nasyirotul Khoiriyah, SP.) atas kebersamaan suka duka, perjuangan dan berbagi ilmu, selama penulis belajar pada Program Magister Pascasarjana IPB.
Terima kasih juga kepada Dr. Ir. Dwi Wahyuni Ganefianti, M.Si., atas arahan dan bimbingan informal selama penelitian, serta kesempatan penulis menguji materi genetiknya. Teman-teman penelitian pada Lab. Genetika dan Pemuliaan Tanaman IPB (Nurwanita Ekasari Putri, SP. MSi., Endah Wahyuningrum, SP., Purwati, SP., dan Swici Margaret, SP.), Lab. Virologi Tumbuhan Departemen Proteksi Tanaman IPB (Cici Budi Utami, SP., Devi Agustina, SP. MSi., Dr. Ir. Dwi Wahyuni Ganefanti, MSi., Tuti Susanti Legiastuti, Ir. Ifa Manzilla, M.Si., Ibu Rita, M.Si., Pak Irwan Lakani, M.Si., Donnarina Simanjuntak, SP. M.Si., Eva, SP. M.Si). Ungkapan terima kasih penulis sampaikan kepada teman-teman di Wisma Ponytail (Dr. Susiyanti, SP. M.Si, Dr. Yusniwati, SP. M.Si, Nusidah, SE. M.Si, Andi Yulyani Fadwiwati, SPt. M.Si, Ika Budianti, SSi., Fatmawati, Nur Rohmah, SSi., Yulia Irawati, SP., Fonna, Dian Wulansari, STP., Soraya Gigentika SP, Maryam, Nadea, Murdiati, Meilly Kusumawati, Puspa, Aini, Upmal Deswira, Laras Shirly, Nadiah Nahdi, Tami, Cyntia, dan Restu Dwi Putri) atas kebersamaannya dalam suka dan duka.
Ungkapan terima kasih disampaikan kepada teman-teman Forum Wacana IPB (Hatta Jamil, M.Si, Abdullah Usman, M.Sc, Wawan Tolinggi, SE., Frans Melkior Yekusamon, SE., Chasyim, Rahmat Mawardi, SP Betrixia Barbara, SE. M.Si., Nur Hapsa, SE. M.Si., Ahmad Pidie, SE. M.Si., dan Nur Sangadji, SE. M.Sc.), teman-teman pada Forum Wacana Departemen Agronomi dan Hortikultura (Ismadi Yunus, SP. M.Si., Karlin Agustin, SP. M.Si., dan Ir. Muhammad Alwi Mustaha, M.Si.) atas kesempatan bergabung dan belajar organisasi kampus. Terima kasih juga disampaikan kepada Tim International Roundtable Discussion atas kerjasama dan berbagi ilmunya. Terima kasih juga kepada seluruh teman-teman seperjuangan pada Program Pascasarjana IPB yang tidak dapat penulis sebutkan.
Semoga karya ini bermanfaat bagi pengembangan ilmu pengetahuan, khususnya bidang pemuliaan tanaman dan pertanian pada umumnya. Amiin.
Bogor, Maret 2010
Penulis dilahirkan di Banyumas Jawa Tengah pada tanggal 05 Desember 1983 sebagai anak kedua dari tiga bersaudara dari pasangan Bapak H. Warsito Maduri dan Ibu Hj. Nur Hayati (Alm.). Tahun 2002 penulis lulus dari Madrasah Aliyah Negeri Purwokerto 1 dan pada tahun yang sama diterima di Program Studi Pemuliaan Tanaman Fakultas Pertanian Universitas Jenderal Soedirman (Unsoed) Purwokerto Jawa Tengah melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru) lulus tahun 2006. Tahun 2007 penulis diterima pada Mayor Pemuliaan dan Bioteknologi Tanaman (PBT) Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor (IPB).
Selama mengikuti perkuliahan program S1, penulis aktif sebagai anggota Perhimpunan Mahasiswa Pemuliaan Tanaman Unsoed, Pengurus Ikatan Pelajar Putri Nahdatul Ulama (IPPNU) baik tingkat komisariat perguruan tinggi se-Purwokerto, anak cabang Jatilawang, maupun pengurus cabang Banyumas Purwokerto. Selain itu, penulis juga aktif pada Lembaga Swadaya Masyarakat Komunitas Studi Pinggiran (KSP) Biyung Emban Purwokerto sebagai staff pemberdayaan masyarakat kaum marginal (anak jalanan dan pemulung) bidang Anak dan Perempuan. Penulis diberi kesempatan menerima program kompetisi inkubator bisnis mahasiswa dan alumni, kerjasama program studi Pemuliaan Tanaman Unsoed dengan TPSDP (Technical Profesional Skill Development Program) dari tahun 2005 hingga 2007.
Latar Belakang
Cabai merupakan produk hortikultura unggulan Indonesia dan menempati urutan pertama dalam produksi dalam negeri. Kebutuhan terhadap komoditi cabai semakin meningkat seiring dengan peningkatan jumlah penduduk Indonesia. Menurut Badan Pusat Statistik (BPS) (2009), luas panen tanaman cabai nasional mencapai 109.178 hektar (ha) dengan produksi nasional 695.707 ton dan produktivitas nasional mencapai 6.37 ton/ha.
Salah satu kendala utama rendahnya produktivitas cabai dalam negeri tersebut disebabkan oleh infeksi virus tanaman. Pertanaman cabai yang terserang virus umumnya mengalami hambatan pertumbuhan dan penurunan hasil yang sangat besar. Kerugian yang ditimbulkan oleh adanya suatu epidemi penyakit berkisar antara 30-100% (Agrios 1997). Salah satu virus yang sangat merugikan pertanaman cabai adalah Pepper yellow leaf curl virus (PYLCV) yang termasuk kelompok Begomovirus dari famili Geminiviridae (Aidawati et al. 2005; Hidayat et al. 1999). Di Indonesia infeksi Begomovirus pada tanaman cabai pertama kali dilaporkan di Jawa Barat oleh Rusli et al. (1999) dan Hidayat et al. (1999), dan beberapa tahun kemudian Sukamto et al. (2005) melaporkan bahwa tanaman tomat di beberapa daerah di Jawa (Bandung, Purwokerto, Magelang, dan Malang) telah terinfeksi Begomovirus. Gejala yang ditimbulkan oleh Begomovirus adalah daun keriting kuning, kekerdilan, dan mengakibatkan kerugian hasil produksi yang besar (Umaharan et al. 1998). Hartono (2008) melaporkan tanaman tomat yang terinfeksi Begomovirus menunjukkan gejala berupa klorosis pada daun, tepi daun menggulung ke bawah atau ke atas seperti mangkuk (cupping), daun keriting dan menguning, tanaman menjadi kerdil dan rontok.
Begomovirus. De Barro et al. (2008) juga menyebutkan terdapat kesamaan wilayah geografis antara penyakit daun keriting kuning dengan invasi dari kutukebul (whitefly). Konsekuensi dari interaksi virus dan vektor ini menyebabkan tanaman tomat dan cabai mengalami penurunan produksi.
Upaya untuk mengatasi penurunan produksi dan sekaligus menekan infeksi virus tersebut adalah melakukan penanaman varietas unggul yang tahan penyakit. Keberhasilan program pemuliaan untuk merakit kultivar tahan terhadap virus sangat ditentukan antara lain oleh ketersediaan sumber resistensi, metode seleksi (Herison et al. 2007), dan metode deteksi terhadap virus tersebut. Secara fisiologis, mekanisme ketahanan tanaman terhadap Begomovirus belum diketahui secara pasti. Namun, beberapa penelitian melaporkan bahwa mekanisme ketahanan terhadap virus melibatkan peningkatan aktivitas enzim tertentu, antara lain enzim peroksidase, yang merupakan salah satu enzim yang terkait dengan mekanisme ketahanan tanaman terhadap cekaman (Artlip dan Funkhouser 1995). Aktivitas enzim peroksidase dilaporkan berperanan dalam mekanisme ketahanan tanaman terhadap virus pada tanaman kedelai (Andreeva 1989), mustard (Gupta et al. 1990), rapseed (Zhou et al. 1992), dan mentimun (Yurina et al. 1993).
Metode yang paling praktis dan dapat diharapkan keberhasilannya untuk mengatasi Begomovirus adalah dengan menggunakan kultivar yang tahan (Green dan
Tujuan Penelitian
Penelitian ini terdiri atas dua penelitian, yaitu Karakterisasi Beberapa Genotipe Cabai (Capsiscum spp.) dan Mekanisme Ketahanan Cabai terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning.
1. Penelitian Karakterisasi Beberapa Genotipe Cabai (Capsicum spp.) bertujuan untuk memperoleh informasi:
a. Karakter kualitatif dan kuantitatif genotipe cabai,
b. Pengelompokan genotipe berdasarkan spesies Capsicum, dan c. Mengelompokkan genotipe cabai berdasarkan karakter kualitatif.
2. Penelitian Mekanisme Ketahanan Cabai terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning bertujuan untuk:
a. Mendapatkan informasi respon ketahanan berdasarkan intensitas penyakit, b. Melakukan deteksi PYLCV pada jaringan tanaman cabai, dan
c. Mempelajari mekanisme ketahanan cabai secara struktural dan biokimia terhadap vektor B. tabaci dan Begomovirus penyebab penyakit daun keriting kuning.
Hipotesis Penelitian
1. Hipotesis yang diajukan pada penelitian Karakterisasi Beberapa Genotipe Cabai adalah:
a. Terdapat perbedaan karakter kualitatif dan kuantitatif genotipe cabai, b. Terdapat perbedaan kelompok genotipe berdasarkan spesies Capsicum, dan c. Terdapat perbedaan kelompok 29 genotipe cabai berdasarkan karakter
kualitatif.
2. Hipotesis yang diajukan pada penelitian Mekanisme Ketahanan Cabai terhadap Begomovirus Penyebab Penyakit Daun Keriting Kuning adalah:
a. Terdapat perbedaan respon ketahanan berdasarkan intensitas penyakit pada genotipe yang diuji,
c. Terdapat mekanisme ketahanan cabai secara struktural dan biokimia terhadap vektor B. tabaci dan Begomovirus penyebab penyakit daun keriting kuning.
Ruang Lingkup Penelitian
Pada penelitian pertama dilakukan karakterisasi 29 genotipe cabai berdasarkan karakter kualitatif dan kuantitatif. Berdasarkan hasil karakterisasi tersebut 29 genotipe cabai dibuat pengelompokan. Penelitian kedua, beberapa genotipe dari penelitian pertama digunakan untuk pengujian mekanisme ketahanan cabai terhadap Begomovirus penyebab penyakit daun keriting kuning. Pengujian dilakukan dalam 3 tahap, yaitu (1) deteksi PYLCV pada jaringan tanaman cabai, (2) kajian mekanisme ketahanan cabai berdasarkan sifat-sifat struktural, dan (3) mekanisme ketahanan secara biokimia. Deteksi PYLCV dilakukan dengan teknik PCR dan hibridisasi asam nukleat. Sifat-sifat struktural yang diteliti terdiri dari kerapatan trikoma atau rambut daun, panjang dan lebar sel palisade, serta ketebalan daun. Kajian mekanisme secara biokimia yaitu akumulasi asam salisilat dan aktivitas enzim peroksidase. Pengujian pada penelitian kedua diharapkan juga dapat menghasilkan informasi mengenai mekanisme ketahanan fisik cabai terhadap vektor
I. Karakterisasi tanamaan cabai
Karakter kualitatif Karakter kuantitatif
Analisis deskriptif Analisis ragam
Analisis dendrogram Uji Beda Nyata
Pengelompokan Genotipe
II. Kajian mekanisme ketahanan cabai terhadap Begomovirus
Deteksi PYLCV Struktural Biokimia
• PCR ● Trikoma (rambut daun) ● Enzim peroksidase
• Hibridisasi asam ● Panjang sel palisade ● Asam salisilat nukleat ● Lebar sel palisade
● Ketebalan daun
Mekanisme ketahanan cabai terhadap vektor B. tabaci dan terhadap Begomovirus penyebab penyakit daun keriting kuning
TINJAUAN PUSTAKA
Klasifikasi dan Karakterisasi Tanaman Cabai
Tanaman cabai tergolong divisi Magnoliophyta, kelas Magnolipsida, ordo Solanales, Famili Solanaceae, genus Capsicum. C. annuum merupakan salah satu spesies dalam genus Capsicum yang telah dibudidayakan. Selain C. annuum,spesies lain yang telah dibudidayakan adalah C. frutescens, C. baccatum, C. pubescens, dan
C. chinense (Berke 2000). C. baccatum dan C. pubescens mudah diidentifikasi dan dibedakan satu dengan lainnya, karena terdapat perbedaan yang jelas pada kedua spesies tersebut. C. annuum, C. chinense dan C. frutescens mempunyai banyak sifat yang sama, sehingga untuk membedakannya harus diamati bunga dan buah dari masing-masing spesies (Kusandriani 1996).
C. annuum L. adalah spesies yang paling banyak dibudidayakan dan memiliki arti penting secara ekonomis. Spesies ini mempunyai berbagai bentuk dan ukuran buah meliputi buah besar dan keriting. C. annuum dikelompokkan dalam var.
longum, var. abbreviatum, var. grossum, dan var. minimum. Spesies ini diperkirakan mempunyai pusat asal (penyebaran primer) di Meksiko, kemudian menyebar ke daerah Amerika Selatan dan Tengah, ke Eropa dan tersebar luas di daerah tropik dan subtropik (Tindall 1983). Pusat penyebaran sekunder C. annuum adalah Guatemala (Greenleaf 1986). Capsicum frutescens atau dikenal dengan nama cabai rawit adalah spesies semidomestikasi yang ditemukan di dataran rendah tropika Amerika. Selain itu, Asia Tenggara dikenal sebagai daerah pusat keragaman sekunder. Beberapa varietas ditanam luas di wilayah panas di daerah beriklim sedang maupun wilayah
tropika (Greenleaf 1986). Domestikasi C. chinense tersebar luas di wilayah tropika Amerika, dan spesies ini sering ditanam di sekitar wilayah Amazon. Evolusi C. baccatum sebagian besar terbatas di wilayah tengah Amerika Selatan (Bolivia). Bentuk yang didomestikasi diidentifikasi sebagai C. baccatum var pendulum; bentuk liarnya sebagai C. baccatum dan var. microcarpum (Greenleaf 1986). C. pubescens
Daun berbulu dan keriting (rugulose) dan jaringan dinding buah tebal. Tanaman ini beradaptasi pada suhu rendah pada ketinggian 2.000-3.000 m di daerah tropika. Klasifikasi cabai dan pusat penyebarannya disajikan pada Tabel 1.
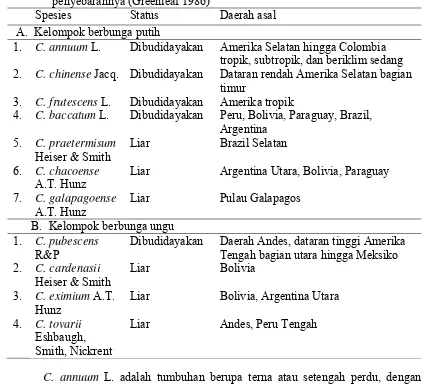
Tabel 1 Klasifikasi cabai yang telah dibudidayakan dan tipe liarnya serta daerah penyebarannya (Greenleaf 1986)
Spesies Status Daerah asal
A. Kelompok berbunga putih
1. C. annuum L. Dibudidayakan Amerika Selatan hingga Colombia tropik, subtropik, dan beriklim sedang 2. C. chinense Jacq. Dibudidayakan Dataran rendah Amerika Selatan bagian
timur
3. C. frutescens L. Dibudidayakan Amerika tropik
4. C. baccatum L. Dibudidayakan Peru, Bolivia, Paraguay, Brazil, Argentina
5. C. praetermisum
Heiser & Smith
Liar Brazil Selatan
6. C. chacoense
A.T. Hunz
Liar Argentina Utara, Bolivia, Paraguay
7. C. galapagoense
A.T. Hunz
Liar Pulau Galapagos
B. Kelompok berbunga ungu 1. C. pubescens
R&P
Dibudidayakan Daerah Andes, dataran tinggi Amerika Tengah bagian utara hingga Meksiko 2. C. cardenasii
Heiser & Smith
Liar Bolivia
3. C. eximium A.T. Hunz
Liar Bolivia, Argentina Utara
4. C. tovarii
Eshbaugh, Smith, Nickrent
Liar Andes, Peru Tengah
atau keunguan; posisi buah menggantung. Biji berwarna kuning pucat. (Heiser & Smith 1953; Heiser & Smith 1957; Heiser 1969a, b; Heiser & Pickersgill 1969).
C. frutescens L. merupakan spesies Capsicum dengan tumbuhan berupa terna atau setengah perdu, tinggi 50-150 cm, hidup mencapai 2 atau 3 tahunan. Bunga muncul berpasangan atau bahkan lebih di bagian ujung ranting, posisinya tegak; mahkota bunga berwarna kuning kehijauan, berbentuk seperti bintang. Kelopak bunga rompang. Buah muncul berpasangan atau bahkan lebih pada setiap ruas, rasa cenderung sangat pedas; bentuk dan warna buah bervariasi; bulat memanjang atau berbentuk setengah kerucut; warna buah setelah masak biasanya merah; posisi buah tegak. Biji berwarna kuning pucat. Spesies ini kadang-kadang disebut cabai burung (Heiser & Smith 1953; Heiser & Smith 1957; Heiser 1969a, b; Heiser dan Pickersgill 1969).
C. pubescens R. & P. adalah Capsicum yang memiliki tumbuhan berupa perdu, tinggi 45-113 cm, berbulu lebat, biasanya berumur hanya semusim. Bunga dan buah tunggal atau bergerombol berjumlah 2-3 pada tiap ruas, posisinya tegak; mahkota bunga berwarna ungu, berbulu, berbentuk seperti bintang. Kelopak berwarna hijau, berbulu. Buah rasanya pedas; berbentuk bulat telur; warna setelah masak bervariasi ada yang merah, jingga atau cokelat; posisi buah menggantung. Biji berwarna hitam (Heiser & Smith 1957; Heiser 1969a, b; Heiser & Pickersgill 1969).
Spesies ini hanya ditemukan tumbuh di dataran tinggi antara 1500-3300 m dan mudah dibedakan dengan spesies Capsicum lainnya dari ciri bijinya yang hitam serta perawakannya yang berbulu lebat. Di Indonesia baru diketahui ditanam di Jawa (Ciwidey, Sindanglaya, Cibodas dan dataran tinggi Dieng) (Djarwaningsih 1986).
kuning pucat (Heiser & Smith 1953). C. baccatum var. baccatum tersebut diduga merupakan nenek moyang liar dari C. baccatum var. pendulum karena apabila disilangkan keduanya dapat menghasilkan biji yang fertil (Eshbaugh 1970).
C. chinense Jacq. ialah spesies Capsicum berupa terna atau setengah perdu, tinggi 45-90 cm. Bunga menggerombol berjumlah 3-5 pada tiap ruas, posisinya tegak atau merunduk; mahkota bunga berwarna kuning kehijauan, berbentuk seperti bintang. Buah muncul bergerombol berjumlah 3-5 pada setiap ruas, panjangnya dapat mencapai 12 cm, rasanya sangat pedas; mempunyai bentuk buah yang bervariasi dari bulat dengan ujung berpapila, berbentuk seperti lonceng dengan sisi-sisi yang beralur, berbentuk kerucut dengan sisi-sisi beralur sampai bulat memanjang; kulit berkeriput atau licin; warna buah masak bervariasi ada yang merah, merah jambu, jingga, kuning atau coklat. Biji kuning pucat. Di Indonesia, dikenal dengan nama daerah yang berbeda-beda antara lain cabai tomat, cabai belimbing, cabai tawau dan cabai cermai; baru diketahui keberadaannya di Jawa Barat (Jakarta dan Bogor) serta Kalimantan Timur (Tarakan) (Djarwaningsih 1986).
Karakteristik Begomovirus
Begomovirus mempunyai genom berupa DNA utas tunggal (single stranded/ss DNA), berbentuk lingkaran dan terselubung protein dalam virion ikosahedral kembar (gemini) dengan ukuran 18~30 nm. Virus ini diklasifikasikan
yang paling banyak dan menginfeksi banyak tanaman dibandingkan 3 genus yang lainnya.
Begomovirus banyak menimbulkan kerusakan pada berbagai tanaman yang dibudidayakan di daerah tropik maupun subtropik (Yang et al. 2004). Berbagai Begomovirus telah dilaporkan misalnya African cassava mosaic Begomovirus
(ACMV) menginfeksi ubi kayu di Afrika, Cotton leaf curl Begomovirus
(CLCV) menginfeksi tanaman kapas di India (Harrison 1985), Mung bean yellow mosaic Begomovirus (MYMV) menginfeksi tanaman kacang hijau di Thailand (Honda et al. 1983), Bean golden yellow mosaic Begomovirus (BGYMV) menginfeksi tanaman kacang buncis di Brazil (Abouzid et al. 2002) dan Pumpkin yellow vein mosaic Begomovirus (PYVMV) menginfeksi labu-labuan di India (Muniyappa et al. 2003).
Interaksi Begomovirus dan Tanaman Cabai
Intensitas serangan penyakit daun keriting kuning di Lampung dan di Yogyakarta pada cabai besar mencapai 20-100% dan 70-100% (Indriatmoko 2004; Sulandari 2004), sementara di Sumatera Barat dilaporkan 1.4 hektar tanaman cabai besar mengalami puso (Daryanto 2005). Epidemi penyakit tersebut sangat dipengaruhi oleh peran aktif serangga vektor (B. tabaci) dalam menularkan penyakit (Rojas et al. 2000). Satu ekor B. tabaci viruliferous sudah mampu menularkan virus dan menyebabkan infeksi (Brown & Nelson 1988; Mehta et al. 1994; Sulandari 2004).
inkompatibel ini terjadi pada tumbuhan tahan dengan seluruh bagian tumbuhan akan memberikan reaksi ketahanan yang bersifat sistemik bila diserang patogen (Wahyuni 2005). Apabila interaksi inang patogen bersifat kompatibel, maka virus dapat menginfeksi tumbuhan inang. Tumbuhan yang bersifat hipersensitif sebenarnya termasuk tipe tahan tetapi masih dapat diserang. Begitu terserang, tumbuhan segera memberikan perlawanan dengan cara mematikan sel yang pertama kali terinfeksi, atau kadang-kadang diikuti oleh sel-sel di sekitarnya, agar virus tidak dapat menyebar ke sel lain. Biasanya sifat hipersensitif ini timbul hanya bila tumbuhan terserang virus, dan bila virus tidak ada, ketahanan tidak bekerja. Sifat ketahanan demikian sebagai ketahanan perolehan lokal (lokal acquired resistance, LAR) dan bila sifatnya sistemik disebut systemic acquired resistance, SAR) (Wahyuni 2005).
Begomovirus ditularkan oleh aktifitas serangga vektor B. tabaci (Sulandari 2004; Delatte et al. 2005). Hasil penelitian Uzcategui & Lastra (1978) menunjukkan periode makan akuisisi (PMA) minimum B. tabaci untuk menularkan Begomovirus adalah 2 jam dengan periode laten 20 jam. Efisiensi penularan B. tabaci yang dipelihara pada suhu 30-34˚C adalah 93%, sedangkan yang dipelihara pada suhu 20-30˚C hanya 75%. Besarnya kerusakan yang disebabkan oleh suatu serangga hama tergantung pada besarnya populasi serangga hama dan kemampuan tanaman untuk mempertahankan diri dari serangan tersebut (Smith 1989). Kemampuan tanaman
untuk menghindar, toleran, atau terlindungi dari serangan suatu serangga hama merupakan ciri dari tanaman yang tahan (Smith 1989).
yang dapat meningkatkan populasi serangga vektor; dan (4) timbulnya strain Begomovirus yang akan memicu epidemi penyakit di lapangan.
Mekanisme Ketahanan Struktural
Pertahanan tanaman yang mempunyai nilai potensial dalam pemuliaan tanaman untuk tahan terhadap virus dapat dikelompokkan menjadi pertahanan berdasarkan biokimia dan pertahanan berdasarkan biofisika atau morfologi. Respon tanaman terhadap serangan patogen adalah dengan mengaktifkan berbagai mekanisme pertahanan alaminya, yang dapat diketahui dengan adanya perubahan fisik dan biokimia tertentu (Broglie et al. 1993).
Pembentukan penghalang pada dinding sel dan kutikula dari permukaan daun merupakan suatu strategi pertahanan tanaman yang umum. Beberapa contoh struktur penghalang tersebut adalah lapisan lilin yang menutupi sel epidermis, ketebalan dinding sel palisade, dan kerapatan trikoma (Indiati 2004). Menurut Norris dan Kogan (1980), faktor-faktor ketahanan tanaman secara struktural antara lain ketebalan dinding sel, peningkatan kekerasan jaringan dinding sel, pemulihan jaringan-jaringan yang terluka, kekokohan dan sifat-sifat lain dari batang tanaman, rambut-rambut batang dan daun, akumulasi lilin pada permukaan tanaman, kandungan silika, dan adaptasi anatomi dari organ nonspesifik serta struktur pelindung tanaman terhadap serangan dan infeksi penyakit. Perubahan fisik berupa
penebalan dinding sel (disebut juga callose) akibat akumulasi glikoprotein (Bradley
et al. 1992), dan fenolik (Hunter 1974), serta terbentuk lignifikasi (Vance et al. 1980).
(1996) menyebutkan karakter sel palisade genotipe kacang tanah kelompok tahan terhadap penyakit bercak daun hitam nyata lebih tebal dibanding karakter yang sama untuk tingkat ketahanan lainnya. Hemingway (1957) menyatakan ketebalan sel palisade berasosiasi dengan ketahanan terhadap penyakit bercak daun. Selanjutnya Kusumo (1996) menyatakan bahwa pada kacang tanah ketebalan sel palisade bila diikuti kandungan kloroplas tinggi dan klorofil yang tinggi juga, diduga berperan sama dengan mekanisme ketahanan yang ditimbulkan oleh warna daun hijau tua.
Imaningsih (2006) menyatakan terdapat perbedaan sifat-sifat ketahanan struktural terhadap kekeringan antara padi sawah dan padi gogo yang ditandai dengan perbedaan susunan anatomi daun, yaitu tebal daun, tebal kutikula, jumlah scabaia, dan jumlah sel motor setiap deret. Darmanti (2009) menyebutkan tebal helaian daun
Acalypa indica L. mengalami penurunan yang disebabkan oleh penurunan tebal jaringan palisade dan jaringan bunga karang yang disebabkan oleh penurunan panjang sel palisade. Esau (1977) menyatakan kerapatan trikoma yang tinggi dapat mengurangi transpirasi dan melindungi palisade dan bunga karang dari suhu tinggi. Adjie et al. (2000) menambahkan selain berperan dalam mendukung aktifitas fisiologis tanaman, trikoma juga berfungsi sebagai parameter morfologis dan anatomis yang penting pada ketahanan tanaman.
Mekanisme Ketahanan Biokimia
tanaman yang dapat digunakan patogen untuk menentukan inang yang sesuai. Tanaman ini juga dapat mempertahankan diri dengan tidak memproduksi senyawa metabolit yang diperlukan oleh patogen sehingga patogen tidak berkembang.
Deteksi dan pengenalan yang tepat dan cepat dari patogen yang potensial adalah langkah yang paling utama dalam usaha untuk melindungi tanaman dari serangan patogen. Tanaman memiliki suatu protein yang disebut protein reseptor (plant receptors proteins) yang dapat mengenali suatu senyawa yang dikeluarkan oleh patogen yang disebut elisitor. Elisitor di sini dapat berupa produk gen dari patogen, protein selubung virus, atau komponen dinding sel patogen lainnya. Interaksi inilah yang selanjutnya akan mendorong diaktifkannya mekanisme pertahanan tanaman. Kemungkinan mekanisme pertahanan konstitutif yang utama dari tanaman hanya untuk menghambat perkembangan patogen dan memberi kesempatan mekanisme pertahanan inducible (mekanisme pertahanan terinduksi) terekspresi. Pertahanan terinduksi ini termasuk pembentukan dinding sel tambahan dan menginduksi senyawa-senyawa toksik yang dapat mematikan sel tanaman dan patogen, sehingga perkembangan patogen dapat dilokalisir. Hasil dari respon ini dapat berupa reaksi hipersensitif (hypersensitive response, HR) yaitu suatu respon yang menginduksi kematian sel secara cepat mengelilingi patogen sehingga terlokalisasi (apoptosis). Selama respon ini berlangsung, terjadi pengiriman signal ke bagian tanaman yang tidak terinfeksi untuk mengaktifkan mekanisme pertahanan
inducible dan selanjutnya akan timbul resistensi yang sistemik (Systemic Acquired Resistance, SAR) untuk mengurangi tingkat keparahan serangan (Agrios 1997).
tanaman yang terinfeksi sehingga pertumbuhan patogen terhambat. Respon ketahanan lokal ini menyebabkan bagian yang terinfeksi mengembangkan ketahanan sekunder pada patogen yang sama atau lainnya. Secara umum, ketahanan ini disebut systemic acquired resistance (SAR) (Ryals et al. 1996; Wobbe and Klessig 1996). Asosiasi antara HR dan SAR merupakan ekspresi dari gen ketahanan yang mengkode
pathogenesis-related protein (PR-protein). Sintesis PR-protein dapat digunakan sebagai indikator dalam aktivasi mekanisme ketahanan tanaman (De Hu & Klessig 1997).
Pemicu timbulnya respon hipersensitif pada tanaman yang terserang virus diduga berupa produksi asam salisilat setelah terjadi infeksi virus. Asam salisilat ini diproduksi beberapa detik atau menit setelah terjadi kontak antara sel tanaman dengan elisitor yang disekresikan oleh virus. Dengan memproduksi asam salisilat, maka tanaman akan mengaktifkan jalur mekanisme pertahanan dengan gen-gen yang terlibat akan diekspresikan, salah satunya adalah PR-gene yang akan menghasilkan protein yang dikenal dengan sebutan pathogenesis-related protein (PR-protein) seperti yang dilaporkan van Loon (1985) dan Payne et al. (1990). PR-protein adalah kelompok protein yang terlibat dalam mekanisme pertahanan tanaman baik pada keadaan infeksi antara tanaman dan patogen yang sesuai (compatible) maupun yang tidak (Ashfield et al. 1994). Pathogenensis-related protein adalah kelompok protein karakteristik dari tanaman yang terakumulasi setelah adanya infeksi atau perlakuan elisitor. Pieterse et al. (1992) mengatakan bahwa ekspresi dari gen-gen yang mengkode PR-protein dan akumulasi dari protein-protein ini dapat dianggap sebagai bagian dari mekanisme pertahanan tanaman.
Naylor et al. (1998) menyebutkan asam salisilat dapat mencegah perkembangan PVX (Potato virus X) dengan dua cara, yaitu menghambat replikasi virus pada daerah terinfeksi dan menunda perpindahan virus PVX untuk keluar dari jaringan atau sel yang terinfeksi. SHAM (asam salisilhidroksamil) adalah signal pertahanan yang menginduksi tidak hanya pada replikasi penyakit yang disebabkan oleh virus, namun juga menginduksi perpindahan patogen virus. Lanjut Naylor at al.
(karbohidrat) tanaman inang yang dapat dilihat pada metabolisme karbohidrat yang terganggu di sekitar infeksi virus.
Asam salisilat digunakan sebagai komponen jalur sinyal transduksi yang menyebabkan ketahanan tanaman pada beberapa patogen (Ryals et al. 1996; Wobbe and Klessig 1996). Pada tembakau, asam salisilat meningkat setelah terjadi serangan patogen Tobacco mosaic virus (TMV), yang berkorelasi dengan ekspresi gen-gen
pathogenesis-related (PR-genes). Menurut De Hu & Klessig (1997), produksi asam salisilat digunakan untuk mengaktifkan respon ketahanan tanaman jagung hasil persilangan antara SA-CAT#17 dan tanaman yang mengandung NahG.
Resistensi terhadap penyakit tanaman berasosiasi dengan peningkatan aktivitas peroksidase dan ekpresi isoenzim yang spesifik (Ye et al. 1990); Goy et al.
1992). Aktivitas peroksidase sebagai penanda biokimia dapat digunakan untuk menduga ketahanan muskmelon terhadap Pseudoperonispora cubensis (Reuveni et al.
1991) dan ketahanan gray leaf pada jagung (Garraway & Beltran 1997). Menurut Souza et al. (2003), aktivitas peroksidase dapat digunakan untuk menduga ketahanan galur murni jagung yang resisten Maize dwarf mosaic virus (MDMV). Galur murni jagung yang tidak diinokulasi menunjukkan perbedaan aktivitas guaiacol peroksidase pada tanaman rentan dan tahan, namun tidak terjadi kualitas isoenzim pada tanaman tahan dan rentan yang diinokulasi MDMV. Lanjut Souza et al. (2003), aktivitas enzim peroksidase meningkat setelah terjadi inokulasi virus, kemudian diikuti peningkatan aktivitas anionik isoform spesifik pada beberapa galur murni tahan. Peningkatan aktivitas enzim peroksidase sangat penting dalam melindungi dinding sel dalam penyebaran virus MDMV.
Deteksi PYLCV
mengamplifikasi sekuen DNA secara in vitro dengan melibatkan penempelan primer tertentu yang dirancang untuk mendeteksi adanya Begomovirus di dalam jaringan tanaman cabai. Teknik Polymerase Chain Reaction (PCR) akhir-akhir ini banyak digunakan untuk mendeteksi Begomovirus secara cepat dan akurat dari berbagai sampel tanaman sakit dan serangga vektor di berbagai negara (Rojas et al. 1993; Navot et al. 1991). Metode PCR juga telah berhasil digunakan untuk mendeteksi Begomovirus asal tomat maupun cabai dari sampel yang dikumpulkan dari berbagai daerah di Indonesia (Sudiono et al. 2005; Hidayat et al. 1999).
Prinsip deteksi dengan hibridisasi adalah terjadinya hibridisasi antara pelacak dan genom DNA virus. Deteksi ini mempunyai spesifisitas yang tinggi karena ketepatan deteksi didasarkan atas kesamaan runutan nukleotida antara pelacak dan genom virus yang akan dideteksi. Teknik hibridisasi didasarkan pada perpaduan dua basa nukleotida dan rantai asam nukleat yang komplementer (DNA dengan DNA). Teknik hibridisasi meliputi dua proses, yaitu proses denaturasi atau pemisahan dua rantai asam nukleat yang komplementer dari proses renaturasi atau perpaduan kembali dua rantai asam nukleat. Proses denaturasi biasanya dilakukan dengan cara pemanasan DNA untuk memecah ikatan hidrogen yang terdapat di antara pasangan basa sehingga rantai asam nukleat akan terpisah. Proses ini kemudian diikuti dengan proses renaturasi dengan cara pendinginan. Teknik hibridisasi dot blot telah banyak
KARAKTERISASI BEBERAPA GENOTIPE CABAI
(
Capsicum spp
.)
Abstrak
Lebih dari 100 spesies Capsicum telah diidentifikasi dan lima diantaranya telah dibudidayakan. Spesies tersebut yaitu C. annuum, C. chinense, C. frutescens, C. baccatum, dan C. pubescens. Perbedaan spesies ini didasarkan pada karakter morfologi bunga dan buah, kemampuan tanaman untuk bersilang, dan biji yang dihasilkan hasil persilangan adalah fertil. Penelitian ini bertujuan untuk memperoleh informasi karakter kualitatif dan kuantitatif genotipe cabai, pengelompokan genotipe berdasarkan spesies Capsicum, dan mengelompokkan 29 genotipe cabai berdasarkan karakter kualitatif. Genotipe tersebut adalahIPB C1, IPB C2, IPB C3, IPB C4, IPB C5, IPB C6, IPB C7, IPB C9, IPB C10, IPB C11, IPB C12, IPB C14, IPB C15, IPB C16, IPB C17, IPB C19, IPB C20, IPB C21, IPB C28, IPB C37, IPB C50, IPB C51, IPB C63, IPB C64, IPB C68, IPB C105, IPB C107, IPB C110, dan IPB C111. Penelitian dilaksanakan pada bulan April hingga September 2008 di Kebun Percobaan Leuwikopo dan Laboratorium Genetika dan Pemuliaan Tanaman IPB. Perlakuan disusun dalam Rancangan Kelompok Lengkap Teracak (RKLT) faktor tunggal 3 ulangan, masing-masing ulangan terdiri atas 10 tanaman. Hasil penelitian menunjukkan bahwa karakter morfologi daun, batang, bunga, dan buah dapat dibedakan antar genotipe cabai. Terdapat perbedaan sangat nyata antar genotipe cabai terhadap peubah tinggi dikotomus, tinggi tanaman, lebar tajuk, diameter batang, panjang dan lebar daun, serta waktu berbunga. Berdasarkan karakter kualitatif, 29 genotipe cabai yang diamati dibagi menjadi 4 kelompok yang sebagian besar masuk pada kelompok I, genotipe IPB C15 dan IPB C63 masuk kelompok II, genotipe IPB C12 masuk kelompok III, dan genotipe IPB C20 dan IPB C21 masuk kelompok IV. Seluruh genotipe termasuk ke dalam C. annuum kecuali genotipe IPB C63 yang termasuk C. frutescens. Perbedaan spesies Capsicum terdapat pada bentuk daun, jumlah bunga pada tiap percabangan, posisi bunga, warna buah intermediate, dan habitus tanaman.
Kata kunci: karakterisasi, cabai, kualitatif, kuantitatif, Capsicum
PENDAHULUAN
Cabai (Capsicum spp.) diperkenalkan di Asia dan Afrika pada abad ke-16 oleh pedagang Portugis dan Spayol melalui jalur perdagangan dari Amerika Selatan. Dalam perkembangannya, cabai dan paprika lebih banyak dibudidayakan dan memiliki distribusi yang besar serta lebih penting karena banyak digunakan untuk kebutuhan konsumsi dan kuliner (Berke and Engle 2009). Lebih dari 100 spesies
annuum, C. chinense, C. frutescens, C. baccatum, dan C. pubescens (Pickersgill 1997). Klasifikasi spesies-spesies ini didasarkan pada 1) karakter morfologi, terutama morfologi bunga, 2) persilangan dapat dilakukan antarspesies, dan 3) biji hibrida antarspesies fertil (Heiser dan Smith 1953). C. annuum berbunga tunggal dengan petal berwarna putih bersih. C. chinense berbunga dua atau lebih per percabangan dengan warna bunga putih kehijauan dan penyempitan kelopak yang mencolok. C. frutescens membentuk 1-3 bunga per percabangan, warna bunga putih kehijauan tanpa penyempitan kelopak yang mencolok. C. baccatum mempunyai bercak kuning pada petal yang berwarna putih, dan C. pubescens mempunyai petal ungu dan biji hitam (Pickersgill 1988).
Dari kelima spesies tersebut, C. annuum merupakan spesies yang paling banyak dibudidayakan, dan merupakan tanaman diploid dengan jumlah kromosom
2n=2x=24 (Pickersgill 1997). Spesies ini menyerbuk sendiri (Allard 1960), tipe bunga hermaprodit, pembungaan dimulai dengan satu atau dua bunga pada percabangan pertama, kemudian dilanjutkan pada tiap percabangan seterusnya. C. annuum dapat menyerbuk silang (5-36%) dengan bantuan serangga polinator pada kondisi lingkungan yang sesuai (Pisckersgill 1997; Tanksley 1984). Zat karotinoid dan capsainoid pada buah cabai sangat berpengaruh pada keragaman rasa, warna, dan aroma pada plasma nutfah C. annuum. Berdasarkan pada kandungan gizi dan tingkat kepedasan, genotipe cabai dibedakan menjadi manis, sedang, dan pedas. Berdasarkan pada bentuk buah, diklasifikasikan elongate, blocky, triangular atau heart shaped,
dan elongated (Pochard 1966).
ini adalah memperoleh informasi karakter kualitatif dan kuantitatif plasma nutfah tanaman cabai serta mengelompokkan genotipe berdasarkan karakter kualitatif.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan April hingga September 2008 di Kebun Percobaan Leuwikopo dan Laboratorium Genetika dan Pemuliaan Tanaman IPB.
Bahan dan Metode
Bahan yang digunakan adalah 29 genotipe cabai yang berasal dari introduksi dan koleksi Bagian Genetika dan Pemuliaan Tanaman IPB. Genotipe tersebut adalah IPB C1, IPB C2, IPB C3, IPB C4, IPB C5, IPB C6, IPB C7, IPB C9, IPB C10, IPB C11, IPB C12, IPB C14, IPB C15, IPB C16, IPB C17, IPB C19, IPB C20, IPB C21, IPB C28, IPB C37, IPB C50, IPB C51, IPB C63, IPB C64, IPB C68, IPB C105, IPB C107, IPB C110, dan IPB C111 (Tabel 8). Perlakuan disusun berdasarkan Rancangan Kelompok Lengkap Teracak (RKLT) faktor tunggal 3 ulangan, dimana masing-masing ulangan terdiri atas 20 tanaman dengan 10 tanaman contoh. Sebagai perlakuan adalah 29 genotipe cabai. Penanaman dilakukan melalui tahapan persemaian, pengolahan lahan, pemupukan, pemeliharaan, dan panen.
Persemaian dan Pengolahan Lahan
Pengolahan tanah dilaksanakan maksimum satu bulan sebelum tanam untuk menggemburkan tanah dan mengendalikan gulma yang ada. Lahan percobaan disiapkan dengan membuat bedengan dengan ukuran 1 m x 6 m dengan tinggi bedengan 0.25-0.35 m. Bibit ditanam dalam 2 baris per bedengan dan dalam satu bedengan ditanam 20 tanaman. Jarak tanam yang dipakai adalah 50 cm x 50 cm. Jarak antar bedengan 0.5 m. Luas tanah yang diperlukan adalah ± 900 m2. Bedengan selanjutnya ditutup dengan mulsa plastik hitam perak dan dibuat lubang tanam dalam dua baris tanam (double rows). Lubang tanam dibuat dengan menggunakan pelat pemanas yang berisi bara api untuk membuat lubang di permukaan mulsa plastik. Lubang tanam yang terbentuk kemudian dilubangi dengan menggunakan tugal. Pada setiap lubang tanam diberi pupuk kandang kambing sebanyak 0.75 kg sebelum tanaman ditanam.
Pemupukan dan Pemeliharaan
Pupuk yang digunakan adalah Urea, TSP, SP-36, dan KCl dengan dosis 150 kg/ha, 200 kg/ha dan 150 kg/ha. Setelah tanaman berumur 2 minggu, tanaman dipupuk dengan menggunakan NPK mutiara dengan dosis 10 g/l dan masing-masing tanaman diberikan 250 ml. Pemupukan NPK yang dicairkan dilakukan seminggu sekali pada tiap lubang tanam. Pemeliharaan meliputi pengendalian hama dan penyakit, penyiangan, membuang tunas samping serta pengajiran. Pengendalian hama
dan penyakit dilakukan bila hal itu diperlukan dengan menggunakan pestisida. Penyiangan dilakukan jika ada gulma yang tumbuh dan dilakukan secara manual. Membuang tunas samping sebelum waktu berbunga. Pengajiran dilakukan pada saat pindah tanam. Ajir yang digunakan terbuat dari bambu dengan ukuran 120 cm.
Panen
Peubah Pengamatan
Pengamatan dilakukan terhadap karakter kualitatif dan kuantitatif. Karakter kualitatif terdiri dari warna batang muda, warna batang dewasa, bentuk batang, bulu batang, habitus tanaman, warna daun, bentuk daun, jumlah bunga per cabang, posisi bunga, warna mahkota bunga, warna semburat mahkota, bentuk mahkota, warna anter, warna tangkai sari, bentuk tepi kelopak, warna buah intermediet, warna buah masak, bentuk buah, bentuk pangkal buah, bentuk ujung buah, permukaan buah dan waktu berbunga. Karakter kuantitatif terdiri dari tinggi dikotomus, tinggi tanaman, lebar tajuk, diameter batang, panjang daun, lebar daun, bobot buah, panjang buah, panjang tangkai buah, diameter buah, dan ketebalan buah. Pengamatan didasarkan pada IPGRI (1995) Descriptor for Capsicum (Lampiran 1).
Analisis data
Data karakter kualitatif dianalisis secara deskriptif dan dilanjutkan pengelompokan genotipe menggunakan program Minitab 14. Data karakter kuantitatif dianalisis ragam (Uji F) menggunakan program SAS 9.1 dan apabila berbeda nyata dilanjutkan uji DMRT taraf 5%.
HASIL DAN PEMBAHASAN
Karakter Kualitatif Tanaman Cabai
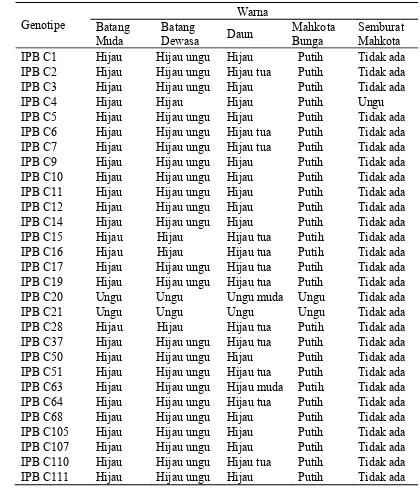
C20 dan IPB C21 yang memiliki warna ungu. Mahkota bunga tidak terdapat semburat kecuali IPB C4 dengan semburat ungu.
Tabel 2 Karakter kualitatif 29 genotipe cabai berdasarkan warna pada bagian batang, daun, dan mahkota bunga
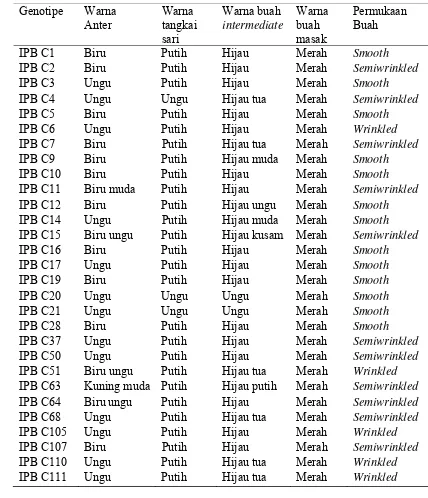
Warna anter 29 genotipe cabai juga menunjukkan adanya keragaman (Tabel 3). Warna anter tersebut adalah biru (IPB C1, IPB C2, IPB C5, IPB C7, IPB C9, IPB C10, IPB C12, IPB C16, IPB C19, IPB C28, dan IPB C107), ungu (IPB C3, IPB C4, IPB C6, IPB C14, IPB C17, IPB C20, IPB C21, IPB C37, IPB C50, IPB C68, IPB C105, IPB C110, dan IPB C111), biru muda (IPB C11), biru ungu (IPB C15, IPB C51, dan IPB C64), dan kuning muda (IPB C63). Untuk warna tangkai sari, seluruh genotipe cabai memiliki tangkai sari berwarna putih, kecuali IPB C4, IPB C20 dan IPB C21 yang berwarna ungu. Warna buah intermediate menunjukkan warna yang beragam, dengan sebagian berwarna hijau, hijau tua, hijau muda, hijau ungu, hijau kusam, hijau putih. Warna buah masak mempunyai warna merah pada semua genotipe yang diamati. Permukaan buah menunjukkan keberagaman, yaitu smooth
(halus) dan semiwrinkled (semi keriting), serta wrinkled (keriting).
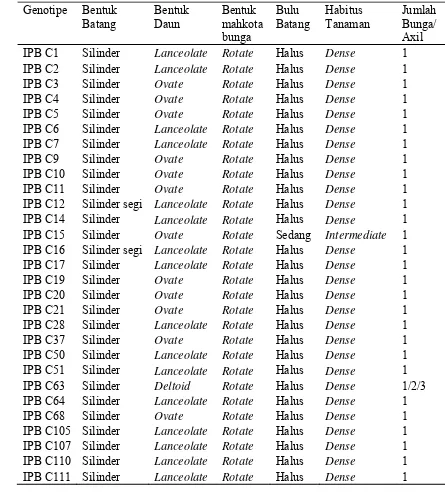
Bentuk batang pada 29 genotipe cabai adalah silinder, kecuali IPB C12 dan IPB C16 yang berbentuk silinder segi (Tabel 4). Sebagian besar bentuk daun adalah
lanceolate dan ovate, kecuali IPB C63 yang berbentuk deltoid. Bentuk mahkota bunga menunjukkan bentuk rotate. Bulu batang pada semua genotipe bersifat halus, kecuali IPB C15 yang bersifat sedang. Semua genotipe memiliki habitus tanaman
dense (tegak), kecuali IPB C15 yang mempunyai sifat intermediate. Jumlah bunga percabangan pada semua genotipe adalah satu, kecuali IPB C63 yang memiliki lebih
dari satu pada tiap percabangan.
Bentuk tipe kelopak bunga cabai sebagian besar agak bergerigi, kecuali IPB C7, IPB C12, IPB C14, IPB C17, IPB C37, IPB C50, IPB C63, dan IPB C64 memiliki tipe kelopak bunga rata. Bentuk buah semua genotipe cabai adalah
elongate, kecuali genotipe IPB C20 yang bentuk buahnya triangular. Bentuk pangkal buah seluruh genotipe adalah tumpul dan bentuk ujung buah semua genotipe adalah pointed, kecuali IPB C3 berbentuk sunken dan IPB C10 berbentuk blunt
Tabel 3 Karakter kualitatif 29 genotipe cabai berdasarkan warna anter, tangkai sari, buah intermediate, dan permukaan buah
Genotipe Warna
IPB C63 Kuning muda Putih Hijau putih Merah Semiwrinkled
Tabel 4 Karakter kualitatif 29 genotipe cabai berdasarkan bentuk batang, daun, mahkota bunga, bulu batang, habitus tanaman, dan jumlah bunga/axil
Tabel 5 Krakter kualitatif 29 genotipe cabai berdasarkan bentuk kelopak bunga, buah, pangkal buah, ujung buah, dan posisi bunga
Genotipe Bentuk tipe kelopak bunga
IPB C1 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C2 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C3 Agak bergerigi Elongate Tumpul Sunken Intermediate
IPB C4 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C5 Agak bergerigi Elongate Tumpul Pointed Pendant
IPB C6 Agak bergerigi Elongate Tumpul Pointed Pendant
IPB C7 Rata Elongate Tumpul Pointed Intermediate
IPB C9 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C10 Agak bergerigi Elongate Tumpul Blunt Erect
IPB C11 Agak bergerigi Elongate Tumpul Pointed Pendant
IPB C12 Rata Elongate Tumpul Pointed Pendant
IPB C14 Rata Elongate Tumpul Pointed Pendant
IPB C15 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C16 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C17 Rata Elongate Tumpul Pointed Intermediate
IPB C19 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C20 Agak bergerigi Triangular Tumpul Pointed Erect
IPB C21 Agak bergerigi Elongate Tumpul Pointed Pendant
IPB C28 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C37 Rata Elongate Tumpul Pointed Pendant
IPB C50 Rata Elongate Tumpul Pointed Pendant
IPB C51 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C63 Rata Elongate Tumpul Pointed Erect
IPB C64 Rata Elongate Tumpul Pointed Pendant
IPB C68 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C105 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C107 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C110 Agak bergerigi Elongate Tumpul Pointed Intermediate
IPB C111 Agak bergerigi Elongate Tumpul Pointed Intermediate
Karakter kuantitatif tanaman cabai
Hasil analisis ragam menunjukkan karakter kuantitatif dari 29 genotipe cabai yang diamati terdapat perbedaan (Lampiran 2). Peubah pengamatan pada tinggi
ketebalan daging buah menunjukkan perbedaan sangat nyata (Tabel 6). Dengan demikian, genotipe yang diamati memiliki karakter kuantitatif yang berbeda-beda.
Tabel 6 Rekapitulasi analisis ragam karakter kuantitatif pada 29 genotipe cabai
No. Karakter kuantitatif Kuadrat tengah genotipe (cm)
1. Tinggi dikotomus 248.30**
2. Tinggi tanaman 1010.56**
3. Lebar tajuk 289.72**
4. Diameter batang 0.02**
5. Panjang daun 11.88**
6. Lebar daun 6.04**
7. Waktu berbunga 170.06**
8. Bobot buah 47.84**
9. Panjang buah 29.81**
10. Panjang tangkai buah 1.95**
11. Diameter buah 0.24**
12. Ketebalan daging buah 0.02** Keterangan: ** : berbeda pada taraf 1% berdasarkan uji F.
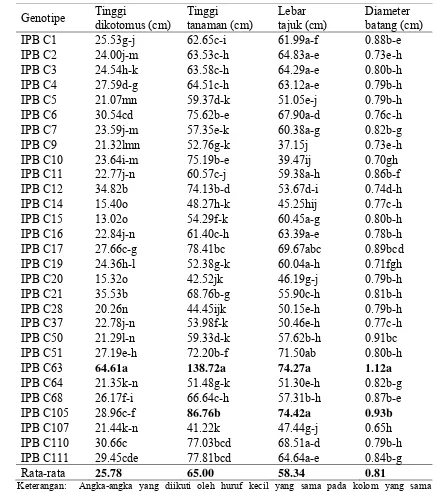
Genotipe IPB C63 memiliki nilai yang tinggi untuk karakter tinggi dikotomus, tinggi tanaman, lebar tajuk, diameter batang (Tabel 7), panjang daun, dan lebar daun (Tabel 10). Genotipe IPB C63 juga memiliki waktu berbunga paling lambat dibandingkan genotipe lainnya. Genotipe ini memiliki tajuk yang lebih tinggi dan lebar dibandingkan genotipe yang lain serta memiliki umur yang panjang. Sebaliknya, genotipe IPB C20 dan IPB C107 memiliki tinggi tanaman, lebar tajuk, dan diameter batang yang kecil atau pendek. Dengan demikian, genotipe IPB C20 dan IPB C107 memiliki keragaan tanaman yang lebih kecil dibandingkan genotipe lainnya. Genotipe IPB C10, IPB C20, dan IPB C63 memiliki bobot buah rendah dan ukuran buah yang pendek. Genotipe IPB C28 mempunyai bobot buah tinggi dan
Tabel 7 Rataan karakter kuantitatif tinggi dikotomus, tinggi tanaman, lebar tajuk, dan diameter batang 29 genotipe cabai
Genotipe Tinggi
IPB C105 28.96c-f 86.76b 74.42a 0.93b
IPB C107 21.44k-n 41.22k 47.44g-j 0.65h IPB C110 30.66c 77.03bcd 68.51a-d 0.79b-h IPB C111 29.45cde 77.81bcd 64.64a-e 0.84b-g
Rata-rata 25.78 65.00 58.34 0.81
Keterangan: Angka-angka yang diikuti oleh huruf kecil yang sama pada kolom yang sama
Tabel 8 Rataan karakter kuantitatif panjang daun, lebar daun, waktu berbunga, dan bobot buah 29 genotipe cabai
Genotipe Panjang daun (cm)
Keterangan: Angka-angka yang diikuti oleh huruf kecil yang sama pada kolom yang sama
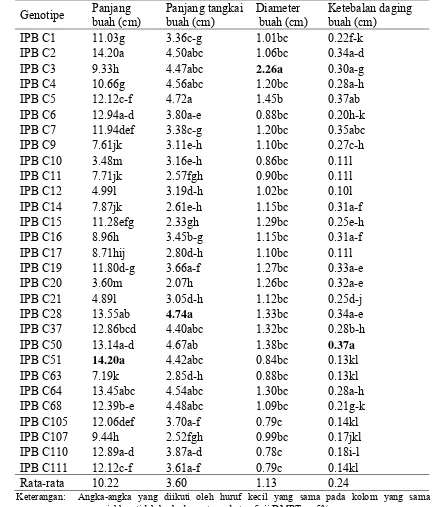
Tabel 9 Rataan karakter kuantitatif panjang buah dan tangkai buah, diameter, serta ketebalan buah 29 genotipe cabai
Genotipe Panjang
Keterangan: Angka-angka yang diikuti oleh huruf kecil yang sama pada kolom yang sama
menunjukkan tidak berbeda nyata pada taraf uji DMRT α=5%.
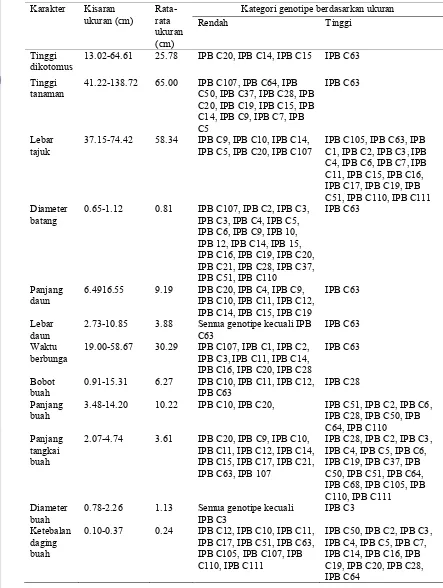
pada panjang daun pada genotipe yang diamati. Ukuran daun terlebar dimiliki oleh genotipe IPB C63 (10.85 cm) dan lebar daun kecil dimiliki genotipe IPB C20 (2.73 cm) dengan rata-rata 3.88 cm. Rata-rata waktu berbunga genotipe yang diamati adalah 30.3 hari. Waktu berbunga paling lama dimiliki genotipe IPB C63 (58.67 hari), sedangkan waktu berbunga genjah pada genotipe IPB C107 (19 hari). Bobot buah tertinggi dihasilkan oleh genotipe IPB C28 (15.31 g) dan rendah adalah genotipe IPB C10 (0.91 g) dengan rata-rata seluruh genotipe 6.27 g.
Tabel 10 Pengelompokan genotipe berdasarkan kisaran dan rata-rata ukuran terhadap karakter kuantitatif 29 genotipe cabai
Karakter Kisaran
Kategori genotipe berdasarkan ukuran
Rendah Tinggi
2.73-10.85 3.88 Semua genotipe kecuali IPB
C63
0.78-2.26 1.13 Semua genotipe kecuali
Pengelompokan Capsicum dan Analisis Gerombol
Berdasarkan pengelompokan spesies, diketahui bahwa dari 29 genotipe yang diamati, seluruh genotipe merupakan C. annuum, kecuali genotipe IPB C63 yang berbeda spesies, yaitu C. frutescens (Tabel 11). Spesies C. annuum memiliki ciri warna batang muda hijau dan ungu; warna batang dewasa hijau, hijau ungu, dan ungu; warna daun hijau, hijau tua, ungu, dan ungu muda. Mahkota bunga putih atau ungu, tidak ada atau terdapat semburat ungu. Warna anter biru, ungu, biru muda, dan biru ungu. Warna tangkai sari putih dan ungu. Warna buah intermediet bervariasi, dari hijau, hijau tua, hijau muda, hijau ungu, dan hijau kusam. Bentuk daun
lanceolate dan ovate, serta habitus tanaman intermediate atau tegak. Jumlah bunga pada percabangan satu dengan posisi bunga menggantung (pendant, intermediate) atau ke atas (erect). Genotipe IPB C63 merupakan C. frutescens yang memiliki tinggi tanaman mencapai 150 cm, warna daun hijau muda, warna anter kuning muda, warna tangkai sari putih, warna buah intermediet hijau putih. Bentuk daun deltoid, habitus tanaman dence (tegak), jumlah bunga pada tiap percabangan lebih dari satu. Posisi bunga erect atau ke atas. Dengan demikian, selain morfologi bunga dan buah, perbedaan spesies C. annuum dan C. frutescens terletak pada bentuk daun, jumlah bunga pada tiap percabangan, posisi bunga, warna buah intermediate, dan habitus tanaman.
agak bergelombang sehingga memberi kesan keriting. Penampakan fisik tanamannya tegak dan ukuran daunnya lebih besar dibandingkan cabai merah pada umumnya (Setiadi 1996).
Tabel 11 Pengelompokan spesies, tipe buah, dan asal benih 29 genotipe cabai
No. Genotipe Spesies Tipe Buah Asal Benih
1. IPB C1 C. annuum Besar PSPT C-17
2. IPB C2 C. annuum Besar PSPT C-11
3. IPB C3 C. annuum Besar Cilibangi 1
4. IPB C4 C. annuum Besar Cilibangi 2
5. IPB C5 C. annuum Besar Cilibangi 3
6. IPB C6 C. annuum Keriting Keriting bogor
7. IPB C7 C. annuum Besar Jatilaba
8. IPB C9 C. annuum Besar ICPN 12#4
9. IPB C10 C. annuum Rawit PBC 495
10. IPB C11 C. annuum Besar PBC 137
11. IPB C12 C. annuum Besar VC 211a
12. IPB C14 C. annuum Besar CCA 321
13. IPB C15 C. annuum Besar 0209-4
14. IPB C16 C. annuum Besar Cilibangi 5
15. IPB C17 C. annuum Besar VC 246
16. IPB C19 C. annuum Besar Randu
17. IPB C20 C. annuum Hias CA-MAZ
18. IPB C21 C. annuum Hias CF-LKP
19. IPB C28 C. annuum Besar Helem
20. IPB C37 C. annuum Besar Tit segitiga
21. IPB C50 C. annuum Besar Tanjung
22. IPB C51 C. annuum Keriting Laris
23. IPB C63 C. frutescens Rawit RTN
24. IPB C64 C. annuum Besar Tit bulat
25. IPB C68 C. annuum Keriting PBC 549 26. IPB C105 C. annuum Keriting Payakumbuh
27. IPB C107 C. annuum Besar Karo
Keragaan pada genotipe cabai yang diamati menunjukkan perbedaan berdasarkan bentuk dan ukuran buah serta tipe buah. Genotipe IPB C10 dan IPB C63 tergolong cabai rawit dengan keragaan buah kecil dan rasanya pedas; genotipe IPB C12, IPB C14, IPB C15, dan IPB C64 adalah cabai besar dengan buah lebih panjang dan besar serta rasanya tidak terlalu pedas; genotipe IPB C111 adalah salah satu cabai keriting dengan keragaan bentuk buah panjang seperti cabai besar namun diameter buah lebih kecil, rasa agak pedas; dan genotipe IPB C20 dan IPB C21 adalah cabai hias yang didominasi keragaan warna ungu (Lampiran 3).
Tabel 12 Analisis gerombol 29 genotipe cabai berdasarkan karakter kualitatif
No Kelompok Genotipe
1. I IPB C1, IPB C107, IPB C2, IPB C16, IPB C28, IPB C19, IPB C9, IPB C10, IPB C5, IPB C11, IPB C4, IPB C51, IPB C110, IPB C111, IPB C68, IPB C17, IPB C50, IPB C105, IPB C37, IPB C6, IPB C64, IPB C14, IPB C7, dan IPB C3.
2. II IPB C15 dan IPB C63
3. III IPB C12
4. IV IPB C20, IPB C21
Analisis gerombol (Cluster analysis) berdasarkan karakter kualitatif menunjukkan pada tingkat kesamaan 96.40% 29 genotipe cabai mengelompok menjadi 4 kelompok (Tabel 12). Sebagian besar genotipe mengelompok pada kelompok I, genotipe IPB C15 dab IPB C63 termasuk ke dalam kelompok II, IPB C12 termasuk ke dalam kelompok III, dan IPB C20 dan IPB C21 berada pada
Di samping itu juga, semakin banyak karakter yang digunakan, pengelompokan akan semakin menunjukkan perbedaan.
Gambar 2 Analisis gerombol 29 genotipe cabai berdasarkan karakter kualitatif.
Analisis gerombol membuktikan adanya perbedaan 29 genotipe cabai menjadi 4 kelompok besar (Gambar 2). Kelompok I menunjukkan sebagian besar genotipe merupakan cabai besar dan keriting, yang memiliki warna daun hijau dan hijau tua, bentuk daun lanceolate dan ovate, dan habitus tanaman dense (tegak). Kelompok II adalah genotipe IPB C15 dan IPB C63 yang memiliki warna, bentuk, dan ukuran yang berbeda. Genotipe IPB C15 memiliki ciri morfologi yang mencolok dengan genotipe yang lainnya, yaitu warna daun hijau tua, bentuk daun ovate, warna buah intermediate hijau kusam, memiliki bulu batang sedang, dan habitus tanaman yang
intermediate atau sedang. IPB C63 memiliki morfologi warna daun hijau muda, warna buah intermediate hijau putih, bentuk daun deltoid, habitus tanaman tegak, jumlah bunga/axil lebih dari satu (1 atau 2 atau 3) / axil (percabangan). Kelompok III adalah genotipe IPB C12 yang memiliki morfologi warna daun hijau, buah intermediate hijau ungu, batang dewasa hijau ungu, bentuk daun lanceolate, bentuk
96,40
III
II I
batang silinder sedang, bulu batang halus, dan habitus tanaman tegak (dence). Kelompok IV adalah genotipe IPB C20 dan IPB C21. Genotipe IPB C20 memiliki warna daun ungu muda; warna batang muda, warna batang dewasa, anter, tangkai sari, dan buah intermediet memiliki warna ungu. Bentuk daun ovate, bulu batang sedang, bentuk buah triangular, dan habitus tanaman tegak. IPB C21 memiliki warna daun, batang, bunga, dan buah muda berwarna ungu, bentuk daun ovate, dan habitus tanaman tegak.
Perbedaan kelompok genotipe tersebut (Tabel 12) dapat digunakan untuk mengetahui kesamaan dan kekerabatan antar genotipe. Genotipe yang berada pada kelompok yang sama, memiliki kesamaan dan tingkat kekerabatan yang dekat. Genotipe yang berada pada kelompok yang berbeda menunjukkan kesamaan dan kekerabatan yang cukup jauh. Program persilangan cabai untuk mendapatkan zuriat yang memiliki keragaman yang luas dapat dilakukan dengan menyilangkan genotipe yang berada pada kelompok yang berbeda.
SIMPULAN
1. Karakter morfologi daun, batang, bunga, dan buah dapat dibedakan antar genotipe cabai. Terdapat perbedaan sangat nyata antar genotipe cabai terhadap peubah tinggi dikotomus, tinggi tanaman, lebar tajuk, diameter batang, panjang dan lebar daun, serta waktu berbunga.
2. Berdasarkan karakter kualitatif, 29 genotipe cabai yang diamati dibagi menjadi 4 kelompok yang sebagian besar masuk pada kelompok I, genotipe IPB C15 dan IPB C63 masuk kelompok II, genotipe IPB C12 masuk kelompok III, dan genotipe IPB C20 dan IPB C21 masuk kelompok IV.