KAJIAN KEBERADAAN VIRUS AVIAN INFLUENZA
PADA UNGGAS DI PASAR BURUNG PRAMUKA, JAKARTA
DORDIA ANINDITA ROTINSULU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis dengan judul Kajian Keberadaan Virus Avian Influenza pada Unggas di Pasar Burung Pramuka, Jakarta adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2013
Dordia Anindita Rotinsulu
i
RINGKASAN
DORDIA ANINDITA ROTINSULU. Kajian Keberadaan Virus Avian Influenza pada Unggas di Pasar Burung Pramuka, Jakarta. Dibimbing oleh SURACHMI SETIYANINGSIH dan ABDULGANI AMRI SIREGAR.
Penyakit Avian Influenza (AI) atau flu burung yang disebabkan oleh virus influenza tipe A dari keluarga Orthomyxoviridae telah menimbulkan dampak global yang besar, baik di bidang kesehatan, sosial maupun ekonomi. Virus AI dapat menginfeksi beragam unggas maupun mamalia sehingga pasar burung sebagai tempat bertemunya manusia dan unggas berpotensi menjadi sarana penyebaran virus AI antar unggas atau penularan dari unggas ke manusia. Mengingat peran unggas dalam penyebaran virus AI dan banyaknya spesies unggas di Indonesia, maka penelitian mengenai keberadaan virus AI pada unggas, terutama di Pasar Burung Pramuka sebagai pasar burung terbesar di DKI Jakarta sangat diperlukan.
Secara umum penelitian ini bertujuan untuk mengkaji keberadaan virus AI pada berbagai spesies unggas di Pasar Burung Pramuka Jakarta. Secara khusus, penelitian ini bertujuan untuk: (1) mengkaji keberadaan virus AI dan H5 dari sampel usap orofaringeal, usap kloakal, dan feses (kontaminasi lingkungan) dari berbagai spesies unggas menggunakan metode real time Reverse Transcriptase-Polymerase Chain Reaction (rRT-PCR); (2) mendeteksi keberadaan antibodi terhadap virus AI (H5) pada berbagai spesies unggas dengan uji hemaglutinasi inhibisi (HI); dan (3) mengetahui pengaruh cuaca dan asal geografis unggas dengan keberadaan virus AI.
Selama bulan April sampai dengan September 2011, jumlah sampel lapangan yang berhasil dikoleksi dari Pasar Burung Pramuka, Jakarta adalah sebanyak 862 sampel dari 28 famili dan 96 spesies unggas yang berbeda. Sampel tersebut terdiri atas 649 sampel feses, 114 sampel usap kloakal, dan 99 sampel usap orofaringeal. Dari sampel lapangan, sebanyak 7 dari 649 sampel feses (1.08%) positif AI. Namun, tidak ada sampel usap orofaringel dan usap kloakal yang positif AI. Sampel feses yang positif terdeteksi pada empat spesies unggas, yaitu tiga ekor burung Kacer (Copsychus saularis, famili Turdidae), dua ekor burung Kacamata (Zosterops palpebrosus, famili Zostropidae), satu ekor burung Trucuk (Pycnonotus goiavier, famili Pycnotidae), dan satu ekor burung Robin (Leiothrix lutea, famili Sylviidae).
Selain sampel lapangan, selama bulan April sampai dengan September 2011, sebanyak 178 unggas dari 21 famili dan 47 spesies yang berbeda dibeli dari pasar yang sama. Dari unggas yang dibeli, sebanyak dua ekor unggas (1.12%) postif virus AI. Kedua ekor unggas tersebut merupakan burung Kacamata (Zosterops palpebrosus, famili Zostropidae). Seluruh sampel feses maupun unggas dibeli yang positif dikoleksi dari ordo Passeriformis. Namun berdasarkan uji rRT-PCR tidak ada sampel yang positif H5.
tujuh dari 163 unggas (4.29%) positif memiliki antibodi terhadap AI (H5). Terdapat perbedaan titer HI antara kedua antigen tersebut. Dengan menggunakan antigen A/Legok/IPB-SGT/1/2004 (H5N1), terdapat dua sampel yang positif kuat
dengan titer ≥ 24
, sedangkan lima lainnya positif lemah dengan titer < 24. Hasil positif kuat berdasarkan uji HI diperoleh dari dua ekor burung kutilang (Pycnonotus aurigaster, famili Pycnotidae). Sedangkan hasil positif lemah diperoleh dari masing-masing satu ekor angsa (Cygnus sp., famili Anatidae), bebek (Anas sp., famili Anatidae), burung emprit/bondol haji (Lonchura maja,
famili Ploceidae), tekukur (Streptopelia chinensis, famili Columbidae), dan kruwok (Nyctorax nyctorax¸ famili Ardeidae). Dengan menggunakan antigen A/Ck/West Java/PWT-Wij/2006 (H5N1), rata-rata titer HI yang diperoleh lebih tinggi, yakni lima ekor unggas positif kuat (emprit, angsa, kruwok dan dua ekor kutilang), sedangkan dua ekor unggas (bebek dan tekukur) positif lemah.
Unggas di Pasar Burung Pramuka, Jakarta yang terinfeksi AI umumnya berasal dari pulau Jawa, namun ada pula unggas yang diimpor. Virus AI terdeteksi pada kelompok burung hias atau kicauan, sedangkan antibodi AI (H5) terdeteksi pada kelompok unggas air, unggas lahan basah, dan burung hias atau kicauan. Tidak ada pengaruh nyata antara kejadian AI dengan cuaca walaupun terjadi peningkatan kasus AI di musim pancaroba.
Penelitian ini menambah informasi mengenai AI pada unggas yang dijual di Pasar Burung. Diperlukan penelitian lebih lanjut untuk mengetahui subtipe virus AI selain H5 pada unggas maupun hewan lain yang dijual di Pasar Burung Pramuka, Jakarta.
iii
SUMMARY
DORDIA ANINDITA ROTINSULU. Investigation of Avian Influenza Virus on Birds in Pramuka Bird Market, Jakarta. Under direction of SURACHMI SETIYANINGSIH and ABDULGANI AMRI SIREGAR.
Avian Influenza (AI) which is caused by influenzavirus A of the family
Orthomyxoviridae cause an important impact, including in health, social and economic sectors. AI viruses (AIV) can infect various birds and mammals, therefore bird market as a meeting place for human and poultry can potentially transmit AI virus among birds or from birds to human. Indonesia is a habitat of various bird species; therefore research about AIV on bird, especially which are sold in the Pramuka Bird Market, as the biggest bird market in Jakarta, is urgently needed.
In general, the aim of this study was to examine the presence of AIV in various bird species sold in Pramuka Bird Market, Jakarta. Specifically, the aims of this study were: (1) to assess the presence of H5 AI virus in oropharyngeal swab, cloacal swab, and fecal samples of various bird species using real time Reverse Transcriptase-Polymerase Chain Reaction (rRT-PCR); (2) to detect the presence of antibodies against AIV (H5) in various bird species using hemagglutination inhibition (HI) test, and (3) to determine the relationship among weather and geographic origin of birds to the prevalence of AIV.
During April until September 2011, a number of 862 field samples from 28 families and 96 bird species were collected in Pramuka Bird Market, Jakarta. These field samples consisted of 649 fecal samples, 114 cloacal swab samples, and 99 oropharyngeal swab samples. As many as 7 of 649 faecal samples (1.08%) were positive AI. However, none cloacal or oropharyngel swab were positive AI. Positive fecal samples were detected in four bird species, which are three magpie-robins (Copsychus saularis, family Turdidae), two white-eyes (Zosterops palpebrosus, family Zostropidae), a yellow-vented bulbul (Pycnonotus goiavier, family Pycnotidae), and a robin (Leiothrix lutea, family Sylviidae).
In addition to field samples, during April until September 2011, 178 birds from 21 families and 47 species were purchased from the same bird market. From 178 birds, two birds (1.12%), which were two white-eyes (Zosterops palpebrosus, family Zostropidae), were positive AI. The whole positive samples were from
Passeriformis order. However, based on rRT-PCR result, there were no H5 positive samples.
night heron (Nyctorax nyctorax, family Ardeidae). By using A/Ck/West Java/PWT-Wij/2006 (H5N1) antigen, the average HI titer obtained was higher. Five samples were strongly positive (Lonchura maja, Cygnus sp., Nyctorax nyctorax, and two Pycnonotus aurigaster), while samples from Anas sp. and
Streptopelia chinensis were weakly positive.
Most of the positive samples were from birds caught in Java Island, but beside that there was also one imported bird. Avian influenza virus were detected in singing birds, whereas the antibody against AI (H5) were detected in waterfowl, wetland birds, and singing birds. There was no significant relationship between the prevalence of AI and weather, despite an increase in AI cases during the transition season. Results of this study provide important information about the prevalence of AI virus on birds sold in Bird Market, Jakarta. Further research is needed to determine the subtype other than H5 AI virus in birds and other animals sold in Pramuka Bird Market, Jakarta.
v
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
vii
KAJIAN KEBERADAAN VIRUS AVIAN INFLUENZA
PADA UNGGAS DI PASAR BURUNG PRAMUKA, JAKARTA
DORDIA ANINDITA ROTINSULU
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Keberadaan Virus Avian Influenza pada Unggas di Pasar Burung Pramuka, Jakarta
Nama : Dordia Anindita Rotinsulu
NRP : B253100021
Disetujui oleh Komisi Pembimbing
Drh. Surachmi Setiyaningsih, Ph.D Ketua
Drh. Abdulgani Amri Siregar, MS Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof. Dr. drh. Fachriyan H. Pasaribu
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M.Sc Agr
PRAKATA
Puji syukur ke hadirat Tuhan Yang Maha Kuasa atas berkat, rahmat,dan karuniaNya sehingga penulis dapat menyelesaikan penyusunan tesis yang berjudul Kajian Keberadaan Virus Avian Influenza pada Unggas di Pasar Burung Pramuka, Jakarta. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains Sekolah Pascasarjana Institut Pertanian Bogor (SPS IPB).
Proses penulisan tesis ini tidak terlepas dari dukungan berbagai pihak. Oleh karena itu, dengan rasa tulus dan hormat, Penulis mengucapkan banyak terima kasih kepada drh. Surachmi Setiyaningsih, Ph.D sebagai ketua komisi pembimbing dan drh. Abdulgani Amri Siregar, MS sebagai anggota komisi pembimbing yang telah dengan sabar meluangkan banyak waktu dalam memberikan arahan dan masukan kepada penulis. Ucapan terima kasih penulis haturkan kepada Dr. drh. Idwan Sudirman sebagai penguji luar komisi atas masukan dan saran yang diberikan. Terima kasih kepada Prof. Dr. drh. Fachriyan H. Pasaribu sebagai Ketua Program Studi serta seluruh dosen maupun tenaga kependidikan program studi Mikrobiologi Medik SPS IPB yang telah turut medukung studi penulis.
Ucapan terima kasih penulis haturkan kepada Prof. Dr. drh. I Wayan Teguh Wibawan sebagai pihak Fakultas Kedokteran Hewan IPB; Dick Bowen, Ph.D dan Dr. Christy Pabilonia sebagai pihak Colorado State University yang telah memberikan beasiswa dan dukungan dana untuk melaksanan penelitian dan proses pendidikan Magister Sains di IPB. Terima kasih kepada Bakrie Center Foundation atas beasiswa yang telah diberikan.Terima kasih kepada Dinas Kelautan dan Pertanian DKI Jakarta, PD Pasar Jaya, dan pihak Pasar Burung Pramuka, Jakarta yang telah memfasilitasi dan mendukung penelitian yang penulis lakukan.
Terima kasih kepada Mama dan Papa yang dengan tulus dan sabar memberikan doa, motivasi maupun semangat dalam setiap aktivitas yang penulis lakukan. Terima kasih kepada suami, Dungdang P. Hutapea, SE yang dengan kasih sayang mendukung proses studi penulis. Terima kasih juga penulis ucapkan kepada keluarga besar yang turut memotivasi dan menginspirasi penulis selama menjalani perkuliahan,
xi
Penulisan tesis ini masih jauh dari sempurna, sehingga saran dan kritik yang membangun sangat diharapkan. Semoga tesis ini dapat bermanfaat bagi semua pihak dan bagi perkembangan ilmu pengetahuan.
DAFTAR ISTILAH
AI Avian Influenza
Ct Cycle threshold
H5 Hemaglutinin 5
HA Hemaglutinin
HI Hemaglutinasi Inhibisi
HPAI Highly Pathogenic Avian Influenza
LPAI Low Pathogenic Avian Influenza
RBC Red blood cell
RNA Ribonucleic Acid
rRT-PCR real time Reverse Transcriptase Polymerase Chain Reaction
xiii
DAFTAR ISI
DAFTAR TABEL xv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xv
1. PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 2
1.3 Tujuan Penelitian 2
1.4 Manfaat Penelitian 2
1.5 Hipotesis 2
2. TINJAUAN PUSTAKA 3
2.1 Virus Influenza A 3
2.2 Mutasi Virus AI 4
2.3 Patogenisitas Avian Influenza 6
2.4 Virus Avian Influenza pada Unggas Liar dan Pasar Unggas 7
2.5 Diagnosa Laboratorium untuk Avian Influenza 9
2.6 Studi Cross-Sectional 13
3. METODE PENELITIAN 15
3.1 Bahan dan Alat 15
3.2 Tempat dan Waktu Penelitian 15
3.3 Desain Penelitian 15
3.4 Analisa Data 19
4. HASIL 21
4.1 Kondisi Pasar Burung Pramuka, Jakarta 21
4.2 Koleksi Sampel 22
4.3 Deteksi Avian Influenza dengan rRT-PCR 24
4.4 Deteksi Antibodi terhadap AI (H5) 26
4.5 Asal Unggas dan Cuaca 26
5. PEMBAHASAN 29
5.2 Deteksi Avian Influenza 29
5.3 Uji Hemaglutinasi Inhibisi 33
6. SIMPULAN DAN SARAN 37
6.1 Simpulan 37
6.2 Saran 37
DAFTAR PUSTAKA 39
LAMPIRAN 47
DAFTAR TABEL
1 Pasangan primer dan probe untuk mendeteksi gen AI 12
2 Campuran rRT-PCR 18
3 Primer dan probe yang digunakan 18
4 Kondisi amplifikasi untuk rRT-PCR Matriks 18
5 Kondisi amplifikasi untuk rRT-PCR H5 19
6 Sampel lapangan yang dikoleksi dari Pasar Burung Pramuka, Jakarta pada April sampai dengan September 2011 berdasarkan bulan dan jenis
sampel 23
7 Sampel lapangan yang dikoleksi dari Pasar Burung Pramuka, Jakarta pada April sampai dengan September 2011 berdasarkan kelompok
unggas dan jenis sampel` 23
8 Unggas yang dibeli dari Pasar Burung Pramuka, Jakarta berdasarkan
kelompok unggas 24
9 Sampel positif virus Avian Influenza dan antibodi terhadap Avian
Influenza subtipe H5 25
DAFTAR GAMBAR
1 Struktur dan segmen-segmen genom virus influenza A 4
2 rRT-PCR menggunakan TaqMan Probe 11
3 Desain penelitian 16
4 Lokasi Pasar Burung Pramuka, Jakarta 21
5 Amplifikasi rRT-PCR matriks sampel dari Pasar Burung Pramuka,
Jakarta 25
6 Cuaca di Pasar Burung Pramuka Jakarta selama pengambilan sampel 27
DAFTAR LAMPIRAN
1 Sampel Lapangan dari Pasar Burung Pramuka, Jakarta pada bulan April
sampai dengan September 2011 47
2 Lampiran 1 Sampel Lapangan dari Pasar Burung Pramuka, Jakarta pada
1
1. PENDAHULUAN
1.1 Latar Belakang
Penyakit Avian Influenza (AI) atau flu burung merupakan penyakit unggas menular yang disebabkan virus influenza tipe A dari famili Orthomyxoviridae
(Boyce et al. 2009). Penyakit ini telah menimbulkan dampak global yang besar, baik di bidang kesehatan, sosial maupun ekonomi (FKH IPB dan DEPTAN RI 2005, Bavink et al. 2009). Indonesia telah terserang AI sejak bulan Juli 2003 dan secara resmi diumumkan pemerintah pada 25 Januari 2004 (FKH IPB dan DEPTAN RI 2005). Penyakit ini secara intensif mendapat perhatian karena menyebar dengan cepat, mudah bermutasi, dan dikhawatirkan dapat berkembang menjadi pandemi seperti pandemi virus influenza A H1N1 tahun 1918 (Tumpey dan Belser 2009).
Virus AI umumnya menyerang unggas (ayam peliharaan, kalkun, itik, puyuh, dan angsa) juga berbagai jenis burung liar (Boyce et al. 2009, Whitworth
et al. 2007). Unggas air merupakan inang alami dan reservoir virus AI (Gall et al. 2009), sehingga walaupun telah terinfeksi virus AI, unggas air tidak selalu menunjukkan gejala (Webster et al. 1992). Beberapa virus AI juga diketahui dapat menyerang mamalia, termasuk manusia (Cardona et al. 2009). Hingga kini masih terdapat silang pendapat terkait mekanisme penularan virus AI dari unggas ke manusia sehingga terdapat dugaan adanya carrier virus ini (FKH IPB dan DEPTAN RI 2005), misalnya burung liar.
Keterkaitan burung liar dengan penyebaran virus AI perlu menjadi perhatian Indonesia karena merupakan salah satu negara terpenting yang disinggahi 243 spesies burung berjumlah jutaan individu setiap tahunnya (Whitworth et al. 2007). Berbagai studi menyebutkan bahwa burung migran dapat berpotensi menjadi sumber penyebaran virus AI subtipe H5N1 (Perez-Ramirez et al. 2010). Namun peran unggas liar dalam penyebaran H5N1 masih belum jelas. Survailans AI pada unggas liar dapat menunjang pemahaman yang lebih komprehensif terhadap spesifitas induk semang dan evolusi virus AI. Oleh karena itu, penelitian multidisipliner untuk lebih memahami ekologi virus AI pada unggas liar sangat diperlukan.
Berbagai studi menunjukkan bahwa pasar sebagai tempat bertemunya manusia dan unggas berpotensi menjadi sarana penyebaran virus AI pada unggas atau kemungkinan penularan dari unggas ke manusia. Menurut Wang et al. (2006), di Guangzhou, Cina tercatat seorang pasien yang terinfeksi Highly Pathogenic AI dari pasar makanan yang sekaligus menjual unggas hidup (Wang et al. 2006).
Di Thailand, sebanyak 12 virus H5N1 terisolasi dari pasar burung dan pasar makanan pada bulan Juli 2006-Agustus 2007 (Amonsin et al. 2008). Virus H5N1 tersebut secara genetis mirip dengan H5N1 yang beredar di Thailand tahun 2004-2005. Studi pada 10 pasar unggas hidup di Hanoi, Vietnam menunjukkan bahwa virus H5N1 terdeteksi pada 2 dari 33 sampel kloakal dan orofaringeal angsa sehat (Nguyen et al. 2005).
manusia. Mengingat peran unggas dalam penyebaran virus AI dan banyaknya spesies unggas di Indonesia, maka penelitian mengenai keberadaan virus AI pada unggas sangat diperlukan. Pada penelitian ini, sampel akan diambil dari berbagai spesies unggas di Pasar Burung Pramuka, Jakarta.
1.2 Perumusan Masalah
Hingga kini, masih diperlukan banyak data dan informasi untuk membuktikan bahwa terjadi penularan dari burung ke unggas lokal bahkan manusia. Mengingat peran unggas dalam penyebaran virus AI dan banyaknya spesies unggas di Indonesia, maka penelitian mengenai keberadaan virus AI pada unggas sangat diperlukan. Pada penelitian ini, sampel akan diambil dari berbagai spesies unggas di Pasar burung Pramuka, Jakarta.
1.3 Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mengkaji keberadaan virus AI pada berbagai spesies unggas di Pasar Pramuka, Jakarta pada kurun waktu tertentu. Secara khusus, penelitian ini bertujuan untuk:
1. Mengkaji keberadaan virus AI dan H5 dari sampel orofaring dan kloaka unggas maupun feses (kontaminasi lingkungan) dari berbagai spesies unggas menggunakan metode real time Reverse Transcriptase-Polymerase Chain Reaction (rRT-PCR).
2. Mendeteksi keberadaan antibodi terhadap virus AI (H5) pada berbagai spesies unggas dengan uji hemaglutinasi inhibisi.
3. Mengetahui pengaruh cuaca dan asal geografis unggas dengan keberadaan virus AI.
1.4 Manfaat Penelitian Manfaat penelitian ini yaitu:
1. Memberikan informasi mengenai virus AIpada berbagai spesies unggas. 2. Memberikan informasi mengenai antibodi terhadap virus AI subtipe H5
pada berbagai spesies unggas.
3. Memberikan informasi mengenai hubungan antara cuaca dan keberadaan virus AI.
4. Memberikan informasi geografis asal unggas dengan keberadaan virus AI.
1.5 Hipotesis Hipotesis penelitian ini yaitu:
1. Virus Avian Influenza terdeteksi pada unggas di Pasar Burung Pramuka, Jakarta.
2. Unggas yang diperdagangkan pernah terpapar oleh virus Avian Influenza H5.
3
2. TINJAUAN PUSTAKA
2.1 Virus Influenza A
Virus influenza penyebab penyakit flu adalah virus anggota famili
Orthomyxoviridae (Boyce et al. 2009). Famili Orthomyxoviridae terdiri atas lima genus yaitu Influenzavirus A, Influenzavirus B, Influenzavirus C, Thogotovirus, dan Isavirus (Alexander 2007). Hanya Influenzavirus A yang dapat menginfeksi unggas.
Virus influenza merupakan virus RNA utas tunggal dan memiliki nukleokapsid yang berbentuk heliks dengan dibungkus oleh selubung (envelope) lipoprotein. Bentuk dan ukuran virus influenza bersifat pleiomorfik, berbentuk filamen atau sferoid (bola) dengan diameter 80-120 nm (Harris et al. 2006).
Protein permukaan virus influenza terdiri atas hemaglutinin (HA), Neuramidase (NA) dan Matriks 2 (M2) (Kalthoff et al. 2009). Protein HA trimerisasi berfungsi sebagai protein reseptor dan pengikat yang mengenali terminal asam sialik (sialic acid, SA) tertentu pada permukaan sel spesies (Kalthoff et al. 2009). Virus influenza A manusia memilih untuk terikat pada α -2,6-linked sialic acids (SA), sedangkan virus influenza avian pada α-2,3-linked SA (Kalthoff et al. 2009). Protein NA berfungsi memotong ujung SA dari reseptor sel hospes sehingga progeni virion lepas dari sel. Protein M2 sekaligus berfungsi sebagai
ion channel (Susanti 2008).
Pada bagian dalam, envelope dilapisi oleh protein Matriks 1 (M1) yang mengelilingi delapan kompleks ribonukleoprotein (RNP). Nukleoprotein (NP) merupakan protein yang menyelubungi setiap segmen RNA virus influenza A. Pada virion, RNP dibentuk dari RNA virus, monomer NP, dan tiga protein polymerase : polymerase basic protein 1 (PB 1), polymerase basic protein 2 (PB 2), dan polymerase acidic protein (PA) (Noda et al. 2006 di dalam Kalthoff et al. 2009). Protein non struktural 1 (NS 1) berfungsi mengekspor mRNA virus dari nukleus, menghambat ekspor mRNA seluler, menghambat respon anti virus interferon (IFN), dan menginduksi badai sitokin (sitokines storm). Sedangkan protein non struktural 2 (NS 2) berperan mengeluarkan kompleks RNP virus dari dalam inti (Susanti 2008).
Berdasarkan perbedaan antigenik pada nukleoprotein (NP) dan matriks (M), virus influenza dibagi menjadi influenza tipe A, B dan C (Payungporn et al. 2004). Struktur virus influenza A dan B tidak dapat dibedakan dengan menggunakan mikroskop elektron, keduanya memiliki delapan segmen gen RNA untai tunggal. Kedelapan segmen RNA bersama-sama dengan nukleoprotein membentuk ribonuleoprotein (Munch et al. 2001). Virus influenza C memiliki tujuh segmen gen RNA, karena hanya memiliki satu glikoprotein permukaan, yakni hemaglutinin esterase fusion (HEF), yang berfungsi sebagai pengikat reseptor (H), esterase (E) dan fusi membrane (F) (Whittaker 2001). Hanya virus influenza tipe A yang dapat menyebabkan infeksi secara alami pada unggas (Alexander 2000), sedangkan virus influenza B dan C hampir selalu diisolasi dari manusia walaupun pernah juga diisolasi dari mamalia lain.
menyandi satu protein (PB1, PB2, PA, NA, HA, NP) ada yang lebih dari satu protein (gen NS dan M) (Gambar 1). Gen matriks (M) bersifat sangat lestari (conserved) untuk semua HA dari semua regio geografis sehingga merupakan target deteksi virus AI secara global (Hoffmann et al. 2009; Suarez et al. 2000). Selain itu, regio HA2 menjadi target regio untuk H5 dan H7 TaqMan rRT-PCR karena bersifat relatif lestari (conserved) (Hoffmann et al. 2009).
Gambar 1 Struktur dan segmen-segmen genom virus influenza A (Webster 2001).
Virus influenza A memiliki derajat genetik tinggi dan variasi antigen (Gall
et al. 2009). Virus ini dibagi ke dalam berbagai subtipe berdasarkan analisis serologis dan genetis glikoprotein hemaglutinin (HA) dan neuraminidase (NA) (Alexander 2000, Lee et al. 2001). Sampai saat ini diketahui terdapat 17 subtipe HA (HA1-HA17) dan 9 subtipe NA (NA1-NA9). Unggas liar air merupakan reservoir alami untuk semua 16 hemaglutinin (HA) dan 9 neuraminidase (NA) subtipe virus influenza (Alexander 2007), sedangkan manusia, babi, dan kuda terinfeksi oleh beberapa subtipe yang telah teradaptasi (Gall et al. 2009). Pada tahun 2011, ditemukan subtipe HA terbaru yakni HA17 pada kelelawar-berpundak-kuning (yellow-shouldered bat) di Guatemala (Tong et al. 2012).
2.2 Mutasi Virus AI
Virus RNA seperti influenza A tidak memiliki kemampuan proof reading
selama replikasi sehingga mudah mengalami mutasi, baik pada unggas, manusia maupun spesies lain (Boyce et al. 2009). Berbeda dengan 18 polimerasi DNA yang hanya mempunyai kesalahan 1 dari 109 nukleotida/siklus replikasi, kesalahan replikasi oleh enzim RdRp pada virus RNA adalah 1 dari 104 nukletida/siklus replikasi (Webster et al. 1992). Menurut Chen dan Holmes (2006), virus influenza A memiliki tingkat mutasi yang tinggi yakni 1x10-3 sampai dengan 8x10-3 substitusi/situs/tahun.
5
mutasi nonsinonim/sinonim (ω = d
N/dS) atau disebut juga tekanan selektif, merupakan indikator tekanan seleksi pada level protein. Nilai ω=1 berarti seleksi
netral, ω<1 berarti terjadi seleksi pemurnian (purifying selection) dan ω>1 berarti
terjadi seleksi positif (Susanti 2008). Analisis genom VAI subtipe H5N1 yang menginfeksi unggas dan manusia dari tahun 1997-2004 menunjukkan bahwa gen PB2, HA dan NS1 mengalami tekanan seleksi positif, sementara gen lainnya (PA, PB1, M, NA, NS2, NP) mengalami tekanan seleksi pemurnian (Campitelli et al. 2006). Hal ini menunjukkan bahwa gen Matriks lebih banyak mengalami mutasi sinonim dibandingkan mutasi nonsinonim, sedangkan gen HA lebih banyak mengalami mutasi nonsinonim dibandingkan mutasi sinonim. Hal ini juga menunjukkan bahwa gen Matriks lebih conserved dibandingkan gen HA.
Gen Matriks (1027 pasang basa) mengkode protein matriks 1 (M1) pada posisi nukleotida 26 -784 dan protein membran (M2) pada posisi nuklotida 26-51 dan 740-1.007 (Furuse et al. 2009). Tekanan selektif (ω) terhadap keseluruhan sekuens M adalah 0.13, sedangkan untuk M1 dan M2 adalah 0.06 dan 0.45 secara berturut-turut (Furuse et al. 2009). Nilai ω yang lebih rendah pada M1 dibandingkan M2 menunjukkan bahwa protein Matriks lebih jarang mengalami mutasi dibandingkan M2 yang berperan sebagai ion channel.
Tingkat evolusi (kecepatan mutasi) gen Matriks untuk virus AI dari garis keturunan Amerika Utara adalah 1.63 × 10-4 substitusi/situs/tahun, sedangkan virus AI dari garis keturunan Asia adalah 5.76 × 10-4 substitusi/situs/tahun (Furuse
et al. 2009). Kecepatan mutasi HA kira-kira 2x10-3 nukleotida/posisi/replikasi (Webster et al. 1992), sedangkan menurut Bush et al. (1999), kecepatan substitusi nonsinonim gen HA 1 VAI subtipe H3 adalah sebesar 5,7 x 10-3/situs/tahun. Kecepatan mutasi HA ini lebih tinggi dibandingkan NA (Susanti 2008) dan M.
Antigen permukaan yang dimiliki virus influenza dapat berubah secara periodik yang lebih dikenal dengan istilah antigenic drift dan antigenic shift. Antigenic drift merupakan perubahan secara periodik yang terjadi akibat mutasi genetik struktur protein permukaan virus sehingga antibodi yang telah terbentuk oleh tubuh akibat vaksinasi sebelumnya tidak dapat mengenali keberadaan virus tersebut (Munch et al. 2001). Antigenic shift merupakan perubahan genetik virus yang memungkinkan munculnya strain baru dan kemampuan virus untuk menginfeksi secara lintas spesies (Murphy et al. 1999). Selain itu, karena genom virus AI adalah RNA bersegmen maka infeksi campuran beberapa virus influenza dalam satu host dapat menyebabkan reasortment (Dugan et al. 2008).
Akibat mutasi dan reasortment, pada HPAI H5N1 yang bersirkulasi di Asia terdapat empat genotipe utama (Z, V, W, G) dengan garis keturunan (lineage) yang beragam. Semua strain H5N1 Asia dapat dikelompokkan pada satu
clade yang sama karena gen H5-nya berasal dari nenek moyang yang sama (A/Goose/Guangdong/1/96 H5N1) (Xu et al. 1999). Namun, semua virus HPAI H5N1 Asia berbeda nyata dengan virus LPAI H5N1 yang bersirkulasi di unggas liar Amerika Utara (Boyce et al. 2009).
dan reasortment virus influenza A pada manusia telah bersifat endemik walaupun tanpa introduksi virus atau elemen genetik dari unggas (Boyce et al. 2009).
2.3 Patogenisitas Avian Influenza
Berdasarkan patogenitasnya, virus Avian Influenza dapat dibedakan menjadi dua kelompok yaitu virus Avian Influenza berpatogenitas tinggi (Highly Pathogenic Avian Influenza/HPAI) dan virus Avian Influenza berpatogenitas rendah (Low Pathogenic Avian Influenza/LPAI) (Alexander 2000).
2.3.1 Highly Pathogenic Avian Influenza
Definisi HPAI terkait dengan virulensi VAI pada ayam. Tingkat mortalitas HPAI dapat mencapai 100%, dan biasanya berasal dari subtipe H5 dan H7 (Alexander 2000, Alexander 2007, Bavink et al. 2009), walaupun tidak semua H5 dan H7 bersifat HPAI. Karena terdapat kemungkinan mutasi dari LPAI H5 dan H7 menjadi HPAI, maka semua H5 dan H7 harus dilaporkan (OIE 2009). Pada tahun 1999-2000, industri perunggasan Italia terkena epidemi HPAI subtipe H7N1 (Busani et al. 2008), sedangkan industri perunggasan Belanda terinfeksi HPAI subtipe H7N7 pada tahun 2003 (Bavink et al. 2009).
Virus HPAI relatif jarang terisolasi dari unggas liar dan unggas air. Namun pada tahun 2012 terjadi wabah HPAI H5N1 pada peternakan bebek di Indonesia. Perubahan patogenitas virus AI dapat terjadi karena perubahan pada proteolytic cleavage site hemaglutinin, termasuk 1) substitusi asam amino non-basic dengan asam amino basic (arginin atau lisin), 2) insersi asam amino basic, 3) rekombinasi dengan insert dari segmen gen lain sehingga memperpanjang cleavage site, 4) hilangnya penahan situs glikosilasi pada residu-13 disertai asam-amino basic
multiple pada cleavage site (OIE 2009).
Suatu strain dinyatakan bersifat HPAI apabila menyebabkan kematian sebanyak 75% dari 10 ekor ayam berusia 4-8 minggu dalam 10 hari sehingga menghasilkan Indeks Patogenisitas Intravena (IPIV) yang lebih besar dari 1,2 (OIE 2009). Uji indeks patogenitas intravena dilakukan dengan menginfeksikan virus AI pada ayam (SPF) berumur 4-8 minggu. Virus yang digunakan berasal dari cairan alantois segar dengan titer HA > 24 yang diencerkan dalam 1/10 cairan fisiologis. Sebanyak 0.1 ml virus yang telah diencerkan disuntikkan secara intravena pada 10 ekor ayam berumur 4-8 minggu. Pengamatan dilakukan dengan interval 24 jam selama 10 hari, dan ayam diberi skor 1 jika sakit, 2 jika sakit parah, dan 3 jika mati. Ayam dinyatakan sakit (skor 1) jika menunjukkan salah satu gejala klinis, sedangkan dinyatakan sakit parah (skor 2) jika menunjukkan lebih dari satu gejala klinis sebagai berikut: infeksi pernafasan, depresi, diare, cyanosis, udema wajah/kepala, dan gejala saraf. Indeks Patogenitas Intravena merupakan rataan skor/ayam/observasi selama periode 10 hari. Nilai IPIV 3.00 menunjukkan bahwa semua ayam mati dalam 24 jam, sedangkan nilai 0.00 menunjukkan bahwa tidak ada unggas yang menunjukkan gejala klinis selama 10 hari masa observasi (OIE 2009).
7
dalam waktu singkat. Sejak tahun 2002, HPAI H5N1 menjadi penyakit emerging
di Asia. HPAI H5N1 lebih banyak terisolasi pada saluran pernafasan (trachea) dibandingkan gastrointestinal, sehingga hal tersebut mempengaruhi transmisi virus (inhalasi vs. fekal-oral), maupun pemilihan koleksi sampel (orofaring/trachea vs. kloaka) (Boyce et al. 2009).
Secara molekuler, HPAI dapat ditentukan patotipenya berdasarkan analisa sekuens cleavage site antara protein prekursor HA0 (OIE 2007, Alexander 2007).
Virus HPAI mengalami perubahan susunan asam amino pada cleavage site HA yang mempengaruhi replikasi virus (Boyce et al. 2009). Virus HPAI, dengan beberapa pengecualian, memiliki asam amino polibasik (arginin dan lisin) pada HA0 cleavage site, sehingga dapat dipecah oleh ubiquitous subtilisin-like protease
secara intraseluler (Perdue dan Suarez 2000 di dalam Gall et al. 2009). Virus HPAI dapat bereplikasi pada seluruh organ unggas sehingga menyebabkan kerusakan serius pada jaringan maupun organ sehingga menyebabkan kematian (Alexander 2007).
2.3.2 Low Pathogenic Avian Influenza
Burung liar air merupakan reservoir LPAI (Gall et al. 2009). Wabah virus Avian Influenza sangat patogen/Highly Pathogenic Avian Influenza (HPAI) pada unggas komersil diduga berasal dari virus Low Pathogenic Avian Influenza
(LPAI) pada unggas liar (Cheung et al. 2009). Transmisi LPAI subtipe H5 dan H7 pada unggas Gallinaceous, dapat menimbulkan HPAI, yang menyebabkan infeksi sistemik yang parah dan epidemi penyakit dengan tingkat kematian yang tinggi (Gall et al. 2009).
Gejala klinis dari LPAI tidak terlalu nyata. Infeksi pada LPAI terlokalisir pada pernapasan dan saluran pencernaan (Gall et al. 2009). Ditinjau dari segi molekuler, virus LPAI memiliki komposisi asam amino monobasik pada HA0 cleavage site, dan HA0-nya terbelah secara ekstrasel oleh jaringan-spesifik
protease, seperti tripsin (Perdue dan Suarez 2000 di dalam Gall et al. 2009).
2.4 Virus Avian Influenza pada Unggas Liar dan Pasar Unggas
Virus Avian Influenza (VAI) terutama menyerang berbagai macam unggas seperti ayam, kalkun, angsa, unggas air, burung laut, dan burung liar (Boyce et al. 2009). Selain unggas, beberapa subtipe VAI dapat menyerang manusia, primata, babi, musang, kuda, sapi, anjing laut, dan paus (Whitworth et al. 2007, Cardona et al. 2009).
Virus Avian influenza telah diisolasi dari sedikitnya 105 spesies burung liar dari 26 famili yang berbeda (Perez-Ramirez et al. 2010). Unggas air, yaitu itik, entok dan angsa, merupakan inang alami virus influenza A (Cheung et al. 2009, Boyce et al. 2009). Unggas liar, terutama unggas air, diketahui sebagai reservoir virus AI karena semua H1-16 dan N1-9 dapat ditemukan pada unggas liar (Boyce et al. 2009, Cardona et al. 2009). Umumnya virus AI yang terdeteksi pada unggas liar bersifat low pathogenic dan menyerang saluran gastrointestinal (Boyce et al. 2009).
rendahnya rasio substitusi N/S (Taubenberger et al. 2005). Antara hospes dengan virus terjadi toleransi yang seimbang, sehingga walaupun virus bereplikasi namun inang tidak menunjukkan gejala klinis. Virus bereplikasi di saluran pencernaan unggas air, sehingga ekskresi virus bersama feses dapat ditransmisikan ke unggas atau mamalia lain melalui feses atau secara oral (Sturm-Ramirez et al. 2004).
Isolasi virus influenza pertama dari unggas feral (Sterna hirundo)
dilakukan pada tahun 1961 di Afrika Selatan (Alexander 1995). Pada tahun 1970an dilakukan investgasi yang menunjukkan bahwa terdapat pool virus yang besar pada populasi unggas liar (Alexander 1995).
Survei oleh Stallknecht dan Shane (1988) menunjukkan bahwa dari 21.318 sampel yang berasal dari berbagai spesies unggas terisolasi 2.317 (10.9%) virus. Dari sampel tersebut, 14.303 sampel berasal dari Ordo Anseriformes, dengan hasil positif 2.173 isolat (15.2%). Tingkat isolasi tertinggi selanjutnya berasal dari unggas ordo Passeriformes dan Charadriiformes (2.9% dan 2.2%). Faktor yang berperan penting dalam tingkat isolasi virus influenza pada unggas liar yaitu (1) usia unggas, (2) lokasi geografis terkait migrasi, (3) waktu pengambilan sampel dalam tahun tersebut, (4) spesies unggas, and (5) karakteristik virus (Alexander 1995).
Strain patogenik virus AI H5N1 hanya menyebabkan gejala klinis ringan pada itik, tetapi unggas dapat tetap mengekskresikan virus (viral shedding) bersama kotorannya sehingga berpotensi menyebarkan virus yang bersifat patogenik bagi unggas lain dan juga manusia (Hulse-Post et al. 2005). HPAI jarang terisolasi dari unggas liar, namun tingkat isolasi yang tinggi dapat ditemukan pada bebek dan angsa (15%) dan hanya 2% pada spesies yang lain (Alexander 2000). Virus HPAI H5N1 berhasil terisolasi dari angsa (prevalensi 2%) dan bebek (prevalensi 4%) (Nguyen et al. 2005). Ordo Colombiformis yang secara eksperimental diinfeksi virus HPAI H5N1 lebih resisten dibandingkan ayam (Perkins dan Swayne 2002). Psittaciformes dapat terinfeksi LPAI, walaupun jarang (Cardona et al. 2009).
Salah satu unggas air, yaitu itik, dianggap sebagai sumber virus AI H5N1 pada wabah di Cina tahun 2000-2004 dan Hongkong tahun 2001 (Susanti 2008). Unggas air yang bermigrasi diduga kuat sebagai pembawa virus HPAI subtipe H5N1 (Perez-Ramirez et al. 2010), terutama setelah terjadinya wabah di Danau Qinghai, Cina yang menyebabkan kematian ribuan burung liar (Chen et al., 2005, Boyce et al. 2009).
Beberapa spesies unggas seperti Mallard (Anas platyrhinchos) mampu bertahan dari infeksi H5N1 dan terjangkit virus selama periode waktu tertentu, sehingga menjadi diduga kuat sebagi spesies pembawa HPAI H5N1 pada proses transmisi jarak jauh (Keawcharoen et al. 2008). Namun, peran unggas air dalam penyebaran H5N1 masih belum jelas (Perez-Ramirez et al. 2010).
9
Selain di peternakan dan alam, studi mengenai VAI dilakukan di pasar unggas hidup dan pasar makanan. Studi pada pasar unggas hidup dan pasar makanan di Thailand tahun 2006-2007 menunjukkan bahwa VAI H5N1 terisolasi pada 12 dari 930 sampel yang diuji (Amonsin et al. 2008). Sampel yang positf berupa sampel daging (5 ekor puyuh, 2 ekor mandar, dan 2 ekor ayam-ayaman maupun unggas sehat (satu ayam dan dua bebek). Analisa filogenetik menunjukkan bahwa VAI H5N1 termasuk dalam garis keturunan (lineage) Vietnam dan Thailand (clade 1) dan berkorelasi erat dengan virus yang beredar di Thailand tahun 2004-2005 (Amonsin et al. 2008)
2.5 Diagnosa Laboratorium untuk Avian Influenza
Diagnosa laboratorium untuk Avian Influenza dapat dilakukan dengan mendeteksi antibodi atau mendeteksi virus. Diagnosa serologis untuk mendeteksi antibodi terhadap AI dapat dilakukan menggunakan uji Hemaglutinasi Inhibisi (HI), Agar Gel Immunodiffusion Test (AGID) atau Enzyme Linked Immunosorbent Assay (ELISA). Metode untuk mendiagnosa virus dapat dilakukan melalui isolasi virus, rapid antigen detection, Reverse Transcriptase-Polymerase Chain Reaction
(RT-PCR) konvensional, realtime RT-PCR (rRT-PCR), dan Nucleic acid sequence based amplification (NASBA) (Suarez 2003). Beberapa metode lain yang sedang berkembang yaitu Microarray (Gall et al. 2009) dan Loop Mediated Isothermal Amplification (LAMP). Dalam penelitian ini, metode uji serologis yang akan digunakan adalah HI, sedangkan deteksi virus akan menggunakan rRT-PCR.
2.5.1 Uji Hemaglutinasi Inhibisi
Uji Hemaglutinasi Inhibisi (HI) merupakan metode yang direkomendasikan untuk uji spesifik terhadap suatu subtipe virus AI (FAO 2007). Uji ini dapat digunakan untuk pemantauan respon terhadap vaksinasi dan untuk memantau sirkulasi virus pada unggas yang bertahan terhadap infeksi, misalnya LPAI dan HPAI pada bebek (FAO 2007).
Virus influenza memiliki protein amplop yang disebut hemaglutinin (HA). Hemaglutinin dapat berikatan dengan reseptor sialik pada sel, termasuk pada sel darah merah (red blood cell, RBC). Apabila HA berikatan pada RBC maka akan terjadi hemaglutinasi yang ditandai dengan terbentuknya butir-butir menyerupai pasir. Apabila RBC tidak berikatan dengan virus influenza, maka RBC akan mengendap pada dasar well (Capua dan Alexander 2009). Uji ini dilakukan dengan pengenceran bertingkat dan berlangsung selama kira-kira 40 menit sehingga merupakan indikator cepat untuk mengetahui kuantitas relatif partikel virus.
ayam terkandung HA nonspesifik sehingga sebelum dilakukan uji HI perlu diberi perlakuan dengan RBC ayam terlebih dulu. Selain itu, perlu dilakukan inaktifasi terhadap serum melalui pemanasan dalam penangas air pada suhu 56oC selama 30 menit (Capua dan Alexander 2009).
2.5.2 Real time Reverse Transcriptase Polymerase Chain Reaction (rRT-PCR)
Reaksi berantai polymerase (Polymerase Chain Reaction, PCR) adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu secara in vitro (Yuwono 2006). Metode PCR memungkinkan terjadinya pelipatgandaan suatu fragmen DNA (110 bp, 5x10-19 mol) sebesar 200.000 kali setelah dilakukan 20 siklus reaksi selama 220 menit (Yuwono 2006). Kelebihan reaksi ini yaitu dapat dilakukan menggunakan komponen yang sangat sedikit, misalnya DNA cetakan yang diperlukan hanya sekitar 5 µg dan oligonukleotida yang diperlukan hanya sekitar 1 mM (Yuwono 2006). Virus AI merupakan virus RNA (Boyce et al. 2009), maka perlu dilakukan transkripsi balik (reverse transcription, RT) terhadap molekul RNA sehingga diperoleh
complementary DNA (cDNA) yang digunakan sebagai cetakan (template) dalam proses PCR (Yuwono 2006).
Teknik real time RT-PCR (rRT-PCR) merupakan hasil pengembangan RT-PCR konvensional yang memungkinkan dilakukan pemonitoran amplifikasi DNA pada saat proses amplifikasi berlangsung (real time). Dibandingkan PCR konvensional, rRT-PCR lebih menguntungkan dari segi sensitivitas dan spesifisitas, bersifat kuantitatif, lebih cepat, dan lebih ramah lingkungan. Walaupun biaya investasi peralatan lebih mahal, namun biaya operasional dan pengamanan lingkungan memerlukan biaya yang lebih sedikit (Aminah 2012).
Real time PCR disebut juga PCR kinetik dan bersifat kuantitatif. Secara teori, terdapat hubungan kuantitatif antara jumlah DNA awal (sekuen target) dan jumlah produk PCR untuk setiap siklus PCR. Amplifikasi pada rRT-PCR dideteksi berdasarkan pancaran sinar flouresen yang digunakan sebagai indikator amplifikasi DNA (Artika 2008). Hasil rRT-PCR berupa Ct (cycle threshold) yang merupakan perpotongan antara kurva amplifikasi (siklus PCR) dimana floresen yang dihasilkan memotong garis threshold, atau garis ambang deteksi. Nilai Ct dapat menggambarkan konsentrasi relatif target PCR. Pada rRT-PCR menggunakan TaqMan Probe, proses ekstensi amplikon menyebabkan reporter
(R) dan quencher (Q) pada probe terpisah sehingga floresen tereksitasi (Gambar 2).
11
Gambar 2 rRT-PCR menggunakan TaqMan Probe.
Proses ekstensi amplikon menyebabkan reporter berfloresen (F) dan
quencher (Q) sehingga floresen terksitasi.
Tahap ekstraksi RNA menjadi tahap yang penting karena RNA dengan kualitas yang tinggi diperlukan untuk mengoptimalkan hasil uji. Beberapa sampel, seperti sampel feses, usap kloaka dan usap orafaring sulit untuk diproses, karena hasil ektraksi RNA yang kurang baik atau adanya faktor inhibitor (Suarez et al. 2007). Pengembangan kontrol internal, sistem robotik dan penggunaan reagen bead menunjukkan hasil yang lebih baik dibandingkan metode sebelumnya.
Deteksi influenza A menggunakan rRT-PCR biasanya mentarget regio yang lestari (conserved) seperti Matriks, Nukleoprotein atau gen Nonstruktural. Berbagai primer untuk mendeteksi subtipe influenza A seperti H5 dan H7 juga telah dikembangkan. Spackman et al. (2002) pertama kali mengembangkan teknik rRT-PCR untuk influenza A, subtipe H5 dan H7. Dalam pengujiannya untuk mendeteksi influenza A digunakan sistem one-step rRT-PCR serta primer dan probe yang mendeteksi regio lestari ujung 5’ segmen gen 7 (Matriks 1/M1) dengan panjang 100 nukleotida. Guna mendeteksi subtipe H5 dan H7, primer dan probe dirancang untuk mendeteksi region lestari subunit HA2 virus AI Amerika
Utara (Spackman et al. 2002).
Limit deteksi rRT-PCR terhadap gen matriks (M1) adalah sebesar 10 femtogram (fg, 1 fg = 10-15 gram) atau sekitar 103 kopi target RNA dan dapat mendeteksi virus hingga 0.1 EID50 (50% egg infective dose) (Spackman et al.
2002, Lee dan Suarez 2004). Sedangkan limit deteksi rRT-PCR untuk H5 dan H7 mencapai 100 fg target RNA atau 103-104 kopi gen (Spackman et al. 2002). Namun, tingkat kesepakatan antara pengujuan rRT-PCR matriks dan isolasi virus pada telur ayam berembrio (TAB) tidaklah 100% (Spackman et al. 2002, Elvinger
et al. 2007). Pada kasus wabah LPAI H7N1 di Virginia tahun 2007, sensitivitas diagnostik relatif rRT-PCR terhadap isolasi virus pada TAB adalah 85%, dengan probabilitas 95% dan interval 71,9%-95.7%, sedangkan spesifisitas diagnostik relatifnya adalah 98.9% dengan probabilitas 95% dan interval 98.0%-99.5% (Elvinger et al. 2007). Sedangkan menurut Spackman et al. (2002), spesifisitas relatif antara rRT-PCR dan isolasi virus pada TAB adalah 89%.
Tabel 1 Pasangan primer dan probe untuk mendeteksi gen AI
Target Primer/Probe Urutan basa (5’-3’) Amerika Utara dan Eurasia (Spackman et al. 2002)
Gen M1 M +25 AGA TGA GTC TTC TAA CCG AGG TCG
M -124 TGC AAA AAC ATC TTC AAG TCT CTG
M +64 FAM-TCA GGC CCC CTC AAA GCC GA-TAMRA
Gen H5 (HA2) H5 +1456 ACG TAT GAC TAT CCA CAA TAC TCA G
H5 -1685 AGA CCA GCT ACC ATG ATT GC
H5 +1637 FAM-TCA ACA GTG GCG AGT TCC CTA
GCA-TAMRA
Qinghai lineage yang terjadi di Eropa (Hoffmann et al. 2007) Gen H5
(cleavage site
HA1 dan HA0)
FliH5-1028F GGG GAA TGC CCC AAA TAT GT
FliH5-1190R TCT ACC ATT CCC TGC CAT CC
FliH5-CS-FAM
FAM-AGA GAG AAG AAG AAA AAA GAG AGG ACT A-TAMRA
FliH5-1148-HEX
HEX-TTG GAG CTA TAG CAG GTT TTA TAG AGG-BHQ1
Eurasia (Loendt et al. 2008)
Gen H5 (HA2) H5LH1 ACA TAT GAC TAC CCA CARTAT
TCAG
H5RH1 AGA CCA GCT AYC ATG ATT GC
H5PRO FAM-TCW ACA GTG GCGAGT TCC CTA
13
2.6 Studi Cross-Sectional
Studi cross sectional adalah studi deskriptif dimana penyakit dan status paparan penyakit diukur secara bersamaan dalam suatu populasi tertentu (CDPH 2009). Penelitian cross sectional dapat menyediakan gambaran singkat frekuensi dan karakteristik penyakit dalam suatu populasi pada titik waktu tertentu. Studi ini mengambil satu titik pengumpulan data untuk setiap peserta atau sistem yang dipelajari dan digunakan untuk mempelajari fenomena yang diharapkan tetap statis selama periode studi (Miller-Keane dan O’Toole 2003).
15
3. METODE PENELITIAN
3.1 Bahan dan Alat
Dalam pengambilan sampel, bahan dan alat yang diperlukan yaitu media transport berupa Brain Heart Infusion (BHI) dalam tabung berukuran 2 ml, sampel usap steril, syringe, kapas dan alkohol 70%.
Peralatan yang diperlukan selama pemerikasaan di laboratorium yaitu
biosafety cabinet (BSC), vortex, sentrifus, mikropipet, tips, alkohol, desinfektan, plat ekstraksi 96 sumuran, plat mikrotirasi 96 sumuran berdasar V, kulkas, freezer -20oC dan freezer -80oC.
Pemeriksaan sampel dilakukan menggunakan real time RT-PCR dan uji Hemaglutinasi Inhibisi (HI). Isolasi RNA virus dilakukan menggunakan MagMAXTM AI/ND Viral RNA Isolation kit dari Ambion®, plat ekstraksi 96 sumuran, dan magnetic stand. Alat dan Bahan untuk pengujian real time RT-PCR yaitu Ag-Path IDTM One-Step RT-PCR kit dari Ambion® dengan plat optik 96 sumuran pada mesin Applied Biosystem 7500 Real Time PCR System.
Pada pengujian HI diperlukan larutan phosphate buffer saline (PBS) pH 7.2, red blood cell (RBC) ayam, plat mikrotitrasi 96 sumuran berdasar V, plat sentrifus, kontrol serum positif (A/Legok/SGT/1/2004 (H5N1) dari PT IPB-Shigeta Animal Pharmaceuticals dan A/Ck/West Java/PWT-Wij/2006 (H5N1) dari Balai Besar Penelitian dan Veteriner, Bogor) serta antigen H5 standar (A/Legok/IPB-SGT/1/2004 (H5N1) dari PT IPB-Shigeta Animal Pharmaceuticals dan A/Ck/West Java/PWT-Wij/2006 (H5N1) dari Balai Besar Penelitian dan Veteriner, Bogor).
3.2 Tempat dan Waktu Penelitian
Pengambilan sampel untuk dianalisa pada penelitian ini dilaksanakan di Pasar Burung Pramuka, Jakarta secara cross-sectional pada bulan April sampai dengan September 2011. Pemeriksaan sampel dilaksanakan di Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB) pada bulan Oktober 2011 sampai dengan Juni 2012.
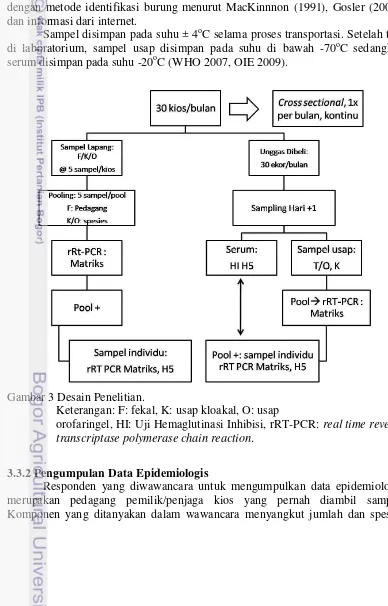
3.3 Desain Penelitian 3.3.1 Pengambilan Sampel
Pengambilan sampel dilakukan terhadap 30 kios secara cross sectional
Sampel usap orofaringeal/trakeal, kloakal dan fekal diambil menggunakan tip steril berbahan polyester dan disimpan di dalam tabung berisi Brain Heart Infusion (BHI) sesuai metode oleh National Veterinary Services Laboratories
(NVSL) (Killian 2008). Protein di dalam media transport virus dapat mencegah degradasi virus hidup selama penanganan dan transportasi ke laboratorium. Sampel darah dari unggas yang dibeli disimpan di dalam syringe sebelum dibawa ke laboratorium. Semua sampel diberi kode berdasarkan waktu pengambilan sampel, pedagang, jenis sampel dan spesies unggas (Whitworth et al. 2007). Identifikasi unggas dilakukan berdasarkan informasi pedagang yang dicocokkan dengan metode identifikasi burung menurut MacKinnnon (1991), Gosler (2007), dan informasi dari internet.
Sampel disimpan pada suhu ± 4oC selama proses transportasi. Setelah tiba di laboratorium, sampel usap disimpan pada suhu di bawah -70oC sedangkan serum disimpan pada suhu -20oC (WHO 2007, OIE 2009).
Gambar 3 Desain Penelitian.
Keterangan: F: fekal, K: usap kloakal, O: usap
orofaringel, HI: Uji Hemaglutinasi Inhibisi, rRT-PCR: real time reverse transcriptase polymerase chain reaction.
3.3.2 Pengumpulan Data Epidemiologis
17
unggas yang masuk dan dijual, asal unggas, cara memperoleh unggas (dari penangkaran/tangkapan), dan lama unggas dipelihara oleh pedagang.
Sumber data cuaca diperoleh dari Bagian Database Badan Meteorologi, Klimatologi, dan Geofisika (BMKG) Republik Indonesia. Adapun data cuaca yang dikaji yaitu rataan suhu bulanan, rataan kelembapan bulanan, dan rataan curah hujan bulanan yang dikoleksi oleh stasiun Priok, Jakarta.
3.3.3 Pemeriksaan Laboratorium
Sampel usap kloakal, orofaringeal dan fekal akan diuji terhadap keberadaan matriks dan H5 virus Avian Influenza (VAI) dengan menggunakan teknik real time reverse transcriptase polymerase chain reaction (rRT-PCR). Sampel serum akan diperiksa menggunakan uji Hemaglutinasi Inhibisi (HI) untuk mengetahui keberadaan antibodi terhadap VAI H5. Pemeriksaan dilakukan di Bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
3.3.3.1 Pooling
Sampel usap dikelompokkan berdasarkan jenis sampel (sampel usap kloakal, usap orofaringeal dan fekal) dan pedagang. Setiap kelompok/pool berisi maksimal 5 sampel (NVSL 2008) dimana dari setiap sampel diambil 100 µl selanjutnya dihomogenkan dengan vorteks. Setiap pool diperiksa menggunakan uji tapis terhadap keberadaan Matriks VAI. Apabila terdapat pool yang positif Matriks VAI, maka dilakukan pengujian H5 terhadap setiap sampel individu dalam pool tersebut.
3.3.3.2 Isolasi RNA
Isolasi RNA dilakukan menggunakan kit Isolasi MagMAXTM AI/ND Viral RNA dari Ambion®. Sebanyak 50 µl sampel dimasukkan ke dalam 100 µl buffer lisis pada plat ekstraksi 96 sumuran. Selanjutnya ditambahkan larutan beads
(manik-manik sangat kecil yang bersifat paramagnetik untuk mengikat RNA) sebanyak 20 µl, diagitasi selama 4 menit, dan didiamkan di atas magnetic stand
(lempeng magnetik yang berfungsi mengendapkan beads paramagnetik ke dasar plat) selama 2 menit. Supernatan dibuang dengan cara disedot dengan mikropipet. Plat diturunkan dari magnetic stand lalu ditambahkan 100 µl wash buffer I (buffer pencuci I), diagitasi selama 30 detik dan didiamkan di atas magnetic stand selama 1 menit. Setelah itu, supernatan dibuang menggunakan mikropipet. Proses pencucian ini dilanjutkan menggunakan wash buffer II sebanyak dua kali. Pada tahap selanjutnya beads diagitasi selama 2 menit agar kering. RNA dielusi menggunakan 50 µl elution buffer kemudian plat diagitasi selama 3 menit lalu didiamkan di atas magnetic stand selama 1 menit untuk mengendapkan beads. Supernatan yang berisi RNA diambil dan dipindahkan ke dalam plat 96 sumuran yang baru. RNA tersebut digunakan sebagai cetakan (template) PCR atau disimpan pada suhu -80oC sampai digunakan (Desiliyarni 2006).
3.3.3.3 Real Time RT-PCR
Tabel 2 Campuran rRT-PCR
Tabel 3 Primer dan probe yang digunakan
Sekuens Referensi
Primer matriks forward
M+25* 5’
5’-AgATgAgTCTTCTAACCgAggTCg-3’ Heine et al. 2005, NVSL 2008
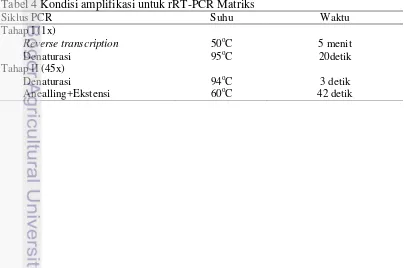
Ke dalam setiap sumur plat optik 96 sumuran dimasukkan 12 µl campuran PCR lalu ditambahkan 8 µl template hasil isolasi (NVSL 2008). Plat ditutup dengan segel optik kemudian ditempatkan pada mesin Applied Biosystems 7500 Real Time PCR System dengan kondisi suhu amplifikasi untuk gen Matriks (Tabel 4) atau H5 (Tabel 5).
Tabel 4 Kondisi amplifikasi untuk rRT-PCR Matriks
Siklus PCR Suhu Waktu
Tahap I (1x)
Reverse transcription 50oC 5 menit
Denaturasi 95oC 20detik
Tahap II (45x)
Denaturasi 94oC 3 detik
19
Tabel 5 Kondisi amplifikasi untuk rRT-PCR H5
Siklus PCR Suhu Waktu
Tahap I (1x)
Reverse transcription 50oC 5 menit
Denaturasi 95oC 20detik
Serum dari spesies selain ayam kadangkala menunjukkan hasil positif yang nonspesifik sehingga perlu dilakukan adsorbsi serum menggunakan RBC ayam. Sebanyak 0.025 ml RBC ayam ditambahkan ke 0.5 ml serum spesies non ayam, dihomogenkan dan diinkubasi selama 30 menit. Selanjutnya, RBC diendapkan melalui sentrifugasi 800 g selama 5 menit dan serum yang diadsorbsi dipisahkan (OIE 2009). Sebelum diuji HI, serum diinaktifasi melalui pemanasan pada penangas air dengan suhu 56oC selama 30 menit (Kalthoff et al. 2008; Capua dan Alexander 2009).Uji Hemaglutinasi Inhibisi dilakukan sesuai dengan metode OIE 2009, sebagai berikut:
1. Sebanyak 25 µl PBS dimasukkan ke dalam setiap sumur plat mikrotitrasi 96 sumuran berdasar V, sumur 1-12.
2. Sebanyak 25 µl serum dimasukkan ke sumur pertama.
3. Pengenceran bertingkat dua kali dilakukan dengan memasukkan 25 µl serum dari sumur 1 ke sumur 2 dan dihomogenkan. Selanjutnya sebanyak 25 µl serum dari sumur kedua dipindahkan ke sumur ketiga, demikian seterusnya. Hal yang sama juga dilakukan terhadap kontrol serum positif. 4. Sebanyak 25 µl 4 HAU antigen standar dimasukkan ke setiap sumur dan
diinkubasi selama 30 menit pada suhu ruang.
5. Sebanyak 25 µl RBC 1% (v/v) ditambahkan ke setiap sumur dan dihomogenkan. Larutan diinkubasi selama 40 menit pada suhu ruang
(20oC) atau sampai kontrol RBC (hanya berisi 25 µl RBC 1% (v/v) dan 50 µl PBS) telah mengendap dan membentuk formasi seperti “kancing”. 6. Titer HI merupakan pengenceran tertinggi dimana serum dapat secara
sempurna menginhibisi antigen sebanyak 4 HAU. Aglutinasi dinilai dengan memiringkan plate. Hasil dinyatkan positif jika tidak terjadi aglutinasi dan negatif jika terjadi aglutinasi. Hasil divalidasi dengan
kontrol negatif dan kontrol serum positif ((A/Legok/IPB-SGT/1/2004 (H5N1) dan A/Ck/West Java/PWT-Wij/2006 (H5N1)).
3.4 Analisa Data
21
4. HASIL
4.1 Kondisi Pasar Burung Pramuka, Jakarta
Pasar Burung Pramuka teletak di wilayah Jakarta Timur. Lokasi pasar ini cukup strategis karena dari depan dapat diakses dari Jl. Pramuka, Jl. Matraman, Jl. Rawamangun dan Jl. Salemba. Sedangkan dari belakang, pasar ini dapat diakses dari Jl. Pembina, Jl. Penggalang, Jl. Utan Kayu dan Kayu Manis (Gambar 4).
Gambar 4 Lokasi Pasar Burung Pramuka, Jakarta Timur (maps.google.com).
Pasar Burung Pramuka didirikan sejak tahun 1976 dan merupakan pasar burung terbesar di Jakarta dengan luas lahan 5320 m2 dan luas bangunan 5500 m2. Pasar Burung Pramuka terbagi dalam dua area, yaitu area lama dan baru. Area lama hanya terdiri atas satu lantai sedangkan area baru terletak di sebelah timur dan terdiri atas empat lantai. Pada tahun 2011 tercatat terdapat 289 kios dan 152 pedagang di Pasar Burung Pramuka. Luas setiap kios beragam, mulai 3 m2 sampai dengan 12 m2 untuk setiap kios. Pasar Burung Pramuka dikelola oleh PD. Pasar Jaya dan berada di bawah Binaan Suku Dinas Peternakan dan Perikanan, Kota Administrasi Jakarta Timur (PD Pasar Jaya 2011).
Unggas yang dijual di Pasar Burung Pramuka, Jakarta sangat beragam dan dapat dibagi menjadi beberapa kelompok, yaitu
a. Ayam hias atau ayam hobi, adalah unggas yang termasuk dalam Genus
Gallus, yang memiliki penampilan fisik yang indah atau suara yang khas, serta biasanya dipelihara untuk kontes, dinikmati keindahan suaranya atau sebagai hobi. Komoditi yang dapat ditemukan di Pasar Burung Pramuka, yaitu ayam bangkok, arab, cemani, serama, bekisar, kapas, kate, keriting, kedu, ketawa, mutiara, dan pelung.
b. Unggas air, adalah unggas yang termasuk dalam Ordo Anseriformis yang secara umum hidup di air atau sekitarnya (Whitworth et al. 2007). Komoditi yang dapat ditemukan di Pasar Burung Pramuka, yaitu bebek, angsa, belibis, dan entok.
c. Unggas lahan basah, adalah burung yang berhabitat di air tawar atau pesisir pantai yang secara berkala tertutup air. Lahan basah dapat dibedakan berdasarkan keberadaan substrat, kadar garam, frekuensi genang, dan vegetasinya sehingga mempengaruhi keberadaan spesies burung di habitat tersebut (Whitworth et al. 2007). Komoditi yang dapat ditemukan di Pasar Burung Pramuka, yaitu kuntul, kruwok, blekok sawah, dan mandar.
d. Burung perantara (bridges species), adalah burung yang tidak mempunyai ketergantungan yang kuat terhadap habitat lahan basah dan mempunyai toleransi yang tinggi untuk beradaptasi dengan habitat-habitat yang telah diubah oleh manusia karena kepentingannya untuk memanfaatkan sumber makanan sisa manusia (Withworth et al. 2007). Komoditi yang dapat ditemukan di pasar Burung Pramuka, yaitu pipit, emprit, merpati, puyuh, dan gagak.
e. Burung hias atau burung kicauan, adalah burung yang disukai karena penampilannya yang indah, dan/atau suaranya, dengan spesifikasi kicauan, ocehan atau manggung (Basuni dan Setiyani 1989). Komoditi yang dapat ditemukan di Pasar Burung Pramuka, yaitu burung hias (gelatik, kacamata, putri mandi, parkit), kicauan (muray batu, poksay, kutilang, robin, trucukan, manyar, kenari, anis, branjangan, cucak, sri gunting, samperling), ocehan (beo, kakatua), dan manggung (perkutut, puter, tekukur).
f. Burung Eksotis atau dilindungi (Exotic Birds, Endangered Species), adalah burung yang disukai karena keunikan, keindahan bulu, dan kelangkaannya, yang pada umumnya merupakan burung yang dilindungi undang-undang (Basuni dan Setiyani 1989). Komoditi yang dapat ditemukan di Pasar Pramuka, yaitu elang, kakatua, dan burung hantu.
4.2 Koleksi Sampel
23
dibeli merupakan unggas yang dibeli di Pasar Burung Pramuka, Jakarta untuk pengambilan sampel usap kloakal, usap orofaringeal dan darah.
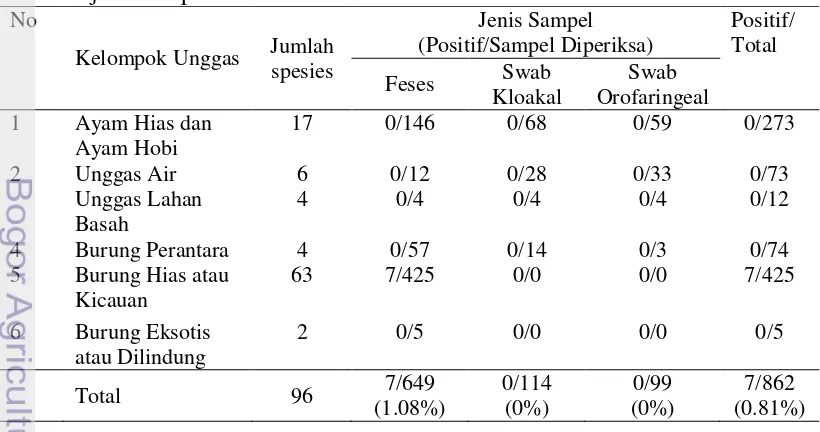
Selama bulan April sampai dengan September 2011, jumlah sampel lapangan yang dikoleksi dari Pasar Burung Pramuka, Jakarta adalah sebanyak 862 sampel dari 28 suku/famili dan 96 spesies unggas yang berbeda. Sampel tersebut terdiri atas 649 sampel feses, 114 sampel usap kloakal, dan 99 sampel usap orofaringeal (Tabel 6). Berdasarkan kelompok unggas, sampel yang dikoleksi terdiri atas 273 sampel dari ayam hias atau ayam hobi, 73 sampel dari unggas air, 10 sampel dari unggas lahan basah, 74 sampel dari unggas perantara, 425 sampel dari burung hias atau burung kicauan, dan 5 sampel dari burung eksotis atau dilindungi (Tabel 7).
Tabel 6 Sampel lapangan yang dikoleksi dari Pasar Burung Pramuka, Jakarta pada April sampai dengan September 2011 berdasarkan bulan dan jenis sampel
No.
Bulan
Jenis Sampel (Positif/Sampel Diperiksa) Jumlah Sampel (Positif/ Total)
Selama bulan April sampai dengan September 2011, sebanyak 178 unggas
No. Kelompok Unggas Sampel Positif/ Sampel Diperiksa
5 Burung Hias atau Kicauan 2/97 Positif: 2 burung kacamata, Agustus 2011, Jawa Tengah 6 Burung Eksotis atau
Dilindung
0/1
Total 2/178 (1.12%)
Berdasarkan hasil wawancara, sumber unggas di Pasar Burung Pramuka diperoleh dari alam, peternakan, maupun dari negara lain. Sumber unggas dari dalam negeri umumnya diperoleh dari pulau Jawa, Sumatera, Kalimantan, Sulawesi, Papua, Bali, dan NTT. Selain itu, terdapat juga unggas dari pulau-pulau lainnya di Indonesia. Dari luar negeri, unggas diperoleh dari negara-negara di Asia Tenggara, Eropa (Belanda), Cina dan Hongkong.
4.3 Deteksi Avian Influenza dengan rRT-PCR
Pemeriksaan rRT-PCR untuk sampel lapangan dilakukan terhadap 131
pool sampel feses, 30 pool sampel usap kloakal, dan 26 pool sampel usap orofaringeal. Jumlah pool yang positif berdasarkan pemeriksaan rRT-PCR yaitu 6
pool sampel feses (berisi 30 sampel individu), namun tidak ada pool sampel usap kloakal dan orofaringeal yang positif.
Berdasarkan uji tapis terhadap pool, dilakukan deteksi AI dengan rRT-PCR terhadap setiap individu pada pool yang positif. Dari 30 sampel individu yang diuji, terdeteksi 7 sampel positif. Dari sampel lapangan, sebanyak 7 dari 649 sampel feses/lingkungan (1.08%) positif AI (Tabel 6). Tidak ada sampel usap orofaringel dan usap kloakal yang positif AI, sehingga secara keseluruhan VAI terdeteksi pada 0.81% (7 dari 862 sampel) sampel lapangan. Adapun data sampel yang positif dapat dilihat pada Tabel 9 sedangkan amplifikasi rRT-PCR matriks dapat dilihat pada Gambar 5.
Ketujuh sampel lapangan yang positif AI terdeteksi pada feses dari empat spesies burung yang terdiri atas tiga ekor burung Kacer (Copsychus saularis,
famili Turdidae), dua ekor burung Kacamata (Zosterops palpebrosus, famili
25
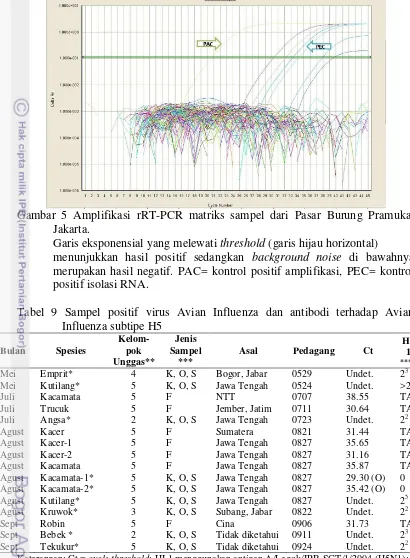
Gambar 5 Amplifikasi rRT-PCR matriks sampel dari Pasar Burung Pramuka, Jakarta.
Garis eksponensial yang melewati threshold (garis hijau horizontal) menunjukkan hasil positif sedangkan background noise di bawahnya merupakan hasil negatif. PAC= kontrol positif amplifikasi, PEC= kontrol positif isolasi RNA.
Keterangan: Ct = cycle threshold; HI 1 menggunakan antigen A/Legok/IPB-SGT/1/2004 (H5N1); HI 2 menggunakan antigen A/Ck/West Java/PWT-Wij/2006 (H5N1).
* : Unggas dibeli dari Pasar Burung Pramuka
** kelompok unggas : (1) Ayam hias dan ayam hobi, (2) unggas air, (3) unggas lahan basah, (4) burung perantara, (5) burung hias dan kicauan, (6) burung eksotis dan dilindungi.
Pada unggas yang dibeli, pemeriksaan rRT-PCR dilakukan terhadap sampel usap kloakal dan orofaringeal dari setiap unggas. Dari 178 ekor unggas, terdapat dua ekor unggas (1.12%) yang postif AI (Tabel 8, Tabel 9). Kedua unggas tersebut merupakan burung kacamata (Zosterops palpebrosus, famili
Zostropidae).
Pada pemeriksaan rRT-PCR terhadap Matriks AI, rataan cycle threshold
(Ct) individu yang positif yaitu 33.31. Seluruh sampel lapangan yang positif termasuk dalam kelompok burung hias atau kicauan (7 dari 425 sampel feses burung hias dan kicauan= 1.65%), demikian pula sampel positif pada unggas yang dibeli (2 dari 94 burung hias dan kicauan= 2.13%).
4.4 Deteksi Antibodi terhadap AI (H5)
Sebanyak 163 sampel serum berhasil dikoleksi dari 178 unggas yang dibeli di Pasar Burung Pramuka. Serum dari lima belas ekor unggas lainnya tidak dapat dikoleksi karena unggas mati atau terlepas sebelum dilakukan pengambilan darah. Pemeriksaan serologis dilakukan menggunakan uji Hemaglutinasi Inhibisi (HI) dengan memakai dua antigen standar yang berbeda. Antigen standar pertama yaitu A/Legok/IPB-SGT/1/2004 (H5N1) dari PT IPB-Shigeta Animal Pharmaceuticals sedangkan antigen standar kedua adalah A/Ck/West Java/PWT-Wij/2006 (H5N1) dari Balai Besar Penelitian dan Veteriner, Bogor.
Berdasarkan uji HI menggunakan antigen A/Legok/IPB-SGT/1/2004 (H5N1) maupun A/Ck/West Java/PWT-Wij/2006 (H5N1), sebanyak tujuh dari 163 unggas (4.29%) positif memiliki antibodi terhadap AI (H5). Terdapat perbedaan titer HI antara kedua antigen tersebut. Dengan menggunakan antigen A/Legok/IPB-SGT/1/2004 (H5N1), terdapat dua sampel yang positif kuat dengan
titer ≥ 24
, sedangkan lima lainnya positif lemah dengan titer < 24 (Tabel 7). Hasil positif kuat berdasarkan uji HI diperoleh dari dua ekor burung kutilang (Pycnonotus aurigaster, famili Pycnotidae). Sedangkan hasil positif lemah diperoleh dari masing-masing satu ekor angsa (Cygnus sp., famili Anatidae), bebek (Anas sp., famili Anatidae), burung emprit/bondol haji (Lonchura maja, famili Ploceidae), tekukur (Streptopelia chinensis, famili Columbidae), dan kruwok (Nyctorax nyctorax, famili Ardeidae). Dengan menggunakan antigen A/Ck/West Java/PWT-Wij/2006 (H5N1), terdapat lima ekor unggas positif kuat (emprit, angsa, kruwok dan dua ekor kutilang) dan dua ekor unggas (bebek dan tekukur) positif lemah.
4.5 Asal Unggas dan Cuaca
27
Secara keseluruhan, selama enam bulan pengambilan sampel lapangan di Pasar Burung Pramuka, Jakarta, sampel positif Avian Influenza dengan uji rRT-PCR paling banyak ditemukan pada bulan Agustus (6 sampel), diikuti bulan Juli (2 sampel), kemudian bulan September (1 sampel). Sedangkan dengan pemeriksaan serologis, unggas yang positif memiliki antibodi terhadap AI dapat ditemukan pada bulan Mei (2 sampel), Juli (1 sampel), Agustus (2 sampel), dan September (2 sampel) (Tabel 9, Gambar 6). Adapun rataan temperatur, kelembapan dan curah hujan bulanan di Pasar Burung Pramuka Jakarta selama bulan April sampai dengan September 2011 menurut data Badan Meteorologi, Klimatologi dan Geofisika dapat dilihat pada Gambar 6.
Sampel positif 0 2 0 3 8 3
Gambar 6 Cuaca di Pasar Burung Pramuka Jakarta selama pengambilan sampel.
Apr Mei Juni Juli Aug Sept
BULAN
Temperatur (oC) 28.5 28.8 28.6 28.2 28.2 28.7
Curah Hujan (mm) 34.4 157.1 77.7 53.1 13.5 2.8
Kelembapan (%) 76 76 73 74 70 69
0.0 50.0 100.0 150.0 200.0
Ni