AKUMULASI LOGAM BERAT Cu DAN Pb PADA
Rhizophora apiculata
TINGKAT PANCANG DAN POHON
SKRIPSI
Oleh :
NOA VIOLEN SIMANGUNSONG 101201119/ Budidaya Hutan
PROGRAM STUDI KEHUTANAN
FAKULTAS KEHUTANAN
UNIVERSITAS SUMATERA UTARA
AKUMULASI LOGAM BERAT Cu DAN Pb PADA
Rhizophora apiculata
TINGKAT PANCANG DAN POHON
SKRIPSI
Oleh :
NOA VIOLEN SIMANGUNSONG 101201119/ Budidaya Hutan
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana kehutanan di Fakultas Kehutanan
Universitas Sumatera Utara
PROGRAM STUDI KEHUTANAN
FAKULTAS KEHUTANAN
UNIVERSITAS SUMATERA UTARA
LEMBAR PENGESAHAN
Judul Skripsi : Akumulasi Logam Berat Cu dan Pb Pada Rhizophora apiculata Tingkat Pancang dan Pohon
Nama : Noa Violen Simangunsong NIM : 101201119
Program Studi : Kehutanan
Disetujui oleh Komisi Pembimbing
Dr. Ir. Yunasfi, M.Si Dr. Budi Utomo, S.P, M.P
Ketua Anggota
Mengetahui
ABSTRACT
NOA VIOLEN S. Accumulation of Heavy Metals Cu and Pb on Rhizophora apiculata Stake and Tree Level. Under academic supervision of YUNASFI and BUDI UTOMO.
The excessive utilizations of using mangrove cause wastes heavy metals enter mangrove ecosystem. The purposes of the research is to find and compare the content of heavy metals Cu and Pb in roots, leaves and barks of Rhizophora apiculata stake and tree level and to know the ability of Rhizophora apiculata in accumulating heavy metals. Analysis of heavy metals is done in Laboratory Research, the Faculty of Pharmaceuticals, University of North Sumatera using the Atomic Absorbsion Spectrofotometer (AAS) method with two stage that is wet destruction and dry destruction.
ABSTRAK
NOA VIOLEN S. Akumulasi Logam Berat Cu dan Pb Pada Rhizophoraapiculata
Tingkat Pancang dan Pohon. Dibawah bimbingan YUNASFI dan BUDI UTOMO.
Banyaknya usaha pemanfaatan mangrove menyebabkan masuknya limbah logam berat ke dalam ekosistem mangrove. Tujuan dari penelitian ini adalah untuk mengetahui dan membandingkan kandungan logam Cu dan Pb pada akar, daun dan kulit Rhizophora apiculata tingkat pancang dan pohon, dan untuk mengetahui kemampuan Rhizophora apiculata dalam mengakumulasi logam berat. Analisis logam berat dilakukan di Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara menggunakan metode Atomic Absorbsion Spectrofotometer (AAS) dengan dua tahap yaitu dekstruksi basah dan dekstruksi kering.
Hasil penelitian menunjukkan bahwa kandungan logam berat Cu dan Pb pada kulit, akar dan daun tingkat pohon lebih besar dibandingkan tingkat pancang. Berdasarkan faktor biokonsentrasi kemampuan Rhizophora apiculata dalam mengakumulasi logam berat Cu pada pancang dan pohon tergolong tinggi sedangkan nilai BCF Pb tergolong sedang.
RIWAYAT HIDUP
Penulis lahir di Tebing Tinggi pada tanggal 6 Februari 1992 dari ayah
M. Simangunsong dan ibu S.M Sianturi. Penulis merupakan anak kedua dari tiga
bersaudara.
Tahun 2004 penulis lulus dari SD Swasta Methodist 2 Tebing Tinggi.
Penulis melanjutkan ke SMP Negeri 4 Tebing Tinggi tamat tahun 2007.
Kemudian melanjut ke SMA Negeri 1 Tebing Tinggi tamat tahun 2010.
Pada tahun 2010 penulis masuk Perguruan Tinggi Universitas Sumatera
Utara melalui jalur SNMPTN dengan jurusan Kehutanan. Penulis melakukan
penelitian dengan judul Akumulasi Logam Berat (Cu dan Pb) Pada Rhizophora apiculata Tingkat Pancang dan Pohon. Penulis masuk organisasi HIMAS (Himpunan Mahasiswa Sylva) tahun 2010, mengikuti kegiatan P2EH (Praktek
Pengenalan Ekosistem Hutan) tahun 2012 di Taman Hutan Raya Bukit Barisan
Tongkoh selama 10 hari. Penulis melakukan PKL (Praktek Kerja Lapang) di Balai
Besar Taman Nasional Gunung Gede Pangrango pada tanggal 4 Februari 2014-
KATA PENGANTAR
Puji dan syukur penulis ucapkan ke hadirat Tuhan Yang Maha Esa, karena
rahmatNya penulis dapat menyelesaikan skripsi yang berjudul “Akumulasi Logam
Berat Cu dan Pb Pada Rhizophora apiculata Tingkat Pancang dan Pohon” ini dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk menyelesaikan
studi di Program Studi Kehutanan Fakultas Pertanian Universitas Sumatera Utara,
Medan.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada Dr. Ir. Yunasfi, M.Si dan Dr. Budi Utomo, S.P, M.P selaku Komisi Pembimbing
yang telah banyak mengarahkan dan memberikan saran kepada penulis dalam
menyelesaikan skripsi ini. Penulis juga ingin mengucapkan terima kasih kepada
kedua orang tua dan kedua saudari (Eva Friska dan Dian Julia) serta teman-teman
di Program Studi Kehutanan Fakultas Pertanian USU (Yepta, Ria, Ervan, Juneith,
Bunga, Soni, Fitri, Sukma, Marisi, Triskin, Gusti, Wika, Riston, Mario, Adrian,
tim PKL dll) yang selalu memberi semangat kepada penulis.
Penulis mengharapkan kritik, saran, dan masukan dari pembaca demi
kelancaran penelitian ini. Semoga penelitian ini akan memberi manfaat dan
DAFTAR ISI
Struktur dan Zonasi Hutan Mangrove ... 5
DAFTAR TABEL
No. Halaman
1. Analisis Parameter Kualitas Lingkungan Perairan ... 22
2. Analisis Rata-Rata Kandungan Logam Berat Cu dan Pb dalam
Akar, Daun dan Kulit Batang Rhizophora apiculata ... 22 3. Analisis Rata-Rata Kandungan Logam Berat Cu dan Pb pada
Air dan Sedimen ... 23
4. Nilai Faktor Biokonsentrasi (BCF) Cu dan Pb pada Tingkat
DAFTAR GAMBAR
No. Halaman
DAFTAR LAMPIRAN
No. Halaman
1. Dokumentasi penelitian ... 37
2. KEPMEN LH No. 51 Tahun 2004 Baku Mutu Air Laut Untuk
Biota Laut ... 41
3. IADC / CEDA Tahun 1997 Tentang Baku Mutu Logam Berat Dalam
Sedimen ... 43
4. Data Dasar Konsentrasi Logam Berat ... 44
ABSTRACT
NOA VIOLEN S. Accumulation of Heavy Metals Cu and Pb on Rhizophora apiculata Stake and Tree Level. Under academic supervision of YUNASFI and BUDI UTOMO.
The excessive utilizations of using mangrove cause wastes heavy metals enter mangrove ecosystem. The purposes of the research is to find and compare the content of heavy metals Cu and Pb in roots, leaves and barks of Rhizophora apiculata stake and tree level and to know the ability of Rhizophora apiculata in accumulating heavy metals. Analysis of heavy metals is done in Laboratory Research, the Faculty of Pharmaceuticals, University of North Sumatera using the Atomic Absorbsion Spectrofotometer (AAS) method with two stage that is wet destruction and dry destruction.
ABSTRAK
NOA VIOLEN S. Akumulasi Logam Berat Cu dan Pb Pada Rhizophoraapiculata
Tingkat Pancang dan Pohon. Dibawah bimbingan YUNASFI dan BUDI UTOMO.
Banyaknya usaha pemanfaatan mangrove menyebabkan masuknya limbah logam berat ke dalam ekosistem mangrove. Tujuan dari penelitian ini adalah untuk mengetahui dan membandingkan kandungan logam Cu dan Pb pada akar, daun dan kulit Rhizophora apiculata tingkat pancang dan pohon, dan untuk mengetahui kemampuan Rhizophora apiculata dalam mengakumulasi logam berat. Analisis logam berat dilakukan di Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara menggunakan metode Atomic Absorbsion Spectrofotometer (AAS) dengan dua tahap yaitu dekstruksi basah dan dekstruksi kering.
Hasil penelitian menunjukkan bahwa kandungan logam berat Cu dan Pb pada kulit, akar dan daun tingkat pohon lebih besar dibandingkan tingkat pancang. Berdasarkan faktor biokonsentrasi kemampuan Rhizophora apiculata dalam mengakumulasi logam berat Cu pada pancang dan pohon tergolong tinggi sedangkan nilai BCF Pb tergolong sedang.
PENDAHULUAN
Latar Belakang
Ekosistem mangrove di Indonesia saat ini kondisinya sangat
mengkhawatirkan akibat tekanan pertambahan penduduk yang sangat pesat.
Jumlah penduduk yang terus bertambah membutuhkan lahan untuk pemukiman
dan mencari nafkah. Mangrove sebagai ekosistem pesisir dan dekat dengan
pusat-pusat pemukiman penduduk sangat rawan ancaman dan tekanan, sehingga
kelestariannya sangat rentan terhadap perubahan lingkungan (Tomlinson, 1986).
Banyaknya usaha pemanfaatan mangrove, menyebabkan luasan mangrove
berkurang dari tahun ke tahun. Kegiatan ini seperti reklamasi pantai, pembukaan
lahan untuk pertanian dan perikanan budidaya, industri serta pengembangan
perumahan di daerah pesisir. Dampak langsung yang disebabkan oleh kegiatan di
atas adalah masuknya limbah ke dalam ekosistem mangrove terutama limbah
yang mengandung logam berat. Peningkatan kadar logam berat pada ekosistem
mangrove dapat juga berasal dari perkapalan, wisata, tumpahan minyak,
pengolahan limbah tumbuhan serta peningkatan sampah dan aktivitas
pertambangan. Konsentrasi logam berat yang tinggi akan menyebabkan kerusakan
lingkungan dan meningkatkan daya toksisitas, persistan dan bioakumulasi logam
itu sendiri (Lindsey dkk., 2004).
Logam berat adalah unsur-unsur kimia dengan bobot jenis lebih besar dari
5 gr/cm3. Bila kadar logam berat yang terlalu rendah di suatu perairan dapat
menyebabkan kehidupan organism mengalami defisiensi,namun bila unsure
logam berat dalam jumlah yang berlebihan dapat bersifat racun. Sifat–sifat logam
perairan dan keberadaannya secara alami sulit terurai (dihilangkan), mudah
terakumulasi pada sedimen, sehingga konsentrasinya selalu lebih tinggi dari
konsentrasi logam dalam air. Selain itu sedimen mudah tersuspensi karena
pergerakan massa air yang akan melarutkan kembali logam yang dikandungnya ke
dalam air, sehingga sedimen menjadi sumber pencemar potensial dalam skala
waktu tertentu (Sutamihardja dkk, 1982).
Brooks (1997) mengatakan akumulasi logam ke dalam akar tumbuhan
melalui bantuan transpor molekul dalam membran akar kemudian akan
membentuk transpor logam kompleks yang menembus xilem dan terus menuju sel
daun. Setelah sampai di daun, logam akan melewati plasmalemma, sitoplasma,
dan tonoplasma untuk memasuki vakuola. Di dalam vakuola transpor, molekul
kompleks bereaksi dengan akseptor terminal molekul untuk membentuk akseptor
kompleks logam kemudian transpor molekul dilepas dan akseptor kompleks
logam terakumulasi dalam vakuola yang tidak akan berhubungan dengan proses
fisiologi sel tumbuhan.
Mangrove yang tumbuh di muara sungai merupakan tempat penampungan
terakhir bagi limbah-limbah yang terbawa aliran sungai, terutama jika jumlah
limbah yang masuk ke lingkungan estuari melebihi kemampuan pemurnian alami
oleh badan air. Penyerapan logam berat oleh akar pohon dipengaruhi sistem
perakaran dan luasan permukaan akarnya. Pohon bakau mempunyai tekanan
osmosis tinggi dalam cairan selnya, dan karena itu sistem akarnya berdaya
absorbsi lebih tinggi daripada larutan tanahnya. Kondisi ini mempermudah
meningkat, potensial osmosis tinggi terjadi karena bertumpuknya zat organik atau
akibat garam mineral yang terserap dari medium beragam(Arisandi, 2008).
Jenis Rhizophora apiculata menyerap polutan cukup besar terutama di bagian akar dan batang. Diperkirakan jenis ini mempunyai akar jangkar yang
cukup banyak, panjang, dan besar, sehingga kemampuan daya serap logam berat
di habitatnya lebih besar dari daya serap sistem perakaran Avicennia marina
(Subiandono dkk, 2013).
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk:
1. Mengukur dan membandingkan kandungan logam Cu dan Pb pada akar, daun
dan kulit Rhizophoraapiculata tingkat pancang dan pohon.
2. Mengukur dan membandingkan nilai BCF logam Cu dan Pb
Rhizophoraapiculata tingkat pancang dan pohon.
Manfaat Penelitian
Manfaat penelitian ini adalah untuk memberikan gambaran mengenai
akumulasi logam berat Cu dan Pb pada Rhizophora apiculata secara kuantitatif berdasarkan komposisi jenis pancang dan pohon serta sebagai referensi bagi
masyarakat untuk menanam mangrove jenis tersebut sebagai akumulator logam
berat.
Hipotesis Penelitian
Hipotesis penelitian ini adalah kandungan logam berat pada tingkat pohon
TINJAUAN PUSTAKA
Pengertian dan Peran Ekosistem Mangrove
Kata mangrove merupakan kombinasi antara mangue (bahasa Portugis) yang berarti tumbuhan dan grove (bahasa Inggris) yang berarti belukar atau hutan kecil. Menurut Macnae (1978), kata mangrove digunakan untuk menyebut jenis
pohon-pohon atau semak-semak yang tumbuh di antara batas air tertinggi saat
pasang dan batas air terendah sampai di atas rata-rata permukaan air laut.
Menurut Nybakken (1992), hutan mangrove adalah sebutan umum yang
digunakan untuk menggambarkan suatu varietas komunitas pantai tropik yang
didominasi oleh beberapa spesies pohon-pohon yang khas atau semak-semak
yang mempunyai kemampuan untuk tumbuh dalam perairan asin. Hutan
mangrove meliputi pohon-pohon dan semak yang tergolong ke dalam 8 famili dan
12 genera tumbuhan berbunga : Avicennia, Sonneratia, Rhyzophora, Bruguiera, Ceriops, Xylocarpus, Lummitzera, Laguncularia, Aegiceras, Aegiatilis, Snaeda, dan Conocarpus (Bengen, 2001).
Menurut Kusmana dkk (2005) hutan mangrove adalah tipe hutan yang
tumbuh di daerah pasang-surut (terutama di pantai yang terlindung, laguna, muara
sungai) yang tergenang pasang dan bebas dari genangan pada saat surut yang
komunitas tumbuhannya toleran terhadap garam. Adapun ekosistem mangrove
merupakan suatu sistem yang terdiri atas organisme (tumbuhan dan hewan) yang
berinteraksi dengan faktor lingkungan di dalam suatu habitat mangrove.
Ekosistem mangrove mempunyai peran yang penting dalam mendukung
kehidupan organisme yang terdapat pada ekosistem tersebut. Fungsi hutan
fungsi kimia, fungsi biologi, fungsi ekonomi, dan fungsi lain (wanawisata) seperti
dibawah ini. Fungsi fisik: (a) Menjaga garis pantai agar tetap stabil; (b)
melindungi pantai dan tebing sungai dari proses erosi atau abrasi, serta menahan
atau menyerap tiupan angin kencang dari laut ke darat; (c) Menahan sedimen
secara periodik sampai terbentuk lahan baru; (d) Sebagai kawasan penyangga
proses intrusi atau rembesan air laut ke darat, atau sebagai filter air asin menjadi
tawar; (e) Mencegah terjadinya erosi pantai. Fungsi kimia: (a) Sebagai tempat
terjadinya proses daur ulang yang menghasilkan oksigen; (b) Sebagai penyerap
karbondioksida; (c) Sebagai pengolah bahan-bahan limbah hasil pencemaran
industri dan kapal-kapal di lautan. Fungsi biologi: (a) Sebagai penghasil bahan
pelapukan yang merupakan sumber makanan penting bagi invertebrata kecil
pemakan detritus, yang kemudian berperan sebagai sumber makanan bagi hewan
yang lebih besar; (b) Sebagai kawasan pemijah bagi udang, ikan, kepiting, dan
kerang yang setelah dewasa akan kembali ke lepas pantai; (c) Sebagai kawasan
untuk berlindung, bersarang, serta berkembang biak bagi burung dan satwa lain;
(d) Sebagai sumber plasma nutfah dan sumber genetik. Fungsi ekonomi: (a)
Penghasil kayu; (b) Penghasil bahan baku industri; (c) Penghasil bibit ikan,
udang, kerang, kepiting, telur burung. Fungsi lain (Wanawisata): (a) Sebagai
kawasan wisata alam pantai; (b) Sebagai tempat pendidikan, konservasi, dan
penelitian.
Struktur dan Zonasi Hutan Mangrove
Tomlinson (1986) membagi flora mangrove menjadi tiga kelompok sesuai
1. Flora mangrove mayor, yakni flora yang menunjukkan kesetiaan terhadap
habitat mangrove, berkemampuan membentuk tegakan murni dan secara
dominan mencirikan struktur komunitas, secara morfologi mempunyai
bentuk-bentuk adaptif khusus (bentuk akar dan viviparitas) terhadap
lingkungan mangrove, dan mempunyai mekanisme fisiologis dan mengontrol
garam. Contohnya adalah: Avicennia, Rhizophora, Bruguiera, Ceriops, Kandelia, Sonneratia, Lumnitzera, Laguncularia, dan Nypa.
2. Flora mangrove minor, yaitu flora mangrove yang tidak mampu membentuk
tegakan murni, sehingga secara morfologis tidak berperan dominan dalam
struktur komunitas, contohnya: Excoecaria, Xylocarpus, Heritiera, Aegialitis, Achrostichum, Camptostemon, Schyphipora, Phempis, Osbornia, dan Peliciera.
3. Asosiasi mangrove, jenis-jenis ini bukan merupakan anggota komunitas
mangrove sejati dan tumbuh pada lingkungan vegetasi darat contohnya adalah
Cerbera, Acanthus, Derris, Hibiscus, Calamus, dll.
Menurut Bengen (2001), penyebaran dan zonasi hutan mangrove
tergantung oleh berbagai faktor lingkungan. Berikut salah satu tipe zonasi hutan
mangrove di Indonesia : daerah yang paling dekat dengan laut, dengan substrat
agak berpasir, sering ditumbuhi oleh Avicennia sp. Pada zona ini biasa berasosiasi
Sonneratia sp, yang dominan tumbuh pada lumpur dalam yang kaya bahan organik. Lebih ke arah darat, hutan mangrove umumnya didominasi oleh
dengan hutan dataran rendah biasa ditumbuhi oleh Nypa fruticans, dan beberapa spesies palem lainnya.
Menurut Supriharyono (2007) beberapa faktor yang menentukan
penyebaran tumbuhan mangrove, yaitu :
1. Gelombang pasang surut, yang menentukan waktu dan tinggi penggenangan
suatu lokasi, sehingga menentukan spesies tumbuhan yang tumbuh.
2. Salinitas, yang berkaitan dengan penyebaran tumbuhan mangrove, karena ada
beberapa spesies yang tidak tahan pada salinitas yang tinggi.
3. Substrat (bentuk tekstur tanah dan kemantapan), tipe substrat yang sesuai
untuk pertumbuhan mangrove adalah lumpur lunak, yang mengandung silt
(debu), clay (liat), dan bahan – bahan organik yang lembut.
4. Suhu, suhu yang baik untuk kehidupan mangrove adalah tidak kurang dari
200C.
Umumnya mangrove di Indonesia jika diurutkan dari arah laut ke arah
daratan biasanya dapat dibedakan menjadi 4 zonasi yaitu sebagai berikut :
1. Zona Api-api – Prepat (Avicennia – Sonneratia)
Terletak paling luar / jauh atau terdekat dengan laut, keadaan tanah
berlumpur agak lunak (dangkal), dengan substrat agak berpasir, sedikit bahan
organik dan kadar garam agak tinggi. Zona ini biasanya didominasi oleh jenis
api-api (Avicennia sp) dan prepat (Sonneratia sp), dan biasanya berasosiasi dengan jenis bakau (Rhizophora sp).
Biasanya terletak di belakang api-api dan prepat, keadaan tanah berlumpur
lunak (dalam). Pada umumnya didominasi bakau (Rhizophora sp) dan di beberapa tempat dijumpai berasosiasi dengan jenis lain seperti tanjang ( Bruguiera sp ). 3. Zona Tanjang (Bruguiera)
Terletak di belakang zona bakau, agak jauh dari laut dekat dengan daratan.
Keadaan berlumpur agak keras, agak jauh dari garis pantai. Pada umumnya
ditumbuhi jenis tanjang (Bruguiera sp) dan di beberapa tempat berasosiasi dengan jenis lain.
4. Zona Nipah (Nypa fruticans)
Terletak paling jauh dari laut atau paling dekat ke arah darat. Zona ini
mengandung air dengan salinitas sangat rendah dibandingkan zona lainnya,
tanahnya keras, kurang dipengaruhi pasang surut dan kebanyakan berada di
tepi-tepi sungai dekat laut. Pada umumnya ditumbuhi jenis nipah (Nypa fruticans) dan beberapa spesies palem lainnya ( Bengen, 2001 ).
Ciri Umum Rhizophora apiculata
Pohon Rhizophora apiculata termasuk kedalam famili Rhizophoraceae.
Dalam bahasa lokal, pohon ini dikenal dengan nama bakau kacang, bakau minyak,
bakau kecil dan lain-lain. Pertumbuhan Rhizophora apiculata akan semakin jelek apabila kadar garam dalam air makin rendah. Rhizophora apiculata memiliki ciri yang sangat khas yaitu memiliki tulang daun berwarna merah kecoklatan dan
daun meruncing. Buahnya (propagul) termasuk tipe vivipari dimana buah telah
berkecambah saat di pohon (Martawijaya dkk.,1989).
Habitusnya berupa pohon, berakar jangkar, daun tebal mengulit,
elips, tunggal, ujung bermukro (ekor), tangkai daun pendek, terdapat stipula di
ujung, dan berbentuk tabung; buah berbentuk bulat telur, berwarna coklat, biji
vivipar, berkecambah dengan mengeluarkan hipokotil, panjang 15-70 cm
(Munawar & Rina, 2010).
Secara ekologis Rhizophora merupakan penyusun vegetasi mangrove muda. Pada tipe vegetasi ini dicirikan oleh satu lapis tajuk hutan yang seragam
tingginya dari jenis Rhizophora dan berperan juga sebagai jenis pioner di tempat-tempat yang posisinya terlindung dari hempasan ombak yang kuat, atau
berkembang setelah kolonisasi dari jenis Avicennia dan Sonneratia yang kemudian Rhizophora tumbuh diantaranya (Sukardjo, 2002).
Gambar 1. Bakau Minyak (Rhizophora apiculata)
Pengertian Logam Berat
Logam berat adalah unsur-unsur kimia dengan bobot jenis lebih besar dari
5 gr/cm3, terletak di sudut kanan bawah sistem periodik, mempunyai afinitas yang
tinggi terhadap unsur S dan biasanya bernomor atom 22 sampai 92 dari periode
pencemar adalah karena adanya sifat-sifat logam berat yang tidak dapat terurai
(non degradable) dan mudah diabsorbsi (Darmono, 1995).
Sifat toksisitas logam berat dapat dikelompokkan ke dalam 3 kelompok,
yaitu bersifat toksik tinggi, sedang dan rendah. Logam berat yang bersifat toksik
tinggi terdiri dari unsur Hg, Cd, Pb, Cu, dan Zn. Bersifat toksik sedang terdiri dari
unsur-unsur Cr, Ni dan Co, sedangkan bersifat tosik rendah terdiri atas unsur Mn
dan Fe (Moore dan Ramamoorthy, 1984).
Kandungan kelompok anorganik logam di perairan alami sangat rendah
(trace element). Kelompok logam berat yang termasuk bersifat esensial adalah Cr, Ni, Cu, Zn dan yang bersifat non esensial adalah As, Cd, Pb, Hg. Elemen yang
bersifat esensial dibutuhkan dalam proses kehidupan biota akuatik. Kelompok
elemen esensial maupun non esensial dapat bersifat toksik atau racun bagi
kehidupan biota akuatik terutama apabila terjadi peningkatan kadarnya dalam
perairan (Sanusi, 2006).
Semua logam berat dapat menimbulkan pengaruh yang negatif terhadap
organisme perairan pada batas dan kadar tertentu. Hal ini dipengaruhi oleh jenis
logam, pengaruh interaksi antar logam dan jenis racun lainnya, spesies hewan
daya permeabilitas organisme, dan mekanisme detoksikasi serta pengaruh
lingkungan seperti suhu, pH, dan oksigen (Bryan, 1984).
Hutagalung (1994) menyatakan selain suhu dan pH, salinitas dan
kesadahan juga mempengaruhi toksisitas logam berat. Penurunan pH dan
salinitas perairan menyebabkan toksisitas logam berat semakin besar. Lain halnya
dengan suhu, toksisitas logam berat semakin tinggi dengan meningkatnya suhu.
berat dalam air dengan kesadahan tinggi membentuk senyawa kompleks yang
mengendap dalam air. Logam berat yang terdapat di perairan dapat diketahui
melalui media air, sedimen maupun organisme hidup.
Tembaga (Cu)
Tembaga merupakan logam berat yang diperlukan untuk terjadinya proses
fisiologis secara normal dalam tubuh makhluk hidup, karena Cu merupakan
logam esensial yang diperlukan makhluk hidup terutama dalam perannya sebagai
kofaktor enzim (membantu kerja enzim). Bahkan pada tumbuhan seperti alga, Cu
dapat berperan sebagai pembawa elektron sebagai baik pada proses fotosintesis
maupun pada proses respirasi (Perales, dkk., 2007).
Tembaga adalah logam merah muda yang lunak, dapat ditempa, dan liat
yang melebur pada 1038°C. Potensial elektroda standardnya positif (+ 0,34 V),
logam ini tidak larut dalam asam klorida dan asam sulfat encer (Vogel 1994).
Logam ini banyak digunakan pada pabrik yang memproduksi alat-alat listrik,
gelas dan zat warna yang biasa dicampur dengan logam lain seperti alloy dengan perak, kadmium, timah putih, dan seng (Merian, 1994).
Tembaga bukan hanya meracuni hewan, tetapi juga bersifat toksik pada
tumbuhan (jasad autotrof). Dalam hal ini tembaga dalam jumlah sedikit
merupakan unsur yang esensial yang diperlukan oleh tubuh, karena tembaga akan
berperan sebagai elemen penting dalam mengatur protein, berpartisipasi dalam
transportasi elektron pada proses fotosintesis, membantu proses respirasi pada
mitokondria, merespon stress oksidatif yang terjadi pada seluruh tubuh,
membantu proses metabolisme pada dinding sel, dan akan membantu kerja
Timbal (Pb)
Timbal atau dikenal sebagai logam Pb dalam susunan unsur merupakan
logam berat yang terdapat secara alami di dalam kerak bumi dan tersebar ke alam
dalam jumlah kecil melalui proses alami termasuk letusan gunung berapi dan
proses geokimia. Pb merupakan logam lunak yang berwarna kebiru-biruan atau
abu-abu keperakan dengan titik leleh pada 327,5 ºC dan titik didih 1.740 ºC pada
tekanan atmosfer. Timbal mempunyai nomor atom terbesar dari semua unsur yang
stabil, yaitu 82 dengan berat atom 207,20 g/mol. Namun logam ini sangat
beracun. Seperti halnya merkuri yang juga merupakan logam berat. Timbal adalah
logam yang yang dapat merusak sistem syaraf jika terakumulasi dalam jaringan
halus dan tulang untuk waktu yang lama. Logam ini sangat resistan (tahan)
terhadap korosi, oleh karena itu seringkali dicampur dengan cairan yang bersifat
korosif (seperti asam sulfat) (BPLHD Jabar, 2013).
Timbal hitam pada perairan ditemukan dalam bentuk terlarut dan
tersuspensi. Kelarutan timbal dalam air cukup rendah sehingga kadarnya relatif
sedikit. Bahan bakar yang mengandung timbal (lead gasoline) memberikan kontribusi yang berarti bagi keberadaan timbal diperairan. Kadar dan toksisitas
timbal di perairan dipengaruhi oleh kesadahan, pH, alkalinitas, dan kadar oksigen
(Effendi, 2003).
Sifat-sifat timbal berdasarkan Darmono (1995) dan Fardiaz (2005) antara
lain:
1. Memiliki titik cair rendah.
2. Merupakan logam yang lunak sehingga mudah diubah menjadi berbagai
3. Timbal dapat membentuk alloy dengan logam lainnya, dan alloy yang terbentuk mempunyai sifat yang berbeda dengan timbal murni.
4. Memiliki densitas yang tinggi dibandingkan logam lain kecuali emas dan
merkuri yaitu 11,34 g/cm3.
5. Sifat kimia timbal menyebabkan logam ini dapat berfungsi sebagai pelindung
jika kontak dengan udara lembab.
Mekanisme Penyerapan Logam Berat oleh Mangrove
Komunitas mangrove sering kali mendapatkan suplai bahan polutan
seperti logam berat yang berasal dari limbah industri, rumah tangga, dan
pertanian. Tumbuhan mangrove ini termasuk jenis tumbuhan air yang mempunyai
kemampuan sangat tinggi untuk mengakumulasi logam berat yang berada pada
wilayah perairan. Proses absorpsi pada tumbuhan terjadi seperti pada hewan
dengan berbagai proses difusi, dan istilah yang digunakan adalah translokasi.
Transpor ini terjadi dari sel ke sel menuju jaringan vaskuler agar dapat
didistribusikan ke seluruh bagian tubuh. Menurut Soemirat (2003), menyatakan
bahwa proses absorpsi dapat terjadi lewat beberapa bagian tumbuhan, yaitu :
1. Akar, terutama untuk zat anorganik dan zat hidrofilik.
2. Daun bagi zat yang lipofilik.
3. Stomata untuk masukan gas.
Tumbuhan mangrove mampu mengalirkan oksigen melalui akar ke dalam
sedimen tanah untuk mengatasi kondisi anaerob pada sedimen tersebut. Jika
logam berat memasuki jaringan, terdapat mekanisme yang sangat jelas,
seperti protein dan glukosida yang berfungsi mengikat logam dan dikumpulkan ke
jaringan tubuh kemudian ditransportasikan ke batang, daun dan bagian lainnya,
sedangkan ekskresinya terjadi melalui transpirasi (Panjaitan, 2009).
Menurut Fitter dan Hay (1991) mekanisme yang mungkin dilakukan oleh
tumbuhan untuk menghadapi konsentrasi toksik adalah :
1. Penanggulangan (ameliorasi), proses ameliorasi dilakukan dengan empat
pendekatan, yaitu :
a. Lokalisasi (intraseluler atau ekstraseluler) biasanya di dalam akar.
b. Ekskresi, secara aktif melalui kelenjar pada tajuk atau secara pasif melalui
akumulasi pada daun-daun tua yang diikuti dengan absisi daun.
c. Dilusi, yaitu melalui pengenceran.
d. Inaktivasi secara kimia.
2. Toleransi, yaitu tumbuhan mengembangkan sistem metabolik yang dapat
berfungsi pada konsentrasi toksik.
Brooks (1997) mengatakan akumulasi logam ke dalam akar tumbuhan
melalui bantuan transpor molekul dalam membran akar kemudian akan
membentuk transpor logam kompleks yang menembus xilem dan terus menuju sel
daun. Setelah sampai di daun, logam akan melewati plasmalemma, sitoplasma,
dan tonoplasma untuk memasuki vakuola. Di dalam vakuola transpor, molekul
kompleks bereaksi dengan akseptor terminal molekul untuk membentuk akseptor
kompleks logam kemudian transpor molekul dilepas dan akseptor kompleks
logam terakumulasi dalam vakuola yang tidak akan berhubungan dengan proses
Menurut Priyanto dan Prayitno (2006) mekanisme penyerapan logam
berat pada tanaman melalui akar dapat dibagi menjadi tiga proses yang
sinambung. Pertama adalah penyerapan logam berat oleh akar. Agar dapat
menyerap logam, tanaman membentuk suatu enzim reduktase di membran
akarnya. Reduktase ini berfungsi mereduksi logam yang selanjutnya diangkut ke
bagian tumbuhan lainnya melalui jaringan pengangkut, yaitu xilem dan floem.
Untuk meningkatkan efisiensi pengangkutan, logam diikat oleh molekul kelat
kemudian senyawa-senyawa yang larut dalam air biasanya diserap oleh akar
bersama air. Kedua, melalui translokasi logam dari akar ke bagian tanaman lain,
yaitu setelah logam menembus endodermis akar, logam atau senyawa asing lain
mengikuti aliran transpirasi ke bagian atas tanaman melalui jaringan pengangkut
xilem ke bagian tanaman lainnya. Ketiga, lokalisasi logam pada sel dan jaringan
yang bertujuan untuk menjaga agar logam tidak menghambat metabolisme
METODE PENELITIAN
Waktu dan Lokasi Penelitian
Penelitian dilakukan pada bulan Juni sampai Februari 2015. Pengambilan
sampel dilakukan di kawasan hutan mangrove Kuala Dewi Desa Kota Pari
kecamatan Pantai Cermin Serdang Bedagai Sumatera Utara yang terletak antara
03039’42” LU dan 98057’40” BT dengan luas ± 4 ha. Analisis logam berat
dilakukan di Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera
Utara. Peta lokasi penelitian dapat dilihat pada Gambar 2.
Alat dan Bahan
Alat yang digunakan pada penelitian adalah pisau, tali rafia, kompas,
kantong plastik, pita ukur, hand refractometer, mortal dan pastle, botol akuades, labu erlenmeyer 100 ml, pipet tetes, oven, corong, tanur, krus porselin, gelas ukur,
labu takar 100 ml dan 25 ml, termometer, timbangan analitik, hot plate, kertas saring whatman ukuran 42, atomic absorbsion spectrofotometer (AAS).
Bahan yang digunakan pada penelitian adalah tally sheet, akar
Rhizophora apiculata, daun Rhizopora apiculata, kulit batang
Rhizophora apiculata, sampel sedimen, sampel air, akuabides, larutan HNO3,
larutan standar Cu dan Pb.
Prosedur Penelitian
1. Pengambilan Sampel
Pengambilan sampel pada lokasi dilakukan dengan metode stasiun secara
purposif. Sampel akar, daun, dan kulit batang diambil dari pohon
Rhizophora apiculata. Akar yang diambil adalah akar tunjang yang berada diatas batas yang terkena batas pasang surut air laut, sedangkan untuk daun yang diambil
adalah daun muda pada pucuk dan daun tua pada pangkal ranting, kulit batang
pohon Rhizophora apiculata yang diambil adalah kulit batang yang terkena pasang surut air laut dengan jarak sekitar 10-15 cm dari batas akar tunjang.
Diambil 3 titik sampel pada setiap lokasi dengan jarak antar titik sampel 50 meter.
Pengambilan sampel pohon Rhizophora apiculata setiap titiknya dengan tiga ulangan. Sebagai data penunjang dilakukan juga pengukuran logam berat pada air
kualitas air, seperti suhu udara, suhu air, pH air, dan salinitas pada keenam titik
tersebut. Gambar lokasi pengambilan sampel dapat dilihat pada Lampiran 1.
2. Preparasi Sampel Akar, Daun, Kulit Batang dan Sedimen
Sampel akar, daun, kulit batang dihomogenkan dengan cara
mengkompositkan sampel yang diambil dari enam titik pengambilan pada setiap
stasiun. Untuk preparasi akar, daun, dan kulit batang, sampel dipotong kecil-kecil
sebelum dihaluskan. Demikian juga sampel sedimen yang dapat langsung
dihaluskan. Setelah itu dikeringkan dalam oven pada suhu 75º C sampai
diperoleh berat konstan.
Sampel akar, daun, kulit batang dan sedimen masing masing ditimbang
sebanyak 5 gram kemudian diarangkan di atas hotplate hingga menjadi arang. Untuk mempercepat terjadinya arang dapat diteteskan sedikit HNO3 secara
perlahan. Sampel yang telah menjadi arang dimasukkan dalam tanur pada suhu
700º C (pengabuan) sampai menjadi abu. Setelah selesai proses pengabuan sampel
akar, daun dan sedimen tersebut dilarutkan dengan menambahkan 10 ml HNO3
pekat.
Campuran larutan tersebut digerus di dalam wadah krus porselin lalu
disaring kedalam labu ukur 25 ml dengan menggunakan kertas saring whatman
ukuran 42. Krus yang telah digerus dibilas dengan menggunakan akuabides
sebanyak dua kali agar kandungan logam yang masih menempel pada krus dapat
larut. Setelah larutan disaring tambahkan akuabides hingga garis tanda batas pada
labu ukur 25 ml. Larutan yang diperoleh dapat diuji dengan menggunakan AAS.
3. Preparasi Sampel Air
Air laut diukur 100 ml, kemudian ditambahkan 10 ml HNO3 pekat.
Panaskan dalam wadah erlenmeyer dalam hot plate sampai volumenya menjadi 35 ml. Larutan yang telah diendapkan disaring fasa airnya dengan kertas saring
whatman ukuran 42. Larutan yang diperoleh siap untuk dianalisis dengan menggunakan AAS. Gambar preparasi dekstruksi basah dapat dilihat pada
Lampiran 1.
4. Pembuatan Larutan Standar Cu dan Pb
Sebanyak 10 ml dari larutan induk logam Cu dan Pb dipipet lalu
dimasukkan kedalam labu takar 100 ml kemudian ditambahkan akuabides sampai
garis tanda akhir. Larutan yang diperoleh mengandung konsentrasi 100 ppm. Dari
larutan 100 ppm dipipet sebanyak 10 ml lalu dimasukkan ke dalam labu takar 100
ml kemudian ditambahkan akuabides sampai garis tanda akhir untuk mendapatkan
larutan dengan konsentrasi 10 ppm. Dibuat larutan dengan konsentrasi 10 ppm
sebanyak 5 ulangan untuk mempermudah pembuatan larutan standar berikutnya.
Untuk mendapatkan larutan standar dengan konsentrasi 0,2; 0,4; 0,6; 0,8
dan 1 ppm, berturut-turut dipipet sebanyak 2 ml, 4 ml, 6 ml, 8 ml dan 10 ml dari
larutan 10 ppm lalu masing masing dimasukkan kedalam labu takar 100 ml
kemudian ditambahkan akuades sampai garis tanda akhir.
5. Prinsip Kerja Atomic Absorpsion Spectrofotometer (AAS)
Alat AAS diset terlebih dahulu sesuai dengan instruksi dalam manual alat
logam Cu dan Pb dengan konsentrasi 0; 0,2; 0,4; 0,6; 0,8 dan 1 ppm. Diukur
absorbansi atau konsentrasi masing-masing sampel.
6. Analisis Data
a. Konsentrasi Sebenarnya
Untuk mendapatkan konsentrasi logam berat sebenarnya maka digunakan
rumus :
K sebenarnya (mg/l) = K AAS (mg /l) x Vol .Pelarut (L) Berat Sampel (mg )
Keterangan :
1. K.AAS : Konsentrasi yang didapat melalui pembacaan alat AAS
2. K. Sebenarnya : Konsentrasi sebenarnya
3. Vol Pelarut : Volume pelarut
4. Berat Sampel : Berat sampel yang akan diuji
b. Faktor Biokonsentrasi (BCF)
Setelah kandungan logam berat dalam air diketahui maka data tersebut
digunakan untuk menghitung kemampuan Rhizophora apiculata mengakumulasi logam berat Cu dan Pb melalui tingkat biokonsentrasi faktor (BCF) dengan
rumus :
BCF Cu / Pb = [Logam berat Cu / Pb ] Tumbuhan [Logam berat Cu / Pb ] Air
Dimana, jika nilai BCF > 1000 = Kemampuan Tinggi
1000 > BCF > 250 = Kemampuan Sedang
c. Analisis Deskriptif
Data yang diperoleh dianalisis secara deskriptif sesuai dengan baku mutu
lingkungan yang terdapat dalam Kepmen LH No. 51 Tahun 2004 untuk kualitas
air. Sedangkan baku mutu untuk logam berat dalam lumpur atau sedimen di
Indonesia belum ditetapkan, sehingga sebagai acuan digunakan baku mutu yang
dikeluarkan IADC/CEDA (1997) mengenai kandungan logam yang dapat
HASIL DAN PEMBAHASAN
Hasil
Kondisi Lingkungan Perairan
Berdasarkan data Tabel 1 yang menunjukkan parameter kualitas
lingkungan di hutan mangrove Kuala Dewi diketahui bahwa pH dan salinitas
tertinggi terdapat pada titik pengamatan tingkat pancang. Suhu air dan suhu udara
tertinggi diperoleh di titik pengamatan tingkat pohon. Hasil analisis parameter
kualitas lingkungan perairan dari tiap stasiun disajikan pada Tabel 1. Data dasar
kondisi lingkungan perairan secara lengkap disajikan dalam Lampiran 4.
Tabel 1. Analisis Parameter Kualitas Lingkungan Perairan
Parameter TINGKAT PERMUDAAN
Kandungan Logam Berat Cu dan Pb Dalam Akar, Daun dan Kulit batang Rhizophora apiculata
Berdasarkan pengukuran konsentrasi logam berat Cu dan Pb dalam akar,
daun dan kulit Rhizophora apiculata diperoleh hasil bahwa penyerapan logam Cu dan Pb dalam akar, daun dan kulit batang lebih tinggi di tingkat pohon daripada di
tingkat pancang. Hasil analisis secara lengkap disajikan pada Tabel 2.
Tabel 2. Analisis Rata-Rata Kandungan Logam Berat Cu dan Pb dalam Akar, Daun dan Kulit Batang Rhizophora apiculata
Sampel Pancang Pohon
Cu (mg/kg) Pb (mg/kg) Cu (mg/kg) Pb (mg/kg)
Akar 19,23 0,53 21,84 1,27
Kulit Batang 9,74 0,36 15,30 1,80
Kandungan Logam Berat Cu dan Pb Pada Air dan Sedimen
Berdasarkan pengukuran konsentrasi logam Cu dan Pb pada air dan
sedimen di titik pengamatan, penyerapan logam Cu dan Pb tertinggi terdapat pada
tingkat pohon. Hasil analisis secara lengkap disajikan pada Tabel 3. Baku mutu air
laut untuk lingkungan pelabuhan secara lengkap disajikan pada Lampiran 2.
Sedangkan baku mutu sedimen disajikan pada Lampiran 3.
Tabel 3. Analisis Rata-Rata Kandungan Logam Berat Cu dan Pb pada Air dan Sedimen Rhizophoraapiculata dalam Mengakumulasi Logam Berat Cu dan Pb
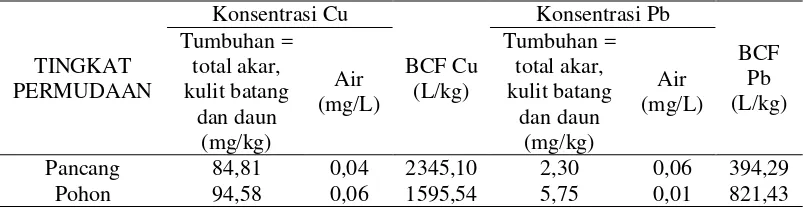
Dari hasil perhitungan faktor biokonsentrasi (BCF) diketahui bahwa nilai
BCF tertinggi untuk logam Cu yaitu pada tingkat pancang dengan nilai 2345,10
dan nilai BCF terendah untuk logam Pb yaitu pada tingkat pancang dengan nilai
394,28.
Pembahasan
Kondisi Lingkungan Perairan
pH rata-rata pada titik pengukuran pancang yaitu 6,67 dan pH rata-rata
pada titik pengukuran pohon yaitu 6,33. Dari kisaran nilai derajat keasaman (pH)
pada kedua stasiun pengukuran sampel dapat disimpulkan bahwa perairan
mangrove Pantai Kuala Dewi bersifat asam. Kondisi di perairan mangrove
biasanya bersifat asam karena banyaknya bahan organik di kawasan itu. Bahan
organik juga mempengaruhi kandungan logam berat di perairan.
Pengukuran pH diperlukan karena perubahan nilai pH perairan dapat
menjadi indikator adanya limbah yang bersifat asam atau basa. pH mempengaruhi
konsentrasi logam berat di perairan. Kelarutan logam berat akan lebih tinggi pada
pH rendah, sehingga menyebabkan toksisitas logam berat semakin besar. Hal ini
sesuai dengan pernyataan Hutagalung (1994) yang menyatakan bahwa penurunan
pH menyebabkan toksisitas logam berat semakin besar. Berdasarkan KEPMEN
LH No.51 Tahun 2004 (Lampiran 2) sebagai baku mutu yang dipakai untuk
kualitas air, pH perairan mangrove tersebut berada di bawah ambang batas yang
ditolerir.
Salinitas laut adalah konsentrasi total ion yang terdapat di perairan.
Salinitas berpengaruh terhadap kehidupan organisme perairan. Salinitas rata-rata
di titik pengambilan sampel pancang yaitu 27,3 ppt sedangkan salinitas rata-rata
di titik pengambilan sampel pohon yaitu 27,1 ppt. Menurut Hutagalung (1994),
bahwa nilai salinitas perairan laut mempengaruhi faktor konsentrasi logam berat
menyebabkan tingkat bioakumulasi logam berat pada organisme semakin
meningkat.
Berdasarkan KEPMEN LH No.51 Tahun 2004 (Lampiran 2) sebagai
baku mutu air laut, salinitas yang terkandung pada lokasi penelitian masih berada
di ambang batas normal. Perubahan salinitas juga mempengaruhi logam berat. Hal
ini sesuai dengan pernyataan Hutagalung (1994) yang menyatakan bahwa
penurunan salinitas perairan menyebabkan toksisitas logam berat semakin besar
dan sebaliknya semakin tinggi salinitas maka konsentrasi logam berat akan
semakin rendah.
Suhu udara rata-rata pada saat pengambilan sampel di titik pengukuran
tingkat pancang dan pohon cukup tinggi yaitu 32,30C dan 32,70C. Kisaran suhu
yang cukup tinggi ini disebabkan adanya intensitas cahaya matahari yang tinggi
pada saat dilakukannya pengukuran di lapangan sementara jumlah individu
tanaman yang ada tidak rapat.
Suhu air rata-rata pada saat pengambilan sampel di titik pengukuran
tingkat pancang dan pohon yaitu 270C dan 28,30C. Kisaran suhu air pada pancang
dan pohon ini tidak jauh berbeda dikarenakan pada titik pengukuran pancang
jumlah vegetasinya lebih rapat sehingga proyeksi tutupan tajuknya lebih besar.
Sedangkan pada titik pengukuran pohon jumlah vegetasinya agak jarang dan lebih
sedikit. Suhu mempengaruhi kandungan logam berat pada suatu lingkungan, hal
ini seperti yang dinyatakan oleh Hutagalung (1994) bahwa suhu yang tinggi akan
memberikan pengaruh terhadap peningkatan kandungan logam berat, naiknya
suhu pada perairan akan mempercepat reaksi dalam pembentukan ion-ion logam
Berdasarkan KEPMEN LH No.51 Tahun 2004 (Lampiran 2) sebagai
baku mutu yang dipakai untuk kualitas air, suhu perairan pada kedua stasiun
pengambilan sampel tergolong baik dan dapat mendukung kehidupan biota laut di
dalamnya. Adapun data mengenai kondisi lingkungan pengambilan sampel
terlampir (Lampiran 4).
Kandungan Logam Berat Cu dan Pb Dalam Akar Rhizophora apiculata
Dari hasil pengukuran sampel akar menggunakan atomic absorbsion spectrofotometer (AAS), diperoleh hasil bahwa akar pada pancang mampu menyerap kandungan logam Cu sebanyak 19,23 mg/kg, sedangkan akar pada
pohon menyerap kandungan logam Cu sebanyak 21,84 mg/kg. Pada pengukuran
logam Pb, akar pancang mengandung konsentrasi Pb sebesar 0,53 mg/kg, akar
pohon mengandung konsentrasi Pb sebesar 1,27 mg/kg.
Dari hasil diatas dapat disimpulkan bahwa akar pohon menyerap lebih
banyak logam Cu dan Pb dibandingkan dengan akar pancang. Hal ini disebabkan
pohon memiliki perakaran yang lebih banyak dan ukurannya yang lebih besar.
Bentuk akar pohon yang besar dan permukaan akar yang luas menyebabkan
bidang penyerapan akar pohon lebih banyak. Hal ini sesuai dengan pendapat
Arisandi (2008) yang menyatakan bahwa penyerapan logam berat oleh akar pohon
di pengaruhi sistem perakaran dan luasan permukaan akarnya. Pohon bakau
mempunyai tekanan osmosis tinggi dalam cairan selnya, dan karena itu sistem
akarnya berdaya absorbsi lebih tinggi.
Akar-akar mangrove merupakan bagian tumbuhan yang pertama kali
menyerap logam. Selain menyerap logam pada sedimen, akar-akar mangrove juga
menyebabkan logam berat yang larut pada sedimen maupun pada perairan ditarik
oleh ujung-ujung akar. Brooks (1997) mengatakan akumulasi logam ke dalam
akar tumbuhan melalui bantuan transpor molekul dalam membran akar kemudian
akan membentuk transpor logam kompleks yang menembus xilem dan terus
menuju sel daun.
Kandungan Logam Berat Cu dan Pb Dalam Daun Rhizophora apiculata
Daun yang dijadikan sampel dalam penelitian ini adalah campuran dari
daun muda pada pucuk dan daun tua pada pangkal ranting. Kandungan logam
pada daun di tingkat pancang dan pohon memiliki nilai yang beragam. Pancang
R. apiculata mampu menyerap logam Cu dengan rata-rata 55,84 mg/kg, sedangkan pada tingkat pohon R. apiculata mampu menyerap logam Cu dengan rata-rata 57,46 mg/kg. Perbedaan yang signifikan juga dapat dilihat pada
penyerapan logam Pb. Pada pancang, daun mengandung Pb sebanyak 1,42 mg/kg
sedangkan daun pada pohon mengandung Pb sebanyak 2,68 mg/kg.
Akumulasi logam paling banyak ditemukan di bagian daun jika
dibandingkan dengan bagian-bagian mangrove lainnya, hal ini merupakan salah
satu proses adaptasi mangrove terhadap logam berat yaitu dengan melakukan
lokalisasi pada salah satu bagian tumbuhan dalam hal ini yaitu daun. Lokalisasi
adalah proses pengumpulan logam berat pada salah satu organ tumbuhan. Hal ini
sesuai dengan pernyataan Fitter dan Hay (1991) yang mengatakan bahwa
mekanisme yang mungkin dilakukan oleh tumbuhan untuk menghadapi
konsentrasi toksik adalah dengan melakukan lokalisasi secara intraseluler maupun
Kandungan logam berat pada daun merupakan yang terbesar karena daun
merupakan organ tumbuhan yang paling peka terhadap logam berat. Masuknya
logam berat pada daun dapat berasal dari xilem yang kemudian diedarkan ke
seluruh tubuh tumbuhan atau terpapar unsur logam berat dari udara. Logam berat
Pb menempel di permukaan daun kemudian masuk melalui stomata dan berikatan
dengan kloroplas.
Bentuk adaptasi mangrove lainnya terhadap logam berat adalah dengan
menyimpan logam berat pada daun yang lebih tua atau ekskresi. Daun yang tua
tersebut akan mengeluarkan kelebihan logam tersebut melalui proses pengguguran
daun-daun yang tua kemudian menggantinya dengan daun yang muda. Hal ini
sesuai dengan pernyataan Fitter dan Hay (1991) yang mengatakan bahwa
ekskresi, secara aktif melalui kelenjar pada tajuk atau secara pasif melalui
akumulasi pada daun-daun tua yang diikuti dengan absisi (pengguguran) daun.
Kandungan Logam Berat Cu dan Pb Dalam Kulit batang Rhizophora apiculata
Untuk kandungan logam pada kulit, pancang mampu menyerap logam
Cu dengan rata-rata 9,74 mg/kg sedangkan pohon menyerap logam Cu dengan
rata-rata 15,30 mg/kg. Dibandingkan dengan logam Cu, konsentrasi penyerapan
logam berat Pb pada tingkat pancang dan pohon lebih sedikit. Logam Pb lebih
sedikit diserap karena sifat translokasinya yang rendah. Translokasi meliputi
gerakan berbagai materi dalam tubuh tumbuhan. Kulit pancang menyerap Pb lebih
sedikit dari kulit pohon yaitu 0,36 mg/kg sedangkan kandungan logam pada kulit
Perbedaan diameter batang pohon dan usia pohon menentukan
banyaknya logam berat dan zat-zat lain yang terakumulasi di dalam pohon
tersebut. Semakin besar diameter batang pohon maka usia pohon juga semakin tua
sehingga akumulasi zat-zat yang terdapat di dalam pohon tersebut semakin besar.
Data mengenai diameter dan tinggi sampel pancang maupun pohon tercantum
pada Lampiran 4.
Jumlah logam berat yang diserap di akar mangrove berkurang kadarnya
ketika sudah sampai di batang mangrove karena logam tersebut sudah
ditranslokasikan ke bagian tanaman lain melalui xilem dan diakumulasikan di
daun-daun tua yang akan mengalami absisi daun sehingga kadar logam berat yang
tertinggal di batang sedikit. Hal ini sesuai dengan pernyataan Priyanto dan
Prayitno (2006) yang mengatakan bahwa mekanisme penyerapan logam berat
pada tanaman melalui akar dapat dibagi menjadi tiga proses yaitu penyerapan
logam berat oleh akar, kedua melalui translokasi logam dari akar ke bagian
tanaman lain melalui jaringan pengangkut (xilem) dan ketiga lokalisasi logam
pada sel dan jaringan yang bertujuan untuk menjaga agar logam tidak
menghambat metabolisme tanaman.
Kandungan Logam Berat Cu dan Pb Pada Air dan Sedimen
Kandungan logam berat Cu pada sampel air pancang dan pohon
bervariasi namun tidak menunjukkan perbedaan nilai yang cukup jauh.
Kandungan logam Cu pada sampel air pancang adalah 0,04 mg/L, sedangkan
kandungan logam Cu pada sampel air pohon adalah 0,06 mg/L. Logam Pb yang
dengan logam Cu. Air pancang mengandung logam Pb 0,01 mg/L dan air pohon
mengandung logam Pb 0,01 mg/L.
Karena menurut KEPMEN KLH No 51 Tahun 2004 (Lampiran 2) baku
mutu air laut untuk biota laut tidak boleh mengandung logam Cu dan Pb melebihi
0,008 mg/L maka kandungan logam pada titik pengambilan sampel pancang dan
pohon R. apiculata di hutan mangrove Kuala Dewi masih berada di bawah ambang batas baku mutu yang telah ditetapkan KEPMEN KLH No 51 Tahun
2004.
Menurut Bryan (1984) logam berat yang masuk ke sistem perairan, baik
di sungai maupun lautan akan dipindahkan dari badan airnya melalui tiga proses
yaitu pengendapan, adsorbsi, dan absorbsi oleh organisme-organisme perairan.
Pada saat buangan limbah industri masuk ke dalam suatu perairan maka akan
terjadi proses pengendapan dalam sedimen. Hal ini menyebabkan konsentrasi
bahan pencemar dalam sedimen meningkat. Logam berat yang masuk ke dalam
lingkungan perairan akan mengalami pengendapan, pengenceran dan dispersi,
kemudian diserap oleh organisme yang hidup di perairan tersebut.
Kandungan logam sedimen pada tingkat pancang dan pohon memiliki
perbedaan nilai yang cukup jauh dimana pancang Cu mengandung 1,24 mg/kg
sedangkan pohon mengandung logam Cu 2,21 mg/kg. Pada logam Pb terdapat
perbedaan yang cukup signifikan juga dimana pancang mengandung 1,23 mg/kg
sedangkan pohon mengandung 2,27 mg/kg. Berdasarkan IADC/CEDA (1997)
kandungan logam berat Pb dan Cu pada sedimen di lokasi pengambilan sampel
masih berada di bawah nilai level target, yang berarti logam berat yang ada di
Pada sedimen yang berada di sekitar pohon logam Pb yang terkandung
lebih banyak jika dibandingkan dengan logam Cu. Hal ini mungkin disebabkan
karena pada lokasi pengambilan sampel pohon sedimen yang berada di sekitarnya
banyak tercemari logam Pb dan potensi buangan Pb ke perairan akibat aktivitas
manusia lebih besar daripada Cu.
Rata-rata kandungan logam berat di air lebih sedikit jika dibandingkan
dengan kandungan logam di dalam sedimen. Hal ini disebabkan karena kelarutan
logam di air cukup rendah sehingga kadarnya relatif sedikit. Hal ini juga didukung
oleh pernyataan Sutamihardja dkk (1982) yang mengatakan bahwa salah satu
sifat dari logam berat adalah mudah terakumulasi pada sedimen, sehingga
konsentrasinya selalu lebih tinggi dari konsentrasi logam dalam air. Selain itu
sedimen mudah tersuspensi karena pergerakan masa air yang akan melarutkan
kembali logam yang dikandungnya ke dalam air, sehingga sedimen menjadi
sumber pencemar potensial dalam skala waktu tertentu.
Faktor Biokonsentrasi (BCF) Untuk Menilai Kemampuan Rhizophoraapiculata dalam Mengakumulasi Logam Berat Cu dan Pb
Faktor biokonsentrasi (BCF) adalah konsentrasi suatu senyawa di dalam
suatu organisme percobaan dibagi dengan konsentrasi senyawa tersebut dalam
medium air satuannya (L/kg). Untuk mendapatkan faktor biokonsentrasi dari
R. apiculata maka kandungan logam berat Cu dan Pb dari akar, kulit batang dan daun dibagi dengan konsentrasi logam berat Cu dan Pb pada air dari kedua
stasiun. Faktor biokonsentrasi dihitung untuk melihat kemampuan
Dari Tabel 4 diatas dapat dilihat bahwa nilai BCF Cu pada pancang
Rhizophora apiculata lebih tinggi daripada tingkat pohon jenis R. apiculata yaitu 2345,10. Sedangkan nilai BCF pada logam Pb lebih tinggi pada tingkat pohon
yaitu 821,43. Data dasar kandungan logam berat pada tiap-tiap bagian pancang
atau pohon tercantum di Lampiran 3.
Berdasarkan Tabel 4, dapat disimpulkan bahwa tingkat pancang lebih
efektif dalam menyerap logam Cu sedangkan tingkat pohon lebih efektif dalam
menyerap logam Pb. Cu merupakan unsur hara mikro yang dibutuhkan tanaman
walaupun dalam jumlah yang sedikit. Pancang merupakan tingkat permudaan
yang masih membutuhkan banyak unsur hara yang dapat menunjang proses
pertumbuhannya serta proses fisiologisnya. Tingginya konsentrasi Cu pada
pancang menunjukkan kebutuhan fisiologi dari pancang itu sendiri.
Logam Pb pada dasarnya merupakan unsur toksik yang sama sekali
tidak dibutuhkan oleh tanaman. Itulah sebabnya pancang hanya mampu menyerap
sedikit logam Pb karena diameter batang, besarnya akar serta jumlah daun yang
dimilikinya masih sedikit. Sedangkan pohon mampu menyerap lebih banyak
logam Pb karena diameter batangnya yang besar, akarnya yang banyak serta
jumlah daunnya yang banyak mampu menjadi tempat menyimpan logam Pb
dalam muatan besar.
Nilai BCF Cu lebih besar dari nilai BCF Pb, hal ini disebabkan karena
Cu merupakan unsur hara mikro bagi tumbuhan yang dibutuhkan dalam jumlah
sedikit namun dapat menghambat metabolisme suatu tanaman jika berada dalam
merupakan unsur hara essensial bagi tanaman dan menjadi toksik bagi tanaman
bila konsentrasi yang terkandung tinggi.
Nilai BCF Cu pada pancang dan pohon tergolong tinggi yaitu 2345,10
dan 1595,54. Nilai BCF Pb pada pancang dan pohon tergolong sedang yaitu
394,29 dan 821,43. Dari faktor biokonsentrasi diatas dapat disimpulkan bahwa
jenis Rhizophora apiculata memiliki kecenderungan untuk menyerap dan mengakumulasi logam berat yang terkandung di dalam habitat tempat tinggalnya.
Perbedaan penyerapan logam pada bagian tumbuhan disebabkan karena
mekanisme penyerapan logam pada tumbuhan itu sendiri yang berbeda satu sama
lain. Hal ini sesuai dengan pernyataan Priyanto dan Prayitno (2006) yang
menyatakan bahwa mekanisme penyerapan logam berat pada tanaman melalui
akar dapat dibagi menjadi tiga proses yang sinambung. Pertama adalah
penyerapan logam berat oleh akar. Kedua, melalui translokasi logam dari akar ke
bagian tanaman lain, Ketiga, lokalisasi logam pada sel dan jaringan yang
KESIMPULAN DAN SARAN
Kesimpulan
1. Kandungan logam Cu rata-rata pada akar, daun dan kulit pancang Rhizophora apiculata berturut-turut adalah 19,23 mg/kg, 55,84 mg/kg dan 9,74 mg/kg. Kandungan logam Cu rata-rata pada akar, daun dan kulit pohon R. apiculata
berturut-turut adalah 21,84 mg/kg, 57,46 mg/kg dan 15,30 mg/kg. Kandungan
logam Pb rata-rata pada akar, daun dan kulit pancang R. apiculata berturut-turut adalah 0,53 mg/kg, 1,42 mg/kg dan 0,36 mg/kg. Kandungan logam Pb
rata-rata pada akar, daun dan kulit pohon R. apiculata adalah 1,27 mg/kg, 2,68 mg/kg dan 1,80 mg/kg.
2. Nilai BCF Cu pada pancang R. apiculata lebih tinggi daripada tingkat pohon jenis R. apiculata yaitu 2345,10. Sedangkan nilai BCF pada logam Pb lebih tinggi pada tingkat pohon yaitu 821,43.
Saran
Rhizophora apiculata merupakan salah satu jenis mangrove yang dapat mengakumulasi logam Cu dan Pb sehingga perlu dilakukan peningkatan jumlah
DAFTAR PUSTAKA
Arief, A . 2003. Hutan dan Kehutanan. Penerbit Kanisius. Yogyakarta.
Arisandi, P. 2008. Bioakumulasi Logam Berat Dalam Pohon Bakau (Rhizophora mucronata) dan Pohon Api-Api (Avicennia marina). http ://ecoton.terranet.or.id [1 April 2014]
Bengen, D. G. 2001. Pedoman Teknis Pengenalan dan Pengelolaan Ekosistem Mangrove. Pusat Kajian Sumberdaya Pesisir dan Lautan. IPB Press. Bogor.
BPLHD Jawa Barat. 2008. Hasil Analisis Kualitas Air Sungai Cikijing. Jawa Barat.
Brooks, R. R. 1989. Terrestrial Higher Plants Which Hyperaccumulate Metal Elements. A Review of Their Distribution, Ecology And Phytochemistry. Biorecovery.
Bryan, G.W. 1984. Heavy Metal Contamination in The Sea. Marine Pollution Bulletin. London Academic Press. London.
Darmono. 1995. Logam Dalam Sistem Biologi Makhluk Hidup. UI Press. Jakarta.
Effendi, H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumber Daya Dan Lingkungan Perairan. Penerbit Kanisius. Yogyakarta.
Fardiaz, S. 2005. Polusi Air dan Udara. Kanisius. Yogyakarta.
Fitter, A. H dan R.K.M. Hay. 1991. Fisiologi Lingkungan Tanaman. UGM Press. Yogyakarta.
Hutagalung. 1994. Kandungan Logam Berat Dalam Sedimen di Kolam Pelabuhan Tanjung Priok Jakarta. Makalah Penunjang Seminar Pemantauan Pencemaran Laut Pusat Penelitian Dan Pengembangan Oseanologi. LIPI. Jakarta.
Lindsey, H.D., M.M. James, and M.G. Hector. 2004. An Assessment of Metal Contamination in Mangrove Sediments and Leaves From Punta Mala Bay, Pacific Panama. Marine Pollution Bulletin. London Academic Press. London.
Macnae, W. 1978. A General Account of The Fauna and Flora Mangrove Swamp and Forest in The Indo Pacific Region. Adv. Mor .Biol. 6 : 73-270.
Pertanian. Departemen Pertanian. Bogor.
Merian, E. 1994. Toxic Metal In The Environment. Vch verlagsgeselischattmbh. Weinheim.
Moore, J.W., and S. Ramamoorthy. 1984. Organic Chemicals in Natural Waters – Applied Monitoring and Impact Assessment. New York – Berlin – Heidelberg – Tokyo, Springer Verlag.
Munawar, A dan Rina. 2010. Kemampuan Tanaman mangrove Untuk Menyerap
Logam Merkuri Dan Timbal. Jurnal Ilmiah Teknik Lingkungan Vol. 2 No. 2
Nybakken, J.W. 1992. Biologi Laut. Suatu Pendekatan Ekologis. PT. Gramedia. Jakarta.
Panjaitan, G. Y. 2009. Akumulasi Logam Berat Tembaga (Cu) dan Timbal (Pb) Pada Pohon Avicennia marina di Hutan Mangrove. USU Press. Medan. Perales, I. 2003. Culture Media of Aeromonas spp. and Plesiomonas shigelloides.
Handbook of Culture Media for Food Microbiology.
Priyanto, B., dan J. Prayitno. 2006. Fitoremediasi Sebagai Sebuah Teknologi Pemulihan Pencemaran, Khusus Logam Berat. [1 April 2014]
Sanusi, H. S. 2006. Kimia Laut Proses Fisik Kimia dan Interaksinya Dengan Lingkungan. Departemen Ilmu dan Teknologi Kelautan. Fakultas Perikanan dan Ilmu Kelautan. IPB Press. Bogor.
Soemirat, J. 2003. Toksikologi Lingkungan. UGM Press. Yogyakarta.
Subiandono, E, M. Bismark, dan N. M. Heriyanto. 2013. Kemampuan
Avicennia Marina (Forsk.) Vierh. dan Rhizophora apiculata Bl. Dalam Penyerapan Polutan Logam Berat Pusat Litbang Konservasi Dan Rehabilitasi. Bogor.
Sukardjo, S. 2002. Integrated Coastal Zone Management (ICZM) in Indonesia: A View from a Mangrove Ecologist. Southest Asian Studies. Vol. 40 No.2, September 2002.
Supriharyono, 2007. Konservasi Ekosistem Sumber Daya Hayati di Wilayah Pesisir dan Laut Tropis. Pustaka Pelajar. Yogyakarta.
Tomlinson, C. B. 1986. The Botany of Mangroves. Cambridge Tropical Biology Series. Cambridge University Press. Cambridge, New York, U.S.
Vogel. 1994. Qualitative Inorganik Analysis. Department of Chemistry Queens University. Belfast, N. Ireland.
Walsh, G.E. 1974. Mangrove, A Review. In : Ecology of Halophytes sp. New York Academic Press. New York.
Lampiran 1. Dokumentasi Penelitian
Pengambilan Sampel Rhizophora apiculata
Lampiran 1. Lanjutan
Penyaringan Sampel Air
Lampiran 1. Lanjutan
Tanur Untuk Proses Pengabuan
Lampiran 1. Lanjutan
Penambahan HNO3 Pada Sampel Kering
Lampiran 2. KEPMEN LH No 51. Tahun 2004 Tentang Baku Mutu Air Laut
10 PAH (Poliaromatik hidrokarbon) mg/l 0.003
11 Senyawa fenol total mg/l 0.002
18 Kromium heksavalen (Cr(VI)) mg/l 0.005
20 Kadmium (Cd) mg/l 0.001
1. Nihil adalah tidak terdeteksi dengan batas deteksi alat yang digunakan (sesuai dengan metode yang digunakan)
2. Metode analisa mengacu pada metode analisa untuk air laut yang telah ada, baik internasional maupun nasional.
3. Alami adalah kondisi normal suatu lingkungan, bervariasi setiap saat (siang, malam dan musim)
4. Pengamatan oleh manusia (visual).
5. Pengamatan oleh manusia (visual). Lapisan minyak yang diacu adalah lapisan tipis (thin layer) dengan ketebalan 0,01mm
6. Tidak bloom adalah tidak terjadi pertumbuhan yang berlebihan yang dapat menyebabkan eutrofikasi. Pertumbuhan plankton yang berlebihan
dipengaruhi oleh nutrient, cahaya, suhu, kecepatan arus dan kestabilan plankton itu sendiri
7. TBT adalah zat antifouling yang biasanya terdapat pada cat kapal
a. Diperbolehkan terjadi perubahan sampai dengan <10% kedalaman
euphotic
b. Diperbolehkan terjadi perubahan sampai dengan <10% konsentrasi rata-rata musiman
c. Diperbolehkan terjadi perubahan sampai dengan <2oC dari suhu alam. d. Diperbolehkan terjadi perubahan sampai dengan <0,2 satuan pH
e. Diperbolehkan terjadi perubahan sampai dengan <5% salinitas rata-rata musiman
f. Diperbolehkan terjadi perubahan sampai dengan <10% konsentrasi rata-rata musiman.
Lampiran 3. IADC / CEDA Tahun 1997 Tentang Baku Mutu Logam Berat
a. Level target. Jika konsentrasi kontaminan yang ada pada sedimen memiliki
nilai yang lebih kecil dari nilai level target, maka substansi yang ada pada
sedimen tidak terlalu berbahaya bagi lingkungan.
b. Level limit. Jika konsentrasi kontaminan yang ada di sedimen memiliki nilai
maksimum yang dapat ditolerir bagi kesehatan manusia maupun ekosistem.
c. Level tes. Jika konsentrasi kontaminan yang ada di sedimen berada pada
kisaran nilai antara level limit dan level tes, maka dikategorikan sebagai
tercemar ringan.
d. Level intervensi. Jika konsentrasi kontaminan yang ada di sedimen berada pada
kisaran nilai antara level tes dan level intervensi, maka dikategorikan sebagai
tercemar sedang.
e. Level bahaya. Jika konsentrasi kontaminan berada pada nilai yang lebih besar
dari baku mutu level bahaya maka harus dengan segera dilakukan pembersihan
42
Lampiran 3. Data Dasar Konsentrasi Logam Berat
44
NAMA SAMPEL K. AAS VOL. PELARUT BERAT SAMPEL K. SEBENARNYA RATA - RATA
Air Pohon Cu 1 0,33 35 100 0,12 0,06
Air Pohon Cu 2 0,10 35 100 0,04
Air Pohon Cu 3 0,07 35 100 0,03
Air Pancang Pb 1 0,03 35 100 0,01 0,01
Air Pancang Pb 2 0,01 35 100 0,003
Air Pancang Pb 3 0,01 35 100 0,003
Air Pohon Pb 1 0,02 35 100 0,01 0,01
Air Pohon Pb 2 0,01 35 100 0,003
Air Pohon Pb 3 0,03 35 100 0,01
Lampiran 4. Tally Sheet Pengambilan Sampel di Lapangan
Tally sheet pengambilan sampel pancang
TALLY SHEET PENGAMBILAN SAMPEL PANCANG PLOT
Tally sheet pengambilan sampel pohon