ANALISA KOMPONEN KIMIA MINYAK ATSIRI RIMPANG
JAHE MERAH (Zingiber officinale var. amarum) DENGAN
GC-MS DAN UJI ANTIOKSIDAN MENGGUNAKAN
METODE DPPH
SKRIPSI
LIESA SIAHAAN
120822023
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ANALISA KOMPONEN KIMIA MINYAK ATSIRI RIMPANG
JAHE MERAH (Zingiber officinale var. amarum) DENGAN
GC-MS DAN UJI ANTIOKSIDAN MENGGUNAKAN METODE
DPPH
SKRIPSI
Diajukan Untuk Melengkapi Tugas Dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
LIESA SIAHAAN
120822023
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ANALISIS KOMPONEN KIMIA MINYAK
ATSIRI RIMPANG JAHE MERAH (Zingiber officinale var. amarum) DENGAN GC-MS DAN UJI ANTIOKSIDAN MENGGUNAKAN METODE DPPH
Kategori : SKRIPSI
Nama : LIESA SIAHAAN
Nomor Induk Mahasiswa : 120822023
Program : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (MIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan , Juli 2014
Komisi Pembimbing
Pembimbing 2, Pembimbing 1,
Dr. Mimpin Ginting , M.S Dr. Lamek Marpaung, M.Phil, Ph.D NIP. 195510131986011001 NIP. 195208281982031001
Disetujui Oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI RIMPANG JAHE MERAH (Zingiber officinale var. amarum) DENGAN GC-MS DAN UJI
ANTIOKSIDAN MENGGUNAKAN METODE DPPH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan , Juli 2014
PENGHARGAAN
Kepada Tuhan yang melaluiNya penulis dapat melakukan segala hal. Segala puji bagi Allah yang mencurahkan rahmat, berkah dan karunianNya kepada penulis sehingga dapat menyelesaikan perkuliahan dan penulisan karya ilmiah ini merupakan salah satu syarat guna menyelesaikan Studi Program Sarjana (S1) Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, dengan judul Analisis Komponen Kimia Minyak Atsiri Rimpang Jahe Merah (Zingiber officinale var. amarum) dengan GC-MS dan Uji Antioksidan Menggunakan Metode DPPH.
Selesainya Karya Ilmiah ini juga tidak lepas dari bantuan dan bimbingan dari berbagai pihak. Oleh karena itu dengan kerendahan hati penulis mengucapkan terimakasih banyak kepada Bapak Dr. Lamek Marpaung, M.Phil, Ph.D selaku pembimbing I serta Bapak Dr. Mimpin Ginting , M.S selaku pembimbing II yang telah meluangkan waktunya memberikan arahan dan mendampingi penulis melakukan penelitian dan penyusunan skripsi ini hingga selesai.
Mengucapkan terima kasih juga kepada Ibu Dr. Rumondang Bulan M.S dan Bapak Drs. Albert Pasaribu, M.Sc selaku Ketua dan sekretaris Departemen Kimia, seluruh staff pengajar di Depatemen Kimia FMIPA USU yang telah membimbing penulis selama perkuliahan, Dekan dan Pembantu Dekan serta pegawai FMIPA USU.
Penulis juga mengucapkan terima kasih kepada Ayah dan Ibu tercinta , adik-adik tersayang yang telah memberikan doa restunya , semangat dan dukungan baik secara moril maupun materi mulai dari perkuliahan hingga selesainya penelitian dan penyusunan skripsi ini.
Analisis Komponen Kimia Minyak Atsiri Rimpang Jahe Merah (Zingiber officinale var. amarum) dengan GC-MS dan Uji Antioksidan
Menggunakan Metode DPPH
ABSTRAK
ANALYSIS OF CHEMICAL COMPONENTS OF ESSENTIAL OIL RED GINGER RHIZOME (Zingiber officinale var. amarum) WITH GC-MS AND
ANTIOXIDANT ACTIVITY METHOD DPPH
ABSTRACT
DAFTAR ISI
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
1.5. Metodologi Penelitian 3
1.6. Lokasi Penelitian 4
Bab 2. Tinjauan Pustaka
2.1. Tanaman Jahe 5
2.1.1. Klasifikasi Tanaman Jahe 6 2.1.2. Kandungan Kimia Rimpang Jahe secara umum 6 2.1.3. Kegunaan Rimpang Jahe secara umum 7
2.2. Terpenoid 8
2.3. Minyak Atsiri 12
2.3.1. Sifat-sifat Minyak Atsiri 13
2.3.2. Keberadaan Minyak Atsiri dalam tumbuhan 14 2.3.3. Biosintesis Komponen Minyak Atsiri 15
2.3.4. Kandungan Kimiawi Minyak Atsiri 16
2.3.5. Golongan Minyak Atsiri 17
2.3.6. Metode Isolasi Minyak Atsiri 18
2.4. Antioksidan 20
2.4.1. Klasifikasi Antioksidan 21
2.4.2. Radikal bebas dan Pengaruh Antioksidan 22
2.4.3. Uji Aktivitas Antioksidan 24
2.4.4. Metode Pengukuran Aktivitas 25
Antioksidan Dengan Metode DPPH
2.5. Analisa Komponen Kimia Minyak Atsiri 26
2.5.1. Kromatografi Gas-Spektroskopi Massa (GC-MS) 26
2.5.2. Spektrofotometri 28
2.5.2.1. Spektrofotometri UV-VIS 30
2.5.2.2. Prinsip Kerja 30
Bab 3. Metodologi Penelitian
3.1. Alat-alat 32
3.3.4. Uji Sifat Antioksidan Minyak Atsiri 34 Rimpang Jahe Merah dengan Metode DPPH
3.3.4.1. Pembuatan Larutan DPPH 0,3 mM 34 3.3.4.2. Pembuatan Variasi Minyak Atsiri 34 Rimpang Jahe Merah
3.3.4.3. Uji Aktivitas Antioksidan 35
3.3.4.3.1. Larutan Blanko 35
3.3.4.3.2. Uji Aktivitas Antioksidan Rimpang Jahe Merah
Minyak Atsiri 35
3.4. Bagan Penelitian 36
3.4.1. Isolasi Minyak Atsiri Rimpang Jahe Merah 36 dengan Destilasi Stahl
3.4.2. Uji Sifat Antioksidan Minyak Atsiri 36 Rimpang Jahe Merah dengan Metode DPPH
3.4.2.1. Pembuatan Larutan DPPH 0,3 mM 36 3.4.2.2. Pembuatan Variasi Minyak Atsiri 37 Rimpang Jahe Merah
3.4.3. Uji Aktivitas Antioksidan 38
3.4.3.1. Larutan Blanko 38
Bab 4. Hasil dan pembahasan
4.1. Hasil Penelitian 39
4.1.1. Hasil Isolasi Minyak Atsiri Rimpang Jahe Merah 39 4.1.2. Hasil Uji Aktivitas Minyak Atsiri Rimpang Jahe 43
4.2. Pembahasan 43
4.2.1. Minyak Atsiri Dari Hasil Destilasi Alat Stahl 43 4.2.2. Analisis Spektrum Massa Minyak Atsiri 44 Rimpang Jahe Merah
4.2.3. Uji Aktivitas Minyak Atsiri Rimpang Jahe Merah 64 dengan Metode DPPH
Bab 5. Kesimpulan dan Saran
5.1. Kesimpulan 67
5.2. Saran 67
Daftar pustaka 68
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1. Karakteristik Tiga Jenis Jahe 5
2.2. Warna Komplementer 27
4.1. Minyak Atsiri Rimpang Jahe Merah yang Diperoleh
dengan Metode Hidrodestilasi 39
4.2. Hasil Senyawa Analisis GC-MS Minyak Atsiri Rimpang 40 Jahe Merah
DAFTAR GAMBAR
2.3. Perubahan Senyawa Monoterpen 11
2.4. Reaksi Biogenetik Beberapa Seskuiterpen 12
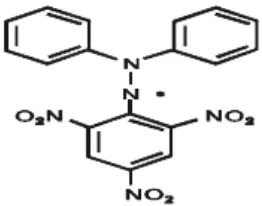
2.5. Ruang Bangun DPPH 24
4.15. Pola Fragmentasi yang Mungkin dari Senyawa Borneol 56
4.16. Spektrum Massa Zingiberen 57
4.17. Pola Fragmentasi yang Mungkin dari Senyawa Zingiberen 58
4.18. Spektrum Massa Limonene 60
4.19. Pola Fragmentasi yang Mungkin dari Senyawa Limonene 60
4.20. Spektrum Massa Mirsen 62
4.21. Pola Fragmentasi yang Mungkin dari Senyawa Mirsen 62
4.22. Spektrum Massa Terpineol 64
4.23. Pola Fragmentasi yang Mungkin dari Senyawa Terpineol 64 4.24. Reaksi antara DPPH dengan atom H netral 65
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lamp.
1. % Minyak Atsiri Yang Diisolasi dengan
Metode Stahl 73
2. Pembuatan Variasi Konsentrasi Sampel 73 3. Hasil Uji Aktivitas Antioksidan 74 4. Perhitungan nilai IC50 Minyak Atsiri Jahe Merah 75 5. Grafik % Peredaman Vs Konsentrasi Dari Uji
Aktivitas Minyak Atsiri Rimpang Jahe Merah
Terhadap DPPH Radikal Bebas 76
6. Gambar Alat Stahl 77
7. Hasil Data GC-MS Minyak Atsiri Rimpang Jahe Merah 78 8. Senyawa Hasil Analisa GC-MS Minyak Atsiri
Rimpang Jahe Merah Sesuai dengan Standart
Library Wiley 79
9. Gambar Hasil Uji Antioksidan 90
Analisis Komponen Kimia Minyak Atsiri Rimpang Jahe Merah (Zingiber officinale var. amarum) dengan GC-MS dan Uji Antioksidan
Menggunakan Metode DPPH
ABSTRAK
ANALYSIS OF CHEMICAL COMPONENTS OF ESSENTIAL OIL RED GINGER RHIZOME (Zingiber officinale var. amarum) WITH GC-MS AND
ANTIOXIDANT ACTIVITY METHOD DPPH
ABSTRACT
BAB I
PENDAHULUAN
1.1. Latar Belakang
Salah satu jahe yang kita kenal adalah jahe merah yang memiliki rimpang dengan bobot 0,5-0,7 kg/rumpun. Strukturnya kecil berlapis-lapis dan daging rimpang berwarna merah. Jahe merah dipanen setelah usia tanaman cukup tua (Hapsoh, et al. , 2010). Komposisi kimia jahe sangat dipengaruhi oleh berbagai faktor, antara lain waktu panen, lingkungan tumbuh (ketinggian tempat, curah hujan, jenis tanah), keadaan rimpang (segar atau kering) dan geografi (Mustafa dan Srivastava 1990; Ali et al., 2008). Rasa pedas dari jahe segar berasal dari kelompok senyawa gingerol, yaitu senyawa turunan fenol. Komponen tertinggi dari gingerol adalah [6]-gingerol. Rasa pedas dari jahe kering berasal dari senyawa shogaol , yang merupakan hasil dehidrasi dari gingerol. Di dalam jahe merah Indonesia senyawa gingerol dan shogaol yang ditemukaan adalah [6]-gingerol dan [6]-shogaol (Hernani dan Hayani 2001). Komponen kimia utama pemberi rasa pedas adalah keton aromatik yang disebut gingerol terdiri dari 6, 8 dan 10 gingerol.
Adanya variasi komponen kimia dalam minyak atsiri jahe bukan saja dikarenakan varitasnya, tetapi kondisi agroklimat (iklim, musim, geografi) lingkungan, tingkat ketuaan, adaptasi metabolit dari tanaman, kondisi destilasi dan bagian yang dianalisa (Anwar et al. 2009; Abd El Baky and El Baroty, 2008; Singh et al., 2008; Wang et al., 2009).
Menurut Hapsoh, et al (2010) jahe merah memiliki kegunaan yang paling banyak dibandingkan jahe yang lainnya. Jahe ini adalah bahan penting dalam industri jamu tradisional dan umumnya dipasarkan dalam bentuk segar dan kering. Jahe jenis ini sangat cocok digunakan untuk ramuan obat-obatan .
Antioksidan adalah zat penghambat reaksi oksidasi akibat radikal bebas yang dapat menyebabkan kerusakan asam lemak tak jenuh, membran dinding sel, pembuluh darah, basa DNA, dan jaringan lipid sehingga menimbulkan penyakit. Suatu tanaman dapat memiliki aktivitas antioksidan apabila mengandung senyawa yang mampu menangkal radikal bebas seperti fenol dan flavonoid (Subeki, 1998). Antioksidan adalah senyawa dengan berat molekul kecil yang dapat bereaksi dengan oksidan (Langseth, 1995). Aktivitas antioksidan dapat diuji dengan menggunakan metode DPPH (2,2 –diphenil-I-picrylhydrazyl).
Hasil penelitian farmakologi menyatakan bahwa senyawa antioksidan alami dalam jahe cukup tinggi dan sangat efisien dalam menghambat radikal bebas superoksida dan hidroksil yang dihasilkan oleh sel-sel kanker dan bersifat sebagai antikarsinogenik, non-toksik dan non-mutagenik pada konsentrasi tinggi (Manju dan Nalini, 2005). Beberapa senyawa, termasuk gingerol, shogaol dan zingeron memberikan aktivitas farmakologi dan fisiologis seperti efek antioksidan, antiinflammasi, analgesik, antikarsinogenik dan kardiotonik (Surh et al., 1998; Masuda et al., 1995). Jahe ternyata dapat mengurangi mual sebagai efek samping dari pengobatan kemoterapi, bahkan hasil dari penelitian menunjukkan bahwa jahe dapat melawan sel kanker (Platel and Srinivasan, 1995). Semua ini dikarenakan adanya efek sinergisitas dari zingiberen dan komponen turunannya yang memberikan efek farmakologi. Kandungan sejumlah magnesium, kalsium, protein, besi, sodium, kalium dan fosfor akan memberikan perbaikan untuk otot, depresi, lemah otot, kejang, dan kerusakan lambung. Tingginya kadar kalium akan melindungi kerusakan tulang, paralisis, sterilitas, lemah otot kerusakan ginjal dan hati (Murad dan Marina, 2002).
sehingga data yang diperoleh peneliti mampu memberikan perbandingan dengan hasil penelitian jahe yang lainnya.
1.2. Permasalahan
1. Komponen senyawa kimia apa sajakah yang terdapat pada minyak atsiri yang diperoleh dari rimpang jahe merah
2. Bagaimanakah aktivitas antioksidan dari minyak atsiri rimpang jahe merah yang ditentukan dengan metode DPPH
1.3. Tujuan Penelitian
1. Untuk mengetahui komposisi senyawa kimia yang terdapat pada rimpang jahe merah dengan metode GC-MS
2. Untuk Menghetahui aktivitas antioksidan dari minyak atsiri rimpang jahe merah menggunakan metode DPPH (2,2 –diphenyl-1- picrylhydrazyl).
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi di bidang kimia bahan alam mengenai komposisi-komposisi senyawa kimia pada minyak atsiri dan aktivitas antioksidan minyak atsiri rimpang jahe merah.
1.5. Metodologi Penelitian
Penelitian yang dilakukan bersifat eksperimen. Rimpang jahe merah diambil dari desa Saribu Dolok secara rendemen. Isolasi minyak atsiri dari bahan segar rimpang jahe merah dilakukan dengan metode hidrodestilasi menggunakan alat Stahl. Destilat ditampung kemudian diekstrak menggunakan dietil eter. Lapisan eter diuapkan. Kemudian ditambahkan Na2SO4 anhidrous sehingga didapat hasil minyak atsiri. Minyak atsiri yang diperoleh dianalisa dengan
1.6. Lokasi Penelitian
1. Pengekstraksian minyak atsiri dilakukan di laboratorium Kimia Bahan Alam FMIPA USU Medan
2. Uji aktioksidan dilakukan dilaboratorium Pusat Penelitian USU Medan 3. Analisa GC-MS dilakukan di laboratorium Kimia Organik FMIPA UGM
BAB II
TINJAUAN PUSTAKA
2.1. Tanaman Jahe
Jahe (Zingiber officinale rosc) merupakan salah satu dari temu-temuan suku
Zingiberaceae yang menempati posisi yang sangat penting dalam perekonomian masyarakat Indonesia serta memiliki banyak kegunaanya (Hapsoh, et al., 2010). Tanaman jahe ini adalah tanaman rumput-rumputan berbatang semu. Batang semu jahe diselubungi oleh dasar pelepah daun. Bagian jahe yang banyak digunakan manusia adalah rhizomanya. Rhizo ataupun rimpang jahe merupakan batang yang tumbuh dalam tanah. Bentuk rimpang jahe bercabang-cabang dan tidak teratur. Tanaman jahe dapat diperbanyak dengan menanam rhizoma yang sudah cukup tua, minimal berumur 9 bulan (Koswara, 1995).
Tabel 2.1. Karakteristik Tiga Jenis Jahe :
Bagian tanaman Jahe gajah Jahe emprit Jahe merah Struktur rimpang Besar berbuku Kecil berlapis Kecil berlapis
Warna irisan Putih
Sumber : Dimodifikasi dari Rostiana dkk. (1991); Sri Yuliani dan Risfaheri (1990) diacu dalam Bermawie, dkk (1997)
2.1.1. Klasifikasi Tanaman Jahe
Divisi : Spermatophyta
Sub-divisi : Angiospermae
Kelas : Monocotyledoneae
Ordo : Zingiberales
Famili : Zingiberaceae
Genus : Zingiber
Species : Zingiber officinale Rosc
Varietas : Zingiber officinale var. officinale (kuning besar / jahe gajah)
Zingiber officinale var. rubrum (kuning kecil/ jahe emprit)
Zingiber officinale var. amarum (jahe Sunti/ jahe merah)
Gambar. 2.1 Tanaman Jahe Merah
2.1.2. Kandungan Kimia Rimpang Jahe Secara Umum
Minyak atsiri merupakan campuran senyawa organik mudah menguap (volatile oil), tidak larut air dan memiliki bau yang khas. Kandungan minyak atsiri dalam jahe kering sekitar 1-3 %. Minyak ini kebanyakan mengandung terpen, fellandren, dextrokamfen, bahan sesquiterpen yang dinamakan zingiberen, zingeron damar dan pati. Komponen utama minyak atsiri jahe yang menyebabkan bau harum adalah zingiberen (35%), kurkumin (18%), farnesene (10%) serta bisaolene dan –sesquiphellandrene dalam jumlah kecil. Disamping itu juga terdapat sedikitnya 40 hidrokarbon monoterpenoid yang berbeda seperti 1,8 – cineole, linalool, borneol, neral dan geraniol (Govindarajan, 1982).
Kandungan minyak atsiri jahe merah sekitar 2,58-3,90% yang dihitung berdasarkan berat kering. Kandungan atsiri pada jahe putih adalah 0,82- 1,68%, sedangkan pada jahe putih kecil yaitu 1,5-3,3 %. Senyawa minyak atsiri pada umumnya berwarna kuning, sedikit kental. Kandungan minyak atsiri pada jahe sangat dipengaruhi umur tanaman dan umur panen. Semakin tua umur jahe maka semakin tinggi kandungan minyak atsirinya.Komponen ini merupakan pembentuk rasa pedas yang tidak menguap pada jahe. Komponen dalam oleoresin jahe terdiri atas gingerol, gingerdiols, gingerdiones, dihidrogingerdiones, shagaol, paradols dan zingerone yang memberikan rasa pedas dimulut. Gingerol merupakan komponen aktif utama pada jahe segar (Govindarajan, 1982). Shagaol adalah komponen utama pada jahe kering (Connel and Sutherland, 1969).
2.1.3. Kegunaan Rimpang Jahe Secara Umum
Jahe merupakan jenis rempah-rempah yang memiliki nilai ekonomis yang cukup tinggi karena rimpangnya paling banyak digunakan sebagai bumbu untuk berbagai resep makanan, pemberi rasa dan aroma pada makanan seperti roti, kue, biskuit, kembang gula maupun sebagai bahan dasar dari pembuatan minuman. Jahe juga digunakan pada industri obat, minyak wangi, industri jamu tradisional, ataupun diolah menjadi asinan jahe dan acar, lalap, bandrek, sekoteng dan sirup.
penawar racun ular dan sebagai obat luar untuk mengobati gatal digigit serangga, keseleo, bengkak, serta memar (Hapsoh ,et.al., 2010).
2.2. Terpenoid
Terpenoid merupakan komponen yang biasa ditemukan dalam minyak atsiri. Sebagian besar terpenoid mengandung atom karbon yang jumlahnya merupakan kelipatan lima. Terpenoid mempunyai kerangka karbon yang terdiri dari dua atau lebih unit C5 yang disebut unit isopren (Sjamsul, 1986).Berdasarkan jumlah atom C yang terdapat pada kerangkanya, terpenoid dapat dibagi menjadi hemiterpen dengan 5 atom C, monoterpen dengan 10 atom C, seskuiterpen dengan 15 atom C, diterpen dengan 20 atom C, triterpen dengan 30 atom C, dan seterusnya sampai dengan politerpen dengan atom C lebih dari 40 (Nagegowda, 2010; Dewick, 2009).
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi selanjutnya dari senyawa antara GPP, FPP, dan GGPP untuk menghasilkan senyawa-senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi sekunder pula. Reaksi –reaksi sekunder ini lazimnya addalah hidrolisa, siklisasi, oksidasi, reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarboksilasi, dan sebagainya. Berikut ini adalah gambar biosintesa terpenoid :
CH3 C
Asetil Koenzim A Asetosetil koenzim A
OPP
Gambar 2.2 Biosintesisa Terpenoid (Achmad, 1986)
CH2OH
Geraniol (trans)
OH
-H2o
Mirsen
CHO
Sitronelal
H , O
Linalool
CH2OH
Nerol (cis)
O
CHO
Gambar 2.3 Perubahan Senyawa Monoterpen (Achmad, 1986).
OH
Gambar 2.4 Reaksi Biogenetik Beberapa Seskuiterpena
Pada minyak atsiri yang bagian utamanya terpenoid, biasanya terpenoid itu terdapat pada fraksi minyak atsiri yang tersuling uap. Zat inilah penyebab wangi, harum atau bau yang khas pada banyak tumbuhan. Secara ekonomi senyawa tersebut penting sebagai dasar wewangian alam dan juga untuk rempah-rempah serta sebagai senyawa citarasa dalam industri makanan (Harborne, 1987).
2.3. Minyak Atsiri
serta warnanya berubah menjadi lebih tua (gelap). Untuk mencegah supaya tidak berubah warna, minyak atsiri harus terlindungi dari pengaruh cahaya, misalnya disimpan dalam bejana yang berwarna gelap. Bejana tersebut juga diisi sepenuh mungkin sehingga tidak memungkinkan berhubungan langsung dengan oksigen , ditutup rapat serta disimpan ditempat yang kering dan sejuk.
Secara kimia minyak atsiri merupakan senyawa tunggal, tetapi tersusun dari berbagai macam komponen yang secara garis besar terdiri dari kelompok terpenoid dan fenil propana. Pengelompokan tersebut didasarkan pada awal terjadinya minyak atsiri didalam tanaman. Melalui asal usul biosintetik, minyak atsiri dapat di bedakan menjadi :
1. Turunan terpenoid yang terbentuk melalui jalur biosintesis asam asetat mevalonat
2. Turunan fenil propanoid yang merupakan senyawa aromatik, terbentuk melalui jalur biosintesis asam sikimat
Terpenoid berasal dari suatu unit senyawa sederhana yang disebut sebagai isoprena. Sementara fenil propana terdiri dari gabungan inti benzena (fenil) dan propana. Penyusun minyak atsiri dari kelompok terpenoid dapat berupa terpena-terpena yang tidak membentuk cincin (asiklik), bercincin satu (monosiklik) ataupun bercincin dua (bisiklik). Masing-masing dapat memiliki percabangan gugus-gugus ester, fenol, oksida, aldehida, dan keton. Sementara kelompok fenil propana juga memiliki percabangan rantai berupa gugus-gugus fenol dan eter fenol ( Gunawan, 2010).
2.3.1. Sifat-Sifat Minyak Atsiri
Menurut Gunawan (2010) sifat-sifat minyak atsiri adalah : 1. Tersusun oleh bermacam-macam komponen senyawa
2. Memiliki bau khas. Umumnya bau ini mewakili bau tanaman asalna. Bau minyak atsiri satu dengan yang lainnya berbeda, sangat tergantung dari macam dan intensitas bau dari masing-masing komoponen penyusunnya 3. Dalam keadaan murni , belum tercemar oleh senyawa lain mudah
maka ketika dibiarkan menguap, tidak meninggalkan bekas noda pada benda yang ditempel
4. Bersifat tidak bisa disabunkan dengan alkali dan tidak bisa berubah menjadi tengik (rancid). Ini berbeda dengan minyak lemak yang tersusun oleh asam-asam lemak
5. Bersifat tidak stabil terhadap pengaruh lingkungan, baik pengaruh oksigen udara, sinar matahari (terutama gelombang ultra violet) dan panas karena terdiri dari berbagai macam komponen penyusun
6. Indeks bias umumnya tinggi
7. Pada umumnya bersifat optis aktif dan memutar bidang polarisasi dengan rotasi yang spesifik karena banyak komponen penyusun yang memiliki atom C simetrik
8. Pada umumnya tidak dapat bercampur dengan air tetapi cukup dapat larut hingga dapat memberikan baunya kepada air walaupun kelarutannya kecil 9. Sangat mudah larut dalam pelarut organik
2.3.2. Keberadaan Minyak Atsiri Dalam Tumbuhan
Tanaman penghasil minyak atsiri diperkirakan berjumlah 150 – 200 spesies tanaman yang termasuk famili Pinaceae, Labiateae, Compositae, Lauraceae, Myrtaceae, dan Umbelliferaceae. Minyak atsiri dapat bersumber pada setiap bagian tanaman yaitu dari daun, bunga, buah, biji, batang atau kulit dan akar atau
rhizome
Minyak atsiri dapat terbentuk secara langsung oleh protoplasma akibat adanya penguraian lapisan resin dari dinding sel atau oleh hidrolisis dari glikosida tertentu. Peranan paling utama dari minyak atsiri terhadap tumbuhan itu sendiri adalah sebagai pengusir serangga (mencegah daun dan bunga rusak) serta sebagai pengusir hewan-hewan pemakan daun lainnya. Namun sebaliknya minyak atsiri juga bersifat sebagai penarik serangga guna membantu terjadinya penyerbukan silang dari bunga.
1. Keturunan terpena yang terbentuk melalui jalur biosintesis asam asetat mevalonat
2. Senyawa aromatik yang terbentuk lewat jalur biosintesis asam sikimat , fenil propanoid (Gunawan, 2010).
2.3.3. Biosintesis Komponen Minyak Atsiri
Kerangka dasar komponen minyak atsiri adalah terpena yang terdiri dari satuan isoprena. Satuan isoprena yang berperan aktif secara biosintetik adalah isopentenil pirofosfat, dimetil alil pirofosfat serta senyawa-senyawa yang terbentuk dari asam asetat lewat jalur bisintesis asam mevalonat. Geranil pirosfat adalah prekursor C10 dari terpena dan dianggap memainkan peran kunci dalam pembentukan monoterpen serta dibentuk melalui kondensasi dari masing-masing satuan isopentenil pirosfosfat dan dimetil alil pirofosfat. Geranil pirofosfat dianggap sebagai prekursor langsung untuk monoterpena siklik. Namun, senyawa ini harus berupa isomer sis terhadap neril pirofosfat sebelum monoterpena siklik dapat dibentuk. Sebab, isomer trans tidak memiliki stereo kimia yang tepat untuk siklisasi. Kemungkinan lain adalah pembentukan neril pirofosfat dari isopentenil pirofosfat. Dalam hal ini dimetilalil pirofosfat tidak bergantung pada langkah geranil pirofosfat. Bentuk pertengahan dalam pembentukan terpena siklis ditunjukkan sebagai ion karbonium.
cabang menuju ke asam prefenat yaitu senyawa nonaromatik terakhir didalam urutan biosintesis. Asam prefanat dapat dijadikan senyawa aromatik melalui dua cara yaitu
1. Melalui cara dehidrasi dan dekarboksilasi secara berkesinambungan menghasilkan asam fenilpiruvat (yaitu prekursor langsung dari senyawa fenilalanina).
2. Melalui dehidrogenasi dan dekarboksilasi menghasilkan asam p-hidroksifenilpiruvat (yakni senyawa yang merupakan prekursor tirosin) Asam sinamat (prekursor fenilpropanoid) dibentuk dengan deaminasi enzimatik langsung dari fenil alanin dan asam p-komarat yang awal proses pembentukannya analog dengan pembentukan tirosin yakni melalui hidroksilasi asam sinamat pada kedudukan para (Gunawan, 2010).
2.3.4. Kandungan Kimiawi Minyak Atsiri
Tidak satu pun minyak atsiri tersusun dari senyawa tunggal, tetapi merupakan campuran komponen yang terdiri dari tipe-tipe berbeda. Berdasarkan cara isolasinya, komponen penyusun minyak atsiri dapat dibedakan menjadi beberapa kelompok seperti berikut
1. Kelompok yang mengkristal pada suhu rendah misalnya stearoptena
2. Kelompok senyawa yang dapat dipisahkan melalui proses destilasi bertingkat
3. Kelompok senyawa yang dipisahkan melalui proses kristalisasi bertingkat 4. Kelompok senyawa yang pemisahannya dilakukan melalui kromatografi 5. Kelompok senyawa yang diisolasi melalui proses-proses kimia
Senyawa yang terdiri atas 2 satuan isoprena disebut monoterpen (C10H16), senyawa yang mengandung 3 satuan isoprena disebut seskuiterpena (C15H24), yang mengandung 4 satuan isoprena disebut diterpena (C20H32), mengandung 6 satuan ioprena disebut triterpen (C30H48) dan seterusnya.
Terpena sering terdapat sebagai komponen penyusun minyak atsiri adalah monoterpena. Monoterpena banyak ditemui dalam bentuk asiklik, monosiklik, serta bisiklis sebagai hidrokarbon dan keturunan yang teroksidasi seperti alkohol, aldehida, keton, fenol, oksida dan ester. Terpena dibawah monoterpena yang berperan penting sebagai penyusun minyak atsiri adalah seskuiterpena dan diterpena. Kelompok besar lain dari komponen penyusun minyak atsiri adalah senyawa golongan fenil propana. Senyawa ini mengandung cincin fenil C6 dengan rantai samping berupa propana C3 (Gunawan, 2010).
2.3.5. Golongan Minyak Atsiri
Pada umumnya perbedaan minyak atsiri komposisi minyak atsiri disebabkan perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat tumbuh , umur panenan, metode ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia yang terbentuk dari unsur karbon (C) , Hidrogen (H) dan oksigen (O). Pada umumya komponen kimia minyak atsiri dibagi menjadi dua golongan yaitu :
1. Golongan Hidrokarbon yang terdiri dari persenyawaan terpen
Minyak atsiri kelompok ini komponen penyusunya sebagian besar terdiri dari senyawa hidrokarbon (C dan H) . Jenis hidrokarbon yang terdapat dalam minyak atsiri sebagian besar terdiri monoterpen (2 unit isoprene), sesquiterpen (3 unit isoprene, diterpen (4 unit isoprene) dan politerpen. 2. Golongan Hidrokarbon teroksigenasi
2.3.6. Metode Isolasi Minyak Atsiri
Menurut Gunawan (2010) minyak atsiri umumnya diisolasi dengan empat metode yang lazim digunakan sebagai berikut :
1. Metode Destilasi
Diantara metode-metode isolasi yang paling lazim dilakukan adalah metode destilasi. Metode destilasi terhadap bagian tanaman yang mengandung minyak. Dasar dari metode ini adalah memanfaatkan perbedaan titik didih. Beberapa metode destilasi yang populer dilakukan diberbagai perusahaan industri penyulingan minyak atsiri antara lain
a) Metode destilasi kering (langsung dari bahan tanpa menggunakan air). Metode ini paling sesuai untuk bahan tanaman kering dan untuk minyak-minyak yang tahan pemanasan.
b) Destilasi air, meliputi destilasi air dan uap air serta destilasi uap langsung. Metode ini dapat digunakan untuk bahan kering maupun bahan segar dan terutama digunakan untuk minyak-minyak yang kebanyakan dapat rusak akibat panas kering. Seluruh bahan dihaluskan kemudian dimasukkan kedalam bejana yang bentuknya mirip dandang. Dalam metode ini ada beberapa versi perlakuan yaitu:
- Bahan tanaman langsung direbus dalam air
- Bahan tanaman langsung masuk air tetapi tidak direbus. Dari bawah dialirkan uap air panas
- Bahan tanaman ditaruh di bejana bagian atas, sementara uap air dihasilkan air mendidih dari bawah dandang
- Bahan tanaman ditaruh dalam bejana tanpa air dan disembukan uap air dari luar bejana
2. Metode Penyarian
dipisahkan dengan metode lain minyaknya akan hilang selama proses pemisahan. Pengambilan minyak atsiri menggunakan cara ini diyakini sangat efektif karena sifat minyak atsiri yang larut sempurna didalam bahan pelarut organik nonpolar.
3. Metode Pengepresan atau Pemerasan
Metode ini hanya bisa dilakukan terhadap simplisia yang mengandung minyak atsiri dalam kadar yang cukup besar. Bila tidak, nantinya hanya akan habis dalam proses. Metode ini dilakukan untuk minyak-minyak atsiri yang tidak stabil dan tidak tahan pemanasan seperti minyak jeruk. Juga terhadap minyak-minyak atsiri yang bau dan warnanya berubah akibat pengaruh pelarut penyari. Metode ini juga hanya cocok untuk minyak atsiri yang rendemenya relatif besar.
4. Metode Enfleurage
Metode ini sering disebut metode pelekatan bau dengan menggunakan media lilin. Cara ini memanfaatkan aktivitas enzim yang diyakini masih terus aktif elama sekitar 15 hari sejak bahan minyak atsiri dipanen. Metode ini digunakan karena diketahui ada beberapa jenis bunga yang setelah dipetik, enzimnya masih menunjukkan kegiatan dalam menghasilkan minyak atsiri sampai beberapa hari/ minggu, misalnya bunga melati, Jasminum sambat sehingga perlu perlakuan yang tidak merusak aktivitas enzim tersebut secara langsung. Caranya adalah dengan menaburkan bunga dihamparan lapisan lilin dalam sebuah baki besar (1m x 2m) dan ditumpuk-tumpuk menjadi beberapa tumpukan baki yang saling menutup rapat. Baki-baki berlapis lilin tersebut dieramkan, dibiarkan menyerap bau bunga sampai beberapa hari/minggu.
Adapun metode-metode penyulingan minyak atsiri dibagi atas : 1) Penyulingan dengan air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak langsung dengan air mendidih. Bahan dapat mengapung diatas air atau terendam secara sempurna, tergantung pada berat jenis dan jumlah bahan yang disuling. Ciri khas model ini adalah adanya kontak langsung antara bahan dan air mendidih. Oleh karena itu sering disebut penyulingan langsung. Penyulingan dengan cara langsung ini dapat menyebabkan banyaknya rendemen minyak yang hilang (tidak tersuling) dan terjadi pula penurunan mutu minyak yang diperoleh.
2) Penyulingan dengan uap
Model ini disebut juga penyulingan uap atau penyulingan tak langsung. Pada prinsipnya, model ini sama dengan penyulingan secara langsung. Hanya saja air penghasil uap tidak diisikan bersama-sama dalam ketel penyulingan. Uap yang digunakan berupa uap jenuh ataupun uap lewat panas dengan tekanan lebih dari satu atmosfer.
3) Penyulingan dengan uap dan air
Bahan tanaman yang akan disuling diletakkan diatas rak-rak ataupun saringan berlubang. Kemudian ketel penyulingan diisi dengan air disampai permukaannya tidak jauh dari bagian bawah saringan. Ciri khas model ini yaitu uap selalu dalam keadaan basah, jenuh dan tidak terlalu panas. Bahan tanaman yang akan disuling hanya berhubungan dengan uap dan tidak dengan air panas (Lutony, 1994).
Penyulingan ini cocok digunakan untuk mengekstraksi biji-bijian, akar dan kayu yang umumnya mengandung minyak yang bertitik didih tinggi dan tidak baik dilakukan pada jenis minyak atsiri yang mudah rusak oleh proses pemanasan dan air (Ketaren, 1985).
2.4. Antioksidan
Zat antioksidan mampu memperlambat atau menghambat yang mudah teroksidasi meskipun dalam konsentrasi rendah (Kochhar dan Rossell, 1990) .
Fungsi utama dari antioksidan yaitu : 1. Pemberi atom hidrogen.
Antioksidan (AH) mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipida.
2. Merupakan fungsi sekunder antioksidan
Memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Buck,1991).
2.4.1. Klasifikasi Antioksidan
Menurut Kumalaningsih (2006), antioksidan tubuh dikelompokkan menjadi tiga yaitu :
1. Antioksidan primer yang berfungsi untuk mencegah pembentuk senyawa radikal baru karena dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi. Contoh, enzim superoksida dismutase (SOD) yang berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh karena radikal bebas
2. Antioksidan sekunder adalah senyawa yang berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai. Contoh , vitamin E, C dan betakaroten yang diperoleh dari berbagai buah.
3. Antioksidan tersier adalah senyawa yang memperbaiki kerusakan sel-sel dan jaringan yang disebabkan radikal bebas. Contoh, enzim metionin sulfoksidan reduktase untuk memperbaiki DNA pada inti sel
Tahapannya menurut Counsell dan Hornig (1981) adalah
Berdasarkan sumber antioksidan, yaitu: a) Antioksidan alami
Adalah antioksidan yang merupakan hasil dari ekstraksi bahan alami. Antioksidan alami dalam makanan dapat berasal dari senyawa antioksidan yang sudah ada dari 1 atau 2 komponen makanan, senyawa antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan, senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke makanan sebagai bahan tambahan pangan.
b) Antioksidan sintetik
Adalah antioksidan yang diperoleh dari hasil reaksi kimia. Contoh antioksidan sintetik yang diijinkan untuk makanan dan sering digunakan, yaitu butil hidroksi anisol (BHA), butil hidroksi toluen (BHT), propil galat, tert-butil hidoksi quinon (TBHQ), dan tokoferol. Antioksidan-antioksidan tersebut merupakan antioksidan alami yang telah diproduksi secara sintetis untuk tujuan komersial.
2.4.2. Radikal Bebas dan Pengaruh Antioksidan
substansi penting yaitu antioksidan yang mampu menangkap radikal bebas tersebut sehingga tidak dapat menginduksi suatu penyakit (Kikuzaki, et al.,2002 ; Sibuea, 2003).
Radikal bebas tersebut dapat mengoksidasi asam nukleat, protein, lemak, bahkan DNA sel dan menginisiasi timbulnya penyakit degeneratif (Leong dan Shui, 2001). Di dalam tubuh kita terdapat senyawa yang disebut antioksidan yaitu senyawa yang dapat menetralkan radikal bebas seperti: enzim SOD (Superoksida Dismutase), gluthatione, dan katalase. Antioksidan juga dapat diperoleh dari asupan makanan yang banyak mengandung vitamin C, vitamin E dan betakaroten serta senyawa fenolik. Bahan pangan yang dapat menjadi sumber antioksidan alami, seperti rempah-rempah, coklat, biji-bijian, buah-buahan, sayur-sayuran seperti buah tomat, pepaya, jeruk dan sebagainya (Prakash, 2001; Trevor, 1995).
Keseimbangan antara kandungan antioksidan dan radikal bebas di dalam tubuh merupakan salah satu faktor yang mempengaruhi kesehatan tubuh. Apabila jumlah radikal bebas terus bertambah sedangkan antioksidan endogen jumlahnya tetap, maka kelebihan radikal bebas tidak dapat dinetralkan. Akibatnya radikal bebas akan bereaksi dengan komponen sel dan menimbulkan kerusakan sel (Arnelia, 2002).
Dampak reaktifitas senyawa radikal bebas bermacam-macam, mulai dari kerusakan sel atau jaringan, penyakit autoimun, penyakit degeneratif seperti kanker, asterosklerosis, penyakit jantung koroner (PJK) dan diabetes mellitus. Pembentukan radikal bebas dan reaksi oksidasi pada biomolekul akan berlangsung sepanjang hidup. Radikal bebas yang sangat berbahaya dalam makhluk hidup antara lain adalah golongan hidroksil (OH-) , superoksida (O-2), nitrogen monooksida (NO), peroksidal (RO-2) , peroksinitrit (ONOO-) , asam hipoklorit (HOCl), hidrogen peroksida (H2O2) (Silalahi, 2006).
memperlambat oksidasi dalam dua cara yaitu baik dengan peredaman radikal bebas, dalam hal ini senyawa tersebut digambarkan sebagai antioksidan primer, atau dengan mekanisme yang tidak melibatkan peredaman radikal bebas langsung, dalam hal ini senyawa tersebut adalah antioksidan sekunder. Antioksidan primer termasuk senyawa fenolik. Komponen ini dikonsumsi selama periode induksi. Antioksidan sekunder beroperasi dengan berbagai mekanisme termasuk mengikat ion logam, peredaman oksigen, mengubah hidroperoksida untuk spesi non-radikal, menyerap radiasi UV atau menonaktifkan oksigen singlet (Pokorny, 2001).
2.4.3. Uji Aktivitas Antioksidan
Menurut Benzie & Strain (1996), pengukuran aktivitas antioksidan dapat dilakukan dengan tiga metode yaitu :
1. Metode CUPRAC
Menggunakan bis (neokuproin) tembaga (II) (Cu(Nc) 22+ sebagai pereaksi kromogenik. Pereaksi Cu(Nc) 22+ yang berwarna biru akan mengalami reduksi menjadi Cu(Nc)2+ yang berwarna kuning dengan reaksi:
n Cu(Nc)2 2+ +AR(OH)n →n Cu(Nc)2+ + AR(=O)n + n H+
2. Metode DPPH
Menggunakan 2,2 difenil-1- pikrilhidrazil sebagai sumber radikal bebas. Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH dari zat antioksidan (Apak et al. 2007). DPPH adalah bubuk kristal berwarna gelap terdiri dari molekul radikal bebas yang stabil dengan berat molekul 394.32 dan rumus molekul C18H12N5O6. Penyimpanan dalam wadah tertutup baik pada suhu -20°C (Molyneux, 2004).
3. Metode FRAP
Menggunakan Fe(TPTZ)23+ kompleks besi- ligan 2,4,6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe(TPTZ)23+ akan berfungsi sebagai zat pengoksidasi dan akan mengalami reduksi menjadi Fe(TPTZ) 22+ yang berwarna kuning dengan reaksi berikut:
Fe(TPTZ) 23+ + AROH → Fe(TPTZ)22+ + H+ + AR=O
2.4.4. Metode Pengukuran Aktivitas Antioksidan dengan Metode DPPH
Aktivitas antioksidan dapat dilakukan beberapa cara salah satu metode pengukuran yang sering digunakan adalah metode DPPH. DPPH merupakan suatu radikal bebas stabil kerena mekanisme delokalisasi elektron bebas oleh molekulnya, sehingga molekul ini tidak mengalami reaksi dimerisasi yang sering terjadi pada sebagian besar radikal bebas lainnya. Delokalisasi juga memberikan efek warna ungu yang dalam pada panjang gelombang 517 nm dalam pelarut etanol. Zat ini berperan sebagai penangkap elektron atau penangkap radikal hidrogen bebas. Hasilnya molekul yang bersifat stabil. Bila suatu senyawa antioksidan direaksikan dengan zat ini maka senyawa antioksidan tersebut akan menetralkan radikal bebas dari DPPH (Bintang, 2010).
2.5. Analisa Komponen Kimia Minyak Atsiri
2.5.1. Kromatografi Gas – Spektroskopi Massa (GC-MS)
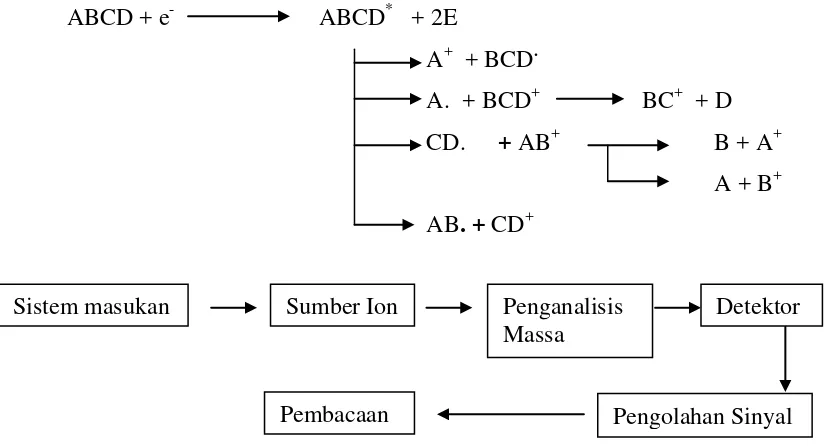
Gas kromatografi adalah satu tehnik analisa yang menggunakan prinsip pemisahan campuran berdasarkan perbedaan kecepatan migrasi komponen-komponen penyusunnya. Gas kromatografi biasa digunakan untuk mengidentifikasi suatu senyawa yang terdapat dalam campuran gas dan juga menentukan suatu senyawa dalam fase gas (Pavia, 2006). Pada kromatografi gas komponennya adalah wadah gas murni bertekanan tinggi yang dilengkapi pengatur tekanan, sistem pemasukan cuplikan atau injektor, tanur bertermostat, kolom dengan kemasan yang cocok, detektor dengan kelengkapan elektroniknya dan perekam untuk detektor. Perilaku senyawa dalam kondisi tertentu (kolom, laju aliran, suhu) sangat khas. Jadi senyawa akan mencapai detektor pada waktu tertentu setelah disuntikkan (Gritter, 1991). Spektroskopi massa adalah suatu metode untuk mendapatkan berat molekul dengan cara mencari perbandingan massa terhadap muatan dari ion yang muatannya diketahui dengan mengatur jari-jari orbit melingkar dalam medan magnetik seragam. Metode spektroskopi massa didasarkan pada pengubahan komponen cuplikan menjadi ion-ion gas dan memisahkannya berdasarkan perbandingan massa terhadap muatan (m/e). Salah satu cara pengubahan suatu molekul menjadi ion molekul dapat digambarkan, yaitu :
Sinar e
-M M M+ + 2e
-50-100 ev Gas Netral
Pengukuran spektrum (m/e) Ion-ion kecil
ABCD + e- ABCD* + 2E
Gambar 2.6. Diagram Spektrometer Massa
Dalam spektrometer massa, sumber ion berguna untuk mengubah komponen cuplikan menjadi partikel bermuatan. Dalam proses ini, pemecahan molekul analit kadang menghasilkan spektrum partikel bermuatan dengan pembandingan massa muatan yang berbeda. Partikel positif dan negatif dihasilkan didalam proses ionisasi dan satu persatu dari partikel-partikel itu dikeluarkan dari sumber ion. Penganalisis massa adalah suatu alat pendispersi yang berfungsi seperti didalam spektrometer optik. Dispersi didasarkan pada massa partikel-partikel bermuatan. Seperti alat optik lainnya, spektometer massa memiliki detektor (suatu detektor ion), pengolah sinyal dan pencacah. Ciri khusus spektrometer massa yang tak terdapat dalam kebanyakan metode optik ialah semua komponen sebelum setektor bertekanan rendah (10-4 – 10-8 torr, 1 tor = 1,2 x 10 -3 at).
Pengambilan spektrum massa dengan suatu instrumen yang terlihat meliputi langkah-langkah sebagai berikut :
1. Semikro mol atau kurang cuplikan dimasukkan ke dalam sumber ion yang dijaga pada tekanan sekitar 10-5 torr, umumnya cuplikan kedalam bentuk gas tetapi dapat juga berbentuk cair dan padat
Sistem masukan Sumber Ion Penganalisis
Massa
Detektor
2. Molekul-molekul cuplikan diionkan dan dipecahkan oleh benturan dengan aliran elektron, ion-ion , atom-atom cepat, foton, panas atau potensial listrik tinggi
3. Ion-ion positif dipisahkan dari ion-ion negatif oleh potensial negatif yang menarik ion positif ke celah penganalisis massa (kadang potensial positif digunakan untuk menolak ion positif dan mempercepat ion negatif ke dalam penganalisis
4. Dalam penganalisis, ion-ion bergerak cepat dihamburkan dan kemudian difokuskan pada detektor
5. Dalam analisis, ion-ion jatuh pada suatu elektoda pengumpul, arus ion yang dihasilkan dan dicatat sebagai fungsi waktu.
Sistem pemasukan cuplikan dapat berasal dari keromatografi gas. Gabungan spektrometer massa dan kromatograf gas ini disebut “GC-MS” (Gas Chromatography –Mass Spectroscopy) (Pavia et.al., 2006).
2.5.2. Spektrofotometri
Spektrofotometri adalah salah satu bagian dari ilmu fisika yang mempelajari tentang analisis spektrum suatu senyawa. Adapun beberapa keunggulan dari spektrofotometri yaitu:
1. Jumlah zat yang diperlukan untuk analisis relatif kecil dan zat tersebut seringkali dapat diperoleh kembali.
2. Waktu pengerjaan relatif cepat
Spektrofotometer adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Jadi spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau ditransmisikan sebagai fungsi dari panjang gelombang.
berbagai warna yang mempunyai spesifikasi melewatkan trayek panjang gelombang tertentu. Pada fotometer filter, tidak mungkin diperoleh panjang gelombang yang benar-benar monokromatis, melainkan suatu trayek panjang gelombang 30-40 nm. Sedangkan pada spektrofotometer, panjang gelombang yang terseleksi dapat diperoleh dengan bantuan alat pengurai cahaya seperti prisma.
Suatu spektrofotometer tersusun dari sumber spektrum tampak yang kontinyu, monokromator, sel pengabsorpsi untuk larutan sampel atau blanko dan suatu alat untuk mengukur perbedaan absorpsi antara sampel dan blanko ataupun pembanding.
1. Sumber
Sumber yang biasa digunakan pada spektroskopi absorpsi adalah lampu wolfram yang arusnya tergantung pada tegangan lampu.
2. Monokromator
Digunakan untuk memperoleh sumber sinar yang monokromatis. Alatnya dapat berupa prisma atau grating. Untuk mengarahkan sinar monokromatis yang diinginkan dari hasil penguraian ini dapat digunakan celah. Jika posisinya tetap, maka prisma atau gratingnya yang dirotasikan untuk mendapatkan λ yang diinginkan.
3. Sel Absorpsi
Pada pengukuran didaerah tampak kuvet kaca corex dapat digunakan, tetapi untuk pengukuran pada daerah UV kita harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini. Umumnya tebal kuvet adalah 10 mm, tetapi yang lebih kecil ataupun lebih besar dapat digunakan. Sel yang biasa yang digunakan berbentuk persegi, tetapi bentuk silinder juga dapat digunakan.
4. Detektor
gelombang yang diperlukan dapat terliputi. Dengan ruang fotosel dalam keadaan tertutup “nol” galvanometer dengan menggunakan tombol dark-current. Pilih yang diinginkan, buka fotosel dan lewatkan berkas cahaya pada blanko dan nol galvanometer didapat dengan memutar tombol sensivitas. Dengan menggunakan tombol transmitasi, kemudian atur besarnya pada 100%. Lewatkan berkas cahaya pada larutan sampel yang akan dianalisis. Skala abosrbansi menunjukkan absorbansi larutan sampel (Khopkar, 2003).
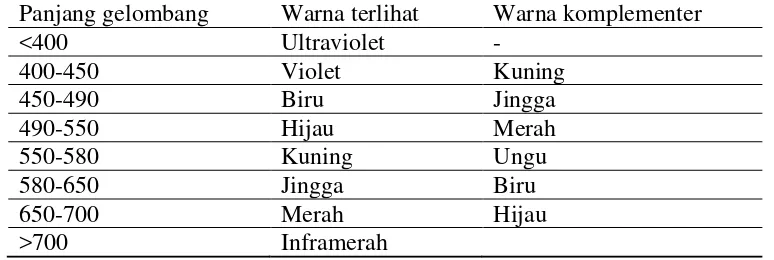
2.5.2.1. Spektofotometri UV-VIS
Spektrofotometri UV-Vis merupakan gabungan antara spektrofotometri UV dan
Visible. Alat ini menggunakan dua buah sumber cahaya yang berbeda, yaitu
sumber cahaya UV dan sumber cahaya Visible. Larutan yang dianalisis diukur
serapan sinar ultra violet atau sinar tampaknya. Konsentrasi larutan yang
dianalisis akan sebanding dengan jumlah sinar yang diserap oleh zat yang terapat
dalam larutan tersebut. Warna yang diserap oleh suatu senyawa merupakan warna
komplementer dari warna yang teramati.
Tabel 2.6. Warna yang diamati dan warna komplementernya
Panjang gelombang Warna terlihat Warna komplementer
<400 Ultraviolet -
400-450 Violet Kuning
450-490 Biru Jingga
Spektrofotometri uv-vis mengacu pada hukum Lambert-Beer. Apabila cahaya
monokromatik melalui suatu media (larutan), maka sebagian cahaya tersebut akan
diserap, sebagian dipantulkan dan sebagian lagi akan dipancarkan. Cahaya yang
diserap diukur sebagai absorbansi (A) sedangkan cahaya yang hamburkan diukur
sebagai transmitansi (T), dinyatakan dengan hukum lambert-beer atau Hukum
Beer, berbunyi: “Jumlah radiasi cahaya tampak (ultraviolet, inframerah dan
fungsi eksponen dari konsentrasi zat dan tebal larutan”. Berdasarkan hukum
Lambert-Beer, rumus yang digunakan untuk menghitung banyaknya cahaya yang
hamburkan:
T = ���
��� atau %T = � ��
��� x 100%
dan absorbansi dinyatakan dengan rumus:
A = - log T = -log ���
���
Dimana I0 merupakan intensitas cahaya datang dan It atau I1 adalah
intensitas cahaya setelah melewati sampel.
Rumus yang diturunkan dari Hukum Beer dapat ditulis sebagai:
A = a . b . c atau A = ε . b . c
Dimana:
A = absorbansi
b = tebal larutan (tebal kuvet umumnya 1 cm)
c = konsentrasi larutan yang diukur (Zysk AM dkk, 2007).
Pada metode spektrofotometri terdapat permasalahan ataupun gangguan seperti sidik jari, kotoran padat yang telah kering yang menempel pada dinding sel yang dapat mengganggu penembusan sinar juga gelembung udara dan lemak (Alaerts, 1987).
Biasanya permasalahan analisis dengan metode spektrofotometri adalah kesalahan pengakuran detektor yang disebabkan oleh :
2. Adanya radiasi sesatan (stary radiation) yang ditimbulkan oleh peralatan spektrofotometer itu sendiri dan ditimbulkan oleh faktor-faktor dari lingkungan seperti debu dan sebagainya.
BAB III
Labu destilasi 2000 ml Pyrex
Pipet tetes
Spektrometer UV-Visible Spectronic 300
3.3. Prosedur Penelitian
3.3.1. Penyediaan Sampel
Bahan yang digunakan dalam penelitian adalah Rimpang jahe merah yang diperoleh dari Desa Saribu dolok.
3.3.2. Destilasi Rimpang Jahe Merah (Sampel)
Rimpang jahe merah yang sudah tua dibersihkan dan diiris kecil dan ditimbang. Sebanyak 700 gram sampel dimasukkan kedalam labu alas 2000 ml ditambahkan air 600 mL, dipasang pada alat penyuling Stahl dan dididihkan selama ± 5-6 jam hingga minyak atsiri menguap sempurna. Destilat yang diperoleh merupakan campuran minyak dengan air. Kemudian destilat diekstrak menggunakan dietil eter. Lalu dikeringkan dengan Na2SO4 anhidrous selanjutnya disaring. Kemudian filtrat hasil saringan diuapkan pada suhu 40-45 OC menggunakan penangas air sehingga diperoleh hasil minyak atsiri sebagai residu. Minyak yang diperoleh dianalisa kandungan kimianya menggunakan alat GC-MS dan dilakukan uji antioksidan.
3.3.3. Analisa Minyak Atsiri Rimpang Jahe Merah dengan GC-MS
Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS. Selanjutnya kondisi disesuaikan dengan kondisi dibawah ini. Kemudian diamati kromatogram yang dihasilkan oleh recorder dan mass recorder serta mass spectra
masing-masing senyawa. Kondisi alat GC-MS yaitu
Kolom : Rastek Stabililwak R-DA
Injection Mode : Split
Pressure : 13,7 kPa
Total Flow : 80 mL/min
Coloum Flow : 0,50 mL/min
Linear Velocity : 25,9 cm/sec
Purge Flow : 0,3 mL/min
Split Ration : 158,4
Equilibrium Time : 0,5 min
GCMS-QP2010
Ion Source Temperature : 250 °C
InterfaceTemperature : 300 °C
Solvent Cut Time : 3 min
3.3.4. Uji Sifat Antioksidan Minyak Atsiri Rimpang Jahe Merah dengan
Metode DPPH
3.3.4.1. Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0,3 Mm dibuat dengan melarutkan 11,85 mg serbuk DPPH dalam etanol p.a dalam labu takar 50 mL, kemudian dihomogenkan.
3.3.4.2. Pembuatan Variasi Minyak Atsiri Rimpang Jahe Merah
dari larutan 100 ppm dibuat lagi variasi konsentrasi 10, 20, 30 dan 40 ppm untuk diuji aktivitas antioksidan.
3.3.4.3. Uji Aktivitas Antioksidan
3.3.4.3.1. Larutan Blanko
Sebanyak 1 ml larutan DPPH 0,3 mM ditambahkan 2,5 ml Etanol p.a . Dihomogenkan dalam tabung reaksi dan dibiarkan selamat 30 menit pada ruang gelap. Setelah itu diukur absorbansi dengan panjang gelombang maksimum 515 nm.
3.3.4.3.2. Uji Aktivitas Antioksidan Minyak Atsiri Rimpang Jahe Merah
3.4. Bagan Penelitian
3.4.1. Isolasi Minyak Atsiri Rimpang Jahe Merah dengan Destilasi Stahl
dimasukkan kedalam labu Stahl 2 liter
ditambahkan air 600 mL dirangkai alat Stahl
didihkan hingga ± 5-6 jam hingga keluar uap air bersama minyak
diekstraksi dengan dietil eter
ditambahkan Na2SO4 anhidrous didekantasi
diuapkan pada suhu 40 -45 OC diatas penangas air
3.4.2. Uji Sifat Antioksidan Minyak Atsiri Rimpang Jahe Merah dengan
Metode DPPH
3.4.2.1. Pembuatan larutan DPPH 0,3 mM
Dimasukkan kedalam labu takar 100 mL Ditambahkan etanol p.a sampai garis batas
Dihomogenkan
11,85 mg serbuk DPPH
Hasil
700 gram Rimpang Jahe Merah diiris halus
Destilat
Lapisan Air Lapisan Minyak
3.4.2.2. Pembuatan Variasi Minyak Atsiri Rimpang Jahe Merah
Dimasukkan kedalam labu takar 25 mL
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Dipipet 2, 5 mL larutan induk 1000 ppm
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Dibuat variasi konsentrasi 10,20,30 dan 40 ppm Dipipet 2,5 mL dipipet 5 mL dipipet 7,5 mL dipipet 10 mL Dengan pipet dengan pipet dengan pipet dengan pipet Volume volume volume volume Dimasukkan dimasukkan dimasukkan dimasukkan kedalam labu kedalam labu kedalam labu kedalam labu takar 25 ml takar 25 ml takar 25 ml takar 25 ml
diencerkan diencerkan diencerkan diencerkan dengan etanol dengan etanol dengan etanol dengan etanol p.a hingga p.a hingga hingga garis hingga garis garis batas garis batas garis batas garis batas
dihomogenkan dihomogenkan dihomogenkan dihomogenkan 0,025 g minyak atsiri
25 mL Larutan Induk 1000
25 mL Larutan Induk 100 ppm
3.4.2.3. Uji Aktivitas Antioksidan a. Uji Blanko
dimasukkan kedalam tabung reaksi ditambahkan 2,5 mL etanol p.a dihomogenkan
dibiarkan selama 50 menit pada ruangan gelap
diukur absorbansi pada panjang gelombang maksimum 515 nm
b. Uji Sampel
dimasukkan kedalam tabung reaksi ditambahkan 2,5 mL sampel dihomogenkan
dibiarkan selama 50 menit pada ruangan gelap
diukur absorbansi pada panjang gelombang maksimum 515 nm 1 Ml Larutan DPPH 0,3 mM
Hasil
1 Ml Larutan DPPH 0,3 mM
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Hasil Isolasi Minyak Atsiri Rimpang Jahe Merah
Minyak atsiri rimpang jahe merah segar diperoleh dengan metode hidrodestilasi menggunakan alat Stahl. Proses ini dilakukan secara triplo. Hasilnya seperti yang ditunjukkan pada tabel 4.1.
Tabel 4.1. Minyak Atsiri Rimpang Jahe Merah yang diperoleh dengan Metode Hidrodestilasi
Berat Sampel (g)
Hasil (g)
Rata-rata (g)
Kadar (%)
I II III
700 gram 0,71 0,70 0,71 0,878 0,125
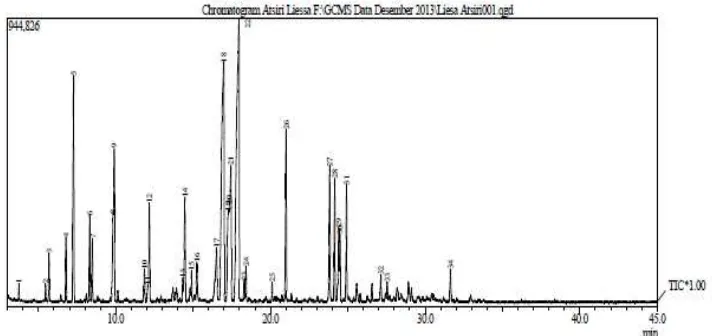
Kemudian minyak atsiri yang diperoleh dianalisis komponen senyawa kimianya dengan GC-MS dimana kromatogram hasil analisisa GC seperti yang ditunjukkan pada gambar 4.1.
Gambar 4.1. Kromatogram Komponen Kimia Minyak Atsiri Rimpang Jahe Merah
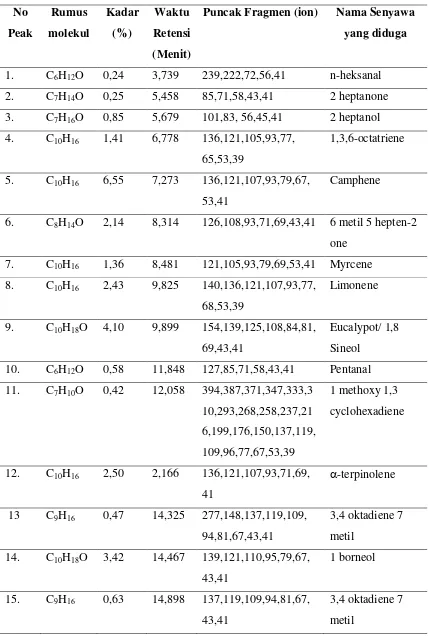
Tabel 4.2. Hasil senyawa analisis GC-MS minyak atsiri rimpang jahe merah
Puncak Fragmen (ion) Nama Senyawa
yang diduga
9. C10H18O 4,10 9,899 154,139,125,108,84,81, 69,43,41
Eucalypot/ 1,8 Sineol 10. C6H12O 0,58 11,848 127,85,71,58,43,41 Pentanal 11. C7H10O 0,42 12,058 394,387,371,347,333,3
10,293,268,258,237,21 6,199,176,150,137,119, 109,96,77,67,53,39
1 methoxy 1,3 cyclohexadiene
16. C10H18O 1,05 15,234 136,121,107,93,81,59, 19. C10H18O 4,47 17,267 134,119,109,91,81,69,
43,41
Nerol
20. C9H16O 1,99 17,342 385,365,329,308,282, 231,217,203,167,133, 122,108,92,68,43,41
Trans 2 cis 6 monadie 1 ol
21. C10H18O 4,31 17,439 123,111,93,70,69,53,41 Trans geraniol 22. C10H16O 22,11 17,964 137,128,109,83,69,53,
41
25. C12H22O2 0,37 20,104 136,123,109,95,81,69, 41
6 okten 1 ol -3,7 dimetil asetat 26. C12H20O2 4,66 21,008 136,121,107,93,80,69,
41
Geranil asetat
27. C15H22 3,73 23,828 202,187,159,145,132, 119,105,91,77,69,55,41
α- curcumen
119,109,93,79,69,43,41
Dari Tabel 4.2. Rimpang jahe merah ada 34 senyawa berdasarkan standart yang telah didapat di interprestasi hanya sebanyak 11 senyawa yang sesuai dengan standart libarary wiley seperti pada tabel 4.3.
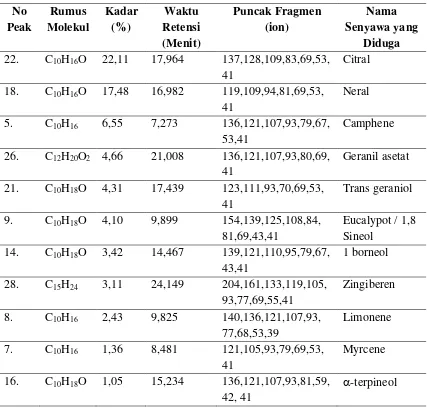
Tabel 4.3. Senyawa Hasil Analisa GC-MS Minyak Atsiri Rimpang Jahe Merah Sesuai Dengan Standart Library Wiley
No
18. C10H16O 17,48 16,982 119,109,94,81,69,53, 41
Neral
5. C10H16 6,55 7,273 136,121,107,93,79,67,
53,41
Camphene
26. C12H20O2 4,66 21,008 136,121,107,93,80,69, 41
Geranil asetat
21. C10H18O 4,31 17,439 123,111,93,70,69,53, 41
28. C15H24 3,11 24,149 204,161,133,119,105,
93,77,69,55,41
16. C10H18O 1,05 15,234 136,121,107,93,81,59,
42, 41
4.1.2. Hasil Uji Aktivitas Antioksidan Minyak Atsiri Rimpang Jahe Merah
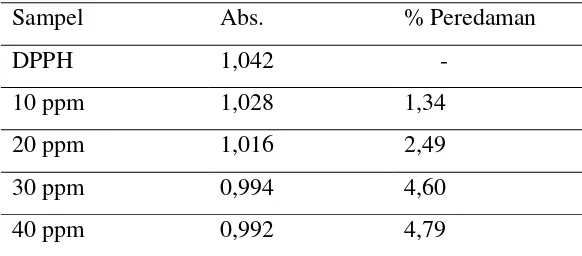
Minyak atsiri rimpang jahe merah segar dilakukan uji aktivitas antioksidan dengan metode DPPH radikal bebas untuk diperoleh nilai IC50 dengan dilakukan pengamatan secara spektrofotometri UV-Visible (absorbansi yang diukur terlampir pada lampiran ) pada panjang gelombang maksimum 515 nm.
Tabel 4.4. Hasil Pengukuran Absorbansi Minyak Atsiri Jahe Merah
Sampel Abs. % Peredaman
DPPH 1,042
-10 ppm 1,028 1,34
20 ppm 1,016 2,49
30 ppm 0,994 4,60
40 ppm 0,992 4,79
Dari persamaan regresi linier diperoleh nilai IC50 = 375,22 ��/��
4.2. Pembahasan
4.2.1. Minyak Atsiri Dari Hasil Destilasi dengan Alat Stahl
Dari hasil penelitian yang telah dilakukan diperoleh minyak atsiri rimpang jahe merah segar rata – rata sebanyak 0,878 gram dari sebanyak 700 gram rimpang jahe merah. Jadi kadar minyak atsiri rimpang jahe merah adalah % (v/b) yang diperoleh dari perhitungan berikut :
% kadar minyak atsiri = ������������������
�������ℎ�����ℎ � 100%
= 0,878����
700���� � 100%
= 0,125 %
4.2.2. Analisis Spektrum Massa Minyak Atsiri Rimpang Jahe Merah Segar
Minyak atsiri rimpang jahe merah segar yang diperoleh dari hasil penelitian dianalisa dengan GC-MS yang disesuaikan dengan Library Wiley 229 , maka diperoleh kandungan utama dari rimpang jahe merah segar yaitu Citral (22,11%), Neral (17,48%), Kamfen (6,55%), Geranil Asetat (4,66%), Trans Geraniol (4,31%), 1,8 Sineol (4,10%), Borneol (3,42%), Zingiberen (3,11%) Limonene (2,43%), Mirsen (1,36%), Terpineol (1,05%). Berikut adalah 11 senyawa yang ditemukan pada minyak atsiri jahe merah yang mungkin pola fragmentasinya:
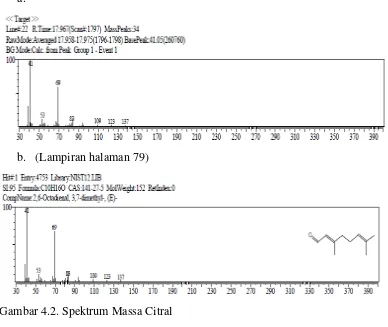
1. Spektrum massa dari Citral
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library Wiley 229 , maka spektrum Citral ditunjukkan pada gambar 4.2.
a.
b. (Lampiran halaman 79)
Gambar 4.2. Spektrum Massa Citral
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
dan 41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum
library, yang lebih mendekati adalah golongan monoterpen yaitu citral sebanyak 22,11 % .
Adapun pola fragmentasi yang mungkin dari senyawa Citral ditunjukkan pada gambar 4.3.
Gambar 4.3. Pola Fragmentasi yang Mungkin dari Senyawa Citral
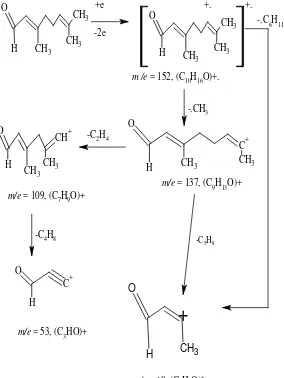
2. Spektrum massa dari Neral
a.
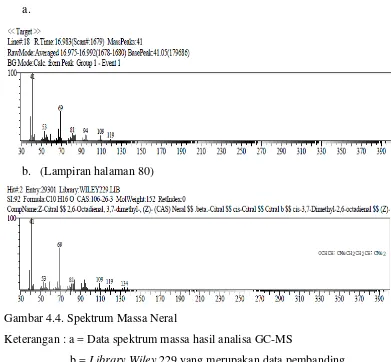
b. (Lampiran halaman 80)
Gambar 4.4. Spektrum Massa Neral
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 16,982 menit merupakan senyawa dengan rumus molekul C10H16O. Spektrum menunjukkan puncak ion molekul pada m/e 119 diikuti fragmen- fragmen pada m/e 109, 94, 81, 69, 53, dan 41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum
library, yang lebih mendekati adalah golongan monoterpen yaitu Neral sebanyak 17,48 % .
CH3
Gambar 4.5. Pola Fragmentasi yang Mungkin dari Senyawa Neral
3. Spektrum massa dari Kamfen
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library Wiley 229 , maka spektrum Kamfen ditunjukkan pada gambar 4.6.
b. (Lampiran halaman 81)
Gambar 4.6. Spektrum Massa Kamfen
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 9,825 menit merupakan senyawa dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion
molekul pada m/e 136 diikuti fragmen- fragmen pada m/e
136,121,107,93,79,67,53,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu kamfen sebanyak 6,55 % . Adapun pola fragmentasi yang mungkin dari senyawa Kamfen ditunjukkan pada gambar 4.7.
CH3
4. Spektrum massa dari Geranil Asetat
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library Wiley 229 , maka spektrum Geranil Asetat ditunjukkan pada gambar 4.8.
a.
b. (Lampiran halaman 82)
Gambar 4.8. Spektrum Massa Geranil Asetat
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 21,008 menit merupakan senyawa dengan rumus molekul C10H18O. Spektrum menunjukkan puncak ion
molekul pada m/e 136 diikuti fragmen- fragmen pada m/e
136,121,107,93,80,69,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu Geranil Asetat sebanyak 4,66 % .
C
Gambar 4.9. Pola Fragmentasi yang Mungkin dari Senyawa Geranil Asetat
5. Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
a.
b. (Lampiran halaman 83)
Gambar 4.10. Spektrum Massa Trans Geraniol
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 21,008 menit merupakan senyawa dengan rumus molekul C10H18O. Spektrum menunjukkan puncak ion molekul pada m/e 123 diikuti fragmen- fragmen pada m/e 123,111,93,70,69,53,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu Trans Geraniol sebanyak 4,31 % .
CH3
Gambar 4.11. Pola Fragmentasi yang Mungkin dari Senyawa Trans Geraniol
6. Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
a.
b. (Lampiran halaman 84)
Gambar 4.12. Spektrum Massa 1,8 Sineol
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 9,899 menit merupakan senyawa dengan rumus molekul C10H18O. Spektrum menunjukkan puncak ion
molekul pada m/e 154 diikuti fragmen- fragmen pada m/e
154,139,125,108,84,81,69,43,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu 1,8 Sineol sebanyak 4,10 % .
O CH3
CH3 CH3
+e - 2e
O CH3
CH3 CH3
+ .
m/e = 154 [C10H18O]+.
- CH3
O
CH3 CH3
m/e = 139 , (C9H15O)+
+
- C3H6O
m/e = 81 , (C6H9O)+
Gambar 4.13. Pola Fragmentasi yang Mungkin dari 1,8 Sineol
7. Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
a.
b. (Lampiran halaman 85)
Gambar 4.14. Spektrum Massa Borneol
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 14,467 menit merupakan senyawa dengan rumus molekul C10H18O. Spektrum menunjukkan puncak ion
molekul pada m/e 139 diikuti fragmen- fragmen pada m/e
139,121,110,95,79,67,43,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu borneol sebanyak 3,42 % .
C
8. Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
Library Wiley 229 , maka spektrum Zingiberen ditunjukkan pada gambar 4.16.
a.
b. (Lampiran halaman 86)
Gambar 4.16. Spektrum Massa Zingiberen
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 24,149 menit merupakan senyawa dengan rumus molekul C10H18O. Spektrum menunjukkan puncak ion
molekul pada m/e 110 diikuti fragmen- fragmen pada m/e
110,123,109,95,81,69,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu Zingiberen sebanyak 3,11 % .
C
Gambar 4.17. Pola Fragmentasi yang Mungkin dari Senyawa Zingiberen
9. Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
a.
b. (Lampiran halaman 87)
Gambar 4.18. Spektrum Massa limonene
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 9,899 menit merupakan senyawa dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion
molekul pada m/e 140 diikuti fragmen- fragmen pada m/e
140,136,121,107,93,77,68,53,39. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu limonene sebanyak 2,43 % .
C
Gambar 4.19. Pola Fragmentasi yang Mungkin dari Senyawa limonene
10.Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
a.
b. (Lampiran halaman 98)
Gambar 4.20. Spektrum Massa Mirsen
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 8,481 menit merupakan senyawa dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion molekul pada m/e 121 diikuti fragmen- fragmen pada m/e 121,105,93,79,69,53,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu mirsen sebanyak 1,36 % .
+e
Gambar 4.21. Pola Fragmentasi yang Mungkin dari Senyawa Mirsen
11.Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan
a.
b. (Lampiran halaman 89)
Gambar 4.22. Spektrum Massa α-terpineol
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 9,899 menit merupakan senyawa dengan rumus molekul C10H18O. Spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti fragmen- fragmen pada m/e 136, 121,107,93,81,59,42,41. Dengan membandingkan spektrum yang diperoleh dengan data spektrum library, yang lebih mendekati adalah golongan monoterpen yaitu Terpineol sebanyak 1,05 % .