Lampiran 2. Gambar tumbuhan, rimpang dan simplisia rimpang kunyit (Curcuma domestica Valeton)
Lampiran 2 (lanjutan).
( C )
Lampiran 2 (lanjutan).
( E )
Keterangan :
A = Gambar tumbuhan kunyit (Curcuma domestica Valeton)
B = Gambar rimpang kunyit (Curcumae domestica Valeton Rhizoma) C = Gambar simplisia kering rimpang kunyit (Curcumae domestica Valeton
Rhizoma)
D = Gambar simplisia basah rimpang kunyit (Curcumae domestica Valeton Rhizoma)
Lampiran 3. Gambar mikroskopik simplisia rimpang kunyit
Keterangan :
1. Butir-butir pati 2. Periderm
3. Rambut penutup
4. Parenkim berisi butir pati
5. Parenkim dengan sel-sel minyak atsiri
6. Penebalan kayu dengan dinding berbentuk spiral 1
2
3
4
Lampiran 4. Perhitungan Penetapan kadar simplisia 1. Penetapan kadar air
Sampel I : berat sampel = 2,002 g Volume air = 0,1 ml
= 4,99%
Sampel II : berat sampel = 2,003 g Volume air = 0,1 ml
= 4,98%
Sampel III : berat sampel = 2,002 g Volume air = 0,1 ml
= 4,99%
2. Penetapan kadar sari larut dalam air Sampel I : berat sampel = 5,006 g
Berat sari = 0,220 g
= 21,97% Sampel II : berat sampel = 5,007 g Berat sari = 0,325 g
= 32,45% Sampel III : berat sampel = 5,005 g Berat sari = 0,220 g
Lampiran 4 (Lanjutan).
3. Penetapan kadar sari larut dalam etanol Sampel I : berat sampel = 5,008 g
Berat sari = 0,260 g
= 25,95% Sampel II : berat sampel = 5,001 g
Berat sari = 0,338 g
= 33,79% Sampel III : berat sampel = 5,006 g
Berat sari = 0,297 g
= 29,66%
4. Penetapan kadar abu total
Sampel I : berat sampel = 2,015 g Berat abu = 0,150 g
= 7,44%
Sampel II : berat sampel = 2,007 g Berat abu = 0,102 g
= 5,08%
Sampel III : berat sampel = 2,021 g Berat abu = 0,135 g
Lampiran 4 (Lanjutan).
5. Penetapan kadar abu tidak larut dalam asam
Sampel I : berat sampel = 2,015 g Berat abu tidak larut asam = 0,012 g
= 0,59%
Sampel II : berat sampel = 2,007 g Berat abu tidak larut asam = 0,008 g
= 0,39%
Sampel III : berat sampel = 2,021 g Berat abu tidak larut asam = 0,017 g
Lampiran 5. Bagan pembuatan ekstrak
Dimasukkan ke dalam bejana
Ditambah pelarut etanol 96% (75 bagian) Dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali di aduk
Diserkai, diperas
Dicuci dengan pelarut etanol 96% hingga diperoleh (100 bagian) Dipindahkan ke dalam bejana tertutup
Dibiarkan di tempat sejuk, terlindung dari cahaya selama 2 hari Dienap tuangkan dan di saring
Digabung
Dipekatkan dengan alat rotary evaporator 40oC Diuapkan diatas waterbath
Serbuk simplisia
Ampas Maserat
Ampas Maserat
Lampiran 6. Contoh perhitungan bahan tablet
R/ Parasetamol 120 mg
Ekstrak Rimpang kunyit 1% Suspensi pati singkong 10% b/v q.s
Amilum Manihot 5%
Talk 1%
Mg stearat 1%
Laktosa ad 350 mg
m.f tab dtd No C
I. Rencana kerja
1. Berat 1 tablet = 350 mg 2. Diameter tablet = 11 mm
3. Metode = granulasi basah 4. Bentuk tablet = bulat pipih II. Perhitungan Bahan
1. Parasetamol = 0,120 g x 100 = 12 g 2. Ekstrak warna = 1/100 x 35 g = 0,35 g 3. Amilum manihot
• Pengembang luar = 2,5/100 x 35 g = 0,875 g • Pengembang dalam = 2,5/100 x 35 g = 0.875 g 4. Talkum = 1/100 x 35 g = 0,35 g 5. Mg Stearat = 1/100 x 35 g = 0,35 g 6. Suspensi pati singkong 10%
Suspensi pati singkong terpakai 30% dari berat total maka : 30/100 x 35 g = 10,5 g mengandung pati singkong sebanyak: 10/100 x 10,5 = 1,05 g
Lampiran 7. Gambar sediaan tablet parasetamol
Keterangan :
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
F1 F2
Lampiran 8. Gambar Perbandingan warna tablet dengan warna standar (standart color)
Gambar warna standart (Standart color)
F1 F2 F3 F4
Keterangan :
Lampiran 9
Lampiran 9 (Lanjutan).
3,2064 0,212 0,67975 10,281000 0,044944
4,4088 0,292 1,28736 19,43751 0,085264
6,0120 0,393 2,362716 36,14414 0,154449 7,2144 0,463 3,34026 52,04756 0,214369
Persamaan regresi : Y = 0,064425x + 0,00186434 Dengan nilai r sebagai berikut :
Lampiran 10. Perhitungan keragaman bobot tablet parasetamol Contoh : Formula 1 ( 0,5 % )
Ditimbang masing-masing berat 10 tablet:
1. 350,0 6. 347,3
2. 347,8 7. 350,2
3. 349,2 8. 350,1
4. 348,0 9. 348,0
5. 350,0 10. 347,3
Berat rata-rata 10 tablet : 348,34 mg
Rata-rata hasil penetapan kadar = 102,7 % x 350 mg
= 359,45 mg (zat berkhasiat/tablet) Berat tablet 1 = 350,0 mg
Maka kadar zat berkhasiatnya = x 359,45 mg = 361,16 mg
Maka % penyimpangan berat terhadap berat rata-rata :
= x 100 %
Lampiran 10 (Lanjutan).
Rata-rata 348,34 359,45 0,316
Lampiran 10 (Lanjutan).
Rata-rata 350,004 355,175 0,15
Lampiran 10 (Lanjutan).
Rata-rata 348,96 358,99 0,35
Lampiran 11. Perhitungan hasil uji disolusi Misalnya pada Formula F1 (0,5 %)
• Pengujian I
1. Konsentrasi ( C )
Dengan persamaan regresi Y = 0,064425 + 0,00186434 X = Konsentrasi
Y = Absorbansi
Pada t = 5 Menit, Y = 0,2945 2. Faktor Pengenceran
Fp = (pengenceran dalam labu 25 ml) / jumlah pemipetan aliquot = 25 / 1
Fp = 25
3. Konsentrasi dalam 1 ml (Cp x Fp) C = 4,5422mcg/ml x 25 = 113,55mcg/ml 4. konsentrasi dalam 900ml
C dalam 900ml = C dalam 1ml x 900 Contoh pada t = 5 menit
C = 113,55mcg/ml x 900 ml = 102201,04mcg/900 ml 5. Parasetamol yang terlepas
Parasetamol yang terlepas = 102201,04mcg + 0 = 102201,04mcg = 102,20104mg 6. Persen Kumulatif
% kumulatif =
Dosis parasetamol = 120 mg % kumulatif = x 100%
Lampiran 13 . Perhitungan kadar tablet parasetamol Misalnya untuk formula F1 (0,5% )
Berat 20 tablet = 7420 mg
Berat parasetamol dalam 20 tablet = 20 x 350mg = 7000 mg
Berat setara 25 mg parasetamol = x 7420mg = 26,5 mg
- Pengujian 1 Serbuk ditimbang seksama sebanyak 26,2 mg kemudian dilarutkan sesuai prosedur yang telah disebutkan sebelumnya dan diukur serapan pada panjang gelombang maksimum, Misalnya A(Y) = 0,4250 dengan menggunakan persamaan regresi :
Y = 0,064425 X + 0,00 186434 maka diperoleh konsentrasi larutan ( X ) : 0,4250 = 0,064425 X + 0,00186434
X =
Diketahui konsentrasi teoritisnya
Lampiran 14. Perhitungan uji hedonik
Untuk menghitung nilai kesukaan rerata dari setiap panelis digunakan rumus sebagai berikut:
• P ( ) ≤ µ ≤ ( + (1,96 . s / )) 95%
S2 : keragaman nilai kesukaan
1,96 : koefisien standar deviasi pada taraf 95% : nilai kesukaan rata-rata
Lampiran 14 (lanjutan). Formula F1 (0,5%)
• =
= 1,8
• S2
= 0,628
• S
= 0,792
• P ( ) ≤ µ ≤ ( + (1,96 . s / ))
P (1,8 – (1,96 . 0,792 / )) ≤ µ ≤ (1,8 + (1,96 . 0,792 / ))
Lampiran 14 (Lanjutan). Formula F2 (1%)
• =
= 4,5
• S2
= 0,35
• S
= 0,592
• P ( ) ≤ µ ≤ ( + (1,96 . s / ))
P (4,5 – (1,96 . 0,592 / )) ≤ µ ≤ (4,5 + (1,96 . 0,592 / ))
Lampiran 14 (Lanjutan). Formula F3 (1,5%)
• =
= 2,75
• S2
= 0,487
• S
= 0,697
• P ( ) ≤ µ ≤ ( + (1,96 . s / ))
P (2,75 – (1,96 . 0,697 / )) ≤ µ ≤ (2,75 + (1,96 . 0,697 / ))
Lampiran 14 (Lanjutan). Formula F4 (2%)
• =
= 2,3
• S2
= 0,51
• S
= 0,714
• P ( ) ≤ µ ≤ ( + (1,96 . s / ))
P (2,3 – (1,96 . 0,714 / )) ≤ µ ≤ (2,3 + (1,96 . 0,714 / ))
Lampiran 15. Kuisioner Uji Hedonik
Uji Hedonik
Pilihlah tablet mana yang saudara sangat suka sampai yang sangat tidak suka berdasarkan warna tablet pada tiap formulasi.
No Nama Umur
(Tahun)
Konsentrasi pewarna tablet 0,5 % 1% 1,5% 2%
Kategori: Sangat tidak suka : 1 Tidak suka : 2
Netral : 3
Suka : 4
DAFTAR PUSTAKA
Agoes, G. (2008). Pengembangan Sediaan Farmasi. Edisi revisi dan perluasan. Penerbit ITB. Bandung. Hal. 59-67.
Ansel, H.C. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi Keempat. UI Press. Jakarta. Hal. 96.
Banker, G. S., Anderson N. R. (1994). Tablet. Editor: Lahman, L. Teori dan Praktek Farmasi Industri. Edisi III. Jilid II. Penerjemah : Suyatmi,S.UI-Press. Jakarta. Hal. 643-703.
Budiyono & Kaseno. (2004). Studi Penerapan Teknologi Membran Untuk Pemisahan Zat Warna Alami dan Ekstrak Kunyit. Prosiding Seminar Nasional Teknik Kimia Kejuangan. Yogyakarta.
Cartensen, J.T. (1977). Pharmaceutics of Solids and Solid Dosage Forms. A Wiley Interscience Publication. New York: John Wiley and Sons. Hal. 133-135, 209-214, 216-218 dan 342.
Depkes RI. (1977). Materia Medika Indonesia. Jilid I. Departemen Kesehatan RI. Jakarta. Hal. 27-32, 129-138.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Departemen Kesehatan RI. Jakarta. Hal. 6-7.
Depkes RI. (1995). Farmakope Indonesia. Edisi keempat. Departemen Kesehatan RI. Jakarta. Hal. 970-971, 999, 1083-1087.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tanaman. Cetakan Pertama. Depkes RI. Jakarta. Hal. 1, 9-12.
Ganiswarna, S.G. (editor). (1995), Farmakologi dan Terapi. edisi 5. Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia. Jakarta.
Harbone, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terjemahan K. Padmawinata. Edisi II. ITB Press. Bandung. Hal. 259-260.
Hayati, M. (2003). Terampil Membuat Ekstrak Temu-temuan. Adi Cita Karya Nusa. Yogyakarta. Hal. 19-21.
Muhlisah, Fauziah. (1996). Tanaman obat keluarga (toga): kunyit. Cetakan Kedua. Penebar Swadaya. Jakarta. Hal. 40-41.
Nugroho, N.A. (1998). Manfaat dan Prospek Pengembangan Kunyit. Penerbit Trubus Agriwidya. Yogyakarta. Hal. 1, 4-6
Parrot, L. (1971). Pharmaceutical Technology. Burges Publishing Company. United Stated of America. Hal. 82.
Saati, E.A. dan Hidayat, N. (2006). Membuat Pewarna Alami. Cetakan I. Trubus Agrisana. Hal. 5-10.
Saifullah,T.N. (2007). Teknologi dan Formulasi Sediaan Tablet. Pustaka Laboratorium Teknologi Farmasi Fakultas Farmasi Universitas Gadjah Mada. Yogyakarta. Hal. 80
Siregar, C.J.P., Wikarsa, S. (2010). Teknologi Farmasi Sediaan Tablet Dasar-Dasar Praktis. Cetakan II. Penerbit Buku Kedokteran EGC. Jakarta. Hal. 1-2, 8, 416- 418.
Soekarto, S.T. (1985). Penilaian Organoleptik untuk Industri Pangan dan Hasil Pertanian. Bhatara Aksara. Jakarta. Hal. 57.
Soekemi, R. A. Yuanita, T. Fat Aminah, Salim Usman. (1987). Tablet. Mayang Kencana. Hal. 18-19.
Syamsuni, H.A. (2007). Ilmu Resep. Cetakan I. Penerbit Buku Kedokteran EGC. Jakarta. Hal. 165-173
Syarfi. (2013). Pembuatan Zat Warna Alami dari Kunyit dengan Membran Ultrafiltrasi. Jurnal Ilmiah Mahasiswa Universitas Riau Vol. IV No. 1 (2013)
Voigt, R. (1995). Buku Pelajaran Teknologi Farmasi. Cetakan II. Penerjemah: Soedani N. S. UGM-Press. Yogyakarta. Hal. 159.
Wilmana, F.P. (1995). Farmakologi dan Terapi. Edisi Keempat. Gaya Baru. Jakarta. Hal. 215
BAB III
METODE PENELITIAN
3.1 Tempat Dan Waktu Penelitian
Penelitian ini dilakukakan di laboratorium Teknologi Sediaan Farmasi II dan laboratorium Farmakognosi Fakultas Farmasi Universitas Sumatera Utara, Medan selama bulan November 2014 hingga bulan Februari di tahun 2015.
3.2 Alat-alat Yang Digunakan
Alat-alat yang digunakan dalam penelitian ini adalah blender, oven, neraca kasar, neraca analitik, corong, cawan porselen berdasar rata, desikator, mesin cetak tablet single punch, Strong cobb hardness tester (Copley), Roche friabilator (Erweka), stopwatch, termometer, mortir, stamper, lemari pengering, Rotary evaporator, waterbath, ayakan, cawan porselen, lampu spiritus, gelas ukur dan beaker glass.
3.3 Bahan-bahan Yang Digunakan
Bahan-bahan yang digunakan pada penelitian ini adalah rimpang kunyit, parasetamol, etanol 96%, akuades, pati singkong, talkum, Mg stearat, laktosa, Toluena, kloroform, HCl 2 N, serbuk Zn, amil alkohol, pereaksi Meyer (HdCl2,
KI), pereaksi Bouchardat (KI, Iodium), pereaksi Dragendorff (KI, bismut sub nitrat, asam asetat glasial), pereaksi Lieberman-Bouchard (asam asetat anhidrat, asam sulfat konsentrat), pereaksi besi (III) klorida, asam klorida p, dan eter.
3.4 Prosedur Kerja
digunakan adalah rimpang induk kunyit (Curcuma domestica Val.) yang diperoleh dari desa Simpang durian, Kecamatan Linggabayu, Kabupaten Mandailing Natal, Provinsi Sumatera Utara.
3.4.2 Identifikasi sampel
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor.
3.4.3 Pembuatan simplisia rimpang kunyit
Rimpang induk kunyit (Curcuma domestica Val.) yang masih segar dibersihkan, dicuci kemudian ditiriskan dan ditimbang beratnya sebagai berat basah. Selanjutnya dirajang tipis, dikeringkan dalam lemari pengering hingga kering yang ditandai dengan sampel mudah dipatahkan, kemudian ditimbang kembali sebagai berat kering selanjutnya diblender dan ditimbang sebagai berat serbuk simplisia. Serbuk simplisia dimasukkan ke dalam kantong plastik dan disimpan di tempat yang sesuai.
3.5 Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam (Depkes RI., 1995).
3.5.1 Pemeriksaan makroskopik
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia rimpang kunyit, diletakkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat, dipanaskan di atas lampu spiritus, kemudian ditutup dengan deck glass (kaca penutup), kemudian dilihat di bawah mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 mL, pendingin, tabung penyambung, tabung penerima 5 mL berskala 0,05 mL, alat penampung dan pemanas listrik. Cara kerja :
3.5.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 mL air-kloroform (2,5 mL kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105o C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI., 1995).
3.5.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI., 1995). 3.5.6 Penetapan kadar abu total
timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI., 1995).
3.5.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI., 1995).
3.6 Skrining Fitokimia 3.6.1 Pemeriksaan alkaloida Pembuatan pereaksi Meyer :
1,36 g HgCl2 dilarutkan dalam 60 ml air suling. Pada bagian lain
dilarutkan pula 5 g KI dalam 10 ml air suling. Kedua larutan ini kemudian dicampurkan dan diencerkan dengan air suling sampai 100 ml. Pereaksi ini disimpan dalam botol yang berwarna coklat, agar tidak
rusak karena cahaya.
Pembuatan pereaksi Bouchardat :
Sebanyak 2 g Iodium dan 4 g KI dilarutkan dalam 100 ml air suling. Larutan disimpan dalam botol berwarna coklat.
Pembuatan pereaksi Dragendorff :
berwarna coklat. Dalam penggunaannya satu larutan ini diencerkan dengan 2/3 bagian larutan 20 ml asam asetat glasial dalam 100 ml air suling.
Cara kerja :
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Mayer akan terbentuk endapan berwarna putih atau kuning
b. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat akan terbentuk endapan berwarna coklat-hitam
c. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Dragendorff akan terbentuk endapan berwarna merah atau jingga
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua atau tiga dari percobaan di atas (Depkes RI., 1995).
3.6.2 Pemeriksaan flavonoida
Sampel uji ditimbang 1 g, ditambahkan dengan 10 ml air suling kemudian dididihkan selama 5 menit dan disaring dalam keadaan panas. Ke dalam 5 ml filtrat ditambahkan 1 g serbuk Zn dan 1 ml asam klorida pekat, dan dipanaskan. Ditambahkan 2 ml amil alkohol, kemudia dikocok kuat dan dibiarkan memisah. Terjadi warna kuning kehijauan menunjukkan adanya senyawa flavoniod (Depkes RI., 1995).
3.6.3 Pemeriksaan tanin
Cara kerja :
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Depkes RI., 1995).
3.6.4 Pemeriksaan saponin
Pembuata larutan asam klorida 2 N : Sebanyak 55,6 mL Asam Klorida p dimasukkan ke dalam labu takar 1000 Ml, tambahkan air suling sampai tanda. Cara kerja :
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin (Depkes RI., 1995).
3.6.5 Pemeriksaan steroida/triterpenoida
Pembuatan pereaksi Lieberman-Bouchardat : Sebanyak 5 mL asam asetat anhidrat dan 5 mL asam sulfat konsentrat ditambahkan secara hati-hati ke dalam 50 mL etanol absolute dalam keadaan dingin.
Cara kerja :
Kemudian berubah menjadi hijau biru menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.7 Pembuatan Ekstrak Etanol Rimpang Kunyit
Serbuk simplisia diekstraksi dengan cara maserasi dengan menggunakan pelarut etanol. Menurut Farmakope Indonesia Edisi III, (1979) caranya adalah sebagai berikut:
Masukkan 10 bagian simplisia ke dalam sebuah bejana, dituangi dengan 75 bagian etanol 96%, tutup, biarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan etanol 96% secukupnya hingga diperoleh 100 bagian. Pindahkan ke dalam bejana tertutup, biarkan di tempat sejuk, terlindung dari cahaya, selama 2 hari. Enap tuangkan atau saring. Pemekatan ekstrak dilakukan dengan alat rotary evaporator pada suhu 40°C, selanjutnya diuapkan di waterbath pada suhu 40°C sampai diperoleh ekstrak kental.
3.8 Formula Sediaan Tablet
R/ Parasetamol 120 mg
Ekstrak Rimpang kunyit x% Suspensi pati singkong 10% b/v q.s
Amilum Manihot 5%
Talk 1%
Mg stearat 1%
Laktosa ad 350 mg
Keterangan x :
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2% 3.8.1 Pembuatan sediaan tablet
1. Ditimbang laktosa, setengah bagian amilum manihot, dan parasetamol, kemudian digerus sampai homogen (Massa 1).
2. Pembuatan suspensi pati singkong 10 % yaitu:
Cawan porselen dan batang pengaduk ditara, pati singkong digerus dan diayak dengan ayakan mesh 200, ditimbang berat pati singkong sebanyak 1,05 g, lalu disuspensikan dengan sedikit akuades, selanjutnya dipanaskan pada api langsung sambil diaduk-aduk hingga diperoleh massa transparan kekuningan, didinginkan, ditimbang dan dicek beratnya, kekurangan berat ditambahkan akuades panas sedangkan kelebihan berat diuapkan kembali dan ditimbang lagi beratnya hingga diperoleh massa suspensi pati singkong sebanyak 10,5 g.
3. Ditimbang ekstrak zat warna rimpang kunyit dan ditambahkan ke dalam suspensi pati singkong kemudian dihomogenkan (Massa 2).
4. Massa 2 ditambahkan sedikit demi sedikit dengan massa 1, sambil digerus hingga diperoleh massa yang kompak, lalu digranulasi dengan ayakan mesh 12. 5. Granulat dikeringkan pada suhu 40-60 °C pada lemari pengering.
7. Ditimbang magnesium stearat, talkum, dan sisa amilum manihot, kemudian ditambahkan pada granulat kering dan di homogenkan.
8. Massa granul diuji preformulasi dan dicetak menjadi tablet dengan bobot tablet 350 mg dan diameter tablet 11 mm.
9. Dilakukan uji evaluasi tablet. Tabel 3.1 Formula sediaan tablet
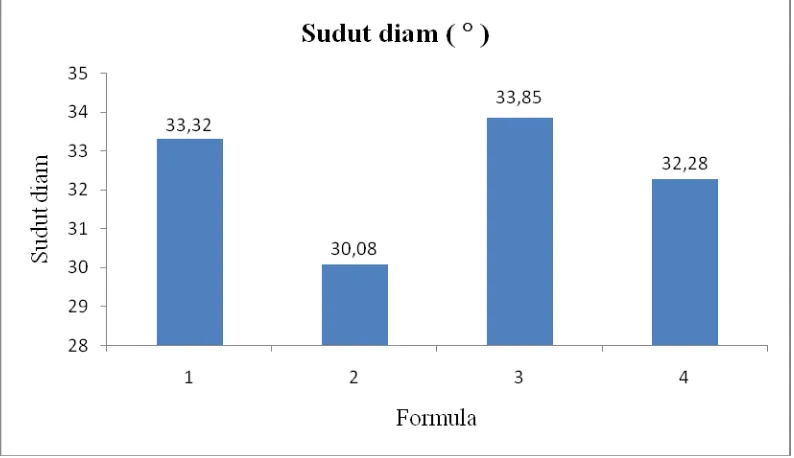
Bahan obat Formula
F1 F2 F3 F4
Konsentrasi pewarna (%) 0,5 1 1,5 2
Pewarna kuning rimpang
kunyit (g) 0,175 0,35 0,525 0,7
Paracetamol (g) 12 12 12 12
Suspensi pati singkong (g) 1,05 1,05 1,05 1,05 Amilum manihot (g)
• Pengembang dalam • Pengembang luar
0,875
Ditimbang 100 g granul kemudian dimasukkan ke dalam corong alir yang telah dirangkai, permukaan granul diratakan, lalu penutup corong dibuka, sehingga granul mengalir sampai habis. Tinggi tumpukan granul yang terbentuk diukur. Sudut diam dapat dihitung dengan menggunakan rumus:
θ = sudut diam
Granul yang mempunyai daya alir bebas akan mempunyai sudut diam antara 30° sampai 40°. (Banker dan Anderson, 1994).
3.9.2 Waktu alir granul
Penentuan waktu granul dilakukan dengan cara:
Ditimbang 100 g granul, kemudian dimasukkan ke dalam corong yang telah dirangkai kemudian permukaanya diratakan. Penutup bawah dibuka bersamaan dengan dihidupkan stopwatch. Stopwatch dihentikan tepat pada saat garnul habis melewati corong dan dicatat waktu alirnya. Syarat waktu alir granul lebih kecil dari 10 detik (Voigt, 1995).
3.9.3 Indeks tap granul
Penentuan indeks tap dilakukan dengan cara:
Dimasukkan granul ke dalam gelas ukur sampai garis tanda dan dinyatakan sebagai volume awalnya (V
1), kemudian gelas ukur dihentakkan
sebanyak 20 kali dengan alat yang dimodifikasi sehingga diperoleh volume akhir (V2). Indekz tap dapat dihitung dengan rumus :
Syarat indeks tap lebih kecil dari 20 % (Voigt, 1995).
Evaluasi tablet yang dilakukan adalah homogenitas warna, kekerasan tablet, friabilitas, disolusi, dan waktu hancur.
3.10 Uji Evaluasi Tablet
3.10.1 Uji homogenitas warna tablet
3.10.2 Uji kekerasan tablet
Penetapan kekerasan tablet menggunakan alat Strong cobb hardness tester. Cara: sebuah tablet diletakkan antara anvil dan punch tegak lurus, tablet dijepit dengan cara memutar skrup pemutar sampai lampu stop menyala. Knop ditekan, dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet pecah. Percobaan ini dilakukan untuk 5 tablet. Syarat kekerasan tablet 4 kg–8 kg (Parrott, 1971).
3.10.3 Uji friabilitas tablet
Penetapan friabilitas tablet menggunakan alat Roche friabilator. Cara: ditimbang 20 tablet yang telah dibersihkan dari debu (A) dimasukkan ke dalam alat dan diputar selama 4 menit. Tablet dikeluarkan dan dibersihkan dari debu kemudian ditimbang (B), kehilangan bobot tidak lebih dari 0,8 % (Banker dan Anderson, 1994).
Friabilitas dapat dihitung dengan rumus:
3.10.4 Uji waktu hancur tablet
tabung-tabung ditahan pada posisi vertikal oleh dua lempeng plastik, masing-masing dengan diameter 9 cm, tebal 6 mm, dengan 6 buah lubang, masing-masing-masing-masing berdiameter lebih kurang 24 mm dan berjarak sama dari pusat lempengan maupun antara lubang satu dengan lainnya.
Cara : Masukkan 1 tablet pada masing-masing tabung dari keranjang, masukkan satu cakram pada tiap tabung dan jalankan alat. Angkat keranjang dan amati semua tablet: semua tablet harus hancur sempurna. Sediaan dinyatakan hancur sempurna bila sisa sediaan, yang tertinggal pada kasa alat uji merupakan masa lunak yang tidak mempunyai inti yang jelas. Waktu hancur tablet tidak lebih dari 30 menit. Bila 1 tablet atau 2 tablet tidak hancur sempurna, ulangi pengujian dengan 12 tablet lainnya: tidak kurang dari 16 dari 18 tablet yang diuji harus hancur sempurna. Dengan cara ini harus dipenuhi persyaratan waktu hancur (Depkes RI., 1995).
3.10.5 Uji penetapan kadar parasetamol
3.10.5.1 Pembuatan larutan dapar fosfat pH 5,8
Masukkan 50 ml kalium fosfat monobasa 0,2 M ke dalam labu tentukur 200 ml, tambahkan 3,6 ml NaOH 0,2 M, kemudian tambahkan air sampai tanda (Depkes RI., 1995)
3.10.5.2 Pembuatan larutan induk baku dalam dapar fosfat pH 5,8
Diperoleh larutan induk baku dengan konsentrasi 40,080 mcg/ml (LIB II). 3.10.5.3 Pembuatan kurva serapan
Dari LIB II Parasetamol, dipipet sebanyak 1,62 ml dan dimasukkan ke dalam labu tentukur 10 ml, diencerkan dengan dapar fosfat pH 5,8 sampai garis tanda. Dikocok homogen maka akan diperoleh konsentrasi 6,5 mcg/ml. Diukur serapannya pada panjang gelombang 200-400 nm dan sebagai blanko digunakan dapar fosfat pH 5,8.
3.10.5.4 Pembuatan linieritas kurva kalibrasi
Dari LIB II dipipet 0,76; 1,12; 1,48; 1,84 dan 2,24 ml, dimasukkan ke dalam labu tentukur 10 ml, kemudian dicukupkan dengan dapar fosfat pH 5,8 sampai garis tanda, sehingga diperoleh konsentrasi 3,2 mcg/ml; 4,4 mcg/ml; 6 mcg/ml; 7,2 mcg/ml dan 8,8 mcg/ml. Diukur serapannya pada panjang gelombang maksimum.
3.10.5.5 Penetapan kadar tablet parasetamol
3.10.6 Uji disolusi tablet
Alat terdiri dari sebuah wadah tertutup yang terbuat dari kaca atau bahan transparan lain yang inert, suatu motor, suatu dayung yang terdiri dari daun dan batang sebagai pengaduk. Batang berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus tanpa goyangan yang berarti. Daun melewati diameter batang sehingga dasar daun dan batang rata. Jarak 25 mm ± 2 mm antara daun dan bagian dalam dasar wadah dipertahankan selama pengujian berlangsung. Daun dan batang logam yang merupakan satu kesatuan dapat disalut dengan penyalut inert yang sesuai. Sediaan dibiarkan tenggelam ke dasar wadah sebelum dayung mulai berputar. Sepotong kecil bahan yang tidak bereaksi seperti gulungan kawat berbentuk spiral dapat digunakan untuk mencegah mengapungnya sediaan. Media disolusi tablet parasetamol menggunakan 900 ml larutan dapar fosfat pH 5,8 Caranya: Masukkan 900 ml larutan dapar fosfat pH 5,8 ke dalam wadah, pasang alat, biarkan media disolusi hingga suhu 37o ± 0,5o dan angkat termometer. Masukkan satu tablet ke dalam alat, hilangkan gelembung udara dari permukaan sediaan yang diuji dan segera jalankan alat pada laju kecepatan 50 rpm. Dalam interval waktu yang ditetapkan atau pada tiap waktu yang dinyatakan, ambil cuplikan pada daerah pertengahan antara permukaan media disolusi dan bagian atas daun dari alat dayung, tidak kurang 1cm dari dinding wadah. Lakukan penetapan seperti yang tertera dalam masing-masing monografi (Depkes RI., 1995).
Dari hasil penetapan kadar, yang diperoleh seperti yang tertera dalam masing-masing monografi, hitung jumlah zat aktif dari masing-masing dari 10 tablet dengan anggapan zat aktif terdistribusi secara homogen. Persyaratan keragaman bobot atau keseragaman kandungan terletak antara 85,0 hingga 115,0% dari yang tertera pada etiket dan simpangan baku relatif kurang dari atau sama dengan 6,0% (Depkes RI., 1995).
3.11 Uji Hedonik
Uji organoleptik warna dilakukan dengan metode Hedonik (Soekarto, 1985), yaitu dengan melakukan analisis menurut uji kesukaan (warna) menggunakan 20 orang panelis yang disuguhi contoh tablet dengan 4 macam konsentrasi untuk diamati warnanya.
Kriteria panelis sebagai berikut:
1. Wanita berbadan sehat yang memiliki anak berumur 6-10 tahun 2. Usia antara 30 - 40 tahun
Untuk melihat tingkat perbandingan warna, dilakukan skorsing pada tabel. Tabel 3.2 Skala uji hedonik untuk penentuan organoleptik warna
Skala hedonik Skala numerik
Sangat suka suka Netral Tidak suka Sangat tidak suka
5 4 3 2 1 Tabel 3.3 Konsentrasi zat warna
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Sampel
Hasil identifikasi Pusat Penelitian Biologi-LIPI terhadap rimpang kunyit yang diteliti adalah jenis Curcuma domestica Valeton (hasil dapat dilihat pada lampiran 1 halaman 57)
4.2 Hasil Karakteristik Simplisia 4.2.1 Hasil makroskopik rimpang
Hasil pemeriksaan makroskopik rimpang segar diperoleh identitas rimpang berbentuk bulat memanjang, berbuku-buku pendek, lurus atau melengkung, kulit rimpang berwarna jingga kecoklatan, warna daging jingga kekuningan dengan bau khas dan rasanya agak pahit.
(Gambar dapat dilihat pada lampiran 2 halaman 58-61) 4.2.2 Hasil mikroskopik simplisia
Hasil pemeriksaan mikroskopik pada simplisia rimpang kunyit terdapat butir-butir pati, periderm, rambut penutup, parenkin yang berisi butir pati, parenkim dengan sel-sel minyak atsiri dan adanya penebalan kayu dengan dinding berbentuk spiral. (Hasil dapat dilihat pada lampiran 3 halaman 62)
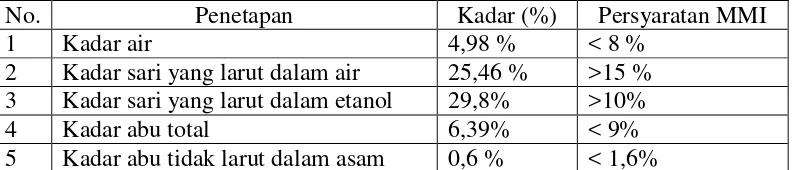
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia
No. Penetapan Kadar (%) Persyaratan MMI
1 Kadar air 4,98 % < 8 %
2 Kadar sari yang larut dalam air 25,46 % >15 % 3 Kadar sari yang larut dalam etanol 29,8% >10%
4 Kadar abu total 6,39% < 9%
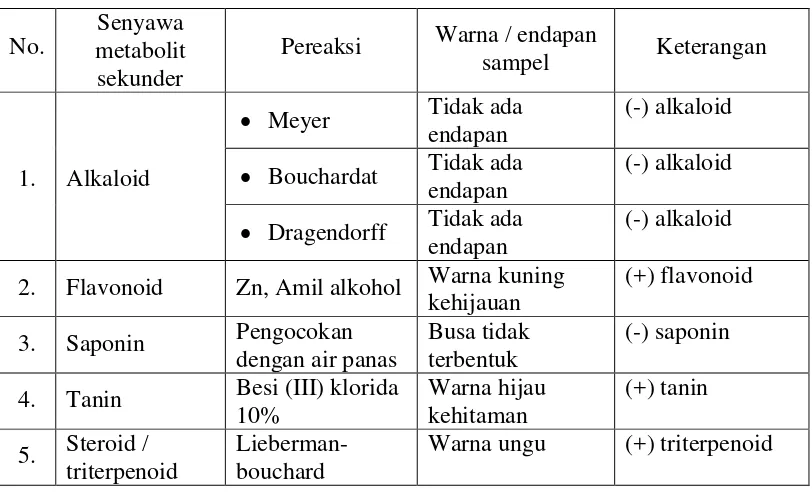
4.3 Hasil Skrining Fitokimia
Tujuan dilakukan skrining fitokimia adalah untuk mengetahui senyawa metabolit sekunder yang terdapat dalam simplisia (Harborne, 1987).
Tabel 4.2 Hasil skrining fitokimia
No.
Senyawa metabolit sekunder
Pereaksi Warna / endapan
sampel Keterangan
1. Alkaloid
• Meyer Tidak ada endapan
(-) alkaloid
• Bouchardat Tidak ada endapan
(-) alkaloid
• Dragendorff Tidak ada endapan
(-) alkaloid
2. Flavonoid Zn, Amil alkohol Warna kuning kehijauan
(+) flavonoid
3. Saponin Pengocokan dengan air panas
Busa tidak
Warna ungu (+) triterpenoid
4.4 Hasil Pembuatan Ekstrak Rimpang Kunyit
Hasil ekstraksi 350 g serbuk simplisia rimpang kunyit dengan menggunakan pelarut etanol 96% diperoleh ekstrak zat warna kuning sebanyak 64,37 g dengan rendemen 18,391%. (Bagan pembuatan ekstrak dapat dilihat pada lampiran 5 halaman 66)
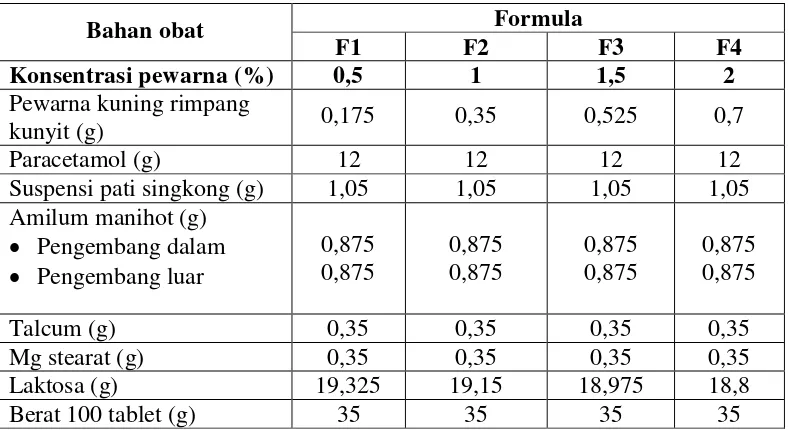
4.5 Hasil Uji Preformulasi Granul 4.5.1 Sudut diam granul
Tabel 4.3 Hasil uji sudut diam granul
Uji preformulasi Formula Persyaratan
F1 F2 F3 F4
Sudut diam ( o ) 33,32 ± 0,25
30,08 ± 0,33
33,85 ± 0,34
32,28 ±
0,21 30
o
-40o
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Gambar 4.1 Histogram sudut diam massa granul
Gambar diatas dapat dilihat sudut diam dari keempat formula tersebut memenuhi persyaratan sudut diam. Banker G.S., dan Anderson N. R., (1994)
4.5.2 Waktu alir granul
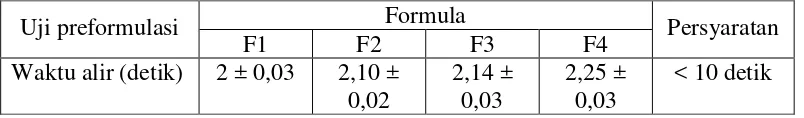
Tabel 4.4 Hasil uji waktu alir granul
Uji preformulasi Formula Persyaratan
F1 F2 F3 F4
Waktu alir (detik) 2 ± 0,03 2,10 ± 0,02
2,14 ± 0,03
2,25 ± 0,03
< 10 detik
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Gambar 4.2 Histogram waktu alir massa granul
Gambar diatas dapat dilihat bahwa keempat formula memiliki waktu alir yang bervariasi akan tetapi masih memenuhi persyaratan waktu alir. Menurut (Voigt, 1995) Syarat waktu alir granul lebih kecil dari 10 detik.
4.5.3 Indeks tap granul
Tabel 4.5 Hasil uji indeks tap granul
Uji preformulasi Formula syarat
F1 F2 F3 F4
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Gambar 4.3 Histogram indeks tap massa granul
Semakin kecil nilai dari indeks tap granul maka penyusutan volume yang terjadi akan tinggi. Dari gambar diatas diperoleh nilai indeks tap yang bervariasi, tetapi masih memenuhi persyaratan indeks tap yaitu lebih kecil dari 20% (Voight, 1995).
4.6 Hasil Uji Evaluasi Tablet 4.6.1 Hasil uji homogenitas warna
Tablet F1, F2, F3, dan F4 tidak terdapat bintik-bintik warna lain selain warna kuning setelah diamati pada permukaan atas, bawah, dan sisi keliling tablet. Warna dibandingkan dengan warna standar (standart color).
4.6.2 Hasil uji kekerasan tablet
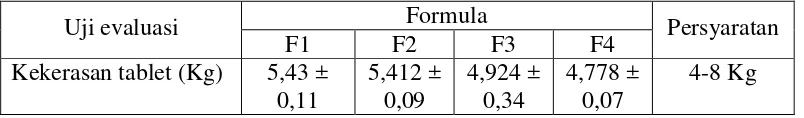
Tabel 4.6 Hasil uji evaluasi kekerasan tablet
Uji evaluasi Formula Persyaratan
F1 F2 F3 F4
Kekerasan tablet (Kg) 5,43 ± 0,11
5,412 ± 0,09
4,924 ± 0,34
4,778 ± 0,07
4-8 Kg
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Gambar 4.4 Histogram kekerasan tablet
4.6.3 Hasil uji friabilitas tablet
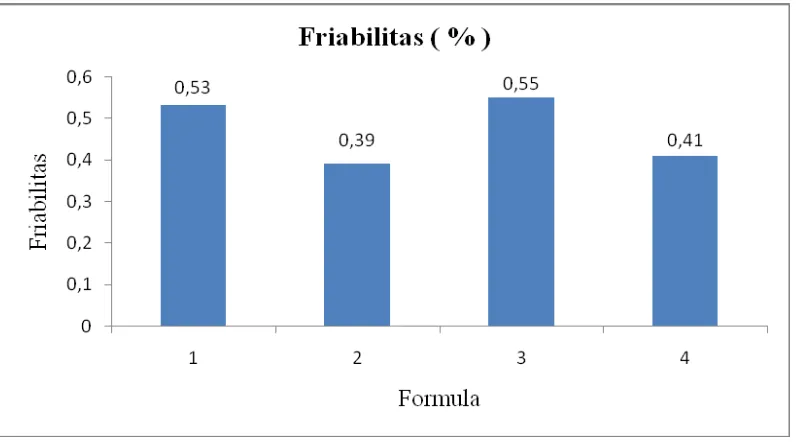
Tabel 4.7 Hasil uji evaluasi friabilitas tablet
Uji evaluasi Formula syarat
F1 F2 F3 F4
Friabilitas (%) 0,53 ± 0,02
0,39 ± 0,02
0,55 ± 0,03
0,41 ± 0,02
≤ 1%
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Gambar 4.5 Histogram friabilitas tablet
Pada gambar diatas terlihat bahwa hasil friabilitas memenuhi persyaratan. Menurut Siregar (2010) menjelaskan bahwa persyaratan friabilitas yaitu maksimal 1% untuk tablet konvensional.
4.6.4 Hasil uji waktu hancur tablet
Tabel 4.8 Hasil evaluasi uji waktu hancur tablet
Evaluasi tablet Formula Persyaratan
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Gambar 4.6 Histogram waktu hancur tablet
Dari histogram di atas dapat dilihat bahwa keempat formula memenuhi persyaratan waktu hancur tablet parasetamol pada Farmakope Indonesia Edisi IV yaitu ≤ 30 menit.
4.6.5 Hasil uji keragaman bobot Tabel 4.9 Hasil uji keragaman bobot
Formula Kadar rata – rata (%) Simpangan baku relatif (%)
F1 102,70 0,04
F2 103,79 0,03
F3 101,48 0,13
F4 102,57 0,004
Syarat 85,0% - 115,0% 6,0%
Keterangan
Dari tabel diatas dapat dilihat bahwa hasil uji keragaman bobot tablet memenuhi persyaratan. Persyaratan keseragaman bobot atau keseragaman kandungan terletak antara 85,0 hingga 115,0% dari yang tertera pada etiket dan simpangan baku relatif ≤ 6,0% (Ditjen POM, 1995). (perhitungan keragaman bobot dapat dilihat pada lampiran 10 halaman 73)
4.6.6 Hasil uji disolusi
Tabel 4.10 Hasil uji disolusi tablet
No Formula Kadar (%)
1 F1 87,74 ± 0,35
2 F2 87,76 ± 0,23
3 F3 87,36 ± 0,22
4 F4 87,72 ± 0,26
Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
(1995) persyaratan uji disolusi, kecuali dinyatakan lain dalam masing-masing monografi, persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Harga Q adalah jumlah zat aktif yang terlarut seperti yang tertera dalam masing-masing monografi, dinyatakan dalam persentasi kadar pada etiket, angka 5% dan 15% dalam tabel adalah persentasi kadar pada etiket, dengan demikian mempunyai arti yang sama dengan Q. Toleransi dalam waktu 30 menit harus larut tidak kurang dari 80% (Q) parasetamol, dari jumlah yang tertera pada etiket (Ditjen POM, 1995) (perhitungan hasil uji dan persen kumulatif disolusi tablet dapat dilihat pada lampiran 11 dan 12 halaman 78-79)
4.6.7 Uji penetapan kadar
4.6.7.1 Hasil pembuatan kurva serapan maksimum dan kurva kalibrasi Menurut Farmakope Indonesia edisi IV (1995), parasetamol memberikan serapan maksimum pada panjang gelombang sekitar 243 nm didalam larutan dapar fosfat pH 5,8. Hasil pengukuran secara spektrofotometri ultraviolet larutan parasetamol BPFI dalam dapar fosfat pH 5,8 yang dilakukan diperoleh serapan maksimum pada panjang gelombang 243,0 nm (Gambar 4.8). Dengan demikian, panjang gelombang maksimum yang didapat sesuai dengan literatur.
Gambar 4.9 Data panjang gelombang maksimum dan absorbansi parasetamol BPFI dalam dapar fosfat pH 5,8 pada c = 6,5 mcg/ml
Dari hasil penentuan linieritas kurva kalibrasi Parasetamol BPFI dalam rentang konsentrasi 3,2064 mcg/ml hingga 8,8176 mcg/ml pada λ maks = 243 nm (gambar 4.9) diperoleh persamaan regresi : Y = 0,064425 X + 0,00186434 dengan nilai r = 0,99967. Menurut Ermer (2005), nilai r yang mendekati 1, menunjukkan korelasi yang linier yang menyatakan adanya hubungan antara X (konsentrasi) dan Y (serapan).
Tabel 4.11 Hasil penetapan kadar tablet parasetamol
Syarat: Kadar = 90,0%-110,0% Keterangan
F1 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 0,5% F2 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1% F3 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 1,5% F4 = Formula tablet parasetamol dengan konsentrasi ekstrak warna 2%
Menurut Farmakope Indonesia edisi IV, tablet parasetamol mengandung parasetamol tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Dari hasil penetapan kadar tablet parasetamol, diperoleh kadar tablet F1 sebesar 102,70%, F2 sebesar 103,79%, F3 sebesar 101,48%, F4 sebesar 102,57%. Dari data tersebut kadar tablet tiap formula bervariasi, namun kadar tersebut masih memenuhi persyaratan yang ditetapkan dalam Farmakope Indonesia edisi IV. Kadar parasetamol dalam tablet berkisar antara 101,48% sampai 103,79%. (perhitungan penetapan kadar tablet dapat dilihat pada lampiran 13 halaman 83)
4.7 Uji Hedonik
Tabel 4.12 Data nilai uji hedonik
Data tentang nilai kesukaan warna terhadap keempat formula dapat dilihat pada histogram dibawah ini.
Gambar 4.11 Histogram terhadap nilai kesukaan warna
Gambar di atas dapat dilihat bahwa nilai kesukaan warna pada masing-masing konsentrasi adalah, F1 (konsentrasi 0,5%) memiliki nilai rata-rata sebesar 1,8 , F2 (konsentrasi 1%) memiliki nilai rata-rata sebesar 4,5 F3 (konsentrasi 1,5%) memiliki nilai rata-rata sebesar 2,75 dan F4 (konsentrasi 2%) memiliki nilai rata-rata sebesar 2,3. Dari histogram diatas menunjukkan bahwa F2 (konsentrasi 1%) menghasilkan nilai rata-rata paling tinggi yaitu 4,5.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Ekstrak dari rimpang kunyit (Curcuma domestica Valeton) memenuhi persyaratan Materia medika Indonesia
2. Pewarna kuning dari ekstrak rimpang kunyit (Curcuma domestica Valeton) dapat digunakan sebagai pewarna tablet.
3. Konsentrasi pewarna kuning dari ekstrak rimpang kunyit (Curcuma domestica Valeton)yang disukai sebagai pewarna tablet adalah 1%.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Kunyit tumbuh dengan baik di wilayah Asia, khususnya Asia Tenggara. Tanaman ini kemudia mengalami persebaran ke daerah Malaysia, Indonesia, Australia, bahkan Afrika. Kunyit dapat tumbuh didataran rendah mulai dari 240 m diatas permukaan laut hingga ketinggian lebih dari 2.000 m diatas permukaan laut dengan curah hujan 1.000 - 4.000 ml/tahun. Tanaman kunyit memerlukan jenis tanah ringan dengan bahan organik yang tinggi seperti tanah lempung berpasir yang terbebas dari genangan air (Nugroho, 1998).
2.1.1 Sistematika tumbuhan
Sistematika tumbuhan kunyit menurut Gembong (1985): Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Monocotyledoneae Ordo : Zingiberales Famili : Zingiberaceae Genus : Curcuma
Spesies : Curcuma domestica Valeton 2.1.2 Morfologi tumbuhan
ketinggian 1300-1600 m dibawah permukaan laut, ada juga yang mengatakan bahwa kunyit berasal dari India. Kata Curcuma berasal dari bahasa Arab Kurkum dan Yunani Karkom. Pada tahun 77-78 SM, Dioscorides menyebut tanaman ini sebagai Cyperus menyerupai jahe, tetapi pahit, kelat, dan sedikit pedas, tetapi tidak beracun. Tanaman ini banyak dibudidayakan di Asia Selatan khususnya di India, Cina Selatan, Taiwan, Indonesia (Jawa), dan Filipina. Tanaman kunyit tumbuh bercabang dengan tinggi 40-100 cm. Batang merupakan batang semu, tegak, bulat, membentuk rimpang dengan warna hijau kekuningan dan tersusun dari pelepah daun (agak lunak). Daun tunggal, bentuk bulat telur (lanset) memanjang hingga 10-40 cm, lebar 8-12,5 cm dan pertulangan menyirip dengan warna hijau pucat. Berbunga majemuk yang berambut dan bersisik dari pucuk batang semu, panjang 10-15 cm dengan mahkota sekitar 3 cm dan lebar 1,5 cm, berwarna putih/kekuningan. Ujung dan pangkal daun runcing, tepi daun yang rata. Kulit luar rimpang berwarna jingga kecoklatan, daging buah merah jingga kekuning-kuningan (Muhlisah, 1996).
2.1.3 Nama daerah
Tanaman kunyit (Curcuma domestica Valeton) di Indonesia memiliki berbagai macam nama daerah, seperti di Sumatera, Jawa, Kalimantan, Nusa Tenggara, Sulawesi, Maluku dan Irian.
Sumatera : Kakunye (Enggano), kunyet (Aceh), kunyet (), kuning, hunik, unik (Batak), odil, ondil, kondil (Simalur), undis (Nias), kunyit (Melayu), kunyir, jinten (Lampung).
Kalimantan : Kunir, janar (Banjar), henda (Ngaju), kunyit (Olon Maanyan), cahang (Dayak Panyabung), dio (), kalesiau (Kenya), kunyit (Tidung).
Nusa Tenggara : Kunyik (Sasak), huni (Bima), kaungi, wingir, winguru (Sumba Timur), dingira, hingiro, kunita, kunyi, konyi, hingira (Sumba Barat), kewuni (Sawu), kuneh, guni (Flores), kuma (Solor), kumoh (Alor), kunik, huni, unik (Roti), hunik, kunir (Timor). Sulawesi : Uinida (Talaud), kuni, hamu (Sangir), alawahu (Gorontalo),
kolalagu (Buol), pagidon (Toli – toli), uni, kuni (Toraja), kunyi (Makassar), kunyi (Salayar), unyi (Bugis), kuni, nuyik (Mandar).
Maluku : Kuriai (Leti), lulu malai (Babar), ulin (Talimbar), tuni (Kai), unin (Goram), iris, kunin, uni (Seram Timur), unin, unine, one (Seram Barat), enelo (Seram Selatan), kunino, unin, unine, unino, uninun (Ambon), unino (Maruku), kunine (Nusa Laut), kunino, uni benal (Saparanal), kone, kunik, uni, unin (Buru), koni, kon (Sula), gurati, gulati, gogohiki (Halmahera), guraci (Ternate, Tidore).
Irian : Rame (Kapaur), kandeifu (Nufor), nikwai (Windesi) mingguai (Wandamen), yaw (Arzo) (Depkes RI., 1977).
2.1.4 Kandungan kimia
lemak, protein, karbohidrat, pati, dan sisanya terdiri dari vitamin C, garam – garam mineral seperti zat besi, fosfor, dan kalsium. Bau dan rasa berasal dari beberpa zat yang terdapat didalam minyak tersebut. Zat – zat tersebut meliputi keton sesquiterpen, termeron, zingeberen, borneol, dan sineol (Nugroho, 1998). 2.1.5 Khasiat tumbuhan
Kunyit memiliki efek farmakologis yaitu : melancarkan peredaran darah, mempermudah persalinan, antiradang (antiinflamatory), antibakteri, memperlancar pengeluaran empedu (colagogum), carminative, pelembab (astringent), antioksidan, dan dapat meningkatkan aktivitas seksual (Winarto, 2003).
2.1.6 Pewarna alami
Pewarna telah lama digunakan pada makanan untuk meningkatkan cita rasanya. Pada mulanya zat warna yang digunakan adalah zat warna alami dari tumbuhan dan hewan. Pewarna alami sebenarnya tidak semahal yang diperkirakan masyarakat dan pembuatannya juga sangat mudah. Bahan-bahan yang dapat digunakan sebagai pewarna ditumbuk, dapat pula menggunakan blender atau penumbuk biasa dengan sedikit ditambah air, lalu diperas dan disaring dengan alat penyaring (Saati dan Hidayat, 2006).
Menurut Saati dan Hidayat, (2006) beberapa contoh zat pewarna alami yang biasa digunakan untuk mewarnai makanan yaitu :
1. Karoten, memberikan warna jingga sampai merah. Dapat diperoleh dari wortel, papaya dan sebagainya.
3. Karamel, memberikan coklat gelap dan merupakan hasil dari hidrolisis pemecahan karbohidrat, gula pasir, laktosa dan sirup malt.
4. Klorofil, memberikan warna hijau dan diperoleh dari daun. Banyak digunakan untuk makanan dan saat ini mulai digunakan pada berbagai produk kesehatan. Pigmen klorofil banyak terdapat pada dedaunan seperti daun suji, daun pandan, daun katuk dan sebagainya. Dedaunan tersebut sebagai penghasil warna hijau untuk berbagai jenis kue jajanan pasar. Selain menghasilkan warna hijau yang cantik, juga memiliki aroma yang khas.
5. Antosianin, memberikan warna merah, oranye, ungu dan biru. Banyak terdapat pada bunga dan buah-buahan seperti bunga mawar, pacar air, kembang sepatu, bunga tasbih, anggur, buah apel, stroberi, buah manggis dan lain-lain. 6. Kurkumin, berasal dari kunyit sebagai salah satu bumbu dapur dan
memberikan warna kuning (Saati dan Hidayat, 2006). 2.1.7 Kurkumin
Kurkumin merupakan zat warna alami yang diperoleh dari tanaman kunyit (Zingiberaceae). Zat warna ini dapat dipakai dalam minuman tidak beralkohol, seperti sari buah. Akan tetapi zat warna ini masih kalah oleh zat warna sintesis dalam hal warnanya (Koswara, 2009).
molekul 368,37 dengan titik lebur 183 °C. Kurkumin tidak larut dalam air dan eter tetapi larut dalam alcohol, asam asetat glacial. Kurkumin berbentuk serbuk kristal dengan warna kuning jingga (Koswara, 2009).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan suatu pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan kedalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dengan cara ekstraksi yang tepat (Ditjen POM, 2000).
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung (Depkes RI., 1979). Metode ekstraksi yang umum digunakan dalam berbagai penelitian antara lain (Ditjen POM, 2000) yaitu:
a. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan, sedangkan remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
b. Perkolasi
bejana perkolator, tetapi dibasahi atau dimaserasi terlebih dahulu dengan cairan penyari sekurang-kurangnya selama 3 jam.
c. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
d. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat soklet dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel. e. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50°C.
f. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit.
g. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit.
Rumus molekul : C8H9NO2
Nama kimia : 4-hidroksiasetanilida [103-90-2] Berat molekul : 151,16
Kandungan : Tidak kurang dari 98,0% dan tidak lebih dari 101,0% C8H9NO2 dihitung terhadap zat anhidrat.
Pemerian : Serbuk hablur, putih; tidak berbau; rasa sedikit pahit. Kelarutan : Larut dalam air mendidih dan dalam natrium hidroksida 1
N; mudah larutan dalam etanol (Depkes RI., 1995) 2.3.2 Farmakologi
Parasetamol merupakan metabolit fenasetin dengan efek antipiretik ditimbulkan oleh gugus aminobenzen. Asetaminofen di Indonesia lebih dikenal dengan nama parasetamol, dan tersedia sebagai obat bebas (Wilmana, 1995).
asetilsalisilat, tetapi mempunyai bentuk toksisitas hepatik sedang sampai berat. (Ganiswara, 1995).
2.4 Uraian Sediaan Tablet
Defenisi tablet menurut Farmakope Indonesia edisi III adalah sediaan padat kompak, dibuat secara kempa cetak, dalam bentuk tabung pipih atau sirkuler, kedua permukaannya rata atau cembung, mengandung satu jenis obat atau lebih, dengan atau tanpa bahan tambahan. Bahan tambahan yang dapat berfungsi sebagai bahan pengisi, bahan pengembang, bahan pengikat, bahan pelicin, bahan pembasah atau bahan lain yang cocok (Depkes RI., 1979).
Tablet merupakan jenis sediaan yang banyak digunakan sampai sekarang karena memberikan dosis yang tepat pada pemakainnya, mudah pemakaiannya, mudah pengemasannya, stabilitas kimia dan aktivitas fisiologi dari bahan-bahan obat cukup baik (Banker dan Anderson, 1994).
Tablet dicetak dari serbuk kering, kristal atau granulat, umumnya dengan penambahan bahan pembantu, pada mesin yang sesuai, dengan menggunakan tekanan tinggi. Tablet dapat memiliki bentuk silinder, kubus, batang, atau cakram, serta bentuk seperti telur atau peluru. Garis tengah tablet pada umumnya 5-17 mm, sedangkan bobot tablet 0,1-1 g (Voigt, 1995).
Butiran granulat yang diperoleh, partikel-partikelnya mempunyai daya lekat. Daya alirnya menjadi lebih baik sehingga pengisian ruang cetak dapat berlangsung secara kontiniu dan homogen. Keseragaman bentuk granulat menyebabkan keseragaman bentuk tablet (Voigt, 1995).
1. Memiliki kemampuan atau daya tahan terhadap pengaruh mekanis selama proses produksi, pengemasan dan distribusi.
2. Bebas dari kerusakan seperti pecah pada permukaan dan sisi-sisi tablet.
3. Dapat menjamin kestabilan fisik maupun kimia dari zat berkhasiat yang terkandung di dalamnya.
4. Dapat membebaskan zat berkhasiat dengan baik sehingga memberikan efek pengobatan seperti yang dikehendaki.
Tablet dapat didefenisikan sebagai bentuk sediaan solid yang mengandung satu atau lebih zat aktif dengan atau tanpa berbagai eksipien (yang meningkatkan mutu sediaan tablet, kelancaran sifat aliran bebas, sifat kohesivitas, kecepatan disintegrasi, dan sifat antilekat) dan dibuat dengan mengempa campuran serbuk dalam mesin tablet. Defenisi lain tablet kempa adalah unit bentuk sediaan solid dibuat dengan mengempa suatu campuran serbuk yang mengandung zat aktif dengan atau tanpa bahan tambahan atau bahan tertentu yang dipilih guna membantu dalam proses pembuatan dan untuk menciptakan sifat-sifat sediaan tablet yang dikehendaki (Siregar dan Wikarsa, 2010).
2.4.1 Bentuk tablet
dan lubang kempa (lesung tablet) cetakan yang didesain secara khusus. Misalnya jika punch kurang konkaf makin datar tablet yang dihasilkannya. Sebaliknya punch yang semakin konkaf, semakin lebih konveks tablet yang dihasilkan.
Tablet dapat diberi monogram pada salah satu atau pada kedua permukaan tablet tergantung keberadaan monogram pada punch bawah dan/atau punch atas yang menghasilkan monogram.
Tablet adalah sediaan solid mengandung zat aktif yang dapat diberikan secara oral dan ditelan, tablet yang hanya ditempatkan di dalam rongga mulut tanpa ditelan, tablet oral yang dikunyah dulu lalu ditelan, atau hanya dikulum/diisap (Siregar dan Wikarsa, 2010).
2.4.2 Bahan pewarna tablet
Zat warna ditambahkan dalam sediaan tablet untuk memperindah tablet, membedakan dosis, spesifikasi dari pabrik, untuk memudahkan pengawasan misalnya warna yang pudar menunjukkan bahwa tablet tersebut telah rusak.
Zat warna yang dipakai harus memenuhi persyaratan Dirjen Pengawasan Obat dan Makanan Departemen Kesehatan Republik Indonesia.
Ada 2 cara penambahan zat warna yaitu: 1. Cara basah
Bahan warna dilarutkan dalam larutan bahan pengikat kemudian ditambahkan ke dalam serbuk yang akan digranulasi.
2. Cara kering
2.4.3 Metode pembuatan sediaan tablet
Tablet dibuat dengan 3 cara umum, yaitu granulasi basah, granulasi kering (mesin rol atau mesin slag) dan kempa langsung. Tujuan granulasi basah dan kering adalah untuk meningkatkan aliran campuran dan atau kemampuan kempa (Depkes RI., 1995).
Metode pembuatan tablet didasarkan pada sifat fisika kimia dari bahan obat, seperti stabilitas dari bahan aktif dalam panas atau terhadap air, bentuk partikel bahan aktif dan sebagainya.
Metode pembuatan sediaan tablet yaitu : 1. Cetak langsung
Cetak langsung adalah pencetakan bahan obat atau campuran bahan obat bahan pembantu tanpa proses pengolahan awal. Cara ini hanya dilakukan untuk bahan-bahan tertentu saja yang berbentuk kristal/ butir-butir granul yang mempunyai sifat-sifat yang diperlukan untuk membuat tablet yang baik.
Keuntungan utama dari cetak langsung ini adalah untuk bahan obat yang peka lembab dan panas, dimana stabilitasnya terganggu akibat pekerjaan granulasi, tetapi dapat dibuat menjadi tablet. Meskipun demikian hanya sedikit bahan obat yang mampu dicetak secara langsung, seperti ammonium bromida, ammonium klorida, kalium bromida, kalium klorida, natrium bromida, natrium klorida dan heksamin (Voigt, 1995).
2. Granulasi kering
Granulasi kering disebut juga slugging atau prekompresi. Cara ini sangat tepat untuk tabletasi zat – zat yang peka suhu atau bahan obat yang tidak
Obat dan bahan pembantu pada mulanya dicetak dulu, artinya mula-mula dibuat tablet yang cukup besar, yang massanya tidak tertentu. Selanjutnya terjadi penghancuran tablet yang dilakukan dalam mesin penggranul kering, atau dalam hal yang sederhana dilakukan di atas sebuah ayakan. Granulat yang dihasilkan kemudian dicetak dengan takaran yang dikehendaki (Voigt, 1995).
Metode ini digunakan pada keadaan dosis efektif terlalu tinggi untuk pencetakan langsung, obatnya peka terhadap pemanasan, kelembaban, atau keduanya (Lachman, dkk., 1994).
3. Granulasi basah
Pada teknik ini juga memerlukan langkah-langkah pengayakan, penyampuran dan pengeringan. Pada granulasi basah, granul dibantuk dengan suatu bahan pengikat. Teknik ini membutuhkan larutan, suspensi atau bubur yang mengandung pengikat yang biasanya ditambahkan ke campuran serbuk.
Cara penambahan bahan pengikat tergantung pada kelarutannya dan tergantung pada komponen campuran. Karena massa hanya sampai konsistensi lembab bukan basah seperti pasta, maka bahan pengikat yang ditambahkan tidak boleh berlebihan (Banker dan Anderson, 1994).
Proses pengeringan diperlukan oleh seluruh cara granulasi basah untuk menghilangkan pelarut yang dipakai pada pembentukan gumpalan-gumpalan granul dan untuk mengurangi kelembaban sampai pada tingkat yang optimum (Banker dan Anderson, 1994).
2.4.4 Komposisi tablet
Tablet tertentu mungkin memerlukan pemacu aliran, zat warna, zat perasa, dan pemanis (Lachman, dkk., 1994).
Komposisi umum dari tablet adalah zat berkhasiat, bahan pengisi, bahan pengikat atau perekat, bahan pengembang dan bahan pelicin. Kadang-kadang dapat ditambahkan bahan pewangi (flavoring agent), bahan pewarna (coloring agent) dan bahan-bahan lainnya (Ansel, 1989).
1. Pengisi
Digunakan agar tablet memiliki ukuran dan massa yang dibutuhkan. Sifatnya harus netral secara kimia dan fisiologis, selain itu juga dapat dicernakan dengan baik (Voigt, 1995).
Bahan-bahan pengisi yaitu : laktosa, sukrosa, manitol, sorbitol, amilum, bolus alba, kalsium sulfat, natrium sulfat, natrium klorida, magnesium karbonat (Soekemi, dkk., 1987).
2. Pengikat
Untuk memberikan kekompakan dan daya tahan tablet, juga untuk menjamin penyatuan beberapa partikel serbuk dalam butir granulat (Voigt, 1995).
Pengikat yang umum digunakan yaitu: amilum, gelatin, glukosa, gom arab, natrium alginat, cmc, polivinilpirolidon, dan veegum (Soekemi, dkk., 1987). 3. Penghancur
4. Pelicin
Ditambahkan untuk meningkatkan daya alir granul-granul pada corong pengisi, mencegah melekatnya massa pada punch dan die, mengurangi pergesekan antara butir-butir granul, dan mempermudah pengeluaran tablet dari die. Bahan pelicin yaitu : metalik stearat, talk, asam stearat, senyawa lilin dengan titik lebur tinggi, amilum maydis (Soekemi, dkk., 1987).
Bahan pelicin mempunyai 3 fungsi, yaitu: a. Lubrikan
Lubrikan adalah bahan yang berfungsi untuk mengurangi friksi antara permukaan dinding/tepi tablet dengan dinding die selama kompresi dan ejeksi. Lubrikan ditambahkan pada pencampuran akhir/final mixing, sebelum proses pengempaan. Lubrikan dapat diklasifikasikan berdasarkan kelarutannya dalam air yaitu larut dalam air dan tidak larut dalam air. Pertimbangan pemilihan lubrikan tergantung pada cara pemakaian, tipe tablet, sifat disintegrasi dan disolusi yang dinginkan, sifat fisika-kimia serbuk/granul dan biaya.
b. Glidan
Tabel 2.1 Tipe dan jumlah glidan yang biasanya digunakan
Glidan Konsentrasi (%)
Logam stearat
Natrium dan Magnesium lauril sulfat PEG 4000 dan 6000
Antiadherents adalah bahan yang dapat mencegah melekatnya (sticking) permukaan tablet pada punch atas dan punch bawah. Talk, magnesium stearat dan amilum jagung merupakan material yang memiliki sifat antiadherent yang sangat baik.
Tabel 2.2 Daftar antiadherent yang biasa digunakan
Jenis Antiadherents Konsentrasi (% b/b) Talk
Magnesium stearat Amilum jagung Collodial silica DL – Leucine Natrium lauril sulfat
1-5
Sebelum dicetak menjadi tablet, massa granul perlu diperiksa apakah memenuhi syarat untuk dapat dicetak. Preformulasi ini menggambarkan sifat massa sewaktu pencetakan tablet, meliputi waktu alir, sudut diam dan indeks tap. 2.5.1 Waktu alir
2.5.2 Sudut diam
Pengukuran sudut diam digunakan metode corong tegak, granul dibiarkan mengalir bebas dari corong ke atas dasar. Serbuk akan membentuk kerucut, kemudian sudut kemiringannya diukur. Semakin datar kerucut yang dihasilkan, semakin kecil sudut diam, semakin baik aliran granul tersebut (Voigt, 1995). 2.5.3 Indeks tap
Indeks tap adalah uji yang mengamati penurunan volume sejumlah serbuk atau granul akibat adanya gaya hentakan. Indeks tap dilakukan dengan alat volumenometer yang terdiri dari gelas ukur yang dapat bergerak secara teratur keatas dan kebawah. Serbuk atau granul yang baik mempunyai indeks tap kurang dari 20% (Cartensen, 1977).
2.6 Evaluasi Tablet 2.6.1 Kekerasan tablet
Ketahanan tablet terhadap goncangan saat pengangkutan, pengemasan dan peredaran bergantung pada kekerasan tablet. Kekerasan yang lebih tinggi menghasilkan tablet yang bagus, tidak rapuh tetapi ini mengakibatkan berkurangnya porositas dari tablet sehingga sukar dimasuki cairan yang mengakibatkan lamanya waktu hancur. Kekerasan dinyatakan dalam kg tenaga yang dibutuhkan untuk memecahkan tablet. Kekerasan untuk tablet secara umum yaitu 4-8 kg, tablet hisap 10-20 kg, tablet kunyah 3 kg (Soekemi, dkk., 1987).
tambahan yang bisa menyebabkan meningkatnya kekerasan tablet bila digunakan terlalu pekat (Lachman, dkk., 1994).
2.6.2 Friabilitas
Tablet mengalami capping atau hancur akibat adanya goncangan dan gesekan, selain itu juga dapat menimbulkan variasi pada berat dan keseragaman isi tablet. Pengujian dilakukan pada kecepatan 25 rpm, menjatuhkan tablet sejauh 6 inci pada setiap putaran, dijalankan sebanyak 100 putaran. Kehilangan berat yang dibenarkan yaitu lebih kecil dari 0,5 sampai 1% (Lachman, dkk., 1994).
Kerenyahan tablet dapat dipengaruhi oleh kandungan air dari granul dan produk akhir. Granul yang sangat kering dan hanya mengandung sedikit sekali persentase kelembapan, sering sekali menghasilkan tablet yang renyah daripada granul yang kadar kelembapannya 2 sampai 4% (Lachman, dkk., 1994).
2.6.3 Waktu hancur
Waktu hancur yaitu waktu yang dibutuhkan tablet pecah menjadi partikel-partikel kecil atau granul sebelum larut dan diabsorpsi. Menyatakan waktu yang diperlukan tablet untuk hancur di bawah kondisi yang ditetapkan dan lewatnya seluruh partikel melalui saringan mesh-10 (Lachman, dkk., 1994).
Hancurnya tablet tidak berarti sempurna larutnya bahan obat dalam tablet. Tablet memenuhi syarat jika waktu hancur tablet tidak lebih dari 15 menit (Soekemi, dkk., 1987).
2.6.4 Kadar zat berkhasiat
Untuk mengevaluasi kemanjuran suatu tablet, jumlah obat dalam tablet harus dipantau pada setiap tablet atau batch, begitu juga kemampuan tablet untuk melepaskan zat atau obat yang dibutuhkan harus diketahui (Lachman, dkk., 1994).
Persyaratan kadar berbeda-beda, dan tertera pada masing-masing monografi masing-masing bahan obat.
2.6.5 Keseragaman sediaan
Dapat ditentukan dengan salah satu dari dua metode :
- Keseragaman bobot dilakukan terhadap tablet yang 50% bahan aktifnya lebih besar atau sama dengan 50 mg.
- Keseragaman kandungan dilakukan terhadap tablet yang 50% bahan aktifnya kurang dari 50 mg (Depkes RI.,1995).
2.7 Uji Penilaian Organoleptik 2.7.1 Uji kesukaan
Uji kesukaan juga disebut uji hedonik. Dalam uji hedonik panelis dimintakan tanggapan pribadinya tentang kesukaan atau sebaliknya ketidaksukaan. Disamping panelis mengemukakan tanggapan senang, suka atau kebalikannya, mereka juga mengemukakan tingkat kesukaannya.
Dalam penganalisaan, skala hedonik ditransformasikan menjadi skala numerik dengan angka menaik menurut tingkat kesukaan. Dengan data numerik ini dapat dilakukan analisa-analisa statistik (Soekarto, 1985).
2.7.2 Panel
Untuk melaksanakan suatu penilaian organoleptik diperlukan panel yang bertindak sebagai instrumen atau alat. Panel adalah satu atau kelompok orang yang bertugas untuk menilai sifat atau mutu benda berdasarkan kesan subjektif. Orang yang menjadi anggota panel disebut panelis.
Dalam uji hedonik panelis dimintakan tanggapan pribadinya tentang kesukaan atau sebaliknya ketidaksukaan. Disamping panelis mengemukakan tanggapan senang, suka atau kebalikannya, mereka juga mengemukakan tingkat kesukaannya.
Dalam penilaian organoleptik dikenal ada macam-macam jenis panel. Penggunaan panel-panel ini dapat berbeda tergantung dari tujuan (Soekarto, 1985).
Menurut Soekarto (1985) ada 6 macam panel yang biasa digunakan dalam penilaian organoleptik yaitu:
1. panel pencicip perorangan (individual expert panel) 2. panel pencicip terbatas (small expert panel)
3. panel terlatih (trained panel) 4. panel agak terlatih
BAB I PENDAHULUAN
1.1 Latar Belakang
Sumber daya alam diperlukan sebagai bahan baku atau bahan mentah untuk menghasilkan barang setengah jadi atau produk jadi. Penampilan suatu produk akan terlihat lebih menarik dengan penggunaan zat warna. Zat warna merupakan senyawa kimia yang dibuat melalui proses kimia atau sudah tersedia di alam yang umumnya sebagian besar terdapat dalam tumbuh-tumbuhan. Hingga saat ini penggunaan pewarna sintetik untuk makanan masih dominan, selain harganya lebih murah, proses produksinya juga lebih cepat bila dibandingkan dengan bahan pewarna alami yang umumnya berasal dari tanaman. Pewarna buatan (sintetis) ternyata memberikan efek terhadap jaringan tubuh makhluk hidup. Apabila kadarnya berlebih akan mengganggu kesehatan manusia (Budiyono dan Kaseno, 2004).